|
|
(21), (22) Заявка: 2006125720/04, 20.12.2004
(24) Дата начала отсчета срока действия патента:
20.12.2004
(30) Конвенционный приоритет:
18.12.2003 EP 03104802.8
30.04.2004 US 60/566,835
(43) Дата публикации заявки: 27.01.2008
(46) Опубликовано: 10.02.2010
(56) Список документов, цитированных в отчете о
поиске:
JASSENS F. ET AL: “New antihistamine N-heterocyclic 4-piperidinamines. 2. Synthesis and antihistaminic activity of 1-(4-fluorophenyl)-1H-benzimidazol-2-amines”,. JOURNAL OF MEDICINAL CHEMISTRY, AMERICAN CHEMICALSOCIETY, WASHINGTON, US vol.28, no.12, December 1982. SU 1637663 A3, 23.03.1991. SU 986297 A3, 30.12.1982.
(85) Дата перевода заявки PCT на национальную фазу:
18.07.2006
(86) Заявка PCT:
EP 2004/053606 20041220
(87) Публикация PCT:
WO 2005/058873 20050630
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
БОНФАНТИ Жан-Франсуа (FR),
АНДРИС Кунрад Йозеф Лодевейк (BE),
ЯНССЕНС Франс Эдуард (BE),
СОММЕН Франсуа Мария (BE),
ГИЙЕМОН Жером Эмиль Жорж (FR),
ЛАКРАМП Жан Фернан Арман (FR)
(73) Патентообладатель(и):
ТИБОТЕК ФАРМАСЬЮТИКАЛЗ ЛТД. (IE)
|
(54) ПИПЕРИДИНАМИНОБЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА
(57) Реферат:
Настоящее изобретение относится к пиперидинаминобензимидазолам, имеющим формулу (I), и к соли присоединения или его стереохимическим изомерным формам, где Q представляет C1-6алкил, необязательно замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из трифторметила, С3-7циклоалкила, Ar2, гидроксила, Ar2-окси-, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, аминокарбонилокси, С1-4алкоксикарбонила, Ar2(СН2)nкарбонилокси, C1-4алкоксикарбонил-(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно(С1-4алкил)аминосульфонила, или гетероциклом, выбранным из группы, состоящей из пирролидинила, дигидропирролила, имидазолила, триазолила, гомопиперидинила, пиридила и тетрагидропиридила; или Q представляет C1-6алкил, замещенный двумя заместителями, причем один заместитель представляет собой аминогруппу, а другой заместитель представляет собой C1-6алкилоксикарбонил; G представляет -CH2-; R1 представляет пиридил, необязательно замещенный 2 заместителями, выбранными из группы заместителей, состоящей из гидроксила, C1-6алкила; каждый n равен 1; один из R2a и R3a представляет C1-6алкил, а другой из R2a и R3a представляет водород; в случае, когда R2a не является водородом, R2b является C1-6алкилом, а R3b является водородом; в случае, когда R3a не является водородом, R3b является C1-6алкилом, a R2b является водородом; или R3b является C1-6алкилом; a R3a, R2a, R2b все представляют собой водород; или R5 является водородом; t равен 2; Ar2 является фенилом или фенилом, замещенным 1 или более, например 2 заместителями, выбранными из галогена, C1-6алкилокси, аминосульфонила и С1-4алкоксикарбонила. Также изобретение относится к фармацевтической композиции на основе соединений формулы I и применению указанных соединений для получения лекарственных средств. Технический результат: получены новые пиперидинаминобензимидазолы, обладающие ингибирующим действием на репликацию респираторного синцитиального вируса. 3 н. и 7 з.п. ф-лы, 3 табл.
Данное изобретение относится к пиперидинаминобензимидазольным производным, обладающим противовирусной активностью, в частности, обладающим ингибирующим действием на репликацию респираторного синцитиального вируса (РСВ). Кроме того, оно относится к их получению и композициям, содержащим эти соединения.
Человеческий РСВ или респираторный синцитиальный вирус является крупным РНК вирусом, представителем семейства Paramyxoviridae, подсемейства Pneumoviridae вместе с РСВ вирусом крупного рогатого скота. Человеческий РСВ ответственен за целый спектр заболеваний респираторного тракта у людей всех возрастов по всему миру. Свыше половины всех младенцев сталкиваются с РСВ в их первый год жизни, и почти все – в течение первых двух лет жизни. Данная инфекция у детей раннего возраста может вызывать поражение легких, которое сохраняется в течение ряда лет и может способствовать хроническому заболеванию легких на более поздних этапах жизни (одышка, стерторозное дыхание, астма). Дети более старшего возраста и взрослые часто страдают от (тяжелой) обычной простуды при инфекции, вызванной РСВ. В старости восприимчивость снова повышается, и с РСВ был связан ряд вспышек пневмонии у пожилых людей, приведших к значительной смертности.
Инфекция, вызванная вирусом из данной подгруппы, не защищает от последующей инфекции, вызываемой штаммом РСВ из той же самой подгруппы в следующем зимнем сезоне. Повторная инфекция, вызываемая РСВ, является, таким образом, обычной несмотря на существование только двух подтипов А и В.
В настоящее время было одобрено только три лекарственных препарата для использования против инфекции, вызванной РСВ. Первым является рибавирин, нуклеозидный аналог, который представляет аэрозольное лечение при тяжелых инфекциях у госпитализированных детей. Аэрозольный путь введения, токсичность (риск тератогенности), стоимость и высоко вариабельная эффективность ограничивают его применение. Другие два лекарственных препарата, респигам (RespiGam®) и паливизумаб, поликлональные и моноклональные антитела, иммуномостимуляторы предназначены для профилактики заболеваний.
Другие попытки разработать безопасную и эффективную вакцину от РСВ, все потерпели неудачу до сих пор. Инактивированные вакцины не способны защитить от заболевания и фактически в некоторых случаях усиливали заболевание во время последующей инфекции. Была предпринята попытка создания живых аттенуированных вакцин с ограниченным успехом. Ясно, что существует потребность в эффективном, нетоксичном и легком в применении лекарственном средстве против репликации РСВ. В патентах, патентных заявках и публикациях Janssen Pharmaceutica N.V. было описано несколько серий бензимидазолил- и имидазопиридинилпиперидинов как соединений, обладающих антигистаминными свойствами. См., например, ЕР-А-5318, ЕР-А-99139, ЕР-А-145037, WO-92/01687, Janssens F. et al. in Journal of Medicinal Chemistry, Am. Chem. Soc., Vol.28, No.12, pp.1934-1943 (1985).
Бензимидазолы и имидазопиридины как ингибиторы репликации РСВ были описаны в WO 01/00611, WO 01/00612 и WO 01/00615.
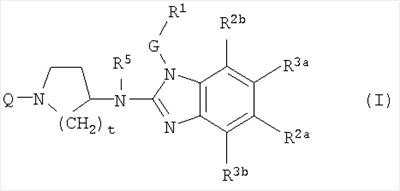
Данное изобретение относится к ингибиторам репликации РСВ, которые могут быть представлены формулой (I)
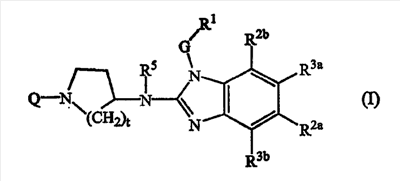
их пролекарствам, N-оксидам, солям присоединения, четвертичным аминам, комплексам с металлами и их стереохимически изомерным формам, где
Q представляет С1-6алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из трифторметила, С3-7циклоалкила, Ar2, гидроксила, С1-4алкокси, С1-4алкилтио, Ar2-окси-, Ar2-тио-, Ar2(СН2)nокси, Ar2(СН2)nтио, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, Аr2карбонила, С1-4алкоксикарбонила, Ar2(СН2)nкарбонила, аминокарбонилокси, С1-4алкилкарбонилокси, Аr2карбонилокси, Ar2(СН2)nкарбонилокси, С1-4алкоксикарбонил-(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, моно- или ди(С1-4алкил)аминокарбонилокси, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, или гетероцикл, выбранный из группы, состоящей из пирролидинила, пирролила, дигидропирролила, имидазолила, триазолила, пиперидинила, гомопиперидинила, пиперазинила, пиридила и тетрагидропиридила, причем каждый из указанных гетероциклов может быть необязательно замещенным оксо- или С1-6алкилом; или Q представляет С1-6алкил, замещенный двумя заместителями, причем один заместитель выбран из амина, моно- и диС1-4-алкиламина и Ar2-С1-4алкиламина, а другой заместитель выбран из карбоксила, С1-6алкилоксикарбонила, Ar2-С1-4алкилоксикарбонила, аминокарбонила и аминосульфонила;
G представляет прямую связь или С1-10алкандиил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей гидрокси, С1-6алкилокси, Ar1C1-6алкилокси, С1-6алкилтио, Ar1C1-6алкилтио, НО(-СН2-СН2-О)n-, С1-6алкилокси(-СН2-СН2-О)n– и Ar1C1-6алкилокси(-СН2-СН2-О)n-;
R1 представляет Ar1 или моноциклический, или бициклический гетероцикл, который выбран из пиперидинила, пиперазинила, пиридила, пиразинила, пиридазинила, пиримидинила, фуранила, тетрагидрофуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, хинолинила, хиноксалинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензтиазолила, пиридопиридила, нафтиридинила, 1Н-имидазо[4,5-b]пиридинила, 3Н-имидазо[4,5-b]пиридинила, имидазо[1,2-a]пиридинила, 2,3-дигидро-1,4-диоксино[2,3-b]пиридила или радикала формулы
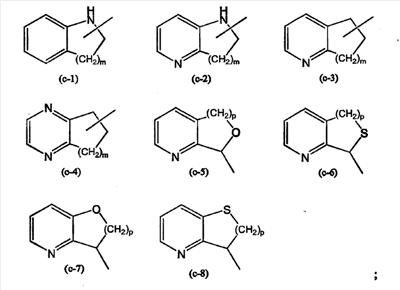
где каждый из указанных моноциклических или бициклических гетероциклов может, необязательно, быть замещенным 1 заместителем, или где возможно, более, а именно 2, 3, 4 или 5, заместителями, отдельно выбранными из группы заместителей, состоящей из галогена, гидроксила, амино, циано, карбоксила, С1-6алкила, С1-6алкилокси, С1-6алкилтио, С1-6алкилоксиС1-6алкила, Ar1, Ar1C1-6алкила, Ar1C1-6алкилокси, гидроксиС1-6алкила, моно- или ди(С1-6алкил)амино, моно или ди(С1-6алкил)аминоС1-6алкила, полигалогеноС1-6алкила, С1-6алкилкарбониламино, С1-6алкил-SO2-NR4a-, Ar1-SO2-NR4a-, С1-6алкилоксикарбонила, -С(=О)-NR4aR4b, НО(-СН2-СН2-О)n-, галоген(-СН2-СН2-О)n-, С1-6алкилокси(-СН2-СН2-О)n-, Ar1C1-6алкилокси(-СН2-СН2-О)n– и моно или ди(С1-6алкил)амино(-СН2-СН2-О)n-;
каждый n независимо равен 1, 2, 3 или 4;
один из R2a и R3a представляет С1-6алкил, а другой из R2a и R3a представляет водород;
в случае, когда R2a не является водородом, R2b является водородом или С1-6алкилом, а R3b является водородом;
в случае, когда R3a не является водородом, R3b является водородом или С1-6алкилом, а R2b является водородом; или
R3b является С1-6алкилом; а R3a, R2a, R2b все представляют собой водород; или
R2b является С1-6алкилом; а R3a, R2a, R3b все представляют собой водород;
R4a и R4b могут быть одинаковыми или могут быть разными относительно друг друга, и являются, каждый независимо, водородом или С1-6алкилом; или
R4a и R4b, взятые вместе, могут образовывать двухвалентный радикал формулы
-(СН2)S-;
R5 является водородом или С1-6алкилом;
m равен 1 или 2;
р равен 1 или 2;
s равен 4 или 5;
t равен 1, 2 или 3;
Ar1 является фенилом или фенилом, замещенным 1 или более, например 2, 3 или 4, заместителями, выбранными из галогена, гидроксила, С1-6алкила, гидроксиС1-6алкила, полигалогеноС1-6алкила и С1-6алкилокси;
Ar2 является фенилом или фенилом, замещенным 1 или более, например 2, 3 или 4, заместителями, выбранными из галогена, гидроксила, амино, циано, С1-6алкила, гидроксиС1-6алкила, полигалогеноС1-6алкила, аминоС1-6алкила, С1-6алкилокси, аминосульфонила, аминокарбонила, гидроксикарбонила, С1-4алкилкарбонила, моно- или ди(С1-4алкил)амино, моно- или ди(С1-4алкил)аминокарбонила, моно- или ди(С1-4алкил)аминосульфонила, моно- или ди(С1-4алкил)-аминоС1-6алкила и С1-4алкоксикарбонила.
Данное изобретение, кроме того, относится к применению соединения формулы (I) или пролекарства, N-оксида, соли присоединения, четвертичного амина, комплекса с металлом и их стереохимически изомерных форм для получения лекарственного средства для ингибирования репликации РСВ. Или данное изобретение относится к способу ингибирования репликации РСВ у теплокровного животного, причем указанный способ включает введение эффективного количества соединения формулы (I) или пролекарства, N-оксида, соли присоединения, четвертичного амина, комплекса с металлом и их стереохимически изомерных форм.
Далее данное изобретение относится к новым соединениям формулы (I), а также способам получения этих соединений.
Термин «пролекарство», который использован в данном тексте, означает фармакологически приемлемые производные, например сложные эфиры и амиды, такие, что получающийся в результате биотрансформации продукт данного производного является активным лекарственным средством, которому дано определение как соединениям формулы (I). Справочный материал Goodman и Gilman (The Pharmacological Basis of Therapeutics, 8th ed., McGraw-Hill, Int. Ed., 1992,  Biotransformation of Drugs Biotransformation of Drugs , p.13-15), описывающий в основном пролекарства, включен в описание в качестве ссылки. Пролекарства характеризуются хорошими растворимостью в воде и биодоступностью и легко метаболизируются в активные ингибиторы in vivo. , p.13-15), описывающий в основном пролекарства, включен в описание в качестве ссылки. Пролекарства характеризуются хорошими растворимостью в воде и биодоступностью и легко метаболизируются в активные ингибиторы in vivo.
Термины «С1-6алкил, необязательно замещенный одним заместителем или более», использованный, например, в определении Q, или «С1-10алкандиил, необязательно замещенный одним заместителем или более», который использован при определении G, означают, что включены С1-6алкильные радикалы, соответственно, С1-10алкандиильные радикалы, не имеющие заместителей и имеющие один, два заместителя или более, например не имеющие или имеющие один, два, три, четыре, пять или шесть заместителей, в частности, с отсутствием, одним, двумя или тремя заместителями, кроме того, в частности, с отсутствием, одним или двумя заместителями. Верхний предел числа заместителей определяется числом атомов водорода, которые могут быть заменены, а также основными свойствами заместителей, такими как их объемность, причем эти свойства позволяют специалисту определить указанный верхний предел.
Термин, как он использован выше и ниже, «полигалогеноС1-6алкил» как группа или часть группы, например в полигалогеноС1-6алкилокси, определяют как моно- или полигалогенозамещенный С1-6алкил, в частности С1-6алкил, замещенный одним, двумя, тремя, четырьмя, пятью, шестью или более атомами галогена, такой как метил или этил с одним или более атомами фтора, например, дифторметил, трифторметил, трифторэтил. Сюда включены также перфторС1-6алкильные группы, которые являются С1-6алкильными группами, у которых все атомы водорода заменены атомами фтора, например пентафторэтил. В случае, если присоединено более одного атома галогена к алкильной группе в определении полигалогеноС1-4алкил, атомы галогена могут быть одинаковыми или разными.
Каждый из моноциклических или бициклических гетероциклов в определении R1 может быть необязательно замещенным 1 заместителем или, где возможно, более, например, 2, 3, 4 или 5 заместителями. В частности, указанные гетероциклы могут быть, необязательно, замещенными до 4, до 3, до 2 заместителями или 1 заместителем.
Каждый из Ar1 или Ar2 может быть незамещенным фенилом или фенилом, замещенным 1 заместителем или более, например 5 или 4 заместителями, или, что предпочтительно, до 3 заместителей, или до двух заместителей, или одним заместителем.
ГидроксиС1-6алкильная группа, когда она замещена по атому кислорода или атому азота, предпочтительно, является гидроксиС2-6алкильной группой, причем гидроксильная группа и кислород или азот разделены, по меньшей мере, двумя атомами углерода.
В соответствии с описанием С1-3алкил как группа или часть группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющей от 1 до 3 атомов углерода, такие как метил, этил, пропил, 1-метилэтил и тому подобное; С1-4алкил как группа или часть группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющей от 1 до 4 атомов углерода, такие как группа, определенная для С1-3алкила и бутил и тому подобного; С2-4алкил как группа или часть группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющей от 2 до 4 атомов углерода, такие как этил, пропил, 1-метилэтил, бутил и тому подобное; С1-6алкил как группа или часть группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющей от 1 до 6 атомов углерода, такие как группы для определения С1-4алкила, и пентил, гексил, 2-метилбутил и тому подобное; С1-9алкил как группа или часть группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющей от 1 до 9 атомов углерода, такие как группы, для определения С1-6алкилом и гептил, октил, нонил, 2-метилгексил, 2-метилгептил и тому подобное; С1-10алкил как группа или часть группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющей от 1 до 10 атомов углерода, такие как группы, для определения С1-9алкила и децил, 2-метилнонил и тому подобное.
С3-7циклоалкил является общим для циклопропила, циклобутила, циклопентила, циклогексила и циклогептила.
С2-5алкандиил определяет насыщенные двухвалентные углеводородные радикалы с прямой или разветвленной цепью, имеющей от 2 до 5 атомов углерода, такие как, например, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,2-пропандиил, 2,3-бутандиил, 1,5-пентандиил и тому подобное; С1-4алкандиил определяет насыщенные двухвалентные углеводородные радикалы с прямой или разветвленной цепью, имеющей от 1 до 4 атомов углерода, такие как, например, метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил и тому подобное; С1-6алкандиил, как подразумевается, включает, С1-4алкандиил и его более высокие гомологи, имеющие от 5 до 6 атомов углерода, такие как, например, 1,5-пентандиил, 1,6-гександиил и тому подобное; С1-10алкандиил, как подразумевается, включает, С1-6алкандиил и его более высокие гомологи, имеющие от 7 до 10 атомов углерода, такие как, например, 1,7-гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10-декандиил и тому подобное.
Как указывалось ранее, элемент (=О) образует карбонильную группу, когда он связан с атомом углерода, сульфоксидную группу, когда связан с атомом серы, и сульфонильную группу, когда два указанных элемента связаны с атомом серы. Элемент (=N-OH) образует гидроксилиминовую группу, когда он связан c атомом углерода.
Термин «галоген» является общим для фтора, хлора, брома и йода.
Нужно отметить, что положения радикалов на любой части молекулы, используемой в определениях, могут быть в любой ее части, если только она химически стабильна.
Радикалы, использованные в определениях переменных групп, включают все возможные изомеры, если не указано иначе. Например, пиридил включает 2-пиридил, 3-пиридил и 4-пиридил; пентил включает 1-пентил, 2-пентил и 3-пентил.
Когда любой радикал встречается более одного раза в любом фрагменте молекулы, каждое определение его является независимым.
При использовании в описании далее «соединения формулы (I)» или «данные соединения» или подобные термины, как подразумевается, включают соединения общей формулы (I), их пролекарства, N-оксиды, соли присоединения, четвертичные амины, комплексы с металлами и стереохимически изомерные формы. Интересующая подгруппа соединений формулы (I) или любая ее подгруппа представляет N-оксиды, соли и все стереохимические формы соединений формулы (I).
Будет понятно, что некоторые из соединений формулы (I) могут содержать один центр или более центров хиральности и существуют в виде стереохимически изомерных форм.
Термин «стереохимически изомерные формы», который использован выше, определяет, что соединения формулы (I) представляют все возможные соединения, образованные теми же самыми атомами, связанными в той же самой последовательности связей, но имеющие разные трехмерные структуры, которые не являются взаимозаменяемыми.
Если не упомянуто или не указано иначе, химическое название соединения включает смесь всех возможных стереохимически изомерных форм, которые может иметь указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры базовой молекулярной структуры указанного соединения. Все стереохимические изомерные формы соединений данного изобретения, в чистом виде или в смеси друг с другом, как подразумевается, охватываются объемом данного изобретения.
Чистые стереоизомерные формы соединений и промежуточных соединений, которые упомянуты в описании, определены как изомеры, по существу не содержащие других энантиомерных или диастереомерных форм той же самой основной структуры указанных соединений или промежуточных соединений. В частности, термин «стереохимически чистое» относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток от, по меньшей мере, 80% (т.е. минимум 90% одного изомера и максимум 10% другого возможного изомера) до стереохимического избытка, равного 100% (т.е. 100% одного изомера и отсутствие другого), более конкретно, соединениям или промежуточным соединениям, имеющим стереоизомерный избыток, равный от 90% до 100%, еще конкретнее, имеющим стереоизомерный избыток, равный от 94% до 100%, и наиболее конкретно, имеющим стереоизомерный избыток от 97% до 100%. Термины «энантиомерно чистое» и «диастереомерно чистое» нужно понимать аналогично, но только в отношении к энантиомерному избытку, соответственно диастереомерному избытку рассматриваемой смеси.
Чистые стереоизомерные формы соединений и промежуточных соединений данного соединения могут быть получены известными специалистам в данной области методиками. Например, энантиомеры могут быть отделены один от другого посредством селективной кристаллизации их диастереомерных солей с оптически активными кислотами или основаниями. Их примерами являются виннокаменная кислота, дибензоилвиннокаменная кислота, дитолуоилвиннокаменная кислота и камфорсульфоновая кислота. Альтернативно, энантиомеры могут быть разделены с помощью хроматографических методов с использованием хиральных неподвижных фаз. Указанные стереохимически чистые изомерные формы могут быть также получены из соответствующих стереохимически чистых изомерных форм соответствующих исходных веществ при условии, что реакция происходит стереоспецифически. Предпочтительно, если желателен специфический стереоизомер, указанное соединение будет синтезировано стереоспецифическими методами получения. При этих методах будут преимущественно применяться энантиомерно чистые исходные вещества.
Диастереомерные рацематы формулы (I) можно получить отдельно общепринятыми методами. Соответствующими методами физического разделения, которые можно преимущественно использовать, являются, например, селективная кристаллизация и хроматография, например колоночная хроматография.
Что касается некоторых соединений формулы (I), их пролекарств, N-оксидов, солей, сольватов, четвертичных аминов или комплексов с металлами и промежуточных соединений, используемых при их получении, абсолютная стереохимическая конфигурация не была экспериментально определена. Специалист в данной области способен определить абсолютную конфигурацию таких соединений, используя известные в данной области методы, такие как, например, рентгеновская дифракция.
Данное изобретение, как подразумевается, включает все изотопы атомов, встречающиеся в данных соединениях. Изотопы включают эти атомы, имеющие то же самое атомное число, но разные числа массы. В качестве общего примера и без ограничения им изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14.
Для терапевтического применения используют соли и соединения формулы (I), у которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые являются фармацевтически неприемлемыми, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, как фармацевтически приемлемые, так и фармацевтически неприемлемые, включены в объем данного изобретения.
Фармацевтически приемлемые соли присоединения кислоты и основания, которые упомянуты выше, как подразумевается, включают терапевтически активные, нетоксичные формы соли присоединения кислоты и основания, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые соли присоединения кислоты можно легко получить путем обработки основания подходящей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенистоводородные кислоты, например соляная кислота или бромистоводородная кислота, серную, азотную, фосфорную и тому подобные кислоты; или органические кислоты, такие как, например, уксусная кислота, пропановая кислота, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандикарбоновая), малоновая, янтарная (т.е. бутандикарбоновая кислота), малеиновая, фумаровая, яблочная (т.е. гидроксибутандикарбоновая кислота), виннокаменная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и тому подобные кислоты.
И наоборот, соли соединений можно превратить путем обработки соответствующим основанием в форму свободного основания.
Соединения формулы (I), содержащие кислотный протон, могут быть также превращены в их нетоксичные формы соли с металлом или амином путем обработки подходящими органическими и неорганическими основаниями. Формы соли подходящего основания включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например соли лития, натрия, калия, магния, кальция и тому подобное, соли с органическими основаниями, например бензатиновые, N-метил-D-глюкаминовые, гидрабаминовые соли, и соли с аминокислотами, такими как, например, аргинин, лизин и тому подобное.
Термин «соль присоединения», в соответствии с применением выше, включает также сольваты, которые способны образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты, алкоголяты и тому подобное.
Термин «четвертичный амин», в соответствии с описанием, определяет соли четвертичного аммония, которые соединения формулы (I) способны образовывать путем реакции между основным азотом соединения формулы (I) и подходящего кватернизирующего вещества, такого как, например, необязательно замещенного алкилгалогенида, арилгалогенида или арилалкилгалогенида, например метилиодида или бензилиодида. Можно также использовать другие реагенты с подходящими удаляемыми группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный азот.
Фармацевтически приемлемые противоионы включают хлор, бром, иод, трифторацетат и ацетат. Противоион по выбору может быть включен с использованием ионообменных смол.
N-оксидные формы данных соединений, как подразумевается, включают соединения формулы (I), у которых один или несколько атомов азота окислены до так называемого N-оксида.
Будет понятно, что соединения формулы (I) могут обладать свойствами связывать металл, хелатирования, комплексообразования и поэтому могут существовать в виде комплексов с металлами или хелатов металлов. Такие металлированные производные соединений формулы (I), как подразумевается, включены в объем данного изобретения.
Некоторые из соединений формулы (I) могут также существовать в их таутомерной форме. Такие формы, хотя явно и не указанные в представленной выше формуле, как подразумевается, включены в объем данного изобретения.
Одно воплощение данного изобретения относится к соединениям формулы (I-а):
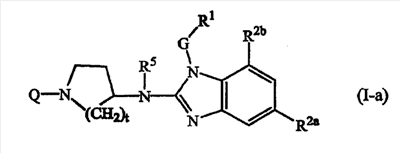
где Q, t, R5, G и R1 имеют значения, описанные выше в определениях соединений формулы (I) или как и для любой из подгрупп соединений (I), представленных в описании, и
R2a является С1-6алкилом;
R2b является водородом или С1-6алкилом.
Другое воплощение данного изобретения относится к соединениям формулы (I-b):
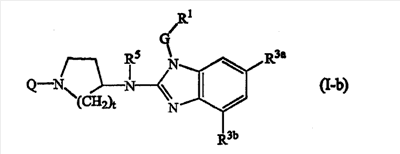
где Q, t, R5, G и R1 имеют значения, описанные выше в определениях соединений формулы (I) или как и для любой из подгрупп соединений (I), представленных в описании, и
R3a является С1-6алкилом;
R3b является водородом или С1-6алкилом.
Еще одно воплощение данного изобретения относится к соединениям формулы (I-с):
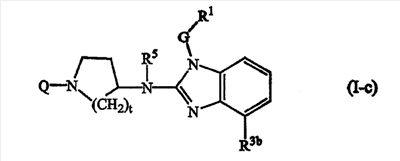
где Q, t, R5, G и R1 имеют значения, описанные выше в определениях соединений формулы (I) или как и для любой из подгрупп соединений (I), представленных в описании, и
R3b является С1-6алкилом.
Однако дополнительные воплощения включают соединения формулы (I-а), (I-b) или (I-с), где t=2, т.е. соединения формул
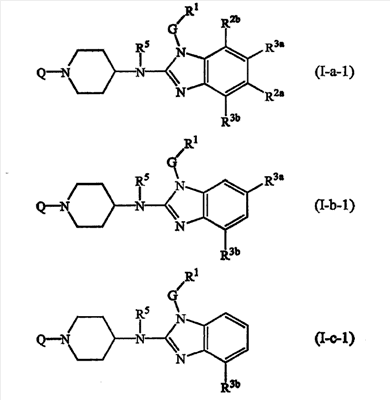
где Q, R5, G, R1, R2a, R2b, R3a, R3b имеют значения, описанные выше в определениях соединений формулы (I) или как и для любой из подгрупп соединений (I), представленных в описании.
Должно быть понятно, что подгруппы соединений формул (I-а), (I-b) и т.д., определенные выше, а также любая другая подгруппа, определенная выше, включает также любые пролекарства, N-оксиды, соли присоединения, четвертичные амины, комплексы с металлами и стереохимически изомерные формы таких соединений.
Особые подгруппы соединений формулы (I) представляют соединения формулы (I) или любую подгруппу соединений формулы (I), описанных выше, у которых G является С1-10алкандиилом, более конкретно, у которых G является метиленом.
Другие особые подгруппы соединений формулы (I) представляют соединения формулы (I) или любую подгруппу соединений формулы (I), представленных в описании, у которых
(а) R1 имеет значение отличное от Ar1; или где
(b) R1 является Ar1 или моноциклическим гетероциклом, который описан в определениях соединений формулы (I) или любых их подгрупп.
Дополнительные особые подгруппы соединений формулы (I) представляют соединения формулы (I) или любую подгруппу соединений формулы (I), представленных в описании, у которых
(с) R1 представляет пиридил, необязательно замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, амино, циано, карбоксила, С1-6алкила, С1-6алкилокси, С1-6алкилтио, С1-6алкилоксиС1-6алкила, Ar1, Ar1C1-6-алкила, Ar1C1-6алкилокси, гидроксиС1-6алкила, моно- или ди(С1-6алкил)амино, моно- или ди(С1-6алкил)аминоС1-6алкила, полигалогеноС1-6алкила, С1-6алкилкарбониламино, С1-6алкил-SO2-NR4a-,
Ar1-SO2-NR4a-, С1-6алкилоксикарбонила, -С(=О)-NR4aR4b, НО(-СН2-СН2-О)n-, галоген(-СН2-СН2-О)n-, С1-6алкилокси(-СН2-СН2-О)n-, Ar1C1-6алкилокси(-СН2-СН2-О)n– и моно- или ди(С1-6алкил)амино(-СН2-СН2-О)n-; или более, в частности,
(d) R1 представляет пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидроксила, С1-6алкила, галогена, С1-6алкилокси, Ar1C1-6алкилокси и (С1-6алкилокси)С1-6алкилокси; предпочтительно, где
(е) R1 представляет пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидроксила, С1-6алкила, галогена и С1-6алкилокси; или где
(f) R1 представляет пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидроксила и С1-6алкила; более предпочтительно, где
(g) R1 представляет пиридил, замещенный гидроксилом и С1-6алкилом; или более предпочтительно, где
(h) R1 представляет пиридил, замещенный гидроксилом и метилом; или где
(i) R1 представляет 3-гидрокси-6-метилпирид-2-ил.
Кроме того, воплощения включают те соединения формулы (I) или любую из подгрупп соединений формулы (I), где
(j) R1 представляет Ar1, хинолинил, бензимидазолил, радикал формулы
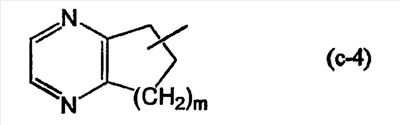
пиразинил или пиридил; или где
(k) R1 представляет Ar1, хинолинил, бензимидазолил, радикал формулы (с-4), где m равно 2, пиразинил или пиридил;
где каждый из радикалов в (j) и (k) могут быть, необязательно, замещенными заместителями, описанными в определении соединений формулы (I) и, в частности, пиридил может быть замещенным, как описано выше в (а)-(i).
Дополнительные воплощения включают те соединения формулы (I) или любую из подгрупп соединений формулы (I), где
(l) R1 представляет Ar1, хинолинил, бензимидазолил или радикал формулы (с-4), где m равно 2, пиразинил или пиридил, причем каждый из этих радикалов может быть, необязательно, замещенным одним, двумя или тремя радикалами, выбранными из группы, состоящей из галогена, гидроксила, С1-6алкила, С1-6алкилокси, Ar1C1-6алкилокси, (С1-6алкилокси)С1-6алкилокси; или более, конкретнее, где
(m) R1 представляет Ar1, хинолинил, бензимидазолил или радикал формулы (с-4), где m равно 2, пиразинил или пиридил, причем каждый из этих радикалов может быть, необязательно, замещенным одним, двумя или тремя радикалами, выбранными из группы, состоящей из галогена, гидроксила, С1-6алкила, С1-6алкилокси, бензилокси; или более точно, где
(n) R1 представляет фенил, необязательно, замещенный одним, двумя или тремя радикалами, выбранными из группы, состоящей из галогена, гидроксила, С1-6алкила, С1-6алкилокси; хинолинил; радикал (с-4), где m равен 2, необязательно, замещенный до двух радикалами, выбранными из С1-6алкила; бензимидазолил, необязательно, замещенный С1-6алкилом; пиридил, необязательно, замещенный одним или двумя радикалами, выбранными из гидроксила, галогена, С1-6алкила, бензилокси и С1-6алкилокси; пиразинил, необязательно, замещенный до трех, радикалами, выбранными из С1-6алкила; или пиридил, замещенный или, необязательно, замещенный, как описано выше в (а)-(i); или где
(о) R1 представляет фенил, замещенный одним или двумя радикалами, выбранными из группы, состоящей из галогена, гидроксила, С1-6алкила, С1-6алкилокси; или
(р) R1 представляет хинолинил; или
(q) R1 представляет радикал (с-4), где m равно 2, необязательно, замещенный до двух радикалами, выбранными из С1-6алкила; или
(r) R1 представляет бензимидазолил, необязательно, замещенный С1-6алкилом; пиридил, необязательно, замещенный одним или двумя радикалами, выбранными из гидроксила, галогена, С1-6алкила, бензилокси и С1-6алкилокси; или
(s) R1 представляет пиразинил, необязательно замещенный до трех радикалами, выбранными из С1-6алкила.
Предпочтительными подгруппами соединений формулы (I) или какой-либо из подгрупп соединений формулы (I) являются те, у которых G является прямой связью или метиленом, а R1 имеет значение, представленное выше в (а)-(s). Кроме того, предпочтительными являются соединения формулы (I) или какой-либо из подгрупп, представленных в описании, причем G является прямой связью, а R1 является радикалом (с-4), в частности, где m равно 2, необязательно, замещенным радикалами до двух, выбранными из С1-6алкилов. Кроме того, предпочтительными являются соединения формулы (I) или какой-либо из подгрупп, представленных в описании, где или G является метиленом, а R1 имеет значение, представленное выше в (а)-(s), но является другой группой, а не радикалом (с-4).
Другие воплощения включают эти соединения формулы (I) или какой-либо из подгрупп соединений формулы (I), представленных в описании, где R5 является водородом.
Дополнительные воплощения включают те соединения формулы (I) или какой-либо из подгрупп соединений формулы (I), представленных в описании, где
(а) Q является С1-6алкилом, необязательно, замещенным одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из трифторметила, С3-7циклоалкила, Ar2, гидроксила, С1-4алкокси, С1-4алкилтио, Ar2-окси-, Ar2-тио-, Ar2(СН2)nокси, Ar2(СН2)nтио, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, Аr2карбонила, С1-4алкоксикарбонила, Ar2(СН2)nкарбонила, аминокарбонилокси, С1-4алкилкарбонилокси, Аr2карбонилокси, Ar2(СН2)nкарбонилокси, С1-4алкоксикарбонил-(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, моно- или ди(С1-4алкил)аминокарбонилокси, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, или гетероциклом, выбранным из группы, состоящей из пирролидинила, пирролила, дигидропирролила, имидазолила, триазолила, пиперидинила, гомопиперидинила, пиперазинила, пиридила и тетрагидропиридила, причем каждый из указанных гетероциклов может быть, необязательно, замещенным оксо или С1-6алкилом; или, в частности, где
(b) Q является С1-6алкилом, необязательно замещенным одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из трифторметила, С3-7циклоалкила, Ar2, гидроксила, С1-4алкокси, С1-4алкилтио, Ar2-окси-, Ar2(СН2)nокси, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, С1-4алкоксикарбонила, аминокарбонилокси, С1-4алкилкарбонилокси, Ar2(СН2)nкарбонилокси, С1-4алкоксикарбонил(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, или гетероциклом, выбранным из группы, состоящей из пирролидинила, пирролила, дигидропирролила, имидазолила, триазолила, пиперидинила, гомопиперидинила, пиперазинила, пиридила и тетрагидропиридила, причем каждый из указанных гетероциклов может быть, необязательно, замещенным оксо или С1-6алкилом; или Q является С1-6алкилом, замещенным двумя заместителями, причем один заместитель выбран из группы, состоящей из амино, моно- и диС1-4алкиламино и Ar2-С1-4алкиламино, а другой заместитель выбран из группы, состоящей из карбоксила, С1-6алкилоксикарбонила и Ar2-С1-4алкилоксикарбонила; или более конкретно, где
(с) Q является С1-6алкилом, необязательно, замещенным одним или двумя заместителями, каждый из которых независимо выбран из трифторметила, С3-7циклоалкила, Ar2, гидроксила, С1-4алкокси, Ar2-окси-, Ar2(СН2)nокси, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, С1-4алкоксикарбонил(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, или гетероциклом, выбранным из пирролидинила, пирролила, дигидропирролила, имидазолила, триазолила, пиперидинила, гомопиперидинила, пиперазинила и тетрагидропиридила, причем каждый из указанных гетероциклов может быть, необязательно, замещенным оксо или С1-6алкилом; или Q является С1-6алкилом, замещенным двумя заместителями, причем один заместитель выбран из амино, а другой заместитель выбран из группы, состоящей из карбоксила, С1-6алкилоксикарбонила;
(d) Q является С1-6алкилом, необязательно, замещенным одним или двумя заместителями, каждый из которых независимо выбран из трифторметила, С3-7циклоалкила, Ar2, гидроксила, С1-4алкокси, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, Ar2карбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, С1-4алкоксикарбонил(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, или гетероциклом, выбранным из пирролидинила, дигидропирролила, имидазолила, триазолила, пиперидинила, гомопиперидинила, пиперазинила, пиридила и тетрагидропиридила, причем каждый из указанных гетероциклов может быть, необязательно, замещенным оксо или С1-6алкилом; или Q является С1-6алкилом, замещенным двумя заместителями, причем один заместитель выбран из амино, моно- и диС1-4алкиламино, а другой заместитель выбран из карбоксила, С1-6алкилоксикарбонила; или предпочтительно, где
(е) Q является С1-6алкилом, необязательно, замещенным одним или двумя заместителями, каждый из которых независимо выбран из трифторметила, С3-7циклоалкила, Ar2, гидроксила, С1-4алкокси, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, С1-4алкоксикарбонил(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, или гетероциклом, выбранным из пирролидинила, дигидропирролила, имидазолила, триазолила, пиперидинила, гомопиперидинила, пиридила и тетрагидропиридила; или Q является С1-6алкилом, замещенным двумя заместителями, причем один заместитель выбран из амино, моно- и диС1-4алкиламино, а другой заместитель выбран из карбоксила и С1-6алкилоксикарбонила; или более предпочтительно, где
(f) Q является С1-6алкилом, необязательно, замещенным одним или двумя заместителями, каждый из которых независимо выбран из Ar2, гидроксила, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, С1-4алкоксикарбонил(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, пирролидинила, дигидропирролила, пиперидинила, гомопиперидинила, пиридила и тетрагидропиридила; или Q является С1-6алкилом, замещенным двумя заместителями, причем один заместитель выбран из амино, а другой заместитель выбран из карбоксила и С1-6алкилоксикарбонила; или более предпочтительно, где
(g) Q является С1-6алкилом, необязательно, замещенным одним или двумя заместителями, каждый из которых независимо выбран из аминокарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, пирролидинила, дигидропирролила, пиперидинила, гомопиперидинила и тетрагидропиридила; или Q является С1-6алкилом, замещенным двумя заместителями, причем один заместитель является амино, а другой заместитель выбран из карбоксила и С1-6алкилоксикарбонила; или
(h) Q является С1-6алкилом, необязательно, замещенным одним или двумя заместителями, каждый из которых независимо выбран из аминокарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, пирролидинила, дигидропирролила, пиперидинила, гомопиперидинила и тетрагидропиридила; или где
(i) Q является С1-6алкилом, необязательно, замещенным одним заместителем, выбранным из аминокарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, пирролидинила, дигидропирролила, пиперидинила, гомопиперидинила и тетрагидропиридила; и, необязательно, вторым заместителем, который является гидроксилом; или Q является С1-6алкилом, замещенным двумя заместителями, причем один заместитель является амино, а другой заместитель выбран из карбоксила и С1-6алкилоксикарбонила;
(j) Q является С1-6алкилом, необязательно, замещенным одним заместителем, выбранным из аминокарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, пирролидинила, дигидропирролила, пиперидинила, гомопиперидинила и тетрагидропиридила; и, необязательно, вторым заместителем, который является гидроксилом; или Q является С1-6алкилом, замещенным двумя заместителями, причем один заместитель является амино, а другой заместитель выбран из карбоксила и С1-6алкилоксикарбонила; или где
(k) Q является С1-6алкилом, необязательно, замещенным одним заместителем, выбранным из аминокарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила, пирролидинила, дигидропирролила, пиперидинила, гомопиперидинила и тетрагидропиридила; и, необязательно, вторым заместителем, который является гидроксилом; или где
(l) Q является С1-6алкилом, необязательно, замещенным аминокарбонилом, С1-4алкоксикарбонилом, аминокарбонилокси, Ar2(СН2)nкарбонилокси, моно- или ди(С1-4алкил)аминокарбонилом, аминосульфонилом, моно- или ди(С1-4алкил)аминосульфонилом, пирролидинилом, дигидропирролилом, пиперидинилом, гомопиперидинилом и тетрагидропиридилом; или где
(m) Q является С1-6алкилом, необязательно, замещенным аминокарбонилом, С1-4алкоксикарбонилом, аминокарбонилокси, моно- или ди(С1-4алкил)аминокарбонилом, аминосульфонилом, моно- или ди(С1-4алкил)аминосульфонилом, пирролидинилом, дигидропирролилом, пиперидинилом, гомопиперидинилом и тетрагидропиридилом.
В частности, Ar1 является фенилом или фенилом, замещенным 1, 2, 3 заместителями или 1, 2 заместителями, выбранными из тех, которые упомянуты в определении соединений формулы (I) или любой их подгруппы.
Кроме того, Ar2 является фенилом или фенилом, замещенным 1, 2, 3 заместителями или 1, 2 заместителями, выбранными из группы, состоящей из тех, которые упомянуты в определении соединений формулы (I) или любой их подгруппы.
В группе соединений формулы (I) или в любой из подгрупп соединений формулы (I):
(а) Ar1 предпочтительно является фенилом или фенилом, замещенным заместителями до 3, или заместителями до 2, или одним заместителем, выбранными из галогена, гидроксила, С1-6алкила, гидроксиС1-6алкила, трифторметила и С1-6алкилокси;
(b) Ar1, более предпочтительно, является фенилом или фенилом, замещенным заместителями до 3, или заместителями до 2, или одним заместителем, выбранным из галогена, гидроксила, С1-6алкила или С1-6алкокси;
(с) Ar1, более предпочтительно, является фенилом или фенилом, замещенным заместителями до 3, или заместителями до 2, или одним заместителем, выбранным из галогена и С1-6алкила.
Кроме того, особыми подгруппами соединений формулы (I) являются те соединения формулы (I) или любой подгруппы соединений формулы (I), представленные в описании, в которых Ar2 имеет значения, указанные для Ar1.
Кроме того, особыми подгруппами соединений формулы (I) являются те соединения формулы (I) или любой подгруппы соединений формулы (I), представленные в описании, где один из R2a и R3a является С1-6алкилом, а другой из R2a и R3a является водородом; в случае, когда R2a не является водородом, то R2b является С1-6алкилом, а R3b является водородом; в случае, когда R3a не является водородом, то R3b является С1-6алкилом, а R2b является водородом.
Особые подгруппы соединений включают группу соединений формулы (I) или любой подгруппы, представленной в описании, у которых R2a, R2b, R3a являются водородом, и R3b является С1-6алкилом.
Другими интересующими соединениями являются те соединения формулы (I), включая любые подгруппы соединений формулы (I), где t равно 2.
Предпочтительными соединениями являются те соединения, которые перечислены в таблицах 1-3, более конкретно, соединения под номерами 1-10 и 17-31.
Соединения формулы (I) или любой из их подгрупп могут быть получены, как показано на следующих схемах реакций.
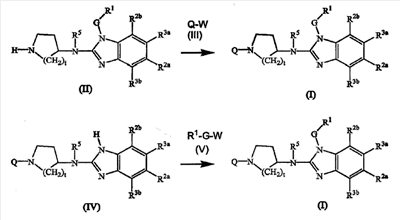
На этих схемах Q, G, t, R1, R2a, R2b, R3a, R3b, R5 имеют значения, указанные выше для соединений формулы (I) или любой их подгрупп.W является подходящей удаляемой группой, предпочтительно она является хлором или бромом. Реакции с этих схем обычно можно проводить в подходящем растворителе, таком как эфир, например ТГФ, галогенированный углеводород, например дихлорметан, CHCl3, толуол, полярный апротонный растворитель, такой как ДМФ, ДМСО, ДМА и тому подобное. Можно добавлять основание, чтобы связать кислоту, которая освобождается во время реакции. Если желательно, можно добавлять некоторые катализаторы, такие как иодидные соли (например, KI).
Соединения формулы (I) могут быть превращены друг в друга известными специалистам в данной области реакциями трансформации, включая описанные ниже.
Соединения формулы (I), где R5 является водородом, могут быть превращены в соответствующие соединения формулы (I), где он не является водородом, путем реакции N-алкилирования, которую проводят в условиях, подобных описанным выше для превращения (II) или (IV) в (I).
Ряд промежуточных соединений, используемых для получения соединений формулы (I), является известными соединениями или является аналогами известных соединений, которые могут быть получены в соответствии с модификациями известных специалистам методик, которые легко может понять специалист в данной области. Ряд методов получения промежуточных соединений представлен ниже несколько более детально.
Промежуточные соединения формулы (II) и (IV) могут быть получены, как в общих чертах описано в следующих схемах реакций.
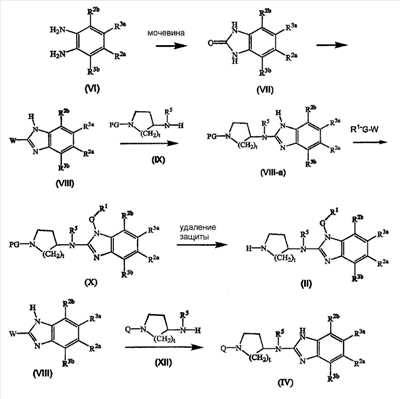
На первой стадии диаминобензол (VI) циклизируют с мочевиной, предпочтительно, в подходящем растворителе, например ксилоле, с получением бензимидазолона (VII). Последний превращают в бензимидазольное производное (VIII), где W является удаляемой группой, как описано выше, в частности, путем реакции (VII) с подходящим галогенирующим веществом, например POCl3. Полученное промежуточное соединение (VIII) приводят во взаимодействие с циклическим аминовым производным (IX) в реакции N-алкилирования с получением (VIII-а), которое превращают с помощью R1-G-W в промежуточное соединение (Х). Группа PG в (IX) и (Х) представляет подходящую защитную N группу, например алкилоксикарбонильную группу, такую как этилоксикарбонильная группа, которая может быть легко удалена, например, с помощью основания с получением промежуточных соединений (II).
Промежуточное соединение (VIII) может подобным же образом взаимодействовать с циклическим амином (XII) в реакции N-алкилирования с получением промежуточного соединения (IV). Указанные выше N-алкилирования проводят в подходящем растворителе и, если желательно, в присутствии основания.
Соединения формулы (I) можно превратить в соответствующие N-оксидные формы известными специалистам методиками для превращения трехвалентного азота в его N-оксидную форму. Указанную реакцию N-окисления можно в основном провести путем взаимодействия исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, перекись водорода, пероксиды щелочного металла или пероксиды щелочноземельного металла, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать надкислоты, такие как, например, бензолкарбопероксокислота или галогенозамещенная бензолкарбопероксокислота, например 3-хлорбензолкарбопероксокислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например этанол и тому подобное, углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей.
Стереохимически чистые изомерные формы соединений формулы (I) могут быть получены путем применения известных специалистам способов. Диастереомеры могут быть разделены физическими методами, такими как селективная кристаллизация и хроматографические методики, например противоточное распределение, жидкостная хроматография и тому подобное.
Соединения формулы (I), которые получены описанными выше процессами, обычно являются рацемическими смесями энантиомеров, которые могут быть отделены один от другого известными специалистам методами разделения. Рацемические соединения формулы (I), которые являются достаточно основными или кислотными, могут быть превращены в соответствующие формы диастереомерной соли путем реакции с подходящей хиральной кислотой, соответственно, хиральным основанием. Указанные диастереомерные формы соли затем разделяют, например, селективной или фракционной кристаллизацией, и энантиомеры выделяют из них с помощью щелочи или кислоты. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в частности жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы могут быть также получены из соответствующих стереохимически чистых изомерных форм соответствующих исходных веществ при условии, что реакция происходит стереоспецифически. Предпочтительно, если желателен специфический стереоизомер, указанное соединение всегда синтезируют стереоспецифическими методами получения. При этих методах нужно преимущественно использовать энантиомерно чистые исходные вещества.
В дополнительном аспекте данное изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), как описано выше, или соединения любой из подгрупп соединений формулы (I), которые описаны выше, и фармацевтически приемлемый носитель. Терапевтически эффективное количество, в этом контексте, является количеством, достаточным для профилактического действия в отношении вирусной инфекции, для стабилизации или снижения вирусной инфекции, и в частности вирусной инфекции, вызванной РСВ, у инфицированных субъектов или субъектов, подвергающихся риску быть инфицированными. В еще одном дополнительном аспекте данное изобретение относится к способу получения фармацевтической композиции, которая описана выше, который включает смешивание до однородного состояния фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы (I), которое описано выше, или соединения любой из подгрупп соединений формулы (I), которые описаны выше.
Поэтому из соединений данного изобретения или любой их подгруппы могут быть приготовлены различные лекарственные формы в зависимости от путей их введения. В качестве подходящих композиций можно привести все композиции, обычно применяемые для системного введения лекарственных средств. Чтобы изготовить фармацевтические композиции данного изобретения эффективное количество конкретного соединения, необязательно в форме соли присоединения или комплекса с металлом, в качестве активного ингредиента смешивают до однородной смеси с фармацевтически приемлемым носителем, который может принимать различные формы, в зависимости от формы препарата, желательного пути введения. Эти фармацевтические композиции желательны в стандартной дозированной форме, пригодной, в частности, для введения перорально, ректально, чрескожно или путем парентеральной инъекции. Например, при изготовлении композиций в виде пероральной дозированной формы можно использовать любую из обычных фармацевтических сред, такую как, например, вода, гликоли, масла, спирты и тому подобное в случае жидких пероральных препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмал разных видов, сахара, каолин, улучшающие скольжение вещества, связывающие вещества, дезинтегрирующие вещества и тому подобное в случае порошков, пилюль, капсул и таблеток. Благодаря легкости применения таблетки и капсулы представляют пероральные дозированные формы из отдельных элементов с наибольшими преимуществами, и в этом случае, разумеется, применяют твердые фармацевтические носители. Для парентеральных композиций носитель будет обычно включать стерильную воду, по меньшей мере, большей частью, хотя могут быть включены и другие ингредиенты, например, для улучшения растворимости. Например, могут быть приготовлены инъекционные растворы, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть также изготовлены инъекционные суспензии, и в этом случае можно использовать подходящие жидкие носители, суспендирующие вещества и тому подобное. Сюда включены также препараты в виде твердого вещества, которые предназначены для превращения, незадолго перед использованием, в препараты в жидкой форме. В композициях, пригодных для чрескожного введения, носитель, необязательно, включает усиливающее проникновение вещество и/или подходящее улучшающее смачивание вещество, необязательно, в сочетании с подходящими добавками любой природы в незначительных пропорциях, причем эти добавки не привносят значительного вредного действия на кожу.
Соединения данного изобретения можно также вводить путем пероральной ингаляции или инсуффляции посредством методов и препаратов, применяемых в медицине для введения этим путем. Так, в основном, соединения данного изобретения можно вводить в легкие в виде раствора, суспензии или сухого порошка, причем предпочтительным является раствор. Любая система, разработанная для доставки растворов, суспензий или сухих порошков путем пероральной ингаляции или инсуффляции, пригодна для введения данных соединений.
Таким образом, данное изобретение относится также к фармацевтической композиции, адаптированной для введения путем ингаляции или инсуффляции через рот, содержащей соединение формулы (I) и фармацевтически приемлемый носитель. Предпочтительно, соединения данного изобретения вводят путем ингаляции раствора в виде небулайзерных или аэрозольных доз.
Особые преимущества дает изготовление вышеуказанных фармацевтических композиций в стандартной дозированной форме для легкости введения и единообразия дозировки. Стандартная дозированная форма, в соответствии с данным описанием, относится к физически изолированным элементам, пригодным в качестве одноразовой дозировки, причем каждый элемент содержит предопределенное количество активного ингредиента, рассчитанное на получение желаемого терапевтического эффекта в сочетании с нужным фармацевтическим носителем. Примерами таких стандартных дозированных форм являются таблетки (включая таблетки с риской или покрытые оболочкой), капсулы, пилюли, суппозитории, пакетики с порошком, облатки, инъекционные растворы или суспензии и тому подобное и их множества из изолированных элементов.
Соединения формулы (I) проявляют противовирусные свойства. Вирусные инфекции, которые можно лечить, используя соединения и способы данного изобретения, включают те инфекции, которые вызываются орто- и пара-миксовирусами и, в частности, респираторным вирусом (РСВ) человека и крупного рогатого скота. Ряд соединений данного изобретения, кроме того, является активным против мутантных штаммов РСВ. Кроме того, многие соединения данного изобретения демонстрируют благоприятные фармакокинетические характеристики и имеют привлекательные свойства в плане биодоступности, включая приемлемый период полувыведения, ППК и значения пика, и отсутствие неблагоприятных проявлений, таких как недостаточно быстрое начало действия и сохранение в тканях.
Противовирусная активность in vitro в отношении РСВ соединений данного изобретения определена при испытании, как описано в экспериментальной части описания, и может быть также продемонстрирована в исследовании по снижению продукции вируса. Противовирусная активность in vitro в отношении РСВ соединений данного изобретения может быть продемонстрирована на модели испытания с использованием хлопковых хомяков, как описано у Wide et al. (Antiviral Research (1998), 38, 31-42).
Благодаря их противовирусным свойствам, в частности их свойствам действия против РСВ, соединения формулы (I) или любая их подгруппа, их пролекарства, N-оксиды, соли присоединения, четвертичные амины, комплексы с металлами и стереохимически изомерные формы пригодны для лечения индивидуумов с вирусной инфекцией, в частности инфекцией, вызванной РСВ, и для профилактики этих инфекций. В основном, соединения данного изобретения могут быть полезны при лечении теплокровных животных, инфицированных вирусами, в частности респираторным вирусом.
Соединения данного изобретения или любую их подгруппу поэтому можно использовать в качестве лекарственных средств. Указанное использование в качестве лекарственного средства или в способе лечения включает системное введение инфицированным вирусом пациентам или пациентам, восприимчивым к вирусным инфекциям, количества, эффективного для борьбы с патологическими состояниями, связанными с вирусной инфекцией, в частности инфекцией РСВ.
Настоящее изобретение относится также к использованию данных соединений или любой их подгруппы в производстве лекарственного средства для лечения или профилактики вирусных инфекций, в частности инфекции РСВ.
Данное изобретение, кроме того, относится к способу лечения теплокровного животного, инфицированного вирусом или подвергающегося риску инфицирования вирусом, в частности РСВ, причем указанный способ включает введение эффективного против вируса количества соединения формулы (I), которое представлено в описании, или соединения любой из подгрупп соединений формулы (I), которые представлены в описании.
В основном, предполагается, что эффективное против вируса суточное количество должно составлять от 0,01 мг/кг до 500 мг/кг веса тела, более предпочтительно, от 0,1 мг/кг до 50 мг/кг веса тела. Необходимую дозу можно вводить как две, три или четыре дробные дозы или более дробных доз через соответствующие интервалы в течение суток. Указанные дробные дозы могут быть изготовлены в виде стандартных дозированных форм, например, содержащих от 1 до 1000 мг, и, в частности, от 5 до 200 мг активного ингредиента на элемент дозированной формы.
Точная дозировка и частота введения зависит от конкретного применяемого соединения формулы (I), конкретного патологического состояния, которое нужно лечить, тяжести состояния, которое нужно лечить, возраста, веса, пола, степени расстройства и общего физического состояния конкретного пациента, а также другого лекарственного лечения, которое может принимать конкретный индивидуум, как известно специалистам в данной области. Кроме того, очевидно, что указанное эффективное суточное количество соединения может быть снижено или увеличено в зависимости от реакции у получающего лечение пациента и/или в зависимости от оценки врачом, прописывающим соединения рассматриваемого изобретения. Пределы эффективного суточного количества, указанные выше, являются поэтому только общими указаниями.
К тому же в качестве лекарственного средства можно использовать комбинацию другого противовирусного средства и соединения формулы (I). Таким образом, данное изобретение относится также к продукту, содержащему (а) соединение формулы (I), и (b) другому противовирусному соединению в виде комбинированного препарата для одновременного, раздельного или последовательного применения при противовирусном лечении. Разные лекарственные средства могут быть объединены в одном препарате вместе с фармацевтически приемлемыми носителями. Например, соединения данного изобретения могут сочетаться с интерфероном-бета или альфа-фактором некроза опухоли для лечения или предотвращения инфекций РСВ.
Примеры
Следующие примеры предназначены только для иллюстрации данного изобретения, а не ограничиваясь ими. Термины «соединение 1», «соединение 4» и т.д., использованные в этих примерах, относятся к тем же соединениям в таблицах.
Данные соединения анализировали ЖХ/МС, используя следующее оборудование:
ЖХТ: электроспрей-ионизация с положительным зарядом, режим сканнирования от 100 до 900 аем; Xterra МС С18 (Waters, Milford, MA) 5 мкм, 3,9 х 150 мм); скорость потока 1 мл/мин. Использовали две подвижные фазы (подвижная фаза А: 85% 6,5 мМ ацетат аммония+15% ацетонитрила; подвижная фаза В: 20% 6,5 мМ ацетат аммония+80% ацетонитрила) для прогона градиента от 100% А в течение 3 мин до 100% В за 5 мин, от 100% В в течение 6 мин до 100% А через 3 мин, и уравновешивание снова 100% А в течение 3 мин.
ZQ: электроспрей-ионизация, как положительная, так и отрицательная (пульсирующая) ионизация, режим сканирования от 100 до 1000 аем; Xterra RP С18 (Waters, Milford, MA) 5 мкм, 3,9 х 150 мм); скорость потока 1 мл/мин. Использовали две подвижные фазы (подвижная фаза А: 85% 6,5 мМ ацетат аммония+15% ацетонитрила; подвижная фаза В: 20% 6,5 мМ ацетат аммония+80% ацетонитрила) для прогона градиента при условиях от 100% А в течение 3 мин до 100% В за 5 мин, от 100% В в течение 6 мин до 100% А через 3 мин, и уравновешивание снова 100% А в течение 3 мин.
Пример 1: Получение диметилбензимидазольных промежуточных соединений
Схема А-1
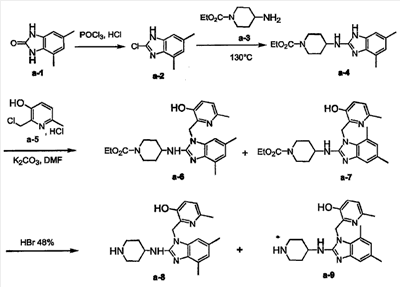
а) Смесь а-1 (0,06 моль) и POCl3 (100 мл) нагревали до 100°С и по каплям, очень осторожно добавляли 12 н HCl (2,5 мл). Затем реакционную смесь перемешивали в течение 12 часов при 120°С и давали остыть до комнатной температуры. Растворитель выпаривали при пониженном давлении и добавляли 10% раствор карбоната калия в воде до выпадения осадка. Полученный осадок отфильтровывали, промывали водой и сушили, получая 10 г а-2 (93%, температура плавления=152°С).
b) а-2 (0,022 моль) и а-3 (0,088 моль) перемешивали при 130°С в течение 12 часов. Реакционной смеси затем давали остыть до комнатной температуры, остаток абсорбировали ацетоном и осадок отфильтровывали. Ацетоновый раствор концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/МеОН/NH4OH 95/5/0,1). Чистые фракции собирали и растворитель выпаривали, получая 5 г а-4 (72%).
с) Смесь а-4 (0,0158 моль), а-5 (0,019 моль) и карбоната калия (0,0553 моль) в диметилформамиде (100 мл) перемешивали при 70°С в течение 24 часов. Растворитель выпаривали досуха. Остаток абсорбировали смесью CH2Cl2/СН3ОН (90/10). Органический слой промывали 10% раствором К2СО3 в воде, сушили (над MgSO4), фильтровали, и растворитель выпаривали при пониженном давлении. Остаток абсорбировали 2-пропаноном. Остаток отфильтровывали, промывали Н2О и сушили, получая 5 г а-6 и а-7 (смесь 50/50, 73%).
d) Смесь а-6 и а-7 (0,0103 моль) в 48% растворе HBr в воде (50 мл) перемешивали при 60°С в течение 12 часов. Растворитель выпаривали досуха. Остаток абсорбировали смесью CH2Cl2/СН3ОН (90/10). Добавляли 10% К2СО3 в воде. Водный слой насыщали К2СО3 (порошок). Органический слой отделяли, сушили (над MgSO4), фильтровали, и растворитель выпаривали досуха, получая 3,7 г а-8 и а-9 (100%). Этот продукт непосредственно использовали на следующей стадии реакции.
Пример 2: Получение диметилбензимидазольных целевых продуктов
Схема А-2
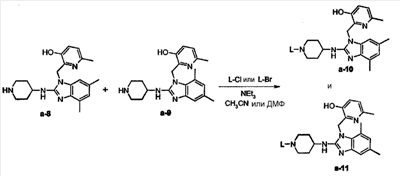
Вариант 1:
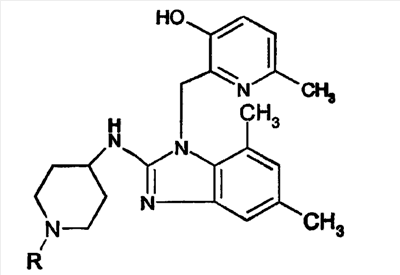
Смесь а-8 (0,0002 моль), а-9 (0,0002 моль), 2-бромэтанола (0,0006 моль) и триэтиламина (0,0011 моль) в ацетонитриле (10 мл) перемешивали при 30°С в течение 12 часов. Растворитель выпаривали досуха. Остаток собирали (абсорбировали) в CH2Cl2. Органический слой промывали Н2О, сушили (над MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент CH2Cl2/СН3ОН/NH4OH 85/15/1; 10 мкм). Две фракции собирали, и растворитель выпаривали, получая: 0,028 г фракции 1 (12,4%) и 0,05 г фракции 2 (22%). Фракцию 1 кристаллизовали из 2-пропанона/диизопропилового эфира. Осадок отфильтровывали и сушили, получая 0,015 г 2-{2-[1-(2-гидроксиэтил)пиперидин-4-иламино]-5,7-диметилбензоимидазол-1-илметил}-6-метилпиридин-3-ола (6,6%, температура плавления: 143°С). Фракцию 2 кристаллизовали из 2-пропанона/диизопропилового эфира. Осадок отфильтровывали и сушили, получая 0,03 г 2-{2-[1-(2-гидроксиэтил)-пиперидин-4-иламино]-4,6-диметилбензоимидазол-1-илметил}-6-метилпиридин-3-ола (соединение 2, 13%, температура плавления: 177°С).
Вариант 2:
Смесь а-8 (0,0008 моль), а-9 (0,0008 моль), 3-хлорпропансульфонамида (0,0019 моль) и триэтиламина (0,0024 моль) в диметилформамиде (50 мл) перемешивали при 70°С в течение 12 часов, затем выливали в Н2О и экстрагировали CH2Cl2. Органический слой отделяли, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (1 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН3ОН/NH4OH 90/10/0,5; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали, получая 0,12 г амида 3-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4,6-диметил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}-пропан-1-сульфоновой кислоты (соединение 1, 15%, температура плавления: 180°С).
Вариант 3
LiAlH4 (0,0002 моль) добавляли при 5°С к смеси этилового эфира 3-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4,6-диметил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}пропионовой кислоты (0,00009 моль; температура плавления: 172°С; полученного по методике, описанной в варианте 2) в тетрагидрофуране (10 мл) в потоке N2. Смесь перемешивали при 5°С в течение 1 часа, затем при комнатной температуре в течение 3 часов. Добавляли минимум Н2О и этилацетат. Органический слой отделяли, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток кристаллизовали из 2-пропанона/CH3CN/диизопропилового эфира. Осадок отфильтровывали и сушили, получая 0,026 г 2-{2-[1-(3-гидроксипропил)пиперидин-4-иламино]-4,6-диметилбензоимидазол-1-илметил}-6-метилпиридин-3-ола (соединение 4, 68%, температура плавления: 209°С).
Вариант 4
Смесь этилового эфира 3-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4,6-диметил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}пропионовой кислоты (0,0065 моль) в метаноле/NH3 7 н (15 мл) перемешивали в герметично закрытом сосуде при 70°С в течение 12 часов. Растворитель выпаривали досуха. Остаток (0,3 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН3ОН/NH4OH 85/14/1; 5 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,09 г, 32%) кристаллизовали из диизопропилового эфира. Осадок отфильтровывали и сушили, получая 0,086 г 3-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4,6-диметил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}пропионамида (соединение 5, 30%, температура плавления: 212°С).
| Таблица 1 – соединения, полученные по схеме А-2 |
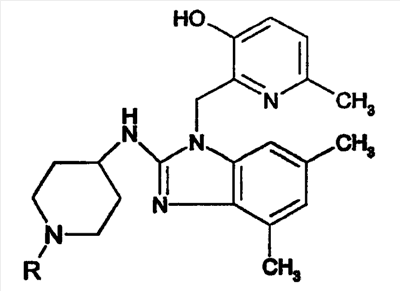 |
Соединение
 |
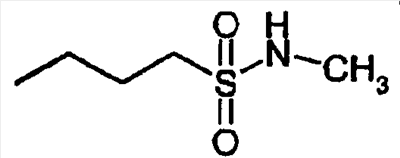
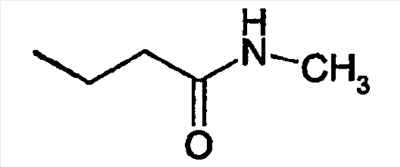
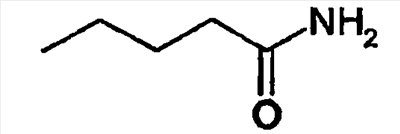
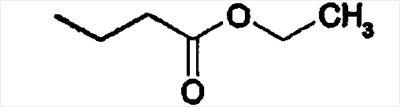
-R |
Активность |
Масс-спектроскопия |
Температура плавления |
Вариант |
| 1 |
 |
8,7 |
МН+=487 |
180°С |
2 |
| 2 |
 |
8,5 |
МН+=410 |
177°С |
1 |
| 3 |
 |
8,5 |
МН+=473 |
242°С |
2 |
| 4 |
 |
8,1 |
МН+=424 |
209°С |
3 |
| 5 |
 |
 |
МН+=437 |
212°С |
4 |
| 6 |
 |
7,8 |
МН+=501 |
179°С |
2 |
| 7 |
 |
7,6 |
МН+=451 |
186°С |
4 |
| 8 |
 |
7,6 |
МН+=438 |
206°С |
3 |
| 9 |
 |
7,4 |
МН+=451 |
206°С |
4 |
| 10 |
 |
7,1 |
МН+=466 |
172°С |
2 |
| 11 |
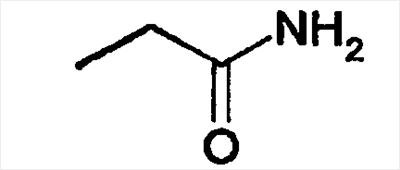 |
6,8 |
МН+=423 |
226°С |
4 |
| 12 |
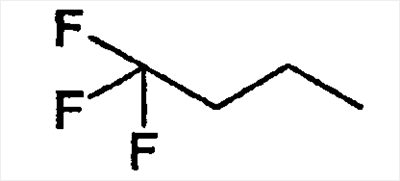 |
6,8 |
МН+=462 |
>260°С |
2 |
| 13 |
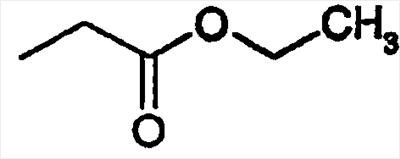 |
6,5 |
МН+=452 |
186°С |
1 |
| 14 |
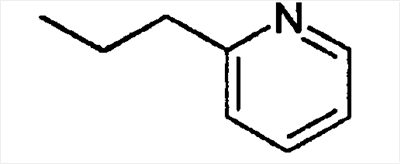 |
6,5 |
МН+=471 |
161°С |
2 |
 |
 |
 |
 |
 |
 |
| Таблица 2 – Дополнительные соединения, полученные по схеме А-2 |
 |
Соединение
 |
-R |
Активность |
Масс-спектроскопия |
Температура плавления |
Вариант |
| 15 |
 |
6,4 |
МН+=410 |
143°С |
1 |
| 16 |
 |
5,8 |
МН+=452 |
186°С |
2 |
Пример 3: Получение метилбензимидазольных промежуточных соединений
Схема В-1
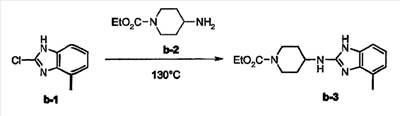
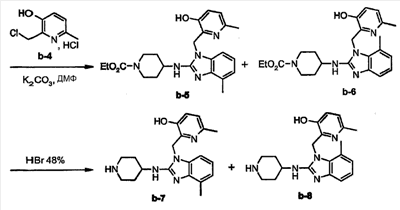
а) Получение этого промежуточного соединения b-3 аналогично получению промежуточного соединения а-4.
b) Получение этих промежуточных соединений b-5 и b-6 аналогично получению промежуточных соединений а-6 и а-7.
с) Получение этих промежуточных соединений b-7 и b-8 аналогично получению промежуточных соединений а-8 и а-8. Кроме того, b-7 было выделено чистым после кристаллизации с помощью диизопропилового эфира (температура плавления:>260°С).
Пример 4: Получение целевых продуктов метилбензимидазольных конечных промежуточных соединений
Схема В-2
Вариант 1
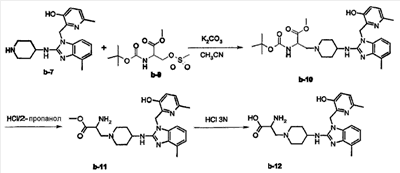
а) Смесь b-7 (0,0056 моль), b-9 (0,0113 моль) и К2СО3 (0,0171 моль) в CH3CN (30 мл) перемешивали и нагревали с обратным холодильником в течение 6 часов. Растворитель выпаривали. Остаток собирали в CH2Cl2 и промывали насыщенным раствором NaCl в воде. Органический слой отделяли, сушили (над MgSO4), фильтровали и растворитель выпаривали. Остаток (2,4 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН3ОН/NH4OH 95/5/0,2; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали, получая 1 г промежуточного соединения b-10 (32%).
b) Насыщенный раствор HCl в 2-пропаноле (1,5 мл) добавляли при комнатной температуре к смеси b-10 (0,0013 моль) в 2-пропаноле (15 мл). Смесь перемешивали при 60°С в течение 12 часов, а затем охлаждали до комнатной температуры. Осадок отфильтровывали, промывали 2-пропанолом, затем диэтиловым эфиром и сушили, получая 0,79 г. Эту фракцию кристаллизовали из 2-пропанола. Осадок отфильтровывали, промывали диэтиловым эфиром и сушили, получая 0,11 г b-11 (14%).
с) Смесь b-11 (0,0011 моль) в 3 н растворе HCl в воде (5 мл) перемешивали и нагревали с обратным холодильником в течение 6 часов, затем охлаждали до комнатной температуры и растворитель выпаривали. Остаток (0,4 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН3ОН/NH4OH 70/30/3; 15-40 мкм). Две фракции собирали и растворитель выпаривали. Выход: 0,111 г. Эту фракцию кристаллизовали из этанола. Осадок отфильтровывали и сушили, получая 0,03 г b-12 (соединение 23, 5%, температура плавления: 195°С).
Вариант 2:
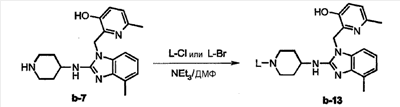
Амид 3-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}-пропан-1-сульфоновой кислоты (соединение 19, температура плавления 250°С) получали аналогично процедуре, описанной в варианте 2, схема А-2.
Вариант 3:
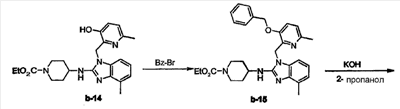
а) Смесь b-14 (0,0236 моль), бензилбромида (Bz-Br, 0,026 моль) и К2СО3 (0,0354 моль) в смеси CH3CN (50 мл), диметилформамида (50 мл) и тетрагидрофурана (100 мл) перемешивали при 60°С в течение 24 часов. Растворитель выпаривали досуха. Остаток собирали в Н2О. Осадок отфильтровывали, промывали Н2О и экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (12 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН3ОН/NH4OH 98/2/0,1; 15-40 мкм). Собирали три фракции и растворитель выпаривали, получая 5 г b-15 (41,3%).
b) Смесь b-15 (0,0095 моль) и КОН (0,0095 моль) в 2-пропаноле (60 мл) перемешивали и нагревали с обратным холодильником в течение 4 часов. Растворитель выпаривали досуха. Остаток собирали в CH2Cl2. Органический слой промывали Н2О, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха, получая 5 г b-16 (>100%, температура плавления: 182°С). Данный продукт непосредственно использовали на следующей стадии реакции.
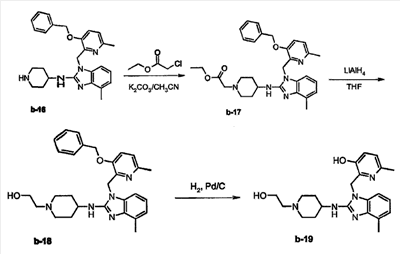
с) Смесь b-16 (0,0307 моль), этилхлорацетата (0,037 моль) и К2СО3 (0,046 моль) в CH3CN (150 мл) перемешивали при 60°С в течение 12 часов. Растворитель выпаривали досуха. Остаток собирали в CH2Cl2. Органический слой промывали Н2О, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток кристаллизовали из 2-пропанона/CH3CN. Осадок отфильтровывали и сушили, получая 14,5 г b-17 (89,5%, температура плавления: 116°С).
d) LiAlH4 (0,047 моль) добавляли частями при 5°С к смеси b-17 (0,023 моль) в тетрагидрофуране (250 мл) в потоке N2. Смесь перемешивали при 5°С в течение 2 часов. Добавляли Н2О. Смесь экстрагировали этилацетатом и фильтровали через целит. Органический слой отделяли, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха, получая 8 г b-18 (71,6%, температура плавления: 159°С).
е) Смесь b-18 (0,0004 моль) и Pd/С (0,1 г) в СН3ОН (20 мл) гидрировали при 40°С в течение 3 часов под давлением 5 бар, затем охлаждали и фильтровали через целит. Фильтрат выпаривали досуха, получая 0,16 г (100%). Эту фракцию кристаллизовали из 2-пропанона/диизопропилового эфира. Осадок отфильтровывали и сушили, получая 0,07 г b-19 (соединение 22, 43%, температура плавления: 258°С).
Вариант 4:
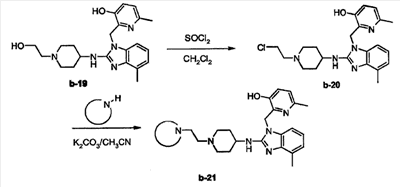
а) SOCl2 (0,0214 моль) каплями добавляли к раствору b-19 с CH2Cl2 при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов. Осадок отфильтровывали, промывали диизопропиловым эфиром и сушили, получая b-20 (100%). Неочищенное вещество использовали на следующей реакционной стадии.
b) Смесь b-20 (0,0011 моль), К2СО3 (0,0038 моль) и пирролидина (0,0013 моль) в CH3CN (10 мл) перемешивали при 70°С в течение 12 часов. Добавляли Н2О. Смесь экстрагировали CH2Cl2. Органический слой отделяли, сушили (над MgSO4), фильтровали и растворитель выпаривали. Остаток (0,27 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН3ОН/NH4OH 88/11/1; 10 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,14 г) кристаллизовали из CH3CN/2-пропанона. Осадок отфильтровывали и сушили, получая 0,105 г 6-метил-2-{4-метил-2-[1-(2-пирролидин-1-илэтил)пиперидин-4-иламино]-бензимидазол-1-илметил}пиридин-3-ола (соединение 18, 28%, температура плавления: 225°С).
Вариант 5
а) Этиловый эфир 3-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}пропионовой кислоты (температура плавления: 226°С) получали аналогично методике, описанной для получения b-19.
b) 3-{4-[1-(3-Гидрокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}пропионамид (соединение 27; температура плавления: 258°С) получали аналогично методике, описанной в варианте 4, схема А-2.
Вариант 6
а) Смесь b-18 (0,002 моль), фенилуксусной кислоты (0,0024 моль), ДЦК (DCC; 0,0029 моль) и ДМАП (0,0029 моль) в ТГФ (50 мл) перемешивали при комнатной температуре в течение 12 часов. Добавляли Н2О. Смесь экстрагировали этилацетатом и фильтровали. Органический слой отделяли, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (1,5 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН3ОН/NH4OH 96/4/0,1; 15-35 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (1,2 г, 96%) кристаллизовали из диизопропилового эфира. Осадок отфильтровывали, сушили, получая 0,8 г фенилуксусной кислоты 2-{4-[1-(3-бензилокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензимидазол-2-иламино]пиперидин-1-ил}-этилового эфира (64%, температура плавления: 105°С).
b) 2-{4-[1-(3-Гидрокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]пиперидин-1-ил}этиловый эфир фенилуксусной кислоты (соединение 24, температура плавления: 207°С) получали аналогично методике, описанной для b-19.
Вариант 7:
а) Смесь этилового эфира 3-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}пропионовой кислоты (0,0009 моль) в 3 н растворе HCl в воде (5 мл) перемешивали и нагревали с обратным холодильником в течение 18 часов, а затем охлаждали до комнатной температуры. Осадок отфильтровывали, промывали диэтиловым эфиром и сушили, получая 0,18 г гидрохлоридной соли 3-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]пиперидин-1-ил}пропионовой кислоты (соединение 33,31%, температура плавления: 245°С).
Вариант 8:
а) 1-{4-[1-(3-Гидрокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}-3-метилбутан-2-он получали аналогично методике, описанной для b-19.
b) NaBH4 (0,0003 моль) порциями добавляли к раствору 1-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]пиперидин-1-ил}-3-метилбутан-2-она (0,0002 моль) в тетрагидрофуране (2 мл) и СН3ОН (2 мл) при 5°С. Смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли 10% раствор К2СО3 в воде. Смесь экстрагировали CH2Cl2. Органический слой промывали Н2О, сушили (над MgSO4), фильтровали и растворитель выпаривали. Остаток (0,08 г) растворяли в CH2Cl2/СН3ОН и кристаллизовали из диизопропилового эфира. Осадок отфильтровывали, промывали диизопропиловым эфиром и сушили, получая 0,049 г 2-{2-[1-(2-гидрокси-3-метилбутил)пиперидин-4-иламино]-4-метилбензоимидазол-1-илметил}-6-метилпиридин-3-ола (соединение 35, 48%, температура плавления: 230°С).
Вариант 9:
а) Хлорсульфонилизоцианат (0,0021 моль) добавляли при -30°С к смеси b-18 (0,0009 моль) в этилацетате (15 мл) в потоке N2. Смесь перемешивали при -30°С в течение 1 часа, затем доводили до 0°С. Добавляли Н2О (0,5 мл), HCl 12 н (0,5 мл) и затем СН3ОН (1 мл). Смесь перемешивали при 40°С в течение 1 часа, затем охлаждали, подщелачивали К2СО3 и экстрагировали этилацетатом. Органический слой отделяли, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха, получая 0,46 г 2-{4-[1-(3-бензилокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}этилового эфира карбаминовой кислоты (94%).
b) 2-{4-[1-(3-гидрокси-6-метилпиридин-2-илметил)-4-метил-1Н-бензоимидазол-2-иламино]-пиперидин-1-ил}этиловый эфир карбаминовой кислоты (соединение 37, температура плавления: 222°С) был получен аналогично методике, описанной для b-19.
Вариант 10:
Смесь b-7 (0,0014 моль), глицидил-4-метоксифенилового эфира (0,0021 моль) в этаноле (10 мл) перемешивали и нагревали с обратным холодильником в течение 4 часов, затем охлаждали до комнатной температуры и растворитель выпаривали. Остаток (0,75 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН3ОН 90/10; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали, получая 0,101 г 2-(2-{1-[2-гидрокси-3-(4-метоксифенокси)пропил]-пиперидин-4-иламино}-4-метилбензоимидазол-1-илметил)-6-метилпиридин-3-ола (соединение 41, 13%, температура плавления: 227°С).
Вариант 11:
Формальдегид, 37% в воде (0,0017 моль) и NaBH3CN (0,001 моль) добавляли при комнатной температуре к смеси b-7 (0,0008 моль) в CH3CN (1 мл). Каплями добавляли уксусную кислоту (0,3 мл). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали досуха. Добавляли этанол (3 мл) и насыщенный раствор HCl в 2-пропаноле (1 мл). Смесь перемешивали при 80°С в течение 2 часов, подщелачивали 10% К2СО3 в воде и экстрагировали CH2Cl2. Органический слой отделяли, сушили (над MgSO4), фильтровали и растворитель выпаривали. Остаток (0,21 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН3ОН/NH4OH от 90/10/0,1 до 80/20/3; 35-70 мкм). Чистые фракции собирали и растворитель выпаривали досуха, получая 0,1 г 6-метил-2-[4-метил-2-(1-метилпиперидин-4-иламино)бензоимидазол-1-илметил]-пиридин-3-ол, соединение 34 (32%, температура плавления: 210 С). С).
| Таблица 3 – соединения, полученные по схеме В-2 |
 |
Соединение
 |
R |
Активность |
Масс-спектроскопия |
Температура плавления |
Вариант |
Соль |
| 17 |
 |
8,7 |
МН+=452 |
210°С |
1 |
HCl |
| 18 |
 |
8,0 |
МН+=449 |
225°С |
4 |
 |
| 19 |
 |
7,9 |
МН+=473 |
250°С |
2 |
 |
| 20 |
 |
7,9 |
МН+=426 |
240°С |
2 |
 |
| 21 |
 |
7,8 |
МН+=461 |
– |
4 |
 |
| 22 |
 |
7,7 |
МН+=396 |
258°С |
3 |
 |
| 23 |
 |
7,6 |
МН+=437 |
195°С |
1 |
HCl |
| 24 |
 |
7,5 |
МН+=514 |
207°С |
6 |
 |
| 25 |
 |
7,5 |
МН+=477 |
 |
4 |
 |
| 26 |
 |
7,4 |
МН+=447 |
 |
4 |
 |
| 27 |
 |
7,3 |
МН+=423 |
258°С |
5 |
 |
| 28 |
 |
7,3 |
МН+=487 |
217°С |
2 |
 |
| 29 |
 |
7,2 |
МН+=424 |
>260°С |
3 |
 |
| 30 |
 |
5,2 |
МН+=410 |
205°С |
7 |
HCl |
| 31 |
 |
7,1 |
МН+=451 |
220°С |
2 |
 |
| 32 |
 |
6,8 |
МН+=452 |
226°С |
2 |
 |
| 33 |
 |
6,8 |
МН+=424 |
245°С |
7 |
HCl |
| 34 |
-CH3 |
6,8 |
МН+=466 |
210°С |
11 |
 |
| 35 |
 |
6,8 |
МН+=438 |
230°С |
8 |
 |
| 36 |
 |
6,8 |
МН+=565 |
>260°С |
2 |
 |
| 37 |
 |
6,8 |
МН+=439 |
222°С |
9 |
 |
| 38 |
 |
6,8 |
МН+=446 |
 |
4 |
 |
| 39 |
 |
6,6 |
МН+=472 |
229°С |
8 |
 |
| 40 |
 |
6,5 |
МН+=450 |
230°С |
3 |
 |
| 41 |
 |
6,5 |
МН+=532 |
227°С |
10 |
 |
| 42 |
 |
6,5 |
МН+=520 |
230°С |
10 |
 |
| 43 |
 |
6,5 |
МН+=502 |
228°С |
10 |
 |
| 44 |
 |
6,4 |
МН+=409 |
254°С |
5 |
 |
| 45 |
 |
6,4 |
МН+=486 |
158°С |
10 |
 |
| 46 |
 |
6,4 |
МН+=447 |
 |
4 |
 |
| 47 |
 |
6,3 |
МН+=558 |
228°С |
2 |
 |
| 48 |
 |
6,2 |
МН+=422 |
230°С |
3 |
 |
| 49 |
 |
6,1 |
МН+=436 |
 |
3 |
 |
| 50 |
 |
6,1 |
МН+=452 |
255°С |
8 |
 |
| 51 |
 |
5,9 |
МН+=468 |
105°С |
6 |
 |
| 52 |
 |
5,8 |
МН+=558 |
196°С |
2 |
 |
| 53 |
 |
5,7 |
МН+=438 |
159°С |
3 |
 |
| 54 |
 |
5,7 |
МН+=464 |
>260°С |
10 |
 |
Пример 5: Отбор in vitro по активности против респираторного синцитиального вируса
Процент защиты от цитопатологии, вызываемой вирусами (противовирусная активность или ЕС50), получаемый с испытуемыми соединениями, и их цитотоксичность (СС50), обе рассчитывали по кривым зависимости реакции от дозы. Селективность противовирусного эффекта представляет показатель селективности (ПС; SI), рассчитываемый путем деления СС50 (цитотоксической дозы для 50% клеток) на ЕС50 (противовирусная активность для 50% клеток). В таблицах в представленной выше экспериментальной части в список включена группа, к которой принадлежит каждое полученное соединение. Соединения, принадлежащие по активности к группе «А», имеют рЕС50 (-log EC50, когда она выражена в молярных единицах), равный или более 7. Соединения, принадлежащие по активности к группе «В», имеют значение рЕС50 между 6 и 7. Соединения, принадлежащие по активности к группе «С», имеют значение рЕС50, равное или ниже 6.
Для определения ЕС50 и СС50 испытуемых соединений использовали автоматические колориметрические исследования на основе окрашивания тетразолием. Плоскодонные 96-луночные микротитровальные планшеты заполняли 180 мкл основной среды Игла, дополненной 5% ФТС (FCS) (0% по FLU) и 20 мМ буфера HEPES. Затем добавляли стандартные растворы (7,8 х конечная испытуемая концентрация) соединений в 45 мкл объемах с сериями из повторов в трех лунках так, чтобы была возможность одновременной оценки их действия на инфицированные вирусом и с имитацией инфицирования клетки. Производили пять пятикратных разведений непосредственно в микротитровальных планшетах, используя робототехнический комплекс. В каждое испытание были включены контроли с вирусом без воздействия соединениями и контроли клеток HeLa. Примерно 100 ТЦИД50 (TCID50) респираторного синцитиального вируса добавляли в два из трех рядов в объеме 50 мкл. Такой же объем среды добавляли в третий ряд для количественного определения цитотоксичности соединений при тех же концентрациях, как и используемые, для определения противовирусной активности. После двух часов инкубации суспензию клеток (4 х 105 клеток/мл) HeLa добавляли во все лунки в объеме 50 мкл. Культуры инкубировали при 37°С в атмосфере с 5% СО2. Через семь дней после инфицирования спектрофотометрически оценивали цитотоксичность и противовирусную активность. В каждую лунку микротитровальной планшеты добавляли 25 мкл раствора МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида). Планшеты дополнительно инкубировали при 37°С в течение 2 часов, после чего среду удаляли из каждой лунки. Растворения кристаллов формазана достигали добавлением 100 мкл 2-пропанола. Полное растворение кристаллов формазана получали после того как планшеты помещали на планшетный шейкер на 10 минут. И, наконец, поглощение считывали на восьмиканальном управляемом компьютером фотометре (Multiskan MCC, Flow Laboratories) при двух длинах волн (540 и 690 нм). Поглощение, измеренное при 690 нм, автоматически вычиталось из поглощения при 540 нм с тем, чтобы устранить эффекты неспецифического поглощения.
Формула изобретения
1. Соединение формулы (I)
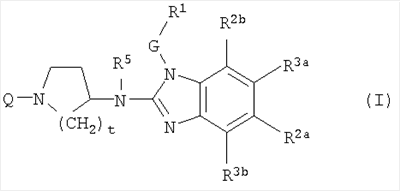
соль присоединения или его стереохимические изомерные формы, где
Q представляет C1-6алкил, необязательно замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из трифторметила, С3-7циклоалкила, Ar2, гидроксила, Ar2-окси-, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, аминокарбонилокси, С1-4алкоксикарбонила,
Ar2(СН2)nкарбонилокси, C1-4алкоксикарбонил-(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно(С1-4алкил)аминосульфонила, или гетероциклом, выбранным из группы, состоящей из пирролидинила, дигидропирролила, имидазолила, триазолила, гомопиперидинила, пиридила и тетрагидропиридила; или Q представляет C1-6алкил, замещенный двумя заместителями, причем один заместитель представляет собой аминогруппу, а другой заместитель представляет собой C1-6алкилоксикарбонил;
G представляет -СН2-;
R1 представляет пиридил, необязательно замещенный 2 заместителями, выбранными из группы заместителей, состоящей из гидроксила, C1-6алкила;
каждый n равен 1;
один из R2a и R3a представляет C1-6алкил, а другой из R2a и R3a представляет водород;
в случае, когда R2a не является водородом, R2b является C1-6алкилом, а R3b является водородом;
в случае, когда R3a не является водородом, R3b является C1-6алкилом, а R2b является водородом; или
R3b является C1-6алкилом; а R3a, R2a, R2b, все представляют собой водород; или
R5 является водородом;
t равен 2;
Ar2 является фенилом или фенилом, замещенным 1 или более, например, 2 заместителями, выбранными из галогена, C1-6алкилокси, аминосульфонила и C1-6алкоксикарбонила.
2. Соединение по п.1, где соединение имеет формулу
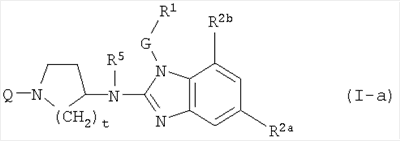
где Q, t, R5, G и R1 имеют значения, указанные в п.1; и
R2a представляет C1-6алкил;
R2b представляет C1-6алкил.
3. Соединение по п.1, где соединение имеет формулу
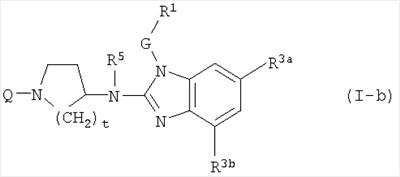
где Q, t, R5, G и R1 имеют значения, указанные в п.1; и
R3a представляет C1-6алкил;
R3b представляет C1-6алкил.
4. Соединение по п.1, где соединение имеет формулу
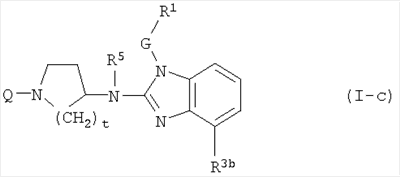
где Q, t, R5, G и R1 имеют значения, указанные в п.1; и
R3b представляет C1-6алкил.
5. Соединение по п.1, где Q является C1-6алкилом, необязательно замещенным одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из трифторметила, С3-7циклоалкила, Ar2, гидроксила, Ar2-окси-, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, С1-4алкоксикарбонил(СН2)nокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно(С1-4алкил)аминосульфонила, или гетероциклом, выбранным из группы, состоящей из пирролидинила, дигидропирролила, имидазолила, триазолила, гомопиперидинила и тетрагидропиридила, или Q является C1-6алкилом, замещенным двумя заместителями, причем один заместитель представляет собой амин, а другой заместитель представляет собой C1-6алкилоксикарбонил.
6. Соединение по п.1, где Q является C1-6алкилом, необязательно, замещенным одним или двумя заместителями, каждый из которых независимо выбран из аминокарбонила, С1-4алкоксикарбонила, аминокарбонилокси, Ar2(CH2)nкарбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно(С1-4алкил)аминосульфонила, пирролидинила, дигидропирролила, гомопиперидинила и тетрагидропиридила; или Q является C1-6алкилом, замещенным двумя заместителями, причем один заместитель является аминогруппой, а другой заместитель является C1-6алкилоксикарбонилом.
7. Соединение по п.1, где Q является C1-6алкилом, необязательно, замещенным одним заместителем, выбранным из аминокарбонила, C1-4алкоксикарбонила, аминокарбонилокси, Ar2(СН2)nкарбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно(С1-4алкил)аминосульфонила, пирролидинила, дигидропирролила, гомопиперидинила и тетрагидропиридила; и, необязательно, вторым заместителем, который является гидроксилом; или Q является
C1-6алкилом, замещенным двумя заместителями, причем один заместитель является аминогруппой, а другой заместитель является C1-6алкилоксикарбонилом.
8. Соединение по п.1, где Q является C1-6алкилом, замещенным аминокарбонилом,
C1-6алкоксикарбонилом, аминокарбонилокси, моно- или ди(С1-4алкил)аминокарбонилом, аминосульфонилом, моно(С1-4алкил)аминосульфонилом, пирролидинилом, дигидропирролилом, гомопиперидинилом и тетрагидропиридилом.
9. Фармацевтическая композиция, обладающая ингибирующим действием на репликацию респираторного синцитиального вируса (RSV), содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-8.
10. Применение соединения по любому из пп.1-8 для получения лекарственного средства для ингибирования репликации PCB(RSV).
|
|