|
|
(21), (22) Заявка: 2006102023/04, 24.06.2004
(24) Дата начала отсчета срока действия патента:
24.06.2004
(30) Конвенционный приоритет:
26.06.2003 US 60/483,428
29.08.2003 US 60/499,054
07.04.2004 US 60/560,481
(43) Дата публикации заявки: 10.08.2007
(46) Опубликовано: 10.02.2010
(56) Список документов, цитированных в отчете о
поиске:
RU 2000130199 А, 10.11.2002. WO 01/21591 A1, 29.03.2001. WO 03/032987 A1, 24.03.2003.
(85) Дата перевода заявки PCT на национальную фазу:
26.01.2006
(86) Заявка PCT:
US 2004/020384 20040624
(87) Публикация PCT:
WO 2005/009973 20050203
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, “ЕВРОМАРКПАТ”, пат.пов. И.А.Веселицкой, рег.  11 11
|
(72) Автор(ы):
ФРИЗМАН Ольга М. (US),
ЛАН Хеньгуйянь (US),
ЛАНЬ Цзян (US),
ЧАН Эдкон (US),
ФАН Юньфэн (US)
(73) Патентообладатель(и):
НОВАРТИС АГ (CH)
|
(54) ПРОИЗВОДНЫЕ 5-ЧЛЕННЫХ ГЕТЕРОЦИКЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ p38
(57) Реферат:
В настоящем изобретении предлагаются 5-членные гетероциклические ингибиторы киназы р38, включая киназу р38 и киназу р38 и киназу р38 , на основе пиразолов и имидазолов, имеющие приведенную ниже общую формулу, в которой кольцо В означает фенил и С означает кольцо пиразола или имидазола, а остальные символы имеют значения, приведенные в п.1 формулы изобретения. Описаны фармацевтические композиции, содержащие указанные соединения. Описаны также способы применения соединений и композиций, включая способ лечения, профилактики или ослабления одного или более симптомов заболеваний и состояний, опосредованных киназой р38, которые включают, без ограничения перечисленным, воспалительные заболевания и состояния. 4 н. и 27 з.п. ф-лы, 6 табл. , на основе пиразолов и имидазолов, имеющие приведенную ниже общую формулу, в которой кольцо В означает фенил и С означает кольцо пиразола или имидазола, а остальные символы имеют значения, приведенные в п.1 формулы изобретения. Описаны фармацевтические композиции, содержащие указанные соединения. Описаны также способы применения соединений и композиций, включая способ лечения, профилактики или ослабления одного или более симптомов заболеваний и состояний, опосредованных киназой р38, которые включают, без ограничения перечисленным, воспалительные заболевания и состояния. 4 н. и 27 з.п. ф-лы, 6 табл.
Область изобретения
Настоящее изобретение относится к производным 5-членных гетероциклов, включая производные пиразола и имидазола, которые проявляют эффективность при ингибировании цитокинов. Настоящее изобретение относится также к прменению таких соединений для лечения состояний, связанных с активностью киназ 38 и и  , а также киназы р38. , а также киназы р38.
Предпосылки создания изобретения
Множество цитокинов участвует в ответной воспалительной реакции, включая IL-1, IL6, IL-8 и TNF- . Избыточное продуцирование цитокинов, таких как IL-1 и TNF- . Избыточное продуцирование цитокинов, таких как IL-1 и TNF- , наблюдается при ряде заболеваний, включая воспаление кишечника, ревматоидный артрит, псориаз, рассеянный склероз, эндотоксический шок, остеопороз, болезнь Альцгеймера, а также застойную сердечную недостаточность (Henry и др., Drugs Fut., 24, cc.1345-1354 (1999); Salituro и др., Curr. Med. Chem., 6, cc.807-823 (1999)). Клинические испытания свидетельствуют об эффективности белковых антагонистов цитокинов при лечении хронических воспалительных заболеваний, таких как, например, моноклональные антитела к TNF- , наблюдается при ряде заболеваний, включая воспаление кишечника, ревматоидный артрит, псориаз, рассеянный склероз, эндотоксический шок, остеопороз, болезнь Альцгеймера, а также застойную сердечную недостаточность (Henry и др., Drugs Fut., 24, cc.1345-1354 (1999); Salituro и др., Curr. Med. Chem., 6, cc.807-823 (1999)). Клинические испытания свидетельствуют об эффективности белковых антагонистов цитокинов при лечении хронических воспалительных заболеваний, таких как, например, моноклональные антитела к TNF- (ремикад, Rankin и др., Br. J. Rheumatol., 34, cc.334-342 (1995)) и растворимый гибридный белок рецептора-Fc TNF- (ремикад, Rankin и др., Br. J. Rheumatol., 34, cc.334-342 (1995)) и растворимый гибридный белок рецептора-Fc TNF- (энтанерцепт) (Moreland и др., 25 Ann. Intern. Med., 130, cc.478-486 (1999)). (энтанерцепт) (Moreland и др., 25 Ann. Intern. Med., 130, cc.478-486 (1999)).
Биосинтез TNF- происходит во многих типах клеток в ответ на внешний стимул, такой как, например, митоген, инфекция или травма. Важными медиаторами прдуцирования TNF- происходит во многих типах клеток в ответ на внешний стимул, такой как, например, митоген, инфекция или травма. Важными медиаторами прдуцирования TNF- являются активированные митогеном белки, киназы (MAP) и, прежде всего, киназы р38. Такие киназы активируются в ответ на различные стресс-факторы, включающие, без ограничения перечисленным, провоспатительные цитокины, эндотоксин, ультрафиолетовое облучение и осмотический шок. Для активации р38 необходимо двойное фосфорилирование на более ранних стадиях метаболического пути киназами каназ MAP (MKK3 и МКК6) по остаткам треонина и тирозина в фрагменте Thr-Gly-Tyr, содержащемся в изоферментах р38. являются активированные митогеном белки, киназы (MAP) и, прежде всего, киназы р38. Такие киназы активируются в ответ на различные стресс-факторы, включающие, без ограничения перечисленным, провоспатительные цитокины, эндотоксин, ультрафиолетовое облучение и осмотический шок. Для активации р38 необходимо двойное фосфорилирование на более ранних стадиях метаболического пути киназами каназ MAP (MKK3 и МКК6) по остаткам треонина и тирозина в фрагменте Thr-Gly-Tyr, содержащемся в изоферментах р38.
Известно 4 изоформы киназы р38, т.е. р38 , р38 , р38 , р38 , р38 и р38 и р38 . .  – и – и  -Изоформы экспрессируются в воспалительных клетках и являются главными модуляторами продуцирования TNF- -Изоформы экспрессируются в воспалительных клетках и являются главными модуляторами продуцирования TNF- . Ингибирование ферментов р38 . Ингибирование ферментов р38 и и  в клетках приводит к снижению экспрессии TNF- в клетках приводит к снижению экспрессии TNF- . Установлено, что при введении ингибиторов р38 . Установлено, что при введении ингибиторов р38 и и  при испытании на моделях животных с воспалительными заболеваниями такие ингибиторы проявляют эффективность при лечении указанных заболеваний. В связи с этим ферменты р38 играют важную роль в воспалительных процессах, опосредованных IL-1 и TNF- при испытании на моделях животных с воспалительными заболеваниями такие ингибиторы проявляют эффективность при лечении указанных заболеваний. В связи с этим ферменты р38 играют важную роль в воспалительных процессах, опосредованных IL-1 и TNF- (см., например, патенты US (см., например, патенты US   6277989, 6130235, 6147080, 5945418, 6251914, 5977103, 5658903, 5932576 и 6087496, а также международные заявки на выдачу патентов WO 00/56738, WO 01/27089. WO 01/34605, WO 00/12497, WO 00/56738, WO 00/12497 и WO 00/12074, патенты US 6277989, 6130235, 6147080, 5945418, 6251914, 5977103, 5658903, 5932576 и 6087496, а также международные заявки на выдачу патентов WO 00/56738, WO 01/27089. WO 01/34605, WO 00/12497, WO 00/56738, WO 00/12497 и WO 00/12074, патенты US   6376527, 6316466 и 6444696 и международные заявки на выдачу патентов WO 99/57101, WO 02/40486, WO 03/032970, WO 03/033482, WO 03/032971, WO 03/032986, WO 03/032980, WO 03/032987, WO 03/033483, WO 03/033457 и WO 03/032972. 6376527, 6316466 и 6444696 и международные заявки на выдачу патентов WO 99/57101, WO 02/40486, WO 03/032970, WO 03/033482, WO 03/032971, WO 03/032986, WO 03/032980, WO 03/032987, WO 03/033483, WO 03/033457 и WO 03/032972.
Таким образом, существует необходимость в разработке ингибиторов киназ р38, включая киназы р38а и p38b, для лечения, профилактики или ослабления от одного или более симптомов заболеваний и нарушений, связанных с активностью киназы р38.
Краткое изложение сущности изобретения
В настоящем изобретении предлагаются соединения, композиции и способы лечения, профилактики или ослабления одного или более симптомов состояний, связанных с активностью киназы р38. В одном варианте соединениями, используемыми в композициях и способах по настоящему изобретению, являются производные пиразола или имидазола. В другом варианте производные пиразола или имидазола используют в качестве ингибиторов киназ, включая киназы р38 и р38 и р38 . .
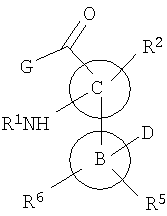
В одном варианте предлагаются соединения формулы
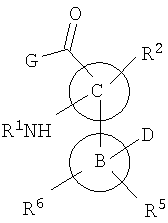
или их фармацевтически приемлемые производные, где:
R1 означает водород, ацил или -Р(O)(ОН)2;
R2 означает водород, галоген, необязательно замещенный алкил, алкилтио, алкилсульфинил, алкилсульфонил, необязательно замещенный алкокси, необязательно замещенный гетероциклилокси или алкиламино;
G означает арил, аралкил, циклоалкил, гетероарил, гетероаралкил или гетероциклил, необязательно конденсированный с фенильным кольцом и замещенный группами R3 и R4, при условии, что гетероциклическое кольцо присоединено к карбонильной группе через атом углерода в цикле или G означает OR83 или NR80R81;
В означает арил или гетероарил;
С означает 5-членное гетероарильное кольцо, содержащее один или два гетероатома в цикле;
D означает гетероарил, необязательно замещенный гетероарил или -C(O)NR80R81;
каждый R80 и R81 независимо означает водород, алкил, циклоалкил, алкокси, гидрокси, гетероарил или необязательно замещенный гетероарил;
R83 означает водород, алкил, циклоалкил, гетероарил или необязательно замещенный гетероарил;
R3 выбирают из группы, включающей:
(а) амино, алкиламино или диалкиламино,
(б) ациламино,
(в) необязательно замещенный гетероциклил,
(г) необязательно замещенные арил или гетероарил,
(д) гетероалкил,
(е) гетероалкенил,
(ж) гетероалкинил,
(з) гетероалкокси,
(и) гетероалкиламино,
(к) необязательно замещенный гетероциклилалкил,
(л) необязательно замещенный гетероциклилалкенил,
(м) необязательно замещенный гетероциклилалкинил,
(н) необязательно замещенный гетероциклилалкокси или гетероциклилокси,
(о) необязательно замещенный гетероциклилалкиламино,
(п) необязательно замещенный гетероциклилалкилкарбонил,
(р) гетероалкилкарбонил;
(с) -NHSO2R6, где R6 означает алкил, гетероалкил или необязательно замещенный гетероциклилалкил;
(т) -NHSO2NR7R8, где R7 и R8 независимо друг от друга означают водород, алкил или гетероалкил;
(у) -Y-(алкилен)-R9, где Y означает простую связь, -O-, -NH- или -S(O)n- (где n означает простое число от 0 до 2) и R9 означает галоген, циано, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный гетероциклил, -СООН, -COR10, -COOR11, -CONR12R13, -SO2R14, -SO2NR15R16, -NHSO2R17 или -NHSO2NR18R19, где R10 означает алкил или необязательно замещенный гетероцикл, R11 означает алкил, a R12, R13, R14, R15, R16, R17, R18 и R19 независимо друг от друга означают водород, алкил или гетероалкил;
(ф) -C(=NR20)(NR21R22), где R20, R21 и R22 независимо означают водород, алкил или гидрокси или R20 и R21 вместе означают -(CH2)n-, где n равно 2 или 3, а R22 означает водород, алкил;
(х) -NHC(X)NR23R24, где Х означает -О- или -S-, а R23 и R24 независимо друг от друга означают водород, алкил или гетероалкил;
(ц) -CONR25R26, где R25 и R26 независимо означают водород, алкил, гетероалкил или необязательно замещенный гетероциклилалкил, или R25 и R26 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенный гетероциклил;
(ч) -S(O)nR27, где n означает простое число от 0 до 2 и R27 означает алкил, гетероалкил, необязательно замещенный гетероциклилалкил или -NR28R29, где R28 и R29 независимо друг от друга означают водород, алкил или гетероалкил;
(ш) циклоалкилалкил, циклоалкилалкенил и циклоалкилалкинил, причем все указанные группы необязательно замещены группами алкил, галоген, гидрокси или амино;
(щ) ариламиноалкилен или гетероариламиноалкилен;
(э) Z-алкилен-NR30R31 или Z-алкилен-OR32, где Z означает -NH-, -N((низш.)алкил)- или -O-, а R30, R31 и R32 независимо друг от друга означают водород, алкил или гетероалкил;
(ю) -ОС(O)-алкилен-CO2H или -OC(O)-NR’R” (где R’ и R” независимо означают водород или алкил),
(я) гетероарилалкенилен или гетероарилалкинилен,
(аа) водород
(бб) галоген,
(вв) псевдогалоген,
(гг) гидрокси,
(дд) необязательно замещенный алкокси,
(ее) C(L)R40, где L означает О, S или NR55; R40 означает водород, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный гетероарилий, необязательно замещенный циклоалкил, необязательно замещенный гетероциклил, C(L)R56, галоген, псевдогалоген, OR55, SR55, NR57R58 или SiR52R53R54, где R52, R53 и R54 выбирают, как описано в следующих пунктах (i) или (ii): (i) R52, R53 и R54 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55 и NR62R63; или (ii) любые два из R52, R53 и R54 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен, а другие выбирают, как описано в пункте (i); R55 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил или гетероциклил; R56 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55 или NR64R65, где R64 и R65 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR66 или NR62R63, или R64 и R65 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен, где R66 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил или гетероциклил; R57 и R58 выбирают, как описано в следующих пунктах (i) или (ii): (i) R57 и R58 каждый независимо означает водород, необязательно замещенный алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55, NR67R68 или C(L)R69, где R67 и R68 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил или гетероциклил, или оба указанных заместителя вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен и R69 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR70 или NR62R63, где R70 означает алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, или (ii) R57 и R58 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен или алкиленоксиалкилен; R62 и R63 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, или R62 и R63 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен, и
(ii) необязательно замещенный алкил;
R4 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил,
(г) алкокси и
(д) гидрокси;
R5 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил,
(г) галогеналкил,
(д) тиоалкил,
(е) гидрокси,
(ж) амино,
(з) алкиламино,
(и) диалкиламино,
(к) гетероалкил,
(л) необязательно замещенный гетероцикл,
(м) необязательно замещенный гетероциклилалкил,
(н) необязательно замещенный гетероциклилалкокси,
(о) алкилсульфонил,
(п) аминосульфонил, моноалкиламиносульфонил или диалкиламиносульфонил,
(р) гетероалкокси и
(с) карбокси;
R6 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил и
(г) алкокси.
В настоящем изобретении предлагаются также фармацевтические композиции, содержащие соединение по настоящему изобретению, в комбинации с фармацевтически приемлемым носителем.
В настоящем изобретении предлагаются также способы лечения, профилактики или ослабления одного или более симптомов заболеваний у млекопитающих, опосредованных цитокинами, причем способы включают введение млекопитающему, нуждающемуся в таком лечении, соединения формулы I. Заболевания и нарушения, которые можно лечить, проводить профилактику или ослабить симптомы, включают, без ограничения перечисленным, хронические воспалительные заболевания, воспаления кишечника, ревматоидный артрит, псориаз, рассеянный склероз, эндотоксический шок, остеопороз, болезнь Альцгеймера и застойную сердечную недостаточность.
В настоящем изобретении предлагаются также способы профилактики или подавления воспалительной ответной реакции с использованием соединений и композиций по настоящему изобретению.
В другом варианте предлагаются способы ингибирования киназ р38, включая киназы р38 и р38 и р38 , с использованием соединений и композиций по настоящему изобретению. , с использованием соединений и композиций по настоящему изобретению.
Предлагаются также изделия, содержащие упаковочный материал, соединение или композицию по настоящему изобретению, предназначенные для лечения, профилактики или ослабления одного или более симптомов заболеваний или нарушений, опосредованных киназой р38, а также этикетки, на которых указано, что соединение или композиция применяется для лечения, профилактики или ослабления одного или более симптомов заболеваний или нарушений, опосредованных киназой р38.
Подробное описание предпочтительных вариантов осуществления изобретения
А. Определения
Использованный в данном контексте термин р38 означает фермент, описанный в работе Han и др., Biochim. Biophys. Acta 1265(2-3):224-7 (1995). Использованный в данном контексте термин р38 означает фермент, описанный в работе Han и др., Biochim. Biophys. Acta 1265(2-3):224-7 (1995). Использованный в данном контексте термин р38 означает фермент, описанный в работе Jiang и др., J. Biol. Chem. 271(30): 17920-6 (1996). Использованный в данном контексте термин р38 означает фермент, описанный в работе Jiang и др., J. Biol. Chem. 271(30): 17920-6 (1996). Использованный в данном контексте термин р38 означает фермент, описанный в работе Li и др., Biochem. Biophys. Res. Commun. 228:334-340 (1996). Использованный в данном контексте термин р38 означает фермент, описанный в работе Li и др., Biochem. Biophys. Res. Commun. 228:334-340 (1996). Использованный в данном контексте термин р38 означает фермент, описанный в работе Wang и др., J. Biol. Chem. 272(38):23668-74 (1997). означает фермент, описанный в работе Wang и др., J. Biol. Chem. 272(38):23668-74 (1997).
Использованные в данном изобретении фармацевтически приемлемые производные соединений включают их соли, сложные эфиры, сложные эфиры енолов, простые эфиры енолов, ацетали, кетали, ортоэфиры, полуацетали, полукетали, кислоты, основания, сольваты, гидраты или пролекарства. Такие производные можно получить по известным методикам для такой модификации. Полученные соединения можно вводить животным или человеку, при этом они являются фармацевтически активными или являются пролекарствами и не проявляют значительную токсичность. Фармацевтически приемлемые соли включают, без ограничения перечисленным, соли аминов, таких как, без ограничения перечисленным, N,N’-дибензилэтилендиамин, хлорпрокаин, холин, аммиак, диэтаноламин и другие гидроксилалкиламины, этилендиамин, N-метилглюкамин, прокаин, N-бензилфенетиламин, 1-пара-хлорбензил-2-пирролидин-1′-илметилбензимидазол, диэтиламин и другие алкиламины, пиперазин и трис(гидроксиметил)аминометан; соли щелочных металлов, таких как, без ограничения перечисленным, калий и натрий; соли щелочно-земельных металлов, таких как, без ограничения перечисленным, барий, кальций и магний; соли переходных металлов, таких как, без ограничения перечисленным, цинк, и соли других металлов, такие как, без ограничения перечисленным, гидрофосфат натрия и динатрий фосфат, а также включают, без ограничения перечисленным, нитраты, бораты, метансульфонаты, бензолсульфонаты, толуолсульфонаты, соли неорганических кислот, такие как, без ограничения перечисленным, гидрохлориды, гидробромиды, гидроиодиды и сульфаты; соли органических кислот, такие как, без ограничения перечисленным, ацетаты, трифторацетаты, оксалаты, бензоаты, салицилаты, малеаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, валераты и фумараты. Используют также цвиттерионные (внутренние) соли. В некоторых вариантах солевые формы соединений обладают повышенной скоростью растворения и пероральной биодоступностью. Фармацевтически приемлемые сложные эфиры включают, без ограничения перечисленным, алкиловые, алкениловые, алкиниловые, ариловые, гетероариловые, аралкиловые, гетероаралкиловые, циклоалкиловые и гетероциклильные эфиры кислот, включая, без ограничения перечисленным, карбоновые кислоты, фосфорные кислоты, фосфиновые кислоты, сульфоновые кислоты, сульфиновые кислоты и бороновые кислоты. Фармацевтически приемлемые простые эфиры енолов включают, без ограничения перечисленным, производные формулы C=C(OR), где R означает водород, алкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, циклоалкил или гетероциклил. Фармацевтически приемлемые сложные эфиры енолов включают, без ограничения перечисленным, производные соединений формулы C=C(OC(O)R), где R означает водород, алкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, циклоалкил или гетероциклил. Фармацевтически приемлемые сольваты и гидраты являются комплексами соединения с одной или более молекул растворителя или воды, или от 1 до приблизительно 100, или от 1 до приблизительно 10, или от 1 до приблизительно 2, 3 или 4 молекулами растворителя или воды.
Термин  алкил алкил означает линейный насыщенный моновалентный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или разветвленный насыщенный моновалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, например метил, этил, пропил, 2-пропил, пентил и т.п. означает линейный насыщенный моновалентный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или разветвленный насыщенный моновалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, например метил, этил, пропил, 2-пропил, пентил и т.п.
Термин  циклоалкил циклоалкил означает насыщенную или частично ненасыщенную неароматическую циклическую углеводородную кольцевую систему, предпочтительно содержащую от 1 до 3 колец и от 3 до 7 атомов углерода в кольце, которая может означать конденсированную систему с С3-С7 карбоциклическим кольцом. Примеры таких групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, циклододецил и адамантил. означает насыщенную или частично ненасыщенную неароматическую циклическую углеводородную кольцевую систему, предпочтительно содержащую от 1 до 3 колец и от 3 до 7 атомов углерода в кольце, которая может означать конденсированную систему с С3-С7 карбоциклическим кольцом. Примеры таких групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, циклододецил и адамантил.  Замещенный циклоалкил Замещенный циклоалкил замещен одной или более алкильных или замещенных алкильных групп, как описано выше, или одной или более групп, описанными выше в качестве алкильных заместителей. Термин замещен одной или более алкильных или замещенных алкильных групп, как описано выше, или одной или более групп, описанными выше в качестве алкильных заместителей. Термин  (низш.)циклоалкил (низш.)циклоалкил означает незамещенную насыщенную или ненасыщенную неароматическую циклическую углеводородную кольцевую систему, содержащую от 3 до 5 атомов углерода. означает незамещенную насыщенную или ненасыщенную неароматическую циклическую углеводородную кольцевую систему, содержащую от 3 до 5 атомов углерода.
Термин  алкилен алкилен означает линейный насыщенный двухвалентный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или разветвленный насыщенный двухвалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, например метилен, этилен, пропилен, 2-метилпропилен, пентилен и т.п. означает линейный насыщенный двухвалентный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или разветвленный насыщенный двухвалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, например метилен, этилен, пропилен, 2-метилпропилен, пентилен и т.п.
Термин  алкенил алкенил означает линейный моновалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, или разветвленный моновалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, содержащий по крайней мере одну двойную связь, например этенил, пропенил и т.п. означает линейный моновалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, или разветвленный моновалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, содержащий по крайней мере одну двойную связь, например этенил, пропенил и т.п.
Термин  алкенилен алкенилен означает линейный двухвалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, или разветвленный двухвалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, содержащий по крайней мере одну двойную связь, например этенилен, пропенилен и т.п. означает линейный двухвалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, или разветвленный двухвалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, содержащий по крайней мере одну двойную связь, например этенилен, пропенилен и т.п.
Термин  алкинил алкинил означает линейный моновалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, или разветвленный двухвалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, содержащий по крайней мере одну тройную связь, например этинил, пропинил и т.п. означает линейный моновалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, или разветвленный двухвалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, содержащий по крайней мере одну тройную связь, например этинил, пропинил и т.п.
Термин  алкинилен алкинилен означает линейный двухвалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, или разветвленный моновалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, содержащий по крайней мере одну тройную связь, например этинилен, пропинилен и т.п. означает линейный двухвалентный углеводородный радикал, содержащий от 2 до 6 атомов углерода, или разветвленный моновалентный углеводородный радикал, содержащий от 3 до 6 атомов углерода, содержащий по крайней мере одну тройную связь, например этинилен, пропинилен и т.п.
Термин  алкокси алкокси означает радикал -OR, где R означает алкил, как описано выше, например метокси, этокси, пропокси, 2-пропокси и т.п. означает радикал -OR, где R означает алкил, как описано выше, например метокси, этокси, пропокси, 2-пропокси и т.п.
Термин  ацил ацил означает радикал -C(O)R, где R означает алкил или галогеналкил, например ацетил, трифторацетил и т.п. означает радикал -C(O)R, где R означает алкил или галогеналкил, например ацетил, трифторацетил и т.п.
Термин  ациламино ациламино означает радикал -NRC(O)R’, где R означает водород или алкил, а R’ означает алкил, гетероалкил или необязательно замещенный гетероциклилалкил, например ацетиламино, 2-амино-2-метилпропионамид и т.п. означает радикал -NRC(O)R’, где R означает водород или алкил, а R’ означает алкил, гетероалкил или необязательно замещенный гетероциклилалкил, например ацетиламино, 2-амино-2-метилпропионамид и т.п.
Термин  галоген галоген означает фтор, хлор, бром или иод, в основном фтор и хлор. означает фтор, хлор, бром или иод, в основном фтор и хлор.
Термин  галогеналкил галогеналкил означает алкил, замещенный одним или более одинаковыми или различными атомами галогена, например -CH2Cl, -CF3, -CH2CF3, -CH2CCl3 и т.п. означает алкил, замещенный одним или более одинаковыми или различными атомами галогена, например -CH2Cl, -CF3, -CH2CF3, -CH2CCl3 и т.п.
Термин  арил арил означает моновалентный моноциклический или бициклический ароматический углеводородный радикал, содержащий от 6 до 10 атомов в кольце, например фенил, 1-нафтил, 2-нафтил и т.п. Арильное кольцо необязательно конденсировано с 5-, 6- или 7-членным моноциклическим насыщенным кольцом, необязательно содержащим 1 или 2 гетероатома, которые независимо выбирают из группы, включающей кислород, азот или серу, при этом остальные атомы в цикле являются атомами углерода, и 1 или 2 атома углерода необязательно заменены на карбонильную группу. Примеры арильных радикалов, конденсированных с другими кольцами, включают, без ограничения перечисленным, 2,3-дигидробензо[1,4]диоксан, хроман, изохроман, 2,3-дигидробензофуран, 1,3-дигидроизобензофуран, бензо[1,3]диоксол, 1,2,3,4-тетрагидроизохинолин, 1,2,3,4-тетрагидрохинолин, 2,3-дигидро-1Н-индол, 2,3-дигидро-1H-изоиндол, бензимидазол-2-он, 3Н-бензоксазол-2-он и т.п. означает моновалентный моноциклический или бициклический ароматический углеводородный радикал, содержащий от 6 до 10 атомов в кольце, например фенил, 1-нафтил, 2-нафтил и т.п. Арильное кольцо необязательно конденсировано с 5-, 6- или 7-членным моноциклическим насыщенным кольцом, необязательно содержащим 1 или 2 гетероатома, которые независимо выбирают из группы, включающей кислород, азот или серу, при этом остальные атомы в цикле являются атомами углерода, и 1 или 2 атома углерода необязательно заменены на карбонильную группу. Примеры арильных радикалов, конденсированных с другими кольцами, включают, без ограничения перечисленным, 2,3-дигидробензо[1,4]диоксан, хроман, изохроман, 2,3-дигидробензофуран, 1,3-дигидроизобензофуран, бензо[1,3]диоксол, 1,2,3,4-тетрагидроизохинолин, 1,2,3,4-тетрагидрохинолин, 2,3-дигидро-1Н-индол, 2,3-дигидро-1H-изоиндол, бензимидазол-2-он, 3Н-бензоксазол-2-он и т.п.
Термин  гетероарил гетероарил означает моновалентный моноциклический или бициклический ароматический радикал, содержащий от 5 до 10 атомов в кольце, при этом содержащий 1, 2 или 3 гетероатома в кольце, которые выбирают из N, О или S, при этом остальные атомы в цикле означают атом углерода. Данный термин включает также радикалы, в которых гетероатом в кольце окислен или кватернизован, такие как, например, образующие N-оксид или четвертичную соль. Типичные примеры включают, без ограничения перечисленным, тиенил, бензотиенил, пиридил, пиразинил, пиримидинил, пиридазинил, хинолинил, хиноксалинил, имидазолил, фуранил, бензофуранил, тиазолил, изоксазолил, бензизоксазолил, бензимидазолил, триазолил, пиразолил, пирролил, индолил, 2-пиридонил, 4-пиридонил, N-алкил-2-пиридонил, пиразинонил, пиридазинонил, пиримидинонил и их соответствующие N-оксиды (например, пиридил N-оксид, хинолинил N-оксид), их четвертичные соли и т.п. означает моновалентный моноциклический или бициклический ароматический радикал, содержащий от 5 до 10 атомов в кольце, при этом содержащий 1, 2 или 3 гетероатома в кольце, которые выбирают из N, О или S, при этом остальные атомы в цикле означают атом углерода. Данный термин включает также радикалы, в которых гетероатом в кольце окислен или кватернизован, такие как, например, образующие N-оксид или четвертичную соль. Типичные примеры включают, без ограничения перечисленным, тиенил, бензотиенил, пиридил, пиразинил, пиримидинил, пиридазинил, хинолинил, хиноксалинил, имидазолил, фуранил, бензофуранил, тиазолил, изоксазолил, бензизоксазолил, бензимидазолил, триазолил, пиразолил, пирролил, индолил, 2-пиридонил, 4-пиридонил, N-алкил-2-пиридонил, пиразинонил, пиридазинонил, пиримидинонил и их соответствующие N-оксиды (например, пиридил N-оксид, хинолинил N-оксид), их четвертичные соли и т.п.
Термин  гетероцикл или гетероциклил гетероцикл или гетероциклил означает циклический неароматический радикал, содержащий от 3 до 8 атомов в цикле, в котором 1 или 2 циклических атома являются гетероатомами, выбранными из N, О или S(O)n (n означает целое число от 0 до 2), причем остальные атомы в циклеозначают углерод, и 1 или 2 атома углерода необязательно заменены на карбонильную группу. Данный термин включает также радикалы, в которых атом азота в кольце окислен или кватернизован, такие как, например, образующие N-оксид или четвертичную соль. Типичные примеры включают, без ограничения перечисленным, тетрагидропиранил, тетрагидрофуранил, тетрагидротиофенил, пиперидино, морфолино, пиперазино, пирролидино, оксиранил, диоксан, 1,3-диоксоланил, 2,2-диметил-1,3-диоксоланил, сульфоланил, 2-оксазолидонил, 2-имидазолидонил, S,S-диоксотиоморфолино и т.п. означает циклический неароматический радикал, содержащий от 3 до 8 атомов в цикле, в котором 1 или 2 циклических атома являются гетероатомами, выбранными из N, О или S(O)n (n означает целое число от 0 до 2), причем остальные атомы в циклеозначают углерод, и 1 или 2 атома углерода необязательно заменены на карбонильную группу. Данный термин включает также радикалы, в которых атом азота в кольце окислен или кватернизован, такие как, например, образующие N-оксид или четвертичную соль. Типичные примеры включают, без ограничения перечисленным, тетрагидропиранил, тетрагидрофуранил, тетрагидротиофенил, пиперидино, морфолино, пиперазино, пирролидино, оксиранил, диоксан, 1,3-диоксоланил, 2,2-диметил-1,3-диоксоланил, сульфоланил, 2-оксазолидонил, 2-имидазолидонил, S,S-диоксотиоморфолино и т.п.
Термин  гетероциклоамино гетероциклоамино означает насыщенную моновалентную циклическую группу, содержащую от 4 до 8 атомов в цикле, в котором по крайней мере 1 атом в цикле означает N и необязательно содержит один дополнительный циклический атом, выбранный из N или О, причем остальные атомы в цикле означают С. Термин включает группы, такие как пирролидино, пиперидино, морфолино, пиперазино и т.п. означает насыщенную моновалентную циклическую группу, содержащую от 4 до 8 атомов в цикле, в котором по крайней мере 1 атом в цикле означает N и необязательно содержит один дополнительный циклический атом, выбранный из N или О, причем остальные атомы в цикле означают С. Термин включает группы, такие как пирролидино, пиперидино, морфолино, пиперазино и т.п.
Термин  необязательно замещенный алкил, алкенил, алкинил, алкокси или циклоалкил необязательно замещенный алкил, алкенил, алкинил, алкокси или циклоалкил означает группу алкил, алкенил, алкинил, алкокси или циклоалкил, как описано выше, которые необязательно независимо замещены 1 или 2 заместителями, выбранными из группы, включающей алкил, фенил, бензил, галогеналкил, гетероалкил, галоген, циано, гетероциклил, ацил, -OR (где R означает водород или алкил), -NRR’ (где R и R’ независимо выбирают из группы, включающей водород, ацил или алкил, которые необязательно замещены группами гидрокси, алкокси, циано, галоген или гетероциклил), -NHCOR (где R означает алкил, который необязательно замещен группами гидрокси, алкокси, циано, галоген или гетероциклил), -NRS(O)nR’ (где R означает водород или алкил, n означает целое число от 0 до 2; и R’ означает водород, алкил или гетероалкил, и необязательно замещен группами гидрокси, алкокси, циано, галоген или гетроциклил), -NRS(O)nNR’R” (где R означает водород или алкил, п означает целое число от 0 до 2; и R’ и R” независимо означает водород, алкил или гетероалкил, которые необязательно замещены группами гидрокси, алкокси, циано, галоген или гетероциклил), -S(O)nR (где n означает целое число от 0 до 2; и R означает водород, алкил или гетероалкил, и необязательно замещен группами гидрокси, алкокси, циано, галоген или гетроциклил), -S(O)nNRR’ (где n означает целое число от 0 до 2 и R и R’ независимо означают водород, алкил или гетероалкил и необязательно замещены группами гидрокси, алкокси, циано, галоген или гетероциклил), -COOR, -(алкилен)COOR (где R означает водород или алкил), -CONR’R” или -(алкилен)CONR’R” (где R’ и R” независимо означают водород или алкил или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо). означает группу алкил, алкенил, алкинил, алкокси или циклоалкил, как описано выше, которые необязательно независимо замещены 1 или 2 заместителями, выбранными из группы, включающей алкил, фенил, бензил, галогеналкил, гетероалкил, галоген, циано, гетероциклил, ацил, -OR (где R означает водород или алкил), -NRR’ (где R и R’ независимо выбирают из группы, включающей водород, ацил или алкил, которые необязательно замещены группами гидрокси, алкокси, циано, галоген или гетероциклил), -NHCOR (где R означает алкил, который необязательно замещен группами гидрокси, алкокси, циано, галоген или гетероциклил), -NRS(O)nR’ (где R означает водород или алкил, n означает целое число от 0 до 2; и R’ означает водород, алкил или гетероалкил, и необязательно замещен группами гидрокси, алкокси, циано, галоген или гетроциклил), -NRS(O)nNR’R” (где R означает водород или алкил, п означает целое число от 0 до 2; и R’ и R” независимо означает водород, алкил или гетероалкил, которые необязательно замещены группами гидрокси, алкокси, циано, галоген или гетероциклил), -S(O)nR (где n означает целое число от 0 до 2; и R означает водород, алкил или гетероалкил, и необязательно замещен группами гидрокси, алкокси, циано, галоген или гетроциклил), -S(O)nNRR’ (где n означает целое число от 0 до 2 и R и R’ независимо означают водород, алкил или гетероалкил и необязательно замещены группами гидрокси, алкокси, циано, галоген или гетероциклил), -COOR, -(алкилен)COOR (где R означает водород или алкил), -CONR’R” или -(алкилен)CONR’R” (где R’ и R” независимо означают водород или алкил или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо).
Термин  необязательно замещенный арил, гетероарил или гетероциклил необязательно замещенный арил, гетероарил или гетероциклил означает арильное, гетероарильное или гетероциклильное кольцо, как описано выше, которое необязательно независимо замещено 1 или 2 заместителями, выбранными из группы, включающей алкил, фенил, бензил, галогеналкил, гетероалкил, галоген, циано, ацил, -OR (где R означает водород или алкил), -NRR’ (где R и R’ независимо выбирают из группы, включающей водород, ацил или алкил), -NHCOR (где R означает алкил), -NRS(O)nR’ (где R означает водород или алкил, n означает целое число от 0 до 2 и R’ означает водород, алкил или гетероалкил), -NRS(O)nNR’R” (где R означает водород или алкил, n означает простое число от 0 до 2 и R’ и R” независимо означают водород, алкил или гетероалкил), -S(O)nR (где n означает целое число от 0 до 2 и R означает водород, алкил или гетероалкил), -S(O)nNRR’ (где n означает целое число от 0 до 2 и R и R’ независимо означают водород, алкил или гетероалкил), -COOR, -(алкилен)COOR (где R означает водород или алкил), -CONR’R” или -(алкилен)CONR’R” (где R’ и R” независимо означают водород или алкил). означает арильное, гетероарильное или гетероциклильное кольцо, как описано выше, которое необязательно независимо замещено 1 или 2 заместителями, выбранными из группы, включающей алкил, фенил, бензил, галогеналкил, гетероалкил, галоген, циано, ацил, -OR (где R означает водород или алкил), -NRR’ (где R и R’ независимо выбирают из группы, включающей водород, ацил или алкил), -NHCOR (где R означает алкил), -NRS(O)nR’ (где R означает водород или алкил, n означает целое число от 0 до 2 и R’ означает водород, алкил или гетероалкил), -NRS(O)nNR’R” (где R означает водород или алкил, n означает простое число от 0 до 2 и R’ и R” независимо означают водород, алкил или гетероалкил), -S(O)nR (где n означает целое число от 0 до 2 и R означает водород, алкил или гетероалкил), -S(O)nNRR’ (где n означает целое число от 0 до 2 и R и R’ независимо означают водород, алкил или гетероалкил), -COOR, -(алкилен)COOR (где R означает водород или алкил), -CONR’R” или -(алкилен)CONR’R” (где R’ и R” независимо означают водород или алкил).
Термин  гетероалкил гетероалкил означает алкильный радикал, определеный выше, содержащий 1, 2 или 3 заместителя, которые выбирают из -NRaRb, -ORc, где Ra, Rb и Rc независимо друг от друга означают водород, алкил или ацил, или Ra и Rb вместе образуют группу гетероциклоамино. Типичные примеры включают, без ограничения перечисленным, гидроксиметил, ацетоксиметил, 3-гидроксипропил, 1,2-дигидроксиэтил, 2-метоксиэтил, 2-аминоэтил, 2-диметиламиноэтил, 2-ацетиламинометил, 3-[пирролидин-1-ил]этил и т.п. означает алкильный радикал, определеный выше, содержащий 1, 2 или 3 заместителя, которые выбирают из -NRaRb, -ORc, где Ra, Rb и Rc независимо друг от друга означают водород, алкил или ацил, или Ra и Rb вместе образуют группу гетероциклоамино. Типичные примеры включают, без ограничения перечисленным, гидроксиметил, ацетоксиметил, 3-гидроксипропил, 1,2-дигидроксиэтил, 2-метоксиэтил, 2-аминоэтил, 2-диметиламиноэтил, 2-ацетиламинометил, 3-[пирролидин-1-ил]этил и т.п.
Термин  гетероалкенил гетероалкенил означает алкенильный радикал, определеный выше, содержащий 1 или 2 заместителя, которые выбирают из -NRaRb, -ORc или -S(O)nRd, где Ra, Rb и Rc независимо друг от друга означают водород или алкил, Rd означает алкил или -NRR’ (где R и R’ независимо друг от друга означают водород или алкил). Типичные примеры включают, без ограничения перечисленным, 3-гидрокси-1-пропенил, 3-аминопроп-1-енил, 2-аминосульфонилэтенил, 2-метилсульфонилэтенил и т.п. означает алкенильный радикал, определеный выше, содержащий 1 или 2 заместителя, которые выбирают из -NRaRb, -ORc или -S(O)nRd, где Ra, Rb и Rc независимо друг от друга означают водород или алкил, Rd означает алкил или -NRR’ (где R и R’ независимо друг от друга означают водород или алкил). Типичные примеры включают, без ограничения перечисленным, 3-гидрокси-1-пропенил, 3-аминопроп-1-енил, 2-аминосульфонилэтенил, 2-метилсульфонилэтенил и т.п.
Термин  гетероалкинил гетероалкинил означает алкинильный радикал, определенный выше, содержащий 1 или 2 заместителя, которые выбирают из -NRaRb, -ORc, -S(O)nRd или -S(O)nNRR’ (где R и R’ независимо друг от друга означают водород или алкил), где Ra, Rb и Rc независимо друг от друга означают водород или алкил и Rd означает алкил, а n означает целое число от 0 до 2. Типичные примеры включают, без ограничения перечисленным, 3-гидрокси-1-пропинил, 3-диметиламинопроп-1-инил и т.п. означает алкинильный радикал, определенный выше, содержащий 1 или 2 заместителя, которые выбирают из -NRaRb, -ORc, -S(O)nRd или -S(O)nNRR’ (где R и R’ независимо друг от друга означают водород или алкил), где Ra, Rb и Rc независимо друг от друга означают водород или алкил и Rd означает алкил, а n означает целое число от 0 до 2. Типичные примеры включают, без ограничения перечисленным, 3-гидрокси-1-пропинил, 3-диметиламинопроп-1-инил и т.п.
Термин  гетероалкокси гетероалкокси означает радикал -OR, где R означает гетероалкильную группу, определенную выше, например, 2-гидроксиэтокси, 3-гидроксипропокси, 2,3-дигидроксипропокси, 2-аминоэтокси и т.п. означает радикал -OR, где R означает гетероалкильную группу, определенную выше, например, 2-гидроксиэтокси, 3-гидроксипропокси, 2,3-дигидроксипропокси, 2-аминоэтокси и т.п.
Термин  гетероалкиламино гетероалкиламино означает радикал -NRaRb, где Ra означает водород или алкил, а Rb означает гетероалкильную группу, определенную выше, например 2-гидроксиэтиламино, 3-диметиламинопропиламино и т.п. означает радикал -NRaRb, где Ra означает водород или алкил, а Rb означает гетероалкильную группу, определенную выше, например 2-гидроксиэтиламино, 3-диметиламинопропиламино и т.п.
Термин  необязательно замещенный гетероциклилалкил необязательно замещенный гетероциклилалкил означает радикал -RaRb, где Ra означает алкиленовую группу, a Rb необязательно замещен гетероциклильной группой, определенной выше, например 2-(морфолин-4-ил)этил, 3-(пиперидин-1-ил)-2-метилпропил и т.п. означает радикал -RaRb, где Ra означает алкиленовую группу, a Rb необязательно замещен гетероциклильной группой, определенной выше, например 2-(морфолин-4-ил)этил, 3-(пиперидин-1-ил)-2-метилпропил и т.п.
Термин  необязательно замещенный гетероциклилалкенил необязательно замещенный гетероциклилалкенил означает радикал -RaRb, где Ra означает алкениленовую группу, а Rb необязательно замещен гетероциклильной группой, определенной выше, например 3-(морфолин-4-ил)проп-1-енил, 3-(пиперидин-1-ил)проп-1-енил, 3-(4-метилпиперазин-1-ил)проп-1-енил и т.п. означает радикал -RaRb, где Ra означает алкениленовую группу, а Rb необязательно замещен гетероциклильной группой, определенной выше, например 3-(морфолин-4-ил)проп-1-енил, 3-(пиперидин-1-ил)проп-1-енил, 3-(4-метилпиперазин-1-ил)проп-1-енил и т.п.
Термин  необязательно замещенный гетероциклилалкинил необязательно замещенный гетероциклилалкинил означает радикал -RaRb, где Ra означает алкинильную группу, а Rb необязательно замещен гетероциклильной группой, определенной выше, например 3-(морфолин-4-ил)проп-1-инил, 3-(пиперидин-1-ил)проп-1-инил и т.п. означает радикал -RaRb, где Ra означает алкинильную группу, а Rb необязательно замещен гетероциклильной группой, определенной выше, например 3-(морфолин-4-ил)проп-1-инил, 3-(пиперидин-1-ил)проп-1-инил и т.п.
Термин  необязательно замещенный гетероциклилалкокси необязательно замещенный гетероциклилалкокси означает радикал -OR, где R необязательно замещен гетероциклильной группой, определенной выше, например 2-(морфолин-4-ил)этокси, 3-(пиперазин-1-ил)пропокси, 2-[2-оксопирролидинил-1-ил]этокси и т.п. означает радикал -OR, где R необязательно замещен гетероциклильной группой, определенной выше, например 2-(морфолин-4-ил)этокси, 3-(пиперазин-1-ил)пропокси, 2-[2-оксопирролидинил-1-ил]этокси и т.п.
Термин  необязательно замещенный гетероциклилалкиламино необязательно замещенный гетероциклилалкиламино означает радикал -NRaRb, где Ra означает водород или алкил, а Rb необязательно замещен гетероциклилалкильной группой, определенной выше, например 2-(пирролидин-2-ил)этиламино, 3-(пиперидин-1-ил)пропиламино и т.п. означает радикал -NRaRb, где Ra означает водород или алкил, а Rb необязательно замещен гетероциклилалкильной группой, определенной выше, например 2-(пирролидин-2-ил)этиламино, 3-(пиперидин-1-ил)пропиламино и т.п.
Термин  необязательно замещенный гетероаралкилокси необязательно замещенный гетероаралкилокси означает радикал -O-Ra, где Ra означает гетероаралкильный радикал, например 2-(пиридин-3-ил)этокси, 2-[3(2Н)-пиридазон-1-ил]этокси и т.п. означает радикал -O-Ra, где Ra означает гетероаралкильный радикал, например 2-(пиридин-3-ил)этокси, 2-[3(2Н)-пиридазон-1-ил]этокси и т.п.
Термин  необязательно необязательно означает, что последовательно описываемые события или обстоятельства могут произойти или не происходят и что описание включает случаи, когда событие или обстоятельство происходит или не происходит. Например, термин означает, что последовательно описываемые события или обстоятельства могут произойти или не происходят и что описание включает случаи, когда событие или обстоятельство происходит или не происходит. Например, термин  арильная группа, необязательно моно- или дизамещенная алкильной группой арильная группа, необязательно моно- или дизамещенная алкильной группой , означает, что алкильная группа присутствует или отсутствует, и описание включает случаи, когда арильная группа моно- или дизамещена алкильной группой, и случаи, когда гетероциклильная группа не замещена алкильной группой. , означает, что алкильная группа присутствует или отсутствует, и описание включает случаи, когда арильная группа моно- или дизамещена алкильной группой, и случаи, когда гетероциклильная группа не замещена алкильной группой.
Термин  аминозащитная группа аминозащитная группа означает такие органические группы, которые предназначены для защиты атомов азота от нежелательных реакций в процессе синтеза, например бензил, бензиоксикарбонил (CBZ), трет-бутоксикарбонил (ВОС), трифторацетил и т.п. означает такие органические группы, которые предназначены для защиты атомов азота от нежелательных реакций в процессе синтеза, например бензил, бензиоксикарбонил (CBZ), трет-бутоксикарбонил (ВОС), трифторацетил и т.п.
В настоящем изобретении выбраны только такие группы и их заместители, которые образуют устойчивые остатки и соединения, как известно специалистам в данной области техники. Следует также понимать, что химические группы, описанные в данном контексте, являются замещенными или незамещенными, разветвленными или неразветвленными, в зависимости от каждого конкретного случая.
В настоящее изобретение включены все стереоизомеры соединений в виде их смесей, в чистой форме или в практически чистой форме. Определения соединений по настоящему изобретению включают все возможные стереоизомеры и их смеси. В настоящее изобретение включены рацемические формы, индивидуальные оптические изомеры, характеризующиеся специфической активностью. Рацемические формы разделяют физическими методами, такими как, например, фракционная кристаллизация, разделение или кристаллизация диастереомерных производных или разделение хроматографией на хиральной колонке. Индивидуальные оптические изомеры получают из рацематов по стандартным методикам, таким как, например, образование соли с оптически активной кислотой с последующей кристаллизацией.
Соединения по настоящему изобретению могут включать также их пролекарства. Любое соединение, которое превращается in vivo в биоактивный агент, называется пролекарством. В данной области техники известны различные формы пролекарств. Примеры таких пролекарств см., например, в работах:
a) Design of Prodrugs, под ред. Н.Bundgaard, (Elsevier, 1985) и Methods in Enzymology, Vol.42, p.309-396, под ред. К.Widder, и др. (Acamedic Press, 1985);
б) A Textbook of Drug Design and Development, под ред. Krosgaard-Larsen and Н.Bundgaard, глава 5,  Design and Application of Prodrugs, Design and Application of Prodrugs, Н.Bundgaard, c.113-191 (1991) и Н.Bundgaard, c.113-191 (1991) и
в) Н.Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992),
каждая из которых включена в описание в качестве ссылки.
Использованный в данном контексте термин  лечение лечение означает любой способ, согласно которому один или более симптомов заболевания или нарушения ослабляется или иным способом изменяется в лучшую сторону. Термин означает любой способ, согласно которому один или более симптомов заболевания или нарушения ослабляется или иным способом изменяется в лучшую сторону. Термин  лечение лечение включает также любое фармацевтическое применение соединений и композиций по настоящему изобретению, такое как применение для лечения заболеваний или нарушений, опосредованных киназой р38, или заболеваний и нарушений, связанных с активностью киназы р38, включая киназы р38 включает также любое фармацевтическое применение соединений и композиций по настоящему изобретению, такое как применение для лечения заболеваний или нарушений, опосредованных киназой р38, или заболеваний и нарушений, связанных с активностью киназы р38, включая киназы р38 и р38 и р38 . .
Использованный в данном контексте термин  ослабление симптомов конкретного заболевания при введении конкретного соединения или конкретной фармацевтической композиции ослабление симптомов конкретного заболевания при введении конкретного соединения или конкретной фармацевтической композиции означает любое снижение интенсивности симптомов, постоянное и временное, продолжительное или кратковременное, которое происходит при действии или связано с введением композиции. означает любое снижение интенсивности симптомов, постоянное и временное, продолжительное или кратковременное, которое происходит при действии или связано с введением композиции.
Использованный в данном контексте термин  IC50 IC50 означает количество, концентрацию или дозу конкретного исследуемого соединения, которое вызывает 50% ингибирование максимальной ответной реакции, такой как модуляция активности киназы р38 означает количество, концентрацию или дозу конкретного исследуемого соединения, которое вызывает 50% ингибирование максимальной ответной реакции, такой как модуляция активности киназы р38 , которую определяют специальным методом анализа. , которую определяют специальным методом анализа.
Б. Соединения
Данные анализа активности киназы р38, включая киназы р38 и р38 и р38 , свидетельствуют о том, что соединения по настоящему изобретению являются активными. В одном варианте изобретение включает соединения по настоящему изобретению, характеризующиеся формулой I , свидетельствуют о том, что соединения по настоящему изобретению являются активными. В одном варианте изобретение включает соединения по настоящему изобретению, характеризующиеся формулой I
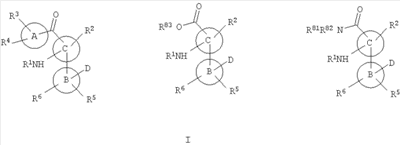
или их фармацевтически приемлемые производные, где:
R1 означает водород, ацил или -Р(O)(ОН)2;
R2 означает водород, галоген, алкил или алкилтио;
А означает арил, гетероарил или гетероциклическое кольцо, необязательно конденсированное с фенильным циклом, при условии, что гетероциклическое кольцо присоединено к карбонильной группе через атом углерода в цикле;
В означает арил или гетероарил;
С означает 5-членный гетероарил, содержащий один или два гетероатома в цикле;
D означает гетероарил, необязательно замещенный гетероарил или -C(O)NR80R81, где R80 и R81 независимо означают водород, алкил, циклоалкил, алкокси, гидрокси, гетероарил или необязательно замещенный гетероарил;
R3 выбирают из группы, включающей:
(а) амино, алкиламино или диалкиламино,
(б) ациламино,
(в) необязательно замещенный гетероциклил,
(г) необязательно замещенный арил или гетероарил,
(д) гетероалкил,
(е) гетероалкенил,
(ж) гетероалкинил,
(з) гетероалкокси,
(и) гетероалкиламино,
(к) необязательно замещенный гетероциклилалкил,
(л) необязательно замещенный гетероциклилалкенил,
(м) необязательно замещенный гетероциклилалкинил,
(н) необязательно замещенный гетероциклилалкокси или гетероциклилокси,
(о) необязательно замещенный гетероциклилалкиламино,
(п) необязательно замещенный гетероциклилалкилкарбонил,
(р) гетероалкилкарбонил,
(с) -NHSO2R6, где R6 означает алкил, гетероалкил или необязательно замещенный гетероциклилалкил,
(т) -NHSO2NR7R8, где R7 и R8 независимо друг от друга означают водород, алкил или гетероалкил,
(у) -Y-(алкилен)-R9, где Y означает простую связь, -O-, -NH- или -S(O)n– (где n означает целое число от 0 до 2), R9 означает галоген, циано, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный гетероциклил, -СООН, -COR10, -COOR11, -CONR12R13, -SO2R14, -SO2NR15R16, -NHSO2R17 или -NHSO2NR18R19, где R10 означает алкил или необязательно замещенный гетероциклил, R11 означает алкил, а R12, R13, R14, R15, R16, R17, R18 и R19 независимо друг от друга означают водород, алкил или гетероалкил,
(ф) -C(=NR20)(NR21R22), где R20, R21 и R22 независимо означают водород, алкил или гидрокси, или R20 и R21 вместе означают -(СН2)n-, где n равно 2 или 3, а R22 означает водород или алкил,
(х) -NHC(X)NR23R24, где Х означает -О- или -S-, а R23 и R24 независимо друг от друга означают водород, алкил или гетероалкил,
(ц) -CONR25R26, где R25 и R26 независимо означают водород, алкил, гетероалкил или необязательно замещенный гетероциклилалкил, или R25 и R26 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное гетероциклическое кольцо,
(ч) -S(O)nR27, где n означает целое число от 0 до 2, или R27 означает алкил, гетероалкил, необязательно замещенный гетероциклилалкил или -NR28R29, где R28 и R29 независимо друг от друга означают водород, алкил или гетероалкил,
(ш) циклоалкилалкил, циклоалкилалкенил и циклоалкилалкинил, все необязательно замещенные группами алкил, галоген, гидрокси или амино,
(щ) ариламиноалкилен или гетероариламиноалкилен,
(э) Z-алкилен-NR30R31 или Z-алкилен-OR32, где Z означает -NH-, -N((низш.)алкил)- или -O-, а R30, R31 и R32 независимо друг от друга означают водород, алкил или гетероалкил,
(ю) -ОС(O)-алкилен-CO2H или -OC(O)-NR’R (где R’ и R (где R’ и R независимо означают водород или алкил), независимо означают водород или алкил),
(я) гетероарилалкенилен или гетероарилалкинилен;
(аа) водород,
(бб) галоген,
(вв) псевдогалоген,
(гг) гидрокси,
(дд) необязательно замещенный алкокси,
(ее) C(L)R40, где L означает О, S или NR55, R40 означает водород, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный гетероарилий, необязательно замещенный циклоалкил, необязательно замещенный гетероциклил, C(L)R56, галоген, псевдогалоген, OR55, SR55, NR57R58 или SiR52R53R54; где R52, R53 и R54 выбирают, как описано в следующих пунктах (и) или (ii): (и) R52, R53 и R54 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55 или NR62R63, или (ii) любые два из R52, R53 и R54 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен, а другие выбирают, как описано в пункте (и); R55 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил или гетероциклил; R56 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55 или NR64R65, где R64 и R65 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR66 или NR62R63, или R64 и R65 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен, где R66 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил или гетероциклил; R57 и R58 выбирают, как описано в следующих пунктах (и) или (ii): (и) R57 и R58 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55, NR67R68 или C(L)R69, где R67 и R68 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил или гетероциклил, или эти заместители вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен, и R69 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR70 или NR62R63, где R70 означает алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, или (ii) R57 и R58 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен; R62 и R63 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, или R62 и R63 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен, и
(ii) необязательно замещенный алкил,
R4 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил,
(г) алкокси и
(д) гидрокси,
R5 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил,
(г) галогеналкил,
(д) тиоалкил,
(е) гидрокси,
(ж) амино,
(з) алкиламино,
(и) диалкиламино,
(к) гетероалкил,
(л) необязательно замещенный гетероцикл,
(м) необязательно замещенный гетероциклилалкил,
(н) необязательно замещенный гетероциклилалкокси,
(о) алкилсульфонил,
(п) аминосульфонил, моноалкиламиносульфонил или диалкиламиносульфонил,
(р) гетероалкокси и
(с) карбокси;
R6 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил и
(г) алкокси.
В одном варианте С означает 5-членное гетероарильное кольцо, содержащее в цикле 1 или 2 гетероатома. В другом варианте С выбирают из группы, включающей пиразол, имидазол, пиррол, тиазол, изотиазол, оксазол, изоксазол, фуран и тиофен. В другом варианте С означает пиразол или имидазол. В еще одном варианте С означает имидазол. В одном варианте С означает пиразол.
1. Производные пиразола
В одном варианте настоящего изобретения С означает пиразольное кольцо, и изобретение включает соединения, характеризующиеся формулой II
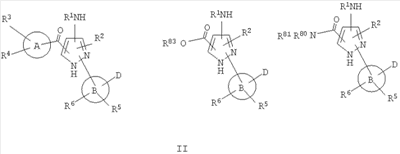
или их фармацевтически-приемлемые производные, в которых указаннные заместители определены в данном контексте.
В данном варианте водород в группе NH в кольце заменен на один из заместителей, показанных на структуре (например, -C(O)-(A)(R3)(R4), -R2 или -B(D)(R6)R5)).
В другом варианте настоящее изобретение включает соединения, характеризующиеся формулой III
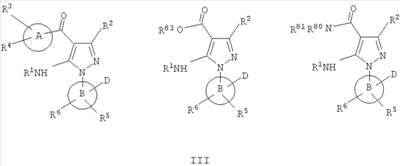
или их фармацевтически приемлемые производные, в которых указанные заместители определены в данном контексте.
В одном варианте настоящее изобретение включает соединения, характеризующиеся формулой IV
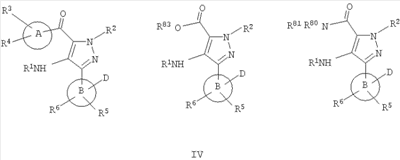
или их фармацевтически приемлемые производные, в которых указанные заместители определены в данном контексте.
В другом варианте настоящее изобретение включает соединения, характеризующиеся формулой V
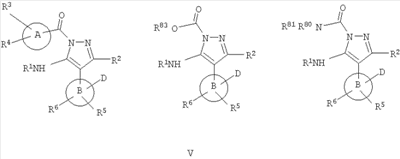
или их фармацевтически приемлемые производные, в которых указанные заместители определены в данном контексте.
В одном варианте настоящее изобретение включает соединения, характеризующиеся формулой Va
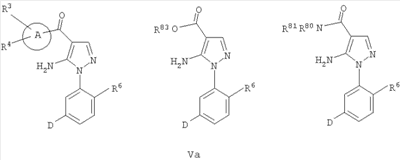
или их фармацевтически приемлемые производные, где A, D, R3, R4 и R6 определены в данном контексте.
2. Производные имидазола
В другом варианте настоящее изобретение включает соединения имидазола формулы VI
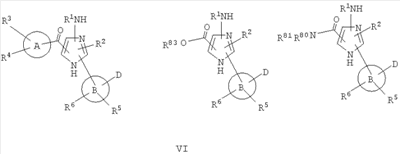
или их фармацевтически приемлемые производные, в которых указанные заместители определены в данном контексте.
В данном варианте водород в группе NH в цикле заменен на один из заместителей, показанных на структуре (например, -C(O)-A(R3)(R4), -R2 или -В(D)(R6)(R5)).
В другом варианте изобретение включает соединения, характеризующиеся формулой VII
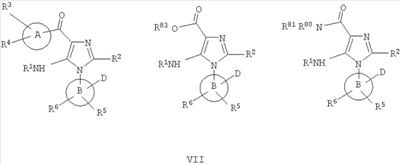
или их фармацевтически приемлемые производные, в которых указанные заместители определены в данном контексте.
В еще одном варианте изобретение включает соединения, характеризующиеся формулой VIII
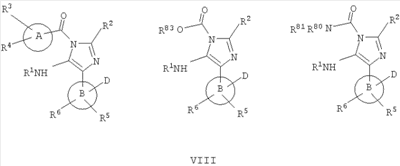
или их фармацевтически приемлемые производные, в которых указанные заместители определены в данном контексте.
3. Другие варианты осуществления настоящего изобретения
В других вариантах используют соединения, характеризующиеся показанными выше формулами, или их фармацевтически приемлемые производные, где R1 означает водород. В одном варианте R2 означает водород или (низш.)алкил. В другом варианте R2 означает водород.
В еще одном варианте G означает OR83 или NR80R81. В другом варианте R83 означает алкил или циклоалкил. В одном варианте R83 означает алкил. В другом варианте R83 означает этил. В еще одном варианте R80 и R81 каждый независимо означает водород или циклоалкил. В одном варианте R80 и R81 каждый независимо означает водород, алкил или циклоалкил. В другом варианте R80 и R81 каждый независимо означает водород или циклогексил. В одном варианте G означает NH2 или NH (циклогексил).
В другом варианте G означает арил, гетероарил, циклоалкил, гетероциклил или гетероциклическое кольцо, необязательно конденсированное с фенильным кольцом и замещенное группами R3 и R4, при условии, что гетероциклическое кольцо присоединено к карбонильной группе через атом углерода в цикле. В одном варианте G означает фенил, циклогексил, циклопентил или бензил и замещено группами R3 и R4. В другом варианте G означает фенил и замещено группами R3 и R4.
В одном варианте А означает арильное кольцо. В другом варианте А означает фенильное кольцо.
В одном варианте В означает арильное кольцо. В другом варианте В означает фенильное кольцо.
В одном варианте D означает -C(O)NR80R81. В другом варианте R80 и R81 каждый независимо означает водород, циклоалкил или алкокси. В одном варианте R80 означает водород. В другом варианте R81 означает циклоалкил или алкокси. В одном варианте R81 означает С3-С6циклоалкил или C1-С6алкокси. В другом варианте R81 означает циклопропил или метокси.
В одном варианте D означает необязательно замещенный гетероарил. В другом варианте D означает необязательно замещенный триазолил. В одном варианте D означает 1,2,4-триазол-3-ил.
В другом варианте R3 означает водород, необязательно замещенный гетероциклил, необязательно замещенный алкил, C(L)R40, галоген, псевдогалоген или OR41, где L означает О, S или NR55, R40 означает водород, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный гетероарилий, необязательно замещенный циклоалкил, необязательно замещенный гетероциклил, C(L)R56, галоген, псевдогалоген, OR55, SR55, NR57R58 или SiR52R53R54, R41 означает водород, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный гетероарилий, необязательно замещенный циклоалкил, необязательно замещенный гетероциклил, C(L)R59, NR60R61 или SiR52R53R54, где R52, R53 и R54 выбирают, как описано в следующих пунктах (i) или (ii): (i) R52, R53 и R54 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55 или NR62R63; или (ii) любые два из R52, R53 и R54 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен, а другие выбирают, как описано в пункте (i); R55 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил или гетероциклил; R56 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55 или NR64R65, где R64 и R65 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR66 или NR62R63, или R64 и R65 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен, где R66 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил или гетероциклил; R57 и R58 выбирают, как описано в следующих пунктах (i) или (ii): (i) R57 и R58 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55, NR67R68 или C(L)R69, где R67 и R68 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил или гетероциклил, или эти заместители вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен и R69 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR70 или NR62R63, где R70 означает алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, или (ii), R57 и R58 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен; R59 означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR70 или NR62R63; R60 и R61 каждый независимо означает водород, алкил, алкенил, алкинил, арилттетероария, гетероарилий, циклоалкил, гетероциклил или C(L)R71; где R71 означает алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, OR55 или NR62R63; R60 и R61 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен; R62 и R63 каждый независимо означает водород, алкил, алкенил, алкинил, арил, гетероарил, гетероарилий, циклоалкил, гетероциклил, или R62 и R63 вместе образуют алкилен, алкенилен, алкинилен, гетероалкилен.
В одном варианте R3 означает водород, необязательно замещенный гетероциклил, необязательно замещенный алкил, C(L)R40, галоген или OR41. В другом варианте R3 означает водород, необязательно замещенный гетероциклил, необязательно замещенный алкил, C(L)R40, иод, хлор или OR41. В одном варианте R3 означает водород, необязательно замещенный диоксоланил, необязательно замещенный метил, C(L)R40, иод, хлор или OR41. В другом варианте R3 означает водород, 2-диоксоланил, необязательно замещенный метил, C(O)R40, иод, хлор или OR41. В одном варианте R3 означает водород, 2-диоксоланил, необязательно замещенный метил, СНО, иод, хлор или OR41. В другом варианте R3 означает водород.
В одном варианте R3 означает необязательно замещенный метил. В другом варианте R3 означает метил, который необязательно замещен группами гетероциклил, гидрокси, аралкиламино или гетероциклилалкиламино. В одном варианте R3 означает N-морфолинилметил, гидроксиметил, N-(2-(3-хлорфенил)-1-этил)аминометил, N-(2-морфолинил-1-этил)аминометил или 4-пиперизинилметил.
В другом варианте А означает О. В одном варианте R40 означает водород, необязательно замещенный алкил или циклоалкил. В другом варианте R40 означает водород или алкил. В одном варианте R40 означает водород.
В еще одном варианте R41 означает водород или необязательно замещенный алкил. В другом варианте R41 означает водород или алкил, который необязательно замещен группами гетероциклил, арил, диалкиламино, галоген или гидрокси. В одном варианте R41 означает водород или C1-С3алкил, который необязательно замещен группами гетероциклил, фенил, диалкиламино, галоген или гидрокси. В другом варианте R41 означает водород, 2-(N-морфолинил)эт-1-ил, бензил, 2-(N,N-ди-(2-гидрокси-1-этил)амино)-1-этил, 2-бром-1-этил, 2,2-диоксолан-4-илметил, 2-(4-метилпиперазин-1-ил)-1-этил или 2,3-дигидрокси-1-пропил. В одном варианте R41 означает (S)-2,3-дигидрокси-1-пропил.
В другом варианте R4 означает водород. В одном варианте R5 означает алкил. В другом варианте R5 означает метил. В одном варианте R6 означает водород.
В другом варианте используют соединения, характеризующиеся показанными выше формулами, включая формулы I-VIII, или их фармацевтически приемлемые производные, где:
R1 означает водород, ацил или -Р(O)(ОН)2;
R2 означает водород, галоген, алкил или алкилтио;
А означает арил, гетероарил или гетероциклическое кольцо, необязательно конденсированное с фенильным кольцом, при условии, что гетероциклическое кольцо присоединено к карбонильной группе через атом углерода в цикле;
В означает арил или гетероарил;
D означает гетероарил, необязательно замещенный гетероарил или -C(O)NR80R81; где R80 и R81 независимо означают водород, алкил, циклоалкил, алкокси, гидрокси, гетероарил или необязательно замещенный гетероарил;
R3 выбирают из группы, включающей:
(а) амино, алкиламино или диалкиламино,
(б) ациламино,
(в) необязательно замещенный гетероциклил,
(г) необязательно замещенный арил или гетероарил,
(д) гетероалкил,
(е) гетероалкенил,
(ж) гетероалкинил,
(з) гетероалкокси,
(и) гетероалкиламино,
(к) необязательно замещенный гетероциклилалкил,
(л) необязательно замещенный гетероциклилалкенил,
(м) необязательно замещенный гетероциклилалкинил,
(н) необязательно замещенный гетероциклилалкокси или гетероциклилокси,
(о) необязательно замещенный гетероциклилалкиламино,
(п) необязательно замещенный гетероциклилалкилкарбонил,
(р) гетероалкилкарбонил,
(с) -NHSO2R6, где R6 означает алкил, гетероалкил или необязательно замещенный гетероциклилалкил,
(т) -NHSO2NR7R8, где R7 и R8 независимо друг от друга означают водород, алкил или гетероалкил,
(у) -Y-(алкилен)-R9, где Y означает простую связь, -O-, -NH- или -S(O)n– (где n означает целое число от 0 до 2) и R9 означает циано, необязательно замещенный гетероарил, -СООН, -COR10, -COOR11, -CONR12R13, -SO2R14, -SO2NR15R16, -NHSO2R17 или -NHSO2NR18R19, где R10 означает алкил или необязательно замещенный гетероциклил, R11 означает алкил и R12, R13, R14, R15, R16, R17, R18 и R19 независимо друг от друга означают водород, алкил или гетероалкил,
(ф) -C(=NR20)(NR21R22), где R20, R21 и R22 независимо означают водород, алкил или гидрокси, или R20 и R21 вместе означают -(СН2)n-, где n равно 2 или 3, а R22 означает водород или алкил,
(х) -NHC(X)NR23R24, где Х означает -О- или -S-, а R23 и R24 независимо друг от друга означают водород, алкил или гетероалкил,
(ц) -CONR25R26, где R25 и R26 независимо означают водород, алкил гетероалкил или необязательно замещенный гетероциклилалкил, или R25 и R26 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное гетероциклическое кольцо
(ч) -S(O)nR27, где n означает целое число от 0 до 2, или R27 означает алкил, гетероалкил, необязательно замещенный гетероциклилалкил или -NR28R29, где R28 и R29 независимо друг от друга означают водород, алкил или гетероалкил,
(ш) циклоалкилалкил, циклоалкилалкенил и циклоалкилалкинил, все необязательно замещенные группами алкил, галоген, гидрокси или амино,
(щ) ариламиноалкилен или гетероариламиноалкилен,
(э) Z-алкилен-NR30R31 или Z-алкилен-OR32, где Z означает -NH-, -N((низш.)алкил)- или -O-, а R30, R31 и R32 независимо друг от друга означают водород, алкил или гетероалкил,
(ю) -ОС(O)-алкилен-CO2H или -OC(O)-NR’R” (где R’ и R” независимо означают водород или алкил) и
(я) гетероарилалкенилен или гетероарилалкинилен;
R4 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил,
(г) алкокси и
(д) гидрокси,
R5 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил,
(г) галогеналкил,
(д) тиоалкил,
(е) гидрокси,
(ж) амино,
(з) алкиламино,
(и) диалкиламино,
(к) гетероалкил,
(л) необязательно замещенный гетероцикл,
(м) необязательно замещенный гетероциклилалкил,
(н) необязательно замещенный гетероциклилалкокси,
(о) алкилсульфонил,
(п) аминосульфонил, моноалкиламиносульфонил или диалкиламиносульфонил,
(р) гетероалкокси и
(с) карбокси.
R6 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил и
(г) алкокси;
их пролекарства, индивидуальные изомеры, смеси изомеров и фармацевтически приемлемые соли.
В другом варианте предлагаются соединения, где:
R1 означает водород или ацил,
R2 означает водород или алкил,
А означает арильное или гетероарильное кольцо.
В одном варианте предлагаются соединения, где:
R1 означает водород, ацил или -Р(O)(ОН)2;
R2 означает водород, галоген, алкил или алкилтио;
А означает арил, гетероарил или гетероциклил, необязательно конденсированный с фенильным кольцом, при условии, что гетероциклическое кольцо присоединено к карбонильной группе через атом углерода в цикле;
В означает арил или гетероарил;
R3 выбирают из группы, включающей:
(а) амино,
(б) ациламино,
(в) необязательно замещенный гетероцикл,
(г) гетероарил, необязательно замещенный заместителями, которые выбирают из группы, включающей галоген, алкил или алкокси,
(д) гетероалкил,
(е) гетероалкенил,
(ж) гетероалкинил,
(з) гетероалкокси,
(и) гетероалкиламино,
(к) необязательно замещенный гетероциклилалкил,
(л) необязательно замещенный гетероциклилалкенил,
(м) необязательно замещенный гетероциклилалкинил,
(н) необязательно замещенный гетероциклилалкокси,
(о) необязательно замещенный гетероциклилалкиламино,
(п) необязательно замещенный гетероциклилалкилкарбонил,
(р) гетероалкилкарбонил,
(с) -NHSO2R6, где R6 означает алкил, гетероалкил или необязательно замещенный гетероциклилалкил,
(т) -NHSO2NR7R8, где R7 и R8 независимо друг от друга означают водород, алкил или гетероалкил,
(у) -Y-(алкилен)-R9, где Y означает простую связь, -O-, -NH- или -S(O)n– (где n равно целому числу от 0 до 2) и R9 означает циано, гетероарил, -СООН, -COR10, -COOR11, -CONR12R13, -SO2R14, -SO2NR15R16, -NHSO2R17 или -NHSO2NR18R19, где R10 означает алкил или необязательно замещенный гетероцикл, R11 означает алкил, a R12, R13, R14, R15, R16, R17, R18 и R19 независимо друг от друга означают водород, алкил или гетероалкил,
(ф) -C(=NR20)(NR21R22), где R20, R21 и R22 независимо означают водород, алкил или гидрокси, или R20 и R21 вместе означают -(СН2)n-, где n равно 2 или 3, а R22 означает водород или алкил,
(х) -NHC(X)NR23R24, где Х означает -О- или -S-, а R23 и R24 независимо друг от друга означает водород, алкил или гетероалкил,
(ц) -CONR25R26, где R25 и R26 независимо означают водород, алкил, гетероалкил или необязательно замещенный гетероциклилалкил, или R25 и R26 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное гетероциклическое кольцо,
(ч) -S(O)nR, где n равно целому числу от 0 до 2, и R27 означает алкил, гетероалкил, необязательно замещенный гетероциклилалкил, или -NR28R29, где R28 и R29 независимо друг от друга означают водород, алкил или гетероалкил,
R4 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил и
(г) алкокси;
R5 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил,
(г) галогеналкил,
(д) тиоалкил,
(е) гидрокси,
(ж) амино,
(з) алкиламино,
(и) диалкиламино,
(к) гетероалкил,
(л) необязательно замещенный гетероцикл,
(м) необязательно замещенный гетероциклилалкил и
(н) необязательно замещенный гетероциклилалкокси.
R6 выбирают из группы, включающей
(а) водород,
(б) галоген,
(в) алкил и
(г) алкокси.
В другом варианте предлагаются соединения, где R3 означает
(а) необязательно замещенный гетероциклил,
(б) арил или гетероарил, оба необязательно замешенные заместителями, которые выбирают из группы, включающей галоген, алкил, амино, алкокси, карбокси, (низш.)алкоксикарбонил, SO2R’ (где R’ означает алкил) или -O2NHR’R” (где R’ и R” независимо означают водород или алкил),
(в) гетероалкил,
(г) гетероалкенил,
(д) гетероалкиламино,
(е) гетероалкокси,
(ж) необязательно замещенный гетероциклилалкил или гетероциклилокси,
(з) необязательно замещенный гетероциклилалкенил,
(и) необязательно замещенный гетероциклилалкинил,
(к) необязательно замещенный гетероциклилалкокси,
(л) необязательно замещенный гетероциклилалкиламино,
(м) необязательно замещенный гетероциклилалкилкарбонил,
(н) -Y-(алкилен)-R9, где Y означает простую связь, -O-, -NH- и R9 означает необязательно замещенный гетероарил, -CONR12R, -SO2R14, -SO2NR15R16, -NHSO2R17 или -NHSO2NR18R19, где R12, R13, R14, R15, R16, R17, R18 и R19 независимо друг от друга означают гетероалкил, водород, алкил или гетероалкил,
(о) циклоалкилалкил, циклоалкилалкенил и циклоалкилалкинил, все необязательно замещенные группами алкил, галоген, гидрокси или амино,
(п) ариламиноалкилен или гетероариламиноалкилен или
(р) Z-алкилен-NR30R31, где Z означает -NH-, -N(алкил)- или -O-, а R30 и R31 независимо друг от друга означают водород, алкил или гетероалкил.
В другом варианте предлагаются соединения, где R1 и R2 означают водород, а В означает фенил. В дополнительном варианте предлагаются соединения, где R4 означает водород, a R5 означает галоген или алкил. В другом варианте предлагаются соединения, где R5 означает хлор, фтор или метил, а R6 означает водород, хлор, фтор, метил или метокси. В одном варианте предлагаются соединения, где R3 означает необязательно замещенный гетероарил.
В другом варианте предлагаются соединения, где R3 означает пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, N-оксидопиридин-2-ил, N-оксидопиридин-3-ил, N-оксидопиридин-4-ил или пиридон-2-ил, все необязательно замещенные. В ином варианте предлагаются соединения, где R3 находится в положении 3. В другом варианте предлагаются соединения, где R5 означает 4-F или 2-Ме, а R6 означает водород. В одном варианте предлагаются соединения, где R3 необязательно замещен фенильной группой.
В дополнительном варианте предлагаются соединения, где R3 означает 3-сульфамоилфенил, 3-метилсульфонилфенил, 3-карбоксифенил или 3-этоксикарбонилфенил. В другом варианте предлагаются соединения, где R5 означает 4-F, а R6 означает водород.
В другом варианте предлагаются соединения, где R3 означает
(а) гетероалкил,
(б) гетероалкокси,
(в) гетероалкиламино,
(г) необязательно замещенный гетероциклилалкил,
(д) необязательно замещенный гетероциклилалкокси,
(е) необязательно замещенный гетероциклилалкиламино,
(ж) -Y-(алкилен)-R9, где Y означает простую связь, -О- или -NH- и R9 означает необязательно замещенный гетероарил, -CONR12R13, -SO2R14, -SO2NR15R16, -NHSO2R17 или -NHSO2NR18R19, где R12, R13, R14, R15, R16, R17, R18 и R19 независимо друг от друга означают водород, алкил или гетероалкил, или
(з) Z-алкилен-NR30R31, где Z означает -NH-, -N(алкил)- или -O-, а R30 и R31 независимо друг от друга означают водород, алкил или гетероалкил.
В другом варианте предлагаются соединения, где R3 означает гетероалкил. В ином варианте предлагаются соединения, где R3 находится в положении 3 и его выбирают из группы, включающей 2-диметиламиноэтил, 3-диметиламинопропил, 4-диметиламинобутил, 2-диметиламиноэтиламино, 3-диметиламинопропиламино, гидроксиметил, 1,2-дигидроксиэтил, 3-гидрокси-3-метил-1-бутил или 3-гидроксибутил. В одном варианте предлагаются соединения, где R5 означает 2-F, a R6 означает 4-F.
В другом варианте предлагаются соединения, где R5 означает 2-Ме, а R6 означает водород. В дополнительном варианте предлагаются соединения, где R9 означает гетероалкокси или гетероалкиламино. В одном варианте предлагаются соединения, где R3 находится в положении 3 и его выбирают из группы, включающей 3-диметиламинопропокси, 2-диметиламиноэтокси, 2-гидроксиэтокси, 2,3-дигидроксипропокси, 2-диметиламиноэтиламино и 3-диметиламинопропиламино.
В другом варианте предлагаются соединения, где R3 означает необязательно замещенный гетероциклилалкил, необязательно замещенный гетероциклилалкокси или необязательно замещенный гетероциклилалкиламино. В одном варианте предлагаются соединения, где R3 находится в положении 3 и его выбирают из группы, включающей 3-(морфолин-4-ил)пропокси, 2-(морфолин-4-ил)этокси, 2-(2-оксопирролидин-1-ил)этокси, 3-(морфолин-4-ил)пропил, 2-(морфолин-4-ил)этил, 4-(морфолин-4-ил)бутил, 3-(морфолин-4-ил)пропиламино, 2-(морфолин-4-ил)этиламино, 4-гидроксипиперидинилметил, 2-(S,S-диоксотиаморфолин-4-ил)этил, 3-(S,S-диоксотиаморфолин-4-ил)пропил и N-метилпиперазинилметил.
В еще одном варианте предлагаются соединения, где R3 означает -Y-(алкилен)-R9, где Y означает простую связь, -О- или -NH- и R9 означает необязательно замещенный гетероарил, -CONR12R13, -SO2R14, -SO2NR15R16, -NHSO2R17 или -NHSO2NR18R19, где R12, R13, R14, R15, R16, R17, R18 и R19 независимо друг от друга означают водород, алкил или гетероалкил. В еще одном варианте предлагаются соединения, где Y означает простую связь, а R9 означает -SO2R14 или -SO2NR15R16.
В другом варианте предлагаются соединения, где R3 означает 5-метилсульфонилэтил или сульфамоилэтил.
В одном варианте соединения выбирают из группы, включающей 5-амино-1-(4-фторфенил)-4-[3-(2-морфолин-4-илэтокси)бензоил]пиразол, 5-амино-1-(2,4-дифторфенил)-4-[3-(3-морфолин-4-илпропил)бензоил]пиразол, 5-амино-4-(3-аминобензоил)-1-(4-фторфенил)пиразол, 5-амино-1-(4-фторфенил)-4-[3-(3-морфолин-4-илпропил)бензоил]пиразол, 5-амино-4-[3-(2-аминосульфонилэтенил)бензоил]-1-(4-фторфенил)пиразол, 5-амино-4-(3-ацетиламинобензоил)-1-фенилпиразол, 5-амино-4-[3-(2-аминоэтил)бензиол]-1-(4-фторфенил)пиразол, 5-амино-1-(4-фторфенил)-4-[3-(3-морфолин-4-илпропиламино)бензоил]пиразол, 5-амино-4-[3-(2-аминосульфонилэтил)бензоил]-1-(4-фторфенил)пиразол и 5-амино-1-(4-фторфенил)-4-(3-пиридин-3-илбензоил)пиразол.
В другом варианте соединения выбирают из группы, включающей 5-амино-1-(2-метилфенил)-4-[3-пиридин-3-ил)бензоил]пиразол, 5-амино-1-(2-метилфенил)-4-[3-(N-оксидопиридин-3-ил)бензоил]пиразол, 5-амино-4-[3-(2,3-дигидроксипропокси)бензоил]-1-(4-фторфенил)пиразол, 5-амино-4-[3-(1,2-дигидроксиэтил)бензоил]-1-(4-фторфенил)пиразол, 5-амино-1-(4-фторфенил)-4-[3-(сульфамоилбензоил]пиразол, 5-амино-1-(4-фторфенил)-4-[3-(3-гидрокси-3-метилбутил)бензоил]пиразол, 5-амино-1-(4-фторфенил)-4-[3-(2-(1-гидроксициклопентил)этил)бензоил]пиразол, 5-амино-4-[3-(2-метилсульфонилэтил)бензоил]-1-(4-фторфенил)пиразол и 5-амино-1-(2,4-дифторфенил)-4-[3-(2-гидроксиэтилсульфонил)бензоил]пиразол.
В одном варианте соединения выбирают из группы, включающей 3-[5-амино-4-(3-иодобензоил)пиразол-1-ил]-N-метокси-4-метилбензамид, 3-(5-амино-4-бензоилпиразол-1-ил)-N-метокси-4-метилбензамид, 3-(5-амино-4-бензоилпиразол-1-ил)-4-метилбензойную кислоту, 3-(5-амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-4-метилбензойную кислоту, 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, {5-амино-1-[2-метил-5-(4Н-[1,2,4]триазол-3-ил)фенил]-1Н-пиразол-4-ил}фенилметанон, 3-[5-амино-4-(3-[1,3]диоксолан-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-формилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-гидроксиметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-{5-амино-4-[3-(4-метилпиперазин-1-илметил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-морфолин-4-илметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-морфолин-4-илметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-бензилоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-гидроксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(4-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид и 3-(5-амино-4-бензоилимидазол-1-ил)-N-циклопропил-4-метилбензамид.
В другом варианте соединения выбирают из группы, включающей 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-метокси-4-метилбензамид, 3-(5-амино-4-бензоилпиразол-1-ил)-N-метокси-4-метилбензамид, 3-(5-амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, {5-амино-1-[2-метил-5-(4Н-[1,2,4]триазол-3-ил)-фенил]-1Н-пиразол-4-ил}фенилметанон, 3-[5-амино-4-(3-[1,3]диоксолан-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-формилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-гидроксиметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-{5-амино-4-[3-(4-метилпиперазин-1-илметил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-морфолин-4-илметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-морфолин-4-илметилбензоил)-пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-бензилоксибензол)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(3-гидроксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, 3-[5-амино-4-(4-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид или 3-(5-амино-4-бензоилимидазол-1-ил)-N-циклопропил-4-метилбензамид.
В другом варианте соединения выбирают из группы, включающей
3-{5-амино-4-[3-(2-диметиламиноэтилкарбамоил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(5-хлортиофен-2-карбонил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-гидразинокарбонилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-циклогексанкарбонилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-циклопентанкарбонилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-фенилацетилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(тетрагидропиран-4-карбонил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-этилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид и
3-[5-амино-4-(3-изопропилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид.
В еще одном варианте соединения выбирают из группы, включающей
этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метил-1Н-пиразол-4-карбоновой кислоты,
этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-(5-амино-4-циклопентанкарбонилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-гидразинокарбонилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
бензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-(5-амино-4-циклогексанкарбонилпиразол-1-ил)-N-циклопропил-4-метилбензамид и
циклогексиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты.
В другом варианте соединения выбирают из группы, включающей:
амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты,
амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метансульфонил-1Н-пиразол-4-карбоновой кислоты,
этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты,
этиловый эфир 5-амино-3-[(3-хлорбензилкарбамоил)метокси]-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-[5-амино-4-бензоил-3-(пиперидин-4-илокси)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-3-метансульфонилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-3-метоксипиразол-1-ил)-N-циклопропил-4-метилбензамид,
этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-(2-гидроксиэтокси)-1Н-пиразол-4-карбоновой кислоты,
трет-бутиловый эфир 4-[5-амино-4-бензоил-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-3-илокси]пиперидин-
1-карбоновой кислоты,
3-(5-амино-4-бензоил-3-метилсульфанилпиразол-1-ил)-N-циклопропил-4-метилбензамид и
3-[5-амино-4-бензоил-3-(2-метоксиэтокси)пиразол-1-ил]-N-циклопропил-4-метилбензамид.
В другом варианте соединения выбирают из группы, включающей:
3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-метокси-4-метилбензамид,
3-(5-амино-4-бензоилпиразол-1-ил)-N-метокси-4-метилбензамид,
3-(5-амино-4-бензоилпиразол-1-ил)-4-метилбензойная кислота,
3-(5-амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-4-метилбензойная кислота,
3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
{5-амино-1-[2-метил-5-(4Н-[1,2,4]триазол-3-ил)фенил]-1Н-пиразол-4-ил}фенилметанон,
3-[5-амино-4-(3-[1,3]диоксолан-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-формилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-гидроксиметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(4-метилпиперазин-1-илметил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-морфолин-4-илметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(2-морфолин-4-илэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-бензилоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-гидроксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-циклогексанкарбонилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-циклопентанкарбонилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-фенилацетилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-изопропилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(2-диметиламиноэтилкарбамоил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-этилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-метилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-циклопропилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-циклопентилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(морфолин-4-карбонил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(циклопропилметилкарбамоил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(тетрагидропиран-4-карбонил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-3-метоксипиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-3-этоксипиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-бензоил-3-(2-метоксиэтокси)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-бензоил-3-(2-бензилоксиэтокси)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
трет-бутиловый эфир 4-[5-амино-4-бензоил-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-3-илокси]пиперидин-1-
карбоновой кислоты,
трифторацетат 3-[5-амино-4-бензоил-3-(пиперидин-4-илокси)пиразол-1-ил]-N-циклопропил-4-метилбензамида,
3-(5-амино-4-бензоил-3-метилсульфанилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-3-метансульфонилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты,
амид 5-Амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метансульфонил-1Н-пиразол-4-карбоновой кислоты и
этиловый эфир 5-Амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты.
В. Синтез соединений
В настоящем изобретении предлагается также способ получения соединения формулы (I), причем указанный способ включает следующие стадии:
(i) взаимодействие 2-кето-3-фениламиноакрилонитрила формулы 1:
с гидразином формулы 2
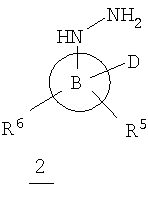
где R3, R4, R5 и R6 определены выше, при этом получают соединение формулы (I), где R1 означает водород, или
(ii) взаимодействие 2-кето-3-фениламиноакрилонитрила формулы 3
где Z означает гидрокси, нитро или галоген и R4 определен выше, с гидразином формулы 2, при этом получают соединение формулы 4
с последующим превращением группы Z в требуемую группу R3, при этом получают соединение формулы (I), где R1 означает водород;
(iii) необязательная модификация любых групп R1, R3, R , R5 или R6; , R5 или R6;
(iv) необязательное превращение соединения формулы (I), полученного на стадиях (i), (ii) или (iii), описанных выше, в соответствующую кислотно-аддитивную соль при обработке кислотой;
(v) необязательное превращение соединения формулы (I), полученного на стадиях (i), (ii) или (iii), описанных выше, в соответствующее свободное основание при обработке основанием и
(vi) необязательное разделение смеси стереоизомеров соединения формулы (I), полученного на стадиях (i)-(v), описанных выше, при этом получают индивидуальный стереоизомер.
В настоящем изобретении предлагается также способ получения соединения формулы I, который включает взаимодействие соединений формулы 5
где R5 и R6 определены выше, a L означает уходящую группу в условиях реакции металлоорганического замещения, которая включает без ограничения перечисленным галоген, псевдогалоген, арилокси, перфторарилокси, N-алкоксиамино, включая N-метоксиамино,
с металлоорганическим реагентом формулы
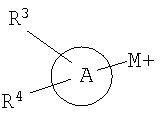
где R3 и R4 определены выше, а М означает атом металла, включающий, без ограничения перечисленным, щелочной металл, щелочно-земельный металл и переходный металл, такой как Li, К и Mg, при этом получают соединение формулы (I), где R1 означает водород,
(ii) необязательная модификация любых групп R1, R3, R4, R5 или R6;
(iii) необязательное превращение соединения формулы (I), полученного на стадиях (i) или (ii), описанных выше, в соответствующую кислотно-аддитивную соль при обработке кислотой;
(iv) необязательное превращение соединения формулы (I), полученного на стадиях (i) или (ii), описанных выше, в соответствующее свободное основание при обработке основанием, и необязательное разделение смеси стереоизомеров соединения формулы (I), полученного на стадиях (i) или (iv), описанных выше, при этом получают индивидуальный стереоизомер.
Описанные в данном контексте соединения представлены в качестве примеров, и их можно получить по известным методикам, аналогично тому, как описано в настоящем изобретении, с использованием известных методов химического синтеза, включая методы, аналогичные описанным в разделе Примеры.
Предлагаемые в настоящем изобретении соединения в основном получают по следующим схемам, а также по известным методикам. Дополнительные способы синтеза описаны, например, в патентах US   6376527, 6316466 и 6444696 и в международной заявке 6376527, 6316466 и 6444696 и в международной заявке  WO 99/57101, причем все они включены в настоящее изобретение в качестве ссылки. WO 99/57101, причем все они включены в настоящее изобретение в качестве ссылки.
Кроме перечисленных документов, в настоящем изобретении представлены следующие примеры способов (без ограничения перечисленным) получения соединений по настоящему изобретению (см. ниже схемы 1-8).
В качестве промежуточных соединений по настоящему изобретению используют амины, присоединенные к арильной или гетероарильной кольцевой системе. Известно множество методов получения таких промежуточных соединений. Несколько способов получения аминов, используемых для получения соединений по настоящему изобретению, показано на схемах 1-7.
Замещенные анилины типа (II), используемые в настоящем изобретении, получают из коммерческого препарата 3-амино-4-метилбензойной кислоты, как показано на схеме 1, с использованием методов, аналогично тому, как описано в международной заявке  WO 02/40486. Аминогруппу в составе анилина защищают группой Boc. Затем проводят конденсацию с метиламином в присутствии конденсирующих агентов EDC и HOBt. Группу Boc удаляют с использованием HCl в диоксане, при этом получают требуемый замещенный анилин типа (II) в виде гидрохлорида. WO 02/40486. Аминогруппу в составе анилина защищают группой Boc. Затем проводят конденсацию с метиламином в присутствии конденсирующих агентов EDC и HOBt. Группу Boc удаляют с использованием HCl в диоксане, при этом получают требуемый замещенный анилин типа (II) в виде гидрохлорида.
Схема 1
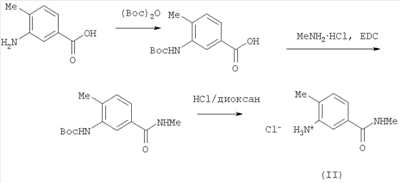
Замещенные анилины типа (III), используемые в настоящем изобретении, получают из коммерческого препарата 3-амино-4-метилбензойной кислоты, как показано на схеме 2. После конденсации с циклопропиламином в присутствии конденсирующего агента EDC получают анилин типа (III).
Схема 2

Замещенные анилины типа (IV), используемые в настоящем изобретении, получают из коммерческого препарата 4-метил-3-нитробензойной кислоты, как показано на схеме 3, с использованием методов, аналогично тому, как описано в международной заявке  WO 03/033482. После конденсации кислоты с трет-бутоксикарбонилгидразидом в присутствии конденсирующих агентов HBTU и HOBt получают защищенный ацилгидразид. После удаления защитных групп в присутствии ТФУ и конденсации с триэтилортоформиатом получают оксадиазолилзамещенный нитротолуол. После гидрирования нитрогрупп получают требуемый анилин типа (IV). WO 03/033482. После конденсации кислоты с трет-бутоксикарбонилгидразидом в присутствии конденсирующих агентов HBTU и HOBt получают защищенный ацилгидразид. После удаления защитных групп в присутствии ТФУ и конденсации с триэтилортоформиатом получают оксадиазолилзамещенный нитротолуол. После гидрирования нитрогрупп получают требуемый анилин типа (IV).
Схема 3
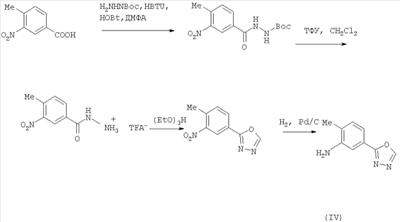
Замещенные анилины типа (V), используемые в настоящем изобретении, получают из коммерческого препарата 4-метил-3-нитробензамида, как показано на схеме 4, с использованием методов, описанных в работе Han и др. J. Med. Chem., 41, 2019-2028 (1998). Указанный арилкарбоксамид конденсируют с диэтилацеталем N,N-диметилформамида. Затем проводят реакцию с гидразином в уксусной кислоте, при этом получают триазолилзамещенный нитротолуол. После гидрирования нитрогрупп получают требуемый анилин типа (V).
Схема 4
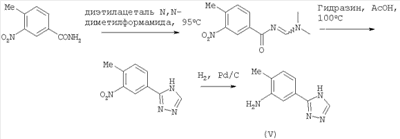 Замещенные анилины типа (VI), используемые в настоящем изобретении, получают из коммерческого препарата метилового эфира 4-иодбензойной кислоты, как показано на схеме 5. После нитрования ароматического предшественника с последующим восстановлением нитрогруппы получают анилин. Затем проводят конденсацию с этинилтриметилсиланом в присутствии катализатора на основе палладия с последующим десилилированием и омылением, при этом получают требуемую этинилзамещенную аминобензойную кислоту. При конденсации с метоксиамином в присутствии конденсирующего агента EDC получают требуемый анилин (VI). См., например, работу Eur. J. Org. Chem; 4607 (2001). Замещенные анилины типа (VI), используемые в настоящем изобретении, получают из коммерческого препарата метилового эфира 4-иодбензойной кислоты, как показано на схеме 5. После нитрования ароматического предшественника с последующим восстановлением нитрогруппы получают анилин. Затем проводят конденсацию с этинилтриметилсиланом в присутствии катализатора на основе палладия с последующим десилилированием и омылением, при этом получают требуемую этинилзамещенную аминобензойную кислоту. При конденсации с метоксиамином в присутствии конденсирующего агента EDC получают требуемый анилин (VI). См., например, работу Eur. J. Org. Chem; 4607 (2001).
Схема 5
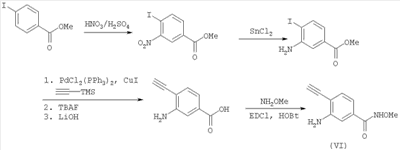 В другом варианте замещенный анилин типа (VI), используемый в настоящем изобретении, получают из 4-амино-3-нитробензойной кислоты, как показано на схеме 6. После реакции замещения диазогруппы на иод с использованием соли диазония с последующей этерификацией метанолом получают метиловый эфир 4-иод-3-нитробензойной кислоты. Нитрогруппу восстанавливают SnCl2, при этом получают требуемый анилин. Затем проводят конденсацию с этинилтриметилсиланом в присутствии катализатора на основе палладия с последующим десилилированием и омылением, при этом получают этинилзамещенную аминобензойную кислоту. При конденсации с метоксиамином в присутствии конденсирующего агента EDC получают требуемый анилин (VI). См., например, Eur. J. Org. Chem., 4607 (2001). В другом варианте замещенный анилин типа (VI), используемый в настоящем изобретении, получают из 4-амино-3-нитробензойной кислоты, как показано на схеме 6. После реакции замещения диазогруппы на иод с использованием соли диазония с последующей этерификацией метанолом получают метиловый эфир 4-иод-3-нитробензойной кислоты. Нитрогруппу восстанавливают SnCl2, при этом получают требуемый анилин. Затем проводят конденсацию с этинилтриметилсиланом в присутствии катализатора на основе палладия с последующим десилилированием и омылением, при этом получают этинилзамещенную аминобензойную кислоту. При конденсации с метоксиамином в присутствии конденсирующего агента EDC получают требуемый анилин (VI). См., например, Eur. J. Org. Chem., 4607 (2001).
Схема 6
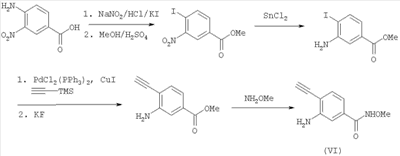 Как показано на схеме 7, замещенные анилины типа (VII), используемые в настоящем изобретении, получают из промежуточного метилового эфира 4-иодтринитробензойной кислоты, который синтезируют, как показано на схеме 6. Затем проводят конденсацию с винилтрибутилоловом с использованием катализатора на основе палладия, с последующим присоединением карбена к образующейся стирольной двойной связи, при этом получают циклопропилзамещенный метиловый эфир нитробензойной кислоты. После восстановления нитрогруппы с последующим введением защитной группы Boc и омылением получают защищенную 3-амино-4-циклопропилбензойную кислоту. После конденсации с алкоксиамином в присутствии конденсирующего агента EDC получают требуемый анилин (VII). См., например, международные заявки Как показано на схеме 7, замещенные анилины типа (VII), используемые в настоящем изобретении, получают из промежуточного метилового эфира 4-иодтринитробензойной кислоты, который синтезируют, как показано на схеме 6. Затем проводят конденсацию с винилтрибутилоловом с использованием катализатора на основе палладия, с последующим присоединением карбена к образующейся стирольной двойной связи, при этом получают циклопропилзамещенный метиловый эфир нитробензойной кислоты. После восстановления нитрогруппы с последующим введением защитной группы Boc и омылением получают защищенную 3-амино-4-циклопропилбензойную кислоту. После конденсации с алкоксиамином в присутствии конденсирующего агента EDC получают требуемый анилин (VII). См., например, международные заявки  WO 02/092087 и WO 02/40486. WO 02/092087 и WO 02/40486.
Схема 7
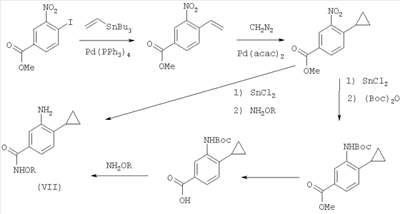 В качестве промежуточных соединений по настоящему изобретению используют гидразины, присоединенные к арильной или гетероарильной кольцевой системе. Известно множество методов получения таких промежуточных соединений. Пример такого метода получения некоторых гидразинов, используемых в настоящем изобретении, показан на схеме 8. В качестве промежуточных соединений по настоящему изобретению используют гидразины, присоединенные к арильной или гетероарильной кольцевой системе. Известно множество методов получения таких промежуточных соединений. Пример такого метода получения некоторых гидразинов, используемых в настоящем изобретении, показан на схеме 8.
Арилгидразины типа (VIII), используемые в настоящем изобретении, получают из гидрохлорида 3-амино-N-метокси-4-метилбензамида, который получают по методикам, описанным в международной заявке  WO 02/40486. После образования соли арилдиазония и ее последующего восстановления SnCl2 получают требуемый гидразин типа (VIII). WO 02/40486. После образования соли арилдиазония и ее последующего восстановления SnCl2 получают требуемый гидразин типа (VIII).
Как показано на схеме 8, арилгидразины типа (IX), используемые в настоящем изобретении, получают из 3-амино-N-циклопропил-4-метилбензамида, который получают по методикам, показанным на схеме 2. После образования соли арилдиазония и ее последующего восстановления SnCl2 получают требуемый гидразин типа (IX).
Аналогичным образом можно получить другие гидразины из аминов, показанных выше на схемах 1-7.
Схема 8
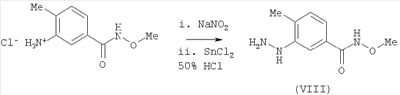
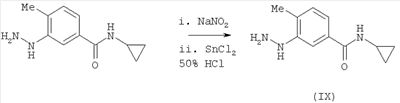
Как показано на схеме 9, акрилонитрилы типа (X), используемые в настоящем изобретении, получают из арилового эфира и ацетонитрила. Ацетонитрил обрабатывают диизопропиламидом лития в ТГФ при -78°С, затем добавляют ариловый эфир, при этом получают соответствующий арилоилацетонитрил. Полученное промежуточное соединение вводят в реакцию с N,N’-дифенилформамидином в растворителе, таком как толуол, при температуре кипения растворителя, при этом получают соответствующий акрилонитрил типа (X).
Схема 9
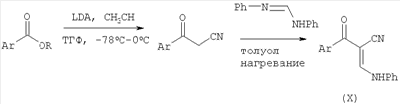
Как показано на схеме 10, аминопиразолы типа (XI), используемые в настоящем изобретении, получают из акрилонитрила типа (X), который получают по методикам, показанным на схеме 9, и гидразинов, таких как гидразины типа (VIII) и (IX), которые получают по методикам, показанным на схеме 8. Акрилонитрил и гидразин нагревают при температуре от 60 до 100°С в растворителе, таком как ДМФА или этанол, при этом получают требуемый аминопиразол типа (XI).
Схема 10
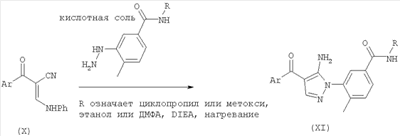
Как показано на схеме 11, аминопиразолы типа (XIII), используемые в настоящем изобретении, получают из акрилонитрила типа (XII), который получают при обработке акрилонитрила типа (X), полученного по методикам, показанным на схеме 9, гидридом натрия и дисульфидом углерода с последующей обработкой иодметаном, и гидразинов, таких как гидразины типа (VIII) и (IX), которые получают по методикам, показанным на схеме 8. Акрилонитрил и гидразин нагревают при температуре от 60 до 100°С в растворителе, таком как ДМФА или этанол, при этом получают требуемый аминопиразол типа (XIII).
Схема 11
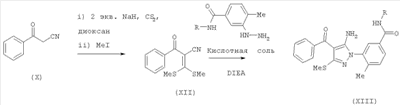 Как показано на схеме 12, аминопиразолы типа (XIV), используемые в настоящем изобретении, получают из акрилонитрила типа (XII), который получают по методикам, показанным на схеме 11, и гидразинов, таких как гидразины типа (VIII) и (IX), которые получают по методикам, показанным на схеме 8. При обработке полученного промежуточного соединения (XII) спиртовым раствором алкоксида с последующим нагреванием при температуре от 60 до 100°С в присутствии гидразина в растворителе, таком как ДМФА или этанол, получают требуемый аминопиразол типа (XIII). Как показано на схеме 12, аминопиразолы типа (XIV), используемые в настоящем изобретении, получают из акрилонитрила типа (XII), который получают по методикам, показанным на схеме 11, и гидразинов, таких как гидразины типа (VIII) и (IX), которые получают по методикам, показанным на схеме 8. При обработке полученного промежуточного соединения (XII) спиртовым раствором алкоксида с последующим нагреванием при температуре от 60 до 100°С в присутствии гидразина в растворителе, таком как ДМФА или этанол, получают требуемый аминопиразол типа (XIII).
Схема 12
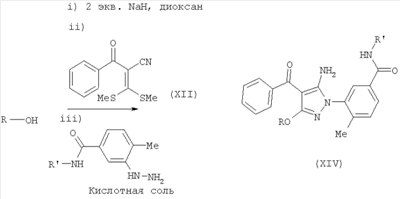
Как показано на схеме 13, аминоимидазолы типа (XV), используемые в настоящем изобретении, получают из замещенных анилинов типа (III), которые получают по методикам, показанным на схеме 2. Анилин нагревают в триэтилортоформиате. После удаления растворителя в вакууме продукт вводят в реакцию с пара-толуолсульфонатом аминомалононитрила и ацетатом натрия в уксусной кислоте, при этом получают промежуточное производное аминоцианоимидазола. После взаимодействия данного промежуточного соединения с реактивом Гриньяра получают требуемый аминоимидазол типа (XV).
Схема 13
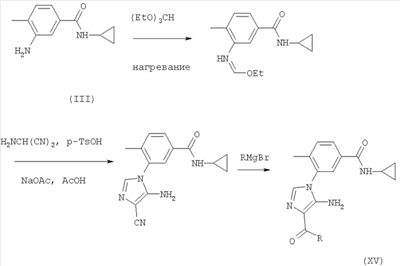
Предлагаемые в настоящем изобретении соединения получают из гидразинов, присоединенных к арильной или гетероарильной кольцевой системе, с использованием методов, описанных в патентах US   6316466, 6376527 и 6444696. 6316466, 6376527 и 6444696.
Дополнительные методы синтеза, используемые при синтезе соединений по настоящему изобретению, описаны в следующих научных журналах, которые включены в описание изобретения в качестве ссылок:
1. J. Heterocyclic Chem. 17, 631 (1980)
2. Tetrahedron 55(48), 13703 (1999)
3. European Patent No. EP 0713876
4. Chemische Berichte 126(10), 2317 (1993)
5. Journal of Organic Chem. 58(24), 6620 (1993)
6. Tetrahedron Letters 35, 3239 (1973)
7. Journal of Chemical Research, Synopses 1, 2 (1997)
8. Boletin de la Sociedad Quimica del Peru 53(3), 150 (1987)
9. Journal of the Chemical Society, Chemical Communications 2, 35 (1973)
10. Comptes Rendus des Seances de l’Academie des Sciences, Series C: Sciences Chimiques 274(20), 1703 (1972)
В настоящем изобретении предлагаются также соединения, которые получают с использованием способа, описанного в настоящем изобретении.
Г. Составы фармацевтических композиций
В настоящем изобретении предлагается также фармацевтическая композиция, включающая соединения по настоящему изобретению. Композицию используют, например, в качестве лекарственного средства. Композиция содержит, например, фармацевтически приемлемый наполнитель или носитель. Композицию или лекарственное средство по настоящему изобретению используют для лечения, профилактики или ослабления одного или более симптомов, заболеваний или нарушений, опосредованных киназой р38, включая воспалительные заболевания.
Таким образом, в настоящем изобретении предлагаются фармацевтические композиции, предназначенные для лечения состояний, связанных с киназой р38, включая состояния, опосредованные TNF- , IL-1 и/или IL-8, как описано выше. Композиции содержат другие терапевтические агенты, как описано в данном контексте, и их получают, например, с использованием стандартных твердых или жидких носителей или разбавителей, а также фармацевтических добавок, тип которых зависит от способа введения (например, наполнители, связующие агенты, консерванты, стабилизаторы, ароматизаторы и т.п.), по известным методикам. , IL-1 и/или IL-8, как описано выше. Композиции содержат другие терапевтические агенты, как описано в данном контексте, и их получают, например, с использованием стандартных твердых или жидких носителей или разбавителей, а также фармацевтических добавок, тип которых зависит от способа введения (например, наполнители, связующие агенты, консерванты, стабилизаторы, ароматизаторы и т.п.), по известным методикам.
Соединения по настоящему изобретению вводят любыми способами, пригодными для данного состояния, предназначенного для лечения, которые зависят от специфического взаимодействия с участком связывания или от количества вводимого лекарственного средства. Местное введение обычно используют при лечении кожных заболеваний, а системное лечение используют обычно при лечении раковых или предраковых состояний, при этом используют также другие способы доставки лекарственных средств. Например, соединения вводят пероральным способом, в форме таблеток, капсул, гранул, порошков или жидких композиций, включающих сиропы, местным способом в форме растворов, суспензий, гелей или мазей, подъязычным способом; трансбуккальным способом, парентеральным способом в форме подкожных, внутривенных, внутримышечных, внутригрудинных инъекций или вливаний (например, с использованием стерильных водных или неводных растворов или суспензий для инъекций), назальным способом в виде спреев для ингаляций, местным способом в форме кремов или мазей, ректальным способом в форме суппозиториев или в виде липосом. Композиции вводят в виде стандартных лекарственных форм, содержащих нетоксичные фармацевтически приемлемые носители или разбавители. Соединения вводят в формах, пригодных для немедленного или пролонгированного высвобождения. Немедленное или пролонгированное высвобождение достигается с использованием пригодных фармацевтических композиций или прежде всего в случае пролонгированного высвобождения с использованием средств, таких как подкожные имплантаты или осмотические насосы. Примеры композиций для местного введения включают местный носитель, такой как PLASTIBASE® (гель минерального масла в полиэтилене).
Примеры композиций для перорального введения включают суспензии, которые содержат, например, микрокристаллическую целлюлозу в качестве наполнителя, альгиновую кислоту или альгинат натрия в качестве суспендирующего агента, метилцеллюлозу в качестве загустителя, и подсластители или ароматизаторы, известные специалистам в данной области техники; таблетки для немедленного высвобождения, которые содержат, например, микрокристаллическую целлюлозу, дикальций фосфат, крахмал, стеарат магния и/или лактозу и/или другие наполнители, связующие агенты, наполнители, дезинтегрирующие агенты, разбавители и замасливатели, известные специалистам в данной области техники. Соединения по настоящему изобретению вводят также пероральным, подъязычным и/или трансбуккальным способом, например, с использованием таблеток, полученных формованием, прессованием или лиофилизацией. Типичные композиции включают быстрорастворимые разбавители, такие как маннит, лактоза, сахароза и/или циклодекстрины. Указанные композиции включают также высокомолекулярные наполнители, такие как целлюлозы (AVICEL®) или полиэтиленгликоли (ПЭГ); наполнители для повышения адгезии слизистыми оболочками, такие как гидроксипропилцеллюлоза (ГПЦ), гидроксипропилметилцеллюлоза (ГПМЦ), натриевая соль карбоксиметилцеллюлозы (НКМЦ) и/или сополимер малеинового ангидрида (например, GANTREZ®), и агенты, контролирующие высвобожнение лекарственного средства, такие как сополимер полиакриловой кислоты (например, CARBOPOL 934®). Для упрощения получения и применения композиций в них добавляют также замасливатели, глиданты, ароматизаторы, красители и стабилизаторы.
Типичные композиции для назального введения в форме аэрозоля или ингаляцией включают растворы, которые содержат, например, бензиловый спирт или другие пригодные консерванты, ускорители абсорбции для ускорения впитывания и/или для увеличения биодоступности и/или другие солюбилизаторы или диспергирующие агенты, известные специалистам в данной области техники.
Типичные композиции для парентерального введения включают растворы или суспензии для инъекции, которые включают, например, нетоксичные пригодные парентерально приемлемые растворители или разбавители, такие как маннит, 1,3-бутандиол, вода, раствор Рингера, изотонический раствор хлорида натрия или другие пригодные диспергирующие или смачивающие и суспендирующие агенты, включающие синтетические моно- или диглицериды и жирные кислоты, включая олеиновую кислоту.
Типичные композиции для ректального введения включают суппозитории, которые содержат, например, пригодные не вызывающие раздражения наполнители, такие как масло какао, синтетические эфиры глицеридов или полиэтиленгликолей, которые являются твердыми при обычных температурах и расплавляются и/или растворяются в прямой кишке с высвобождением лекарственного средства.
Эффективное количество соединения по настоящему изобретению определяется специалистами в данной области техники, а типичная доза для млекопитающих составляет от приблизительно 0,05 до 100 мг/кг массы тела активного компонента в сутки, которую вводят однократно или в виде нескольких раздельных доз, например, от 1 до 4 раз в сутки. Следует понимать, что количество отдельной дозы и частота применения для каждого субъекта изменяется и зависит от множества факторов, включая активность используемого соединения, метаболическую устойчивость и срок действия соединения, возраст, массу тела, общее состояние здоровья, пол и режим питания субъекта, режим и время введения, скорость выведения, сочетание с другими лекарственными средствами и тяжесть конкретного заболевания. Субъекты, нуждающиеся в лечении, включают животных, прежде всего млекопитающих, таких как люди и домашние животные, такие как собаки, кошки, лошади и т.п. Таким образом, термин  пациент пациент , используемый в данном контексте, включает всех субъектов, прежде всего млекопитающих, включая человека, которые страдают от заболевания, связанного с различным уровнем фермента р38. , используемый в данном контексте, включает всех субъектов, прежде всего млекопитающих, включая человека, которые страдают от заболевания, связанного с различным уровнем фермента р38.
В одном варианте настоящего изобретения предлагается также способ получения лекарственных средств, который включает смешивание соединения по настоящему изобретению с фармацевтически приемлемым эксципиентом и переработку смеси в готовую галеновую форму.
Д. Способы применения соединений и композиций
В другом варианте соединения по настоящему изобретению используют для лечения, профилактики или ослабления одного или более симптомов воспалительных заболеваний. В одном варианте соединения по настоящему изобретению используют для получения лекарственного средства для лечения или профилактики воспалительных заболеваний.
Соединения по настоящему изобретению являются селективными ингибиторами активности киназы р38 и прежде всего изоформ р38 и р38 и р38 . В связи с этим соединения по настоящему изобретению используют для лечения состояний, связанных с активностью киназы р38. Такие состояния включают заболевания, при которых уровень цитокинов модулируется в ответ на внутриклеточный сигнал с участием р38, и прежде всего заболевания, которые связаны с избыточным продуцированном цитокинов IL-1, IL-4, IL-8 и TNF- . В связи с этим соединения по настоящему изобретению используют для лечения состояний, связанных с активностью киназы р38. Такие состояния включают заболевания, при которых уровень цитокинов модулируется в ответ на внутриклеточный сигнал с участием р38, и прежде всего заболевания, которые связаны с избыточным продуцированном цитокинов IL-1, IL-4, IL-8 и TNF- . В настоящем изобретении предлагаются способы лечения заболеваний при введении соединения по настоящему изобретению, которое ингибирует активность киназы р38. В настоящем изобретении предлагаются также способы подавления или приостановку развития заболевания или нарушения при введении соединения по настоящему изобретению. Способы по настоящему изобретению можно использовать для полного исключения или частичного снижения интенсивности симптомов заболевания или состояния и/или для ослабления, снижения интенсивности или исключения заболевания или нарушения и/или их симптомов. Термин . В настоящем изобретении предлагаются способы лечения заболеваний при введении соединения по настоящему изобретению, которое ингибирует активность киназы р38. В настоящем изобретении предлагаются также способы подавления или приостановку развития заболевания или нарушения при введении соединения по настоящему изобретению. Способы по настоящему изобретению можно использовать для полного исключения или частичного снижения интенсивности симптомов заболевания или состояния и/или для ослабления, снижения интенсивности или исключения заболевания или нарушения и/или их симптомов. Термин  ингибирование киназы р-38 ингибирование киназы р-38 / /  означает ингибирование киназы р38 означает ингибирование киназы р38 и р38 и р38 . Таким образом, величина IC50 для ингибирования киназы р-38 . Таким образом, величина IC50 для ингибирования киназы р-38 / / означает, что соединение характеризуется эффективностью ингибирования по крайней мере одной или обеих киназ р38 означает, что соединение характеризуется эффективностью ингибирования по крайней мере одной или обеих киназ р38 и р38 и р38 . .
Так как соединения по настоящему изобретению проявляют активность в качестве ингибиторов киназы р-38 / / , то их используют для лечения состояний, опосредованных р38, включая, без ограничения перечисленным, воспалительные заболевания, аутоиммунные заболевания, увеличение хрупкости костной ткани, пролиферативные заболевания, ангиогенные нарушения, инфекционные заболевания, нейродегенеративные заболевания и вирусные инфекции. , то их используют для лечения состояний, опосредованных р38, включая, без ограничения перечисленным, воспалительные заболевания, аутоиммунные заболевания, увеличение хрупкости костной ткани, пролиферативные заболевания, ангиогенные нарушения, инфекционные заболевания, нейродегенеративные заболевания и вирусные инфекции.
Более предпочтительно специфические состояния или заболевания, предназначенные для лечения соединениями по настоящему изобретению, включают, без ограничения перечисленным, панкреатит (острый или хронический), астму, аллергии, респираторный дистресс-синдром у взрослых, хроническое обструктивное заболевание легких, гломерулонефрит, ревматоидный артрит, красную волчанку, склеродерму, хронический тиреоидит, заболевание Грейвса, аутоиммунный гастрит, диабет, аутоиммунную гемолитическую анемию, аутоиммунную нейтропению, тромбоцитопению, атопический дерматит, хронический активный гепатит, бульбоспинальный паралич, рассеянный склероз, воспалительное заболевание кишечника, язвенный колит, заболевание Крона, псориаз, реакция  трансплантат против хозяина трансплантат против хозяина , воспалительная реакция, вызванная эндотоксином, туберкулез, атеросклероз, дистрофия мышечных тканей, общее истощение, псориатический артрит, синдром Рейтера, подагру, травматический артрит, краснуху, острый синовит, панкреатит, опосредованный базофильными островками Лангерханса, заболевания, характеризующиеся множественной инфильтрацией нейтрофилов, ревматоидный спондилит, подагрический артрит и другие артритоподобные состояния, церебральную малярию, хроническое воспалительное заболевание легких, силикоз, саркоидоз легких, резорбцию костной ткани, отторжение аллотрансплантата, лихорадку и мышечные боли, вызванные инфекционным заболеванием, истощение, вызванное инфекционным заболеванием, образование келоида, образование рубцов, язвенный колит, парез, вирус гриппа, остеопороз, остеоартрит и заболевание костной ткани, связанное с образованием множественных миелом, острый миелогенный лейкоз, хронический миелогенный лейкоз, метостатическую меланому, саркому Капоши, множественную миелому, сепсис, септический шок и бактериальную дизентерию, болезнь Альцгеймера, болезнь Паркинсона, церебральную ишемию или нейродегенеративное заболевание, вызванное травматическим повреждением, ангиогенные заболевания, включающие солидные опухоли, реваскуляризация в глазной ткани и инфантильные гемангиомы, вирусные заболевания, включающие острый гепатит (включая гепатит А, гепатит В и гепатит С), вирус иммунодефицита человека (ВИЧ), ретинит, вызванный цитомегаловирусом, синдром приобретенного иммунодефицита (СПИД), тяжелый острый респираторный синдром (SARS), СПИД-ассоциированный комплекс или злокачественное развитие болезни и герпес, инсульт, ишемию миокарда, ишемию при инфаркте, гипоксию органов, сосудистую гиперплазию, сердечную или почечную реперфузию, тромбоз, сердечную гипертрофию, агрегацию тромбоцитов, вызванную тромбином, эндотоксимию и/или токсический шоковый синдром и состояния, связанные с действием простагландин-эндопероксидсинтазы-2. , воспалительная реакция, вызванная эндотоксином, туберкулез, атеросклероз, дистрофия мышечных тканей, общее истощение, псориатический артрит, синдром Рейтера, подагру, травматический артрит, краснуху, острый синовит, панкреатит, опосредованный базофильными островками Лангерханса, заболевания, характеризующиеся множественной инфильтрацией нейтрофилов, ревматоидный спондилит, подагрический артрит и другие артритоподобные состояния, церебральную малярию, хроническое воспалительное заболевание легких, силикоз, саркоидоз легких, резорбцию костной ткани, отторжение аллотрансплантата, лихорадку и мышечные боли, вызванные инфекционным заболеванием, истощение, вызванное инфекционным заболеванием, образование келоида, образование рубцов, язвенный колит, парез, вирус гриппа, остеопороз, остеоартрит и заболевание костной ткани, связанное с образованием множественных миелом, острый миелогенный лейкоз, хронический миелогенный лейкоз, метостатическую меланому, саркому Капоши, множественную миелому, сепсис, септический шок и бактериальную дизентерию, болезнь Альцгеймера, болезнь Паркинсона, церебральную ишемию или нейродегенеративное заболевание, вызванное травматическим повреждением, ангиогенные заболевания, включающие солидные опухоли, реваскуляризация в глазной ткани и инфантильные гемангиомы, вирусные заболевания, включающие острый гепатит (включая гепатит А, гепатит В и гепатит С), вирус иммунодефицита человека (ВИЧ), ретинит, вызванный цитомегаловирусом, синдром приобретенного иммунодефицита (СПИД), тяжелый острый респираторный синдром (SARS), СПИД-ассоциированный комплекс или злокачественное развитие болезни и герпес, инсульт, ишемию миокарда, ишемию при инфаркте, гипоксию органов, сосудистую гиперплазию, сердечную или почечную реперфузию, тромбоз, сердечную гипертрофию, агрегацию тромбоцитов, вызванную тромбином, эндотоксимию и/или токсический шоковый синдром и состояния, связанные с действием простагландин-эндопероксидсинтазы-2.
Ингибиторы р38 по настоящему изобретению подавляют экспрессию индуцируемых провоспалительных белков, таких как простагландин-эндопероксидсинтаза-2 (PGHS-2), которая называется также циклооксигеназой-2 (СОХ-2). В связи с этим состояния, опосредованные р38, включают отеки, отсутствие болевой чувствительности, лихорадки и боли, такие как нервно-мышечная боль, головная боль, боль, сопровождающая онкологические заболевания, зубная боль и боль при артрите. Соединения по настоящему изобретению используют также для лечения вирусных заболеваний животных, таких как лентивирусные инфекции, включающие, без ограничения перечисленным, вирус инфекционной анемии у лошадей или ретровирусные инфекции, включающие вирус иммунодефицита семейства кошачьих, вирус иммунодефицита семейства бычьих и вирус иммунодефицита семейства псовых. Термины  состояния, связанные с р38 состояния, связанные с р38 или или  заболевания или нарушения, связанные с р38 заболевания или нарушения, связанные с р38 , использованные в данном контексте, объединяют все состояния, описанные выше, а также все другие состояния, связанные с активностью киназы р38. , использованные в данном контексте, объединяют все состояния, описанные выше, а также все другие состояния, связанные с активностью киназы р38.
Таким образом, в настоящем изобретении предлагаются способы лечения указанных состояний, включающие введение субъекту, нуждающемуся в таком лечении, эффективного количества по крайней мере одного соединения по настоящему изобретению или его фармацевтически приемлемого производного. Способы лечения состояний, связанных с активностью киназы р38, включают введение соединений по настоящему изобретению в отдельности или в комбинации с другими пригодными терапевтическими агентами, предназначенными для лечения таких состояний. Примеры таких других терапевтических агентов включают кортикостероиды, ролипрам, кальфостин, CSAID, 4-замещенные имидазо[1,2-А]хиноксалины, описанные в патенте US  4200750 и в работе S.Ceccarelli и др. European Journal of Medicinal Chemistry, 33, 943-955 (1998), интерлейкин-10, глюкокортикоиды, салицилаты, оксид азота и другие иммунодепрессанты, ингибиторы транслокации ядер клеток, такие как дезоксиспергуалин (DSG), нестероидные противовоспалительные лекарственные средства (NSAID), такие как ибупрофен, целекоксиб и рофекоксиб, стероиды, такие как преднизон и дексаметазон, противовирусные агенты, такие как абакавир, антипрофилеративные агенты, такие как метотрексат, лефлюномид, FK506 (такролимус, програф), цитотоксические лекарственные средства, такие как азатиоприн и циклофосфамид, ингибиторы TNF- 4200750 и в работе S.Ceccarelli и др. European Journal of Medicinal Chemistry, 33, 943-955 (1998), интерлейкин-10, глюкокортикоиды, салицилаты, оксид азота и другие иммунодепрессанты, ингибиторы транслокации ядер клеток, такие как дезоксиспергуалин (DSG), нестероидные противовоспалительные лекарственные средства (NSAID), такие как ибупрофен, целекоксиб и рофекоксиб, стероиды, такие как преднизон и дексаметазон, противовирусные агенты, такие как абакавир, антипрофилеративные агенты, такие как метотрексат, лефлюномид, FK506 (такролимус, програф), цитотоксические лекарственные средства, такие как азатиоприн и циклофосфамид, ингибиторы TNF- , такие как тенидап, антитела против TNF или растворимый рецептор TNF и рапамицин (сиролимус или рапамун) или их производные. , такие как тенидап, антитела против TNF или растворимый рецептор TNF и рапамицин (сиролимус или рапамун) или их производные.
Описанные выше другие терапевтические агенты при использовании в комбинации с соединениями по настоящему изобретению вводят, например, в количествах, указанных в справочнике Physicians’ Desk Reference (PDR) или определяемых специалистами в данной области техники. Согласно способам, описанным в настоящем изобретении, такие другие терапевтические агенты вводят до введения соединений по настоящему изобретению, одновременно с ними или после их введения.
Следующие примеры предназначены только для иллюстрации вариантов осуществления настоящего изобретения и не ограничивают его объем, как определено в формуле изобретения. Сокращения, использованные в примерах, описаны ниже. Соединения, описанные в примерах, обозначены номером примера и стадии, в которых они были получены (например,  1А 1А означает, что указанное в заголовке соединение получено в примере 1, стадия А), или только по номеру примера, в котором соединение указано в заголовке (например, означает, что указанное в заголовке соединение получено в примере 1, стадия А), или только по номеру примера, в котором соединение указано в заголовке (например,  2 2 означает соединение, указанное в заголовке примера 2). означает соединение, указанное в заголовке примера 2).
Сокращения
Ph = фенил
Bz = бензил
t-Bu = трет-бутил
Me = метил
Et = этил
Pr = пропил
Iso-P или i-Pr = изопропил
МеОН = метанол
EtOH = этанол
EtOAc = этилацетат
Boc = трет-бутилоксикарбонил
CBZ = карбобензилокси, или карбобензокси, или бензилоксикарбонил
ДХМ или CH2Cl2 = дихлорметан
ДХЭ = 1,2-дихлорэтан
ДМФА = диметилформамид
ДМСО = диметилсульфоксид
ТФУ = трифторуксусная кислота
ТГФ = тетрагидрофуран
HATU = O-(7-Азабензотриазол-1-ил-N,N,N’,N’-тетраметилмочевины гексафторфосфат
КОН = гидроксид калия
К2СО3 = карбонат калия
POCl3 = оксихлорид фосфора
KQtBu = трет-бутоксид калия
EDC или EDCl = гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида
DIPEA = диизопропилэтиламин
HOBt = гидрат 1-гидроксибензотриазола
m-СРВА = мета-хлорпербензойная кислота
NaH = гидрид натрия
NaOH = гидроксид натрия
Na2S2O3 = тиосульфат натрия
Na2SO4 = сульфат натрия
Pd = палладий
Pd/C = палладий на угле
мин = минута(ты)
л = литр
мл = милилитр
мкл = микролитр
г = грамм(ы)
мг = миллиграмм(ы)
мол = моль
ммол = миллимоль(и)
мэкв. = миллиэквивалент
КТ = комнатная температура
в.у. = время удерживания на колонке ЖХВР (мин)
Общие методы. Масс-спектры получали с использованием масс-спектрометра Thermo Finnigan LCQ Duo Ion Trap. В примерах:  ЖХВР (градиент в течение 6 мин) ЖХВР (градиент в течение 6 мин) означает колонку Keystone С 18 Beta Basic, скорость элюции 0,4 мл/мин, элюент: линейный градиент в течение 6 мин (исходный растворитель %В=0, конечный растворитель %В=100), растворитель А: ацетонитрил + 0,025% ТФУ; растворитель В=Н2О + 0,025% ТФУ. означает колонку Keystone С 18 Beta Basic, скорость элюции 0,4 мл/мин, элюент: линейный градиент в течение 6 мин (исходный растворитель %В=0, конечный растворитель %В=100), растворитель А: ацетонитрил + 0,025% ТФУ; растворитель В=Н2О + 0,025% ТФУ.  ЖХВР (градиент в течение 4 мин) ЖХВР (градиент в течение 4 мин) означает колонку Keystone С 18 Beta Basic, скорость элюции 0,5 мл/мин, элюент: линейный градиент в течение 4 мин (исходный растворитель %В = 0, конечный растворитель %В=100), растворитель А: ацетонитрил+0,025% ТФУ; растворитель В=H2O + 0,025% ТФУ. означает колонку Keystone С 18 Beta Basic, скорость элюции 0,5 мл/мин, элюент: линейный градиент в течение 4 мин (исходный растворитель %В = 0, конечный растворитель %В=100), растворитель А: ацетонитрил+0,025% ТФУ; растворитель В=H2O + 0,025% ТФУ.
Пример 1
Получение 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-метокси-4-метилбензамида
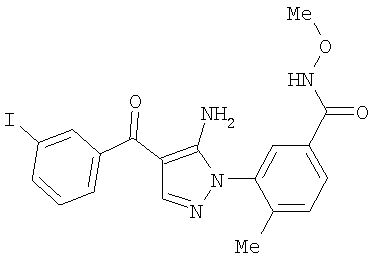
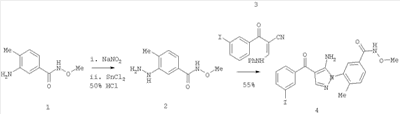
А. 3-Гидразино-N-метокси-4-метилбензамид
В раствор 3-амино-N-метокси-4-метилбензамида 1 (102 мг, 0,56 ммоля, получение описано в заявке WO 02/40486 А2, с.66) в воде (5 мл) при перемешивании при 0°С добавляли конц. HCl (5 мл) и нитрит натрия (43 мг, 0,62 ммоля). Реакционную смесь перемешивали при 0°С в течение 40 мин, затем добавляли раствор хлорида олова (II) (241 мг, 1,27 ммоля) в конц. HCl (1 мл) и смесь перемешивали в течение 1 ч, затем выдерживали при -20°С в течение 20 ч и нагревали до КТ с последующим концентрированном до твердого вещества белого цвета. Твердое вещество растирали в этаноле, фильтровали и фильтрат концентрировали, при этом получали 3-гидразино-N-метокси-4-метилбензамид 2 (486 мг) в виде твердого вещества белого цвета в виде смеси с солями олова и этанолом, полученный продукт использовали без дальнейшей очистки. ЖХВР (градиент в течение 6 мин): в.у. 0,78 мин. МС: m/z 195,9 [М+Н]+.
Б. 3-[5-Амино-4-(3-иодбензоил)пиразол-1-ил]-N-метокси-4-метилбензамид
В перемешиваемый раствор 3-гидразино-N-метокси-4-метилбензамида 2 (116 мг, рассчитанные 0,14 ммоля) в EtOH (10 мл) добавляли 2-(3-иодбензоил)-3-фениламиноакрилонитрил 3 (59 мг, 0,14 ммоля, получение: описано в заявке No. WO 02/57101 А1, с.84) и полученную смесь нагревали на бане (при температуре 65-70°С) в течение 4 ч, затем добавляли еще одну порцию 3-гидразино-N-метокси-4-метилбензамида 2 (80 мг, 0,11 ммоля) и смесь нагревали при указанной температуре в течение 27 ч. Смесь охлаждали до комнатной температуры, концентрировали и повторно растворяли в EtOAc, затем промывали водой и солевым раствором, сушили над Na2SO4 и концентрировали, при этом получали неочищенное полутвердое вещество. Затем смесь очищали экспресс-хроматографией (элюент: EtOAc/гексан, 1:1), при этом удаляли примеси, и затем при элюции 100% EtOAc получали 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-метокси-4-метилбензамид 4 (38 мг, 0,08 ммоля, 55%) в виде твердого вещества грязно-белого цвета. ЖХВР (градиент в течение 6 мин): в.у. 3,49 мин. МС: m/z 476,96 [М+Н]+.
1Н-ЯМР (300 МГц, CD3OD):  8,10 (s, 1H), 7,95 (d, J 8,0, 1H), 7,88 (d, J 8,0. 1H), 7,82 (m, 2H), 7,78 (s, 1H), 7,58 (d, J 8,0, 1H), 7,33 (t, J 7,8, 1H), 5,02 (s, 3H), 2,33 (s, 3H). 8,10 (s, 1H), 7,95 (d, J 8,0, 1H), 7,88 (d, J 8,0. 1H), 7,82 (m, 2H), 7,78 (s, 1H), 7,58 (d, J 8,0, 1H), 7,33 (t, J 7,8, 1H), 5,02 (s, 3H), 2,33 (s, 3H).
13С-ЯМР (125 МГц, ДМСО-d6):  189,3, 154,3, 143,5, 143,3, 142,0, 138,3, 137,4, 133,5, 132,9, 132,0, 130,4, 128,8, 128,4, 104,8, 95,4, 64,8, 18,2. 189,3, 154,3, 143,5, 143,3, 142,0, 138,3, 137,4, 133,5, 132,9, 132,0, 130,4, 128,8, 128,4, 104,8, 95,4, 64,8, 18,2.
Пример 2
Получение 3-(5-амино-4-бензоилпиразол-1-ил)-N-метокси-4-метилбензамида
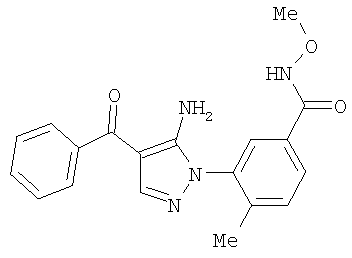
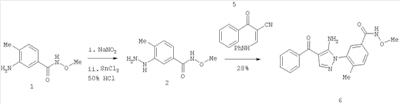
В перемешиваемый раствор 3-амино-N-метокси-4-метилбензамида 1 (104 мг, 0,58 ммоля) в воде (2 мл) при 0°С добавляли конц. HCl (2 мл), затем добавляли нитрит натрия (44 мг, 0,63 ммоля). Реакционную смесь перемешивали при 0°С в течение 40 мин, затем добавляли раствор хлорида олова (II) (245 мг, 1,30 ммоля) в конц. HCl (1 мл) и полученную смесь перемешивали в течение 40 мин, затем выдерживали при -20°С в течение 20 ч и затем смесь нагревали до комнатной температуры и концентрировали, при этом получали твердое вещество белого цвета. Твердое вещество растирали в этаноле, твердое вещество удаляли и добавляли 2-бензоил-3-фениламиноакрилонитрил 5 (144 мг, 0,58 ммоля, получение описано в статье Grothaus, J. Am. Chem. Soc., 58, 1334 (1936)) и смесь нагревали на бане (при температуре 65-70°С) в течение 16 ч. Смесь охлаждали до комнатной температуры, концентрировали и очищали экспресс-хроматографией (элюент: EtOAc/гексан, 1:1), при этом удаляли примеси, и затем при элюции 100% EtOAc получали 3-(5-амино-4-бензоилпиразол-1-ил)-N-метокси-4-метилбензамид 6 в виде твердого вещества грязно-белого цвета (41 мг, 0,12 ммоля, 28%). ЖХВР (градиент в течение 4 мин): в.у. 1,93 мин. МС: m/z 351,1 [М+Н]+.
1H-ЯМР (300 МГц, ДМСО-d6):  11,88 (s, 1Н, NH), 7,803 (m, 4H), 7,56 (m, 4H), 7,01 (s, 2H, NH2), 3,32 (s, 3H), 2,162 (s, 3H). 11,88 (s, 1Н, NH), 7,803 (m, 4H), 7,56 (m, 4H), 7,01 (s, 2H, NH2), 3,32 (s, 3H), 2,162 (s, 3H).
13С-ЯМР (125 МГц, ДМСО-d6):  187,6, 151,9, 141,2, 139,7, 139,6, 135,7, 131,4, 131,2, 130,9, 128,5, 128,1, 127,8, 126,4, 102,6, 63,2, 17,2. 187,6, 151,9, 141,2, 139,7, 139,6, 135,7, 131,4, 131,2, 130,9, 128,5, 128,1, 127,8, 126,4, 102,6, 63,2, 17,2.
Пример 3
Получение 3-(5-амино-4-бензоилпиразол-1-ил)-4-метилбензойной кислоты
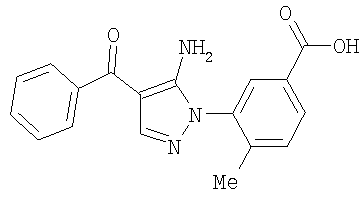
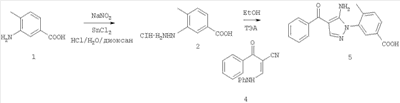
А. Гидрохлорид 3-гидразино-4-метилбензойной кислоты
В перемешиваемый раствор 3-амино-4-метилбензойной кислоты 1 (5,64 г, 31,2 ммоля, 1,0 экв.) в 100 мл диоксана и 100 мл воды при 0°С добавляли 100 мл конц. HCl, затем добавляли порциями нитрит натрия (2,82 г, 40,9 ммоля, 1,1 экв.) в виде твердого вещества в течение 45 мин с пригодной скоростью, чтобы обеспечить удовлетворительную скорость выделения газа и уровень вспенивания, при этом получали прозрачный раствор коричневого цвета. Безводный хлорид олова (II) (15,62 г, 83,7 ммоля, 2,25 экв.) растворяли в конц. HCl (25 мл) и добавляли в раствор по каплям приблизительно 25 мл при 0°C. Через 1 ч осадок отфильтровывали и промывали диоксаном, затем сушили в вакууме, при этом получали гидрохлорид 3-гидразино-4-метилбензойной кислоты 2 в виде твердого вещества желто-коричневого цвета (4,98 г, 66%). ЖХВР (градиент в течение 4 мин): в.у. 0,97 мин. МС: m/z 167 [М+Н]+.
1H-ЯМР  (300 МГц, ДМСО-d6) 10,03 (s, 1Н, COOH), 7,89 (s, 1H), 7,51 (s, 1H), 7,27 (d, J 8,0, 1H), 3,38 (s, 3H, NHNH2), 2,23 (s, 3H). (300 МГц, ДМСО-d6) 10,03 (s, 1Н, COOH), 7,89 (s, 1H), 7,51 (s, 1H), 7,27 (d, J 8,0, 1H), 3,38 (s, 3H, NHNH2), 2,23 (s, 3H).
Б. 3-(5-Амино-4-бензоилпиразол-1-ил)-4-метилбензойная кислота
В перемешиваемый раствор гидрохлорида 3-гидразино-4-метилбензойной кислоты 2 (242 мг, 1,19 ммоля, 1,0 экв.) в 25 мл этанола добавляли 2-бензоил-3-фениламиноакрилонитрил 4 (296 мг, 1,19 ммоля, 1,0 экв., получение описано в статье Grothasu, Davis, J. Am. Chem. Soc., 58, 1334 (1936)) и триэтиламин (161 мкл, 1,19 ммоля, 1,0 экв.) и смесь нагревали до 65°С. Все твердые вещества растворяли при достижении температуры 65°С. Через 3 ч по данным ЖХ-МС определяли полное потребление гидразина. Твердое вещество отфильтровывали, при этом получали 3-(5-амино-4-бензоилпиразол-1-ил)-4-метилбензойную кислоту 5 (95 мг, 25%) в виде твердого вещества бежевого цвета. ЖХВР (градиент в течение 4 мин): в.у. 2,10 мин. МС: m/z 322 [М+Н]+.
1H-ЯМР (300 МГц, ДМСО-d6):  7,99 (d, J 7,6, 1H), 7,81 (s, 2H), 7,78 (s, 1H), 7,57 (m, 4H), 7,02 (s, 2H, NH2), 2,18 (s, 3H). 7,99 (d, J 7,6, 1H), 7,81 (s, 2H), 7,78 (s, 1H), 7,57 (m, 4H), 7,02 (s, 2H, NH2), 2,18 (s, 3H).
12С-ЯМР (75 МГц, ДМСО-d6):  187,6, 166,3, 152,0, 141,3, 141,2, 139,6, 135,9, 131,6, 131,2, 130,1, 129,8, 128,6, 127,8, 102,6, 17,4. 187,6, 166,3, 152,0, 141,3, 141,2, 139,6, 135,9, 131,6, 131,2, 130,1, 129,8, 128,6, 127,8, 102,6, 17,4.
Пример 4
Получение 3-(5-амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамида
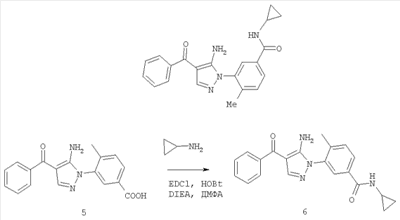
В перемешиваемый раствор 3-(5-амино-4-бензоилпиразол-1-ил)-4-метилбензойной кислоты 5 (пример 3, 700 мг, 2,18 ммоля, 1,0 экв.) в 30 мл ДМФА добавляли EDCI (855 мг, 4,35 ммоля, 2,0 экв.), HOBt (589 мг, 4,35 ммоля, 2,0 экв.) и диизопропилэтиламин (1,59 мл, 8,71 ммоля, 4,0 экв.) и раствор перемешивали в течение 15 мин при комнатной температуре, затем добавляли циклопропиламин (302 мкл, 4,35 ммоля, 2,0 экв.) и реакционную смесь перемешивали в течение 1 ч. Смесь разбавляли EtOAc (300 мл), промывали водой (2×25 мл) и солевым раствором (25 мл), сушили (Na2SO4) и концентрировали. Продукт очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/МеОН, 8:2), при этом получали продукт в виде масла коричневого цвета. Затем продукт очищали растиранием в смеси (EtOAc/гексан/CH2Cl2, 1:1:1) и сушили в вакууме, при этом получали 3-(5-амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамид 6 (387 мг, 50%) в виде порошка белого цвета. ЖХВР (градиент в течение 4 мин): в.у. 2,11 мин. МС: m/z 361 [М+Н]+.
1H-ЯМР (300 МГц, CD3OD):  7,92 (d, J 7,6, 1H), 7,81 (m, 4H), 7,54 (m, 4H), 2,85 (m, 1H), 2,22 (s, 3H), 0,80 (d, J 5,7, 2H), 0,63 (s, 2H). 7,92 (d, J 7,6, 1H), 7,81 (m, 4H), 7,54 (m, 4H), 2,85 (m, 1H), 2,22 (s, 3H), 0,80 (d, J 5,7, 2H), 0,63 (s, 2H).
13С-ЯМР (75 МГц, CD3OD):  191,2, 170,1, 153,8, 143,3, 142,0, 141,1, 136,9, 134,8, 132,9, 132,7, 130,1, 129,7, 129,2, 128,1, 104,8, 24,1, 17,7, 6,6. 191,2, 170,1, 153,8, 143,3, 142,0, 141,1, 136,9, 134,8, 132,9, 132,7, 130,1, 129,7, 129,2, 128,1, 104,8, 24,1, 17,7, 6,6.
Пример 5
Получение 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-4-метилбензойной кислоты
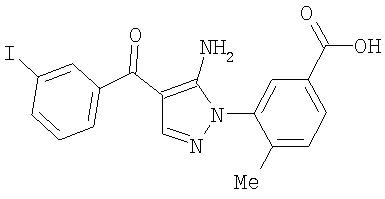
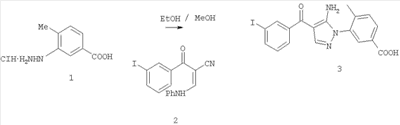 В перемешиваемый раствор гидрохлорида 3-гидразино-4-метилбензойной кислоты 1 (пример 3А, 314 мг, 1,54 ммоля, 1,0 экв.) в 50 мл этанола и 5 мл метанола добавляли 2-(3-иодбензоил)-3-фениламиноакрилонитрил 2 (579 мг, 1,54 ммоля, получение: описано в заявке No. WO 02/57101 А1, с.84). Смесь нагревали при 75°С в течение 18 ч. Полученный осадок собирали на стеклянном пористом фильтре и промывали этанолом, при этом получали 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-4-метилбензойную кислоту 3 (153 мг, 22%) в виде твердого вещества белого цвета. МС: m/z 448 [М+Н]+. В перемешиваемый раствор гидрохлорида 3-гидразино-4-метилбензойной кислоты 1 (пример 3А, 314 мг, 1,54 ммоля, 1,0 экв.) в 50 мл этанола и 5 мл метанола добавляли 2-(3-иодбензоил)-3-фениламиноакрилонитрил 2 (579 мг, 1,54 ммоля, получение: описано в заявке No. WO 02/57101 А1, с.84). Смесь нагревали при 75°С в течение 18 ч. Полученный осадок собирали на стеклянном пористом фильтре и промывали этанолом, при этом получали 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-4-метилбензойную кислоту 3 (153 мг, 22%) в виде твердого вещества белого цвета. МС: m/z 448 [М+Н]+.
1H-ЯМР (300 МГц, ДМСО-d6):  2,18 (s, 3H), 7,05 (ушир.s, 2H), 7,34 (dd, J1=J2 7,7 Гц), 7,58 (d, J 8,1 Гц, 1H), 7,78 (s, 1H), 7,81 (m, 2H), 7,94 (m, 1H), 7,98 (m, 1H), 8,03 (m, 1H). 2,18 (s, 3H), 7,05 (ушир.s, 2H), 7,34 (dd, J1=J2 7,7 Гц), 7,58 (d, J 8,1 Гц, 1H), 7,78 (s, 1H), 7,81 (m, 2H), 7,94 (m, 1H), 7,98 (m, 1H), 8,03 (m, 1H).
Пример 6
Получение 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
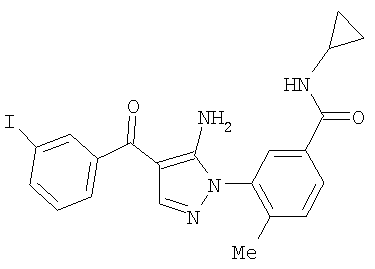
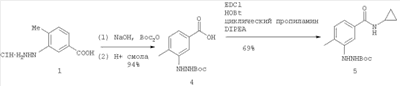 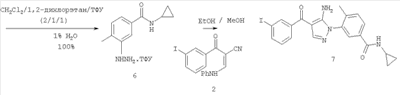
А. 3-(N’-трет-Бутоксикарбонилгидразино)-метилбензойная кислота
Гидрохлорид 3-гидразино-4-метилбензойной кислоты 1 (пример 3А, 13 г, 64,5 ммоля) растворяли в диоксане (200 мл) и Н2О (100 мл), добавляли водный NaOH (5,16 г NaOH в 100 мл Н2О, 2×64,5 ммоля), затем немедленно добавляли (Вос)2O (15,5 г, 1,1×64,5 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали на роторном испарителе. Затем добавляли Н2О и CH2Cl2 (содержащий МеОН) и добавляли при перемешивании сильную ионообменную смолу в Н+ форме для нейтрализации смеси до рН<2, смолу отфильтровывали и промывали CH2Cl2 и МеОН. Водный слой промывали двумя порциями CH2Cl2 (с добавлением небольшого количества МеОН). Объединенные органические слои сушили над Na2SO4 (с добавлением небольшого количества EtOAc). После фильтрования и концентрирования получали 3-(N’-трет-бутоксикарбонилгидразино)-4-метилбензойную кислоту 4 (16 г, 94%) в виде твердого вещества белого цвета.
1H-ЯМР (300 МГц, CDCl3):  1,48 (s, 9H), 2,27 (s, 3H), 5,76 (s, 1H), 7,14 (d, J 7,7 Гц, 1H), 7,56 (d, J 7,7 Гц, 1H), 7,61 (s, 1H). 1,48 (s, 9H), 2,27 (s, 3H), 5,76 (s, 1H), 7,14 (d, J 7,7 Гц, 1H), 7,56 (d, J 7,7 Гц, 1H), 7,61 (s, 1H).
Б. трет-Бутиловый эфир N’-(5-циклопропилкарбамоил-2-метилфенил)гидразинкарбоновой кислоты
3-(N’-трет-Бутоксикарбонилгидразино)-4-метилбензойную кислоту 4 (14 г, 52,6 ммоля) растворяли в ДМФА (250 мл), добавляли EDCI (20 г, 105,2 ммоля) и HOBt (16 г, 105,2 ммоля). Смесь перемешивали при комнатной температуре в течение 30 мин, добавляли циклопропиламин (7,4 мл, 105,2 ммоля), затем добавляли DIPEA (37 мл, 4×52,6 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. После концентрирования реакционной смеси в вакууме добавляли Н2О. Затем смесь экстрагировали тремя порциями CH2Cl2. Органический слой промывали водным раствором NaCl. После сушки над Na2SO4, фильтрования и концентрирования получали твердое вещество белого цвета. Неочищенный продукт растворяли в CH2Cl2/MeOH и затем очищали колоночной хроматографией на колонке с силикагелем (элюент: CH2Cl2/EtOAc, градиент от 2:1 до 1:1), при этом получали требуемый продукт, который очищали перекристаллизацией из EtOAc/CH2Cl2, полученное твердое вещество промывали EtOAc и получали трет-бутиловый эфир N’-(5-циклопропилкарбамоил-2-метилфенил)гидразинкарбоновой кислоты 5 (11 г, 69%).
1H-ЯМР (300 МГц, CDCl3):  0,58 (m, 2H), 0,84 (m, 2H), 1,48 (s, 9H), 2,23 (s, 3H), 2,87 (m, 1H), 5,69 (ушир.s, 1H), 6,17 (ушир.s, 1H), 6,39 (ушир.s, 1Н), 7,70 (m, 2H), 7,32 (s, 1H). 0,58 (m, 2H), 0,84 (m, 2H), 1,48 (s, 9H), 2,23 (s, 3H), 2,87 (m, 1H), 5,69 (ушир.s, 1H), 6,17 (ушир.s, 1H), 6,39 (ушир.s, 1Н), 7,70 (m, 2H), 7,32 (s, 1H).
В. Трифторацетат N-циклопропил-3-гидразино-4-метилбензамида
трет-Бутиловый эфир N’-(5-циклопропилкарбамоил-2-метилфенил)гидразинкарбоновой кислоты 5 растворяли в смеси CH2Cl2/ТФУ (2:1), содержащей 2% Н2О, и смесь перемешивали при комнатной температуре в течение 3 ч. После концентрирования в вакууме получали сироп, в который добавляли CH2Cl2 и толуол, концентрировали в вакууме, при этом получали Трифторацетат N-циклопропил-3-гидразино-4-метилбензамида 6 (100%) в виде твердого вещества грязно-белого цвета. МС: m/z 206 [М+Н]+.
1Н-ЯМР (300 МГц, D2O):  0,68 (m, 2H), 0,88 (m, 2H), 2,31 (s, 3H), 2,79 (m, 1H), 7,31 (s, 1H), 7,36 (ушир.s, 2H). 0,68 (m, 2H), 0,88 (m, 2H), 2,31 (s, 3H), 2,79 (m, 1H), 7,31 (s, 1H), 7,36 (ушир.s, 2H).
Г. 3-[5-Амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
В перемешиваемый раствор трифторацетата N-циклопропил-3-гидразино-4-метилбензамида 6 (648 мг, 1,74 ммоля, 1,0 экв.) в 2 мл этанола добавляли 2-(3-иодбензоил)-3-фениламиноакрилонитрил 2 (550 мг, 1,74 ммоля, получение описано в заявке No. WO 02/57101 А1, с.84) и DIEA (0,50 мл, 2,9 ммоля). Смесь нагревали при 160°С в течение 40 мин в микроволновом реакторе, затем смесь концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией на колонке с силикагелем (элюент: EtOAc/гексан, градиент от 1:1 до 2:1), при этом получали 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид 7 (589 мг, 70%) в виде твердого вещества белого цвета. МС: m/z 497 [М+Н]+.
1H-ЯМР (300 МГц, CDCl3):  0,60 (m, 2H), 0,86 (m, 2H), 2,24 (s, 3H), 2,87 (m, 1H), 5,81 (ушир.8, 2H), 6,35 (ушир.s, 1H), 7,25 (dd, J1=J2 7,8 Гц, 1Н), 7,45 (d, J 8,1 Гц, 1H), 7,69 (d, J 1,7 Гц, 1H), 7,80 (m, 3H), 7,89 (m, 1H), 8,00 (s, 1H). 0,60 (m, 2H), 0,86 (m, 2H), 2,24 (s, 3H), 2,87 (m, 1H), 5,81 (ушир.8, 2H), 6,35 (ушир.s, 1H), 7,25 (dd, J1=J2 7,8 Гц, 1Н), 7,45 (d, J 8,1 Гц, 1H), 7,69 (d, J 1,7 Гц, 1H), 7,80 (m, 3H), 7,89 (m, 1H), 8,00 (s, 1H).
Пример 7
Получение {5-амино-1-[2-метил-5-(4Н-[1,2,4]триазол-3-ил)фенил]-1Н-пиразол-4-ил}фенилметанона
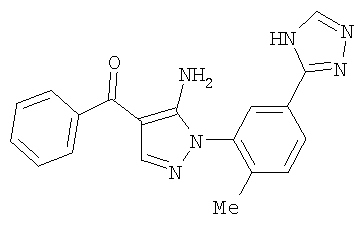 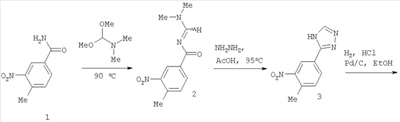
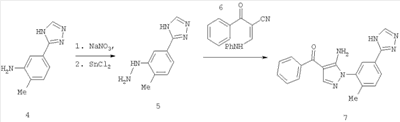 А. N-Диметиламинометилен-4-метил-3-нитробензамид А. N-Диметиламинометилен-4-метил-3-нитробензамид
4-Метил-3-нитробензамид 1 (10 г, 56 ммолей) суспендировали в 80 мл диметилацеталя N,N-диметилформамида и затем нагревали при 95°С в течение 2 ч. Полученный раствор красного цвета при перемешивании охлаждали до комнатной температуры. Через еще 2 ч полученный осадок красного цвета собирали на стеклянном пористом фильтре и промывали тремя порциями Et2O, при этом получали N-диметиламинометилен-4-метил-3-нитробензамид 2 (8,7 г, 66%) в виде твердого вещества красного цвета. ЖХВР (градиент в течение 4 мин): в.у. 1,76 мин. МС: m/z 236,0 [М+Н]+.
Б. 3-(4-Метил-3-нитрофенил)-4Н-[1.2.4]триазол
В раствор N-диметиламинометилен-4-метил-3-нитробензамида 2 (8,6 г, 37 ммолей) в 250 мл уксусной кислоты добавляли по каплям безводный гидразин (4,7 мл, 180 мл). Полученный раствор светло-оранжевого цвета нагревали при 95°С в течение 1,5 ч, затем охлаждали и перемешивали при комнатной температуре в течение 18 ч. Уксусную кислоту удаляли в вакууме и остаток распределяли между Н2О и EtOAc. Органический слой промывали двумя порциями насыщенного раствора NaHCO3, затем сушили над MgSO4. После фильтрования и концентрирования в вакууме остаток растирали в теплом EtOAc и полученное твердое вещество грязно-белого цвета собирали на стеклянном пористом фильтре, при этом получали 3-(4-метил-3-нитрофенил)-4Н-[1,2,4]триазол 3 (5,8 г, 77%). ЖХВР (градиент в течение 4 мин): в.у. 1,82 мин. МС: m/z 205,1 [М+Н]+.
1H-ЯМР (300 МГц, ДМСО-d6):  8,57 (ушир.8, 1Н), 8,46 (s, 1H), 8,12 (d, J 7,9, 1H), 7,56 (d, J 7,9, 1H), 2,5 (s, 3H). 8,57 (ушир.8, 1Н), 8,46 (s, 1H), 8,12 (d, J 7,9, 1H), 7,56 (d, J 7,9, 1H), 2,5 (s, 3H).
13С-ЯМР (125 МГц, ДМСО-d6):  149,1, 133,5, 130,1, 121,3, 19,5. 149,1, 133,5, 130,1, 121,3, 19,5.
В. 2-Метил-5-(4Н-[1.2.4]триазол-3-ил)фениламин
3-(4-Метил-3-нитрофенил)-4Н-[1,2,4]триазол 3 (5,75 г, 28,2 ммоля) суспендировали в 220 мл этанола и 2,35 мл (приблизительно 28,2 ммоля) концентрированной водной HCl. Затем осторожно добавляли в атмосфере азота 900 мг 10% палладия на активированном угле (сухой) и через смесь пропускали газообразный водород в течение 5 мин с использованием баллона, присоединенного к игле от шприца. Затем реакционную смесь перемешивали в атмосфере газообразного водорода (из баллона) при комнатной температуре в течение 5 ч. Катализатор удаляли фильтрованием через тонкий слой целита. Фильтрат концентрировали в вакууме и остаток нейтрализовали насыщенным раствором NaHCO3. Смесь экстрагировали шестью порциями EtOAc и объединенные органические слои сушили над MgSO4. После фильтрования и концентрирования в вакууме остаток перекристаллизовывали из EtOAc, при этом получали 2-метил-5-(4Н-[1,2,4]триазол-3-ил)фениламин 4 (4,5 г, 92%) в виде твердого вещества грязно-белого цвета. ЖХВР (градиент в течение 4 мин): в.у. 0,79 мин. МС: m/z 175,2 [М+Н]+.
1H-ЯМР (300 МГц, МеОН-d3):  8,10 (ушир.s, 1Н), 7,54 (s, 1H), 7,29 (m, 2H), 7,15(d, J 7,6, 2H), 2,23(s, 3H). 8,10 (ушир.s, 1Н), 7,54 (s, 1H), 7,29 (m, 2H), 7,15(d, J 7,6, 2H), 2,23(s, 3H).
Г. [2-Метил-5-(4Н-[1,2,4]триазол-3-ил)фенил]гидразин
В раствор 2-метил-5-(4Н-[1,2,4]триазол-3-ил)фениламина 4 (200 мг, 1,15 ммоля) в диоксане (5 мл) и воде (5 мл) добавляли конц. HCl (10 мл) при 0°С, затем добавляли нитрит натрия (87 мг, 1,26 ммоля). Реакционную смесь перемешивали при 0°С в течение 40 мин, затем добавляли по каплям раствор хлорида олова (II) (481 мг, 2,59 ммоля) в конц. HCl (1 мл). Смесь перемешивали при 0°С в течение 2 ч, при этом получали осадок твердого вещества белого цвета. Твердое вещество отфильтровывали и идентифицировали как [2-метил-5-(4Н-[1,2,4]триазол-3-ил)фенил]гидразин 5 (261 мг), который использовали без дальнейшей очистки. ЖХВР (градиент в течение 4 мин): в.у. 0,71 мин. МС: m/z 190,1 [М+Н]+.
Д. {5-амино-1-[2-метил-5-(4Н-[1,2,4]триазол-3-ил)фенил]-1Н-пиразол-4-ил}фенилметанон
В перемешиваемый раствор [2-метил-5-(4Н-[1,2,4]триазол-3-ил)фенил]гидразина 5 (261 мг, рассчитанные 1,15 ммоля) в EtOH (25 мл) добавляли 2-бензоил-3-фениламиноакрилонитрил 6 (285 мг, 1,15 ммоля, получение описано в статье Grothaus, J. Am. Chem. Soc., 58, 1334 (1936)) и смесь нагревали при 65-70°С в течение 12-16 ч, затем охлаждали до комнатной температуры и концентрировали, при этом получали неочищенный продукт. Затем смесь очищали экспресс-хроматографией (элюент: EtOAc/гексан, 1:1), при этом получали {5-амино-1-[2-метил-5-(4Н-[1,2,4]триазол-3-ил)фенил]-1Н-пиразол-4-ил}фенилметанон 7 (21 мг, 0,09 ммоля, 8%) в виде твердого вещества белого цвета. ЖХВР (градиент в течение 4 мин): в.у. 1,89 мин. МС: m/z 345,2 [M+H]+.
1H-ЯМР (500 МГц, ДМСО-d6):  8,40 (d, 1H), 8,24 (ушир.s, 1Н), 8,14 (s, 1 H), 8,12 (d, 2H), 7,34 (ушир.s, 2H), 7,92-7,85 (m, 4H), 2,49 (s, 3H). 8,40 (d, 1H), 8,24 (ушир.s, 1Н), 8,14 (s, 1 H), 8,12 (d, 2H), 7,34 (ушир.s, 2H), 7,92-7,85 (m, 4H), 2,49 (s, 3H).
13С-ЯМР (500 МГц, ДМСО-d6):  152,9, 142,2, 140,5, 137,1, 132,7 132,2, 129,4, 128,8, 127,6, 126,0, 103,6, 18,1. 152,9, 142,2, 140,5, 137,1, 132,7 132,2, 129,4, 128,8, 127,6, 126,0, 103,6, 18,1.
Пример 8
Получение 3-[5-амино-4-(3-[1,3]диоксолан-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
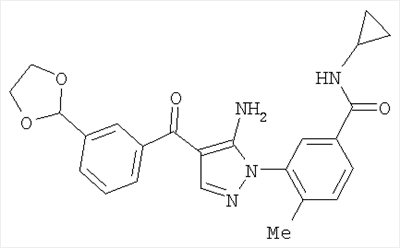 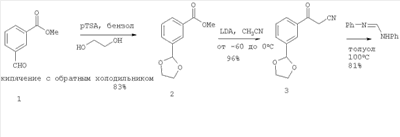 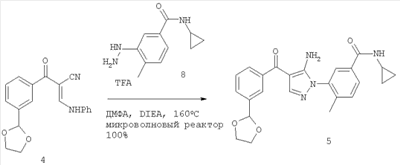
А. Метиловый эфир 3-[1,3]диоксолан-2-илбензойной кислоты
Смесь метилового эфира 3-формилбензойной кислоты 1 (6,09 г, 37,2 ммоля), этиленгликоля (2,28 мл, 40,9 ммоля) и моногидрата пара-толуолсульфоновой кислоты (0,78 г, 4,09 ммоля) нагревали с обратным холодильником и использованием насадки Дина-Старка в течение ночи. Анализ методом ТСХ показал полное потребление исходного материала. Реакционную смесь выливали в охлажденный водный NaHCO3 и EtOAc. Органический слой отделяли и сушили над Na2SO4, затем фильтровали и концентрировали, при этом получали неочищенный продукт, который очищали хроматографией на силикагеле (элюент: гексан/этилацетат, 8:1), при этом получали требуемый метиловый эфир 3-[1,3]диоксолан-2-илбензойной кислоты 2 (6,41 г, 83%) в виде бесцветного масла.
1Н-ЯМР (300 МГц, CDCl3):  3,92 (s, 3H), 4,01 (m, 2Н), 4,13 (m, 2H), 5,85 (s, 1H), 7.46 (dd, J1=J2 7,7 Гц, 1Н), 7,68 (dt, J1 7,7 Гц, J2 1,2 Гц, 1Н), 8,05 (dt, J1 7,7 Гц, J2 1,5 Гц, 1Н), 8,16 (dd, J1=J2 1,5 Гц, 1Н). 3,92 (s, 3H), 4,01 (m, 2Н), 4,13 (m, 2H), 5,85 (s, 1H), 7.46 (dd, J1=J2 7,7 Гц, 1Н), 7,68 (dt, J1 7,7 Гц, J2 1,2 Гц, 1Н), 8,05 (dt, J1 7,7 Гц, J2 1,5 Гц, 1Н), 8,16 (dd, J1=J2 1,5 Гц, 1Н).
Б. 3-(3-[1,3]Диоксолан-2-илфенил)-2-оксопропионитрил
В смесь ацетонитрила (1,90 мл, 36,4 ммоля) в ТГФ (60 мл) добавляли LDA (1,8 М в ТГФ, 33,9 мл) при -78°С. После перемешивания смеси при -78°С в течение 20 мин добавляли одной порцией метиловый эфир 3-[1,3]диоксолан-2-илбензойной кислоты 2 (6,06 г, 29,1 ммоля) в ТГФ (20 мл). Смесь перемешивали при -78°С в течение 1,5 ч, затем нагревали до 0°С и перемешивали в течение 1 ч при указанной температуре. Реакцию останавливали добавлением насыщенного NH4Cl. Смесь экстрагировали тремя порциями EtOAc. Органические слои объединяли и сушили над Na2SO4. После фильтрования и концентрирования в вакууме получали остаток, который очищали хроматографией на силикагеле (элюент: CH2Cl2, затем CH2Cl2/этилацетат, 20:1), при этом получали требуемый 3-(3-[1,3]диоксолан-2-илфенил)-2-оксопропионитрил 3 (5,71 г, 96%) в виде твердого вещества белого цвета.
1H-ЯМР (300 МГц, CDCl3):  4,12 (m, 6H), 5,86 (s, 1Н), 7,55 (dd, J1=J2 7,7 Гц, 1Н), 7,77 (d, J 7,7 Гц, 1 Н), 7,92 (d, J 7,7 Гц, 1Н), 8,01 (s, 1Н). 4,12 (m, 6H), 5,86 (s, 1Н), 7,55 (dd, J1=J2 7,7 Гц, 1Н), 7,77 (d, J 7,7 Гц, 1 Н), 7,92 (d, J 7,7 Гц, 1Н), 8,01 (s, 1Н).
В. 2-(3-[1,3]Диоксолан-2-илбензоил)-3-фениламиноакрилонитрил
Смесь 3-(3-[1,3]диоксолан-2-илфенил)-2-оксопропионитрила 3 (3,07 г, 15,0 ммолей) и N,N’-дифенилформамидина (4,10 г, 21 ммолей) в толуоле нагревали с обратным холодильником в течение 18 ч. После концентрирования в вакууме получали остаток, который очищали хроматографией на силикагеле (элюент: гексан/EtOAc, градиент от 3:1 до 2:1, затем 1:1), при этом получали требуемый 2-(3-[1,3]диоксолан-2-илбензоил)-3-фениламиноакрилонитрил 4 (3,88 г, 81%) в виде твердого вещества желтого цвета.
1H-ЯМР (300 МГц, CDCl3):  4,12 (m, 4H), 5,92 (s, 1H), 7,26 (m, 4H), 7,47 (m, 3H), 7,65 (d, J 7,7 Гц, 1H), 7,94 (dt, J1 7,7 Гц, J2 1,3 Гц, 1H), 8,05 (m, 2H). 4,12 (m, 4H), 5,92 (s, 1H), 7,26 (m, 4H), 7,47 (m, 3H), 7,65 (d, J 7,7 Гц, 1H), 7,94 (dt, J1 7,7 Гц, J2 1,3 Гц, 1H), 8,05 (m, 2H).
Г. 3-[5-амино-4-(3-[1,3]диоксолан-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
Смесь 2-(3-[1,3]диоксолан-2-илбензоил)-3-фениламиноакрилонитрила 4 (0,20 г, 0,62 ммоля), трифторацетата N-циклопропил-3-гидразино-4-метилбензамида 8 (пример 6В, 0,20 г, 0,62 ммоля) и DIEA (0,5 мл) в ДМФА (3 мл) нагревали при 160°С в течение 40 мин в микроволновом реакторе. Затем смесь охлаждали до комнатной температуры и концентрировали. Полученный остаток очищали хроматографией на силикагеле (элюент: гексан/EtOAc, градиент от 1:4 до 100% EtOAc), при этом получали требуемый 3-[5-амино-4-(3-[1,3]диоксолан-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид 5 (0,26 г, 100%) в виде твердого вещества оранжевого цвета. МС: m/z 433,2 [М+Н]+.
1H-ЯМР (300 МГц, CDCl3):  0,60 (m, 2H), 0,86 (m, 2H), 2,24 (s, 3H), 2,87 (m, 1H), 4,11 (m, 4H), 5,85 (m, 3H), 6,51 (ушир.s, 1H), 7,43 (d, J 8,0 Гц, 1H), 7,45 (dd, J1=J2 7,6 Гц; 1Н) 7,70 (m, 2H), 7,82 (m, 3H), 7,95 (s, 1H), 8,00 (s, 1Н). 0,60 (m, 2H), 0,86 (m, 2H), 2,24 (s, 3H), 2,87 (m, 1H), 4,11 (m, 4H), 5,85 (m, 3H), 6,51 (ушир.s, 1H), 7,43 (d, J 8,0 Гц, 1H), 7,45 (dd, J1=J2 7,6 Гц; 1Н) 7,70 (m, 2H), 7,82 (m, 3H), 7,95 (s, 1H), 8,00 (s, 1Н).
Пример 9
Получение 3-[5-амино-4-(3-формилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
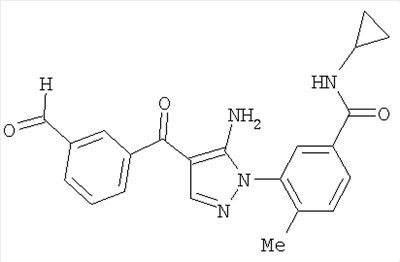 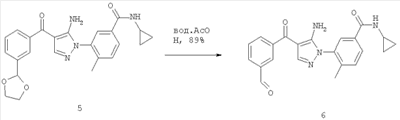
Смесь 3-[5-амино-4-(3-[1,3]диоксолан-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида 5 (пример 8, 1,14 г, 2,6 ммоля) суспендировали в водной АсОН (10 мл, 1,5 М в Н2О). Добавляли по каплям ледяную АсОН до образования прозрачного раствора. Реакционную смесь перемешивали при комнатной температуре в течение ночи. После упаривания растворителя при пониженном давлении получали остаток, добавляли толуол и EtOAc, смесь снова концентрировали, при этом получали неочищенный продукт, который очищали хроматографией на силикагеле (элюент: гексан/EtOAc, 1:4), и получали требуемый 3-[5-амино-4-(3-формилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид 6 (0,91 г, 89%) в виде твердой пены желтого цвета. МС: m/z 389,1 [M+H]+.
1H-ЯМР (300 МГц, CDCl3):  0,61 (m, 2H), 0,85 (dd, J1 6,9 Гц, J2 12,4 Гц, 2Н), 2,25 (s, 3H), 2,87 (m, 1H), 5,95 (ушир.s, 2H), 6,57 (ушир.s, 1H), 7,44 (d, J 8,0 Гц, 1H), 7,67-7,78 (m, 4H), 8,07 (s, 1H), 8,09 (d, J 1,3 Гц, 1H), 8,31 (s, 1H), 10,12 (s, 1H). 0,61 (m, 2H), 0,85 (dd, J1 6,9 Гц, J2 12,4 Гц, 2Н), 2,25 (s, 3H), 2,87 (m, 1H), 5,95 (ушир.s, 2H), 6,57 (ушир.s, 1H), 7,44 (d, J 8,0 Гц, 1H), 7,67-7,78 (m, 4H), 8,07 (s, 1H), 8,09 (d, J 1,3 Гц, 1H), 8,31 (s, 1H), 10,12 (s, 1H).
Пример 10
Получение 3-[5-амино-4-(3-гидроксиметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
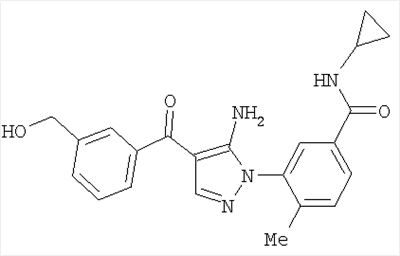 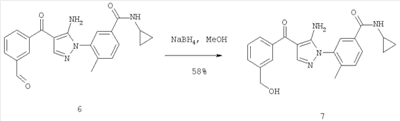
В смесь 3-[5-амино-4-(3-формилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида 6 (38 мг, 0,098 ммоля) в метаноле (3 мл) добавляли NaBH4 (11 мг, 0,29 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию останавливали добавлением водного NaOH и смесь экстрагировали этилацетатом. Органический слой отделяли и промывали водой и насыщенным раствором NaCl. Затем органический слой сушили над Na2SO4, фильтровали и концентрировали, при этом получали остаток, который очищали хроматографией на силикагеле (элюент: гексан/EtOAc, 1:4), и получали требуемый 3-[5-амино-4-(3-гидроксиметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид 7 (22 мг, 58%) в виде твердого вещества белого цвета. МС: m/z 391,2 [М+Н]+.
1H-ЯМР (300 МГц, CDCl3):  0,56 (m, 2H), 0,82 (m, 2H), 2,22 (s, 3H), 2,82 (m, 1H), 4,75 (s, 2H), 5,91 (ушир.s, 2H), 6,75 (ушир.s, 1H), 7,49 (m, 3H), 7,76 (m, 4H), 7,99 (s, 1H). 0,56 (m, 2H), 0,82 (m, 2H), 2,22 (s, 3H), 2,82 (m, 1H), 4,75 (s, 2H), 5,91 (ушир.s, 2H), 6,75 (ушир.s, 1H), 7,49 (m, 3H), 7,76 (m, 4H), 7,99 (s, 1H).
Пример 11
Получение 3-{5-амино-4-[3-(4-метилпиперазин-1-илметил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамида
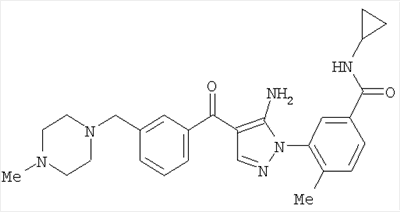
В смесь 3-[5-амино-4-(3-формилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида 6 (пример 9, 1,0 экв.) и 1-метилпиперазина (1,09 экв.) в смеси равных объемов 1,2-дихлорэтана и дихлорметана добавляли АсОН (0,96 экв.), затем добавляли триацетоксиборгидрид натрия (1,5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакцию останавливали добавлением водного NaOH и смесь экстрагировали этилацетатом. Органический слой отделяли и промывали водой и насыщенным раствором NaCl. Затем органический слой сушили над Na2SO4, фильтровали и концентрировали, при этом получали остаток, который очищали хроматографией на силикагеле (элюент: CH2Cl2/метанол, 9:1, затем CH2Cl2/МеОН/NH3H2O, 9:1:0,05) и получали продукт (67%). МС: m/z 473,3 [M+H]+.
1H-ЯМР (300 МГц, CDCl3):  0,61 (m, 2H), 0,86 (m, 2H), 2,26 (s, 3H), 2,30 (s, 3H), 2,52 (ушир.s, 8Н), 2,90 (m, 1H), 3,60 (s, 2H), 5,87 (ушир.s, 1H), 6,30 (ушир.s, 2H), 7,45 (m, 3H), 7,70 (m, 2H), 7,83 (m, 3H). 0,61 (m, 2H), 0,86 (m, 2H), 2,26 (s, 3H), 2,30 (s, 3H), 2,52 (ушир.s, 8Н), 2,90 (m, 1H), 3,60 (s, 2H), 5,87 (ушир.s, 1H), 6,30 (ушир.s, 2H), 7,45 (m, 3H), 7,70 (m, 2H), 7,83 (m, 3H).
Пример 12
Получение 3-[5-амино-4-(3-морфолин-4-илметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
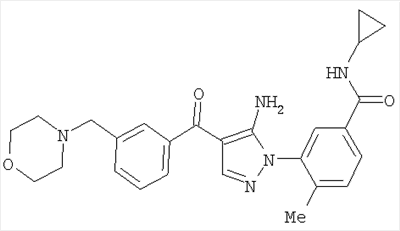
Соединение получают аналогично тому, как описано в примере 11, но при замене 1-метилпиперидина на морфолин, при этом получают продукт (45%). МС: m/z 460,2 [М+Н]+.
1Н-ЯМР (300 МГц, CDCl3):  0,61 (m, 2Н), 0,87 (m, 2Н), 2,26 (s, 3H), 2,25 (s, 3H), 2,49 (m, 4H). 2,90 (m, 1H), 3,59 (s, 2Н), 3,72 (t, J 4,4 Гц, 2Н), 5,85 (ушир.s, 2Н), 6,35 (ушир.s, 1H), 7,45 (m, 3H), 7,71 (m, 2Н), 7,83 (m, 3H). 0,61 (m, 2Н), 0,87 (m, 2Н), 2,26 (s, 3H), 2,25 (s, 3H), 2,49 (m, 4H). 2,90 (m, 1H), 3,59 (s, 2Н), 3,72 (t, J 4,4 Гц, 2Н), 5,85 (ушир.s, 2Н), 6,35 (ушир.s, 1H), 7,45 (m, 3H), 7,71 (m, 2Н), 7,83 (m, 3H).
Пример 13
Получение 3-{5-амино-4-[3-(2-морфолин-4-илэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамида
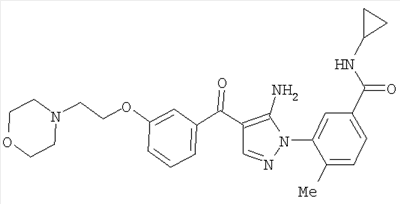
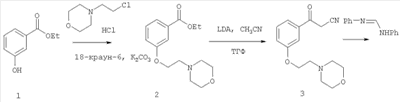 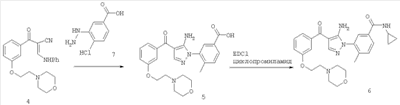
А. Этиловый эфир 3-(2-морфолин-4-илэтокси)бензойной кислоты
В раствор этил-3-гидроксибензоата 1 (3,32 г, 20 ммолей), гидрохлорида 4-(2-хлорэтил)морфолина (5,58 г, 30 ммолей) и 18-краун-6 (20 мг) в ДМФА (100 мл) добавляли карбонат калия (6,2 г, 45 ммолей). Смесь перемешивали при 100°С в течение 20 ч. Растворитель удаляли в вакууме и остаток суспендировали в этилацетате. Органический слой промывали насыщенным раствором NaHCO3, затем солевым раствором и сушили над сульфатом натрия. Растворитель упаривали, при этом получали продукт этиловый эфир 3-(2-морфолин-4-илэтокси)бензойной кислоты 2 (5,3 г, 95%) в виде масла светло-желтого цвета. ЖХВР (градиент в течение 4 мин): в.у. 1,47 мин. МС: m/z 280,2 [М+Н]+.
Б. 3-[3-(2-Морфолин-4-илэтокси)фенил]-3-оксопропионитрил
Диизопропиламид лития (16,4 мл, 29,6 ммоля, 1,8 М раствор в гептане/тетрагидрофуране/этилбензоле) добавляли по каплям в атмосфере азота к раствору ацетонитрила (1,2 г, 29,6 ммоля) в сухом тетрагидрофуране (20 мл) при -78°С. После перемешивания реакционной смеси в течение 30 мин добавляли по каплям раствор этилового эфира 3-(2-морфолин-4-илэтокси)бензойной кислоты 2 (5,5 г, 19,7 ммоля) в сухом тетрагидрофуране (20 мл) и перемешивали при -78°С в течение 1 ч, затем добавляли воду, водный слой отделяли и подкисляли разбавленной соляной кислотой до рН 7. Продукт экстрагировали этилацетатом. Органический слой промывали солевым раствором и затем сушили над сульфатом натрия. Растворитель удаляли в вакууме, при этом получали 3-[3-(2-морфолин-4-илэтокси)фенил]-3-оксопропионитрил 3 (4,8 г) в виде масла светло-желтого цвета. ЖХВР (градиент в течение 4 мин): в.у. 1,11 мин. МС: m/z 275,2 [М+Н]+.
В. 2-[3-(2-Морфолин-4-илэтокси)бензоил]-3-фениламиноакрилонитрил
Смесь 3-[3-(2-морфолин-4-илэтокси)фенил]-3-оксопропионитрила 3 (4,8 г, 17,5 ммоля) и N,N-дифенилформамидина (1,2 г, 24,5 ммоля) в сухом толуоле (100 мл) нагревали при 110 С в течение 3 ч в атмосфере азота. Растворитель удаляли и маслообразный остаток очищали хроматографией на колонке с силикагелем (элюент: градиент от 100% EtOAc до EtOAc/MeOH/Et3N, 100:10:1), при этом получали 2-[3-(2-морфолин-4-илэтокси)бензоил]-3-фениламиноакрилонитрил 4 (3,1 г, 47%) в виде твердого вещества светло-желтого цвета. ЖХВР (градиент в течение 4 мин): в.у. 2,04 мин. МС: m/z 378,2 [М+Н]+.
Г. 3-{5-Амино-4-[3-(2-морфолин-4-илэтокси)бензоил]пиразол-1-ил}-4-метилбензойная кислота
2-[3-(2-Морфолин-4-илэтокси)бензоил]-3-фениламиноакрилонитрил 4 (189 мг, 0,5 ммоля) и гидрохлорид 3-гидразино-4-метилбензойной кислоты 7 (пример 3А, 152 мг, 0,75 ммоля) суспендировали в N,N-диметилформамиде (5 мл) и нагревали при 160°С в микроволновом реакторе в течение 30 мин. Растворитель упаривали и остаток очищали хроматографией на колонке (элюент: EtOAc~МеОН), при этом получали продукт, 3-{5-амино-4-[3-(2-морфолин-4-илэтокси)бензоил]пиразол-1-ил}-4-метилбензойную кислоту 5 (200 мг) в виде твердого вещества светло-желтого цвета. ЖХВР (градиент в течение 4 мин): в.у. 1,60 мин. МС: m/z 451,2 [М+Н]+.
Д. 3-{5-Амино-4-[3-(2-морфолин-4-илэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид
Смесь 3-{5-амино-4-[3-(2-морфолин-4-илэтокси)бензоил]пиразол-1-ил}-4-метилбензойной кислоты 5 (400 мг, 0,89 ммоля), циклопропиламина (0,89 ммоля), EDCI (340 мг, 1,78 ммоля), HOBt (272 мг, 1,78 ммоля) и диизопропилэтиламина (459 мг, 3,56 ммоля) в сухом N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 18 ч. Растворитель упаривали, остаток суспендировали в EtOAc и промывали водой, насыщенным раствором NaHCO3 и солевым раствором. Органический слой сушили над сульфатом натрия. После очистки хроматографией на колонке (элюент: EtOAc/MeOH/Et3N, 100:10:1) получали продукт 3-{5-амино-4-[3-(2-морфолин-4-илэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид 6 (45 мг, 10%) в виде твердого вещества светло-желтого цвета. ЖХВР (градиент в течение 4 мин): в.у. 1,69 мин. МС: m/z 490,24 [М+Н]+.
Пример 14
Получение 3-[5-амино-4-(3-бензилоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
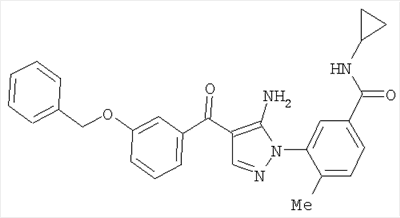
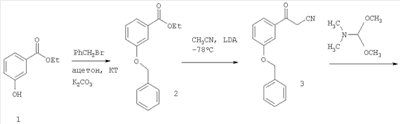 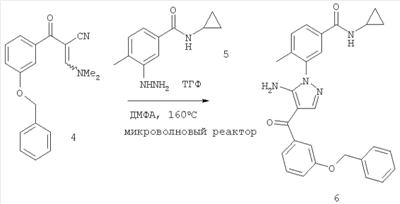
А. Этиловый эфир 3-бензилоксибензойной кислоты
К2СО3 (6,9 г, 50 ммолей) и 18-краун-6 добавляли в раствор этилового эфира 3-гидроксибензойной кислоты 1 (8,3 г, 50 ммолей) в ацетоне (100 мл) и смесь перемешивали при комнатной температуре в течение 18 ч. Твердое вещество отфильтровывали, фильтрат концентрировали в вакууме, при этом получали этиловый эфир 3-бензилоксибензойной кислоты 2 в виде бесцветной жидкости.
Б. 3-(3-Бензилоксифенил)-3-оксопропионитрил
LDA (1,8 М, 100 ммолей, 56 мл) добавляли в раствор ацетонитрила (4,1 г, 100 ммолей) в ТГФ (100 мл, сухой) при -78°С в атмосфере азота. Смесь перемешивали при -78°С в течение 30 мин. Затем раствор этилового эфира 3-бензилоксибензойной кислоты 2 в 50 мл безводного ТГФ добавляли по каплям в реакционную смесь. Смесь перемешивали при -78°С в течение 1 ч, затем добавляли воду, органический слой отделяли, водный слой подкисляли соляной кислотой до рН~2 и экстрагировали EtOAc. Слои ТГФ и EtOAc объединяли и промывали водой и солевым раствором, сушили над Na2SO4. Растворитель удаляли в вакууме и твердый остаток растирали в Et2O и сушили в вакууме, при этом получали требуемый продукт, 3-(3-бензилоксифенил)-3-оксопропионитрил 3 (11,0 г, 87%), в виде твердого вещества светло-коричневого цвета.
В. 2-(3-Бензилоксибензоил)-3-диметиламиноакрилонитрил
Диметилацеталь N,N-диметилформамида (10 мл) добавляли к раствору 3-(3-бензилоксифенил)-3-оксопропионитрила 3 (2,5 г, 10 ммолей) в ДМФА (20 мл, сухой) и смесь перемешивали при 100°С в течение 3 ч. Растворитель удаляли и остаток очищали хроматографией на колонке с силикагелем (элюент: EtOAc), при этом получали требуемый продукт, 2-(3-бензилоксибензоил)-3-диметиламиноакрилонитрил 4 (2,6 г, 90%), в виде твердого вещества светло-желтого цвета.
Г. 3-[5-Амино-4-(3-бензилоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
2-(3-Бензилоксибензоил)-3-диметиламиноакрилонитрил 4 (147 мг, 0,5 ммоля) и трифторацетат N-циклопропил-3-гидразино-4-метилбензамида 8 (пример 6 В, 240 мг, 0,75 ммоля) растворяли в ДМФА (5 мл) и нагревали при 160°С в микроволновом реакторе в течение 30 мин. Растворитель удаляли и остаток очищали хроматографией на колонке (элюент: EtOAc/гексан, 3:1), при этом получали требуемый продукт, 3-[5-амино-4-(3-бензилоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид 6 (120 мг, 52%), в виде твердого вещества светло-желтого цвета.
Пример 15
Получение 3-[5-амино-4-(3-гидроксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
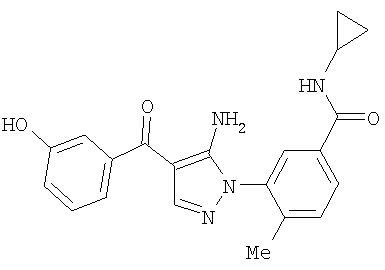 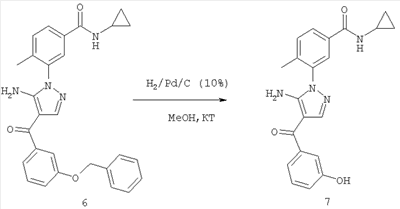
3-[5-Амино-4-(3-бензилоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид 6 (200 мг, 0,43 ммоля) растворяли в МеОН (10 мл), добавляли катализатор 10% палладий на активированном угле (сухой) и перемешивали в атмосфере водорода в течение 2 ч. Катализатор удаляли фильтрованием, растворитель удаляли в вакууме, при этом получали требуемый продукт, 3-[5-амино-4-(3-гидроксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид 7 (140 мг, 87%), в виде твердого вещества светло-желтого цвета.
Пример 16
Получение 3-[5-амино-4-(4-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
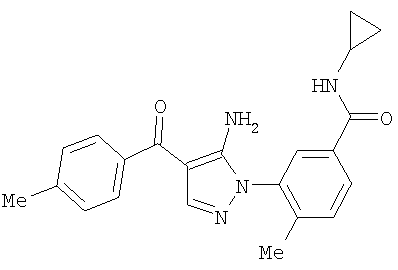
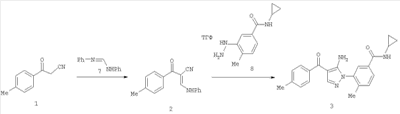
А. 2-(4-Метилбензоил)-3-фениламиноакрилонитрил
Смесь 4-толуоилацетонитрила 1 (4,0 г, 25 ммолей) и N,N-дифенилформамидина (4,9 г, 25 ммолей) в сухом толуоле (50 мл) нагревали при 85°С в течение 16 ч в атмосфере азота. Смесь охлаждали до комнатной температуры и добавляли 170 мл гексана. После перемешивания смеси при комнатной температуре в течение 5 мин образовывался осадок желтого цвета. Твердое вещество собирали в колбу со стеклянным фильтром и промывали гексаном, при этом получали чистый 2-(4-метилбензоил)-3-фениламиноакрилонитрил 2 (4,5 г, 68%).
1H-ЯМР (300 МГц, CDCl3):  8,04 (d, J 13,0, 1H), 7,86 (d, J 7,9, 2H), 7,42 (t, J 7,4, 1H), 7,28-7,25 (m, 3H), 7,19 (d, J 7,6, 1H), 2,41 (s, 3H). 8,04 (d, J 13,0, 1H), 7,86 (d, J 7,9, 2H), 7,42 (t, J 7,4, 1H), 7,28-7,25 (m, 3H), 7,19 (d, J 7,6, 1H), 2,41 (s, 3H).
Б. 3-[5-Амино-4-(4-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
Смесь 2-(4-метилбензоил)-3-фениламиноакрилонитрила 2 (205 мг, 0,78 ммоля), трифторацетата N-циклопропил-3-гидразино-4-метилбензамида 7 (пример 6В, 250 мг, 0,78 ммоля) и диизопропиламина (0,14 мл, 0,78 ммоля) в 8 мл этанола нагревали при 65°С в течение 18 ч. Растворитель удаляли и остаток очищали хроматографией на колонке с силикагелем (элюент: EtOAc/гексан, градиент от 1:3 до 3:1). Затем продукт очищали растиранием в Et2O, при этом получали 3-[5-амино-4-(4-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид 3 (64 мг, 22%) в виде твердого вещества белого цвета. ЖХВР (градиент в течение 4 мин): в.у. 2,26 мин. МС: m/z 375,2 [М+Н]+.
1Н-ЯМР (300 МГц, ДМСО-d6):  8,51 (d, J 4,0, 1H), 7,93 (d, J 8,0, 1H), 8,51 (d, J 4,0, 1H), 7,83 (ушир.s, 1H), 7,82 (s, 1H), 7,70 (d, J 7,9, 2H), 7,53 (d, J 8,0, 1H), 7,35 (d, J 7,9, 2H), 6,95 (ушир.s, 2H), 2,86 (m, 1H), 2,40 (s, 3H), 2,14 (s, 3H), 0,68 (m, 2H), 0,56 (m, 2H). 8,51 (d, J 4,0, 1H), 7,93 (d, J 8,0, 1H), 8,51 (d, J 4,0, 1H), 7,83 (ушир.s, 1H), 7,82 (s, 1H), 7,70 (d, J 7,9, 2H), 7,53 (d, J 8,0, 1H), 7,35 (d, J 7,9, 2H), 6,95 (ушир.s, 2H), 2,86 (m, 1H), 2,40 (s, 3H), 2,14 (s, 3H), 0,68 (m, 2H), 0,56 (m, 2H).
13С-ЯМР (300 МГц, ДМСО-d6):  187,4, 166,0, 151,9, 141,3, 141,1, 139,2, 136,9, 135,6, 133,0, 131,2, 129,1, 128,3, 128,0, 126,5, 102,6, 23,1, 21,0, 17,2, 5,6. 187,4, 166,0, 151,9, 141,3, 141,1, 139,2, 136,9, 135,6, 133,0, 131,2, 129,1, 128,3, 128,0, 126,5, 102,6, 23,1, 21,0, 17,2, 5,6.
Пример 17
Получение 3-(5-амино-4-бензоилимидазол-1-ил)-N-циклопропил-4-метилбензамида
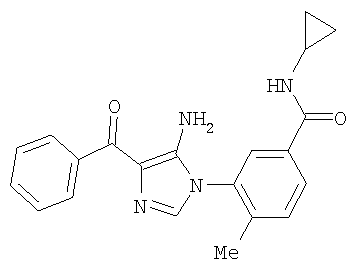
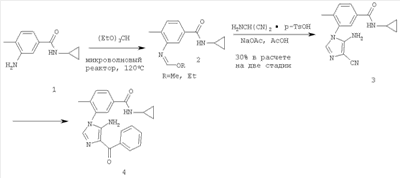
А. 3-(5-Амино-4-цианоимидазол-1-ил)-N-циклопропил-4-метилбензамида
Смесь 3-амино-N-циклопропил-4-метилбензамида 1 (380 мг, 2,0 ммоля) в 2,0 мл триэтилортоформиата перемешивали в микроволновом реакторе при 120°С в течение 20 мин. Растворитель удаляли при пониженном давлении. Остаток растворяли в 5 мл уксусной кислоты и затем добавляли пара-толуолсульфонат аминомалононитрила (506 мг, 2,0 ммоля) и ацетат натрия (164 мг, 2,0 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли 20 мл воды и затем добавляли водный NaOH до рН 8. Полученную смесь экстрагировали EtOAc (3×50 мл). Объединенные органические слои промывали водой (10 мл) и солевым раствором (10 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на колонке силикагелем (элюент: хлористый метилен/метанол, 10:1), при этом получали 3-(5-амино-4-цианоимидазол-1-ил]-N-циклопропил-4-метилбензамид 3 (170 мг, 30%) в виде бесцветного твердого вещества. ЖХВР (градиент в течение 4 мин): в.у. 1,39 мин. МС: m/z 282 [М+Н]+.
Б. 3-(5-Амино-4-бензоилимидазол-1-ил)-N-циклопропил-4-метилбензамид
В раствор 3-(5-амино-4-цианоимидазол-1-ил)-N-циклопропил-4-метилбензамида 3 (56,4 мг, 0,2 ммоля) в сухом ТГФ (10 мл) добавляли фенилмагнийбромид (1 М, 1 мл) при комнатной температуре в атмосфере азота. Через 1 ч добавляли раствор HCl (3 н., 10 мл) и смесь перемешивали в течение ночи. Раствор нейтрализовали при добавлении водного NaOH. Смесь экстрагировали этилацетатом (2×100 мл), промывали водой и сушили над Na2SO4. После упаривания растворителя остаток очищали методом ЖХВР, при этом получали 3-(5-амино-4-бензоилимидазол-1-ил)-N-циклопропил-4-метилбензамид (56 мг, 78%) в виде твердого вещества белого цвета. ЖХМС (градиент в течение 4 мин): в.у. 2,07 мин. МС: m/z 316,17 [М+Н]+.
Пример 18
Получение 3-(5-амино-4-циклогексанкарбонилимидазол-1-ил)-N-циклопропил-4-метилбензамида
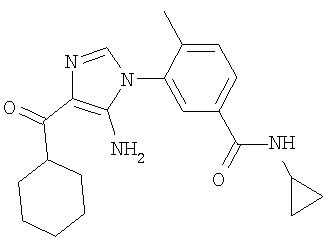
Соединение получали по аналогично тому, как описано в примере 17, но при замене фенилмагнийбромида на циклогексилмагнийбромид. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 2,01 мин. МС: m/z 367,29 [М+Н]+.
Пример 19
Получение 3-(5-амино-4-циклопентанкарбонилимидазол-1-ил)-N-циклопропил-4-метилбензамида
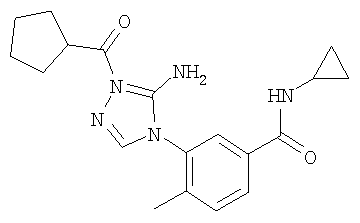
Соединение получали аналогично тому, как описано в примере 17, но при замене фенилмагнийбромида на циклопентилмагнийбромид. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 1,92 мин. МС: m/z 353,22 [М+Н]+.
Пример 20
Получение 3-(5-амино-4-фенилацетилимидазол-1-ил)-N-циклопропил-4-метилбензамида
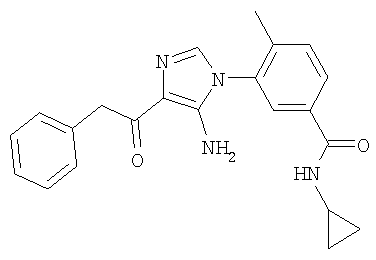
Соединение получали аналогично тому, как описано в примере 17, но при замене фенилмагнийбромида на бензилмагнийбромид. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 2,14 мин. МС: m/z 375,20 [М+Н]+.
Пример 21
Получение 3-[5-амино-4-(3-изопропилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
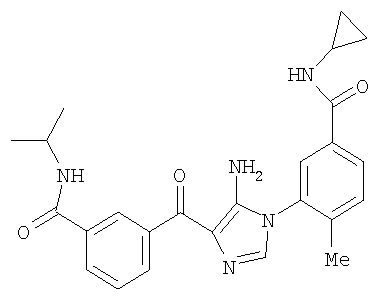
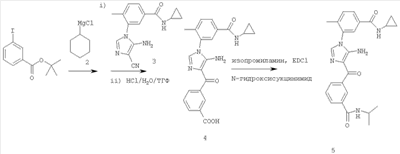 А. 3-[5Амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-имидазол-4-карбонил]бензойная кислота А. 3-[5Амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-имидазол-4-карбонил]бензойная кислота
В раствор трет-бутилового эфира 3-иодбензойной кислоты (4,6 г) в ТГФ (20 мл) добавляли циклогексилмагнийхлорид (2 М в ТГФ, 8,5 мл) в атмосфере N2 при -40°С. Температуру раствора поддерживали от -40°С до 0°С в течение 20 мин, при этом добавляли 3-(5-амино-4-цианоимидазол-1-ил)-N-циклопропил-4-метилбензамид и реакцию проводили при комнатной температуре в течение 1 ч. Затем добавляли HCl (4 М, 10 мл) и смесь нагревали при температуре от 40°С до 45°С в течение ночи. Смесь нейтрализовали раствором К2СО3 и экстрагировали EtOAc (2×100 мл), объединенные органические слои сушили над Na2SO4 и концентрировали. После очистки неочищенного продукта хроматографией на колонке (элюент: EtOAc/МеОН, 6:1) получали требуемый продукт (0,46 г).
Б. 3-[5-Амино-4-(3-изопропилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид
Раствор кислоты 4 (160 мг), EDCl (90 мг) и N-гидроксисукцинимида (53 мг) в ДМФА (2 мл) выдерживали при комнатной температуре в течение ночи, добавляли воду (12 мл), раствор экстрагировали EtOAc (2×15 мл) и сушили над Na2SO4. После упаривания растворителя получали остаток, в который добавляли EtOAc (4 мл) и 2-пропиламин (1,2 экв.). Реакцию проводили при комнатной температуре в течение 1 ч, затем реакционную смесь концентрировали и неочищенный продукт очищали хроматографией на колонке, при этом получали требуемый продукт (80%). ЖХВР (градиент в течение 4 мин): в.у. 2,00 мин. МС: m/z 446,19 [M+H]+.
Пример 22
Получение 3-{5-амино-4-[3-(2-диметиламиноэтилкарбамоил)бензоил]имидазол-1-ил)-N-циклопропил-4-метилбензамида
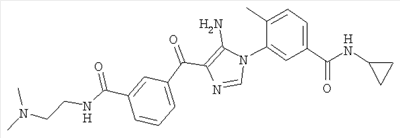
Соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на 2-диметиламиноэтиламин. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 2,18 мин. МС: m/z 475,15 [М+Н]+.
Пример 23
Получение 3-[5-амино-4-(3-этилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
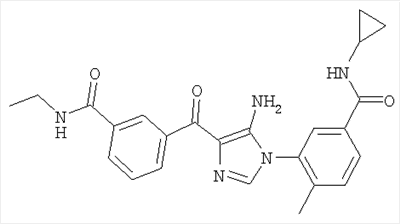
Соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на этиламин. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 1,70 мин. МС: m/z 432,18 [М+Н]+.
Пример 24
Получение 3-[5-амино-4-(3-метилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
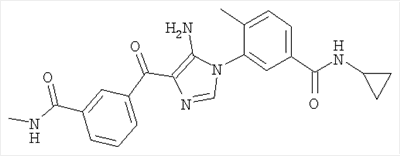
Соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на метиламин. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 1,61 мин. МС: m/z 418,15 [М+Н]+.
Пример 25
Получение 3-[5-амино-4-(3-циклопропилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
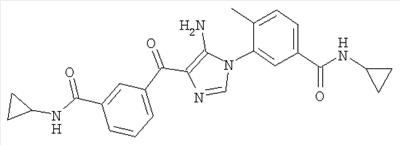
Соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на циклопропиламин. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 1,74 мин. МС: m/z 444,14 [М+H]+.
Пример 26
Получение 3-[5-амино-4-(3-циклопентилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
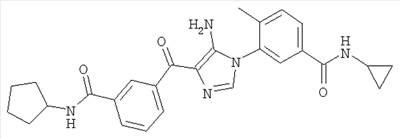
Соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на циклопентиламин. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 1,95 мин. МС: m/z 472,24 [М+Н]+.
Пример 27
Получение 3-{5-амино-4-[3-(морфолин-4-карбонил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамида
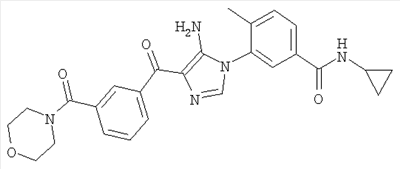
Соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на морфолин. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 1,67 мин. МС: m/z 474,17 [М+Н]+.
Пример 28
Получение 3-{5-амино-4-[3-(циклопропилметилкарбамоил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамида
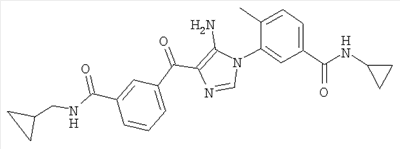
Соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на циклопропилметиламин. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 1,86 мин. МС: m/z 458,23 [М+Н]+.
Пример 29
Получение 3-[5-амино-4-(тетрагидропиран-4-карбонил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
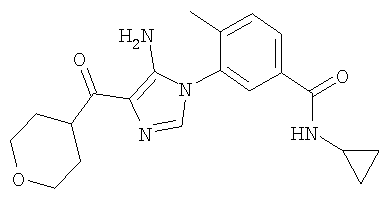
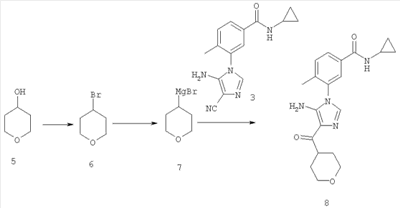
А. 4-Бромтетрагидропиран
Тетрагидро-4Н-пиран-4-ол (1,0 г, 10 ммолей), четырехбромистый углерод (3,6 г, 11 ммолей) и трифенилфосфин (3,1 г, 12 ммолей) растворяли в CH2Cl2 (25 мл) и перемешивали при комнатной температуре в течение ночи. Неочищенную реакционную смесь концентрировали, затем очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/гексан, 1:20), при этом получали продукт (1,4 г, 87%) в виде бесцветного масла.
Б. 3-[5-Амино-4-(тетрагидропиран-4-карбонил)имидазол-1-ил]-N-циклопропил-4-метилбензамид
Раствор 4-бромтетрагидропирана (0,82 г, 5 ммолей) в сухом ТГФ (10 мл) добавляли по каплям в суспензию магния (132 мг, 5,5 ммоля) и иода (25 mg) в сухом ТГФ (20 мл) при 50°С в атмосфере N2. После добавления реагентов смесь перемешивали в течение 30 мин при 50°С, затем охлаждали до комнатной температуры. В реакционную смесь добавляли раствор 3-(5-амино-4-цианоимидазол-1-ил)-N-циклопропил-4-метилбензамида (90 мг, 0,32 ммоля) в ТГФ (10 мл) и смесь перемешивали при комнатной температуре в течение 3 ч, затем реакцию останавливали добавлением HCl (2 н.) и смесь перемешивали при комнатной температуре в течение ночи. В раствор добавляли насыщенный водный К2СО3 до рН~8 и экстрагировали EtOAc. Органический слой промывали водой и солевым раствором, сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали хроматографией на колонке с силикагелем (элюент: EtOAc~EtOAc/МеОН/Et3N, 100:10:1), при этом получали продукт (35 мг, 30%) в виде твердого вещества бежевого цвета. ЖХВР (градиент в течение 4 мин): в.у. 3,05 мин. МС: m/z 369,18 [М+Н]+.
Пример 30
Получение 3-(5-амино-4-бензоил-3-метоксипиразол-1-ил)-N-циклопропил-4-метилбензамида
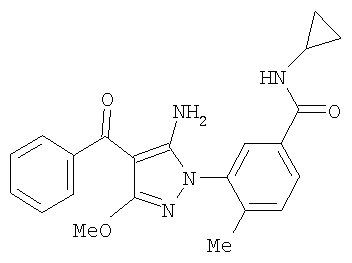
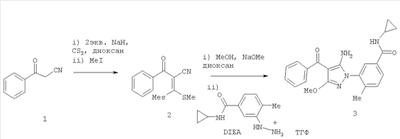
А. 3-Бензоил-3,3-бис-метилсульфанилакрилонитрил
В перемешиваемый раствор бензоилацетонитрила 1 (7,50 г, 51,7 ммоля) в ТГФ (100 мл) при 0°С добавляли сухой гидрид натрия (2,61 г, 103 ммолей). Полученную суспензию перемешивали при 0°С в течение 45 мин, затем добавляли дисульфид углерода (2,39 мл, 54,8 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Полученный раствор красного цвета охлаждали до 0°С и добавляли иодметан (6,75 мл, 109 ммолей). Смесь перемешивали при комнатной температуре в течение 18 ч. Растворитель удаляли в вакууме. Остаток разбавляли эфиром и промывали солевым раствором. Водный слой экстрагировали двумя порциями эфира. Объединенные органические слои промывали двумя порциями 5% тиосульфата натрия и затем солевым раствором. Органический слой сушили над MgSO4, фильтровали и концентрировали, при этом получали 3-бензоил-3,3-бис-метилсульфанилакрилонитрил 2 в виде порошка желтого цвета (9,5 г, 74%). Продукт использовали на следующей стадии без дальнейшей очистки.
Б. 3-(5-Амино-4-бензоил-3-метоксипиразол-1-ил)-N-циклопропил-4-метилбензамид
Натрий (317 мг, 13,8 ммоля) добавляли в метанол (10 мл) при 0°С. После потребления всего количества натрия полученный раствор метилата натрия при 0°С добавляли в перемешиваемый раствор 3-бензоил-3,3-бис-метилсульфанилакрилонитрила 2 (3,12 г, 12,5 ммоля) в диоксане (30 мл). Реакционную смесь нагревали до комнатной температуры и затем нагревали при 80°С в течение 3 ч. Полученный раствор темно-красного цвета охлаждали до комнатной температуры и добавляли в раствор трифтор ацетата N-циклопропил-3-гидразино-4-метилбензамида (4,00 г, 12,5 ммоля) и диизопропилэтиламина (2,18 мл, 12,5 ммоля) в диоксане (15 мл). Смесь нагревали при 85°С в течение еще 6 ч. Растворитель удаляли в вакууме, остаток разбавляли насыщенным раствором NaHCO3 и экстрагировали тремя порциями EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/гексан, градиент EtOAc от 75% до 90%) и перекристаллизовывали из EtOAc, при этом получали требуемый 3-(5-амино-4-бензоил-3-метоксипиразол-1-ил)-N-циклопропил-4-метилбензамид 3 (950 мг, 19%) в виде твердого вещества белого цвета. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 2,33 мин. МС: m/z 391,2 [М+Н]+.
1H-ЯМР (300 МГц, ДМСО-d6):  8,50 (d, J 3,4, 1H), 7,91 (d, J 7,9, 1H), 7,85 (s, 1H), 7,61 (d, J 6,9, 2H), 7,41-7,62 (m, 4H), 7,00 (ушир.s, 2 H), 3,66 (s, 3H), 2,87 (m, 1H), 2,20 (s, 3H), 0,70 (m, 2H), 0,85 (m, 2 H). 8,50 (d, J 3,4, 1H), 7,91 (d, J 7,9, 1H), 7,85 (s, 1H), 7,61 (d, J 6,9, 2H), 7,41-7,62 (m, 4H), 7,00 (ушир.s, 2 H), 3,66 (s, 3H), 2,87 (m, 1H), 2,20 (s, 3H), 0,70 (m, 2H), 0,85 (m, 2 H).
13С-ЯМР (125 МГц, ДМСО-d6):  188,1, 166,0, 159,5, 152,8, 140,1, 139,5, 135,5, 132,9, 131,1, 130,6, 128,1, 128,0, 127,4, 126,8, 91,0, 55,2, 23,0, 15,1, 5,6. 188,1, 166,0, 159,5, 152,8, 140,1, 139,5, 135,5, 132,9, 131,1, 130,6, 128,1, 128,0, 127,4, 126,8, 91,0, 55,2, 23,0, 15,1, 5,6.
Пример 31
Получение 3-(5-амино-4-бензоил-3-этоксипиразол-1-ил)-N-циклопропил-4-метилбензамида
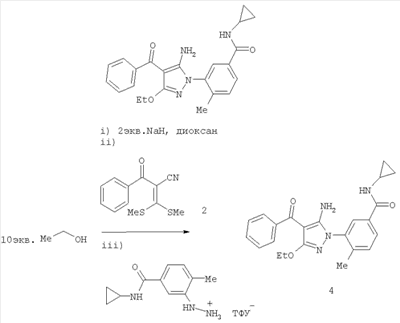 Этанол (0,47 мл, 8,0 ммоля) добавляли в суспензию сухого гидрида натрия (41 мг, 1,6 ммоля) в диоксане (2 мл). Смесь перемешивали при комнатной температуре в течение 10 мин, добавляли 2-бензоил-3,3-бис-метилсульфанилакрилонитрил 2 (0.20 г, 0.80 ммоля) и смесь перемешивали при 85°С в течение 2,5 ч. Смесь охлаждали до комнатной температуры, добавляли трифторацетат N-циклопропил-3-гидразино-4-метилбензамида (0,26 г, 0,80 ммоля) и реакционную смесь нагревали при 85°С в течение еще 3 ч. Растворители удаляли в вакууме, остаток разбавляли насыщенным раствором NaHCO3 и экстрагировали тремя порциями EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/гексан, градиент EtOAc от 75% до 85%). Затем продукт очищали промывкой теплой смесью EtOAc и гексана, при этом получали требуемый 3-(5-амино-4-бензоил-3-этоксипиразол-1-ил)-N-циклопропил-4-метилбензамид 4 (27 мг, 8,3%) в виде твердого вещества белого цвета. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 2,37 мин. МС: m/z 405,2 [М+Н]+. Этанол (0,47 мл, 8,0 ммоля) добавляли в суспензию сухого гидрида натрия (41 мг, 1,6 ммоля) в диоксане (2 мл). Смесь перемешивали при комнатной температуре в течение 10 мин, добавляли 2-бензоил-3,3-бис-метилсульфанилакрилонитрил 2 (0.20 г, 0.80 ммоля) и смесь перемешивали при 85°С в течение 2,5 ч. Смесь охлаждали до комнатной температуры, добавляли трифторацетат N-циклопропил-3-гидразино-4-метилбензамида (0,26 г, 0,80 ммоля) и реакционную смесь нагревали при 85°С в течение еще 3 ч. Растворители удаляли в вакууме, остаток разбавляли насыщенным раствором NaHCO3 и экстрагировали тремя порциями EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/гексан, градиент EtOAc от 75% до 85%). Затем продукт очищали промывкой теплой смесью EtOAc и гексана, при этом получали требуемый 3-(5-амино-4-бензоил-3-этоксипиразол-1-ил)-N-циклопропил-4-метилбензамид 4 (27 мг, 8,3%) в виде твердого вещества белого цвета. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 2,37 мин. МС: m/z 405,2 [М+Н]+.
1Н-ЯМР (300 МГц, ДМСО-d6):  8,49 (d, J 4,0, 1H), 7,90 (d, J 8,0, 1H), 7,85 (s, 1H), 7,62 (d, J 7,1, 2H), 7,50 (d, J 7,5, 2H), 7,41-7,45 (m, 2H), 6,99 (ушир.s, 2H), 4.05 (q, J 7,0, 2H), 2,87 (m, 1H), 2,19 (s, 3H), 1,09 (t, J 7,0, 3H), 0,69 (m, 2H), 0,58 (m, 2H). 8,49 (d, J 4,0, 1H), 7,90 (d, J 8,0, 1H), 7,85 (s, 1H), 7,62 (d, J 7,1, 2H), 7,50 (d, J 7,5, 2H), 7,41-7,45 (m, 2H), 6,99 (ушир.s, 2H), 4.05 (q, J 7,0, 2H), 2,87 (m, 1H), 2,19 (s, 3H), 1,09 (t, J 7,0, 3H), 0,69 (m, 2H), 0,58 (m, 2H).
13С-ЯМР (125 МГц, ДМСО-d6):  188,2, 166,0, 158,9, 152,6, 140,0, 139,5, 135,5, 132,9, 131,1, 130,6, 128,1, 127,2, 126,7, 91,2, 63,4, 23,0, 17,3, 14,2, 5,6. 188,2, 166,0, 158,9, 152,6, 140,0, 139,5, 135,5, 132,9, 131,1, 130,6, 128,1, 127,2, 126,7, 91,2, 63,4, 23,0, 17,3, 14,2, 5,6.
Пример 32
Получение 3-[5-амино-4-бензоил-3-(2-метоксиэтокси)пиразол-1-ил]-N-циклопропил-4-метилбензамида
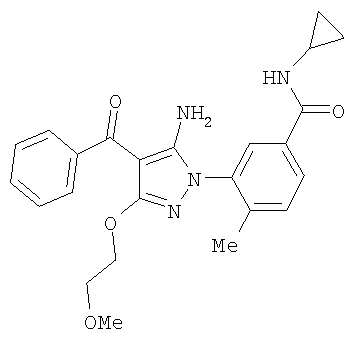 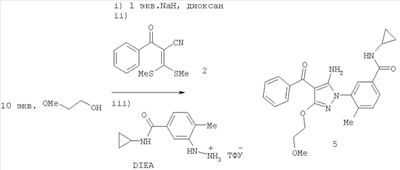
Сухой гидрид натрия (21 мг, 0,84 ммоля) добавляли в раствор 2-метоксиэтанола (0,63 мл, 8,0 ммоля) в диоксане (2 мл) при 0°С. Смесь перемешивали при комнатной температуре в течение 30 мин, добавляли 2-бензоил-3,3-бис-метилсульфанилакрилонитрил 2 (0,20 г, 0,80 ммоля) и смесь перемешивали при 85°С в течение 4 ч. Смесь охлаждали до комнатной температуры, добавляли трифторацетат N-циклопропил-3-гидразино-4-метилбензамида (0,26 г, 0,80 ммоля), затем добавляли диизопропилэтиламин (0,14 мл, 0,80 ммоля) и реакционную смесь нагревали при 85°С в течение еще 11 ч. Растворители удаляли в вакууме, остаток разбавляли насыщенным раствором NaHCO3 и экстрагировали тремя порциями EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/гексан, градиент EtOAc от 70% до 90%). Затем продукт очищали промывкой теплой смесью EtOAc и гексана, при этом получали требуемый 3-[5-амино-4-бензоил-3-(2-метоксиэтокси)пиразол-1-ил]-N-циклопропил-4-метилбензамид 5 (60 мг, 17%) в виде твердого вещества белого цвета. ЖХВР (градиент 10-90 в течение 4 мин): в.у. 2,17 мин. МС: m/z 435,2 [М+Н].+
1H-ЯМР (500 МГц, ДМСО-d6):  8,47 (s, 1Н), 7,89 (d, J 7,9, 1H), 7,83 (s, 1H), 7,64 (d, J 7,4, 2H), 7,49 (d, J 7,7, 2H), 7,40-7,43 (m, 2H), 6,99 (ушир.s, 2Н), 4,12 (m, 2,H), 3,42 (m, 2H), 3,12 (s, 3H), 2,86 (m, 1H), 2,07 (s, 3H), 0,69 (m, 2H), 0,56 (m, 2H). 8,47 (s, 1Н), 7,89 (d, J 7,9, 1H), 7,83 (s, 1H), 7,64 (d, J 7,4, 2H), 7,49 (d, J 7,7, 2H), 7,40-7,43 (m, 2H), 6,99 (ушир.s, 2Н), 4,12 (m, 2,H), 3,42 (m, 2H), 3,12 (s, 3H), 2,86 (m, 1H), 2,07 (s, 3H), 0,69 (m, 2H), 0,56 (m, 2H).
Пример 33
Получение 3-[5-амино-4-бензоил-3-(2-бензилоксиэтокси)пиразол-1-ил]-N-циклопропил-4-метилбензамида
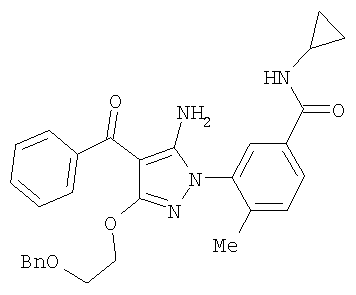 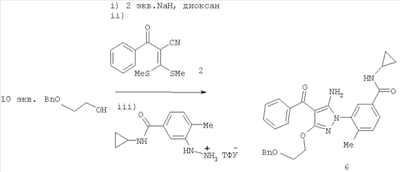
В раствор 2-бензилоксиэтанола (1,1 мл, 8,0 ммоля) в диоксане (2 мл) при 0°С добавляли сухой гидрид натрия (21 мг, 0,84 ммоля). Полученную реакционную смесь перемешивали при комнатной температуре в течение 35 мин. Затем добавляли 2-бензоил-3,3-бис-метилсульфанилакрилонитрил 2 (0,20 г, 0,80 ммоля), реакционную смесь перемешивали при температуре 80°С в течение 2,5 ч и охлаждали до комнатной температуры, добавляли трифторацетат N-циклопропил-3-гидразино-4-метилбензамида (0,26 г, 0,80 ммоля) и реакционную смесь нагревали при 80°С в течение еще 8,5 ч. После охлаждения реакционной смеси до комнатной температуры растворитель удаляли в вакууме. Полученный остаток разбавляли насыщенным раствором NaHCO3 и три раза экстрагировали EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали экспресс-хроматографией (SiO2, элюент: градиент EtOAc/гексан, от 60% до 85%). Полученный продукт очищали промывкой теплым EtOAc, при этом получали требуемый 3-[5-амино-4-бензоил-3-(2-бензилоксиэтокси)пиразол-1-ил]-N-циклопропил-4-метилбензамид 6 в виде твердого вещества грязно-белого цвета (74 мг, 18%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,57 мин. МС: m/z 511,2
[M+H]+.
1Н ЯМР (ДМСО-d6, 300 МГц)  8,49 (d, J 4,0 Гц, 1Н), 7,90 (d, J 8,0 Гц, 1Н), 7,85 (s, 1Н), 7,66 (d, J 7,1 Гц, 2Н), 7,49 (m, 2H), 7,27-7,40 (m, 5Н), 7,22 (d, J 6,7 Гц, 2H), 7,02 (ушир.s, 2H), 4,34 (s, 2H), 4,19 (m, 2H), 3,57 (m, 2H), 2,87 (m, 1Н), 2,17 (s, 3H), 0,69 (m, 2H), 0,59 (m, 2H). 8,49 (d, J 4,0 Гц, 1Н), 7,90 (d, J 8,0 Гц, 1Н), 7,85 (s, 1Н), 7,66 (d, J 7,1 Гц, 2Н), 7,49 (m, 2H), 7,27-7,40 (m, 5Н), 7,22 (d, J 6,7 Гц, 2H), 7,02 (ушир.s, 2H), 4,34 (s, 2H), 4,19 (m, 2H), 3,57 (m, 2H), 2,87 (m, 1Н), 2,17 (s, 3H), 0,69 (m, 2H), 0,59 (m, 2H).
Пример 34
Получение трет-бутилового эфира 4-[5-амино-4-бензоил-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-3-илокси]пиперидин-
1-карбоновой кислоты
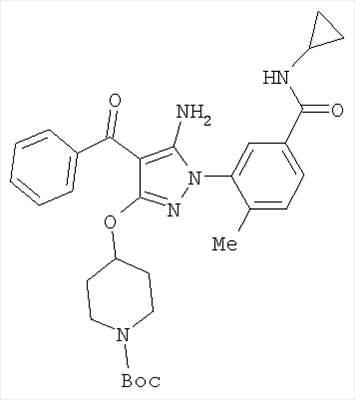
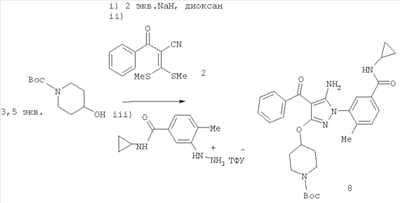
В раствор трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты 7 (0,565 г, 2,81 ммоля) в диоксане (2 мл) при 0°С добавляли сухой гидрид натрия (41,0 мг, 1,60 ммоля). Полученную реакционную смесь перемешивали при комнатной температуре в течение 45 мин. Затем добавляли 2-бензоил-3,3-бис-метилсульфанилакрилонитрил 2 (0,20 г, 0,80 ммоля), реакционную смесь перемешивали при температуре 65°С в течение 4 ч и охлаждали до комнатной температуры, добавляли трифторацетат N-циклопропил-3-гидразино-4-метилбензамида (0,26 г, 0,80 ммоля) и реакционную смесь нагревали при 80°С в течение еще 3 ч. После охлаждения реакционной смеси до комнатной температуры растворитель удаляли в вакууме. Полученный остаток разбавляли насыщенным раствором NaHCO3 и три раза экстрагировали EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали экспресс-хроматографией (SiO2, элюент: градиент EtOAc/гексан, от 65% до 85%). Полученный продукт очищали промывкой теплым EtOAc, при этом получали требуемый трет-бутиловый эфир 4-[5-амино-4-бензоил-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-3-илокси]пиперидин-
1-карбоновой кислоты 8 в виде твердого вещества грязно-белого цвета (70 мг, 16%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,63 мин. МС: m/z 559,9 [М+Н]+.
1H ЯМР (ДМСО-d6, 300 МГц)  8,49 (d, J 3,6 Гц, 1Н), 7,90 (d, J 8,1 Гц, 1Н), 7,84 (s, 1Н), 7,59 (d, J 7,7 Гц, 2Н), 7,40-7,51 (m, 4H), 6,99 (ушир.s, 2H), 4,75 (m, 1Н), 3,18 (m, 2H), 2,99 (m, 2H), 2,87 (m, 1Н), 2,19 (s, 3H), 1,68 (m, 2H), 1,43 (m, 2H), 1,37 (s, 9H), 0,71 (m, 2H), 0,58 (m, 2H). 8,49 (d, J 3,6 Гц, 1Н), 7,90 (d, J 8,1 Гц, 1Н), 7,84 (s, 1Н), 7,59 (d, J 7,7 Гц, 2Н), 7,40-7,51 (m, 4H), 6,99 (ушир.s, 2H), 4,75 (m, 1Н), 3,18 (m, 2H), 2,99 (m, 2H), 2,87 (m, 1Н), 2,19 (s, 3H), 1,68 (m, 2H), 1,43 (m, 2H), 1,37 (s, 9H), 0,71 (m, 2H), 0,58 (m, 2H).
Пример 35
Получение трифторацетата 3-[5-амино-4-бензоил-3-(пиперидин-4-илокси)пиразол-1-ил]-N-циклопропил-4-метилбензамида
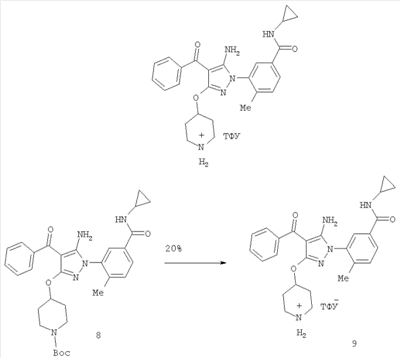
В раствор трет-бутилового эфира 4-[5-амино-4-бензоил-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-3-илокси]пиперидин-
1-карбоновой кислоты 8 (5,0 мг, 0,0089 ммоля) в дихлорметане (2,0 мл) добавляли трифторуксусную кислоту (0,5 мл). Полученную реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Летучие компоненты удаляли в вакууме и остаток промывали эфиром и небольшим количеством EtOAc, при этом получали требуемый трифторацетат 3-[5-амино-4-бензоил-3-(пиперидин-4-илокси)пиразол-1-ил]-N-циклопропил-4-метилбензамида 9 в виде твердого вещества белого цвета (3.0 мг, 59%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,75 мин. МС: m/z 460,1 [М+Н]+.
1Н ЯМР (ДМСО-d6, 300 МГц)  8,50 (d, J 4,0 Гц, 1Н), 8,33 (ушир.s, 2H), 7,90 (d, J 8,0 Гц, 1Н), 7,83 (s, 1Н), 7,62 (d, J 7,0 Гц, 2H), 7,44-7,52 (m, 4H), 7,03 (ушир.s, 2H), 4,82 (m, 1Н), 2,97 (m, 2H), 2,85 (m, 1Н), 2,73 (m, 2H), 2,27 (s, 3H), 1,91 (m, 2H), 1,73 (m, 2H), 0,71 (m, 2H), 0,57 (m, 2H). 8,50 (d, J 4,0 Гц, 1Н), 8,33 (ушир.s, 2H), 7,90 (d, J 8,0 Гц, 1Н), 7,83 (s, 1Н), 7,62 (d, J 7,0 Гц, 2H), 7,44-7,52 (m, 4H), 7,03 (ушир.s, 2H), 4,82 (m, 1Н), 2,97 (m, 2H), 2,85 (m, 1Н), 2,73 (m, 2H), 2,27 (s, 3H), 1,91 (m, 2H), 1,73 (m, 2H), 0,71 (m, 2H), 0,57 (m, 2H).
Пример 36
Получение 3-(5-амино-4-бензоил-3-метилсульфанилпиразол-1-ил)-N-циклопропил-4-метилбензамида
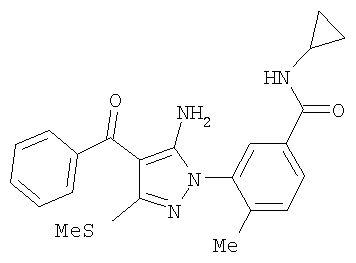
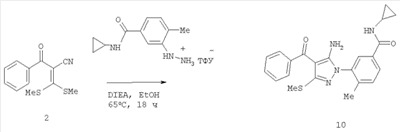
В раствор бензоил-3,3-бис-метилсульфанилакрилонитрила 2 (0,218 г, 0,874 ммоля) в этаноле (5 мл) добавляли трифторацетат N-циклопропил-3-гидразино-4-метилбензамида (0,243 г, 0,874 ммоля) и диизопропилэтиламин (0,152 мл, 0,874 ммоля). Полученную смесь нагревали при 65°С в течение 18 ч, затем охлаждали до комнатной температуры и растворитель удаляли в вакууме. Полученный остаток разбавляли насыщенным раствором NaHCO3 и три раза экстрагировали EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали экспресс-хроматографией (SiO2, элюент: градиент EtOAc/гексан, от 65% до 100%). Полученный продукт очищали промывкой теплым EtOAc и гексаном, при этом получали требуемый 3-(5-амино-4-бензоил-3-метилсульфанилпиразол-1-ил)-N-циклопропил-4-метилбензамид 10 в виде твердого вещества грязно-белого цвета (57 мг, 16%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,34 мин. МС: m/z 407,1
[M+H]+.
1Н ЯМР (ДМСО-d6, 300 МГц)  8,50 (d, J 4,0 Гц, 1Н), 7,93 (dd, J 1,2, 7,9 Гц, 1Н), 7,86 (s, 1Н), 7,45-7,57 (m, 6H), 6,85 (ушир.s, 2Н), 2,88 (m, 1Н), 2,23 (s, 3H), 2,18 (s, 3H), 0,69 (m, 2Н), 0,58 (m, 2Н). 8,50 (d, J 4,0 Гц, 1Н), 7,93 (dd, J 1,2, 7,9 Гц, 1Н), 7,86 (s, 1Н), 7,45-7,57 (m, 6H), 6,85 (ушир.s, 2Н), 2,88 (m, 1Н), 2,23 (s, 3H), 2,18 (s, 3H), 0,69 (m, 2Н), 0,58 (m, 2Н).
13С ЯМР (ДМСО-d6, 125 МГц)  189,3, 165,9, 152,8, 148,0, 140,4, 139,3, 135,4, 132,9, 131,2, 130,6, 128,4, 128.1, 127,2, 126,6, 102,0, 23,0, 17,3, 13,4, 5,6. 189,3, 165,9, 152,8, 148,0, 140,4, 139,3, 135,4, 132,9, 131,2, 130,6, 128,4, 128.1, 127,2, 126,6, 102,0, 23,0, 17,3, 13,4, 5,6.
Пример 37
Получение 3-(5-амино-4-бензоил-3-метансульфонилпиразол-1-ил)-N-циклопропил-4-метилбензамида
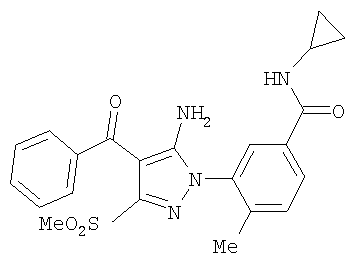 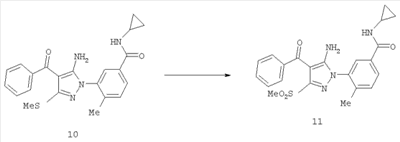
В суспензию 3-(5-амино-4-бензоил-3-метилсульфанилпиразол-1-ил)-N-циклопропил-4-метилбензамида 10 (40 мг, 0,098 ммоля) в дихлорметане (1 мл) добавляли 3-хлорпероксибензойную кислоту (70-75%, 53 мг, 0,22 ммоля). Полученный раствор перемешивали при комнатной температуре в течение 2 ч, а затем выдерживали при 4°С в течение ночи. При нагревании до комнатной температуры в растворе наблюдалось выпадение осадка. Твердое вещество белого цвета собирали на пористом фильтре и промывали дихлорметаном и эфиром, при этом получали требуемый 3-(5-амино-4-бензоил-3-метансульфонилпиразол-1-ил)-N-циклопропил-4-метилбензамид 11 (27 мг, 63%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,98 мин. МС: m/z 439,08 [М+Н]+.
1H ЯМР (ДМСО-d6, 300 МГц)  8,53 (d, J 3,7 Гц, 1Н), 7,97 (d, J 8,1 Гц, 1Н), 7,92 (s, 1Н), 7,76 (d, J 7,2 Гц, 1Н), 7,48-7,64 (m, 5H), 6,30 (ушир.s, 2Н), 3,29 (s 3H), 2,88 (m, 1Н), 2,17 (s, 3H), 0,69 (m, 2Н), 0,58 (m, 2Н). 8,53 (d, J 3,7 Гц, 1Н), 7,97 (d, J 8,1 Гц, 1Н), 7,92 (s, 1Н), 7,76 (d, J 7,2 Гц, 1Н), 7,48-7,64 (m, 5H), 6,30 (ушир.s, 2Н), 3,29 (s 3H), 2,88 (m, 1Н), 2,17 (s, 3H), 0,69 (m, 2Н), 0,58 (m, 2Н).
Пример 38
Получение амида 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты
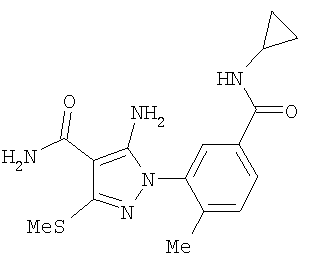 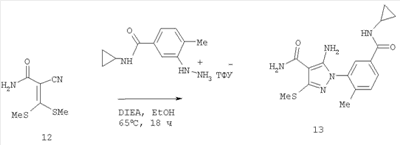
В раствор 2-циано-3,3-бис-метилсульфанилакриламида 12 (100 мг, 0,574 ммоля) в этаноле (5 мл) добавляли трифторацетат N-циклопропил-3-гидразино-4-метилбензамида (0,183 г, 0,574 ммоля) и диизопропилэтиламин (0,100 мл, 0,574 ммоля). Полученную смесь нагревали при 65°С в течение 18 ч, затем охлаждали до комнатной температуры и растворитель удаляли в вакууме. В полученный остаток добавляли EtOAc, при этом наблюдалось выпадение осадка. Твердое вещество собирали на пористом фильтре и промывали EtOAc и эфиром, при этом получали требуемый амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты 13. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,98 мин. МС: m/z 439,08 [М+Н]+.
1H ЯМР (ДМСО-d6, 500 МГц)  8,47 (d, J 3,7 Гц, 1Н), 7,90 (d. J 7,9 Гц, 1Н), 7,78 (s, 1Н), 7,49 (d, J 8,0 Гц, 1Н), 6,81 (ушир.s, 2H), 6,30 (s, 2H), 2,86 (m, 1Н), 2,45 (s, 3H), 2,11 (s, 3H), 0,68 (m, 2H), 0,57 (m, 2H). 8,47 (d, J 3,7 Гц, 1Н), 7,90 (d. J 7,9 Гц, 1Н), 7,78 (s, 1Н), 7,49 (d, J 8,0 Гц, 1Н), 6,81 (ушир.s, 2H), 6,30 (s, 2H), 2,86 (m, 1Н), 2,45 (s, 3H), 2,11 (s, 3H), 0,68 (m, 2H), 0,57 (m, 2H).
Пример 39
Получение амида 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метансульфонил-1Н-пиразол-4-карбоновой кислоты
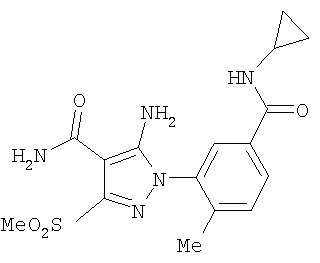
 В суспензию амида 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты 13 (100 мг, 0,289 ммоля) в дихлорметане (3 мл) добавляли 3-хлорпероксибензойную кислоту (70-75%, 157 мг, 0,637 ммоля). Полученный прозрачный раствор перемешивали при комнатной температуре в течение 16 ч, а затем добавляли насыщенный раствор NaHCO3 и реакционную смесь интенсивно перемешивали в течение мин. Полученную суспензию фильтровали на пористом фильтре и полученное твердое вещество три раза промывали Н2О и три раза эфиром, при этом получали требуемый амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метансульфонил-1Н-пиразол-4-карбоновой кислоты 14 в виде твердого вещества белого цвета (87 мг, 80%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,66 мин. МС: m/z 378,1 [М+Н]+. В суспензию амида 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты 13 (100 мг, 0,289 ммоля) в дихлорметане (3 мл) добавляли 3-хлорпероксибензойную кислоту (70-75%, 157 мг, 0,637 ммоля). Полученный прозрачный раствор перемешивали при комнатной температуре в течение 16 ч, а затем добавляли насыщенный раствор NaHCO3 и реакционную смесь интенсивно перемешивали в течение мин. Полученную суспензию фильтровали на пористом фильтре и полученное твердое вещество три раза промывали Н2О и три раза эфиром, при этом получали требуемый амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метансульфонил-1Н-пиразол-4-карбоновой кислоты 14 в виде твердого вещества белого цвета (87 мг, 80%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,66 мин. МС: m/z 378,1 [М+Н]+.
1H ЯМР (ДМСО-d6, 500 МГц)  8,49 (s, 1H), 7,95 (d, J 7,6 Гц, 1Н), 7,83 (s, 1H), 7,53 (d, J 7,8 Гц, 1H), 7,46 (ушир.s, 2Н), 6,74 (ушир.s, 2Н), 3,40 (s, 3H), 2,84 (m, 1H), 2,09 (s, 3H), 0,68 (m, 2Н). 0,55 (m, 2Н). 8,49 (s, 1H), 7,95 (d, J 7,6 Гц, 1Н), 7,83 (s, 1H), 7,53 (d, J 7,8 Гц, 1H), 7,46 (ушир.s, 2Н), 6,74 (ушир.s, 2Н), 3,40 (s, 3H), 2,84 (m, 1H), 2,09 (s, 3H), 0,68 (m, 2Н). 0,55 (m, 2Н).
Пример 40
Получение этилового эфира 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты
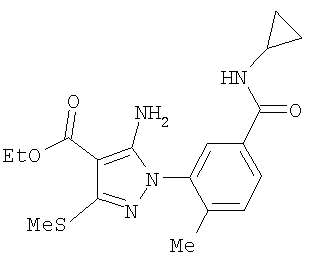 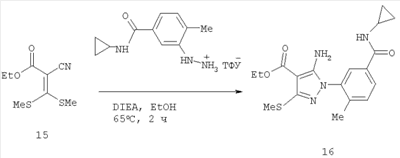
В раствор этилового эфира 2-циано-3,3-бис-метилсульфанилакриловой кислоты 15 (78,0 мг, 0,359 ммоля) в этаноле (3 мл) добавляли трифторацетат N-циклопропил-3-гидразино-4-метилбензамида (0,100 г, 0,313 ммоля) и диизопропилэтиламин (0,0626 мл, 0,359 ммоля). Полученную смесь нагревали при 65°С в течение 2 ч, затем охлаждали до комнатной температуры и растворитель удаляли в вакууме. В полученный остаток добавляли EtOAc и эфир, при этом наблюдалось выпадение осадка. Твердое вещество собирали на пористом фильтре и промывали EtOAc и эфиром, при этом получали требуемый этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1H-пиразол-4-карбоновой кислоты 16 в виде твердого вещества белого цвета (80 мг, 59%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,18 мин. МС: m/z 375,1 [М+Н]+.
1H ЯМР (ДМСО-d6, 300 МГц)  8,47 (d, J 3,7 Гц, 1Н), 7,90 (d, J 7,9 Гц, 1Н), 7,78 (s, 1Н), 7,49 (d, J 8,0 Гц, 1Н), 6,81 (ушир.s, 2H), 6,30 (s, 2H), 2,86 (m, 1Н), 2,45 (s, 3H), 2,11 (s, 3H), 0,68 (m, 2H), 0,57 (m, 2H). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,66 мин. МС m/z 378,1 [М+Н]+. 8,47 (d, J 3,7 Гц, 1Н), 7,90 (d, J 7,9 Гц, 1Н), 7,78 (s, 1Н), 7,49 (d, J 8,0 Гц, 1Н), 6,81 (ушир.s, 2H), 6,30 (s, 2H), 2,86 (m, 1Н), 2,45 (s, 3H), 2,11 (s, 3H), 0,68 (m, 2H), 0,57 (m, 2H). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,66 мин. МС m/z 378,1 [М+Н]+.
1Н ЯМР (ДМСО-d6, 300 МГц)  8,50 (d, J 2,6 Гц, 1Н), 7,92 (dd, J 7,9, Гц, 1Н), 7,81 (s, 1Н), 7,51 (d, J 7,9 Гц, 1Н), 6,24 (ушир.s, 2H), 4,22 (q, J 6,6 Гц, 2H), 2,88 (m, 1H), 2,35 (s, 3H), 2,14 (s, 3H), 1,29 (t, J 6,7 Гц, 3H), 0,72 (m, 2H), 0,58 (m, 2H). 8,50 (d, J 2,6 Гц, 1Н), 7,92 (dd, J 7,9, Гц, 1Н), 7,81 (s, 1Н), 7,51 (d, J 7,9 Гц, 1Н), 6,24 (ушир.s, 2H), 4,22 (q, J 6,6 Гц, 2H), 2,88 (m, 1H), 2,35 (s, 3H), 2,14 (s, 3H), 1,29 (t, J 6,7 Гц, 3H), 0,72 (m, 2H), 0,58 (m, 2H).
13С ЯМР (ДМСО-d6 125 МГц)  166,0, 163,1, 151,8, 148,5, 139,4, 135,8, 132,9, 131,1, 128,2, 126,7, 91,3, 58,9, 23,0, 17,2, 14,4, 12,3, 5,6. 166,0, 163,1, 151,8, 148,5, 139,4, 135,8, 132,9, 131,1, 128,2, 126,7, 91,3, 58,9, 23,0, 17,2, 14,4, 12,3, 5,6.
Пример 41
Получение 3-[5-амино-4-(3-хлорбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
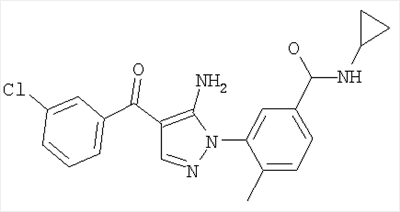
А. 2-(3-Хлорбензоил)-3-фениламиноакрилонитрил
Раствор 3-хлорбензоилацетонитрила (476 мг, 2,66 ммоля, 1,0 экв.) и дифенилформамидина (522 мг, 2,66 ммоля, 1,0 экв.) в 25 мл толуола перемешивали при комнатной температуре в течение 2 ч, а затем нагревали при 100°С в течение ночи. Полученный раствор охлаждали и разбавляли гексаном. Полученное твердое вещество отфильтровывали и сушили, при этом получали требуемый продукт (566 мг, 75%). ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 2,97 мин. МС: m/z 283,2 [M+H]+.
1H ЯМР (CDCl3)  8,06 (d, J 13,2 Гц, 1H), 7,85 (m, 2H), 7,46 (m, 4H), 7,27 (m, 4H). 8,06 (d, J 13,2 Гц, 1H), 7,85 (m, 2H), 7,46 (m, 4H), 7,27 (m, 4H).
Б. 3-[5-Амино-4-(3-хлорбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
Раствор 2-(3-хлорбензоил)-3-фениламиноакрилонитрила (63 мг, 0,22 ммоля, 1,0 экв.), трифторацетата N-циклопропил-3-гидразино-4-метилбензамида (72 мг, 0,22 ммоля, 1.экв.) и триэтиламина (31 мкл, 0,22 ммоля, 1,0 экв.) в 10 мл этанола нагревали при 65°С в течение 20 ч. После охлаждения реакционную смесь концентрировали и остаток очищали экспресс-хроматографией на силикагеле для удаления побочных продуктов (элюент:гексан/этилацетат, 7:3), а затем для выделения указанного в заголовке соединения (элюент:этилацетат/гексан, 3:2) в виде твердого вещества коричневого цвета (33 мг, 38%). ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 2,35 мин. МС: m/z 395,1 [М+Н]+.
1Н ЯМР (CD3OD)  7,92 (dd, J 7,2, Гц, 1Н), 7,77 (m, 4H), 7,55 (m, 3H), 2,85 (m, 1Н), 2,23 (s, 3H), 0,80 (d, J 5,5 Гц, 2Н), 0,63 (d, J 2,0 Гц, 2Н). 7,92 (dd, J 7,2, Гц, 1Н), 7,77 (m, 4H), 7,55 (m, 3H), 2,85 (m, 1Н), 2,23 (s, 3H), 0,80 (d, J 5,5 Гц, 2Н), 0,63 (d, J 2,0 Гц, 2Н).
13С ЯМР (CD3OD)  187,1, 168,1, 151,9, 141,0, 140,9, 140,0, 134,9, 133,8, 132,8, 130,9, 130,5, 129,4, 128,1, 127,0, 126,1, 125,6, 102,6, 22,1, 15,7, 4,6. 187,1, 168,1, 151,9, 141,0, 140,9, 140,0, 134,9, 133,8, 132,8, 130,9, 130,5, 129,4, 128,1, 127,0, 126,1, 125,6, 102,6, 22,1, 15,7, 4,6.
Пример 42
Получение 3-[5-амино-4-(3-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
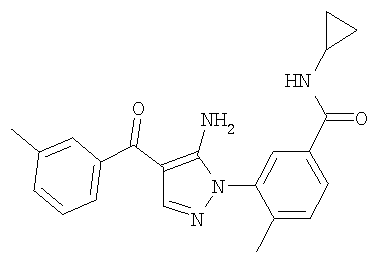
Указанное соединение получали аналогично тому, как описано в примере 41, но при замене 3-хлорбензоилацетонитрила на 3-метилбензоилацетонитрил. ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 2,27 мин. МС: m/z 375,16 [M+H]+.
1H ЯМР (CD3OD)  7,92 (d, J 7,0 Гц, 1Н), 7,83 (s, 1Н), 7,80 (s, 1Н), 7,57 (m, 3H), 7,42 (m, 2Н), 2,85 (гептет, J 3,6 Гц, 1Н), 2,45 (s, 3H), 2,23 (s, 3H), 0,80 (d, J 5.4 Гц, 2Н), 0,64 (s, 2Н). 7,92 (d, J 7,0 Гц, 1Н), 7,83 (s, 1Н), 7,80 (s, 1Н), 7,57 (m, 3H), 7,42 (m, 2Н), 2,85 (гептет, J 3,6 Гц, 1Н), 2,45 (s, 3H), 2,23 (s, 3H), 0,80 (d, J 5.4 Гц, 2Н), 0,64 (s, 2Н).
Пример 43
Получение 3-[5-амино-4-(2-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
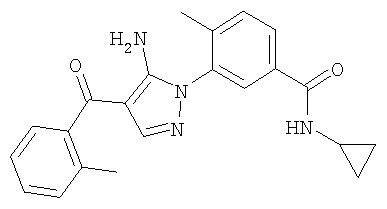
Указанное соединение получали аналогично тому, как описано в примере 41, но при замене 3-хлорбензоилацетонитрила на 2-метилбензоилацетонитрил. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,21 мин. МС: m/z 375,15 [М+Н]+.
Пример 44
Получение 3-[5-амино-4-(2-метоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
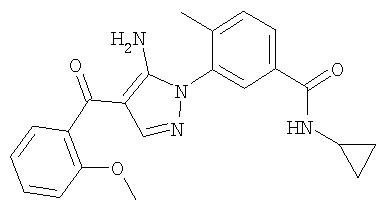
Указанное соединение получали аналогично тому, как описано в примере 41, но при замене 3-хлорбензоилацетонитрила на 2-метоксибензоилацетонитрил. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,03 мин. МС: m/z 391,16 [М+Н]+.
Пример 45
Получение 3-[5-амино-4-(4-хлорбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
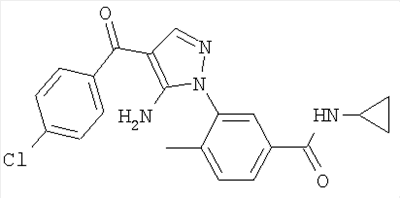
Указанное соединение получали аналогично тому, как описано в примере 41, но при замене 3-хлорбензоилацетонитрила на 3-метилбензоилацетонитрил. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,65 мин. МС: m/z 394,2 [М+Н]+.
Пример 46
Получение 3-[5-амино-4-(2-хлорбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
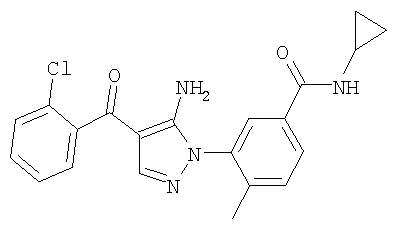
А. 2-(2-Хлорбензоил)-3-фениламиноакрилонитрил
Раствор 2-хлорбензоилацетонитрила (1,0 г, 5,6 ммоля, 1,0 экв.) и дифенилформамидина (1,10 г, 5,6 ммоля, 1,0 экв.) в 50 мл толуола нагревали при 85°С в течение ночи. Источник нагревания удаляли, при этом требуемый продукт медленно выпадал в осадок из раствора. Полученное твердое вещество отфильтровывали и сушили, при этом получали требуемый продукт (826 мг, 52%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 3,13 мин. МС: m/z 283,2 [М+Н]+.
Б. 3-[5-Амино-4-(2-хлорбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
Раствор 2-(2-хлорбензоил)-3-фениламиноакрилонитрила (93 мг, 0,33 ммоля, 1,0 экв.), трифторацетата Н-циклопропил-3-гидразино-4-метилбензамида (104 мг, 0,33 ммоля, 1 экв.) и триэтиламина (31 мкл, 0,22 ммоля, 1,0 экв.) в 20 мл этанола нагревали при 60°С в течение 48 ч. После охлаждения реакционную смесь концентрировали и остаток растворяли в минимальном количестве этилацетата, добавляли 100 мл диэтилового эфира, полученный осадок отфильтровывали и сушили, при этом получали требуемый продукт (50 мг, 39%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,51 мин. МС: m/z 395,1 [М+Н]+.
1Н ЯМР (ДМСО)  8,50 (d, J 3,8 Гц, 1Н), 7,93 (d, J 8,0 Гц, 1H), 7,84 (s, 1H), 7,57 (m, 5H), 7,32 (s, 1H), 7.01 (s, 2H), 3,37 (m, 2H), 2,86 (m, 1H), 2,14 (s, 3H), 1,09 (t, 2H), 0,68 (m, 2H), 0,58 (m, 2H). 8,50 (d, J 3,8 Гц, 1Н), 7,93 (d, J 8,0 Гц, 1H), 7,84 (s, 1H), 7,57 (m, 5H), 7,32 (s, 1H), 7.01 (s, 2H), 3,37 (m, 2H), 2,86 (m, 1H), 2,14 (s, 3H), 1,09 (t, 2H), 0,68 (m, 2H), 0,58 (m, 2H).
Пример 47
Получение 3-[5-амино-4-(3-метоксибензоил)пиразол-1-ил]-4,N-циклопропил-4-метилбензамида
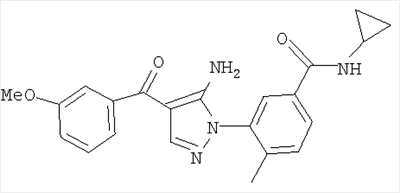
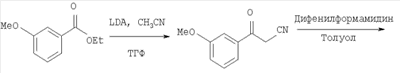 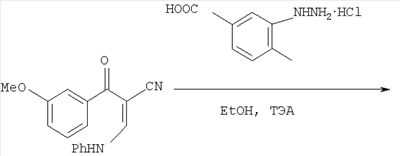
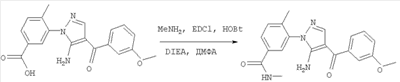
А. 3-Метоксибензоилацетонитрил
В раствор этилового эфира 3-метоксибензойной кислоты (3,05 мл, 18,6 ммоля, 1,0 экв.) и ацетонитрила (1,19 мл, 22,9 ммоля, 1,23 экв.) в 5 мл ТГФ при -50°С в атмосфере N2 при перемешивании через трубку добавляли свежеприготовленный раствор LDA (диизопропиламин, 5,3 мл, 38,0 ммоля, 2,04 экв. и 2,5 М н-бутиллития в гексане, 15,25 мл, 38,0 ммоля, 2,04 экв.). Реакционную смесь перемешивали при указанной температуре в течение 3 ч, а затем нагревали до 0°С в течение 1 ч. Реакцию останавливали добавлением 10 мл насыщенного раствора NH4Cl и реакционную смесь нагревали до комнатной температуры. Полученную смесь экстрагировали EtOAc, органический слой промывали водой и солевым раствором, сушили (Na2SO4) и концентрировали. Остаток очищали экспресс-хроматографией на силикагеле, при этом получали продукт в виде твердого вещества грязно-белого цвета.
Б. 2-(3-Метоксибензоил)-3-фениламиноакрилонитрил
Раствор 3-метоксибензоилацетонитрила (1,20 г, 68,5 ммоля, 1,0 экв.) и дифенилформамидина (1,34 г, 68,5 ммоля, 1,0 экв.) в 25 мл толуола перемешивали при комнатной температуре в течение 2 ч, а затем нагревали при 100°С в течение ночи. Полученный раствор охлаждали и разбавляли гексаном. Полученное твердое вещество отфильтровывали и сушили, при этом получали требуемый продукт. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 3,05 мин. МС: m/z 279,2 [М+Н]+.
В. 3-[5-Амино-4-(3-метоксибензоил)пиразол-1-ил]-4-метилбензойная кислота
Раствор 2-(3-хлорбензоил)-3-фениламиноакрилонитрила (63 мг, 0,22 ммоля, 1,0 экв.), гидрохлорида 3-гидразино-4-метилбензойной кислоты (72 мг, 0,22 ммоля, 1 экв.) и триэтиламина (31 мкл, 0,22 ммоля, 1,0 экв.) в 10 мл этанола нагревали при 65°С в течение 20 ч. После охлаждения реакционную смесь концентрировали и остаток очищали экспресс-хроматографией на силикагеле для удаления побочных продуктов (элюент:гексан/этилацетат, 7:3), а затем для выделения указанного в заголовке соединения (элюент:этилацетат/гексан, 3:2) в виде твердого вещества коричневого цвета (15 мг, 32%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,13 мин. МС: m/z 352,2 [М+Н]+.
Г. 3-[5-Амино-4-(3-метоксибензоил)пиразол-1-ил]-4,N-метилбензамид
В раствор 3-[5-амино-4-(3-метоксибензоил)пиразол-1-ил]-4-метилбензойной кислоты (50 мг, 0,14 ммоля, 1,0 экв.) в 10 мл ДМФА при перемешивании добавляли EDCI (41 мг, 0,21 ммоля, 1,5 экв.), HOBt (29 мг, 1,5 ммоля, 2,0 экв.) и диизопропилэтиламин (55 мг, 0,43 ммоля, 3,0 экв.), раствор перемешивали при комнатной температуре в течение 15 мин, затем добавляли гидрохлорид метиламина (13 мг, 0,19 ммоля, 1,5 экв.) и реакционную смесь перемешивали в течение 1 ч. Полученную реакционную смесь разбавляли EtOAc (300 мл) и промывали водой (2×25 мл), солевым раствором (25 мл), сушили (Na2SO4) и концентрировали. Остаток очищали экспресс-хроматографией на силикагеле, при этом получали продукт (15 мг, 32%) в виде твердого вещества коричневого цвета. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,97 мин. МС: m/z 365,2 [М+Н]+.
Пример 48
Получение этилового эфира 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
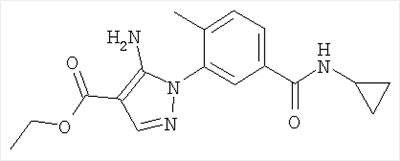
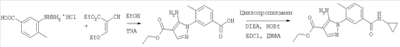
А. Этиловый эфир 5-амино-1-(5-карбокси-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
В раствор гидрохлорида 3-гидразино-4-метилбензойной кислоты (пример 3А, 478 мг, 2,36 ммоля, 1,0 экв.) в 20 мл этанола добавляли этил(этоксиметилен)цианоакрилат (399 мг, 2,36 ммоля, 1,0 экв.) и триэтиламин (329 мкл, 2,36 ммоля, 1,0 экв.), полученную смесь при перемешивании нагревали при 65°С в течение 5 ч. После выдерживания при комнатной температуре в течение ночи добавляли еще одну порцию гидрохлорида 3-гидразино-4-метилбензойной кислоты (159 мг, 0,78 ммоля, 0,3 экв.) и триэтиламина (110 мкл, 0,78 ммоля, 0,3 экв.), нагревали в течение 2,5 ч. Полученную смесь охлаждали до комнатной температуры и концентрировали. Неочищенный остаток очищали экспресс-хроматографией на силикагеле для удаления побочных продуктов (элюент: гексан/EtOAc, от 7:3 до 1:1), а затем для выделения указанного в заголовке соединения (элюент: от EtOAc до EtOAc/МеОН, 9:1) в виде твердого вещества коричневого цвета (464 мг, 68%). ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 1,87 мин. МС: m/z 290,1 [М+Н]+.
1H ЯМР (CD3OD)  8,08 (d, J 7,0 Гц, 1H), 7,93 (s, 1H), 7,76 (s, 1H), 7,54 (d, J 8,0 Гц, 1H), 4,29 (q, J 7,1 Гц, 2H), 2,19 (s, 3H), 1,35 (d, J 7,1 Гц, 3H). 8,08 (d, J 7,0 Гц, 1H), 7,93 (s, 1H), 7,76 (s, 1H), 7,54 (d, J 8,0 Гц, 1H), 4,29 (q, J 7,1 Гц, 2H), 2,19 (s, 3H), 1,35 (d, J 7,1 Гц, 3H).
13С ЯМР (CD3OD)  166,5, 163,8, 150,4, 141,7, 139,9, 135,3, 130,8, 129,5, 128,6, 93,8, 58,8, 15,8, 12,9. 166,5, 163,8, 150,4, 141,7, 139,9, 135,3, 130,8, 129,5, 128,6, 93,8, 58,8, 15,8, 12,9.
Б. Этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
Раствор этилового эфира 5-амино-1-(5-карбокси-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты (47 мг, 0,16 ммоля, 1,0 экв.), EDCl (62 мг, 0,32 ммоля, 2,0 экв.), HOBt (44 мг, 0,32 ммоля, 2,0 экв.) и диизопропилэтиламина (119 мкл, 0,32 ммоля, 2,0 экв.) в ДМФА (5 мл) перемешивали при КТ в течение 15 мин, затем добавляли циклопропиламин (23 мкл, 0,32 ммоля, 2,0 экв.). После перемешивания в течение ночи раствор разбавляли EtOAc и водой, органический слой промывали водой и солевым раствором, сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/гексан, 8:2), при этом получали продукт в виде бесцветного масла (42 мг, 79%). ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 1,84 мин. МС: m/z 329,09 [М+Н]+.
1H ЯМР (CD3OD)  7,96 (s, 1H, NH), 7,88 (d, J 7,9 Гц, 1H), 7,78 (s, 1H), 7,75 (s, 1H), 7,50 (d, J 8,0 Гц, 1H), 4,28 (q, J 7,1 Гц, 2Н), 2,83 (m, 1H), 2,16 (s, 3H), 1,35 (d, J 7,0 Гц, 3H), 0,78 (dd, J 12,3, 7,0 Гц, 2Н), 0,63 (dd, J 7,0, 4,5 Гц, 2Н). 7,96 (s, 1H, NH), 7,88 (d, J 7,9 Гц, 1H), 7,78 (s, 1H), 7,75 (s, 1H), 7,50 (d, J 8,0 Гц, 1H), 4,28 (q, J 7,1 Гц, 2Н), 2,83 (m, 1H), 2,16 (s, 3H), 1,35 (d, J 7,0 Гц, 3H), 0,78 (dd, J 12,3, 7,0 Гц, 2Н), 0,63 (dd, J 7,0, 4,5 Гц, 2Н).
13С ЯМР (CD3OD)  170,1, 165,8, 152,3, 142,1, 141,8, 137,2, 134,6, 132,8, 130,0, 128,2, 128,1, 95,8, 60,8, 24,1, 17,6, 14,9, 6,6. 170,1, 165,8, 152,3, 142,1, 141,8, 137,2, 134,6, 132,8, 130,0, 128,2, 128,1, 95,8, 60,8, 24,1, 17,6, 14,9, 6,6.
Пример 49
Получение этилового эфира 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метил-1Н-пиразол-4-карбоновой кислоты
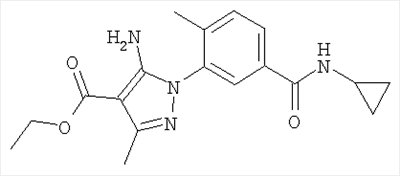
А. Этиловый эфир 5-амино-1-(5-карбокси-2-метилфенил)-3-метил-1Н-пиразол-4-карбоновой кислоты
В раствор гидрохлорида 3-гидразино-4-метилбензойной кислоты (пример 3А, 353 мг, 1,74 ммоля, 1,0 экв.) в 15 мл этанола добавляли этиловый эфир 2-циано-3-этоксибут-2-еновой кислоты (полученный, как описано в статье Xia и др., J. Med. Chem., 40, 4372, (1997), 319 мг, 1,746 ммоля, 1,0 экв.) и триэтиламин (242 мкл, 1,74 ммоля, 1,0 экв.), полученную смесь при перемешивании нагревали при 65°С в течение ночи. Смесь охлаждали до комнатной температуры и концентрировали. Неочищенный остаток очищали экспресс-хроматографией на силикагеле (нанесение в CH2Cl2), затем заполняли колонку и для удаления побочных продуктов использовали элюент: гексан/EtOAc, 6:4, а затем для выделения продукта (элюент: EtOAc/гексан, 8:2 и EtOAc/МеОН, 8:2) в виде твердого вещества коричневого цвета (464 мг, 68%). ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 1,97 мин. МС: m/z 304,1 [М+Н]+.
Б. Этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метил-1Н-пиразол-4-карбоновой кислоты
Раствор этилового эфира 5-амино-1-(5-карбокси-2-метилфенил)-3-метил-1Н-пиразол-4-карбоновой кислоты (150 мг, 0,49 ммоля, 1,0 экв.), EDCl (190 мг, 0,98 ммоля, 2,0 экв.), HOBt (134 мг, 0,98 ммоля, 2,0 экв.) и диизопропилэтиламина (362 мкл, 0,98 ммоля, 2,0 экв.) в ДМФА (5 мл) перемешивали при КТ в течение 15 мин, затем добавляли циклопропиламин (68 мкл, 0,98 ммоля, 2,0 экв.). После перемешивания в течение ночи раствор разбавляли EtOAc и водой, органический слой промывали водой (2 раза) и солевым раствором, сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали экспресс-хроматографией на силикагеле (элюент: градиент от EtOAc/гексан, 3:2 до 100% EtOAc), при этом получали продукт в виде твердого вещества белого цвета (29 мг, 17%). ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 1,97 мин. МС: m/z 343 [М+Н]+.
1H ЯМР (CD3OD)  7,87 (d, J 7,1 Гц, 1H), 7,76 (s, 1H), 7,50 (d, J 8,0 Гц, 1Н), 4,29 (q, J 7,0 Гц, 2Н), 2,84 (m, 1H), 2,34 (s, 3H), 2,18 (s, 3H), 1,36 (t, J 7,0 Гц, 3H), 0,79 (d, J 5,5 Гц, 2Н), 0,62 (s, 2Н). 7,87 (d, J 7,1 Гц, 1H), 7,76 (s, 1H), 7,50 (d, J 8,0 Гц, 1Н), 4,29 (q, J 7,0 Гц, 2Н), 2,84 (m, 1H), 2,34 (s, 3H), 2,18 (s, 3H), 1,36 (t, J 7,0 Гц, 3H), 0,79 (d, J 5,5 Гц, 2Н), 0,62 (s, 2Н).
13С ЯМР (CD3OD)  168,1, 164,4, 151,3, 149,8, 140,1, 135,2, 132,6, 130,7, 127,9, 126,3, 92,0, 58,6, 22,1, 15,7, 12,9, 12,6, 4,6. 168,1, 164,4, 151,3, 149,8, 140,1, 135,2, 132,6, 130,7, 127,9, 126,3, 92,0, 58,6, 22,1, 15,7, 12,9, 12,6, 4,6.
Пример 50
Получение этилового эфира 5-амино-3-[(3-хлорбензилкарбамоил)метокси]-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
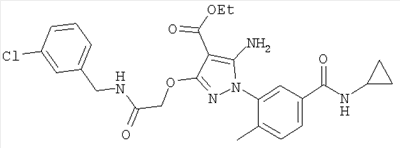
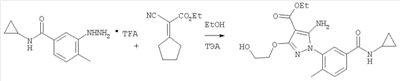
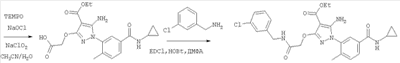
А. Этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-(2-гидроксиэтокси)-1Н-пиразол-4-карбоновой кислоты
Раствор этилового эфира циано[1,3]диоксолан-2-илиденуксусной кислоты (полученного, как описано в статье Neidlein и Kikelj, Synthesis, 981, (1988, 266 мг, 1,45 ммоля, 1,0 экв.), трифторацетата N-циклопропил-3-гидразино-4-метилбензамида (пример 6С, 463 мг, 1,45 ммоля, 1,0 экв.) и триэтиламина (405 мкл, 2,9 ммоля, 2,0 экв.) в 20 мл этанола нагревали при 65°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь концентрировали и остаток очищали экспресс-хроматографией на силикагеле (элюент: градиент от гексан/EtOAc, 1:1 до 100% EtOAc), при этом получали требуемое соединение в виде твердого вещества желто-коричневого цвета (350 мг, 62%). ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 1,59 мин. МС: m/z 389,06 [M+H]+.
1Н ЯМР (CD3OD)  7,87 (d, J 7,9 Гц, 1Н), 7,78 (s, 1H), 7,49 (d, J 7,8 Гц, 1Н), 4,29 (dd, J 14,9, 6,9 Гц, 2Н), 4,19 (d, J 4,3 Гц, 2Н), 3,84 (d, J 4,4, Гц, 2Н), 2,84 (m, 1Н), 2,22 (s, 3H), 1,35 (t, J 7,3 Гц, 3H), 0,81 (d, J 5,3 Гц, 2Н), 0,63 (s, 2Н). 7,87 (d, J 7,9 Гц, 1Н), 7,78 (s, 1H), 7,49 (d, J 7,8 Гц, 1Н), 4,29 (dd, J 14,9, 6,9 Гц, 2Н), 4,19 (d, J 4,3 Гц, 2Н), 3,84 (d, J 4,4, Гц, 2Н), 2,84 (m, 1Н), 2,22 (s, 3H), 1,35 (t, J 7,3 Гц, 3H), 0,81 (d, J 5,3 Гц, 2Н), 0,63 (s, 2Н).
Б. Этиловый эфир 5-амино-3-карбоксиметокси-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
В раствор спирта 50А (48 мг, 0,12 ммоля, 1,0 экв.) в 5 мл ацетонитрила при перемешивании добавляли 2,2′,6,6′-тетраметилпиперидинилоксил (TEMPO) (каталитическое количество) и полученный раствор нагревали до 35°С. Затем последовательно по каплям добавляли хлорит натрия (17 мг, 0,24 ммоля, 2,0 экв.) в воде (2 мл) и водный раствор гипохлорита натрия, разбавленный до 2%, (1 мл) нагревание продолжали в течение 24 ч, при этом раствор окрашивался в ярко-оранжевый цвет. Полученную реакционную смесь охлаждали до КТ и разбавляли водой, затем реакцию останавливали 1 М Na2SO3 и смесь перемешивали в течение 30 мин, промывали EtOAc, pH водного слоя доводили от 8 до 2 при добавлении 3 М HCl и экстрагировали CH2Cl2. Экстракты CH2Cl2 сушили и концентрировали, при этом получали продукт в виде твердого вещества желтого цвета. ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 1,70 мин. МС: m/z 403,02 [М+Н]+.
1Н ЯМР (CD2OD)  7,83 (d, J 7,9 Гц, 1H), 7,52 (s, 1H), 7,46 (d, J 7,9 Гц, 1Н), 4,73 (s, 2H), 4,19 (q, J 7,1 Гц, 2Н), 2,84 (m, 1H), 2,18 (s, 3H), 1,31 (t, J 7,0 Гц, 3H), 0,78 (d, J 6,1 Гц, 2H), 0,62 (s, 2H). 7,83 (d, J 7,9 Гц, 1H), 7,52 (s, 1H), 7,46 (d, J 7,9 Гц, 1Н), 4,73 (s, 2H), 4,19 (q, J 7,1 Гц, 2Н), 2,84 (m, 1H), 2,18 (s, 3H), 1,31 (t, J 7,0 Гц, 3H), 0,78 (d, J 6,1 Гц, 2H), 0,62 (s, 2H).
13С ЯМР (CD3OD)  171,1, 170,2, 168,4, 163,6, 159,7, 151,3, 140,5, 135,2, 132,5, 130,7, 127,6, 126,2, 80,9, 59,6, 58,7, 22,1, 15,8, 12,5, 4,6. 171,1, 170,2, 168,4, 163,6, 159,7, 151,3, 140,5, 135,2, 132,5, 130,7, 127,6, 126,2, 80,9, 59,6, 58,7, 22,1, 15,8, 12,5, 4,6.
В. Этиловый эфир 5-амино-3-[(3-хлорбензилкарбамоил)метокси]-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
В раствор кислоты 50В (28 мг, 0,7 ммоля, 1,0 экв.), EDCl (32 мг, 0,17 ммоля, 2,4 экв.), HOBt (22 мг, 0,16 ммоля, 2,4 экв.) в ДМФА (3,0 мл) при комнатной температуре добавляли 3-хлорбензиламин (18 мкл, 0,07 ммоля, 1,0 экв.) и полученную смесь перемешивали в течение ночи. Затем реакционную смесь разбавляли EtOAc, промывали водой (2 раза) солевым раствором, сушили (Na2SO4) и концентрировали. Остаток очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/гексан, 9:1), при этом получали продукт в виде бесцветного масла (16 мг, 44%). ЖХВР: (градиент 10-95% в течение 4 мин), в.у. 2,34 мин. МС: m/z 525,99 [М+Н]+.
1H ЯМР (CD3OD)  7,85 (d, J 7,9 Гц, 1H), 7,56 (s, 1H), 7,47 (d, J 8,0 Гц, 1H), 7,25 (m, 3H), 4,73 (s, 2H), 4,45 (s, 2H), 4,25 (q, J 7,0 Гц, 2H), 2,84 (m, 1H), 2,17 (s, 3H), 1,27 (t, J 7,0 Гц, 3H), 0,80 (dd, J 12,3, 6,7 Гц, 2H), 0,62 (d, J 2,2 Гц, 2H). 7,85 (d, J 7,9 Гц, 1H), 7,56 (s, 1H), 7,47 (d, J 8,0 Гц, 1H), 7,25 (m, 3H), 4,73 (s, 2H), 4,45 (s, 2H), 4,25 (q, J 7,0 Гц, 2H), 2,84 (m, 1H), 2,17 (s, 3H), 1,27 (t, J 7,0 Гц, 3H), 0,80 (dd, J 12,3, 6,7 Гц, 2H), 0,62 (d, J 2,2 Гц, 2H).
13С ЯМР (CD3OD)  168,9, 168,3, 163,4, 159,6, 151,1, 140,3, 140,1, 135,2, 133,6, 132,6, 130,8, 129,1, 127,7, 126,6, 126,4, 125,0, 66,3, 58,8, 41,1, 22,1, 15,9, 12,9, 4,6. 168,9, 168,3, 163,4, 159,6, 151,1, 140,3, 140,1, 135,2, 133,6, 132,6, 130,8, 129,1, 127,7, 126,6, 126,4, 125,0, 66,3, 58,8, 41,1, 22,1, 15,9, 12,9, 4,6.
Пример 51
Получение 3-(5-амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамида
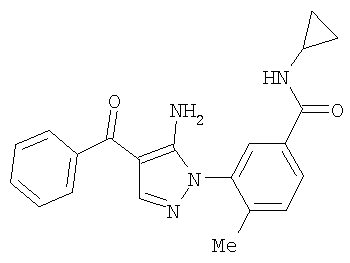
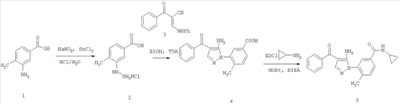
А. Гидрохлорид 3-гидразино-4-метилбензойной кислоты
Раствор 3-амино-4-метилбензойной кислоты 1 (100 г, 0,66 моля, 1,0 экв.) в воде (1,78 л) охлаждали до температуры 0-5°С, используя ледяную воду. При указанной температуре последовательно добавляли конц. HCl (1,78 л) и нитрит натрия (68,5 г, 0,99 моля, 1,5 экв.), полученную реакционную смесь перемешивали при 0-5°С в течение 1 ч. При той же температуре добавляли дигидрат хлорида олова (II) (336 г, 1,488 моля, 2,25 экв.) в конц. HCl (540 мл) и смесь перемешивали в течение 2 ч. Полученное твердое вещество отфильтровывали и промывали водой (3×500 мл), сушили в вакууме при 25-30°С в течение 15 ч, при этом получали неочищенный материал (110 г), который растворяли в этаноле (1 л) и перемешивали при 70°С в течение 1 ч. Полученный материал фильтровали в горячем состоянии, промывали этанолом (50 мл) и сушили на воздухе, при этом получали чистый гидразин 2 (60 г, 45%) в виде твердого вещества грязно-белого цвета.
Б. 3-(5-Амино-4-бензоилпиразол-1-ил)-4-метилбензойная кислота
В раствор гидразина 2 (59 г, 0,29 моля, 1,0 экв.) в этаноле (4,5 л) при перемешивании добавляли соединение 3 (65 г, 0,262 моля, 0,9 экв., полученное, как описано в статье Grothasu Davis, J. Am. Chem. Soc., 58, 1334 (1936)), и триэтиламин (29 г, 0,29 моля, 1,0 экв.), полученную смесь нагревали при 65°С. Образовавшуюся гомогенную смесь перемешивали при 65°С в течение 4 ч, при этом продукт выпадал в осадок. Твердое вещество фильтровали в горячем состоянии и сушили, при этом получали кислоту 4 (45 г, 53%) в виде твердого кристаллического вещества грязно-белого цвета. ЖХВР: (колонка С18 Waters X-Terra, 5 мкм, 4,6 мм×250 мм, скорость элюции 1,0 мл/мин, элюент: 0,1% ТЭА в Н2О/ацетонитриле, 40:60, в течение 30 мин), в.у. 2,12 мин, чистота 96,6%. Данные 1H ЯМР (ДМСО-d6, 400 МГц) см. в примере 3.
В. 3-(5-Амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамид
В раствор кислоты 4 (46 г, 0,143 моля, 1,0 экв.) в ДМФА (1,9 л) при перемешивании добавляли EDCl (57,5 г, 0,299 моля, 2,09 экв.), HOBt (41,4 г, 0,306 моля, 2,14 экв.) и диизопропилэтиламин (76,6 г, 0,59 моля, 4,15 экв.), полученный раствор перемешивали при комнатной температуре в течение 20 мин. Затем раствор охлаждали до 15-20°С, добавляли циклопропиламин (20,6 г, 0,36 моля, 2,51 экв.) и перемешивали при комнатной температуре. Ход реакции контролировали методом ТСХ. Так как через 14 ч реакция не завершена, добавляли еще одну порцию циклопропиламина (9,36 г, 0,16 моля, 1,14 экв.) и перемешивали в течение еще 2 ч. ДМФА удаляли при пониженном давлении при температуре 50-55°С. К остатку добавляли EtOAc (1 л) и воду (500 мл), полученную смесь перемешивали в течение 10 мин, экстрагировали и органический слой отделяли. Водный слой экстрагировали EtOAc (2×250 мл). Объединенные органические слои промывали бикарбонатом натрия (2×500 мл) и солевым раствором (2×500 мл), сушили над безводным сульфатом натрия и концентрировали. К остатку добавляли EtOAc/дихлорметан/гексан (50 мл:50 мл:50 мл), смесь перемешивали в течение 10 мин и фильтровали, при этом получали продукт (34,1 г, 65,7%) в виде кристаллического твердого вещества грязно-белого цвета. ЖХВР: (колонка С18 Waters Х-Terra, 5 мкм, 4,6 мм×250 мм, скорость элюции 1,0 мл/мин, элюент: 0,1% ТФУ в Н2О/ацетонитриле, 50:50, в течение 30 мин), в.у. 5,53 мин, чистота 99,3%. MC: m/z 360 [M]+. 1H ЯМР (ДМСО-d6, 400 МГц), см. в примере 4.
Пример 52
Получение 3-[5-амино-4-(3-цианобензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
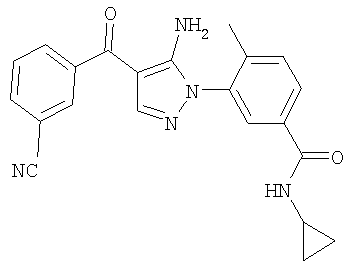
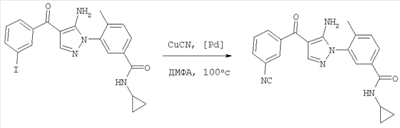
В раствор 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида (110 мг, 0,23 ммоля) в ДМФА (5 мл) добавляли CuCN (40 мг, 0,45 ммоля) и тетракис(трифенилфосфин)палладий (каталитическое количество), полученную смесь нагревали при 100°С в атмосфере N2 в течение ночи. Растворитель удаляли и остаток суспендировали в EtOAc, твердое вещество отфильтровывали, фильтрат промывали водой, солевым раствором, сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали хроматографией на колонке с силикагелем (элюент: EtOAc). Продукт получали в виде твердого вещества бежевого цвета (30 мг, 34%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,02 мин. МС: m/z 386,13 [M+H]+.
Пример 53
Получение 3-[5-амино-4-(3-[1,3,4]оксадиазол-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
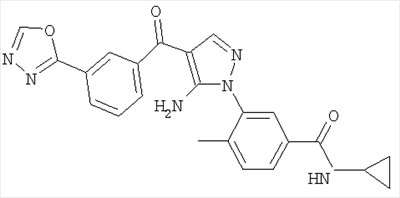
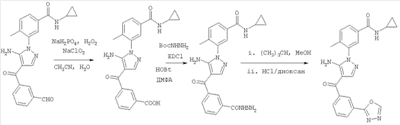 А. 3-[5-Амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбонил]бензойная кислота А. 3-[5-Амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбонил]бензойная кислота
В раствор 3-[5-амино-4-(3-формилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида (900 мг) в CH3CN (25 мл) добавляли NaH2PO4 (55 мг в 2 мл воды) и H2O2 (1,3 г, 30% раствор в воде), а затем при 10° по каплям добавляли водный раствор NaClO2 (365 мг). Полученную смесь перемешивали при указанной температуре в течение 4 ч, затем добавляли Na2SO3. Растворитель удаляли и остаток растворяли в EtOAc, органический слой промывали водой и солевым раствором, затем концентрировали. Неочищенный продукт очищали хроматографией на колонке с силикагелем (элюент: градиент от EtOAc до EtOAc/AcOH, 100:1), при этом получали требуемое промежуточное соединение в виде пены бежевого цвета (345 мг, 37%).
Б. 3-[5-Амино-4-(3-гидразинокарбонилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
Соединение 53А (50 мг, 0,12 ммоля), трет-бутил карбазат (33 мг, 0,24 ммоля), EDCl (46 мг, 0,24 ммоля), HOBt (37 мг, 0,24 ммоля) растворяли в сухом ДМФА (5 мл) и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли и остаток растворяли в EtOAc, органический слой промывали водой, водным раствором К2СО3 и солевым раствором, сушили над Na2SO4. Затем добавляли ТФУ/ДХЭ (5 мл, 1:1) и перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли и остаток растворяли в EtOAc, промывали водным раствором К2СО3 и сушили над Na2SO4. Растворитель удаляли, при этом получали соединение В в виде твердого вещества бежевого цвета (45 мг, 88%).
В. 3-[5-Амино-4-(3-[1,3,4]оксадиазол-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
В раствор соединения 53В в МеОН (2 мл) добавляли триметилортоформиат (2 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли и остаток растворяли в 1,4-диоксане, затем добавляли 5 капель 4 М раствора HCl в диоксане и смесь нагревали в микроволновом реакторе при 120°С в течение 30 мин. Растворитель удаляли и остаток растворяли в EtOAc, органический слой промывали водой и солевым раствором, неочищенный продукт очищали препаративной ТСХ (элюент: EtOAc/MeOH, 95:5), при этом получали продукт в виде твердого вещества бежевого цвета (25 мг, 63%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,81 мин. МС: m/z 429,13 [М+Н]+.
Пример 54
Получение 3-{5-амино-4-[3-(5-метил[1,3,4]оксадиазол-2-ил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамида
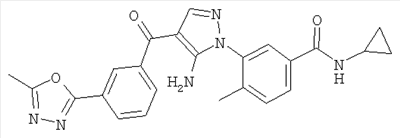
Указанное соединение получали аналогично тому, как описано в примере 53, но при замене триметилортоформиата на триметилортоацетат. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,84 мин. МС: m/z 443,15 [М+Н]+.
Пример 55
Получение 3-{5-амино-4-[3-(пирролидин-1-карбонил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамида
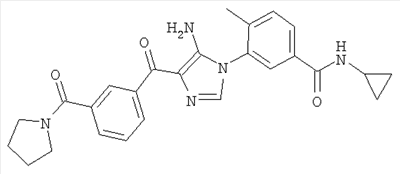
Указанное соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на пирролидин. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,93 мин. МС: m/z 458,2 [М+Н]+.
Пример 56
Получение 3-[5-амино-4-(3-циклопропилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
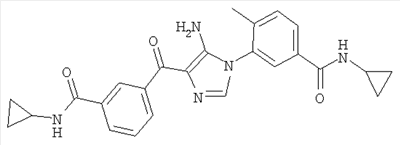
Указанное соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на циклопропиламин. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,74 мин. МС: m/z 444,14 [М+Н]+.
Пример 57
Получение 3-[5-амино-4-(3-карбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
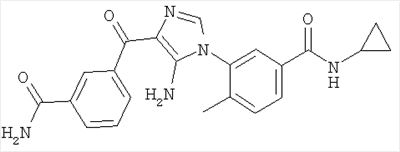
Указанное соединение получали аналогично тому, как описано в примере 21, но при замене изопропиламина на аммиак. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,51 мин. МС: m/z 404,2 [М+Н]+.
Пример 58
Получение 3-[5-амино-4-(3-изопропилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
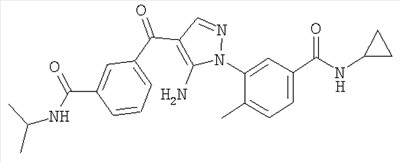
Указанное соединение получали аналогично тому, как описано в примере 21Б, но при замене 3-[5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-имидазол-4-карбонил]бензойной кислоты на 3-[5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбонил]бензойную кислоту. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,89 мин. МС: m/z 446,2 [М+Н]+.
Примеры 59-69
Соединения, приведенные в указанных ниже примерах, получали аналогично тому, как описано в примере 58, но при замене изопропиламина на соответствующий амин.
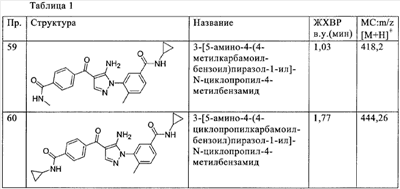 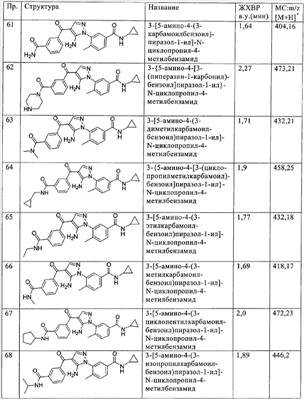 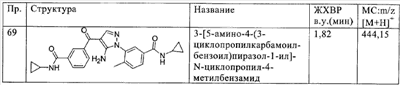
Примеры 70-75
Соединения, приведенные в указанных ниже примерах, получали аналогично тому, как описано в примере 11, но при замене 1-метилпиперазина на соответствующий амин.
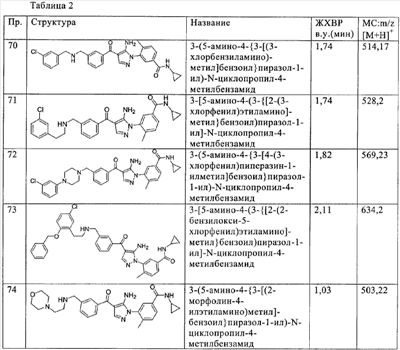 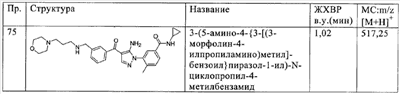
Примеры 76-93
Соединения, приведенные в указанных ниже примерах, получали аналогично тому, как описано в примере 17, но при замене фенилмагнийбромида на соответствующий реактив Гриньяра.
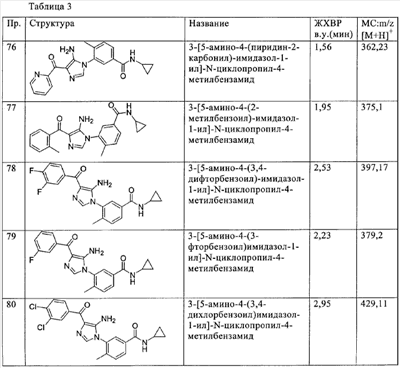 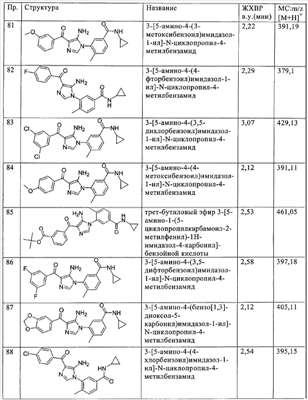 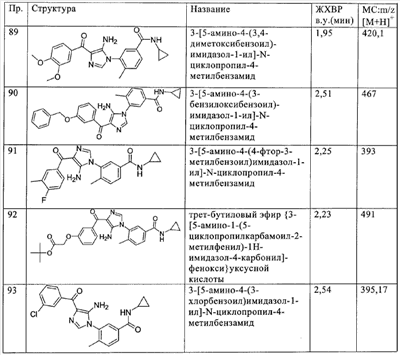
Пример 94
Получение 3-(5-амино-4-бензоил-2-метилимидазол-1-ил)-N-циклопропил-4-метилбензамида
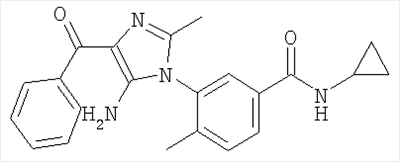
Указанное соединение получали аналогично тому, как описано в примере 17, но при замене триэтилортоформиата на триэтилортоацетат. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,56 мин. МС: m/z 375 [М+Н]+.
Пример 95
Получение 3-(5-амино-4-бензоил-2-пропилимидазол-1-ил)-N-циклопропил-4-метилбензамида
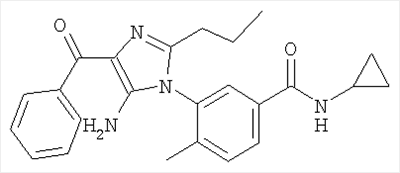
Указанное соединение получали аналогично тому, как описано в примере 17, но при замене триэтилортоформиата на триэтилортобутират. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,14 мин. МС: m/z 403 [М+Н]+.
Пример 96
Получение 3-[5-амино-4-(3-карбамоилметоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамила
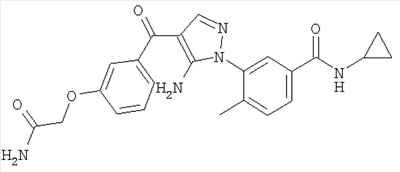 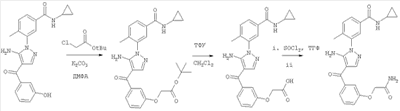
А. {3-[5-Амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбонил]фенокси}уксусная кислота
В раствор 3-[5-амино-4-(3-гидроксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида (400 мг, 1,06 ммоля) и трет-бутилхлорацетата (319 мг, 2,12 ммоля) в ДМФА (20 мл) при перемешивании добавляли К2СО3 (292 мг, 2,12 ммоля) и полученную смесь нагревали при 100°С в течение ночи. Растворитель удаляли и остаток суспендировали в EtOAc, промывали водой, солевым раствором, сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали хроматографией на колонке с силикагелем (элюент: EtOAc/гексан, 3:1), при этом получали продукт в виде масла светло-желтого цвета (140 мг, 27%).
Б. {3-[5-Амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбонил]фенокси}уксусная кислота
Масло (180 мг, 0,37 ммоля), полученное на последней стадии, растворяли в ДХМ (5 мл), добавляли ТФУ (5 мл) и при комнатной температуре перемешивали в течение ночи. Летучие органические компоненты удаляли, добавляли толуол, затем удаляли его в вакууме, при этом получали продукт в виде твердого вещества белого цвета (140 мг, 88%).
В. 3-[5-Амино-4-(3-карбамоилметоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
В раствор промежуточного соединения, полученного на предыдущей стадии, в ТГФ (5 мл) добавляли SOCl2 (1 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Летучие компоненты удаляли, затем добавляли NH3 (0,5 М раствор в диоксане) и полученную смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли и остаток очищали препаративной ТСХ (элюент: EtOAc/MeOH/Et3N, 100:10:1), а затем препаративной ЖХВР, при этом получали продукт в виде твердого вещества бежевого цвета (4,2 мг, 10%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,78 мин. МС: m/z 434,14 [M+H]+.
Примеры 97-105
Соединения, приведенные в указанных ниже примерах, получали аналогично тому, как описано в примере 96, но при замене аммиака на соответствующий амин.
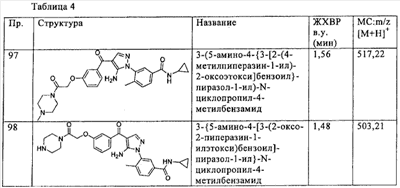 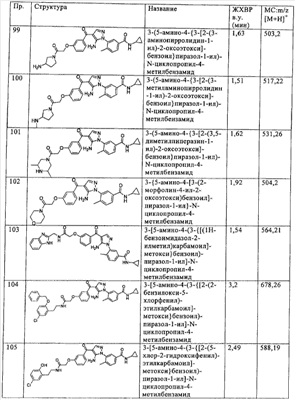
Пример 106
Получение 3-[5-амино-4-(3-пиразин-2-илбензоил)пиразол-1 -ил]-N-циклопропил-4-метилбензамида
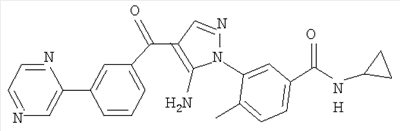
В раствор 3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида (130 мг, 0,27 ммоля) и 2-трибутилстаннилпиразина (119 мг, 0,32 ммоля) в ДМФА (2 мл) при перемешивании добавляли тетракис(трифенилфосфин)палладий (каталитическое количество) и полученную смесь нагревали в микроволновом реакторе при 160°С в течение 15 мин. Растворитель удаляли и остаток растворяли в EtOAc. Органические слои промывали водой, солевым раствором и концентрировали. Неочищенный материал очищали препаративной ЖХВР, при этом получали требуемый продукт в виде твердого вещества бежевого цвета (6,2 мг, 5%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,12 мин. МС: m/z 439,19 [M+H]+.
Пример 107
Получение 3-[5-амино-4-(3-пиридин-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
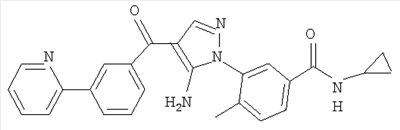
Указанное соединение получали аналогично тому, как описано в примере 106, но при замене 2-трибутилстаннилпиразина на 2-трибутилстаннилпиридин.
ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,94 мин. МС: m/z 438,26 [M+H]+.
Пример 108
Получение 3-[5-амино-4-(пиридин-2-карбонил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
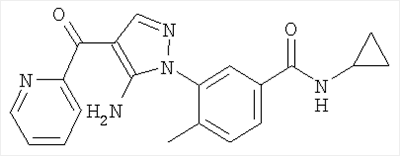
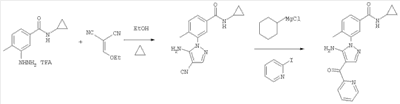
А. 3-(5-Амино-4-цианопиразол-1-ил)-N-циклопропил-4-метилбензамид
В раствор трифторацетата N-циклопропил-3-гидразино-4-метилбензамида (8,45 г, 26,5 ммоля) и 2-этоксиметиленмалононитрила (3,2 г, 26,5 ммоля) в EtOH (100 мл) добавляли DIPEA (3,4 г, 26,5 ммоля) и перемешивали при 65°С в течение 3 ч. Растворитель удаляли и остаток суспендировали в EtOAc (~100 мл), затем к полученной суспензии добавляли воду. Твердое вещество отфильтровывали, фильтрат промывали водой, солевым раствором, сушили над Na2SO4, концентрировали и очищали хроматографией на колонке с силикагелем (элюент: EtOAc), фильтрат и фракции, полученные после хроматографии, объединяли, при этом получали продукт в виде твердого вещества бежевого цвета (7,1 г, 96%).
Б. 3-[5-Амино-4-(пиридин-2-карбонил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
В раствор 2-иодпиридина (1,03 г, 5 ммолей) в ТГФ (15 мл) при -20°С по каплям добавляли циклогексилмагнийхлорид (5 мл, 2,0 М раствор в Et2O). Смесь перемешивали при указанной температуре в течение 20 мин, затем добавляли 3-(5-амино-4-цианопиразол-1-ил)-N-циклопропил-4-метилбензамид (140 мг, 0,5 ммоля) и продолжали перемешивание при комнатной температуре в течение ночи. Реакцию останавливали добавлением водного раствора К2СО3, полученную смесь экстрагировали EtOAc и органические слои промывали водой и солевым раствором. После очистки хроматографией на колонке с силикагелем (элюент: EtOAc) получали продукт в виде твердого вещества белого цвета (60 мг, 33%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,09 мин. МС: m/z 362,20 [М+Н]+.
Пример 109
Получение 3-(5-амино-4-циклопентанкарбонилпиразол-1-ил)-N-циклопропил-4-метилбензамида
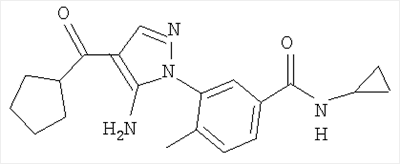
Указанное соединение получали аналогично тому, как описано в примере 17Б, но при замене 3-(5-амино-4-цианоимидазол-1-ил)-N-циклопропил-4-метилбензамида на 3-[5-амино-4-(3-цианобензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид и фенилмагнийбромида на циклопентилмагнийбромид. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,54 мин. МС: m/z 353,19 [М+Н]+.
Примеры 110-126
Соединения, приведенные в указанных ниже примерах, получали аналогично тому, как описано в примере 109, но при замене циклопентилмагнийбромида на соответствующий реактив Гриньяра.
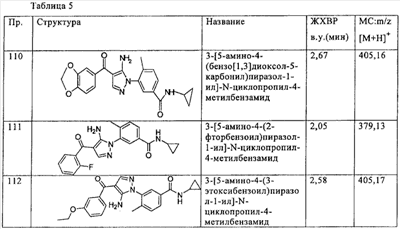 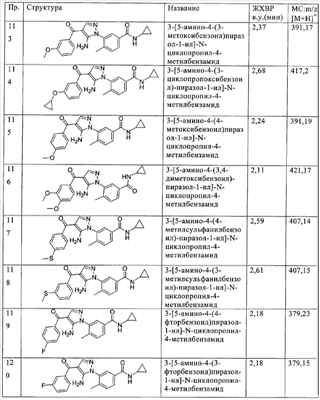 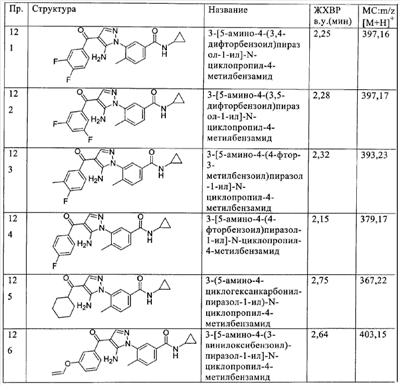
Пример 127
Получение 3-{5-амино-4-[3-([1,3,4]оксадиазол-2-илметокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамида
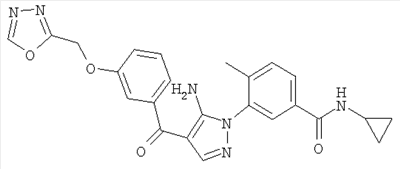
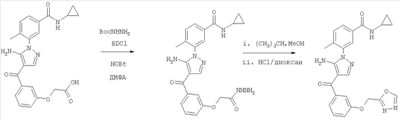
А. 3-[5-Амино-4-(3-гидразинокарбонилметоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
Соединение 97А (300 мг, 0,69 ммоля), трет-бутилкарбазат (182 мг, 1,38 ммоля), EDCl (263 мг, 1,38 ммоля) и HOBt (211 мг, 1,38 ммоля) растворяли в сухом ДМФА (10 мл) и перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли, остаток растворяли в EtOAc, промывали водой, водным раствором К2СО3, солевым раствором и сушили над Na2SO4. К полученной смеси добавляли ТФУ/ДХЭ (5 мл, 1:1) и перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли, остаток растворяли в EtOAc, промывали водным раствором К2СО3 и сушили над Na2SO4. Неочищенный остаток очищали хроматографией на колонке с силикагелем (элюент: EtOAc/MeOH, 10:1), при этом получали требуемое соединение в виде твердого вещества белого цвета (88 мг, 28%).
Б. 3-{5-Амино-4-[3-([1,3,4]оксадиазол-2-илметокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид
В раствор соединения 52 В (48 мг, 0,11 ммоля) в МеОН (3 мл) добавляли триметилортоформиат (3 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли, твердый остаток растворяли в 1,4-диоксане, добавляли 5 капель HCl в диоксане (4 М) и смесь нагревали в микроволновом реакторе при 120°С в течение 30 мин. Растворитель удаляли, остаток растворяли в EtOAc, промывали водой и солевым раствором. Неочищенный продукт очищали препаративной ЖХВР, при этом получали продукт в виде твердого вещества белого цвета (3,3 мг, 6,7%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,07 мин. МС: m/z 459,13 [М+Н]+.
Пример 128
Получение (2-метилциклогексил)амида 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
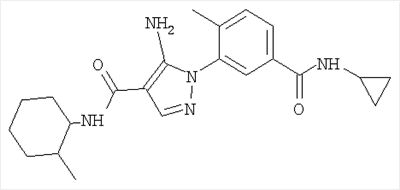
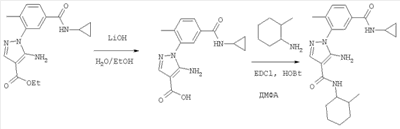
А. 5-Амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновая кислота
Раствор этилового эфира 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты (1,0 г, см. пример 44), LiOH (1,2 г) в воде/этаноле (15 мл:20 мл) нагревали при 50°С в течение ночи. Раствор нейтрализовали разбавленной HCl (2 М) и экстрагировали этилацетатом (2×200 мл), сушили над Na2SO4. Растворитель упаривали при пониженном давлении, затем добавляли этилацетат и диэтиловый эфир. Полученное твердое вещество – отфильтровывали, при этом получали требуемую 3-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновую кислоту (0,8 г, выход 88%).
Б. (2-метилциклогексил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
Раствор 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты (21 мг), 2-метилциклогексиламина (10 мг), EDCl (28 мг) и HOBt (12 мг) в ДМФА (0,75 мл) выдерживали при комнатной температуре в течение 24 ч, добавляли воду (4 мл) и раствор экстрагировали этилацетатом (2×3 мл). Органическую фазу промывали водой (3 мл), сушили над Na2SO4 и упаривали. Остаток очищали на пластинке для препаративной ТСХ, при этом получали требуемый (2-метилциклогексил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты (19 мг, 70%). ЖХВР: (градиент в течение 4 мин), в.у. 2,34 мин. МС: m/z 396,31 [М+Н]+.
Пример 129-156
Соединения, приведенные в указанных ниже примерах, получали аналогично тому, как описано в примере 128, но при замене 2-метилциклогексиламина на соответствующий амин.
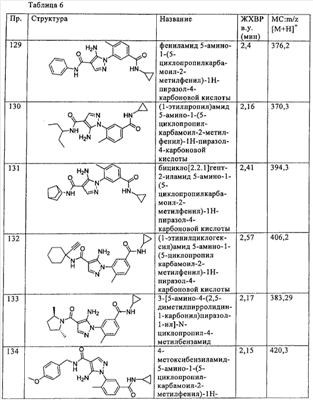 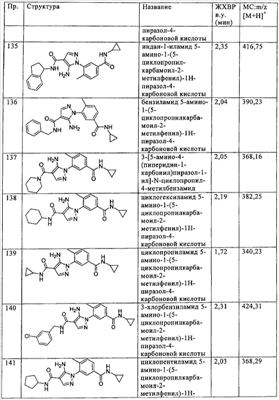 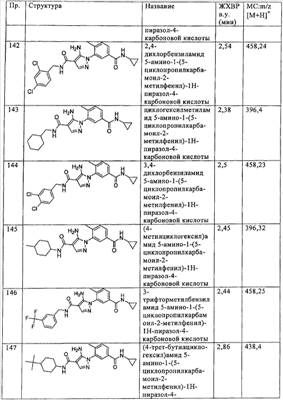 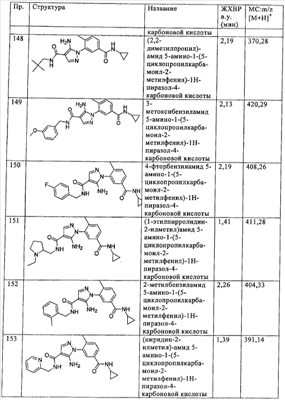 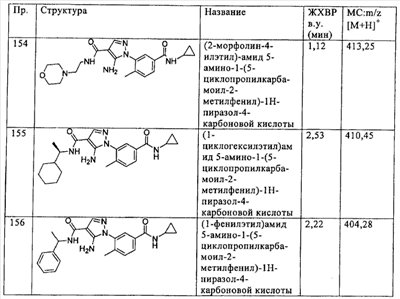
Пример 157
Получение (2,2-диметилпропил)амида 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
Указанное соединение получали аналогично тому, как описано в примере 128, но при замене изопропиламина на неопентиламин. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,19 мин. МС: m/z 370,32 [М+Н]+.
Пример 158
Получение (1-этилпирролидин-2-илметил)амида 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
Указанное соединение получали аналогично тому, как описано в примере 128, но при замене изопропиламина на 2-(аминометил)-1-этилпирролидин. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,41 мин. МС: m/z 411,25 [M+H]+.
Пример 159
Получение (2-пирролидин-1-илэтил)амида 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
Указанное соединение получали аналогично тому, как описано в примере 128, но при замене изопропиламина на 1-(2-аминоэтил)пирролидин. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,34 мин. МС: m/z 397,22 [М+Н]+.
Пример 160
Получение циклогексилметиламида 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты
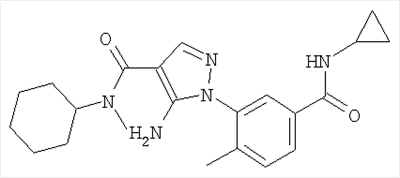
Указанное соединение получали аналогично тому, как описано в примере 57, но при замене изопропиламина на N-метилциклогексиламин. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,37 мин. МС: m/z 396,3 [М+Н]+.
Пример 161
Получение 3-[5-амино-4-(3-цианобензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
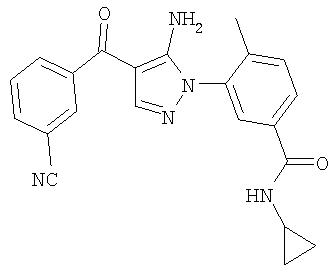
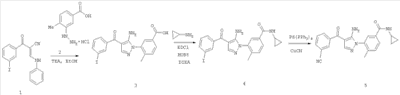
А. 3-[5-Амино-4-(3-иодбензоил)пиразол-1-ил]-4-метилбензойная кислота
В раствор гидразина 2 (32,5 г, 0,160 моля, 1,0 экв.) в этаноле (3,6 л) при перемешивании добавляли соединение 1 (60 г, 0,160 моля, 1,0 экв.), полученное, как описано в заявке WO 02/57101 А1, стр.84, и триэтиламин (16,56 г, 0,16 моля, 1,0 экв.), полученную смесь нагревали до 65°С. Все твердые вещества растворялись при 65°С. После охлаждения твердое вещество отфильтровывали, при этом получали кислоту 3 (22 г, 30%) в виде твердого вещества светло-коричневого цвета. ЖХВР: (колонка C18 Waters Х-Terra, 5 мкм, 4,6 мм×250 мм, скорость элюции 1,0 мл/мин, элюент: 0,1% ТЭА в Н2О/ацетонитриле, 40:60, в течение 30 мин), в.у. 6,74 мин, чистота 95,2%.
Б. 3-[5-Амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
В раствор кислоты 3 (21 г, 0,0469 моля, 1,0 экв.) в ДМФА (30 мл) добавляли EDCl (17 г, 0,0886 моля, 2,0 экв.), HOBt (12,6 г, 0,0939 моля, 2,0 экв.) и диизопропилэтиламин (24,2 г, 0,18 моля, 4,0 экв.), полученный раствор перемешивали при комнатной температуре в течение 15 мин, затем добавляли циклопропиламин (10,7 г, 0,0939 моля, 2,0 экв.) и реакционную смесь перемешивали в течение 1 ч. Полученную смесь добавляли в воду и экстрагировали EtOAc (1 л), промывали водой (2×200 мл) и солевым раствором (200 мл), сушили над безводным сульфатом натрия и концентрировали. Продукт очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/гексан, 8:2), при этом получали продукт в виде масла коричневого цвета. Для дальнейшей очистки продукт растирали в изопропиловом эфире (1 л) и сушили в вакууме, при этом получали амид 4 (12 г, 50%) в виде твердого вещества грязно-белого цвета.
В. 3-[5-Амино-4-(3-цианобензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид
В раствор иодида 4 (7,4 г, 0,015 моля, 1,0 экв.) в N,N-диметилформамиде (25 мл) в атмосфере n2 добавляли цианид меди. Полученную суспензию кипятили с обратным холодильником в течение 1 ч. Завершение реакции контролировали методом ТСХ. Нагревание прекращали и реакционную смесь охлаждали до 80°С. Реакцию останавливали добавлением ледяной воды (15 мл), 25% водного аммиака (15 мл) и этилацетата (50 мл). Смесь фильтровали для удаления твердого вещества, из фильтрата отделяли органический слой, который промывали водой, насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и неочищенный материал сушили при 60°С в высоком вакууме, затем очищали на колонке (элюент: этилацетат), при этом получали продукт (3 г, 51%) в виде твердого вещества грязно-белого цвета. ЖХВР: (колонка С18 Waters X-Terra, 5 мкм, 4,6 мм×250 мм, скорость элюции 1,0 мл/мин, элюент: 0,1% ТЭА в Н2О/ацетонитриле, 70:30, в течение 30 мин), в.у. 23,70 мин, чистота 99,4%.
1Н ЯМР (400 МГц, CDCl3)  8,10 (t, J 2,9 Гц, 1Н), 8,06 (t, J 2,7 Гц, 1Н), 8,04 (m, 1Н), 7,85 (t, J 2,5 Гц, 1Н), 7,83 (m, 1Н), 7,81 (d, J 1,8 Гц, 1Н), 7,95 (d, J 1,6 Гц, 1Н), 7,37 (s, 1Н), 7,65 (t, J 7,8 Гц, 1Н), 7,45 (d, J 8,0 Гц, 1Н), 6,41 (s, 1Н), 5,94 (s, 2H), 2,88 (m, 1Н), 2,24 (s, 3H), 0,86 (dd, J 6,9, 6,1 Гц, 2Н), 0,61 (m, 2H). 8,10 (t, J 2,9 Гц, 1Н), 8,06 (t, J 2,7 Гц, 1Н), 8,04 (m, 1Н), 7,85 (t, J 2,5 Гц, 1Н), 7,83 (m, 1Н), 7,81 (d, J 1,8 Гц, 1Н), 7,95 (d, J 1,6 Гц, 1Н), 7,37 (s, 1Н), 7,65 (t, J 7,8 Гц, 1Н), 7,45 (d, J 8,0 Гц, 1Н), 6,41 (s, 1Н), 5,94 (s, 2H), 2,88 (m, 1Н), 2,24 (s, 3H), 0,86 (dd, J 6,9, 6,1 Гц, 2Н), 0,61 (m, 2H).
13С ЯМР (400 МГц, CDCl3)  186,6, 167,2, 151,5, 141,3, 140,7, 140,3, 135,1, 134,5, 134,0, 132,2, 131,8, 129,5, 128,7, 126,2, 118,1, 113,0, 103,7, 30,9, 23,2, 17,7, 6,8. 186,6, 167,2, 151,5, 141,3, 140,7, 140,3, 135,1, 134,5, 134,0, 132,2, 131,8, 129,5, 128,7, 126,2, 118,1, 113,0, 103,7, 30,9, 23,2, 17,7, 6,8.
Пример 162
Получение 3-[5-амино-4-(3-пиразин-2-илбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
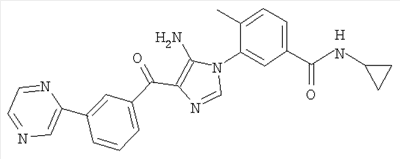
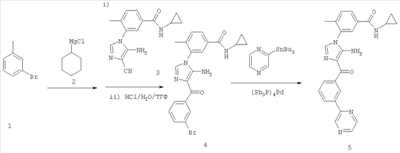
А. 3-[5-Амино-4-(3-бромбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид
В раствор 3-бром-1-иодбензола (2,82 г) в ТГФ (20 мл) при -40°С в атмосфере N2 добавляли циклогексилмагнийхлорид (2 М раствор в ТГФ, 6 мл). Раствор выдерживали при температуре от -40°С до 0°С в течение 20 мин, затем добавляли 3-(5-амино-4-цианоимидазол-1-ил)-N-циклопропил-4-метилбензамид (0,18 г) и реакционную смесь выдерживали при КТ в течение 1 ч. Затем добавляли HCl (4 М, 20 мл) и смесь выдерживали при КТ в течение 2 сут. Смесь нейтрализовали раствором К2СО3 и экстрагировали EtOAc (2×100 мл), объединенные органические слои сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали хроматографией на колонке (элюент: EtOAc), при этом получали требуемый продукт (0,15 г, 54%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,85 мин. МС: m/z 438,10, 441,07 [М+Н]+.
Б. 3-[5-Амино-4-(3-пиразин-2-илбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид
Раствор 3-[5-амино-4-(3-бромбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида (60 мг), 2-трибутилстаннилпиразина (120 мкл) и тетракис(трифенилфосфин)палладия (0) (30 мг) в 1,4-диоксане (0,8 мл) нагревали в микроволновом реакторе при 160°С в течение 25 мин, затем добавляли воду (3 мл) и смесь экстрагировали этилацетатом (2×4 мл), растворитель упаривали и остаток очищали препаративной ТСХ (элюент: EtOAc/МеОН, 10:1), при этом получали требуемый продукт (38 мг, 63%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,18 мин. МС: m/z 439,27 [М+Н]+.
Пример 163
Получение 3-[5-амино-4-(3-пиримидин-5-илбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
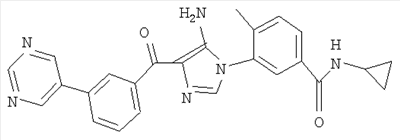
Указанное соединение получали аналогично тому, как описано в примере 162, но при замене 2-трибутилстаннилпиразина на 4-трибутилстаннилпиримидин. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,93 мин. МС: m/z 439,19 [М+Н]+.
Пример 164
Получение 3-[5-амино-4-(3-пиридин-2-илбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамида
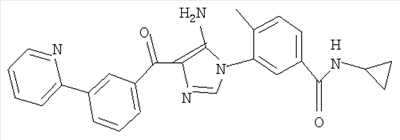
Указанное соединение получали аналогично тому, как описано в примере 162, но при замене 2-трибутилстаннилпиразина на 2-трибутилстаннилпиридин. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,04 мин. МС: m/z 438,25 [М+Н]+.
Пример 165
Получение 3-[5-амино-4-(3-пиримидин-2-илбензоил)имидазол-1-ил-1-N-циклопропил-4-метилбензамида
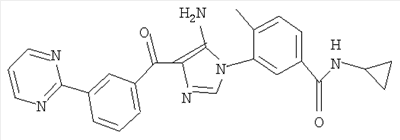
Указанное соединение получали аналогично тому, как описано в примере 162, но при замене 2-трибутилстаннилпиразина на 2-трибутилстаннилпиримидин. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,49 мин. МС: m/z 439,24 [М+Н]+.
Пример 166
Получение 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-4-метилсульфонилбензоил-1Н-имидазола
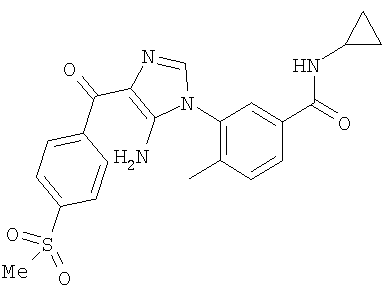 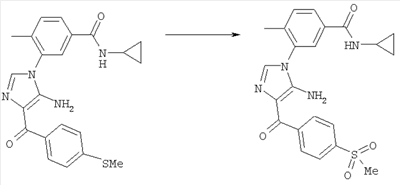
Раствор 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-4-метилсульфонилбензоил-1H-имидазола (64 мг) и оксона (242 мг) в воде/метаноле (2 мл:2 мл) выдерживали при комнатной температуре в течение 2 ч. Затем раствор упаривали и добавляли ТГФ/МеОН (2 мл:2 мл). Полученную смесь нагревали до растворения твердых веществ и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали препаративной ЖХВР, при этом получали продукт (1,6 мг). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,90 мин. МС: m/z 439,15 [М+Н]+.
Пример 167
Получение 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-4-[3-(5-метил)оксадиазол-3-илбензоил]-1Н-имидазола
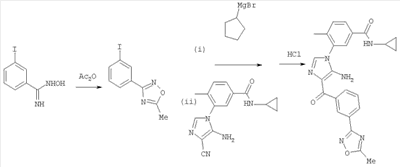
Смесь N-гидрокси-3-иодбензимидина (1,31 г), уксусного ангидрида (1 мл) и каталитического количества пара-толуолсульфоновой кислоты нагревали в уксусной кислоте (10 мл) при 90°С в течение 6 ч. Растворитель упаривали, добавляли воду и метанол (1:1, 100 мл). Образовавшийся осадок отфильтровывали, при этом получали требуемый продукт (1,1 г).
В раствор 3-(3-иодфенил)-5-метилоксадиазола (0,286 г) в ТГФ (15 мл) в атмосфере N2 добавляли циклопентилмагнийбромид (2 М, 1,1 мл) при -20°С, затем постепенно повышали температуру в течение приблизительно 20 мин до 5-10°С, добавляли 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-4-цианоимидазол (96 мг) и реакционную смесь выдерживали при комнатной температуре в течение 0,5 ч. Затем добавляли разбавленную HCl (4 М, 12 мл) и реакционную смесь нагревали при 60°С в течение 3 ч. После распределения в воде и этилацетате конечный продукт очищали хроматографией на колонке (элюент: этилацетат/гексан, 1:1). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,03 мин. МС: m/z 443,20 [М+Н]+.
Пример 168
Получение 3-(5-амино-4-{3-[2-(4-метилпиперазин-1-ил)этокси]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамида
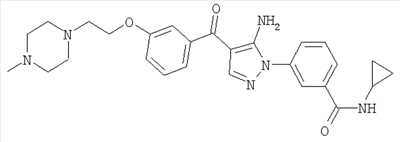
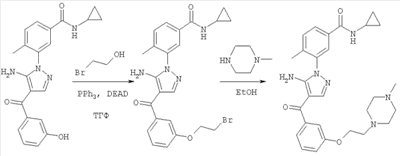
А. 3-{5-Амино-4-[3-(2-бромэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид
В раствор 3-[5-амино-4-(3-гидроксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида (472 мг, 1,26 ммоля) в сухом ТГФ (20 мл) при 0°С добавляли 2-бромэтанол (785 мг, 6,3 ммоля), PPh3 (1,3 г, 5,04 ммоля) и диэтилазодикарбоксилат (877 мг, 5,04 ммоля), полученную смесь перемешивали при комнатной температуре в течение 72 ч. К смеси добавляли водный раствор NH4Cl, затем слой ТГФ отделяли. Водный слой экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, очищали препаративной ЖХВР, при этом получали продукт в виде твердого вещества белого цвета (360 мг, 59%).). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,723 мин. МС: m/z 483,14/485,09 [М+Н]+.
Б. 3-(5-Амино-4-{3-[2-(4-метилпиперазин-1-ил)этокси]бензоил}пиразол-1-ил)-]-N-циклопропил-4-метилбензамид
В суспензию 3-{5-амино-4-[3-(2-бромэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамида (24 мг, 0,05 ммоля) в EtOH (1 мл) добавляли 1-метилпиперазин (100 мг, 1 ммоль), полученную смесь перемешивали при 80°С в течение ночи. Растворитель удаляли, остаток растворяли в EtOAc, промывали водой, сушили над Na2SO4. Растворитель удаляли, при этом получали требуемый продукт в виде бесцветного масла (18 мг, 72%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,33 мин. МС: m/z 503,29 [М+Н]+.
Пример 169
Получение 3-[5-амино-4-(3-{2-[бис-(2-гидроксиэтил)амино]этокси}бензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида
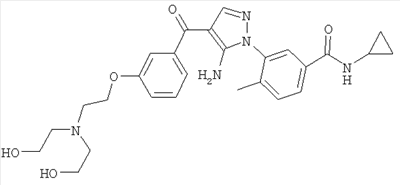
Указанное соединение получали аналогично тому, как описано в примере 168, но при замене 1-метилпиперазина на 2-[бис-(2-гидроксиэтил)амино]этанол. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,39 мин. МС: m/z 508,24 [М+Н]+.
Пример 170
Получение 3-{5-амино-4-[3-(2-диметиламиноэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамида
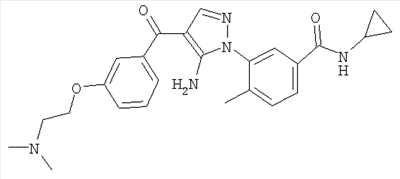
Указанное соединение получали аналогично тому, как описано в примере 168, но при замене 1-метилпиперазина на 2-диметиламиноэтанол. ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,59 мин. МС: m/z 448,22 [М+Н]+.
Пример 171
Получение 3-{5-амино-4-[3-(2,3-дигидроксипропокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамида
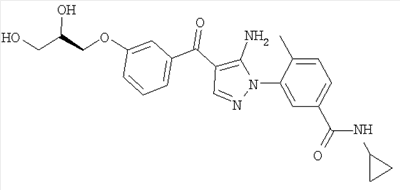
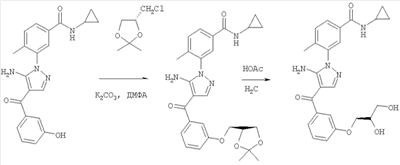
А. 3-{5-Амино-4-[3-(2,2-диметил[1,3]диоксолан-4-илметокси)бензоил]пиразол-1-ил)-N-циклопропил-4-метилбензамид
В раствор 3-[5-амино-4-(3-гидроксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида (75 мг, 0,2 ммоля) и 4-хлорметил-2,2-диметил[1,3]диоксолана (36 мг, 0,24 ммоля) в ДМФА (4 мл) при перемешивании добавляли К2СО3 и полученную смесь перемешивали при 150°С в микроволновом реакторе в течение 2 ч. Растворитель удаляли, остаток растворяли в EtOAc, промывали водой, солевым раствором, сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на колонке (элюент: EtOAc/гексан, 3:1), при этом получали продукт в виде бесцветного масла (18 мг, 18%). ЖХВР: (градиент в течение 4 мин), в.у. 2,57 мин. МС: m/z 491,11 [М+Н]+.
Б. 3-{5-Амино-4-[3-(2,3-дигидроксипропокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид
Соединение 171А (10 мг) растворяли в НОАс (1 мл), добавляли 0,5 мл воды и полученную смесь перемешивали при 50°С в течение ночи. Растворитель удаляли, остаток очищали препаративной ТСХ (элюент: EtOAc), при этом получали продукт в виде масла светло-желтого цвета (4,1 мг, 45%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,73 мин. МС: m/z 451,21 [М+Н]+.
Пример 172
Получение 3-(5-амино-4-{3-[2-(4-хлорфенокси)этокси]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамида
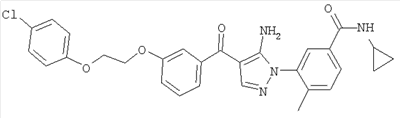
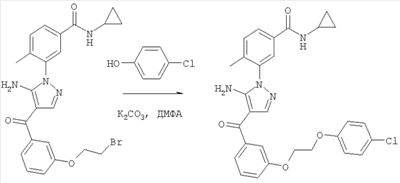
В раствор 3-{5-амино-4-[3-(2-бромэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамида (24 мг, 0,05 ммоля) и 4-хлорфенола (128 мг, 1 ммоль) в ДМФА (1 мл) добавляли К2СО3 (138 мг, 1 ммоль) и полученную смесь перемешивали при 100°С в течение 2 ч. Затем смесь охлаждали и твердое вещество отфильтровывали. Фильтрат концентрировали и очищали препаративной ЖХВР, при этом получали продукт в виде твердого вещества бежевого цвета (10 мг, 38%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 2,77 мин. МС: m/z 531,21 [М+Н]+.
Пример 173
Получение 3-{5-амино-4-[3-(4Н-[1,2,4]триазол-3-ил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамида
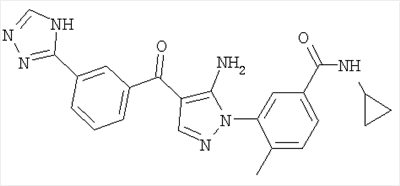
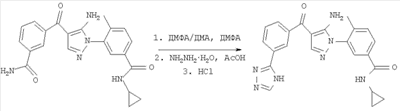
В раствор 3-[5-амино-4-(3-карбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамида (120 мг), в ДМФА (2 мл) при перемешивании добавляли диметилацеталь N,N-диметилформамида (5 мл) и полученный раствор перемешивали при 80°С в течение ночи. Растворитель удаляли, остаток растворяли в АсОН (5 мл), добавляли моногидрат гидразина (3 мл) и полученную смесь перемешивали при 90°С в течение ночи. Раствор подкисляли хлористоводородной кислотой до рН~1 и перемешивали при 80°С в течение ночи. Растворитель удаляли, остаток ресуспендировали в EtOAc, затем промывали водным раствором К2СО3, водой, солевым раствором и концентрировали. Неочищенный продукт очищали хроматографией на колонке с силикагелем (элюент: EtOAc), при этом получали продукт в виде твердого вещества белого цвета (65 мг, 51%). ЖХВР: (градиент 10-90% в течение 4 мин), в.у. 1,58 мин. МС: m/z 428,18 [М+Н]+.
Пример 174
Получение 3-{5-амино-4-[3-(4Н-[1,2,4]триазол-3-ил)бензоил]имидазол-1-ил} -N-циклопропил-4-метилбензамида
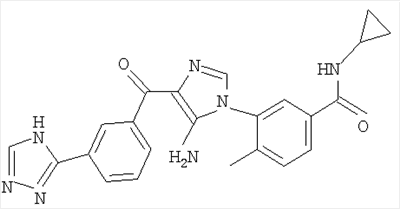
Указанное соединение получали, как описано в примере 173, но при замене 3-[5-амино-4-(3-карбамоилбензоил)пиразол-1-ил]-1-циклопропил-4-метилбензамида на 3-[5-амино-4-(3-карбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид. ЖХВР (градиент, 10-90% в течение 4 мин), в.у. 1,58 мин; МС: m/z 428,24 [М+Н]+.
Пример 175
Способность соединений по настоящему изобретению ингибировать синтез или активность цитокинов оценивали с использованием следующих методов анализа in vitro.
Получение киназ р38
Препараты кДНК р38 и и  человека получали при клонировании методом ПЦР. кДНК человека получали при клонировании методом ПЦР. кДНК  – и – и  -изоформ субклонировали в плазмиду DEST2 (фирмы Gateway, In Vitrogen). Гибридный белок His6-p38 экспрессировали в Е. coli и выделяли из бактериальных лизатов аффинной хроматографией с использованием Ni+2-NTA-агарозы. Белок His6-p38 активировали инкубацией в присутствии активной киназы МКК6. Активную киназу р38 отделяли от МКК6 аффинной хроматографией. Конститутивную активную МКК6 получали по методике, описанной в работе Raingeaud и др. Mol. Cell. Biol., 1247-1255 (1996). -изоформ субклонировали в плазмиду DEST2 (фирмы Gateway, In Vitrogen). Гибридный белок His6-p38 экспрессировали в Е. coli и выделяли из бактериальных лизатов аффинной хроматографией с использованием Ni+2-NTA-агарозы. Белок His6-p38 активировали инкубацией в присутствии активной киназы МКК6. Активную киназу р38 отделяли от МКК6 аффинной хроматографией. Конститутивную активную МКК6 получали по методике, описанной в работе Raingeaud и др. Mol. Cell. Biol., 1247-1255 (1996).
Продуцирование TNF- в клетках РВМС, стимулированных липолисахаридом (LPS) в клетках РВМС, стимулированных липолисахаридом (LPS)
Гепаринизированную цельную кровь человека получали от здоровых добровольцев. Мононуклеары перефирийной крови (РВМС) выделяли из цельной крови человека центрифугирования в градиенте плотности Accu-paque и ресуспендировали при концентрации 5×106/мл в среде для анализа (среда RPMI, содержащая 10% эмбриональной бычьей сыворотки). 175 мкл Суспензии клеток инкубировали в присутствии 10 мкл исследуемого соединения (в 4% ДМСО) в 96-луночных планшетах для культивирования тканей в течение 30 мин при КТ. Затем в суспензию клеток добавляли 15 мкл LPS (исходный раствор 13,33 нг/мл) и планшет инкубировали в течение 18 ч при 37°С во влажной атмосфере, содержащей 5% СО2. После инкубирования культуральную среду собирали и хранили при -20°С.
Клетки ТНР-1 (TIB-202, ATCC) промывали и ресуспендировали при концентрации 1×105/мл в среде для анализа (среда RPMI, содержащая 3% эмбриональной бычьей сыворотки). 175 мкл Суспензии клеток инкубировали в присутствии 10 мкл исследуемого соединения (в 4% ДМСО) в 96-луночных планшетах для культивирования тканей в течение 30 мин при КТ. В суспензию клеток добавляли 15 мкл LPS (исходный раствор 13,33 нг/мл) и планшет инкубировали в течение 18 ч при 37°С во влажной атмосфере, содержащей 5% СО2. После инкубирования культуральную среду собирали и хранили при -20°С.
Концентрацию TNF- в среде определяли количественно с использованием стандартного набора для ИФА (ELISA, BioSource International, Camarillo, CA). Концентрацию TNF- в среде определяли количественно с использованием стандартного набора для ИФА (ELISA, BioSource International, Camarillo, CA). Концентрацию TNF- и величины IC50 исследуемых соединений (концентрацию соединения, при которой наблюдается ингибирование на 50% продуцирования TNF- и величины IC50 исследуемых соединений (концентрацию соединения, при которой наблюдается ингибирование на 50% продуцирования TNF- , стимулированного LPS) рассчитывали с использованием логистического уравнения с четырьмя параметрами (SigmaPlot, SPSS, Inc.). , стимулированного LPS) рассчитывали с использованием логистического уравнения с четырьмя параметрами (SigmaPlot, SPSS, Inc.).
Анализ киназы р38
Активность киназы р38 определяли по количеству высвобождаемого АТФ в исследуемой реакции при окислении NADH, которое происходит при конденсации пируваткиназы и лактатдегидрогиназы. Анализ проводили в 384-луночных планшетах, предназначенных для исследования методом УФ-спектроскопии. Конечный объем в лунке составлял 25 мкл, который получают при добавлении 2,5 мкл раствора соединения в 10% ДМСО, 17,5 мкл буферного раствора для анализа и 5 мкл АТФ. Буферный раствор для анализа содержит следующие реагенты, которые добавляют до конечной концентрации, необходимой для анализа: 25 мМ HEPES, 20 мМ 2-глицерофосфата, рН 7,6, 10 мМ MgCl2, 0,1 мМ ортованадата натрия, 0,5 мМ фосфоенолпирувата, 0,12 мМ NADH, 3,1 мг/мл LDH, 6,67 мг/мл пируваткиназы, 0,25 мМ субстрата пептида, 2 мМ DTT, 0,005% Tween 80 и 20 нМ киназы р38 определяли по количеству высвобождаемого АТФ в исследуемой реакции при окислении NADH, которое происходит при конденсации пируваткиназы и лактатдегидрогиназы. Анализ проводили в 384-луночных планшетах, предназначенных для исследования методом УФ-спектроскопии. Конечный объем в лунке составлял 25 мкл, который получают при добавлении 2,5 мкл раствора соединения в 10% ДМСО, 17,5 мкл буферного раствора для анализа и 5 мкл АТФ. Буферный раствор для анализа содержит следующие реагенты, которые добавляют до конечной концентрации, необходимой для анализа: 25 мМ HEPES, 20 мМ 2-глицерофосфата, рН 7,6, 10 мМ MgCl2, 0,1 мМ ортованадата натрия, 0,5 мМ фосфоенолпирувата, 0,12 мМ NADH, 3,1 мг/мл LDH, 6,67 мг/мл пируваткиназы, 0,25 мМ субстрата пептида, 2 мМ DTT, 0,005% Tween 80 и 20 нМ киназы р38 фирмы Upstate. Исследуемые соединения предварительно инкубировали в присутствии киназы р38 фирмы Upstate. Исследуемые соединения предварительно инкубировали в присутствии киназы р38 в течение 60 мин и реакцию инициировали добавлением АТФ в конечной концентрации 0,15 мМ. Скорость реакции определяли при 340 нм на спектрофотометре SpectraMax для считывания планшет в течение 10 мин при 37°С. Данные по ингибированию анализировали нелинейным регрессионным методом наименьших квадратов с использованием приложения SigmaPlot. в течение 60 мин и реакцию инициировали добавлением АТФ в конечной концентрации 0,15 мМ. Скорость реакции определяли при 340 нм на спектрофотометре SpectraMax для считывания планшет в течение 10 мин при 37°С. Данные по ингибированию анализировали нелинейным регрессионным методом наименьших квадратов с использованием приложения SigmaPlot.
Продуцирование TNF- у мышей, стимулированное липолисахаридом (LPS) у мышей, стимулированное липолисахаридом (LPS)
Мышам (самки Balb/с, возраст 6-8 недель, фирмы Taconic Labs; no 8 особей в группе (n=8)) вводили внутрибрюшинно липополисахарид (LPS, 50 нг/кг Е. coli, штамм 0111:В4, фирмы Sigma), суспендированный с стерильном солевом растворе. Через 90 мин мышей усыпляли в атмосфере СО2/О2 и отбирали образцы крови. В полученной сыворотке определяли содержание TNF- с использованием коммерческого набора для ИФА (ELISA) по инструкции изготовителя (фирмы BioSource International). Исследуемые соединения вводили перорально через различные периоды времени до введения LPS. Соединения вводили в виде соединений или растворов в присутствии различных носителей или солюбилизирующих агентов. с использованием коммерческого набора для ИФА (ELISA) по инструкции изготовителя (фирмы BioSource International). Исследуемые соединения вводили перорально через различные периоды времени до введения LPS. Соединения вводили в виде соединений или растворов в присутствии различных носителей или солюбилизирующих агентов.
Результаты
Все соединения, полученные в примерах, проявляют активность в качестве ингибиторов киназы р38 по данным описанных выше анализов. Ингибирующая активность некоторых соединений по настоящему изобретению в отношении киназы р38 представлена в приведенной ниже таблице. Величина IC50 в отношении киназы р38, обозначенная знаком  +++ +++ , означает активность <1 мкМ, знаком , означает активность <1 мкМ, знаком  ++ ++ – от 1,0 до 10 мкМ и знаком – от 1,0 до 10 мкМ и знаком  + + – >10 мкМ. – >10 мкМ.
| Пример |
IC50 в отношении киназы р38 |
| 1 |
+++ |
| 2 |
+++ |
| 3 |
++ |
| 4 |
+++ |
| 5 |
++ |
| 6 |
+++ |
| 7 |
+++ |
| 8 |
+++ |
| 9 |
+++ |
| 10 |
+++ |
| 18 |
+++ |
| 29 |
+++ |
| 30 |
+++ |
| 33 |
+++ |
| 34 |
+++ |
| 48 |
+++ |
| 49 |
+++ |
| 50 |
+++ |
| 52 |
+++ |
| 53 |
+++ |
| 76 |
+++ |
| 87 |
+++ |
| 128 |
+++ |
| 129 |
+++ |
| 135 |
+++ |
| 148 |
+++ |
| 171 |
+++ |
Поскольку модификации вариантов настоящего изобретения представляются очевидными для специалистов в данной области техники, заявляемый предмет и объем изобретения определены в прилагаемой формуле изобретения.
Формула изобретения
1. Соединение формулы:

или его фармацевтически приемлемая соль,
где R1 означает водород;
R2 означает водород, алкил, алкилтио, алкилсульфонил, необязательно замещенный алкокси, в котором заместитель выбирают из -OR, где R представляет собой алкил; 3-хлорбензоиламинокарбонилметокси, или R2 означает необязательно замещенный -COOR пиперидинилокси, где R представляет собой алкил;
G означает фенил, пиридил, циклогексил, циклопентил, тетрагидропиранил или бензил, и является замещенным группами R3 и R4, при условии, что пиридильное кольцо присоединено к карбонильной группе через атом углерода в цикле, или G означает OR83 или NR80R81;
В означает фенил;
С означает кольцо пиразола или имидазола формул
или  соответственно, соответственно,
где высокие связи связаны с G-C(=0), низкие связи связаны с кольцом В, и средние связи связаны с R1NH;
D означает триазолил или -C(O)NR80xR81x, где R80x и R81x означают водород, алкокси или циклоалкил, включающий одно кольцо из 3-7 атомов углерода;
каждый R80 и R81 независимо означает водород, алкил, циклоалкил, который означает насыщенную неароматическую циклическую углеводородную систему, содержащую 1-2 кольца и от трех до семи атомов углерода в кольце, где циклоалкил может быть необязательно конденсирован с бензольным кольцом, и который является незамещенным или замещен одним или двумя заместителями, независимо выбранными из алкила, 1-этинилциклогексил, метоксибензил, бензил, 3-хлорбензил, циклопентил, 2,4-дихлорбензил, циклогексилметил, 3,4-дихлорбензил, 3-трифторметилбензил, фторбензил, N-этил-2-пирролидинилметил, метилбензил, пиридилметил, морфолинилэтил, 1-циклогексилэтил, 1-фенилэтил или 2-пирролидинилэтил; или R80 и
R81 вместе образуют необязательно замещенный одним или двумя алкилами С4-С5-алкилен;
R83 означает водород или алкил, или циклоалкил, который представляет собой насыщенное неароматическое углеводородное кольцо, содержащее от трех до семи атомов углерода;
R3 выбирают из группы, включающей:
(b) необязательно замещенный гетероциклил, где гетероциклил означает циклический неароматический радикал, содержащий 5-6 кольцевых атомов, где один или два кольцевых атома представляют собой гетероатомы, выбранные из N и О, а оставшиеся атомы являются атомами С, где заместителями могут быть один или два заместителя, независимо выбранных из алкила;
(c) необязательно замещенный гетероарил, который представляет собой моноциклический радикал, содержащий 5-6 кольцевых атомов, где один или два кольцевых атома представляют собой гетероатомы, выбранные из N и О, а оставшиеся атомы являются атомами С, где заместителями могут быть один или два заместителя, независимо выбранных из алкила;
(d) необязательно замещенный гетероциклилалкил, где гетероциклил означает циклический неароматический радикал, содержащий 5-6 кольцевых атомов, где один или два кольцевых атома представляют собой гетероатомы, выбранные из N и О, а оставшиеся атомы являются атомами С, где заместителями могут быть два заместителя, независимо выбранных из алкила;
(f) -Y-(алкилен)-R9, где Y означает -О-, и R9 означает необязательно замещенный алкилом гетероциклил, содержащий 5-6 кольцевых атомов, где один или два кольцевых атома представляют собой гетероатомы, выбранные из N и О, а оставшиеся атомы являются атомами С, оксадиазолил, -СООН, -COOR11 или -CONR12R13, где R11 означает алкил, а R12 и R13 каждый независимо друг от друга означают водород или алкил;
(g) -CONR25R26, где R25 и R26 независимо означают водород или алкил, или R25 и R26 вместе с атомом азота, к которому они присоединены, образуют пирролидин, пиперидин, морфолин или пиперазин;
(h) водород;
(i) галоген;
(j) циано;
(k) гидрокси;
(1) алкокси, необязательно замещенный одним заместителем, выбранным из фенила, -CONR’R”, где R’ и R” вместе образуют пирролидин, пиперазин или морфолин, NRR’, где R и R’ независимо выбраны из водорода и алкила, необязательно замещенного гидрокси, и -OR, где R означает водород или алкил;
(m) C(L)R40, где L означает О; R40 означает водород, OR55 или NR57 R58, где R55 означает водород или алкил, R57 и R58 каждый независимо означает водород, циклоалкил, содержащий одно кольцо из 3-7 атомов углерода, алкил, замещенный диалкиламино, ди(гидроксиалкил)амино или вышеуказанным циклоалкилом;
(n) алкил или гидроксиалкил;
(о) 2-(4-метилпиперазин-1-ил)-2-оксоэтокси, 2-(3-аминопирролидин-1-ил)-2-оксоэтокси, 2-(3-метиламинопирролидин-1-ил)-2-оксоэтокси, [(1Н-бензоимидазол-2-илметил)карбамоил]метокси, [2-(2-бензилокси-5-хлорфенил)этилкарбамоил]метокси, [2-(5-хлор-2-гидроксифенил)этилкарбамоил]метокси, 2-(3,5-диметилпиперизин-1-ил)-2-оксоэтокси или 4-хлорфеноксиэтокси;
(р) циклопропокси;
(q) метилтио; и
(r) метилсульфонил;
R4 выбирают из группы, включающей
(a) водород;
(b) галоген;
(c) алкил;
(d) алкокси; и
(e) гидрокси;
или R3 и R4, которые являются заместителями соседних атомов в цикле, вместе образуют алкилендиокси;
R5 означает водород;
R6 выбирают из группы, включающей
(a) водород; и
(b) алкил;
или соединение представляет собой
3-(5-амино-4-{3-[(3-хлорбензиламино)метил]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-{[2-(3-хлорфенил)этиламино]метил}бензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[4-(3-хлорфенил)пиперазин-1-илметил]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-{[2-(2-бензилокси-5-хлорфенил)этиламино]-метил}бензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[(2-морфолин-4-илэтиламино)метил]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[(3-морфолин-4-илпропиламино)метил]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-винилоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
фениламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-(5-амино-4-бензоилпиразол-1-ил)-4-метилбензойную кислоту,
3-[5-амино-4-(3-йодбензоил)пиразол-1-ил]-4-метилбензойную кислоту,
3-[5-амино-4-бензоил-3-(2-бензилоксиэтокси)пиразол-1-ил]N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(2-диметиламиноэтилкарбамоил)бензоил]имидазол-1-ил}-]N-циклопропил-4-метилбензамид, или
трет-бутиловый эфир {3-[5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-имидазол-4-карбонил]фенокси}уксусной кислоты, или их фармацевтически приемлемая соль.
2. Соединение по п.1, где G означает OR83 или NR80R81.
3. Соединение по п.1, где R80 и R81 каждый независимо означает водород, циклогексил, 2-метилциклогексил, 3-пентил, бицикло[2.2.1]гептил, 1-этинилциклогексил, метоксибензил, бензил, циклопропил, 3-хлорбензил, циклопентил, 2,4-дихлорбензил, циклогексилметил, 3,4-дихлорбензил, 4-метилциклогексил, 3-трифторметилбензил, 4-трет-бутилциклогексил, неопентил, фторбензил, N-этил-2-пирролидинилметил, метилбензил, пиридилметил, морфолинилэтил, 1-циклогексилэтил, 1-фенилэтил или 2-пирролидинилэтил.
4. Соединение по п.1, где G означает NH2 или NН(пиклогексил).
5. Соединение по п.1, где G означает фенил, пиридил, циклогексил, циклопентил или бензил, замещенные группами R3 и R4.
6. Соединение по п.1, где G означает фенил, замещенный группами R3 и R4.
7. Соединение по п.1 формулы III:
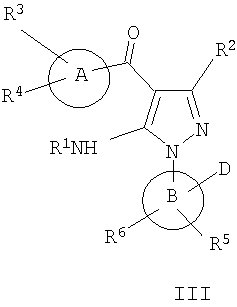
которая соответствует формуле, приведенной в п.1, или его фармацевтически приемлемая соль, где А соответствует G и означает фенил, пиридил, циклогексил, циклопентил или бензил.
8. Соединение по п.1 формулы VII:
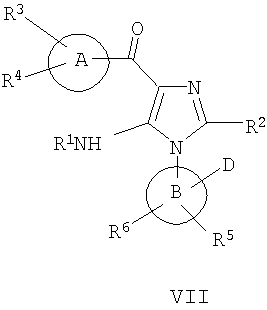
которая соответствует формуле, приведенной в п.1, или его фармацевтически приемлемая соль, где А соответствует G и означает фенил, пиридил, циклогексил, циклопентил или бензил.
9. Соединение по п.1, где R2 означает водород или (низш.)алкил.
10. Соединение по п.1, где R2 означает водород, метил, н-пропил или 3-хлорбензиламинокарбонилметокси.
11. Соединение по п.7, где А означает фенил.
12. Соединение по п.7, где В означает фенил.
13. Соединение по п.7, где D означает 1,2,4-триазол-3-ил.
14. Соединение по п.7, где R3 означает циано.
15. Соединение по п.1, где R3 означает водород, диоксоланил, пиримидинил, пиридил, пиразинил, циано, оксадиазолил, триазолил, метилтио или метансульфонил.
16. Соединение по п.7, где R3 означает N-морфолинилметил, гидроксиметил, N-(2-(3-хлорфенил)-1-этил)аминометил, N-(2-морфолинил-1-этил)аминометил, (3-хлорбензиламино)метил, 4-(3-хлорфенил)пиперазин-1-илметил, [2-(2-бензилокси-5-хлорфенил)этиламино]метил, (3-морфолин-4-илпропиламино)метил, карбамоилметокси, 2-(4-метилпиперазин-1-ил)-2-оксоэтокси, 2-оксо-2-пиперазин-1-илэтокси, 2-(3-аминопирролидин-1-ил)-2-оксоэтокси, 2-(3-метиламинопирролидин-1-ил)-2-оксоэтокси, 2-(3,5-диметилпиперазин-1-ил)-2-оксоэтокси, 2-морфолин-4-ил-2-оксоэтокси, [(1Н-бензоимидазол-2-илметил)карбамоил]метокси, [2-(2-бензилокси-5-хлорфенил)этилкарбамоил]метокси, [2-(5-хлор-2-гидроксифенил)этилкарбамоил]метокси или 4-пиперизинилметил.
17. Соединение по п.7, где R4 означает водород.
18. Соединение по п.1, которое имеет одну из следующих формул III или VII, соответственно,
 или или 
в которых А соответствует G в формуле, приведенной в п.1, и где
R1 означает водород;
R2 означает водород, алкил или алкилтио;
А означает фенил;
В означает фенил;
D означает триазолил или -C(O)NR80xR81x, где R80x и R81x означают водород, алкокси или циклоалкил, включающий одно кольцо из 3-7 атомов углерода;
R3 выбирают из группы, включающей:
(b) необязательно замещенный гетероциклил, где гетероциклил означает циклический неароматический радикал, содержащий 5-6 кольцевых атомов, где один или два кольцевых атома представляют собой гетероатомы, выбранные из N и О, а оставшиеся атомы являются атомами С, где заместителями могут быть один или два заместителя, независимо выбранных из алкила;
(c) необязательно замещенный гетероарил, который представляет собой моноциклический радикал, содержащий 5-6 кольцевых атомов, где один, два или три кольцевых атома представляют собой гетероатомы, выбранные из N и О, а оставшиеся атомы являются атомами С, где заместителями могут быть один или два заместителя, независимо выбранных из алкила;
(d) необязательно замещенный гетероциклилалкил, где гетероциклил означает циклический неароматический радикал, содержащий 5-6 кольцевых атомов, в которых один или два кольцевых атома представляют собой гетероатомы, выбранные из N и О, а оставшиеся атомы являются атомами С, где заместителями могут быть два заместителя, независимо выбранных из алкила;
(f) -Y-(алкилен)-R9, где Y означает -О-, и R9 означает необязательно замещенный алкилом гетероциклил, содержащий 5-6 кольцевых атомов, где один или два кольцевых атома представляют собой гетероатомы, выбранные из N и О, а оставшиеся атомы являются атомами С, оксадиазолил, -СООН, -COOR11 или -CONR12R13, где R11 означает алкил, а R12 и R13 каждый независимо друг от друга означают водород или алкил;
(g) -CONR25R26, где R25 и R26 независимо означают водород или алкил, или R25 и R26 вместе с атомом азота, к которому они присоединены, образуют пирролидин, пиперидин, морфолин или пиперазин;
(h) водород;
(j) циано;
R4 выбирают из группы, включающей
(a) водород;
(b) галоген;
(c) алкил;
(d) алкокси; и
(e) гидрокси;
R5 означает водород;
R6 выбирают из группы, включающей
(a) водород; и
(b) алкил;
или его фармацевтически приемлемая соль.
19. Соединение по п.18, где R1 и R2 означают водород, а В означает фенил.
20. Соединение по п.7, где R3 находится в положении 3.
21. Соединение по п.7, где R3 находится в положении 3 и его выбирают из группы, включающей гидроксиметил, 1,2-дигидроксиэтил, 3-гидрокси-3-метил-1-бутил или 3-гидроксибутил.
22. Соединение по п.1, которое выбирают из группы, включающей
3-[5-амино-4-(3-йодбензоил)пиразол-1-ил]-N-метокси-4-метилбензамид,
3-(5-амино-4-бензоилпиразол-1-ил)-N-метокси-4-метилбензамид,
3-(5-амино-4-бензоилпиразол-1-ил)-4-метилбензойную кислоту,
3-(5-амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-4-метилбензойную кислоту,
3-[5-амино-4-(3-иодбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
{5-амино-1-[2-метил-5-(4Н-[1,2,4]триазол-3-ил)фенил]-1Н-пиразол-4-ил}фенилметанон,
3-[5-амино-4-(3-[1,3]диоксолан-2-ил-бензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-формилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-гидроксиметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(4-метилпиперазин-1-илметил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-морфолин-4-илметилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(2-морфолин-4-илэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-бензилоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-гидроксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид, и
3-(5-амино-4-бензоилимидазол-1-ил)-]-N-циклопропил-4-метилбензамид.
23.Соединение по п.7, которое представляет собой 3-(5-амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамид.
24. Соединение по п.1, которое выбирают из группы, включающей
3-(5-амино-4-бензоилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-циклогексанкарбонилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-циклопентанкарбонилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-фенилацетилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-изопропилкарбамоилбензоил)имидазол-1-ил]-Н-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-этилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-метилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-циклопропилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-циклопентилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(морфолин-4-карбонил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(циклопропилметилкарбамоил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(тетрагидропиран-4-карбонил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-3-метоксипиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-3-этоксипиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-бензоил-3-(2-метоксиэтокси)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-бензоил-3-(2-бензилоксиэтокси)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
трет-бутиловый эфир 4-[5-амино-4-бензоил-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-3-илокси]пиперидин-1-карбоновой кислоты,
3-[5-амино-4-бензоил-3-(пиперидин-4-илокси)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-3-метилсульфанилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-3-метансульфонилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1 Н-пиразол-4-карбоновой кислоты,
амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метансульфонил-1 Н-пиразол-4-карбоновой кислоты,
этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метилсульфанил-1Н-пиразол-4-карбоновой кислоты,
3-[5-амино-4-(3-хлорбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(2-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(2-метоксибензоил)пиразол-1-ил]-Н-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-хлорбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(2-хлорбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-метоксибензоил)пиразол-1-ил]-4-N-циклопропил-4-метилбензамид,
этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
этиловый эфир 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-3-метил-1Н-пиразол-4-карбоновой кислоты,
этиловый эфир 5-амино-3-[(3-хлорбензилкарбамоил)метокси]-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-(5-амино-4-бензоилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-цианобензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-[1,3,4]оксадиазол-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(5-метил[1,3,4]оксадиазол-2-ил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(пирролидин-1-карбонил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-циклопропилкарбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-карбамоилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-изопропилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-метилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-циклопропилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-карбамоилбензоил)-пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(пиперазин-1-карбонил)-бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-диметилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(циклопропилметилкарбамоил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-этилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-метилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-циклопентилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-изопропилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-циклопропилкарбамоилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[(3-хлорбензиламино)метил]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-{[2-(3-хлорфенил)этиламино]метил}бензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[4-(3-хлорфенил)пиперазин-1-илметил]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-{[2-(2-бензилокси-5-хлорфенил)этиламино]-метил}бензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[(2-морфолин-4-илэтиламино)метил]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[(3-морфолин-4-илпропиламино)метил]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(пиридин-2-карбонил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(2-метилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3,4-дифторбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-фторбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3,4-дихлорбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-метоксибензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-фторбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3,5-дихлорбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-метоксибензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
трет-бутиловый эфир 3-[5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-имидазол-4-карбонил]бензойной кислоты,
3-[5-амино-4-(3,5-дифторбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(бензо[1,3]диоксол-5-карбонил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-хлорбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3,4-диметоксибензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-бензилоксибензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-фтор-3-метилбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-хлорбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-2-метилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-бензоил-2-пропилимидазол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-карбамоилметоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[2-(4-метилпиперазин-1-ил)-2-оксоэтокси]бензоил}-пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(2-оксо-2-пиперазин-1-илэтокси)бензоил]-пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[2-(3-аминопирролидин-1-ил)-2-оксоэтокси]-бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[2-(3-метиламинопирролидин-1-ил)-2-оксоэтокси]-бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[2-(3,5-диметилпиперазин-1-ил)-2-оксоэтокси]-бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(2-морфолин-4-ил-2-оксоэтокси)бензоил]-пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-{[(1Н-бензоимидазол-2-илметил)карбамоил]-метокси}бензоил)-пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-{[2-(2-бензилокси-5-хлорфенил)этилкарбамоил]-метокси}бензоил)-пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-{[2-(5-хлор-2-гидроксифенил)этилкарбамоил]-метокси}бензоил)-пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-пиразин-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-пиридин-2-илбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(пиридин-2-карбонил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-циклопентанкарбонилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(бензо[1,3]диоксол-5-карбонил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(2-фторбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-этоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-метоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-циклопропоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-метоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3,4-диметоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-метилсульфанилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-метилсульфанилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-фторбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-фторбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3,4-дифторбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3,5-дифторбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-фтор-3-метилбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(4-фторбензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-(5-амино-4-циклогексанкарбонилпиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-винилоксибензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-([1,3,4]оксадиазол-2-илметокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
(2-метилциклогексил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
фениламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(1-этилпропил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1 Н-пиразол-4-карбоновой кислоты,
бицикло[2.2.1]гепт-2-иламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(1-этинилциклогексил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-[5-амино-4-(2,5-диметилпирролидин-1-карбонил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
4-метоксибензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
индан-1-иламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
бензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-[5-амино-4-(пиперидин-1-карбонил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
циклогексиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
циклопропиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-хлорбензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
циклопентиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
2,4-дихлорбензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
циклогексилметиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3,4-дихлорбензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(4-метилциклогексил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-трифторметилбензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(4-трет-бутилциклогексил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(2,2-диметилпропил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-метоксибензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
4-фторбензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(1-этилпирролидин-2-илметил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
2-метилбензиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(пиридин-2-илметил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(2-морфолин-4-илэтил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(1-циклогексилэтил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(1-фенилэтил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(2,2-диметилпропил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
(2-пирролидин-1-илэтил)амид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
циклогексилметиламид 5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-1Н-пиразол-4-карбоновой кислоты,
3-[5-амино-4-(3-цианобензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-пиразин-2-илбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-пиримидин-5-илбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-пиридин-2-илбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-пиримидин-2-илбензоил)имидазол-1-ил]-N-циклопропил-4-метилбензамид,
5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-4-метилсульфонилбензоил-1Н-имидазол,
5-амино-1-(5-циклопропилкарбамоил-2-метилфенил)-4-[3-(5-метил)оксадиазол-3-илбензоил]-1Н-имидазол,
3-(5-амино-4-{3-[2-(4-метилпиперазин-1-ил)этокси]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-[5-амино-4-(3-{2-[бис-(2-гидроксиэтил)амино]этокси}бензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(2-диметиламиноэтокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(2,3-дигидроксипропокси)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид,
3-(5-амино-4-{3-[2-(4-хлорфенокси)этокси]бензоил}пиразол-1-ил)-N-циклопропил-4-метилбензамид,
3-{5-амино-4-[3-(4Н-[1,2,4]триазол-3-ил)бензоил]пиразол-1-ил}-N-циклопропил-4-метилбензамид, и
3-{5-амино-4-[3-(4Н-[1,2,4]триазол-3-ил)бензоил]имидазол-1-ил}-N-циклопропил-4-метилбензамид,
или его фармацевтически приемлемая соль.
25. Соединение по п.7, которое представляет собой 3-(5-амино-4-бензоил-3-метоксипиразол-1-ил)-N-циклопропил-4-метилбензамид.
26. Соединение по п.7, которое представляет собой 3-[5-амино-4-(3-цианобензоил)пиразол-1-ил]-N-циклопропил-4-метилбензамид.
27. Фармацевтическая композиция, ингибирующая киназу р38, включающая соединение по п.7 или 26 и фармацевтически приемлемый носитель.
28. Фармацевтическая композиция по п.27, полученная для введения в виде единой лекарственной формы.
29. Соединение по п.7 или 26, предназначенное для лечения, профилактики или снижения интенсивности одного или более симптомов опосредованного киназой р38 заболевания или состояния.
30. Применение соединения по п.7 или 26 для получения лекарственного средства, предназначенного для лечения, профилактики или снижения интенсивности одного или более симптомов опосредованного киназой р38 заболевания или состояния.
31. Способ индукции ответной цитокиновой реакции, где ответную цитокиновую реакцию индуцируют с использованием активности киназы р38, включающий введение субъекту, нуждающемуся в этом, соединения по п.7 или 26.
|
|