|
|
(21), (22) Заявка: 2006107565/15, 13.08.2004
(24) Дата начала отсчета срока действия патента:
13.08.2004
(30) Конвенционный приоритет:
13.08.2003 US 60/494,962
12.05.2004 US 60/570,368
09.07.2004 US 60/586,509
(43) Дата публикации заявки: 27.08.2006
(46) Опубликовано: 10.02.2010
(56) Список документов, цитированных в отчете о
поиске:
Michael F. et al. Induction of antibodies against murine fall-length prion protein in wild-type mice. Journal of Neuroimmunology. 2002, Vol.132, pages 113-116. US 6,370,214 B1, 16.04.2002.
(85) Дата перевода заявки PCT на национальную фазу:
13.03.2006
(86) Заявка PCT:
US 2004/026363 20040813
(87) Публикация PCT:
WO 2005/016127 20050224
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
МИХЕЛИЧ Мелисса Д. (US),
ХУ Селин (US),
ЗУКЕРМАНН Рональд (US),
КОННОЛЛИ Майкл Д. (US)
(73) Патентообладатель(и):
НОВАРТИС ВЭКСИНЕС ЭНД ДАЙЭГНОСТИКС, ИНК. (US)
|
(54) СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ ПРИОНОВ ПЕПТИДНЫЕ РЕАГЕНТЫ
(57) Реферат:
Изобретение относится к пептидным реагентам, которые взаимодействуют с прионными белками, к полинуклеотидам, кодирующим эти пептидные реагенты, к способам получения антител с использованием таких пептидных реагентов и полинуклеотидов, и к антителам, полученным с использованием этих способов. Заявлен выделенный пептидный реагент, который преимущественно взаимодействует с патогенными формами белка конформационного заболевания по сравнению с непатогенными формами белка конформационного заболевания, где пептидный реагент получают из фрагмента пептидного белка, где пептидный реагент получают из пептида, выбранного из группы, включающей пептиды с SEQ ID NO:12-132. Заявленное изобретение обеспечивает обнаружение патогенных прионов в образце и могут быть использованы в качестве компонентов терапевтической или профилактической композиции и/или для образования специфичных в отношении прионов антител. 20 н. 32 з.п. ф-лы, 4 табл., 5 ил.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к пептидным реагентам, которые взаимодействуют с прионными белками, к полинуклеотидам, кодирующим эти пептидные реагенты, к способам получения антител с использованием таких пептидных реагентов и полинуклеотидов, и к антителам, полученным с использованием этих способов. Изобретение также относится к способам применения этих пептидных реагентов для обнаружения патогенных прионов в образце и к способам применения этих пептидных реагентов в качестве компонентов терапевтической или профилактической композиции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Заболевания, связанные с конформацией белка, охватывают различные неродственные заболевания, включая инфекционные губчатые энцефалопатии, происходящие вследствие аномального конформационного изменения белка (белка конформационного заболевания), которое, в свою очередь, приводит к самопроизвольной ассоциации аномальных форм белка, с последующим замещением и повреждением ткани. Такие заболевания также имеют замечательное сходство в клинических проявлениях, обычно быстрое прогрессирование от диагностики до смерти после различной длительности инкубационного периода.
Одна из групп конформационных заболеваний называется «прионные заболевания» или «инфекционные губчатые энцефалопатии (TSE)». У людей такие заболевания включают болезнь Крейтцфельдта-Якоба (CJD), синдром Герштманна-Штрауслера-Шейнкера (GSS), фатальную семейную бессонницу и куру (см., например, Harrison’s Principles of Internal Medicine, Isselbacher et al., eds., McGraw-Hill, Inc. New York, (1994); Medori et al. (1992) N.Engl. J. Med. 326: 444-9). У животных TSE включают скрэпи овец, губчатую энцефалопатию крупного рогатого скота (BSE), инфекционную энцефалопатию норок и болезнь хронической усталости рожденного в неволе гибрида оленя и лося (Gajdusek, (1990) Subacute Spongiform Encephalopathies: Transmissible Cerebral Amyloidoses Caused by Unconventional Viruses. Pp. 2289-2324 In: Virology, Fields, ed. New York: Raven Press, Ltd.). Инфекционные губчатые энцефалопатии характеризуются следующими отличительными признаками: наличием аномальной (богатой бета-структурой, устойчивой к протеиназе K) конформации прионного белка, которая переносит заболевание при экспериментальной инокуляции лабораторным животным, включая приматов, грызунов и трансгенных мышей.
Недавнее быстрое распространение губчатой энцефалопатии крупного рогатого скота и его корреляция с повышенной частотой губчатых энцефалопатий у людей привело к значимому повышению интереса к обнаружению инфекционных губчатых энцефалопатий у неотносящихся к человеку млекопитающих. Трагические последствия случайной передачи этих заболеваний (см., например, Gajdusek, Infectious Amyloids, и Prusiner, Prions In Fields Virology. Fields, et al., eds. Lippincott-Ravin, Pub. Philadelphia (1996); Brown et al. (1992) Lancet, 340: 24-27), трудности в дезинфекции (Asher et al. (1986) pages 59-71 In: Laboratory Safety: Principles and Practices, Miller ed. Am. Soc.Micro.), и недавний интерес к губчатой энцефалопатии крупного рогатого скота (British Med. J. (1995) 311: 1415-1421) поддерживают срочную потребность в диагностическом тесте, который мог бы идентифицировать людей и животных с инфекционными губчатыми энцефалопатиями, и в способах лечения инфицированных индивидуумов.
Прионы представляют собой инфекционный патоген, который вызывает губчатые энцефалопатии (прионные заболевания). Прионы значимо отличаются от бактерий, вирусов и вироидов. Основной гипотезой является то, что в отличие от других инфекционных патогенов инфекция вызвана аномальной конформацией прионного белка, которая действует как шаблон и преобразует нормальные конформации приона в аномальные конформации. Прионный белок впервые был охарактеризован в начале 1980-х. (См., например, Bolton, McKinley et al. (1982) Science 218: 1309-1311; Prusiner, Bolton et al. (1982) Biochemistry 21: 6942-6950; McKinley, Bolton et al. (1983) Cell 35: 57-62). Гены, кодирующие полный прионный белок, были затем клонированы, секвенированы и экспрессированы в трансгенных животных. См., например, Basler, Oesch et al. (1986) Cell 46: 417-428.
Ключевой характеристикой прионных заболеваний является образование белка аномальной формы (PrPSc), также называемого белком скрэпи, из нормальной (клеточной или непатогенной) формы прионного белка (PrPC). См., например, Zhang et al. (1997) Biochem. 36 (12): 3543-3553; Cohen & Prusiner (1998) Ann Rev. Biochem. 67: 793-819; Pan et al. (1993) Proc Natl Acad Sci USA 90: 10962-10966; Safar et al. (1993) J Biol Chem 268: 20276-20284. Оптическая спектроскопия и кристаллографические исследования выявили, что связанные с заболеванием формы прионов существенно обогащены бета-структурой по сравнению с преимущественно обладающими альфа-спиральным скручиванием, не связанными с заболеванием формами. См., например, Wille et al. (2001) Proc. Nat’l Acad. Sci. USA 99: 3563-3568; Peretz et al. (1997) J. Mol. Biol. 273: 614-622; Cohen & Prusiner, Chapter 5: Structural Studies of Prion Proteins in PRION BIOLOGY AND DISEASES, ed. S. Prusiner, Cold Spring Harbor Laboratory Press, 1999, pp: 191-228). За структурными изменениями, оказывается, следуют изменения биохимических свойств: PrPC растворим в неденатурирующих детергентах, PrPSc нерастворим; PrPC легко расщепляется протеазами, тогда как PrPSc частично устойчив, что приводит к образованию укороченного по N-концу фрагмента, известного как «PrPres» (Baldwin et al. (1995); Cohen & Prusiner (1995)),”PrP 27-30″ (27-30 kDa) или «PK-устойчивая» (устойчивая к протеиназе K) форма. Кроме того, PrPSc может преобразовывать PrPC в патогенную конформацию. См., например, Kaneko et al. (1995) Proc. Nat’l Acad. Sci. USA 92: 11160-11164; Caughey (2003) Br Med Bull. 66: 109-20.
Обнаружение патогенных изоформ белков конформационных заболеваний в живых индивидуумах и образцах, полученных из живых индивидуумов, оказалось сложным. Таким образом, окончательный диагноз и паллиативные способы лечения данных инфекционных и содержащих амилоид состояний до гибели индивидуума остаются, по существу, нерешенной задачей. Гистопатологическая оценка биопсий мозга рискованна для индивидуума, и повреждения и отложения амилоида могут быть потеряны в зависимости от того, откуда взят биопсийный образец. Однако еще имеется риск, связанный с биопсиями, для животных, пациентов и медицинского персонала. Далее результаты тестов головного мозга животных обычно не успевают получить до того, как животное пойдет в пищу. Кроме того, антитела, полученные против прионных пептидов, распознают как денатурированный PrPSc, так и PrPC, но не способны избирательно распознавать инфекционный (неденатурированный) PrPres. (См., например, Matsunaga et al. (2001) PROTEINS: Structure, Function and Genetics 44: 110-118).
Таким образом, сохраняется потребность в композиции и способах обнаружения патогенных прионных белков в различных образцах, например в образцах, полученных от живых индивидуумов, в продуктах крови, в сельскохозяйственных животных и в других источниках питания человека и животных. Кроме того, остается необходимость в способах и композициях для диагностики и лечения, связанных с прионами заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение частично относится к пептидным реагентам, которые взаимодейествуют с прионными белками. Более конкретно, описанные здесь пептидные реагенты взаимодействуют преимущественно с патогенными изоформами прионных белков. Эти пептидные реагенты могут использоваться в различных применениях, включая средства для обнаружения патогенных прионов или для обнаружения патогенных прионов в образце, в качестве компонентов терапевтической или профилактической композиции и/или для образования специфичных в отношении прионов антител.
Например, пептидные реагенты, которые взаимодействуют предпочтительно с PrPSc по сравнению с PrPC, могут использоваться для прямого обнаружения патогенных форм в образцах, полученных из живых индивидуумов, например, для диагностики заболевания или для скрининга образцов донорской крови или скрининга донорских органов для трансплантации.
В более широком аспекте изобретение относится к пептидному реагенту, который преимущественно взаимодействует с патогенными формами белка конформационного заболевания. В некоторых вариантах осуществления описанные здесь пептидные реагенты взаимодействуют предпочтительно с патогенными формами прионного белка по сравнению с непатогенными формами прионного белка. Описанные здесь пептидные реагенты могут быть полностью или частично синтетическими, например, могут включать в себя одну или несколько следующих групп: циклизованные остатки или пептиды, мультимеры пептидов, метки, и/или другие химические радикалы. Примеры подходящих пептидных реагентов включают в себя те, что получают из пептидов SEQ ID NO: 12-132, например, пептидов, таких как те, что обозначены на SEQ ID NO: 66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126, 127, 14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 128, 129, 130, 131, 132, 56, 57, 65, 82, или 84, и их аналогов и производных. Описанные здесь пептидные реагенты могут взаимодействовать с любыми белками конформационных заболеваний, например, прионные белки (например, патогенный белок PrPSc, и непатогенную форму PrPC). В некоторых вариантах осуществления пептидные реагенты взаимодействуют предпочтительно с PrPSc по сравнению с PrPC. Пептидные реагенты, в основном, являются специфичными в отношении PrPSc более из одного вида, но могут быть специфичны в отношении PrPSc из одного вида.
В другом варианте осуществления пептидные реагенты, полученные из пептидов, показанных в любой из описанных здесь последовательностей. В некоторых вариантах осуществления использованы пептидные реагенты, полученные из областей прионного белка, например из тех областей, которые соответствуют остаткам 23-43 или 85-156 (например, 23-30, 86-111, 89-112, 97-107, 113-135, и 136-156, пронумерованными согласно последовательности мышиного приона, показанной в SEQ ID NO: 2). Для удобства номера аминокислотных остатков, приведенные выше, соответствуют последовательности мышиного прионного белка SEQ ID NO: 2; обычный специалист в данной области может легко идентифицировать соответствующие области в прионных белках других видов, основываясь на последовательностях, известных в данной области и на предоставленных здесь сведениях. Типовые пептидные реагенты включают в себя те, что получают из пептидов, имеющих SEQ ID NO: 66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126, или 127; или из пептидов, имеющих SEQ ID NO: 14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 129, 130, 131, 132 или 128; или из пептидов, имеющих SEQ ID NO: 56, 57, 65, 82 или 84.
В другом аспекте изобретение относится к комплексу, содержащему один или несколько пептидных реагентов, описанных здесь, и прионный белок.
В другом аспекте – способ получения антител, которые распознают прионные белки, причем данный способ включает в себя стадию введения любого из пептидных реагентов, описанных здесь (или полинуклеотидов, кодирующих пептидные реагенты) индивидууму (например, животному). В некоторых вариантах осуществления способ далее включает в себя стадию выделения антител из животного. Связанный аспект изобретения относится к антителам, полученным данным способом. Предпочтительные антитела специфичны в отношении патогенных форм.
Еще в одном аспекте изобретение относится к комплексу, содержащему любое из описанных здесь антител и прионный белок. В некоторых вариантах осуществления прионный белок представляет собой непатогенную изоформу, в то время как в других вариантах осуществления она представляет собой патогенную изоформу.
Любой из описанных здесь пептидных реагентов и/или антител может кодироваться, полностью или частично, одним или несколькими полинуклеотидами, которые также образуют часть настоящего изобретения.
Еще в одном аспекте предоставляются способы для обнаружения прионных белков. Способы обнаружения могут использоваться, среди прочих, в связи со способами диагностики связанного с прионами заболевания (например, у людей или у индивидуумов-животных, не относящихся к людям), при обеспечении поставки крови, продуктов крови, или поставки пищевых продуктов, по существу, лишенных PrPSc, при анализе образцов органов или тканей для трансплантации, при мониторинге отсутствия контаминации хирургических инструментов и оборудования, а также любой другой ситуации, в которой важно знание наличия или отсутствия патогенного приона.
Способы обнаружения основываются на преимущественном взаимодействии пептидных реагентов по изобретению с патогенной изоформой приона. В некоторых вариантах осуществления предоставляется способ обнаружения патогенного приона в биологическом образце.
В одном из вариантов осуществления способ включает в себя контакт образца, подозреваемого в наличии в нем патогенного приона, с одним или несколькими описанными здесь пептидными реагентами, в условиях, которые обеспечивают взаимодействие пептидного(-ых) реагента(-ов) и патогенного приона, если он присутствует; и обнаружение наличия или отсутствия патогенного приона в образце за счет его связывания с пептидным(-и) реагентом(-ами). Взаимодействие пептидного(-ых) реагента(-ов) и патогенного приона может осуществляться в растворе, или один или несколько реагентов могут предоставляться в твердой фазе или на ней. Могут проводиться анализы сэндвич-типа, в которых пептидные реагенты по изобретению могут использоваться в качестве реагентов для захвата, реагентов для обнаружения или обоих. Другие связывающие прион реагенты (например, антитела и другие связывающие молекулы, которые связываются с денатурированным прионным белком), могут применяться в данном аспекте в комбинации с пептидными реагентами по изобретению.
В одном из аспектов данного изобретения один или несколько пептидных реагентов по настоящему изобретению получаются на твердой основе и контактируют с образцом, в котором предполагается наличие патогенного приона, в условиях, которые обеспечивают связывание патогенного приона, если он присутствует, с пептидным реагентом. Несвязанные материалы образца, включая любой непатогенный прион, могут удаляться, и патогенный прион может обнаруживаться, оставаясь связанным с пептидным реагентом, или после диссоциации от пептидного реагента. Патогенный прион может обнаруживаться с использованием меченого и способного к визуализации пептидного реагента (того же пептида, который использовали для «захвата» патогенного приона или второго пептидного реагента по изобретению) или меченого и способного к визуализации антитела против приона или другого связывающего прион реагента. Это антитело или связывающий прион реагент не обязательно специфичен к патогенной форме приона.
В другом аспекте данного варианта осуществления связывающий прион реагент предоставляется на твердой основе и контактирует с образцом, в котором предполагается наличие патогенного приона, в условиях, которые обеспечивают связывание патогенного приона, если он присутствует, со связывающим прион реагентом. Несвязанные материалы образца могут удаляться, и патогенный прион может обнаруживаться, оставаясь связанным с пептидным реагентом, или после диссоциации от пептидного реагента. Патогенный прион может выявляться с использованием одного или нескольких меченых и способных к визуализации пептидных реагентов по изобретению.
В другом аспекте данного изобретения патогенный прион в образце может неспецифично связываться с твердой основой (например, с планшетом ELISA) и выявляться путем связывания одного или нескольких меченых и способных к визуализации пептидных реагентов по изобретению, которые взаимодействуют предпочтительно с патогенной изоформой приона.
В дополнительном варианте осуществления способ предусматривает контактирование образца, в котором предполагается наличие патогенного приона, с одним или несколькими пептидными реагентами, выбранными из группы, включающей пептиды, с последовательностями SEQ ID NO: 12-132, и их аналогами и производными, в условиях, которые обеспечивают связывание пептидного(-ых) реагента(-ов) с патогенным прионом, если он присутствует; и обнаружение наличия или отсутствия патогенного приона в образце путем его связывания с пептидным(-и) реагентом(-ами). В предпочтительных вариантах осуществления образец контактирует с одним или несколькими пептидными реагентами, выбранными из группы, включающей пептиды, с последовательностями SEQ ID NO: 66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126, 127, 14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 128, 129, 130, 131, 132, 56, 57, 65, 82 или 84, и из аналогов и производных.
В других вариантах осуществления предоставляется способ обнаружения патогенного приона в образце, причем данный способ предусматривает: получение твердой основы, содержащей первый пептид, где первый пептид включает в себя один или несколько пептидных реагентов, описанных здесь, которые предпочтительно взаимодействуют с PrP; контактирование твердой основы с образцом в условиях, которые позволяют патогенным прионам, присутствующим в образце, связываться с первым пептидом; контактирование твердой основы с меченым и способным к визуализации вторым пептидом, где второй пептид включает в себя один или несколько пептидных реагентов, описанных здесь, которые взаимодействуют преимущественно с белками PrPSc, в условиях, которые позволяют второму пептиду связываться с патогенными прионами, связанными с первым пептидом; и обнаружение комплексов, образованных между первым пептидом, патогенным прионом из образца и вторым пептидом, с обнаружением таким образом наличия в образце патогенного приона.
В других вариантах осуществления предоставляется способ обнаружения патогенного приона в образце, предусматривающий: получение твердой основы, содержащей связывающий прион реагент, где связывающий прион реагент связывается с прионными белками; контактирование твердой основы с образцом в условиях, которые позволяют прионным белкам, если они присутствуют в образце, связываться со связывающим прион реагентом; контактирование твердой основы с меченым и способным к визуализации пептидным реагентом по изобретению, где пептидный реагент преимущественно взаимодействует с патогенным прионным белком; и обнаружение комплексов, образованных между связывающим прион реагентом, патогенным прионом из образца и пептидным реагентом.
В другом варианте осуществления предоставляется способ обнаружения патогенного приона в образце, причем данный способ включает в себя стадии получения твердой основы, содержащей описанный здесь первый пептидный реагент, где указанный первый пептидный реагент преимущественно взаимодействует с патогенными формами; контактирование твердой основы с меченым и способным к визуализации первым лигандом (например, плазминогеном, рецептором ламинина и гепаран-сульфатом), в условиях, которые обеспечивают образование комплекса меченый и способный к визуализации пептидный реагент-лиганд, где сродство связывания первого пептидного реагента в отношении меченого и способного к визуализации первого лиганда слабее, чем сродство связывания первого пептидного реагента в отношении патогенного приона; контактирование образца, в котором предполагается наличие патогенных прионов с твердой основой в условиях, которые позволяют патогенному приону, если он присутствует в образце, связываться с первым пептидом и замещать первый лиганд; и обнаружение патогенного приона в образце путем снижения количества меченого и способного к визуализации лиганда на твердой основе.
Любые из указанных выше способов обнаружения патогенных прионов могут использоваться в способе диагностики связанных с прионами заболеваний.
Настоящее изобретение также относится к способу выделения патогенного приона, предусматривающему: получение твердой основы, содержащей один или несколько пептидных реагентов по изобретению, контактирование твердой основы с образцом, о котором известно, или в котором предполагается наличие патогенного приона, в условиях, которые обеспечивают связывание патогенного приона, если он присутствует, с пептидным реагентом; и удаление любых несвязавшихся материалов образца. Дополнительные варианты осуществления далее включают в себя стадию диссоциации связанного патогенного приона и пептидного реагента и, необязательно, получения диссоциированного патогенного приона.
Настоящее изобретение также относится к способу удаления патогенных прионов из образца, предусматривающему: получение твердой основы, содержащей один или несколько пептидных реагентов по изобретению, контактирование твердой основы с образцом, о котором известно или в котором предполагается наличие патогенных прионов, в условиях, которые обеспечивают связывание патогенных прионов, если они присутствует, с пептидным реагентом; и получение несвязавшихся материалов образца.
Во всех следующих вариантах осуществления, получения твердой основы, содержащей один или несколько реагентов по изобретению, рассматриваются альтернативные варианты осуществления, когда пептидный реагент контактирует с образцом перед тем, как пептидный реагент присоединяют к твердой основе. В данных вариантах осуществления пептидный реагент включает в себя одного из представителей связывающейся пары, и твердая основа включает в себя второго представителя связывающейся пары. Например, пептидный реагент по изобретению может содержать биотин или модифицироваться так, что он содержит биотин. Биотинилированный пептидный реагент контактирует с образцом, в котором предполагается наличие патогенного приона, в условиях, обеспечивающих связывание пептидного реагента с патогенным прионом. Твердая основа, содержащая авидин или стрептавидин, затем контактирует с биотинилированным пептидным реагентом. Здесь описаны другие подходящие связывающие пары.
В любом из описанных здесь способов с использованием твердой подложки она может представлять собой, например, нитроцеллюлозу, полистирол, полипропилен, латекс, поливинилфторид, диазотированную бумагу, нейлоновые мембраны, активированные гранулы, и/или отвечающие на магнитное поле гранулы, поливинилхлорид; полипропилен, полистирольный латекс, поликарбонат, нейлон, декстран, хитин, песок, силикагель, пемзу, агарозу, целлюлозу, стекло, металл, полиакриламид, силикон, резину, полисахариды; диазотированную бумагу; активированные гранулы, отвечающие на магнитное поле гранулы, и любые материалы, обычно используемые для твердофазного синтеза, аффинного разделения, реакций гибридизации, иммунных анализов и других таких применений. Основа может представлять собой дисперсные частицы или находиться в виде непрерывной поверхности, и включает в себя мембраны, сита, планшеты, шарики, слайды, диски, капилляры, полые волокна, иглы, пины, чипы, твердые волокна, гели (например, силикагели) и гранулы (например, гранулы пористого стекла, силикагели, полистирольные гранулы, необязательно перекрестно связанные с дивинилбензолом, гранулы с привитыми сополимерами, полиакриламидные гранулы, латексные гранулы, гранулы диметилакриламида, необязательно перекрестно связанные с N-N’-бис-акрилилэтилендиамином, магнитные гранулы с оксидом железа, и стеклянные частицы, покрытые гидрофобным полимером.
Кроме того, в любом из описанных здесь способов образец может представлять собой биологический образец, то есть образец, полученный или происходящий из живого или когда-либо жившего организма, например органы, цельная кровь, фракции крови, компоненты крови, плазма, тромбоциты, сыворотка, цереброспинальная жидкость (ЦСЖ), ткань головного мозга, ткань нервной системы, мышечная ткань, костный мозг, моча, слезы, не относящаяся к нервной системе ткань, органы и/или биопсии или некропсии. В предпочтительном осуществлении биологический образец включал в себя кровь, фракции крови или компоненты крови. Образец может представлять собой небиологический образец.
Еще в одном аспекте настоящее изобретение относится к способу диагностики связанного с прионом заболевания у индивидуума путем обнаружения наличия или отсутствия приона в биологическом образце от данного индивидуума любыми описанными здесь способами обнаружения.
В другом аспекте изобретение относится к способам получения источника крови, который, по существу, лишен патогенных прионов, причем данный способ предусматривает стадии скрининга аликвот крови (например, цельной крови, плазмы, тромбоцитов и сыворотки) из собранных образцов крови любым из описанных здесь способов; элиминации любого образца, в котором обнаружен патогенный прион; и комбинации образцов, в которых не обнаружены патогенные прионы, для обеспечения источника крови, по существу, лишенного патогенных прионов.
Еще в одном аспекте изобретение относится к способам получения продуктов питания, в частности мясных продуктов (например, говядины, баранины, или свинины, используемых для потребления людьми или животными), который, по существу, лишен патогенных прионов, причем данный способ включает в себя стадии скрининга любым из описанных здесь способов образцов, взятых от живых или мертвых организмов, которые будут служить продуктами питания, или образцов, взятых из пищи, предназначенной для продуктов питания; идентификации образцов, в которых обнаружен патогенный прион; и удаления из продуктов питания любого живого или мертвого организма, предназначенного для получения продуктов питания, в образцах которых обнаружены патогенные прионы; с обеспечением таким образом продукта питания, по существу, лишенного патогенных прионов.
В другом аспекте изобретение относится к твердой основе, включающей в себя один или несколько описанных здесь пептидных реагентов. Твердая основа может, среди прочих, использоваться в способах по изобретению для обнаружения патогенного прионного белка в образце, для выделения прионного белка из образца, и для элиминации из образца патогенных прионных белков. Твердая основа может соответствовать описанной выше.
В другом аспекте изобретение относится к различным наборам для обнаружения патогенного приона в образце, для выделения патогенного приона из образца, для элиминации из образца патогенного приона, причем набор включает в себя: один или несколько описанных здесь пептидных реагентов; и/или любую из твердых основ, включающих в себя один или несколько описанных здесь пептидных реагентов и другие необходимые реагенты, и, необязательно, положительные и отрицательные контроли. Пептидный(-е) реагент(-ы) могут быть мечеными и способными к визуализации.
В других аспектах здесь предоставлены композиции, включающие в себя один или несколько описанных здесь пептидных реагентов, полинуклеотидов и/или антител.
В дальнейшем аспекте предоставлены способы лечения или профилактики прионного заболевания, например способы, включающие в себя введение животному (например, не относящееся к человеку или относящееся к человеку млекопитающее) одного или нескольких описанных здесь композиций. В других вариантах осуществления способы предусматривают введение первой композиции, содержащей любую описанную здесь композицию в качестве стадии первичной стимуляции, и введение второй композиции, содержащей любые из описанных здесь композиций, в качестве вторичной стимуляции, например, в количестве, достаточном для индукции у индивидуума иммунного ответа. Композиция(-и) может(-гут) вводиться внутримышечно, через слизистые, интраназально, подкожно, внутрикожно, чрезкожно, интравагинально, интраректально, перорально и/или внутривенно.
Эти и другие варианты осуществления изобретения легко реализуются специалистами в данной области в свете приведенного здесь описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 изображена аминокислотная последовательность человеческих (SEQ ID NO: 1) и мышиных (SEQ ID NO: 2) прионных белков.
На фиг.2 изображено выравнивание прионных белков из людей (SEQ ID NO: 3), сирийского хомячка (хомячка) (SEQ ID NO: 4), крупного рогатого скота (SEQ ID NO: 5), овцы (SEQ ID NO: 6), мыши (SEQ ID NO: 7), лося (SEQ ID NO: 8), лани (SEQ ID NO: 9), гибридного оленя (SEQ ID NO: 10) и белохвостого оленя (SEQ ID NO: 11). Лось, лань, гибридный олень отличаются один от другого только на два остатка S/N128 и Q/E226 (показаны жирным шрифтом).
На фиг.3, панелях A-F, показаны типовые пептоидные замены, которые могут быть сделаны для получения любого из описанных здесь пептидных реагентов. Пептоиды показаны кружками на каждой панели и показаны в типовом пептидном реагенте, описанном здесь (SEQ ID NO: 14, QWNKPSKPKTNG), в котором пролиновый остаток (остаток 8 в SEQ ID NO: 14) замещен N-замещенным глициновым (пептоидным) остатком. На панели A показан пептидный реагент, в котором пролиновый остаток замещен пептоидным остатком: N-(S)-(1-фенилэтил)глицином; на панели B показан пептидный реагент, в котором пролиновый остаток замещен пептоидным остатком: N-(4-гидроксифенил)глицином; на панели C показан пептидный реагент, в котором пролиновый остаток замещен пептоидным остатком: N-(циклопропилметил)глицином; на панели D показан пептидный реагент, в котором пролиновый остаток замещен пептоидным остатком: N-(изопропил)глицином; на панели Е показан пептидный реагент, в котором пролиновый остаток замещен пептоидным остатком: N-(3,5-диметоксибензил)глицином; и на панели F показан пептидный реагент, в котором пролиновый остаток замещен пептоидным остатком: N-бутилглицином.
На фиг.4 показаны результаты экспериментов по вестерн-блоттингу, описанных в примере 2. На дорожках 1 и 2 показано наличие прионных белков в гомогенатах головного мозга нормальных мышей (дорожка 1, помечена «С») и в денатурированных гомогенатах инфицированных мышей (дорожка 2, помечена «Sc»). Дорожки 3, 4 и 5 показывают специфичное связывание описанного здесь пептидного реагента (SEQ ID NO: 68) с патогенными формами приона в присутствии человеческой плазмы. В частности, дорожка 3 представляет собой контроль человеческой плазмы, и дорожка 4 представляет собой образец гомогената головного мозга нормальной мыши. На дорожке 5 показано сильное связывание пептидного реагента PrPSc в образцах гомогената инфицированной мыши.
На фиг.5 показаны структуры типовых связанных с ПЭГ пептидных реагентов, как описано выше.
ПОДРОБНОЕ ОПИСАНИЕ
Изобретение относится к удивительному и неожиданному открытию, что относительно малые пептиды (менее 50-100 аминокислот в длину, предпочтительно, менее чем примерно 50 аминокислот в длину и даже более предпочтительно, менее чем примерно 30 аминокислот в длину) могут использоваться для дискриминации между непатогенными и патогенными прионными белками. Таким образом, настоящее описание относится к неожиданному открытию, что данные пептиды и их производные (вместе называемые «пептидными реагентами») могут связываться с патогенными и непатогенными белковыми формами с разной специфичностью и/или сродством и, в соответствии с этим, могут использоваться в реагентах для диагностики/обнаружения или в качестве них, или в качестве компонентов терапевтических композиций. До настоящего описания полагали, что только более крупные молекулы (например, антитела, PrPC,  -форма rPrP и плазминоген) могут использоваться для различения патогенной и непатогенной форм. Как таковые, ранее описанные антигенные пептиды использовали для получения антител, которые оценивали на предмет их способности различать патогенную и непатогенную формы. Однако вследствие относительно неиммуногенной природы прионных белков оказалось сложной задачей генерировать антитела, специфичные в отношении патогенных форм. См., например, R.A.Williamson et al. “Antibodies as Tools to Probe Prion Protein Biology” in PRION BIOLOGY AND DISEASES, ed. S. Prusiner, Cold Spring Harbor Laboratory Press, 1999, pp: 717-741. -форма rPrP и плазминоген) могут использоваться для различения патогенной и непатогенной форм. Как таковые, ранее описанные антигенные пептиды использовали для получения антител, которые оценивали на предмет их способности различать патогенную и непатогенную формы. Однако вследствие относительно неиммуногенной природы прионных белков оказалось сложной задачей генерировать антитела, специфичные в отношении патогенных форм. См., например, R.A.Williamson et al. “Antibodies as Tools to Probe Prion Protein Biology” in PRION BIOLOGY AND DISEASES, ed. S. Prusiner, Cold Spring Harbor Laboratory Press, 1999, pp: 717-741.
Открытие того, что некоторые пептиды, описанные здесь, взаимодействуют предпочтительно с патогенными (PrPSc) прионными белками, обеспечивает разработку новых реагентов для диагностики, анализов для обнаружения и терапевтических средств, среди прочих. Таким образом, изобретение относится к пептидным реагентам и, кроме того, относится к анализам для обнаружения и диагностическим анализам, использующим данные пептидные реагенты, к способам очистки и выделения, использующим данные пептидные реагенты, и к терапевтическим композициям, содержащим данные пептидные реагенты. Также предоставлены полинуклеотиды, кодирующие данные пептидные реагенты, и антитела, генерированные с использованием данных пептидных реагентов. Пептидные реагенты, полинуклеотиды и/или антитела, описанные здесь, используются в композициях и способах обнаружения патогенного приона, например, в биологическом образце. Кроме того, изобретение далее относится к способам применения таких пептидных реагентов, антител и/или полинуклеотидов в качестве компонента в терапевтической или профилактической композиции.
Пептидные реагенты (и полинуклеотиды, кодирующие данные пептидные реагенты), применяемые по изобретению, включают в себя пептид, который взаимодействует преимущественно с патогенными изоформами, по сравнению с непатогенными изоформами. Например, в некоторых вариантах осуществления описанные здесь пептидные реагенты специфично связываются с патогенными белковыми формами конформационных заболеваний и не связываются (или связываются в меньшей степени) с непатогенными формами. Пептидные реагенты, описанные здесь (и кодирующие их полинуклеотиды) могут использоваться, например, для получения антител. Данные антитела могут распознавать патогенные формы, непатогенные формы, или оба варианта. Данные молекулы могут использоваться, отдельно или в различных комбинациях, в диагностических анализах и/или в профилактических и терапевтических композициях.
В практике настоящего изобретения, кроме указанных иначе случаев, будут использованы общепринятые способы химии, биохимии, молекулярной биологии, иммунологии и фармакологии, в пределах знания специалиста в данной области. Такие способы полностью объясняются в литературе. См., например, Remington’s Pharmaceutical Sciences, 18th Edition (Easton, Pennsylvania: Mack Publishing Company, 1990); Methods In Enzymology (S. Colowick and N. Kaplan, eds., Academic Press, Inc.); и Handbook of Experimental Immunology, Vols.I-IV (D. M. Weir and C. C. Blackwell, eds., 1986, Blackwell Scientific Publications); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Handbook of Surface and Colloidal Chemistry (Birdi, K. S. ed., CRC Press, 1997); Short Protocols in Molecular Biology, 4th ed. (Ausubel et al. eds., 1999, John Wiley & Sons); Molecular Biology Techniques : An Intensive Laboratory Course, (Ream et al., eds., 1998, Academic Press); PCR (Introduction to Biotechniques Series), 2nd ed. (Newton & Graham eds., 1997, Springer Verlag); Peters and Dalrymple, Fields Virology (2ded), Fields et al. (eds.), B. N. Raven Press, New York, NY.
Понятно, что пептидные реагенты, антитела и способы по данному изобретению не ограничены конкретными препаратами или параметрами способа, поскольку таковые, конечно, могут изменяться. Также следует понимать, что применяемая здесь терминология предназначена только для целей описания конкретных вариантов осуществления изобретения, но не для ограничения.
Все цитируемые здесь публикации, патенты и патентные заявки включены сюда полностью в качестве ссылки.
I. Определения
Для облегчения понимания изобретения избранные термины, применяемые в заявке, будут обсуждаться ниже.
Термины «прион», «прионный белок», «белок PrP» и «PrP» используются здесь взаимозаменяемо для ссылки на патогенную форму белка (различно обозначаемую как скрэпи-белок, патогенная форма белка, патогенный прион и PrPSc) и непатогенную форму (различно обозначаемую как клеточная форма белка, клеточная изоформа, непатогенная изоформа, непатогенный прионный белок, и PrPс), а также денатурированная форма и различные рекомбинантные формы прионного белка, которые могут не иметь патогенную конформацию или нормальную клеточную конформацию.
Патогенная форма белка ассоциирована с состоянием заболевания (губчатые энцефалопатии) у людей и животных; непатогенная форма обычно присутствует в животных клетках и может в подходящих условиях преобразовываться в патогенную конформацию PrPSc. Прионы продуцируются в природе в различных видах млекопитающих, включая человека, овец, крупный рогатый скот, и мышей. Репрезентативная аминокислотная последовательность человеческого прионного белка приведена в SEQ ID NO: 1. Репрезентативная аминокислотная последовательность мышиного прионного белка SEQ ID NO: 2. Другие репрезентативные последовательности показаны на фиг.2.
Используемый здесь термин «патогенный» означает, что данный белок действительно вызывает заболевание, или он может просто означать, что белок ассоциирован с заболеванием, и поэтому присутствует при наличии заболевания. Таким образом, патогенный белок при использовании термина в связи с данным описанием не обязательно представляет собой белок, который является конкретным каузативным агентом заболевания. Патогенные формы могут быть инфекционными, или не инфекционными. Термин «патогенная форма приона» применяется более специфично со ссылкой на конформацию и/или богатую бета-листами конформацию прионных белков млекопитающих, птиц или рекомбинантных прионных белков. В общем, богатая бета-листами конформация устойчива к действию протеиназы K. Термины «непатогенный» и «клеточный» при использовании в отношении к формам белка конформационного заболевания используются взаимозаменяемо для обозначения на нормальную изоформу белка, присутствие которого не ассоциировано с заболеванием.
Более того, используемый здесь термин «прионный белок» или «белок конформационного заболевания» не ограничивается полипептидом, имеющим точную последовательность, соответствующие описанным здесь. Хорошо понятно, что данные термины охватывают белки конформационного заболевания из любого из идентифицированных или неидентифицированных видов или заболеваний (например, болезни Альцгеймера, болезни Паркинсона, и т.д.). Обычный специалист в данной области в свете учения настоящего описания и данной области знания может определить области, соответствующие последовательностям, показанным на фигурах в любых других прионных белках, с использованием, например, программ сравнения последовательностей (например, BLAST и других описанных здесь) или идентификации и выравнивания структурных характеристик или мотивов.
Термин «ген PrP» используется здесь для описания любого генетического материала, который экспрессирует прионные белки, включающие в себя известные полиморфизмы и патогенные мутации.
Термин «ген PrP» относится, в общем, к любому гену любого вида, который кодирует любой вид белка PrP. Некоторые широко известные последовательности PrP описаны в Gabriel et al., Proc. Natl. Acad. Sci. USA 89: 9097-9101 (1992), и в патентах США 5565186; 5763740; 5792901; и W097/04814, включенными сюда в качестве ссылки для раскрытия и описания таких последовательностей. Ген PrP может происходить из любого животного, включая животных-«хозяев» и «экспериментальных» животных, описанных здесь, и включать в себя их любые полиморфизмы и мутации, причем понятно, что данные термины включают в себя другие такие гены PrP, которые еще не открыты. Данный белок, экспрессируемый таким геном, может принимать форму PrPC (не относящуюся к болезни) или PrPSc (относящуюся к болезни).
Используемый здесь термин «связанное с прионом заболевание» относится к заболеванию, вызванному целиком или частично патогенным прионным белком (PrPSc). Связанные с прионами заболевания включают в себя в качестве неограничивающих примеров скрэпи, губчатые энцефалопатии крупного рогатого скота (BSE), коровье бешенство, кошачья губчатая энцефалопатия, куру, болезнь Крейтцфельдта-Якоба (CJD), новый вариант болезни Крейтцфельдта-Якоба (nvCJD), болезнь хронической усталости (CWD), болезнь Герштманн-Штрасслера-Шейнкера (GSS) и фатальную семейную бессонницу (FFI).
Используемый здесь термин «пептидные реагенты» обычно относится к любому соединению, включающему в себя встречающиеся в природе или синтетические полимеры аминокислот или подобных аминокислотам молекул, включая в качестве неограничивающих примеров соединения, содержащие только амино- и/или иминомолекулы. Пептидные реагенты по настоящему изобретению взаимодействуют преимущественно с патогенным прионным белком и они обычно получены из фрагментов прионного белка. Термин «пептид» будет использоваться взаимозаменяемо с терминами «олигопептид» или «полипептид», и применением данных терминов не конкретизируется размер молекулы. В состав определения входят, например, пептиды, содержащие один или несколько аналогов аминокислоты (включая, например, неприродные аминокислоты, пептиоиды, и т.д.), пептиды с замещенными связями, а также с другими модификациями, известными в данной области, встречающимися в природе и неприродными (например, синтетическими). Таким образом, синтетические пептиды, димеры, мультимеры (например, тандемные повторы, формы пептидов-множественных антигенов (MAP), линейно связанные пептиды), циклизованные, разветвленные молекулы и тому подобное, включены в данное определение. Термины также включают в себя молекулы, содержащие один или несколько N-замещенных остатков глицина («пептоидов») и других синтетических аминокислот или пептидов. (См., например, патент США  5831005; 5877278; и 5977301; Nguyen et al. (2000) Chem Biol. 7(7): 463-473; и Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89 (20): 9367-9371, для описания пептоидов). Неограничивающие длины пептидов, подходящих для применения по настоящему изобретению, включают в себя пептиды от 3 до 5 остатков в длину, от 6 до 10 остатков в длину (или соответствующие любому целому числу между ними), от 11 до 20 остатков в длину (или соответствующие любому целому числу между ними), от 21 до 75 остатков в длину (или соответствующие любому целому числу между ними), от 75 до 100 остатков в длину (или соответствующие любому целому числу между ними), или полипептиды более 100 остатков в длину. Обычно пептиды, которые могут использоваться по данному изобретению, могут иметь максимальную длину, подходящую для предназначенного применения. Предпочтительно, пептид составляет от 3 до 100 остатков в длину. В общем, специалист в данной области может легко выбрать максимальную длину в свете приведенного здесь учения. Далее, описанные здесь пептидные реагенты, например синтетические пептиды, могут включать в себя дополнительные молекулы, такие как метки, линкеры или другие химические радикалы (например, биотин, специфичные в отношении амилоида красители, такие как Конго красный или тиофлавин). Такие радикалы могут далее усиливать взаимодействия пептидов с прионными белками и/или дальнейшую детекцию прионных белков. 5831005; 5877278; и 5977301; Nguyen et al. (2000) Chem Biol. 7(7): 463-473; и Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89 (20): 9367-9371, для описания пептоидов). Неограничивающие длины пептидов, подходящих для применения по настоящему изобретению, включают в себя пептиды от 3 до 5 остатков в длину, от 6 до 10 остатков в длину (или соответствующие любому целому числу между ними), от 11 до 20 остатков в длину (или соответствующие любому целому числу между ними), от 21 до 75 остатков в длину (или соответствующие любому целому числу между ними), от 75 до 100 остатков в длину (или соответствующие любому целому числу между ними), или полипептиды более 100 остатков в длину. Обычно пептиды, которые могут использоваться по данному изобретению, могут иметь максимальную длину, подходящую для предназначенного применения. Предпочтительно, пептид составляет от 3 до 100 остатков в длину. В общем, специалист в данной области может легко выбрать максимальную длину в свете приведенного здесь учения. Далее, описанные здесь пептидные реагенты, например синтетические пептиды, могут включать в себя дополнительные молекулы, такие как метки, линкеры или другие химические радикалы (например, биотин, специфичные в отношении амилоида красители, такие как Конго красный или тиофлавин). Такие радикалы могут далее усиливать взаимодействия пептидов с прионными белками и/или дальнейшую детекцию прионных белков.
Пептидные реагенты также включают в себя производные аминокислотных последовательностей по изобретению, имеющие одну или несколько замен, дополнений и/или делеций, включающие одну или несколько не встречающихся в природе аминокислот. Предпочтительно, производные характеризуются, по меньшей мере, 50%-ной идентичностью в отношении любой последовательности дикого типа или последовательности сравнения, предпочтительно, по меньшей мере, примерно 70%-ной идентичностью, более предпочтительно, по меньшей мере, идентичностью последовательности, примерно равной 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%, в отношении любой описанной здесь последовательности дикого типа или последовательности сравнения. Идентичность по последовательности (или в процентах) может определяться, как описано ниже. Такие производные могут включать в себя постэкспрессионные модификации полипептида, например гликозилирование, ацетилирование, фосфорилирование, и тому подобное.
Пептидные производные также могут включать в себя модификации нативной последовательности, например делеции, добавления и замены (в общем консервативные по природе), при том что полипептид сохраняет требуемую активность. Данные модификации могут быть преднамеренными, например созданными путем сайтспецифического мутагенеза, или могут быть случайными, например произошедшими за счет мутаций хозяев, которые продуцируют данные белки, или за счет ошибок амплификации ПЦР.
Более того, могут быть сделаны модификации, которые имеют один или несколько следующих эффектов: снижение токсичности; повышение сродства и/или специфичности прионных белков; облегчение процессинга в клетках (например, секреции, презентации антигена, и т.д.); и облегчение презентации B-клеткам и/или Т-клеткам. Описанные здесь полипептиды могут быть получены рекомбинантно, синтетически, могут быть очищены из природных источников или из культуры ткани.
Используемый здесь термин «фрагмент» относится к пептиду, состоящему только из части интактного полноразмерного белка и структуры, которая находится в природе. Например, фрагмент может включать в себя С-концевую делецию и/или N-концевую делецию белка. Обычно фрагмент сохраняет одну, некоторые или все функции полноразмерного белка, из которого он получен. Обычно фрагмент включает в себя, по меньшей мере, 5 следующих друг за другом аминокислотных остатков нативного белка; предпочтительно, по меньшей мере, 8 следующих друг за другом аминокислотных остатков; более предпочтительно, по меньшей мере, примерно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, или 30 следующих друг за другом аминокислотных остатков нативного белка.
Термин «полинуклеотид», известный в данной области, в общем относится к молекуле нуклеиновой кислоты. «Полинуклеотид» может включать в себя двух- и одноцепочечные последовательности и относится к приведенным в качестве неограничивающих примеров прокариотическим последовательностям, эукариотическим мРНК, кДНК из вирусной, прокариотической или эукариотической мРНК, геномных РНК- и ДНК-последовательностей из вирусов (например, РНК- и ДНК-вирусов и ретровирусов), прокариотической ДНК или эукариотической ДНК (например, относящейся к млекопитающим), и, особенно, к синтетическим последовательностям ДНК. Данный термин также охватывает последовательности, которые включают в себя любой из известных аналогов ДНК и РНК, и включает в себя такие модификации, как делеции, добавления и замены (обычно консервативные по природе) в отношение нативной последовательности.
Данные модификации могут быть преднамеренными, например, созданными путем сайтспецифического мутагенеза, или могут быть случайными, например, произошедшими за счет мутаций хозяев, содержащих полинуклеотиды, содержащие прионы. Модификации полинуклеотидов могут иметь любое количество эффектов, включая, например, облегчение экспрессии полипептидного продуктуа в клетке хозяина.
Полинуклеотид может кодировать биологически активный (например, иммуногенный или терапевтический) белок или полипептид. В зависимости от природы полипептида, кодируемого полинуклеотидом, полинуклеотид может включать в себя минимум 10 нуклеотидов, например, в случае, когда полинуклеотид кодирует антиген или эпитоп. Обычно полинуклеотид кодирует пептиды, по меньшей мере, составляющие 18,19, 20,21, 22,23, 24,25, 30 или большее количество аминокислот.
«Кодирующая полинуклеотидная последовательность» или последовательность, которая «кодирует» выбранный полипептид, представляет собой молекулу нуклеиновой кислоты, которая транскрибируется (в случае ДНК) и транслируется (в случае мРНК) в полипептид in vivo при помещении под контроль подходящих регуляторных последовательностей (или «контрольных элементов»). Границы кодирующей последовательности определяются стартовым кодоном на 5′-(N-)конце и стоп-кодоном трансляции на 3′-(С-)конце. Последовательность терминации транскрипции может быть локализована в 3′-направлении от кодирующей последовательности. Типичные «элементы контроля» включают в себя, в качестве неограничивающих примеров, регуляторы транскрипции, такие как промоторы, элементы-энхансеры транскрипции, сигналы терминации транскрипции и последовательности полиаденилирования; и регуляторы трансляции, например последовательности для оптимизации инициации трансляции, например последовательности Шайна-Дальгарно (участок связывания рибосомы), последовательности Козака (т.е., последовательности оптимизации трансляции, расположенные, например, в 5′-направлении от кодирующей последовательности), лидерные последовательности (гетерологичные или нативные), кодон инициации трансляции (например, ATG), и последовательности терминации трансляции. Промоторы могут включать в себя индуцируемые промоторы (где экспрессия полинуклеотидной последовательности, функционально связанной с промотором, индуцируется аналитом, кофактором, регуляторным белком, и т.д.), репрессируемые промоторы (где экспрессия полинуклеотидной последовательности, функционально связанной с промотором, подавляется аналитом, кофактором, регуляторным белком, и т.д.) и конститутивные промоторы.
«Функционально связанный» означает перестройку элементов, при которой компоненты, описанные таким образом, конфигурируются так, что они выполняют их обычную функцию. Таким образом, данный промотор функционально связаный с кодирующей последовательностью способен осуществлять экспрессию кодирующей последовательности в присутствии надлежащего фермента. Промотору не нужно непосредственно прилегать к кодирующей последовательности, если он функционирует для управления ее экспрессии. Таким образом, например, промежуточные нетранслируемые, но транскрибируемые последовательности могут присутствовать между промоторной последовательностью и кодирующей последовательностью, и промоторная последовательность, тем не менее, будет считаться «функционально связанной» с кодирующей последовательностью.
Используемый здесь для описания молекулы нуклеиновой кислоты термин «рекомбинантная» молекула нуклеиновой кислоты означает полинуклеотид геномного, кДНК, полусинтетического или синтетического происхождения, который в силу его происхождения или манипуляции: (1) не ассоциирован частично или полностью с полинуклеотидом, с которым он ассоциирован в природе; и/или (2) связан с полинуклеотидом, отличным от того, с которым он связан в природе. Используемый здесь в отношении белка или полипептида термин «рекомбинантный» означает полипептид, продуцируемый путем экспрессии рекомбинантного полинуклеотида. Термины «рекомбинантные клетки хозяина», «клетки хозяина», «клетки», «клеточные линии», «клеточные культуры» и другие такие термины, обозначающие прокариотические микроорганизмы или эукариотические клеточные линии, культивируемые в одноклеточном виде, используются взаимозаменяемо и относятся к клеткам, которые могут использоваться или ранее использовались в качестве реципиентов для рекомбинантных векторов или другой ДНК для переноса, и включают в себя потомство исходной клетки, которая была трансфицирована. Понятно, что потомство одной родительской клетки может не быть обязательно полностью идентично по морфологии или по геномной или общей ДНК, комплементарной исходной родительской ДНК, вследствие случайной или преднамеренной мутации. Потомство родительской клетки, которое достаточно сходно с родительской клеткой, характеризующееся соответствующими свойствами, такими как присутствие нуклеотидной последовательности, кодирующей требуемый пептид, включается в потомство, предполагаемое данным определением, и охватывается указанными выше терминами.
Под «изолированным», при указании на полинуклеотид или полипептид, подразумевается, что отмеченная молекула является отдельной и дискретной от целого организма, в котором данная молекула находится в природе или когда полинуклиатид или полиамид не находится в природе, является достаточно свободной от других биологических макромолекул, так что полинуклеотид или полипептид может использоваться для предназначенной ему цели.
Термин «антитело», известный в данной области, включает в себя один или несколько биологических радикалов, которые химическими и физическими средствами могут связываться или ассоциироваться с эпитопом интересующего полипептида. Например, антитела по изобретению могут преимущественно взаимодействовать (например, специфично связываться) с патогенными конформациями приона. Термин «антитело» включает в себя антитела, полученные из поликлональных и моноклональных препаратов, а также следующее: гибридные (химерные) молекулы (см., например, Winter et al. (1991) Nature 349: 293-299; и патент США  4816567); F(ab’)2– и F(ab)-фрагменты; Fv-молекулы (нековалентные гетеродимеры, см., например, Inbar et al. (1972) Proc Natl Acad Sci USA 69: 2659-2662; и Ehrlich et al. (1980) Brochent 19: 4091-4096); одноцепочечные Fv-молекулы (sFv) (см., например, Huston et al. (1988) Proc Natl Acad Sci USA 85:5897-5883); димерные и тримерные конструкции антитела; минитела (см., например, Pack et al. (1992) Biochem 31: 1579-1584; Cumber et al. (1992) J Immunology 149B: 120-126); гуманизированные молекулы антитела (см., например, Riechmann et al. (1988) Nature 332: 323-327; Verhoeyan et al. (1988) Science 239: 1534-1536; и публикацию патента Великобритании 4816567); F(ab’)2– и F(ab)-фрагменты; Fv-молекулы (нековалентные гетеродимеры, см., например, Inbar et al. (1972) Proc Natl Acad Sci USA 69: 2659-2662; и Ehrlich et al. (1980) Brochent 19: 4091-4096); одноцепочечные Fv-молекулы (sFv) (см., например, Huston et al. (1988) Proc Natl Acad Sci USA 85:5897-5883); димерные и тримерные конструкции антитела; минитела (см., например, Pack et al. (1992) Biochem 31: 1579-1584; Cumber et al. (1992) J Immunology 149B: 120-126); гуманизированные молекулы антитела (см., например, Riechmann et al. (1988) Nature 332: 323-327; Verhoeyan et al. (1988) Science 239: 1534-1536; и публикацию патента Великобритании  GB 2276169, опубликованную 21 сентября 1994 г.); и любые функциональные фрагменты, полученные из таких молекул, где такие фрагменты сохраняют свойства иммунологического связывания родительской молекулы антитела. Термин «антитело» далее включает в себя антитела, полученные необщепринятыми способами, такими как фаговый дисплей. GB 2276169, опубликованную 21 сентября 1994 г.); и любые функциональные фрагменты, полученные из таких молекул, где такие фрагменты сохраняют свойства иммунологического связывания родительской молекулы антитела. Термин «антитело» далее включает в себя антитела, полученные необщепринятыми способами, такими как фаговый дисплей.
Используемый здесь термин «моноклональное антитело» относится к композиции антител, содержащей гомогенную популяцию антител. Данный термин не ограничен в плане вида или источника антитела, и он не подразумевает ограничения способа, которым оно получено. Таким образом, термин охватывает антитела, полученные из мышиных гибридом, а также человеческие моноклональные антитела, полученные с использованием человеческих, а не мышиных антител. См., например, Cote, et al. Monoclonal Antibodies and Cancer Therapy, Alan R. Liss,1985, p 77.
Если требуются поликлональные антитела, выбранное млекопитающее (например, мышь, кролик, коза, лошадь, и т.д.), в общем, иммунизируют иммуногенной композицией (например, описанным здесь пептидным реагентом). Сыворотку из иммунизированного животного собирают и обрабатывают по известным процедурам. Если сыворотка, содержащая поликлональные антитела к выбранному пептидному антигену, содержит антитела к другим антигенам, поликлональные антитела могут очищаться иммуноаффинной хроматографией. Способы продукции и обработки поликлональных антисывороток известны в данной области, см., например, Mayer and Walker, eds. (1987) IMMUNOCHEMICAL METHODS IN CELL AND MOLECULAR BIOLOGY (Academic Press, London).
Специалист в данной области может легко продуцировать моноклональные антитела, направленные против описанных здесь пептидных реагентов. Общая методология для получения моноклональных антител гибридомами хорошо известна. Иммортализованные антителопродуцирующие клеточные линии могут создаваться путем слияния клеток, и также другими способами, такими как прямая трансформация B-лимфоцитов онкогенной ДНК или трансфекция вирусом Эпштейна-Барр. См., например, M. Schreier et al. (1980) HYBRIDOMA TECHNIQUES; Hammerling et al. (1981), MONOCLONAL ANTIBODIES AND T-CELL HYBRIDOMAS; Kennett et al. (1980) MONOCLONAL ANTIBODIES; см. также патенты США  4341761; 4399121; 4427783; 4444887; 4466917; 4472500; 4491632; и 4493890. 4341761; 4399121; 4427783; 4444887; 4466917; 4472500; 4491632; и 4493890.
Используемый здесь термин «однодоменное антитело» (dAb) представляет собой антитело, состоящее из VH-домена, которое специфично связывается с обозначенным антителом. dAb не содержит VL-домен, но может содержать другие антигенсвязывающие домены, которые, как известно, существуют в антителах, например каппа- и лямбда-домены. Способы получения dAb известны в данной области. См., например, Ward et al, Nature 341: 544 (1989).
Антитела могут также состоять из VH– и VL-доменов, а также другие антигенсвязывающие домены. Примеры данных типов антител и способы их получения известны в данной области (см., например, патент США 4816467, который включен сюда в качестве ссылки) и включают в себя следующее. Например, термин «антитела позвоночных» относится к антителам, которые являются тетрамерами или их агрегатами, включающим в себя легкие и тяжелые цепи, которые обычно агрегируют в «Y»-конфигурацию и которые могут иметь ковалентные связи между цепями, но могут и не иметь их. В антителах позвоночных аминокислотные последовательности цепей гомологичны тем последовательностям, которые обнаружены в антителах, продуцируемых в позвоночных, in situ или in vitro (например, в гибридомах). Антитела позвоночных включают в себя, например, очищенные поликлональные антитела и моноклональные антитела, способы получения которых описаны ниже.
«Гибридные антитела» представляют собой антитела, где цепи отдельно друг от друга гомологичны в отношении цепей антител млекопитающих и представляют собой новые их соединения, так что два других антигена могут преципитировать с образованием тетрамера или агрегируют. В гибридных антителах одна пара тяжелых и легких цепей гомологичны тем, которые находятся в антителе, полученном против первого антигена, тогда как вторая пара цепей гомологична тем, которые находятся в антителе, полученном против второго антитела. Результатом этого является свойство «бивалентности», т.е., способность связывать два антигена одновременно. Такие гибриды могут также образовываться с использованием химерных цепей, как указано выше.
Термин «химерные антитела» относится к антителам, в которых тяжелые и/или легкие цепи являются белками слияния. Обычно одна часть аминокислотных последовательностей цепи гомологична соответствующим последовательностям в антителе, происходящем из конкретного вида или конкретного класса, в то время как оставшийся сегмент цепи гомологичен последовательностям, происходящим их другого вида и/или класса. Обычно вариабельная область обеих легких и тяжелых цепей имитирует вариабельные области или антитела, происходящие из одного вида позвоночных, тогда как константные части гомологичны последовательностям, происходящих из другого вида позвоночных. Однако определение не ограничивается данным конкретным примером. Также включено любое антитело, в котором тяжелая или легкая цепь или обе составлены из комбинаций последовательностей, имитирующих последовательности антител из различных источников, причем данные источники происхождения являются различными классами или различными видами, и точка слияния находится на границе вариабельной и константной области или в другом положении. Таким образом, возможно продуцировать антитела, в которых ни константная, ни вариабельная область не имитирует какой-либо известной последовательности антитела. Затем становится возможным, например, конструировать антитела, вариабельная область которых имеет высокоспецифичное сродство в отношении конкретного антигена, или константная область которых может проявлять повышенное связывание комплемента, или реализовывать другие улучшения свойств, проявляемых конкретной константной областью.
Другим примером являются «измененные антитела», относящиеся к антителам, в которых встречающаяся в природе аминокислотная последовательность антитела позвоночных была изменена. С использованием способа рекомбинантной ДНК антитела могут быть реконструированы с получением требуемых характеристик. Возможных вариаций много, и они изменяются от замены одной или нескольких аминокислот до полной реконструкции области, например константной области. Изменения в константной области, в общем, для придания требуемых характеристик клеточных процессов, например изменений фиксации комплемента, взаимодействий с мембранами, и других эффекторных функций. Изменения вариабельной области могут быть сделаны для изменения антигенсвязывающих характеристик. Антитело может также конструироваться для обеспечения специфичной доставки молекулы или вещества к специфичной клетке или участку ткани. Требуемые изменения могут быть сделаны известными способами молекулярной биологии, например рекомбинантными способами, сайтспецифическим мутагенезом, и т.д.
Еще одним примером являются «унивалентные антитела», которые представляют собой агрегаты, составленные из димера тяжелая цепь/легкая цепь, связанного с Fc- (т.е., стволовой) областью второй тяжелой цепи. Данный тип антител избегает антигенной модуляции. См., например, Glennie et al. Nature 295: 712 (1982). Также в определение антител входят «Fab»-фрагменты антител. «Fab»-область относится к тем частям тяжелой и легкой цепей, которые приблизительно эквивалентны или аналогичны последовательностям, которые составляют часть, относящуюся к ветвям тяжелой и легкой цепей, и которые, как показано, характеризуются иммунологическим связыванием со специфичным антигеном, но не имеют эффекторной Fc-части. «Fab» включает в себя агрегаты одной тяжелой и одной легкой цепей (обычно известные как Fab’), а также тетрамеры, состоящие из 2 H- и 2 L-цепей (обозначаемые как F(ab)2), которые способны избирательно взаимодействовать с обозначенным антигеном или семейством антигенов. Антитела Fab могут подразделяться на подмножества, аналогичные описанным выше, т.е., «Fab позвоночных», «гибридный Fab», «химерный Fab», и «измененный Fab». Способы продукции Fab-фрагментов антител известны в данной области и включают в себя, например, протеолиз и синтез рекомбинантными способами.
Термин «комплекс антиген-антитело» относится к комплексу, образованному антителом, которое специфично связывается с эпитопом на антигене.
Говорят что пептид (или пептидный реагент) «взаимодействует» с другим пептидом или белком, если он связывается специфично, неспецифично или в некоторой комбинации специфичного или неспецифичного связывания. Говорят что пептид (или пептидный реагент) «взаимодействует предпочтительно» с патогенным прионным белком, если он связывается с большим сродством и/или с большей специфичностью с патогенной формой, по сравнению с непатогенными изоформами. Пептидный реагент, который взаимодействует преимущественно с патогенным прионным белком, также обозначается здесь как патогенный специфичный в отношении приона пептидный реагент. Следует понимать, что преимущественное взаимодействие не обязательно требует взаимодействия между специфичными аминокислотными остатками и/или мотивами каждого пептида. Например, в некоторых вариантах осуществления описанные здесь пептидные реагенты взаимодействуют преимущественно с патогенными изоформами, но, тем не менее, могут быть способными связывать непатогенные изоформы на слабом, но выявляемом уровне (например, 10%-ное или менее выраженное связывание по сравнению с интересующим полипептидом). Обычно слабое связывание или фоновое связывание легко отличимо от преимущественного связывания с интересующим соединением или полипептидом, например, за счет применения подходящих контролей. В общем, пептиды по изобретению связывают патогенные прионы в присутствии 106-кратного избытка непатогенных форм.
Термин «сродство» относится к силе связывания и может выражаться количественно в виде константы диссоциации (Kd). Предпочтительно, пептид (или пептидный реагент), который взаимодействует преимущественно с патогенной изоформой, предпочтительно, взаимодействует с патогенной изоформой, по меньшей мере, с двукратно более высоким сродством, более предпочтительно, по меньшей мере, с 10-кратно более высоким сродством, и даже более предпочтительно, по меньшей мере, с 100-кратно более высоким сродством, чем он взаимодействует с непатогенной изоформой. Сродство связывания (т.е., Kd) может определяться стандартными способами.
Способы определения «сходства» или «процентной идентичности» аминокислотной последовательности хорошо известны в данной области. В общем, «сходство» означает сравнение аминокислот одного или нескольких полипептидов в соответствующем месте, где аминокислоты идентичны или обладают сходными химическими и/или физическими свойствами, такими как заряд или гидрофобность. Между сравниваемыми полипептидными последовательностями может, таким образом, определяться так называемая «процентная идентичность». Способы определения идентичности последовательности нуклеиновой кислоты и аминокислотной последовательности хорошо известны в данной области и включают в себя определение нуклеотидной последовательности мРНК для данного гена (обычно через кДНК-интермедиат) и определение кодируемой ей аминокислотной последовательности, и ее сравнение со второй аминокислотной последовательностью. В общем, «идентичность» относится к точному соответствию нуклеотида нуклеотиду или аминокислоты аминокислоте двух полинуклеотидных или полипептидных последовательностей, соответственно.
Два или большее количество аминокислотных или пoлинуклеотидных последовательностей могут сравниваться путем определения их «процентной идентичности». Процентная идентичность может определяться прямым сравнением информации о последовательности двух молекул (последовательностью сравнения и последовательностью с неизвестной % идентичностью в отношении последовательности сравнения) путем выравнивания последовательностей, подсчета точного количества совпадений между двумя выровненными последовательностями, разделения этого количества на длину последовательности сравнения, и умножения результата на 100. Легко доступные компьютерные программы могут использоваться для упрощения анализа, например, ALIGN, Dayhoff, M. O. in Atlas of Protein Sequence and Structure M. O. Dayhoff ed., 5 Suppl. 3: 353-358, National biomedical Research Foundation, Washington, DC, которая адаптирует алгоритм местной гомологии по Smith and Waterman, Advances in Appl. Math. 2: 482-489, 1981, для пептидного анализа. Программы для определения идентичности нуклеотидной последовательности доступны в Wisconsin Sequence Analysis Package, Version 8 (доступны от Genetics Computer Group, Мэдисон, Висконсин), например программы BESTFIT, FASTA и GAP, которые также основываются на алгоритме Smith and Waterman. Данные программы могут легко использоваться с программами по умолчанию, рекомендуемыми производителем и описанными в Wisconsin Sequence Analysis Package, указанном выше. Например, процентная идентичность конкретной нуклеотидной последовательности в отношении последовательности сравнения может определяться с использованием алгоритма гомологии Smith and Waterman с таблицей коэффициентов по умолчанию и штрафом за вставку, равным шести нуклеотидным положениям.
Другой способ определения процентной идентичности в контексте настоящего изобретения представляет собой применение пакета программ MPSRCHTM, правами на который обладает University of Edinburgh, и который разработан John F. Collins и Shane S. Sturrok и доступен из многих источников, например из Интернета. Из данного набора пакетов может использоваться алгоритм Smith-Waterman, где используются параметры по умолчанию для таблицы коэффициентов (например, штраф за открытие вставки 12, штраф за продление вставки один, и вставка, равная шести). Из генерированных данных значение «Match» отражает «идентичность последовательности». Другие подходящие программы для расчета процентной идентичности или сходства между последовательностями, в общем, известны в данной области, например, другая программа выравнивания представляет собой BLAST, используемый с параметрами по умолчанию. Например, BLASTN и BLASTP могут использоваться с использованием параметров по умолчанию: генетический код = стандарт; фильтр = отсутствует; цепи = обе; уровень отсечения = 60; ожидание = 10; матрица = BLOSUM62; описания = 50 последовательностей; сортировка по = HIGH SCORE; базы данных = невырожденные, GenBank + EMBL + DDBJ + PDB + GenBank CDS translations + Swiss protein + Spupdate + PIR. Легко доступны подробности по данным программам.
Используемый здесь термин «иммуногенная композиция» относится к любым композициям (например, композициям пептидов, антител и/или полинуклеотидов), где введение данной композиции индивидууму приводит к развитию у индивидуума гуморального и/или клеточного иммунного ответа. Иммуногенная композиция может вводиться непосредственно индивидууму-реципиенту, например, путем инъекции, ингаляции, пероральным, интраназальным или любым другим парентеральным путем введения или путем введения через слизистые (например, интраректально или интравагинально).
Под «эпитопом» подразумевается участок на антигене, на которые отвечают специфичные В-клетки и/или Т-клетки, и это дает возможность молекуле, содержащей такой эпитоп, вызывать иммунологическую реакцию или взаимодействовать с антителами, присутствующими в биологическом образце. Данный термин также используется взаимозаменяемо с «антигенной детерминанто» или «участком антигенной детерминанты». Эпитоп может включать в себя 3 или большее количество аминокислот в пространственной конформации, уникальной для эпитопа. В общем, эпитоп состоит, по меньшей мере, из 5 таких аминокислот и, чаще всего, состоит, по меньшей мере, 8-10 таких аминокислот. Способы определения пространственной конформации аминокислот известны в данной области и включают в себя, например, рентгеновскую кристаллографию и 2-мерный ядерный магнитные резонанс. Более того, идентификации эпитопов в данном белке легко выполняется с использованием способов, хорошо известных в данной области, например, с применением исследований гидрофобности и путем сайт-специфической серологии. См., также, Geysen et al., Proc. Natl. Acad Sci. USA (1984) 81: 3998-4002 (общий способ быстрого синтеза пептидов для определения локализации иммуногенных эпитопов к полученному антигену); патент США  4708871 (процедуры идентификации и химического синтеза эпитопов антигенов); и Geysen et al., Molecular Immunology (1986) 23: 709-715 (способ идентификации пептидов с высоким сродством в отношении данного антитела). Антитела, которые распознают один и тот же эпитоп, могут идентифицироваться в простом иммунном анализе, показывающем способность одного антитела блокировать связывание другого антитела с антигеном-мишенью. 4708871 (процедуры идентификации и химического синтеза эпитопов антигенов); и Geysen et al., Molecular Immunology (1986) 23: 709-715 (способ идентификации пептидов с высоким сродством в отношении данного антитела). Антитела, которые распознают один и тот же эпитоп, могут идентифицироваться в простом иммунном анализе, показывающем способность одного антитела блокировать связывание другого антитела с антигеном-мишенью.
Используемый здесь термин «иммунологический ответ» или «иммунный ответ» представляет собой развитие у индивидуума гуморального и/или клеточного иммунного ответа на пептид, описанный выше, где данный полипептид присутствует в вакцинной композиции. Данные антитела также могут нейтрализовать инфекционность и/или опосредовать действие системы антитело-комплемент или антителозависимую клеточную цитотоксичность для предоставления защиты иммунизированного хозяина. Иммунологическая реактивность может определяться в стандартных иммунных анализах, таких как конкурентный анализ, хорошо известный в данной области.
«Перенос гена» или «доставка гена» относится к способам или системам надежного встраивания интересующей ДНК в клетку хозяина. Такие способы могут приводить к временной экспрессии неинтегрированной перенесенной ДНК, экстрахромосомной репликации и экспрессии перенесенных репликонов (например, эписом), или интеграции перенесенного генетического материала в геномную ДНК клеток хозяина. Экспрессирующие векторы для доставки генов включают в себя в качестве неограничивающих примеров векторов, происходящих из альфавирусов, поксвирусов, и вирусов коровьей оспы. При использовании для иммунизации такие экспрессирующие векторы для генной доставки могут называться вакцинами или вакцинными векторами.
Термин «образец» включает в себя биологические и небиологические образцы. Биологические образцы представляют собой те, которые получены или происходят из живых или живущих когда-либо организмов. Небиологические образцы не происходят из живых или живущих когда-либо организмов. Биологические образцы включают в себя в качестве неограничивающих примеров образцы, происходящие из животных (живых или мертвых), например из органов (например, головного мозга, печени, почки, и т.д.), цельной крови, фракций крови, плазмы, цереброспинальной жидкости (CSF), мочи, слез, ткани, органов, биопсий. Примеры небиологических образцов включают в себя фармацевтические средства, продукты питания, косметику и тому подобное.
Термины «метка» и «выявляемая метка» относятся к молекуле, способной выявляться, включая в качестве неограничивающих примеров радиоактивные изотопы, флуорофоры, люминофоры, хемилюминофоры, ферменты, субстраты ферментов, кофакторы ферментов, ингибиторы ферментов, хромофоры, красители, ионы металлов, золи металлов, лиганды (например, биотин или гаптены) и тому подобное. Термин «флуорофор» относится к веществу или к его части, которое способно излучать флуоресценцию в выявляемом интервале. Конкретные примеры меток, которые могут использоваться по изобретению, включают в себя в качестве неограничивающих примеров флуоресценин, родамин, дансил, умбеллиферон, Техасский красный, люминол, сложные эфиры акрадимума, NADPH, бета-галактозидазу, пероксидазу хрена, глюкозооксидазу, целочную фосфатазу и уреазу. Метка также может представлять собой эпитопную метку (например, метку His-His), антитело или амплифицируемый или выявляемый иначе олигонуклеотид.
II. Общий обзор
Здесь описаны композиции, включающие в себя пептидный реагент (и/или полинуклеотиды, кодирующие эти пептидные реагенты), в которых пептидный реагент способен отличать патогенные и непатогенные изоформы прионных белков, например, за счет преимущественного взаимодействия с одной формой и отсутствия взаимодействия с другой. Также предоставлены антитела, генерируемые с использованием данных пептидных реагентов, а также композиции и способы получения и применения данных пептидных реагентов и/или антител (например, выделения и/или обнаружения патогенного прионного белка).
Изобретение частично относится к открытию авторов изобретения, состоящему в том, что относительно малые фрагменты прионного белка могут преимущественно связываться с патогенной формой приона. Для проявления преимущественного взаимодействия с патогенной изоформой приона данные фрагменты не обязательно должны быть частями более крупной белковой структуры или другого типа каркасной молекулы. Хотя это и не связано с какой-либо конкретной теорией, оказывается, что пептидные фрагменты спонтанно принимают конформацию, которая обеспечивает связывание патогенной изоформы приона, но не непатогенной изоформы приона, возможно, путем имитации конформации, которая присутствует в непатогенной изоформе. Данный общий принцип, указывающий на то, что некоторые фрагменты белка конформационного заболевания взаимодействуют преимущественно с патогенной формой данного белка конформационного заболевания, продемонстрированный здесь для прионов, может легко применяться в отношении других белков конформационного заболевания для продукции пептидных реагентов, которые взаимодействуют преимущественно с патогенными формами. Обычному специалисту в данной области понятно, что данные фрагменты предоставляют исходную точку (в плане размера или характеристик последовательности, например), что в данных фрагментах могут быть сделаны модификации для продукции пептидных реагентов с более необходимыми свойствами (например, с более высоким сродством, большей стабильностью, большей растворимостью, меньшей чувствительностью к протеазам, большей специфичностью, большей простотой в плане синтеза, и т.д.).
В общем описанные здесь пептидные реагенты способны преимущественно взаимодействовать с патогенными формами прионных белков. Таким образом, данные пептидные реагенты обеспечивают более простое обнаружение патогенных форм белков и, следовательно, диагностику связанных с прионами заболеваний практически в любом образце, биологическом или небиологическом, включающем живой или мертвый головной мозг, спинной мозг, или другую ткань нервной системы, а также кровь.
Кроме того, описанные здесь пептидные реагенты могут использоваться для получения антител, которые могут использоваться в диагностических или терапевтических композициях или способах. В частности, когда пептидный реагент и/или антитело взаимодействует преимущественно с патогенным белком, оно может использоваться преимущественно для обнаружения патогенных изоформ, например, за счет упорядочения, агрегации или иной индукции относящихся к заболеванию форм белков в состоянии, которое затем может выявляться. Описанные здесь пептидные реагенты могут использоваться в различных диагностических анализах, включая обнаружение патогенных форм в содержащих кровь образцах. Антитела и/или пептидные реагенты (или один или несколько из их составляющих частей) могут метиться или маркироваться для облегчения обнаружения и/или усиления взаимодействия с прионными белками.
Кроме того, любая система для амплификации сигнала может использоваться для дальнейшего облегчения обнаружения, включая в качестве неограничивающих примеров применение разветвленной ДНК для амплификации сигнала (см., например, патенты США 5681697; 5424413; 5451503; 54547025; и 6235483); применение способов амплификации мишени, таких как ПЦР, амплификация по вращающемуся кругу, Third Wave’s invader (Arruda et al. 2002 Expert. Rev. Mol. Diagn. 2: 487; патенты США  6090606, 5843669, 5985557, 6090543, 5846717), NASBA, TMA, и т.д. (патент США 6511809; EP0544212A1); и/или способы иммуно-ПЦР (см., например, патенты США 6090606, 5843669, 5985557, 6090543, 5846717), NASBA, TMA, и т.д. (патент США 6511809; EP0544212A1); и/или способы иммуно-ПЦР (см., например, патенты США  5665539; Международные публикации WO 98/23962; WO 00/75663; и WO 01/31056). 5665539; Международные публикации WO 98/23962; WO 00/75663; и WO 01/31056).
Более того, могут использоваться описанные здесь пептидные реагенты и антитела, отдельно или в комбинации для лечения или профилактики заболевания.
III. A. Пептидные реагенты
Здесь описаны пептиды, которые взаимодействуют с патогенными формами белка конформационного заболевания. Примерами белков конформационных заболеваний служат здесь прионные белки.
Далее следует неограничивающий список заболеваний с ассоциированными белками, которые принимают две или большее количество различных конформаций.
| Заболевание |
Белок(-ки) конформационного заболевания |
| Прионные заболевания (например, болезнь Крейтцфельдта-Якоба, скрэпи, губчатая энцефалопатия крупного рогатого скота) |
PrPSc |
| Болезнь Альцгеймера |
APP, А*-пептид, *1-антихимотрипсин, tan, не относящийся к А* компонент |
| ALS |
SOD и нейрофиламент |
| Болезнь Пика |
Тельца Пика |
| Болезнь Паркинсона |
Тельца Леви |
| Диабет I типа |
Амилин |
| Множественная миелома – дискразия плазматических клеток |
IgG, L-цепь |
| Семейная амилоидозная полинейропатия |
Транстиретин |
| Медуллярная карцинома щитовидной железы |
Прокальцитонин |
| Хроническая почечная недостаточность |
бета-2-микроглобин |
| Застойная сердечная недостаточность |
атриальный натрийуретический фактор |
| Сенильный сердечный и системный амилоидоз |
Транстиретин |
| Хроническое воспаление |
Сывороточный амилоид А |
| Атеросклероз |
Апо-А1 |
| Семейный амилоидоз |
Гельзолин |
Далее, каждый из перечисленных выше белков конформационных заболеваний включают в себя некоторое количество вариантов или мутаций, происходящих в различных штаммах, которые относятся к настоящему изобретению. Функциональный анализ различных областей и последовательностей мышиного прионного белка даны ниже. См. также Priola (2001) Adv. Protein Chem. 57: 1-27. Области и остатки, соответствующие установленным ниже для мыши (Mo), хомяка (Ha), человека (Hu), птицы (A) и овцы (Sh), могут легко определяться для других видов стандартными процедурами и по приведенному здесь учению.
| Аминокислота(-ы) |
Функция |
| Mo1-28 |
Домен транслокации (отщепляемый) |
| 22 |
Предполагаемый участок расщепления |
| 23-28 |
Основная область, потенциально взаимодействующая с участком связывания белка Х, поскольку ее делеция отменяет эффект ассоциированных с белком Х мутаций на С-конце прионных белков |
| 23-88 |
Область окта-повтора (вставка 1-9 или делеция 2 усиливают заболевание). Координация меди гистидинами в каждом из повторов |
| 34-52 |
Часть окта-повтора, которая, как показано, образует полипролиновую спираль и также образует гидроксипролин |
| 86-91 |
Участки расщепления PrPSc при расщеплении протеиназой К |
| Hu82-146 |
7 кДа фрагмент, обнаруженный в поврежденном головном мозге пациентов с GSS; синтетический пептид, соответствующей данной области, образует ионные каналы |
| HuP102 |
Мутация P102L, ассоциированная с GSS, оказывается, не вызывает спонтанного преобразования прионного белка в устойчивую к протеазам конформацию. Пролин консервативен во всех оцениваемых видах. |
| HuP105 |
Мутация P105L, ассоциированная с GSS, оказывается, не вызывает спонтанного преобразования прионного белка в устойчивую к протеазам конформацию. Пролин консервативен во всех оцениваемых видах. |
| Hu102-105 |
PXXP-мотив; возможно, полипролиновая спираль II типа |
| Mo_106 |
Ассоциирован с устойчивостью к заболеванию |
| Hu106-126 |
Мутантные формы синтетических пептидов, как считается, образуют модулирующие медь ионные каналы, G114 и G119, как показано, снижают фибриллогенное поведение пептида, когда мутируют с получением А. |
| Mo_111 |
Ассоциирован с устойчивостью к заболеванию |
| Sh104-113 |
Пептид, совместно кристаллизованный с D13 Fab |
| Ha109-112 |
Петля, специфично распознаваемая пептидом D13, что показано кристаллической структурой (М109 и М112 встроены в связывающие карманы внутри Fab). |
| Hu113-120 |
Палиндромная последовательность, полностью консервативная |
| А117V |
Патогенная мутация в палиндроме; повышает амилоидогенные свойства пептидов, содержащих данную область |
| Ha129-131 |
Бета-лист в PrPC |
| На129/Go132 |
Полиморфизм, ассоциированный с чувствительностью/устойчивостью к прионному заболеванию |
| На136 |
Аланиновый полиморфизм, ассоциированный с повышением окаймленных ямок у овец |
| Мо138/Go142 |
Полиморфизм, ассоциированный с чувствительностью/устойчивостью к прионному заболеванию |
| Mo141-176 |
Область, делеция которой (вместе с 23-88) из мышиного миниприона PrP106 не имела эффекта; это указывает на незначительную функцию данной области |
| Ha144-154 |
Спираль А |
| Ha155 |
Полиморфизм, ассоциированный с чувствительностью/устойчивостью против прионного заболевания |
| Ha160-163 |
Лист 2 |
| MoV165 |
Видовой барьер. Когда у трансгенных по человеческому гену мышей данные остатки мутируют обратно в мышиную последовательность, наблюдается намного более короткий инкубационный период |
| MoQ167 |
Видовой барьер. Когда у трансгенных по человеческому гену мышей данные остатки мутируют обратно в мышиную последовательность, наблюдается намного более короткий инкубационный период |
| MoQ168 |
Предполагаемый участок связывания белка Х; при мутации он защищает от прионного заболевания |
| Sh171 |
Полиморфизм, ассоциированный с чувствительностью/устойчивостью против прионного заболевания |
| MoQ172 |
Предполагаемый участок связывания белка Х; при мутации он защищает от прионного заболевания |
| 176 |
Связанный дисульфидной связью цистеин |
| Ha173-194 |
Спираль В |
| 178 |
Ассоциированная с заболеванием мутация |
| 180 |
Ассоциированная с заболеванием мутация, участок гликозилирования |
| 196 |
Участок гликозилирования |
| 198 |
Ассоциированная с заболеванием мутация |
| Hu200-228 |
Спираль С |
| HuE200 |
Мутация на К ассоциирована с семейным CJD у ливийских евреев (полиморфизм М129 в комбинации также повышает шансы на заболеваемость) |
| 208 |
Ассоциированная с заболеванием мутация |
| 210 |
Ассоциированная с заболеванием мутация |
| MoT215 |
Предполагаемый участок связывания белка Х; при мутации он защищает от прионного заболевания |
| 217 |
Ассоциированная с заболеванием мутация |
| MoQ219 |
Предполагаемый участок связывания белка Х; при мутации он защищает от прионного заболевания |
| 232 |
Ассоциированная с заболеванием мутация |
| 232 |
GPI-якорь |
| ~233 |
Предполагаемый участок расщепления GPI-якоря |
| 233-254 |
Часть, удаляемая из зрелого белка |
Следует также заметить, что прионные белки (и другие белки конформационного заболевания) имеют две разные 3-мерные конформации при одинаковой аминокислотной последовательности. Одна из конформаций ассоциирована с характеристиками заболевания и в общем нерастворима, в то время как другая конформация не ассоциирована с характеристиками заболевания и растворима. См., например, Wille, et al., “Structural Studies of the Scrapie Prion Protein by Electron Crystallography”, Proc.Natl. Acad. Sci. USA, 99 (6): 3563-3568 (2002). Хотя настоящее изобретение и проиллюстрированно примером прионных белков, оно не ограничено перечисленными заболеваниями, белками и штаммами.
Таким образом, в некоторых аспектах описанные здесь пептидные реагенты включают в себя аминокислотную последовательность происходящую из встречающегося в природе белка, например белка конформационного заболевания (например, прионного белка) или белка, который содержит мотивы или последовательности, которые проявляют гомологию в отношении прионных белков. В частности, пептидные реагенты по изобретению обычно происходят из встречающегося в природе прионного белка. Пептидные реагенты предпочтительно получают из аминокислотных последовательностей из некоторых областей прионных белков. Примерами данных предпочтительных областей в плане мышиной прионной последовательности (SEQ ID NO: 2) являются аминокислотные остатки 23-43 и 85-156, и входящие в их состав области. Изобретение не ограничено пептидными реагентами, полученными из мышиных последовательностей, но относится к пептидным реагентам, полученным сходным образом, как описано, из прионных последовательностей любых видов, включая человека, крупный рогатый скот, овец, оленей, лосей и хомяка. Когда описанные здесь пептидные реагенты получены из прионных белков, они могут включать в себя полипролиновый спиральный мотив II типа. Данный мотив обычно содержит общую последовательность PxxP (например, остатки 102-105 of SEQ ID NO: 1), хотя другие последовательности, в частности аланиновые тетрапептиды, также, как предполагается, образуют полипролиновые спирали II типа (см., например, Nguyen et al. Chem Biol. 2000 7: 463; Nguyen et al. Science 1998 282: 2088; Schweitzer-Stenner et al. J. Am. Chem Soc. 2004 126: 2768). В последовательности PxxP «x» может представлять собой любую аминокислоту и «P» представляет собой пролин во встречающейся в природе последовательности, но может находиться во встречающейся в природе последовательности, но может меняться на заместитель пролина в пептидных реагентах по изобретению. Такие заместители пролина включают в себя N-замещенные глицины, обычно называемые пептоидами. Таким образом, в пептидных реагентах по изобретению, которые включают в себя полипролиновую спираль типа II, основанные на последовательности PxxP, «P» представляет собой пролин или N-замещенные глициновые остатки, и «x» представляет собой аминокислоту или аналог аминокислоты. Здесь описаны особенно предпочтительные N-замещенные глицины.
Кроме того, известна полинуклеотидная и аминокислотная последовательность прионных белков, продуцируемых многими различными видами, включая человека, мышь, овец и крупный рогатый скот. Варианты данных последовательностей также существуют в каждом виде. Таким образом, пептидные реагенты, используемые по изобретению, могут включать в себя фрагменты или производные аминокислотных последовательностей любых видов или вариантов. Например, в некоторых вариантах осуществления описанные здесь пептидные реагенты происходят из любых последовательностей, приведенных на фиг.2 (SEQ ID NO: 3-11). Последовательности пептидных реагентов, которые специфично описаны здесь, в общем, основаны на мышиной прионной последовательности, однако специалист в данной области может легко заместить ее соответствующими последовательностями из другого вида, если они подходят. Например, если требуются человеческие диагностические или терапевтические средства, может быть легко сделана замена мышиных последовательностей на соответствующие человеческие последовательности. В конкретном примере, в пептидных реагентах, происходящих из области примерно от остатка 85 до остатка 112 (например, SEQ ID NO: 35, 36, 37, 40), лейцин в положении, соответствующем остатку 109, может замещаться метионином, валин в положении соответствующем остатку 112, может замещаться метионином, и аспарагин в положении, соответствующем остатку 97, может замещаться серином. Сходным образом, если требуется средство для диагностики крупного рогатого скота, могут проводиться подходящие замены в описанных пептидных последовательностях, чтобы они отражали последовательность приона крупного рогатого скота. Таким образом, продолжая с указанным выше примером для пептидных реагентов, происходящих из области примерно от остатка 85 до остатка 112, лейцин в положении, соответствующем остатку 109, может замещаться метионином, и аспарагин в положении соответствующем остатку 97, может замещаться глицином. Также могут использоваться производные прионных белков, включая аминокислотные замены, делеции, добавления и другие мутации данных последовательностей. Предпочтительно, любые аминокислотные замены, добавления и делеции, по сравнению с последовательностью прионного белка, не влияют на способность пептидного реагента взаимодействовать с патогенной формой.
Следует понимать, что вне зависимости от того, какой источник использован для описанных здесь пептидных реагентов, данные пептидные реагенты не обязательно проявят идентичность последовательности в отношении известных прионных белков. Таким образом, описанные здесь пептидные реагенты могут включать в себя одну или несколько аминокислотных замен, добавлений или делеций в отношении встречающегося в природе прионного белка или описанных здесь последовательностей до тех пор, пока они сохраняют способность преимущественно взаимодействовать с патогенными формами белков конформационных заболеваний. В некоторых вариантах осуществления предпочтительны консервативные аминокислотные замены. Консервативными аминокислотными заменами являются те, которые имеют место в пределах семейства аминокислот, которые относятся к их боковым цепям. Генетически кодируемые аминокислоты в основном подразделяются на три семейства: (1) кислые = аспартат, глутамат; (2) основные = лизин, аргинин, гистидин; (3) неполярные = аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные = глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют совместно как ароматические аминокислоты. Например, можно резонно предположить, что отдельная замена лейцина на изолейцин или валин, аспартата на глутамат, треонин на серин, или сходная консервативная замена аминокислоты структурно связанной аминокислотой не будет иметь большого влияния на биологическую активность.
Также понятно, что любая комбинация природных аминокислот и неприродных аналогов аминокислот может использоваться для получения описанных здесь пептидных реагентов. Обычно рассматриваемые аналоги аминокислот, не кодируемые генами, включают в себя в качестве неограничивающих примеров орнитин (Orn); аминоизомасляную кислоту (Aib); бензотиофенилаланин (BtPhe); альбиццин (Abz); трет-бутилглицин (Tle); фенилглицин (PhG); циклогексилаланин (Cha); норлейцин (Nle); 2-нафтилаланин (2-Nal); 1-нафтилаланин (1-Nal); 2-тиенилаланин (2-Thi); 1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту (Tic); N-метилизолейцин (N-MeIle); гомоаргинин (Har); N -метиларгинин (N-MeArg); фосфотирозин (pTyr или pY); пипеколиновую кислоту (Pip); 4-хлорфенилаланин (4-ClPhe); 4-фторфенилаланин (4-FPhe); 1- аминоциклопропанкарбоновую кислоту (1-NCPC); и саркозин (Sar). Любая из используемых в пептидных реагентах по настоящему изобретению аминокислот может быть D- или, чаще, L-изомером. -метиларгинин (N-MeArg); фосфотирозин (pTyr или pY); пипеколиновую кислоту (Pip); 4-хлорфенилаланин (4-ClPhe); 4-фторфенилаланин (4-FPhe); 1- аминоциклопропанкарбоновую кислоту (1-NCPC); и саркозин (Sar). Любая из используемых в пептидных реагентах по настоящему изобретению аминокислот может быть D- или, чаще, L-изомером.
Другие не встречающиеся в природе аналоги аминокислот, которые могут использоваться для образования описанных здесь пептидных реагентов, включают в себя пептоиды и/или соединения-пептидомиметики, например, основанные на сульфоновой или бороновой кислоте аналоги аминокислот, которые представляют собой биологически функциональные эквиваленты, также могут использоваться в соединениях по настоящему изобретению и включают в себя соединения, имеющие одну или несколько амидных связей, необязательно замещенных изостерой. В контексте настоящего изобретения, например, –CONH– может замещаться –CH2NH–, –NHCO–, –SO2NH–, –CH2O–, –CH2CH2–, –CH2S–, –CH2SO–, –CH–CH– (цис или транс), –COCH2–, –CH(OH)CH2— и 1,5-дизамещенным тетразолом, так что радикалы, связанные данными изостерами, будут поддерживаться в сходных ориентациях с радикалами, связанными –CONH–. Один или несколько остатков в описанных здесь пептидных реагентах могут включать в себя пептоиды.
Таким образом, пептидные реагенты также могут включать в себя один или несколько N-замещенных глициновых остатков (пептиды, имеющие один или несколько N-замещенных глициновых остатков, могут обозначаться как «пептоиды»). Например, в некоторых вариантах осуществления один или несколько остатков пролина любого из описанных здесь пептидных реагентов замещены N-замещенными глициновыми остатками. Конкретные N-замещенные глицины, которые подходят в данном отношении, включают в себя в качестве неограничивающих примеров N-(S)-(1-фенилэтил)глицин; N-(4-гидроксифенил)глицин; N-(циклопропилметил)глицин; N-(изопропил)глицин; N-(3,5-диметоксибензил)глицин; и N-бутилглицин (например, фиг.3). Другие N-замещенные глицины могут также подходить для замещения одного или нескольких аминокислотных остатков в последовательностях описанных здесь пептидных реагентов. Для общего обзора данных и других аналогов аминокислот и пептидомиметиков см. Nguyen et al. (2000) Chem Biol. 7 (7): 463-473; Spatola, A.F., in Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, B. Weinstein, eds., Marcel Dekker, New York, p. 267 (1983). См. также Spatola, A. F., Peptide Backbone Modifications (general review), Vega Data, Vol.1, Issue 3, (March 1983); Morley, Trends Pharm Sci (общий обзор), pp. 463-468 (1980); Hudson, D. et al., Int J Pept Prot Res, 14: 177-185 (1979) (–CH2NH–, CH2CH2–); Spatola etal., Life Sci, 38: 1243-1249 (1986) (–CH2–S); Hann J. Chem. Soc. Perkin Trans. I, 307-314 (1982) (–CH–CH–, цис и транс); Almquist et al., J Med Chem, 23:1392-1398 (1980) (–COCH2–); Jennings-White et al., Tetrahedron Lett, 23: 2533 (1982) (–COCH2–); Szelke et al., European Appln. EP 45665 CA: 97: 39405 (1982) (–CH(OH)CH2–); Holladay et al., Tetrahedron Lett, 24:4401-4404(1983) (–C(OH)CH2–); и Hruby, Life Sci, 31: 189-199 (1982) (–CH2–S–); каждая из данных публикаций включена сюда в качестве ссылки. C-концевая карбоновая кислота может замещаться бороновой кислотой –B(OH)2 или бороновым эфиром –B(OR)2 или другим таким производным бороновой кислоты, как описано в патенте США  5288707, включенном сюда в качестве ссылки. 5288707, включенном сюда в качестве ссылки.
Описанные здесь пептидные реагенты могут включать в себя мономеры, мультимеры, циклизованные молекулы, разветвленные молекулы, линкеры и тому подобное. Также рассматриваются мультимеры (т.е., димеры, триммеры и тому подобное) любой из описанных здесь последовательностей или их биологически функциональных эквивалентов. Мультимер может быть гомомультимером, т.е., составленным из идентичных мономеров, например, каждый мономер представляет собой одну и ту же аминокислотную последовательность. Альтернативно, мультимер может представлять собой гетеромультимер, под чем подразумевается то, что не все мономеры, образующие мультимер идентичны.
Мультимеры могут образовываться путем непосредственного присоединения мономеров друг к другу или путем присоединения к субстрату, включая, например, пептиды-множественные антигены (MAP) (например, симметричные MAP), пептиды, присоединенные к полимерным каркасам, например к каркасу ПЭГ, и/или пептиды, соединенные тандемами со спейсерными единицами или без них.
Альтернативно, связывающие группы могут быть добавлены к мономерным последовательностям для соединения мономеров вместе и образования мультимера. Неограничивающие примеры мультимеров с использованием связывающих групп включают в себя тандемные повторы с использованием глициновых линкеров; MAP, соединенные посредством линкера с субстратом и/или линейно связанные пептиды, присоединенные линкерами к субстрату. Связывающие группы могут включать в себя применение бифункциональных спейсерных единиц (гомобифункциональных или гетеробифункциональных), известных специалисту в данной области. В качестве неограничивающих примеров многие способы включения таких спейсерных единиц в связывающие пептиды вместе с применением таких реагентов, как сукцинимидил-4-(п-малеимидометил)циклогексан-1-карбоксилат (SMCC), сукцинимидил-4-(п-малеимидофенил)бутират и подобных им описаны в Pierce Immunotechnology Handbook (Pierce Chemical Co., Rockville, Ill.) и также доступны от Sigma Chemical Co. (St. Louis, Mo.) и Aldrich Chemical Co. (Milwaukee, Wis.) и описаны в “Comprehensive Organic Transformations”, VCK-Verlagsgesellschaft, Weinheim/Germany (1989). Одним из примеров связывающей группы, которая может использоваться для связывания вместе мономерных последовательностей, является –Y1–F–Y2, где Y1 и Y2 идентичны или отличны и представляют собой алкиленовые группы 0-20, предпочтительно, 0-8, более предпочтительно, 0-3 атомов углерода, и F представляет собой одну или несколько функциональных групп, таких как –O–, –S–, –S–S–, –C(O) –O–, –NR–, –C(O)–NR–, –NR–C(O)–O–, –NR–C(O)–NR–, –NR–C(S)–NR–, –NR–C(S)–O–. Y1 и Y2 могут необязательно замещаться на гидрокси, алкокси, гидроксиалкил, алкоксиалкил, амино, карбоксил, карбоксиалкил и тому подобное. Следует понимать, что любой подходящий атом мономера может присоединяться к связывающей группе.
Кроме того, пептидные реагенты по изобретению могут быть линейными, разветвленными или циклизованными. Мономерные единицы могут быть циклизованы или могут быть связаны вместе для обеспечения мультимеров в линейном или разветвленном виде, в виде кольца (например, макроцикл), в виде звезды (дендримеры) или в форме шара (например, фуллерены). Специалисты в данной области легко распознают различные полимеры, которые могут образовываться из описанных здесь мономерных последовательностей. В некоторых вариантах осуществления мультимер представляет собой циклический димер. С использованием той же терминологии, что указана выше, димер может представлять собой гомодимер или гетеродимер.
Циклические формы, мономеры это или мультимеры, могут быть получены посредством любой из описанных здесь связей, например, в качестве неограничивающих примеров: (1) путем циклизации N-концевого амина с C-концевой карбоновой кислотой посредством прямого образования амидной связи между азотом и С-концевым карбонилом, или посредством промежуточной спейсерной группы, например, путем конденсации с эпсилон-амино-карбоновой кислотой; (2) путем циклизации посредством образования связи между боковыми цепями двух остатков, например, путем образования амидной связи между аспартатной или глутаматной боковой цепью и боковой цепью лизина, или путем образования дисульфидной связи между двумя боковыми цепями цистеина, или между пеницилламином и боковой цепью цистеина, или между двумя боковыми цепями пеницилламина; (3) путем циклизации за счет образования амидной связи между боковой цепью (например, аспартата или лизина) и N-концевым амином или С-концевым карбоксилом, соответственно; и/или (4) путем связывания двух боковых цепей посредством промежуточной короткой углеводородной спейсерной группы.
Предпочтительно описанные здесь пептидные реагенты не являются патогенными и/или инфекционными.
Пептидные реагенты по изобретению могут находиться в пределах от 3 примерно до 100 остатков в длину (или любой длины между данными значениями) или даже длиннее, предпочтительно, примерно от 4 до 75 остатков (или любой длины между данными значениями), предпочтительно примерно от 5 до 63 остатков (или любой длины между данными значениями), и даже более предпочтительно примерно от 8 до 30 остатков (или любой длины между данными значениями), и, наиболее предпочтительно, пептидный реагент составляет 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 остатков.
Неограничивающие примеры пептидных реагентов, которые могут использоваться в описанных здесь композициях и способах, происходят из последовательностей, показанных в таблице 1 и в таблице 4. Пептидные реагенты в таблицах представлены общепринятыми однобуквенными аминокислотными кодами и обозначены с N-конца слева и с C-конца справа. Аминокислоты в квадратных скобках указывают на альтернативные остатки, которые могут использоваться в данном положении в различных пептидных реагентах. Круглые скобки указывают на остаток(-ки), который(-ые) могут присутствовать или отсутствовать в пептидном реагенте. Любой пролиновый остаток может замещаться N-замещенными глициновыми остатками с образованием пептоидов. Любые из последовательностей в таблицах могут необязательно включать в себя линкеры Gly (Gn, где n = 1, 2, 3, или 4) с N- и/или C-конца.
Таблица 1





В одном из аспектов пептидный реагент по изобретению включает в себя каждый из описанных здесь пептидов и их производных (как описано здесь). Таким образом, изобретение включает в себя пептидный реагент, полученный из пептида с SEQ ID NO: 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, или 132.
Изобретение предпочтительно включает в себя пептидный реагент, полученный из пептида с SEQ ID NO: 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 72, 74, 76, 77, 78, 81, 82, 84, 89, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, или 132.
В некоторых предпочтительных вариантах осуществления пептидные реагенты специфично связываются с патогенными прионами, например пептидные реагенты, полученные из пептидов SEQ ID NO: 66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126, 127, 14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 128, 129, 130, 131, 132, 56, 57, 65, 82, или 84, и их аналоги (например, с заменой одного или нескольких пролинов N-замещенным глицином) и производные.
Как описано выше, описанные здесь пептидные реагенты могут включать в себя одну или несколько замен, добавлений и/или мутаций. Например, один или несколько остатков в пептидных реагентах может замещаться другими остатками, например, аланиновыми остатками, или аналогом аминокислоты или N-замещенным глициновым остатком для получения пептоида (см., например, Nguyen et al. (2000) Chem Biol. 7 (7): 463-473).
Более того, описанные здесь пептидные реагенты могут также включать в себя дополнительные пептидные или непептидные компоненты. Неограничивающие примеры дополнительных пептидных компонентов включают в себя спейсерные остатки, например, два или большее число глициновых остатков (природных или дериватизированных) или линкеров аминогексановой кислоты на одном или обоих концах, или остатки, которые могут способствовать солюбилизации пептидных реагентов, например кислых остатков, таких как аспарагиновая кислота (Asp или D), как показано, например, в SEQ ID NO: 83, 86. В некоторых вариантах осуществления, например, пептидные реагенты синтезируются в виде пептидов-множественных антигенов (MAP). Обычно множественные копии пептидных реагентов (например, 2-10 копий) синтезируются непосредственно на MAP-носителе, таком как разветвленный лизин или другой несущее ядро MAP. См., например, Wu et al. (2001) J Am Chem Soc. 2001123 (28): 6778-84; Spetzler et al. (1995) Int J Pept Proten Res. 45(1): 78-85.
Неограничивающие примеры непептидных компонентов (например, химических радикалов), которые могут быть включены в описанные здесь пептидные реагенты, включают в себя одну или несколько выявляемых меток (например, биотин, His-метки, олигонуклеотиды), красители, представители связывающихся пар, и тому подобное, как на конце, так и внутри пептидного реагента. Непептидные компоненты могут также присоединяться (например, посредством ковалентного присоединения одной или нескольких меток), непосредственно или через спейсер (например, амидную группу), в положение(-я) соединения, которое(-ые), как предсказано количественными данными по исследованию структуры-активности и/или молекулярным моделированием, не препятствуют активности. Пептидные реагенты, описанные здесь, могут также включать в себя специфичные в отношении приона химические радикалы, такие как специфичные в отношении амилоида красители (например, Конго красный или тиофлавин). Дериватизация соединений (например, мечение, циклизация, присоединение химических радикалов, и т.д.) не должна существенно препятствовать (и может даже усиливать) свойства связывания, биологической функции и/или фармакологической активности пептидного реагента.
Пептидные реагенты по изобретению обычно имеют, по меньшей мере, примерно 50% идентичности по последовательности в отношении фрагментов прионного белка или приведенных здесь пептидных последовательностей. Предпочтительно, пептидные реагенты имеют, по меньшей мере, 70% идентичность последовательности, более предпочтительно, по меньшей мере, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, или 100% идентичность по последовательности в отношении фрагментов прионного белка или приведенных здесь пептидных последовательностей.
Описанные здесь пептидные реагенты взаимодействуют преимущественно с патогенными формами и, соответственно, могут использоваться в разнообразных применениях по выделению, очистке, обнаружению, диагностике и лечению. Например, в вариантах осуществления, в которых пептидный реагент взаимодействует преимущественно с патогенными формами, сами пептидные реагенты могут использоваться для обнаружения в образце, таком как кровь, ткань нервной системы (головной мозг, спинной мозг, ЦСЖ, и т.д.) или образец другой ткани или органа. Пептидные реагенты также могут использоваться для диагностики присутствия заболевания, ассоциированного с патогенными формами, обнаружения патогенных форм и для деконтаминации образцов посредством удаления патогенных форм.
Взаимодействие пептидных реагентов с прионными белками может тестироваться с использованием любых известных анализов связывания, например стандартных иммунных анализов, таких как ELISA, вестерн-блот и тому подобное.
Одним из удобных способов тестирования специфичности пептидных реагентов по настоящему изобретения является выбор образца, содержащего как патогенные, так и непатогенные прионы. Такие обычные образцы содержат ткань головного или спинного мозга из больных животных. Описанные здесь пептидные реагенты, которые специфично связываются с патогенными формами, присоединяются к твердой основе (способами, хорошо известными в данной области и далее описанными ниже) и используются для отделения («осаждения») патогенного приона от других компонентов образца и получения количественного значения, непосредственно относящегося к числу взаимодействий связывания пептид-прион на твердой основе. Вариации и другие анализы, известные в данной области, могут также использоваться для демонстрации специфичности пептидных реагентов по изобретению. См., например, примеры.
Хотя при использовании описанных здесь пептидных реагентов это не обязательно, в данных анализах может использоваться тот факт, что прионы, имеющие патогенную конформацию, в основном, устойчивы к протеазам, таким как протеиназа К. Те же протеазы могут разрушать прионы в непатогенной конформации. Поэтому при использовании протеазы образец может разделяться на два равных объема. Протеаза может добавляться ко второму образцу, и может проводиться тот же тест. Поскольку протеаза во втором образце разрушает любые непатогенные прионы, любые взаимодействия по связыванию пептид-прион во втором образце могут быть отнесены к патогенным прионам.
Таким образом, неограничивающие примеры способов оценки специфичности связывания и/или сродства описанных здесь пептидных реагентов включают в себя стандартные процедуры вестерн- и фар-вестерн-блоттинга; меченые пептиды; ELISA-подобные анализы; и/или основанные на клетках анализы. В вестерн-блотах, например, используются меченое первичное антитело, которое выявляет денатурированный прионный белок в геле SDS-PAGE образцов, полученных при описанном здесь анализе «осаждения», который подвергают электроблоттингу на нитроцеллюлозу или PVDF. Описаны антитела, которые распознают денатурированный прионный белок (среди прочих, описаны в Peretz et al. 1997 J. Mol. Biol. 273: 614; Peretz et al. 2001 Nature 412: 739; Williamson et al. 1998 J. Virol. 72: 9413; патенте США  6765088; патенте США 6765088; патенте США  6537548), и некоторые из них коммерчески доступны. Описаны другие связывающие прион молекулы, например гибридные полипептиды с привитыми мотивами (см., WО03/085086), некоторые катионные или анионные полимеры (см., WО03/073106), некоторые пептиды, которые представляют собой «катализаторы размножения» (см., WО02/0974444) и плазминоген. Затем выявляется первичное антитело (и/или амплифицируется) посредством зонда для метки (например, конъюгированная со стрептавидином щелочная фосфатаза, пероксидаза хрена, реагент ECL, и/или амплифицируемые олигонуклеотиды). Связывание также может оцениваться с использованием реагентов для обнаружения, таких как пептидов с меткой сродства (например, биотином), которые мечены и амплифицированы посредством зонда для данной метки сродства (например, конъюгированной со стрептавидином щелочной фосфатазы, пероксидазы хрена, реагента ECL, или амплифицируемых олигонуклеотидов). Кроме того, могут использоваться процедуры, выполняемые в планшетах для микротитрования, сходные с сэндвич-методом ELISA, например, специфичный в отношении приона пептидный реагент, описанный здесь, используют для иммобилизации прионного(-ых) белка(-ов) на твердой основе (например, на лунке планшета для микротитрования, на грануле, и т.д.), и дополнительный реагент для выявления может включать в себя в качестве неограничивающих примеров другой специфичный в отношении прионов пептидный реагент с метками сродства и/или обнаружения, такими как конъюгированная щелочная фосфатаза, пероксидаза хрена, реагент ECL, или амплифицируемые олигонуклеотиды. Анализы, основанные на клетках, также могут использоваться, например, когда прионный белок выявляется непосредственно на индивидуальных клетках (например, с использованием флуоресцентно меченного, специфичного в отношении приона пептидного реагента, что обеспечивает основанную на флуоресценции сортировку, подсчет клеток, или обнаружение специфично меченых клеток). 6537548), и некоторые из них коммерчески доступны. Описаны другие связывающие прион молекулы, например гибридные полипептиды с привитыми мотивами (см., WО03/085086), некоторые катионные или анионные полимеры (см., WО03/073106), некоторые пептиды, которые представляют собой «катализаторы размножения» (см., WО02/0974444) и плазминоген. Затем выявляется первичное антитело (и/или амплифицируется) посредством зонда для метки (например, конъюгированная со стрептавидином щелочная фосфатаза, пероксидаза хрена, реагент ECL, и/или амплифицируемые олигонуклеотиды). Связывание также может оцениваться с использованием реагентов для обнаружения, таких как пептидов с меткой сродства (например, биотином), которые мечены и амплифицированы посредством зонда для данной метки сродства (например, конъюгированной со стрептавидином щелочной фосфатазы, пероксидазы хрена, реагента ECL, или амплифицируемых олигонуклеотидов). Кроме того, могут использоваться процедуры, выполняемые в планшетах для микротитрования, сходные с сэндвич-методом ELISA, например, специфичный в отношении приона пептидный реагент, описанный здесь, используют для иммобилизации прионного(-ых) белка(-ов) на твердой основе (например, на лунке планшета для микротитрования, на грануле, и т.д.), и дополнительный реагент для выявления может включать в себя в качестве неограничивающих примеров другой специфичный в отношении прионов пептидный реагент с метками сродства и/или обнаружения, такими как конъюгированная щелочная фосфатаза, пероксидаза хрена, реагент ECL, или амплифицируемые олигонуклеотиды. Анализы, основанные на клетках, также могут использоваться, например, когда прионный белок выявляется непосредственно на индивидуальных клетках (например, с использованием флуоресцентно меченного, специфичного в отношении приона пептидного реагента, что обеспечивает основанную на флуоресценции сортировку, подсчет клеток, или обнаружение специфично меченых клеток).
III. B. Продукция пептидных реагентов
Пептидные реагенты по настоящему изобретению могут продуцироваться любыми путями, которые известны в данной области.
В одном из вариантов осуществления пептидный реагент представляет собой, полностью или частично, генетически кодируемый пептид, причем данный пептид может генерироваться с использованием рекомбинантных способов, хорошо известных в данной области. Специалист в данной области может легко определить нуклеотидные последовательности, которые кодируют требуемый пептид с использованием стандартной методологии и приведенного здесь учения. После выделения рекомбинантный пептид необязательно может модифицироваться так, что они включают в себя не кодируемые генетически компоненты (например, выявляемые метки, представители связывающихся пар, и т.д.), как описано здесь и хорошо известно в данной области, для продукции пептидных реагентов.
Олигонуклеотидные зонды могут быть сконструированы на основе известных последовательностей и использованы для зондирования геномных или кДНК-библиотек. Последовательности могут быть далее выделены с использованием стандартных способов и, например, ферментов рестрикции, используемых для укорочения гена с получением требуемых частей полноразмерной последовательности. Сходным образом, интересующие последовательности могут выделяться непосредственно из содержащих их клеток и тканей, с использованием известных способов, таких как экстракция фенолом, с последовательностью манипулируют далее с получением требуемых укороченных частей. См., например, Sambrook et al., supra, для описания способов, используемых для получения и выделения ДНК.
Последовательности, кодирующие пептид, также могут продуцироваться синтетически, например, на основе известных последовательностей. Нуклеотидная последовательность может конструироваться с подходящими кодонами для конкретной требуемой аминокислотной последовательности. Полная последовательность, в общем, соединяется из перекрывающихся олигонуклеотидов, полученных стандартными способами, и объединяется из полной кодирующей последовательности. См., например, Edge (1981) Nature 292: 756; Nambair et al. (1984) Science 223: 1299; Jay et al. (1984) J. Biol. Chem. 259: 6311; Stemmer et al. (1995) Gene 164: 49-53.
Рекомбинантные способы легко используются для клонирования последовательностей, кодирующих полипептиды, применимые в заявленных пептидных реагентах, которые затем могут подвергаться мутагенезу in vitro путем замены подходящей(-их) пары(-р) оснований с получением в результате кодона для требуемой аминокислоты. Такое изменение может включать в себя, как минимум, одну пару оснований, что приводит к изменению одной аминокислоты, или может охватывать изменения в нескольких пар оснований. Альтернативно, мутации могут осуществляться с использованием несоответствующего праймера, который гибридизуется с исходной нуклеотидной последовательностью (в общем, кДНК, соответствующей последовательности РНК), при температуре ниже температуры плавления несовпадающего дуплекса. Праймер может быть получен специфичным за счет поддержания длины праймера и сочетания оснований в пределах относительно узких пределов и поддержания мутантного основания, локализованного по центру. См., например, Innis et al, (1990) PCR Applications: Protocols for Functional Genomics; Zoller and Smith, Methods Enzymol. (1983) 100: 468. Продление праймера осуществляется с использованием ДНК-полимеразы, продукт клонируют и отбирают клоны, содержащие мутированную ДНК, происходящие за счет сегрегации цепи продления праймера. Отбор может выполняться с использованием мутантного праймера в качестве зонда для гибридизации. Способ также может использоваться для получения множественных точечных мутаций. См., например, Dalbie-McFarland et al. Proc. Natl. Acad. Sci USA (1982) 79: 6409.
После выделения и/или синтеза кодирующих последовательностей они могут быть клонированы в любой подходящий вектор или репликон для экспрессии. (См., также, примеры). Как понятно из приведенных здесь сведений, разнообразные векторы, кодирующие модифицированные полипептиды, могут генерироваться путем создания экспрессирующих конструкций, которые функционально связывают в различных сочетаниях полинуклеотиды, кодирующие полипептиды, содержащие делеции или мутации.
Многочисленные клонирующие векторы известны специалистам в данной области, и селекция подходящего клонирующего вектора является предметом выбора. Примеры рекомбинантных ДНК-векторов для клонирования и клеток хозяина, которые могут трансформироваться ими, включают в себя бактериофаг  (E. coli), pBR322 (E. coli), pACYC177 (E. coli), pKT230 (грамотрицательные бактерии), pGV1106 (грамотрицательные бактерии), pLAFRl (грамотрицательные бактерии), pME290 (не относящиеся к E. coli грамотрицательные бактерии), pHV14 (E. coli и Bacillus subtilis), pBD9 (Bacillus), pIJ61 (Streptomyces), pUC6 (Streptonzyces), YIp5 (Saccharomyces), YCpl9 (Saccharomyces) и вирус папилломы крупного рогатого скота (клетки млекопитающих). См., в общем, DNA Cloning: Vols. I & II, supra; Sambrook et al., supra; B. Perbal, supra. (E. coli), pBR322 (E. coli), pACYC177 (E. coli), pKT230 (грамотрицательные бактерии), pGV1106 (грамотрицательные бактерии), pLAFRl (грамотрицательные бактерии), pME290 (не относящиеся к E. coli грамотрицательные бактерии), pHV14 (E. coli и Bacillus subtilis), pBD9 (Bacillus), pIJ61 (Streptomyces), pUC6 (Streptonzyces), YIp5 (Saccharomyces), YCpl9 (Saccharomyces) и вирус папилломы крупного рогатого скота (клетки млекопитающих). См., в общем, DNA Cloning: Vols. I & II, supra; Sambrook et al., supra; B. Perbal, supra.
Экспрессирующие системы клеток насекомых, такие как бакуловирусные системы, могут также использоваться и известны специалистам в данной области и описаны, например, в Summers and Smith, Texas Agricultural Experiment Station Bulletin No. 1555 (1987). Материалы и методы по экспрессирующим системам бакуловирус/клетки насекомых коммерчески доступны, среди прочих, от Invitrogen, Сан-Диего, Калифорния (набор «MaxBac»).
Растительные экспрессирующие системы могут также использоваться для продукции описанных здесь пептидных реагентов. В общем, в таких системах применяются основанные на вирусе векторы для трансфекции растительных клеток гетерологичными генами. Для описания таких систем см., например, Porta et al., Mol. Biotech. (1996) 5: 209-221; и Hackland et al., Arch. Virol. (1994) 139: 1-22.
Вирусные системы, такие как основанная на вирусе коровьей оспы система инфекции/трансфекции, описанная в Tomei et al., J. Virol. (1993) 67: 4017-4026 и Selby et al., J. Gen. Virol. (1993) 74: 1103-1113, также найдут применение по настоящему изобретению. В данной системе клетки вначале трансфицируют in vitro рекомбинантных вирусом коровьей оспы, который кодирует РНК-полимеразу бактериофага T7. Данная полимераза характеризуется исключительной специфичностью, при которой она транскрибирует только те матрицы, которые несут промотор T7. После инфицирования клетки трансфицируют интересующей ДНК, управляемой промотором T7. Полимераза, экспрессируемая в цитоплазме с рекомбинантного вируса коровьей оспы, транскрибирует трансфицированную ДНК в РНК, которая затем транслируется в белок посредством механизма трансляции хозяина. Способ предоставляет временную продукцию высокого уровня в цитоплазме больших количеств РНК и продукта(-ов) ее трансляции.
Ген может помещаться под контроль промотора, участка, связывающего рибосому (для бактериальной экспрессии) и, необязательно, оператора (вместе указываемых здесь как элементы «контроля»), так что последовательность ДНК, кодирующая требуемый полипептид, транскрибируется в РНК в клетке хозяина, трансформированного вектором, содержащим данную конструкцию экспрессии. Кодирующая последовательность может содержать сигнальный пептид или лидерную последовательность, или может не содержать их. По настоящему изобретению могут использоваться как встречающиеся в природе сигнальные пептиды, так и гетерологичные последовательности. Лидерные последовательности могут удаляться хозяином при посттрансляционном процессинге. См., например, патенты США  4431739; 4425437; 4338397. Такие последовательности включают в себя, в качестве неограничивающих примеров, лидер TPA, а также сигнальную последовательность меллитина медоносной пчелы. 4431739; 4425437; 4338397. Такие последовательности включают в себя, в качестве неограничивающих примеров, лидер TPA, а также сигнальную последовательность меллитина медоносной пчелы.
Могут также потребоваться другие регуляторные последовательности, которые обеспечат регуляцию экспрессии последовательностей белка в отношении роста клетки хозяина. Такие регуляторные последовательности известны специалистам в данной области, и примеры их включают в себя те последовательности, которые вызывают выключение или включение экспрессии гена в ответ на химический или физический стимул, включая присутствие регуляторного соединения. Другие типы регуляторных элементов также могут присутствовать в векторе, например энхансерные последовательности.
Последовательности контроля и другие регуляторные последовательности могут лигироваться с кодирующей последовательностью перед встраиванием в вектор. Альтернативно, кодирующая последовательность может клонироваться непосредственно в экспрессирующий вектор, который уже содержит последовательности контроля и подходящий участок рестрикции.
В некоторых случаях может быть необходимо модифицировать кодирующую последовательность, так что она может быть присоединена к последовательностям контроля в подходящей ориентации; т.е., для поддержания подходящей рамки считывания. Мутанты или аналоги могут быть получены путем делеции части последовательности, кодирующей белок, путем вставки последовательности и/или путем замены одного или нескольких нуклеотидов в последовательности. Способы модификации нуклеотидных последовательностей, таких как сайтспецифический мутагенез, хорошо известны специалистам в данной области. См., например, Sambrook et al., supra; DNA Cloning, Vols. I and II, supra; Nucleic Acid Hybridization, supra.
Затем экспрессирующий вектор используют для трансформации подходящей клетки хозяина. Некоторые клеточные линии млекопитающих известны в данной области и включают в себя иммортализованные клеточные линии, доступные из American Type Culture Collection (ATCC), например, в качестве неограничивающих примеров, клетки яичника китайского хомячка (CHO), клетки HeLa, клетки почки джунгарского хомячка (BHK), клетки почки обезьяны (COS), клетки человеческой гепатоцеллюлярной карциномы (например, Hep G2), клетки Vero293, а также другие клетки. Сходным образом, бактериальные хозяева, такие как E. coli, Bacillus subtilis и Streptococcus spp., найдут применение в конструкциях по настоящему изобретению. Дрожжевые хозяева, которые могут использоваться по настоящему изобретению, включают в себя, среди прочих, Saccharomyces cerevisiae, Candida albicans, Candida maltosa, Hansenula polymorpha, Kluyveromyces fragilis, Kluyveromyces lactis, Pichia guillerimondii, Pichia pastoris, Schizosaccharomyces pombe и Yarrowia lipolytica. Клетки насекомых для применения с бакуловирусными экспрессирующими векторами включают в себя, среди прочих, Aedes aegypti, Autographa californica, Bombyx mori, Drosophila melanogaster, Spodoptera frugiperda и Trichoplusia ni.
В зависимости от выбранных экспрессирующей системы и хозяина, белки по настоящему изобретению продуцируют путем выращивания клеток хозяина, трансформированных экспрессирующими векторами, описанными выше, в условиях, в которых экспрессируется интересующий белок. Выбор подходящих условий роста находится в пределах знаний специалиста в данной области.
В одном из осуществлений трансформированные клетки секретируют продукт-полипептид в окружающую среду. Некоторые регуляторные последовательности могут включать в состав вектора для усиления секреции белкового продукта, например, используют лидерную последовательность тканевого плазминогена (TPA), последовательности сигнальных пептидов интерферонов ( или или  ) или другие последовательности сигнальных пептидов известных секреторных белков. Секретируемый полипептидный продукт может затем выделяться различными описанными здесь способами, например, с использованием стандартных способов очистки, таких как, например, гидроксиапатитные смолы, колоночная хроматография, ионообменная хроматография, гель-фильтрация, электрофорез, ВЭЖХ, способы иммуноадсорбции, аффинная хроматография, иммунопреципитация, и тому подобное. ) или другие последовательности сигнальных пептидов известных секреторных белков. Секретируемый полипептидный продукт может затем выделяться различными описанными здесь способами, например, с использованием стандартных способов очистки, таких как, например, гидроксиапатитные смолы, колоночная хроматография, ионообменная хроматография, гель-фильтрация, электрофорез, ВЭЖХ, способы иммуноадсорбции, аффинная хроматография, иммунопреципитация, и тому подобное.
Альтернативно, трансформированные клетки разрушают с использованием химических, физических или механических средств, которые лизируют клетки, при этом сохраняя рекомбинантные полипептиды, по существу, интактными. Внутриклеточные белки также могут быть получены путем удаления компонентов из клеточной клетки или мембраны, например, с использованием детергентов или органических растворителей, так что происходит вымывание полипептида. Такие способы известны специалистам в данной области и описаны, например, в Protein Purification Applications: A Practical Approach, (E. L. V. Harris and S. Angal, Eds., 1990).
Например, способы разрушения клеток для применения по настоящему изобретению включают в качестве неограничивающих примеров: обработка звуком или ультразвуком; встряхивание; жидкая или твердая экструзия; обработка нагреванием; замораживание-оттаивание; сушка; взрывная декомпрессия; осмотический шок; обработка литическими ферментами, включая протеазы, такие как трипсин, нейраминидаза и лизоцим; щелочная обработка; и применение детергентов и растворителей, таких как желчные кислоты, натрия Triton, NP40 и CHAPS. Конкретный способ, используемый для разрушения клеток, главным образом является предметом выбора и зависит от клеточного типа, в котором экспрессируется полипептид, условий культивирования и используемых условий предобработки.
После разрушения клеток удаляют клеточный дебрис, в основном, центрифугированием, и далее очищают продуцированные внутриклеточно полипептиды с использованием стандартных способов очистки, включающих в себя в качестве неограничивающих примеров колоночную хроматографию, ионообменную хроматографию, гель-фильтрацию, электрофорез, ВЭЖХ, способы иммуноадсорбции, аффинную хроматографию, иммунопреципитации, и тому подобное.
Например, один из способов получения внутриклеточных полипептидов по настоящему изобретению включает в себя аффинную очистку, такую как иммунноаффинную хроматографию с использованием антител (например, ранее образованные антитела), или аффинную хроматографию на лектине. Особенно предпочтительными лектиновыми смолами являются те, что распознают маннозные радикалы, такие как, в качестве неограничивающих примеров смолы, полученные из агглютинина Galarathus nivalis (GNA), агглютинина Lens culinaris (LCA или лектин чечевицы), агглютинина Pisum sativum (PSA или лектин гороха), агглютинина Narcissus pseudonarcissus (NPA) и агглютинина Allium ursinum (AUA). Выбор подходящей аффинной смолы находится в пределах знаний специалиста в данной области. После аффинной очистки полипептиды могут далее очищаться с использованием общепринятых способов, хорошо известных в данной области, например любыми способами, описанными выше.
Пептидные реагенты могут общепринятым способом химически синтезироваться, например, любым из нескольких способов, которые известны специалистам в области пептидной химии. В общем, данные способы используют последовательное добавление одной или нескольких аминокислот к растущей пептидной цепи. Обычно амино- и карбоксильную группу первой аминокислоты защищают подходящей защитной группой. Защитная или дериватизированная аминокислота затем может присоединяться к инертной твердой основе или использоваться в растворе путем добавления следующей аминокислоты к последовательности, имеющем подходящим образом защищенную комплементарную группу (амино- или карбоксильную), в условиях, которые обеспечивают образование амидной связи. Защитную группу затем удаляют с вновь образованного аминокислотного остатка, и затем добавляют следующую аминокислоту (должным образом защищенную), и так далее. После связывания требуемых аминокислот с образованием надлежащей последовательности, все оставшиеся защитные группы (и любые твердые основы при использовании способа твердофазного синтеза) удаляют последовательно или одновременно для получения конечного полипептида. Простой модификацией данной общей процедуры возможно добавить более одной аминокислоты в один момент к растущей цепи, например, путем связывания (в условиях, которые не обуславливают рацемизацию хиральных центров) защищенного трипептида с защищенным надлежащим образом дипептидом с образованием после депротекции пептапептида. См., например, J. M. Stewart and J. D. Young, Solid Phase Peptide Synthesis (Pierce Chemical Co., Rockford, IL 1984) и G. Barany and R. B.Merrifield, The Peptides: Analysis, Synthesis, Biology, editors E. Gross and J. Meienhofer, vol. 2, (Academic Press, New York, 1980), pp. 3-254, для способов твердофазного пептидного синтеза; и M. Bodansky, Principles of Peptide Synthesis, (Springer-Verlag, Berlin 1984) and E. Gross and J. Meienhofer, Eds., The Peptides: Analysis. Synthesis. Biology, Vol.1, для классического синтеза в растворе. Данные способы обычно применяются для относительно малых полипептидов, т.е., до 50-100 аминокислот в длину, но также применяются к более протяженным полипептидам.
Обычные защитные группы включают в себя трет-бутоксикарбонил (Boc), 9-флуоренилметоксикарбонил (Fmoc), бензилоксикарбонил (Cbz); п-толуолсульфонил (Tx); 2,4-динитрофенил; бензил (Bzl); бифенилизопропилоксикарбонилоксикарбонил, трет-амилоксикарбонил, изоборнилоксикарбонил, о-бромбензилоксикарбонил, циклогексил, изопропил, ацетил, о-нитрофенилсульфонил и тому подобное.
Обычные твердые основы являются перекрестно связанными полимерными основами. Они могут включать в себя перекрестно связанные полимеры на основе стирола, например сополимеры дивинилбензола-гидроксиметилстирола, сополимеры дивинилбензола-хлорметилстирола и сополимеры дивинилбензола-бензгидриламинополистирола.
Синтез пептоида, содержащего полимеры, может проводиться, например, по патенту США  5877278; 6033631; Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89: 9367. 5877278; 6033631; Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89: 9367.
Пептидный реагент по настоящему изобретению также может быть получен химически другими способами, такими как способ одновременного множественного пептидного синтеза. См., например, Houghten Proc. Natl. Acad. Sci. USA (1985) 82: 5131-5135; патент США  4631211. 4631211.
IV. Антитела
Кроме того, описанные здесь пептидные реагенты, применяемые по изобретению, могут использоваться для получения антител. В некоторых вариантах осуществления антитела, полученные против данных пептидных реагентов, специфичны в отношении патогенных прионов. В других вариантах осуществления антитела связываются с патогенной и непатогенной формами. В дальнейших вариантах осуществления антитела специфичны в отношении непатогенных изоформ. Необязательно, описанные здесь антитела ингибируют преобразование непатогенной формы в патогенную конформацию. Обычно антитела по изобретению получают путем введения описанного здесь пептидного реагента (или полинуклеотида, кодирующего такой пептидный реагент) животному. Способы также могут включать в себя выделение из животного антител.
Антитела по изобретению могут быть препаратами поликлональных или моноклональных антител, моноспецифическими антисыворотками, человеческими антителами, или могут представлять собой гибридные или химерные антитела, такие как гуманизированные антитела, измененные антитела, (Fab’)2-фрагменты, F(ab)-фрагменты, Fv-фрагменты, однодоменные антитела, димерные или тримерные фрагменты или конструкции антител, минитела, или их функциональные фрагменты, которые связываются с интересующим антигеном.
Антитела продуцируют с использованием способов, хорошо известных специалистам в данной области и описанных например, в патенте США  4011308; 4722890; 4016043; 3876504; 3770380; и 4372745. Например, поликлональные антитела получают путем иммунизации подходящего животного, такого как мышь, крыса, кролик, овца, или коза, интересующим антигеном (например, описанным здесь пептидным реагентом). Для усиления иммуногенности антиген может быть связан с носителем перед иммунизацией. Таким носители хорошо известны обычным специалистам в данной области. Иммунизацию в общем проводят путем смешивания или эмульгирования антигена в солевом растворе, предпочтительно в адъюванте, таком как полный адъювант Фрейнда, и путем парентеральной инъекции эмульсии (в общем, подкожно или внутримышечно). Животное, в общем, повторно стимулируют через 2-6 недели одной или несколькими инъекциями антигена в солевом растворе, предпочтительно, с использованием неполного адъюванта Фрейнда. Антитела также могут генерироваться путем иммунизации in vitro с использованием способов, известных в данной области. Затем от иммунизированного животного получают поликлональную антисыворотку. 4011308; 4722890; 4016043; 3876504; 3770380; и 4372745. Например, поликлональные антитела получают путем иммунизации подходящего животного, такого как мышь, крыса, кролик, овца, или коза, интересующим антигеном (например, описанным здесь пептидным реагентом). Для усиления иммуногенности антиген может быть связан с носителем перед иммунизацией. Таким носители хорошо известны обычным специалистам в данной области. Иммунизацию в общем проводят путем смешивания или эмульгирования антигена в солевом растворе, предпочтительно в адъюванте, таком как полный адъювант Фрейнда, и путем парентеральной инъекции эмульсии (в общем, подкожно или внутримышечно). Животное, в общем, повторно стимулируют через 2-6 недели одной или несколькими инъекциями антигена в солевом растворе, предпочтительно, с использованием неполного адъюванта Фрейнда. Антитела также могут генерироваться путем иммунизации in vitro с использованием способов, известных в данной области. Затем от иммунизированного животного получают поликлональную антисыворотку.
Моноклональные антитела в общем получают с использованием способа Kohler and Milstein (1975) Nature 256: 495-497 или по его модификации. Обычно мышь или крысу иммунизируют, как описано выше. Однако вместо забора у животного крови для выделения сыворотки у него удаляют селезенку (и необязательно несколько больших лимфоузлов) и разделяют на отдельные клетки. Если требуется, клетки селезенки могут подвергаться скринингу (после удаления неспецифично прилипающих клеток) путем нанесения клеточной суспензии на планшет или лунку, покрытую антигеном. B-клетки, экспрессирующие мембраносвязанный иммуноглобулин, специфичный для антигена, будут связываться с планшетом и не будут смываться с оставшейся суспензией. Полученные в результате В-клетки или все диссоциированные клетки селезенки затем индуцируют для слияния с миеломными клетками с образованием гибридом и культивируют в селективной среде (например, среда гипоксантин, аминоптерин, тимидин, «HAT»). Полученные в результате гибридомы высевают путем лимитирующих разведений и анализируют на продукцию антител, которые специфично связываются с иммунизирующим антигеном (и которые не связываются с неродственными антигенами). Выбранные секретирующие моноклональное антитело гибридомы затем культивируют in vitro (например, в бутылках для культуры ткани или реактор с полыми волокнами), или in vivo (например, в асцитах у мышей).
Гуманизированные и химерные антитела также могут использоваться по изобретению. Молекулы гибридного (химерного) антитела в общем обсуждаются в Winter et al. (1991) Nature 349: 293-299 и патенте США  4816567. Humanized antibody molecules are generally discussed in Riechmann et al. (1988) Nature 332: 323-327; Verhoeyan et al. (1988) Science 239: 1534-1536; и публикации патента Великобритании 4816567. Humanized antibody molecules are generally discussed in Riechmann et al. (1988) Nature 332: 323-327; Verhoeyan et al. (1988) Science 239: 1534-1536; и публикации патента Великобритании  GB 2276169, опубликованные 21 сентября 1994 г.). Один из подходов для конструирования гуманизированного антитела использует клонирование рекомбинантной ДНК, содержащей промотор, лидер и последовательности вариабельной области из гена мышиного антитела и экзоны константной области из гена человеческого антитела с образованием мышино-человеческого антитела, гуманизированного антитела. См., в общем, Kuby, “Immunology, 3rd Edition”, W. H. Freeman and Company, New York (1998) на странице 136. GB 2276169, опубликованные 21 сентября 1994 г.). Один из подходов для конструирования гуманизированного антитела использует клонирование рекомбинантной ДНК, содержащей промотор, лидер и последовательности вариабельной области из гена мышиного антитела и экзоны константной области из гена человеческого антитела с образованием мышино-человеческого антитела, гуманизированного антитела. См., в общем, Kuby, “Immunology, 3rd Edition”, W. H. Freeman and Company, New York (1998) на странице 136.
Антитела, как моноклональные, так и поликлональные, которые направлены против описанных здесь пептидных реагентов, особенно применимы в диагностических и терапевтических применениях, например, те антитела, которые являются нейтрализующими, могут использоваться в пассивной иммунотерапии. Моноклональные антитела, в частности, могут использоваться для получения антиидиотипических антител.
Антиидиотипические антитела представляют собой иммуноглобулины, которые несут «внутреннее изображение» антигена агента, против которого требуется защита. Способы получения антиидиотипических антител известны в данной области. См., например, Grzych (1985), Nature 316: 74; MacNamara et al. (1984), Science 226: 1325, Uytdehaag et al (1985), J. Immunol. 134: 1225. Данные антиидиотипические антитела могут использоваться для лечения и/или диагностики конформационных заболеваний.
Фрагменты антитела также входят в объем изобретения. В данной области известно некоторое количество фрагментов антитела, которые содержат антигенсвязывающие участки, способные проявлять свойства иммунологического связывания интактной молекулы антитела. Например, функциональные фрагменты антитела могут продуцироваться путем отщепления константной области, не отвечающей за связывание антигена, от молекулы антитела, например, с использованием пепсина, с продукцией F(ab’)2-фрагментов. Данные фрагменты содержат два антигенсвязывающих участка, но не содержат часть константной области из каждой тяжелой цепи. Сходным образом, если требуется, могут продуцироваться Fab-фрагменты, содержащие единичный участок связывания антитела, например, путем расщепления поликлональных или моноклональных антител папаином. Функциональные фрагменты, включающие только вариабельные области тяжелых и легких цепей, также могут продуцироваться с использованием стандартных способов, таких как рекомбинантная продукция или преимущественное протеолитическое расщепление иммуноглобулиновых молекул. Данные фрагменты известны как F . См., например, Inbar et al. (1972) Proc. Nat. Acad. Sci USA 69: 2659-2662; Hochman et al. (1976) Biochem 15: 2706-2710; и Ehrlich et al. (1980) Biochem 19: 4091-4096. . См., например, Inbar et al. (1972) Proc. Nat. Acad. Sci USA 69: 2659-2662; Hochman et al. (1976) Biochem 15: 2706-2710; и Ehrlich et al. (1980) Biochem 19: 4091-4096.
Одноцепочечный Fv-полипептид («sFv» или «scFv») представляет собой ковалентно связанный гетеродимер VH-VL, который экспрессируется с гена слияния, включающего VH– и VL-кодирующие гены, соединенные кодирующим пептид линкером. Huston et al. (1988) Proc. Nat. Acad. Sci. USA 85: 5879-5883. Описано несколько способов для распознавания и разработки химических структур (линкеров) для преобразования агрегированных в природе, но разделенных химически легких и тяжелых полипептидных цепей из V-области антитела в молекулу sFv, которая будет сворачиваться в трехмерную структуру, по существу, сходную со структурой антигенсвязывающего участка. См., например, патент США  5091513; 5132405; и 4946778. Молекулы sFv могут продуцироваться с использованием способов, описанных в данной области. См., например, Huston et al. (1988) Proc. Nat. Acad. Sci USA 85: 5879-5338; патент США 5091513; 5132405; и 4946778. Молекулы sFv могут продуцироваться с использованием способов, описанных в данной области. См., например, Huston et al. (1988) Proc. Nat. Acad. Sci USA 85: 5879-5338; патент США  5091513; 5132405 и 4946778. Критерии конструирования включают определение подходящей длины для охвата расстояния C-конца одной цепи и N-конца другой, где линкер в общем, образуется из малых гидрофобных аминокислотных остатков, которые не сворачиваются или не образуют вторичной структуры. Такие способы описаны в данной области. См., например, патент США 5091513; 5132405 и 4946778. Критерии конструирования включают определение подходящей длины для охвата расстояния C-конца одной цепи и N-конца другой, где линкер в общем, образуется из малых гидрофобных аминокислотных остатков, которые не сворачиваются или не образуют вторичной структуры. Такие способы описаны в данной области. См., например, патент США  5091513; 5132405 и 4946778. Подходящие линкеры, в общем, включают в себя полипептидные цепи из перемежающихся наборов глициновых и сериновых остатков и могут включать в себя остатки глутаминовой кислоты и лизина, встроенные для повышения растворимости. 5091513; 5132405 и 4946778. Подходящие линкеры, в общем, включают в себя полипептидные цепи из перемежающихся наборов глициновых и сериновых остатков и могут включать в себя остатки глутаминовой кислоты и лизина, встроенные для повышения растворимости.
«Мини-антитела» или «минитела» также найдут применение по настоящему изобретению. Минитела представляют собой полипептидные цепи sFv, которые содержат на их C-конце домены олигомеризации, отделенные от sFv шарнирной областью. Pack et al., (1992) Biochem 31: 1579-1584. Домен олигомеризации включает в себя аутоассоциирующиеся  -спирали, например лейциновые застежки, которые могут далее стабилизироваться дополнительными дисульфидными связями. Домен олигомеризации сконструирован так, что он совместим с векторным фолдингом сквозь мембрану процессом, который, как полагают, облегчает фолдинг полипептида in vivo в функциональный связывающий белок. В общем, минитела продуцируются с использованием рекомбинантных способов, хорошо известных в данной области. См., например, Pack et al., (1992) Biochem 31: 1579-1584; Cumber et al. (1992) J. Immunology 149B: 120-126. -спирали, например лейциновые застежки, которые могут далее стабилизироваться дополнительными дисульфидными связями. Домен олигомеризации сконструирован так, что он совместим с векторным фолдингом сквозь мембрану процессом, который, как полагают, облегчает фолдинг полипептида in vivo в функциональный связывающий белок. В общем, минитела продуцируются с использованием рекомбинантных способов, хорошо известных в данной области. См., например, Pack et al., (1992) Biochem 31: 1579-1584; Cumber et al. (1992) J. Immunology 149B: 120-126.
Для получения и идентификации антител могут также использоваться необщепринятые способы. Например, библиотека фагового дисплея может подлежать скринингу на антитела, которые больше связываются с патогенными формами, чем с непатогенными формами, или наоборот. См., в общем, Siegel, “Recombinant Monoclonal Antibody Technology”, Transfus. Clin. Biol. (2002) 9(1): 15-22; Sidhu, “Phage Display in Pharmaceutical Biotechnology”, Curr.Opin.Biotechnol. (2000) 11(6): 610-616; Sharon, et al.,”Recombinant Polyclonal Antibody Libraries”, Comb. Chem. High Throughput Screen (2000) 3(3): 185-196; и Schmitz et al., “Phage Display: A Molecular Tool for the Generation of Antibodies-Review”, Placenta, (2000) 21 Suppl A:S 106-12.
Как отмечено выше, антитела могут также генерироваться путем введения животному полинуклеотидной последовательности, кодирующей описанный здесь пептидный реагент. Когда пептид экспрессируется in vivo, антитела генерируются in vivo. Способы доставки полинуклеотидов обсуждаются ниже.
Специфичность антител по изобретению может тестироваться, как описано выше для пептидных реагентов. Как упоминалось выше, прионы, имеющие патогенную конформацию, в общем, устойчивы к некоторым протеазам, таким как протеиназа K. Те же протеазы способны разрушать прионы в непатогенной конформации. Одним из способов тестирования специфичности антител по настоящему изобретению является отбор биологического образца, содержащего патогенные и непатогенные прионы. Образец может разделяться на равные объемы. Антитела по изобретению могут добавляться адсорбированными на твердую основу (как далее описано ниже) и использоваться для получения количественного значения, непосредственно связанного с числом взаимодействий антитело-прион на твердой основе. Протеаза может добавляться ко второму образцу, и может проводиться тот же тест. Поскольку протеаза во втором образце разрушает любые непатогенные прионы, любые взаимодействия по связыванию пептид-прион во втором образце могут быть отнесены к патогенным прионам. Вариации и другие анализы, известные в данной области, также могут использоваться для демонстрации специфичности антител по изобретению.
V. Анализы
Пептидные реагенты по изобретению могут использоваться в различных анализах для скрининга образцов (например, биологических образцов, таких как кровь, головной мозг, спинной мозг, ЦСЖ или образцы органов), например, для обнаружения наличия или отсутствия в данных образцах патогенных форм белков конформационного заболевания. В отличие от многих современных реагентов для диагностики прионов описанные здесь пептидные реагенты обеспечат обнаружение по существу любого типа биологического или небиологического образца, включая образец крови, продукты крови или образцы биопсии.
Изобретение, таким образом, относится к способу обнаружения патогенного приона в образце, предусматривающем: контактирование образца, в котором предполагается наличие патогенного приона, с пептидным реагентом по изобретению, в условиях, которые обеспечивают связывание пептидного реагента и патогенного прионного белка, если он присутствует; и обнаружение в образце патогенного приона, если он присутствует, за счет его связывания с пептидным реагентом.
Для применения по способу изобретения об образце может быть каким-либо образом известно, или в нем может предполагаться наличие патогенного прионного белка. Образец может представлять собой биологический образец (то есть, образец, полученный из живого или когда-либо жившего организма) или небиологический образец. Подходящие биологические образцы включают в себя в качестве неограничивающих примеров органы, цельную кровь, фракции крови, компоненты крови, плазму, тромбоциты, сыворотку, цереброспинальную жидкость (CSF), ткань головного мозга, ткань нервной системы, мышечную ткань, костный мозг, мочу, слезы, не относящуюся к нервной системе ткань, органы и/или биопсии или некропсии. Предпочтительные биологические образцы включают в себя кровь, фракции крови, компоненты крови, плазму, тромбоциты и сыворотку.
Образец контактирует с одним или несколькими пептидным реагентами по изобретению в условиях, которые обеспечивают связывание пептидного(-ых) реагента(-ов) с патогенным прионным белком, если он присутствует в образце. В компетенции обычного специалиста в данной области определение конкретных условий, основанных на данном описании. Обычно образец и пептидный(-ые) реагент(-ы) инкубируют вместе в подходящем буфере примерно при нейтральных pH (например, буфер TBS при 7,5) при подходящей температуре (например, около 4ºC), в течение подходящего периода времени (например, примерно от 1 часа до ночи) для обеспечения связывания.
Наличие патогенного прионного белка в образце выявляется за счет его связывания с пептидным(-и) реагентом(-ами). Обнаружение патогенного прионного белка за счет его связывания с пептидным(-и) реагентом(-ами) по изобретению может выполняться несколькими путями. Например, пептидный(-е) реагент(-ы) по изобретению могут использоваться для специфичного «захвата» патогенного прионного белка путем образования первого комплекса между пептидным(-и) реагентом(-ами) и патогенным прионным белком, причем первый комплекс может быть отделен от несвязанных материалов образца, включающих непатогенный прионный белок, присутствующий в образце. Патогенный прионный белок может затем обнаруживаться путем добавления и связывания одного или нескольких пептидных реагентов по изобретению, причем данные пептидные реагенты мечены со способностью к визуализации (т.е., меченый(-е) пептидный(-е) реагент(-ы)). Патогенный прионный белок может при этом обнаруживаться в первом комплексе, или патогенный прионный белок может диссоциировать с первого комплекса перед добавлением и связыванием с меченым пептидным(ми) реагентом(ами) по изобретению.
Альтернативно, когда пептидный(-е) реагенты(-ы) по изобретению применяются для захвата патогенного прионного белка, как описано выше, и первый комплекс отделяется от несвязанных материалов образца, меченый и способный к визуализации, связывающий прион реагент может использоваться для обнаружения патогенного прионного белка, при том, что патогенный прионный белок находится в первом комплексе или после диссоциации патогенного прионного белка из первого комплекса. «Связывающий прион реагент» представляет собой реагент, который связывается с прионным белком в любой конформации, обычно связывающий прион реагент связывается с денатурированной формой прионного белка. Такие реагенты описаны и включают в себя, например, антитела против приона (описаны, среди прочих, в Peretz et al. 1997 J. Mol. Biol. 273: 614; Peretz et al. 2001 Nature 412: 739; Williamson et al.1998 J. Virol. 72: 9413; в патенте США  6765088; в патенте США 6765088; в патенте США  6537548), гибридные полипептиды с привитыми мотивами (см., WО03/085086), некоторые катионные или анионные полимеры (см., WО03/073106), некоторые пептиды, которые представляют собой «катализаторы размножения» (см., WО02/0974444) и плазминоген. Ясно, что если конкретный используемый связывающий прион реагент связывается с денатурированной формой приона, то «захватываемый» патогенный прионный белок должен быть денатурирован перед обнаружением связывающим прион реагентом. 6537548), гибридные полипептиды с привитыми мотивами (см., WО03/085086), некоторые катионные или анионные полимеры (см., WО03/073106), некоторые пептиды, которые представляют собой «катализаторы размножения» (см., WО02/0974444) и плазминоген. Ясно, что если конкретный используемый связывающий прион реагент связывается с денатурированной формой приона, то «захватываемый» патогенный прионный белок должен быть денатурирован перед обнаружением связывающим прион реагентом.
В другой альтернативе связывающий прион реагент может использоваться для захвата каких-либо прионов (патогенных или непатогенных), присутствующих в образце, с образованием первого комплекса, и один или несколько меченых и способных к визуализации пептидных реагентов по изобретению может использоваться для обнаружения патогенных прионов в первом комплексе или после диссоциации из первого комплекса.
В первой альтернативе образец может захватываться непосредственно (т.е., без какого-либо связывающего прион реагента) на твердой основе, и патогенные прионные белки, если они присутствуют, могут выявляться с использованием одного или нескольких меченых и способных к визуализации реагентов по изобретению.
Описанные выше стадии захвата и обнаружения могут проводиться в растворе или могут проводиться в твердой основе или на ней, или с использованием некоторой комбинации раствора и твердой фазы. Некоторые подходящие форматы растворенной фазы включают в себя, например, флуоресцентную корреляционную спектроскопию (см., Giese et al. Arch. Virol. Suppl. 2000 16: 161; Bieschke et al. Proc. Natl Acad. Sci. USA 2000 97: 55468) и перенос энергии резонанса флуоресценции. Обычно пептидный(-е) реагент(-ы) по изобретению в данном формате растворенной фазы мечен(-ы) и способный(ые) к визуализации. Предпочтительно, пептидный(-е) реагент(-ы) мечены двумя или большим количеством различимых между собой выявляемых меток. Наличие патогенного прионного белка может обнаруживаться за счет сочетания двух или нескольких выявляемых меток в первом комплексе. Подходящие форматы твердофазных анализов описаны здесь. В основном в твердофазных форматах реагент захвата (который может представлять собой один или несколько пептидных реагентов по изобретению или один или несколько связывающих прион реагентов) присоединяется или адаптируется для присоединения к твердой основе. Реагент захвата может адаптироваться для присоединения к твердой основе любыми средствами, известными в данной области, например, реагент захвата и твердая основа оба могут включать в себя одного из представителей пары связывания, так что, когда реагент захвата контактирует с твердой основой, связующий реагент связывается с твердой основой посредством связывания представителей пары связывания.
Например, реагент захвата может включать в себя биотин, а основа может содержать авидин или стрептавидин. В дополнение к биотин-авидину и биотин-стрептавидину, другие подходящие пары связывания для данного варианта осуществления включают в себя, например, антиген-антитело, гаптен-антитело, миметоп-антитело, рецептор-гормон, рецептор-лиганд, агонист-антагонист, лектин-углевод, белок A – Fc антитела. Такие пары связывания хорошо известны (см., например, патент США  6551843 и 6586193), и обычный специалист в данной области будет компетентен в выборе подходящей пары связывания и адаптирует их для применения по настоящему изобретению. Когда реагент захвата адаптируется для присоединения к основе, как описано выше, образец может контактировать с реагентом захвата до и после того, как реагент захвата будет присоединяться к основе. 6551843 и 6586193), и обычный специалист в данной области будет компетентен в выборе подходящей пары связывания и адаптирует их для применения по настоящему изобретению. Когда реагент захвата адаптируется для присоединения к основе, как описано выше, образец может контактировать с реагентом захвата до и после того, как реагент захвата будет присоединяться к основе.
Изобретение, таким образом, относится к способу обнаружения патогенного приона в образце, предусматривающем:
(a) контактирование образца, в котором предполагается наличие патогенного приона, с первым пептидным реагентом в условиях, которые обеспечивают связывание первого пептидного реагента с патогенным прионным белком, если он присутствует, с образованием первого комплекса; и
(b) обнаружение патогенного приона, если он есть, в образце путем его связывания с первым пептидным реагентом.
Пептидный реагент соответствует описанному здесь, предпочтительно, пептидный реагент получают из пептида, имеющего последовательность SEQ ID NO: 12-132, более предпочтительно, из пептида, имеющего последовательность, соответствующую одной из SEQ ID NO: 66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126, 127, 129, 130, 131, 132; или из пептидов, имеющих SEQ ID NO: 14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118 или 128; или из пептидов, имеющих SEQ ID NO: 56, 57, 65, 82, или 84. Пептидный реагент может быть биотинилирован. Пептидный реагент может быть присоединен к твердой основе. В некоторых вариантах осуществления пептидный реагент может быть меченым и способным к визуализации.
Изобретение также относится к способу обнаружения патогенного приона в образце, предусматривающему:
(a) контактирование образца, в котором предполагается наличие патогенного приона, с первым пептидным реагентом в условиях, которые обеспечивают связывание первого пептидного реагента с патогенным прионом, если он присутствует, с образованием первого комплекса;
(b) контактирование указанного первого комплекса со вторым пептидным реагентом в условиях, которые обеспечивают связывание второго пептидного реагента с патогенным прионом в указанном первом комплексе, где указанный второй пептидный реагент включает в себя выявляемую метку; и
(c) обнаружение патогенного приона, если он есть, в образце путем его связывания с вторым пептидным реагентом.
Когда в способе используется первый пептидный реагент и второй пептидный реагент, первый и второй пептидные реагенты могут быть одинаковыми или различными. Под «одинаковыми» подразумевается, что первый и второй пептидные реагенты различаются только включением во второй пептидный реагент выявляемой метки.
Первый пептидный реагент и второй пептидный реагент может быть получен из пептидных фрагментов из одной области прионного белка или из пептидных фрагментов из различных областей прионного белка. Первый пептидный реагент и второй пептидный реагент могут быть независимо выбраны из пептидных реагентов, полученных из пептидов, характеризующихся SEQ ID NO: 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, или 132.
Первый пептидный реагент и второй пептидный реагент могут быть независимо выбраны из пептидных реагентов, полученных из пептидов, характеризующихся SEQ ID NO: 66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126, 127, 14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 128, 129, 130, 131, 132, 56, 57, 65, 82, и 84.
Первый пептидный реагент может быть выбран из пептидного реагента, полученного из пептидов, характеризующихся SEQ ID NO: 66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126, или 127, и второй пептидный реагент может быть выбран из пептидного реагента, полученного из пептидов, характеризующихся SEQ ID NO: 14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 128, 129, 130, 131, или 132, или наоборот. Первый пептидный реагент может быть выбран из пептидного реагента, полученного из пептидов, характеризующихся SEQ ID NO: 66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126, или 127, и второй пептидный реагент может быть выбран из пептидного реагента, полученного из пептидов, характеризующихся SEQ ID NO: 56, 57, 65, 82, и 84, или наоборот. Первый пептидный реагент может быть выбран из пептидного реагента, полученного из пептидов, характеризующихся SEQ ID NO: 14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 128, 129, 130, 131, или 132, и второй пептидный реагент может быть выбран из пептидного реагента, полученного из пептидов, характеризующихся SEQ ID NO: 56, 57, 65, 82, и 84, или наоборот.
Первый пептидный реагент может быть биотинилированным или может присоединяться к твердой основе.
Изобретение также относится к способу обнаружения патогенного приона в образце, предусматривающему:
(a) контактирование образца, в котором предполагается наличие патогенного приона, с первым пептидным реагентом в условиях, которые обеспечивают связывание первого пептидного реагента с патогенным прионным белком, если он присутствует, с образованием первого комплекса;
(b) удаление несвязанных материалов образца;
(c) диссоциацию указанного патогенного приона с указанного первого комплекса;
(d) контактирование указанного диссоциированного патогенного приона со вторым пептидным реагентом в условиях, которые обеспечивают связывание второго пептидного реагента с патогенным прионом, где указанный второй пептидный реагент включает в себя выявляемую метку; и
(e) обнаружение патогенного приона, если он есть, в образце за счет его связывания со вторым пептидным реагентом. Первый и второй пептидные реагенты могут быть одинаковыми или различными.
Изобретение также относится к способу обнаружения патогенного приона в образце, предусматривающему:
(a) контактирование образца, в котором предполагается наличие патогенного приона, с первым пептидным реагентом в условиях, которые обеспечивают связывание первого пептидного реагента с патогенным прионным белком, если он присутствует, с образованием первого комплекса;
(b) удаление несвязанных материалов образца;
(c) диссоциацию указанного патогенного приона с указанного первого комплекса;
(d) контактирование указанного диссоциированного патогенного приона со связывающим прион реагентом в условиях, которые обеспечивают связывание связывающего прион реагента с патогенным прионом, где указанный связывающий прион реагент включает в себя выявляемую метку; и
(e) обнаружение патогенного приона, если он есть, в образце за счет его связывания со связывающим прион реагентом. Связывающий прион реагент может представлять собой антитело против приона, гибридный полипептид с привитым мотивом, катионные или анионные полимеры, катализаторы размножения и плазминоген, или любой другой радикал, который, как известно, связывает прионные белки.
Изобретение также относится к способу обнаружения патогенного приона в образце, предусматривающему:
(a) контактактирование образца, в котором предполагается наличие патогенного приона, со связывающим прион реагентом в условиях, которые обеспечивают связывание связывающего прион реагента с патогенным прионным белком, если он присутствует, с образованием первого комплекса;
(b) удаление несвязанных материалов образца;
(с) контактирование указанного первого комплекса с пептидным реагентом в условиях, которые обеспечивают связывание пептидного реагента с патогенным прионом, где указанный второй пептидный реагент включает в себя выявляемую метку; и
(d) обнаружение патогенного приона, если он есть, в образце за счет его связывания с пептидным реагентом.
Изобретение также относится к способу обнаружения в образце патогенного приона, предусматривающему:
(a) получение твердой основы, содержащей первый пептидный реагент;
(b) контактирование твердой основы с образцом в условиях, которые обеспечивают связывание патогенных прионов, если они присутствуют в данном образце, с первым пептидным реагентом;
(c) контактирование твердой основы с меченым и способным к визуализации вторым пептидным реагентом в условиях, которые обеспечивают связывание второго пептидного реагента с патогенными прионами, связанными с первым пептидным реагентом; и
(d) выявление комплексов, образованных между первым пептидным реагентом, патогенным прионом из образца и вторым пептидным реагентом, с выявлением за счет этого присутствия патогенного приона в образце.
Альтернативно на твердой основе может предоставляться связывающий прион реагент. Изобретение, таким образом, относится к способу обнаружения в образце патогенного приона, предусматривающему:
(a) получение твердой основы, содержащей связывающий прион реагент;
(b) контактирование твердой основы с образцом в условиях, которые обеспечивают связывание патогенных прионов, если они присутствуют в данном образце, со связывающим прион реагентом;
(c) контактирование твердой основы с меченым и способным к визуализации вторым пептидным реагентом; и
(d) выявление комплексов, образованных между связывающим прион реагентом, патогенным прионом из биологического образца и вторым пептидным реагентом.
Анализ может предоставляться в конкурентном формате; таким образом, изобретение относится к способу обнаружения в образце патогенного приона, предусматривающему:
(a) получение твердой основы, содержащей первый пептидный реагент;
(b) комбинацию твердой основы с выявляемо меченым первым лигандом, причем сродство связывания первого пептидного реагента с меченым и способным к визуализации первым лигандом слабее, чем сродство связывания первого пептидного реагента с патогенным прионом;
(c) комбинацию образца с твердой основой в условиях, которые позволяют патогенному приону, когда он присутствует в образце, связываться с первым пептидным реагентом и вытеснять первый лиганд; и
(d) выявление комплексов, образованных между первым пептидным реагентом и патогенным прионом из образца.
В основном, описанные здесь пептидные реагенты используют для связывания прионных белков в образце (например, в качестве реагента захвата) и/или для обнаружения прионных белков (например, в качестве реагентов обнаружения). Реагент захвата и реагент обнаружения могут быть различными молекулами или, альтернативно, одна молекула может служить для функций захвата и обнаружения. В некоторых осуществлениях реагент захвата и/или обнаружения представляют собой описанные здесь пептидные реагенты, которые взаимодействуют преимущественно с патогенными прионами (т.е., специфичны в отношении патогенного приона). В других вариантах осуществления реагент захвата специфичен в отношении патогенных прионов, и реагент обнаружения связывается с патогенными и непатогенными прионами, например это антитела, которые связываются с прионными белками. Такие связывающие прион реагенты описаны здесь выше. Альтернативно, в других вариантах осуществления реагент захвата не специфичен в отношении патогенных прионов, и реагент обнаружения специфичен в отношении патогенных прионов.
Для идентификации связывания между описанным здесь пептидным реагентом и прионным белком может использоваться любой подходящий способ обнаружения. Например, описанные здесь анализы могут включать в себя применение меченых пептидных реагентов или антител. Выявляемые метки, подходящие для применения по изобретению, включают в себя любые молекулы, подходящие для обнаружения, включая в качестве неограничивающих примеров радиоактивные изотопы, флуорофоры, хемилюминофоры, хромофоры, флуоресцентные полупроводниковые нанокристаллы, ферменты, субстраты ферментов, кофакторы ферментов, ингибиторы ферментов, хромофоры, красители, ионы металлов, золи металлов, лиганды (например, биотин или гаптены) и тому подобное. Дополнительные метки включают в себя в качестве неограничивающих примеров те, что используют флуоресценцию, включая те вещества или их части, которые способны испускать флуоресценцию в выявляемом интервале. Конкретные примеры меток, которые могут использоваться по изобретению, включают в себя в качестве неограничивающих примеров пероксидазу хрена (HRP), флуоресцеин, FITC, родамин, дансил, умбеллиферон, сложный эфир диметилакридиния (DMAE), техасский красный, люминол, NADPH и  -галактозидазу. Кроме того, выявляемая метка может включать в себя олигонуклеотидную метку, причем данная метка может выявляться любым известным способом выявления нуклеиновой кислоты, включая ПЦР, TMA, b-DNA, NASBA, и т.д. -галактозидазу. Кроме того, выявляемая метка может включать в себя олигонуклеотидную метку, причем данная метка может выявляться любым известным способом выявления нуклеиновой кислоты, включая ПЦР, TMA, b-DNA, NASBA, и т.д.
В дополнение к применению меченых реагентов обнаружения (описанных выше) для отделения пептидных реагентов, которые связываются с прионным белком (например, патогенным прионом) используется иммунопреципитация. Предпочтительно, иммунопреципитация облегчается добавлением средства усиления преципитации. Средство усиления преципитации включает в себя радикалы, которые могут усиливать или повышать преципитацию пептидных реагентов, которые связаны с патогенными прионами. Такие средства усиления преципитации включают в себя полиэтиленгликоль (ПЭГ), белок G, белок A и тому подобное. Там, где в качестве усиливающих преципитацию средств используют белок G или белок A, белок может, необязательно, присоединяться к грануле, предпочтительно, к магнитной грануле. Преципитация может далее усиливаться применением центрифугирования или применением магнитных сил. Применение таких усиливающих преципитацию средств известно в данной области.
Также известны анализы, которые амплифицируют сигналы от реагента детекции. Их примеры включают в себя анализы, где используется биотин и авидин, и иммунные анализы, связанные с ферментом и опосредованные им, такие как анализы ELISA.
Одна или несколько стадий описанного здесь анализа может проводиться в растворе (например, в жидкой среде) или на твердой основе. Твердая основа для целей изобретения может представлять собой любой материал, который является нерастворимым матриксом, и может иметь жесткую или полужесткую поверхность, к которой может привязываться или присоединяться интересующая молекула (например, пептидные реагенты по изобретению, прионные белки, антитела, и т.д.). Типовые твердые основы включают в себя в качестве неограничивающих примеров такие субстраты, как нитроцеллюлоза, поливинилхлорид; полипропилен, полистирол, латекс, поликарбонат, нейлон, декстран, хитин, песок, силикагель, пемзу, агарозу, целлюлозу, стекло, металл, полиакриламид, силикон, резину, полисахариды, поливинилфторид; диазотированную бумагу; активированные гранулы, гранулы, отвечающие на магнитное поле, и любые материалы, обычно используемые в твердофазном синтезе, аффинных разделениях, очистке, реакциях гибридизации, иммунных анализах и других таких применениях. Основа может представлять собой дисперсные частицы или находиться в виде непрерывной поверхности и включает в себя мембраны, сита, планшеты, шарики, слайды, диски, капилляры, полые волокна, иглы, пины, чипы, твердые волокна, гели (например, силикагели) и гранулы (например, гранулы пористого стекла, силикагели, полистирольные гранулы, необязательно перекрестно связанные с дивинилбензолом, гранулы с привитыми сополимерами, полиакриламидные гранулы, латексные гранулы, гранулы диметилакриламида, необязательно перекрестно связанные с N-N’-бис-акрилилэтилендиамином, магнитные гранулы с оксидом железа и стеклянные частицы, покрытые гидрофобным полимером.
Описанные здесь пептидные реагенты могут легко присоединяться к твердой основе с использованием стандартных способов. Иммобилизация на основе может усиливаться исходным присоединением пептидного реагента к белку (например, когда белок имеет улучшенные свойства связывания с твердой фазой). Подходящие белки связывания включают в себя в качестве неограничивающих примеров такие макромолекулы, как сывороточные альбумины, включая бычий сывороточный альбумин (BSA), гемоцианин морского блюдечка, молекулы иммуноглобулина, тиреоглобулин, овальбумин и другие белки, хорошо известные специалистам в данной области. Другие реагенты, которые могут использоваться для связывания молекул с основой, включают в себя полисахариды, полимолочные кислоты, полимерные аминокислоты, сополимеры аминокислот и тому подобное. Такие молекулы и способы связывания данных молекул с белками, хорошо известны обычным специалистам в данной области. См., например, Brinkley, M. A., (1992) Bioconjugate Chem., 3: 2-13; Hashida et al. (1984) J. Appl.Biochem., 6: 56-63; и Anjaneyulu and Staros (1987) International J. of Peptide and Protein Res. 30: 117- 124.
Если требуется, молекулы, подлежащие добавлению к твердой основе, могут легко функционализоваться с образованием стиролов или акрилатных радикалов, что, таким образом, обеспечивает включение молекул в полистирол, полиакрилат или другие полимеры, такие как полиимид, полиакрилат, полиэтилен, поливинил, полидиацетилен, полифенилен-винилен, полипептид, полисахарид, полисульфон, полипиррол, полиимидазол, политиофен, полиэфир, эпоксиды, кварцевое стекло, силикагель, силоксан, полифосфат, гидрогель, агароза, целлюлоза и тому подобное.
Пептидные реагенты могут присоединяться к твердой основе посредством взаимодействия пары связывающихся молекул. Такие связывающие пары хорошо известны, и их примеры описаны здесь в других местах. Один из представителей пары связывания присоединяется описанными выше способами к твердой основе, и другой представитель пары связывания присоединяют к пептидному реагенту (до, во время или после синтеза). Модифицированный таким образом пептидный реагент может контактировать с образцом, и в растворе может происходить взаимодействие с патогенными прионом, если он есть, после чего твердая основа может контактировать с пептидным реагентом (или комплексом пептид-прион). Предпочтительные пары связывания для данного варианта осуществления включают в себя биотин и авидин, и биотин и стрептавидин.
Подходящие контроли также могут использоваться в анализах по изобретению. Например, в анализах может использоваться отрицательный контроль PrPC. Положительный контроль PrPSc (или PrPres) также может использоваться в анализах. Такие контроли могут необязательно быть меченым.
Некоторые вариации и комбинации с использованием пептидных реагентов по изобретению могут применяться в анализах по изобретению. Следующие неограничивающие примеры, описанные для иллюстрации.
В некоторых вариантах осуществления описаны анализы обнаружения патогенных прионов в биологическом образце. В таких способах пептидный реагент по изобретению может использоваться в качестве реагента захвата патогенных прионов в биологическом или небиологическом образце. В таком варианте осуществления твердая основа (например, магнитные гранулы) вначале взаимодействуют с описанным здесь пептидным реагентом, который преимущественно взаимодействует с патогенными прионами, так что пептидный реагент достаточно иммобилизуются на основе. Твердая основа затем контактирует с образцом, в котором предполагается наличие патогенныех прионов, в условиях, которые позволяют пептидному реагенту связываться с патогенными прионами. После удаления несвязанного материала образца связанные патогенные прионы могут диссоциироваться с пептидного реагента и обнаруживаются с использованием любого другого механизма для обнаружения, включая в качестве неограничивающих примеров вестерн-блот и ELISA, например, как описано выше в примерах и цитируемых здесь ссылках. Альтернативно, связанный патогенный прион может обнаруживаться без диссоциации с пептидного реагента.
Альтернативно, пептидный реагент по изобретению может контактировать в образце, в котором предполагается наличие патогенныех прионов до присоединения к твердой основе, с последующим присоединением пептидного реагента к твердой основе (например, пептидный реагент может биотинилироваться, и твердая основа может включать в себя авидин или стрептавидин). После удаления несвязанного материала образца патогенные прионы могут диссоциировать с пептидного реагента и обнаруживаются с использованием любого механизма обнаружения, включая в качестве неограничивающих примеров, вестерн-блот и ELISA, например, как описано выше в примерах и цитируемых здесь ссылках. Альтернативно, связанный патогенный прион не обязательно должен диссоциировать с пептидного реагента перед обнаружением.
Обнаружение патогенных прионов в образце может выполняться с использованием описанного здесь пептидного реагента, который преимущественно взаимодействует с патогенными формами. Альтернативно, патогенные прионы могут обнаруживаться неспецифическими реагентами обнаружения (например, пептидами или антителами, которые связываются с PrP в общем смысле). В некоторых вариантах осуществления после диссоциации с твердой основы захваченный патогенный прион денатурируют перед обнаружением, что может способствовать обнаружению, давая возможность применения неспецифичных реагентов обнаружения. Альтернативно, захваченный патогенный прион может денатурировать без диссоциации с пептидного реагента, если, например, пептидный реагент модифицирован так, что он содержит активируемую реакционно-способную группу (например, фотореактивную группу), которая может использоваться для ковалентного связывания пептидного реагента и патогенного приона.
Такие протоколы, как ELISA, описанный в Ryou et al. (2003) Lab Invest. 83 (6): 837-43, могут осуществляться для определения количества патогенного приона, элюированного с твердой основы (см. примеры). В кратком изложении, лунки планшета для микротитрования покрывают захваченным патогенным прионом, который диссоциировал (был элюирован) с твердой основы. Планшет(-ы) могут промывать для удаления несвязанных радикалов и добавляют меченую и способную к визуализации связывающую молекулу, такую как антитело против приона или пептидный реагент по изобретению (тот же, что используют для захвата или другой). Данной связывающей молекуле позволяют взаимодействовать с любым захваченным прионом из образца, планшет промывают, и присутствие меченых антител и/или меченых пептидных реагентов обнаруживают с использованием способов, хорошо известных в данной области. Связанная молекула не обязательно должно быть специфичной в отношении патогенного приона, но может связываться с обеими изоформами или с денатурированным PrP, если реагент захвата специфичен в отношении патогенной формы приона.
В других типовых анализах реагент захвата и прион не диссоциируют перед обнаружением. Например, твердая основа (например, лунки планшета для микротитрования) связывается с первым с первой специфичной в отношении приона молекулой (пептидный реагент). Затем биологический образец, содержащий патогенные прионы или в котором предполагается наличие их, добавляют к твердой основе. После периода инкубации, достаточного для того, чтобы патогенные прионы связывались с первой молекулой, твердая основа может промываться для удаления несвязанных радикалов, и добавляется меченая и способная к визуализации вторичная связывающаяся молекула, описанная выше, такая как второе антитело против PrP или специфичный в отношении приона пептидный реагент. Альтернативно, молекула, которая связывается с патогенной и непатогенной формами (например, неспецифичный реагент захвата) может присоединяться к твердой основе (например, покрывать лунки планшета для микротитрования), и обнаружение может осуществляться с использованием патогенного специфичного в отношении приона реагента обнаружения (например, описанного здесь пептидного реагента).
Другим типовым анализом является «сэндвич-анализ с двумя пептидами», который может использоваться для обнаружения прионов (например, патогенных прионов). В данном способе твердая основа взаимодействует, как описано здесь, с одним или несколькими первыми пептидными реагентами по изобретению, промывается для удаления непрореагировавшего первого пептидного реагента и затем подвергается воздействию тестируемого образца (например, биологического образца), в котором предполагается наличие патогенного прионного белка, в условиях, обеспечивающих взаимодействие между первым(-и) пептидным(-и) реагентом(-ами) и любым патогенными прионным белком, присутствующим в образце. Непрореагировавшие компоненты образца удаляют и добавляют один или несколько вторых пептидных реагентов по изобретению в условиях, которые обеспечивают взаимодействие второго(-ых) пептидного(-ых) реагента(-ов) с любым патогенными прионным белком, присутствующим в образце. Взаимодействие между первым пептидом-прионным белком-вторым пептидом может выявляться любыми средствами, известными в данной области. Обычно второй(-ые) пептидный(-ые) реагент(-ы) включает(-ют) в себя выявляемую метку. В данном анализе первый(-ые) пептидный(-ые) реагент(-ы) и/или второй(-ые) пептидный(-ые) реагент(-ы) включает(-ют) взаимодействуют преимущественно с патогенным прионным белком.
В некоторых вариантах осуществления антитела против PrP применяют для обнаружения прионных белков. Антитела, модифицированные антитела и другие реагенты, которые связываются с прионами, особенно с PrPC или с денатурированным PrP, описаны, и некоторые из них доступны коммерчески (см., например, антитела против прионов, описанные в Peretz et al. 1997 J. Mol. Biol. 273: 614; Peretz et al. 2001 Nature 412: 739; Williamson et al. 1998 J. Virol. 72: 9413; в патенте США  6765088. Некоторые из них и других доступны коммерчески, среди прочих, от InPro Biotechnology, South San Francisco, Калифорния, Cayman Chemicals, Ann Arbor MI; Prionics AG, Цюрих; также см. WO03/085086 для описания модифицированных антител). 6765088. Некоторые из них и других доступны коммерчески, среди прочих, от InPro Biotechnology, South San Francisco, Калифорния, Cayman Chemicals, Ann Arbor MI; Prionics AG, Цюрих; также см. WO03/085086 для описания модифицированных антител).
Пептидные реагенты по изобретению могут также использоваться в конкурентных анализах. Средства обнаружения могут использоваться для идентификации того, когда лиганд, слабо связывающийся с PrPSc, замещается описанным здесь пептидным реагентом, который специфичен в отношении PrPSc. Например, образец, в котором предполагается наличие PrPSc, может адсорбироваться на твердой основе. Впоследствии твердую основу комбинируют с меченым и способным к визуализации лигандом, который связывается с PrPSc (например, плазминоген, рецептор ламинина и гепарансульфат) в условиях, таких что меченый и способный к визуализации лиганд связывается с PrPSc. Выявляются комплексы лиганд-PrPSc. Затем добавляют описанный здесь связывающий PrPSc пептидный реагент. Сродство связывания меченого и способного к визуализации лиганда слабее, чем сродство связывания пептидного реагента в отношении патогенного приона. В соответствии с этим связывающий PrPSc пептидный реагент замещает меченый лиганд, и может обнаруживаться снижение выявляемых количеств меченого лиганда, указывающее на комплексы, образованные между пептидным реагентом и патогенными прионами из биологического образца.
Описанные выше реагенты для анализа, включая описанные здесь пептидные реагенты, могут предоставляться в наборах с подходящими инструкциями и другими необходимыми реагентами, для проведения анализов обнаружения, как описано выше. Там, где пептидный реагент адсорбируется на твердую основу, набор может дополнительно или альтернативно включать в себя такие пептидные реагенты, адсорбированные на одну или несколько твердых основ. Набор может далее содержать подходящие положительные и отрицательные контроли, описанные выше. Набор также может содержать, в зависимости от используемых конкретных анализов обнаружения, подходящие метки и другие упакованные реагенты и материалы (т.е., буферы промывки и тому подобное).
В дальнейших вариантах осуществления изобретение относится к твердым основам, содержащим специфичный в отношении патогенного приона пептидный реагент. Также предоставляются способы продукции данных твердых основ, например, путем
a) получения твердой основы; и
(b) связывания с ней одного или нескольких специфичных в отношении патогенного приона пептидных реагентов.
Специфичные в отношении приона пептидные реагенты могут далее применяться для выделения патогенных прионных белков с использованием аффинных основ. Пептидные реагенты могут добавляться к твердой основе, например, путем адсорбции, ковалентной связи, и т.д., так что пептидные реагенты сохраняют их селективную в отношении прионов связывающую активность. Необязательно, могут включаться спейсерные группы, например, так что связывающий участок пептидного реагента остается доступным. Затем иммобилизованные молекулы могут затем применяться для связывания патогенного прионного белка из биологического образца, такого как кровь, плазма, головной мозг, спинной мозг, другие ткани. Связанные пептидные реагенты или комплексы снимают с соновы, например, изменением pH, или патогенный прион может диссоциировать с комплекса.
Образцы, которые могут тестироваться по изобретению, включают в себя любые образцы, подлежащие анализу с антителами, включая образцы из ткани нервной системы (например, головного мозга, спинного мозга, ЦСЖ, и т.д.), образцы крови и/или другой ткани из живых или мертвых индивидуумов. Как отмечено выше, в предпочтительных вариантах осуществления образцы включают в себя кровь, продукты крови, или образцы ткани, полученные из живого индивидуума.
VI. Дополнительные применения
A. Обнаружение
Как описано выше, описанные здесь пептидные реагенты могут использоваться для диагностики у индивидуума прионного заболевания. Кроме того, описанные выше пептидные реагенты могут также применяться для обнаружения контаминации патогенного приона в продуктах крови и/или питания. Таким образом, может быть получен продукт крови, который, по существу, лишен патогенных прионов, путем скрининга аликвот полученных от индивидуумов образцов или объединенных образцов с использованием любого из описанных здесь анализов обнаружения. Образцы или объединенные образцы, которые контаминированы патогенными прионами, могут удаляться до их комбинации. Данным путем может предоставляться продукт крови, по существу лишенный контаминации патогенного приона. Под «по существу свободными патогенными прионами» подразумевается, что присутствие патогенных прионов не выявляется с использованием любого из описанных здесь анализов. Важно, что описанные здесь пептидные реагенты, которые, как уже было показано, обнаруживали патогенные белковые формы в тканях головного мозга, разбавленных в 106 раз нормальной тканью, являются единственным продемонстрированным реагентом, который может обнаруживать патогенные прионы в крови.
Изобретение, таким образом, предоставляет способ получения продукта крови, который, по существу, лишен патогенных прионов, где указанный продукт содержит цельную кровь, эритроциты, плазму, тромбоциты или сыворотку, причем указанный способ предусматривает:
(a) скрининг аликвот цельной крови, эритроцитов, плазмы, тромбоцитов или сыворотки из собранных образцов крови любыми способами обнаружения, предоставленными здесь для обнаружения патогенных прионов;
(b) элиминацию образцов, в которых обнаружены патогeнные прионы; и
(c) комбинацию образцов, в которых не обнаружены патогенные прионы, для предоставления продукта крови, по существу, лишенного патогенных прионов.
Сходным образом, продукт питания может подвергаться скринингу на присутствие патогенных принов для получения пищи, по существу лишенной патогенных прионов. Таким образом, с использованием любого из описанных здесь способов образцы из живых организмов, предназначенные для потребления в пищу людей и животных, могут подвергаться скринингу на присутствие патогенных прионов. Образцы, взятые из продукта питания, предназначенного для снабжения пищей, также могут подвернаться скринингу. Образцы, в которых обнаруживают патогенные прионы, идентифицируют, и живой организм и пища, предназначенные для снабжения питанием, в образцах, в которых обнаружены патогенные прионы, удаляют из снабжения питанием. Таким путем предоставляются продукты питания, по существу, лишенные патогенных прионов.
Таким образом, изобретение относится к способу получения продукта питания, по существу, лишенного патогенных прионов, причем указанный способ предусматривает:
(a) скрининг образца, взятого из живых организмов, которые пойдут на продукты питания или образца, взятого из пищи, предназначенного для снабжения питанием, любыми способами обнаружения, предоставленными здесь для обнаруженния патогенных прионов;
(b) элиминацию образцов, в которых обнаружены патогeнные прионы; и
(c) комбинацию образцов, в которых не обнаружены патогенные прионы, для предоставления продукта питания, по существу, лишенного патогенных прионов.
B. Очистка
Пептиды по изобретению могут также использоваться для удаления патогенных прионов из образца как для цели выделения патогенного приона (например, для концентрирования прионного белка перед обнаружением), так и для цели удаления из образца патогенного приона (например, в качестве средства предоставления образца, по существу, лишенного патогенных прионов). В данных способах пептидные реагенты обычно предоставляются на твердой основе. Твердая основа, содержащая пептидный реагент, контактирует с образцом, содержащим патогенный прион в условиях для связывания приона с пептидным реагентом. Если целью является выделение патогенного приона, несвязавшийся образец удаляют и собирают твердую основу, содержащую прионы; если целью является удаление прионов из образца, собирают несвязавшийся образец.
Таким образом, изобретение относится к способу выделения патогенного прионного белка из образца, предусматривающему:
(a) получение твердой основы, содержащей пептидный реагент по изобретению;
(b) контактирование указанного образца с указанной твердой основой в условиях, которые обеспечивают связывание патогенного прионного белка, если он присутствует в указанном образце, с указанным первым пептидным реагентом, с образованием первого комплекса, и
(c) удаление несвязанных материалов образца.
В дальнейшем варианте осуществления указанный патогенный прионный белок может диссоциироваться с указанного первого комплекса. Эта диссоциация может выполняться способами, которые хорошо известны в области очистки белка.
Изобретение также относится к способу элиминации патогенных прионных белков из образца, предусматривающему:
(a) получение твердой основы, содержащей пептидный реагент по изобретению;
(b) контактирование указанной твердой основы с образцом, в котором предполагается наличие патогенных прионных белков в условиях, которые обеспечивают связывание патогенных прионных белков, если они присутствуют, с пептидным реагентом; и
(c) получение несвязанных материалов образца.
C. Композиции
Изобретение далее относится к композициям, содержащим описанные здесь пептидные реагенты и/или антитела (и полинуклеотиды, кодирующие данные пептидные реагенты и/или антитела) и к способам применения данных композиций в терапевтических и профилактических композициях для лечения или профилактики связанных с прионами заболеваний. Более того, антитела, пептидные реагенты (и полинуклеотиды, кодирующие данные антитела и/или пептидные реагенты) могут также применяться в композициях, индивидуально или в комбинации, для профилактических (например, для предоствращения патогенеза) или терапевтических (для лечения заболевания после инфекции) целей.
Точный механизм, по которому описанные здесь композиции действуют в плане лечения или профилактики заболевания, не критичен. Хотя это и не связано с какой-либо одной теорией, описанные здесь композции могут действовать в плане лечения или профилактики заболеваний по одному или нескольким из следующих механизмов: индукция у индивидуума иммунного ответа, который затем лечит или предотвращает состояние болезни; связывание непатогенных форм, которые могут предотвращать переход в патогенные формы; связывание патогенных формы, которое может предотвращать патогенные последствия; и/или связывание с патогенными формами, которое может препятствовать переходу за счет патогенных форм непатогенных форм в формы, связанные с заболеванием. (См., например, Peretz et al. (2001) Nature 412: 739-743, где анализируется способность некоторых Fab ингибировать размножние прионов).
Композиции могут включать в себя смеси одного или нескольких пептидных реагентов, антител и/или полинуклеотидов. Данные молекулы могут быть получены из различных источников, например рекомбинантно продуцированные белки, синтетически продуцированные белки и т.д. Композиции также могут вводиться в связи с другими молекулами, например, антигенами и иммунорегуляторными агентами, такими как иммуноглобулины, цитокины, лимфокины, и хемокины, включая в качестве неограничивающих примеров IL-2, модифицированные IL-2 (cys125-ser125), GM-CSF, IL-12, альфа- или гамма-интерферон, IP-10, MIP1 и RANTES. Композиции могут вводиться в виде полипептидов или, альтернативно, в виде голой нуклеоиновой кислоты (например, ДНК), с использованием вирусных векторов (например, ретровирусных векторов, аденовирусных векторов, аденоассоциированных вирусных векторов, альфавирусных векторов) или невирусных векторов (например, липосом, частиц, покрытых нуклеиновой кислотой или белком).
Композиции могут также включать в себя смесь пептидного реагента и нуклеиновой кислоты, которая, в свою очередь, может быть доставлена с использованием различных способов и/или носителей. Одинаковые или различные композиции могут вводиться более одного раза (например, «первичное» введение с последующей одной или несколькими «стимуляциями») для достижения требуемых эффектов. Одна и та же композиция может вводиться в качестве первичной и в качестве одной или нескольких стимуляций. Альтернативно, различные композиции могут использоваться для первичного эффекта и стимуляции.
Композиции по изобретению предпочтительно являются фармацевтически приемлемыми и фармакологически приемлемыми. В частности, композиции предпочтительно не являются нежелательными в биологическом или другом смысле, т.е., данный материал может вводиться в препарате или композиции без индукции каких-либо нежелательных биологических эффектов или без вредоносного взаимодействия с любыми компонентами композиции, в которой он содержится.
Описанные здесь композиции могут обычно включать в себя терапевтически эффективное количество молекул (пептидных реагентов) или кодирующих их нуклеотидных последовательностей, антител, направленных на данные молекулы и любых других указанных выше компонентов, если это требуется. Под «терапевтически эффективным количеством» подразумевается количество, которое индуцирует протективный и/или терапевтический ответ в неинфицированном, инфицированном или не испытавшем воздействия индивидууме, которому оно введено. «Терапевтически эффективное количество» попадает в относительно широкий интервал, который определяется рутинными испытаниями. Точное необходимое количество изменяется в зависимости от подлежащего лечению индивидуума; возраста и общего состояния подлежащего лечению индивидуума; способности иммунной системы индивидуума синтезировать антитела; степени требуемой защиты; тяжести подлежащего лечению состояния; конкретно выбранной композиции и способ ее введения, среди прочих факторов.
В некоторых вариантах осуществления пептидные реагенты являются иммуногенными, и способы по изобретению включают в себя введение животному иммуногенной композиции, содержащей описанный здесь пептидный реагент, антитело, специфичное в отношении патогенных прионов и/или полинуклеотиды, кодирующие данные пептидные реагенты или антитела. Иммуногенные композиции, применяемые по изобретению, предпочтительно включают в себя иммунологически эффективное количество данных компонентов. «Иммунологически эффективное количество» представляет собой количество, достаточное для того, чтобы у животного был вызыван иммунный ответ против прионного белка, предпочтительно, патогенного приона. Иммунный ответ, в общем, приводит к развитию у индивидуума секреторного, клеточного и/или опосредованного антителом иммунного ответа. Обычно такой ответ включает в себя в качестве неограничивающих примеров один или несколько из следующих эффектов: продукцию антител любого из иммунологических классов, таких как иммуноглобулины A, D, E, G или M; пролиферацию B- и T-лимфоцитов; предоставление иммунологическим клеткам сигналов активации, роста и дифференцировки; размножение хелперной T-клетки, супрессорной Т-клетки, и/или цитотоксической Т-клетки. Количество продуцируемых антител изменяется в зависимости от нескольких факторов, включая используемое животное, присутствие адъюванта и т.д.
Композиции по изобретению могут далее включать в себя один или несколько адъювантов. Адъюванты, подходящие для применения по изобретению, включают в себя один или несколько из следующих:
– термолабильный энтеротоксин E. coli («LT») или его детоксифицированные мутанты, такие как мутанты K63 или R72;
– холерный токсин («CT») или его детоксифицированные мутанты;
– микрочастицы (т.е., частица от «~100 нм до ~150 мкм» в диаметре, более предпочтительно, от ~200 нм до ~30 мкм в диаметре, и, наиболее предпочтительно, от ~500 нм до ~10 мкм в диаметре), образованные из материалов, которые являются биодеградируемыми и нетоксичными (например, поли( -гидрокси кислота), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапронолактон и т.д.); -гидрокси кислота), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапронолактон и т.д.);
– полиоксиэтиленовый простой эфир или полиоксиэтиленовый сложный эфир (см. заявку на выдачу Международного патента WO 99/52549);
– поверхностно-активное вещество из полиоксиэтиленового сорбитанового эфира в комбинации с октоксинолом (см. заявку на выдачу Международного патента WO 01/21207) или поверхностно-активное вещество из полиоксиэтиленового алкильного простого эфира или сложного эфира в комбинации, по меньшей мере, с одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (см. заявка на выдачу Международного патента WO01/21152);
– хитозан (например, заявка на выдачу Международного патента WO 99/27960);
– иммуностимулирующий олигонуклеотид (например, олигонуклотид CpG) и сапонин (см. заявка на выдачу Международного патента WO00/62800);
– иммуностимулирующая двухцепочечная РНК;
– соединения алюминия (например, гидроксид алюминия, фосфат алюминия, гидроксифосфат алюминия, оксигидроксид, ортофосфат, сульфат и т.д. (например, см. главы 8 & 9 Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995 (ISBN 0-306-44867-X) (здесь и далее «Vaccine design»), или смеси различных соединений алюминия, с соединениями, принимающими какую-либо подходящую форму (например, гелевую, кристаллическую, аморфную, и т.д.), и с предпочтительной адсорбцией;
– MF59 (5% сквален, 0,5% Tween 80 и 0,5% Span 85, составленные в субмикронные частицы с использованием микрофлюидизатора) (см. главу 10 «Vaccine design»; см. также заявку на выдачу Международной заявки WO 90/14837);
– липосомы (см. главы 13 и 14 «Vaccine design»);
– ISCOM (см. главы 23 «Vaccine design»);
– SAF, содержащий 10% сквален, 0,4% Tween 80, 5% блок-сополимер этилена и оксида пропилена L121, и thr-MDP, микроожиженные в субмикронную эмульсию, или смешивают на vortex с образованием эмульсии с большим размером частиц (см. главу 12 «Vaccine design»);
– адъювантная система Ribi (RAS) (Ribi Immunochem), содержащая 2% сквален, 0,2% Tween 80, и один или несколько компонентов бактериальной клеточной стенки из группы, состоящей из монофосфориллипида A (MPL), димиколата трегалозы (TDM), и скелета клеточной стенки (CWS), предпочтительно, MPL + CWS (Detox (RAS) (Ribi Immunochem), содержащая 2% сквален, 0,2% Tween 80, и один или несколько компонентов бактериальной клеточной стенки из группы, состоящей из монофосфориллипида A (MPL), димиколата трегалозы (TDM), и скелета клеточной стенки (CWS), предпочтительно, MPL + CWS (Detox ); );
– адъюванты сапонина, такие как QuilA или QS21 (см. главу 22 «Vaccine design»), также известные как Stimulon ; ;
– ISCOM, которые могут быть лишены дополнительным детергентом (заявка на выдачу Международного патента WO 00/07621);
– полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA);
– цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12, и т.д.), интерфероны (например, интерферон- ), макрофагальный колониестимулирующий фактор, фактор некроза опухолей, и т.д. (см. главы 27 & 28 «Vaccine design»); ), макрофагальный колониестимулирующий фактор, фактор некроза опухолей, и т.д. (см. главы 27 & 28 «Vaccine design»);
– монофосфориллипид A (MPL) или 3-O-деацетилированный MPL (3dMPL) (например, глава 21 «Vaccine design»);
– комбинации 3dMPL, например QS21, и/или эмульсии масло-в-воде (заявки на выдачу Европейского патента 0835318, 0735898 и 0761231);
– олигонуклеотиды, содержащие CpG-мотивы (см. Krieg (2000) Vaccine, 19: 618-622; Krieg (2001) Curr.Open.Mol.Ther., 2001, 3: 15-24; WO 96/02555, WO 98/16247, WO98/18810, WO 98/40100, WO 98/55495, WO98/37919 и WO 98/52581, и т.д.), т.е. содержащие, по меньшей мере, один динуклеотид CG,
– полиоксиэтиленовый простой эфир или полиоксиэтиленовый сложный эфир (заявка на выдачу Международного патента WO 99/52549);
– поверхностно-активное вещество из полиоксиэтиленового сорбитанового эфира в комбинации с октоксинолом (см. заявку на выдачу Международного патента WO 01/21207) или поверхностно-активное вещество из полиоксиэтиленового алкильного простого эфира или сложного эфира в комбинации, по меньшей мере, с одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (см. заявка на выдачу Международного патента WO01/21152);
– иммуностимуляторный олигонуклеотид (например, олигонуклеотид CpG) и сапонин (заявка на выдачу Международного патента WO00/62800);
– иммуностимулятор и частица соли металла (заявка на выдачу Международного патента WO00/23105);
– сапонин и эмульсия масла в воде (заявка на выдачу Международного патента WO99/11241); и
– сапонин (например, QS21) + 3dMPL + IL-12 (необязательно + стерол) (заявка на выдачу Международного патента WO 98/57659).
Мурамиловые пептиды включают в себя в качестве неограничивающих примеров N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-актеилнормурамил-L-аланил-D-изоглутамат (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1′-2′-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (MTP-PE), и т.д.
Другие адъюванты, подходящие для применения введения через слизистые и парентерального введения также доступны (например, см. главу 7 Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995 (ISBN 0-306-44867-X).
Мутанты LT представляют собой предпочтительные адъюванты (например, адъюванты слизистых), в частности мутанты «K63» и «R72» (например, см. заявку на выдачу Международного патента WO 98/18928), поскольку они приводят к повышенному иммунному ответу.
Микрочастицы также могут использоваться, и предпочтительно их получают из поли( -гидроксикислоты), в частности из поли(лактида) («PLA»), сополимера D,L-лактида и гликолида или гликолевой кислоты, такого как поли(D,L-лактид-когликолид) («PLG» или «PLGA»), или сополимера D,L-лактида и капролактона. Микрочастицы могут быть получены из любого из различных полимерных исходных материалов, которые имеют различные молекулярные массы и, в случае сополимеров, таких как PLG, различные отношения лактида:гликолида, которые во многом являются предметом выбора. Прионы, антитела и/или полинуклеотиды по изобретению могут захватываться внутрь микрочастиц, или могут адсорбироваться на них. Захват внутрь микрочастиц PLG является предпочтительным. Микрочастицы PLG обсуждаются более подробно в Morris et al., (1994), Vaccine, 12: 5-11, в главе 13 Mucosal Vaccines, eds. Kiyono et al., Academic Press 1996 (ISBN 012410587), и в главах 16 & 18 Vaccine design : the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995 (ISBN0-306-44867-X). -гидроксикислоты), в частности из поли(лактида) («PLA»), сополимера D,L-лактида и гликолида или гликолевой кислоты, такого как поли(D,L-лактид-когликолид) («PLG» или «PLGA»), или сополимера D,L-лактида и капролактона. Микрочастицы могут быть получены из любого из различных полимерных исходных материалов, которые имеют различные молекулярные массы и, в случае сополимеров, таких как PLG, различные отношения лактида:гликолида, которые во многом являются предметом выбора. Прионы, антитела и/или полинуклеотиды по изобретению могут захватываться внутрь микрочастиц, или могут адсорбироваться на них. Захват внутрь микрочастиц PLG является предпочтительным. Микрочастицы PLG обсуждаются более подробно в Morris et al., (1994), Vaccine, 12: 5-11, в главе 13 Mucosal Vaccines, eds. Kiyono et al., Academic Press 1996 (ISBN 012410587), и в главах 16 & 18 Vaccine design : the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995 (ISBN0-306-44867-X).
Мутанты LT можно успешно использовать в комбинации с захваченным внутрь микрочастицы антигеном, приводя к значительно повышенному иммунному ответу.
Соединения аллюминия и MF59 являются предпочтительными адъювантами для парентерального применения.
Типично, композиции готовят в виде инъецируемых композиций, либо в качестве жидких растворов, либо суспензий; можно также приготовить твердые формы, подходящие для растворения или суспендирования в жидком растворителе перед инъекцией. Препарат также можно приготовить в виде эмульсии или инкапсулировать в липосомы для увеличения адъювантного эффекта, как обсуждалось выше.
Фармацевтически приемлемые соли можно также использовать в композициях по изобретению, например минеральные соли, такие как гидрохлориды, гидробромиды, фосфаты или сульфаты, а также соли органических кислот, такие как ацетаты, пропионаты, малонаты или бензоаты. Особенно применимые белковые субстраты представляют собой сывороточные альбумины, гемоцианин морского блюдечка, молекулы иммуноглобулинов, тироглобулин, овальбумин, столбнячный анатоксин и другие белки, хорошо известные специалистам в данной области.
Композиции по изобретению могут также содержать жидкости или наполнители, такие как вода, физиологический раствор, глицерин, декстроза, этанол или тому подобное, отдельно или в комбинации, а также такие вещества, как смачивающие средства, эмульгирующие средства или буферизующие pH средства. Необязательно присутствует носитель, который является молекулой, которая сама по себе не вызывает продукцию антител, вредных для индивидуума, получающего композицию. Подходящие носители типично представляют собой большие медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолиевые кислоты, полимерные аминокислоты, сополимеры аминокислот, липидные агрегаты (такие как масляные капельки или липосомы) и инактивированные вирусные частицы. Такие носители хоршо известны обычным специалистам в данной области. Кроме того, один или более полипептидов в композиции можно конъюгировать с бактериальным анатоксином, таким как анатоксин дифтерии, столбняка, холеры и т.д.
D. Доставка
Композицию по изобретению можно вводить в однократной дозе или как часть режима приема. Нуклеиновые кислоты и/или пептиды можно вводить любым подходящим способом, включая в качестве неограничивающих примеров внутримышечно, через слизистую, подкожно, внутрикожно, чрескожно, интравагинально, интраректально, перорально и/или внутривенно. Режим дозировки может включать в себя первичные и стимулирующие дозы, которые можно вводить через слизистую, парентерально или различными их комбинациями.
В некоторых осуществлениях один или более компонентов композиций вводят парентерально или через слизистую. Подходящие способы парентерального введения включают в себя внутримышечный (IM), подкожный, внутривенный, внутрибрюшинный, внутрикожный, чрескожный и трансдермальный (см., например, Международную заявку на патент WO 98/20734) способы, а также доставку в интерстициальное пространство ткани. Подходящие способы введения через слизистую включают в себя пероральный, интраназальный, внутрижелудочный, легочный, кишечный, ректальный, глазной и вагинальный способы. Композицию можно адаптировать для введения через слизистую. Например, если композиция предназначена для перорального введения, она может находиться в форме таблеток или капсул, необязательно покрытых энтеросолюбильной оболочкой жидкостей, трансгеных растений и т.д. Если композиция предназначена для интраназального введения, она может находиться в форме спрея для носа, капель в нос, геля или порошка. Дозировка при лечении может представлять собой режим однократной дозировки или режим многократной дозировки.
Композиции (или ее компонентны) можно также инкапсулировать, адсорбировать или связать с частицами-носителями. Такие носители представляют собой многократные копии выбранного антигена для иммунной системы и обеспечивают захват и задержание антигенов в региональных лимфатических узлах. Макрофаги могут фагоцитировать частицы и могут усилить презентацию антигена посредством высвобождения цитокина. Примеры частиц-носителей включают в себя частицы, полученные из полиметилметакрилатовых полимеров, а также микрочастицы, полученные из поли(лактидов) и поли(лактид-когликолидов), известных как PLG. См., например, Jeffery et al., Phann. Res. (1993) 10: 362-368; McGee JP, et al., J Microeizcapsul. 14 (2): 197-210, 1997; O’Hagan DT, et al., Vaccine 11 (2): 149-54, 1993. Подходящие микрочастицы можно также промышленно получать в присутствии заряженных детергентов, таких как анионогенные и катионогенные детергенты, чтобы получить миктрочастицы с поверхностью, несущей суммарный отрицательный или суммарный положительный заряд. Например, микрочастицы, полученные с анионогенными детергентами, такими как бромид гексадецилтриметиламмониума (CTAB), то есть микрочастицы CTAB-PLG, адсорбируют отрицательно заряженные макромолекулы, такие как ДНК (см., например, Международную заявку  PCT/US99/17308). PCT/US99/17308).
Кроме того, другие системы частиц и полимеры можно использовать для доставки in vivo или ex vivo. Например, такие полимеры, как полилизин, полиаргинин, полиорнитин, спермин, спермидин, так же, как и конъюгаты данных молекул, применимы для переноса интересующей нуклеиновой кислоты. Подобным образом, опосредованная декстраном трансфекция DEAE, осаждение фосфатом кальция или осаждение с использованием других нерастворимых неорганических солей, таких как фосфат стронция, силикаты алюминия, включая сюда бентонит и каолин, окись хрома, силикат магния, тальк и тому подобное, найдет использование с настоящими способами. Для обзора систем доставки, применимых для переноса гена, см., например, Felgner, P.L., Advanced Drug Delivery Reviews (1990) 5: 163-187. Пептоиды (Zuckerman, R. N., et al., патент США  5831005, опубликованный 3 ноября 1998 г., включен сюда в качестве ссылки) можно также использовать для доставки конструкции по настоящему изобретению. 5831005, опубликованный 3 ноября 1998 г., включен сюда в качестве ссылки) можно также использовать для доставки конструкции по настоящему изобретению.
Как отмечалось выше, пептиды (или антитела) можно также доставлять при помощи нуклеиновых кислот, кодирующих данные молекулы. Необходимую последовательность встраивают в одноцистронный или мультицистронный вектор, содержащий выбранные контрольные элементы (например, промотор, энхансер и т.д.). В собранном виде конструкции можно доставлять, используя стандартные протоколы доставки генов, включающих в себя инъекцию с использованием традиционного шприца (например, патенты США  5399346, 5580859, 5589466) или генной пушки, такой как система доставки гена в клетки (Accell® gene delivery system; PowderJect Technologies, Inc., Оксфорд, Англия); используя системы, на основе вирусов, такие как ретровирусные системы, как описано в (патенте США 5399346, 5580859, 5589466) или генной пушки, такой как система доставки гена в клетки (Accell® gene delivery system; PowderJect Technologies, Inc., Оксфорд, Англия); используя системы, на основе вирусов, такие как ретровирусные системы, как описано в (патенте США  5219740), аденовирусные системы (Barr et al., Gene Therapy (1994) 1: 51-58; Berkner, K. L. BioTechniques (1988) 6: 616-629; and Rich et al., Human Gene Therapy (1993)4 : 461-476), системы с аденоассоциированным вирусом (AAV) (патенты США 5219740), аденовирусные системы (Barr et al., Gene Therapy (1994) 1: 51-58; Berkner, K. L. BioTechniques (1988) 6: 616-629; and Rich et al., Human Gene Therapy (1993)4 : 461-476), системы с аденоассоциированным вирусом (AAV) (патенты США  5173414 и 5139941), системы на основе вируса оспы, системы доставки на основе вируса коровьей оспы (см., например, международную публикаци. 5173414 и 5139941), системы на основе вируса оспы, системы доставки на основе вируса коровьей оспы (см., например, международную публикаци.  WO 94/26911), системы на основе вируса птичьей оспы, такие вирусы оспы домашней птицы и оспы канареек, альфавирусную систему доставки (патенты США WO 94/26911), системы на основе вируса птичьей оспы, такие вирусы оспы домашней птицы и оспы канареек, альфавирусную систему доставки (патенты США  5843723; 5789245; 6342372; 6329201), а также и другие вирусные системы; невирусные системы, такие как заряженные и незаряженные липосомы (см., например, Hug and Sleight, Biochim. Biophys. Acta. (1991) 1097: 1-17; Straubinger et al., in Methods of Enzymology (1983), Vol. 101, pp. 512-527; Felgner et al., Proc. Natl. Acad. Sci. USA (1987) 84: 7413-7416)); и/или кохлеатные липидные композиции, похожие на композиции, описанные Papahadjopoulos et al., Biochem. Bioplys. Acta. (1975) 394: 483-491. См. также патенты США 5843723; 5789245; 6342372; 6329201), а также и другие вирусные системы; невирусные системы, такие как заряженные и незаряженные липосомы (см., например, Hug and Sleight, Biochim. Biophys. Acta. (1991) 1097: 1-17; Straubinger et al., in Methods of Enzymology (1983), Vol. 101, pp. 512-527; Felgner et al., Proc. Natl. Acad. Sci. USA (1987) 84: 7413-7416)); и/или кохлеатные липидные композиции, похожие на композиции, описанные Papahadjopoulos et al., Biochem. Bioplys. Acta. (1975) 394: 483-491. См. также патенты США  4663161 и 4871488. Полинуклеотиды можно доставлять либо непосредственно позвоночным индивидуумам, либо альтернативно, доставлять ex vivo, в клетки, полученные от индивидуума, и клетки реимплантировать индивидууму. 4663161 и 4871488. Полинуклеотиды можно доставлять либо непосредственно позвоночным индивидуумам, либо альтернативно, доставлять ex vivo, в клетки, полученные от индивидуума, и клетки реимплантировать индивидууму.
Способы по изобретению дополнительно охватывают лечение или предупреждение развития связанного с прионом заболевания введением животному композиции, содержащей эффективное количество антител по изобретению.
Способы лечения могут объединять любые описанные здесь композиции, например, содержащие пептиды композиции и/или композиции антител. Различные компоненты можно вводить совместно или отдельно.
Животные, подходящие для использования в способах по изобретению, включают человека и других приматов, включая отличных от человека приматов, таких как шимпанзе, и другие виды человекообразных обезьян и мартышек; сельскохозяйственных животных, таких как крупный рогатый скот, овцы, свиньи, козы и лошади, домашних животных, таких как собаки и кошки; лабораторных животных, включая грызунов, таких как мыши, крысы, хомячки и морские свинки; птиц, включая домашних, диких и охотничьих птиц, таких как куры, индюки и другие куриные, утки, гуси и тому подобное. Животные, подходящие для использования в изобретении, могут быть любого возраста, включая как взрослых, так и новорожденных. Трансгенных животных также можно использовать в изобретении. Для обсуждения трансгенных животных, используемых в настоящее время для изучения связанных с прионами заболеваний, см., главным образом, Prusiner “Prions” Proc. Natl. Acad. Sci. USA (1998) 95: 13363-13383.
Композиции по изобретению можно использовать для лечения или предупреждения развития связанных с прионами заболеваний. Такие связанные с прионами заболевания включают в себя заболевания, вызванные полностью или отчасти патогенным прионным белком (PrPSc). Связанные с прионами заболевания включают в себя скрэпи, губчатые энцефаломиелиты крупного рогатого скота (BSE), коровье бешенство, кошачий губчатый энцефаломиелит, куру, болезнь Крейтцфельдта-Якоба (CJD), болезнь Герштманн-Штрасслера-Шейнкера (GSS) и фатальную семейную бессонницу (FFI).
ПРИМЕРЫ
Ниже приведены примеры определенных осуществлений для выполнения настоящего изобретения. Примеры представлены исключительно с иллюстративными целями и не предназначены каким-либо образом ограничить объем настоящего изобретения.
Были приложены усилия для того, чтобы гарантировать точность используемых чисел (например, количества, температуры и т.д.), но некоторая экспериментальная ошибка и отклонение должны, конечно же, учитываться.
Пример 1. Пептидные реагенты
Получение
Пептидные фрагменты прионных белков химически синтезировали, используя стандартные методики синтеза пептидов, по существу как описано у Merrifield (1969) Advan. Enzymol. 32: 221 и Holm и Medal(1989), Multiple column peptide synthesis, p. 208E, Bayer and G. Jung (ed.), Peptides 1988, Walter de Gruyter & Co. Berlin-N. Y. Пептиды очищали ВЭЖХ и последовательность подтверждали при помощи масс-спектроскопии.
В некоторых случаях синтезированные пептиды включали в себя дополнительные остатки на N- или C-концах, например остатки GGG и/или включали в себя одну или более аминокислотные замены по сравнению с последовательностями дикого типа.
A. Пептоидные замены
Пептоидные замены также делали в пептиде, представленном в SEQ ID NO : 14 (QWNKPSKPKTN, соответствующем остаткам с 97 по 107 SEQ ID NO : 2), SEQ ID NO : 67 (KKRPKPGGWNTGG, соответствующем остаткам 23-36 SEQ ID NO : 2) и SEQ ID NO : 68 (KKRPKPGG, соответсвующем остаткам 23-30 SEQ ID NO : 2). В частности, один или более остатков пролина данных пептидов замещали различными N-замещенными пептиодами. См. на фиг.3 пептоид, которым можно заменить дюбой пролин. Пептоиды получали и синтезировали, как описано в патентах США  5877278 и 6033631, оба полностью включены сюда в качестве ссылки; Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89: 9367. 5877278 и 6033631, оба полностью включены сюда в качестве ссылки; Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89: 9367.
B. Мультимеризация
Некоторые пептидные реагенты можно получить в виде мультимеров, например, получая тандемные повторы (связывая множестово копий пептида посредством линкеров, таких как GGG), пептиды-множественные антигены (MAP) и/или линейно связанные пептиды.
В частности, MAP получали, используя стандартные методики, по существу, как описано у Wu et al. (2001) J Am Chem Soc. 2001 123 (28): 6778-84; Spetzler et al. (1995) Int J Pept Protein Res. 45 (1): 78-85.
Линейные и разветвленные пептиды (например, мультимеризация с линкером ПЭГ) также получали, используя полиэтиленгликолевые (ПЭГ) линкеры, с использованием стандартных методик. В частности, каркасы ПЭГ разветвленных мультипептидов получали с использованием следующих структур: биотин-ПЭГ-Lys-ПЭГ-Lys-ПЭГ-Lys-ПЭГ-Lys-ПЭГ-Lys (без пептидного контроля) и биотин-ПЭГ-Lys(пептид)-ПЭГ-Lys(пептид)-ПЭГ-Lys(пептид)-ПЭГ-Lys(пептид)-ПЭГ-Lys(пептид). Дополнительно, связь пептида с Lys представляла собой: Lys-эпсилон-NH-CO-(CH2)3-Mal-S-Cys-пептид. См. фиг.5.
C. Биотинилирование
Пептиды биотинилировали, используя стандартные методики, после синтеза и очистки. Биотин добавляли к N- или C-концу пептида.
Пример 2: Анализы связывания
A. Осаждение
Пептидные реагенты, как описано здесь, исследовали на их способность специфически связываться с прионными белками, используя анализ осаждения с магнитными гранулами. Для данного анализа пептидные реагенты помечали биотином, который обеспечивал связывание с покрытыми стрептавидином магнитными гранулами.
Гомогенат мозга получали из мышей Balb-c RMLPrPsc+ и PrPc+. Вкратце, 5 мл буфера TBS (50 мМ Tris-HCl pH 7,5 и 37,5 мМ NaCl) с 1% TW20 и 1% Triton 100 добавляли к навеске мозга ~0,5 г, чтобы получить 10% гомогенат. Мозговую взвесь гомогенизировали до тех пор, пока не исчезнут большие частицы. Аликвоты по 200 мкл, разбавленные в соотношении 1:1 в буфере, добавляли в предварительно охлажденные пробирки типа эппендорф и образцы подвергали действию ультразвука при нескольких повторах в течение нескольких секунд каждый. Образцы центрифугировали в течение 10-15 минут при 500x и удаляли надосадочную жидкость.
Для проверки расщепления протеиназой K некоторые супернатанты разделяли на два образца и 4 мкл протеиназы K добавляли в один образец и вращали при 37ºC в течение 1 часа. Восемь микролитров PMSF добавляли в пробирку с протеиназой K, чтобы остановить расщепление, и пробирки инкубировали минимум в течение 1 часа при 4ºC.
Гомогенаты хранили при 4ºC до дальнейшего использования и, если необходимо, снова подвергали действию ультразвука, как описано выше. 10 мас.%/об. препарата PrPc+ или PrPSc+ гомогената мозга инкубировали в течение ночи при 4ºC с меченым биотином пептидным реагентом, как указано ниже: подготовили пробирки, содержащие 400 мкл буфера, 50 мкл экстракта и 5 мкл меченного биотином пептидного реагента (10 мМ маточный раствор). Пробирки инкубировали в течение 2 часов минимум при комнатной температуре или в течение ночи при 4ºC на шейкере с платформой.
После инкубации добавляли 50 мкл SA-гранул (Dynal M280 Streptavidin 112,06) и пробирки мешали путем встряхивания. Пробирки инкубировали с использованием шейкера (VWR, Rocking platform, Model 100) в течение 1 часа при комнатной температуре или в течение ночи при 4ºC.
Образцы забирали из шейкера, помещали в магнитное поле, чтобы отобрать магнитные гранулы с присоединенным пептидным реагентом и прионом и отмывали 5-6 раз, используя 1 мл буфера для анализа. Образцы использовали сразу же или хранили при -20ºC до вестерн-блоттинга или ELISA, описанных ниже.
B. Вестерн-блоттинг
Анализ путем вестерн-блоттинга проводили, как указано ниже. Комплексы гранула-пептид-прион, осажденные, как описано выше, денатурировали после последней промывки, добавляя 25-30 мкл буфера SDS (Novex Tris-Glycine SDS-Sample Buffer 2X), добавленного к каждой пробирке. Пробирки перемешивали при встряхивании до тех пор, пока все гранулы не суспендировались. Содержимое пробирок кипятили до открывания крышек, разгоняли на стандартном SDS-PAGE геле и переносили на твердую мембрану для анализа WB.
Мембраны блокировали в течение 30 минут в 5% молоке/TBS-T [50 мл 1 M Tris pH 7,5; 37,5 мл 4M NaCl, 1-10 мл Tween доводили молоком до объема 1 л] при комнатной температуре. Поликлональные антитела против приона в объеме между 10 и 15 мл, как описано в Международной заявке  PCT/US03/31057, поданной 30 сентября 2003, называемой «Prion Chimeras and Uses Thereof», добавляли при разбавлении 1:50 к мембране и инкубировали в течение 1 часа при комнатной температуре. Мембрану многократно отмывали в TBS-T. После отмывки, добавляли вторичное антитело (антитело козы против кроличьих IgG (H+L) (Pierce), конъюгированное с щелочной фосфатазой c (AP), в разведении 1:1000 (в TBS-T) и инкубировали в течение 20 минут при комнатной температуре. Мембрану многократно отмывали в TBS-T. Добавляли реагент, осаждающий щелочную фосфатазу (1-стадийный NBT/BCIP (Pierce) и проявляли, пока не появлялся фон или пока не появлялся сигнал. PCT/US03/31057, поданной 30 сентября 2003, называемой «Prion Chimeras and Uses Thereof», добавляли при разбавлении 1:50 к мембране и инкубировали в течение 1 часа при комнатной температуре. Мембрану многократно отмывали в TBS-T. После отмывки, добавляли вторичное антитело (антитело козы против кроличьих IgG (H+L) (Pierce), конъюгированное с щелочной фосфатазой c (AP), в разведении 1:1000 (в TBS-T) и инкубировали в течение 20 минут при комнатной температуре. Мембрану многократно отмывали в TBS-T. Добавляли реагент, осаждающий щелочную фосфатазу (1-стадийный NBT/BCIP (Pierce) и проявляли, пока не появлялся фон или пока не появлялся сигнал.
C. ELISA
После последней отмывки комплексы гранула-пептид, описанный выше, денатурировали гуанидином тиоционатом и проводили ELISA с денатурированным белком, как ранее описано Ryou et al. (2003) Lab Invest. 83 (6): 837-43. Величины O.D., превышающие пустые контроли (в диапазоне 0,172-0,259), считались положительными.
D. Результаты
Результаты анализов связывания путем вестерн-блоттинга и ELISA сведены в таблице 2. Вкратце, расщепление протеиназой K гомогената мозга не являлось необходимым для того, чтобы определить специфическое связывание пептидных реагентов, как описано здесь, для связывания с PrPSc. Как показано на фиг.4, ни в одном из случаев не наблюдали связывание с гомогенатом мозга дикого типа, указывая на то, что пептидные реагенты связывались с PrPSc специфически. Кроме того, при анализе путем вестерн-блоттинга, описанным выше, определили PrPSc при более чем четырех логарифмических разведениях, в то время как ELISA была, по крайней мере, 10X более чувствительным, чем вестерн-блоттинг.
Таблица 2
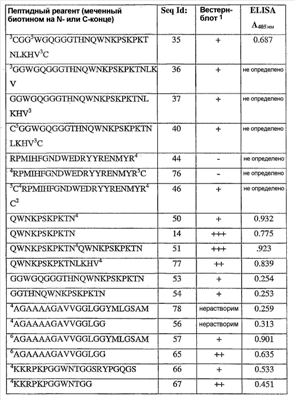
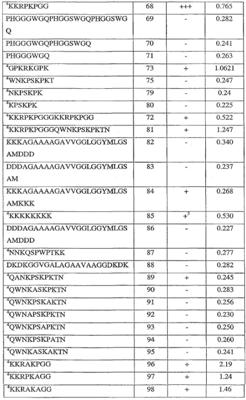
1: Визуально оцениваемая относительная интенсивность сигнала
2: циклизованная
3: остатки GGGG, добавленные/встроенные в указанное положение
4: остатки GGG, добавленные/встроенные в указанное положение
5: остатки GG, добавленные/встроенные в указанное положение
6: остатки KKK, добавленные/встроенные в указанное положение
Также для идентификации остатков, вовлеченных в связывание, проводили аланиновое сканирование.
Результаты показаны в таблице 3.
Таблица 3
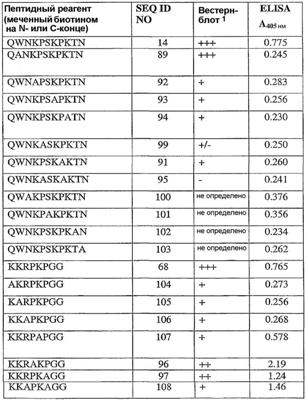
Кроме того, как показано в таблице 4, связывание PrPSc пептидными реагентами, имеющими SEQ ID NO: 14, SEQ ID NO: 67 и SEQ ID NO: 68, далее усиливали заменами пролиновых остатков несколькими N-замещенными глицинами (пиптоидами).
| Таблица 4 |
 |
Вестерн-блот |
ELISA A405 нм |
| в (GGG)1QWNKPSK*KTN (SEQ ID NO: 14) |
 |
 |
| Пролин |
+++ |
0,775 |
| N-(S)-(1-фенилэтил)глицин (пептоид, обведенный на фиг.3A) (SEQ ID NO : 109) |
++ |
0,865 |
| N-(4-гидроксифенил)глицин (пептоид, обведенный на фиг.3B) (SEQ ID NO: 110) |
– |
0,934 |
| N-(циклопропилметил)глицин (пептоид, обведенный на фиг.3С) (SEQ ID NO: 111) |
+++++ |
1,141 |
| N-(изопропил)глицин (пептоид, обведенный на фиг.3D) (SEQ ID NO: 112) |
Не определено |
0,974 |
| N-(3,5-диметоксибензил)глицин (пептоид, обведенный на фиг.3E) (SEQ ID NO: 113) |
+++ |
2,045 |
| N-бутилглицин (пептоид, обведенный на фиг.3F) (SEQ ID NO : 114) |
++++ |
0,776 |
| *в (GGG)1QWNK*SKPKTN (SEQ ID NO: 14) |
 |
 |
| N-(циклопропилметил)глицин (SEQ ID NO: 115) |
Не определено |
0,498 |
| N-(изопропил)глицин (SEQ ID NO: 116) |
Не определено |
1,57 |
| N-(3,5-диметоксибензил)глицин (SEQ ID NO: 117) |
Не определено |
0,823 |
| N-бутилглицин (SEQ ID NO: 118) |
Не определено |
0,619 |
| *в (GGG)1KKRPK*GG (SEQ ID NO: 68) |
 |
 |
| Пролин |
Не определено |
0,765 |
| N-бутилглицин (SEQ ID NO: 119) |
Не определено |
0,61 |
| N-(3,5-диметоксибензил)глицин (SEQ ID NO: 120) |
Не определено |
0,631 |
| N-(изопропил)глицин (SEQ ID NO: 121) |
Не определено |
0,509 |
| N-(циклопропилметил)глицин (SEQ ID NO : 122) |
Не определено |
0,503 |
| *в (GGG)1KKRPK*GGWNTGG (SEQ ID NO: 67) |
 |
 |
| Пролин |
Не определено |
0,451 |
| N-бутилглицин (SEQ ID NO: 123) |
Не определено |
0,503 |
| N-(3,5-диметоксибензил)глицин (SEQ ID NO: 124) |
Не определено |
0,464 |
| N-(изопропил)глицин (SEQ ID NO: 125) |
Не определено |
0,555 |
| N-(циклопропилметил)глицин (SEQ ID NO: 126) |
Не определено |
0,344 |
| (GGG)1QWNKX1SKX2KTN |
 |
 |
| N-(циклопропилметил)глицин в X1; N- (циклопропилметил) глицин в X2 (SEQ ID NO:129) |
Не определено |
Не определено |
| N-(циклопропилметил)глицин в X1; N-(3,5-диметоксибензил)глицин в X2 (SEQ ID NO:130) |
Не определено |
Не определено |
| N-(циклопропилметил)глицин в X1; N-бутилглицин в X2 (SEQ ID NO:131) |
Не определено |
Не определено |
| N-(изопропил)глицин в X1; N-(циклопропилметил)глицин в X2 (SEQ ID NO:132) |
Не определено |
Не определено |
| 1Необязательный линкер GGG не присутствовал в пептидных реагентах в экспериментах, показанных в данной таблице |
Более того, мультимеризация связывающих PrPSc реагентов также улучшала сродство к PrPSc. В частности, тандемные повторы давали более сильные сигналы (измеряемые вестерн-блоттингом), чем единичные копии. Предварительно дериватизированные формы MAP на гранулах в некоторых случаях повышали связывания до 2 раз. Однако формы MAP вызывали осаждение пептида в растворе. Линейно связанные пептиды также тестировали на их способность усиливать связывания, не вызывая преципитации.
Пример 3. Продукция антител
Далее предоставляется пример протокола, который может использоваться для получения антител к пептидным реагентам по изобретению.
Мышей иммунизируют композицией, содержащей описанный здесь пептидный реагент (например, любой из SEQ ID NO: 12-108, предпочтительно, любой из SEQ ID NO: 14, 35, 50, 51, 56, 57, 65, 66, 67, 68, 72, 73, 77, 81, 82) ВМ (внутримышечно) или ВБ (внутрибрюшинно) на 0 сутки, с последующими 2-5 стимуляциями с интервалами не чаще, чем каждые 2 недели. Кровь собирали перед первой иммунизацией и затем через 7 суток после каждой стимуляции для мониторинга гуморального ответа на антиген. 6 порций крови из орбитальной вены брали от каждого животного (три из каждого глаза) примерно по 0,2 мл или менее на одну порцию. Последнюю стимуляцию доставляли путем ВВ (внутривенной) инъекции. Через трое суток после последней стимуляции мышей подвергали эвтаназии путем воздействия CО2 или изофлурана с последующим смещением шейных позвонков. Затем собирали селезенки для продукции гибридом.
Для первой инъекции использовали полный адъювант Фрейнда с последующим применением неполного адъюванта Фрейнда для остальных инъекций, за исключением ВВ инъекции. Препарат для ВВ инъекции получали в солевом растворе.
Хотя предпочтительные осуществления настоящего изобретения описаны в некоторых подробностях, понятно, что могут быть сделаны очевидные вариации без уклонения от определенных здесь сущности и объема изобретения.
Формула изобретения
1. Выделенный пептидный реагент, который преимущественно взаимодействует с патогенными формами белка конформационного заболевания по сравнению с непатогенными формами белка конформационного заболевания,
где пептидный реагент получают из фрагмента пептидного белка,
где пептидный реагент получают из пептида, выбранного из группы, включающей пептиды с SEQ ID NO:12-132.
2. Пептидный реагент по п.1, где конформационное заболевание представляет собой прионное заболевание, а патогенный белок представляет собой PrPSc, и непатогенный белок представляет собой PrPC.
3. Пептидный реагент по п.2, где пептидный реагент содержит полипролиновый спиральный мотив II типа.
4. Пептидный реагент по п.1, где пептидный реагент содержит мотив последовательности РХХР, в котором Р представляет собой пролин или N-замещенный глицин, и Х представляет собой любую аминокислоту.
5. Пептидный реагент по п.2, где пептидный реагент содержит мотив последовательности РХХР, в котором Р представляет собой пролин или N-замещенный глицин, и Х представляет собой любую аминокислоту.
6. Пептидный реагент по п.1, где указанный пептидный реагент кодируется генетически.
7. Пептидный реагент по п.1, где пептидный реагент получают из пептида, выбранного из группы, состоящей из пептидов SEQ ID NO:66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126, 127, 14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 128, 129, 130, 131, 132, 56, 57, 65, 82 и 84.
8. Пептидный реагент по п.1, где пептидный реагент получают из пептида, выбранного из группы, состоящей из пептидов с SEQ ID NO: 66, 67, 68, 72, 81, 96, 97, 98, 107, 108, 119, 120, 121, 122, 123, 124, 125, 126 и 127.
9. Пептидный реагент по п.1, где пептидный реагент включает в себя аминокислотную последовательность (G)n, где n=1, 2, 3 или 4, с N-конца и/или C-конца.
10. Пептидный реагент по п.7 или 8, где пептидный реагент биотинилирован.
11. Пептидный реагент по п.1, где пептидный реагент получают из пептида, выбранного из группы, состоящей из пептидов SEQ ID NO:14, 35, 36, 37, 40, 50, 51, 77, 89, 100, 101, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 128, 129, 130, 131 и 132.
12. Пептидный реагент по п.11, где пептидный реагент включает аминокислотную последовательность (G)n, где n-1, 2, 3 или 4, с N-конца и/или C-конца.
13. Пептидный реагент по п.11 или 12, где пептидный реагент биотинилирован.
14. Пептидный реагент по п.1, где пептидный реагент получают из пептида, выбранного из группы, состоящей из пептидов SEQ ID NO:109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 129, 130, 131, и 132.
15. Пептидный реагент по п.14, где пептидный реагент биотинилирован.
16. Пептидный реагент по п.1, где пептидный реагент получают из пептида, выбранного из группы, состоящей из пептидов SEQ ID NO:56, 57, 65, 82, и 84.
17. Пептидный реагент по п.16, где пептидный реагент биотинилирован.
18. Полинуклеотид, кодирующий пептидный реагент по п.1.
19. Комплекс, содержащий пептидный реагент по любому из пп.2-17 и патогенный прионный белок.
20. Способ обнаружения в образце патогенного приона, предусматривающий:
(a) контактирование образца, в котором предполагается наличие патогенного приона, с первым пептидным реагентом по любому из пп.1, 2, 7, 8, 11 или 14, в условиях, которые обеспечивают связывание первого пептидного реагента с патогенным прионным белком, если он присутствует, с образованием первого комплекса; и
(b) обнаружение патогенного приона, если он есть, в образце путем его связывания с первым пептидным реагентом.
21. Способ по п.20, в котором указанный первый пептидный реагент является меченым и может быть обнаружен.
22. Способ по п.20, в котором указанный первый пептидный реагент биотинилирован.
23. Способ по п.20, в котором указанный первый пептидный реагент присоединен к твердой основе.
24. Способ обнаружения в образце патогенного приона, предусматривающий:
(a) контактирование образца, в котором предполагается наличие патогенного приона, с первым пептидным реагентом по любому из пп.1, 2, 7, 8, 11 или 14, в условиях, которые обеспечивают связывание первого пептидного реагента с патогенным прионом, если он присутствует, с образованием первого комплекса;
(b) контактирование указанного первого комплекса со вторым пептидным реагентом по любому из пп.1, 2, 7, 8, 11 или 14, в условиях, которые обеспечивают связывание второго пептидного реагента с патогенным прионом в указанном первом комплексе, где указанный второй пептидный реагент включает в себя выявляемую метку; и
(c) обнаружение патогенного приона, если он есть, в образце путем его связывания со вторым пептидным реагентом.
25. Способ по п.24, в котором указанный первый пептидный реагент и указанный второй пептидный реагент различны.
26. Способ по п.24, в котором указанный первый пептидный реагент и указанный второй пептидный реагент одинаковы.
27. Способ по п.24, в котором указанный первый пептидный реагент присоединен к твердой основе.
28. Способ по п.24, в котором указанный первый пептид биотинилирован.
29. Способ обнаружения в образце патогенного приона, предусматривающий:
(a) контактирование образца, в котором предполагается наличие патогенного приона, с первым пептидным реагентом по любому из пп.1, 2, 7, 8, 11 или 14, в условиях, которые обеспечивают связывание первого пептидного реагента с патогенным прионом, если он присутствует, с образованием первого комплекса;
(b) удаление несвязанных материалов образца;
(c) диссоциацию указанного патогенного приона с указанного первого комплекса;
(d) контактирование указанного диссоциированного патогенного приона со вторым пептидным реагентом по любому из пп.1, 2, 7, 8, 11 или 14, в условиях, которые обеспечивают связывание второго пептидного реагента с патогенным прионом, где указанный второй пептидный реагент включает в себя выявляемую метку; и
(e) обнаружение патогенного приона, если он есть, в образце за счет его связывания со вторым пептидным реагентом.
30. Способ обнаружения в образце патогенного приона, предусматривающий:
(a) контактирование образца, в котором предполагается наличие патогенного приона, с первым пептидным реагентом по любому из пп.1, 2, 7, 8, 11 или 14, в условиях, которые обеспечивают связывание первого пептидного реагента с патогенным прионом, если он присутствует, с образованием первого комплекса;
(b) удаление несвязанных материалов образца;
(b) диссоциацию указанного патогенного приона с указанного первого комплекса;
(d) контактирование указанного диссоциированного патогенного приона со связывающим прион реагентом в условиях, которые обеспечивают связывание связывающего прион реагента с патогенным прионом, где указанный связывающий прион реагент включает в себя выявляемую метку;и
(e) обнаружение патогенного приона, если он есть, в образце за счет его связывания со связывающим прион реагентом.
31. Способ по п.30, где связывающий прион реагент выбран из группы, включающей антитела против приона, гибридные полипептиды с привитым мотивом, катионные или анионные полимеры, катализаторы размножения и плазминоген.
32. Способ обнаружения в образце патогенного приона, предусматривающий:
(a) контактирование образца, в котором предполагается наличие патогенного приона, со связывающим прион реагентом в условиях, которые обеспечивают связывание связывающего прион реагента с патогенным прионом, если он присутствует, с образованием первого комплекса;
(b) удаление несвязанных материалов образца;
(c) контактирование указанного первого комплекса с пептидным реагентом по любому из пп.1, 2, 7, 8, 11 или 14, в условиях, которые обеспечивают связывание пептидного реагента с патогенным прионом, где указанный пептидный реагент включает в себя выявляемую метку; и
(d) обнаружение патогенного приона, если он есть, в образце за счет его связывания с пептидным реагентом.
33. Способ обнаружения в образце патогенного приона, предусматривающий:
(a) получение твердой основы, содержащей первый пептидный реагент по любому из пп.1, 2, 7, 8, 11 или 14;
(b) контактирование твердой основы с образцом, в условиях, которые обеспечивают связывание патогенных прионов, если они присутствуют в данном образце, с первым пептидным реагентом; контактирование твердой основы с меченым и способным к визуализации вторым пептидным реагентом по любому из пп.1, 2, 7, 8, 11 или 14, в условиях, которые обеспечивают связывание второго пептидного реагента с патогенными прионами, связанными с первым пептидным реагентом; и
(c) выявление комплексов, образованных между первым пептидным реагентом, патогенным прионом из образца и вторым пептидным реагентом, с обнаружением за счет этого наличия патогенного приона в образце.
34. Способ обнаружения в образце патогенного приона, предусматривающий:
(a) получение твердой основы, содержащей связывающий прион реагент;
(b) контактирование твердой основы с образцом в условиях, которые обеспечивают связывание прионных белков, если они присутствуют в данном образце, со связывающим прион реагентом;
(c) контактирование твердой основы с меченым и способным к визуализации вторым пептидным реагентом по любому из пп.1, 2, 7, 8, 11 или 14; и
(d) выявление комплексов, образованных между связывающим прион реагентом, патогенным прионом из биологического образца, и вторым пептидным реагентом.
35. Способ обнаружения в образце патогенного приона, предусматривающий:
(a) получение твердой основы, содержащей первый пептидный реагент по любому из пп.1, 2, 7, 8, 11 или 14;
(b) объединение твердой основы с меченым и способным к визуализации первым лигандом, причем сродство связывания первого пептидного реагента с меченым и способным к визуализации первым лигандом слабее, чем сродство связывания первого пептидного реагента с патогенным прионом;
(c) объединение образца с твердой основой в условиях, которые позволяют патогенному приону, когда он присутствует в образце, связываться с первым пептидным реагентом и вытеснять первый лиганд; и
(d) выявление комплексов, образованных между первым пептидным реагентом и патогенным прионом из образца.
36. Способ по п.23, в котором твердая основа выбрана из группы, состоящей из нитроцеллюлозы, полистирольного латекса, поливинилфторида, диазотированной бумаги, нейлоновых мембран, активированных гранул и отвечающих на магнитное поле гранул.
37. Способ по п.20, в котором образец представляет собой биологический образец.
38. Способ по п.37, в котором биологический образец выбран из группы, включающей органы, цельную кровь, фракцию крови, компоненты крови, плазму, тромбоциты, сыворотку, цереброспинальную жидкость (ЦСЖ), ткань головного мозга, ткань нервной системы, мышечную ткань, костный мозг, мочу, слезы, не относящиеся к ткани нервной системы, органы и/или продукты биопсии или некропсии.
39. Способ по п.38, в котором биологический образец представляет собой цельную кровь, плазму, тромбоциты, фракции крови или сыворотку.
40. Твердая основа, содержащая по меньшей мере один пептидный реагент по любому из пп.1, 2, 7, 8, 11 или 14.
41. Набор для обнаружения в образце патогенного приона, содержащий:
(а) твердую основу по п.40; и другие необходимые реагенты и, необязательно, положительные и отрицательные контроли.
42. Композиция, содержащая пептидный реагент по любому из пп.1, 2, 7, 8, 11 или 14.
43. Композиция, содержащая полинуклеотид по п.18.
44. Способ лечения или профилактики прионного заболевания, предусматривающий введение животному одной или нескольких композиций по п.42.
45. Способ по п.44, где индивидуум представляет собой млекопитающее.
46. Способ по п.45, в котором млекопитающее представляет собой человека.
47. Способ по п.44, в котором композицию вводят внутримышечно, через слизистую оболочку, интраназально, подкожно, внутрикожно, чрезкожно, интравагинально, интраректально, перорально или внутривенно.
48. Способ выделения из образца патогенного прионного белка, предусматривающий:
(a) получение твердой основы, содержащей пептидный реагент по любому из пп.1, 2, 7, 8, 11 или 14;
(b) контактирование указанного образца с указанной твердой основой в условиях, которые обеспечивают связывание патогенного прионного белка, если он присутствует в указанном образце, с указанным первым пептидным реагентом, для образования первого комплекса, и
(a) удаление несвязанных материалов образца.
49. Способ по п.48, дополнительно предусматривающий стадию диссоциации указанного патогенного прионного белка с указанного первого комплекса.
50. Способ элиминации из образца патогенных прионных белков, включающий в себя:
(a) получение твердой основы, содержащей пептидный реагент по любому из пп.1, 2, 7, 8, 11 или 14;
(b) контактирование указанной твердой основы с образцом, в котором предполагается наличие патогенных прионных белков, в условиях, которые обеспечивают связывание патогенных прионных белков, если они присутствуют, с пептидным реагентом; и
(a) получение несвязанных материалов образца.
51. Способ получения продукта крови, который, по существу, лишен патогенных прионов, причем указанный продукт крови включает в себя цельную кровь, плазму, тромбоциты или сыворотку, указанный способ предусматривает:
(a) скрининг аликвот цельной крови, плазмы, тромбоцитов или сыворотки из собранных образцов крови способом по п.20;
(a) элиминацию образцов, в которых обнаружены патогенные прионы; и
(a) комбинирование образцов, в которых не обнаружены патогенные прионы, для получения продукта крови, по существу, лишенного патогенных прионов.
52. Способ получения продукта питания, который, по существу, лишен патогенных прионов, причем указанный способ предусматривает:
(a) скрининг образца, взятого из живых организмов, которые пойдут на продукты питания, или образца, взятого из пищи, предназначенного для снабжения питанием, способом по п.20;
(b) элиминацию образцов, в которых обнаружены патогенные прионы; и
(c) комбинирование образцов, в которых не обнаружены патогенные прионы, для предоставления продукта питания, по существу, лишенного патогенных прионов.
РИСУНКИ
|
|