Патент на изобретение №2166955
|
||||||||||||||||||||||||||
(54) СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ОБУСЛОВЛЕННЫХ ПОВЫШЕНИЕМ УРОВНЯ ФАКТОРА, ВЫЗЫВАЮЩЕГО НЕКРОЗ ОПУХОЛЕВЫХ КЛЕТОК
(57) Реферат: Предложен новый способ лечения или профилактики опосредованного ФНО-заболевания, выбранного из группы, включающей фиброз легких, остеоартрит, анкилозирующий спондилит, красную волчанку, гонококковый артрит, артрит болезни Рейтера и подагру, путем введения пациенту от 0,1 – 200,0 мг/кг веса тела ингибитора ФНО, представляющего собой белок, выбранный из ингибитора ФНО 30 кДа, ингибитора ФНО 40 кДа, ингибитора ФНО  53 40 кДа или ингибитора ФНО 53 40 кДа или ингибитора ФНО  51 40 кДа. Изобретение расширяет арсенал способов указанного назначения. 11 з.п. ф-лы, 17 ил., 4 табл. 51 40 кДа. Изобретение расширяет арсенал способов указанного назначения. 11 з.п. ф-лы, 17 ил., 4 табл.
Изобретение в основном относится к способам профилактики и лечения заболеваний и, более конкретно, к способу профилактики и лечения заболеваний, обусловленных активизацией фактора, вызывающего некроз опухолевых клеток /фактор некроза опухоли, ФНО/. Факторы некроза опухоли /ФНО/ являются классом цитокинов, продуцированных многочисленными видами клеток, включая моноциты и макрофаги. По крайней мере два ФНОа были описаны ранее, в частности ФНО альфа и ФНО бета /лимфотоксин/. Эти известные ФНОы имеют важное физиологическое воздействие на ряд различных клеток-мишеней, участвующих в ответной воспалительной реакции. Белки заставляют фибробласты и синовидальные клетки секретировать латентную коллагеназу и простагладин E2, а также заставляют костные клетки стимулировать резорбцию кости. Эти белки увеличивают также адгезивные свойства поверхности клеток эндотелия для нейтрофилов. Они также заставляют эндотелиальные клетки активизировать способствующую коагуляции деятельность и уменьшить их способность растворять сгустки крови. Помимо этого они изменяют характер активности адипоцитов, они перестают накапливать липиды, путем ингибирования экспрессии фермента липопротеинлипазы. ФНОы заставляют гепатоциты синтезировать класс белков, известных под названием “реагенты острой фазы”, и воздействующих на гипоталамус как пирогены. На примере этой активности видно, что ФНОы играют важную роль в ответной реакции организма на различные условия, как, например, инфекция или рана. Смотри, например, статьи P.J. Sebby et al., Lancet February. 27, 1988, с. 483; H.F.Starnes, Jr et al, J.Clin Invest., т. 82, с. 1321 /1988/; A.Oliff et al, Cell, т. 50, с. 555 /1987/; и A.Waage et al., Lancet February 14, 1987, с. 355. Считается, что “заболевание обусловлено ФНОом”, если спонтанное заболевание или экспериментальное сопровождается повышением уровней ФНО в жидкостях тела или в тканях, прилегающих к очагу заболевания, или симптома внутри тела. Во многих случаях обусловленные ФНО заболевания распознаются также по следующим двум дополнительным условиям: 1/ патологические симптомы заболевания могут быть имитированы в эксперименте на животных путем введения им ФНО; и 2/ патология, индуцированная в эксперименте на животных моделях, может быть подавлена или ликвидирована путем лечения средствами, которые ингибируют действие ФНО. В большинстве случаев при “обусловленных ФНО заболеваниях” встречаются по крайней мере два из трех условий, а во многих случаях при таких заболеваниях встречаются все три условия. Перечень заболеваний, которые удовлетворяют этим критериям, включает, но не ограничивается ими, следующие заболевания: 1/ респираторный дистресс-синдром взрослых, 2/ фиброз легких, 3/ артрит, 4/ воспаление кишечника, 5/ септический шок. Будут представлены данные, свидетельствующие о том, что эти пять заболеваний являются обусловленными ФНО. Животные модели септического шока, артрита и респираторного дистресс-синдрома взрослых хорошо известны и используются здесь для демонстрации способности ингибиторов ФНО лечить обусловленные ФНО заболевания. Респираторный дистресс-синдром взрослых /РДСВ/ характеризуется стремительным развитием одышки, полипноз, цианозом, сильной кислородной недостаточностью, уменьшением объема легких и увеличением сосудистой проницаемости легких. Смертность при РДСВ превышает 50%. Факторы риска, связанные с развитием РДСВ, включают травму, объемное переливание крови, диссеминированное внутрисосудистое свертывание, кислородную токсичность, вдыхание токсинов и раздражающих веществ, системную реакцию на заражение крови, геморрагический панкреатит, ожоги, а также осложнения вследствие хирургической операции в брюшной полости. В этиологии синдрома имеет значение целый ряд посредников, как, например, простагландины, лейкотриены, комплемент и свободные радикалы кислорода; однако различное лечение, предназначенное затормозить действие определенных посредников не улучшило клиническое течение РДСВ. Ниже представлены результаты экспериментов на животных, поддерживающие гипотезу о том, что ФНО является посредником РДСВ. 1. Введение ФНО крысам имитирует РДСВ. После вливания с ФНО уменьшается объем легких, увеличивается количество воды в легких и насыщенность клетками, очень заметными становятся петехиальные кровоизлияния, а также присутствуют гистологические свидетельства наличия нейтрофильных тромбов и диффузных альвеолярных повреждений. Смотри: E.Ferrari-Balivera et al., Arch. Serg, т. 124, с. 1400-1405 /1989/; K.J. Tracey et al., Scienel, т. 234, с. 470-474 /1986/. 2. У крыс, которым были предварительно введена анти-ФНО иммунная сыворотка, была заторможена индукция модели РДСВ. РДСВ был индуцирован с помощью печеночной ишемии путем вторичной перфузии печени. Предполагалось, что после вторичной перфузии повышенные уровни ФНО в крови явятся следствием большой массы оседлых печеночных макрофагов. Просачивание сквозь легочные капилляры у крыс, которым была введена анти-ФНО сыворотка было уменьшено в сравнении с теми животными, которым вводили сыворотку, не обладающую свойствами блокировать ФНО. Смотри: L.M. Colletti et al., Transplantation, т. 49, с. 268-272 /1990/. 3. Концентрации ФНО измерялись в бронхо-легочной секреции пациентов, больных РДСВ, во время двух клинических исследований. В первом обследовании пяти больных РДСВ концентрации ФНО превышали 12,5 нг/мл. В контрольной выборке концентрации ФНО не были обнаружены. Во втором обследовании значительные уровни ФНО были обнаружены в жидкости бронхоальвеолярного лаважа у трех из четырех пациентов, больных РДСВ, однако они были ниже предела определения в контрольной группе. Смотри: A.B.Millar et al., Lancet, т. 2, с. 712-714 /1989/; D.J.Roberts et al., Lancet, т. 2, с. 1043-1044 /1989/. Фиброз легких возникает на последней стадии различных легочных заболеваний. Фиброз является результатом роста фибробластов и увеличения отложения коллагена внутри альвеолярных стенок. ФНО является фактором роста нормальных диплоидных фибробластов при пикомолярных концентрациях. Смотри: B.J.Sugarman et al., Science, т. 230, с. 943-945 /1985/. Результаты экспериментов на животных, включающие индуцирование легочной травмы с помощью блеомицина, химиотерапевтического средства от рака, предоставляют данные, поддерживающие это предположение. О том, что ФНО является посредником фиброза легких свидетельствует следующее: 1. Внутривенное вливание ФНО индуцирует рассеянное повреждение альвеол, особенно сопровождающееся некрозом эпителиальных и эндотелиальных клеток альвеол и заметным утолщением альвеолярных мембран. Подкожное вливание ФНО крысам ведет к заметному увеличению пролиферации фибробластов и отложения коллагена. Смотри: K.J.Trancey et al., Science, т. 234, с. 470-474 /1986/; P.F.Piguet et al., Int. Arch Allerg. Apol. Immunol, т. 83, с. 18 /1986/. 2. Введение анти-ФНО антитела кролика мыши предотвратило индуцированную блеомицином альвеолярную травму, рост фибробластов и отложение коллагена. Смотри: Pierre. F.Piguet et al., J. Exp. Med., т. 170, с. 655-663 /1989/. 3. Общим осложнением для больных РДСВ является фиброз легких. Во время острой стадии заболевания РДСВ ФНО в значительных количествах присутствует в бронхоальвеолярной жидкости. Термин “артрит” используется для описания различных симптомов, которые характеризуются хроническим воспалением суставов. Под определение термина “артрит” попадают следующие заболевания: ревматоидный артрит, остеоартрит, анкилозирующий спондилоартрит, волчанка обыкновенная эритематозная, гонококковый артрит, болезнь /триада/ Рейтера и подагра. Ниже приводятся данные, свидетельствующие о том, что ФНО является посредником при ревматоидном артрите. Ревматоидный артрит является хроническим аутоиммунным заболеванием, вызывающим разрушение суставного хряща в суставах. Синовиальная выстилка находится в хронически воспаленном состоянии и подвергается прогрессирующему фиброзному развитию. ФНО активизирует и эндотелий и лейкоциты с тем, чтобы вызвать адгезию лейкоцитов, стимулирует резорбцию и ингибирует синтез протеогликанов в хрящах. Смотри: J. R. Gamble et al., Proc. Natl. Acad. Sci USA, т. 82, с. 8667-8673 /1985/; J.Saklatvala, Nature, т. 322, с. 547-552 /1986/. Эта активность in vitro определенно наводит на мысль, что ФНО может быть посредником патологии суставов при ревматоидном артрите. Ниже приводятся данные, поддерживающие мнение, что ФНО является посредником при ревматоидном артрите: 1. Внутрисуставное введение ФНО в сустав кролика вызывает инфильтрацию лейкоцитов в сустав при отсутствии потери протеогликанов из хряща. Введение почти максимальных доз ФНО и интерлейкина-1 /ИЛ-1/ в сустав вызывало синергическое накопление нейтрофилов. Смотри: B.Henderson et al., Clin. Exp. Immunol, т. 75, с. 306-310 /1989/. В противоположность этому, в другой серии экспериментов на кроликах одно внутрисуставное введение ФНО  вызвало как клеточную инфильтрацию, так и потерю протеогликанов хряща. Уровни содержания вещества P, вызывающего воспаление нейропептида, оказались повышенными в синовиальной жидкости. Смотри: A.S. Rubin et al., Arthritis and Rheumatism, т. 33, с. 1023-1028 /1990/.
2. У больных ревматоидным артритом определяли воздействие ФНО антител на продуцирование синовиальной клетки ИЛ-1. Культуры мононуклеарных клеток, выделенные из синовиального слоя или из синовиальной жидкости ревматоидных суставов, продуцируют цитокины вплоть до 6 дней без внешней стимуляции. У больных ревматоидным артритом продуцирование синовиальной клетки ИЛ-1 в культуре было значительно уменьшено с помощью анти-ФНО антитела. Эти результаты наводят на мысль, что ФНО играет центральную роль в индуцировании ИЛ-1 в ревматоидных суставах. Смотри: F.M. Brennan et al., Lancet, т. 2 /8657/, с. 244-247 /1989/.
3. Выявляемые уровни ФНО присутствуют в синовиальной жидкости при ревматоидном артрите. Смотри: F.S.Di Giovine et al., Ann Rheum. Dis., т. 47, с. 768-776 /1988/.
Идиопатическое воспалительное заболевание кишечника /ВЗК/ включает два симптомокомплекса: неспецифический язвенный колит и болезнь Крона /гранулематозная болезнь/. Болезнь Крона характеризуется гранулематозной воспалительной реакцией, захватывающей всю толщину стенки окончания подвздошной кишки или толстой кишки, в то время как язвенный колит представляет собой неспецифическую воспалительную ответную реакцию, ограниченную слизистой оболочкой и подслизистой основой толстой кишки. Хотя существуют различия в патологии этих двух синдромов, а этиология их обоих остается неясной, существует мнение, что эти два заболевания представляют изменчивый тканевый или иммунологический ответ на воздействие общего этиологического фактора. У больных ВЗК был обнаружен широкий круг иммунологических нарушений. Одна гипотеза состоит в том, что иммунная система пациентов реагирует аномально или несоответствующим образом на антигены, как, например, бактериальные продукты, воздействию которых обычно подвержен каждый. Синтез высоких уровней ФНО в кишке может способствовать образованию воспалительной клеточной инфильтрации при ВЗК. Нижеприведенные сведения поддерживают предположение, что ФНО является посредником ВЗК: вызвало как клеточную инфильтрацию, так и потерю протеогликанов хряща. Уровни содержания вещества P, вызывающего воспаление нейропептида, оказались повышенными в синовиальной жидкости. Смотри: A.S. Rubin et al., Arthritis and Rheumatism, т. 33, с. 1023-1028 /1990/.
2. У больных ревматоидным артритом определяли воздействие ФНО антител на продуцирование синовиальной клетки ИЛ-1. Культуры мононуклеарных клеток, выделенные из синовиального слоя или из синовиальной жидкости ревматоидных суставов, продуцируют цитокины вплоть до 6 дней без внешней стимуляции. У больных ревматоидным артритом продуцирование синовиальной клетки ИЛ-1 в культуре было значительно уменьшено с помощью анти-ФНО антитела. Эти результаты наводят на мысль, что ФНО играет центральную роль в индуцировании ИЛ-1 в ревматоидных суставах. Смотри: F.M. Brennan et al., Lancet, т. 2 /8657/, с. 244-247 /1989/.
3. Выявляемые уровни ФНО присутствуют в синовиальной жидкости при ревматоидном артрите. Смотри: F.S.Di Giovine et al., Ann Rheum. Dis., т. 47, с. 768-776 /1988/.
Идиопатическое воспалительное заболевание кишечника /ВЗК/ включает два симптомокомплекса: неспецифический язвенный колит и болезнь Крона /гранулематозная болезнь/. Болезнь Крона характеризуется гранулематозной воспалительной реакцией, захватывающей всю толщину стенки окончания подвздошной кишки или толстой кишки, в то время как язвенный колит представляет собой неспецифическую воспалительную ответную реакцию, ограниченную слизистой оболочкой и подслизистой основой толстой кишки. Хотя существуют различия в патологии этих двух синдромов, а этиология их обоих остается неясной, существует мнение, что эти два заболевания представляют изменчивый тканевый или иммунологический ответ на воздействие общего этиологического фактора. У больных ВЗК был обнаружен широкий круг иммунологических нарушений. Одна гипотеза состоит в том, что иммунная система пациентов реагирует аномально или несоответствующим образом на антигены, как, например, бактериальные продукты, воздействию которых обычно подвержен каждый. Синтез высоких уровней ФНО в кишке может способствовать образованию воспалительной клеточной инфильтрации при ВЗК. Нижеприведенные сведения поддерживают предположение, что ФНО является посредником ВЗК:1/ В двух проведенных на крысах исследованиях некроз желудочно-кишечного тракта индуцировался путем внутривенного введения болюса ФНО. Воздействие ФНО представляется связанным с величиной дозы. Дозы, превышающие 0,6 мг/кг индуцировали макроскопический и микроскопический некроз тонкой кишки. На кишке была видна сегментная ишемия с участками выраженного кровоизлияния или некроза. Слепая кишка представляется наиболее чувствительной к воздействию ФНО. Гистологические срезы не пораженных некрозом участков кишечника также показали воспалительные изменения с поражением подслизистой основы и слизистой оболочки нейтрофильными лейкоцитами. Эпителий был оголен отдельными очагами по всему кишечнику. Смотри: X.M. Sun et al., J. Clin. Invest, т. 81, с. 1328-1331 /1988/; и K. J. Tracey, et al., Science, т.234, с. 470-474 /1986/. 2/ В исследовании Tracey введение 4 мг нейтрализующего мышь моноклонального антитела, направленного против ФНО человека, крысам за один час перед введением ФНО не только полностью защитило животных от смертельных доз ФНО, но также предотвратило развитие патологических изменений, обычно индуцируемых ФНО. 3/ Взятые у детей, больных болезнью Крона, пробы на биопсию показали увеличение частоты секретирования клеток ФНО у всех лиц, обследованных методом твердофазного иммуноферментного анализа /EII A/ Пробы, взятые у обычных детей, не показали этого увеличения. У четверых из восьми детей, больных язвенным колитом, было обнаружено повышенное продуцирование ФНО. Эти результаты говорят о том, что ФНО является важным посредником воспалительных процессов в кишке человека. Сморти: T.T. MacDonald et. al., Clin. Exp. Immunol., (England), т. 81, с. 301-305 /1990/. Септический шок является состоянием, связанным с массовой бактериальной инвазией. Обычно считается, что развитию шока вследствие грамотрицательных инфекций способствует, по крайней мере частично, присутствие бактериальных эндотоксинов /липополисахаридов/. Септический шок является относительно распространенной причиной смертности в больницах. В настоящее время существует несколько вариантов лечения пациентов, страдающих от септического шока, и, обычно, доступные варианты лечения являются по своей сути поддерживающими. Септический шок характеризуется различными симптомами, включая снижение среднего артериального давления /MAP/, уменьшение минутного сердечного выброса, тахикардию, тазипноэ, лактацидемию и лейко/цито/пению. В опосредование септического шока были вовлечены различные цитокины, включая ФНО, хотя этиология заболевания до конца не понятна. Существует несколько свидетельств, говорящих о том, что ФНО может играть роль в опосредовании септического шока: 1. Для индуцирования шокоподобного состояния у животных, им был введен ФНО. Смотри: Everhaerdt et al., Biochem, Biophus. Res. Commun, т. 163, с. 378 /1989/. Было показано, что введение липополисахаридов мышам имитирует симптомы септического шока у животных. Было обнаружено, что у обработанных таким образом животных повысились уровни ФНО в крови. Смотри: Parillo et al. , Ann Inter Med. , т. 9, с. 28-31 /1988/; и Carswell et al., Proc. Natl. Acad. Sci, USA, т. 72, с. 3666-3670 /1975/. 2. Было показано, что введение антител против ФНО уменьшает летальное воздействие больших доз эндотоксина у мышей и обезьян. Смотри: Tracey et al. , Nature, т. 330, с. 662-664 /1987/; Buetler et al., Science, т. 229, с. 869-871 /1985/. 3. Было также проведено дополнительное исследование, в котором сыворотка крови детей, страдающих грамотрицательной септицемией, анализировалась на определение в ней концентрации ФНО. Это исследование показало, что повышенные уровни ФНО были обнаружены у 91% обследованных пациентов. Помимо этого, уровни ФНО в сыворотке крови были значительно выше у тех больных, которые умерли, по сравнению с выжившими. Смотри: Firrardin et al., New Englang J. of Med., т. 319, с. 397-400 /1988/. Авторы изобретения были вынуждены предположить, что вещества, которые препятствуют деятельности ФНО, могут оказаться эффективными при лечении обусловленных ФНО заболеваний, как было сказано выше. Авторы настоящего изобретения определили класс соединений, называемых здесь ингибиторы ФНО, которые предупреждают и лечат обусловленные ФНО заболевания. В Европейской патентной заявке EP-A-0422339, признаки которой включены путем этой ссылки, описаны предпочтительный класс встречающихся в природе белковых ингибиторов ФНО и метод производства значительного количества этих веществ с высокой степенью чистоты. В частности, в вышеупомянутой заявке подробно описываются две подгруппы ингибиторов ФНО, которые упоминаются как 30 кДа ингибитор ФНО и 40 кДа ингибитор ФНО. Кроме непроцессированного белка 40 кДа ингибитора ФНО, были также получены две усеченные, однако биологически активные формы 40 кДа ингибитора ФНО. Непроцессированный 40 кДа ингибитор ФНО представляет собой ингибитор ФНО, имеющий молекулярную массу около 40 кДа на электрофорезе в полиакриламидном геле с натрия додецилсульфатом /SDS-PA GE/, который может быть выделен из среды, кондиционированной человеческими U937 клетками или из мочи человека. Непроцессированный 40 кДа ингибитор ФНО может быть гликозилирован как и встречающийся в природе белок; или негликозилирован как белок, рекомбинантно выдавленный из бактериальной экспрессионной системы. Усеченные белки, в которых 51 и 53 карбоксильные концы аминокислот были отщеплены от непроцессированного белка, упоминаются соответственно как 40 кДа ингибитор ФНО  51 и 40 кДа ингибитор ФНО 51 и 40 кДа ингибитор ФНО  53.
30 кДа ингибитор ФНО демонстрирует способность тормозить активность ФНО альфа. 40 кДа ингибиторы ФНО, включая непроцессированный 40 кДа ингибитор ФНО, 40 кДа ингибитор ФНО 53.
30 кДа ингибитор ФНО демонстрирует способность тормозить активность ФНО альфа. 40 кДа ингибиторы ФНО, включая непроцессированный 40 кДа ингибитор ФНО, 40 кДа ингибитор ФНО  51 и 40 кДа ингибитор ФНО 51 и 40 кДа ингибитор ФНО  53, демонстрируют способность тормозить активность как ФНО альфа, так и ФНО бета.
В EP-A-0422339 на странице 32, строки 49-51 описывается ряд модифицированных образцов ингибитора ФНО. Мутеины ингибиторов ФНО получают путем замены выбранного/ных/ радикала/лов/ аминокислоты на радикалы цистеина. Эти мутеины могут быть затем сайт-селективно прореагированы с функциональными единицами полиэтиленгликоля /ПЭГ/ с тем, чтобы дать ПЭГ разновидность ингибитора ФНО. В частности, описывается мутеин 30 кДа ингибитора, который называется в тексте Ц105, в котором аспарагин в положении 105 30 кДа ингибитора ФНО замещается цистеином. В другом варианте настоящего изобретения мутеиновые белки могут реагировать с бифункциональными единицами ПЭГ с тем, чтобы образовать двухвалентную разновидность “гантели”, в которой два мутеина ингибитора ФНО присоединены одиночной ПЭГ цепью.
Настоящее изобретение раскрывает методы профилактики и лечения обусловленных ФНО заболеваний путем введения нуждающимся больным терапевтического средства. В частности, настоящее изобретение предлагает метод лечения обусловленного ФНО септического шока путем введения нуждающимся пациентам терапевтического средства. Также содержатся методы лечения обусловленного ФНО артрита и обусловленного ФНО респираторного дистресс-синдрома взрослых путем введения нуждающимся пациентам терапевтического средства.
В соответствии с настоящим изобретением раскрываются методы лечения и профилактики обусловленных ФНО заболеваний, в частности обусловленного ФНО септического шока, обусловленного ФНО артрита и обусловленного ФНО респираторного дистресс-синдрома взрослых с помощью эффективных количеств ингибиторов ФНО.
Предлагаемые настоящим изобретением ингибиторы ФНО представляют собой встречающиеся в природе белки, а также усеченные формы встречающихся в природе белков. Естественно встречающиеся белки являются предпочтительными потому, что они дают относительно низкий риск возникновения непредсказуемых побочных осложнений у проходящих лечение пациентов. В некоторых вариантах настоящего изобретения предлагаются также ингибиторы ФНО, в которых мутеины белка ингибиторов ФНО отличались от естественной белковой последовательности только незначительным количеством аминокислотных остатков.
Предлагаемым классом ингибиторов ФНО являются человеческие связывающие ФНО белки. Предлагаемые ингибиторы ФНО по-видимому должны быть растворимыми фрагментами рецепторных белков ФНО. Предлагаемые для практического применения ингибиторы ФНО выбраны из группы, включающей 30 кДа ингибитор ФНО и 40 кДа ингибитор ФНО, причем заявленный ингибитор 40 кДа далее выбран из группы, состоящей из непроцессированного 40 кДа ингибитора ФНО, 40 кДа ингибитора ФНО 53, демонстрируют способность тормозить активность как ФНО альфа, так и ФНО бета.
В EP-A-0422339 на странице 32, строки 49-51 описывается ряд модифицированных образцов ингибитора ФНО. Мутеины ингибиторов ФНО получают путем замены выбранного/ных/ радикала/лов/ аминокислоты на радикалы цистеина. Эти мутеины могут быть затем сайт-селективно прореагированы с функциональными единицами полиэтиленгликоля /ПЭГ/ с тем, чтобы дать ПЭГ разновидность ингибитора ФНО. В частности, описывается мутеин 30 кДа ингибитора, который называется в тексте Ц105, в котором аспарагин в положении 105 30 кДа ингибитора ФНО замещается цистеином. В другом варианте настоящего изобретения мутеиновые белки могут реагировать с бифункциональными единицами ПЭГ с тем, чтобы образовать двухвалентную разновидность “гантели”, в которой два мутеина ингибитора ФНО присоединены одиночной ПЭГ цепью.
Настоящее изобретение раскрывает методы профилактики и лечения обусловленных ФНО заболеваний путем введения нуждающимся больным терапевтического средства. В частности, настоящее изобретение предлагает метод лечения обусловленного ФНО септического шока путем введения нуждающимся пациентам терапевтического средства. Также содержатся методы лечения обусловленного ФНО артрита и обусловленного ФНО респираторного дистресс-синдрома взрослых путем введения нуждающимся пациентам терапевтического средства.
В соответствии с настоящим изобретением раскрываются методы лечения и профилактики обусловленных ФНО заболеваний, в частности обусловленного ФНО септического шока, обусловленного ФНО артрита и обусловленного ФНО респираторного дистресс-синдрома взрослых с помощью эффективных количеств ингибиторов ФНО.
Предлагаемые настоящим изобретением ингибиторы ФНО представляют собой встречающиеся в природе белки, а также усеченные формы встречающихся в природе белков. Естественно встречающиеся белки являются предпочтительными потому, что они дают относительно низкий риск возникновения непредсказуемых побочных осложнений у проходящих лечение пациентов. В некоторых вариантах настоящего изобретения предлагаются также ингибиторы ФНО, в которых мутеины белка ингибиторов ФНО отличались от естественной белковой последовательности только незначительным количеством аминокислотных остатков.
Предлагаемым классом ингибиторов ФНО являются человеческие связывающие ФНО белки. Предлагаемые ингибиторы ФНО по-видимому должны быть растворимыми фрагментами рецепторных белков ФНО. Предлагаемые для практического применения ингибиторы ФНО выбраны из группы, включающей 30 кДа ингибитор ФНО и 40 кДа ингибитор ФНО, причем заявленный ингибитор 40 кДа далее выбран из группы, состоящей из непроцессированного 40 кДа ингибитора ФНО, 40 кДа ингибитора ФНО  51 и 40 кДа ингибитора ФНО 51 и 40 кДа ингибитора ФНО  53. Также предлагаются белки, которые были модифицированы, например, полиэтиленгликолем /ПЭГ/ или любым другим полимером, чтобы увеличить период их полураспада в крови и/или снизить иммуногенность. Ингибиторы ФНО, действующие как рецепторы антагонисты ФНО также включены в объем настоящего изобретения.
Несмотря на то, что ингибиторы ФНО могут быть получены из естественных доступных источников, например из человеческой мочи, путем экстрагирования, предлагаемым методом производства ингибиторов ФНО является метод рекомбинантных ДНК. Метод рекомбинантных ДНК является предпочтительным отчасти потому, что он дает возможность получения сравнительно больших количеств ингибиторов ФНО с большей степенью чистоты.
Дополнительные предлагаемые ингибиторы ФНО включают мутеины 30 кДа ингибиторов ФНО, в которых отобранные аминокислоты 30 кДа ингибиторов ФНО замещены цистеином. Эти мутеины могут быть использованы как ингибиторы ФНО или они могут быть прореагированы с полиэтиленгликолем /ПЭГ/ с тем, чтобы образовать ингибирующие ФНО ПЭГ соединения, содержащие один или два ингибитора ФНО на молекулу. В наиболее предпочтительном варианте настоящего изобретения ингибитором ФНО является двухвалентная разновидность, образовавшаяся в результате реакции между мутеином 30 кДа ингибитора ФНО и бифункциональным ПЭГ предшественником. Предлагаемым мутеином является Ц105 30 кДа ингибитор ФНО, в котором радикал 105 30 кДа ингибитора ФНО замещен радикалом цистеина.
Следует понимать, что оба предшествующие общие описания являются иллюстративными и пояснительными и не являются ограничительными по отношению к формуле изобретения.
На фиг. 1 изображены показатели смертности как функция дозы человеческого рекомбинантного интерлейкина-1 бета /чрИЛ-1 53. Также предлагаются белки, которые были модифицированы, например, полиэтиленгликолем /ПЭГ/ или любым другим полимером, чтобы увеличить период их полураспада в крови и/или снизить иммуногенность. Ингибиторы ФНО, действующие как рецепторы антагонисты ФНО также включены в объем настоящего изобретения.
Несмотря на то, что ингибиторы ФНО могут быть получены из естественных доступных источников, например из человеческой мочи, путем экстрагирования, предлагаемым методом производства ингибиторов ФНО является метод рекомбинантных ДНК. Метод рекомбинантных ДНК является предпочтительным отчасти потому, что он дает возможность получения сравнительно больших количеств ингибиторов ФНО с большей степенью чистоты.
Дополнительные предлагаемые ингибиторы ФНО включают мутеины 30 кДа ингибиторов ФНО, в которых отобранные аминокислоты 30 кДа ингибиторов ФНО замещены цистеином. Эти мутеины могут быть использованы как ингибиторы ФНО или они могут быть прореагированы с полиэтиленгликолем /ПЭГ/ с тем, чтобы образовать ингибирующие ФНО ПЭГ соединения, содержащие один или два ингибитора ФНО на молекулу. В наиболее предпочтительном варианте настоящего изобретения ингибитором ФНО является двухвалентная разновидность, образовавшаяся в результате реакции между мутеином 30 кДа ингибитора ФНО и бифункциональным ПЭГ предшественником. Предлагаемым мутеином является Ц105 30 кДа ингибитор ФНО, в котором радикал 105 30 кДа ингибитора ФНО замещен радикалом цистеина.
Следует понимать, что оба предшествующие общие описания являются иллюстративными и пояснительными и не являются ограничительными по отношению к формуле изобретения.
На фиг. 1 изображены показатели смертности как функция дозы человеческого рекомбинантного интерлейкина-1 бета /чрИЛ-1 /, вводившегося постоянной дозой, равной 300 мк/кг человеческого рекомбинантного фактора опухолевого некроза альфа /чрФНО /, вводившегося постоянной дозой, равной 300 мк/кг человеческого рекомбинантного фактора опухолевого некроза альфа /чрФНО /. Группе мышей, состоящей из 6 особей, вводили различные количества чрИЛ-1 /. Группе мышей, состоящей из 6 особей, вводили различные количества чрИЛ-1 . Смертность оценивалась через 72 ч. после подкожной инъекции смеси цитокина. Представленные значения являются средними плюс/минус средняя квадратичная ошибка /S.E.M./ для трех экспериментов.
На фиг. 2 поверхностная температура представлена как функция времени после введения 300 мг/кг чрФНО . Смертность оценивалась через 72 ч. после подкожной инъекции смеси цитокина. Представленные значения являются средними плюс/минус средняя квадратичная ошибка /S.E.M./ для трех экспериментов.
На фиг. 2 поверхностная температура представлена как функция времени после введения 300 мг/кг чрФНО и 2500 мкг/кг чрИЛ-1 и 2500 мкг/кг чрИЛ-1 , введенных подкожно в нулевой момент времени.
На фиг. 3 представлена поверхностная температура как функция времени, так же как и на фиг. 2, где , введенных подкожно в нулевой момент времени.
На фиг. 3 представлена поверхностная температура как функция времени, так же как и на фиг. 2, где 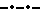 представляет данные о мышах, которым внутрибрюшинно ввели две дозы 40 кДа ингибитора ФНО представляет данные о мышах, которым внутрибрюшинно ввели две дозы 40 кДа ингибитора ФНО  53: за 30 мин и через 30 мин после подкожного введения смеси цитокина. Общее количество введенного 40 кДа ингибитора ФНО 53: за 30 мин и через 30 мин после подкожного введения смеси цитокина. Общее количество введенного 40 кДа ингибитора ФНО  53 составило 200 мг/кг. * обозначает статистически значимую разницу между данными, полученными от мышей, которым вводили цитокин и которым не вводили цитокин, причем и тем и другим был введен ингибитор ФНО, статистическая разница оценивалась с помощью критерия Стьюдента /p < 0,05/.
На фиг. 4 смертность представлена как функция времени в эксперименте, отображенном на фиг. 3.
На фиг. 5 поверхностная температура представлена как функция времени, как и на фиг. 2, где 53 составило 200 мг/кг. * обозначает статистически значимую разницу между данными, полученными от мышей, которым вводили цитокин и которым не вводили цитокин, причем и тем и другим был введен ингибитор ФНО, статистическая разница оценивалась с помощью критерия Стьюдента /p < 0,05/.
На фиг. 4 смертность представлена как функция времени в эксперименте, отображенном на фиг. 3.
На фиг. 5 поверхностная температура представлена как функция времени, как и на фиг. 2, где 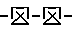 отображает данные о мышах, которым внутрибрюшинно ввели шесть доз 40 кДа ингибитор ФНО отображает данные о мышах, которым внутрибрюшинно ввели шесть доз 40 кДа ингибитор ФНО  53 за 30 мин до введения смеси цитокина и через 30 мин, 3 ч, 6 ч, 9 ч, и 12 ч после введения этой смеси. Общее количество введенного 40 кДа ингибитора ФНО 53 за 30 мин до введения смеси цитокина и через 30 мин, 3 ч, 6 ч, 9 ч, и 12 ч после введения этой смеси. Общее количество введенного 40 кДа ингибитора ФНО  53 составило 600 мг/кг. * обозначает статистически значимую разницу в данных о мышах, которым вводили ингибитор ФНО и которым вводили фосфатно-буферный раствор /PBS/, полученную с помощью непарного критерия Стьюдента /p < 0,001/.
На фиг. 6 изображена смертность как функция времени в эксперименте, представленном на фиг. 5.
На фиг. 7 поверхностная температура, как и на фиг. 2, представлена как функция времени, где 53 составило 600 мг/кг. * обозначает статистически значимую разницу в данных о мышах, которым вводили ингибитор ФНО и которым вводили фосфатно-буферный раствор /PBS/, полученную с помощью непарного критерия Стьюдента /p < 0,001/.
На фиг. 6 изображена смертность как функция времени в эксперименте, представленном на фиг. 5.
На фиг. 7 поверхностная температура, как и на фиг. 2, представлена как функция времени, где 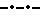 представляет данные о мышах, которым внутрибрюшинно ввели десять доз 40 кДа ингибитора ФНО представляет данные о мышах, которым внутрибрюшинно ввели десять доз 40 кДа ингибитора ФНО  53 за 30 мин до подкожного введения смеси цитокина и через 30 мин, 3 ч, 6 ч, 9 ч, 12 ч, 15 ч, 18 и 24 ч после введения этой смеси. Общее количество введенного 40 кДа ингибитора ФНО 53 за 30 мин до подкожного введения смеси цитокина и через 30 мин, 3 ч, 6 ч, 9 ч, 12 ч, 15 ч, 18 и 24 ч после введения этой смеси. Общее количество введенного 40 кДа ингибитора ФНО  53 составило 1000 мг/кг.
На фиг. 8 изображена смертность как функция времени в эксперименте, представленном на фиг. 7.
На фиг. 9 представлен вес тела животных как функция времени в эксперименте, отображенном на фиг. 7.
На фиг. 10 поверхностная температура, как и на фиг. 2, представлена как функция времени, где 53 составило 1000 мг/кг.
На фиг. 8 изображена смертность как функция времени в эксперименте, представленном на фиг. 7.
На фиг. 9 представлен вес тела животных как функция времени в эксперименте, отображенном на фиг. 7.
На фиг. 10 поверхностная температура, как и на фиг. 2, представлена как функция времени, где 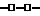 представляет данные о мыши, которой внутрибрюшинно ввели 6 доз 30 кДа ингибитора ФНО за 30 мин до подкожного введения смеси цитокина, через 30 мин, через 3 ч, через 6 ч и далее через 9 и 12 ч после введения смеси /всего 240 мг/кг/; представляет данные о мыши, которой внутрибрюшинно ввели 6 доз 30 кДа ингибитора ФНО за 30 мин до подкожного введения смеси цитокина, через 30 мин, через 3 ч, через 6 ч и далее через 9 и 12 ч после введения смеси /всего 240 мг/кг/;  представляет данные о мыши, которой внутрибрюшинно ввели 10 доз 30 кДа ингибитора ФНО за 30 мин до подкожного введения смеси цитокина, через 30 мин, через 3 ч, и далее через 6 ч, 9 ч, 12 ч, 15 ч, 18 ч, 21 и 24 ч после введения смеси цитокина /всего 400 мг/кг/; и представляет данные о мыши, которой внутрибрюшинно ввели 10 доз 30 кДа ингибитора ФНО за 30 мин до подкожного введения смеси цитокина, через 30 мин, через 3 ч, и далее через 6 ч, 9 ч, 12 ч, 15 ч, 18 ч, 21 и 24 ч после введения смеси цитокина /всего 400 мг/кг/; и  представляет данные о мыши, которой внутрибрюшинно ввели 15 доз 30 кДа ингибитора ФНО, первая доза была введена за 30 мин до подкожного введения смеси цитокина, остальные дозы были введены через 30 мин, через 3 ч и далее через 6 ч, 9 ч, 12 ч, 15 ч, 18 ч, 21 ч, 24 ч, 27 ч, 33 ч, 36 и 39 ч после введения смеси цитокина /всего 600 мг/кг/.
На фиг. 11 смертность представлена как функция времени в эксперименте, изображенном на фиг. 10.
На фиг. 12 представлен вес тела животных как функция времени в эксперименте, изображенном на фиг. 10.
На фиг. 13 представлено увеличение диаметра сустава как функция времени после реактивации стрептококковой клеточной оболочкой /SCW/ на 21 день в соответствии с описанным ниже в примере 3 методом 1.
На фиг. 14 изображено максимальное изменение диаметра сустава в течение 72 ч после реактивации стрептококковой клеточной оболочкой /СКО/ в эксперименте, представленном на фиг. 13. * обозначает статистически значимую разницу при сравнении с ПЭГ 3400 контрольной группой с помощью непарного критерия Стьюдента t = 4,36, p < 0,001.
На фиг. 15 изображено максимальное изменение диаметра сустава в течение 72 ч после реактивации СКО в соответствии с описанным ниже в примере 3 методом 2.
На фиг. 16 изображено выраженное в процентах торможение стимулированного эндотоксином нейтрофильного вливания в бронхоальвеолярные промежутки введением 30 кДа ингибитора ФНО – эксперимент проводился на крысах, как это описано ниже в примере 4.
На фиг. 17 изображено следствие воздействия внутритрахеальной инстилляции 5 доз 30 кДа ингибитора ФНО на несколько нейтрофилов, перемещающихся в альвеолярные промежутки в ответ на эндотоксинный стимул в эксперименте, представленном на фиг. 16. * обозначает статистически значимую разницу с необработанной контрольной группой крыс, определенную с помощью непарного критерия Стьюдента, p < 0,01.
Теперь будет дано подробное описание предлагаемых настоящим изобретением вариантов его применения, что вместе с нижеследующими примерами поможет объяснить принципы настоящего изобретения.
Как отмечалось выше, настоящее изобретение относится к методам профилактики и лечения обусловленных ФНО заболеваний у больных, страдающих от этих заболеваний. Этот метод включает введение терапевтически эффективного количества ингибитора ФНО больному, страдающему обусловленным ФНО заболеванием. Несмотря на то, что главная цель настоящего изобретения состоит в том, чтобы предложить методы профилактики и лечения заболеваний у человека, приведенное здесь описание изобретения дает указания относительно общего использования, и использование в области ветеринарии также включено в объем настоящего изобретения.
Заболевание, или медицинский симптом, должно рассматриваться как обусловленное ФНО, если естественное или экспериментально вызванное заболевание связано с повышением уровней ФНО в жидкостях тела или в тканях, прилегающих к очагу заболевания или симптома внутри тела. Обусловленные ФНО заболевания могут быть также распознаны по следующим двум симптомам: 1/ сопровождающие заболевание патологические симптомы могут быть имитированы экспериментально на животных путем введения им ФНО; и 2/ патология, индуцированная на экспериментальных животных моделях заболевания может быть подавлена или ликвидирована с помощью лечения средствами, которые ингибируют действие ФНО. Многие из обусловленных ФНО заболеваний удовлетворяют два из этих трех условий, а другие удовлетворяют все три условия. Неполный список обусловленных ФНО заболеваний включает респираторный дистресс-синдром взрослых, фиброз легких, артрит, воспаление кишечника и септический шок.
В одном варианте настоящего изобретения предлагаемыми ингибиторами ФНО являются естественно встречающиеся белки, которые выступают в роли белков, связывающих ФНО. Естественно встречающиеся белки являются предпочтительными потому, что они дают относительно низкий риск возникновения непредсказуемых или нежелательных физиологических побочных осложнений у проходящих лечение пациентов.
В описании изобретения и в формуле изобретения белок считается “естественно встречающимся”, если он или в значительной степени равноценный ему белок может быть обнаружен нормально существующим в организмах здоровых людей. “Естественно встречающиеся” белки определенно включают формы белков, существующие в организме здорового человека, которые являются частично усеченными на карбоксильном конце, а также негликозилированная форма белков, которая существует в гликозилированном виде в организме здорового человека. “Естественно встречающиеся” белки могут быть получены методом рекомбинантных ДНК, а также путем изоляции из клеток, которые их обычно продуцируют. Термин “естественно встречающиеся” белки также охватывает белки, которые содержат N-концевые метионильные группы, как результат экспрессии в E.Coli.
Термин “в значительной степени равноценный”, так как он используется в описании изобретения и в формуле изобретения, означает обладающий очень высокой степенью остаточной гомологии аминокислот /Смотри: M.Dayhoff, Atlas of Protein Seguence and Structure, т. 5, с. 124 /1972/, Национальный фонд по биомедицинским исследованиям, Вашингтон, О.К., признаки которого включены сюда путем ссылки/, а также обладающий сравнимой биологической активностью.
Среди предлагаемых настоящим изобретением ингибиторов ФНО есть естественно встречающиеся белки, которые существуют in vivo, как связывающие белки ФНО, которые известны из рассматриваемой в настоящее время патентной заявки США. Эта заявка является патентной заявкой США N 07/555274, поданной 19 июля 1990 г., которая озаглавлена “ингибитор фактора опухолевого некроза /ФНО/ и метод его получения”.
Существуют две различные формы предлагаемых ингибиторов ФНО, каждая из которых раскрыта и описана в упоминавшейся выше заявке Brewer et al. Первая из них является 30 кДа ингибитором ФНО, которая была определена и выделена из среды, кондиционированной человеческими U937 клетками и из мочи человека. Ингибитор 30 кДа является приближенно 30 кДа на электрофорезе в полиакриламидном геле с натрия додецилсульфатом /SDS-PAGE/ и элюируется из диэтиламиноэтил CL6B колонки в приблизительно 80 миллимолярном растворе хлорида натрия в трис-буферном растворе, pH 7,5. Было показано, что 30 кДа ингибитор ФНО подавляет активность ФНО альфа и оказывает незначительное воздействие на активность ФНО бета. Естественно встречающийся белок гликозилируется. Негликозилированный 30 кДа ингибитор ФНО также демонстрирует ингибирующую ФНО активность.
Второй формой предлагаемых ингибиторов ФНО является 40 кДа ингибитор ФНО, который также был определен и выделен из среды, кондиционированной человеческими U937 клетками и из мочи человека. Ингибитор 40 кДа является приближенно 40 кДа на электрофорезе в полиакриламидном геле с натрия додецилсульфатом /SDS-PAGE/, и элюируется из диэтиламиноэтиловой колонки в приблизительно 100 миллимолярном растворе хлорида натрия в трис буферном растворе, pH 7,5. Было показано, что 40 кДа ингибитор ФНО подавляет активность как ФНО альфа, так и ФНО бета. 40 кДа ингибитор ФНО является также гликопротеином и, опять, негликозилированный белок демонстрирует ингибирующую ФНО активность.
Нуклеинокислотная последовательность генов, кодирующая как 30 кДа ингибитор ФНО, так и 40 кДа ингибитор ФНО, а также аминокислотная последовательность обоих белков приводится в заявке Brewer et al. Настоящее изобретение включает негликозилированные формы ингибиторов ФНО, а также определенные усеченные формы естественно встречающихся белков, описанных ниже. В другом варианте настоящего изобретения ингибиторы ФНО модифицированы присоединением одного или более полиэтиленгликолевого /ПЭГ/ или другого повторяющегося полимерного звена.
Три формы 40 кДа ингибитора ФНО были продуцированы путем экспрессии в E. Coli. Каждая из этих форм, указываемые здесь как непроцессированный 40 кДа ингибитор ФНО, 40 кДа ингибитор ФНО представляет данные о мыши, которой внутрибрюшинно ввели 15 доз 30 кДа ингибитора ФНО, первая доза была введена за 30 мин до подкожного введения смеси цитокина, остальные дозы были введены через 30 мин, через 3 ч и далее через 6 ч, 9 ч, 12 ч, 15 ч, 18 ч, 21 ч, 24 ч, 27 ч, 33 ч, 36 и 39 ч после введения смеси цитокина /всего 600 мг/кг/.
На фиг. 11 смертность представлена как функция времени в эксперименте, изображенном на фиг. 10.
На фиг. 12 представлен вес тела животных как функция времени в эксперименте, изображенном на фиг. 10.
На фиг. 13 представлено увеличение диаметра сустава как функция времени после реактивации стрептококковой клеточной оболочкой /SCW/ на 21 день в соответствии с описанным ниже в примере 3 методом 1.
На фиг. 14 изображено максимальное изменение диаметра сустава в течение 72 ч после реактивации стрептококковой клеточной оболочкой /СКО/ в эксперименте, представленном на фиг. 13. * обозначает статистически значимую разницу при сравнении с ПЭГ 3400 контрольной группой с помощью непарного критерия Стьюдента t = 4,36, p < 0,001.
На фиг. 15 изображено максимальное изменение диаметра сустава в течение 72 ч после реактивации СКО в соответствии с описанным ниже в примере 3 методом 2.
На фиг. 16 изображено выраженное в процентах торможение стимулированного эндотоксином нейтрофильного вливания в бронхоальвеолярные промежутки введением 30 кДа ингибитора ФНО – эксперимент проводился на крысах, как это описано ниже в примере 4.
На фиг. 17 изображено следствие воздействия внутритрахеальной инстилляции 5 доз 30 кДа ингибитора ФНО на несколько нейтрофилов, перемещающихся в альвеолярные промежутки в ответ на эндотоксинный стимул в эксперименте, представленном на фиг. 16. * обозначает статистически значимую разницу с необработанной контрольной группой крыс, определенную с помощью непарного критерия Стьюдента, p < 0,01.
Теперь будет дано подробное описание предлагаемых настоящим изобретением вариантов его применения, что вместе с нижеследующими примерами поможет объяснить принципы настоящего изобретения.
Как отмечалось выше, настоящее изобретение относится к методам профилактики и лечения обусловленных ФНО заболеваний у больных, страдающих от этих заболеваний. Этот метод включает введение терапевтически эффективного количества ингибитора ФНО больному, страдающему обусловленным ФНО заболеванием. Несмотря на то, что главная цель настоящего изобретения состоит в том, чтобы предложить методы профилактики и лечения заболеваний у человека, приведенное здесь описание изобретения дает указания относительно общего использования, и использование в области ветеринарии также включено в объем настоящего изобретения.
Заболевание, или медицинский симптом, должно рассматриваться как обусловленное ФНО, если естественное или экспериментально вызванное заболевание связано с повышением уровней ФНО в жидкостях тела или в тканях, прилегающих к очагу заболевания или симптома внутри тела. Обусловленные ФНО заболевания могут быть также распознаны по следующим двум симптомам: 1/ сопровождающие заболевание патологические симптомы могут быть имитированы экспериментально на животных путем введения им ФНО; и 2/ патология, индуцированная на экспериментальных животных моделях заболевания может быть подавлена или ликвидирована с помощью лечения средствами, которые ингибируют действие ФНО. Многие из обусловленных ФНО заболеваний удовлетворяют два из этих трех условий, а другие удовлетворяют все три условия. Неполный список обусловленных ФНО заболеваний включает респираторный дистресс-синдром взрослых, фиброз легких, артрит, воспаление кишечника и септический шок.
В одном варианте настоящего изобретения предлагаемыми ингибиторами ФНО являются естественно встречающиеся белки, которые выступают в роли белков, связывающих ФНО. Естественно встречающиеся белки являются предпочтительными потому, что они дают относительно низкий риск возникновения непредсказуемых или нежелательных физиологических побочных осложнений у проходящих лечение пациентов.
В описании изобретения и в формуле изобретения белок считается “естественно встречающимся”, если он или в значительной степени равноценный ему белок может быть обнаружен нормально существующим в организмах здоровых людей. “Естественно встречающиеся” белки определенно включают формы белков, существующие в организме здорового человека, которые являются частично усеченными на карбоксильном конце, а также негликозилированная форма белков, которая существует в гликозилированном виде в организме здорового человека. “Естественно встречающиеся” белки могут быть получены методом рекомбинантных ДНК, а также путем изоляции из клеток, которые их обычно продуцируют. Термин “естественно встречающиеся” белки также охватывает белки, которые содержат N-концевые метионильные группы, как результат экспрессии в E.Coli.
Термин “в значительной степени равноценный”, так как он используется в описании изобретения и в формуле изобретения, означает обладающий очень высокой степенью остаточной гомологии аминокислот /Смотри: M.Dayhoff, Atlas of Protein Seguence and Structure, т. 5, с. 124 /1972/, Национальный фонд по биомедицинским исследованиям, Вашингтон, О.К., признаки которого включены сюда путем ссылки/, а также обладающий сравнимой биологической активностью.
Среди предлагаемых настоящим изобретением ингибиторов ФНО есть естественно встречающиеся белки, которые существуют in vivo, как связывающие белки ФНО, которые известны из рассматриваемой в настоящее время патентной заявки США. Эта заявка является патентной заявкой США N 07/555274, поданной 19 июля 1990 г., которая озаглавлена “ингибитор фактора опухолевого некроза /ФНО/ и метод его получения”.
Существуют две различные формы предлагаемых ингибиторов ФНО, каждая из которых раскрыта и описана в упоминавшейся выше заявке Brewer et al. Первая из них является 30 кДа ингибитором ФНО, которая была определена и выделена из среды, кондиционированной человеческими U937 клетками и из мочи человека. Ингибитор 30 кДа является приближенно 30 кДа на электрофорезе в полиакриламидном геле с натрия додецилсульфатом /SDS-PAGE/ и элюируется из диэтиламиноэтил CL6B колонки в приблизительно 80 миллимолярном растворе хлорида натрия в трис-буферном растворе, pH 7,5. Было показано, что 30 кДа ингибитор ФНО подавляет активность ФНО альфа и оказывает незначительное воздействие на активность ФНО бета. Естественно встречающийся белок гликозилируется. Негликозилированный 30 кДа ингибитор ФНО также демонстрирует ингибирующую ФНО активность.
Второй формой предлагаемых ингибиторов ФНО является 40 кДа ингибитор ФНО, который также был определен и выделен из среды, кондиционированной человеческими U937 клетками и из мочи человека. Ингибитор 40 кДа является приближенно 40 кДа на электрофорезе в полиакриламидном геле с натрия додецилсульфатом /SDS-PAGE/, и элюируется из диэтиламиноэтиловой колонки в приблизительно 100 миллимолярном растворе хлорида натрия в трис буферном растворе, pH 7,5. Было показано, что 40 кДа ингибитор ФНО подавляет активность как ФНО альфа, так и ФНО бета. 40 кДа ингибитор ФНО является также гликопротеином и, опять, негликозилированный белок демонстрирует ингибирующую ФНО активность.
Нуклеинокислотная последовательность генов, кодирующая как 30 кДа ингибитор ФНО, так и 40 кДа ингибитор ФНО, а также аминокислотная последовательность обоих белков приводится в заявке Brewer et al. Настоящее изобретение включает негликозилированные формы ингибиторов ФНО, а также определенные усеченные формы естественно встречающихся белков, описанных ниже. В другом варианте настоящего изобретения ингибиторы ФНО модифицированы присоединением одного или более полиэтиленгликолевого /ПЭГ/ или другого повторяющегося полимерного звена.
Три формы 40 кДа ингибитора ФНО были продуцированы путем экспрессии в E. Coli. Каждая из этих форм, указываемые здесь как непроцессированный 40 кДа ингибитор ФНО, 40 кДа ингибитор ФНО  51 и 40 кДа ингибитор ФНО 51 и 40 кДа ингибитор ФНО  53 /наряду с гликозилированным непроцессированным 40 кДа ингибитором ФНО, выделенным из среды, кондиционированной человеческими U937 клетками и из мочи человека, в гликозилированной и негликозилированной форме, все вместе они называются здесь 40 кДа ФНО/ описаны в заявке Brewer et al., 53 /наряду с гликозилированным непроцессированным 40 кДа ингибитором ФНО, выделенным из среды, кондиционированной человеческими U937 клетками и из мочи человека, в гликозилированной и негликозилированной форме, все вместе они называются здесь 40 кДа ФНО/ описаны в заявке Brewer et al.,  51 белок является усеченным вариантом природного /нативного/ белка, у которого на карбоксильном конце зрелого белка отщеплен 51 аминокислотный остаток. 51 белок является усеченным вариантом природного /нативного/ белка, у которого на карбоксильном конце зрелого белка отщеплен 51 аминокислотный остаток.  53 белок является усеченным вариантом зрелого белка, у которого на карбоксильном конце нативного белка 53 аминокислотных остатка. Естественно встречающийся 40 кДа ингибитор ФНО /гликозилированный/ и негликозилированные ингибиторы /нативные, 53 белок является усеченным вариантом зрелого белка, у которого на карбоксильном конце нативного белка 53 аминокислотных остатка. Естественно встречающийся 40 кДа ингибитор ФНО /гликозилированный/ и негликозилированные ингибиторы /нативные,  51 и 51 и  53/ обладают такой ингибирующей ФНО активностью.
Методы получения описанных Brewer et al. ингибиторов также раскрываются в упоминавшейся выше заявке. Один из описанных методов состоит в выделении ингибиторов из различных источников, как, например, моча человека или среда, кондиционированная человеческими U937 клетками. Второй описанный метод включает изолирование генов, ответственных за кодирование ингибиторов, клонирование гена в соответствующие векторы и виды клеток и экспрессию генов с целью продуцирования ингибиторов. Последний метод, который иллюстрирует метод рекомбинантных ДНК вообще, является предпочтительным методом, предлагаемым настоящим изобретением. Методы рекомбинантных ДНК являются предпочтительными отчасти потому, что они дают возможность получать сравнительно большие количества с большей степенью чистоты.
В объем настоящего изобретения включены также мутеины ингибиторов ФНО и мутеины, которые были модифицированы так, как это описано в патентной заявке США N 07/669862, поданной 15 марта 1991 года. Одним из предлагаемых мутеинов является 30 кДа ингибитор ФНО, у которого положение 105 занимает цистеин. Предпочтительным ПЭГилированным ингибитором ФНО является “гантелеобразная” разновидность, в которой два Ц105 30 кДа ингибитора ФНО присоединены к полиэтиленгликолевой /ПЭГ/ части. В самом предпочтительном варианте осуществления настоящего изобретения ПЭГ цепь имеет мол.м. 20000. Изготовление гантельного соединения описано ниже в примере 5.
Предпочтительно, чтобы вышеописанные ингибиторы ФНО производились с помощью приведенного выше способа в “по существу чистой” форме. Выражение “по существу чистая” подразумевает, что ингибитор, в немодифицированном виде, обладает сравнительно высокой удельной активностью. Следует, однако, признать, что производные ингибиторов ФНО могут иметь различную удельную активность. В предлагаемом варианте осуществления настоящего изобретения терапевтический состав, включающий по крайней мере один 30 кДа ингибитор ФНО или 40 кДа ингибитор ФНО, в действенном количестве вводится пациенту, страдающему обусловленным ФНО заболеванием.
Дополнительные ингибиторы ФНО включают соединения, способные конкурировать с ФНО за рецепторные места ФНО. Эти соединения включают рецепторные антагонисты. Другие ингибиторы ФНО включают соединения и белки, которые блокируют in vivo синтез или экстрацеллюлярное высвобождение ФНО. Эти соединения включают вещества, которые воздействуют на транскрипцию или трансляцию генов ФНО или процессинг предбелков ФНО.
Поскольку вероятно, что ингибирующая функция предлагаемых ингибиторов передается одной или более отдельных или отделяемых частей, то также предусматривается, что предлагаемый настоящим изобретением метод может осуществляться на практике путем введения терапевтического состава, активный ингредиент которого состоит из той части /или тех частей/ ингибитора, которая контролирует /или контролируют/ торможение ФНО.
Предлагаемый настоящим изобретением терапевтический состав предпочтительно вводится парентерально путем инъекции, хотя предусматриваются также другие действенные способы введения, как, например, внутрисуставная инъекция, аэрозоли для ингаляции, составы для орального приема, чрезкожный лекарственный электрофорез или суппозитории. Одним предлагаемым носителем является физиологический раствор, однако можно предположить, что другие фармацевтически приемлемые носители также могут быть использованы. В одном из предлагаемых вариантов осуществления настоящего изобретения предусматривается, что носитель и ингибитор ФНО образуют физиологически совместимый медленно высвобождающий состав. Основной растворитель в таком носителе может быть водным или неводным по природе. Помимо этого, носитель может содержать другие фармакологически приемлемые наполнители для изменения или поддержания pH, осмотического давления, вязкости, прозрачности, цвета, стерильности, стабильности, скорости растворения или запаха состава. Аналогичным образом носитель может содержать и другие фармакологически приемлемые наполнители для изменения или поддержания стабильности, скорости растворения, высвобождения или абсорбции ингибитора ФНО. Эти наполнители являются веществами, обычно используемыми при создании системы доз для парентерального введения или в виде унифицированной дозы, или в виде многодозовой формы.
После создания терапевтический состав может храниться в стерильных флаконах в виде раствора, суспензии, геля, эмульсии, твердого вещества или дегидратированного, или лиофилизированного порошка. Эти составы могут храниться или в готовом к употреблению виде, или в виде, требующем воссоздания формы непосредственно перед введением. Такие составы предлагаетсяе хранить при температуре не выше 4oC и предпочтительно при температуре -70oC. Также предлагается, чтобы такие составы, содержащие ингибитор ФНО, хранились и вводились при физиологических или близких к ним значениях pH. В настоящее время считается, что введение состава при высоком значении pH /например, более 8/ или при низком значении pH /например, менее 5/ является нежелательным.
Предпочтительным способом введения содержащих ингибитор ФНО составов при системном лечении является подкожный, внутримышечный, внутривенный, внутриносовой и вагинальный или ректальный суппозиторий. Предпочтительным способом введения содержащих ингибитор ФНО составов при локальном лечении является внутрисуставной, внутритрахеальный, или инстилляция, или ингаляции в дыхательные пути. Помимо этого может быть желательным введение ингибитора ФНО в определенные участки пищеварительного тракта или путем орального введения ингибитора ФНО с помощью соответствующего состава или устройства, или с помощью суппозитория или клизмы.
В некоторых вариантах осуществления настоящего изобретения введение осуществляется с целью создать заранее выбранный вариационный размах концентрации ингибитора ФНО в крови пациента. Считается, что поддержание в крови концентрации ингибитора ФНО ниже 0,01 нг на мл плазмы может быть недейственным, в то время как длительное поддержание в крови уровней, превышающих 10 мкг на мл, может иметь нежелательные побочные действия.
Предлагаемый диапазон дозировки при лечении обусловленных ФНО заболеваний и, более конкретно, при лечении обусловленного ФНО септического шока находится приблизительно между 0,1-200 мг на кг веса тела пациента в течение 24 ч, вводится равными дозами от 4 до 15 раз за 24 ч. В более предпочтительном варианте осуществления настоящего изобретения дозировка составляет 0,1-100 мг на кг веса тела пациента, введение осуществляется через каждые 3 часа равными дозами в течение 24 ч. В самом предпочтительном варианте осуществления изобретения дозировка составляет 1-50 мг на кг веса тела пациента, введение осуществляется равными дозами через каждые 3 ч в течение 24 ч. В предлагаемом варианте осуществления изобретения введение продолжается от 12 до 60 ч. В самом предпочтительном варианте введение продолжается по крайней мере 24 ч. Частота приема и оптимальная доза будут зависеть от фармакокинетических параметров ингибитора ФНО в используемом составе.
В еще одном предлагаемом способе лечения обусловленных ФНО заболеваний и, более конкретно, при лечении обусловленного ФНО септического шока первичная внутривенная инъекция ударной дозы ФНО вводится вслед за непрерывным внутривенным вливанием ингибитора ФНО до тех пор, пока уровень ФНО в крови больше не увеличивается. Уровень ФНО альфа в сыворотке крови может быть установлен с помощью коммерчески доступных комплектов для проведения иммунологического анализа. Лечение обусловленного ФНО септического шока должно начаться, любым способом лечения, как можно скорее после того, как диагностирован сепсис или вероятность его возникновения. Например, лечение может быть начато немедленно вслед за хирургической операцией, или несчастным случаем, или любым другим событием, которое несет риск возникновения септического шока.
Предлагаемые способы лечения обусловленных ФНО заболеваний и, более конкретно, лечения обусловленного ФНО артрита включают: 53/ обладают такой ингибирующей ФНО активностью.
Методы получения описанных Brewer et al. ингибиторов также раскрываются в упоминавшейся выше заявке. Один из описанных методов состоит в выделении ингибиторов из различных источников, как, например, моча человека или среда, кондиционированная человеческими U937 клетками. Второй описанный метод включает изолирование генов, ответственных за кодирование ингибиторов, клонирование гена в соответствующие векторы и виды клеток и экспрессию генов с целью продуцирования ингибиторов. Последний метод, который иллюстрирует метод рекомбинантных ДНК вообще, является предпочтительным методом, предлагаемым настоящим изобретением. Методы рекомбинантных ДНК являются предпочтительными отчасти потому, что они дают возможность получать сравнительно большие количества с большей степенью чистоты.
В объем настоящего изобретения включены также мутеины ингибиторов ФНО и мутеины, которые были модифицированы так, как это описано в патентной заявке США N 07/669862, поданной 15 марта 1991 года. Одним из предлагаемых мутеинов является 30 кДа ингибитор ФНО, у которого положение 105 занимает цистеин. Предпочтительным ПЭГилированным ингибитором ФНО является “гантелеобразная” разновидность, в которой два Ц105 30 кДа ингибитора ФНО присоединены к полиэтиленгликолевой /ПЭГ/ части. В самом предпочтительном варианте осуществления настоящего изобретения ПЭГ цепь имеет мол.м. 20000. Изготовление гантельного соединения описано ниже в примере 5.
Предпочтительно, чтобы вышеописанные ингибиторы ФНО производились с помощью приведенного выше способа в “по существу чистой” форме. Выражение “по существу чистая” подразумевает, что ингибитор, в немодифицированном виде, обладает сравнительно высокой удельной активностью. Следует, однако, признать, что производные ингибиторов ФНО могут иметь различную удельную активность. В предлагаемом варианте осуществления настоящего изобретения терапевтический состав, включающий по крайней мере один 30 кДа ингибитор ФНО или 40 кДа ингибитор ФНО, в действенном количестве вводится пациенту, страдающему обусловленным ФНО заболеванием.
Дополнительные ингибиторы ФНО включают соединения, способные конкурировать с ФНО за рецепторные места ФНО. Эти соединения включают рецепторные антагонисты. Другие ингибиторы ФНО включают соединения и белки, которые блокируют in vivo синтез или экстрацеллюлярное высвобождение ФНО. Эти соединения включают вещества, которые воздействуют на транскрипцию или трансляцию генов ФНО или процессинг предбелков ФНО.
Поскольку вероятно, что ингибирующая функция предлагаемых ингибиторов передается одной или более отдельных или отделяемых частей, то также предусматривается, что предлагаемый настоящим изобретением метод может осуществляться на практике путем введения терапевтического состава, активный ингредиент которого состоит из той части /или тех частей/ ингибитора, которая контролирует /или контролируют/ торможение ФНО.
Предлагаемый настоящим изобретением терапевтический состав предпочтительно вводится парентерально путем инъекции, хотя предусматриваются также другие действенные способы введения, как, например, внутрисуставная инъекция, аэрозоли для ингаляции, составы для орального приема, чрезкожный лекарственный электрофорез или суппозитории. Одним предлагаемым носителем является физиологический раствор, однако можно предположить, что другие фармацевтически приемлемые носители также могут быть использованы. В одном из предлагаемых вариантов осуществления настоящего изобретения предусматривается, что носитель и ингибитор ФНО образуют физиологически совместимый медленно высвобождающий состав. Основной растворитель в таком носителе может быть водным или неводным по природе. Помимо этого, носитель может содержать другие фармакологически приемлемые наполнители для изменения или поддержания pH, осмотического давления, вязкости, прозрачности, цвета, стерильности, стабильности, скорости растворения или запаха состава. Аналогичным образом носитель может содержать и другие фармакологически приемлемые наполнители для изменения или поддержания стабильности, скорости растворения, высвобождения или абсорбции ингибитора ФНО. Эти наполнители являются веществами, обычно используемыми при создании системы доз для парентерального введения или в виде унифицированной дозы, или в виде многодозовой формы.
После создания терапевтический состав может храниться в стерильных флаконах в виде раствора, суспензии, геля, эмульсии, твердого вещества или дегидратированного, или лиофилизированного порошка. Эти составы могут храниться или в готовом к употреблению виде, или в виде, требующем воссоздания формы непосредственно перед введением. Такие составы предлагаетсяе хранить при температуре не выше 4oC и предпочтительно при температуре -70oC. Также предлагается, чтобы такие составы, содержащие ингибитор ФНО, хранились и вводились при физиологических или близких к ним значениях pH. В настоящее время считается, что введение состава при высоком значении pH /например, более 8/ или при низком значении pH /например, менее 5/ является нежелательным.
Предпочтительным способом введения содержащих ингибитор ФНО составов при системном лечении является подкожный, внутримышечный, внутривенный, внутриносовой и вагинальный или ректальный суппозиторий. Предпочтительным способом введения содержащих ингибитор ФНО составов при локальном лечении является внутрисуставной, внутритрахеальный, или инстилляция, или ингаляции в дыхательные пути. Помимо этого может быть желательным введение ингибитора ФНО в определенные участки пищеварительного тракта или путем орального введения ингибитора ФНО с помощью соответствующего состава или устройства, или с помощью суппозитория или клизмы.
В некоторых вариантах осуществления настоящего изобретения введение осуществляется с целью создать заранее выбранный вариационный размах концентрации ингибитора ФНО в крови пациента. Считается, что поддержание в крови концентрации ингибитора ФНО ниже 0,01 нг на мл плазмы может быть недейственным, в то время как длительное поддержание в крови уровней, превышающих 10 мкг на мл, может иметь нежелательные побочные действия.
Предлагаемый диапазон дозировки при лечении обусловленных ФНО заболеваний и, более конкретно, при лечении обусловленного ФНО септического шока находится приблизительно между 0,1-200 мг на кг веса тела пациента в течение 24 ч, вводится равными дозами от 4 до 15 раз за 24 ч. В более предпочтительном варианте осуществления настоящего изобретения дозировка составляет 0,1-100 мг на кг веса тела пациента, введение осуществляется через каждые 3 часа равными дозами в течение 24 ч. В самом предпочтительном варианте осуществления изобретения дозировка составляет 1-50 мг на кг веса тела пациента, введение осуществляется равными дозами через каждые 3 ч в течение 24 ч. В предлагаемом варианте осуществления изобретения введение продолжается от 12 до 60 ч. В самом предпочтительном варианте введение продолжается по крайней мере 24 ч. Частота приема и оптимальная доза будут зависеть от фармакокинетических параметров ингибитора ФНО в используемом составе.
В еще одном предлагаемом способе лечения обусловленных ФНО заболеваний и, более конкретно, при лечении обусловленного ФНО септического шока первичная внутривенная инъекция ударной дозы ФНО вводится вслед за непрерывным внутривенным вливанием ингибитора ФНО до тех пор, пока уровень ФНО в крови больше не увеличивается. Уровень ФНО альфа в сыворотке крови может быть установлен с помощью коммерчески доступных комплектов для проведения иммунологического анализа. Лечение обусловленного ФНО септического шока должно начаться, любым способом лечения, как можно скорее после того, как диагностирован сепсис или вероятность его возникновения. Например, лечение может быть начато немедленно вслед за хирургической операцией, или несчастным случаем, или любым другим событием, которое несет риск возникновения септического шока.
Предлагаемые способы лечения обусловленных ФНО заболеваний и, более конкретно, лечения обусловленного ФНО артрита включают:1/ одиночную внутрисуставную инъекцию ингибитора ФНО, осуществляемую периодически по мере потребности с целью профилактики или инъекцию лекарственного препарата в случае внезапного обострения артрита; и 2/ периодические подкожные инъекции ингибитора ФНО. Предлагаемые способы лечения обусловленных ФНО заболеваний и, более конкретно, лечения обусловленного ФНО респираторного дистресс-синдрома взрослых включают: одиночные или многократные внутритрахеальные введения ингибитора ФНО; и 2/ введение ударной дозы или непрерывное внутривенное вливание ингибитора ФНО. Также предполагается, что некоторые содержащие ингибитор ФНО составы должны приниматься орально. Предпочтительно, чтобы вводимый таким образом ингибитор ФНО был заключен в желатиновую капсулу. Заключенный в желатиновую капсулу ингибитор ФНО может быть составлен с включением тех носителей, или без них, которые обычно используются при приготовлении твердых дозированных форм. Предпочтительно, чтобы желатиновая капсула была выполнена так, чтобы активная часть состава высвобождалась на том участке пищеварительного тракта, где биодоступность является максимальной, досистемная деградация – минимальной. Для облегчения абсорбции ингибитора ФНО могут быть включены дополнительные наполнители. Могут быть также использованы разбавители, ароматические вещества, парафины с низкой точкой плавления, растительные масла, смазывающие вещества, суспендирующие средства, средства, способствующие распадаемости таблеток, и связывающие вещества. Независимо от способа введения, точная доза рассчитывается в соответствии с приблизительным весом тела пациента. Дальнейшая обработка расчетов, необходимая для определения соответствующей дозы для лечения, включающая в себя все упоминавшиеся выше составы, рутинно выполняется обычными специалистами в данной области и находится в пределах задач, выполняемых ими обычно без ненужного экспериментирования, главным образом с учетом сведений о дозировке и испытаний, раскрытых здесь. Дозировки могут быть уточнены с помощью отработанных тестов определения дозировки, примененных в сочетании с соответствующими данными о зависимости между дозой и эффектом лекарственного вещества. Следует отметить, что описанные здесь составы с ингибитором ФНО, могут быть использованы в ветеринарии, равно как и для лечения людей, и что термин “пациент” не следует интерпретировать в ограничивающем смысле. При использовании в области ветеринарии дозировки должны быть такими же, как сказано выше. Очевидно, что применение идей настоящего изобретения к конкретной проблеме или в конкретных условиях будет зависеть от возможностей лица, являющегося специалистом в данной области в свете идей, содержащихся в настоящей заявке. Примеры, отражающие использование настоящего изобретения, будут приведены ниже. Нижеследующими примерами описывается применение настоящего изобретения для лечения одного из описанных здесь обусловленных ФНО заболеваний. Различия, если таковые существуют, в лечении пациентов, страдающих от других обусловленных ФНО заболеваний, и лечением пациентов, страдающих от обусловленного ФНО септического шока, будут быстро рутинно определяться специалистом в данной области. Способность облегчать последствия воздействия обусловленного ФНО септического шока, как это видно приводимых ниже примеров, показывает, что введение ингибитора ФНО будет в равной мере эффективно при лечении всех обусловленных ФНО заболеваний, как здесь определено. Пример 1: Демонстрация защитного эффекта человеческого рекомбинантного КОкДа ингибитора ФНО  53 на мышиной модели индуцированного цитокином септического шока.
A. Протокол индуцирования системного шока у мышей.
В этом примере для демонстрации терапевтической эффективности ингибитора ФНО при лечении септического шока была использована модификация мышиной модели септического шока, разработанная Everaerdt et al. Статья Everaerdt et al. , Biochem. Biophys. Res. Commun, т. 163, с. 378 /1989/, конкретные признаки которой включены здесь путем ссылки. В этой модели синергическое действие сочетания цитокина, человеческого рекомбинантного фактора опухолевого некроза альфа /чрФНО 53 на мышиной модели индуцированного цитокином септического шока.
A. Протокол индуцирования системного шока у мышей.
В этом примере для демонстрации терапевтической эффективности ингибитора ФНО при лечении септического шока была использована модификация мышиной модели септического шока, разработанная Everaerdt et al. Статья Everaerdt et al. , Biochem. Biophys. Res. Commun, т. 163, с. 378 /1989/, конкретные признаки которой включены здесь путем ссылки. В этой модели синергическое действие сочетания цитокина, человеческого рекомбинантного фактора опухолевого некроза альфа /чрФНО / и человеческого рекомбинантного интерлейкина-1 / и человеческого рекомбинантного интерлейкина-1 /чрИЛ-1 /чрИЛ-1 / продуцирует у мышей септический шок, характеризующийся глубокой гипотермией и затем смертью.
Септический шок с летальным исходом был индуцирован C57B1/6 самкам мышей в возрасте 8-12 недель, вес тела 18-21 г, путем введения чрФНО / продуцирует у мышей септический шок, характеризующийся глубокой гипотермией и затем смертью.
Септический шок с летальным исходом был индуцирован C57B1/6 самкам мышей в возрасте 8-12 недель, вес тела 18-21 г, путем введения чрФНО и чрИЛ-1 и чрИЛ-1 . Человеческий рекомбинантный фактор опухолевого некроза был получен, как правило, в соответствии с процедурой, описанной в статье Shirai et al., Nature /1985/, т. 313, с. 803-806, конкретные признаки которой включены здесь путем ссылки; смотри также патентную заявку Brewer et al. Человеческий рекомбинантный интерлейкин-1 . Человеческий рекомбинантный фактор опухолевого некроза был получен, как правило, в соответствии с процедурой, описанной в статье Shirai et al., Nature /1985/, т. 313, с. 803-806, конкретные признаки которой включены здесь путем ссылки; смотри также патентную заявку Brewer et al. Человеческий рекомбинантный интерлейкин-1 был получен, как правило, в соответствии с процедурой, описанной в статье Kronheim et al., Biotechnology 1986/, т. 4, с. 1078-1082, конкретные признаки которой включены здесь путем этой ссылки. Цитокины были проверены на наличие липополисахаридов /LPS/ в соответствии с процедурами, описанными в Фармакопее США XXII, Национальный фармакологический справочник XXV, 1 января 1990, с. 1493-1495. Инъекции цитокина осуществлялись подкожно в виде одиночных ударных доз в дорсальную поверхность мышей в объемах 100 мкл. 40 кДа ингибитор ФНО был получен, как правило, в соответствии с процедурой, описанной в статье Kronheim et al., Biotechnology 1986/, т. 4, с. 1078-1082, конкретные признаки которой включены здесь путем этой ссылки. Цитокины были проверены на наличие липополисахаридов /LPS/ в соответствии с процедурами, описанными в Фармакопее США XXII, Национальный фармакологический справочник XXV, 1 января 1990, с. 1493-1495. Инъекции цитокина осуществлялись подкожно в виде одиночных ударных доз в дорсальную поверхность мышей в объемах 100 мкл. 40 кДа ингибитор ФНО  53 был получен в соответствии с методом рекомбинантных ДНК, описанным в заявке Brewer et al., и вводился в виде множественных внутрибрюшинных инъекций в объемах 300 мкл или менее на одну дозу.
Были проведены предварительные эксперименты с тем, чтобы определить отношение чрИЛ-1 53 был получен в соответствии с методом рекомбинантных ДНК, описанным в заявке Brewer et al., и вводился в виде множественных внутрибрюшинных инъекций в объемах 300 мкл или менее на одну дозу.
Были проведены предварительные эксперименты с тем, чтобы определить отношение чрИЛ-1 к чрФНО к чрФНО , необходимое для достижения 100% смертности /фиг. 1/. Дозы выражаются в мкг/кг веса тела. Дозировка чрФНО , необходимое для достижения 100% смертности /фиг. 1/. Дозы выражаются в мкг/кг веса тела. Дозировка чрФНО удерживалась постоянной на уровне 300 мкг/кг, в то время как количество чрИЛ-1 удерживалась постоянной на уровне 300 мкг/кг, в то время как количество чрИЛ-1 в ударной дозе увеличивалось. Результаты, выраженные в виде мкг чрИЛ-1 в ударной дозе увеличивалось. Результаты, выраженные в виде мкг чрИЛ-1 /кг : % смертности, были следующими: 250 : 0,500; 10,1500 : 50,2000; 67,2500 : 100. Все дозы, превышающие 2500 мкг/кг, вызывали смертность равную 100%. Во всех последующих экспериментах цитокины использовались в количествах 250 мкг/кг чрИЛ-1 /кг : % смертности, были следующими: 250 : 0,500; 10,1500 : 50,2000; 67,2500 : 100. Все дозы, превышающие 2500 мкг/кг, вызывали смертность равную 100%. Во всех последующих экспериментах цитокины использовались в количествах 250 мкг/кг чрИЛ-1 и 300 мкг/кг чрФНО и 300 мкг/кг чрФНО и вводились в виде одиночной ударной дозы подкожно на дорсальной поверхности.
Комбинированное введение чрФНО и вводились в виде одиночной ударной дозы подкожно на дорсальной поверхности.
Комбинированное введение чрФНО и чрИЛ-1 и чрИЛ-1 oC, до 28oC приблизительно через 15 часов после инъекции.
В противоположность этому введение одного из цитокинов не вызывает аналогичное проявление гипотермии /фиг. 2/ и не вызывает смертельного исхода. Одиночные подкожные ударные инъекции чрИЛ-1 oC, до 28oC приблизительно через 15 часов после инъекции.
В противоположность этому введение одного из цитокинов не вызывает аналогичное проявление гипотермии /фиг. 2/ и не вызывает смертельного исхода. Одиночные подкожные ударные инъекции чрИЛ-1 в количестве 25000 мкг/кг вызывали временное снижение температуры тела до 34oC, достигая этого самого низкого уровня через 12-16 ч после инъекции. чрФНО в количестве 25000 мкг/кг вызывали временное снижение температуры тела до 34oC, достигая этого самого низкого уровня через 12-16 ч после инъекции. чрФНО в количестве 300 мкг/кг не вызвал поддающегося измерению воздействия на температуру тела мышей, также не наблюдалось смертельных исходов.
B. Воздействие 40 кДа ингибитора ФНО в количестве 300 мкг/кг не вызвал поддающегося измерению воздействия на температуру тела мышей, также не наблюдалось смертельных исходов.
B. Воздействие 40 кДа ингибитора ФНО  53 на индуцированный цитокином шок.
40 кДа ингибитор ФНО 53 на индуцированный цитокином шок.
40 кДа ингибитор ФНО  53 был введен мышам путем инъекции вместе со смесью цитокинов /чрИЛ-1 53 был введен мышам путем инъекции вместе со смесью цитокинов /чрИЛ-1 и чрФНО и чрФНО взяты в количествах, описанных выше/. Была проведена серия экспериментов над группами мышей, в каждой из которых было по шесть животных, в ходе экспериментов мышей подвергали воздействию белка-ингибитора /в данном эксперименте 40 кДа ингибитор ФНО взяты в количествах, описанных выше/. Была проведена серия экспериментов над группами мышей, в каждой из которых было по шесть животных, в ходе экспериментов мышей подвергали воздействию белка-ингибитора /в данном эксперименте 40 кДа ингибитор ФНО  53/ в течение увеличивавшихся промежутков времени. Количество белка-ингибитора, вводимого за 1 инъекцию оставалось постоянным, в то время как общее количество инъекций увеличивалось. Таким образом, абсолютное количество белка-ингибитора, использованного в трех экспериментах, изменялось вместе с изменением продолжительности схемы лечения. В каждом эксперименте определялась температура тела и смертность.
В первом эксперименте белок-ингибитор вводился внутрибрюшинно за 30 мин до введения ударной дозы цитокина и через 30 мин 53/ в течение увеличивавшихся промежутков времени. Количество белка-ингибитора, вводимого за 1 инъекцию оставалось постоянным, в то время как общее количество инъекций увеличивалось. Таким образом, абсолютное количество белка-ингибитора, использованного в трех экспериментах, изменялось вместе с изменением продолжительности схемы лечения. В каждом эксперименте определялась температура тела и смертность.
В первом эксперименте белок-ингибитор вводился внутрибрюшинно за 30 мин до введения ударной дозы цитокина и через 30 минпосле этого /фиг. 3/. Каждая инъекция содержала 100 мг/кг белка-ингибитора в объеме 300 мкл, общая доза: 200 мг/кг. Из всех мышей, которым с помощью цитокина был индуцирован шок, в группе, получившей белок-ингибитор, отмечено значительное уменьшение гипотермии в течение 4-6 часов после введения цитокинов по сравнению с группой, которой не вводили белок-ингибитор. В обработанной белком-ингибитором группе смертность была отсрочена приблизительно на 12 ч /фиг. 4/. Однако в обеих группах через 48 ч после инъекции смертность составила 100%. Во втором эксперименте лечение продолжалось в общем 12 ч после инъекции /фиг. 5/. Время введения белка-ингибитора относительно времени введения цитокина было: -30 мин, +30 мин, 3 ч, 6 ч, 9 ч и 12 ч. В результате такого режима общая доза введенного белка-ингибитора составила 600 мг/кг. После инъекции цитокина в непролечиваемой группе развилась характерная гипотермия, самый низкий уровень которой составил 26oC через 15 ч. Первые смерти были отмечены через 36 ч /фиг. 6/. Через 43 ч смертность составила 100%. В противоположность этому группа, которой вводили белок-ингибитор, была защищена от сильной гипотермии в течение приблизительно 24 ч после инъекции цитокиновой смеси. Через 12 ч температура тела достигла первоначального самого низкого уровня 35,5oC через 12 ч. В это время закончилось лечение с применением белка-ингибитора. Температура тела незначительно повысилась в течение следующих 6 ч, а затем упала до 26oC к 36 ч. В пролечиваемой группе начало смертности было отсрочено по сравнению с непролечиваемой группой. Первые смерти наблюдались через 42 ч после инъекции и через 44 ч смертность составила 100%. В третьем эксперименте описанный выше режим был продлен с 12 до 24 ч после введения цитокина /фиг. 7/. Дополнительные внутрибрюшинные инъекции были введены через 15, 18, 21 и 24 ч после инъекции цитокина. Общая результирующая доза составила 1000 мг/кг. Непролечиваемая группа, получающая чрИЛ-1  и чрФНО и чрФНО , принимала тот же курс, что и во втором эксперименте. Температура тела достигла самого низкого уровня, составившего 27oC, через 12 ч. Смертность началась через 18 ч после инъекции и составила 100% через 42 ч /фиг. 8/. В противоположность этому группа, получающая белок-ингибитор, была защищена от тяжелой гипотермии и летальности. Средняя температура тела снизилась только до 33,5oC через 10 ч после введения цитокина и потом поднялась до почти нормальной через 24 ч после прекращения лечения белком-ингибитором /фиг. 7/. Через 42 ч /18 ч после прекращения терапии/ температура тела временно снизилась до 34,5oC и оставалась незначительно ниже нормальной до того, как со времени инъекции цитокинов прошло 90 ч. Смертность в этой группе составила 1 из 6. Эта одиночная смерть осталась необъясненной. Однако животное во время эксперимента вело себя необычно, возможно вследствие неправильного выбора места для внутрибрюшинной инъекции. Вес тела этих животных регистрировался с тем, чтобы оценить полное выздоровление от индуцированного цитокином шока /фиг. 9/. В группе, пролечиваемой белком-ингибитором, через 62 ч средний вес снизился до 79% от первоначального веса. Однако через 200 ч после инъекции цитокина средний вес восстановился до веса животных в контрольной группе, которым вводили фосфатный физиологический раствор /PBS/. Поведение животных и их внешний вид были нормальными. Продлив лечение белком-ингибитором до 24 ч, мы могли устранить глубокую гипотермию и смертность, наблюдаемую у мышей на индуцированной цитокином модели септического шока. Продолжительность и частота введения ингибитора должна быть совместимой с интенсивным лечением, которое получают больные с септическим шоком.
C. Контрольные группы, на которых показано, что жидкостная терапия не оказывает воздействия и что ингибитор обладает нетоксичной природой.
В описанных выше последних трех экспериментах белок-ингибитор /40 кДа ингибитор ФНО , принимала тот же курс, что и во втором эксперименте. Температура тела достигла самого низкого уровня, составившего 27oC, через 12 ч. Смертность началась через 18 ч после инъекции и составила 100% через 42 ч /фиг. 8/. В противоположность этому группа, получающая белок-ингибитор, была защищена от тяжелой гипотермии и летальности. Средняя температура тела снизилась только до 33,5oC через 10 ч после введения цитокина и потом поднялась до почти нормальной через 24 ч после прекращения лечения белком-ингибитором /фиг. 7/. Через 42 ч /18 ч после прекращения терапии/ температура тела временно снизилась до 34,5oC и оставалась незначительно ниже нормальной до того, как со времени инъекции цитокинов прошло 90 ч. Смертность в этой группе составила 1 из 6. Эта одиночная смерть осталась необъясненной. Однако животное во время эксперимента вело себя необычно, возможно вследствие неправильного выбора места для внутрибрюшинной инъекции. Вес тела этих животных регистрировался с тем, чтобы оценить полное выздоровление от индуцированного цитокином шока /фиг. 9/. В группе, пролечиваемой белком-ингибитором, через 62 ч средний вес снизился до 79% от первоначального веса. Однако через 200 ч после инъекции цитокина средний вес восстановился до веса животных в контрольной группе, которым вводили фосфатный физиологический раствор /PBS/. Поведение животных и их внешний вид были нормальными. Продлив лечение белком-ингибитором до 24 ч, мы могли устранить глубокую гипотермию и смертность, наблюдаемую у мышей на индуцированной цитокином модели септического шока. Продолжительность и частота введения ингибитора должна быть совместимой с интенсивным лечением, которое получают больные с септическим шоком.
C. Контрольные группы, на которых показано, что жидкостная терапия не оказывает воздействия и что ингибитор обладает нетоксичной природой.
В описанных выше последних трех экспериментах белок-ингибитор /40 кДа ингибитор ФНО  53/ вводился в объемах от 200 до 300 мкл за 1 инъекцию. Существовала вероятность, что жидкостный объем белка-ингибитора сам по себе мог оказать воздействие на терапию. Чтобы проверить эту возможность, сравнили уровень гипотермии и смертность в одной группе мышей, которой вводили только цитокины, с данными другой группы, которой вводили цитокины плюс внутрибрюшинную инъекцию PBS в объемах и с частотой, идентичными вводимым в группе, пролеченной белком-ингибитором /фиг. 5/. Наблюдалось отсутствие существенных различий в уровне гипотермии и в смертности. В последующих экспериментах PBS вводился внутрибрюшинно не получившим лечение мышам с индуцированным цитокином шоком.
Для оценки воздействия собственно белка-ингибитора отдельно была включена особая контрольная группа. Во всех экспериментах группе мышей вводили только белок-ингибитор в идентичных объемах и с частотой, как это осуществлялось в пролечиваемой группе с индуцированным цитокином шоком. В этой контрольной группе не было отмечено ни изменения температуры тела, ни случаев смерти /фиг. 3, 5, 7/.
Пример 2: Демонстрация защитного действия человеческого рекомбинантного 30 кДа ингибитора ФНО на мышиной модели индуцированного цитокином септического шока.
A. Протокол индуцирования мышиного септического шока.
Для демонстрации терапевтической эффективности 30 кДа ингибитора ФНО была использована та же самая мышиная модель септического шока, описанная в примере 1. Летальный шок был индуцирован C57B1/6 самкам мышей, в возрасте 8-12 недель, с весом тела 18-21 г путем комбинированного подкожного введения чрФНО 53/ вводился в объемах от 200 до 300 мкл за 1 инъекцию. Существовала вероятность, что жидкостный объем белка-ингибитора сам по себе мог оказать воздействие на терапию. Чтобы проверить эту возможность, сравнили уровень гипотермии и смертность в одной группе мышей, которой вводили только цитокины, с данными другой группы, которой вводили цитокины плюс внутрибрюшинную инъекцию PBS в объемах и с частотой, идентичными вводимым в группе, пролеченной белком-ингибитором /фиг. 5/. Наблюдалось отсутствие существенных различий в уровне гипотермии и в смертности. В последующих экспериментах PBS вводился внутрибрюшинно не получившим лечение мышам с индуцированным цитокином шоком.
Для оценки воздействия собственно белка-ингибитора отдельно была включена особая контрольная группа. Во всех экспериментах группе мышей вводили только белок-ингибитор в идентичных объемах и с частотой, как это осуществлялось в пролечиваемой группе с индуцированным цитокином шоком. В этой контрольной группе не было отмечено ни изменения температуры тела, ни случаев смерти /фиг. 3, 5, 7/.
Пример 2: Демонстрация защитного действия человеческого рекомбинантного 30 кДа ингибитора ФНО на мышиной модели индуцированного цитокином септического шока.
A. Протокол индуцирования мышиного септического шока.
Для демонстрации терапевтической эффективности 30 кДа ингибитора ФНО была использована та же самая мышиная модель септического шока, описанная в примере 1. Летальный шок был индуцирован C57B1/6 самкам мышей, в возрасте 8-12 недель, с весом тела 18-21 г путем комбинированного подкожного введения чрФНО в количестве 300 мкг/кг и чрИЛ-1 в количестве 300 мкг/кг и чрИЛ-1 в количестве 2500 мкг/кг. При этих дозах смертность составила 100%. Цитокины вводили одиночной подкожной ударной дозой в шею со стороны спины.
В этом примере снижение температуры тела было использовано в качестве поддающегося измерению показателя тяжести индуцированного шока. Степень гипотермии коррелировала непосредственно с тяжестью клинических симптомов /например, дрожь, вялость, потеря упругости кожи, согнутое положение тела/. После комбинированного введения чрФНО в количестве 2500 мкг/кг. При этих дозах смертность составила 100%. Цитокины вводили одиночной подкожной ударной дозой в шею со стороны спины.
В этом примере снижение температуры тела было использовано в качестве поддающегося измерению показателя тяжести индуцированного шока. Степень гипотермии коррелировала непосредственно с тяжестью клинических симптомов /например, дрожь, вялость, потеря упругости кожи, согнутое положение тела/. После комбинированного введения чрФНО и чрИЛ-1 и чрИЛ-1 температура тела упала с нормального значения, равного 39oC, до 28oC почти за 15 ч после инъекции /фиг. 2/. Температура оценивалась с помощью First Temp температура тела упала с нормального значения, равного 39oC, до 28oC почти за 15 ч после инъекции /фиг. 2/. Температура оценивалась с помощью First Temp инфракрасного ручного сканера /Intelligent Medical System, Карлсбад, Центральная Америка/. В противоположность этому, инъекция или одного чрФНО, или одного чрИЛ-1 инфракрасного ручного сканера /Intelligent Medical System, Карлсбад, Центральная Америка/. В противоположность этому, инъекция или одного чрФНО, или одного чрИЛ-1 не вызвала аналогичной гипотермии и смертельных исходов /фиг. 2/. Использовавшийся в этом эксперименте человеческий рекомбинантный 30 кДа ингибитор ФНО был получен в соответствии с методами, описанными в патентной заявке.
B. Воздействие 30 кДа ингибитора ФНО на индуцированный цитокином септический шок.
Белок-ингибитор /в данном примере 30 кДа ингибитор ФНО/ внутрибрюшинно вводился в количестве 40 мг/кг на одну инъекцию группе из 8 мышей в течение или 12 ч, или 24 ч, или 39 ч после подкожного введения чрФНО не вызвала аналогичной гипотермии и смертельных исходов /фиг. 2/. Использовавшийся в этом эксперименте человеческий рекомбинантный 30 кДа ингибитор ФНО был получен в соответствии с методами, описанными в патентной заявке.
B. Воздействие 30 кДа ингибитора ФНО на индуцированный цитокином септический шок.
Белок-ингибитор /в данном примере 30 кДа ингибитор ФНО/ внутрибрюшинно вводился в количестве 40 мг/кг на одну инъекцию группе из 8 мышей в течение или 12 ч, или 24 ч, или 39 ч после подкожного введения чрФНО и чрИЛ-1 и чрИЛ-1 . В первой группе, состоящей из 1 мыши, белок-ингибитор вводился за 30 мин до инъекции цитокинов и затем через 30 мин, 3 ч, 6 ч, 9 ч и 12 ч после этой инъекции. Эта мышь получила суммарную дозу белка-ингибитора 240 мг/кг за шесть инъекций. В следующей группе лечение было продлено на дополнительные 12 ч, инъекции делались с интервалом в 3 ч. Каждая из трех мышей этой группы получила в течение 24 ч суммарную дозу белка-ингибитора 400 мг/кг за 10 инъекций. В следующей группе лечение было продолжено на дополнительные 15 ч, и добавленные инъекции делались с интервалом в 3 ч. Каждая из четырех мышей этой группы получила суммарную дозу белка-ингибитора 600 мг/кг за 15 инъекций.
Осуществлялось внимательное наблюдение за температурой тела /фиг. 10/ и смертностью /фиг. 11/ у пролеченных и у непролеченных мышей. Средняя температура у непролеченных мышей упала до 28oC за 12 ч и оставалась на этом низком уровне до тех пор, пока мышь не умирала через 36-42 ч после введения цитокинов. В противоположность этому температура тела у мышей во всех трех пролеченных группах снизилась незначительно, и все мыши пережили индуцированный цитокином шок. В течение первых 24 ч после введения цитокинов температура тела упала на 2-4oC через 12 ч во всех трех группах и затем поднялась до нормальной по прошествии 24 ч. Температура удерживалась на нормальном уровне в группах, получавших лечение белком-ингибитором в течение или 24 ч, или в течение 39 ч, в то время как температура тела одной мыши, которую лечили только 12 ч, снизилась на 3oC, и затем через 100 ч после введения цитокина температура поднялась до нормального уровня.
В качестве показателя выздоровления использовалось также время, необходимое для восстановления веса тела до исходного /фиг. 12/. Вес тела мышей, пролеченных белком-ингибитором в течение 24 или 39 ч снизился до 86% исходного веса через 60 ч, а затем через 140 ч восстановился до нормального уровня. Вес тела одной мыши, пролеченной ингибитором в течение 12 ч, достиг 81% от исходного веса несколько позднее, через 75 ч, однако восстановился до исходного значения приблизительно через 140 ч; в то же время, как и две другие группы.
Действие 30 кДа ингибитора ФНО оказалось эффективным при защите мышей от индуцированного цитокином синдрома летального септического шока, когда терапия осуществлялась с 3-часовыми интервалами в течение 12, 24 или 39 ч после инъекции цитокиновой смеси. Аналогичный терапевтический режим может быть применен для лечения пациентов с септическим шоком в отделениях интенсивной терапии.
Пример 3: Демонстрация воздействия человеческого рекомбинантного 30 кДа ингибитора ФНО на стрептококковую клеточную оболочку /SCW/ – индуцированная реактивация SCW-индуцированного артрита у крыс.
В этом эксперименте используется модель, описанная в статье Esser et al. , Артрит и ревматизм, 28: 1401-1411 /1985/, конкретные признаки которой включены здесь путем ссылки. Эту модель можно кратко описать следующим образом: стрептококковую клеточную оболочку внутрисуставно вводят в голеностопный сустав крысы Льюиса. Для контроля в контралатеральный сустав вводили физиологический раствор. Через двадцать дней, после того как затихло первичное воспаление, была опять введена SCW, на этот раз путем внутривенной инъекции. Эта доза является недостаточной сама по себе для того, чтобы вызвать воспаление сустава и поэтому она оказывает незначительное воздействие на голеностопный сустав, в который вводили физиологический раствор. В противоположность этому, однако, эта доза способна реактивировать воспаление и разрушение в голеностопном суставе, в который ранее ввели SCW. Чтобы оценить масштаб воспаления, последовавшего за вторым введением ежедневно обмеряли величину голеностопного сустава.
Относительно индуцированного стрептококковой клеточной оболочкой артрита R. L. Wilder в статье “Иммунопатогенетические механизмы артрита” говорит в главе 9, озаглавленной “Экспериментальные животные модели хронического артрита”, что “клинические, гистологические и радиологические характеристики болезни суставов в эксперименте имеют тесное сходство с характерными чертами артрита у взрослых и болезни Стилла”.
Были подготовлены два метода лечения артрита с использованием модели разъедающего SCW-индуцированного артрита.
Метод 1. В одном цикле экспериментов больным артритом крысам вводили одиночную внутрисуставную дозу ингибитора ФНО в фосфатном буферном растворе /PB/, используя SCW-индуцированную модель артрита. Артрит был индуцирован путем введения каждой крысе в день 0 в левый голеностопный сустав инъекции с SCW /эквивалентность 1,8 мкг рамнозы/. В правый голеностопный сустав ввели равный объем аспирогенного физиологического раствора. Размеры голеностопного сустава обмерялись в 0, 1, 2 и 7 день. Опухоль на левом голеностопном суставе на 1 и 2 день /табл. 1/ отражает острую стадию SCW-индуцированного артрита. Правый голеностопный сустав, являющийся контрольным вследствие механической травмы, связанной с внутрисуставной инъекцией, не подвергся заметному опуханию /данные не представлены/.
На 21 день, после того как затихла фаза артрита, крысы были произвольно разделены на 4 группы, по 9 или 10 крыс в каждой, подвергнуты анестезии, а затем им ввели инъекции в соответствии с описанным ниже протоколом. Ц105 является мутеином 30 кДа ингибитора ФНО, в котором аминокислотное замещение выполняется с целью создания участка для ковалентного присоединения полиэтиленгликоля /ПЭГ/. В Ц105 аспарагин был замещен цистеином в положении 105 30 кДа ингибитора ФНО. В Ц105-ПЭГ 3400 гантельной молекуле, 2 молекулы Ц105 сшиты одной молекулой ПЭГ с приблизительной молекулярной массой 3400 дальтон. Гантельная молекула и процедура межмолекулярного сшивания молекулой ПЭГ более полно описаны в патентной заявке США N 07/669862, зарегистрированной 15 марта 1991 г. и озаглавленной “Сайт-специфическое межмолекулярное сшивание полипептидов молекулой ПЭГ”. Признаки этой заявки конкретно включены здесь путем ссылки. Процесс получения Ц105-ПЭГ 3400 с гантельной молекулой описан ниже в примере 5.
Группа I (см. табл. A) играет роль векторной контрольной группы для получавшей Ц105 группы IV. Группа II играет роль векторной группы для получавшей Ц105-ПЭГ 3400 с гантельной молекулой группы III. Введенная путем внутрисуставной инъекции суммарная доза составила 10 мкл, для введения использовалась игла 25 размера, присоединенная к автоматической пипетке. Сразу же после внутрисуставных инъекций в различных группах каждой крысе внутривенно ввели SCW /150 мкг эквивалент рамнозы/ с целью реактивации артрита. Кроме этого крысам не давали никакого другого лечения. Диаметры голеностопных суставов измеряли на 21, 22, 23 и 24 день.
Как и ожидалось, во всех группах в ответ на внутривенное введение SCW было отмечено опухание левого голеностопного сустава на 21 день /табл. 1 и фиг. 13/. Однако ответные реакции значительно различались в зависимости от вида лечения. В то время как суставы крыс в контрольных группах I и II опухали на 30% и 32% соответственно по сравнению со своими первоначальными размерами, суставы в группе III, получавшей Ц105-ПЭГ 3400 с гантельной молекулой, увеличились только на 15%, и в группе IV, получавшей Ц105 – на 25%. На фиг. 14 графически представлено максимальное увеличение диаметра сустава в течение 72-часового интервала после SCW-индуцированной реактивации в группах I, II, III и IV. Одна внутрисуставная инъекция Ц105-ПЭГ 3400 с гантельной молекулой обеспечивает статистически значимое уменьшение опухания артритных суставов.
Метод два. Во второй группе экспериментов, больным артритом крысам осуществили множественное подкожное вливание 30 кДа ингибитора ФНО в фосфатном буферном растворе /PBS/, используя ту же самую модель SCW артрита. Артрит был индуцирован путем введения каждой крысе в первый день в левый голеностопный сустав SCW /1,8 мкг эквивалент рамнозы/, а в правый голеностопный сустав вводили равный объем апирогенного физиологического раствора.
На 21 день после ослабления острого приступа артрита крысы были произвольно разбиты на четыре группы. Каждой крысе внутривенно ввели вторую дозу SCW /150 мкг-эквивалент рамнозы/ с целью реактивации артрита. В течение трех минут после инъекции девяти крысам в контрольной группе I ввели, а пяти крысам в каждой из групп II, III, и IV были введены 1, 3 и 9 мг на кг веса тела, соответственно, 30 кДа ингибитора ФНО в PBS. Через 2 и 6 ч после введения SCW были повторены подкожные инъекции PBS в группе I и 30 кДа ингибитора ФНО в группах II, III и IV /1, 3 и 9 мг/кг соответственно/, затем они повторялись каждые шесть часов в течение следующих 42 ч. Диаметры голеностопных суставов измерялись в 0, 24, 39, 48, и 72 ч после внутривенного введения.
На фиг. 15 и табл. 2 показаны максимальные изменения диаметров суставов в течение 72 ч после SCW-индуцированной реактивации артрита в четырех экспериментальных группах. Как и ожидалось, голеностопные суставы крыс в группе I, которым вводили физиологический раствор, опухли в ответ на внутривенное вливание SCW. Однако максимальное опухание в группах II, III, и IV сократилось на 58%, 85%, и 75% соответственно. В табл. 2 представлены результаты статистического анализа данных фиг. 15 с использованием критерия Стьюдента на средних значениях, прошедших логарифмическое преобразование.
Пример 4: Демонстрация воздействия человеческого рекомбинантного 30 кДа ингибитора ФНО на острую легочную травму, индуцированную эндотоксином у крыс как метода лечения респираторного дистресс-синдрома взрослых /РДСВ/.
В этом эксперименте используется септический стимул, эндотоксин, для индуцирования острой нейтрофил-обусловленной легочной травмы в соответствии с моделью, раскрытой в статье American Journal of Pathology 138: 1485-1496 /1991/, конкретно включенной здесь путем ссылки. Эта модель может быть коротко описана следующим образом: эндотоксин внутритрахеально вводится в среднецервикальный участок трахеи анестезированных крыс. По прошествии длящегося шесть часов латентного периода был выполнен бронхоальвеолярный лаваж легких в качестве терминальной процедуры. На материале полученной с помощью лаважа жидкости была получена гемограмма и определена лейкоцитарная формула. Внутритрахеальная инъекция аспирогенного физиологического раствора имела следствием преобладание альвеолярных макрофагов /приблизительно 99% в малом количестве. Внутритрахеальная инъекция эндотоксина вызвала значительное увеличение количества клеток в лаважной жидкости и преобладание нейтрофилов. Резкий приток нейтрофилов в альвеолярное пространство достигает пиковых значений через 6-12 ч и сопровождается аккумуляцией содержащей белок отечной жидкости в этом пространстве. Считается, что ФНО является одним из медиаторов индуцированного эндотоксином альвеолита. ФНО присутствует в лаважной жидкости после стимуляции эндотоксином. Считается, что альвеолярный макрофаг является источником его синтеза. Более того, внутритрахеальная инъекция экзогенного ФНО индуцирует острый внутриальвеолярный нейтрофильный экссудат, который в количественном отношении аналогичен экссудату, индуцированному эндотоксином.
Хотя считается, что животные модели не в полной мере воспроизводят заболевание у человека, в частности переход от острой к хронической стадии РДСВ, однако многие из них используются, а именно те, которые приближаются к измененному отеку легких, секвестрации лейкоцитов, а также гипоксемии во время острой стадии легочной парентиматозной травмы при РДСВ. J.F. Murray, et al., Am. Rev. of Respiratory Diseases, т. 138, с. 720-723 /1991/. Острые формы РДСВ имеют место в присутствии некоторых поддающихся выявлению факторов риска, как, например, сепсис, аспирация или многократные переливания крови. В современных исследованиях подчеркивается главная роль обусловленной нейтрофилами травмы в патофизиологии РДСВ /Tate, R.M. Am. Rev. Resp. Dis., т. 128, с. 552-559 /1983/. Считается, что токсические продукты, высвобождаемые активированным нейтрофилом повреждают мембрану альвеолярных капилляров. Проницаемость поврежденной мембраны значительно увеличивается, стимулируя движение белков плазмы и воспалительных клеток в альвеолярные пространства. В экспериментальной овечьей модели РДСВ септического происхождения снижение количества нейтрофилов защищает от развития легочной травмы /Heflin A.C. J. Clin. Invest. 68: 1253-1260 /1981/.
Был осуществлен метод лечения нейтрофильного альвеолита у крыс путем внутритрахеального введения 30 кДа ингибитора ФНО в PBS. Легочная травма была индуцирована введением эндотоксина /5 мкг одной крысе/ в общем объеме 0,5 мл стерильного PBS с помощью иглы 27 размера 1/2 дюйма, введенной между трахеальными кольцами в среднецервикальном участке трахеи. Во время медленного введения инокулята в трахею велось наблюдение за крысой и глубиной ее дыхания. Через шесть часов крысы были подвергнуты анестезии изофлураном с тем, чтобы можно было провести лапаротомию для облегчения осуществления лаважа легких. Каудальная полая вена была перерезана для уменьшения содержания крови в легких. Была вскрыта диафрагма для того, чтобы во время проведения лаважа легкие могли увеличиться в объеме. Бронхоальвеолярный лаваж был выполнен путем введения 40 мл сбалансированного физиологического раствора Ханка в бронхоальвеолярные пространства с помощью ангиокатетера, который был введен и закреплен на участке надреза среднецервикальной трахеи. Приток воспалительных клеток был восстановлен из осадка в пробирке, полученного в результате центрифугирования лаважной жидкости со скоростью 1500 об./мин в течение 15 мин. Общее количество лейкоцитов определено с помощью счетчика Коултера. Процентное содержание полиморфно-ядерных нейтрофилов было определено вручную путем определения лейкоцитарной формулы на слайде с окрашенными клетками.
Воздействие 30 кДа ингибитора ФНО на стимулированный эндотокоином приток клеток в бронхоальвеолярные пространства определялось при одновременном введении 30 кДа ингибитора ФНО и внутритрахеальной инстилляции эндотоксина. 30 кДа ингибитор ФНО испытывался в дозах от 1 до 10 мкг на одну крысу. Доза 30 кДа ингибитора ФНО, равная 1 мкг/1 крыса, не уменьшала приток нейтрофилов в альвеолярные пространства. Однако внутритрахеальное введение 30 кДа ингибитора ФНО в дозах от 2,5 мкг до 10 мкг одной крысе вызывало максимальное уменьшение притока нейтрофилов в альвеолярные пространства. В процентном выражении ингибирование клеточного притока у крыс, которым вводили 30 кДа ингибитор ФНО, при сравнении с нейтрофильным притоком у непролеченных крыс составило приблизительно 35% т /фиг. 16/. Общее количество нейтрофилов, присутствующих в бронхоальвеолярных пространствах, было значительно у крыс, пролеченных 30 кДа ингибитором ФНО в дозах от 2,5 до 10 мкг на одно животное /фиг. 17 и табл. 3/.
Пример 5: Получение Ц105-ПЭГ 3400 с гантельной молекулой.
Ц105-ПЭГ с гантельной молекулой соединения были получены в результате реакции цистеина, содержащего мутеин Ц105 30 кДа ингибитора ФНО, с ПЭГ-бис-малеимидом. Чтобы получить ПЭГ-бис-малеимид ПЭГ-трезилат был получен из ПЭГ-бис-диола, как это описано в статье Nilson and Mosback. Методы в ферментологии, т. 104, с. 56-69, Academic Press, Inc., Нью-Йорк /1984/. Количество сульфонированного промежуточного вещества определялось с помощью элементарного анализа для фтора. Это промежуточное вещество было преобразовано в производное соединение фталамида, которое было потом восстановлено гидратом гидразина до промежуточного веществ ПЭГ-бис-амина. Эти две реакции проводились согласно процедурам, описанным Pillai, et al., J. Org. Chem., т. 45, с. 5364-5370 /1980/. Количество каждого промежуточного вещества оценивалось с помощью элементарного анализа для азота. Кроме того, количество ПЭГ-бис-амина определялось реакцией с 2,4,6-тринитробензолсульфоновой кислотой. Производные соединения ПЭГ-бис-амина были преобразованы в соответствующие бис-малеимидные продукты в ходе реакции с малеиновым ангидридом путем адаптации процедур, описанных Butler and Hartley в Methods in Enzymology т. XXV, с. 191-199, Академик Пресс, Инк., Нью-Йорк /1972/, и путем циклизации промежуточного вещества согласно методу, описанному Wunschetal, Biol. Chem. Hoppe-Seyler, т. 366, p. 56-61 /1985/.
Мутеин Ц105 30 кДа ингибитора ФНО получается так, как это описано в патентной заявке США N 07/669862, поданной 15 марта 1991 г. Ц105 30 кДа ингибитор ФНО при концентрации 2-3 мг/мл был подвергнут воздействию дитиотреитола /ДТТ/ с четырехкратным молярным преобладанием в течение 2 ч при температуре окружающей среды. Затем мутеин подвергается диализу рядом с 50 мМ HEPES pH 7,0 в течение 3 ч при 4oC. Для получения соединения с гантельной молекулой – которое может рассматриваться как связанный димер полиэтиленгликоля /ПЭГ/ – диализованный мутеин прореигирован с ПЭГ-бис-малеимидом. Отношение мутеина к ПЭГ-бис-малеимиду меняется в зависимости от молекулярной массы ПЭГ соединения. Для ПЭГ-бис-малеимида с молекулярной массой около 1900 использовалось молярное соотношение 1:1, а для соединений ПЭГ с молекулярной массой 3400 или 20000 использовалось молярное соотношение мутеина к ПЭГ 2:1. Реакции инкубировались в течение 3-12 ч при температуре окружающей среды.
После инкубации ПЭГ-связанные димеры были очищены от не вступившего в реакцию с ПЭГ мутеина и от ПЭГ-мутеин мономеров с использованием MOHO-SFPLC /жидкостная экспресс-хроматография белков/ в 50 мМ HOAc pH 4,0, применяя 260 мМ, 310 мМ и 350 мМ NaCl ступенчатый градиент. Соединения с гантельной молекулой элюируются на этапе 310 мм NaCl. Оставшийся не вступивший в реакцию с ПЭГ мутеин удаляется с помощью хроматографии на superdex 75. Соединение Ц105-ПЭГ 3400 с гантельной молекулой относится к соединениям с гантельной молекулой /ПЭГ-связанный димер ингибитора ФНО/, где ингибитором ФНО является Ц105 мутеин 30 кДа ингибитора ФНО, а единица ПЭГ имеет молекулярную массу приблизительно 3400 дальтонов.
Несмотря на то, что настоящее изобретение было описано в связи с предпочтительными вариантами его осуществления, следует понимать, что специалисты в данной области техники могут осуществлять модификации и изменения, не выходя за пределы существа или объема настоящего изобретения. Таким образом, приведенные выше предлагаемые варианты осуществления настоящего изобретения не следует рассматривать в ограничивающем смысле, настоящее изобретение лучше всего определяет нижеследующая формула изобретения. . В первой группе, состоящей из 1 мыши, белок-ингибитор вводился за 30 мин до инъекции цитокинов и затем через 30 мин, 3 ч, 6 ч, 9 ч и 12 ч после этой инъекции. Эта мышь получила суммарную дозу белка-ингибитора 240 мг/кг за шесть инъекций. В следующей группе лечение было продлено на дополнительные 12 ч, инъекции делались с интервалом в 3 ч. Каждая из трех мышей этой группы получила в течение 24 ч суммарную дозу белка-ингибитора 400 мг/кг за 10 инъекций. В следующей группе лечение было продолжено на дополнительные 15 ч, и добавленные инъекции делались с интервалом в 3 ч. Каждая из четырех мышей этой группы получила суммарную дозу белка-ингибитора 600 мг/кг за 15 инъекций.
Осуществлялось внимательное наблюдение за температурой тела /фиг. 10/ и смертностью /фиг. 11/ у пролеченных и у непролеченных мышей. Средняя температура у непролеченных мышей упала до 28oC за 12 ч и оставалась на этом низком уровне до тех пор, пока мышь не умирала через 36-42 ч после введения цитокинов. В противоположность этому температура тела у мышей во всех трех пролеченных группах снизилась незначительно, и все мыши пережили индуцированный цитокином шок. В течение первых 24 ч после введения цитокинов температура тела упала на 2-4oC через 12 ч во всех трех группах и затем поднялась до нормальной по прошествии 24 ч. Температура удерживалась на нормальном уровне в группах, получавших лечение белком-ингибитором в течение или 24 ч, или в течение 39 ч, в то время как температура тела одной мыши, которую лечили только 12 ч, снизилась на 3oC, и затем через 100 ч после введения цитокина температура поднялась до нормального уровня.
В качестве показателя выздоровления использовалось также время, необходимое для восстановления веса тела до исходного /фиг. 12/. Вес тела мышей, пролеченных белком-ингибитором в течение 24 или 39 ч снизился до 86% исходного веса через 60 ч, а затем через 140 ч восстановился до нормального уровня. Вес тела одной мыши, пролеченной ингибитором в течение 12 ч, достиг 81% от исходного веса несколько позднее, через 75 ч, однако восстановился до исходного значения приблизительно через 140 ч; в то же время, как и две другие группы.
Действие 30 кДа ингибитора ФНО оказалось эффективным при защите мышей от индуцированного цитокином синдрома летального септического шока, когда терапия осуществлялась с 3-часовыми интервалами в течение 12, 24 или 39 ч после инъекции цитокиновой смеси. Аналогичный терапевтический режим может быть применен для лечения пациентов с септическим шоком в отделениях интенсивной терапии.
Пример 3: Демонстрация воздействия человеческого рекомбинантного 30 кДа ингибитора ФНО на стрептококковую клеточную оболочку /SCW/ – индуцированная реактивация SCW-индуцированного артрита у крыс.
В этом эксперименте используется модель, описанная в статье Esser et al. , Артрит и ревматизм, 28: 1401-1411 /1985/, конкретные признаки которой включены здесь путем ссылки. Эту модель можно кратко описать следующим образом: стрептококковую клеточную оболочку внутрисуставно вводят в голеностопный сустав крысы Льюиса. Для контроля в контралатеральный сустав вводили физиологический раствор. Через двадцать дней, после того как затихло первичное воспаление, была опять введена SCW, на этот раз путем внутривенной инъекции. Эта доза является недостаточной сама по себе для того, чтобы вызвать воспаление сустава и поэтому она оказывает незначительное воздействие на голеностопный сустав, в который вводили физиологический раствор. В противоположность этому, однако, эта доза способна реактивировать воспаление и разрушение в голеностопном суставе, в который ранее ввели SCW. Чтобы оценить масштаб воспаления, последовавшего за вторым введением ежедневно обмеряли величину голеностопного сустава.
Относительно индуцированного стрептококковой клеточной оболочкой артрита R. L. Wilder в статье “Иммунопатогенетические механизмы артрита” говорит в главе 9, озаглавленной “Экспериментальные животные модели хронического артрита”, что “клинические, гистологические и радиологические характеристики болезни суставов в эксперименте имеют тесное сходство с характерными чертами артрита у взрослых и болезни Стилла”.
Были подготовлены два метода лечения артрита с использованием модели разъедающего SCW-индуцированного артрита.
Метод 1. В одном цикле экспериментов больным артритом крысам вводили одиночную внутрисуставную дозу ингибитора ФНО в фосфатном буферном растворе /PB/, используя SCW-индуцированную модель артрита. Артрит был индуцирован путем введения каждой крысе в день 0 в левый голеностопный сустав инъекции с SCW /эквивалентность 1,8 мкг рамнозы/. В правый голеностопный сустав ввели равный объем аспирогенного физиологического раствора. Размеры голеностопного сустава обмерялись в 0, 1, 2 и 7 день. Опухоль на левом голеностопном суставе на 1 и 2 день /табл. 1/ отражает острую стадию SCW-индуцированного артрита. Правый голеностопный сустав, являющийся контрольным вследствие механической травмы, связанной с внутрисуставной инъекцией, не подвергся заметному опуханию /данные не представлены/.
На 21 день, после того как затихла фаза артрита, крысы были произвольно разделены на 4 группы, по 9 или 10 крыс в каждой, подвергнуты анестезии, а затем им ввели инъекции в соответствии с описанным ниже протоколом. Ц105 является мутеином 30 кДа ингибитора ФНО, в котором аминокислотное замещение выполняется с целью создания участка для ковалентного присоединения полиэтиленгликоля /ПЭГ/. В Ц105 аспарагин был замещен цистеином в положении 105 30 кДа ингибитора ФНО. В Ц105-ПЭГ 3400 гантельной молекуле, 2 молекулы Ц105 сшиты одной молекулой ПЭГ с приблизительной молекулярной массой 3400 дальтон. Гантельная молекула и процедура межмолекулярного сшивания молекулой ПЭГ более полно описаны в патентной заявке США N 07/669862, зарегистрированной 15 марта 1991 г. и озаглавленной “Сайт-специфическое межмолекулярное сшивание полипептидов молекулой ПЭГ”. Признаки этой заявки конкретно включены здесь путем ссылки. Процесс получения Ц105-ПЭГ 3400 с гантельной молекулой описан ниже в примере 5.
Группа I (см. табл. A) играет роль векторной контрольной группы для получавшей Ц105 группы IV. Группа II играет роль векторной группы для получавшей Ц105-ПЭГ 3400 с гантельной молекулой группы III. Введенная путем внутрисуставной инъекции суммарная доза составила 10 мкл, для введения использовалась игла 25 размера, присоединенная к автоматической пипетке. Сразу же после внутрисуставных инъекций в различных группах каждой крысе внутривенно ввели SCW /150 мкг эквивалент рамнозы/ с целью реактивации артрита. Кроме этого крысам не давали никакого другого лечения. Диаметры голеностопных суставов измеряли на 21, 22, 23 и 24 день.
Как и ожидалось, во всех группах в ответ на внутривенное введение SCW было отмечено опухание левого голеностопного сустава на 21 день /табл. 1 и фиг. 13/. Однако ответные реакции значительно различались в зависимости от вида лечения. В то время как суставы крыс в контрольных группах I и II опухали на 30% и 32% соответственно по сравнению со своими первоначальными размерами, суставы в группе III, получавшей Ц105-ПЭГ 3400 с гантельной молекулой, увеличились только на 15%, и в группе IV, получавшей Ц105 – на 25%. На фиг. 14 графически представлено максимальное увеличение диаметра сустава в течение 72-часового интервала после SCW-индуцированной реактивации в группах I, II, III и IV. Одна внутрисуставная инъекция Ц105-ПЭГ 3400 с гантельной молекулой обеспечивает статистически значимое уменьшение опухания артритных суставов.
Метод два. Во второй группе экспериментов, больным артритом крысам осуществили множественное подкожное вливание 30 кДа ингибитора ФНО в фосфатном буферном растворе /PBS/, используя ту же самую модель SCW артрита. Артрит был индуцирован путем введения каждой крысе в первый день в левый голеностопный сустав SCW /1,8 мкг эквивалент рамнозы/, а в правый голеностопный сустав вводили равный объем апирогенного физиологического раствора.
На 21 день после ослабления острого приступа артрита крысы были произвольно разбиты на четыре группы. Каждой крысе внутривенно ввели вторую дозу SCW /150 мкг-эквивалент рамнозы/ с целью реактивации артрита. В течение трех минут после инъекции девяти крысам в контрольной группе I ввели, а пяти крысам в каждой из групп II, III, и IV были введены 1, 3 и 9 мг на кг веса тела, соответственно, 30 кДа ингибитора ФНО в PBS. Через 2 и 6 ч после введения SCW были повторены подкожные инъекции PBS в группе I и 30 кДа ингибитора ФНО в группах II, III и IV /1, 3 и 9 мг/кг соответственно/, затем они повторялись каждые шесть часов в течение следующих 42 ч. Диаметры голеностопных суставов измерялись в 0, 24, 39, 48, и 72 ч после внутривенного введения.
На фиг. 15 и табл. 2 показаны максимальные изменения диаметров суставов в течение 72 ч после SCW-индуцированной реактивации артрита в четырех экспериментальных группах. Как и ожидалось, голеностопные суставы крыс в группе I, которым вводили физиологический раствор, опухли в ответ на внутривенное вливание SCW. Однако максимальное опухание в группах II, III, и IV сократилось на 58%, 85%, и 75% соответственно. В табл. 2 представлены результаты статистического анализа данных фиг. 15 с использованием критерия Стьюдента на средних значениях, прошедших логарифмическое преобразование.
Пример 4: Демонстрация воздействия человеческого рекомбинантного 30 кДа ингибитора ФНО на острую легочную травму, индуцированную эндотоксином у крыс как метода лечения респираторного дистресс-синдрома взрослых /РДСВ/.
В этом эксперименте используется септический стимул, эндотоксин, для индуцирования острой нейтрофил-обусловленной легочной травмы в соответствии с моделью, раскрытой в статье American Journal of Pathology 138: 1485-1496 /1991/, конкретно включенной здесь путем ссылки. Эта модель может быть коротко описана следующим образом: эндотоксин внутритрахеально вводится в среднецервикальный участок трахеи анестезированных крыс. По прошествии длящегося шесть часов латентного периода был выполнен бронхоальвеолярный лаваж легких в качестве терминальной процедуры. На материале полученной с помощью лаважа жидкости была получена гемограмма и определена лейкоцитарная формула. Внутритрахеальная инъекция аспирогенного физиологического раствора имела следствием преобладание альвеолярных макрофагов /приблизительно 99% в малом количестве. Внутритрахеальная инъекция эндотоксина вызвала значительное увеличение количества клеток в лаважной жидкости и преобладание нейтрофилов. Резкий приток нейтрофилов в альвеолярное пространство достигает пиковых значений через 6-12 ч и сопровождается аккумуляцией содержащей белок отечной жидкости в этом пространстве. Считается, что ФНО является одним из медиаторов индуцированного эндотоксином альвеолита. ФНО присутствует в лаважной жидкости после стимуляции эндотоксином. Считается, что альвеолярный макрофаг является источником его синтеза. Более того, внутритрахеальная инъекция экзогенного ФНО индуцирует острый внутриальвеолярный нейтрофильный экссудат, который в количественном отношении аналогичен экссудату, индуцированному эндотоксином.
Хотя считается, что животные модели не в полной мере воспроизводят заболевание у человека, в частности переход от острой к хронической стадии РДСВ, однако многие из них используются, а именно те, которые приближаются к измененному отеку легких, секвестрации лейкоцитов, а также гипоксемии во время острой стадии легочной парентиматозной травмы при РДСВ. J.F. Murray, et al., Am. Rev. of Respiratory Diseases, т. 138, с. 720-723 /1991/. Острые формы РДСВ имеют место в присутствии некоторых поддающихся выявлению факторов риска, как, например, сепсис, аспирация или многократные переливания крови. В современных исследованиях подчеркивается главная роль обусловленной нейтрофилами травмы в патофизиологии РДСВ /Tate, R.M. Am. Rev. Resp. Dis., т. 128, с. 552-559 /1983/. Считается, что токсические продукты, высвобождаемые активированным нейтрофилом повреждают мембрану альвеолярных капилляров. Проницаемость поврежденной мембраны значительно увеличивается, стимулируя движение белков плазмы и воспалительных клеток в альвеолярные пространства. В экспериментальной овечьей модели РДСВ септического происхождения снижение количества нейтрофилов защищает от развития легочной травмы /Heflin A.C. J. Clin. Invest. 68: 1253-1260 /1981/.
Был осуществлен метод лечения нейтрофильного альвеолита у крыс путем внутритрахеального введения 30 кДа ингибитора ФНО в PBS. Легочная травма была индуцирована введением эндотоксина /5 мкг одной крысе/ в общем объеме 0,5 мл стерильного PBS с помощью иглы 27 размера 1/2 дюйма, введенной между трахеальными кольцами в среднецервикальном участке трахеи. Во время медленного введения инокулята в трахею велось наблюдение за крысой и глубиной ее дыхания. Через шесть часов крысы были подвергнуты анестезии изофлураном с тем, чтобы можно было провести лапаротомию для облегчения осуществления лаважа легких. Каудальная полая вена была перерезана для уменьшения содержания крови в легких. Была вскрыта диафрагма для того, чтобы во время проведения лаважа легкие могли увеличиться в объеме. Бронхоальвеолярный лаваж был выполнен путем введения 40 мл сбалансированного физиологического раствора Ханка в бронхоальвеолярные пространства с помощью ангиокатетера, который был введен и закреплен на участке надреза среднецервикальной трахеи. Приток воспалительных клеток был восстановлен из осадка в пробирке, полученного в результате центрифугирования лаважной жидкости со скоростью 1500 об./мин в течение 15 мин. Общее количество лейкоцитов определено с помощью счетчика Коултера. Процентное содержание полиморфно-ядерных нейтрофилов было определено вручную путем определения лейкоцитарной формулы на слайде с окрашенными клетками.
Воздействие 30 кДа ингибитора ФНО на стимулированный эндотокоином приток клеток в бронхоальвеолярные пространства определялось при одновременном введении 30 кДа ингибитора ФНО и внутритрахеальной инстилляции эндотоксина. 30 кДа ингибитор ФНО испытывался в дозах от 1 до 10 мкг на одну крысу. Доза 30 кДа ингибитора ФНО, равная 1 мкг/1 крыса, не уменьшала приток нейтрофилов в альвеолярные пространства. Однако внутритрахеальное введение 30 кДа ингибитора ФНО в дозах от 2,5 мкг до 10 мкг одной крысе вызывало максимальное уменьшение притока нейтрофилов в альвеолярные пространства. В процентном выражении ингибирование клеточного притока у крыс, которым вводили 30 кДа ингибитор ФНО, при сравнении с нейтрофильным притоком у непролеченных крыс составило приблизительно 35% т /фиг. 16/. Общее количество нейтрофилов, присутствующих в бронхоальвеолярных пространствах, было значительно у крыс, пролеченных 30 кДа ингибитором ФНО в дозах от 2,5 до 10 мкг на одно животное /фиг. 17 и табл. 3/.
Пример 5: Получение Ц105-ПЭГ 3400 с гантельной молекулой.
Ц105-ПЭГ с гантельной молекулой соединения были получены в результате реакции цистеина, содержащего мутеин Ц105 30 кДа ингибитора ФНО, с ПЭГ-бис-малеимидом. Чтобы получить ПЭГ-бис-малеимид ПЭГ-трезилат был получен из ПЭГ-бис-диола, как это описано в статье Nilson and Mosback. Методы в ферментологии, т. 104, с. 56-69, Academic Press, Inc., Нью-Йорк /1984/. Количество сульфонированного промежуточного вещества определялось с помощью элементарного анализа для фтора. Это промежуточное вещество было преобразовано в производное соединение фталамида, которое было потом восстановлено гидратом гидразина до промежуточного веществ ПЭГ-бис-амина. Эти две реакции проводились согласно процедурам, описанным Pillai, et al., J. Org. Chem., т. 45, с. 5364-5370 /1980/. Количество каждого промежуточного вещества оценивалось с помощью элементарного анализа для азота. Кроме того, количество ПЭГ-бис-амина определялось реакцией с 2,4,6-тринитробензолсульфоновой кислотой. Производные соединения ПЭГ-бис-амина были преобразованы в соответствующие бис-малеимидные продукты в ходе реакции с малеиновым ангидридом путем адаптации процедур, описанных Butler and Hartley в Methods in Enzymology т. XXV, с. 191-199, Академик Пресс, Инк., Нью-Йорк /1972/, и путем циклизации промежуточного вещества согласно методу, описанному Wunschetal, Biol. Chem. Hoppe-Seyler, т. 366, p. 56-61 /1985/.
Мутеин Ц105 30 кДа ингибитора ФНО получается так, как это описано в патентной заявке США N 07/669862, поданной 15 марта 1991 г. Ц105 30 кДа ингибитор ФНО при концентрации 2-3 мг/мл был подвергнут воздействию дитиотреитола /ДТТ/ с четырехкратным молярным преобладанием в течение 2 ч при температуре окружающей среды. Затем мутеин подвергается диализу рядом с 50 мМ HEPES pH 7,0 в течение 3 ч при 4oC. Для получения соединения с гантельной молекулой – которое может рассматриваться как связанный димер полиэтиленгликоля /ПЭГ/ – диализованный мутеин прореигирован с ПЭГ-бис-малеимидом. Отношение мутеина к ПЭГ-бис-малеимиду меняется в зависимости от молекулярной массы ПЭГ соединения. Для ПЭГ-бис-малеимида с молекулярной массой около 1900 использовалось молярное соотношение 1:1, а для соединений ПЭГ с молекулярной массой 3400 или 20000 использовалось молярное соотношение мутеина к ПЭГ 2:1. Реакции инкубировались в течение 3-12 ч при температуре окружающей среды.
После инкубации ПЭГ-связанные димеры были очищены от не вступившего в реакцию с ПЭГ мутеина и от ПЭГ-мутеин мономеров с использованием MOHO-SFPLC /жидкостная экспресс-хроматография белков/ в 50 мМ HOAc pH 4,0, применяя 260 мМ, 310 мМ и 350 мМ NaCl ступенчатый градиент. Соединения с гантельной молекулой элюируются на этапе 310 мм NaCl. Оставшийся не вступивший в реакцию с ПЭГ мутеин удаляется с помощью хроматографии на superdex 75. Соединение Ц105-ПЭГ 3400 с гантельной молекулой относится к соединениям с гантельной молекулой /ПЭГ-связанный димер ингибитора ФНО/, где ингибитором ФНО является Ц105 мутеин 30 кДа ингибитора ФНО, а единица ПЭГ имеет молекулярную массу приблизительно 3400 дальтонов.
Несмотря на то, что настоящее изобретение было описано в связи с предпочтительными вариантами его осуществления, следует понимать, что специалисты в данной области техники могут осуществлять модификации и изменения, не выходя за пределы существа или объема настоящего изобретения. Таким образом, приведенные выше предлагаемые варианты осуществления настоящего изобретения не следует рассматривать в ограничивающем смысле, настоящее изобретение лучше всего определяет нижеследующая формула изобретения.
Формула изобретения
 53 40 кДа или его фрагмента или мутеина и ингибитора ФНО 53 40 кДа или его фрагмента или мутеина и ингибитора ФНО  51 40 кДа или его фрагмента или мутеина.
2. Способ по п.1, отличающийся тем, что в ингибиторе ФНО по меньшей мере один остаток аминокислоты заменен на остаток цистеина.
3. Способ по п.2, отличающийся тем, что указанные остатки аминокислоты, замененные на остатки цистеина, находятся в положении 105 ингибитора 30 кДа.
4. Способ по п.1 или 3, отличающийся тем, что ингибитор ФНО гликозилирован или ингибитор ФНО негликозилирован.
5. Способ по любому из пп.1 – 3, отличающийся тем, что ингибитор ФНО имеет остаток метионина при N-конце.
6. Способ по любому из пп.1 – 5, отличающийся тем, что ингибитор ФНО получают способами рекомбинантных ДНК.
7. Способ по любому из пп.1 – 6, отличающийся тем, что ингибитор ФНО является практически чистым.
8. Способ по любому из пп.1 – 7, отличающийся тем, что полипептид связан с полимером.
9. Способ по п.8, отличающийся тем, что полимер представляет собой полиэтиленгликоль.
10. Способ по любому из пп.1 – 9, отличающийся тем, что ингибитор ФНО вводят в виде фармакологически совместимой лекарственной формы для медленного высвобождения активного ингредиента.
11. Способ по любому из пп.1 – 10, отличающийся тем, что ингибитор ФНО вводят внутрисуставно, подкожно, внутримускульно, внутривенно, интраназально, перорально или местно.
12. Способ по любому из пп.1 – 11, отличающийся тем, что ингибитор ФНО вводят посредством непрерывной инфузии. 51 40 кДа или его фрагмента или мутеина.
2. Способ по п.1, отличающийся тем, что в ингибиторе ФНО по меньшей мере один остаток аминокислоты заменен на остаток цистеина.
3. Способ по п.2, отличающийся тем, что указанные остатки аминокислоты, замененные на остатки цистеина, находятся в положении 105 ингибитора 30 кДа.
4. Способ по п.1 или 3, отличающийся тем, что ингибитор ФНО гликозилирован или ингибитор ФНО негликозилирован.
5. Способ по любому из пп.1 – 3, отличающийся тем, что ингибитор ФНО имеет остаток метионина при N-конце.
6. Способ по любому из пп.1 – 5, отличающийся тем, что ингибитор ФНО получают способами рекомбинантных ДНК.
7. Способ по любому из пп.1 – 6, отличающийся тем, что ингибитор ФНО является практически чистым.
8. Способ по любому из пп.1 – 7, отличающийся тем, что полипептид связан с полимером.
9. Способ по п.8, отличающийся тем, что полимер представляет собой полиэтиленгликоль.
10. Способ по любому из пп.1 – 9, отличающийся тем, что ингибитор ФНО вводят в виде фармакологически совместимой лекарственной формы для медленного высвобождения активного ингредиента.
11. Способ по любому из пп.1 – 10, отличающийся тем, что ингибитор ФНО вводят внутрисуставно, подкожно, внутримускульно, внутривенно, интраназально, перорально или местно.
12. Способ по любому из пп.1 – 11, отличающийся тем, что ингибитор ФНО вводят посредством непрерывной инфузии.
РИСУНКИ
|
||||||||||||||||||||||||||
