Патент на изобретение №2166950
|
||||||||||||||||||||||||||
(54) ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОЛЛАГЕНАЗЫ МИКРОБНОГО ПРОИСХОЖДЕНИЯ
(57) Реферат: Изобретение относится к области медицины, в частности к созданию новой фармацевтической композиции, содержащей коллагеназу микробного происхождения. Сущность изобретения заключается в том, что фармацевтическая композиция содержит коллагеназу из Streptomyces lavendulae в расчете 3-10 ЕД на 100 г продукта. Кроме того, композиция содержит антисептик мирамистин, проксанол и полиэтиленгликоль. Техническим результатом является создание новой высокоэффективной нетоксичной, неаллергенной фармацевтической композиции для заживления и очищения раневых, ожоговых и других повреждений кожи на основе коллагеназы микробного происхождения. 1 з.п.ф-лы, 4 табл. Изобретение относится к области медицины, в частности к созданию новой фармацевтической композиции, содержащей протеолитические ферменты для очищения ран и других повреждений кожи, а именно микробную коллагеназу. Для лечения повреждений кожи (ран, ожогов, отморожений и т.д.) используют фармацевтические композиции, содержащие коллаген. Известны такие препараты, как “Метуракол”, “Колоцил”, коллагеновые губки. “Метуракол” одобрен Фармакологическим комитетом МЗ СССР (Рег. N 87/637/3) – комбинированный препарат, состоящий из коллагена, полученного из гольевого спилка крупного рогатого скота и метилурацила, представляет собой мелкопористые сухие пластины белого цвета со специфическим запахом. “Метуракол” применяют в качестве местного средства при комплексном лечении трофических язв, пролежней, глубоких и длительно не заживающих ран, поверхностных ожогов кожи. Препарат оказывает противовоспалительное действие, стимулирует репаративные процессы в ранах, ускоряя рост и созревание грануляционной ткани и эпителизацию. При наложении на рану “Метуракол” плотно прилегает к ее поверхности, впитывает раневое отделяемое, набухает и постепенно лизируется, освобождая входящий в его состав метилурацил. Губка “Колоцил”, Приказ МЗ СССР N 1353 от 30.11.1984 года (Регистрационный N 8/353/9), является комбинированным препаратом, содержит коллаген, получаемый из гольевого спилка крупного рогатого скота, фурацилин, борную кислоту, новокаин, хонсурид, представляет собой трехслойные мелкопористые пластины желтого и белого цвета со слабым специфическим запахом. “Колоцил” применяют как местное средство для лечения термических ожогов II-III степени в начальной стадии их эпителизации и для временного закрытия гранулирующих ран при ожогах IIIб-IV степени. Препарат также назначают при лечении донорских участков кожи, трофических язв, пролежней, глубоких ран. “Колоцил” оказывает стимулирующее действие на репаративные процессы в ранах, ускоряя рост грануляционной ткани и эпителизацию, обладает противовоспалительным, гемостатическим и анестезирующим свойствами, а также препятствует плазмопотере через раневую поверхность. Губку гемостатическую коллагеновую (Регистрационный N 78/860/7) готовят из раствора коллагена, полученного из гольевого спилка крупного рогатого скота. В состав губки входят борная кислота и фурацилин. Она представляет собой сухую пористую массу желтого цвета со слабым запахом уксусной кислоты, хорошо впитывает жидкость, при этом слегка набухает. Губка оказывает гемостатические и антисептическое действие, стимулирует регенерацию тканей. Губка коллагеновая с сангвиритрином (Регистрационный N 96/399/3) содержит 0,005 г сангвиритрина и раствор коллагена 2% (50 г) и представляет собой пластины желтовато-оранжевого цвета, она оказывает антимикробное и противовоспалительное действие, стимулирует восстановительные процессы, заживляет раны, хорошо впитывает раневое отделяемое. Коллагеновую губку с сангвиритрином применяют для лечения инфицированных ран, в том числе нагноившихся послеоперационных гнойных ран в 1 и 2 фазах раневого процесса, открытых инфицированных переломах, ожоговых и длительно не заживающих ран и трофических язв. “Дигиспон” (Московский ВНИИМП и Институт хирургии им. А.В. Вишневского) – повязка гелевинколлагеновая антимикробная на основе раствора коллагена, содержит гелевин, диоксидин, глутаровый альдегид, представляет собой мягкие пористые пластины. “Дигиспон” предназначен для лечения и подготовки к аутодермопластике ожогов IIIa, IIIб и IV степени с осложненным течением, после удаления струпа, лечения плоских инфицированных, вялотекущих длительно незаживающих ран, трофических язв, пролежней. Покрытие сорбирует 40+3 г/г биологических жидкостей, паровоздухопроницаемо, пластично, обеспечивает пролонгированный дозированный выход диоксидина в рану, стимулирует репаративные процессы в условиях инфицированных ран, рост грануляционной ткани, ускоряет краевую и островковую эпителизацию, способствует снижению риска образования грубой рубцовой ткани. Препараты, содержащие коллаген, обладая рядом преимуществ, имеют и некоторые недостатки, в частности каждый из названных препаратов может быть использован только на определенной стадии раневого процесса, иногда только для тяжелых ранений и других тяжелых повреждений кожи и близлежащих тканей, не обеспечивает очищение ран от некротизированных тканей. Наиболее известный препарат широкого применения “Солкосерил” (Инструкция по применению. Специальная информация “Солко”, 1990 г.) для заживления ран, возникающих от порезов, ожогов и отморожений, не разрушает коллагеновые некротические ткани и требует сложного индивидуального терапевтического подхода при использовании. Недостатком большинства применяемых в настоящее время препаратов, заживляющих кожные повреждения, является обусловленная их составом узкая направленность действия, неспособность к функционированию на разных стадиях патологического процесса, а также к воспроизведению травмированного нарастающего эпителия и стимулированию регенерации кожи и близлежащих тканей. Кроме того, с их помощью не удается достичь оптимального очищения раны, так как они не содержат коллагеназу и не способны к разложению коллагена в нативном состоянии. Коллагеназа – фермент, обладающий протеолитической активностью с узко специфической направленностью к расщеплению коллагена с выделением свободной аминокислоты – оксипролина. По международной классификации ферментов коллагеназа имеет номер 3.4.24.3 (3-гидролаза, 3.4.-действует на пептидные связи, 3.4.24. – металлопротеиназа (содержит кальций). Известны два типа коллагеназ: В качестве исходного материала для выделения коллагеназы использовали среду, в которой культивировали эксплантаты ткани кожи и хвостового плавника головастиков. После очистки был получен препарат фермента, содержащий в небольшом количестве (5%) примеси других протеиназ, обладающих казеинолитической активностью. Коллагеназа животных тканей имеет меньший молекулярный вес, чем бактериальная и отличается от последней по ряду других свойств. Было установлено, что фермент инактивируется цистеином и после прогревания при 50-60o в течение 10 минут имеет оптимум действия при pH 7,0-8,0. Коллагеназа является уникальным ферментом, который способен избирательно гидролизовать нерастворимый белок – коллаген, входящий в состав соединительной ткани живого организма. Расщепляя крайне устойчивые к действию других протеаз коллагеновые волокна с образованием высокомолекулярных фрагментов, коллагеназа выполняет в организме человека и животных важнейшие функции, участвует в превращениях соединительной ткани при росте и морфогенезе, а также в устранении некоторых патологических процессах при артритах, опухолевых метастазах и т.д. Коллагеназы, действующие на коллагены разных типов, выделены из тканей позвоночных, крабов, личинок мух, экскретов насекомых, а также из микроскопических бактерий, грибов и актиномицетов. Известная в настоящее время группа микробных коллагеназ, отличающаяся большим разнообразием свойств, может быть использована в фундаментальных научных исследованиях, а также в биотехнологии, когда необходим эффективный, специфический и быстрый гидролиз нативных и денатурированных коллагеновых волокон различных типов. Важная область применения – при терапии грыжи интервертебрального диска позвоночника, ожоговых ран, отморожений для ускорения отторжения струпов и некротических язв, для очищения гнойно-некротических налетов. Кроме того, они необходимы для получения и культивирования клеточных культур человеческих и животных тканей, являющихся источником активаторов плазминогенеза в тромболитической терапии. Выделенные с помощью микробных коллагеназ жизнеспособные клетки островков Лангерганца применяют в новой методике лечения диабета (В.И. Мазуров Биохимия коллагеновых белков. – М.: Медицина, 1974). Среди коллагеназ микробного происхождения наиболее изученными и хорошо известными являются коллагеназы, синтезируемые бактерией Clostridium histolyticum. Клостридиальные коллагеназы характеризуются высокой специфичностью действия на коллагеновые волокна и могут быть отнесены к “истинным” коллагеназам. Они широко используются в биотехнологии и для лабораторных целей. Однако для культивирования Cl. histolyticum и массовой продукции коллагеназы необходимы сложные меры предосторожности, так как эта бактерия является анаэробным патогеном, вызывающим газовую гангрену и продуцирующим токсины. Для оптимального биосинтеза коллагеназ культурой Cl. Histolyticum использовалась сложная питательная среда. Высокоочищенные клостридиальные коллагеназы проявляют активность против нативного и денатурированного коллагена и не действуют на другие белки, в то время как неочищенные препараты, содержащие и другие протеазы. способны расщепить не только коллаген, но и другой внеклеточный материал, в связи с чем широко используются для изоляции клеток в различных типах животных тканей. Как и коллагеназы амфибий, очищенные клостридиальные коллагеназы могут гидролизовать коллаген для полного его растворения, действуя как на волокнистый нативный коллаген, так и на трехспиральные тропоколлагеновые частицы. Очищенная коллагеназа из Achromobacter iophagus проявляла высокую специфичность действия, гидролизуя только коллаген и не действуя на другие субстраты. Активность ее была в 6 раз более высокой, чем активность клостридилпептидазы. Свойства коллагеназ из A. iophagus и Cl. histolyticum оказались сходными. На их активность не влиял парахлормеркурийбензоат. Установлено, что оба препарата являются металлоферментами, содержащими Zn в активном центре и сохраняющими активность в присутствии ионов Ca2+. У некоторых штаммов микроорганизмов обнаружена способность к биосинтезу внеклеточных низкомолекулярных коллагенолитических протеаз нового серинового типа, отличающихся от “истинных” коллагеназ в первую очередь строением активного центра. Такие же коллагеназы выделены из насекомых Hypoderma lineatum и краба Uca pugilator. В последние годы появились ранозаживляющие композиции, содержащие коллагеназу. В частности патент RU 2033805, 30.04.95 описывает способ получения пористого ранозаживляющего материала, содержащего раствор коллагеназы. Микробиальный полисахарид маннан растворяют в воде до концентрации 6-8 маc.%, а затем смешивают с равным объемом коллагеназы. Этот лекарственный препарат выполняет только одну функцию – очистку раневой поверхности от некротической ткани, не обладает антисептическими свойствами, не освобождает раны от гноя и экссудата. Наиболее близким к предлагаемой композиции является препарат “Ируксол” (Германия, фирма Кнолл АГ Д-67008 Людвигскафен) (Машковский М.Д. Лекарственные средства. – М.: Медицина, 1988 г.), который содержит коллагеназу в смеси с протеазами, выделенными из бактериальной культуры Clostridium histolyticum (справочник “Sigma”, 2000, с. 274). 1 г мази содержит клостридиопептидазы A 0,6 ЕД, хлорамфеникола 10 мг, сопутствующие энзимы в липофильной безводной мазевой основе. “Ируксол” является комбинированным препаратом с протеолитическим и противомикробным действием для наружного применения. Коллагеназа – протеолитический фермент, выделенный из Clostridium histolyticum, вызывает лизис некротических тканей, тем самым способствуя энзиматическому, безболезненному очищению раны. Кроме того, коллагеназа стимулирует процесс грануляции и не угнетает эпителизацию. Коллагеназа не оказывает действия на неповрежденный эпителий, грануляционную, жировую и мышечные ткани. Хлорамфеникол является антибиотиком широкого спектра действия, активен в отношении грамотрицательных и грамположительных бактерий. Очищающее действие мази “Ируксол” на рану у 97% больных начинается с 1 дня или не позже 14-го дня, при этом более чем у 50% больных эффект мази проявляется уже в течение первых 6-ти дней. “Ируксол” применяется для энзиматического очищения ран, в том числе при варикозных язвах, пролежнях, при гангрене конечностей, в особенности у больных сахарным диабетом, а также при отморожениях, при длительно незаживающих послеоперационных ранах, после лучевой терапии, при подготовке к трансплантации кожи. Технической задачей данного изобретения является создание новой более эффективной и экономически выгодной ранозаживляющей композиции, которая характеризуется разносторонней направленностью действия, многофункциональностью, способностью удалять некротические ткани, гной и экссудат из ран, осуществлять быстрое их заживление, не пересушивать ткани, активно удалять струпы, улучшать качественный состав рубцовой ткани, оптимизировать процессы репарации, подавлять патогенную микрофлору, не вызывая аллергических реакций, и тем самым создать возможность использования одного препарата для многовекторного воздействия на раневой процесс в разных стадиях его течения. Указанная цель достигается тем, что новая фармацевтическая композиция содержит коллагеназу из Streptomyces lavendulae из расчета 3-10 Ед на 100 г продукта. Композиция может содержать вспомогательные вещества, такие как антисептики, различные мазевые наполнители и фармацевтически приемлемые добавки. В частности нами изучена композиция, состоящая из следующих компонентов: Коллагеназа из Streptomyces lavendulae – 3-10 ЕД Мирамистин – 0,1-0,5 г Проксанол – 22,0 – 30,0 г Полиэтиленгликоль – Остальное до 100 г В качестве активного начала композиции выбрана коллагеназа, которая действует избирательно только на коллагеновые волокна, осуществляет щадящее и бескровное оптимальное очищение ран от некротизированных тканей. Этот фермент выделен из непатогенного штамма Streptomyces lavendulae (патент RU N 2075219, 10.03.97). В патенте описана коллагеназа, выделенная из культуральной жидкости штамма Streptomyces lavendulae, обладающая коллагенолитической и общей протеолитической активностью, расщепляет бета-цепь нативного коллагена до 84-86 кДа+26-28кДа, имеет М.м. 110-120 кДа. Кроме того, в фармацевтическую композицию введен мирамистин (ФС 42-3498-98), являющийся антисептиком широкого спектра действия, не вызывающим аллергию. Далее композиция содержит проксанол (НТУ-6-14-164-87), обладающий способностью оттягивать экссудат и гной из ран. В качестве основы композиция включает фармацевтически приемлемый полиэтиленгликоль. Было проведено разностороннее изучение ранозаживляющего действия заявленной композиции: исследование влияния композиции на скорость регенерации повреждения кожи в асептических условиях, влияние на такую скорость при инфицировании раны, влияние композиции на качество образования рубца. Для проведения перечисленных исследований были выбраны следующие адекватные поставленным целям экспериментальные модели. Модель плоскостной асептической раны кожи. Модель линейной раны кожи. Модель инфицированной (гнойной) раны. Модель ожоговой раны. Для получения модели и оценки результатов использовали известные методы. (Турищев С.Н., Фармакология 4/5, 25-36, 1996) Модель плоскостной асептической раны кожи была получена следующим образом. Опыты проведены на белых неинбредных мышах самцах массой 20-30 г. У животных в стерильных условиях под наркозом (этаминал натрия 50 мг/г) в межлопаточной области спины после предварительного удаления волос вырезали полнослойный лоскут кожи таким образом, чтобы получалась овальная рана площадь которой составляла 80-100 мм. Для сравнительного изучения динамики и заживления ран проводили визуальное наблюдение и измерение площади ран в течение 2-3 недель ежедневно, оценивая состояние краев раны, ее отделяемое, формирование рубца. Лечение животных начинали сразу же после операции: на рану наносили испытуемое вещество в виде мази. Контрольные животные получали плацебо. В качестве препарата сравнения использовано известное ранозаживляющее средство – “Ируксол” (Машковский). Скорость заживления ран оценивали по уменьшению площади раневой поверхности. Площадь овала рассчитывали по математической формуле: 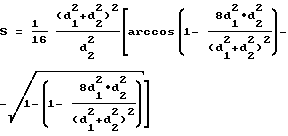 где d1 – больший диаметр овала; d2 – меньший диаметр овала; S – площадь раны. Модель линейной раны кожи получена в эксперименте следующим образом. Опыты проведены на белых неинбредных крысах-самцах массой 300 г. У животных под наркозом (этаминал натрия 40 мг/кг) в межлопаточной области спины после предварительного удаления волос наносили 2 линейных разреза через все слои кожи длиной 1 см по одному справа и слева от позвоночника (примерно на расстоянии 2 см от него). На рану накладывали один узловой шов (стерильный шелк). Для сравнительного изучения динамики и заживления ран проводили визуальное наблюдение в течение 2-3 недель ежедневно, оценивая состояние краев раны, ее отделяемое, формирование рубца. Качество заживления оценивали при микроскопическом исследовании регенератов. Для этого ткани из области дефекта и прилежащую к нему кожу фиксировали в жидкости Карнуа, заливали в парафин и готовили срезы (толщиной 8-10 мкм. Срезы окрашивали гематоксилином и эозином. Лечение животных начинали сразу же после операции. На рану справа наносили испытуемую композицию в форме мази. Левая рана того же животного служила контролем – на нее наносили основу мази. Препарат сравнения – “Ируксол”. Модель инфицированной (гнойной) раны была получена экспериментальным путем В опытах использованы белые неинбредные крысы массой 300-320 г. Под общим наркозом на тыльной стороне шейной области крыс выстригали волосы и в асептических условиях удаляли участок кожи с подкожной клетчаткой и поверхностной фасцией. В рану вставляли тефлоновое кольцо (диаметр 8 мм), покрытое сверху перфорированной пленкой. Края и дно раны дополнительно травмировали зубчатым зажимом. В раневую поверхность внутрь кольца вводили 0,5 мл взвеси суточной культуры патогенного стафилококка, штамм 209 (1.5 млрд. микробных клеток в 1 мл физ. р-ра). Кольца снимали через 2 суток и проводили стандартную первичную хирургическую обработку раны, после чего начинали лечение испытуемым веществом. Контрольные животные получали плацебо (основу мази). В качестве методов оценки скорости и полноты заживления ран использованы следующие методы. Цитологическое исследование раневого процесса Мазок-отпечаток с поверхности раны позволяет судить о характере раневого отделяемого и клеточном составе грануляций. Такой мазок получают путем прикосновения специально обработанного предметного стекла к поверхности раны, предварительно очищенной от гноя. Препараты сушат на воздухе, фиксируют метиловым спиртом и окрашивают по Романовскому-Гимзе. В каждом мазке подсчитывают не менее 400 клеток: нейтрофильные лейкоциты, мононуклеары, макрофаги, фибробласты, а также их процентное содержание. Микробиологическое исследование инфицированной раны Микробиологический контроль эффективности лечения ран проводится в динамике (каждые 3 дня) по сравнению с исходными показателями (до начала лечения). Изучается качественный состав микрофлоры раны и количественная динамика микробных тел в ране. Гистологические исследования в динамике заживления ран дают представление о качественных изменениях в ране под воздействием препарата. Использована окраска гематоксилином и эозином Морфометрическое исследование рубцовой ткани Кусочки кожи, взятые на 13 сутки после операции для гистологического исследования, фиксировали в жидкости Карнуа, изготовляли ступенчатые парафиновые срезы, окрашивали гематоксилином и эозином и просматривали в световом микроскопе. Проводили морфометрическое исследование рубцовой ткани: в серийных препаратах с помощью сетки Автандилова Г.Г. методом точечного счета определяли объемную плотность соединительной ткани и клеточных элементов. Подсчитывали процентное содержание фибробластов на 500 клеток. Полученные результаты обрабатывали с помощью статистических методов: определяли среднее арифметическое значение, ошибку средней арифметической, достоверность различий между группами определяли с использованием критерия Стъюдента. Для проведения сравнительных исследований использовали 3 группы животных. Первая группа животных получала лечение мазью на основе заявленной композиции при содержании активного компонента 3 ед., вторая группа животных получала лечение мазью на основе заявленной композиции с содержанием активного компонента 7 ед. Третья группа животных получала лечение мазью “Ируксол”. В качестве контроля во всех трех группах использовали плацебо. Результаты исследования приведены в таблицах 1 и 2. В таблице 1 приведены показатели динамики заживления ран кожи спины у мышей (площадь плоскостных ран (эллипса) в мм2 под влиянием заявленной композиции. В таблице 2 приведены морфометрические показатели, характеризующие заживление линейных ран кожи у крыс в контроле и при воздействии заявленной композиции. Результаты исследований, проведенных на моделях линейных и плоскостных ран, показали, что заявленная композиция обладает ранозаживляющими свойствами и, кроме того, положительно влияет на качественный состав рубцовой ткани, образующейся при заживлении асептических ран, о чем свидетельствует соотношение фибробластов и фиброцитов в соединительной ткани рубца ран, леченных мазью. Изобретение поясняется следующими примерами рецептур. Пример 1. Коллагеназа из Streptomyces lavendulae – 3 ЕД Мирамистин – 0,1 г Проксанол – 22,0 г Полиэтиленгликоль – остальное до 100 г Пример 2. Колагеназа из Streptomyces lavendulae – 10 ЕД Мирамистин – 0,5 г Проксанол – 30,0 г Полиэтиленгликоль – остальное до 100 г Для токсикологического исследования использован активный ингредиент композиции, т.е. содержащий ферментативные компоненты, этот ингредиент имеет коричневый цвет, специфический запах, pH = 5,0-7,0. Изучение острой токсичности субстанции проводилось на белых мышах (самцы и самки с массой тела 19-21 г). Эксперименты выполнены в соответствии с “Методическими рекомендациями по изучению общетоксического действия (фармакологических средств” (1997). Субстанцию активного ингредиента вводили животным (мышам) внутривенно, однократно, в объеме 0,2-0,5 мл, со скоростью 0,1 мл/с. Длительность наблюдения за мышами составляла 10-15 дней. В ходе эксперимента следили за поведением, внешним видом, двигательной активностью, реакцией животных на внешние раздражители. В случаях летального исхода фиксировались клиническая картина и проводилось вскрытие погибших мышей. При внутривенном введении препарата мышам в дозах до 3500-4000 ЕД/кг признаков интоксикации не наблюдалось. Животные оставались подвижными, нормально реагировали на окружающую среду. При дальнейшем увеличении дозы введенного вещества отмечалась гибель отдельных животных. Были установлены среднесмертельные дозы (LD50) для мышей при однократном внутривенном введении субстанции: LD50=12400  2500 ЕД/кг.
Максимально переносимая доза вещества при внутривенном введении мышам составляла 2500 ЕД/кг.
Максимально переносимая доза вещества при внутривенном введении мышам составляла  4500 ЕД/кг. В этих случаях при наблюдении за животными в течение 2 недель гибели не отмечено.
Были также проведены исследования на микробиологическую чистоту и пирогенность заявленной композиции.
Были проведены исследования на наличие пирогенных примесей в препарате. Испытание проводили на кроликах породы Шиншилла, содержащихся на стандартном рационе вивария.
Так как данный препарат применяется только наружно в качестве мази, установить четкую терапевтическую дозу сложно. Поэтому для подбора тест-дозы для испытания на пирогенность мы использовали дозу на коллагеназный препарат – 5 ЕД/кг.
Установлено, что этот препарат в тест-дозе 5 ЕД на кг массы животного – пирогенен.
Отмечена тенденция снижения пирогенной реакции с уменьшением вводимого объема.
Установление четкой терапевтической дозы позволит более надежно подобрать тест-дозу на пирогенность. Проведение дополнительных испытаний с новыми образцами препарата, в минимальном объеме разбавителя, в обоснованной тест-дозе, возможно, позволит получить результаты, свидетельствующие об отсутствии пирогенности.
Сравнительное изучение антимикробной активности нашей композиции и мази “Ируксол” проводилось методом “колодцев” (Методические рекомендации по экспериментальному – доклиническому изучению лекарственных препаратов для местного лечения ран. – М., 1989), для чего использовались среды N 3 и N 6 (рецептуры названных сред приведены в указанных рекомендациях). В качестве тест-культур были использованы клинические свежевыделенные штаммы микроорганизмов (S. aureus, S. epidermidis, Е. Coli., Proteus sp., P. aeruginosa), от больных с гнойными ранами мягких тканей.
Выделение и идентификация чистой культуры проводилось методом, изложенным в методических рекомендациях “Бактериологическая диагностика раневой инфекции” (М., 1984). Микроорганизмы выращивали на плотной питательной среде – на мясо-пептонном агаре.
Микробная взвесь тест-культур готовили в соответствии со стандартом мутности Государственного института санитарного контроля (ГИСК) им. Л.А. Тарасевича. Концентрация опытной взвеси составляла 108 микробных клеток в 1 мл.
Опытные и контрольные микроорганизмы культивировали в термостате при температуре – 37oC в течение 24 – 48 часов. По зоне задержки роста микроорганизмов учитывали результаты.
Изучена антимикробная активность: 4500 ЕД/кг. В этих случаях при наблюдении за животными в течение 2 недель гибели не отмечено.
Были также проведены исследования на микробиологическую чистоту и пирогенность заявленной композиции.
Были проведены исследования на наличие пирогенных примесей в препарате. Испытание проводили на кроликах породы Шиншилла, содержащихся на стандартном рационе вивария.
Так как данный препарат применяется только наружно в качестве мази, установить четкую терапевтическую дозу сложно. Поэтому для подбора тест-дозы для испытания на пирогенность мы использовали дозу на коллагеназный препарат – 5 ЕД/кг.
Установлено, что этот препарат в тест-дозе 5 ЕД на кг массы животного – пирогенен.
Отмечена тенденция снижения пирогенной реакции с уменьшением вводимого объема.
Установление четкой терапевтической дозы позволит более надежно подобрать тест-дозу на пирогенность. Проведение дополнительных испытаний с новыми образцами препарата, в минимальном объеме разбавителя, в обоснованной тест-дозе, возможно, позволит получить результаты, свидетельствующие об отсутствии пирогенности.
Сравнительное изучение антимикробной активности нашей композиции и мази “Ируксол” проводилось методом “колодцев” (Методические рекомендации по экспериментальному – доклиническому изучению лекарственных препаратов для местного лечения ран. – М., 1989), для чего использовались среды N 3 и N 6 (рецептуры названных сред приведены в указанных рекомендациях). В качестве тест-культур были использованы клинические свежевыделенные штаммы микроорганизмов (S. aureus, S. epidermidis, Е. Coli., Proteus sp., P. aeruginosa), от больных с гнойными ранами мягких тканей.
Выделение и идентификация чистой культуры проводилось методом, изложенным в методических рекомендациях “Бактериологическая диагностика раневой инфекции” (М., 1984). Микроорганизмы выращивали на плотной питательной среде – на мясо-пептонном агаре.
Микробная взвесь тест-культур готовили в соответствии со стандартом мутности Государственного института санитарного контроля (ГИСК) им. Л.А. Тарасевича. Концентрация опытной взвеси составляла 108 микробных клеток в 1 мл.
Опытные и контрольные микроорганизмы культивировали в термостате при температуре – 37oC в течение 24 – 48 часов. По зоне задержки роста микроорганизмов учитывали результаты.
Изучена антимикробная активность:– основы композиции (комбинация проксанола и полиэтиленгликоля); – мазевой композиции без мирамистина (коллагеназа + проксанол + полиэтиленгликоль); – заявленной композиции, в составе которой вышеуказанная основа, мирамистин и коллгеназа. Контрольным препаратом был “Ируксол” – комбинированный препарат, в составе которого – жировая основа, коллагеназа и хлорамфеникол. Результаты изучения антимикробной активности представлены в таблице 4. Результаты свидетельствуют, что разработанная композиция мази является активным препаратом и в отношении грамположительной и грамотрицательной флоры. Учитывая, что в группу Staphylococcus входили коагулазонегативные и метициллинрезистентные штаммы (25%), результаты можно считать положительными. Положительные результаты получены и в отношении P. aeruginosa, зона задержки роста 15,8 мм указывает на чувствительность синегнойной палочки к испытываемой мази, хотя известно, что P. aeruginosa часто оказывается полирезистентной к антибактериальным средствам. Меньшую активность заявленная композиция оказывает в отношении бактерий семейства Enterobacteriaceae – E. coli, Proteus, их чувствительность можно сравнивать как среднюю, но здесь необходимо учитывать, что компоненты, составляющие мазевую основу, относят к полупроницаемым. В соответствии с современными представлениями сочетание полупроникающих и непроникающих компонентов внутрь клеток предохраняет здоровые ткани раны от осмотического шока и делает их применение безвредным. Как видно из представленной таблицы, все изучаемые штаммы микроорганизмов были резистентны к мази “Ируксол”. Проведенные исследования мази на стерильность показали отсутствие микроорганизмов в заявленной композиции. Таким образом, проведенные исследования по изучению новой композиции на основе коллагеназы, выделенной из Streptomyces lavendulae, показали, что предлагаемый новый препарат является высокоэффективным, нетоксичным, неаллергенным средством для заживления раневых, ожоговых и других повреждений кожи. Формула изобретения
Коллагеназа – 3 – 10 ЕД Мирамистин – 0,1 – 0,5 г Проксанол – 22,0 – 30,0 г ПЭГ – Остальное до 100 г РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 34-2003
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 06.10.2003 № 17459
Извещение опубликовано: 10.12.2003
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 4-2004
(73) Патентообладатель:
(73) Патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 06.10.2003 № 17459
Извещение опубликовано: 10.02.2004
QB4A Регистрация лицензионного договора на использование изобретения
Лицензиар(ы): ОАО “Система-Венчур”
Вид лицензии*: НИЛ
Лицензиат(ы): ЗАО “ИНФАМЕД”
Номер и год публикации бюллетеня: 21-2004
Договор № 19258 зарегистрирован 08.06.2004
Извещение опубликовано: 27.07.2004
* ИЛ – исключительная лицензия НИЛ – неисключительная лицензия
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 19.02.2007 № РД0018845
Извещение опубликовано: 27.03.2007 БИ: 09/2007
QZ4A – Регистрация изменений (дополнений) лицензионного договора на использование изобретения
Лицензиар(ы): Открытое акционерное общество “Система-Венчур”
Вид лицензии*: НИЛ
Лицензиат(ы): Закрытое акционерное общество “ИНФАМЕД”
Характер внесенных изменений (дополнений):
Дата и номер государственной регистрации договора, в который внесены изменения:
Извещение опубликовано: 27.03.2007 БИ: 09/2007
* ИЛ – исключительная лицензия НИЛ – неисключительная лицензия
|
||||||||||||||||||||||||||
