Патент на изобретение №2166946
|
||||||||||||||||||||||||||
(54) СОСТАВ, СОДЕРЖАЩИЙ 1,2,4-БЕНЗОТРИАЗИН-3-АМИН-1,4-ДИОКСИД, ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ И СПОСОБ ЛЕЧЕНИЯ С ЕГО ПРИМЕНЕНИЕМ
(57) Реферат: Изобретение может быть использовано в медицине для терапии злокачественных новообразований. Состав для парентерального введения имеет форму раствора. Он содержит терапевтически эффективное количество 1,2,4-бензотриазин-3-амин-1,4-диоксида и цитратный буфер с концентрацией 0,005-0,05 М, обеспечивающий рН раствора от 3,7 до 4,3. Состав может дополнительно содержать 0,100-9,000 г хлорида натрия, 0,9000-10,00 г лимонной кислоты и 0,200-3,000 г гидроксида натрия в 1000 мл раствора. Способ лечения злокачественных опухолей заключается в том, что больному вводят терапевтически эффективное количество заявленного состава. Раствор стабилен при хранении и может быть использован для внутривенного и внутримышечного введения. Стабильность раствора упрощает его применение для лечения раковых больных. 2 с. и 3 з.п. ф-лы, 4 табл. Настоящее изобретение относится к терапии злокачественных новообразований. В частности, настоящее изобретение относится к терапии злокачественных опухолей с использованием 1,2,4-бензотриазин-3-амин-1,4-диоксида в носителе в виде водного забуференного раствора. Известно использование в данной области 1,2,4-бензотриазиноксидов. В патенте США N 3980779 описаны составы на основе 3-амино-1,2,4-бензотриазин-1,4-диоксида формулы 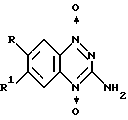 где в одном варианте каждый из радикалов R и R1 означает водород, галоген, низший алкил, галогензамещенный (низший алкил), низший алкокси, карбамоил, сульфонамидо, карбокси или карбо(низший алкокси), а в другом варианте каждый из радикалов R и R1 означает группу галогена, низший алкил, галогензамещенный (низший алкил), низший алкокси, карбамоил, сульфонамидо, карбокси или карбо(низший алкокси), которые используют в качестве антимикробного препарата для ускорения роста поголовья скота. В патенте США 5175287, опубликованном 29 декабря 1992, раскрывается использование 1,2,4-бензотриазиноксидов в сочетании с лучевой терапией для лечения злокачественных новообразований. Под действием 1,2,4-бензотриазиноксидов происходит сенсибилизация опухолевых клеток к облучению и они легко поддаются лечению по этой методике. Holden и др. в статье “Потенцирование активности алкилирующих соединений с помощью SR-4233 при мышиной фибросаркоме FsallC”, JNCI, вып. 84: стр. 187-193 (1992), описывает использование в комбинации с противоопухолевым алкилирующим средством соединения SR-4233, или 3-амино-1,2,4-бензотриазин-1,4-диоксида, который также хорошо известен в данной области и далее в описании иногда упоминается как тирапазамин. Были проведены испытания четырех противоопухолевых алкилирующих средств, в частности цисплатина, циклофосфамида, кармустина и мелфалана, с целью проверки способности тирапазамина сенсибилизировать гипоксичные опухолевые клетки к воздействию алкилирующих веществ. Тирапазамин испытывали как в чистом виде, так и в комбинации с каждым из указанных противоопухолевых алкилирующих средств, взятых в различных дозах. При однократном введении SR-4233 непосредственно перед лечением в комбинации с циклофосфамидом, кармустином или мелфаланом отмечено заметное усиление эффекта дозы, обеспечивающее синергическое цитотоксическое их действие на опухолевые клетки. В международной заявке PCT/US89/01037 описаны 1,2,4-бензотриазиноксиды, пригодные для использования в качестве радиосенсибилизаторов и избирательно действующих цитотоксических веществ. В других родственных патентных документах, например в патентах США N 3868372 и 4001410 раскрывается лекарственный препарат на основе 1,2,4-бензотриазиноксидов; в патентах США N 3991189 и 3957799 описаны соединения класса 1,2,4-бензотриазиноксидов. Члены класса 1,2,4-бензотриазиноксидов, как установлено, эффективны при лечении злокачественных опухолей при использовании их в сочетании с лучевой терапией и химиотерапией. Лучевая терапия и химиотерапия, наряду с хирургическим лечением, остаются в настоящее время основными методами в терапии рака. Лучевую терапию и химиотерапию используют в качестве альтернативы хирургическому методу лечения при первичном контроле большого количества различных видов злокачественных опухолей в тех случаях, когда радикальная операция ограничена анатомическими соображениями. Результаты современных исследований свидетельствуют о том, что более высокий показатель эффективности лечения и улучшение качества жизни ракового больного можно обеспечить путем повышения эффективности лучевой терапии и химиотерапии. Один из способов повышения эффективности лучевой терапии или химиотерапии основан на использовании феномена гипоксии, которая имеет место, то есть одном из немногочисленных различий, имеющихся между здоровой и опухолевой тканями. Аномальное развитие системы кровеносных сосудов является характерной особенностью большого числа твердых (солидных) злокачественных опухолей. Эта патология капиллярной системы часто приводит к гипоксии в тканях, как транзиторной, так и постоянной. По существу, при гипоксии повышается чувствительность к терапии клеток, как нормальных, так и опухолевых. Способ, который потенцирует механизм гибели гипоксичных опухолевых клеток (или ограничивает разрушение клеток здоровой ткани, обусловленное облучением), позволяет повысить терапевтический индекс облучения или химиотерапии. В ходе создания лекарственных средств на основе соединений ряда бензотриазинов использовали феномен этой относительной гипоксии в опухолевой ткани. В настоящее время тирапазамин – наиболее многообещающее соединение бензотриазинового ряда биологически восстанавливается в состоянии гипоксии до активного промежуточного соединения. Это активное промежуточное соединение может индуцировать повреждение ДНК, которая, в свою очередь, усиливает эффекты облучения или химиотерапии и сама обладает цитотоксичностью. Поскольку окружающие опухоль здоровые ткани не гипоксичны, этот биологический процесс восстановления обеспечивает избирательное цитотоксическое воздействие на гипоксичные опухолевые клетки. Результаты проведенных исследований, приведенные в таблице 1, свидетельствуют о том, что бензотриазины значительно превосходят по активности радиосенсибилизаторы на основе нитроимидазола и другие биовосстанавливающие агенты in vitro. Недостатками тирапазамина, однако, является его недостаточная растворимость и нестабильность в фармацевтических носителях для парентерального введения. Установлено, что растворимость тирапазамина в воде составляет примерно 0,81 мг/мл и для обеспечения введения больному надлежащей его дозы, необходимо использовать большое объемное количество раствора – примерно 1 л. Попытки, предпринятые с целью повышения растворимости тирапазамина, оказались неуспешными при использовании носителей, содержащих ПАВ, например Твин 80 и полимеры, например как Плуроник F68, Повидон и Альбумин, при этом было достигнуто только минимальное увеличение его растворимости. Эксперименты, проведенные с целью повышения растворимости тирапазамина, где использовали сорастворители, оказались более удачными, однако, соотношение сорастворителей, необходимое для растворения расчетной минимально допустимой дозы тирапазамина означало парентеральное введение значительных количеств сорастворителей, например, до 120 мл пропиленгликоля в виде 50% водного раствора пропиленгликоля, об. /об. Использование сорастворителя в таком большом объемном количестве в парентеральном составе нецелесообразно из-за риска возникновения у больного нежелательных эффектов. Недостатком тирапазамина также является его нестабильная форма при хранении: полное его разложение имеет место после кипячения его с обратным холодильником в течение менее четырех часов в 0,1 н. растворе NaOH. В основу изобретения положена задача создания фармацевтического препарата в форме водного раствора для внутривенного и внутримышечного введения, который содержит необходимое и достаточное количество противоопухолевого агента и обладает стабильностью при хранении. Во время проведения обширных клинических исследований тирапазамина стало очевидным, что этот самый многообещающий химиопрепарат не сможет помочь бесчисленному количеству раковых больных, если не будет иметь достаточную растворимость и стабильность при хранении. Задача решена тем, что заявляемый состав для парентерального введения в форме водного раствора для лечения злокачественных опухолей согласно изобретению содержит терапевтически эффективное количество 1,2,4-бензотриазин-3-амин-1,4-диоксида и цитратный буфер с концентрацией 0,005-0,05 М, обеспечивающий pH раствора от 3,7 до 4,3. Заявляемый состав дополнительно может содержать 0,100-9,000 г хлорида натрия, 0,9000-10,00 г лимонной кислоты и 0,200-3,000 г гидроксида натрия в 1000 мл раствора. Предпочтительно эффективное количество 1,2,4-бензотриазин-3-амин-1,4-диоксида составляет примерно от 0,500 г до 0,810 г/1000 мл. Предпочтительный вариант заявляемого состава содержит 0,700 г 1,2,4-бензотриазин-3-амин-1,4-диоксида, 8,700 г хлорида натрия, 0,9605 г лимонной кислоты, 0,2500 г гидроксида натрия и достаточное количество буфера для обеспечения pH 4 в объеме 1000 мл. Изобретением также является способ для лечения злокачественных опухолей, который согласно изобретению заключается в том, что больному вводят терапевтически эффективное количество вышеуказанного состава. Настоящее изобретение предлагает состав и способ лечения злокачественных опухолей у млекопитающего, в том числе у человека, в частности твердых опухолей. В этом аспекте изобретение заключается в том, что эффективное количество соединения – 1,2,4-бензотриазин-3-амин-1,4-диоксида, растворенного в цитратном буферном растворе, вводят млекопитающему со злокачественной опухолью или в случае необходимости такого лечения в течение примерно от 30 минут до примерно 24 часов до введения млекопитающему эффективной дозы химиопрепарата, к которому чувствительна опухоль. 1,2,4-бензотриазин-3-амин-1,4-диоксид и результаты его испытания описаны в заявке на патент США N 125609, поданной 22 сентября, 1993, описание которой в полном объеме включено в настоящую заявку в качестве противопоставленного материала. В процессе создания фармацевтического состава настоящего изобретения были проведены широкомасштабные исследования, которые позволили обеспечить достаточную растворимость указанного противоопухолевого соединения и получить состав, имеющий стабильную форму при хранении, что станет очевидным специалистам из нижеследующего описания изобретения. Настоящее изобретение описывается далее со ссылкой на конкретные фармацевтические составы на основе тирапазамина. Способность тирапазамина к растворению. Данные по растворимости тирапазамина в воде и различных других носителях приведены в таблице 2. При ограниченной растворимости тирапазамина 0,81 мг/мл обычно требуется при инфузии до литра жидкого носителя и поэтому для сведения к минимуму его объемного количества необходимо повысить его растворимость. Предпринятые попытки по увеличению растворимости тирапазамина с использованием ПАВ (Твин 80) и полимеров (Плуроника F68, Повидона и Альбумина) оказались неудачными, поскольку было достигнуто только минимальное увеличение его растворимости. Повышение растворимости тирапазамина было достигнуто за счет использования сорастворителей, однако, под долей сорастворителя, необходимого для растворения прогнозируемой максимально допустимой дозы тирапазамина (~700 мг) подразумевается инфузия значительного количества сорастворителя (например, до 120 мл пропиленгликоля (ПГ) в виде 50% водного раствора ПГ, об./об.). Анализ физико-химических свойств тирапазамина показывает, что его молекула, по своей природе, не является ни высоко полярной, ни высоко липофильной. Это подтверждают результаты, полученные по (i) коэффициенту распределения (смесь октанол/вода) 0,15 (logP – 0,82) и (ii) разложению, отмечаемому при температуре плавлении тирапазамина 200oC, что позволяет сделать предположение о том, что строение кристаллов тирапазамина прочно связано силами межмолекулярного взаимодействия. Планарная природа молекулы облегчает получение упорядоченной упаковки кристаллической решетки с межмолекулярным притяжением (взаимодействия с переносом заряда) между каждой плоскостью кристаллической решетки через азот и кислород N-оксидной функциональности. Тирапазамин может существовать в гидратной форме в случае, когда молекулы воды связаны по водороду с кислородными составляющими. Для получения расчетной величины растворимости соединений в водных смесях растворителей было предпринято множество различных попыток классифицировать органические растворители исходя из их параметров, например как диэлектрическая постоянная, коэффициент растворимости, поверхностное натяжение, межфазное натяжение, плотность донорных и акцепторных групп по водородной связи и коэффициент фазового распределения смеси октанол-вода. В таблице 3 приведены показатели, полученные для селективных растворителей, используемых в экспериментальных исследованиях по растворимости тирапазамина. Эти показатели использовали для прогнозирования математическим методом растворимости растворенных веществ в неполярных растворителях по корреляции полученных параметров в зависимости от тангенса наклона кривых растворимости, построенных на основе экспериментальных данных. Те параметры, которые характеризуют когезионную способность растворителей, например коэффициент растворимости и межфазное натяжение, обеспечивают получение самого высокого уровня корреляции с тангенсом угла наклона кривой, сопоставимую со способностью чистого сорастворителя к образованию водородной связи, которую можно выразить как плотность протонотдающих групп или акцепторных групп. При высокой объемной доле апротонных растворителей, например диметилсульфоксида (DMSO), диметилформамида (DMF) и диметилацетамида (DMA), происходит разрушение молекулярной структуры воды через биполярные и гидрофобные эффекты. Амфипротонные растворители, например глицерин, ПЭГ 400 и пропиленгликоль (ПГ), обладают способностью как самоассоциации, так и образования водородной связи с водой, и следовательно, такие растворители не подходят в качестве идеального раствора для растворенных веществ, которые не могут участвовать в реакции образования водородной связи. Коэффициент распределения растворенного вещества может служить индикатором для прогноза: будут ли эффективны сорастворители или нет. Нижеприведенное уравнение с успехом использовали для прогнозирования растворимости тирапазамина в различных смесях растворителей: logCs = logCo = f(logR + 0,89logP + 0,03), где Cs и Co означают растворимость в смеси растворителей и воде соответственно, f означает долю сорастворителя, R – относительная растворяющая сила растворителя (стандартные значения для DMF = 4, глицерин = 0,5), а P означает коэффициент распределения. Поскольку P стремится к 1 (logP —> 0), то в этом случае невозможно обеспечить какое-либо повышение растворимости пока LogCs = logCo Поскольку logP для тирапазамина составляет -0,8, то по этому уравнению можно сделать предположение о том, что сорастворители вряд ли будут оказывать существенное влияние на растворимость в воде. В результате экспериментов, проведенных с этими сорастворителями, установлено, что растворимость тирапазамина существенно не повышается при их использовании. Стабильность Исследования в условиях температурного напряжения проводили с использованием многократных циклов выдерживания в автоклаве в течение 21 минуты при температуре 121oC. Проведенные исследования показали, что тирапазамин обладает большей стабильностью в кислых растворах, содержащих стандартный солевой раствор, или растворах, забуференных до значения pH 4 при использовании 0,05 М цитратного или 0,1 М лактатного буфера. Тирапазамин обладал нестабильной формой в присутствии фосфатного буфера, имеющего pH 5,9, и цитратного буфера при pH 6. Сдвиг pH состава, содержащего стандартный солевой раствора, имел место в пределах значений от 4,5 до 4,94 через восемь циклов выдерживания в автоклаве, и поэтому указанные составы необходимо было в некоторой степени забуферить. Фармацевтические составы также испытывали в условиях напряжения при повышенных температурах 50 и 70oC после однократного цикла автоклавирования в течение 21 минуты при температуре 121oC. Установлено, что тирапазамин обладает нестабильностью в присутствии лактатного буфера при хранении его при температуре 70oC. Эта нестабильность, как установлено, не имела отношения к многократному напряжению в автоклаве. Наиболее стабильный фармацевтический состав, как установлено, можно получить при использовании 0, 05 М цитратного буферного раствора, имеющего pH 4. Исходя из полученных данных, были продолжены исследования по разработке составов на основе тирапазамина при использовании цитратного буфера. Для достижения необходимой растворимости тирапазамина при 15oC необходимо было снизить его концентрацию от 1 до 0,5 мг/мл. Последующее напряжение в цитратном буфере, имеющем pH 3,5, 4,0 и 4,5, проводили для определения теоретически возможных граничных значений pH. На основании данных, полученных в результате этого исследования, предельные значения были установлены при pH 4,0  0,3.
В соответствии с полученными данными по стабильности тирапазамина наиболее стабильная форма фармацевтического состава на основе тирапазамина была получена в цитратном буфере при pH 4. Растворимость тирапазамина в цитратном буфере составляла 0,81 мг/мл при температуре 15oC. Таким образом, для ограничения объемного количества парентерального раствора использовали концентрацию 0,7 мг/мл в последующих исследованиях по разработке фармацевтического состава на основе тирапазамина.
Влияние концентрации буфера (0,05 или 0,005 М) на стабильность состава оценивали по нагрузке порций 2 х 10 л тирапазамина (0,7 мг/мл) в цитратном буфере при pH 4,0.
Тирапазамин сохранял стабильность спустя 2 месяца как в 0,005 М, так и в 0,05 М цитратном буферном растворе при 50oC. При температуре 70oC были получены данные, свидетельствующие о его нестабильности в составе, содержащем 0,05 М цитратный буфер, и поэтому была выбрана более низкая концентрация цитратного буфера (0,005 М) для разработки фармацевтического состава для проверки в клинических условиях. Ниже приводится рецептура состава, используемого в клинических исследованиях химических свойств, которые будут рассмотрены ниже: 0,3.
В соответствии с полученными данными по стабильности тирапазамина наиболее стабильная форма фармацевтического состава на основе тирапазамина была получена в цитратном буфере при pH 4. Растворимость тирапазамина в цитратном буфере составляла 0,81 мг/мл при температуре 15oC. Таким образом, для ограничения объемного количества парентерального раствора использовали концентрацию 0,7 мг/мл в последующих исследованиях по разработке фармацевтического состава на основе тирапазамина.
Влияние концентрации буфера (0,05 или 0,005 М) на стабильность состава оценивали по нагрузке порций 2 х 10 л тирапазамина (0,7 мг/мл) в цитратном буфере при pH 4,0.
Тирапазамин сохранял стабильность спустя 2 месяца как в 0,005 М, так и в 0,05 М цитратном буферном растворе при 50oC. При температуре 70oC были получены данные, свидетельствующие о его нестабильности в составе, содержащем 0,05 М цитратный буфер, и поэтому была выбрана более низкая концентрация цитратного буфера (0,005 М) для разработки фармацевтического состава для проверки в клинических условиях. Ниже приводится рецептура состава, используемого в клинических исследованиях химических свойств, которые будут рассмотрены ниже:Тирапазамин – 0,700 г Натрия хлорид – 8,700 г Лимонная кислота – 0,9605 г Натрия гидроксид – 0,2500 г Достаточное количество буфера до pH 4,0 в воде в объеме до 1000 мл Препарат на основе тирапазамина хранят в прозрачных стеклянных 20 мл ампулах, содержащих 0,7 мг/мл (14 мг тирапазамина в изотоническом цитратном буферном растворе). Ампулы хранят при температуре от 15 до 30oC в светонепроницаемой упаковке. Дозирование Фармацевтические составы предлагаемого изобретения исследовали на острую толерантность у мышей, введение однократных и многократных их доз в экспериментах на крысах и собаках и супрессию миеломы in vivo. В исследовании на острую толерантность у мышей, ЛД10 и ЛД50 тирапазамина, как установлено, составляет 98 и 101 мг/кг соответственно. Исследования по оценке введения однократной и многократных доз препарата в течение 2-недельного и 2-месячного курса проводили на крысах и собаках. Клинические и субъективные признаки были отмечены у обоих видов животных и в каждом режиме лечения оценивали слюноотделение, снижение числа лейкоцитов в крови (включая число лимфоцитов у собак), а также снижение количества эритроцитов. Фармакология Влияние тирапазамина на различные аэробные и гипоксичные клетки изучали в клеточной культуре для оценки избирательной цитотоксичности тирапазамина. Тирапазамин (20 мкм), как установлено, является мощным и избирательно действующим цитостатиком, приводящим к гибели гипоксичных клеток in vivo, при этом показатель его цитотоксичноси относительно гипоксичных клеток составляет 150, 119 и 52 для клеточной линии хомяка, мыши и человека соответственно (показатель на 1-2 порядка больше, чем имеют радиосенсибилизаторы, например как нитроимидазолы, митомицин C и порфиромицин). Эта цитотоксичность также отмечена в интервале парциального давления кислорода в тканях (1-20% O2; главным образом, при 1-4% O2). In vivo тирапазамин был одинаково эффективен в эксперименте на мышах с модельной опухолью как при введении его однократно в дозе по 0,30 ммоля/кг (160 мг/м2), так и дробно по 0,08 ммоля/кг (43 /м2) в сочетании с дозированным облучением (2,5 х 8). Тирапазамин был также эффективен при введении его однократно в дозе 0,30 ммоля/кг (160 мг/м2) в сочетании с большой одноразовой дозой облучения (20 Ги). Тирапазамин, как оказалось, наиболее эффективен при введении его дробными дозами по 0,08 ммоля/кг (43 мг/м2) до проведения каждого сеанса облучения (в дозе по 2,5 Ги х 8), что привело к нескольким случаям излечения опухолей SCCVII у мышей. Оказалось, что тирапазамин имел наименьшую эффективность, приводя обычно к гибели клеток менее I log, в тех случаях, когда его использовали без облучения. При использовании в сочетании с дозированным облучением эффект, произведенный тирапазамином, был равен эффекту, ожидаемому скорее в результате его воздействии на отдельную клеточную популяцию (гипоксичные клетки), а не от воздействия облучения (на аэробные клетки). Механизм действия тирапазамина был подробно изучен и, как установлено, он имеет тесную связь с метаболизмом указанного лекарственного средства. На приведенном ниже рисунке отражен предложенный механизм действия тирапазамина по его синтезу свободных радикалов во время процесса восстановления до моно-N-оксида, в результате чего происходят одноцепочечные и двухцепочечные разрывы в ДНК. В условиях пониженного содержания кислорода в тканях тирапазамин трансформируется в результате метаболизма в 2-электронный продукт реакции восстановления, WIN 64102 (моно-N-оксид; SR 4317), а затем в 4-электронный продукт реакции восстановления, WIN 601096 (нуль-N-оксид; SR 43301). Результаты нескольких исследований, проведенных с целью проверки возможности репарации повреждений ДНК после лечения тирапазамином, свидетельствовали о дозазависимом ингибировании восстановления ДНК, сопоставимом с полученным в результате облучения. 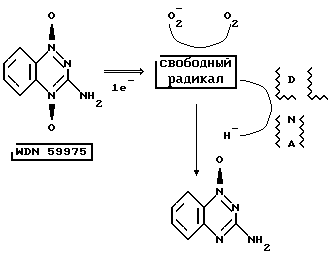 Были проведены широкомасштабные исследования бензотриазин-ди-N-оксида, тирапазамина как in vitro, так и in vivo, с целью определения его эффективности и дозировки и объяснения механизма действия. Исследования in vitro Влияние тирапазамина на различные виды аэробных и гипоксичных клеток изучали в клеточной культуре с целью определения его избирательной цитотоксической активности. В тестах использовали клетки яичника китайского хомяка (CHO-HA-1), мышиные клетки (C3H 10T1/2, RJF-1 и SCCVII) и линии клеток человека (HCT-8, AC 1522, A549 и HT 1080). Из таблицы 4 видно, что тирапазамин (при концентрации 20 мкмоль) обладает мощной и избирательной цитотоксичностью к гипоксичньм клеткам in vitro. Исследования in vivo Использование только одного тирапазамина В испытаниях in vivo у мышей, получавших только тирапазамин, ожидали, что одноразовые его дозы, приведут к относительно небольшому киллингу клеток, соответствующему проценту опухолевых клеток, которые относятся к гипоксичным. Результаты многочисленных экспериментов подтвердили это предположение, причем клеточные летали составляют менее 1 log (доля выживших клеток  1 1 10-1). Например, максимальный киллинг клеток, наблюдаемый после введения одноразовых доз, отмечен в опухоли SCCVII (доля выживших клеток = 5 10-1). Например, максимальный киллинг клеток, наблюдаемый после введения одноразовых доз, отмечен в опухоли SCCVII (доля выживших клеток = 5 10-1) и только небольшая задержка роста опухоли примерно 3 дня была при фибросаркоме FSallC.
Полагали, что дробная дозировка тирапазамина, получаемого без облучения, должна привести к незначительно более высокому киллингу клеток по сравнению с введением его однократно, даже при более низких его дозах. Однако самая небольшая доля выживших клеток, которая отмечена, в четырех различных видах опухолей у мышей составляла 5 10-1) и только небольшая задержка роста опухоли примерно 3 дня была при фибросаркоме FSallC.
Полагали, что дробная дозировка тирапазамина, получаемого без облучения, должна привести к незначительно более высокому киллингу клеток по сравнению с введением его однократно, даже при более низких его дозах. Однако самая небольшая доля выживших клеток, которая отмечена, в четырех различных видах опухолей у мышей составляла 5 10-1 и еще меньшую долю примерно до 5 10-1 и еще меньшую долю примерно до 5 10-2 в пятой мышиной опухоли (синдроме Терри RLF-1).
Применение тирапазамина в сочетании с облучением.
В ряде модельных систем, описанных ниже, тирапазамин потенцирует противоопухолевую активность облучения, которую оценивали по киллингу клеток или задержке роста опухоли.
Испытания проводили на опухолях FsallC, SCCVII, RIF-1, EMT6 и KHT. Тирапазамин стимулирует гибель раковых клеток у животных, получавших его по схеме в одноразовой дозе или дробных дозах, а также в случае, когда этот химиопрепарат использовали в сочетании с однократным или дозированным облучением.
В одном исследовании противоопухолевая активность тирапазамина в сочетании с облучением превосходит аддитивный эффект, полученный от этих двух методов лечения. Повышение активности тирапазамина имеет место в случае, когда лекарственное средство вводят за 2,5-0,5 часа до проведения облучения или примерно 6 часов спустя. Кроме активности против гипоксичных клеток, тирапазамин радиосенсибилизирует аэробные клетки in vitro, если клетки подвергают воздействию указанного препарата в условиях гипоксии как до, так и после облучения.
Еще в одном исследовании лечение тирапазамином приводило к гораздо заметному потенцированию противоопухолевой активности радиотерапии по сравнению с сенсибилизатором гипоксичных клеток – этанидазолом.
Из кривой зависимости концентрация кислорода – цитотоксичность тирапазамина становится очевидным, что он особенно хорошо подходит для использования в сочетании с лучевой терапией. При давлении менее 30 торр (мм ртутного столба) клетки становятся все более и более резистентыми к разрушающему воздействию облучения. Радиосенсибилизаторы на основе антибиотиков нитроароматического ряда и хинона, однако, наиболее эффективны только при гораздо более низком содержании кислорода. Таким образом, они не оказывают токсического действия к умеренно гипоксичным, резистентным к облучению клеткам, присутствующим в опухолях. В противоположность этому, цитотоксичное действие тирапазамина остается относительно постоянным во всем интервале концентраций кислорода, обеспечивающих резистентность к облучению.
В отличие от других радиосенсибилизаторов, изученных в настоящее время, токсичный эффект тирапазамина снижается при высоких концентрациях кислорода (то есть таких, которые обнаружены в здоровой ткани). В in vitro системе токсичность тирапазамина была по меньшей мере от 50 до >2000 раз выше при гипоксии, чем при 100% испарении кислорода. Поскольку тирапазамин обладает активностью против широкого ряда различных видов опухолевых клеток, которые резистентны к облучению, и не оказывает токсичного воздействия на нормальные клетки с высокими концентрациями кислорода, то можно предположить, что имеет избирательное цитотоксическое действие на гипоксичные опухолевые клетки.
Применение тирапазамина в сочетании с химиотерапией.
При введении тирапазамина мышам с фибросаркомой FSallC (в дозе от 25 до 75 мг/кг, внутрибрюшинно = 83,3 до 250 мг/м2) отмечен некоторый прямой киллинг опухолевых клеток. Введение тирапазамина (в дозе 50 мг/кг, внутрибрюшинно = 167 мг/м2) в сочетании с циклофосфамидом (в дозе 150 мг/кг, внутрибрюшинно = 500 мг/м2), мелфаланом (в дозе 10 мг/кг, внутрибрюшинно = 33 мг/м2) или цисплатиной (в дозе 10 мг/кг, внутрибрюшинно = 33 мг/м2) в этой модели имело место 1,6-5,3-кратное увеличение продолжительности задержки роста опухоли.
Влияние тирапазамина на здоровую ткань 10-2 в пятой мышиной опухоли (синдроме Терри RLF-1).
Применение тирапазамина в сочетании с облучением.
В ряде модельных систем, описанных ниже, тирапазамин потенцирует противоопухолевую активность облучения, которую оценивали по киллингу клеток или задержке роста опухоли.
Испытания проводили на опухолях FsallC, SCCVII, RIF-1, EMT6 и KHT. Тирапазамин стимулирует гибель раковых клеток у животных, получавших его по схеме в одноразовой дозе или дробных дозах, а также в случае, когда этот химиопрепарат использовали в сочетании с однократным или дозированным облучением.
В одном исследовании противоопухолевая активность тирапазамина в сочетании с облучением превосходит аддитивный эффект, полученный от этих двух методов лечения. Повышение активности тирапазамина имеет место в случае, когда лекарственное средство вводят за 2,5-0,5 часа до проведения облучения или примерно 6 часов спустя. Кроме активности против гипоксичных клеток, тирапазамин радиосенсибилизирует аэробные клетки in vitro, если клетки подвергают воздействию указанного препарата в условиях гипоксии как до, так и после облучения.
Еще в одном исследовании лечение тирапазамином приводило к гораздо заметному потенцированию противоопухолевой активности радиотерапии по сравнению с сенсибилизатором гипоксичных клеток – этанидазолом.
Из кривой зависимости концентрация кислорода – цитотоксичность тирапазамина становится очевидным, что он особенно хорошо подходит для использования в сочетании с лучевой терапией. При давлении менее 30 торр (мм ртутного столба) клетки становятся все более и более резистентыми к разрушающему воздействию облучения. Радиосенсибилизаторы на основе антибиотиков нитроароматического ряда и хинона, однако, наиболее эффективны только при гораздо более низком содержании кислорода. Таким образом, они не оказывают токсического действия к умеренно гипоксичным, резистентным к облучению клеткам, присутствующим в опухолях. В противоположность этому, цитотоксичное действие тирапазамина остается относительно постоянным во всем интервале концентраций кислорода, обеспечивающих резистентность к облучению.
В отличие от других радиосенсибилизаторов, изученных в настоящее время, токсичный эффект тирапазамина снижается при высоких концентрациях кислорода (то есть таких, которые обнаружены в здоровой ткани). В in vitro системе токсичность тирапазамина была по меньшей мере от 50 до >2000 раз выше при гипоксии, чем при 100% испарении кислорода. Поскольку тирапазамин обладает активностью против широкого ряда различных видов опухолевых клеток, которые резистентны к облучению, и не оказывает токсичного воздействия на нормальные клетки с высокими концентрациями кислорода, то можно предположить, что имеет избирательное цитотоксическое действие на гипоксичные опухолевые клетки.
Применение тирапазамина в сочетании с химиотерапией.
При введении тирапазамина мышам с фибросаркомой FSallC (в дозе от 25 до 75 мг/кг, внутрибрюшинно = 83,3 до 250 мг/м2) отмечен некоторый прямой киллинг опухолевых клеток. Введение тирапазамина (в дозе 50 мг/кг, внутрибрюшинно = 167 мг/м2) в сочетании с циклофосфамидом (в дозе 150 мг/кг, внутрибрюшинно = 500 мг/м2), мелфаланом (в дозе 10 мг/кг, внутрибрюшинно = 33 мг/м2) или цисплатиной (в дозе 10 мг/кг, внутрибрюшинно = 33 мг/м2) в этой модели имело место 1,6-5,3-кратное увеличение продолжительности задержки роста опухоли.
Влияние тирапазамина на здоровую тканьВ двух испытаниях, проведенных с целью проверки возможных эффектов тирапазамина на чувствительность нормальной ткани к ионизирующему облучению, использовали мышей самок линии C3H/Km. Испытания проводили как на реакцию здоровой ткани кожи, так и на контрактуру мышц нижней конечности (бедра) в сочетании с дозированным облучением. Тирапазамин не оказывал никакого вредного воздействия на ткани в обоих испытаниях. Для определения возможных нежелательных эффектов тирапазамина на здоровую ткань правую заднюю часть бедра мышей-самок C3H/Km облучали восьмью дозами облучения (3, 4, 5 или 6 Грей) в течение более 4 дней (1 раз через каждые 12 часов). Мышам вводили, или физиологический раствор, или тирапазамин (в дозе 0,08 ммоля/кг = 43 мг/м2) за 30 минут до или сразу же после каждого облучения. Кожную реакцию на облученных участках бедра оценивали по бальной системе три раза в неделю, начиная с 10 дня по 32 день после проведения первой дозы облучения. Мышей оценивали слепым методом, то есть была неизвестна группа животных, которая получала лечение в соответствии с бальной системой, аналогичной разработанной ранее (Brown JM, Goffinet DR, Cleaver JE, Kallman RF, “Preferential radiosensitization of mouse sarcoma relative to normal mouse skin by chronic intra-arterial infusion of halogenated pyrimidine analogs”, JNCI (1971) 47, 77-89). Никакой радиосенсибилизации или аддитивного токсического эффекта не отмечено при сочетании тирапазамина с лучевой терапией, как было определено по кожной реакции. Изобретение раскрыто со ссылкой на предпочтительные варианты осуществления изобретения, однако специалистам ясно, что другие варианты могут иметь место в пределах объема настоящего изобретения. Формула изобретения
РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 12.12.2006 № РД0015306
Извещение опубликовано: 20.01.2007 БИ: 02/2007
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 22.08.2008
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
