Патент на изобретение №2166940
|
||||||||||||||||||||||||||
(54) СПОСОБ УМЕНЬШЕНИЯ ПОТЕРЬ КОСТНОЙ ТКАНИ, СПОСОБ ЛЕЧЕНИЯ ОСТЕОПОРОЗА И ПРИМЕНЕНИЕ СОЕДИНЕНИЯ
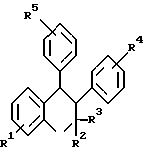
(57) Реферат: Изобретение относится к медицине. Предложен способ снижения или предупреждения потерь костной ткани, вызванных дефицитом эстрогенов, а также способ лечения остеопороза и использование соединения формулы 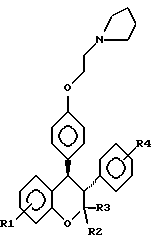 для лечения или предотвращения потерь костной ткани, вызванных дефицитом эстрогенов. Изобретение расширяет арсенал средств указанного назначения. 3 с. 20 з.п. ф-лы, 2 табл., 3 ил. Обновление костной ткани является динамическим процессом, при котором происходит обновление и поддержание массы и строения скелета. Результатом процесса является баланс между рассасыванием и образованием кости. Остеокласты и остеобласты являются двумя ключевыми участниками процесса обновления кости. Остеокласт начинает цикл обновления, рассасывая полость в кости, которая далее заполняется, благодаря тому, что остеобласт синтезирует и откладывает в полость новую костную основу. Активность остеокласта и остеобласта регулируется комплексным взаимодействием системных гормонов и местным производством факторов роста и цитокинов в активных сайтах обновляемой кости. Неустойчивое восстановление кости вызывает такие состояния, как остеопороз, деформирующий остит и гиперпаратироид. Остеопороз, характеризуется уменьшением скелетной массы, является одной из обычных болезней пост-климактерических женщин и часто вызывает болезненные переломы позвоночника, бедра и запястья. Примерно 25% женщин после наступления менопаузы страдают от остеопороза и, в основном признается, что этиология болезни включает снижение в крови эстрогенов (Komm et al. , Science 241, 84-84, 1988), Komm et al. дополнительно сообщают, что количество белых женщин в США, рискующих сломать бедро, составляет 15%, что составляет 247000 переломов бедра в год у женщин старше 45 лет. Остеопороз дорого обходится как отдельным людям, так и всему обществу. В 1984 году 145000 американских женщин старше 65 лет лечились от перелома в стационарных условиях и 107000 подвергались артропластике и замене сустава бедра. Среди пациентов, живших по одиночке до перелома бедра, 15% – 20% требовали длительного ухода, и еще в течение года после перелома не могли восстановить свою независимость. Общая финансовая стоимость лечения остеопороза, включая переломы, в США в 1986 г. составила 7-10 млрд. долларов (Peck et al., Am. J. Med. 84: 275 – 282, 1988). Потери костной ткани, связанные с остеопорозом, останавливаются введением экзогенных эстрогенов. Чтобы дать эффект, согласно Thorneycroff (Am. J. Obstet. Gynecol. 180: 1306 – 1310, 1989), терапия эстрогенами должна начинаться за несколько лет до менопаузы и продолжаться непрерывно в течение 10 – 15 лет. Хотя пригодны несколько различных типов эстрогенов, основным эстрогеном, имеющимся у женщин в период перед менопаузой, является 17-бета-эстрадиол, и это соединение часто выбирают для терапевтического использования. Однако при рекомендованных дозах наблюдается серьезный побочный эффект, наибольшей неприятностью является хорошо коррелируемый эффект между эстрогенной терапией и случаями рака матки и груди. Случаи карциномы зависят также от дозы и продолжительности лечения. Чтобы избежать опасности раковых заболеваний, применяют совместное использование прогестогена с эстрогеном. Это комбинация, однако, вызывает возвращение менструации, что неприемлемо для большинства женщин. Дополнительным недостатком является факт, что долговременный эффект действия прогестогена не ясен полностью. Таким образом, большая часть женщин требует не гормональной терапии, чтобы можно было безопасно предотвратить быструю потерю костной ткани, которая сопровождает менопаузу. Пентхроман является нестероидным соединением с известной антиэстрогенной активностью. Он используется в Индии, как оральный контрацептив (смотри, например, Solmanet et al., пат., США N 4447622; Sinoh et al., Acta Endocrinol (Copenh) 126: 444-450, 1992; Grubb, Curr. Opin. Obstet. Gynecol. 3: 491 – 495, 1991; Sankarar et al., Contraception 9, 279 – 289, 1974; пат. Индии N 129187). Пентхроман изучен также как противоопухолевый агент для лечения прогрессирующего рака груди (Misra et al., Int. J. Cancer 43: 781 – 783, 1989), однако отсутствуют исследования влияния пентхромана на потерю костной ткани. Сохраняется потребность в создании составов и методов, пригодных для уменьшения потерь кости, в частности, связанных с остеопорозом. Кроме того, требуются такие композиции, которые бы не имели побочного эффекта эстрогенов. Настоящее изобретение предлагает такие композиции и методы, а также предлагает другие подобные преимущества. На сопровождающих иллюстрациях показано – на фиг. 1 – эффект пентхромана на потере костной ткани у мышей с удаленными яичниками, на фиг. 2 – влияние пентхромана на объем губчатой кости в проксимальных участках берцовой кости у мышей с удаленными яичниками, на фиг. 3 – влияние пентхромана на потерю костной ткани (слева) и на вес матки (справа) у мышей с удаленными яичниками. Настоящее изобретение основано отчасти на обнаружении того, что представитель 3,4-диарилхроманов, пентхроман (3,4-транс-2,2- диметил-3-фенил-4-[n-(  -пирролидиноэтокси)фенил] -7-метокси- хроман), является эффективным ингибитором рассасывания кости у мышей и крыс с удаленными яичниками. На лабораторных животных имитируют условия периода после менопаузы, и они являются обычно признанными моделями остеопороза. Эти данные таким образом показывают, что 3,4-диарилхроманы пригодны в качестве терапевтических препаратов для уменьшения костных потерь у млекопитающих, включая приматов, таких как человек.
Согласно изобретению, соединения формулы (I) или их фармацевтически приемлемые соли могут использоваться для уменьшения потерь костной ткани у пациента. -пирролидиноэтокси)фенил] -7-метокси- хроман), является эффективным ингибитором рассасывания кости у мышей и крыс с удаленными яичниками. На лабораторных животных имитируют условия периода после менопаузы, и они являются обычно признанными моделями остеопороза. Эти данные таким образом показывают, что 3,4-диарилхроманы пригодны в качестве терапевтических препаратов для уменьшения костных потерь у млекопитающих, включая приматов, таких как человек.
Согласно изобретению, соединения формулы (I) или их фармацевтически приемлемые соли могут использоваться для уменьшения потерь костной ткани у пациента.
 В формуле (I) R1, R4 и R5, независимо друг от друга являются водородом, галогеном, трифторметилом, низшим алкилом, низшим алкокси или трет-эмино-низшим алкокси R2 и R3, независимо друг от друга, представляют водород или низший алкил. Используемый здесь термин “низший алкил” означает неразветвленный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-амил, втор-амил, н-гексил, 2-этилбутил, 2,3-диметилбутил и т.п. Термин “низший алкокси” означает неразветвленный или разветвленный алкокси, содержащий от 1 до 6 атомов углерода, например метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, н-амилокси, втор-амилокси, н-гексилокси, 2-этилбутокси, 2,3-диметилбутокси и т.п. “Галоген” означает хлор, фтор, бром и йод. Трет-аминорадикал может быть диалкиламином, таким как диметил диэтил-, дипропил-, дибутил-, или полиметиленимином, таким как пиперидин, пирролидин, R – метилпиперазин или морфолин. Предпочтительно соединения включают соединения, в которых R1 является низким алкокси; R2 и R3 означает низший алкил, особенно метил; R4 = H и R5 представляет собой трет- амино-низший алкокси типа полиметилениминогруппы. Особенно предпочтительными являются соединения, в которых R1 находится в 7-положении и представляет собой низший алкокси, особенно метокси; каждый из R2 и R3 означает метил, R4 = H, R5 находится в 5-положении и является трет-амино-низший алкокси – радикалом, таким как пирролидиноэтокси. Предпочтительным является использовано соединений формулы (I) в транс-конфигурации. Эти соединения могут использоваться в виде рацемической смеси или в виде отдельных d- или l-энантиомеров. Особенно предпочтительным соединением для использования по этому изобретению является центхроман (II): 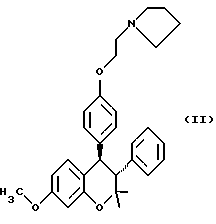 Хотя показан только один энантиомер, понятно, что формула II, используемая здесь для обозначения транс-конфигурации 3- и 4- фенил, включает как d и l энантиомеры, так и рацемическую смесь. 3,4-Диарилхроманы получают по известным методам, таким как описаны в пат. США N 3340276 Carney et al., пат. CIF N 3822287 Bolger и Ray et al., J Med. Chem. 19: 276-279, 1976, которые включены в описание путем ссылки. В пат. США N 3822287 описано превращение цис-изомера в транс-конфигурацию перегруппировкой, катализируемой металлоорганическим основанием. Оптически активные – d и l – энантиомеры могут быть приготовлены, как описано Salmаn et al. в пат. США N 4447622 (включен в описание путем ссылки) с помощью образования оптически активной соли кислоты, которая при щелочном гидролизе образует требуемый энантиомер. Согласно настоящему изобретению 3,4-диарилхроманы могут быть получены в виде фармацевтически приемлемых солей, особенно солей с кислотами, включая соли органических и минеральных кислот. Примерами таких солей являются соли органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, янтарная кислота, яблочная кислота, винная кислота, салициловая кислота и других подобных кислот. Пригодные неорганические соли кислот включают соли соляной, бромистоводородной, серной и фосфорной кислот и другие подобные соли. Соли кислот могут быть получены как прямые продукты синтеза. С другой стороны, свободное основание может растворяться в пригодном растворителе, содержащем соответствующую кислоту, и соли выделяются упариванием растворителя или же разделением соли в растворителе. 3,4-диарилхромана и их соли пригодны в качестве медицинских препаратов для человека и животных для регулирования метаболизма кости. Эти соединения могут использоваться, например, для лечения пациентов, страдающих от костных потерь, обусловленных остеопорозом (включая остеопороз у женщин после менопаузы и остеопороз, связанный с гликокортикоидами), деформирующим оститом, гиперпаратиреозом, повышенным содержанием кальция в крови и другими состояниями, характеризующимися чрезмерной скоростью рассыпания кости и/или пониженной скоростью образования кости. По изобретению 3,4-диарилхроманы и их фармацевтически приемлемые соли используют в рецептурах с фармацевтически приемлемым носителем для получения медицинских препаратов для парентерального, орального, носового, ректального, подкожного или внутрикожного введения обычными методами. Лекарственные формы дополнительно могут включать один или несколько разбавителей, наполнителей, эмульгаторов, консервантов, буферных добавок, эксципиентов и т.д. и выпускаться в таких формах, как жидкие формы, порошки, эмульсии, суппозитории, липосомы, накожные листочки, подкожные имплантаты с контролируемым высвобождением, таблетки и т.д. Работающие в этой области могут формулировать соединения соответствующим способом в соответствии с обычной практикой, описанной в книге Remington’s Pharmaccutical Sciences, Gennaro, ed., Mack Publishing Co. , Eacton, PA, 1990, которая включена в настоящее описание полностью путем ссылки. Предпочтительно оральное введение. Для него активное соединение используют в пригодной для орального введения форме, такой как таблетки или капсулы. Обычно, фармацевтически приемлемую соль соединения комбинируют с носителем и сплавляют в таблетку. Пригодными носителями в этом отношении являются крахмал, сахара, фосфат кальция, стеарат кальция, стеарат магния и т. п. Такие композиции могут дополнительно включать одно или более вспомогательных веществ, таких как смачивающие агенты, эмульгаторы, предохраняющие добавки, стабилизаторы, окрашивающие вещества и т.д. Фармацевтические композиции вводят с суточными – недельными интервалами. “Эффективное количество” такой фармацевтической композиции, – это такое количество, которое обеспечивает клинически значимое ингибирование потерь костной ткани. Эффективное количество будет зависеть, в частности, от конкретных условий лечения, возраста, веса и общего состояния пациента, а также других факторов, что очевидно по предшествующим работам в этой области. Обычно ингибирование потерь кости обнаруживается как статически значимая разница объемов губчатой кости у обработанной и контрольной группы. Это можно наблюдать например, как 5-10% или большую разницу в массе кости позвоночника или в минеральном составе кости в течение 2 лет. Данные на принятых модельных животных, таких как мыши или крысы с удаленными яичниками, в качестве моделей для остеопороза, обычно используются для расчета доз для человека в пределах одного порядка. Например, терапевтическая доза для лечения остеопороза будет изменяться в основном от 0,01 – 50 мг/кг/день, предпочтительно 0,05 – 10 мг/кг/день, более предпочтительно 0,1 – 5,0 мг/кг/день. Использование цис-изомеров или рацемической смеси может обуславливать дозы более высокого установленного ряда. Фармацевтические композиции могут вводиться в виде разовой формы ежедневно – недельно. С другой стороны, они могут быть выполнены как лекарственные формы с контролируемым высвобождением вещества, пригодные для подкожных имплантатов. Имплантаты формулируют для обеспечения высвобождения активного соединения в течение требуемого периода времени, который может составлять вплоть до нескольких лет. Лекарственные формы с контролируемым высвобождением вещества описаны, например, Sanders et al., J. Pharm. Sci 73: 1924 – 1297, 1984, пат. США N 4489056, и пат. США N 4210644, которые включены в описание путем ссылки. Следующие примеры иллюстрируют, но не ограничивают изобретение. Пример 1. Способность центхромана предупреждать остеопению, вызываемую дефицитом эстрогенов, оценивают на модельных животных, мышах с удаленными яичниками. Группу мышей линии Swiss-Webster из 24 самок (возраст 8 недель) подвергают или операции удаления яичников, или хирургической имитации их удаления до проведения 4-х недельных испытаний. При удалении яичников делают боковой надрез на коже, мышах и брюшине с каждой стороны, яичники находят, отделяют от прилегающего жира и соединительных тканей и вырезают. При имитации яичники находят, но затем помещают на место. У всех животных брюшину и мышцы сшивают и надрез на коже закрывают скобами. Центхроман растворяют в минимальном количестве диметилсульфоксида, разбавляют в масляной среде до концентрации 50 мкг/100 мкг. Мышей обрабатывают дважды в неделю в течение 4 недель подкожным введением центхромана или масляной среды согласно следующей прописи: имитация/масляная (SV): OVX/масляная основа; OVX/50 мкг центхромана, 2 раза в неделю. В каждую группу входит по 8 животных. После окончания 4-недельной обработки центхроманом мышей анестезируют эфиром и усыпляют шейным смещением. Непосредственно после этого бедра удаляют, фиксируют в 70% этилового спирте (EtOH), дегидратируют в серии растворов с повышающей концентрацией спирта: 95% EtOH в течение 24 часов, а затем еще три обработки в 100% EtOH в течение 24 часов каждая. После последнего выдерживания в 100% EtOH бедра очищают в двух сменах ксилола, затем обрабатывают, не удаляя кальций, и заливают полиметакрилатопластом по ранее описанной методике (Bain et al., Stain Technology 65: 159 – 163, 1990) Фронтальные участки дистальных метафазов бедра 5 мкм толщиной срезают на роторном микротоме Reichert-Jung 2050, снабженном вольфрамово-карбидным ножом. 5 мкм-срезы помещают на предметное стекло и окрашивают трихромом Голднера. Гистоморфологические измерения дистальных метафизов проводят с использованием специальной программы Bioduant Bone Morphometry Program (Biometrics, Inc., Nashville, TN), пропуская через световую камеру светового эпифлюоресцентного микроскопа (Scientific Instruments Inc., Redmons< WA). Морфологические измерения объема губчатой кости (BV/TV) проводят на тканевом пространстве более чем за 0,25 мм от ростового соединения, чтобы исключить первичную губчатую ткань. Данные показанные на фиг. 1, выражены в виде среднего значения  SD для каждой группы. Сравнение объема губчатой кости наружного бедра основывали на анализе отклонения с использованием статистических программ Statview (Abacus Concets, Inc., Berkeley. CA).
Разницы обработок, полученные ANOVA сравнивали с использованием методики Ланета многократного сравнения.
Значения P менее 0,05 считалось существенным.
У мышей с удаленными яичниками и обработанных масляным носителем наблюдали 50% снижение объема губчатой костной ткани дистальной бедренной кости по сравнению с имитационными животными, обработанными основой. У животных с удаленными яичниками, обработанными 50 мкм центхрома дважды в неделю, эта потеря костной ткани полностью была предотвращена.
Пример 2 SD для каждой группы. Сравнение объема губчатой кости наружного бедра основывали на анализе отклонения с использованием статистических программ Statview (Abacus Concets, Inc., Berkeley. CA).
Разницы обработок, полученные ANOVA сравнивали с использованием методики Ланета многократного сравнения.
Значения P менее 0,05 считалось существенным.
У мышей с удаленными яичниками и обработанных масляным носителем наблюдали 50% снижение объема губчатой костной ткани дистальной бедренной кости по сравнению с имитационными животными, обработанными основой. У животных с удаленными яичниками, обработанными 50 мкм центхрома дважды в неделю, эта потеря костной ткани полностью была предотвращена.
Пример 2Для оценки влияния центхрома на потере костной ткани и массы скелеты 54 самок крыс линии Sprague-Dawley предварительно метили в течение четырех последующих недель, меченными тетрациклином (3H-T; от Dupont NEN’ Research Products, Bocton, MA). Животным вводили каждому по 12 – 15 инъекций 15 мкС так, чтобы в целом это составило примерно 3200 мкС на животное. Через три недели после последнего введения 3H-T восемь животных забивали как основной контроль, а затем оставшихся животных обрабатывали эстрогеном (E2) или центохроманом (C) по следующим группам:имитационные /плацебо; с удаленными яичниками (OVX) плацебо; с удаленными яичниками/E2 (0,05 мг/кг/день); с удаленными яичниками /C (0,05 мг/кг/день); с удаленными яичниками /C (0,5 мг/кг/день); и с удаленными яичниками / C (0,5 мг/кг/день). Обработку гормонами проводили подкожным введением имплантантных целлет, содержащих холестерол, лактозу. Также определяли объем местной ткани бедренных костей и позвонков для документирования изменений физических свойств кости, а для сравнения изменений объемов губчатой кости внутренней большеберцовой кости использовали количественную гистоморфометрию. Через 60 дней после начала протокола обработки животных анестезируют эфиром, усыпляют шейным смещением, непосредственно после этого удаляют матку и записывают ее вес; обе бедренные кости и три грудных позвонка (T11-T13) вырезали для анализа рассасывания кости; одну большеберцовую кость и первый поясничный позвонок собирают для определения физических свойств кости; вторую большеберцовую кость вырезают и проводят гистоморфометрию. Все ткани вначале фиксируют 70% этиловым спиртом и дегидратируют серией растворов с повышающейся концентрацией спирта до 100%. после последней дегидратации 10%-ным спиртом образцы обрабатывают по методике, приведенной ниже. Исследование рассасывания кости базировалось на оценке уровней 3H-T, сохранившихся в меченых бедренных костях и позвонках, в основном так как описано Klein и Tackman (Calcified Tissue Research 20: 275 – 290, 1976). Вкратце, пробы обезжиривали тремя обработками хлороформа по 24 часа каждая, сушили 24 часа при 100oC, затем записывали вес. Для того, чтобы экстрагировать 3H-T, бедренные кости и позвонки деминерализовали в 15 мл 0,5 N соляной кислоты (HCl), а образующиеся вверху слой декантировали и отделяли. Для количественного определения уровней трития 625 мкл аликвоты отбирали пипеткой в стеклянные сцинтилляционные пробирки, содержавшие 10 мл сцинцилляционной жидкости Optiflor (Packard Instruments, Meriden, CT), и рассчитывали уровни 3H-T на жидкостном сцинтилляционном спектрометре (Beckma LS 1300). После дегидратации спиртом пробы, предназначенные для измерения массы кости, обезжиривали тремя обработками в хлороформе по 24 часа каждая, сушили при 60oC в течение ночи. Массу кости выражали в мг сухого веса на грамм веса тела. После последней обработки 100%-ным спиртом большеберцовую кость очищали двухразовой обработкой в ксилоле, обрабатывали не удаляя кальций и заливали полиметакрилатопластом, как описано Bain et al., (Stain Technology 65: 159 – 163, 1990). Фронтальные срезы проксимальной большеберцовой кости 5 мкм толщиной делали на роторном микротоме Reichert – Jung 2050 Leica Instruments, Nuslock, Germany), с вольфрамо-карбидным ножом. 5 мкм-срезы помещали на предметное стекло и окрашивали трихромом Голднера. Гистоморфометрические измерения проксимальной большеберцовой кости определяли при использовании специальной программы Bioguant Bone Morphometry (Biometrics, Inc. , Nasnville, TN), попуская через световую камеру на световом /эпифлюоресцентном микроскопе Olympus BH-2 (Sеientific Instruments, Inc., Redmond, WA). Морфометрические измерения объема губчатой кости (BV/TV) проводятся в 3,0 мм2 образца ткани на 1,5 мм от ростового соединения для исключения первичной губчатой костной ткани. Минимально четыре отдельных среза измеряют от каждого животного. Анализ веса матки, анализ рассасывания кости, физические свойства кости и гистоморфометрия основаны на анализе отклонений (ANOVA) при использовании статистических программ Statview  (Abacus Conceрts, Inc., Berkeley, CA). Когда статистическая значимость показана A 110 A, средние значения контроля и обработки сравнивают при использовании методики многократного сравнения Dunneft. Величины P, меньшие 0,05, считаются значимыми.
В сравнении с группой имитация/ основа обработанных животных удаление яичников у животных вызывает значительное уменьшение в сыром весе метки. Замена эстрогена восстанавливает вес матки до величины, наблюдаемой у имитационной модели, но при обработке центхроманом не наблюдают статистически значимого эффекта, даже при более высоких дозах 5,0 мг/день. Характерное повышенное рассасывание кости, удаление яичников снижает скелетное удерживание 3H-T в бедрах и позвонках (таблицы 1 и 2, соответственно). Как ожидается, обработка эстрогеном повышает удерживание 3H-T в костях. Действие центхромана подражает эффекту этстрагена на рассасывание кости путем дозо-зависимого увеличения скелетного удерживания 3H-T этими двумя частями скелета (r2 – величины, равные 0,96 и 0,92 для бедра и позвонка, соответственно).
Способность центхромана ингибировать рассасывание кости и предупреждать рассасывание кости подтверждается измерениями объема губчатой кости и в большеберцовой кости определением массы кости бедра и позвонка. Сравнение обработки крыс с удаленными яичниками пустой лекарственной средой и центхроманом показывает дозо-зависимое повышение объема губчатой кости проксимальной большеберцовой кости (фиг. 2; 2 = 0,99). Подобно центхроман имеет дозо-зависимое действие на массу бедра и позвонка.
В заключение можно сказать, что эти данные показывают, что способность центхромана предупредить рассасывание кости у крыс с удаленными яичниками не зависит от способности препарата снижать вес матки. Это ясно показано на фиг. 3 путем объединения данных по весу матки и данных при рассасыванию кости из бедра, показывая независимые эффекты центхромана на эти две ткани.
Хотя предшествующее изложение изобретения описывается в некоторых деталях путем иллюстраций и примерами, очевидно, что некоторые изменения и модификации могут вводиться в область заявленной формулы изобретения. (Abacus Conceрts, Inc., Berkeley, CA). Когда статистическая значимость показана A 110 A, средние значения контроля и обработки сравнивают при использовании методики многократного сравнения Dunneft. Величины P, меньшие 0,05, считаются значимыми.
В сравнении с группой имитация/ основа обработанных животных удаление яичников у животных вызывает значительное уменьшение в сыром весе метки. Замена эстрогена восстанавливает вес матки до величины, наблюдаемой у имитационной модели, но при обработке центхроманом не наблюдают статистически значимого эффекта, даже при более высоких дозах 5,0 мг/день. Характерное повышенное рассасывание кости, удаление яичников снижает скелетное удерживание 3H-T в бедрах и позвонках (таблицы 1 и 2, соответственно). Как ожидается, обработка эстрогеном повышает удерживание 3H-T в костях. Действие центхромана подражает эффекту этстрагена на рассасывание кости путем дозо-зависимого увеличения скелетного удерживания 3H-T этими двумя частями скелета (r2 – величины, равные 0,96 и 0,92 для бедра и позвонка, соответственно).
Способность центхромана ингибировать рассасывание кости и предупреждать рассасывание кости подтверждается измерениями объема губчатой кости и в большеберцовой кости определением массы кости бедра и позвонка. Сравнение обработки крыс с удаленными яичниками пустой лекарственной средой и центхроманом показывает дозо-зависимое повышение объема губчатой кости проксимальной большеберцовой кости (фиг. 2; 2 = 0,99). Подобно центхроман имеет дозо-зависимое действие на массу бедра и позвонка.
В заключение можно сказать, что эти данные показывают, что способность центхромана предупредить рассасывание кости у крыс с удаленными яичниками не зависит от способности препарата снижать вес матки. Это ясно показано на фиг. 3 путем объединения данных по весу матки и данных при рассасыванию кости из бедра, показывая независимые эффекты центхромана на эти две ткани.
Хотя предшествующее изложение изобретения описывается в некоторых деталях путем иллюстраций и примерами, очевидно, что некоторые изменения и модификации могут вводиться в область заявленной формулы изобретения.
Формула изобретения
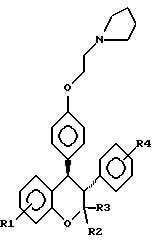 или его фармакологически приемлемую соль, где R1 и R4 независимо являются водородом, гидрокси, галогеном, трифторметилом, C1 – C6-алкилом или C1 – C6-алкокси; R2 и R3 независимо являются водородом или C1 – C6-алкилом. 2. Способ по п.1, отличающийся тем, что R1 представляет низший алкоксил, R2 и R3 представляют низший алкил, а R4 представляет водород. 3. Способ по п.1, отличающийся тем, что R1 является метоксигруппой. 4. Способ по п.1, отличающийся тем, что R2 и R3 представляют метил. 5. Способ по п.1, отличающийся тем, что R4 представляет водород. 6. Способ по п.1, отличающийся тем, что указанное соединение является выделенным d- или l-энантиомером. 7. Способ по п.1, отличающийся тем, что указанное соединение является l-энантиомером. 8. Способ по п.1, отличающийся тем, что указанное соединение является 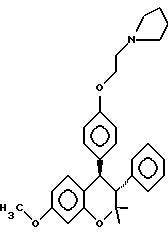 9. Способ по п.8, отличающийся тем, что указанное соединение является выделенным d- или l-энантиомером. 10. Способ по п.9, отличающийся тем, что указанное соединение является l-энантиомером. 11. Способ по п.1, отличающийся тем, что указанным пациентом является женщина после менопаузы. 12. Способ по п. 1, отличающийся тем, что указанная композиция представляет собой форму, пригодную для орального введения. 13. Способ по п.1, отличающийся тем, что указанное соединение вводят в дозе от 0,1 до 0,5 мг на 1 кг веса пациента в день. 14. Способ по п.1, отличающийся тем, что указанную композицию вводят с интервалом от суток до недели. 15. Способ по п.1, отличающийся тем, что указанная композиция находится в форме подкожного имплантанта. 16. Способ лечения остеопороза, отличающийся тем, что пациенту вводят выделенный d- или l-энантиомер соединения, ингибирующего рассасывания кости, связанное с дефицитом эстрогенов, и имеющего формулу 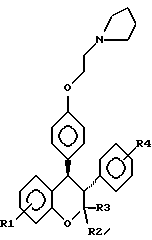 или его фармакологически приемлемую соль, где R1 и R4 независимо являются водородом, гидрокси, галогеном, трифторметилом, C1 – C6-алкилом или C1 – C6-алкокси; R2 и R3 независимо являются водородом или C1 – C6-алкилом, в количестве, достаточном для ингибирования рассасывания кости. 17. Способ по п. 16, отличающийся тем, что R1 представляет низший алкоксил, R2 и R3 представляют низший алкил, а R4 представляет водород. 18. Способ по п.16, отличающийся тем, что R1 является метоксигруппой. 19. Способ по п.16, отличающийся тем, что R2 и R3 представляют метил. 20. Способ по п.16, отличающийся тем, что R4 представляет водород. 21. Способ по п.16, отличающийся тем, что указанное соединение представляет 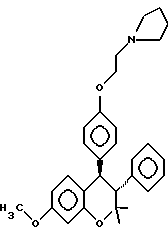 22. Способ по п.16, отличающийся тем, что указанным пациентом является женщина после менопаузы. 23. Применение соединений следующей структуры: 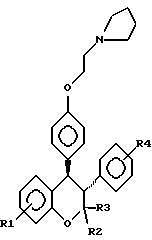 или их фармакологически приемлемых солей, где R1 и R4 независимо являются водородом, гидрокси, галогеном, трифторметилом, C1 – C6-алкилом или C1 – C6-алкокси; R2 и R3 независимо являются водородом или C1 – C6-алкилом, в качестве средства лечения или предотвращения потерь костной ткани, связанных с дефицитом эстрогена. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 14.01.2005
Извещение опубликовано: 20.04.2006 БИ: 11/2006
|
||||||||||||||||||||||||||
