Патент на изобретение №2166935
|
||||||||||||||||||||||||||
(54) ТАБЛЕТИРОВАННАЯ МНОГОЕДИНИЧНАЯ ЛЕКАРСТВЕННАЯ ФОРМА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ СЕКРЕЦИИ ЖЕЛУДОЧНОЙ КИСЛОТЫ ИЛИ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ ЗАБОЛЕВАНИЙ У МЛЕКОПИТАЮЩИХ И ЧЕЛОВЕКА
(57) Реферат: Изобретение относится к фармации. Предложены многоединичная таблетированная лекарственная форма, содержащая в качестве активного вещества кислотонеустойчивый ингибитор H+K+-АТФазы или его щелочную соль, или один из его энантиомеров или его щелочную соль, способ ее изготовления и применение такой лекарственной формы в медицине. Активное вещество не разрушается в кислых средах и стабильно при хранении. 3 с. и 16 з.п. ф-лы, 2 табл. Изобретение касается новых фармацевтических препаратов в виде многоединичной таблетированной лекарственной формы, содержащей активное вещество в виде кислотонеустойчивого ингибитора H+K+-АТФазы. Новая таблетированная лекарственная форма предназначена для перорального применения. Кроме того, данное изобретение относится к способу производства таких препаратов и к применению таких препаратов в медицине. Кислотонеустойчивые ингибиторы H+K+-АТФазы, также называемые ингибиторами желудочной протонной помпы (протонного насоса), представляют собой, например, соединения под родовыми названиями омепразол, лансопразол, пантопразол, парипразол и леминопразол. Целевые соединения для новой таблетированной лекарственной формы данного изобретения представляют собой соединения общей формулы 1 или их щелочные соли или один из энантиомеров подобного соединения или его щелочную соль (соль щелочного металла). 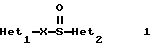 где Het1 представляет собой 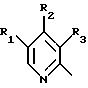 или 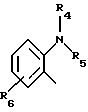 Het2 представляет собой 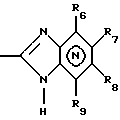 или 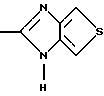 или 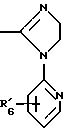 X обозначает 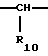 или 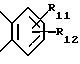 где N в бензимидазольной части обозначает, что один из атомов углерода, замещенных R6-R9, иногда может быть заменен атомом азота без каких-либо заместителей, R1, R2 и R3 одинаковы или различны и выбраны из водорода, алкила, алкоксигруппы, необязательно замещенных фтором, алкилтио-, алкоксиалкокси-, диалкиламино-, пиперидино-, морфолиногруппой, галогеном, фенилом и фенилалкоксигруппой. R4 и R5 одинаковы или различны и выбраны из водорода, алкила и аралкила, R’6 представляет собой водород, галоген, трифторметил, алкил, алкоксигруппу, R6-R9 одинаковы или различны и выбраны из водорода, алкила, алкоксигруппы, галогена, галоген-алкоксигруппы, алкилкарбонила, алкоксикарбонила, оксазолила, трифторалкила или смежные группы R6-R9 образуют кольцевые структуры, которые могут быть дополнительно замещенными, R10 представляет собой водород или образует вместе с R3 алкиленовую цепь, R11 и R12 одинаковы или различны и выбраны из водорода, галогена или алкила, за исключением соединений 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил] сульфинил] -1H- бензимидазол, 5-фтор-2-[[(4-циклопропилметокси-2-пиридинил)метил] сульфинил] -1H-бензимидазол и 5-карбометокси-6-метил-2-[[(3,4-диметокси-2-пиридинил)метил]сульфинил]-1H-бензимидазол. Примерами характерных представляющих интерес соединений формулы 1 являются 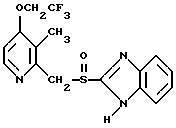 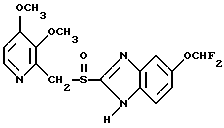 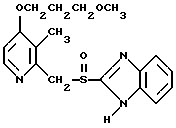 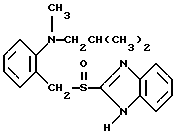 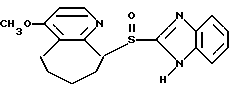 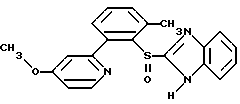 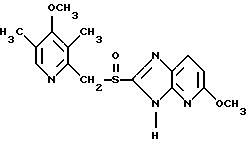 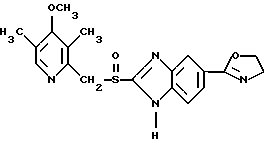 Активное соединение, применяемое в таблетированной лекарственной форме согласно этому изобретению, может быть использовано в нейтральном виде или в форме соли щелочного металла, такой, например, как соли Mg2+, Ca2+, Na+ или K+, предпочтительно в виде солей Mg2+. Эти соединения можно также применять в форме одного из одиночных энантиомеров или его щелочных солей. Некоторые из указанных выше соединений описаны, например, в EP-A1-0005129, EP-A1-174726, EP-A1-166287 и GB 2163747. Эти активные вещества применимы для ингибирования секреции желудочной кислоты у млекопитающих и людей. В более общем смысле, они могут применяться для предотвращения и лечения связанных с желудочной кислотой заболеваний у млекопитающих и людей, в том числе, например, рефлюкс-эзофагита (пептического эзофагита), гастрита, дуоденита, язвы желудка и язвы двенадцатиперстной кишки. Кроме того, их можно применять для лечения других желудочно-кишечных нарушений, при которых желательно ингибирование выделения желудочной кислоты, например, у больных, подвергнутых лечению NSAID-терапии (лечению с применением средства нестероидной противовоспалительной терапии), у больных с неязвенной диспепсией, у больных с симптомами гастро-эзофагеального рефлюкс-заболевания и у больных с ульцерогенной аденомой поджелудочной железы. Их можно также применять для больных в ситуациях интенсивной терапии, для больных с верхним желудочно-кишечным кровотечением, перед операцией и постоперационно для предотвращения аспирации желудочной кислоты и для предотвращения и лечения образования язвы при стрессе. Кроме того, их можно применять в лечении псориаза, а также в лечении инфекций, вызываемых Helicobacter, и родственных им заболеваний. Однако эти активные соединения чувствительны к деградации/превращению в кислых и нейтральных средах. Деградация катализируется кислотными соединениями и стабилизируется в смесях со щелочными соединениями. На стабильность активных веществ влияют также влага, органические растворители и до некоторой степени свет. В отношении свойств стабильности этих активных веществ очевидно, что пероральная твердая лекарственная форма должна быть защищена от контакта с кислым желудочным соком и такое активное вещество должно переноситься в интактной форме к той части желудочно-кишечного тракта, где pH близок к нейтральному и где может происходить быстрое всасывание (поглощение). Фармацевтическая пероральная лекарственная форма таких кислотонеустойчивых ингибиторов H+K+-АТФазы наилучшим образом защищена от контакта с кислым желудочным соком при помощи слоя энтеросолюбильного покрытия. В патенте США 4853230 описан такой препарат с энтеросолюбильным покрытием. Такой препарат содержит щелочное ядро (центральную часть), включающее в себя чувствительное к кислоте вещество, разделяющий слой и слой энтеросолюбильного покрытия. Для дальнейшего увеличения стабильности во время хранения приготовленная лекарственная форма может быть иногда упакована с высушивающим средством. Существует потребность в разработке новых имеющих энтеросолюбильные покрытия многоединичных препаратов с хорошей химической и механической стабильностью, обеспечивающих возможность производства хорошо функционирующих и благоприятных для больного упаковок, таких как, например, упаковок в виде пластырей. Кроме того, существует потребность в готовых лекарственных формах, имеющих улучшенные свойства с точки зрения их приема больными, таких как разделяемые и/или диспергируемые таблетки. Хорошая механическая стабильность может быть получена в случае покрытой энтеросолюбильным покрытием таблетки. WO 95/01783 описывает такую таблетку, содержащую кислотонеустойчивое соединение омепразол. Однако только покрытая энтеросолюбильным покрытием многоединичная таблетка может быть сделана разделяемой и диспергируемой. Дальнейшим преимуществом покрытой энтеросолюбильным покрытием миогоединичной таблетки является то, что она диспергируется на множество малых единиц в желудке при введении. Предшествующие исследования описывают много различных типов многоединичных лекарственных форм. Обычно такой тип лекарственной формы требуется для готовых лекарственных форм с контролируемым выделением, таких как формы с пролонгированным действием. В типичном случае многоединичная готовая лекарственная форма может представлять собой таблетку, которая распадается в желудке, делая доступными множество покрытых энтеросолюбильным покрытием единиц, или шарики, заключенные в капсулу (см., например, EP 0080341 и патент США 4853230). Пример получения лекарственной формы с контролируемым выделением, выделяющей активное вещество путем диффузии через мембрану, описан в патенте США 4927640, т.е. описана многоединичная система, содержащая небольшие инертные ядра (центральные части), покрытые активным веществом и регулирующей выделение активного вещества полимерной мембраной. Механические свойства таких множественных единиц, сформованных в таблетки, описаны в Pharmaceutical Researсh 10 (1993), p. S-274. Другие примеры лекарственных форм с контролируемым выделением описаны, например, в Aulton M.E. (Churchhill Lioingstone Ed. ), Pharmaceutics: The science of dosage form design (1988), p. 316-321. Даже если имеются примеры в предшествующих исследованиях, упоминающие о том, что шарики могут быть сформованы в таблетки, нет примеров, описывающих какие-либо композиции такой таблетированной готовой формы или способ изготовления такой готовой лекарственной формы кислотонеустойчивых ингибиторов H+K+-АТФазы. На практике при прессовании покрытых энтеросолюбильным покрытием шариков, содержащих кислотонеустойчивые вещества, в таблетки возникают проблемы. Если слой энтеросолюбильного покрытия не выдерживает прессования шариков в таблетки, то чувствительное активное вещество будет разрушаться проникающим кислым желудочным соком, т.е. кислотоустойчивость энтеросолюбильного слоя осадков будет недостаточной в таблетке после прессования. Указанные выше проблемы хорошо проиллюстрированы в Стандартных Примерах ниже. Далее, таблетки контролируемого выделения из имеющих энтеросолюбильное покрытие частиц описаны в Drugs Made in Germany, 37, N 2 (1994), p. 53. В этой ссылке сообщается, что комбинация сополимера метакриловой кислоты (L30D-55) и сополимера этилакрилата и метилметакрилата (NE30D) пригодна для имеющих энтеросолюбильное покрытие частиц, спрессованных в таблетки, в качестве покрывающих полимеров. Стандартный Пример III показывает, что эта рекомендация неприменима при изготовлении многоединичных таблетированных лекарственных форм чувствительного к кислоте вещества, такого как омепразол. Устойчивость к кислоте этих шариков, прессованных в таблетки, является слишком низкой. Цитированная ссылка Drugs Made in Germany также утверждает, что применение сополимера L30D-55 без добавления сополимера NE30D в качестве слоя энтеросолюбильного покрытия приведет к получению покрытых шариков, которые не смогут выдержать сил прессования, применяемых во время процесса таблетирования. Со ссылкой на это утверждение неожиданно было обнаружено, что шарики, покрытые L30D-55, в соответствии с данным изобретением (см. Примеры) можно спрессовать в таблетки с выполнением необходимых условий, в том числе с приемлемой устойчивостью к кислотам такой таблетки. Заявителю неизвестны какие-либо пригодные для практики примеры многоединичной таблетированной лекарственной формы, содержащей кислотонеустойчивый ингибитор H+K+-АТФазы. Описание изобретения Заявитель неожиданно обнаружил, что таблетки данного изобретения, содержащие покрытые слоем энтеросолюбильного покрытия единицы, включающие в себя кислотонеустойчивый ингибитор H+K+-АТФазы или один из его одиночных энантиомеров или его щелочную соль, могут быть изготовлены прессованием указанных единиц в таблетки без значительного воздействия на свойства слоя энтеросолюбильного покрытия. Как объяснено выше, если этот слой энтеросолюбильного покрытия повреждается во время прессования покрытых этим слоем единиц, то устойчивость к кислоте слоя энтеросолюбильного покрытия в изготовленных таблетках будет недостаточной и изготовленные таблетки не будут удовлетворять стандартным требованиям, предъявляемым к имеющим энтеросолюбильное покрытие изделиям, таким, например, которые определены в United States Pharmacopeia, включенной здесь в виде полной ссылки. Представляющие интерес кислотонеустойчивые ингибиторы H+K+-АТФазы для новой лекарственной формы данного изобретения приведены в п. 2 формулы изобретения, а особенно предпочтительные соединения приведены в п. 3 формулы изобретения. Одной целью данного изобретения является обеспечение фармацевтической многоединичной таблетировавной лекарственной формы, содержащей кислотонеустойчивый ингибитор H+K+-АТФазы или один из его энантиомеров или его щелочную соль, в которой активное вещество находится в виде отдельно покрытых энтеросолюбильным слоем единиц, спрессованных в таблетку. Слой (слои) энтеросолюбильного покрытия, покрывающий отдельные единицы активного вещества, имеет такие свойства, что прессование этих единиц в таблетку не оказывает существенного влияния на устойчивость к кислоте отдельно покрытых энтеросолюбильным слоем единиц. Активное вещество предохраняется от деградации и растворения в кислых средах и имеет хорошую стабильность при долгосрочном хранении, Энтеросолюбильный покрывающий слой отдельных единиц быстро разрушается/растворяется в близких к нейтральным или щелочных средах. Другой целью данного изобретения является обеспечение фармацевтической многоединичной таблетированной лекарственной формы, содержащей кислотонеустойчивый ингибитор H+K+-АТФазы или один из его энантиомеров или его щелочную соль, которая легко разделяется на единицы и легка для обращения с ней. Такую многоединичную таблетированную лекарственную форму можно диспергировать в водной жидкости и давать больным с нарушениями глотания и применять в педиатрии. Такую суспензию диспергированных единиц со сдоем энтеросолюбильного покрытия приемлемого размера можно использовать для перорального введения и для кормления через назально-желудочную питательную трубку. Подробное описание изобретения Новая многоединичная таблетированная лекарственная форма, содержащая активное вещество в виде кислотонеустойчивого ингибитора H+K+-АТФазы или один из его энантиомеров или его щелочную соль, имеет следующие характеристики. Отдельно покрытые энтеросолюбильным слоем единицы, содержащие активное вещество и иногда щелочные вещества, смешивают с наполнителями для таблеток и прессуют в многоединичные таблетированные лекарственные формы. Выражение “индивидуальные (отдельные) единицы” означает небольшие гранулы, частицы, гранулы или шарики, в дальнейшем называемые шариками. Процесс уплотнения (прессования) для изготовления многоединичной таблетированной лекарственной формы не должен оказывать существенного влияния на кислотоустойчивость покрытых энтеросолюбильным слоем шариков. Другими словами, механические свойства, такие как пластичность и жесткость, а также толщина, энтеросолюбильного покрывающего слоя (слоев) должны гарантировать, что требования к имеющим энтеросолюбильное покрытие изделиям, предъявляемые в United States Pharmacopeia, выполняются и что кислотоустойчивость не снижается более чем на 10% во время прессования шариков в таблетки. Пластичность/твердость слоев энтеросолюбильного покрытия может быть охарактеризована, например, как твердость по Виккерсу, измеряемая при помощи прибора Shimadzu micro hardness identation tester type HMV 2000. Кислотостойкость (кислотоустойчивость) определяют как количество активного вещества в таблетках или шариках после выдерживания с имитированной желудочной жидкостью, USP, или с 0,1 М HCl (водной) по сравнению с необработанными таблетками или шариками, соответственно. Испытание проводят следующим образом. Таблетки или шарики подвергают действию имитированной желудочной жидкости при температуре 37oC. Таблетки разрушаются и высвобождают покрытые энтеросолюбильным слоем шарики в среду. После двух часов шарики удаляют и анализируют на содержание активного вещества при помощи жидкостной хроматографии высокого разрешения (HPLC, ЖХВР). Представленные величины кислотостойкости представляют собой средние из не менее трех отдельных определений. Материал центральной части (ядро) Материал ядра для отдельно покрытых энтеросолюбильным слоем осадков может быть составлен согласно различным принципам. Включения, переслоенные с активным веществом, иногда смешанным со щелочными соединениями, могут быть использованы в качестве материала ядра для дальнейшей обработки. Эти включения, которые должны быть переслоены с активным веществом, могут быть водонерастворимыми материалами, содержащими различные оксиды, целлюлозы, органические полимеры и другие материалы по отдельности или в смесях, или водорастворимыми материалами, содержащими различные неорганические соли, сахара, уникальные вещества и другие материалы по отдельности или в смесях. Далее включения могут содержать активное вещество в виде кристаллов, агломератов, спрессованных материалов и т.д. Размер материалов включения не является существенным для данного изобретения и может варьировать между приблизительно 0,1 и 2 мм. Включения, покрытые активным веществом, получают наслаиванием либо суспензии, либо раствора порошка с применением, например, гранулирования или установки для нанесения покрытия распылением. Перед покрытием материала включения активное вещество можно смешать с другими компонентами. Такими компонентами могут быть связующие вещества, поверхностно-активные вещества, наполнители, дезинтегрирующие агенты, щелочные добавки или иные фармацевтически приемлемые ингредиенты по отдельности или в смесях. Связующие вещества представляют собой, например, целлюлозы, такие как гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза и натриевая карбоксиметилцеллюлоза, поливинилпирролидон, сахара, крахмалы и другие фармацевтически приемлемые вещества с клейкими свойствами. Подходящие поверхностно-активные вещества обнаружены в группах фармацевтически приемлемых неионогенных или ионогенных сурфактантов, таких как, например, лаурилсульфат натрия. Альтернативно, ингибитор H+K+-АТФазы или один из его выделенных энантиомеров или его щелочная соль, иногда смешанные со щелочными соединениями и, кроме того, смешанные с подходящими компонентами, могут быть сформованы в материал ядра. Эти материалы ядра могут быть получены экструзией/сферонизацией (образованием шарообразных частиц), образованием комков или прессованием с применением различных установок. Размер приготовленных материалов ядра составляет приблизительно 0,1-4 мм и предпочтительно 0,1-2 мм. Изготовленные материалы ядра могут затем покрываться слоями дополнительных ингредиентов, содержащих активное вещество, и/или могут быть применены для дальнейшей обработки. Активное вещество смешивают с фармацевтическими компонентами для получения предпочтительных свойств для манипулирования и обработки и подходящей концентрации активного вещества в конечной смеси. Можно использовать фармацевтические компоненты, такие как наполнители, связующие вещества, смазывающие вещества, дезинтегрирующие агенты, поверхностно-активные вещества и другие фармацевтически приемлемые добавки. Активное вещество может быть также смешано со щелочным фармацевтически приемлемым веществом (или веществами). Такие вещества могут быть выбраны из (но не только из них) таких веществ, как соли натрия, калия, кальция, магния и алюминия фосфорной кислоты, угольной кислоты, лимонной кислоты или других подходящих слабых неорганических или органических кислот; соосажденных гидроксида алюминия/бикарбоната натрия; веществ, обычно применяемых в антацидных препаратах, таких как гидроксиды алюминия, кальция и магния; оксида магния или композиционных веществ, таких как Al2O3  6MgO 6MgO 12H2O, (Mg6Al2(OH)16CO3 12H2O, (Mg6Al2(OH)16CO3 4H2O), MgO 4H2O), MgO Al2O3 Al2O3 2SiO2 2SiO2 nH2O или подобные соединения, органических pH-буферирующих веществ, таких как трисгидроксиметиламинометан, основные аминокислоты и их соли или другие подобные, фармацевтически приемлемые регулирующие pH вещества.
Альтернативно, указанный выше материал ядра может быть приготовлен при помощи сушки распылением или способом распыления с вымораживанием.
Активное вещество находится в форме кислотонеустойчивого ингибитора H+K+-АТФазы формулы 1 или одного из его энантиомеров или его щелочной соли. Эти соединения имеют асимметричный центр в атоме серы, т.е. существуют в виде двух оптических изомеров (энантиомеров). Как чистые энантиомеры, рацемические смеси (50% каждого энантиомера), так и неравные смеси этих двух энантиомеров пригодны для фармацевтической готовой лекарственной формы согласно данному изобретению.
Слой энтеросолюбильного покрытия (слои) nH2O или подобные соединения, органических pH-буферирующих веществ, таких как трисгидроксиметиламинометан, основные аминокислоты и их соли или другие подобные, фармацевтически приемлемые регулирующие pH вещества.
Альтернативно, указанный выше материал ядра может быть приготовлен при помощи сушки распылением или способом распыления с вымораживанием.
Активное вещество находится в форме кислотонеустойчивого ингибитора H+K+-АТФазы формулы 1 или одного из его энантиомеров или его щелочной соли. Эти соединения имеют асимметричный центр в атоме серы, т.е. существуют в виде двух оптических изомеров (энантиомеров). Как чистые энантиомеры, рацемические смеси (50% каждого энантиомера), так и неравные смеси этих двух энантиомеров пригодны для фармацевтической готовой лекарственной формы согласно данному изобретению.
Слой энтеросолюбильного покрытия (слои)Перед нанесением слоя (слоев) энтеросолюбильного покрытия на материал ядра в форме отдельных шариков эти шарики могут быть иногда покрыты одним или несколькими разделяющими слоями, содержащими фармацевтические наполнители, иногда включающие в себя щелочные соединения, такие как, например, pH-буферирующие соединения. Такой (такие) слой (слои) отделяет (отделяют) материал ядра от наружного слоя (слоев), являющегося слоем энтеросолюбильного покрытия. Разделяющий слой (слои) может быть нанесен на материал ядра при помощи способов покрытия или наслаивания в подходящих установках, таких как кристаллизатор, гранулятор для покрытия, или в аппарате с псевдоожиженным слоем с применением воды и/или органических растворителей для процесса нанесения покрытия. В качестве альтернативы разделяющий слой или слои могут быть нанесены на материал ядра при помощи способа нанесения покрытия в виде порошка. Материалами для разделяющих слоев являются фармацевтически приемлемые соединения, такие как, например, сахар, полиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, поливинилацетат, гидроксипропилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая карбоксиметилцеллюлоза и другие, применяемые по отдельности или в виде смесей. В разделяющий слой или слои могут быть также включены добавки, такие как пластификаторы, красители, пигменты, наполнители, антиадгезивы и антистатики, такие как стеарат магния, диоксид титана, тальк и другие добавки. Когда этот необязательный слой или слои наносят на материал ядра, он может быть различной толщины. Максимальная толщина этого необязательного разделяющего слоя обычно лимитируется только условиями обработки. Разделяющий слой или слои могут служить в качестве диффузионного барьера и могут действовать как зона, регулирующая pH. Буферные свойства разделительного слоя могут быть далее усилены введением в этот слой или слои веществ, выбранных из группы соединений, обычно применяемых в антацидных препаратах, таких как, например, оксид магния, гидроксид или карбонат магния, гидроксид алюминия или кальция, карбонат или силикат алюминия или кальция; композиционные соединения алюминия/магния, такие как Al2O3  6MgO 6MgO CO2 CO2 12H2O, (Mg6Al2(OH)16CO3 12H2O, (Mg6Al2(OH)16CO3 4H2O), MgO 4H2O), MgO Al2O3 Al2O3 2SiO2 2SiO2 nH2O, соосажденные гидроксид алюминия/бикарбонат натрия или подобные соединения; или другие фармацевтически приемлемые регулирующие pH-соединения, такие как соли натрия, калия, кальция, магния и алюминия фосфорной, угольной, лимонной или других подходящих слабых неорганических или органических кислот; или подходящие органические основания, в том числе основные аминокислоты и их соли. Для увеличения толщины слоя или слоев и, следовательно, усиления диффузионного барьера могут быть добавлены тальк или другие соединения. Иногда наносимый разделяющий слой (или слои) не является существенным для изобретения. Однако этот разделяющий слой или слои могут улучшить химическую стабильность активного вещества и/или физические свойства новой многоединичной таблетированной лекарственной формы.
Один или несколько слоев энтеросолюбильного покрытия наносят на материал ядра или на материал ядра, покрытый разделяющим слоем или слоями, при помощи пригодного для этого способа нанесения покрытия. Материал слоя энтеросолюбильного покрытия может быть диспергирован или растворен либо в воде, либо в подходящих органических растворителях. В качестве полимеров слоя энтеросолюбильного покрытия можно использовать один или более, отдельно или в комбинации, из следующих полимеров: например, растворы или дисперсии сополимеров метакриловой кислоты, ацетат-фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксипропилметилцеллюлозы, поливинилацетат-фталат, ацетат-тримеллитат целлюлозы, карбоксиметилцеллюлозу, шеллак или другие подходящие для слоя энтеросолюбильного покрытия полимеры.
Слои энтеросолюбильного покрытия содержат фармацевтически приемлемые пластификаторы для получения желательных механических свойств, таких как пластичность и твердость слоев энтеросолюбильного покрытия. Такие пластификаторы представляют собой (но не ограничиваются ими) триацетин, эфиры лимонной кислоты, эфиры фталевой кислоты, дибутилсебакат, цетиловый спирт, полиэтиленгликоли, полисорбаты или иные пластификаторы.
Количество пластификатора оптимизируют для каждой формулы слоя энтеросолюбильного покрытия в отношении выбранных полимеров слоя, выбранных пластификаторов и примененного количества указанных полимеров таким образом, что механические свойства, т.е. пластичность и твердость слоев энтеросолюбильного покрытия, например, выраженные в виде твердости по Виккерсу, регулируются таким образом, что кислотостойкость шариков, покрытых слоем энтеросолюбильного покрытия, не уменьшается существенно во время прессования этих шариков в таблетки. Количество пластификатора обычно более 10% по весу от полимеров слоя энтеросолюбильного покрытия, предпочтительно 15-50% и более, предпочтительно 20-50%. В слой энтеросолюбильного покрытия могут быть включены добавки, такие как диспергаторы, красители, пигменты, полимеры, например поли(этилакрилат, метилметакрилат), антиадгезивы и противовспенивающие агенты. Другие соединения могут быть добавлены для увеличения толщины пленки и для уменьшения диффузии кислого желудочного сока в чувствительный к кислоте материал.
Для защиты чувствительного к кислоте вещества, такого как ингибиторы H+K+-АТФазы, и для получения приемлемой кислотостойкости многоединичной таблетированной лекарственной формы согласно данному изобретению слой энтеросолюбильного покрытия дает толщину приблизительно не менее 10 мкм, предпочтительно более 20 мкм. Максимальная толщина нанесенного энтеросолюбильного покрытия (в виде слоя или слоев) обычно лимитируется только условиями обработки.
Слой защитного покрытия nH2O, соосажденные гидроксид алюминия/бикарбонат натрия или подобные соединения; или другие фармацевтически приемлемые регулирующие pH-соединения, такие как соли натрия, калия, кальция, магния и алюминия фосфорной, угольной, лимонной или других подходящих слабых неорганических или органических кислот; или подходящие органические основания, в том числе основные аминокислоты и их соли. Для увеличения толщины слоя или слоев и, следовательно, усиления диффузионного барьера могут быть добавлены тальк или другие соединения. Иногда наносимый разделяющий слой (или слои) не является существенным для изобретения. Однако этот разделяющий слой или слои могут улучшить химическую стабильность активного вещества и/или физические свойства новой многоединичной таблетированной лекарственной формы.
Один или несколько слоев энтеросолюбильного покрытия наносят на материал ядра или на материал ядра, покрытый разделяющим слоем или слоями, при помощи пригодного для этого способа нанесения покрытия. Материал слоя энтеросолюбильного покрытия может быть диспергирован или растворен либо в воде, либо в подходящих органических растворителях. В качестве полимеров слоя энтеросолюбильного покрытия можно использовать один или более, отдельно или в комбинации, из следующих полимеров: например, растворы или дисперсии сополимеров метакриловой кислоты, ацетат-фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксипропилметилцеллюлозы, поливинилацетат-фталат, ацетат-тримеллитат целлюлозы, карбоксиметилцеллюлозу, шеллак или другие подходящие для слоя энтеросолюбильного покрытия полимеры.
Слои энтеросолюбильного покрытия содержат фармацевтически приемлемые пластификаторы для получения желательных механических свойств, таких как пластичность и твердость слоев энтеросолюбильного покрытия. Такие пластификаторы представляют собой (но не ограничиваются ими) триацетин, эфиры лимонной кислоты, эфиры фталевой кислоты, дибутилсебакат, цетиловый спирт, полиэтиленгликоли, полисорбаты или иные пластификаторы.
Количество пластификатора оптимизируют для каждой формулы слоя энтеросолюбильного покрытия в отношении выбранных полимеров слоя, выбранных пластификаторов и примененного количества указанных полимеров таким образом, что механические свойства, т.е. пластичность и твердость слоев энтеросолюбильного покрытия, например, выраженные в виде твердости по Виккерсу, регулируются таким образом, что кислотостойкость шариков, покрытых слоем энтеросолюбильного покрытия, не уменьшается существенно во время прессования этих шариков в таблетки. Количество пластификатора обычно более 10% по весу от полимеров слоя энтеросолюбильного покрытия, предпочтительно 15-50% и более, предпочтительно 20-50%. В слой энтеросолюбильного покрытия могут быть включены добавки, такие как диспергаторы, красители, пигменты, полимеры, например поли(этилакрилат, метилметакрилат), антиадгезивы и противовспенивающие агенты. Другие соединения могут быть добавлены для увеличения толщины пленки и для уменьшения диффузии кислого желудочного сока в чувствительный к кислоте материал.
Для защиты чувствительного к кислоте вещества, такого как ингибиторы H+K+-АТФазы, и для получения приемлемой кислотостойкости многоединичной таблетированной лекарственной формы согласно данному изобретению слой энтеросолюбильного покрытия дает толщину приблизительно не менее 10 мкм, предпочтительно более 20 мкм. Максимальная толщина нанесенного энтеросолюбильного покрытия (в виде слоя или слоев) обычно лимитируется только условиями обработки.
Слой защитного покрытияШарики, покрытые слоем или слоями энтеросолюбильного покрытия, могут быть дополнительно покрыты одним или несколькими защитными слоями. Эти защитные слои могут быть нанесены на покрытые энтеросолюбильным слоем шарики при помощи способов нанесения покрытий в соответствующих установках, таких как кристаллизатор, гранулятор, или в аппарате с псевдоожиженным слоем с использованием воды и/или органических растворителей для процесса нанесения покрытия. Материалами для слоев защитного покрытия являются фармацевтически приемлемые соединения, такие как сахар, полиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, поливинилацетат, гидроксипропилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая карбоксиметилцеллюлоза и другие, используемые отдельно или в виде смесей. В защитные слои могут быть включены также добавки, такие как пластификаторы, красители, пигменты, наполнители, антиадгезивы и антистатики, такие, например, как стеарат магния, диоксид титана, тальк и другие добавки. Описанный защитный слой может, кроме того, предотвращать потенциальную агломерацию покрытых энтеросолюбильным слоем осадков, защищать слой энтеросолюбильного покрытия против растрескивания во время процесса уплотнения и ускорять процесс таблетирования. Максимальная толщина нанесенного защитного слоя или слоев обычно лимитируется только условиями обработки. Таблетки Покрытые энтеросолюбильным слоем шарики смешивают с наполнителями таблетки и прессуют в многоединичную таблетированную лекарственную форму согласно данному изобретению. Покрытые энтеросолюбильным слоем шарики с защитным слоем или без него смешивают с наполнителями для таблеток, такими как носители, связующие вещества, дезинтегрирующие агенты, смазывающие средства и другие фармацевтически приемлемые добавки, и прессуют в таблетки. Спрессованную таблетку иногда покрывают пленкообразующим агентом или агентами для получения гладкой поверхности таблетки и дальнейшего повышения стабильности таблетки во время упаковки и транспортировки. Такой покрывающий таблетку слой может дополнительно содержать добавки, такие как антиадгезивы, красители и пигменты или другие добавки, для получения таблетки с хорошим внешним видом. Количество покрытых энтеросолюбильным слоем шариков составляет менее 75 весовых % от общего веса таблетки и предпочтиоельно менее 60%. Путем выбора малых покрытых энтеросолюбильным слоем шариков в готовой лекарственной форме данного изобретения количество таких шариков в каждой таблетке можно поддерживать высоким, что, в свою очередь, делает таблетку разделяемой с сохраняемой точностью дозирования. Механические свойства, т.е. пластичность и твердость энтеросолюбильного слоя покрытия, существенны для кислотостойкости многоединичной таблетированной лекарственной формы. Пластичность/твердость поверхности слоя энтеросолюбильного покрытия могут быть охарактеризованы в виде предварительного параметра, такого как твердость по Виккерсу, измеренного на покрытых энтеросолюбильным слоем шариках перед прессованием их в таблетки. Твердость по Виккерсу можно измерить при помощи прибора Shimadzu micro hardness identation tester tupe HMV 2000 (Micro Hardness Testing Marchines for vickers and knoop Hardness JIS B 7734-1984 и JIS Z 2251-1980). Способность энтеросолюбильного слоя покрытия противостоять прессованию в таблетки зависит, конечно, как от количества нанесенного слоя покрытия, так и от механических свойств материала этого покрывающего слоя. Для получения хорошо функционирующих покрытых энтеросолюбильным слоем шариков с разумным количеством материала энтеросолюбильного слоя, при котором шарики можно спрессовать в таблетки без значительного влияния на кислотостойкость, предпочтительна поверхность слоя энтеросолюбильного покрытия с твердостью по Виккерсу менее 8. В случае, если энтеросолюбильный слой осадков покрыт защитным слоем, твердость по Виккерсу должна быть охарактеризована перед нанесением защитного слоя. Твердый защитный слой (с твердостью по Виккерсу более 8) может быть нанесен на пластичный и мягкий (твердость по Виккерсу менее 8) энтеросолюбильный слой с сохраняемой кислотостойкостью во время уплотнения. Таким образом, готовая лекарственная форма данного изобретения состоит из материала ядра, содержащего активное вещество, иногда смешанное со щелочными соединениями, и наполнителей. Добавление щелочного материала может не быть необходимым, однако такое вещество может далее увеличивать стабильность активного вещества. Материал ядра иногда покрыт одним или несколькими разделяющими слоями, иногда содержащими щелочное вещество или вещества. Эти шарики, иногда покрытые разделяющим слоем или слоями, покрывают затем одним или несколькими слоями энтеросолюбильного покрытия, делая эти шарики нерастворимыми в кислых средах, но распадающимися/растворяющимися в близкой к нейтральной и щелочных средах, таких как жидкости, присутствующие в проксимальной части тонкой кишки, месте, где желательным является растворение таблетки. Покрытые энтеросолюбильным слоем шарики могут быть дополнительно покрыты защитным слоем перед прессованием их в многоединичную таблетированную лекарственную форму. Способ Способ изготовления этой лекарственной формы представляет собой дальнейший аспект данного изобретения. Фармацевтические способы могут быть предпочтительно процессами на основе воды, и имеются различные описания, даваемые в примерах ниже. Применение препарата Препарат данного изобретения особенно выгоден для уменьшения секреции желудочной кислоты. Его вводят от одного до нескольких раз в день. Типичная дневная доза активного вещества варьирует и зависит от различных факторов, таких как индивидуальные потребности больных, способ введения и тип заболевания. В общем дневная доза находится в пределах 1-1000 мг активного вещества. Препарат данного изобретения применим также для диспергирования в водной жидкости с нейтральной или слабокислой величиной pH перед его пероральным введением или питанием через назально-желудочную питательную трубку. Изобретение иллюстрируется более детально следующими примерами. Пример 1 Материал кора Лансопразол – 400 г Сферические включения сахара – 400 г Гидроксипропилметилцеллюлоза – 82 г Лаурилсульфат натрия – 3 г Очищенная вода – 1600 г Разделяющий слой Материал ядра – 400 г Гидроксипропилцеллюлоза – 40 г Тальк – 69 г Стеарат магния – 6 г Очищенная вода – 800 г Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 400 г Сополимер метакриловой кислоты – 200 г Триэтилцитрат – 60 г Моно- и диглицериды – 10 г Полисорбат 80 – 1 г Очищенная вода – 420 г Таблетки Покрытые энтеросолюбильным покрытием шарики – 80 г Микрокристаллическая целлюлоза – 191 г Наслаивание суспензии проводят в аппарате с псевдоожиженным слоем с применением метода донного распыления. Лансопразол распыляют на сферические включения сахара из водной суспензии, содержащей растворенный буфер. Размер сахарных сферических включений находится в пределах 0,25-0,35 мм. Полученный материал ядра покрывают разделяющим слоем в аппарате с псевдоожиженным слоем раствором гидроксипропилцеллюлозы, содержащим тальк и стеарат магния. Слой энтеросолюбильного покрытия наносят распылением водной суспензии на шарики, покрытые разделяющим слоем, в аппарате с псевдоожиженным слоем. Твердость по Виккерсу на покрытых энтеросолюбильным слоем таблетках измеряют до значения 2. Покрытые энтеросолюбильным слоем шарики и микрокристаллическую целлюлозу смешивают и прессуют в таблетки с применением таблетировочной машины с одним штампом, использующей круглые штампы 10 мм. Высшую силу штампа устанавливают на 5 и твердость таблетки измеряют на приборе Schleuniger для определения твердости. Твердость составляла 168-185 Н. Пример 2 Материал кора Пантопразол – 600 г Маннит – 1000 г Микрокристаллическая целлюлоза – 300 г Гидроксипропилцеллюлоза – 100 г Лаурилсульфат натрия – 8 г Очищенная вода – 802 г Разделяющий слой Материал ядра – 400 г Гидроксипропилметилцеллюлоза – 48 г Очищенная вода – 960 г Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 200 г Сополимер метакриловой кислоты – 100 г Триэтилцитрат – 30 г Моно- и диглицериды – 5 г Полисорбат 80 – 0,5 г Очищенная вода – 309 г Таблетки Шарики, покрытые энтеросолюбильным слоем – 200 г Микрокристаллическая целлюлоза – 299 г Стеарилфумарат натрия – 1,2 г Лаурилсульфат натрия растворяют в очищенной воде с образованием жидкости для гранулирования. Пантопразол, маннит, микрокристаллическую целлюлозу и гидроксипропилцеллюлозу смешивают в сухом виде. Жидкость для гранулирования добавляют к порошкообразной смеси и массу смешивают в сыром виде. Влажную массу проталкивают через экструдер, снабженный ситами с размером отверстий 0,5 мм. Экструдат обрабатывают для получения шаровых частиц на фрикционном диске устройства для получения шаровых частиц. Материал ядра высушивают в сушильной установке с псевдоожиженным слоем и сортируют. Полученный материал ядра покрывают разделяющим слоем в установке с псевдоожиженным слоем с применением раствора гидроксипропилметилцеллюлоза/вода. Слой энтеросолюбильного покрытия наносят на шарики, покрытые разделяющим слоем, из водной дисперсии сополимера метакриловой кислоты, пластифицированной триэтилцитратом, к которой была добавлена дисперсия моно- и диглицеридов/полисорбата. Шарики сушат в установке с псевдоожиженным слоем. Покрытые энтеросолюбильным слоем шарики, микрокристаллическую целлюлозу и стеарилфумарат натрия смешивают и прессуют в таблетки, имеющие вес, соответствующий 20 мг активного вещества, с применением таблетировочной машины с круглыми штампами размером 10 мм. Пример 3 Материал ядра Пантопразол – 500 г Сферические включения сахара – 500 г Гидроксипропилметилцеллюлоза – 150 г Коллоидный диоксид кремния – 3 г Очищенная вода – 1400 г Разделяющий слой Материал ядра – 500 г Гидроксипропилцеллюлоза – 40 г Тальк – 67 г Стеарат магния – 6 г Очищенная вода – 800 г Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 500 г Сополимер метакриловой кислоты – 200 г Триэтилцитрат – 60 г Очищенная вода – 392 г Таблетки Покрытые энтеросолюбильным слоем шарики – 400 г Микрокристаллическая целлюлоза – 871 г Стеарилфумарат натрия – 3 г Пантопразол, часть гидроксипропилметилцеллюлозы и коллоидный диоксид кремния смешивают в сухом виде с образованием порошкообразной смеси. Сферические включения сахара (0,25-0,35 мм) покрывают этим порошком в центрифужном грануляторе для покрытия псевдоожиженным слоем при распылении раствора гидроксипропилметилцеллюлозы (6 вес.%). Полученный материал ядра высушивают и покрывают разделяющим слоем в центрифужном грануляторе для покрытия псевдоожиженным слоем. Для наслаивания энтеросолюбильного покрытия используют установку с псевдоожиженным слоем. Покрытые энтеросолюбильным слоем шарики и наполнители для таблеток смешивают и прессуют в таблетки при помощи ротационной таблетировочной машины, оборудованной 6 парами 10 мм круглых штампов. Количество активного вещества составляет приблизительно 20 мг. Пример 4 Материал ядра Леминопразол – 200 г Включения диоксида кремния – 200 г Гидроксипропилметилцеллюлоза – 35 г Лаурилсульфат натрия – 2 г Очищенная вода – 700 г Разделяющий слой Материал ядра – 400 г Гидроксипропилметилцеллюлоза – 32 г Очищенная вода – 700 г Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 400 г Сополимер метакриловой кислоты – 250 г Полиэтиленгликоль 400 – 50 г Моно- и диглицериды – 10 г Полисорбат 80 – 1 г Очищенная вода – 650 г Таблетки Покрытые энтеросолюбильным слоем шарики – 500 г Микрокристаллическая целлюлоза – 1496 г Стеарилфумарат натрия – 2 г Наслаивание суспензии выполняют в аппарате с псевдоожиженным слоем. Леминопразол распыляют на включения диоксида кремния (диапазон размеров 0,15-0,30 мм) из водной суспензии, содержащей растворенное связующее вещество и поверхностно-активный ингредиент. Полученный материал ядра покрывают разделяющим слоем в аппарате с псевдоожиженным слоем с применением раствора гидроксипропилметилцеллюлозы. Материал слоя энтеросолюбильного покрытия распыляют в виде водной дисперсии на осадки в аппарате с псевдоожиженным слоем. Покрытые энтеросолюбильным слоем шарики и наполнители для таблеток смешивают и прессуют в таблетки, как описано в Примере 2. Пример 5 Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем (приготовление и состав, как описано в Примере 1) – 500 г Сополимер метакриловой кислоты – 250 г Полиэтиленгликоль 6000 – 75 г Моно- и диглицериды – 12,5 г Полисорбат 80 – 1,2 г Очищенная вода – 490 г Таблетки Покрытые энтеросолюбильным слоем шарики – 600 г Микрокристаллическая целлюлоза – 1395 г Стеарилфумарат натрия – 5 г Покрытые энтеросолюбильным слоем шарики, микрокристаллическую целлюлозу и стеарилфумарат натрия смешивают и прессуют в таблетки, как описано в Примере 3. Пример 6 Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем (приготовление и состав, как описано в Примере 1) – 400 г Фталат гидроксипропилметилцеллюлозы – 400 г Диэтилфталат – 80 г Этанол – 1600 г Ацетон – 4000 г Таблетки Шарики, покрытые энтеросолюбильным слоем – 500 г Микрокристаллическая целлюлоза – 1500 г Стеарат магния – 5 г Наслаивание энтеросолюбильного покрытия выполняют распылением раствора в псевдоожиженном слое. Покрытые энтеросолюбильным слоем шарики, микрокристаллическую целлюлозу и стеарат магния смешивают и прессуют в таблетки, как описано в Примере 3. Пример 7 Материал ядра Лансопразол – 400 г Сферические включения сахара (мелкие) – 400 г Гидроксипропилметилцеллюлоза – 80 г Очищенная вода – 1600 г Разделяющий слой Материал ядра – 800 г Гидроксипропилцеллюлоза – 80 г Тальк – 137 г Стеарат магния – 11 г Очищенная вода – 1600 г Шарики, покрытые разделяющим слоем – 800 г Слой энтеросолюбильного покрытия Сополимер метакриловой кислоты – 400 г Триэтилцитрат – 120 г Моно- и диглицериды – 8 г Полисорбат 80 – 1 г Очищенная вода – 800 г Таблетки Покрытые энтеросолюбильным слоем шарики – 1000 г Двухосновной фосфат кальция (безводный) – 1760 г Микрокристаллическая целлюлоза – 440 г Стеарат магния – 16 г Наслаивание суспензии выполняют в аппарате с псевдоожиженным слоем. Лансопразол распыляют на сферические включения сахара из водной суспензии, содержащей растворенное связующее вещество. Приготовленный материал ядра покрывают разделяющим слоем в псевдоожиженном слое с раствором гидроксипропилцеллюлозы, содержащим тальк и стеарат магния. Слой энтеросолюбильного покрытия распыляют в виде дисперсии на шарики, покрытые разделяющим слоем, в псевдоожиженном слое. Покрытые энтеросолюбильным слоем шарики, двухосновной безводный фосфат кальция в гранулированной форме, микрокристаллическую целлюлозу и стеарат магния смешивают и прессуют в таблетки, как описано в Примере 3. Высшую силу штампа устанавливают приблизительно при 30 кН. Пример 8 Таблетки Покрытые энтеросолюбильным слоем шарики (приготовление и состав, как в Примере 1) – 1,00 кг Микрокристаллическая целлюлоза – 1,45 кг Безводная лактоэа – 0,14 кг Крахмал – 0,23 кг Повидон – 0,18 кг Очищенная вода – 0,836 кг Повидон растворяют в воде. Микрокристаллическую целлюлозу, безводную лактозу и крахмал смешивают в сухом виде. Добавляют раствор повидона, выполняя смешивание во влажном виде. Влажную массу сушат в термостате. Гранулированную массу размалывают в вибрационном грануляторе. Покрытые энтеросолюбильным слоем шарики и приготовленный гранулят смешивают и прессуют в профилированные и имеющие метки таблетки при помощи ротационной таблетировочной машины, оборудованной 16 парами овальных, 8,5 х 17 мм, таблеточных штампов. Пример 9 Защитный слой Покрытые энтеросолюбильным слоем шарики (приготовление и состав, как в Примере 7) – 400 г Гидроксипропилметилцеллюлоза – 120 г Очищенная вода – 2280 г Таблетки Покрытые защитным слоем шарики – 100 г Микрокристаллическая целлюлоза – 233 г В аппарате с псевдоожиженным слоем раствор гидроксипропилметилцеллюлозы распыляют на покрытые энтеросолюбильным слоем шарики. Твердость по Виккерсу на покрытых энтеросолюбильным слоем шариках перед нанесением защитного слоя равна 2, а твердость по Виккерсу, измеренная на покрытых защитным слоем шариках, равна 11. Покрытые защитным слоем шарики смешивают с микрокристаллической целлюлозой и прессуют в таблетки, как описано в Примере 2. Пример 10 Материал ядра Пантопразол – 100 г Сферические включения сахара – 200 г Гидроксипропилцеллюлоза – 25 г Очищенная вода – 607 г Разделяющий слой Материал ядра – 200 г Гидроксипропилцеллюлоза – 20 г Тальк – 34 г Стеарат магния – 3 г Очищенная вода – 400 г Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 200 г Сополимер метакриловой кислоты – 100 г Триэтилцитрат – 30 г Моно- и диглицериды – 5 г Полисорбат 80 – 0,5 г Очищенная вода – 282 г Таблетки Покрытые энтеросолюбильным слоем шарики – 100 г Микрокристаллическая целлюлоза – 232 г Стеарилфумарат натрия – 1 г Наслаивание суспензии выполняют в аппарате с псевдоожиженным слоем. Пантопразол распыляют на сферические включения сахара из водной суспензии, содержащей растворенное связующее вещество. Полученный материал ядра покрывают разделяющим слоем в аппарате с псевдоожиженным слоем. Слой энтеросолюбильного покрытия наносят распылением водной суспензии на шарики, покрытые разделяющим слоем, в аппарате с псевдоожиженным слоем. Покрытые энтеросолюбильным слоем шарики и наполнители таблеток смешивают и прессуют в таблетки весом приблизительно 600 мг с применением одноштамповой таблетировочной машины, использующей круглые (12 мм) штампы. Высшая сила штампа устанавливается на 5 кН, и твердость таблеток, измеренная в приборе Schleuniger для определения твердости, равна 200-220 Н. Пример 11 Слой энтеросолюбильного покрытия Материал ядра (без разделяющего слоя) – 500 г Сополимер метакриловой кислоты – 500 г Триэтилцитрат – 150 г Моно- и диглицериды – 25 г Полисорбат 80 – 2,5 г Очищенная вода – 978 г Таблетки Покрытые энтеросолюбильным слоем шарики – 800 г Микрокристаллическая целлюлоза – 1860 г Стеарилфумарат натрия – 7 г Материалы ядра получают, как в Примере 1 и в Примере 10. Покрытые энтеросолюбильным слоем шарики и наполнители таблеток прессуют, как описано в Примере 3. Пример 12 Материал ядра Парипразол – 100 г Сферические включения сахара – 200 г Повидон – 25 г Очищенная вода – 750 г Разделяющий слой Материал ядра – 100 г Повидон – 5 г Очищенная вода – 150 г Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 100 г Сополимер метакриловой кислоты – 50 г Триэтилцитрат – 15 г Тальк – 15 г Очищенная вода – 125 г Таблетки Покрытые энтеросолюбильным слоем шарики – 125 г Микрокристаллическая целлюлоза – 300 г Наслаивание суспензии выполняют в аппарате с псевдоожиженным слоем. Парипразол распыляют на сферические включения сахара из водной суспензии, содержащей растворенное связующее вещество. Полученный материал ядра покрывают разделяющим слоем в аппарате с псевдоожиженным слоем. Энтеросолюбильный слой наносят распылением водной дисперсии на шарики, покрытые разделяющим слоем, в аппарате с псевдоожиженным слоем. Покрытые энтеросолюбильным слоем шарики и микрокристаллическую целлюлозу смешивают и прессуют в таблетки, как описано в Примере 1. Пример 13 Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 200 г Ацетат-сукцинат гидроксипропилметилцеллюлозы – 100 г Триэтилацетат – 30 г Очищенная вода – 309 г Этанол – 720 г Таблетки Покрытые энтеросолюбильным слоем шарики – 100 г Микрокристаллическая целлюлоза – 227 г Кросповидон – 5 г Стеарилфумарат натрия – 1 г Шарики, покрытые разделяющим слоем, получают, как в Примере 7. Слой энтеросолюбильного покрытия наносят в псевдоожиженном слое из раствора вода/этанол. Твердость по Виккерсу на покрытых энтеросолюбильным слоем осадках измеряют до величины 5. Покрытые энтеросолюбильным слоем шарики и наполнители таблеток смешивают и прессуют в таблетки, как в Примере 2. Пример 14 Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 200 г Сополимер метакриловой кислоты – 200 г Триэтилцитрат – 60 г Моно- и дигдицериды – 10 г Полисорбат 80 – 1 г Очищенная вода – 391 г Защитный слой Покрытые энтеросолюбильным слоем шарики – 471 г Гидроксипропилметилцеллюлоза – 6 г Стеарат магния – 0,2 г Очищенная вода – 120 г Таблетки Покрытые защитным слоем шарики – 140 г Микрокристаллическая целлюлоза – 114 г Стеарилфумарат натрия – 0,4 г Шарики, покрытые разделяющим слоем, получают в соответствии с Примером 7. Слой энтеросолюбильного покрытия и защитный слой наносят распылением на шарики в аппарате с псевдоожиженным слоем. Покрытые защитным слоем шарики и наполнители таблеток прессуют при помощи одноштамповой таблетировочной машины (круглый штамп, 12 мм). Высшую силу штампа устанавливают на 6 кН. Пример 15 Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 200 г Сополимер метакриловой кислоты – 40 г Триэтилцитрат – 12 г Моно- и диглицериды – 2 г Полисорбат 80 – 0,2 г Очищенная вода – 78 г Защитный слой Покрытые энтеросолюбильным слоем шарики – 200 г Гидроксипропилметилцеллюлоза – 4 г Стеарат магния – 0,1 г Таблетки Покрытые защитным слоем шарики – 69 г Микрокристаллическая целлюлоза – 230 г Стеарилфумарат натрия – 0,7 г Шарики, покрытые разделяющим слоем, получают в соответствии с Примером 7. Энтеросолюбильный слой и защитный слой наносят распылением на шарики в аппарате с псевдоожиженным слоем. Количество материала энтеросолюбильного слоя в этом примере соответствует толщине энтеросолюбильного покрытия приблизительно 20 мкм. Покрытые защитным слоем осадки и наполнители таблеток прессуют с применением одноштамповой таблетировочной машины (круглый штамп, 10 мм). Вес таблетки приблизительно 330 мг. Пример 16 Слой энтеросолюбильного покрытия Покрытые разделяющим слоем шарики – 500 г Ацетат-фталат целлюлозы – 375 г Диэтилфталат – 150 г Ацетон – 2000 г Этанол – 2000 г Таблетки Покрытые энтеросолюбильным слоем шарики – 100 г Микрокристаллическая целлюлоза – 300 г Кросповидон – 8 г Стеарилфумарат натрия – 1 г Шарики, покрытые разделяющим слоем, получают, как в Примере 7. Слой энтеросолюбильного покрытия наносят распылением в псевдоожиженном слое из раствора в смеси ацетон/этанол. Покрытые энтеросолюбильным слоем шарики и наполнители таблеток смешивают и прессуют в таблетки, как в Примере 2. Результаты испытаний на кислотостойкость покрытых энтеросолюбильным слоем шариков и прессованных таблеток представлены в Таблице I. Замечания: Неожиданно кислотостойкость таблеток показывает, что энтеросолюбильный слой покрытия данного изобретения достаточно противостоит прессованию. Ссылочный пример I Таблетки Осадки омепразола, покрытые энтеросолюбильным слоем – 180 г Микрокристаллическая целлюлоза – 219 г Стеарилфумарат натрия – 1 г Шарики омепразола из Losec  капсул 40 мг смешивают с микрокристаллической целлюлозой и стеарилфумаратом натрия и прессуют в таблетки при помощи одноштамповой таблетировочной машины. Твердость по Виккерсу на покрытых энтеросолюбильным слоем шариках измеряют до величины 22. Инструмент для таблетирования круглый с диаметром 10 мм. Сила штампа устанавливается на 3,7 кН.
Ссылочный пример II капсул 40 мг смешивают с микрокристаллической целлюлозой и стеарилфумаратом натрия и прессуют в таблетки при помощи одноштамповой таблетировочной машины. Твердость по Виккерсу на покрытых энтеросолюбильным слоем шариках измеряют до величины 22. Инструмент для таблетирования круглый с диаметром 10 мм. Сила штампа устанавливается на 3,7 кН.
Ссылочный пример IIТаблетки Шарики лансопразола, покрытые энтеросолюбильным слоем (содержимое Lanzo  30 мг капсул) – 276 г 30 мг капсул) – 276 гМикрокристаллическая целлюлоза – 644 г Шарики лансопразола смешивают с микрокристаллической целлюлозой и таблетируют в одноштамповой таблетировочной машине. Твердость по Виккерсу на покрытых энтеросолюбильным слоем шариках измеряют до величины 18. Инструмент для таблетирования круглый с диаметром 12 мм. Силу штампа устанавливают на 3,6 кН. Ссылочный пример III Материал ядра Омепразол магния – 15,0 кг Сферические включения сахара – 15,0 кг Гидроксипропилметилцеллюлоза – 2,25 кг Очищенная вода – 40 кг Разделяющий слой Материал ядра – 15,0 кг Гидроксипропилцеллюлоза – 1,5 кг Тальк – 2,57 Стеарат магния – 0,21 кг Очищенная вода – 30 кг Слой энтеросолюбильного покрытия Шарики, покрытые разделяющим слоем – 200 г Материал энтеросолюбильного слоя используют, как описано в Drugs made in Germany, 37, N 2 (1994), p. 53, Таблица I, препарат N 9. Количество покрывающего полимера, как рассчитано в указанной ссылке, составляет 40% (вес/вес). Защитный слой Покрытые энтеросолюбильным слоем осадки – 291 г Гидроксипропилметилцеллюлоза – 4 г Стеарат магния – 0,2 г Очищенная вода – 80 г Таблетки Покрытые защитным слоем шарики – 75 г Микрокристаллическая целлюлоза – 174 г Стеарилфумарат натрия – 0,6 г Наслаивание суспензии выполняют в аппарате с псевдоожиженным слоем. Омепразол магния распыляют на сферические включения сахара из водной суспензии, содержащей растворенное связующее вещество. Разделяющий слой, слой энтеросолюбильного покрытия и защитный слой наносят распылением на шарики в аппарате с псевдоожиженным слоем. Защитный слой наносят для предотвращения слипания шариков перед таблетированием. Покрытые защитным слоем шарики и наполнители таблеток таблетируют, как в Примере 1. Высшая сила штампа устанавливается на 5 кН. Результаты испытаний на кислотостойкость покрытых энтеросолюбильным слоем шариков и спрессованных таблеток представлены в Таблице II. Комментарий: Как видно из представленных данных, исследованный энтеросолюбильный слой этих продуктов, в том числе двух продаваемых продуктов (ссылочные примеры I и II), не обладали механическими свойствами, требующимися для выдерживания прессования в таблетки. Формула изобретения
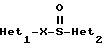 где Het1 представляет собой 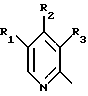 или 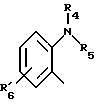 Het2 представляет собой 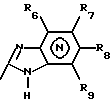 или 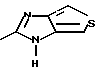 или 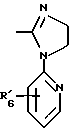 X обозначает 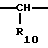 или 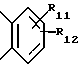 где N в бензимидазольном остатке молекулы обозначает, что один из атомов углерода, замещенных R6-R9, необязательно заменен атомом азота без каких-либо заместителей; R1, R2 и R3 – одинаковы или различны и выбраны из водорода, алкила, алкоксигруппы, необязательно замещенных фтором, алкилтио-, алкоксиалкокси-, диалкиламино-, пиперидино-, морфолиногруппой, галогеном, фенилом и фенилалкоксигруппой; R4 и R5 – одинаковы или различны и выбраны из водорода, алкила и аралкила; R’6 представляет собой водород, галоген, трифторметил, алкил и алкоксигруппу; R6-R9 – одинаковы или различны и выбраны из водорода, алкила, алкоксигруппы, галогена, галогеналкоксигруппы, алкилкарбонила, алкоксикарбонила, оксазолила, трифторалкила или смежные группы R6-R9 образуют кольцевые структуры, которые могут быть дополнительно замещенными; R10 представляет собой водород или образует вместе с R3 алкиленовую цепь; R11 и R12 – одинаковы или различны и выбраны из водорода, галогена или алкила, за исключением соединений 5-метокси-2[[(4-метокси-3,5-диметил-2-пиридинил)метил] сульфинил] -1Н-бензимидазола, 5-фтор-2[[(4-циклопропилметокси-2-пиридинил)метил] сульфинил] -1Н-бензимидазола и 5-карбометокси-6-метил-2[[(3,4-диметокси-2-пиридинил)метил] сульфинил]-1Н-бензимидазола, или их одиночных энантиомеров, или их щелочных солей. 3. Таблетированная лекарственная форма по п.1, отличающаяся тем, что активным веществом является одно из следующих соединений: 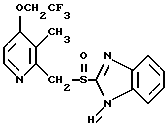 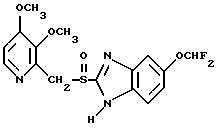 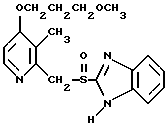 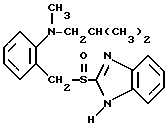 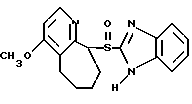 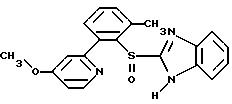 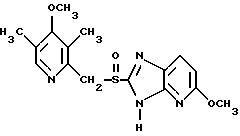 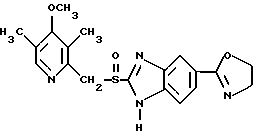 или его щелочная соль, или один из его энантиомеров, или его щелочная соль. 4. Таблетированная лекарственная форма по п.1, отличающаяся тем, что кислотостойкость отдельно покрытых энтеросолюбильным слоем единиц соответствует требованиям, предъявляемым к покрытым энтеросолюбильным слоем изделиям, определенным в United States Pharmacopeia. 5. Таблетированная лекарственная форма по п.4, отличающаяся тем, что имеет твердость по Викерсу менее 8. 6. Таблетированная лекарственная форма по п.1, отличающаяся тем, что кислотостойкость отдельно покрытых энтеросолюбильным слоем единиц не уменьшается более чем на 10% во время таблетирования. 7. Таблетированная лекарственная форма по п.1, отличающаяся тем, что слой энтеросолюбильного покрытия содержит пластификатор. 8. Лекарственная форма по п.1, отличающаяся тем, что энтеросолюбильное покрытие имеет толщину по меньшей мере 10 мкм. 9. Таблетированная лекарственная форма по п.1, отличающаяся тем, что отдельно покрытые энтеросолюбильным слоем единицы дополнительно покрыты защитным слоем, содержащим фармацевтически приемлемые наполнители. 10. Таблетированная лекарственная форма по п.1, отличающаяся тем, что является разделяемой. 11. Таблетированная лекарственная форма по п.1, отличающаяся тем, что она является диспергируемой в водном растворе с образованием суспензии отдельно покрытых энтеросолюбильным слоем единиц, содержащих активное вещество. 12. Таблетированная лекарственная форма по п.1, отличающаяся тем, что разделяющий слой расположен под энтеросолюбильным слоем. 13. Таблетированная лекарственная форма по п.12, отличающаяся тем, что разделяющий слой содержит фармацевтически приемлемые наполнители, которые растворимы или нерастворимы, но дезинтегрируются в воде и необязательно являются щелочными соединениями. 14. Таблетированная лекарственная форма по п.1, отличающаяся тем, что материал ядра представляет собой включение, прослоенное активным веществом. 15. Таблетированная лекарственная форма по п.12, отличающаяся тем, что включения имеют размер 0,1 – 2 мм. 16. Таблетированная лекарственная форма по пп. 1 – 15 как ингибитор секреции желудочной кислоты или средство лечения желудочно-кишечных воспалительных заболеваний у млекопитающих и человека. 17. Способ получения таблетированной многоединичной лекарственной формы по п. 1, согласно которому единицы материала, содержащие активное вещество, смешивают, в случае необходимости, со щелочными соединениями, затем могут быть покрыты разделяющими слоями, наносят энтеросолюбильное покрытие, смешивают с наполнителями и таблетируют. 18. Способ по п.17, отличающийся тем, что отдельно покрытые энтеросолюбильным слоем единицы активного вещества дополнительно покрывают защитным слоем перед прессованием. 19. Способ ингибирования секреции желудочной кислоты или лечения желудочно-кишечных заболеваний у млекопитающих и человека путем введения терапевтически эффективной дозы многоединичной таблетированной лекарственной формы по любому из пп.1 – 16. РИСУНКИ
|
||||||||||||||||||||||||||
