|
|
(21), (22) Заявка: 2008115714/13, 21.04.2008
(24) Дата начала отсчета срока действия патента:
21.04.2008
(46) Опубликовано: 27.01.2010
(56) Список документов, цитированных в отчете о
поиске:
US 5929046 А, 27.07.1999. STN on the Web, БД CA, AN 131:116252, RN 100644-065-3.
Адрес для переписки:
630117, г.Новосибирск, а/я 5, Л.Я. Кучумовой
|
(72) Автор(ы):
Кузнецов Никита Александрович (RU),
Коваль Владимир Васильевич (RU),
Воробьев Юрий Николаевич (RU),
Жарков Дмитрий Олегович (RU),
Сильников Владимир Николаевич (RU),
Федорова Ольга Семеновна (RU)
(73) Патентообладатель(и):
Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук (СО РАН) (RU)
|
(54) СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА 8-ОКСОГУАНИН-ДНК-ГЛИКОЗИЛАЗЫ ЧЕЛОВЕКА
(57) Реферат:
Изобретение относится к молекулярной биологии, биохимии и биотехнологии и касается соединения 6-амино-4-хлоропиразоло[3,4-d] пиримидин. Предлагаемое соединение получают из 2-амино-4,6-дихлорпиримидин-5-альдегида в две стадии способом, основанным на известной реакции селективного замещения гидроксильной группы атомом хлора (хлордегидроксилирование) и замещения атома водорода карбонильной группой с последующей циклизацией продукта гидразином. Заявленное соединение оказывает специфическое ингибирующее действие на фермент 8-оксогуанин-ДНК-гликозилазу человека (hOggl) и, являясь более дешевым и доступным соединением, расширяет арсенал специфических ингибиторов данного фермента и может с успехом применяться в медицине. 2 ил.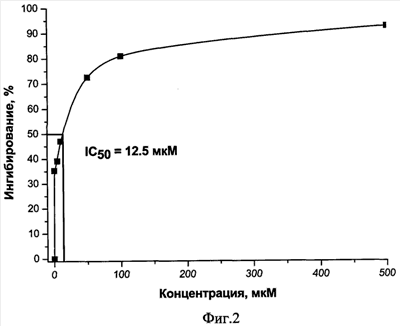
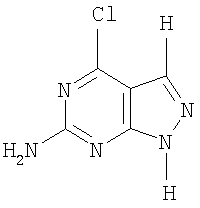
Изобретение относится к молекулярной биологии, биохимии и биотехнологии, конкретно к средству для ингибирования фермента 8-оксогуанин-ДНК-гликозилазы человека (hOggl), представляющему собой 6-амино-4-хлоропиразоло[3,4-d]пиримидин общей формулы (I):
В процессе функционирования клеточная ДНК подвергается воздействию различных факторов, приводящих к ее повреждениям. Одними из наиболее агрессивных факторов окружающей среды являются активные формы кислорода, которые индуцируют окислительные повреждения ДНК. Основным продуктом окислительной модификации пуриновых оснований ДНК является 7,8-дигидро-8-оксогуанин (8-оксогуанин). Подобные повреждения генетического аппарата обладают цитотоксическим и мутагенным эффектом и способны приводить к развитию сердечно-сосудистых, нейродегенеративных и онкологических заболеваний. Показано, что уровень 8-оксогуанина в ДНК возрастает при таких заболеваниях, как лейкемия, болезнь Паркинсона, болезнь Альцгеймера, рассеянный склероз, гепатит, рак груди, рак легких и многих других (Cooke M.S. et al. FASEB J. 2003, 17, 1195-1214; Evans M.D. et al. Mutat. Res. 2004, 567, 1-61).
Удаление остатков 8-оксогуанина из ДНК человека осуществляет фермент 8-оксогуанин-ДНК-гликозилаза (hOgg1) (Radicella J.P. et al. Proc. Natl. Acad. Sci. USA 1997, 94, 8010-8015). Фермент hOggl является бифункциональным ферментом, который расщепляет N-гликозидную связь поврежденного основания с образованием свободного остатка 8-оксогуанина и апуринового/апиримидинового сайта в ДНК. После чего он разрушает фосфодиэфирную связь со стороны 3′-атома углерода остатка 2′-дезоксирибозы путем  -элиминирования (АР-лиазная активность), образуя в ДНК одноцепочечный разрыв (Karahalil В. et al. Nucleic Acids Res. 1998, 26, 1228-1232). Альтернативный путь разрыва потенциально мутагенного апуринового/апиримидинового сайта связан с взаимодействием ДНК с АР-эндонуклеазой человека Apel. -элиминирования (АР-лиазная активность), образуя в ДНК одноцепочечный разрыв (Karahalil В. et al. Nucleic Acids Res. 1998, 26, 1228-1232). Альтернативный путь разрыва потенциально мутагенного апуринового/апиримидинового сайта связан с взаимодействием ДНК с АР-эндонуклеазой человека Apel.
Ингибиторы ферментов репарации ДНК, в частности 8-оксогуанин-ДНК-гликозилазы человека (hOgg1), могут быть использованы при химиотерапии онкологических заболеваний, поскольку уменьшение репарационной устойчивости организма необходимо для более эффективного действия противоопухолевых препаратов.
Известны ингибиторы ДНК-гликозилаз (Патент US  006369237 B1, кл. С07D 207/00, оп. 09.04.2002), представляющие собой ряд соединений с общей формулой (II) 006369237 B1, кл. С07D 207/00, оп. 09.04.2002), представляющие собой ряд соединений с общей формулой (II)
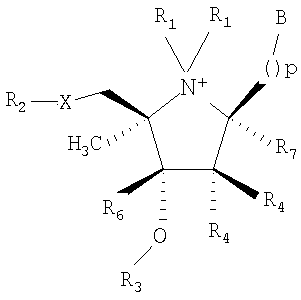
где В – это пуриновое или пиримидиновое азотистое основание или его производное;
X – это О, N, S или СН2;
R1 – это водород или защитная аминогруппа;
R2, R3, R4, R5, R6, R7 – это, независимо от окружения, насколько позволяет валентность и стабильность, водород, нуклеотид или олигонуклеотид, фосфорил, фосфонат, фосфоамидат, карбамат, фосфотиоат, галоген, алкил, алкенил, алкинил, карбонил, тиокарбонил, кетил, альдегид, амино, ациламино, амидо, амидино, циано, нитро, азидо, сульфонил, сульфоксидо, сульфат, сульфонат;
р – может быть равно 0-6.
Эти ингибиторы являются аналогами нуклеозидов, модифицированных по остатку рибозы.
Недостатком известных ингибиторов ДНК-гликозилаз является то, что эти соединения труднодоступны в связи со сложностью синтеза производных нуклеозидов, несущих заместители по остатку рибозы, и их последующего выделения из реакционной смеси.
Технической задачей изобретение является создание высокоспецифичного средства для ингибирования 8-оксогуанин-ДНК-гликозилазы человека, не содержащего остаток рибозы в своем составе.
Поставленная техническая задача решается предлагаемым средством для ингибирования фермента 8-оксогуанин-ДНК-гликозилазы человека, представляющим собой 6-амино-4-хлоропиразоло[3,4-d]пиримидин вышеуказанной общей формулы (I).
Предлагаемое соединение является аналогом гетероциклических оснований нуклеиновых кислот, а именно пуринов, которые являются бициклическими азотсодержащими молекулами.
Предлагаемое соединение получают из 2-амино-4,6-дихлорпиримидин-5-альдегида в две стадии способом, основанным на известной реакции селективного замещения гидроксильной группы атомом хлора (хлордегидроксилирование) и замещения атома водорода карбонильной группой с последующей циклизацией продукта гидразином.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1.
Предлагаемое соединение 6-амино-4-хлоропиразоло[3,4-d]пиримидин получают в две стадии. На 1 стадии получают промежуточное соединение 2-амино-4,6-дихлорпиримидин-5-альдегид.
Для этого к охлажденной до 0°С РОСl3 (90 мл) при интенсивном перемешивании по каплям добавляют в течение 20 мин 21 мл (0.138 моль) сухого диметилформамида. Охлаждающую баню убирают и добавляют 15 г (0.117 моль) порциями по 1 г сухого 2-амино-4,6-дигидроксипиримидина. Реакционную смесь нагревают до 100°С и перемешивают при этой температуре 4 ч. Раствор охлаждают до комнатной температуры и выливают в 0.6 л Н2О и 400 г льда. Водный раствор затем нагревают до 50°С и перемешивают 2 ч. Суспензию охлаждают (+6°С) в течение ночи, выпавший осадок отфильтровывают и сушат. Выход 16.0 г (71%).
На 2 стадии получают целевое соединение 6-амино-4-хлоропиразоло[3,4-d]пиримидин.
К суспензии соединения 2-амино-4,6-дихлорпиримидин-5-альдегид (15.0 г, 78.5 ммоль) в 270 мл ТГФ и 12.5 мл триэтиламина при перемешивании добавляют по каплям в течение 25 мин 2.55 мл гидразина в 60 мл Н2О. Смесь перемешивают 1 ч. Раствор фильтруют и фильтрат упаривают на 80% и добавляют 100 мл Н2О. Выпавший осадок отфильтровывают и сушат в вакууме. После переосаждения водой из минимального количества горячего ДМФА (90°С) получают 11.2 г (85%) 6-амино-6-хлоропиразоло[3,4-d]пиримидина в виде желтого мелкокристаллического вещества. На фиг.1 представлена схема получения заявленного соединения.
Данные ЯМР анализа: (ДМСО-D6)  : Н1 8.48 (1Н, с); С13 100.91 (С9), 131.14 (С8), 149.64 (С3), 153.92 (С4), 156.92 (С6). : Н1 8.48 (1Н, с); С13 100.91 (С9), 131.14 (С8), 149.64 (С3), 153.92 (С4), 156.92 (С6).
Данные масс-спектрометрии: рассчитано М=169,0155, найдено М=169,0335.
Пример 2. Ингибирование фермента 8-оксогуанин-ДНК-гликозилазы hOggl (IC50) различными концентрациями соединения вышеуказанной общей формулы (I).
Определение IC50 выполняли путем количественной оценки активности фермента 8-оксогуанин-ДНК-гликозилазы hOggl в образце, который содержит буфер (50 мМ Tris-HCl, (pH 7,5), 50 мМ КСl, 1 мМ дитиотреит, 1 мМ ЭДТА, 9% глицерин) фермент (1 мкМ), АР-субстрат (2 мкМ) и испытуемое соединение данного изобретения в разных концентрациях (0-500 мкМ) при 25°С.
Использовали 32Р-меченный субстрат, содержащий АР-сайт. Для этого олигонуклеотид d(CTCTCUCCTTCC) (0,1 мкмоль) обрабатывали урацил-ДНК-гликозилазой (15 ед. акт.) (СибЭнзим, Россия) в 150 мкл буфера (20 мМ Tris-HCl, 1 мМ ЭДТА, 1 мМ дитиотреит, 0,1 мг/мл BSA, pH 8,0). Реакционную смесь выдерживали 14 ч при 37°С. Для выделения продукта реакции, содержащего АР-сайт, использовали обращенно-фазовую хроматографию на смоле Nucleosil 100-10-C18 в буферном растворе 0,1 М TEA-Ac, pH 7,0 и линейном градиенте 0-20% ацетонитрила. Введение метки 32P по 5′-концу полученного олигонуклеотида проводили согласно (Маниатис Т. и др. Методы генетической инженерии. Молекулярное клонирование. М.: Мир. 1984. С.402). Для этого 30 пмоль олигонуклеотида в 30 мкл буферного раствора 50 мМ Tris-HCl, pH 7,6, 10 мМ MgCl2, 5 мМ дитиотреит, 30 пмоль [ –32Р]-АТР (уд. акт.3,3 мкКи/пмоль) выдерживали 60 мин с 10-20 ед. акт.полинуклеотидкиназы фага Т4 при 37°С. Реакционную смесь осаждали 10-кратным объемом 2% LiClO4 в ацетоне. Меченый олигонуклеотид выделяли электрофорезом в денатурирующем 20% ПААГ, радиоактивную полосу выявляли радиоавтографией и вырезали из геля. Далее олигонуклеотид переносили электроэлюцией на бумажный фильтр DE-81 (Whatman, Великобритания), откуда смывали нагретым до 56°С раствором 3 М LiClO4 и осаждали 2%-ным раствором LiClO4 в ацетоне. Осадок трижды промывали 200 мкл ацетона, высушивали в вакууме и растворяли в 100 мкл дважды дистиллированной воды. –32Р]-АТР (уд. акт.3,3 мкКи/пмоль) выдерживали 60 мин с 10-20 ед. акт.полинуклеотидкиназы фага Т4 при 37°С. Реакционную смесь осаждали 10-кратным объемом 2% LiClO4 в ацетоне. Меченый олигонуклеотид выделяли электрофорезом в денатурирующем 20% ПААГ, радиоактивную полосу выявляли радиоавтографией и вырезали из геля. Далее олигонуклеотид переносили электроэлюцией на бумажный фильтр DE-81 (Whatman, Великобритания), откуда смывали нагретым до 56°С раствором 3 М LiClO4 и осаждали 2%-ным раствором LiClO4 в ацетоне. Осадок трижды промывали 200 мкл ацетона, высушивали в вакууме и растворяли в 100 мкл дважды дистиллированной воды.
Реакцию в испытуемом образце (4 мкл) инициировали добавлением раствора фермента к образцу смеси и после инкубации в течение 10 мин при 25°С реакцию останавливали добавлением 4 мкл раствора, содержащего 7 М мочевину, 0,1% бромфеноловый синий и 0,1% ксиленцианол.
Активность фермента 8-оксогуанин-ДНК-гликозилазы hOggl количественно оценивали путем анализа продуктов реакции электрофорезом в 20%-ном полиакриламидном геле, содержащем 7 М мочевину. Аликвоты 4 мкл наносили в карманы геля и разделяют при напряжении 50 В/см.
Проводили автографирование геля на рентгеновскую пленку Agfa СР-BU New (Agfa-Geveart, Бельгия) в течение 10-20 ч при температуре -10°С. Степень расщепления субстрата определяли, обрабатывая радиоавтограф, предварительно переведенный в цифровую форму, в программном пакете Gel-Pro Analyzer 4.0 (Media Cybernetics, США). Величину степени расщепления рассчитывали как отношение площади пика, соответствующего продукту реакции, к сумме площадей пика продукта и пика исходного олигонуклеотида.
Значение 1С50 представляет собой концентрацию испытуемого соединения, которая вызывает 50% снижение активности фермента 8-оксогуанин-ДНК-гликозилазы hOggl. Полученные данные приведены на фиг.2. Значение IC50 равно 12,5 мкМ.
Из фиг.2 видно, что описываемое соединение оказывает выраженное ингибирующее действие на фермент 8-оксогуанин-ДНК-гликозилазу hOggl при микромолярных концентрациях.
Таким образом, предлагаемое соединение оказывает специфическое ингибирующее действие на фермент 8-оксогуанин-ДНК-гликозилазу человека (hOggl) и, являясь более дешевым и доступным соединением, расширяет арсенал специфических ингибиторов данного фермента и может с успехом применяться в медицине.
Формула изобретения
Средство для ингибирования фермента 8-оксогуанин-ДНК-гликозилазы человека, представляющее собой 6-амино-4-хлоропиразоло[3,4-d] пиримидин общей формулы:

РИСУНКИ
|
|