|
|
(21), (22) Заявка: 2008128523/13, 15.07.2008
(24) Дата начала отсчета срока действия патента:
15.07.2008
(46) Опубликовано: 27.01.2010
(56) Список документов, цитированных в отчете о
поиске:
AZZI A. “The use of acetylated fericytochrome с for the detection of superoxide radicals produced in biological membranes” Biochem. Biophys. Res. Commun. 1975, v.22, p.597-603. FORMAN H.J. “Superoxide dismutase: a comparison of rate constants” Arch Biochem Biophys. 1973, v.158, p.396-400. THOMSON L. “Kinetics of cytochrome c2+ oxidation byperoxynitrite: implications for superoxide measurements in nitric oxide-producing biological systems” Arch Biochem Biophys. 1995, v.319,  2, p.396-400. МЯТЛЕВА О. В. Влияние меди на строение и функционирование метанолоксидазной системы у облигатного метилотрофа Methylobacillus flagellatum КТ, “Ломоносов-1999”, 20-24 апреля 1999, с.44. 2, p.396-400. МЯТЛЕВА О. В. Влияние меди на строение и функционирование метанолоксидазной системы у облигатного метилотрофа Methylobacillus flagellatum КТ, “Ломоносов-1999”, 20-24 апреля 1999, с.44.
Адрес для переписки:
117997, Москва, ГСП-7, В-437, ул. Миклухо-Маклая, 16/10, ИБХ РАН, патентный отдел
|
(72) Автор(ы):
Черткова Рита Валерьевна (RU),
Пепелина Татьяна Юрьевна (RU),
Долгих Дмитрий Александрович (RU),
Виноградов Андрей Дмитриевич (RU),
Гривенникова Вера Георгиевна (RU),
Кирпичников Михаил Петрович (RU)
(73) Патентообладатель(и):
Учреждение Российской академии наук Институт биологической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ СКОРОСТИ ГЕНЕРАЦИИ СУПЕРОКСИДА
(57) Реферат:
Изобретение относится к биотехнологии, в частности к способу определения скорости генерации супероксида. Способ может быть использован для количественного определения супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с – редуктазной и цитохром с – оксидазной активностью. Кроме того, возможно его использование в медицинской биохимии для исследования роли супероксида в патогенезе нейродегенеративных заболеваний. Способ включает приготовление среды измерения, смешивание источника супероксида со средой измерения, добавление в полученную смесь субстрата окисления и мутантного цитохрома с К27Е/Е69К/К72Е/К86Е/К87Е/Е90К или К8Е/Е62К/Е69К7К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К. Спектрофотометрически проводят измерение скорости восстановления производного цитохрома с и определяют скорость генерации супероксида. Способ является более простым в сравнении с известными аналогами и позволяет определить скорость генерации супероксида с повышенной точностью. 1 табл., 4 ил.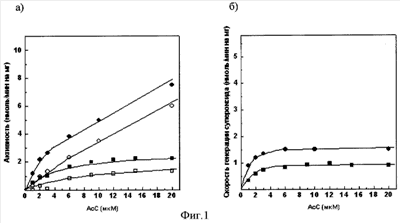
Изобретение относится к области биохимии, молекулярной биологии и биотехнологии. Может быть использовано для измерения скорости генерации супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с – редуктазной и цитохром с – оксидазной активностью, а также в медицинской биохимии для исследования роли супероксида в патогенезе нейродегенеративных заболеваний.
Цитохром с – небольшой белок с железопорфириновой группой, ковалентно присоединенной к единственной полипептидной цепи. У эукариот цитохром с локализован на поверхности внутренней мембраны митохондрий, обращенной в межмембранное пространство. Основная его функция – участие в переносе электронов от убихинол: цитохром с – оксид оредуктазы (комплекс III) на цитохром с – оксидазу (комплекс IV) дыхательной цепи. Кроме того, известна его способность окислять супероксид 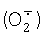 . Мутантные варианты цитохрома с, лишенные дыхательной функции, но сохранившие способность окислять . Мутантные варианты цитохрома с, лишенные дыхательной функции, но сохранившие способность окислять 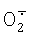 , являются потенциальной основой для создания тест-систем определения супероксида. , являются потенциальной основой для создания тест-систем определения супероксида.
2O2), гидроксил-радикал 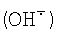 ). Для локализации мест генерации супероксида в клетках необходим точный метод его количественного определения. ). Для локализации мест генерации супероксида в клетках необходим точный метод его количественного определения.
+ вызывают частичное разобщение дыхательной цепи, что ведет к снижению истинной генерации супероксида. Перечисленные недостатки АсС приводят к низкой точности измерения генерации супероксида при использовании АсС: побочные реакции взаимодействия АсС с окислительно-восстановительными партнерами составляют 60-80%, при измерении в среде с фосфатом калия значения скорости генерации супероксида занижены в 2 раза.
Изобретение решает задачу упрощения и повышения точности способа определения скорости генерации супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с – редуктазной и цитохром с – оксидазной активностью, в отсутствие высоких концентраций солей, т.е в условиях, близких к нативным.
Поставленная задача достигается за счет способа определения скорости генерации супероксида, включающего приготовление среды измерения, смешивание источника супероксида со средой измерения, добавление в полученную смесь субстрата окисления и производного цитохрома с с последующим спектрофотометрическим измерением скорости восстановления производного цитохрома с и определением скорости генерации супероксида, состоящего в том, что в качестве производного цитохрома с используют мутантный цитохром с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.
Технический результат заявленного способа заключается в упрощении и повышении точности способа определения скорости генерации супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с – редуктазной и цитохром с – оксидазной активностью, в отсутствии высоких концентраций солей, т.е в условиях, близких к нативным.
Рекомбинантный мутантный цитохром с лошади получают путем конструирования мутантного гена цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62КУЕ69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К с аминокислотными заменами в сайте взаимодействия с окислительно-восстановительными партнерами дыхательной цепи: убихинол: цитохром с – оксидоредуктазой (комплекс III) и цитохром с – оксидазой (комплекс IV). За счет замены положительно заряженных остатков лизина (К), окружающих гемовую впадину цитохрома с дикого типа, на отрицательные остатки глутаминовой кислоты (Е) достигается снижение способности к окислительно-восстановительным реакциям с комплексом III и комплексом IV. Используется подход направленного изменения поверхностных зарядов цитохрома с с целью «перемещения» сайта связывания от гемовой впадины к периферии. Для сохранения суммарного положительного заряда белка вне сайта взаимодействия вводятся обратные замены (Е К). К).
Плазмидная ДНК pBPCYCS/3 содержит мутантный ген цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К, встроенный между сайтами рестрикции Xho I и ВаmН. I, кодирующий синтез мутантного рекомбинантного белка цитохрома с К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К, промоторы lac и trc перед геном цитохрома с, ген blа, обеспечивающий синтез  -лактамазы (устойчивость к ампициллину), ген дрожжевой гем-лигазы (CYC3), кодирующий фермент, осуществляющий лигирование рекомбинантного цитохрома с с гемом бактериальных клеток. -лактамазы (устойчивость к ампициллину), ген дрожжевой гем-лигазы (CYC3), кодирующий фермент, осуществляющий лигирование рекомбинантного цитохрома с с гемом бактериальных клеток.
Плазмидной ДНК pBPCYCS/3, содержащей мутантный ген цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К, трансформируют клетки бактерий Escherichia coli штамма JM-109. Проводят экспрессию целевого белка в бактериальных клетках, его выделение и очистку помощью хроматографичеких методов (ионообменной хроматографии на MonoS и адсорбционной хроматографии на гидроксиапатите).
Скорость генерации супероксида измеряют по чувствительному к супероксиддисмутазе восстановлению мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К7Е69К/К72Е/К86Е/К87Е/Е90К, обладающего сниженной способностью к окислительно-восстановительным реакциям с компонентами дыхательной цепи. Эксперименты по подбору концентраций цитохрома с показали, что оптимальной для измерения скорости генерации супероксида является концентрация 20 мкМ как для АсС, так и для мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.
Измеряют сукцинат: цитохром с – редуктазную активность сопряженных СМЧ сердца быка при окислении сукцината калия спектофотометрически при 550 нм по восстановлению АсС или мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К7К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К. Чувствительная к супероксиддисмутазе скорость восстановления цитохрома с (СОД-чувствительная фракция сукцинат: цитохром с – редуктазной активности) соответствует скорости генерации супероксида комплексом I в реакции обратного переноса электронов при окислении сукцината калия. Нечувствительная к супероксиддисмутазе скорость восстановления цитохрома с (СОД – нечувствительная фракция сукцинат: цитохром с – редуктазной активности) соответствует скорости восстановления цитохрома с от комплекса III (убихинол: цитохром с – оксидоредуктазы) дыхательной цепи, находящегося на обрывках митохондриальных мембран, присутствующих в препарате СМЧ.
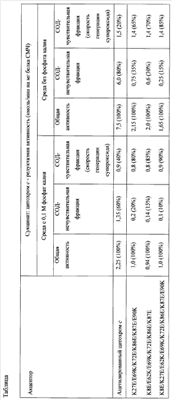
Вклад СОД-нечувствителыюй составляющей сукцинат: цитохром с – редуктазной активности в среде с фосфатом калия при применении 20 мкМ АсС составляет 60%, при применении 20 мкМ мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К составляет 20%, при применении 20 мкМ мутантного цитохрома с К8Е/Е62К/Е69КУК72Е/К86Е/К87Е – 15%, при применении 20 мкМ мутантного цитохрома с К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К – 10%. Вклад СОД-нечувствительной составляющей сукцинат: цитохром с – редуктазной активности при использовании АсС в среде без фосфата резко повышается до 80%, в случае мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К этот вклад составляет 35%, в случае мутантного цитохрома с К8Е/Е62К/Е69КУК72Е/К86Е/К87Е – 30%. При использовании мутантного варианта цитохрома с К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К для количественного определения скорости генерации супероксида в СМЧ в среде, не содержащей фосфат, вклад СОД-нечувствительной составляющей сукцинат: цитохром с – редуктазной активности значительно снижен (15%), при этом выявляется более 80% активности Комплекса I в реакции генерации супероксида (таблица).
Таким образом, при применении способа, основанного на восстановлении мутантного цитохрома с лошади, точность измерения скорости генерации супероксида в митохондриальных препаратах (в частности, СМЧ) в 4 раза выше по сравнению с применением способа, основанного на восстановлении АсС. Возможность проведения измерений в среде без фосфата калия обеспечивает упрощение способа измерения скорости генерации супероксида.
Изобретение иллюстрируют чертежи:
Фиг.1а). Зависимость сукцинат: цитохром с – редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия от концентрации добавленного ацетилированного цитохрома с
 – без фосфата калия, в отсутствии СОД, о – в присутствии СОД, – без фосфата калия, в отсутствии СОД, о – в присутствии СОД, – с фосфатом калия, – с фосфатом калия,  – с фосфатом калия, в присутствии СОД. – с фосфатом калия, в присутствии СОД.
Фиг.1б). СОД – чувствительная сукцинат: цитохром с – редуктазная активность (скорость генерации супероксида), измеренная с помощью ацетилированного цитохрома с
 – без фосфата калия, – без фосфата калия,  – с фосфатом калия. – с фосфатом калия.
Фиг.2а. Зависимость сукцинат: цитохром с – редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия от концентрации добавленного мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К
 – без фосфата калия, в отсутствии СОД, о – в присутствии СОД, – без фосфата калия, в отсутствии СОД, о – в присутствии СОД, – с фосфатом калия, – с фосфатом калия,  – с фосфатом калия, в присутствии СОД. – с фосфатом калия, в присутствии СОД.
Фиг.2б). СОД – чувствительная сукцинат: цитохром с – редуктазная активность (скорость генерации супероксида), измеренная с помощью мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К
 – без фосфата калия, – без фосфата калия,  – с фосфатом калия. – с фосфатом калия.
Фиг.3а). Зависимость сукцинат: цитохром с – редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия от концентрации добавленного мутантного цитохрома с лошади К8Е/Е62К/Е69К/К72Е/К86Е/К87Е
 – без фосфата калия, в отсутствии СОД, о – в присутствии СОД, – без фосфата калия, в отсутствии СОД, о – в присутствии СОД, – с фосфатом калия, – с фосфатом калия,  – с фосфатом калия, в присутствии СОД. – с фосфатом калия, в присутствии СОД.
Фиг.3б). СОД-чувствительная сукцинат: цитохром с – редуктазная активность (скорость генерации супероксида), измеренная с помощью мутантного цитохрома с лошади К8Е/Е62К/Е69К/К72Е/К86Е/К87Е
 – без фосфата калия, – без фосфата калия,  – с фосфатом калия. – с фосфатом калия.
Фиг.4а). Зависимость сукцинат: цитохром с – редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия от концентрации добавленного мутантного цитохрома с лошади К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К
 – без фосфата калия, в отсутствии СОД, о – в присутствии СОД, – без фосфата калия, в отсутствии СОД, о – в присутствии СОД,  – с фосфатом калия, – с фосфатом калия,  – с фосфатом калия, в присутствии СОД. – с фосфатом калия, в присутствии СОД.
Фиг.4б). СОД-чувствительная сукцинат: цитохром с – редуктазная активность (скорость генерации супероксида), измеренная с помощью мутантного цитохрома с лошади К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К
 – без фосфата калия, – без фосфата калия,  – с фосфатом калия. – с фосфатом калия.
Изобретение иллюстрируют примеры.
Определение генерации супероксида в СМЧ сердца быка с помощью мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К
1. Получение препарата митохондрий из сердца быка
Все процедуры проводят на холоду (0-4°С).
Сердца только что забитых животных охлаждают, разрезают на небольшие куски, удаляют соединительную ткань и жир и гомогенизируют механическим способом.
Гомогенат (~1 кг) промывают 5 раз тремя литрами среды, содержащей 0,9% КС1, 1 мМ ЭДТА, 5 мМ Tris-HCl (pH 7.8), и отфильтровывают промывные воды через слой плотной ткани (марли). При промывании суспензии pH среды контролируют и поддерживают добавлением небольших количеств раствора 1 М Tris. Затем гомогенат промывают средой выделения, содержащей 0,25 М сахарозы, 15 мМ ЭДТА и 10 мМ Tris-HCl (pH 7.5). К отжатому гомогенату добавляют среду выделения до объема ~ 4 л, продувают 15 мин аргоном и обрабатывают при помощи гомогенизатора «Fisher PowerGen 700» 5 раз по 1 мин со скоростью 4000 об/мин с интервалами в 1 мин при непрерывном продувании суспензии аргоном.
Гомогенат центрифугируют 13 мин при 1600 g (центрифуга «Beckman», ротор JA-10). Супернатант фильтруют, доводят до pH 7.5 раствором 1 М Tris и затем центрифугируют 15 мин при 12000 g (ротор JA-14). Осадок суспендируют в 350 мл среды, содержащей 0,25 М сахарозы и 10 мМ Tris-HCl (pH 7.8) в стеклянном гомогенизаторе Поттера с тефлоновым пестиком и доводят до pH 7.8-7.9 раствором 1 М Tris. Суспензию центрифугируют 10 мин при 17000 g. Осадок представлен двумя фракциями: нижней, более темной («тяжелые» митохондрии) и верхней, светлой, более рыхлой («легкие» митохондрии). «Легкую» фракцию отделяют встряхиванием осадка с добавлением небольших объемов среды, содержащей 0,25 М сахарозу и 10 мМ Tris-HCl (pH 7.5). «Тяжелые» митохондрии суспендируют в 0,25 М сахарозе, замораживают и хранят при -20°С.
2. Получение препарата СМЧ из митохондрии сердца быка
Препарат митохондрии, хранящийся при -20°С, размораживают и разводят раствором 0,25 М сахарозы до концентрации белка 30 мг/мл. После этого суспензию разбавляют бидистиллированной водой, до конечной концентрации 20 мг белка/мл. Затем добавляют нейтрализованный раствор К+-ЭДТА до конечной концентрации 1 мМ. В течение 20 мин суспензию митохондрии деаэрируют, пропуская аргон, чтобы удалить из среды кислород и избежать процессов перекисного окисления липидов мембран в получаемом препарате. pH суспензии доводят до 8.6 при постоянном перемешивании добавлением 1 М NH4OH. С помощью ультразвукового дезинтегратора “Soniprep 150-MSE” препарат митохондрии обрабатывают 5 раз по 30 с с перерывами в 1 мин. Процесс обработки проводят на льду, в непрерывном токе аргона. Неразрушенные митохондрии отделяют с помощью центрифугирования при 26000g в течение 15 мин при 0°С. Осадок отбрасывают, а супернатант фильтруют через плотную ткань и центрифугируют на ультрацентрифуге при 105000g в течение 1 ч при 0°С. Затем супернатант отбрасывают, а полученный осадок суспендируют в 6 мл буфера, содержащего 75 мМ сахарозы, 0,25 М КС1, 2 мМ ЭДТА и 30 мМ Tris-HCl (pH 7.5). Полученную суспензию наносят на колонку 40×3,2 см с сефадексом G-50 (coarse) и пропускают тот же буфер со скоростью 2,0 мл/мин при 25°С (в ходе этой процедуры препарат СМЧ освобождается от белкового ингибитора FoFi-АТРазы). Пропущенные через колонку СМЧ осаждают ультрацентрифугированием при 105000g в течение 1 ч при 18°С и промывают раствором 0,25 М сахарозы с последующим центрифугированием в тех же условиях. Полученный осадок суспендируют в 0,25 М сахарозы, разливают аликвотами в пластиковые пробирки и хранят в жидком азоте.
3. Сопряжение и активация СМЧ
СМЧ (120 мг), суспендированные в 0,25 М сахарозы, разбавляют стандартной средой, содержащей 0,25 М сахарозы, 50 мМ Tris-HCl (pH 8.0) и 0,2 мМ ЭДТА, до концентрации белка 5 мг/мл. При хорошем перемешивании добавляют малонат калия (конечная концентрация 0,5 мМ) и олигомицин в количестве 0,5 мкг/мг белка и инкубируют в течение 30 мин при 30°С. Затем смесь разбавляют в 10 раз стандартной средой, содержащей 1 мМ NADPH, и инкубируют при комнатной температуре в течение 45 мин при энергичном перемешивании. После этого смесь центрифугируют при 30000g и 4°С в течение 1 ч. Супернатант отбрасывают, осадки ополаскивают стандартной средой, содержавшей 0,1 мМ малоната калия, и полученные СМЧ суспендируют в той же среде до концентрации ~10 мг/мл. Препарат разливают на небольшие аликвоты (около 0,2 мл) и хранят в жидком азоте. Перед экспериментом активированные СМЧ размораживают и хранят на льду.
4. Измерение сукцинат: цитохром с – редуктазной активности СМЧ сердца быка в присутствии мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.
СОД-нечувствительную составляющую сукцинат: цитохром с – редуктазной активности (восстановление цитохрома с от комплекса III дыхательной цепи) измеряют в среде, которая содержит 0,25М сахарозы, 50 мМ Tris-HCl (pH 8.0) и 0,2 мМ ЭДТА, СМЧ (концентрация белка 0,1 мг/мл), а также, где указано, 0,1 М фосфат калия, спектрофотометрически при 550 нм по восстановлению АсС (Sigma) или мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К. Генерацию супероксида начинают добавлением субстрата окисления – 5 мМ сукцината калия. Для измерения сукцинат: цитохрома с – редуктазной активности АсС или мутантный цитохром с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К добавляют в концентрации от 1 до 30 мкМ.
СОД-чувствительную составляющую сукцинат: цитохром с – редуктазной активности (генерацию супероксида комплексом I в реакции обратного переноса электронов) измеряют в среде, которая содержит 0,25М сахарозы, 50 мМ Tris-HCl (pH 8.0) и 0,2 мМ ЭДТА, СМЧ (концентрация белка 0,1 мг/мл), а также, где указано, 0,1 М фосфата калия, спектрофотометрически при 550 нм по чувствительному к супероксиддисмутазе (СОД, 3 ед/мл в среде измерения) восстановлению АсС или мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.
Генерацию супероксида начинают добавлением субстрата окисления – 5 мМ сукцината калия. Для измерения сукцинат: цитохрома с – редуктазной активности АсС или мутантный цитохром с К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К добавляют в концентрации от 1 до 30 мкМ.
Показано, что оптимальной для измерения скорости генерации супероксида является концентрация 20 мкМ как для АсС, так и для мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К (фиг.1 -4.).
При измерении сукцинат: цитохром с – редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия с помощью 20 мкМ АсС в среде, содержащей 0,1 М фосфат калия, СОД-чувствительная активность (скорость генерации супероксида) составляет 0,9 нмоль/мин на 1 мг белка СМЧ, в среде без фосфата – 1,5 нмоль/мин на 1 мг белка СМЧ (фиг.1.).
При измерении сукцинат: цитохром с – редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия с помощью 20 мкМ мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К в среде, содержащей фосфат калия, СОД-чувствительная активность (скорость генерации супероксида) составляет 0,8 нмоль/мин на 1 мг белка СМЧ, в среде без фосфата – 1,4 нмоль/мин на 1 мг белка СМЧ (фиг.2.).
При измерении сукцинат: цитохром с – редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия с помощью 20 мкМ мутантного цитохрома с лошади К8Е/Е62К/Е69К/К72Е/К86Е/К87Е в среде, содержащей фосфат калия, СОД-чувствительная активность (скорость генерации супероксида) составляет 0,8 нмоль/мин на 1 мг белка СМЧ, в среде без фосфата – 1,4 нмоль/мин на 1 мг белка СМЧ (фиг.3.).
При измерении сукцинат: цитохром с – редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия с помощью 20 мкМ мутантного цитохрома с лошади К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К в среде, содержащей фосфат калия, СОД-чувствительная активность (скорость генерации супероксида) составляет 0,9 нмоль/мин на 1 мг белка СМЧ, в среде без фосфата – 1,4 нмоль/мин на 1 мг белка СМЧ (фиг.4.).
Формула изобретения
Способ определения скорости генерации супероксида, включающий приготовление среды измерения, смешивание источника супероксида со средой измерения, добавление в полученную смесь субстрата окисления и производного цитохрома с последующим спектрофотометрическим измерением скорости восстановления производного цитохрома с и определением скорости генерации супероксида, отличающийся тем, что в качестве производного цитохрома с используют мутантный цитохром с К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.
РИСУНКИ
|
|