|
|
(21), (22) Заявка: 2006126784/15, 22.12.2004
(24) Дата начала отсчета срока действия патента:
22.12.2004
(30) Конвенционный приоритет:
23.12.2003 SI P-200300318
(43) Дата публикации заявки: 27.01.2008
(46) Опубликовано: 27.01.2010
(56) Список документов, цитированных в отчете о
поиске:
Vuillard L et. al. “Interactions of non-detergent sulfobetaines with early folding intermediates facilitate in vitro protein renaturation.”, Eur J Biochem. 1998 Aug 15; 256(1):128-35. EP 0674524 A1, 04.10.1995. US 5500416 A, 19.03.1996. WO 9725404 A, 17.07.1997. US 4470919, 11.09.1984. WO 9952550 A, 21.10.1999. RU 2152984 C2, 20.07.2000.
(85) Дата перевода заявки PCT на национальную фазу:
24.07.2006
(86) Заявка PCT:
SI 2004/000043 20041222
(87) Публикация PCT:
WO 2005/060989 20050707
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, “ЕВРОМАРКПАТ”, пат.пов. И.А.Веселицкой, рег.  11 11
|
(72) Автор(ы):
МЕНАРТ Виктор (SI),
ГАБЕРЦ-ПОРЕКАР Владка (SI),
ПОДОБНИК Барбара (SI)
(73) Патентообладатель(и):
ЛЕК ФАРМАСЬЮТИКЛЗ Д.Д. (SI)
|
(54) ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ДЕЙСТВУЮЩЕЕ НАЧАЛО И СУЛЬФОБЕТАИН
(57) Реферат:
Изобретение относится к фармакологии и представляет собой фармацевтическую композицию, включающую терапевтически эффективный белок и недетергентный сульфобетаин (NDSB), где NDSB выбирают из группы, включающей диметилэтил-(3-сульфопропил) аммониевой соли, 3-(1-пиридино)-1-пропансульфоната, пропансульфоната диметилбензиламмония, диметил-трет-бутил-(3-сульфопропил) аммониевой соли, 3-(1-метилпиперидин)-1-пропансульфоната и диметил-(2-гидроксиэтил)-(сульфопропил) аммониевой соли. Изобретение обеспечивает получение стабилизированных фармацевтических композиций. 4 н. и 4 з.п. ф-лы, 3 табл., 2 ил.
Область техники, к которой относится изобретение
Изобретение относится к фармацевтической композиции, которая содержит недетергентный сульфобетаин (NDSB).
Уровень техники
Фармацевтические композиции, содержащие действующие фармацевтические ингредиенты, хорошо известны. Описанные обычные фармацевтические композиции включают различные фармацевтически приемлемые эксципиенты, которые из-за различных присущих им свойств (например, стабилизации действующего фармацевтического ингредиента, подведения и/или регулирования значения рН, влияния на растворимость действующего фармацевтического ингредиента, поддержания изотоничности фармацевтической композиции и т.д.) делают возможным применение действующих фармацевтических ингредиентов в фармацевтических композициях. Фармацевтически приемлемые эксципиенты подробно описаны в кн.: Ainley Wade и Paul J.Weller «Handbook of Pharmaceutical Excipients», изд-во American Pharmaceutical Association, 1994.
Терапевтически действующие белки также были описаны в качестве действующих фармацевтических ингредиентов в фармацевтических композициях. Эти фармацевтические композиции также содержат различные фармацевтические эксципиенты, которые благодаря своим свойствам позволяют создавать стабильные фармацевтические композиции, содержащие терапевтически действующие белки. Указанные фармацевтические композиции подробно описаны: см., например, Yu-Chang John Wang and Musetta A.Hanson в J. of Parenteral Science & Technology, 42, 1988, cc.S4-S26; Wong D. и Parasrampuria J. в Biopharm, ноябрь, 1997, cc.52-61.
Стабильные фармацевтические композиции, содержащие белковый гранулоцитарный колониестимулирующий фактор (G-CSF) терапевтического действия, заявлены в ЕР 373679 и описаны в качестве стабилизирующих главным образом G-CSF в растворе с низкой проводимостью и кислым значением рН в диапазоне 2,75-4,0. Для повышения стабильности добавлялись различные сахара, аминокислоты, полимеры и детергенты. В частности, подчеркивается, что значение рН содержащей G-CSF композиции должно быть менее 4 для того, чтобы уменьшить образование агрегатов и таким образом повысить стабильность. Образование агрегатов и сниженная стабильность при значении рН, превышающем 4,0, находятся в соответствии с имеющимися литературными данными (Kuzniar и др., Pharm Dev Technol 6, 2001, cc.441-447; Bartkowski и др., J Protein Chem 21, 2002, cc. 137-143; Narhi и др., J Protein Chem 10, cc.359-367; Wang W., Int J Pharmaceut 185, 1999, cc.129-188. Стабильность G-CSF, описанная в других фармацевтических композициях в патентах и научной литературе, достигалась добавлением различных стабилизаторов, например, сульфатных ионов (ЕР 1129720), смеси различных консервантов, аминокислот и поверхностно-активных соединений (ЕР 607156), различных буферных систем (фосфата, цитрата, аргинина, ацетата) в присутствии поверхностно-активного соединения (ЕР 674525), высокомолекулярных соединений, например, гидроксипропилцеллюлозы, полиэтиленгликоля, поливинилового спирта, поливинилпирролидона и других (GB 2193621), поверхностно-активного соединения (ЕР 1060746), различных буферных систем (TRIS, HEPES, TRICINE) (EP 0988861), сахаров, например, целлобиозы, гентиобиозы, изомальтозы, рафинозы, трегалозы и других (ЕР 0674524), и одной или нескольких аминокислот (ЕР 1197221, WO 51629, ЕР 1260230 и ЕР 1329224, ЕР 0975335). Хотя низкая ионная сила является предпочтительной в содержащих G-CSF фармацевтических композициях, описывается, что в большинстве случаев для стабилизации G-CSF применяются различные поверхностно-активные соединения и другие стабилизаторы. Кроме того, для поддержания рН в большинстве случаев дополнительно применяются различные буферные системы.
В литературе было описано применение недетергентных сульфобетаинов (NDSB) в качестве сорастворителей (применяемых в высоких концентрациях, примерно в виде 1-молярного раствора) при белковых ренатурациях (Chong Y. и Chen Н. в Biotechiques 29, 2000, cc.1166-1167; Vuillard L. и др., Biochem. J. 305, 1995, cc.337-343; Vuillard L. и др. Electrophoresis 16, 1995, cc.295-297; Vuillard L. и др., Eur. J. Biochem. 256, 1998, cc.128-135; Goldberg M. E. и др., Folding & Design 1, 1995, cc.21-27.
В настоящее время существует потребность получать стабилизированные фармацевтические композиции. Описание NDSB в составе фармацевтических композиций не было найдено ни в научной, ни в патентной литературе.
Подписи к фигурам
Фиг.1. Результат SE-HPLC образцов изобретения и контрольного образца, хранимых при 40°С (±2°С) в течение 1 месяца (40).
Фиг.2. Результат SE-HPLC образцов изобретения, хранимых при 40°С (±2°С) в течение 1 месяца (40).
Описание изобретения
В контексте настоящего изобретения было обнаружено, что NDSB может применяться в качестве эксципиента в составе фармацевтической композиции. При применении NDSB могут быть получены стабилизированные фармацевтические композиции.
Таким образом, настоящее изобретение относится к фармацевтической композиции, содержащей NDSB.
Согласно первой задаче, решаемой в настоящем изобретения, предусмотрена фармацевтическая композиция, которая включает действующий фармацевтический ингредиент и недетергентный сульфобетаин (NDSB).
Действующий фармацевтический ингредиент настоящего изобретения выбран из группы, состоящей из терапевтически эффективных синтетических или природных органических молекул (например, слабо растворимых в воде синтетических и природных органических молекул), и терапевтически действующего белка (например, слабо растворимого в воде и/или гидрофобного белка), и/или других действующих фармацевтических ингредиентов, обладающих терапевтическим действием. Действующий фармацевтический ингредиент, предпочтительно, содержится в терапевтически эффективном количестве. Понятие «терапевтически эффективное количество действующего фармацевтического ингредиента», применяемое в настоящем изобретении, обозначает действующий фармацевтический ингредиент в количестве, обладающем терапевтическим эффектом.
Фармацевтическая композиция настоящего изобретения включает недетергентный сульфобетаин (NDSB).
Понятие «недетергентный сульфобетаин», применяемое в настоящем изобретении, относится к сульфобетаину, который не образует мицелл в водном растворе.
В предпочтительном варианте осуществления фармацевтической композиции настоящего изобретения NDSB является четвертичной солью аммония, в которой группы R1, R2, R3 и R4-SO3 – связаны с центральным атомом азота и где: – связаны с центральным атомом азота и где:
R1 обозначает метил, этил, пропил, бутил, пентил, гексил или их производные;
R2 обозначает метил, этил, пропил, бутил, пентил, гексил или их производные;
R3 обозначает метил, этил, пропил, бутил, пентил, гексил или их производные, и все комбинации R1, R2 и R3 и R4 могут быть представлены в виде (СН2)n, где n=1-6; наиболее предпочтительно, n=3.
Четвертичный атом азота может быть также частью алифатической или ароматической циклической структуры.
Таким образом, в предпочтительном варианте осуществления фармацевтической композиции настоящего изобретения NDSB является солью четвертичного аммония формулы 1,
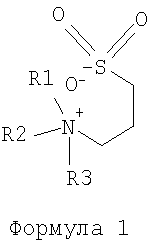
где R1, R2 и R3 могут быть одинаковыми и/или различными, выбранными из группы, состоящей из метила, этила, пропила, бутила, пентила, гексила или их производных, и R4 может быть представлен в виде (CH2)n, где n=1-6, наиболее предпочтительно, n=3.
Предпочтительно, в фармацевтической композиции настоящего изобретения применяется NDSB, который выбран из группы, включающей диметилэтил(3-сульфопропил)аммониевую соль (SB 195, Vuillard и др., FEBS Letters, 353, 1994, cc.294-296; Goldberg и др., Folding & Design, 1, 1995/1996, cc.21-27, 3-(1-пиридино)-1-пропансульфоната (SB201), пропансульфонат диметилбензиламмония (SB256), диметил-трет-бутил(3-сульфопропил)аммониевую соль (SB222t), 3-(1-метилпиперидин)-1-пропансульфонат (SB221) и диметил(2-гидроксиэтил)-(сульфопропил)аммониевую соль (SB211; Vuillard и др., Anal Biochem, 230, 1995, cc.290-294). Два или более указанных соединения NDSB могут также применяться во всех возможных комбинациях. Предпочтительно применяются диметил-трет-бутил-(3-сульфопропил)аммониевая соль (SB222t), диметилэтил-(3-сульфопропил)аммониевая соль (SB 195) и 3-(1-метилпиперидин)-1-пропансульфонат (SB221). Наиболее предпочтительно применяется диметил-трет-бутил-(3-сульфопропил)аммониевая соль (SB222t).
Концентрация NDSB применяется в зависимости от значения рН, которое подводится и/или поддерживается. Она выбирается в пределах от 1 до 1000 ммолей, предпочтительно, от 5 до 100 ммолей. Значение рН фармацевтической композиции настоящего изобретения может быть в диапазоне от 2 до 9, предпочтительно от 3 до 8, наиболее предпочтительно от 3,5 до 7,5.
Согласно второй задаче настоящего изобретения была предусмотрена фармацевтическая композиция, которая включает терапевтически эффективный белок и недетергентный сульфобетаин (NDSB).
Понятие «терапевтически эффективный белок», применяемое в настоящем изобретении, означает белок с терапевтическим действием. Терапевтически эффективный белок, применяемый в фармацевтической композиции настоящего изобретения, выбран из группы, состоящей из гранулоцитарного колониестимулирующего фактора (G-CSF), интерферонов (IFN); например, IFN-альфа 2а, IFN-альфа 2b, IFN-бета, IFN-гамма 1b; интерлейкинов (ILs), например, IL-1, IL-2, IL-3, IL-4, IL5 – IL-10; гранулоцитарного макрофагового колониестимулирующего фактора (GM-CSF); макрофагового колониестимулирующего фактора (M-CSF); эпидермального фактора роста (EGF); эритропоэтина (ЕРО); фолликулостимулирующего гормона (FSH); альбумина сыворотки человека (HSA); дезоксирибонуклеазы (ДНКазы); фактора роста фибробластов (aFGF или bFGF); фактора некроза опухоли альфа (TNF-альфа) и фактора некроза опухоли бета (TNF-бета); кальцитонина; гематопротеина; плазминогенных активаторов и их предшественников (t-PA, урокиназы, проурокиназы, стрептокиназы, белка С); цитокинов; семейства TNF-лигандов (TRAIL, Fasl, остеопротогерина); растворимых рецепторов (р55, р75), гормона роста, например, гормона роста человека, бычьего гормона роста и паратироидного гормона; липопротеинов; альфа-1-антитрипсина; инсулина, проинсулина, субъединицы А инсулина, субъединицы В инсулина; глюкагонов; факторов свертывания крови, например, фактора VIII, фактора IX, тканевого фактора, фактора Виллебрандта; бомбазина; тромбина; энкефалиназы; макрофагового воспалительного белка (MIP-1 альфа); субъединицы А релаксина, субъединицы В релаксина, прорелаксина; ингибина; активина; сосудистого эндотелиального фактора роста (VEGF); гормональных рецепторов или рецепторов фактора роста; интегринов; белка А, белка D; ревматоидных факторов; нейротрофического фактора, формирующегося в кости (BDNF), нейротропина-3, -4, -5 или -6; фактора роста нервов (NGF); фактора роста, полученного из тромбоцитов (PDGF); фактора роста фибробластов (aFGF и bFGF); фактора роста Т-клеток (TGF-альфа и TGF-бета); инсулиноподобного фактора роста (IGF1 и IGF2); тромбопоэтина (ТРО); белка, участвующего в остеогенезе (BMP); супероксиддисмутазы; биологически активных фрагментов вышеуказанных белков и других терапевтически эффективных белков.
Терапевтически эффективные белки настоящего изобретения применяются в терапевтически эффективных количествах.
Понятие «терапевтически эффективное количество белка» в контексте настоящего изобретения относится к количеству белка, обладающему терапевтическим действием.
Наиболее предпочтительным действующим фармацевтическим ингредиентом является G-CSF, предпочтительно применяемый в терапевтически эффективных количествах.
В контексте настоящего изобретения предусмотрена фармацевтическая композиция, которая включает G-CSF и недетергентный сульфобетаин (NDSB).
Понятие «G-CSF» в контексте настоящего изобретения означает белок, который регулирует дифференциацию и пролиферацию гематопоэтических клеток у млекопитающих, а также активацию зрелых клеток гематопоэтической системы. Он выбран из группы G-CSF человека и его производных и аналогов, приведенных ниже. Предпочтительно G-CSF относится к рекомбинантному G-CSF человека, продуцируемому в результате экспрессии в бактерии E.coli.
Фармацевтическая композиция настоящего изобретения может применяться для всех типов G-CSF; она может также применяться наряду с другими в случае выделения модифицированных форм G-CSF, а именно: метионил-G-CSF (Met-G-CSF), гликолизированного, ферментативно и химически модифицированного (например, пегилированного) G-CSF, аналогов G-CSF и гибридных белков, которые содержат G-CSF.
Понятие «терапевтически эффективное количество G-CSF» в контексте настоящего изобретения относится к количеству G-CSF, необходимому для терапевтического действия G-CSF.
Фармацевтическая композиция настоящего изобретения необязательно может также включать полиол.
Понятие «полиол» в контексте настоящего изобретения относится к какому-либо высокомолекулярному спирту, т.е. химическому соединению, содержащему одну или более гидроксильных групп в составе молекулы.
Предпочтительно, полиол выбран из группы, включающей сорбит, глицерин, инозит, трегалозу и маннит.Предпочтительная концентрация полиола находится в пределах 1-10% (мас./об.).
Фармацевтическая композиция настоящего изобретения может также необязательно содержать один или несколько фармацевтически приемлемых наполнителей.
Фармацевтически приемлемый эксципиен выбран из группы, состоящей из поглотителей катионов металлов (например, EDTA и аналогичных хелатирующих агентов), растворителей и поглотителей свободных радикалов (например, ДМСО), различных кислот (например, уксусной кислоты, лимонной, метансульфоновой, фосфорной, соляной и других), различных оснований (например, NaOH или органических азотсодержащих оснований, например, буферов Гуда, например, TRIS, TES, HEPES), различных буферных систем (например, уксусная кислота/ацетат, глутаминовая кислота/глутамат, малеиновая кислота/малеат, лимонная кислота/цитрат, фосфорная кислота/фосфат и других), различных фармацевтически приемлемых наполнителей для поддержания изотоничности раствора (например, неорганических солей, например, CaCl2 и NaCl), белковых стабилизаторов, выбранных из группы поверхностно-активных веществ, например сложных эфиров гликоля и глицерина, сложных и простых эфиров макроголя, производных сорбитана или полисорбатов (полисорбат 20, полисорбат 80), аминокислот, полоксамеров (Pluronic F68), поливинилпирролидона (PVP) и других. Предпочтительно, фармацевтически приемлемый наполнитель выбран из группы EDTA и ДМСО.
NDSB в фармацевтических композициях настоящего изобретения может объединяться с одним или несколькими из перечисленных выше фармацевтически приемлемых эксципиентов.
Понятие «стабилизатор» в контексте настоящего изобретения относится к фармацевтически приемлемому эксципиенту, который может стабилизировать действующий фармацевтический ингредиент (например, белок, например, G-CSF).
Понятие «белковый стабилизатор» в контексте настоящего изобретения относится к фармацевтически приемлемому наполнителю, который может стабилизировать белок (например, G-CSF).
Понятие «стабильность белка» (например, G-CSF) в контексте настоящего изобретения относится к поддержанию содержания белка (например, G-CSF), a также к поддержанию биологической активности белка (например, G-CSF). На снижение стабильности белка (например, G-CSF) могут влиять наряду с прочими следующие процессы: адсорбция белка стенками контейнера, денатурация или разложение белка, а также образование агрегатов, например, белковых димеров (например, димеров G-CSF) и/или белковых мультимеров (например, мультимеров G-CSF) и/или аналогичных молекул с более высокой молекулярной массой. Указанные процессы могут быть результатом различных факторов, например, повышенной температуры, неподходящих контейнеров, применения неподходящих белковых стабилизаторов, нахождения на свету, замораживания/оттаивания, неподходящих способов получения и/или неподходящего хранения.
Фармацевтическая композиция настоящего изобретения может стабилизировать белок (например, G-CSF) при температуре выше температуры холодильной камеры (2-8°С), а также при комнатной температуре (т.е. ниже 25°С) и даже при более высокой температуре (например, примерно равной 40°С).
Фармацевтическая композиция настоящего изобретения может содержать только один фармацевтически приемлемый эксципиент, т.е. NDSB, для стабилизации белка (например, G-CSF) и для поддержания подходящего значения рН раствора.
Таким образом, еще одно свойство фармацевтической композиции, предусмотренной в настоящем изобретении, заключается в том, что она включает действующий фармацевтический ингредиент (согласно отмеченному выше) и NDSB в качестве единственного дополнительного эксципиента.
NDSB в фармацевтической композиции представляет защитную молекулу, которая стабилизирует белок и таким образом является белковым стабилизатором, который применяется в других фармацевтических композициях (например, сахарах, аминокислотах и других), а также молекулу, которая подводит подходящее значение рН раствора и таким образом применяется вместо кислот (например, уксусной кислоты, лимонной, метансульфоновой, фосфорной, соляной и других), которые применяются для подведения подходящего значения рН раствора в других фармацевтических композициях. Соединения NDSB также могут поддерживать подходящее значение рН и таким образом заменять различные буферные системы и/или их комбинации, применяемые в других фармацевтических композициях (например, уксусная кислота/ацетат, глутаминовая кислота/глутамат, малеиновая кислота/малеат, лимонная кислота/цитрат, фосфорная кислота/фосфат и другие). По сравнению с применением двух или более молекул с различными функциями применение одной молекулы с несколькими различными функциями лучше в отношении экономии получения, более низкой цены, а также более легкого и быстрого получения фармацевтической композиции, а также лучше для самого пациента, поскольку это касается потребления меньшего количества дополнительных веществ организмом. Отличительными свойствами NDSB, представляющими дополнительные преимущества, является то, что он является простой молекулой, которая нечувствительна к свету, температуре, различным окисляющим агентам (например, кислороду воздуха), гидролизу, не является химически реактивной молекулой и обладает цвиттерионной природой в широком диапазоне рН, что означает, что механизм взаимодействия в этом диапазоне не изменяется существенно.
Свойством настоящего изобретения является применение NDSB в качестве стабилизатора в фармацевтической композиции.
Свойством настоящего изобретения является применение NDSB в качестве стабилизатора белка в фармацевтической композиции.
Свойством настоящего изобретения является применение NDSB в качестве агента для подведения рН фармацевтической композиции.
Свойством настоящего изобретения является применение NDSB в качестве буферного агента в фармацевтической композиции.
Предпочтительная фармацевтическая композиция настоящего изобретения является жидкой фармацевтической композицией, что, несмотря на это, лимитирует применение соединений NDSB в лиофилизированных фармацевтических содержащих белок композициях в контексте настоящего изобретения.
Фармацевтическая композиция настоящего изобретения делает возможным парентеральное введение подкожно, внутривенно или внутримышечно без изменения состава, разбавления или дополнительного предварительного приготовления, которые могут привести к уменьшению активности действующего фармацевтического ингредиента, например, белка, например, G-CSF, и к дополнительным техническим проблемам во время введения.
Предпочтительно фармацевтическая композиция настоящего изобретения не содержит белков сыворотки человека, с которыми возможна вирусная контаминация. В этом случае снижается возможность появления различных аллергических реакций, которые могут быть результатом введения альбуминов сыворотки человека. Ее получают в изотоническом растворе, который является фармацевтически приемлемым и не вызывает нежелательных эффектов.
В фармацевтической композиции настоящего изобретения терапевтически эффективное количество белка соответствует терапевтически эффективным количествам белка, которые коммерчески доступны. В случае применения G-CSF терапевтически эффективное количество G-CSF выбирают из диапазона от 0,3 мг/мл до 1,2 мг/мл, которые, несмотря на это, не ограничивают настоящее изобретение.
Фармацевтическая композиция настоящего изобретения может применяться в получении медицинских препаратов (для лечения) и для лечения заболеваний, требующих применения терапевтически эффективных белков, перечисленных выше.
Фармацевтическая композиция настоящего изобретения может также применяться для лечения всех тех заболеваний и для получения медицинских препаратов, предназначенных для лечения всех тех заболеваний, для которых показано применение G-CSF. Указанные заболевания и осложнения могут быть выбраны из группы, состоящей из: нейтропении и ее клинического осложнения, уменьшенной возможностью госпитализации при фибрильной нейтропении после химиотерапии, мобилизации кроветворных зародышевых клеток, альтернативной инфузии донорских лейкоцитов, хронической нейтропении, нейтропенической и ненейтропенической инфекции, трансплантации приемных датчиков, хронических воспалительных заболеваний, сепсиса и септического шока, сниженного риска, сниженной заболеваемости, сниженной смертности и сниженного количества суток госпитализации при нейтропенических и ненейтропенических инфекциях, профилактики инфекций и осложнений инфекций у нейтропенических и ненейтропенических пациентов, профилактики внутрибольничных инфекций и снижения смертности и частоты возникновения внутрибольничных инфекций, применения внутрь у новорожденных детей, стимулирования иммунной системы новорожденных, улучшения клинического результата у пациентов в отделении интенсивной терапии и у больных, находящихся в критическом состоянии, вакцинации и обработки ожогов, кожных язв и повреждений, интенсификации химиотерапии и/или радиотерапии, панцитопении, повышения противовоспалительных цитокинов, снижения высоких доз химиотерапевтических интервалов с помощью профилактического использования G-CSF, потенциации противоопухолевых эффектов протодинамической терапии, профилактики и лечения заболеваний, вызванных различными церебральными дисфункциями, лечения тромботических заболеваний и их осложнений и восстановления эритропоэза после облучения.
Объектом настоящего изобретения является применение NDSB для получения фармацевтической композиции.
Фармацевтическая композиция настоящего изобретения может быть заложена в фармацевтическую упаковку, выбранную из группы, состоящей из ампул, инъекционных шприцов и флаконов. Фармацевтическая упаковка делает возможным применение объемов в пределах 0,2-2 мл (на дозу).
Кроме того, объектом настоящего изобретения также является способ получения фармацевтической композиции настоящего изобретения. Способ получения фармацевтической композиции настоящего изобретения предусматривает смешивание NDSB с терапевтически эффективным количеством действующего фармацевтического ингредиента (например, белка, например, G-CSF).
Настоящее изобретение детально иллюстрируется следующими примерами, но не ограничивается ими. В частности, примеры относятся к предпочтительным вариантам осуществления настоящего изобретения.
Примеры
Аналитические методы
Для анализа фармацевтической композиции настоящего изобретения применяют следующие методы: ситовую высокоэффективную жидкостную хроматографию (SE-HPLC), высокоэффективную жидкостную хроматографию с обращенной фазой (RP-HPLC), электрофорез в натрий-додецилсульфат-полиакриламидном геле (SDS-PAGE) и измерение биологической активности in vitro.
SE-HPLC
SE-HPLC применяют для определения концентраций агрегатов G-CSF, в частности, димеров и полимеров. Предел обнаружения для определения димеров и полимеров составляет 0,01%.
Прибор ВЭЖХ содержит: УФ-детектор, оперативный аппарат для дегазации, бинарный модуль насоса и термостатируемый аутосамплер (например, ВЭЖХ-системы фирмы Waters Alliance). Анализ проводят в следующих условиях:
Хроматографические условия:
Колонка: TSK G3000 SW, 10 мкм, 300×7,5 мм внутреннего диаметра
Температура колонки: 30°С
Подвижная фаза: фосфатный буфер рН 7,0 (5 ммоль фосфата натрия, 50 ммоль NaCl)
Скорость потока: 0,8 мл/мин, изократический способ
Обнаружение: УФ-детектор, длина волны 215 нм.
Объем инъекции: 20 мкл (количество инъецируемого белка: 6-12 мкг)
Температура аутосамплера от +2 до +8°С
Время пробега: 20 мин.
RP-HPLC
RP-HPLC применяют для определения содержания G-CSF и количественного определения примесей, которые варьируют в зависимости от степени гидрофобности.
Система HPLC содержит: УФ-детектор, оперативный аппарат для дегазации, бинарный модуль насоса и термостатируемый аутосамплер и термостатируемый отдел колонки (например, ВЭЖХ-системы фирмы Waters Alliance). Анализ проводят в следующих условиях:
Хроматографические условия:
Колонка: YMC-Pack ODS-AQ, 200 ангстрем, сферическая, 3 мкм, 150×4,6 мм внутреннего диаметра
Температура колонки: 65°С
Подвижная фаза: Фаза А: 0,1% трифторуксусная кислота (TFA) и 50% ацетонитрила (ACN) в воде
Фаза В: 0,1% TFA и 95% ACN в воде для ВЭЖХ
Скорость потока: 1,0 мл/мин, градиент:
| Время (мин) |
Подвижная фаза В (%) |
| 0,0 |
8 |
| 4,0 |
8 |
| 19,0 |
28 |
| 19,1 |
100 |
| 21,0 |
100 |
| 21,1 |
8 |
| 25,0 |
8 |
Обнаружение: УФ-детектор, длина волны 215 нм.
Объем инъекции: 10 мкл (количество инъецируемого белка: 3-6 мкг)
Температура аутосамплера +2 – +8°С
Время выхода: 25 минут.
SDS-PAGE
SDS-PAGE применяют для визуального определения присутствия белковых димеров и других агрегированных форм (тримеров и форм с высокой молекулярной массой).
Образцы загрузки получают в буфере загрузки, не содержащей восстанавливающий агент. Вертикальный SDS-PAGE, NuPAGE Bis-Tris 12%-ный гель 8×8 см, толщина 1,0 мм, 15 линий (фирма Invitrogen) в электрофорезном буфере MOPS SDS (фирма Invitrogen).
Электрофорез длится 1 час при постоянном напряжении 200 В. Образцы окрашивают красителем кумасином синим (0,1% Phast Gel Blue R 350 в 30%-ном метаноле).
Тестирование in vitro биологической активности G-CSF
Биологическую активность G-CSF определяют по способу, основанному на стимулировании клеточной пролиферации (клеток NFS-60) с применением известного метода (Hammerling, U. и др. в J Pharm Biomed Anal 13, 1995, cc.9-20) и применением международного стандартного рекомбинантного G-CSF человека (88/502 получен из клеток дрожжей; NIBSC Potters Bar, Hertfordshire, Великобритания; см. Mire-Sluis, A.R. и др. в J Immunol Methods 179, 1995, cc.117-126).
Измерение значений рН
Значение рН измеряют с применением рН-метра МА 5741 (фирма Iskra) и биотриодных электродов (фирма Hamilton). Калибровку рН-метра осуществляют в пределах рН 3,0-5,0 соответствующими свежими калибровочными буферами. Значение рН измеряют при температуре 25°С. Стандартное отклонение измерений рН составляет 0,003 единицы от значения рН (0,3%).
Условия для тестирования стабильности G-CSF в фармацевтических композициях
4°С: хранение в холодильнике при температуре холодильной камеры (в пределах от +4 до +6°С)
40°С: хранение при 40±2°С
25°С: хранение при комнатной температуре от 25 до 30°С в 1 мл наполненного шприца в процессе встряхивания при 75 об/мин в шейкере Vibromix 314EVT.
Пример 1: Тесты на стабильность
Приготовляют следующие жидкие фармацевтические композиции:
FP1 0,3 мг/мл G-CSF, 39 ммоль NDSB, 5 ммоль Na EDTA, рН 4,4
FP2 0,3 мг/мл G-CSF, 39 ммоль NDSB, 5 ммоль Na EDTA, 5%-ный ДМСО, рН 4,4
FP3 0,3 мг/мл G-CSF, 7 ммоль NDSB, 5%-ный сорбит, рН 4,4
FP4 0,6 мг/мл G-CSF, 6 ммоль NDSB, 8%-ный сорбит, рН 4,6
FP5 0,6 мг/мл G-CSF, 13 ммоль NDSB, 8%-ный сорбит, рН 4,3
FP6 0,6 мг/мл G-CSF, 10 ммоль NDSB, 8%-ный сорбит, рН 4,5
FP7 0,6 мг/мл G-CSF, 10 ммоль NDSB, 5%-ный сорбит, рН 4,4
FP8 0,6 мг/мл G-CSF, 10 ммоль NDSB, 10%-ный сорбит, рН 4,4
FP9 0,6 мг/мл G-CSF, 10 ммоль NDSB, 8%-ный инозит, рН 4,4
FP10 0,6 мг/мл G-CSF, 10 ммоль NDSB, 8%-ная трегалоза, рН 4,4
FP11 0,6 мг/мл G-CSF, 50 ммоль NDSB, 8%-ный сорбит, рН 4,9
Базовая фармацевтическая композиция:
A(S16-10ACT): 0,3 мг/мл G-CSF, 10 ммоль уксусной кислоты, 5%-ный (масса/объем) сорбит, 0,004% Tween 80, рН подводят до 4,0 с помощью NaOH (идентичный Neupogen).
Образцы G-CSF в концентрации 0,6 мг/мл хранились при температуре 40°С в течение 1 месяца. Их анализируют с применением SE-HPLC; в колонку загружают 6 мкг G-CSF. Фигура 1 показывает соответствующие результаты (AU = единица абсорбции).
Легенда фигуры 1:
Образцы G-CSF в концентрации 0,6 мг/мл хранят при температуре 40°С в течение 1 месяца. Образцы анализируют с применением SE-HPLC; на колонку наносят 6 мкг G-CSF. Результаты показаны на фиг.2 (AU = единица абсорбции).
Легенда фигуры 2:
Результаты тестов на стабильность
Анализ SE-HPLC образцов FP1 и FP2, хранимых в течение 1 месяца при 40°С, показывает, что образцы стабильны, поскольку нет видимого повышения содержания агрегатов и гидрофобного разложения продуктов (табл.1, фиг.1). Стабильность сравнивают с базовым образцом (AS16-10ACT), который идентичен коммерческой фармацевтической композиции, содержащей G-CSF (фирма Neupogen, G-CSF=0,3 мг/мл). Стабильность также подтверждается анализами RP-HPLC, которые не показывают существенных изменений в примесях или в содержании белка после хранения. Эти результаты согласуются с результатами анализа SDS-PAGE (результаты не представлены) и с измерениями биологической активности in vitro. Биологическая активность in vitro G-CSF, который применялся в исследованиях, находится на уровне международного стандарта (номер в каталоге 88/502, фирма NIBSC, Великобритания). Биологическая активность FP1 и FP2 in vitro не изменяется после хранения в условиях тестирования (результаты не показаны).
| Таблица 1 |
 |
NDSB |
pH |
Эксципиент |
Период хранения |
Температура |
Димеры (SE-HPLC) |
Высшие агрегаты (SE-HPLC) |
| AS 16-10АСТ с=0,3 мг/мл |
– |
4,0 |
Tween80 Сорбит |
1 месяц |
40°С |
0,00% |
0,13% |
| FP1 |
39 ммоль |
4,4 |
EDTA |
1 месяц |
40°С |
0,00% |
0,18% |
| FP2 |
39 ммоль |
4,4 |
EDTA ДМСО |
1 месяц |
40°С |
0,00% |
0,23% |
| FP3 |
7 ммоль |
4,4 |
сорбит |
1 месяц |
40°С |
0,00% |
1,02% |
| %: количество димера/высших агрегатов относительно общего количества G-CSF; с = концентрации G-CSF. |
Результаты показывают, что стабильность фармацевтических композиций, содержащих NDSB, сравнимы с базовым образцом (AS16-10ACT). Более высокие концентрации NDSB показывают преимущественное влияние на стабильность.
SE-HPLC-анализ образцов FP4 – FP11, хранимых при 25°С в течение от 1 недели до 1 месяца, показали, что образцы стабильны, поскольку не наблюдается заметного повышения содержания агрегатов и гидрофобного разложения продуктов, (табл.2, фиг.2). Стабильность сравнима со стабильностью базового образца (AS16-10ACT), который идентичен коммерческой фармацевтической композиции, содержащей G-CSF (продукт Neupogen, G-CSF=0,3 мг/мл). Стабильность также подтверждается анализами RP-HPLC, которые не показывают существенных изменений в примесях или в содержании белка после хранения. Эти результаты согласуются с результатами анализа SDS-PAGE (результаты не представлены) и с измерениями биологической активности in vitro. Биологическая активность in vitro G-CSF, который применялся в исследованиях, находится на уровне международного стандарта (номер в каталоге 88/502, фирма NIBSC, Великобритания). После хранения в условиях исследования биологическая активность in vitro образцов с FP4 по FP11 изменяется (результаты не представлены).
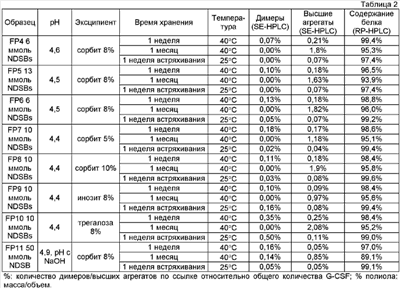
Результаты, представленные в табл.2, показывают, что фармацевтические композиции с добавкой NDSB являются стабильными. Слабое снижение стабильности по сравнению с базовым образцом (табл.1) отмечают в образцах, которые подвергались более экстремальным условиям (1 месяц, 40°С). Возможно, что указанное снижение стабильности происходит в результате того, что значение рН выше 4 не является благоприятным для G-CSF, что также очевидно из литературных данных. Базовый образец получен при значении рН 4,0.
Пример 2
Состав предложенных фармацевтических композиций G-CSF
Составы предложенных фармацевтических композиций представлены в табл.3.
| Таблица 3 |
| Образец |
Содержание G-CSF (мг/мл) |
Неактивные ингредиенты |
рН |
| FP1 |
0,3 |
39 ммоль NDSB, 5 ммоль Na EDTA, 5% ДМСО |
4,4 |
| FP2 |
0,3 |
39 ммоль NDSB, 5 ммоль Na EDTA |
4,4 |
| FP3 |
0,3 |
7 ммоль NDSB, 8%-ный сорбит |
4,4 |
| FP4 |
0,6 |
6 ммоль NDSB, 8%-ный сорбит |
4,6 |
| FP5 |
0,6 |
13 ммоль NDSB, 8%-ный сорбит |
4,3 |
| FP6 |
0,6 |
10 ммоль NDSB, 8%-ный сорбит |
4,5 |
| FP7 |
0,6 |
10 ммоль NDSB, 5%-ный сорбит |
4,4 |
| FP8 |
0,6 |
10 ммоль NDSB, 10%-ный сорбит |
4,4 |
| FP9 |
0,6 |
10 ммоль NDSB, 8%-ный инозит |
4,4 |
| FP10 |
0,6 |
10 ммоль NDSB, 8%-ная трегалоза |
4,4 |
Получение насыпного концентрата
Исходный материал G-CSF для получения насыпного концентрата получают экспрессией в E.coli. Насыпной концентрат получают в растворе с чистой кислотой (уксусная кислота или НС1) при рН 4,4 с применением концентрации G-CSF=1,5 мг/мл. SE-HPLC-анализ этого концентрата показывает, что содержание димеров и высших агрегатов ниже определяемого предела. Содержание примесей, определенное с помощью RP-HPLC-анализа, находится в пределах от 2 до 4%. (RP-HPLC-анализ свежего образца Neupogen показал сравнимое количество примесей).
Качество веществ
NDSB: NDSB-195 (фирма Calbiochem) для анализа, сорбит: качество Европейской фармакопеи; глицерин: фирма Merck; для анализа; инозит: миоинозит (фирма Fluka: >99,5% HPLC), трегалоза (фирма Fluka: >99,5% HPLC), EDTA (фирма Sigma: 99%), ДМСО (фирма Merck: >99,5%), Tween 80 (фирма Sigma, низкий уровень пероксидов, содержит ВНТ в качестве антиоксиданта); вода для инъекций: качество Европейской фармакопеи; вода для анализа: Milli-Q (фирма Millipore).
Получение базовой фармацевтической композиции
A (S16-10ACT): Фракции гель-фильтрации, которые содержат мономер G-CSF, накапливают и замещают буфером, содержащим 10 ммоль уксусной кислоты и 5% сорбита в воде для инъекций. Значение рН буфера подводилось раствором NaOH до 3,96. Замещение проводилось на приборе LabscaleTM TFF System/Millipore с применением трех мембран Ultracel-5 PLCC. Tween 80 добавляют до тех пор, пока не получают концентрацию 0,004%. Значение рН конечного раствора после замещения составляет 4,0 с концентрацией 0,304 мг/мл.
Получение заявляемых фармацевтических композиций:
Основное положение:
Предложенные фармацевтические композиции получают разбавлением насыпного концентрата адекватным стерильным буферным раствором, предварительно профильтрованным через фильтр 0,2 PES/Nalgene. Конечная концентрация G-CSF составляет 0,3 мг/мл и 0,6 мг/мл, соответственно.
Фармацевтические композиции FP1 и FP2 помещают во флаконы объемом 2 мл, изготовленные из бесцветного стекла гидролитического типа 1, промытые, стерилизованные и укупоренные пробками из бромбутилкаучука, снабженными алюминиевыми колпачками.
Другими фармацевтическими композициями (FP3 – FP11) наполняют (вручную) инъекционные шприцы (объем 1,3-1,4 мл) так, чтобы было минимальное количество воздуха вокруг отверстия.
FP1, FP2, FP3: К 1 части насыпного концентрата добавляют 4 части подходящего буферного раствора. Получают конечные концентрации, указанные в табл.3. Значение рН больше не подводят.
FP4 – FP11: К 4 частям насыпного концентрата добавляют 6 частей раствора с подходящим буфером. Получают конечные концентрации, указанные в табл.3. Значение рН больше не подводят.
Формула изобретения
1. Стабильная фармацевтическая композиция, которая включает терапевтически эффективный белок и недетергентный сульфобетаин (NDSB), где NDSB выбирают из группы, включающей диметилэтил-(3-сульфопропил) аммониевой соли, 3-(1-пиридино)-1-пропансульфоната, пропансульфоната диметилбензиламмония, диметил-трет-бутил-(3-сульфопропил) аммониевой соли, 3-(1-метилпиперидин)-1-пропансульфоната и диметил-(2-гидроксиэтил)-(сульфопропил) аммониевой соли.
2. Стабильная фармацевтическая композиция по п.1, в которой терапевтически эффективным белком является G-CSF.
3. Стабильная фармацевтическая композиция по п.2, в которой NDSB является диметил-трет-бутил-(3-сульфопропил) аммониевой солью.
4. Стабильная фармацевтическая композиция по п.1, где указанная композиция дополнительно включает полиол, выбранный из группы, включающей сорбит, инозит и трегалозу.
5. Стабильная фармацевтическая композиция по п.1, где указанная композиция дополнительно включает один или более фармацевтически приемлемых эксципиентов, выбранных из группы, включающей EDTA и ДМСО.
6. Способ получения фармацевтической композиции по п.1, в котором указанную фармацевтическую композицию получают смешиванием NDSB с терапевтически эффективным количеством белка.
7. Применение NDSB для получения стабильной фармацевтической композиции по п.1.
8. Применение NDSB в качестве стабилизатора в фармацевтической композиции по п.1.
РИСУНКИ
|
|