|
|
(21), (22) Заявка: 2008134085/15, 19.08.2008
(24) Дата начала отсчета срока действия патента:
19.08.2008
(46) Опубликовано: 27.01.2010
(56) Список документов, цитированных в отчете о
поиске:
US 6258121 B1, 10.07.2001. US 6702850 B1, 09.03.2004. RU 2004124387 А, 10.06.2005.
Адрес для переписки:
660073, г.Красноярск, а/я 2504 Л.Т. Жуковой
|
(72) Автор(ы):
Шишацкая Екатерина Игоревна (RU),
Волова Татьяна Григорьевна (RU),
Протопопов Алексей Владимирович (RU)
(73) Патентообладатель(и):
Шишацкая Екатерина Игоревна (RU)
|
(54) ПОКРЫТИЕ СТЕНТА
(57) Реферат:
Изобретение относится к медицине и предназначено для использования в сердечно-сосудистой хирургии при стентировании артерий. В покрытии стента, включающем полимерный материал с активным антипролиферативным веществом, в качестве полимерного материала используют сополимер масляной и валериановой кислот, а в качестве активного антипролиферативного вещества – рубомицин, количество сополимера масляной и валериановой кислот на один стент равно 2-15 мг/стент, рубомицин включают в слой полимера в количестве 0,002-0,025 мг/стент. Техническим результатом является создание более простого покрытия стента, обладающего биосовместимостью и гемосовместимостью, с оптимальными физико-механическими свойствами, а также способностью медленно биорезорбироваться in vivo без образования токсичных продуктов и негативных реакций со стороны стенки сосуда в процессе использования. 2 з.п. ф-лы, 3 ил., 1 табл.
Изобретение относится к медицине и предназначено для использования в сердечнососудистой хирургии при стентировании артерий.
Известно гибридное покрытие, состоящее из двух слоев, первый – из трех компонентов полимерной основы, сшивающего вещества и паклитакселя (таксола), и второго слоя – гепарина. (Патент США  6231600, М.кл. A61F 2/06, 1999 г.). 6231600, М.кл. A61F 2/06, 1999 г.).
Недостатком известного покрытия является сложная структура, которая имеет два слоя, первый слой покрытия состоит из трех компонентов: полимера, активного вещества и сшивающего агента, т.е. тип полимера не позволяет включить препарат прямо в полимерную матрицу без использования дополнительного сшивающего агента.
Наиболее близким техническим решением является двухслойное полимерное покрытие с активным веществом паклитакселем. Первый слой покрытия состоит из смеси двух полимеров: полилактида полиэтиленоксида (PLA-PEO) – это быстро разрушающийся гидрофильный материал. Второй слой – медленно разрушающийся гидрофобный материал, состоящий из смеси полилактида и поликапролактона (PLA-PCL), а в качестве активного вещества применяют таксол (паклитаксел), подавляющий развитие рестеноза после пластических операций на сосудах. (Патент США  6258121 В1, М. кл. A61F 2/06, 1999 г.) 6258121 В1, М. кл. A61F 2/06, 1999 г.)
Недостатками известного покрытия являются использование в качестве биосовместимого покрытия полимера молочной кислоты (полилактида), у которого при гидролизе полимерной цепи in vivo происходит высвобождение мономеров молочной кислоты, сопровождающееся существенным закислением тканей (сдвиг рН 3,2-3,4). Полилактид уступает многим синтетическим полимерам по теплостойкости, при нагревании свыше 50°С изделия из полилактида деформируются, и, как следствие этого, они не могут быть подвергнуты стерилизации с применеием тепловых методов. Полиактид подвергается гидролизу в жидких средах, поэтому время его резорции in vivo исчисляется небольшим периодом 10-12 суток. Для повышения прочностных, температурных и биосовместимых свойств полилактид подвергают модификации с добавлением полигликолиевой кислоты и других технологических добавок. Это приводит к тому, что покрытие является сложным.
Применение цитостатического препарата паклитаксель (таксола) является дорогостоящим из-за получения его из экзотического сырья.
Задачей предлагаемого изобретения является создание более простого покрытия стента, обладающего биосовместимостью и гемосовместимостью, оптимальными физико-механическими свойствами, а также способностью медленно биорезорбироваться in vivo без образования токсичных продуктов и негативных реакций со стороны стенки сосуда в процессе использования.
Поставленная задача достигается тем, что в покрытии стента, включающем полимерный материал с активным антипролиферативным веществом, новым является то, что в качестве полимерного материала используют сополимер гидроксибутирата и гидоксивалериата кислот, а в качестве активного антипролиферативного вещества – рубомицин, количество сополимера гидроксибутирата и гидроксивалериата на один стент равно 2-15 мг/стент, и рубомицин включают в слой полимера в количестве 0,002-0,025 мг/стент.
В предлагаемом покрытии стента использован представитель нового класса термопластичных, биоразрушаемых и биосовместимых полимеров – полимеры гидроксипроизводных алкановых кислот (полигидроксиалкаонаты), а именно сополимер гидроксибутирата и гидроксивалериата и в качестве антипролиферативного вещества (цитостатического препарата) применен рубомицин – антибиотик антрациклинового ряда.
Сополимер гидроксибутирата и гидроксивалериата обладает следующими преимуществами:
– высокой биосовместимостью, включая гемосовместимость, так как не активирует ферментные системы крови и не вызывает агрегации тромбоцитов на поверхности;
– способностью не гидролизоваться в жидких средах, так как деградация данного сополимера является истинно биологической и происходит клеточным и гуморальными путями, образующиеся при этом мономеры гидроксибутирата и гидроксивалериата не вызывают резкого закисления тканей и, следовательно, выраженной воспалительной реакции;
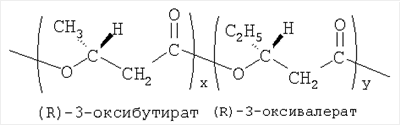
– скорости биорезорбции сополимера значительно ниже, чем у полилактида, и поэтому покрытие стента in vivo может функционировать до 120 суток и более. Описание используемого сополимера гидроксибутирата и гидроксивалериата и примеры его получения следующие. Сополимер гидроксибутирата и гидроксивалериата (или другое название- гидроксимасляной и гидроксивалериановой кислот) – перспективный представитель семейства полигидроксиалканаотов (ПГА) – синтезируется микроорганизмами. Это химическое соединение (не два вещества!), образованные внутриклеточно в результате сополимеризации двух мономеров (гидрокси-бутирата и гидрокси-валериата); химическая формула:
Способ синтеза сополимеров защищен патентом РФ 2051968 «Способ получения гетерополимера  -оксимасляной и -оксимасляной и  -оксивалериановой кислот». 1996. Волова Т.Г., Калачева Г.С., Константинова В.М., и опубликован в статье «Синтез сополимеров полигидроксибутирата и полигидроксивалерата поли(3ГБ/3ГВ) бактериями Ralstonia eutropha» в журнале «Микробиология», 2005. Т.74, -оксивалериановой кислот». 1996. Волова Т.Г., Калачева Г.С., Константинова В.М., и опубликован в статье «Синтез сополимеров полигидроксибутирата и полигидроксивалерата поли(3ГБ/3ГВ) бактериями Ralstonia eutropha» в журнале «Микробиология», 2005. Т.74,  1, С.63-69. / Волова Т.Г., Калачева Г.С. 1, С.63-69. / Волова Т.Г., Калачева Г.С.
Получение сополимеров гидоксибутирата и гидроксивалериата [поли(3ГБ/3ГВ)] осуществляется микробиологическим способом. Для этого бактерии Ralstonia eutropha B5786 культивировали на минеральной солевой среде с использованием в качестве источника углерода и энергии при автотрофном режиме СO2 и Н2, при гетеротрофном – фруктозу. Бактерии культивировали в периодическом режиме в лабораторном аппарате объемом до 10 литров при коэффициенте заполнения 0.3, оснащенном турбинной мешалкой открытого типа с частотой 1000 об/мин. Исходное соотношение компонентов в газовой смеси в контроле составляло для СО2, О2 и Н2 соответственно как 1:2:6 по объему. При гетеротрофных условиях подачу фруктозы осуществляли перистальтическим насосом-дозатором (при текущей концентрации фруктозы в культуре не выше 10 г/л). Для максимальной аккумуляции ПГА применяли разработанный режим культивирования бактерий с лимитированием роста по азоту на первом этапе и в без азотной среде – на втором, при рН 7.0 и температуре 30°С [Волова Т.Г., Калачева Г.С. Способ получения полимера  -оксимасляной кислоты. Патент РФ -оксимасляной кислоты. Патент РФ  2051967, 1996]. Для включения в ПГА в качестве сополимера гидрокси-валериата в среду вносили добавки валерата. Содержание полимера в биомассе и химический состав мономеров определяли хроматографией метиловых эфиров жирных кислот после метанолиза проб сухой биомассы на хроматомасс-спектрометре GSD plus (Hewlett Packard, USA). Вследствие токсичности валерата для культуры повышение фракции 3ГВ в сополимере увеличением дозы валерата оказалось невозможным. Выявлено, что при увеличение разовой подачи валерата в культуру в концентрации свыше 2.0 г/л наблюдается выраженное ингибирование роста бактерий и синтеза ПГА в целом. Для повышения включения фракции 3ГВ в поли(3ГБ/3ГВ) с учетом токсичности для культуры R.eutropha B5786 валерата в концентрации, свыше 2 г/л, разработаны режимы культивирования бактерий с дробной подачей валерата. Сочетанием количества добавок валерата в культуру (1, 2, 3 и более) и последующего времени культивирования найдены условия, при которых возможен синтез ПГА с варьированием соотношения мономеров 3ГБ/3ГВ в широких пределах, от 9:1 до 1:9 (мол%). Реализован процесс выращивания бактерий, обеспечивающий высокий общий выход сополимера (свыше 80-85%) с варьированием соотношения мономеров в нем. 2051967, 1996]. Для включения в ПГА в качестве сополимера гидрокси-валериата в среду вносили добавки валерата. Содержание полимера в биомассе и химический состав мономеров определяли хроматографией метиловых эфиров жирных кислот после метанолиза проб сухой биомассы на хроматомасс-спектрометре GSD plus (Hewlett Packard, USA). Вследствие токсичности валерата для культуры повышение фракции 3ГВ в сополимере увеличением дозы валерата оказалось невозможным. Выявлено, что при увеличение разовой подачи валерата в культуру в концентрации свыше 2.0 г/л наблюдается выраженное ингибирование роста бактерий и синтеза ПГА в целом. Для повышения включения фракции 3ГВ в поли(3ГБ/3ГВ) с учетом токсичности для культуры R.eutropha B5786 валерата в концентрации, свыше 2 г/л, разработаны режимы культивирования бактерий с дробной подачей валерата. Сочетанием количества добавок валерата в культуру (1, 2, 3 и более) и последующего времени культивирования найдены условия, при которых возможен синтез ПГА с варьированием соотношения мономеров 3ГБ/3ГВ в широких пределах, от 9:1 до 1:9 (мол%). Реализован процесс выращивания бактерий, обеспечивающий высокий общий выход сополимера (свыше 80-85%) с варьированием соотношения мономеров в нем.
Результаты потенциальных областей применения сополимеров гидроксибутирата и гидроксивалериата для получения специальных изделий опубликованы нами в следующих работах.
 3. С.6-8. 3. С.6-8.
 5. С.40-44. 5. С.40-44.
 .3. – С.50-55. .3. – С.50-55.
 2-3. – С.3-14. 2-3. – С.3-14.
 3. – С.25-29. 3. – С.25-29.
 .4 – С.65-70. .4 – С.65-70.
 2. – С.68-76. 2. – С.68-76.
Свойства семейства ПГА, в том числе сополимеров гидроксибутирата и гидроксивалериата, изучены в различных аспектах и широко опубликованы в следующих работах.
На отсутствие цитотоксичности.
 4. С.561-564. 4. С.561-564.
 4. С.59-63. 4. С.59-63.
 3. С.40-47. 3. С.40-47.
Токсикологические исследования.
Шишацкая Е.И., Волова Т.Г., Гительзон И.И. Токсикологические исследования полиоксиалканоатов в эксперименте in vivo II ДАН. 2002. Т.383,  4. С.565-567 4. С.565-567
 4. С.29-32. 4. С.29-32.
Благоприятная тканевая реакция на сополимеры гидроксибутирата и гидроксивалериата.
 4. С.23-26. 4. С.23-26.
 12. – С.635-639. 12. – С.635-639.
Результаты исследования биосовместимости.
 5. С.46-55. 5. С.46-55.
Пригодность для контакта с кровью.
 10. Р.1029-1042. 10. Р.1029-1042.
Исследование разрушаемости сополимеров гидроксибутирата и гидроксивалериата в биологических средах, подтверждающие отсутствие гидролиза и закономерности медленного биоразрушения.
 5. С.539-543. 5. С.539-543.
 2. С.56-62. 2. С.56-62.
Физические свойства.
Волова Т.Г., Плотников В.Ф., Шишацкая Е.И., Миронов П.В., Васильев А.Д. «Физико-химические свойства двухкомпонентных -[поли(3ГБ/3ГВ)] полигидроксиалканоатов» в журнале «Биофизика». 2004. Т.49.,  6, С.1038-1046. 6, С.1038-1046.
Примеры осуществления изобретения при указании количества используемых сополимеров гидроксибутирата и гидроксивалериата в интервале от 2 до 15 мг и количества рубомицина в интервале от 0,002 до 0,025 мг/стент следующие.
Пример 1.
Раствор сополимера гидроксибутирата и гидроксивалериата в дихлорметане (или хлороформе), содержащий рубомицин, наносят на поверхности стента, далее изделие высушивают в беспылевом боксе-ламинаре. Масса полимерного покрытия составляет 2 мг/стент, содержание рубомицина в покрытие – 0,002 мг/стент.
Пример 2.
Раствор сополимера гидроксибутирата и гидроксивалериата в дихлорметане (или хлороформе), содержащий рубомицин, наносят на поверхности стента, далее изделие высушивают в беспылевом боксе-ламинаре. Масса полимерного покрытия составляет 8 мг/стент, содержание рубомицина в покрытие – 0,012 мг/стент.
Пример 3.
Раствор сополимера гидроксибутирата и гидроксивалериата в дихлорметане (или хлороформе), содержащий рубомицин, наносят на поверхности стента, далее изделие высушивают в беспылевом боксе-ламинаре. Масса полимерного покрытия составляет 10 мг/стент, содержание рубомицина в покрытие – 0,018 мг/стент.
Пример 4.
Раствор сополимера гидроксибутирата и гидроксивалериата в дихлорметане (или хлороформе), содержащий рубомицин, наносят на поверхности стента, далее изделие высушивают в беспылевом боксе-ламинаре. Масса полимерного покрытия составляет 12 мг/стент, содержание рубомицина в покрытие – 0,020 мг/стент.
Пример 5.
Раствор сополимера гидроксибутирата и гидроксивалериата в дихлорметане (или хлороформе), содержащий рубомицин, наносят на поверхности стента, далее изделие высушивают в беспылевом боксе-ламинаре. Масса полимерного покрытия составляет 15 мг/стент, содержание рубомицина в покрытие – 0,025 мг/стент; вариант осуществления изобретения примера 5 является оптимальным.
При включении рубомицина в слой полимера в количестве меньше 0,002 мг/стент не обеспечивает подавление развития неоинтимы, а в количестве больше 0,025 мг/стент может иметь побочный токсический эффект.
В качестве полимерной основы (полимера) для получения покрытия стента используют одно вещество – сополимер гидроксибутирата и гидроксивалериата, который растворяют в дихлорметане или хлороформе, а затем вводят раствор рубомицина. Полученный гомогенный прозрачный раствор наносят на поверхность стента. Стент помещают в беспылевой бокс-ламинар при комнатной температуре. После испарения растворителя на поверхности стента образуется покрытие в виде пленки. Покрытие состоит из одногослоя из двух компонентов: один полимер и одно активное вещество.
В таблице приведены характеристики покрытий.
 п/п п/п |
Характеристики |
Прототип |
Предлагаемое изобретение |
| 1 |
Количество слоев |
2 |
1 |
| 2 |
Количество компонентов для приготовления покрытия |
4 |
2 |
| 3 |
Состав полимерной основы покрытия |
1-й слой: смесь полилактид + полиэтиленоксид 2-й слой: смесь полилактид + поликапрола ктон |
1 слой: сополимер гидроксибутирата и гидроксивалериата |
| 4 |
Активное антипролифератив ное вещество |
Паклитаксель (таксол) |
Рубомицин |
| 5 |
Температура плавления (деформации) покрытия |
50°С |
160°С |
| 6 |
Время разрушения покрытия в организме (крови) |
10-12 суток |
90-120 суток |
| 7 |
Сдвиг рН тканей сосуда |
3,2-3,4 |
4,2-4,6 |
Предлагаемое изобретение поясняется фотографиями и графиком.
На фиг.1 изображена морфология фрагмента стенки сосуда через две недели после стентирования в месте контакта сосуда с полимерным покрытием (а) и стентом с полимерным покрытием, содержащем рубомицин (б): где 1 – отверстие от элемента стента, 2- неоинтима. Окраска – гематоксилин-эозин. Маркер – 1 мм; Фиг.2 – морфология фрагмента стенки сосуда через двенадцать недель после стентирования вместе контакта стенки сосуда со стентом с полимерным покрытием (а) и стентом с полимерным покрытием, содержащем рубомицин (б): где 1 – отверстие от элемента стента, 2-неоинтима. Окраска – гематоксилин-эозин. Маркер – 1 мм. Фиг.3 – динамика образования и толщина неоинтимы вокруг стента с полимерным покрытием и стентом с полимерным покрытием, содержащем рубомицин.
Техническим результатом является создание более простого покрытия стента, обладающего биосовместимостью и гемосовместимостью, с оптимальными физико-механическими свойствами, а также способностью медленно биорезорбироваться in vivo без образования токсичных продуктов и негативных реакций со стороны стенки сосуда в процессе использования.
Авторами получены высокоочищенные образцы полимеров для покрытия стентов, пригодные для биомедицинских применений, включая контакт с кровью.
Формула изобретения
1. Покрытие стента, включающее полимерный материал с активным антипролиферативным веществом, отличающееся тем, что в качестве полимерного материала используют сополимер гидрокси-бутирата и гидрокси-валериата, а в качестве активного антипролиферативного вещества – рубомицин.
2. Покрытие стента по п.1, отличающееся тем, что количество сополимера гидрокси-бутирата и гидрокси-валериата на один стент равно 2-15 мг.
3. Покрытие стента по п.1, отличающееся тем, что рубомицин включают в слой полимера в количестве 0,002-0,025 мг/стент.
РИСУНКИ
|
|