Патент на изобретение №2379307
|
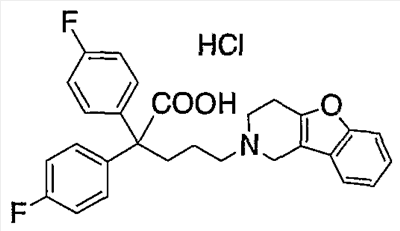
||||||||||||||||||||||||||
(54) СОЕДИНЕНИЕ ЦИКЛИЧЕСКОГО АМИНА
(57) Реферат:
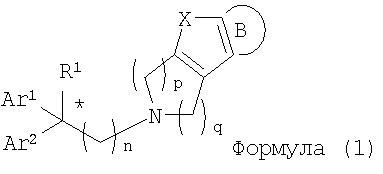
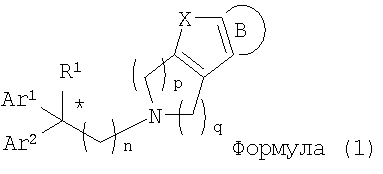
Изобретение относится к новым соединениям циклического амина формулы (1) или его фармацевтически приемлемой соли:
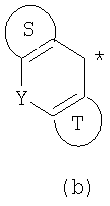
где Х означает О, S, NR2 (где R2 означает Н, C1-C12 алкил); когда Х означает О, S, то R1 означает Н, CN, СООН, С2-С13 алкоксикарбонил, карбамоильную группу; а когда Х означает NR2 (где значение R2 указано выше), то R1 означает CN; Ar1 и Ar2 одинаковы или различны и каждый означает арил, который может быть замещен 1-3 галогенами; или же Ar1 и Ar2 вместе с соседними атомами углерода, к которым они присоединены, образуют группу, представленную формулой (b):
(где цикл S и цикл Т одинаковы и каждый означает бензольный цикл; Y означает О); цикл В означает бензольный цикл, который может быть замещен 1-3 заместителями, независимо выбранными из группы, включающей галоген, С1-С12 алкил, C1-C8 галогеналкил, C1-C12 алкокси, C1-C8 галогеналкоксигруппы; n означает целое число от 1 до 10; p, q одинаковы или различны и каждый означает целое число 1 или 2. Соединения (I) являются ингибиторами связывания
Область техники, к которой относится изобретение Настоящее изобретение относится к новому соединению циклического амина, его сольвату, его фармацевтически приемлемой соли и фармацевтической композиции. Уровень техники
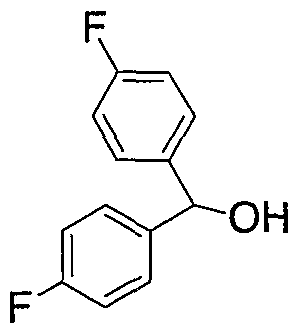
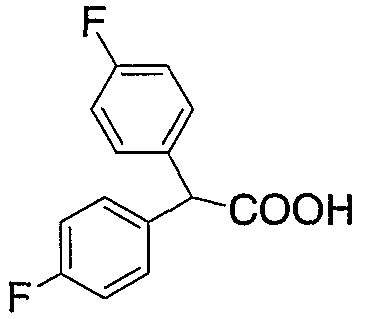
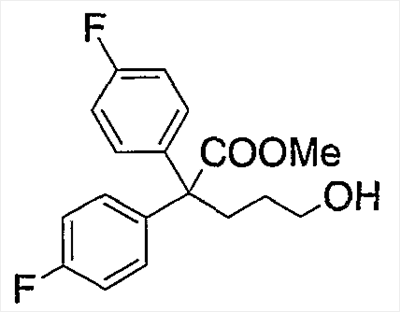
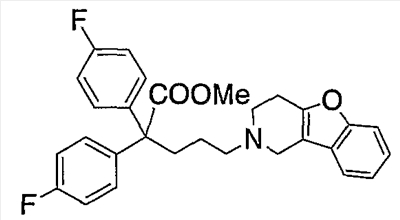
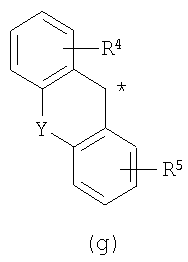
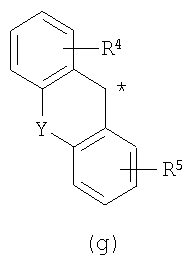
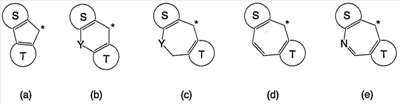
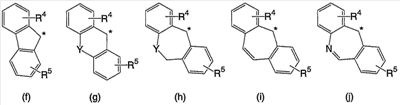
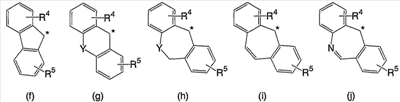
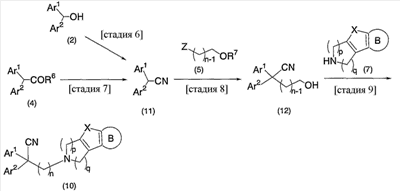
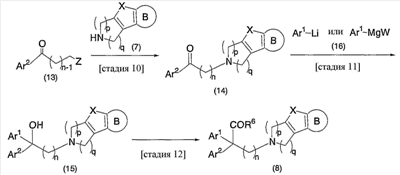
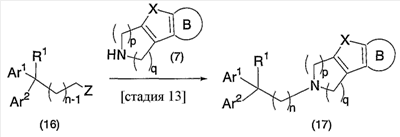
В настоящее время в качестве терапевтических средств против депрессии широко применяют ингибиторы захвата нейротрансмиттеров, таких как серотонин и норадреналин. Для ряда указанных ингибиторов было высказано предположение, что на их эффективность влияет антагонизм Среди антагонистов С другой стороны, клозапин, который является атипичным лекарством против шизофрении, считается терапевтическим средством, обладающим наибольшей эффективностью по сравнению с обычными терапевтическими средствами. Полагают, что действие клозапина является результатом подавления активности мезолимбической допаминергической нервной системы за счет блокады D2 рецептора. Полагают, что значительную активность клозапина можно отнести на счет блокирования 5-ТН2А рецептора, D4 рецептора или Кроме того, на основании проведенных экспериментов на животных сообщалось, что для антагониста D2 рецептора наблюдалось заметное высвобождение допамина из средней префронтальной коры головного мозга; что селективно наблюдалось заметное высвобождение допамина в средней префронтальной коре в том случае, когда совместно использовали антагонист Вызванная блокадой D2 рецептора стимуляция каталепсии подавляется соединением, обладающим сродством к В настоящее время известно множество соединений циклических аминов (непатентные документы 9, 10, 11, 12 и 13; патентные документы 1, 2, 3, 4 и 5). Непатентные документы 9 и 10 описывают воздействие на D2 рецептор и 5-НТ2А рецептор, а непатентные документы 11 и 12 описывают действие против амфетамина, соответственно. Ни в одном из указанных документов не отмечается воздействие на [Патентный документ 1] WO 98/45297; [Патентный документ 2] WO 00/20421; [Патентный документ 3] WO 00/20422; [Патентный документ 4] WO 00/20423; [Патентный документ 5] WO 00/37466; [Непатентный документ 1] Sallinen et al., Mol. Psychiatry., (1999), 4(5), 443-452; [Непатентный документ 2] Potter and Manji, Clin. Chem., (1994), 40(2), 279-287; [Непатентный документ 3] Sussman and Stahl, Am. J. Med., (1996), 101(6A), 26S-36S; [Непатентный документ 4] Hertel et al., Neuropsychopharmacology, (1997), 17(1), 44-55; [Непатентный документ 5] Hertel et al., Science, (1999), 286(5437), 105-107; [Непатентный документ 5] Van Dorth, Acta. Psychiatr. Scand. Suppl., (1983), 302, 72-80; [Непатентный документ 6] Litman et al., Br. J. Psychiatry., (1996), 168(5), 571-579; [Непатентный документ 8] Kalkman et al., Br. J. Pharmacol., (1998), 124(7), 1550-1556; [Непатентный документ 9] Abou-Gharbia et al., J. Med. Chem., (1987), 30, 1100-1105; [Непатентный документ 10] Abou-Gharbia et al., J. Med. Chem., (1987), 30, 1818-1823; [Непатентный документ 11] Harbert et al., J. Med. Chem., (1980), 23, 635-643; [Непатентный документ 12] Harbert et al., Molecular Pharmacol., (1980), 17, 38-42; [Непатентный документ 13] Kennis et al., Bioorg. Med. Chem. Lett., (2000), 10, 71-74. Описание изобретения Как указано выше, еще не были предложены новые соединения циклического амина, которые потенциально обладают ингибирующим действием на связывание В результате интенсивных и экстенсивных исследований, направленных на решение указанной выше проблемы, авторы настоящего изобретения обнаружили, что специфические соединения циклического амина являются действенными и проявляют подтип-селективную активность по отношению к (1) Соединение циклического амина, представленное следующей формулой (1), его сольват или его фармацевтически приемлемая соль: где Х означает O, S, SO, SO2 или NR2 (где R2 представляет собой атом водорода, С1-С12 алкильную группу, С2-С8 алканоильную группу или С2-С13 алкоксикарбонильную группу); Когда Х означает O, S, SO, SO2, то R1 представляет собой атом водорода, цианогруппу, карбоксильную группу, С2-С13 алкоксикарбонильную группу, карбамоильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу, С3-С13 циклическую аминокарбонильную группу, С1-С12 алкильную группу, С1-С12 алкоксигруппу, С1-С8 алкилтио-группу, С1-С8 алкилсульфинильную группу, С1-С8 алкилсульфонильную группу, С2-С8 алканоильную группу, нитрогруппу или гидроксильную группу; а когда Х означает NR2 (где значение R2 указано выше), то R1 представляет собой цианогруппу, карбоксильную группу, С2-С13 алкоксикарбонильную группу, карбамоильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу, С3-С13 циклическую аминокарбонильную группу, С1-С12 алкильную группу, С1-С12 алкоксигруппу, С1-С8 алкилтио-группу, С1-С8 алкилсульфинильную группу, С1-С8 алкилсульфонильную группу, С2-С8 алканоильную группу, нитрогруппу или гидроксильную группу; Ar1 и Ar2 одинаковы или различны и каждый представляет собой арильную или гетероарильную группу, которая может быть замещена 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С7-С26 аралкильную, С2-С8 алкенильную, С2-С8 алкинильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С8 алкилтио, С1-С8 алкилсульфинильную, С1-С8 алкилсульфонильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, С2-С8 алканоильную, циано, нитро, фенильную и феноксигруппы; или же Ar1 и Ar2 вместе с соседними атомами углерода, к которым они присоединены, образуют группу, представленную одной из следующих формул (а) – (е): (где цикл S и цикл Т одинаковы или различны, и каждый означает бензольный цикл, пиррольный цикл, фурановый цикл, тиофеновый цикл, имидазольный цикл, пиразольный цикл, оксазольный цикл, изоксазольный цикл, тиазольный цикл, изотиазольный цикл, пиридиновый цикл, пиримидиновый цикл, пиразиновый цикл или пиридазиновый цикл, каждый из которых может быть замещен 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С7-С26 аралкильную, С2-С8 алкенильную, С2-С8 алкинильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С8 алкилтио, С1-С8 алкилсульфинильную, С1-С8 алкилсульфонильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, С2-С8 алканоильную, циано, нитро, фенильную и фенокси группы; а Y означает O, S, SO, SO2 или NR3 (где R3 представляет собой атом водорода, С1-С12 алкильную группу, С2-С8 алканоильную группу или С2-С13 алкоксикарбонильную группу); цикл В означает бензольный цикл, пиррольный цикл, фурановый цикл, тиофеновый цикл, имидазольный цикл, пиразольный цикл, оксазольный цикл, изоксазольный цикл, тиазольный цикл, изотиазольный цикл, пиридиновый цикл, пиримидиновый цикл, пиразиновый цикл или пиридазиновый цикл, каждый из которых может быть замещен 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С7-С26 аралкильную, С2-С8 алкенильную, С2-С8 алкинильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С8 алкилтио, С1-С8 алкилсульфинильную, С1-С8 алкилсульфонильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, С2-С8 алканоильную, циано, нитро, фенильную и феноксигруппы; n означает целое число от 1 до 10; и p и q одинаковы или различны и каждый означает целое число 1 или 2. (2) Соединение циклического амина, его сольват или его фармацевтически приемлемая соль в соответствии с приведенным выше пунктом (1), где Х означает O, S, SO или SO2; R1 означает атом водорода, цианогруппу, карбоксильную группу, С2-С13 алкоксикарбонильную группу, карбамоильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу, С3-С7 циклическую аминокарбонильную группу, нитрогруппу или гидроксильную группу; Ar1 и Ar2 одинаковы или различны и каждый означает фенильную группу, нафтильную группу, фурильную группу, тиенильную группу, пиридильную группу или имидазолильную группу, каждая из которых может быть замещена 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, циано, нитро, фенильную и феноксигруппы; или же Ar1 и Ar2 вместе с соседними атомами углерода, к которым они присоединены, образуют группу, представленную одной из следующих формул (f) – (j): (где R4 и R5 одинаковы или различны, и каждый означает атом водорода, атом галогена, С1-С12 алкильную группу, С1-С8 галогеналкильную группу, С1-С12 алкоксигруппу, С1-С8 галогеналкоксигруппу, гидроксильную группу, С1-С12 алкиламиногруппу, С2-С24 диалкиламиногруппу, С2-С12 циклическую аминогруппу, аминогруппу, С2-С13 алкоксикарбонильную группу, карбоксильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу, С3-С13 циклическую аминокарбонильную группу, карбамоильную группу, цианогруппу, нитрогруппу, фенильную группу или феноксигруппу; а Y означает O, S, SO, SO2 или NR3 (где R3 представляет собой атом водорода или С1-С12 алкильную группу); цикл В означает бензольный цикл, фурановый цикл, тиофеновый цикл, пиридиновый цикл или имидазольный цикл, каждый из которых может быть замещен 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, циано, нитро, фенильную и феноксигруппы; n означает целое число от 1 до 5; и p и q различны и каждый означает целое число 1 или 2. (3) Соединение циклического амина, его сольват или его фармацевтически приемлемая соль в соответствии с приведенным выше пунктом (1), где Х означает NR2 (где R2 представляет собой атом водорода или С1-С12 алкильную группу); R1 означает цианогруппу, карбоксильную группу, С2-С13 алкоксикарбонильную группу, карбамоильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу, С3-С7 циклическую аминокарбонильную группу, нитрогруппу или гидроксильную группу; Ar1 и Ar2 одинаковы или различны и каждый означает фенильную группу, нафтильную группу, фурильную группу, тиенильную группу, пиридильную группу или имидазолильную группу, каждая из которых может быть замещена 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, циано, нитро, фенильную и феноксигруппы; или же Ar1 и Ar2 вместе с соседними атомами углерода, к которым они присоединены, образуют группу, представленную одной из следующих формул (f) – (j): (где R4 и R5 одинаковы или различны, и каждый означает атом водорода, атом галогена, С1-С12 алкильную группу, С1-С8 галогеналкильную группу, С1-С12 алкоксигруппу, С1-С8 галогеналкоксигруппу, гидроксильную группу, С1-С12 алкиламиногруппу, С2-С24 диалкиламиногруппу, С2-С12 циклическую аминогруппу, аминогруппу, С2-С13 алкоксикарбонильную группу, карбоксильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу, С3-С13 циклическую аминокарбонильную группу, карбамоильную группу, цианогруппу, нитрогруппу, фенильную группу или феноксигруппу; а Y означает O, S, SO, SO2 или NR3 (где R3 представляет собой атом водорода или С1-С12 алкильную группу); цикл В означает бензольный цикл, фурановый цикл, тиофеновый цикл, пиридиновый цикл или имидазольный цикл, каждый из которых может быть замещен 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, циано, нитро, фенильную и феноксигруппы; n означает целое число от 1 до 5; и p и q различны и каждый означает целое число 1 или 2. (4) Соединение циклического амина, его сольват или его фармацевтически приемлемая соль в соответствии с приведенным выше пунктом (1), где Х означает O или N; R1 означает атом водорода, цианогруппу, карбоксильную группу, С1-С6 алкоксикарбонильную группу или карбамоильную группу; Ar1 и Ar2 одинаковы или различны и каждый означает фенильную группу, которая может быть замещена атомом(ами) галогена, С1-С6 алкильной(ыми) группой(ами), С1-С6 алкоксигруппой(ами), трифторметильной(ыми) группой(ами) или трифторметоксигруппой(ами); или же Ar1 и Ar2 вместе с соседними атомами углерода, к которым они присоединены, образуют 9Н-ксантен-9-ильную группу; цикл В означает бензольный цикл, в котором один из его атомов водорода может быть замещен атомом галогена, С1-С6 алкильной группой, С1-С6 алкоксигруппой, трифторметильной группой или трифторметоксигруппой; n означает целое число от 2 до 4; и p и q различны и каждый означает целое число 1 или 2. (5) Соединение циклического амина, его сольват или его фармацевтически приемлемая соль в соответствии с приведенным выше пунктом (1), где Х означает NR2 (где R2 представляет собой атом водорода, метильную группу или этильную группу); R1 означает цианогруппу, карбоксильную группу, С1-С6 алкоксикарбонильную группу или карбамоильную группу; Ar1 и Ar2 одинаковы или различны и каждый означает фенильную группу, которая может быть замещена атомом(ами) галогена, С1-С6 алкильной(ыми) группой(ами), С1-С6 алкоксигруппой(ами), трифторметильной(ыми) группой(ами) или трифторметоксигруппой(ами); цикл В означает бензольный цикл, в котором один из его атомов водорода может быть замещен атомом галогена, С1-С6 алкильной группой, С1-С6 алкоксигруппой, трифторметильной группой или трифторметоксигруппой; n означает целое число от 2 до 4; и p и q различны и каждый означает целое число 1 или 2. (6) Ингибитор связывания (7) Фармацевтическая композиция, содержащая соединение циклического амина, его сольват или его фармацевтически приемлемую соль в соответствии с любым из приведенных выше пунктов (1) – (5) и фармацевтически приемлемый носитель. (8) Фармацевтическая композиция по приведенному выше пункту (7), которую применяют для предупреждения или лечения депрессии, тревоги или шизофрении. Согласно настоящему изобретению можно получить новое соединение циклического амина, которое обладает ингибирующим действием на связывание Согласно предпочтительному варианту осуществления настоящего изобретения можно получить новое соединение циклического амина, которое проявляет высокую селективность по отношению к подтипам Кроме того, согласно настоящему изобретению можно получить ингибитор связывания Наилучший способ осуществления настоящего изобретения Соединение циклического амина по настоящему изобретению Соединение циклического амина представлено следующей формулой (1) В приведенной выше формуле (1) Х означает O, S, SO, SO2 или NR2 (где R2 представляет собой атом водорода, С1-С12 алкильную группу, С2-С8 алканоильную группу или С2-С13 алкоксикарбонильную группу). Предпочтительно Х означает O, S, SO, SO2 или NR2 (где R2 представляет собой атом водорода или С1-С12 алкильную группу). Более предпочтительно Х означает O, S или NR2 (где R2 представляет собой атом водорода, метильную группу или этильную группу). Когда Х означает O, S, SO, SO2, то R1 в вышеприведенной формуле (1) означает атом водорода, цианогруппу, карбоксильную группу, С2-С13 алкоксикарбонильную группу, карбамоильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу, С3-С13 циклическую аминокарбонильную группу, С1-С12 алкильную группу, С1-С12 алкоксигруппу, С1-С8 алкилтио-группу, С1-С8 алкилсульфинильную группу, С1-С8 алкилсульфонильную группу, С2-С8 алканоильную группу, нитрогруппу или гидроксильную группу. Когда Х означает O, S, SO, SO2, то R1 предпочтительно означает атом водорода, цианогруппу, карбоксильную группу, С2-С13 алкоксикарбонильную группу, карбамоильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу или С3-С13 циклическую аминокарбонильную группу. Когда Х означает NR2 (где значение R2 указано выше), то R1 в вышеприведенной формуле (1) означает цианогруппу, карбоксильную группу, С2-С13 алкоксикарбонильную группу, карбамоильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу, С3-С13 циклическую аминокарбонильную группу, С1-С12 алкильную группу, С1-С12 алкоксигруппу, С1-С8 алкилтио-группу, С1-С8 алкилсульфинильную группу, С1-С8 алкилсульфонильную группу, С2-С8 алканоильную группу, нитрогруппу или гидроксильную группу. Когда Х означает NR2 (где значение R2 указано выше), то R1 предпочтительно означает цианогруппу, карбоксильную группу, С2-С13 алкоксикарбонильную группу, карбамоильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу или С3-С13 циклическую аминокарбонильную группу. Ar1 и Ar2 в вышеприведенной формуле (1) могут быть одинаковы или различны. Ar1 и Ar2 каждый представляет собой арильную или гетероарильную группу, которая может быть замещена 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С7-С26 аралкильную, С2-С8 алкенильную, С2-С8 алкинильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С8 алкилтио, С1-С8 алкилсульфинильную, С1-С8 алкилсульфонильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, С2-С8 алканоильную, циано, нитро, фенильную и феноксигруппы. Количество заместителей в арильной или гетероарильной группе в Ar1 и Ar2 преимущественно составляет 1 или 0. Предпочтительными заместителями в арильной или гетероарильной группе в Ar1 и Ar2 являются атомы галогена, С1-С12 алкильная, С1-С8 галогеналкильная, С7-С26 аралкильная, С2-С8 алкенильная, С2-С8 алкинильная, С1-С12 алкокси, С1-С8 галогеналкокси, амино, карбоксильная, карбамоильная, циано, нитро, фенильная и феноксигруппы. Иначе, Ar1 и Ar2 вместе с соседними атомами углерода, к которым они присоединены, образуют группу, представленную одной из следующих формул (а) – (е). Среди групп, представленных формулами (а) – (е), предпочтительной является группа, представленная формулой (b) В приведенных выше формулах (а) – (е) цикл S и цикл Т могут быть одинаковы или различны. В приведенных выше формулах (а) – (е) цикл S и цикл Т каждый означает бензольный цикл, пиррольный цикл, фурановый цикл, тиофеновый цикл, имидазольный цикл, пиразольный цикл, оксазольный цикл, изоксазольный цикл, тиазольный цикл, изотиазольный цикл, пиридиновый цикл, пиримидиновый цикл, пиразиновый цикл или пиридазиновый цикл, каждый из которых может быть замещен 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С7-С26 аралкильную, С2-С8 алкенильную, С2-С8 алкинильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С8 алкилтио, С1-С8 алкилсульфинильную, С1-С8 алкилсульфонильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, С2-С8 алканоильную, циано, нитро, фенильную и феноксигруппы. Цикл S и цикл Т в приведенных выше формулах (а) – (е) каждый предпочтительно представляет собой монозамещенный цикл или незамещенный цикл. Более предпочтительно цикл S и цикл Т в приведенных выше формулах (а) – (е) каждый означает монозамещенный бензольный цикл или незамещенный бензольный цикл. В этом случае группы, представленные выше формулами (а) – (е), совпадают с группами, представленными формулами (f) – (j), соответственно, которые описываются позднее. Предпочтительными заместителями в цикле S и цикле Т являются атомы галогена, С1-С12 алкильная, С1-С8 галогеналкильная, амино, карбоксильная, циано, нитро, фенильная или феноксигруппы. Y в формулах (b) и (с) означает O, S, SO, SO2 или NR3 (где R3 представляет собой атом водорода, С1-С12 алкильную группу, С2-С8 алканоильную группу или С2-С13 алкоксикарбонильную группу). В формулах (b) и (с) Y предпочтительно означает O, S, SO, SO2 или NR3 (где R3 представляет собой атом водорода или С1-С12 алкильную группу). Как указано выше, группы, представленные формулами (а) – (е), предпочтительно являются группами, представленными формулами (f) – (j), соответственно. Таким образом, Ar1 и Ar2 в формуле (1) вместе с соседними атомами углерода, к которым они присоединены, могут образовывать группу, представленную любой из формул (f) – (j). Среди групп, представленных формулами (f) – (j), предпочтительной является группа, представленная формулой (g). В формулах (f) – (j) R4 и R5 могут быть одинаковы или различны. В формулах (f) – (j) R4 и R5 каждый означает атом водорода, атом галогена, С1-С12 алкильную группу, С1-С8 галогеналкильную группу, С1-С12 алкоксигруппу, С1-С8 галогеналкоксигруппу, гидроксильную группу, С1-С12 алкиламиногруппу, С2-С24 диалкиламиногруппу, С2-С12 циклическую аминогруппу, аминогруппу, С2-С13 алкоксикарбонильную группу, карбоксильную группу, С2-С13 алкиламинокарбонильную группу, С3-С25 диалкиламинокарбонильную группу, С3-С13 циклическую аминокарбонильную группу, карбамоильную группу, цианогруппу, нитрогруппу, фенильную группу или феноксигруппу. В формулах (f) – (j) R4 и R5 каждый предпочтительно означает атом водорода, атом галогена, С1-С12 алкильную группу или С1-С8 галогеналкильную группу, а наиболее предпочтительно, атом водорода или атом галогена. Y в формулах (f) – (j) означает O, S, SO, SO2 или NR3 (где R3 представляет собой атом водорода или С1-С12 алкильную группу). Y предпочтительно означает O, S, SO или NН, а наиболее предпочтительно означает О. Цикл В в формуле (1) Цикл В в формуле (1) означает бензольный цикл, пиррольный цикл, фурановый цикл, тиофеновый цикл, имидазольный цикл, пиразольный цикл, оксазольный цикл, изоксазольный цикл, тиазольный цикл, изотиазольный цикл, пиридиновый цикл, пиримидиновый цикл, пиразиновый цикл или пиридазиновый цикл, каждый из которых может быть замещен 1-3 заместителями, независимо выбранными из группы, включающей атомы галогена, С1-С12 алкильную, С1-С8 галогеналкильную, С7-С26 аралкильную, С2-С8 алкенильную, С2-С8 алкинильную, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильную, С1-С8 алкилтио, С1-С8 алкилсульфинильную, С1-С8 алкилсульфонильную, С1-С12 алкиламино, С2-С24 диалкиламино, С2-С12 циклическую амино, амино, С2-С13 алкоксикарбонильную, карбоксильную, С2-С13 алкиламинокарбонильную, С3-С25 диалкиламинокарбонильную, С3-С13 циклическую аминокарбонильную, карбамоильную, С2-С8 алканоильную, циано, нитро, фенильную и феноксигруппы. Количество заместителей в цикле В в формуле (1) предпочтительно равно 1 или 0. Цикл В в формуле (1) предпочтительно означает бензольный цикл, пиррольный цикл, фурановый цикл, пиридиновый цикл, пиримидиновый цикл или пиразиновый цикл. Предпочтительными заместителями в цикле В в формуле (1) являются атомы галогена, С1-С12 алкильная, С1-С8 галогеналкильная, С1-С12 алкокси, С1-С8 галогеналкокси, гидроксильная, амино, карбоксильная, карбамоильная, циано, нитро, фенильная и феноксигруппы. Более предпочтительными заместителями в цикле В в формуле (1) являются атомы галогена, С1-С12 алкильная, С1-С8 галогеналкильная, С1-С12 алкокси, С1-С8 галогеналкоксигруппы. n в формуле (1) означает целое число от 1 до 10. Предпочтительно n означает целое число от 1 до 5; и более предпочтительно n означает целое число от 2 до 4. p и q в формуле (1) могут быть одинаковы или различны и каждый означает целое число 1 или 2. Предпочтительно p равно 1, а q равно 2; или p равно 2, а q равно 1. (Описание заместителей и т.п.) Ниже описываются различные заместители и т.п., которые используют в настоящем изобретении. Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин Термин (Конкретные примеры соединения циклического амина по настоящему изобретению) Конкретные примеры соединения циклического амина по настоящему изобретению включают, однако этим не ограничиваясь, следующие соединения. Соединение 1: метил-5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентаноат; Соединение 2: 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентановая кислота; Соединение 3: амид 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентановой кислоты; Соединение 4: 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентаннитрил; Соединение 5: 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил; Соединение 6: 5-(3,4-дигидро[1]бензофуро[2,3-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил; Соединение 7: 5-(3,4-дигидро[1]бензотиено[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил; Соединение 8: 2,2-дифенил-5-(1,3,4,5-тетрагидро-2Н-пиридо[4,3-b]индол-2-ил)пентаннитрил; Соединение 9: 5-(5-метил-1,3,4,5-тетрагидро-2Н-пиридо[4,3-b]индол-2-ил)-2,2-дифенилпентаннитрил; Соединение 10: 5-(8-фтор-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил; Соединение 11: 5-(8-хлор-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил; Соединение 12: 5-(8-метил-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил; Соединение 13: 5-(8-метокси-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил; Соединение 14: 2,2-дифенил-5-(8-трифторметокси-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)пентаннитрил; Соединение 15: 2-(4,4-дифенилбутил)-1,2,3,4-тетрагидро-[1]-бензофуро[3,2-c]пиридин; Соединение 16: 9-[3-(3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)пропил]-9Н-ксантенкарбонитрил; Соединение 17: 4-(3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилбутиронитрил; Соединение 18: 6-(3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилгексаннитрил. Соединение циклического амина по настоящему изобретению может представлять собой его сольват или его фармацевтически приемлемую соль. Далее по тексту данного описания термин В данном описании примеры сольвата включают фармацевтически приемлемые сольваты, такие как гидраты. При контакте с воздухом или в процессе перекристаллизации соединение циклического амина по настоящему изобретению может поглощать влагу. В результате соединение может быть покрыто абсорбированной водой или может превратиться в гидрат. Сольват производного соединения циклического амина по настоящему изобретению также включает подобный гидрат. В данном описании примеры фармацевтически приемлемой соли могут включать кислотно-аддитивные соли, такие как соли неорганических кислот (в частности, гидрохлориды, гидроброматы, гидроиодаты, сульфаты, фосфаты или нитраты), соли сульфоновой кислоты (в частности, метансульфонаты, этансульфонаты, бензолсульфонаты или п-толуолсульфонаты) и соли органических кислот (в частности, оксалаты, тартраты, цитраты, малеаты, сукцинаты, ацетаты, бензоаты, манделаты, аскорбаты, лактаты, глюконаты или малеаты); соли аминокислот, такие как соли глицина, соли лизина, соли аргинина, соли орнитина, глутаматы или аспартаты; неорганические соли (в частности, соли лития, соли натрия, соли калия, соли кальция или соли магния) или соли аммония; и соли с органическими основаниями, такими как соли триэтиламина, соли диизопропиламина или соли циклогексиламина. Среди них подходящими являются гидрохлориды, гидроброматы, фосфаты, метансульфонаты, п-толуолсульфонаты, оксалаты, тартраты, цитраты, ацетаты, лактаты, глутаматы, аспартаты, соли натрия, соли калия, соли аммония или соли триэтиламина. Предпочтительно применяют соли натрия, гидрохлориды или сульфаты; более предпочтительно применяют гидрохлориды. Следует отметить, что соединения по настоящему изобретению включают также такие соединения, которые в организме в процессе метаболизма превращаются в другие соединения по настоящему изобретению, т.е. так называемые пролекарства. Соединение циклического амина по настоящему изобретению может иметь изомеры, такие как цис- и транс-изомеры. Соединение циклического амина по настоящему изобретению включает такие изомеры, а также смеси, в которых соединение циклического амина и подобные изомеры содержатся в любых соотношениях. Соединение циклического амина может включать асимметрический центр. В таком случае могут существовать различные оптические изомеры или различные конфигурации. Таким образом, соединение по настоящему изобретению может существовать в виде различных оптически активных веществ, (+) и (-), а также в виде рацемических модификаций или (±) смесей. В том случае, если соединение по настоящему изобретению включает два или больше асимметрических центров, то могут также существовать диастереомеры, полученные из индивидуальных оптических изомеров. Соединение циклического амина по настоящему изобретению включает все указанные типы в любых соотношениях. Диастереомеры можно разделить с помощью методов, хорошо известных специалистам в данной области техники, такими как дробная кристаллизация; а оптически активные вещества могут быть получены с помощью методов органической химии, применение которых хорошо известно для достижения указанных целей. Способы получения соединения по настоящему изобретению Соединение по настоящему изобретению может быть получено с помощью известных из органической химии методов. Например, соединение по настоящему изобретению может быть получено любыми способами, приведенными в следующих схемах реакций. На схемах реакций с 1 по 5, приведенных ниже, значения Ar1, Ar2, n, X, p, q и цикла В указаны выше; R6 означает С1-С12 алкильную группу, С1-С12 алкоксигруппу, аминогруппу, С1-С12 алкиламиногруппу, С2-С24 диалкиламиногруппу или С1-С12 циклическую аминогруппу; R7 означает обычную защитную группу для спиртов; а Z означает атом галогена (такой как атом хлора, брома или иода) или уходящую группу (такую как метансульфонилокси, бензолсульфонилокси или трифторметансульфонилоксигруппа). Схема реакций 1 Ниже описывается способ получения соединения по настоящему изобретению на примере следующей схемы реакций 1. Указанный способ представляет собой способ получения соединения (8) по настоящему изобретению из соединения (2). Стадия 1 На стадии 1 проводят замещение гидроксильной группы соединения (2) карбоксильной группой и в результате получают соединение (3). Соединение (2) можно превратить в соединение (3), например, по способу, раскрытому в Takahashi Y. et al. Chemistry letters, 1985, 1733-1734. Соединение (2) является известным соединением или же соединением, которое может быть легко синтезировано из известных соединений. Стадия 2 На стадии 2 проводят этерификацию или амидирование соединения (3) и в результате получают соединение (4). Что касается способа этерификации на стадии 2, то могут быть применены условия, которые используют при обычной этерификации карбоновой кислоты. Например, этерификацию можно осуществить согласно способу, приведенному в T.W.Greene and P.G.М.Wuts, Protective Groups in Organic Synthesis. Что касается способа амидирования на стадии 2, то могут быть применены условия, которые используют при обычном амидировании карбоновой кислоты. Может быть использован, например, способ, в котором карбоновую кислоту превращают в галогенангидрид карбоновой кислоты, такой как хлорангидрид карбоновой кислоты или бромангидрид карбоновой кислоты, а затем осуществляют взаимодействие с амином; способ, в котором смешанный ангидрид кислоты, полученный из карбоновой кислоты и хлоркарбоната и т.п., взаимодействует с амином; способ, в котором карбоновую кислоту превращают в активный сложный эфир, такой как 1-бензотриазолиловый эфир или сукцинимидиловый эфир, а затем вводят во взаимодействие с амином; или способ, в котором карбоновая кислота взаимодействует с амином в присутствии дегидратирующего конденсирующего агента. Все указанные реакции можно проводить в инертном растворителе в присутствии или в отсутствие основания. В том случае, когда на стадии 2 используют дегидратирующий конденсирующий агент, то его примеры включают гидрохлорид 3-(3-диметиламинопропил)-1-этилкарбодиимида, дициклогексилкарбодиимид, дифенилфосфорилазид и карбонилдиимидазол. Если необходимо, может быть добавлен активатор, такой как 1-гидроксибензотриазол или гидроксисукцинимид. В том случае, когда на стадии 2 используют основание, то его примеры включают органические амины, такие как пиридин, триэтиламин или диизопропилэтиламин; и неорганические основания, такие как карбонат калия, гидрокарбонат натрия и гидроксид натрия. Примеры инертного растворителя, который применяют на стадии 2, включают спирты, такие как метанол, этанол или изопропанол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил, воду и их смеси. Стадия 3 Стадия 3 представляет собой стадию, на которой осуществляют взаимодействие соединения (4) с соединением (5) в инертном растворителе в присутствии основания, а затем удаляют защитную группу R7 и таким образом получают соединение (6). Соединение (5) является известным соединением или соединением, которое может быть легко синтезировано из известного соединения. R7 в соединении (5) является обычной защитной группой для спиртов, и ее примеры включают тетрагидропиранильную, метоксиметильную, бензильную, п-метоксибензильную, тритильную, триметилсилильную, трет-бутилдиметилсилильную, ацетильную и бензоильную группы. Примеры основания, которое используют на стадии 3, включают неорганические основания, такие как карбонат калия, карбонат натрия, гидрид натрия или гидрид калия; амиды металлов, такие как амид натрия, бис(триметилсилиламид) лития или диизопропиламид лития; алкоголяты, такие как метоксид натрия или трет-бутоксид калия; и органические основания, такие как триэтиламин или пиридин. Примеры инертного растворителя, который используют на стадии 3, включают спирты, такие как метанол, этанол или изопропанол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил, воду и их смеси. Удаление защитной группы на стадии 3 можно осуществить способами, хорошо известными из области синтетической органической химии. Например, можно применить способ, описанный в T.W.Greene and P.G.М.Wuts, Protective Groups in Organic Synthesis или John Wiley and Sons: J.F.W.McOmis, Protective Groups in Organic Chemistry, Plenum Press. Стадия 4 На стадии 4 проводят реакцию конденсации между соединением (6) и соединением (7) и таким образом получают соединение (8) по настоящему изобретению. Соединение 7 является известным соединением или соединением, которое может быть легко синтезировано из известного соединения согласно, например, способам, описанным в Cattanach et al., J. Chem. Soc.(C), (1971), 53-60; Capps et al., J. Am. Chem. Soc., (1953), 75, 697-699; Jaen et al. J., Heterocycl. Chem., (1987), 24, 1317-1319; и Campaigne et al., J. Heterocycl. Chem., (1979), 16(7), 1321-1324. Что касается реакции конденсации на стадии 4, то можно применить, например, способ, в котором соединение (6) взаимодействует с галогенирующим агентом или сульфонирующими агентом в инертном растворителе в присутствии или в отсутствие основания и тем самым преобразует гидроксильную группу в соответствующую уходящую группу, а затем провести реакцию конденсации в инертном растворителе в присутствии или в отсутствие основания. Если необходимо, в реакционную смесь можно добавить бромид натрия, иодид калия и т.п. В том случае, когда на стадии 4 применяют галогенирующий агент, то его примеры включают тионилхлорид, тионилбромид, фосфорилхлорид, пентахлорид фосфора и тетрахлорид углерода-трифенилфосфин. В том случае, когда на стадии 4 применяют сульфонирующий агент, то его примеры включают метансульфонилхлорид, бензолсульфонилхлорид, ангидрид трифторметансульфоновой кислоты и N-фенил-бис(трифторметансульфонимид). В том случае, когда на стадии 4 применяют основание, то его примеры включают органические амины, такие как пиридин или триэтиламин; и неорганические основания, такие как карбонат калия, гидрокарбонат натрия или гидроксид натрия. Примеры инертного растворителя, который используют на стадии 4, включают спирты, такие как метанол, этанол или изопропанол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил, воду и их смеси. Другой вариант проведения стадии 4-1 В качестве альтернативы, соединение (8) может быть также получено взаимодействием соединения (6) с фосфорорганическим соединением (таким как трифенилфосфин или трибутилфосфин) и диэтилазобискарбоксилатом, ди-трет-бутилазобискарбоксилатом и т.п. в инертном растворителе. Примеры инертного растворителя включают простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил и их смеси. Другой вариант проведения стадии 4-2 В качестве альтернативы, соединение (8) может быть также получено путем окисления в инертном растворителе гидроксильной группы в соединении (6) для его превращения в альдегид, а затем полученное соединение (6) вводят во взаимодействие с восстановителем в инертном растворителе в присутствии или в отсутствие кислоты. Окисление можно осуществлять обычным способом, применяемым для окисления спирта в альдегид, в частности, по способу, в котором применяют диметилсульфоксид и активатор (такой как оксалилхлорид, N-хлорсукцинимид или дихлоркарбодиимид); по способу с использованием перрутената тетра-н-пропиламмония (VII) и N-метилморфолиноксида; по способу, в котором применяют йодные кислоты, такие как реагент Десс-Мартина (1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3-(1Н)-он). Например, окисление можно осуществить согласно способу, описанному в S.D.Burke and R.L.Danheiser, Oxidizing and Reducing Agents. Примеры кислоты, которую используют на этой стадии, включают неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота или фосфорная кислота; или органические кислоты, такие как п-толуолсульфоновая кислота, метансульфоновая кислота, трифторуксусная кислота, муравьиная кислота или уксусная кислота. Примеры восстановителя, который применяют на данной стадии, включают борсодержащие восстановители, такие как боргидрид натрия, цианоборгидрид натрия, триацетоксиборгидрид натрия или боргидрид лития. Примеры инертного растворителя, который применяют на данной стадии, включают простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил и их смеси. Превращение заместителя в соединении по настоящему изобретению – 1 Путем превращения заместителя в соединении по настоящему изобретению с помощью известных методов можно получить другое соединение по настоящему изобретению. Например, в том случае, когда R1 в формуле (1) представляет собой алкоксикарбонильную группу в соединении по настоящему изобретению, то можно получить другое соединение по настоящему изобретению, в котором R1 в формуле (1) представляет собой карбоксильную группу, путем превращения алкоксикарбонильной группы в карбоксильную группу с помощью известного метода. С целью превращения алкоксикарбонильной группы в R1 в формуле (1) в карбоксильную группу, соединение по настоящему изобретению, в котором R1 в формуле (1) представляет собой алкоксикарбонильную группу, можно гидролизовать с помощью кислоты или основания. Примеры кислоты, которую применяют при проведении гидролиза, включают неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, разбавленная серная кислота, концентрированная серная кислота, азотная кислота или фосфорная кислота; и органические кислоты, такие как трифторуксусная кислота или трифторметансульфоновая кислота. Примеры основания, которое применяют при проведении гидролиза, включают неорганические основания, такие как гидроксид натрия или гидроксид калия; и органические основания, такие как трет-бутоксикалий. Превращение заместителя в соединении по настоящему изобретению – 2 Кроме того, в том случае, когда R1 в формуле (1) представляет собой карбоксильную группу в соединении по настоящему изобретению, то можно получить другое соединение по настоящему изобретению, в котором R1 в формуле (1) представляет собой карбамоильную, алкиламинокарбонильную, диалкиламинокарбонильную или циклическую аминокарбонильную группу путем превращения карбоксильной группы в карбамоильную, алкиламинокарбонильную, диалкиламинокарбонильную или циклическую аминокарбонильную группу с помощью известного способа. Для превращения карбоксильной группы в R1 в формуле (1) в карбамоильную, алкиламинокарбонильную, диалкиламинокарбонильную или циклическую аминокарбонильную группу соединение по настоящему изобретению, в котором R1 в формуле (1) означает карбоксильную группу, можно амидировать. В качестве способа амидирования можно применять обычный способ амидирования карбоновой кислоты; в частности, можно использовать метод, описанный на стадии 2. Схема реакций 2 Ниже описывается способ получения соединения по настоящему изобретению на примере следующей схемы реакций 2. Указанный способ представляет собой способ получения соединения (10) по настоящему изобретению путем превращения карбамоильной группы в соединении (9) по настоящему изобретению в цианогруппу. Стадия 5 Если коротко, то можно получить соединение (10) по настоящему изобретению взаимодействием соединения (9) с дегидратирующим агентом в инертном растворителе в присутствии или в отсутствие основания. В том случае, когда на стадии 5 применяют основание, то его примеры включают органические амины, такие как пиридин, триэтиламин или диизопропилэтиламин; и неорганические основания, такие как карбонат калия или гидрокарбонат натрия. Примеры дегидратирующего агента, который применяют на стадии 5, включают трифторуксусный ангидрид, ангидрид трифторметансульфоновой кислоты, ангидрид бензойной кислоты, тионилхлорид, фосфорилхлорид или пентаоксид фосфора. Примеры инертного растворителя, который применяют на стадии 5, включают простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил и их смеси. Схема реакций 3 Далее описывается способ получения соединения по настоящему изобретению, представленный ниже схемой реакций 3. Указанный способ представляет собой способ получения соединения (10) по настоящему изобретению из соединения (2) или соединения (4). Стадия 6 Стадию 6 проводят, осуществляя реакцию конденсации между соединением (2) и цианидом металла (таким как цианид натрия, цианид калия или цианид меди) и в результате получают соединение (11). Реакцию конденсации на стадии 6 можно осуществить, например, по способу, в котором соединение (2) взаимодействует с галогенирующим агентом или сульфонирующим агентом в инертном растворителе в присутствии или в отсутствие основания и при этом гидроксильная группа превращается в соответствующую уходящую группу, а затем проводят реакцию конденсации в инертном растворителе в присутствии или в отсутствие основания. Если необходимо, в реакционную смесь можно добавить бромид натрия, иодид калия и т.п. В том случае, когда на стадии 6 применяют галогенирующий агент, то его примеры включают тионилхлорид, тионилбромид, фосфорилхлорид, пентахлорид фосфора и тетрахлорид углерода-трифенилфосфин. В том случае, когда на стадии 6 применяют сульфонирующий агент, то его примеры включают метансульфонилхлорид, бензолсульфонилхлорид, ангидрид трифторметансульфоновой кислоты и N-фенил-бис(трифторметансульфонимид). В том случае, когда на стадии 6 применяют основание, то его примеры включают органические амины, такие как пиридин, триэтиламин или диизопропилэтиламин; и неорганические основания, такие как карбонат калия, гидрокарбонат натрия или гидроксид натрия. Примеры инертного растворителя, который используют на стадии 6, включают спирты, такие как метанол, этанол или изопропанол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил, воду и их смеси. Стадия 7 Стадия 7 представляет собой стадию, на которой соединение (4), где R6 = NH2, превращают в соединение (11). На этой стадии можно использовать те же самые условия, что и приведенные для стадии 5 на схеме реакций 2. Стадия 8 Стадия 8 представляет собой стадию, на которой соединение (11) превращают в соединение (12). На данной стадии могут быть использованы условия, которые приведены для стадии 3 на схеме реакций 1 (в частности, условия, раскрытые в J. Med. Chem., 1985, 1621-28). Стадия 9 На Стадии 9 получают соединение (10) по настоящему изобретению взаимодействием соединения (12) с соединением (7). На данной стадии можно использовать те же условия, которые приведены для стадии 4 на схеме реакций 1. Схема реакций 4 Далее описывается способ получения соединения по настоящему изобретению, представленный ниже схемой реакций 4. Указанный способ представляет собой способ получения соединения (13) по настоящему изобретению из соединения (8). Стадия 10 На стадии 10 получают соединение (14) взаимодействием соединения (13) с соединением (7) в инертном растворителе в присутствии или в отсутствие основания. Соединение (13) является известным соединением или же соединением, которое может быть легко синтезировано из известного соединения. В том случае, когда на стадии 10 применяют основание, то его примеры включают органические амины, такие как пиридин, триэтиламин или диизопропилэтиламин; и неорганические основания, такие как карбонат калия, гидрокарбонат натрия или гидроксид натрия. Примеры инертного растворителя, который используют на стадии 10, включают спирты, такие как метанол, этанол или изопропанол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил, воду и их смеси. Стадия 11 На стадии 11 получают соединение (15) взаимодействием соединения (14) с литиевым реагентом или реактивом Гриньяра (16) в инертном растворителе. Примеры инертного растворителя, который используют на стадии 10, включают спирты, такие как метанол, этанол или изопропанол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил, воду и их смеси. В том случае, если на стадии 11 применяют литиевый реагент, то указанный реагент представлен формулой Ar1-Li (где значение Ar1 указано выше). Конкретные примеры литиевого реагента включают фениллитий, 4-фторфениллитий, 3-фторфениллитий, 2-фторфениллитий, 4-метилфениллитий, 3,4-дихлорфениллитий, 4-метоксинафтиллитий и 4-пиридиллитий. В том случае, если на стадии 11 применяют реактив Гриньяра, то указанный реагент представлен формулой Ar1-MgW (где значение Ar1 указано выше, а W означает атом хлора, брома или иода). Конкретные примеры реактивов Гриньяра включают фенилмагнийбромид, 4-фторфенилмагнийбромид, 3-фторфенилмагнийхлорид, 2-фторфенилмагнийиодид, 4-метилфенилмагнийбромид, 3,4-дихлорфенилмагнийхлорид, 4-метоксинафтилмагнийиодид и 4-пиридилмагнийбромид. Стадия 12 На стадии 12 соединение (15) превращают в соединение (8) по настоящему изобретению. На данной стадии можно использовать те же условия, что и приведенные для стадий 1 и 2 на схеме реакций 1. Схема реакций 5 Далее описывается способ получения соединения по настоящему изобретению, представленный ниже схемой реакций 5. Указанный способ представляет собой способ получения соединения (17) по настоящему изобретению по реакции конденсации между соединением (16) и соединением (7). Стадия 13 Если коротко, то можно получить соединение (17) по настоящему изобретению по реакции конденсации между соединением (16) и соединением (7) в инертном растворителе в присутствии или в отсутствие основания. Соединение (16) является известным соединением или же соединением, которое может быть легко синтезировано из известного соединения. В том случае, когда на стадии 13 применяют основание, то его примеры включают органические амины, такие как пиридин, триэтиламин или диизопропилэтиламин; и неорганические основания, такие как карбонат калия, гидрокарбонат натрия или гидроксид натрия. Примеры инертного растворителя, который используют на стадии 13, включают спирты, такие как метанол, этанол или изопропанол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан; ароматические углеводороды, такие как толуол или бензол; галогенсодержащие углеводороды, такие как хлороформ или дихлорметан; амиды, такие как диметилформамид или N-метил-2-пирролидон; диметилсульфоксид; ацетонитрил, воду и их смеси. На каждой из приведенных выше стадий количества соединений и растворителей, используемые при осуществлении реакции, время проведения реакции, температура и давление в реакционной системе и т.п. могут быть подобраны в зависимости от стадии. Кроме того, соединения, получаемые на каждой стадии, могут быть очищены с использованием обычных методов очистки, таких как перекристаллизация, повторное осаждение или очистка с помощью хроматографии. Применение соединения по настоящему изобретению в качестве лекарственного средства Как показано в приведенных ниже примерах, соединение по настоящему изобретению обладает действенным ингибирующим эффектом на связывание В том случае, когда вышеуказанные препараты вводят перорально, соединение по настоящему изобретению можно вводить в форме гранул, капсул, таблеток, медицинских капель, пастилок, твердых леденцов, порошков, аэрозолей и т.п. путем смешивания соединения по настоящему изобретению с разбавителями, эксципиентами, дезинтегрантами, связующими, лубрикантами, антиоксидантами, покрытиями, поверхностно-активными веществами, пластификаторами, красителями, отдушками/ароматизаторами и т.д. В подобные препараты могут добавляться соответствующие подсластители или ароматизаторы. В том случае, когда вышеуказанные препараты вводят парентерально, соединение по настоящему изобретению можно вводить в форме инъекций, капельных клизм, глазных капель, кремов, пластырей, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий и т.п. Препараты из соединения по настоящему изобретению можно приготовить обычными способами. Примеры эксципиентов, которые могут использоваться в указанных препаратах, включают маннит, ксилит, сорбит, глюкозу, белый сахар, лактозу, кристаллическую целлюлозу, смесь кристаллической целлюлозы и натрийкарбоксиметилцеллюлозы, гидрофосфат кальция, пшеничный крахмал, рисовый крахмал, кукурузный крахмал, картофельный крахмал, натрийкарбоксиметилкрахмал, декстрин, Примеры дезинтегрантов, которые могут использоваться в указанных препаратах, включают низкозамещенную гидроксипропилцеллюлозу, карбоксиметилцеллюлозу, кальцийкарбоксиметилцеллюлозу, натрийкарбоксиметилцеллюлозу, натрийкроскармелозу/тип А (актизол), крахмал, кристаллическую целлюлозу, гидроксипропилкрахмал и частично прежелатинированный крахмал. Примеры связующих, которые могут использоваться в указанных препаратах, включают метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, желатин, гуммиарабик, этилцеллюлозу, поливиниловый спирт, пуллулан, прежелатинированный крахмал, агар, смолу траганта, альгинат натрия и альгинат пропиленгликоля. Примеры лубрикантов, которые могут использоваться в указанных препаратах, включают стеариновую кислоту, стеарат магния, стеарат кальция, полиоксилстеарат, цетанол, тальк, гидрогенизированное масло, жирную кислоту сахарозы, диметилполисилоксан, микрокристаллический воск, пчелиный воск и белый пчелиный воск. Примеры антиоксидантов, которые могут использоваться в указанных препаратах, включают дибутилгидрокситолуол (ВНТ), пропилгаллат, бутилгидроксианизол (ВНА), Примеры покрытий, которые могут использоваться в указанных препаратах, включают гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, этилцеллюлозу, фталат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксипропилметилцеллюлозы, карбоксиметилэтилцеллюлозу, ацетат-фталат целлюлозы, диэтиламиноацетат поливинилацеталя, сополимер аминоалкилметакрилата, ацетат-сукцинат гидроксипропилметилцеллюлозы, сополимер метакрилата, ацетат-тримеллитат целлюлозы (САТ), фталат поливинилацеталя и шеллак. Примеры поверхностно-активных веществ, которые могут использоваться в указанных препаратах, включают полиоксиэтилированное гидрированное касторовое масло, моностеарат глицерина, моностеарат сорбитана, монопальмитат сорбитана, монолаурат сорбитана, блок-сополимер полиоксиэтилена и полиоксипропилена, полисорбаты, лаурилсульфат натрия, макроголи и сложный эфир жирной кислоты сахарозы. Примеры пластификаторов, которые могут использоваться в указанных препаратах, включают триэтилцитрат, триацетин и цетанол. Примеры красителей, которые могут использоваться в указанных препаратах, включают пигменты дегтя и оксид титана. Примеры отдушек/ароматизаторов, которые могут использоваться в указанных препаратах, включают лимонную кислоту, адипиновую кислоту, аскорбиновую кислоту и ментол. В том случае, когда соединение по настоящему изобретению вводят перорально, то соединение можно вводить от 1 до 6 раз в день, например, с дозой от 1 до 2000 мг за один прием. В том случае, когда соединение по настоящему изобретению вводят парентерально, то соединение можно вводить от 1 до 6 раз в день, например, с дозой от 0,1 до 500 мг за один прием. Уровень дозы соединения по настоящему изобретению может быть соответствующим образом подобран в зависимости от возраста, веса тела и симптомов пациента, лечение которого проводят. Примеры, справочные примеры и примеры испытаний Далее настоящее изобретение подробно описывается со ссылкой на следующие справочные примеры, примеры и примеры испытаний. Однако настоящее изобретение указанными примерами не ограничивается. Справочный пример 1 Синтез бис(4-фторфенил)метанола
Раствор 4-фторбромбензола (19,26 г) в тетрагидрофуране (280 мл) охлаждают до минус 78°С и к нему при перемешивании в течение 10 мин или дольше добавляют по каплям н-бутиллитий (2,66 М в растворе гексана; 42 мл). Реакционную смесь перемешивают в течение 1 ч, поддерживая указанную температуру. Затем к полученной смеси при перемешивании в течение 10 мин или больше добавляют по каплям 4-фторбензальдегид (12,42 г). Реакционную смесь перемешивают в течение 2 ч, поддерживая указанную температуру. После этого к реакционной смеси добавляют насыщенный водный раствор хлорида аммония и дают смеси нагреться до комнатной температуры. Тетрагидрофуран удаляют при пониженном давлении и полученный остаток экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле и получают указанное в названии соединение (8,28 г). Справочный пример 2 Синтез 2,2-бис(4-фторфенил)уксусной кислоты
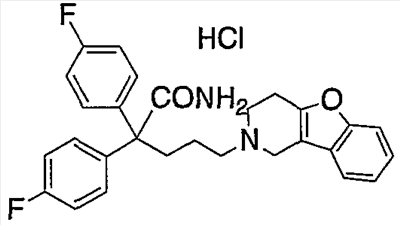
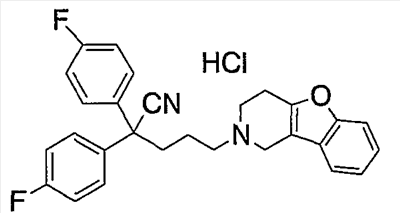
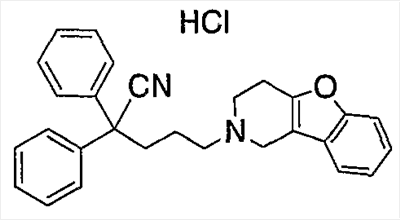
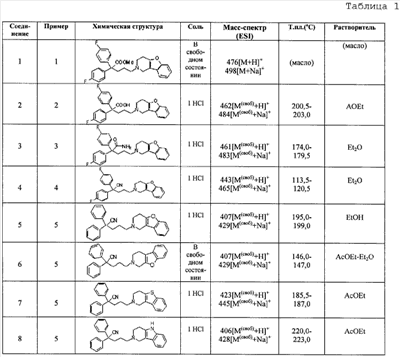
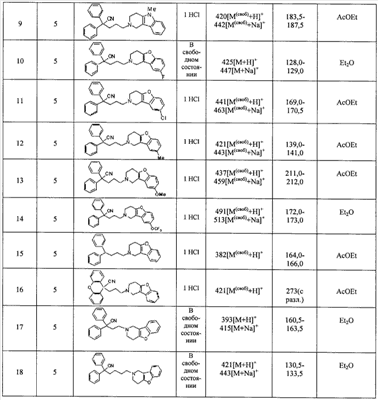
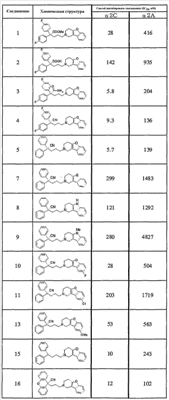
К концентрированной серной кислоте (440 мл) на бане со льдом медленно добавляют бис(4-фторфенил)метанол (10,97 г), полученный в справочном примере 1. К полученной смеси по каплям в течение 50 мин добавляют муравьиную кислоту (120 мл). Затем реакционной смеси дают нагреться до комнатной температуры, оставляют на 17 ч, выливают на лед (5 л) и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток растирают в гексане и получают целевое соединение (6,36 г). Справочный пример 3 Синтез метил 2,2-бис(4-фторфенил)-5-гидроксипентаноата (1) Концентрированную серную кислоту (1,5 мл) добавляют к 2,2-бис(4-фторфенил)уксусной кислоте (6,2 г; полученный по справочному примеру 2) в метаноле (60 мл) и перемешивают в течение 30 мин. Полученную смесь выливают на лед и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат сульфатом натрия, концентрируют при пониженном давлении и сушат, получая метил 2,2-бис(4-фторфенил)ацетат (6,53 г). (2) Тетрагидрофуран (3 мл) добавляют к гидриду натрия (0,60 г) и получают суспензию. К полученной суспензии при комнатной температуре при перемешивании добавляют по каплям метил-2,2-бис(4-фторфенил)ацетат (3,93 г; полученный выше на стадии (1)) в диметилсульфоксиде (15 мл). Затем к полученной смеси при комнатной температуре при перемешивании добавляют по каплям 2-(3-бромпропокси)тетрагидро-2Н-пиран (3,35 г) в диметилсульфоксиде (10 мл). Полученную смесь перемешивают в течение 1 ч. К реакционной смеси добавляют водный раствор хлорида аммония и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором соли, сушат сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле и получают метил 2,2-бис(4-фторфенил)-5-(2-тетрагидропиранилокси)пентаноат (4,45 г). (3) Метанол (25 мл) добавляют к метил 2,2-бис(4-фторфенил)-5-(2-тетрагидропиранилокси)пентаноату (4,04 г), полученному выше на стадии (2), и получают раствор, к которому добавляют п-толуолсульфоновую кислоту (0,50 г), затем смесь перемешивают в течение 3 ч. К полученной реакционной смеси добавляют насыщенный водный раствор гидрокарбоната натрия (5 мл), а затем упаривают смесь при пониженном давлении. К остатку добавляют воду (5 мл) и экстрагируют этилацетатом. Органический слой сушат сульфатом натрия и концентрируют при пониженном давлении, получая указанное в названии соединение (3,05 г). Пример 1 Синтез метил 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентаноата (соединение 1) (1) Тетрагидрофуран (20 мл) добавляют к метил 2,2-бис(4-фторфенил)-5-гидроксипентаноату (3,0 г), полученному в справочном примере 3, и получают раствор, к которому при перемешивании добавляют тетрабромид углерода (3,14 г). Полученную смесь перемешивают в течение 5 мин. Затем добавляют трифенилфосфин (2,48 г) и перемешивают в течение 30 мин. Реакционную смесь концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле и получают метил-2,2-бис(4-фторфенил)-5-бромпентаноат (2,46 г). (2) К метил-2,2-бис(4-фторфенил)-5-бромпентаноату (1,72 г), полученному выше на стадии (1), добавляют изопропанол (7 мл), диизопропилэтиламин (1,45 г) и гидрохлорид 1,2,3,4-тетрагидро-бензо[4,5]фуро[3,2-c]пиридина (0,94 г), а затем перемешивают при температуре 110°С в течение 15 ч. К полученной смеси добавляют насыщенный водный раствор гидрокарбоната натрия, а затем экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле и получают указанное в названии соединение (1,77 г). Получают спектр ЯМР синтезированного соединения. Получены следующие результаты. 1Н-ЯМР (300 МГц, CDCl3) d 7,42-7,39 (м, 1H) 7,34-7,31 (м, 1H) 7,26-7,18 (м, 6H) 7,02-6,95 (м, 4H) 3,69 (с, 3H) 3,49 (с, 2H) 2,82-2,79 (ушир.с, 4H) 2,58 (т, J = 7,15 Гц, 2H) 2,44-2,39 (м, 2H) 1,39-1,34 (м, 2H). Пример 2 Синтез гидрохлорида 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентановой кислоты (соединение 2) Концентрированную хлористоводородную кислоту (15 мл) добавляют к метил 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентаноату (1,0 г), полученному в примере 1, и полученную смесь перемешивают при температуре 150°С в течение 3,5 ч. Полученную смесь оставляют при комнатной температуре для охлаждения и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле и растворяют в метаноле (5 мл). К полученному раствору добавляют 4 моль/л раствора хлористого водорода в этилацетате (1,5 мл). Смесь перемешивают, а затем концентрируют при пониженном давлении. Полученный остаток кристаллизуют из этилацетата и таким образом получают указанное в названии соединение (0,18 г). Пример 3 Синтез гидрохлорида амида 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентановой кислоты (соединение 3) (1) Диметилформамид (2 мл) добавляют к гидрохлориду 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентановой кислоты (0,3 г), синтезированному в примере 2, и получают суспензию. К указанной суспензии добавляют 1-гидроксибензотриазол (0,15 г) и N-(3-диметиламинопропил)-N’-этилкарбодиимид (0,15 г). Смесь перемешают при комнатной температуре в течение 15 мин. Затем к смеси добавляют 28%-ный водный раствор аммиака и перемешивают еще в течение 1 ч. Реакционную смесь выливают в ледяную воду и выпавший осадок отделяют фильтрованием. Полученные сырые кристаллы очищают колоночной хроматографией на силикагеле и таким образом получают амид 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентановой кислоты (0,19 г). (2) Этилацетат (2 мл) добавляют к амиду 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентановой кислоты (0,06 г), полученному выше на стадии (1), чтобы приготовить раствор. К полученному раствору добавляют 4 моль/л раствора хлористого водорода в этилацетате (0,07 мл). Смесь перемешивают, а затем концентрируют при пониженном давлении. Полученный остаток кристаллизуют из диэтилового эфира и таким образом получают указанное в названии соединение (0,017 г). Пример 4 Синтез гидрохлорида 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентаннитрила (соединение 4) 1,4-Диоксан (2,5 мл) и пиридин (0,04 г) добавляют к амиду 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-бис(4-фторфенил)пентановой кислоты (0,1 г), полученному в примере 3. Смесь охлаждают до 0°С на бане со льдом и к ней по каплям при перемешивании добавляют трифторуксусный ангидрид (0,05 г). Затем смеси в течение 30 мин дают нагреться до комнатной температуры и перемешивают еще в течение 15 мин. Полученную реакционную смесь выливают в воду со льдом и экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли, сушат сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле и растворяют в этилацетате (3 мл), чтобы получить раствор. К нему добавляют 4 моль/л раствора хлористого водорода в этилацетате (0,1 мл), перемешивают и концентрируют при пониженном давлении. Полученный остаток кристаллизуют из диэтилового эфира и таким образом получают указанное в названии соединение (0,134 г). Пример 5 Синтез гидрохлорида 5-(3,4-дигидро[1]бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрила 5-Бром-2,2-дифенилпентаннитрил (1,08 г) и гидрохлорид 1,2,3,4-тетрагидробензо[4,5]фуро[3,2-c]пиридина (0,72 г) суспендируют в метаноле (1,72 мл). К полученной суспензии добавляют диизопропилэтиламин (1,11 г), а затем при перемешивании кипятят смесь с обратным холодильником в течение 40 ч. Реакционную смесь концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и растворяют в этаноле (5 мл), чтобы получить раствор. К полученному раствору добавляют 4 моль/л раствора хлористого водорода в этилацетате (0,73 мл), затем перемешивают и концентрируют при пониженном давлении. Полученный остаток кристаллизуют из этанола (4 мл) и таким образом получают указанное в названии соединение (0,85 г). Примеры 6-18 Соединения с 6 по 18 или их соли (см. таблицу 1 далее) получают аналогично методике, приведенной в примере 5. В частности, синтезируют следующие соединения. Соединение 6: 5-(3,4-дигидро[1]бензофуро[2,3-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил; Соединение 7: 5-(3,4-дигидро[1]бензотиено[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил (гидрохлорид); Соединение 8: 2,2-дифенил-5-(1,3,4,5-тетрагидро-2Н-пиридо[4,3-b]индол-2-ил)пентанитрил (гидрохлорид); Соединение 9: 5-(5-метил-1,3,4,5-тетрагидро-2Н-пиридо[4,3-b]индол-2-ил)-2,2-дифенилпентаннитрил (гидрохлорид); Соединение 10: 5-(8-фтор-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил; Соединение 11: 5-(8-хлор-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил (гидрохлорид); Соединение 12: 5-(8-метил-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил (гидрохлорид); Соединение 13: 5-(8-метокси-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилпентаннитрил (гидрохлорид); Соединение 14: 2,2-дифенил-5-(8-трифторметокси-3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)пентаннитрил (гидрохлорид); Соединение 15: 2-(4,4-дифенилбутил)-1,2,3,4-тетрагидро-[1]-бензофуро[3,2-c]пиридин (гидрохлорид); Соединение 16: 9-[3-(3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)пропил]-9Н-ксантенкарбонитрил (гидрохлорид); Соединение 17: 4-(3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилбутиронитрил; Соединение 18: 6-(3,4-дигидро-[1]-бензофуро[3,2-c]пиридин-2(1Н)-ил)-2,2-дифенилгексаннитрил. Структуры, физические свойства и т.п. соединений, полученных в отдельных примерах, приведены ниже в таблице 1. Пример испытаний 1. Эксперимент по связыванию (1) Эксперимент по связыванию Данный эксперимент проводят по улучшенной методике способа, приведенного в Uhlen et al., Journal of Pharmacology and Experimental Therapeutics (1994), 1558-1565. Если коротко, то клетки COS-1, экспрессирующие (1) Эксперимент по связыванию Данный эксперимент проводят по улучшенной методике способа, приведенного в Uhlen et al., Journal of Pharmacology and Experimental Therapeutics (1994), 1558-1565. Если коротко, то клетки COS-7, экспрессирующие Таблица 2 Как показано в таблицах 1 и 2, соединение по настоящему изобретению обладает высокоселективным ингибирующим действием на связывание Промышленная применимость Соединение по настоящему изобретению химически и фармакологически применимо в качестве нового соединения циклического амина, его сольвата или его фармацевтически приемлемой соли. Поскольку соединение по настоящему изобретению обладает ингибирующим действием, особенно против связывания
Формула изобретения
1. Соединение циклического амина, представленное следующей формулой (1), или его фармацевтически приемлемая соль 2. Соединение циклического амина или его фармацевтически приемлемая соль по п.1, 3. Соединение циклического амина или его фармацевтически приемлемая соль по п.1, 4. Соединение циклического амина или его фармацевтически приемлемая соль по п.1, 5. Соединение циклического амина или его фармацевтически приемлемая соль по п.1, 6. Ингибитор связывания 7. Фармацевтическая композиция, ингибирующая связывание
|
||||||||||||||||||||||||||

 2С-адренорецептора, что позволяет использовать их в фармацевтических композициях. 3 н. и 4 з.п. ф-лы, 2 табл.
2С-адренорецептора, что позволяет использовать их в фармацевтических композициях. 3 н. и 4 з.п. ф-лы, 2 табл.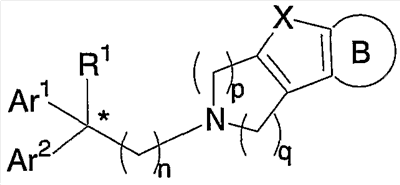
 С1-С12 алкильная группа
С1-С12 алкильная группа в данном описании означает алкильную группу с прямой или разветвленной цепью или циклическую алкильную группу, содержащую от 1 до 12 атомов углерода, и ее примеры включают метильную, этильную, пропильную, изопропильную, циклопропильную, бутильную, трет-бутильную, пентильную, неопентильную, гексильную, циклогексильную, гептильную, октильную, децильную и додецильную группы. Предпочтительными среди них являются С1-С6 алкильные группы (в частности, метильная, этильная и пропильная группы).
в данном описании означает алкильную группу с прямой или разветвленной цепью или циклическую алкильную группу, содержащую от 1 до 12 атомов углерода, и ее примеры включают метильную, этильную, пропильную, изопропильную, циклопропильную, бутильную, трет-бутильную, пентильную, неопентильную, гексильную, циклогексильную, гептильную, октильную, децильную и додецильную группы. Предпочтительными среди них являются С1-С6 алкильные группы (в частности, метильная, этильная и пропильная группы).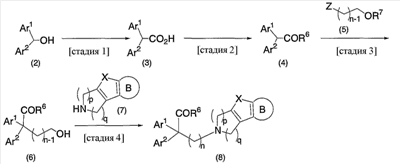

 -циклодекстрин, карбоксивиниловый полимер, легкий кремневый ангидрид, оксид титана, алюмометасиликат магния, полиэтиленгликоль и триглицерид жирной кислоты с углеродной цепью средней длины.
-циклодекстрин, карбоксивиниловый полимер, легкий кремневый ангидрид, оксид титана, алюмометасиликат магния, полиэтиленгликоль и триглицерид жирной кислоты с углеродной цепью средней длины.