|
|
(21), (22) Заявка: 2006139030/04, 04.04.2005
(24) Дата начала отсчета срока действия патента:
04.04.2005
(30) Конвенционный приоритет:
05.04.2004 EP 04075997.9
(43) Дата публикации заявки: 20.05.2008
(46) Опубликовано: 20.01.2010
(56) Список документов, цитированных в отчете о
поиске:
WO 0185685 А, 15.11.2001. SU 240566 A1, 01.01.1969. ANA MARTINEZ ET ALL, J. Med. Chem., 2002, 45, 1292-1299.
(85) Дата перевода заявки PCT на национальную фазу:
07.11.2006
(86) Заявка PCT:
EP 2005/003613 20050404
(87) Публикация PCT:
WO 2005/097117 20051020
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
МАРТИНЕС ГИЛ Ана (ES),
ДОРРОНСОРО ДИАС Исабель (ES),
АЛОНСО КАСКОН Мерседес (ES),
ПАНИСО ДЕЛЬ ПЛЬЕГО Гема (ES),
ФУЭРТЕС УЭРТА Ана (ES),
ПЕРЕС ПУЭРТО Мария Хосе (ES),
МЕДИНА ПАДИЛЛА Мигель (ES)
(73) Патентообладатель(и):
НОСКИРА, С.А. (ES)
|
(54) ИНГИБИТОРЫ GSK-3
(57) Реферат:
Настоящее изобретение относится к ингибиторам GSK-3 общей формулы (I), способу их получения и фармацевтическим композициям на их основе, которые можно использовать в медицине:
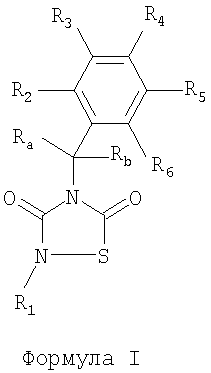
где R1 обозначает органическую группу, содержащую по меньшей мере 8 атомов, выбранных из С или О, включающую ароматическое кольцо фенила, нафтила или метилендиоксифенила, которая не связана непосредственно с N через -С(O)- или кислород; Ra, Rb, R2, R3, R4, R5 и R6 представляют собой водород. Технический результат – получение новых биологически активных соединений для лечения опосредуемых GSK-3 заболеваний. 5 н. и 23 з.п. ф-лы, 5 табл.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к ингибиторам ферментов и, в частности, к гетероциклическим ингибиторам гликогенсинтаз-киназы 3 , GSK-3, к способам получения таких соединений, к включающим их фармацевтическим композициям и к их применению для лечения и/или профилактики заболевания, в котором участвует GSK-3, таких как болезнь Альцгеймера или инсулиннезависимый сахарный диабет. , GSK-3, к способам получения таких соединений, к включающим их фармацевтическим композициям и к их применению для лечения и/или профилактики заболевания, в котором участвует GSK-3, таких как болезнь Альцгеймера или инсулиннезависимый сахарный диабет.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Поиску новых терапевтических средств значительно помогло в последние годы лучшее понимание структуры ферментов и других биомолекул, связанных с целевыми заболеваниями. Один важный класс ферментов, который был объектом обширного исследования, составляют протеинкиназы. Многие заболевания связаны с патологическими клеточными реакциями, вызванными опосредуемыми протеинкиназой событиями. Эти заболевания включают аутоиммунные заболевания, воспалительные заболевания, неврологические и нейродегенеративные заболевания, рак, сердечно-сосудистые заболевания, аллергии и астму, болезнь Альцгеймера или гормон-связанные заболевания. Соответственно, были приложены реальные усилия в области фармацевтической химии, чтобы найти ингибиторы протеинкиназы, которые являются эффективными как терапевтические средства.
Гликогенсинтаз-киназа 3 (GSK-3) представляет собой серин/треонин протеинкиназу, включающую изоформы  и и  , каждая из которых кодируется различными генами (Coghlan et al., Chemistry & Biology, 7, 793-803 (2000); Kim and Kimmel, Curr. Opinion Genetics Dev., 10, 508-514 (2000)). Треонин/серин киназа типа гликогенсинтаз-киназы 3 (GSK-3) выполняет центральную роль в различных связанных с рецептором сигнальных путях (Doble, BW, Woodgett, JRJ. Cell Sci. 2003, 116:1175-1186). Дисрегуляцию в пределах этих проводящих путей считают критическим событием в развитии некоторых распространенных нарушений в организме человека, таких как диабет типа II (Kaidanovich О, Eldar-Finkelman H, Expert Opin. Ther. Targets, 2002, 6:555-561), болезнь Альцгеймера (Grimes CA, Jope RS, Prog. Neurobiol. 2001,65:391-426), нарушения ЦНС, такие как маниакально-депрессивное нарушение и нейродегенеративные заболевания, и хронические воспалительные нарушения (Hoeflich KP, Luo J, Rubie EA, Tsao MS, Jin О, Woodgett J, Nature 2000,406:86-90). Эти заболевания могут быть вызваны аномальным функционированием сигнальных путей в некоторых клетках, в которых GSK-3 играет роль, или приводить к нему. , каждая из которых кодируется различными генами (Coghlan et al., Chemistry & Biology, 7, 793-803 (2000); Kim and Kimmel, Curr. Opinion Genetics Dev., 10, 508-514 (2000)). Треонин/серин киназа типа гликогенсинтаз-киназы 3 (GSK-3) выполняет центральную роль в различных связанных с рецептором сигнальных путях (Doble, BW, Woodgett, JRJ. Cell Sci. 2003, 116:1175-1186). Дисрегуляцию в пределах этих проводящих путей считают критическим событием в развитии некоторых распространенных нарушений в организме человека, таких как диабет типа II (Kaidanovich О, Eldar-Finkelman H, Expert Opin. Ther. Targets, 2002, 6:555-561), болезнь Альцгеймера (Grimes CA, Jope RS, Prog. Neurobiol. 2001,65:391-426), нарушения ЦНС, такие как маниакально-депрессивное нарушение и нейродегенеративные заболевания, и хронические воспалительные нарушения (Hoeflich KP, Luo J, Rubie EA, Tsao MS, Jin О, Woodgett J, Nature 2000,406:86-90). Эти заболевания могут быть вызваны аномальным функционированием сигнальных путей в некоторых клетках, в которых GSK-3 играет роль, или приводить к нему.
Было обнаружено, что GSK-3 фосфорилирует и модулирует активность множества регуляторных белков. Эти белки включают гликогенсинтазу, которая является ограничивающим ферментом, необходимым для синтеза гликогена, ассоциированный с микротрубочками белок Tau, фактор генной транскрипции  -катенин, фактор инициации трансляции e1F2B, а также АТФ-цитратлиаза, аксин, фактор теплового шока-1, c-Jun, c-Myc, c-Myb, CREB и CEPB -катенин, фактор инициации трансляции e1F2B, а также АТФ-цитратлиаза, аксин, фактор теплового шока-1, c-Jun, c-Myc, c-Myb, CREB и CEPB . Эти разнообразные белковые мишени вовлекают GSK-3 во многие аспекты клеточного метаболизма, пролиферации, дифференцировки и развития. . Эти разнообразные белковые мишени вовлекают GSK-3 во многие аспекты клеточного метаболизма, пролиферации, дифференцировки и развития.
В настоящее время, ингибирование GSK-3 может представлять жизнеспособную стратегию разработки новых лекарственных средств для лечения таких до сих пор неизлечимых заболеваний (Martinez A, Castro A, Dorronsoro I, Alonso M, Med. Res. Rev., 2002, 22:373-384) через мимикрию инсулина, дефосфорилирование tau и процессинг амилоидных белков или модуляцию транскрипции соответственно.
Среди большого разнообразия уже обнаруженных химических структур, ингибирующих GSK-3 (Dorronsoro, I; Castro, A; Martinez, A Exp Opin Ther Patents 2002, 12:1527-1536; Alonso, M. and Martinez, A. Current Medicinal Chemistry, 2004, 11, 753-761), 2,4-дизамещенный тиадиазолидинон (TDZD) представляют собой первые АТФ-неконкурентные ингибиторы GSK-3 (Martinez A, Alonso M, Castro A, Perez C, Moreno F, J Med Chem, 2002, 45:1292-1299; WO 01 85685 и US 2003/0195238). Эти соединения представляют большой интерес, так как они являются селективными и не демонстрируют ингибирования некоторых других киназ, таких как PKA, PKC, CK-2 и CDK1/циклин B. Однако тиадиазолидиноны имеют тенденцию реагировать с нуклеофилами, и это свойство может снизить их потенциал в качестве лекарственного средства.
Все еще существует потребность найти хорошие ингибиторы GSK-3, которые были бы и эффективными, и селективными, и обладали бы хорошими свойствами в плане использования в качестве лекарственных средств, то есть хорошими фармацевтическими свойствами, связанными с введением, распределением, метаболизмом и экскрецией.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используя в своих интересах некоторые из результатов молекулярного моделирования и теорий, авторы разработали и синтезировали второе поколение 2,4-дизамещенных тиадиазолидинонов (TDZD), которые являются очень устойчивыми против тиолсодержащих биологических молекул, таких как глутатион и БСА (бычий сывороточный альбумин). Неожиданным образом, эти соединения имеют также очень благоприятный лекарственный профиль, в частности пероральную биодоступность и способность проникать через гематоэнцефалический барьер.
В одном аспекте изобретение относится к соединениям общей формулы I:
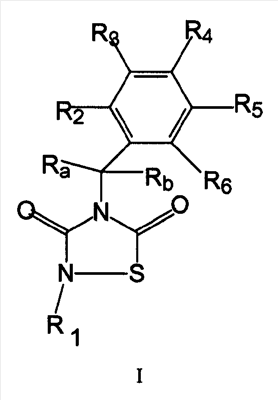
в которой:
R1 обозначает органическую группу, содержащую по меньшей мере 8 атомов, выбранных из C или О, которая не связана непосредственно с N через -C(O)- и включающую по меньшей мере ароматическое кольцо;
Ra, Rb, R2, R3, R4, R5, R6 независимо выбраны из водорода, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного арила, замещенного или незамещенного гетероциклила, -COR7, -C(O)OR7, -C(O)NR7R8-C=NR7, -CN, -OR7, -OC(O)R7, -S(O)t-R7, -NR7R8, -NR7C(О)R8, -NО2, -N=CR7R8 или галогена,
t=0, 1, 2 или 3,
R7 и R8, каждый независимо, выбраны из водорода, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного арила, замещенного или незамещенного гетероциклила, замещенного или незамещенного алкокси, замещенного или незамещенного арилокси, галогена;
причем Ra и Rb вместе могут образовывать группу =О, и причем любая из пар Ra R2, R2 R3, R3 R4, R4 R5, R5 R6, R6 Rb или R7 R8 может образовывать циклический заместитель;
или к их фармацевтически приемлемой соли, пролекарству или сольвату.
Авторы обнаружили, что соединения с бензилоподобной структурой в положении 4 и пространственно затрудненной группой, включающей ароматическое кольцо или ароматические кольца в положении 2 тиадиазолидинонов, оптимально взаимодействуют с ферментом GSK-3, в то же самое время обладая хорошими свойствами как лекарственные препараты.
Предпочтительными соединениями являются такие соединения, в которых R1 имеет ароматическую группу, содержащую по меньшей мере 10 ароматических атомов углерода. Эти соединения показывают хорошую активность, стабильность и уменьшенное связывание с белками плазмы, такими как глутатион и альбумин.
Также предпочтительными являются соединения, в которых R1 имеет ароматическую группу, непосредственно связанную с N тиадиазолидина.
В частных вариантах осуществления предпочтительны соединения, в которых R1 является нафтилом, более предпочтительно, если R1 является  -нафтилом. -нафтилом.
Другой предпочтительный класс соединений представляет такие соединения, в которых заместитель в положении 4 TDZD является незамещенной группой бензила.
В другом аспекте изобретение относится к фармацевтическим композициям, которые включают соединение согласно формуле (I) или его фармацевтически приемлемую соль, пролекарство или сольват, и фармацевтически приемлемую основу, адъювант или носитель. В предпочтительном варианте осуществления состав является пероральным.
Настоящее изобретение также относится к применению определенных выше соединений в получении лекарственного средства, предпочтительно для опосредованного GSK-3 заболевания или состояния.
Альтернативно, изобретение также относится к способу лечения опосредованного GSK-3 заболевания или состояния, включающему введение пациенту эффективного количества соединения формулы I, как определено выше, или его фармацевтически приемлемой соли, пролекарства или сольвата.
В другом аспекте изобретение относится к применению определенных выше соединений в качестве реагентов для биологических тестов, предпочтительно в качестве реагентов для ингибирования GSK-3.
В другом аспекте изобретение относится к способу получения соединения формулы I реакцией соответствующего бензилизотиоцианата с изоцианатом формулы R1-N=C=O.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Типичные соединения по изобретению селективно ингибируют GSK-3 , не ингибируя другие протеинкиназы, такие как PKA, PKC, CK-2 и CdK2, что могло бы обесценить их значение. Дополнительно они не связываются в существенной степени с модельными белками, такими как глутатион и бычий сывороточный альбумин, что является хорошим показателем относительно их стабильности в плазме. Они также показывают хорошую абсорбцию и способность проходить через гематоэнцефалический барьер, как демонстрируется в примерах. , не ингибируя другие протеинкиназы, такие как PKA, PKC, CK-2 и CdK2, что могло бы обесценить их значение. Дополнительно они не связываются в существенной степени с модельными белками, такими как глутатион и бычий сывороточный альбумин, что является хорошим показателем относительно их стабильности в плазме. Они также показывают хорошую абсорбцию и способность проходить через гематоэнцефалический барьер, как демонстрируется в примерах.
В вышеприведенном определении соединений формулы (I) следующие термины имеют указанные ниже значения.
“Алкил” относится к прямой или разветвленной углеводородной цепи, состоящей из атомов углерода и водорода, не содержащей ненасыщенных связей, содержащей один-восемь атомов углерода, и которая присоединена к остальной части молекулы простой связью, например метил, этил, н-пропил, изопропил, н-бутил, трет.-бутил, н-пентил и т.д. Алкильные радикалы могут быть замещены одним или более заместителями, такими как галоген, гидрокси, алкокси, карбокси, циано, карбонил, ацил, алкоксикарбонил, амино, нитро, меркапто и алкилтио.
“Алкокси” относится к радикалу формулы -ORa, где Ra обозначает алкил, как определено выше, например метокси, этокси, пропокси и т.д.
“Алкоксикарбонил” относится к радикалу формулы -C(O)ORa, где Ra обозначает алкил, как определено выше, например метоксикарбонил, этоксикарбонил, пропоксикарбонил и т.д.
“Алкилтио” относится к радикалу формулы -SRa, где Ra обозначает алкил, как определено выше, например метилтио, этилтио, пропилтио и т.д.
“Амино” относится к радикалу формулы -NH2, -NHRa или -NRaRb, где Ra и Rb имеют определенные выше значения.
“Арил” относится к фенилу, нафтилу, иденилу, фенантрилу или антрацилу, предпочтительно, к нафтилу или фенилу. Арил может быть замещен одним или более заместителями, такими как гидрокси, меркапто, галоген, алкил, фенил, алкокси, галогеналкил, нитро, циано, диалкиламино, аминоалкил, ацил и алкоксикарбонил, как определено в настоящем описании.
“Аралкил” относится к арильной группе, связанной с алкильной группой. Предпочтительные примеры включают бензил и фенетил.
“Ацил” относится к радикалу формулы -C(O)-Rc и -C(O)-Rd, где Rc обозначает алкил, такой как определенный выше, и Rd обозначает арил, как определено выше, например ацетил, пропионил, бензоил и т.п.
“Арилалкил” относится к алкилу, замещенному -Ra-C(O)-Rd, где Ra обозначает алкил. Предпочтительные примеры включают бензоилметил.
“Карбокси” относится к радикалу формулы -C(O)ОН.
“Циклоалкил” относится к стабильному 3-10-членному моноциклическому или бициклическому радикалу, который является насыщенным или частично насыщенным и который состоит исключительно из атомов углерода и водорода. Если не указано иное, термин “циклоалкил” включает циклоалкильные радикалы, которые могут быть замещены одним или более заместителей, таких как алкил, галоген, гидрокси, амино, циано, нитро, алкокси, карбокси и алкоксикарбонил.
“Конденсированный арил” относится к арилу, особенно фенилу или гетероарилу, конденсированному с другим кольцом.
“Галоген” относится к брому, хлору, йоду или фтору.
“Галогеналкил” относится к алкилу, как определено выше, который замещен одним или более галогенами, как определено выше, например трифторметил, трихлорметил, 2,2,2-трифторэтил, 1-фторметил-2-фторэитл и т.п.
“Гетероцикл” относится к гетероциклилу. Гетероцикл относится к стабильному 3-15-членному кольцу, которое состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, предпочтительно, к 4-8-членному кольцу с одним или более гетероатомами, более предпочтительно, к 5- или 6-членному кольцу с одним или более гетероатомами. В рамках изобретения, гетероцикл может быть моноциклической, бициклической или трициклической кольцевой системой, которая может включать конденсированные кольцевые системы; и атомы азота, углерода или серы в гетероциклиле могут быть окислены; атом азота может быть кватернизован; и гетероциклил может быть частично или полностью насыщенным или ароматическим. Примеры таких гетероциклов включают, но не ограничены ими, азепины, бензимидазол, бензотиазол, фуран, изотиазол, имидазол, индол, пиперидин, пиперазин, пурин, хинолин, тиадиазол, тетрагидрофуран.
Приведенные здесь ссылки на замещенные группы в соединениях согласно изобретению относятся к указанной группе, которая может быть замещена в одном или более доступных положениях одной или более подходящими группами, например галогеном, таким как фтор, хлор, бром и йод; циано; гидроксилом; нитро; азидо; алканоилом, таким как С1-6-алканоил, такой как ацил и т.п.; карбоксамидо; алкил, включая группы, имеющие от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода и более предпочтительно 1-3 атома углерода; алкенил и алкинил, включая группы, имеющие одну или более ненасыщенных связей и от 2 до приблизительно 12 атомов углерода или от 2 до приблизительно 6 атомов углерода; алкокси-группы, имеющие один или более кислородных мостиков и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; арилокси, такой как фенокси; алкилтио, включая группы, имеющие одну или более тиоэфирных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; алкилсульфинил, включая группы, имеющие одну или более сульфинильных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; алкилсульфонил, включая группы, имеющие одну или более сульфонильных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; аминоалкильные группы, такие как группы, имеющие один или более атомов N и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; карбоциклический арил, имеющий 6 или более атомов углерода, особенно фенил или нафтил, и аралкил, такой как бензил. Если не указано иное, в случае необходимости замещенная группа может иметь заместитель в каждом возможном для замещения положении группы, и каждое замещение является независимым от другого.
Если не указано иное, соединения по изобретению также включают соединения, которые отличаются только присутствием одного или более изотопически обогащенных атомов. Например, соединения, имеющие структуры по изобретению за исключением замены водорода дейтерием или тритием или замены углерода 13C- или 14С-обогащенным углеродом или 15N-обогащенным азотом, входят в рамки изобретения.
Термин “фармацевтически приемлемые соли, производные, сольваты, пролекарства” относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату или любому другому соединению, которое, при введение реципиенту может образовывать соединение, как описано здесь. Однако следует иметь в виду, что нефармацевтически приемлемые соли также попадают в рамки изобретения, так как они могут быть полезными в получении фармацевтически приемлемых солей. Получение солей, пролекарств и производных может быть осуществлено способами, известными в уровне техники.
Например, фармацевтически приемлемые соли соединений по изобретению синтезируют из исходного соединения, которое содержит основную или кислотную группу, обычными химическими способами. Вообще, такие соли, например, получают, вводя в реакцию свободные кислотные или основные формы этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в их смеси. Вообще, предпочтительны неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Примеры солей присоединения с кислотой включают соли присоединения с неорганической кислотой, такие как, например, гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат, и соли присоединения с органической кислотой, такие как, например, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метилсульфонат и п-толуолсульфонат. Примеры солей присоединения с основанием включают неорганические соли, такие как, например, соли натрия, калия, кальция, аммония, магния, алюминия и лития, и органические соли щелочного металла, такие как, например, этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин, глюкамин и соли основных аминокислот.
Особенно предпочтительными производными или пролекарствами являются такие, которые увеличивают биодоступность соединений по изобретению при введении таких соединений пациенту (например, позволяя перорально вводимому соединению быстрее абсорбироваться в кровь) или которые усиливают доставку исходного соединения в биологический компартемент (например, в мозг или лимфатическую систему) по сравнению с исходными разновидностями.
Любое соединение, которое является пролекарством соединения формулы (I), находится в рамках изобретения. Термин “пролекарство” используется в его самом широком смысле и охватывает производные, которые in vivo превращаются в соединения по изобретению. Такие производные легко определяются специалистом и включают, в зависимости от функциональных групп, имеющихся в молекуле и без ограничения, следующие производные соединений по изобретению: сложные эфиры, сложные эфиры аминокислоты, фосфатные сложные эфиры, сульфонаты солей металлов, карбаматы и амиды. Примеры известных способов получения пролекарства данного действующего соединения известны специалисту и могут быть найдены, например, в Krogsgaard-Larsen et al. “Textbook of Drugdesign and Discovery” Taylor & Francis (april 2002).
Соединения по изобретению могут находиться в кристаллической форме как свободные соединения или как сольваты (например, гидраты), и обе формы входят в рамки настоящего изобретения. Способы сольватирования являются общеизвестными из уровня техники.
Подходящими сольватами являются фармацевтически приемлемые сольваты. В частном варианте осуществления сольват представляет собой гидрат.
Соединения формулы (I), или их соли, или сольваты находятся предпочтительно в фармацевтически приемлемой или в основном чистой форме. Фармацевтически приемлемой формой считается, среди прочего, форма, имеющая фармацевтически приемлемый уровень чистоты, исключая обычные фармацевтические добавки, такие как разбавители и носители, и не включающая какого-либо материала, который считается токсичным в обычных дозах. Уровни чистоты для вещества лекарственного средства – предпочтительно выше 50%, более предпочтительно выше 70%, наиболее предпочтительно выше 90%. В предпочтительном варианте осуществления он составляет более 95% в отношении соединения формулы (I) или ее солей, сольватов или пролекарств.
Соединения согласно изобретению, представленные вышеописанной формулой (I), могут включать энантиомеры, зависящие от наличия хиральных центров, или изомеры, зависящие от наличия множественных связей (например, Z, E). Индивидуальные изомеры, энантиомеры или диастереоизомеры и их смеси находятся в рамках настоящего изобретения.
Авторы обнаружили, что соединения формулы I являются селективными ингибиторами GSK-3 (они не показывают ингибирование других киназ), и дополнительно они представляют хорошие фармакологические свойства, которые делают их подходящими для получения лекарственного средства. Действительно, через адекватный выбор размера и химических характеристик заместителей на кольце TDZD авторы получили соединения, которые являются очень устойчивыми против молекул плазмы, таких как глутатион и БСА, и показывают хорошую пероральную биодоступность и способность проходить через гематоэнцефалический барьер.
R1 включает ароматическую группу, это улучшает свойства стабильности. В одном варианте осуществления R1 имеет по меньшей мере 10 ароматических атомов углерода. Альтернативно, хорошие соединения получены с группами-донорами электронов на ароматическом кольце, такими как алкоксил или метилендиокси.
Хотя R1 может быть связан с TDZD через любые группы, при условии, что он не обозначает -C(O)- (из-за разложения и низкой стабильности в плазме), предпочтительно, если ароматический радикал непосредственно связан с атомом N TDZD.
Примерами заместителей, которые могут использоваться как R1, являются следующие:
Очень хорошие результаты стабильности и биодоступности in vivo были получены с пространственно затрудненным ароматическим радикалом, таким как нафтил. В частности, альфа-нафтил дал хорошие результаты. Когда R1 обозначает альфа-нафтил, он предпочтительно является незамещенным альфа-нафтилом.
Относительно заместителя в положении 4 TDZD, предпочтительно, Ra и Rb обозначают Н.
В другом варианте осуществления предпочтительно, если R2, R3, R4, R5, R6 независимо выбраны из водорода, замещенного или незамещенного алкила, COR7, -C(O)OR7, -OR7, -NR7R8 или галогена.
Наиболее предпочтительно, заместитель в положении 4 обозначает незамещенный бензил. Примерами соединений по изобретению являются следующие соединения:
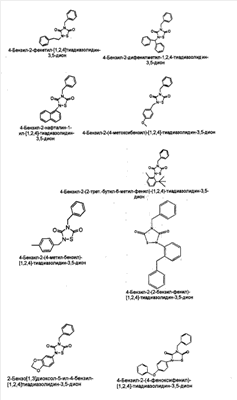
и их соли, пролекарства и сольваты.
Соединения формулы (I), определенной выше, могут быть получены в соответствии с доступными процедурами синтеза. Некоторые примеры этих процедур описаны в WO 01/85685 и US 2003/0195238 и приведенных в них ссылках. Содержание этих документов полностью включено в настоящее описание путем ссылки.
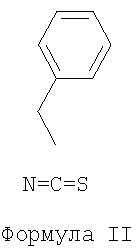
Поэтому в другом аспекте изобретение относится к способу получения соединения формулы (I) или его соли или сольвата, как заявлено в любом из пунктов 1-11 формулы изобретения, который включает введение в реакцию бензил-замещенного изотиоцианата формулы
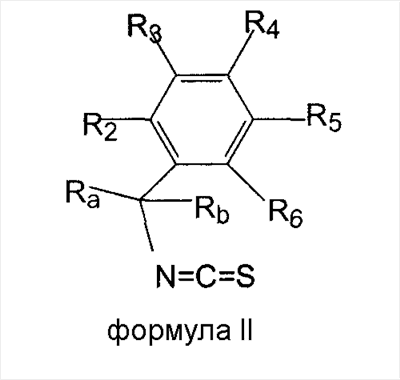
с соединением формулы R1-N=C=O.
Например, следующая процедура может использоваться для получения 4-N-бензил-замещенных тиадиазолидинонов:
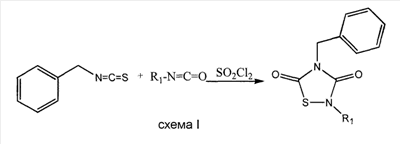
Общая экспериментальная процедура согласно Схеме 1 описана, например, в Slomczynska, U.; Barany, G., “Efficient Synthesis of 1,2,4-Dithiazolidine-3,5-diones (Dithiasuccinoyl-amines) and observation on formation of 1,2,4-Thiadiazolidine-3,5-dione by related Chemistry”, J. Heterocyclic Chem., 1984, 21, 241-246.
Например, сульфурилхлорид добавляют по каплям при перемешивании, в атмосфере азота, предпочтительно, при низкой температуре, предпочтительно, при приблизительно 5°C, к раствору бензилизотиоцианата и изоцианата, обозначенного в каждом случае, в подходящем растворителе, таком как гексан, простой эфир или ТГФ. По завершении добавления, смесь оставляют для реакции, например, при перемешивании в течение 20 часов при комнатной температуре. После этого времени, полученный продукт выделяют обычными способами, такими как фильтрация с отсасыванием или выпаривание растворителя, и затем осуществляют очистку (например, перекристаллизацией или хроматографией на колонках с силикагелем, используя подходящий элюент).
Другие альтернативные процедуры будут очевидны для специалиста, например использование любого другого хлорирующего средства вместо сульфурилхлорида, изменения в порядке добавления реагентов и условиях реакции (растворители, температура и т.д.).
Продукты реакции, если требуется, могут быть очищены обычными способами, такими как кристаллизация, хроматография и измельчение.
Одной предпочтительной фармацевтически приемлемой формой является кристаллическая форма, включая такую форму в составе фармацевтической композиции. В случае солей и сольватов, дополнительные ионные и растворяющие компоненты должны также быть нетоксичными. Соединения по изобретению могут представлять различные полиморфные формы, и изобретение охватывает все такие формы.
Другой аспект настоящего изобретения относится к способу лечения или профилактики опосредуемого GSK-3 заболевания с помощью ингибитора GSK-3, как описано выше, включающему введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтической композиции.
Термины “опосредуемое GSK-3 заболевание или “опосредуемое GSK-3 состояние” в рамках изобретения означают любое заболевание или другое вредное состояние или статус, в котором GSK-3 играет известную роль. Такие заболевания или состояния включают, без ограничения, диабет, состояния, связанные с диабетом, хронические нейродегенеративные состояния, включая деменции, такие как болезнь Альцгеймера, болезнь Паркинсона, прогрессирующий надъядерный паралич, подострый склерозирующий панэнцефалитный паркинсонизм, постэнцефалитный паркинсонизм, боксерский энцефалит, комплекс острова Гуам, болезнь Пика, кортикобазальная дегенерация, лобно-височная деменция, болезнь Гентингтона, СПИД-деменция, боковой амиотрофический склероз, рассеянный склероз и нейротравматические заболевания, такие как острый инсульт, эпилепсия, нарушения настроения, такие как депрессия, шизофрения и биполярные нарушения, поддержка функционального восстановления после инсульта, мозговое кровотечение (например, вследствие солитарной церебральной амилоидной ангиопатии), выпадение волос, ожирение, атеросклеротическое сердечно-сосудистое заболевание, артериальная гипертензия, поликистозный синдром яичника, синдром X, ишемия, повреждение головного мозга, особенно травматическое повреждение головного мозга, рак, лейкопения, синдром Дауна, заболевание с тельцами Леви, воспаление, хронические воспалительные заболевания, рак и гиперпролиферативные заболевания, такие как гиперплазии, и иммунодефицит. или “опосредуемое GSK-3 состояние” в рамках изобретения означают любое заболевание или другое вредное состояние или статус, в котором GSK-3 играет известную роль. Такие заболевания или состояния включают, без ограничения, диабет, состояния, связанные с диабетом, хронические нейродегенеративные состояния, включая деменции, такие как болезнь Альцгеймера, болезнь Паркинсона, прогрессирующий надъядерный паралич, подострый склерозирующий панэнцефалитный паркинсонизм, постэнцефалитный паркинсонизм, боксерский энцефалит, комплекс острова Гуам, болезнь Пика, кортикобазальная дегенерация, лобно-височная деменция, болезнь Гентингтона, СПИД-деменция, боковой амиотрофический склероз, рассеянный склероз и нейротравматические заболевания, такие как острый инсульт, эпилепсия, нарушения настроения, такие как депрессия, шизофрения и биполярные нарушения, поддержка функционального восстановления после инсульта, мозговое кровотечение (например, вследствие солитарной церебральной амилоидной ангиопатии), выпадение волос, ожирение, атеросклеротическое сердечно-сосудистое заболевание, артериальная гипертензия, поликистозный синдром яичника, синдром X, ишемия, повреждение головного мозга, особенно травматическое повреждение головного мозга, рак, лейкопения, синдром Дауна, заболевание с тельцами Леви, воспаление, хронические воспалительные заболевания, рак и гиперпролиферативные заболевания, такие как гиперплазии, и иммунодефицит.
В частном варианте осуществления изобретения соединения формулы (I) или их фармацевтические композиции, например, в пероральной форме используют для лечения Болезни Альцгеймера.
В другом варианте осуществления изобретения соединения формулы (I) или их фармацевтические композиции, например, в пероральной форме используют для лечения диабета.
В другом варианте осуществления изобретения соединения формулы (I) или их фармацевтические композиции, например, в пероральной форме используют для лечения депрессии.
В другом варианте осуществления изобретения соединения формулы (I) или их фармацевтические композиции, например, в пероральной форме используют для лечения повреждения головного мозга.
Настоящее изобретение также относится к фармацевтическим композициям, включающим соединение по изобретению, его фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры с фармацевтически приемлемой основой, адъювантом или носителем, для введения пациенту.
Примеры фармацевтических композиций включают любые твердые (таблетки, пилюли, капсулы, гранулы и т.д.) или жидкие (растворы, суспензии или эмульсии) композиции для перорального, топического или парентерального введения.
В предпочтительном варианте осуществления фармацевтические композиции находятся в пероральной форме. Подходящие лекарственные формы для перорального введения могут быть таблетками и капсулами и могут содержать обычные эксципиенты, известные в данной области, такие как связующие вещества, например сироп, гуммиарабик, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактоза, сахар, маисовый крахмал, фосфат кальция, сорбит или глицин; лубриканты для таблетирования, например стеарат магния; дезинтеграторы, например крахмал, поливинилпирролидон, гликолят крахмала натрия или микрокристаллическая целлюлоза; или фармацевтически приемлемые смачивающие вещества, такие как лаурилсульфат натрия.
Твердые пероральные композиции могут быть получены обычными способами смешивания, наполнения или таблетирования. Повторные операции смешивания могут использоваться, чтобы распределить активное средство по всей композиции с использованием больших количеств наполнителей. Такие операции обычны в данной области техники. Таблетки могут, например, быть получены влажной или сухой грануляцией, и, в случае необходимости, на них может быть нанесено покрытие согласно способам, известным в обычной фармацевтической практике, в особенности с энтеросолюбильным покрытием.
Фармацевтические композиции могут также быть адаптированы для парентерального введения, например, в виде стерильных растворов, суспензий или лиофилизированных продуктов в подходящей форме разовой дозы. Могут использоваться подходящие эксципиенты, такие как наполнители, буферы или поверхностно-активные вещества.
Указанные составы получают, используя стандартные методы, такие как описанные или упомянутые в Испанской и Американской Фармакопеях и подобных источниках.
Введение соединений или композиций по изобретению может быть осуществлено любым подходящим способом, таким как внутривенная инфузия, пероральные препараты и внутрибрюшинное и внутривенное введение. Пероральное введение является предпочтительным из-за удобства для пациента и хронического характера многих из заболеваний, которые подлежат лечению согласно изобретению.
Обычно эффективное вводимое количество соединения по изобретению зависит от относительной эффективности выбранного соединения, серьезности нарушения и массы тела пациента. Однако активные соединения обычно вводят один или более раз в день, например 1, 2, 3 или 4 раза в день, с типичными полными суточными дозами в диапазоне от 0,1 до 1000 мг/кг/день.
Соединения и композиции согласно изобретению могут использоваться с другими препаратами, чтобы обеспечить комбинированную терапию. Другие препараты могут являться частью той же самой композиции или иметь форму отдельной композиции для введения в то же самое время или в другое время.
В другом аспекте изобретение относится к ингибированию активности GSK-3 в биологическом образце с помощью соединений формулы (I), причем указанный способ включает введение в контакт биологического образца с ингибитором GSK-3 формулы (I). Термин “биологический образец”, в рамках изобретения, включает, без ограничения, клеточные культуры или их экстракты; препараты фермента, подходящего для анализа in vitro; материал биопсии, полученный от млекопитающего, или его экстракты; и кровь, слюна, моча, кал, сперма, слезы или другие жидкости организма или их экстракты. Таким образом, в одном аспекте изобретение относится к применению соединений формулы I в качестве реагентов для биологических проб, в особенности в качестве реагентов для ингибирования GSK-3.
Следующие примеры предназначены для дальнейшей иллюстрации изобретения. Они не должны интерпретироваться как ограничение объема изобретения, определенного формулой изобретения.
ПРИМЕРЫ
Синтез соединений
Общая экспериментальная процедура
Сульфурилхлорид добавляли по каплям при перемешивании, в атмосфере азота, при 5°C к раствору бензилизотиоцианата и изоцианата, обозначенного в каждом случае, в гексане, простом эфире или ТГФ. По завершении добавления, смесь перемешивали в течение 20 часов при комнатной температуре. После этого времени, полученный продукт выделяли фильтрацией с отсасыванием или выпариванием растворителя и затем осуществляли очистку перекристаллизацией или хроматографией на колонках с силикагелем, используя подходящий элюент. Более подробное описание может быть найдено в Slomczynska, U.; Barany, G., “Efficient Synthesis of 1,2,4-Dithiazolidine-3,5-diones (Dithiasuccinoyl-amines) and observation on formation of 1,2,4-Thiadiazolidine-3,5-dione by related Chemistry”, J. Heterocyclic Chem., 1984, 21, 241-246.
Пример 1
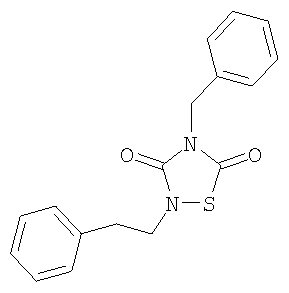
2-Фенетил-4-бензил-(1,2,4)-тиадиазолидин-3,5-дион(1)
Реагенты: Бензил-изотиоцианат (6,5 ммоль, 0,85 мл), фенетилизоцианат (6,5 ммоль, 0,89 мл) и SО2Cl2 (6,5 ммоль, 0,52 мл) в диэтиловом эфире (25 мл). Выделение: выпаривание растворителя. Очистка: хроматография на колонках с силикагелем (AcOEt/ гексан, 1:4).
Выход: 1,5 г (74%), желтое масло.
1H-ЯМР (CDCl3): 2,9 (т, 2H, CH2CH2Ph, J=7,2 Гц); 3,9 (т, 2H, CH2CH2Ph, J=7,2 Гц); 4,8 (с, 2H, CH2Ph); 7,2-7,4 (м, 10Н, аром)
13C-ЯМР (CDCl3): 34,9 (CH2CH2Ph); 4,9 (CH2CH2Ph); 46,2 (CH2Ph); 126,9; 128,5; 128,6; 136,6 (C аром CH2Ph); 128,1; 128,6; 128,6; 135,0 (C аром CH2CH2Ph); 152,6 (3-C=O); 165,6 (5-C=O)
Анал. (C17H16N2О2S), C, Н, N, S.
Пример 2
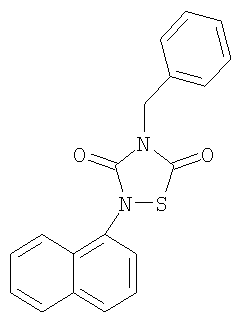
4-Бензил-2-нафталин-1-ил-[1,2,4]-тиадиазолидин-3,5-дион (2)
Реагенты: Бензил-изотиоцианат (13 ммоль, 1,72 мл), 1-нафтил изоцианат (13 ммоль, 1,9 мл) и SО2Cl2 (13 ммоль, 1,04 мл) в гексане (50 мл). Выделение: фильтрация реакционной смеси. Очистка: перекристаллизация из EtOH.
Выход: 3,8 г (87%), белые иглы. Т.пл=150°C.
1H-ЯМР (CDCl3): 4,9 (с, 2H, CH2Ph); 7,3-7,9 (м, 12Н, аром)
13C-ЯМР (CDCl3): 46,5 (CH2Ph); 128,3; 128,6; 129,0; 135,0 (C аром, Ph); 122,0; 125,3; 126,8; 127,2; 127,5; 128,5; 130,8; 134,4 (C аром, нафтил); 152,2 (3-C=O); 165,9 (5-C=O)
Анал. (C19H14N2О2S), C, Н, N, S.
Пример 3 (сравнительный)
2-(1-адамантил)-4-бензил-[1,2,4]-тиадиазолидин-3,5-дион (3)
Реагенты: Бензилизотиоцианат (6,5 ммоль, 0,85 мл), 1-адамантил изоцианат (6,5 ммоль, 1,15 г) и SO2Cl2 (6,5 ммоль, 0,52 мл) в диэтиловом эфире (25 мл). Выделение: выпаривание растворителя. Очистка: хроматография на колонках с силикагелем (AcOEt/гексан, 1:4).
Выход: 0,89 г (40%), желтые кристаллы. Т.пл.=128,8°C.
1Н-ЯМР (CDCl3): 1,7 (м, 6H, адамантил); 2,2 (м, 3H, адамантил); 2,3 (м, 6H, адамантил); 4,8 (с, 2H, CH2Ph); 7,2-7,4 (м, 5H, аром)
13C-ЯМР (CDCl3): 29,9; 30,0; 35,9; 41,0; 60,0 (C адамантил); 45,3 (CH2Ph); 127,8; 128,5; 128,6; 135,4 (C аром)
Анал. (C19H22N2О2S), C, Н, N, S.
Пример 4
4-Бензил-2-(4-метилбензил)-[1,2,4]-тиадиазолидин-3,5-дион (4)
Реагенты: Бензилизотиоцианат (6,5 ммоль, 0,85 мл), 4-метилбензил-изоцианат (6,5 ммоль, 0,90 мл) и SО2Cl2 (6,5 ммоль, 0,52 мл) в диэтиловом эфире (25 мл). Выделение: фильтрация реакционной смеси. Очистка: перекристаллизация из MeOH.
Выход: 0,95 г (48%), твердое вещество белого цвета. Т.пл.=69,1°C.
1Н-ЯМР (CDCl3): 2,4 (с, 3H, CH3); 4,7 (с, 2H, CH2-Ph); 4,8 (2H, с, CH2-Ph); 7,2 (с, 4H, аром); 7,2-7,5 (м, 5H, аром).
13C-ЯМР (CDCl3): 21,3 (CH3); 45,9 (CH2Ph); 48,5 (CH2Ph); 128,1; 128,6; 128,7; 135,0 (C аром); 128,4; 129,5; 131,1; 138,6 (C аром); 152,8 (3-C=O); 165,7 (5-C=O)
Анал. (C17H16N2О2S), C, Н, N, S.
Пример 5
4-бензил-2-((3,4-метилендиокси)фенил)-[1,2,4]-тиадиазолидин-3,5-дион (5)
Реагенты: Бензилизотиоцианат (6,5 ммоль, 0,85 мл), 3,4-(метилендиокси)фенилизоцианат (6,5 ммоль, 1,06 мл) и SО2Cl2 (6,5 ммоль, 0,52 мл) в диэтиловом эфире (25 мл). Выделение: фильтрация реакционной смеси. Очистка: перекристаллизация из MeOH.
Выход: 1,4 г (66%), твердое вещество белого цвета. Т.пл=126,5°C.
1Н-ЯМР (CDCl3): 4,9 (с, 2H, CH2Ph); 6,0 (с, 2H, O-CH2-O); 6,7-7,0 (м, 3H, аром); 7,3-7,5 (м, 5H, аром)
13C-ЯМР (CDCl3): 46,2 (CH2Ph); 128,2; 128,6; 129,0; 134,9 (C аром); 101,8 (О-CH2-О); 106,4; 108,3; 118,2; 129,0; 148,1; 146,8 (C аром); 151,2 (3-C=O); 164,9 (5-C=O)
Анал. (C16H12N2О4S), C, Н, N, S.
Пример 6
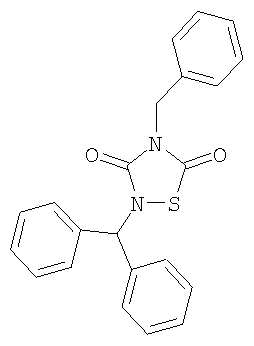
4-Бензил-2-дифенилметил-1,2,4-тиадиазолидин-3,5-дион (6)
Реагенты: Бензилизотиоцианат (6,5 ммоль, 0,85 мл), дифенилметилизоцианат (6,5 ммоль, 1,23 мл) и SО2Cl2 (6,5 ммоль, 0,52 мл) в диэтиловом эфире (25 мл). Выделение: фильтрация реакционной смеси. Очистка: перекристаллизация из MeOH.
Выход: 1,79 г (80%), твердое вещество белого цвета Т.пл=111,5°C.
1Н-ЯМР (CDCl3): 4,85 (с, 2H, CH2Ph); 6,8 (с, 1H, Ph-CH-Ph); 7,2-7,4 (м, 15 Н, аром)
C-ЯМР (CDCl3): 45,9 (CH2Ph); 61,6 (Ph-CH-Ph); 128,0; 128,6; 128,7; 135,0 (C аром); 128,1; 128,5; 128,5; 137,5 (2xPh); 152,6 (3-C=O); 165,8 (5-C=O)
Анал. (C22H18N2О2S), C, Н, N, S.
Пример 7
4-Бензил-2-(4-метоксибензил)-[1,2,4]-тиадиазолидин-3,5-дион (7)
Реагенты: Бензилизотиоцианат (6,5 ммоль, 0,85 мл), п-метоксибензил-изоцианат (6,5 ммоль, 0,92 мл) и SО2Cl2 (6,5 ммоль, 0,52 мл) в диэтиловом эфире (25 мл). Выделение: выпаривание растворителя. Очистка: хроматография на колонках с силикагелем (AcOEt/гексан, 1:4).
Выход: 1,30 г (61%), твердое вещество желтоватого цвета, Т.пл=86,4°C.
1Н-ЯМР (CDCl3): 3,8 (с, 3H, CH3); 4,7 (с, 2H, CH2-Ph-OMe); 4,8 (с, CH2-Ph); 7,2-7,4 (м, 5H, аром); 6,8 (д, 2H, J=8,6 Гц); 7,2 (д, 2H, J=8,6 Гц) (аром)
13C-ЯМР (CDCl3): 45,9 (CH2-Ph); 48,2 (CH2-Ph-OMe); 55,2 (O-CH3); 128,0; 129,8; 128,4; 135,0 (C аром-Ph); 126,2; 128,5; 114,2; 159,7 (C аром Ph-OMe); 152,7 (3-C=O); 165,6 (5-C=O)
Анал. (C17H13N2О3S), C, Н, N, S.
Пример 8
4-Бензил-2-(2-трет.-бутил-6-метил-фенил)-(1,2,4)-тиадиазолидин-3,5-дион (8)
Реагенты: Бензилизотиоцианат (3,5 ммоль, 0,45 мл), 2-трет.-бутил-6-метилизоцианат (3,5 ммоль, 662,5 мг) и SО2Cl2 (3,5 ммоль, 0,25 мл) в диэтиловом эфире (15 мл). Выделение: выпаривание растворителя. Очистка: хроматография на колонках с силикагелем (AcOEt/гексан, 1:10). Выход: 0,17 г (14%), твердое вещество коричневого цвета. Т.пл.=89,8°C.
1Н-ЯМР (CDCl3): 1,4 (с, 9H, C(CH3)3); 2,1 (с, 3H, CH3); 4,9 (2д, 2H, CH2-Ph, J=6,3 гц); 7,1-7,5 (м, 8H, aрoм)
13C-ЯМР (CDCl3): 17,8 (CH3); 31,9 (C(CH3)); 35,9 (C(CH3)); 46,2 (CH2-Ph); 126,1; 128,6; 128,5; 135,1 (C аром-Bn); 131,5; 150,4; 139,4; 128,1; 129,5; 129,9 (C аром-Ph); 152,4 (3-C=O); 165,7 (5-C=O)
Анал. (C20H22N2О2S), C, Н, N, S.
Пример 9
4-Бензил-2-(2-бензилфенила)-[1,2,4]тиадиазолидин-3,5-дион (9)
Реагенты: Бензилизотиоцианат (6,5 ммоль, 0,85 мл), 2-бензилфенил-изоцианат (6,5 ммоль, 0,82 мл) и SО2Cl2 (6,5 ммоль, 0,5 мл) в диэтиловом эфире (25 мл). Выделение: фильтрация реакционной смеси. Очистка: перекристаллизация из EtOH. Выход: 1,50 г (62%), твердое вещество белого цвета. Т.пл.=154,9°C.
1H-ЯМР (CDCl3): 3,9 (с, 2H, Ph-CH2-Ph); 4,86 (с, 2H, CH2Ph); 6,9-7,5 (м, 14 Н, аром)
13C-ЯМР (CDCl3): 38,1 (Ph-CH2-Ph); 46,1 (CH2-Ph); 135,1; 128,5; 128,6; 129,2 (C-Bn); 138,9; 129,9; 131,6; 128,4; 127,9; 133,1 (Ph-CH2-Ph); 140,9; 128,7; 128,6; 126,4 (Ph-CH2-Ph); 151,2 (3-C=O); 166,0 (5-C=O)
Анал. (C22H18N2О2S), C, Н, N, S.
Пример 10
4-Бензил-2-(4-феноксифенил)-[1,2,4]-тиадиазолидин-3,5-дион (10)
Реагенты: Бензилизотиоцианат (13 ммоль, 1,6 мл), 4-феноксифенил-изоцианат (13 ммоль, 2,3 мл) и SО2Cl2 (13 ммоль, 1 мл) в диэтиловом эфире (50 мл). Выделение: фильтрация реакционной смеси. Очистка: перекристаллизация из EtOH.
Выход: 4,12 г (84%), твердое вещество белого цвета. Т.пл=88,8°C.
1H-ЯМР (CDCl3): 4,92 (с, 2H, CH2Ph); 7,0-7,6 (м,, 14 Н, аром)
13C-ЯМР (CDCl3): 46,1 (CH2Ph); 134,9; 128,7; 129,1; 128,3 (CH2-Ph); 130,1; 125,7; 119,2; 156,3 (Ph-O-Ph); 156,3; 119,1; 129,8; 123,8 (Ph-O-Ph); 151,1 (3-C=O); 165,0 (5-C=O)
Анал. (C21H16N203S), C, Н, N, S.
Биологические методы
Пример 11
Ингибирование GSK-3
Активность GSK-3 определяли инкубацией смеси рекомбинантного человеческого фермента GSK-3, источника фосфата и субстрата GSK-3 в присутствии и в отсутствие соответствующего тестируемого соединения и измерением активности GSK-3 этой смеси. определяли инкубацией смеси рекомбинантного человеческого фермента GSK-3, источника фосфата и субстрата GSK-3 в присутствии и в отсутствие соответствующего тестируемого соединения и измерением активности GSK-3 этой смеси.
Рекомбинантную человеческую гликогенсинтаз-киназу 3 анализировали с помощью MOPS 8 мМ рН 7,3, EDTA 0,2 мМ, MgCl2 10 мМ и ортованадата натрия 0,25 мМ в присутствии 62,5 мкМ пептида-2 фосфо-гликоген-синтазы (GS 2), 0,5 мкCi анализировали с помощью MOPS 8 мМ рН 7,3, EDTA 0,2 мМ, MgCl2 10 мМ и ортованадата натрия 0,25 мМ в присутствии 62,5 мкМ пептида-2 фосфо-гликоген-синтазы (GS 2), 0,5 мкCi  –33P-АТФ и немеченного АТФ в конечной концентрации 12,5 мкМ. Конечный объем пробы составил 20 мкл. После инкубации в течение 30 минут при 30°С, 15 мкл аликвот наносили на фильтры из Р81 фосфоцеллюлозной бумаги. Фильтры промывали четыре раза в течение по меньшей мере 10 минут каждый и подсчитывали с 1,5 мл коктейля сцинтилляции в сцинтилляционном счетчике. –33P-АТФ и немеченного АТФ в конечной концентрации 12,5 мкМ. Конечный объем пробы составил 20 мкл. После инкубации в течение 30 минут при 30°С, 15 мкл аликвот наносили на фильтры из Р81 фосфоцеллюлозной бумаги. Фильтры промывали четыре раза в течение по меньшей мере 10 минут каждый и подсчитывали с 1,5 мл коктейля сцинтилляции в сцинтилляционном счетчике.
Рассчитывали величины IC50 соединений, анализируя кривые ингибирования нелинейной регрессией, используя GraphPad Prism.
Значения IC50 (концентрация, при которой наблюдают 50% ингибирование фермента) приведены в таблице 1.
Пример 12
Связывание с GSH и БСА
Получение образцов
Соединения (рабочий раствор 1 мМ) инкубировали в течение 30 минут при комнатной температуре с глутатионом (Sigma) и бычьим сывороточным альбумином (Фракция V) (Sigma) в эквимолекулярных концентрациях (1 мМ). После этого времени раствор отфильтровывали и анализировали с помощью ВЭЖХ-УФ/MС.
Хроматографические методы
ВЭЖХ осуществляли с симметричной колонкой C18 (2,1×150 мм, 3,5 мкм), используя Water Aliance 2695 со светодиодной матрицей 2996 и масс-спектрометром ZQ2000, используемым для аналитического разделения и для УФ и масс-спектрометрического определения. Градиент, используемый для элюирования, был следующим:
| Время (мин) |
%A |
%B |
| 0 |
100 |
0 |
| 20 |
0 |
100 |
| 21 |
100 |
0 |
| 25 |
100 |
0 |
Скорость потока: 0,25 мл/мин; температура: 30°C; детекция: 250 нм; объем инъекции: 10 мкл.
Результаты представлены в Таблице 2
| Таблица 2 |
| Композиция |
% несвязанного соединения |
| Глутатион |
альбумин |
| 1 |
34,7 |
80,2 |
| 2 |
95,0 |
98,0 |
| 3 (сравнительный) |
15,0 |
54,0 |
| 4 |
32,3 |
67,2 |
| 5 |
72,0 |
65,5 |
| 6 |
52,0 |
84,0 |
| 7 |
31,0 |
68,3 |
| 8 |
59,4 |
62,3 |
| 9 |
71,7 |
91,4 |
| 10 |
100,0 |
98,9 |
В таблице ясно показано, что все соединения, кроме соединения 3, которое не содержит ароматического кольца, по меньшей мере по одному из этих двух анализируемых свойств имеют более 50% несвязанного соединения. Есть также некоторые соединения, демонстрирующие результат более 70% несвязанных соединений в двух тестах. Наличие ароматического радикала в положении 2 (R1) TDZD заметно улучшает свойства этих соединений. Этот эффект больше, если имеется по меньшей мере 10 ароматических атомов углерода в заместителе или электронно-донорных заместителях, как в соединениях 5 и 10. Можно также наблюдать, что, когда ароматический радикал непосредственно связан с N TDZD, результаты оказываются лучше. Лучшие результаты были получены с фенилоксифенилом и с альфа-нафтилом.
Эти данные заметно лучше, чем полученные с соединениями TDZD из уровня техники. Действительно, описанный ранее 2,4,-дибензил-1,2,4-тиадиазолидин-3,5-дион с меньшим заместителем в положении 2 тиадиазолидинона дает значение 17,1 в тесте с глутатионом и 57,0 в тесте с альбумином, намного ниже, чем, например, соединение 4 согласно изобретению, которое имеет дополнительную метильную группу, и в том же диапазоне, что и соединение согласно сравнительному примеру 3, которое не имеет ароматических колец. И соединение, в котором R1=бензоил, разлагается в ходе теста, таким образом показывая намного худшие результаты, чем соединения формулы I.
Пример 13
Проникновение в мозг при пероральном и внутривенном введении
Это исследование проводили в CIDA S.A.L., Sta Perpetua de Mogola (Барселона), Испания.
Целью этого исследования было исследование фармакокинетического поведения соединения 2 (R1=альфа-нафтил) и его возможная аккумуляция в тканях мозга после перорального и внутривенного введения.
В этом исследовании использовались мыши C57/BL6 (15-30 г), полученные из лабораторий Charles River, Испания. Все мыши имели свободный доступ к сухому таблетированному стандартному корму для мышей. Вода была доступна ad libitum. Животных переставали кормить за 4 часа до обработки, но сохраняли доступ к воде ad libitum. Их кормили спустя 2 часа после введения.
Соединение 2 составляли в 10,0% PEG400, 10,0% Cremophor в дважды дистиллированной воде. Соединения вводили однократным пероральным введением в количестве 20 г/кг (10 мл/кг) и однократным внутривенным введением в количестве 2 мг/кг (10 мл/кг). Дополнительный эксперимент осуществляли с введением в количестве 200 мг/кг пероральным путем только, чтобы определить пропорциональность поглощения.
Четыре животных (2 самца и 2 самки) использовались в каждый момент экстракции. Кровь гепаринизировали и после центрифугирования (3000 об/мин, 10 минут, 5°C) две аликвоты плазмы сохраняли при -20°C и -30°C до анализа (ВЭЖХ/МС-МС).
Результаты эксперимента показаны в таблице 3.
| Таблица 3 |
| Доза |
200 мг/кг |
20 мг/кг |
| С max |
9061,34 нг/мл |
904,95 нг/мл |
| Биодоступность |
Не определяли |
31,87% |
Соединение 2 быстро абсорбируется из ЖКТ после перорального введения. Период полужизни после перорального введения в количестве 20 мг/кг составляет 6 часов. Соединение 2 демонстрирует биодоступность 31,87%. Уровни Соединения 2 были обнаружены в мозге как после перорального, так и после внутривенного введения. Это показывает, что описанные выше соединения формулы I имеют хорошие свойства биодоступности и подходят для использования в качестве лекарственного средства для лечения опосредуемых GSK-3 заболеваний или состояний.
Формула изобретения
1. Соединение общей формулы (I)

в которой
R1 обозначает органическую группу, содержащую по меньшей мере 8 атомов, выбранных из С или О, и включающую ароматическое кольцо фенила, нафтила или метилендиоксифенила, которая не связана непосредственно с N через -С(O)- или кислород;
Ra, Rb, R2, R3, R4, R5 и R6 представляют собой водород;
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, в котором R1 имеет по меньшей мере 10 ароматических атомов углерода.
3. Соединение по п.1, в котором ароматическая группа непосредственно связана с N тиадиазолидина.
4. Соединение по п.3, в котором R1 обозначает замещенный или незамещенный нафтил.
5. Соединение по п.4, в котором R1 обозначает замещенный или незамещенный альфа-нафтил.
6. Соединение по п.5, в котором R1 обозначает незамещенный альфа-нафтил.
7. Соединение по п.1, в котором R1 обозначает группу, выбранную из
8. Соединение по п.1, которое имеет формулу
или его фармацевтически приемлемая соль или сольват.
9. Соединение по п.1, которое имеет формулу
или его фармацевтически приемлемая соль или сольват.
10. Соединение по п.1, которое имеет формулу
или его фармацевтически приемлемая соль или сольват.
11. Соединение по п.1, которое имеет формулу
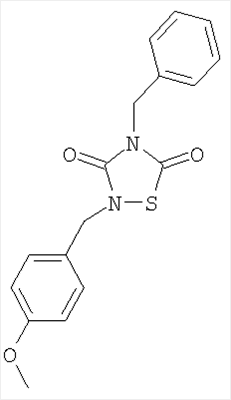
или его фармацевтически приемлемая соль или сольват.
12. Соединение по п.1, которое имеет формулу
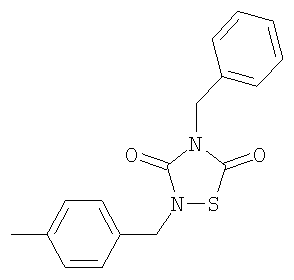
или его фармацевтически приемлемая соль или сольват.
13. Соединение по п.1, которое имеет формулу
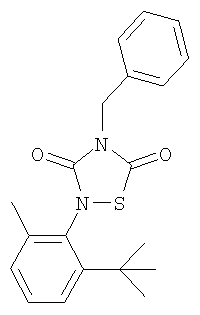
или его фармацевтически приемлемая соль или сольват.
14. Соединение по п.1, которое имеет формулу
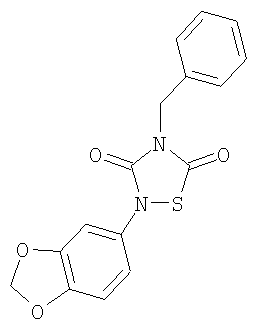
или его фармацевтически приемлемая соль или сольват.
15. Соединение по п.1, которое имеет формулу
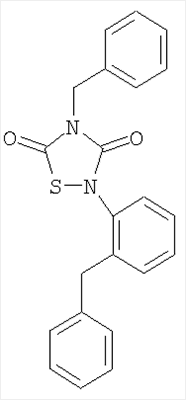
или его фармацевтически приемлемая соль или сольват.
16. Соединение по п.1, которое имеет формулу
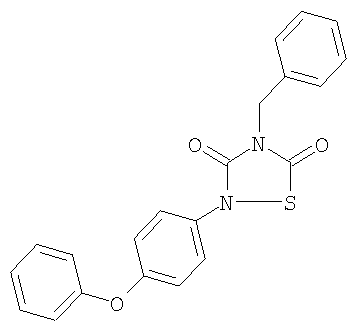
или его фармацевтически приемлемая соль или сольват.
17. Способ получения соединения формулы (I) или его соли или сольвата по любому из пп.1-16, который включает введение в реакцию бензилзамещенного изотиоцианата формулы II
с соединением формулы R1-N=C=O в присутствии хлорирующего агента.
18. Способ по п.17, который включает реакцию
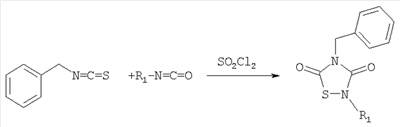
где R1 имеет значение, определенное в п.1, предпочтительно определенное в п.6.
19. Фармацевтическая композиция для ингибирования GSK-3, которая включает эффективное количество соединения по любому из пп.1-16 или его фармацевтически приемлемую соль или сольват и фармацевтически приемлемую основу, адъювант или носитель.
20. Фармацевтическая композиция по п.19 для перорального введения.
21. Применение соединения по любому из пп.1-16 в получении лекарственного средства для лечения заболевания и состояния, опосредованного GSK-3.
22. Применение по п.21, в котором заболевание или состояние представляет собой диабет, состояния, связанные с диабетом, хронические нейродегенеративные состояния, включая деменции, такие как болезнь Альцгеймера, болезнь Паркинсона, прогрессирующий надъядерный паралич, подострый склерозирующий панэнцефалитный паркинсонизм, постэнцефалитный паркинсонизм, боксерский энцефалит, комплекс острова Гуам, болезнь Пика, кортикобазальную дегенерацию, лобно-височную деменцию, болезнь Гентингтона, СПИД-деменцию, боковой амиотрофический склероз, рассеянный склероз и нейротравматические заболевания, такие как острый инсульт, эпилепсия, нарушения настроения, такие как депрессия, шизофрения и биполярные нарушения, поддержка функционального восстановления после инсульта, мозговое кровотечение, например, вследствие солитарной церебральной амилоидной ангиопатии, выпадение волос, ожирение, атеросклеротическое сердечно-сосудистое заболевание, артериальную гипертензию, поликистозный синдром яичника, синдром X, ишемию, повреждение головного мозга, травматическое повреждение головного мозга, рак, лейкопению, синдром Дауна, заболевание с тельцами Леви, воспаление, хронические воспалительные заболевания, рак и гиперпролиферативные заболевания, такие как гиперплазии, и иммунодефицит.
23. Применение по п.22, в котором заболевание представляет собой болезнь Альцгеймера.
24. Применение по п.22, в котором заболевание представляет собой диабет типа II.
25. Применение по п.22, в котором заболевание представляет собой депрессию.
26. Применение по п.22, в котором заболевание представляет собой повреждение головного мозга.
27. Применение по п.22, в котором заболевание представляет собой прогрессирующий надъядерный паралич.
28. Применение соединений формулы (I), определенной в любом из пп.1-16, в качестве реагентов для биологических проб для ингибирования GSK-3.
|
|