Патент на изобретение №2379297
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) 2-(3,4-ДИМЕТИЛФЕНИЛ)-4-{[2-ГИДРОКСИ-3`-(1Н-ТЕТРАЗОЛ-5-ИЛ)БИФЕНИЛ-3- ИЛ]ГИДРАЗОНО}-5-МЕТИЛ-2,4-ДИГИДРОПИРАЗОЛ-3-ОН-ХОЛИН
(57) Реферат:
Описывается новое соединение – холиновая соль 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1Н-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-она, фармацевтическая композиция, ее содержащая, и способ получения композиции. Новое соединение является улучшенным миметиком тромбопоэтина (ТРО) и может быть использовано в качестве агониста ТРО-рецептора, в частности для увеличения продукции тромбоцитов. 3 н.п. ф-лы, 1 табл.
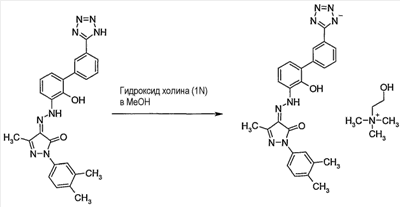
Изобретение относится к улучшенному миметику тромбопоэтина (в дальнейшем ТРО), холиновой соли 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-она. Соединение представлено структурой I: Соединение по изобретению применимо в качестве агониста ТРО-рецептора, в частности для увеличения продукции тромбоцитов. Подробное описание изобретения 2-(3,4-Диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он представляет собой соединение, которое описано и заявлено, вместе с фармацевтически приемлемыми солями, гидратами, сольватами и их эфирами как применимое в качестве агониста ТРО-рецепторов, в частности для увеличения продукции тромбоцитов и, в частности, при лечении тромбоцитопении в Международной Заявке Было неожиданно обнаружено, что холиновая соль 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-она имеет многочисленные преимущества перед свободной кислотой. Свободная кислота слабо растворима в воде. Эта слабая растворимость неблагоприятно влияет на способность свободной кислоты быть включенной в фармацевтические лекарственные формы и снижает биодоступность и пероральное воздействие соединения in vivo. В то время как свободная кислота широко применима как агонист ТРО-рецепторов, в особенности для увеличения продукции тромбоцитов и, в особенности, при лечении тромбоцитопении, холиновая соль 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-она имеет дополнительное преимущество, заключающееся в повышенной биодоступности и пероральном способе применения. Соединение по изобретению, 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он-холин (в дальнейшем – «Активный Ингредиент» или «Соединение А») применимо в качестве агониста ТРО-рецепторов, в частности для повышения продукции тромбоцитов и, в частности, при лечении тромбоцитопении. Активный Ингредиент может быть введен в общепринятых лекарственных формах, приготовленных сочетанием Активного Ингредиента с общепринятым фармацевтически приемлемым носителем или разбавителем согласно методам, полностью известным специалистам в данной области, каковые описаны в международной заявке Соответственно, настоящее изобретение в свой объем включает фармацевтические композиции, содержащие 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он-холин, в качестве Активного Ингредиента, в сочетании с фармацевтически приемлемым носителем или разбавителем. Соединение А по изобретению может быть введено пероральным, парентенральным, интрадермальным или местным путями введения. Термин парентеральный, как использовано в настоящем описании, включает в себя внутривенное, внутримышечное, подкожное, интраназальное, интраректальное, интравагинальное и интраперитонеальное введение. Пероральное введение, как правило, предпочтительно. Соединение А может быть составлено в лекарственную форму, соответствующую каждому пути введения, включая капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение обычно смешано с по меньшей мере одним инертным разбавителем. Пероральные лекарственные формы могут также включать, как в нормальной практике, дополнительные вещества помимо инертных разбавителей, например, смазывающие агенты, глиданты и антиоксиданты. В случае капсул, таблеток и пилюль, лекарственные формы могут также содержать буферные агенты. Таблетки и пилюли могут дополнительно быть приготовлены для замедленного высвобождения. Препараты по изобретению для парентерального введения включают стерильные водные растворы, хотя могут быть использованы неводные суспензии эмульсий. Такие лекарственные формы могут также содержать вспомогательные средства (адъюванты), такие как консервирующие, увлажняющие, осмотические, буферные, эмульгирующие и диспергирующие агенты. Они могут быть стерилизованы, например, фильтрованием через задерживающий бактерии фильтр, включением стерилизующих агентов в композиции, облучением композиций или нагреванием композиций. Как используется в настоящем описании, «холин» означает (2-гидроксиэтил)триметиламмоний. Дозы настоящего изобретенного Активного Ингредиента в фармацевтической стандартной лекарственной форме, как описано выше, будут эффективными, нетоксичными в величинах из диапазона 0,001-100 мг/кг общей массы тела, предпочтительно 0,001-50 мг/кг. Когда при лечении человека необходим ТРО-миметик, выбранная доза предпочтительно назначается от 1-6 раз в день, перорально или парентерально. Предпочтительные формы парентерального введения включают местное, ректальное, трансдермальное, путем инъекции или непрерывной инфузии. Пероральные стандартные лекарственные формы для назначения человеку предпочтительно содержат от 0,05 до 3500 мг Активного Ингредиента, более предпочтительно от 0,5 до 1,000 мг Активного Ингредиента. Пероральное введение, при котором применяются более низкие дозы, предпочтительно. Парентеральное введение в высоких дозах, тем не менее, также может быть использовано, когда это безопасно и удобно для пациента. Приведенные выше дозы относятся к предпочтительным количествам Активного Ингредиента, выраженным для свободной кислоты. Для специалиста в данной области будет понятно, что оптимальное количество и период индивидуальных доз Активного Ингредиента будет зависеть от природы и условий применения, формы, пути и места введения, и особенности пациента, подлежащего лечению, и что такие оптимумы могут быть определены традиционными методами. Также для специалиста в данной области будет принято во внимание, что оптимальный курс лечения, то есть число доз Активного Ингредиента, даваемое в день для определенного числа дней, должно быть установлено такими специалистами применением обычных тестов определения курса лечения. В целом, соединение по изобретению получают путем растворения свободной кислоты, 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-она, в соответствующем органическом растворителе, таком как смесь этанола и этилацетата, фильтрованием полученной смеси для удаления примесей, затем добавлением этого раствора к раствору, например, из 1,5 эквивалентов гидроксида холина в органическом растворителе, предпочтительно водорастворимом растворителе, таком как MeOH или ТГФ. Соединение по изобретению осаждают, как правило, свыше 3-24 часов, затем его отфильтровывают и сушат, например, сушат в вакууме или сушат на воздухе при повышенной температуре. 50 мас.% раствор гидроксида холина в метаноле был приобретен в Aldrich Chemical Company, Milwaukee, Wisconsin. Органические растворители доступны из Aldrich Chemical Company, Milwaukee, Wisconsin. Так как фармацевтически активное соединение по настоящему изобретению является активным в качестве ТРО-миметика, это доказывает терапевтическую полезность при лечении тромбоцитопении и других состояний со сниженной продукцией тромбоцитов. Лечение тромбоцитопении, как описано в настоящем описании, достигается увеличением продукции тромбоцитов. Термин «тромбоцитопения» и его производные, как используется в настоящем описании, широко интерпретируется как любое снижение числа тромбоцитов крови ниже того, что считается нормальным или желательным для здорового человека. Для тромбоцитопении известно много причинных факторов, включающих, без ограничения, лучевую терапию, химиотерапию, иммунотерапию, иммунную тромбоцитопеническую пурпуру (ITP, Bussel J.B., Seminars in Hematology, 2000, 37, Suppl 1, 1-49), миелодиспластический синдром (MDS), апластическую анемию, AML, CML, вирусные инфекции (включая, без ограничения, ВИЧ, гепатит С, парвовирус), заболевание печени, миелоаблацию, пересадку костного мозга, пересадку стволовых клеток, пересадку стволовых клеток периферической крови, дефект клетки-предшественника, полиморфизмы стволовых клеток и клеток-предшественников, дефекты в Тро, нейтропению (Sawai N. J. Leukocyte Biol., 2000, 68, 137-43), подвижность дендритных клеток (Kuter D. J. Seminars in Hematology, 2000, 37, Suppl 4, 41-49), пролиферацию, активацию или дифференцировку. Фармацевтически активное соединение по изобретению применимо при лечении тромбоцитопении независимо от фактора или факторов, вызвавших это состояние. Фармацевтически активное соединение по изобретению применимо также при лечении тромбоцитопении, когда этиологический фактор или факторы данного состояния неизвестны или должны все же быть идентифицированы. Было доказано, что ТРО действует как мобилизатор стволовых клеток в периферической крови (Neumann T.A. et al., Cytokines, Cell. & Mol. Ther., 2000, 6, 47-56). Такая активность может действовать совместно с мобилизаторами стволовых клеток, такими как G-CSF (Somolo et al., Blood, 1999, 93, 2798-2806). Соединение по настоящему изобретению является, таким образом, полезным для увеличения количества стволовых клеток в кровотоке у доноров перед лейкаферезом для гемопоэтической трансплантации стволовых клеток у пациентов, получающих миелоаблативную химиотерапию. Также, ТРО стимулирует рост клеток костного мозга, особенно клеток гранулоцитарной/макрофагальной линии дифференцировки (Holly et al., US-5989537). Предшественники гранулоцитов/макрофагов являются клетками линии дифференцировки костного мозга, которые созревают как нейтрофилы, моноциты, базофилы и эозинофилы. Соединение по настоящему изобретению также терапевтически полезно для стимуляции пролиферации нейтрофилов у пациентов с нейтропеническими состояниями. Профилактическое применение соединения по настоящему изобретению рассматривают, когда ожидается уменьшение крови или тромбоцитов крови. Профилактическое применение Соединения А приводит к накоплению тромбоцитов или началу продукции тромбоцитов до ожидаемой потери крови или тромбоцитов крови. Профилактическое применение Соединения А включает, без ограничения, пересадку тканей, хирургию, анестезию перед родами и защиту кишечника. Для человеческих дендритных клеток показана экспрессия ТРО-рецепторов (Kumamoto et al., Br. J. Haem, 1999, 105, 1025-1033), и ТРО является эффективным мобилизатором дендритных клеток. Соединение ТРО-миметика по настоящему изобретению также применимо в качестве добавки в вакцинах, в которых оно увеличивает активность и подвижность дендритных клеток. Соединение А применимо в качестве иммунологической добавки, даваемой в комбинации с пероральным, трансдермальным или подкожным введением вакцины и/или иммуномодулятора, для возрастания активности и подвижности дендритных клеток. Для ТРО известны различные эффекты, включающие антиапоптический эффект/эффект повышения выживания для мегакариоцитов, тромбоцитов и стволовых клеток, и пролиферативный эффект для стволовых клеток и мегакариоцитов (Kuter D. J. Seminars in Hematology, 2000, 37, 41-49). Эти ТРО-активности эффективно повышают количество стволовых клеток и клеток-предшественников, так что имеются синергичные эффекты, когда ТРО применяют в сочетании с другими цитокинами, которые индуцируют дифференцировку. Другой аспект изобретения предусматривает способ лечения дегенеративных заболеваний у млекопитающего, включая человека, нуждающегося в этом, который включает в себя введение такому млекопитающему терапевтически эффективного количества Соединения А по настоящему изобретению. Термин дегенеративное заболевание и дегенеративные состояния, как используется в настоящем описании, означает болезненное состояние, выбранное из: нарушений нервной системы, включая поперечный миелит, рассеянный склероз, демиелинизацию, возникшую после травмы головного мозга или спинного мозга, острое повреждение головного мозга, травму головы, повреждение периферического нерва, ишемическое повреждение головного мозга, повреждение спинного мозга, наследственные заболевания миелина в ЦНС, эпилепсию, перинатальную асфиксию, асфиксию, аноксию, эпилептический статус и инсульт; нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона и боковой амиотрофический склероз; для лечения, восстановления и/или регенерации тканей, например: при сердечно-сосудистых расстройствах, инфаркте миокарда и сердечно-сосудистой болезни/ткани, для лечения, восстановления и/или регенерации заболевания/ткани печени, желудочно-кишечного заболевания/ткани и заболевания/тканей почек; для лечения СПИДа; и для лечения диабетов/сахарного диабета. Инсульт относится к цереброваскулярному событию (CVI) и включает острый тромбоэмболический инсульт. Инсульт включает и очаговую, и общую ишемию. Также включаются транзиторные церебральные ишемические атаки и другие цереброваскулярные проблемы, сопровождающиеся церебральной ишемией. Пациенты, подвергающиеся каротидной эндартерэктомии в особенности, или другим цереброваскулярным или сосудистым хирургическим процедурам в общем, или диагностическим сосудистым процедурам, включающим церебральную ангиографию и тому подобное. Другие события представляют собой травму головы, травму спинного мозга или нарушения от общей аноксии, гипоксии, гипогликемии, гипотензии, так же как похожие нарушения, замеченные в течение процедур от эмболии, гиперфузии и гипоксии. Соединение А применимо в диапазоне событий, например, в течение кардиальной шунтирующей хирургии, случаев внутримозгового кровоизлияния, при перинатальной асфиксии, при остановке сердца и эпилептическом статусе. Настоящее изобретение, таким образом, относится к способу лечения болезненных состояний, выбранных из: нарушений нервной системы, включающих поперечный миелит, рассеянный склероз, демиелинизацию, возникшую после травмы головного мозга или спинного мозга, острое повреждение головного мозга, травму головы, повреждение спинного мозга, повреждение периферического нерва, ишемическое повреждение головного мозга, наследственные заболевания миелина в ЦНС, эпилепсию, перинатальную асфиксию, асфиксию, аноксию, эпилептический статус и инсульт; нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона и боковой амиотрофический склероз; для лечения, восстановления и/или регенерации тканей, например: при сердечно-сосудистых расстройствах, инфаркте миокарда и сердечно-сосудистой болезни/ткани, и для лечения, восстановления и/или регенерации заболевания/ткани печени, желудочно-кишечного заболевания/ткани и заболевания/тканей почек; для лечения СПИДа; и для лечения диабетов/сахарного диабета, который включает введение эффективного количества Соединения А. Лечение дегенеративных заболеваний, как описано в настоящем описании, совершенствуется введением Соединения А и не ограничивается никаким специфическим механизмом действия. Механизм действия при лечении дегенеративных заболеваний, как описано в настоящем описании, представлен увеличением выживаемости и/или продукции стволовых клеток и/или усиления функционирования стволовых клеток и/или продолжительности жизни. Для дегенеративных заболеваний известно много этиологических факторов, включающих, без ограничения, вирусные инфекции (включая, без ограничения, ВИЧ, гепатит С, парвовирус) и заболевание печени, старение, аутоиммунные заболевания, нервную болезнь/повреждение, болезнь/повреждение печени, болезнь/повреждение почек, гастроинтестинальную болезнь/повреждение, сердечно-сосудистую болезнь/повреждение и болезнь/повреждение поджелудочной железы. Данное изобретение относится к лечению дегенеративных заболеваний, независимо от этиологического фактора или факторов данного состояния. Соединение по изобретению, Соединение А, также применимо при лечении дегенеративных заболеваний, когда этиологический фактор или факторы данного состояния неизвестны или должны все же быть идентифицированы. Квалифицированный врач будет способен определить соответствующую ситуацию, при которой субъекты восприимчивы к или подвергаются риску дегенеративного заболевания, например инсульта, так же как страдание от инсульта, для применения способов по настоящему изобретению. Профилактическое применение соединения по изобретению рассматривается, когда дегенеративное заболевание предполагается. Способность Соединения А лечить дегенеративные заболевания демонстрируется через активность в анализе пролиферации клетки-предшественника CD34+ Анализ пролиферации клетки-предшественника CD34+. Соединение А тестировали на его способность стимулировать выживание и пролиферацию ранних клеток-предшественников CD34+ из человеческого костного мозга. В данном исследовании очищенные человеческие клетки-предшественники CD34+ инкубировали в жидкой культуре с Соединением А в течение 7 дней, и количество клеток, экспрессирующих ранний маркер стволовых клеток CD34, затем измеряли проточной цитометрией и сравнивали с необработанными клетками (см. Liu et al. Bone Marrow Transplantation. 24:247-52, 1999). Настоящее изобретение, следовательно, предоставляет способ лечения дегенеративных заболеваний, который включает введение эффективного количества Соединения А субъекту, нуждающемуся в этом. Соединение А обеспечивает способ лечения указанных выше болезненных состояний вследствие своей способности лечить дегенеративные заболевания. Часть данного открытия заключается в том, что введение in vivo Соединения А применимо для лечения болезни Паркинсона, болезни Хантингтона, рассеянного склероза и ишемического поражения головного мозга. Для стволовых клеток, включая зрелые стволовые клетки костного мозга, показана эффективность при лечении рассеянного склероза; Stangel N. et al., Progress in Neurobiology, 68(5): 361-76, 2002 Dec. Невральные стволовые клетки и их применение при болезни Паркинсона, болезни Хантингтона, рассеянном склерозе и ишемическом поражении головного мозга описаны в Ostenfield T. et al., Advances & Technical standards in Neurosurgery, 28: 3-89, 2003. Далее, часть открытия заключается в том, что введение in vivo Соединения А применимо для регенерации и восстановления тканей, которые реагируют на лечение стволовыми клетками. Такие ткани хорошо известны и хорошо узнаваемы специалистами в данной области. Например, для стволовых клеток показана применимость при лечении пациентов с инфарктом миокарда, сердечно-сосудистых расстройств и сердечно-сосудистых заболеваний: Stamm C. et al., Lancet. 361(9351): 45-6, 2003 и Semsarian C., Internal Medicine Journal. 32(5-6): 259-65, 2002. Стволовые клетки указаны для лечения, восстановления и/или регенерации заболевания/ткани печени, желудочно-кишечного заболевания/ткани и заболевания/тканей почек; Choi D. et al., Cell Transplantation, 11(4): 359-68, 2002, Poulson R. et al., Journal of Pathology, 197(4): 441-56, 2002 и Alison M. et al., Journal of Pathology, 197(4): 419-23, 2002. Далее, часть открытия заключается в том, что введение in vivo Соединения А применимо для лечения диабетов/сахарного диабета. Стволовые клетки указаны для лечения диабета, Berna G., et al., Biomedicine & Pharmacotherapy, 55(4): 206-12, 2001 и Beilhack GF., et al., Diabetes, 52(1): 59-68, 2003. Следующий аспект изобретения предусматривает способы совместного введения Соединения А по настоящему изобретению с добавочными активными ингредиентами, такими как другие известные соединения для лечения дегенеративных заболеваний и/или тромбоцитопении, включая индуцированную химиотерапией тромбоцитопению и трансплантацию костного мозга и другие состояния с подавленной продукцией тромбоцитов, или известные соединения, полезные при применении в комбинации с ТРО-миметиком. Термин «совместное введение» и его производные, как используется в настоящем описании, означает как одновременное введение, так и любой способ раздельного последовательного введения Соединения А и дополнительного активного ингредиента или ингредиентов, известных при лечении дегенеративных заболеваний и/или тромбоцитопении, включая индуцированную химиотерапией тромбоцитопению и трансплантацию костного мозга и другие состояния с подавленной продукцией тромбоцитов. Термин дополнительный активный ингредиент или ингредиенты, как используется в настоящем описании, включает любые соединения или терапевтические агенты, для которых известны или продемонстрированы полезные свойства при введении с ТРО или ТРО-миметиками. Предпочтительно, если введение не одновременное, соединения вводятся в закрытой временной близости друг к другу. Кроме того, не важно, чтобы соединения вводились в одинаковых лекарственных формах, например, одно соединение может быть введено местно, а другое соединение может быть введено перорально. Соединение ТРО-миметик по текущему изобретению также применимо для влияния на выживаемость и пролиферацию клеток в сочетании с другими известными агентами, влияющими на выживаемость и пролиферацию клеток. Такие другие агенты включают, без ограничения: G-GSF, GM-CSF, TPO, M-CSF, EPO, Gro-бета, IL-11, SCF, FLT3 лиганд, LIF, IL-3, IL-6, IL-1, прогенипоэтин, NESP, SD-01 или IL-5, или биологически активные производные любых вышеупомянутых агентов, KT6352 (Shiotsu Y. et al., Exp. Hemat. 1998, 26, 1195-1201), утероферрин (Laurenz JC., et al., Comp. Biochem. & Phys., Part A. Physiology., 1997, 116, 369-77), FK33 (Hasegawa T., et al. Int. J. Immunopharm., 1996, 18 103-112) и другие молекулы, идентифицированные как имеющие антиапоптозные, увеличивающие выживаемость или пролиферативные свойства для стволовых клеток, клеток-предшественников или других клеток, экспрессирующих ТРО-рецепторы. Примеры дополнительного активного ингредиента или ингредиентов для применения в комбинации с Соединением А по настоящему изобретению включают в себя, без ограничения: хемопротективные или миелопротективные вещества, такие как G-GSF, BB-10010 (Clemons et al., Breast Cancer Res. Treatment, 1999, 57, 127), амифостин (этиол) (Fetscher et al., Current Opinion in Hemat., 2000, 7, 255-60), SCF, IL-11, NCP-4, IL-1-бета, AcSDKP (Gaurdon et al., Stem Cells, 1999, 17, 100-6), TNF-a, TGF-b, MIP-1a (Egger et al., Bone Marrow Transpl., 1998, 22 (Suppl. 2), 34-35), и другие молекулы, идентифицированные как имеющие антиапоптозные, увеличивающие выживаемость или пролиферативные свойства. Дополнительные примеры дополнительного активного ингредиента или ингредиентов для применения в комбинации с соединением ТРО-миметиком по настоящему изобретению включают, без ограничения: стволовые клетки, мегакариоциты, мобилизаторы нейтрофилов, такие как химиотерапевтические агенты (то есть цитоксан, этопозид, цисплатин, Ballestrero A. et al., Oncology, 2000, 59, 7-13), хемокины, IL-8, Gro-бета (King A.G. et al. J. Immun., 2000, 164, 3774-82), антитела агонистов или антагонистов рецептора, малую молекулу цитокина или агонисты или антагонисты рецептора, SCF, Flt3 лиганд, ингибиторы адгезионной молекулы или антитела, такие как: анти-VLA-4 (Kikuta T. et al., Exp. Hemat., 2000, 28, 311-7) или анти-СD44 (Vermeulen M. et al., Blood, 1998, 92, 894-900), цитокины/хемокины/интерлейкины или антитела агонистов или антагонистов рецептора, MCP-4 (Berkhout T.A., et al., J. Biol. Chem., 1997, 272, 16404-16413; Uguccioni M. et al., J. Exp. Med., 1996, 183, 2379-2384). Соединение А по изобретению применимо в качестве ТРО-миметика у млекопитающих, в частности у человека, если это необходимо. Способ по данному изобретению индуцирования ТРО-миметической активности у млекопитающих, включая человека, предусматривает введение субъекту, при необходимости в такой активности, эффективного ТРО-миметического количества Соединения А по настоящему изобретению Изобретение также предусматривает применение Соединения А в производстве лекарственных препаратов для использования в терапии. Изобретение также предусматривает применение Соединения А в производстве лекарственных препаратов для использования в качестве ТРО-миметика. Изобретение также предусматривает применение Соединения А в производстве лекарственных препаратов для использования для усиления продукции тромбоцитов. Изобретение также предусматривает применение Соединения А в производстве лекарственных препаратов для использования при лечении тромбоцитопении. Изобретение также предусматривает применение Соединения А в производстве лекарственных препаратов для использования при лечении дегенеративных заболеваний. Изобретение также предусматривает фармацевтическую композицию для применения при лечении дегенеративных заболеваний, которая содержит Соединение А и фармацевтически приемлемый носитель. Изобретение также предусматривает фармацевтическую композицию для применения в качестве ТРО-миметика, которая содержит Соединение А и фармацевтически приемлемый носитель. Изобретение также предусматривает фармацевтическую композицию для применения при лечении тромбоцитопении, которая содержит Соединение А и фармацевтически приемлемый носитель. Изобретение также предусматривает фармацевтическую композицию для применения для усиления продукции тромбоцитов, которая содержит Соединение А и фармацевтически приемлемый носитель. Изобретение также предусматривает фармацевтическую композицию для применения при лечении дегенеративных заболеваний, которая содержит Соединение А и фармацевтически приемлемый носитель. Под термином «лечение» и его производными, как используется в настоящем описании, подразумевается профилактическое и терапевтическое лечение. Публикации, включающие, но не ограничивающиеся патентами и патентными заявками, цитированные в данном описании, включены здесь в качестве ссылки во всей их полноте. Не ожидается никаких неприемлемых токсикологических эффектов при применении соединения по изобретению в соответствии с настоящим изобретением. Рассматриваемые Эквиваленты – Обычным специалистом в данной области будет отмечено, что Соединение А может также существовать в таутомерных формах. Таутомерные формы Соединения А могут включать, без ограничения, структуры, формально представленные следующей формулой (II и III). Все подобные соединения включены в объем изобретения и по существу включены в определение Соединения А. Следующие примеры далее иллюстрируют настоящее изобретение. Примеры не предназначены для ограничения изобретения, как определено выше и сформулировано ниже. ПРИМЕР 1 Приготовление: 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он-холина 2-(3,4-Диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он, 1,1 г неочищенного монолитного оранжа в 7 мл этилацетата и 12 мл этанола (крепость 190) перемешивали при приблизительно 40°C. К этой суспензии добавляли 2,5 мл (1N) раствора гидроксида холина в метаноле, что приводило к образованию темного оранжево-коричневого раствора. Воду (1 мл) добавляли к темному раствору и смесь перемешивали при примерно 35°C в течение примерно 3 часов. В течение этого времени в растворе был замечен осадок. Суспензию перемешивали в течение следующих 72 часов при примерно 20°C и затем твердую фракцию отделяли фильтрованием и сушили при примерно 40°C свыше 12 часов с получением 1,2 г (87% выход) указанного в заголовке соединения в виде твердых кристаллов светло-оранжевого цвета. Чистота твердой фракции была доказана с помощью рентгеновской порошковой дифрактометрии, выполненной на Pillips X’Pert Pro дифрактометре. Образец сканировали при следующих параметрах: область сканирования: 2-35 периода два-тета; мощность генератора: 40 кВ, 40 мА; источник излучения: CuK
DSC-данные показали расслоение твердая фракция-расплав при эндотермической атаке около 235,3°C. Протон ЯМР (400 МГц, MeOH-d4 относится к MeOH-d4 Данные ИК (DATR) 3023, 2920, 2853, 1648, 1606, 1541, 1503, 1457, 1410, 1367, 1334, 1267, 1257, 1224, 1191, 1155, 1135, 1117, 1097, 1054, 1024, 1000, 958, 920, 904, 874, 851, 806, 784, 773, 760, 726, 708, 681 cм-1 ПРИМЕР 2 Приготовление: 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он-холина 2-(3,4-Диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он (2,0 г, 4,29 ммоль) суспендировали в этаноле (17 мл) и воде (1,85 мл). Коричневую взвесь обрабатывали гидроксидом холина (2,68 мл, 2,2 экв.) (суспендированным в виде 45 мас.% раствора в метаноле) при температуре окружающей среды до образования темно-пурпурного раствора, который перемешивали в течение 30 минут. Раствор фильтровали и промывали этанолом (4 мл). Трифторуксусную кислоту (0,36 мл, 1 экв.) в воде (1,85 мл) добавляли к фильтрату до образования оранжево-красной взвеси, которую затем сушили при 78°C (нагревание в колбе с обратным холодильником) и перемешивали в течение 30 минут. Реакционную смесь затем охлаждали до 60°C и обрабатывали этанолом (25 мл, 12,5 объем) и перемешивали в течение следующего часа при 60°C. Затем суспензию охлаждали до температуры окружающей среды и перемешивали в течение 17 часов. После фильтрования осадок на фильтре промывали этанолом (8 мл, 4 объема). Полученное твердое вещество сушили при 50°C в вакууме с получением 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он-холина в виде оранжевого твердого вещества (2,02 г, 83%). Данные протонного ЯМР и ИК согласуются с указанным в заголовке соединением. ПРИМЕР 3 Композиция таблетки Лактозу, микрокристаллическую целлюлозу, натриевый гликолят крахмала, стеарат магния и 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он-холин смешивают в пропорциях, приведенных ниже в таблице. Смесь затем прессуют в таблетки.
ПРИМЕР 4 Инъекционная парентеральная композиция Инъекционную форму для введения 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1H-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он-холина изготавливали путем перемешивания 5,0 мг соединения в 1,0 мл нормального физиологического раствора. Наряду с тем, что предпочтительный вариант воплощения изобретения был проиллюстрирован выше, должно быть понятно, что изобретение не ограничивается точными инструкциями, описанными в настоящем описании, и что право на все модификации, возникающие в пределах следующей формулы изобретения, сохраняется.
Формула изобретения
1. 2-(3,4-Диметилфенил)- 2. Фармацевтическая композиция для использования в повышении продукции тромбоцитов, содержащая эффективное количество 2-(3,4-диметилфенил)-4-{[2-гидрокси-3′-(1Н-тетразол-5-ил)бифенил-3-ил]гидразоно}-5-метил-2,4-дигидропиразол-3-он-холина и фармацевтически приемлемый носитель или разбавитель. 3. Способ получения фармацевтической композиции по п.2, заключающийся в том, что соединение по п.1 смешивают с фармацевтически приемлемым носителем или разбавителем.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

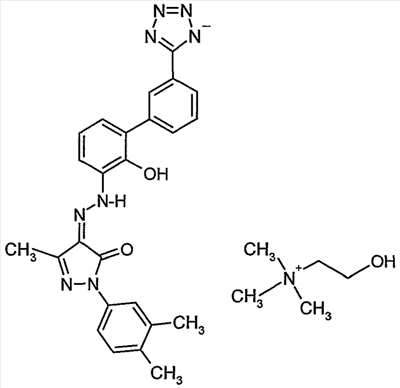
 PCT/US01/16863, имеющей международную дату регистрации заявки май 24, 2001; номер международной публикации WO 01/89457 и дату международной публикации ноябрь 29, 2001 (соединение примера 12), полное описание которого, таким образом, включено в данное описание в качестве ссылки. Международная заявка
PCT/US01/16863, имеющей международную дату регистрации заявки май 24, 2001; номер международной публикации WO 01/89457 и дату международной публикации ноябрь 29, 2001 (соединение примера 12), полное описание которого, таким образом, включено в данное описание в качестве ссылки. Международная заявка 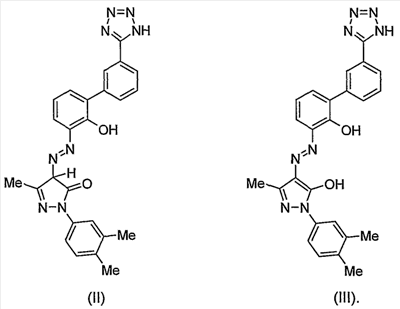
 ; тип сканирования: монотонный; время шага: 10,16 секунд; размер шага: 0,0167 периода два-тета на шаг; простое вращение образца: 25 оборотов в минуту. Далее приведен рентгеновский порошковый шаблон и список пиков.
; тип сканирования: монотонный; время шага: 10,16 секунд; размер шага: 0,0167 периода два-тета на шаг; простое вращение образца: 25 оборотов в минуту. Далее приведен рентгеновский порошковый шаблон и список пиков.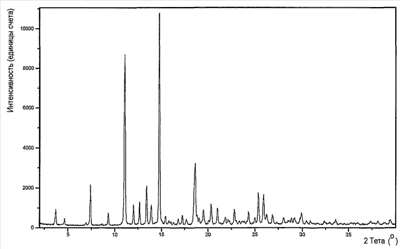
 3,32):
3,32):