|
|
(21), (22) Заявка: 2006132325/04, 10.05.2005
(24) Дата начала отсчета срока действия патента:
10.05.2005
(30) Конвенционный приоритет:
11.05.2004 FR 0405055
(43) Дата публикации заявки: 20.03.2008
(46) Опубликовано: 20.01.2010
(56) Список документов, цитированных в отчете о
поиске:
RU 2152388 С1, 10.07.2000. EP 0607076 A1, 20.07.1994. WO 02/22587 A1, 21.03.2002. Anne Olivier et al. Bioorganic & Medicinal Chemistry Letters. Vol.7, no. 17, pp.2277-2282, 1997. Yoshihiko Kitaura et al. J. Med. Chem. 1982, 25, 337-339.
(85) Дата перевода заявки PCT на национальную фазу:
08.09.2006
(86) Заявка PCT:
FR 2005/001154 20050510
(87) Публикация PCT:
WO 2005/121099 20051222
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ДЮБУА Лоран (FR),
ЭВАННО Янник (FR),
МАЛУАЗЕЛЬ Кристиан (FR),
СЕВРЕН Мирей (FR)
(73) Патентообладатель(и):
САНОФИ-АВЕНТИС (FR)
|
(54) ПРОИЗВОДНЫЕ 2Н- ИЛИ 3Н-БЕНЗО[Е]ИНДАЗОЛ-1-ИЛ-КАРБАМАТА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ
(57) Реферат:
Изобретение относится к соединениям общей формулы (I), где W – кислород или сера; X1 и Х3, независимо друг от друга – водород или C1-С6-алкокси; Х2 – водород, галоген, C1-С6-алкил или C1-С6-алкокси и Х4 – водород, Y находится в положении (N2) или (N3); когда Y находится в положении (N2), У обозначает С1-С6-алкил, C1-С6-фторалкил, фенил, пиридинил или пиразинил; когда Y находится в положении (N3), Y обозначает фенил, пиридинил или пиримидинил, при этом фенил, возможно, замещен одним или несколькими атомами или группами, выбранными из галогена, C1-С6-алкила, C1-С6-алкокси; связь в положении С4-С5 – двойная или простая; R1 и R2 обозначают, каждый независимо друг от друга, фенил и C1-С6-алкил; причем по меньшей мере один из R1 и R2 обозначает C1-С6-алкил; или R1 и R2 образуют с атомом азота, с которым они связаны, циклическую группу, содержащую от 4 до 7 звеньев и атом азота и, возможно, другой гетероатом, такой как азот или кислород, возможно, замещенный одной или несколькими C1-С6-алкильными группами; или к их фармацевтически приемлемым солям. Изобретение относится также к способам получения заявленных соединений формулы (I), а конкретно – соединений формул (Ia) и (Ib), в которых X1, Х3, Х3, Х4 и Y являются такими, как определены в общей формуле (I). Кроме того, изобретение относится к промежуточным продуктам синтеза соединений формулы (I) – соединениям формул (Va) и (Vb). В формуле (Va) X1, Х3 и Х4 – водороды; X2 – водород, галоген или C1-С6-алкокси и Y обозначает C1-С6-алкил, C1-С6-фторалкил, фенил, пиридинил или пиразинил; при этом фенил, возможно, замещен одним или несколькими атомами или группами, выбранными из галогена, С1-С6-алкила, C1-С6-алкокси. В формуле (Vb) X1 и Х3 – водород или С1-С6-алкокси; Х2 – водород, галоген, C1-С6-алкил или C1-С6-алкокси, Х4 – водород; Y обозначает фенил, пиридинил или пиримидинил; при этом фенил, возможно, замещен одним или несколькими атомами или группами, выбранными из галогена, C1-С6-алкила, C1-С6-алкокси. Изобретение относится также к лекарственному средству на основе соединения формулы (I) или его фармацевтически приемлемой соли для профилактики и лечения патологии, в которой участвуют рецепторы бензодиазепинов периферического типа. А также – к применению соединений формулы (I) для получения указанного лекарственного средства и к фармацевтической композиции для профилактики и лечения патологии, в которой участвуют рецепторы бензодиазепинов периферического типа. 8 н. и 3 з. п. ф-лы, 3 табл.
.    
Объектом изобретения являются соединения – производные 2Н- или 3Н-бензо[e]индазол-1-ил-карбамата, которые имеют сродство in vitro и in vivo к рецепторам бензодиазепинов периферического типа (сайты р или PBR).
Первым объектом изобретения являются соединения общей формулы (I), приведенной ниже.
Другим объектом изобретения являются способы получения соединений общей формулы (I).
Другим объектом изобретения является применение соединений общей формулы (I), в частности, в лекарственных средствах или в фармацевтических композициях.
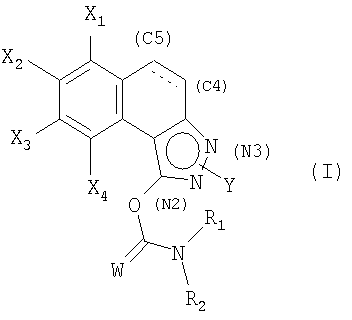
Соединения согласно изобретению соответствуют общей формуле (I):
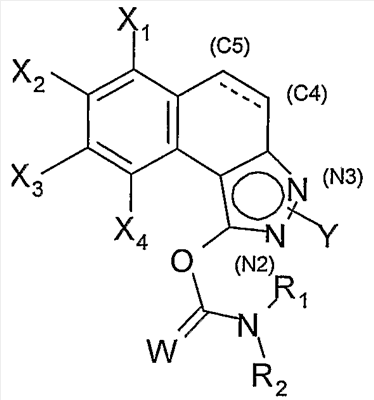
в которой
W обозначает атом кислорода или серы;
Х1, Х2, Х3 и Х4 обозначают, каждый независимо друг от друга, атом водорода или галогена или группу циано, С1-С6-алкильную, С1-С6-фторалкильную, С1-С6-алкокси, С1-С6-фторалкокси;
Y находится в положении (N2) или (N3);
когда Y находится в положении (N2), Y обозначает С1-С6-алкильную, С1-С6-фторалкильную, арильную или гетероарильную группу,
когда Y находится в положении (N3), Y обозначает арильную или гетероарильную группу,
при этом арильная или гетероарильная группы возможно замещены одним или несколькими атомами или группами, выбранными из атомов галогена, С1-С6-алкильной, С1-С6-алкокси, С1-С6-алкилтио, С1-С6-алкил-S(O)-, С1-С6-алкил-S(O)2-, С1-С6-фторалкильной групп;
связь в положении С4-С5 является двойной или простой; R1 и R2 обозначают, каждый независимо друг от друга, арильную, бензильную или С1-С6-алкильную группу; или R1 и R2 образуют с атомом азота, с которым они связаны, гетероцикл, возможно замещенный одной или несколькими С1-С6-алкильными или бензильными группами.
В рамках настоящего изобретения понимают под
– Сt-Сz, где t и z могут иметь значение от 1 до 6, углеродную цепочку, которая может содержать от t до z атомов углерода, например, под С1-3 – углеродную цепочку, которая может содержать от 1 до 3 атомов углерода;
– алкилом: алифатическую насыщенную линейную или разветвленную группу. В качестве примеров можно назвать метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную, пентильную и т.п. группы;
– фторалкилом: алкильную группу, один или несколько атомов водорода которой замещены атомом фтора;
– алкокси: радикал -О-алкил, в котором алкильная группа является такой, как определена выше;
– фторалкокси: группу алкокси, один или несколько атомов водорода которой замещены атомом фтора;
– алкилтио: радикал -S-алкил, в котором алкильная группа является такой, как определена выше;
– гетероциклом: циклическую группу, содержащую от 4 до 7 звеньев и содержащую атом азота и возможно другой герероатом, такой как азот, кислород или сера. В качестве примеров гетероциклов можно назвать азетидинильную, пирролидинильную, пиперидинильную, морфолинильную, тиоморфолинильную, азепинильную, пиперазинильную или гомопиперазинильную группы;
– арилом: ароматическую циклическую группу, содержащую от 6 до 10 атомов углерода. В качестве примеров арильных групп можно назвать фенильную или нафтильную группы;
– гетероарилом: ароматическую циклическую группу, содержащую от 5 до 6 звеньев и содержащую от 1 до 2 гетероатомов, таких как азот, кислород или сера. В качестве примеров гетероарильных групп можно назвать пиридинильную, тиенильную, фуранильную, пиримидинильную, пиразинильную или пиридазинильную группы;
– звеном: в циклической группе обозначает связь между двумя соседними атомами;
– атомом галогена: фтор, хлор, бром или йод.
Соединения общей формулы (I) могут содержать один или несколько асимметрических атомов углерода. Они могут иметь форму энантиомеров или диастереоизомеров. Эти энантиомеры и диастереоизомеры, а также их смеси, включая рацемические смеси, относятся к изобретению.
Соединения формулы (I) могут быть в форме оснований или солей присоединения с кислотой. Такие соли присоединения относятся к изобретению.
Эти соли преимущественно получают с фармацевтически приемлемыми кислотами, но соли других кислот, пригодных, например, для очистки или выделения соединения формулы (I), также относятся к изобретению.
Соединения общей формулы (I) могут быть в форме гидратов или сольватов, а именно в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты или сольваты также относятся к изобретению.
Из соединений формулы (I), являющихся объектом изобретения, первая подгруппа соединений состоит из соединений, в которых:
W обозначает атом кислорода или серы; и/или
Х1, Х2 и Х3 обозначают, каждый независимо друг от друга, атом водорода или галогена, более конкретно фтора, хлора или брома, или циано, С1-С6-алкильную, более конкретно метильную, С1-С6-алкокси, более конкретно метоксигруппу; и/или
Х4 обозначает атом водорода; и/или
Y находится в положении (N2) или (N3);
когда Y находится в положении (N2), Y обозначает С1-С6-алкильную, более конкретно метильную или этильную, С1-С6-фторалкильную, более конкретно трифторэтильную, арильную, более конкретно фенильную, или гетероарильную, более конкретно пиридинилбную или пиразинильную группу;
когда Y находится в положении (N3), Y обозначает арильную, более конкретно фенильную, или гетероарильную, более конкретно пиридинильную или пиримидинильную группу;
при этом арильная или гетероарильная группа возможно замещена одним или несколькими атомами или группами, более конкретно одним или двумя атомами или группами, выбранными из атомов галогена, более конкретно фтора, хлора, С1-С6-алкильной, более конкретно метильной, и С1-С6-алкокси, более конкретно метоксигруппами; и/или
связь в положении С4-С5 является двойной или простой; и/или
R1 и R2 обозначают, каждый независимо друг от друга, арильную, более конкретно фенильную, С1-С6-алкильную, более конкретно метильную, этильную, н-пропильную, трет-бутильную, изопропильную группу; или R1 и R2 образуют с атомом азота, с которым они связаны, гетероцикл, более конкретно пирролидинил, пиперидинил, морфолинил или пиперазинил, возможно замещенный одной или двумя С1-С6-алкильными, более конкретно метильными группами.
Из соединений формулы (I), являющихся объектом изобретения, вторая подгруппа соединений состоит из соединений, в которых:
W обозначает атом кислорода или серы; и/или
Х1, Х2 и Х3 обозначают, каждый независимо друг от друга, атом водорода или галогена, более конкретно фтора, хлора или брома, или С1-С6-алкильную, более конкретно метильную, С1-С6-алкокси, более конкретно метоксигруппу; и/или
Х4 обозначает атом водорода; и/или
Y находится в положении (N2) или (N3) и обозначает арильную, более конкретно фенильную или гетероарильную, более конкретно пиридинильную, пиразинильную или пиримидинильную группу;
при этом арильная или гетероарильная группа возможно замещена одним или несколькими атомами или группами, более конкретно одним или двумя атомами или группами, выбранными из атомов галогена, более конкретно фтора, хлора, С1-С6-алкильной, более конкретно метильной, и С1-С6-алкокси, более конкретно метокси групп; и/или
связь в положении С4-С5 является двойной или простой; и/или
R1 и R2 обозначают, каждый независимо друг от друга, арильную, более конкретно фенильную, С1-С6-алкильную, более конкретно метильную, этильную, н-пропильную, трет-бутильную, изопропильную группу; или R1 и R2 образуют с атомом азота, с которым они связаны, гетероцикл, более конкретно пирролидинил, пиперидинил, морфолинил или пиперазинил, возможно замещенный одной или двумя С1-С6-алкильными, более конкретно метильными группами.
Из соединений формулы (I), являющихся объектом изобретения, третья подгруппа соединений состоит из соединений, в которых:
W обозначает атом кислорода или серы; и/или
Х1, Х2 и Х3 обозначают, каждый независимо друг от друга, атом водорода или галогена, более конкретно фтора, хлора или брома, или С1-С6-алкильную, более конкретно метильную, С1-С6-алкокси, более конкретно метоксигруппу; и/или
Х4 обозначает атом водорода; и/или
Y находится в положении (N3) и обозначает арильную, более конкретно фенильную, или гетероарильную, более конкретно пиридинильную или пиримидинильную группу;
при этом арильная или гетероарильная группа возможно замещена одним или несколькими атомами или группами, более конкретно одним или двумя атомами или группами, выбранными из атомов галогена, более конкретно фтора, хлора, С1-С6-алкильной, более конкретно метильной, и С1-С6-алкокси, более конкретно метокси групп; и/или
связь в положении С4-С5 является двойной или простой; и/или
R1 и R2 обозначают, каждый независимо друг от друга, арильную, более конкретно фенильную, С1-С6-алкильную, более конкретно метильную, этильную, трет-бутильную, изопропильную группу; или R1 и R2 образуют с атомом азота, с которым они связаны, гетероцикл, более конкретно пиперидинил, возможно замещенный одной или двумя С1-С6-алкильными, более конкретно метильными группами.
Соединения общей формулы (I) можно получить способами, которые иллюстрируют следующие схемы.
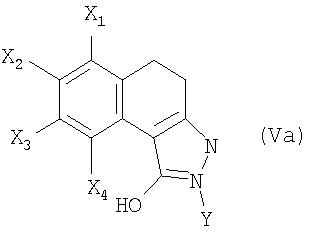
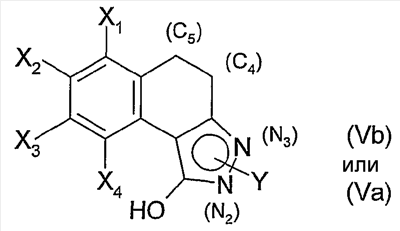
В соответствии с первым вариантом получения (схема 1) соединение общей формулы (II), в которой Х1, Х2, Х3 и Х4 являются такими, как определены в общей формуле (I), вводят во взаимодействие с метилкарбонатом в присутствии каталитического количества основания, такого как метанолат натрия или гидрид натрия для получения сложного кетоэфира общей формулы (III). Конденсация сложного кетоэфира (III) с гидразином, например, в полярном растворителе, таком как ДМФА или уксусная кислота, позволяет выделить пиразол общей формулы (IV). Последний затем подвергают неселективному N-замещению действием галогенида арила или гетероарила общей формулы Y-hal, в которой Y является таким, как определен в общей формуле (I), и hal является атомом галогена, такого как йод или бром, в присутствии основания, такого как карбонат калия или цезия или трифосфат калия, каталитического количества соли меди и диамина (S.L. Buchwald, J. Am. Chem. Soc., 2001, 123, 7727).
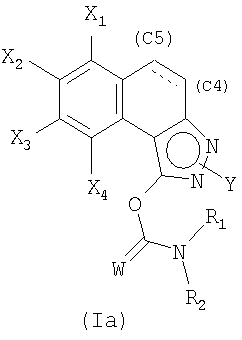
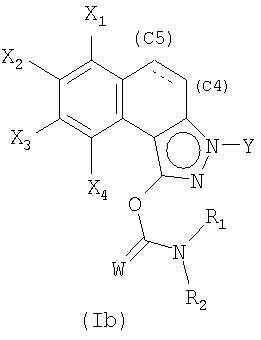
Затем полученную смесь, содержащую позиционные изомеры общей формулы (Va) и (Vb), в которых группа Y находится соответственно в положениях 2 и 3 пиразольного цикла, подвергают действию производного хлорида карбамоила общей формулы CIC(W)NR1R2, в которой W, R1 и R2 являются такими, как определены в общей формуле (I), в присутствии основания, такого как карбонат калия, гидрид натрия или триэтиламин, до получения карбаматов общих формул (Iа) и (Ib), которые на этой стадии отделяют методами, известными специалисту в данной области, такими как хроматография на колонке с силикагелем.
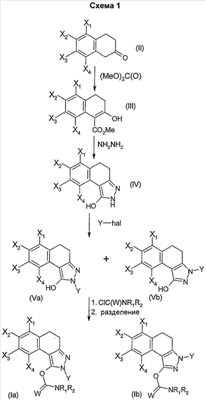
В качестве альтернативы второй вариант получения позволяет получать соединения общей формулы (Iа) (схема 2).
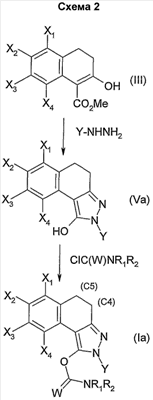
Он заключается в конденсации сложного кетоэфира общей формулы (III), такой как определена выше, с гидразином общей формулы Y-NH-NH2, в которой Y является таким, как определен в общей формуле (I), например, в полярном растворителе, таком как ДМФА или уксусная кислота, и позволяет выделить пиразол общей формулы (Vа), такой как определен выше. Этот последний затем подвергают ацилированию действием производного хлорида карбамоила общей формулы CIC(W)NR1R2, такой как определена выше, в присутствии основания, такого как карбонат калия, гидрид натрия или триэтиламин, до получения карбаматов общей формулы (Iа).
Простая связь в положении С4-С5 соединений общей формулы (I) возможно может быть дегидрирована до получения двойной связи методом, известным специалисту, например, по аналогии с методом, описанным Kozo, Shishido et al. Tetrahedron, 1989, 45, 18, 5791-5804. В качестве альтернативы соединения общей формулы (I), содержащие простую связь в положении С4-С5, можно дегидрировать путем взаимодействия с галогенирующим агентом, таким как N-бромсукцинимид, в присутствии инициатора, такого как 2,2′-азобис(2-метилпропионитрил). В этих условиях соединения общей формулы (I), содержащие простую связь в положении С4-С5, сначала подвергают галогенированию, затем полученный промежуточный продукт подвергают реакции элиминирования до получения соединения (I), содержащего двойную связь в положении С4-С5.
Реактивы на схемах 1 и 2, способ получения которых не описан, являются доступными в продаже или описаны в литературе, или их можно получить методами, которые там описаны или которые известны специалисту в данной области.
Соединения общей формулы (II) можно получить из коммерческих источников или получить методами, описанными в литературе (Sims, J.J. et al. Tetrahedron Lett. 1971, 951).
В соответствии с другим из своих аспектов изобретение относится также к соединениям формул (Va) и (Vb). Эти соединения могут быть пригодны в качестве промежуточных продуктов синтеза соединений формулы (I).
Следующая ниже таблица 1 иллюстрирует химические структуры и физические свойства нескольких соединений общих формул (Va) и (Vb) согласно изобретению. В колонке  PF PF указаны точки плавления продуктов. указаны точки плавления продуктов.
Таблица 1
 |
 |
Х1 |
Х2 |
Х3 |
Х4 |
Y |
PF (°С) |
| Va.1 |
H |
H |
H |
H |
2-(4-метилфенил) |
221-222 |
| Vb.1 |
H |
Me |
H |
H |
3-(пиридин-4-ил) |
315-316 |
| Va.2 |
H |
F |
H |
H |
2-(4-фторфенил) |
220-221 |
| Vb.2 |
H |
Cl |
H |
H |
3-(пиридин-4-ил) |
336-342 |
| Va.3 |
H |
Cl |
H |
H |
2-(пиридин-4-ил) |
190-216 |
В следующих примерах описано получение некоторых соединений согласно изобретению. Эти примеры не ограничивают, а только иллюстрируют изобретение. Номера соединений в примерах соответствуют номерам, приведенным в таблицах 1 и 2. Элементарные микроанализы, анализы ЖХ-МС (жидкостная хроматография в сочетании с масс-спектрометрией), спектры ИК и ЯМР подтверждают структуры полученных соединений.
Пример 1 (соединение 1)
7-фтор-2-(4-фторфенил)-4,5-дигидро-2Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат
1.1 Метил-6-фтор-2-гидрокси-3,4-дигидронафталин-1-илоат
В реактор объмом 2 л вводят 12,66 г (316 ммоль) 60%-ного гидрида натрия в масле, 900 мл толуола и 17,69 мл (210 ммоль) диметилкарбоната. Реакционную смесь перемешивают в течение 1 часа с обратным холодильником. Затем вводят раствор 19 г (115 ммоль) 6-фтор-3,4-дигидро-1Н-нафталин-2-она в 350 мл толуола. Реакционную смесь нагревают с обратным холодильником в течение 24 часов. Затем реакционную смесь охлаждают до 0°С, затем подкисляют путем добавления 114 мл уксусной кислоты. Вводят 114 мл воды и органическую фазу отделяют отстаиванием, промывают два раза 150 мл воды, затем 100 мл насыщенного водного раствора хлорида натрия. Затем органическую фазу сушат на сульфате магния, затем концентрируют при пониженном давлении до получения 26,1 г продукта, который используют как таковой на следующей стадии.
1.2 7-фтор-2-(4-фторфенил)-1-гидрокси-4,5-дигидро-2Н-бензо[e]индазол (Va.2)
В реактор объемом 100 мл вводят 2 г (9 ммоль) продукта, полученного на стадии 1.1 и 2,73 г (16,8 ммоль) 4-фторфенилгидразинхлоргидрата. Смесь растворяют в 100 мл уксусной кислоты и нагревают с обратным холодильником в течение 4 часов. Затем реакционную смесь охлаждают, после чего концентрируют при пониженном давлении. Остаток обрабатывают в 150 мл этилацетата и 100 мл воды. Органическую фазу отстаивают, промывают два раза по 100 мл воды, затем один раз 100 мл насыщенного водного раствора хлорида натрия. Органическую фазу затем сушат на сульфате магния, после чего концентрируют при пониженном давлении до получения 3,5 г целевого продукта.
Точка плавления: 220-221°С
1Н-ЯМР (ДМСО-d6):  (м.д.) 2,72 (дЧд, 2H), 2,95 (дЧд, 2H), 7,01 (м, 2Н), 7,3 (м, 2Н), 7,75 (м, 3Н). (м.д.) 2,72 (дЧд, 2H), 2,95 (дЧд, 2H), 7,01 (м, 2Н), 7,3 (м, 2Н), 7,75 (м, 3Н).
1.3 7-фтор-2-(4-фторфенил)-4,5-дигидро-2Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат (соединение 1)
В реактор объемом 500 мл вводят 3,5 г (9 ммоль) продукта, полученного на стадии 1.2, 3,48 г (25 ммоль) карбоната калия и 2,66 мл (21 ммоль) N,N-диэтилкарбамоилхлорида. Реакционную смесь нагревают с обратным холодильником в течение 24 часов, затем концентрируют при пониженном давлении. Полученный продукт обрабатывают в 100 мл этилацетата. Органическую фазу промывают два раза по 100 мл воды, затем один раз 100 мл насыщенного водного раствора хлорида натрия. Органическую фазу затем сушат на сульфате магния, после чего концентрируют при пониженном давлении до получения 5,96 г необработанного продукта. Смесь очищают хроматографией на колонке с силикагелем, элюируя смесью циклогексана и этилацетата. Таким образом 2,2 г целевого продукта выделяют и перекристаллизовывают в изопропаноле и получают 1,5 г (3,77 ммоль) конечного продукта.
Точка плавления: 141-142°С
1Н-ЯМР (CDCl3):  (м.д.) 1,95 (т, 3Н), 2,6 (т, 3Н), 2,97 (т, 2Н), 3,98 (т, 2Н), 3,4 (кв, 2H), 3,52 (кв, 2H), 7,00 (м, 2Н), 7,2 (м, 2Н), 7,32 (м, 1Н), 7,56 (м, 2Н). (м.д.) 1,95 (т, 3Н), 2,6 (т, 3Н), 2,97 (т, 2Н), 3,98 (т, 2Н), 3,4 (кв, 2H), 3,52 (кв, 2H), 7,00 (м, 2Н), 7,2 (м, 2Н), 7,32 (м, 1Н), 7,56 (м, 2Н).
Пример 2 (соединение 2)
7-фтор-2-(4-фторфенил)-2Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат
Раствор 0,7 г (1,76 ммоль) 7-фтор-2-(4-фторфенил)-4,5-дигидро-2Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамата, полученного на стадии 1.3 примера 1, и 1,2 г (5,2 ммоль) 2,3-дихлор-5,6-дициано-1,4-бензохинона в 25 мл толуола перемешивают в течение 2 часов, затем охлаждают. Смесь опрокидывают на 100 мл этилацетата. Эту органическую фазу промывают два раза 100 мл насыщенного водного раствора гидрогенокарбоната натрия, 100 мл воды, затем 100 мл насыщенного водного раствора хлорида натрия. Органическую фазу отделяют отстаиванием, затем сушат на сульфате магния и концентрируют при пониженном давлении. Очищают хроматографией на колонке с силикагелем (элюент: смесь метиленхлорида и этилацетета) и перекристаллизовывают в изопропаноле и получают 500 мг (1,26 ммоль) целевого продукта.
Точка плавления: 159-160°С
1Н-ЯМР (ДМСО):  (м.д.) 1,04 (т, 3Н), 1,21 (т, 3Н), 3,28 (кв, 2H), 3,55 (кв, 2H), 7,45 (м, 3Н), 7,7 (м, 5Н), 7,9 (дЧд, 1H). (м.д.) 1,04 (т, 3Н), 1,21 (т, 3Н), 3,28 (кв, 2H), 3,55 (кв, 2H), 7,45 (м, 3Н), 7,7 (м, 5Н), 7,9 (дЧд, 1H).
Пример 3 (соединения 3 и 4)
Хлоргидрата 7-хлор-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат (соединение 3) и хлоргидрата 7-хлор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат (соединение 4)
3.1 Метил-6-хлор-2-гидрокси-3,4-дигидронафталин-1-илоат
В реактор объемом 2 л вводят 10,1 г (252 ммоль) 60%-ного гидрида натрия в масле, 621 мл толуола и 14,18 мл (163 ммоль) диметилкарбоната. Реакционную смесь перемешивают в течение 1 часа с обратным холодильником. Затем вводят раствор 15,2 г (84 ммоль) 6-хлор-3,4-дигидро-1Н-нафталин-2-она в 268 мл толуола. Реакционную смесь нагревают с обратным холодильником в течение 24 часов. Затем реакционную смесь охлаждают до 0°С, затем подкисляют путем добавления 92 мл уксусной кислоты. Вводят 114 мл воды и органическую фазу отделяют и отстаивают, промывают три раза 150 мл воды, затем 100 мл насыщенного водного раствора хлорида натрия. Затем органическую фазу сушат на сульфате магния, затем концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюируя смесью циклогексана и дихлорметана) и получают 12,8 г (53,6 ммоль) целевого продукта, который используют как таковой на следующей стадии.
3.2 7-хлор-1-гидрокси-4,5-дигидро-2Н-бензо[e]индазол
В реактор объемом 2 л вводят 28 г (117 ммоль) продукта, полученного на стадии 3.1, и 28,6 мл г (586,6 ммоль) гидразинмоногидрата. Смесь растворяют в 782 мл уксусной кислоты и нагревают с обратным холодильником в течение 4 часов. Затем реакционную смесь охлаждают, после чего концентрируют при пониженном давлении. Полученный продукт обрабатывают в 300 мл этилацетата и 300 мл воды. Органическую фазу отстаивают, промывают два раза по 200 мл воды, затем один раз 200 мл насыщенного водного раствора хлорида натрия. Органическую фазу затем сушат на сульфате магния, после чего концентрируют при пониженном давлении. Полученный остаток растирают в порошок в 200 мл простого этилового эфира, затем фильтруют и получают 25 г (113,3 ммоль) целевого продукта.
Точка плавления: 232-233°С.
3.3 7-хлор-1-гидрокси-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[e]индазол и 7-хлор-1-гидрокси-3-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[e]индазол
В реактор объемом 2 л вводят в инертной атмосфере 15,2 г (68,8 ммоль) продукта, полученного на стадии 3.2, 16,95 г (82,66 ммоль) 4-йодпиридина, 4,14 мл (34,44 ммоль) транс-1,2-диаминоциклогексана, 1,31 г (6,89 ммоль) йодида меди и 36,55 г (172,2 ммоль) фосфата калия. Реакционную смесь суспендируют в 690 мл диоксана, нагревают с обратным холодильником в течение 24 часов, затем охлаждают. Смесь концентрируют при пониженном давлении, затем обрабатывают в 200 мл воды. Эту водную фазу подкисляют до рН 5 путем последовательного введения добавок уксусной кислоты. Суспензию перемешивают в течение 30 минут, затем полученный осадок фильтруют, промывают водой, затем сушат при пониженном давлении и получают 16,6 г (55,7 ммоль) целевого продукта N-арилирования в форме смеси изомеров.
ЖХ-МС: 2 пика при 60,4% и 38%, соответствующих [MH]+=298.
3.4 Хлоргидрата 7-хлор-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат (соединение 3) и хлоргидрата 7-хлор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат (соединение 4)
В реактор объемом 2 л вводят в инертной атмосфере 13 г (43,66 ммоль) смеси изомеров, полученной на стадии 3.3, 18,1 г (131 ммоль) тонкоизмельченного карбоната калия и 11,07 мл (87,32 ммоль) N,N-диэтилкарбамоилхлорида. Реакционную смесь суспендируют в 1 л ацетонитрила, нагревают с обратным холодильником в течение 24 часов, затем охлаждают. Реакционную смесь концентрируют при пониженном давлении. Полученный продукт обрабатывают в 300 мл этилацетата и 300 мл воды. Органическую фазу отстаивают, промывают два раза по 200 мл воды, затем один раз 200 мл насыщенного водного раствора хлорида натрия. Органическую фазу затем сушат на сульфате магния, после чего концентрируют при пониженном давлении. Полученный продукт содержит оба изомера положения (соединения 3 и 4). Их разделяют хроматографией на колонке (300 г силикагеля Merck 15-40 микрон, элюенты: смесь гептана и этилацетата).
Хлоргидрата 7-хлор-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат (соединение 3)
Продукт  3, выделенный таким образом, превращают в хлоргидрат путем растворения в растворе 0,1 н. соляной кислоты в изопропаноле. Раствор концентрируют досуха при пониженном давлении. Растирают в порошок в простом этиловом эфире, затем фильтруют и сушат при пониженном давлении, получают 2,3 г (5,79 ммоль) конечного продукта. 3, выделенный таким образом, превращают в хлоргидрат путем растворения в растворе 0,1 н. соляной кислоты в изопропаноле. Раствор концентрируют досуха при пониженном давлении. Растирают в порошок в простом этиловом эфире, затем фильтруют и сушат при пониженном давлении, получают 2,3 г (5,79 ммоль) конечного продукта.
Точка плавления: 250-251°С
1Н-ЯМР (ДМСО):  (м.д.) 1,08 (т, 3Н), 1,31 (т, 3Н), 2,98 (м, 4Н), 3,3 (кв, 2H), 3,68 (кв, 3H), 7,27 (д, 1Н), 7,38 (дЧд, 1H), 7,46 (дЧд, 1H), 7,92 (д, 2Н), 8,87 (д, 2Н). (м.д.) 1,08 (т, 3Н), 1,31 (т, 3Н), 2,98 (м, 4Н), 3,3 (кв, 2H), 3,68 (кв, 3H), 7,27 (д, 1Н), 7,38 (дЧд, 1H), 7,46 (дЧд, 1H), 7,92 (д, 2Н), 8,87 (д, 2Н).
Хлоргидрата 7-хлор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат (соединение 4)
Продукт  4, выделенный таким образом, превращают в хлоргидрат путем растворения в растворе 0,1 н. соляной кислоты в изопропаноле. Раствор концентрируют досуха при пониженном давлении. Растирают в порошок в простом этиловом эфире, фильтруют и сушат при пониженном давлении и получают 6,2 г (15,62 ммоль) конечного продукта. 4, выделенный таким образом, превращают в хлоргидрат путем растворения в растворе 0,1 н. соляной кислоты в изопропаноле. Раствор концентрируют досуха при пониженном давлении. Растирают в порошок в простом этиловом эфире, фильтруют и сушат при пониженном давлении и получают 6,2 г (15,62 ммоль) конечного продукта.
Точка плавления: 224-226°С
1Н-ЯМР (ДМСО):  (м.д.) 1,18 (т, 3Н), 1,29 (т, 3Н), 3,02 (т, 2Н), 3,31 (м, 4Н), 3,51 (кв, 2H), 7,20 (д, 1Н), 7,32 (дЧд, 1H), 7,45 (д, 1Н), 8,08 (д, 2Н), 8,98 (д, 2Н). (м.д.) 1,18 (т, 3Н), 1,29 (т, 3Н), 3,02 (т, 2Н), 3,31 (м, 4Н), 3,51 (кв, 2H), 7,20 (д, 1Н), 7,32 (дЧд, 1H), 7,45 (д, 1Н), 8,08 (д, 2Н), 8,98 (д, 2Н).
Пример 4 (соединение 5)
Хлоргидрата 8-метокси-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат
4.1 Метил-6-метокси-2-гидрокси-3,4-дигидронафталин-1-илоат
В реактор объемом 1 л вводят 3,4 г (85,12 ммоль) 60%-ного гидрида натрия в масле, 180 мл толуола и 4,78 мл (56,75 ммоль) диметилкарбоната. Реакционную смесь перемешивают в течение 1 часа с обратным холодильником. Затем вводят раствор 5 г (28,37 ммоль) 7-метокси-3,4-дигидро-1Н-нафталин-2-она в 100 мл толуола и затем перемешивают. Реакционную смесь нагревают с обратным холодильником в течение 24 часов. Затем реакционную смесь охлаждают до 0°С, затем подкисляют путем добавления 30 мл уксусной кислоты. Вводят 30 мл воды и отделенную органическую фазу отстаивают, промывают два раза 50 мл воды, затем 50 мл насыщенного водного раствора хлорида натрия. Затем органическую фазу сушат на сульфате магния, затем концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: смесь метиленхлорида и гептана) и получают 3,9 г (16,64 ммоль) целевого продукта, который используют как таковой на следующей стадии.
4.2 1-гидрокси-8-метокси-4,5-дигидро-2Н-бензо[e]индазол
В реактор объемом 0,5 л вводят 3,9 г (16,65 ммоль) продукта, полученного на стадии 4.1, и 4,06 мл (83,24 ммоль) гидразинмоногидрата. Смесь растворяют в 166 мл уксусной кислоты и нагревают с обратным холодильником в течение 4 часов. Затем реакционную смесь охлаждают, после чего концентрируют при пониженном давлении. Полученный продукт обрабатывают в 100 мл этилацетата и 100 мл воды. Органическую фазу отстаивают, промывают два раза по 100 мл воды, затем один раз 100 мл насыщенного водного раствора хлорида натрия. Органическую фазу затем сушат на сульфате магния, после чего концентрируют при пониженном давлении. Полученный остаток растирают в порошок в 50 мл простого этилового эфира, затем фильтруют и получают 2,4 г (11,1 ммоль) целевого продукта.
4.3 1-гидрокси-8-метокси-2-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[e]индазол
В реактор объемом 0,1 л вводят в инертной атмосфере 1,2 г (5,55 ммоль) продукта, полученного на стадии 4.2, 1,36 г (6,66 ммоль) 4-йодпиридина, 0,33 мл (2,77 ммоль) транс-1,2-диаминоциклогексана, 0,105 г (0,55 ммоль) йодида меди и 2,94 г (13,87 ммоль) фосфата калия. Реакционную смесь суспендируют в 55 мл диоксана, нагревают с обратным холодильником в течение 24 часов, затем охлаждают. Потом смесь обрабатывают в 1 л смеси 1/1 воды и этилацетата. Органическую фазу отстаивают, затем промывают водой (50 мл). Эту органическую фазу подкисляют до рН 5 путем последовательного введения добавок уксусной кислоты. Полученный осадок фильтруют и промывают водой, затем сушат при пониженном давлении и получают 0,2 г (0,68 ммоль) ожидаемого продукта N-арилирования. Органическую фазу сушат на сульфате магния, затем концентрируют при пониженном давлении. Полученный продукт очищают хроматографией на колонке с силикагелем (элюенты: смесь дихлорметана и метанола) и получают дополнительно 0,57 г (1,94 ммоль) целевого продукта N-арилирования.
1Н-ЯМР (ДМСО-d6):  (м.д.) 2,89 (дЧд, 3H), 3,09 (дЧд, 2H), 3,73 (с, 3Н), 6,2 (дЧд, 1H), 7,1 (м, 2Н), 7,48 (м, 2Н), 8,6 (м, 2Н). (м.д.) 2,89 (дЧд, 3H), 3,09 (дЧд, 2H), 3,73 (с, 3Н), 6,2 (дЧд, 1H), 7,1 (м, 2Н), 7,48 (м, 2Н), 8,6 (м, 2Н).
4.4 8-метокси-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[e]индазол-1-ил-N,N-диэтилкарбамат (соединение 5)
В реактор объемом 0,1 л вводят в инертной атмосфере 0,77 г (2,63 ммоль) продукта, полученного на стадии 4.3, 1,09 г (7,88 ммоль) тонкоизмельченного карбоната калия и 0,67 мл (5,25 ммоль) N,N-диэтилкарбамоилхлорида. Реакционную смесь суспендируют в 30 мл ацетонитрила, нагревают с обратным холодильником в течение 24 часов, затем охлаждают. Реакционную смесь концентрируют при пониженном давлении. Полученный продукт обрабатывают в 100 мл этилацетата и 100 мл воды. Органическую фазу отстаивают, промывают два раза по 50 мл воды, затем один раз 50 мл насыщенного водного раствора хлорида натрия. Органическую фазу затем сушат на сульфате магния, после чего концентрируют при пониженном давлении. Полученный продукт очищают хроматографией на колонке (90 г силикагеля Merck 15-40 микрон, элюенты: смесь гептана и этилацетата). Выделенный таким образом продукт перекристаллизовывают в изопропаноле, затем повторно растворяют в растворе 0,1 н. соляной кислоты в изопропаноле. Раствор концентрируют досуха при пониженном давлении. Растирают в порошок в простом этиловом эфире, фильтруют и сушат при пониженном давлении и получают 234 мг (0,59 ммоль) целевого продукта.
Точка плавления : 225-227°С
1Н-ЯМР (ДМСО):  (м.д.) 1,15 (т, 3Н), 1,3 (т, 3Н), 2,92 (т, 2Н), 3,2-3,4 (м, 4Н), 3,51 (кв, 2H), 3,71 (с, 3Н), 6,8 (м, 2Н), 7,2 (д, 1H), 7,98 (д, 2H), 8,82 (д, 2Н). (м.д.) 1,15 (т, 3Н), 1,3 (т, 3Н), 2,92 (т, 2Н), 3,2-3,4 (м, 4Н), 3,51 (кв, 2H), 3,71 (с, 3Н), 6,8 (м, 2Н), 7,2 (д, 1H), 7,98 (д, 2H), 8,82 (д, 2Н).
Пример 5 (соединение 82)
Хлоргидрата 7-хлор-4,5-дигидро-3-(пиридин-4-ил)-3Н-бензо[e]индазол-1-ил-N,N-диизопропилкарбамат
В реактор объемом 1 л в инертной атмосфере вводят по каплям и при 0°С в суспензию 0,4 г (10,04 ммоль) гидрида натрия в 17 мл диметилформамида, 23 г (7,72 ммоль) смеси изомеров, полученной на стадии 3.3 примера 3, в растворе в 30 мл диметилформамида. Перемешивают в течение 1 часа при комнатной температуре, потом вводят по каплям 1,39 г (8,5 ммоль) N,N-диизопропилкарбамоилхлорида в 30 мл диметилформамида. Реакционную смесь перемешивают в течение 18 часов при комнатной температуре, затем концентрируют при пониженном давлении. Полученный продукт обрабатывают в 300 мл этилацетата и 300 мл воды. рН водной фазы доводят до 5 путем добавления уксусной кислоты. Органическую фазу отстаивают, промывают два раза по 200 мл воды, затем один раз 200 мл насыщенного водного раствора хлорида натрия. Органическую фазу затем сушат на сульфате магния, после чего концентрируют при пониженном давлении. Полученный продукт очищают хроматографией на колонке (300 г силикагеля Merck 15-40 микрон, элюенты: смесь дихлорметана и этилацетата). Выделенный таким образом продукт превращают в хлоргидрат путем растворения в растворе 0,1 н. соляной кислоты в изопропаноле. Раствор концентрируют досуха при пониженном давлении. Растирают в порошок в простом этиловом эфире, фильтруют и сушат при пониженном давлении и получают 1,2 г (2,6 ммоль) целевого продукта.
Точка плавления: 237-269°С
1Н-ЯМР (ДМСО):  (м.д.) 1,29 (м, 12Н), 3,02 (м, 2Н), 3,19 (м, 2Н), 3,91 (м, 1Н), 4,2 (м, 1Н), 7,2 (д, 1H), 7,35 (дЧд, 1Н), 7,42 (с, 1Н), 7,6 (д, 2H), 8,7 (д, 2Н). (м.д.) 1,29 (м, 12Н), 3,02 (м, 2Н), 3,19 (м, 2Н), 3,91 (м, 1Н), 4,2 (м, 1Н), 7,2 (д, 1H), 7,35 (дЧд, 1Н), 7,42 (с, 1Н), 7,6 (д, 2H), 8,7 (д, 2Н).
Пример 6 (соединение 84)
Хлоргидрата 7-хлор-3-(пиридин-4-ил)-3Н-бензо[e]индазол-1-ил-N,N-диизопропилкарбамат
В реактор объемом 100 мл вводят 1,65 г (3,38 ммоль) 7-хлор-4,5-дигидро-3-(пиридин-4-ил)-3Н-бензо[e]индазол-1-ил-N,N-диизопропилкарбамата, полученного методом, описанным в примере 5, 1,105 г (6,21 ммоль) N-бромсукцинимида и 0,127 г (0,78 ммоль) 2,2′-азобис(2-метилпропионитрила). Смесь растворяют в 40 мл тетрахлорида углерода, перемешивают в течение 24 часов с обратным холодильником при пониженном давлении. Полученный продукт обрабатывают в 300 мл дихлорметана и 2 мл концентрированного водного раствора аммиака. Органическую фазу отделяют, промывают 200 мл воды, затем 200 мл насыщенного водного раствора хлорида натрия. Органическую фазу затем сушат на сульфате магния, после чего концентрируют при пониженном давлении. Полученный продукт очищают хроматографией на колонке с оксидом алюминия (элюенты: смесь дихлорметана и метанола), затем на колонке с кремнеземом (элюенты: смесь дихлорметана и этилацетата).
Выделенный таким образом продукт превращают в хлоргидрат путем растворения в растворе 0,1 н. соляной кислоты в изопропаноле. Раствор концентрируют досуха при пониженном давлении. Растирают в порошок в простом этиловом эфире, фильтруют и сушат при пониженном давлении и получают 1,2 г (2,6 ммоль) целевого продукта.
Точка плавления: 234-248°С
1Н-ЯМР (ДМСО):  (м.д.) 1,42 (м, 12Н), 4,02 (м, 1Н), 4,41 (м, 1Н), 7,6 (дЧд, 1Н) 7,8 (м, 3Н), 7,92 (д, 2H), 8,15 (д, 1H), 8,79 (д, 2H). (м.д.) 1,42 (м, 12Н), 4,02 (м, 1Н), 4,41 (м, 1Н), 7,6 (дЧд, 1Н) 7,8 (м, 3Н), 7,92 (д, 2H), 8,15 (д, 1H), 8,79 (д, 2H).
Нижеследующая таблица 2 иллюстрирует химические структуры и физические свойства нескольких соединений общей формулы (I) согласно изобретению.
В колонке «Соль» этой таблицы «НСl» обозначает хлоргидрат, «-» обозначает соединение в состоянии основания. Молярные отношения кислота:основание указаны в той же колонке. В колонке «PF» указаны точки плавления продуктов, при этом аморфные соединения охарактеризованы результатами их анализа путем масс-спектрометрии (MS).
* [MH]+
Соединения согласно изобретению подвергали фармакологическим испытаниям, которые выявили, что они представляют интерес в качестве веществ, обладающих терапевтической активностью.
Соединения согласно изобретению обладают также свойством растворяться в воде, которое способствует их высокой активности in vivo.
Исследование связывания [3H]Ro5-4864 с рецепторами перифрического типа бензодиазепинов (сайты p или PBR)
Определяли сродство соединений согласно изобретению к сайтам p или PBR (сайты связи периферического типа с бензодиазепинами).
Рецепторы сайтов р селективно метили в почечных мембранах крысы, инкубированных в присутствии [3H]Ro5-4864. Сродство соединений согласно изобретению в отношении указанных рецепторов исследовали in vitro.
Использовали самцов крыс Sprague Dawley (Iffa Credo) весом от 180 до 300 мг. После обезглавливания извлекали почку и ткань гомогенизировали при 4°С при помощи гомогенизатора PolytronTM в течение 2 минут со скоростью, равной 6/10 максимальной скорости, в 35 объемах фосфатного буфера Na2HPO4 50 мМ, с рН, доведенным до 7,5 с помощью NaH2PO4. Мембранный гомогенат фильтровали через газ (sur gaze) и подвергали десятикратному разведению буфером. [3H]Ro5-4864 (специфическая активность: 70-90 Ки/мМоль; New England Nuclear) в концентрации 0,5 нМ инкубировали в присутствии 10 мкл мембранного гомогената в конечном объеме, равном 1 мл, буфера, содержащего тестируемое соединение.
После инкубирования в течение 3 часов при 0°С мембраны отделяли фильтрованием через фильтры Whatman GF/BTM, промывали 2 раза с помощью 4,5 л буфера холодного инкубирования (0°С). Количество радиоактивности на фильтре измеряли жидкостной сцинтиграфией.
Для каждой концентрации исследуемого соединения определяли процент ингибирования связи [3H]Ro5-4864, затем концентрацию CI50, концентрацию, которая ингибирует специфическое связывание на 50%.
Значения CI50 соединений согласно изобретению, обладающих наибольшей активностью, составляли от 0,5 нМ до 300 нМ. В частности, соединения 14, 20 и 56 в таблице 2 имеют значения CI50 1,6 нМ, 2,8 нМ и 1,4 нМ соответственно.
Соединения согласно изобретению являются таким образом лигандами, имеющими сродство к рецепторам бензодиазепинов периферического типа.
Исследование нейропротекторной активности
Тест на выживание двигательных нейронов после рассечения лицевого нерва крысы в возрасте 4 дней
После поражения лицевого нерва четырехдневной крысы мотонейроны лицевого ядра подвергали нейронной смерти путем апоптоза. Оценку выживания нейронов проводили гистологическими методами и подсчетом нейронов.
Проводили анастезию четырехдневных крыс пентобарбиталом (3 мг/кг путем i.p.).
Правый лицевой нерв извлекали и разрезали на его выходе из шилососцевидного отверстия. Проснувшихся крысят возвращали матери и в течение 7 дней проводили лечение путем перорального и внутрибрюшного введения доз от 1 до 10 мг/кг один или два раза в день.
Через 7 дней после рассечения животных обезглавливали и замораживали мозг в изопентане при -40°С. Лицевое ядро полностью разрезали криостатом на секции размером 10 мкм. Мотонейроны окрашивали фиолетовым крезилом и подсчитывали с использованием программы HistoTM (BiocomTM).
В этой модели соединения согласно изобретению повышали выживание нейронов на 38-78%. Ниже в таблице 3 приведены результаты теста на выживание двигательных нейронов в отношении соединений 14, 20 и 56 из таблицы 2.
| Таблица 3 |
 |
14 |
20 |
56 |
| % повышения выживаемости нейронов (10 мг/кг po) |
38% |
59% |
74% |
Результаты испытаний показывают, что соединения согласно изобретению, обладающие наибольшей активностью, способствуют нейропротекции.
Таким образом, соединения согласно изобретению можно использовать для получения лекарственных средств, в частности, для получения лекарственного средства, предназначенного для профилактики или лечения патологии, в которой участвуют рецепторы периферического типа бензодиазепинов.
Таким образом, изобретение в соответствии с другим своим аспектом относится к лекарственным средствам, которые содержат соединение формулы (I) или соль присоединения последнего и фармацевтически приемлемой кислоты или гидрата или сольвата.
Эти лекарственные средства находят применение в терапии, в частности, для профилактики и/или лечения невропатий различных типов, таких как травматические или ишемические невропатии, инфекционная, алкогольнные, диабетические, медикаментозные или генетические невропатии, а также поражения двигательных нейронов, такие как позвоночные амиотрофии и боковой амиотрофический склероз. Эти лекарственные средства также находят применение в лечении нейродегенеративных заболеваний центральной нервной системы или острого типа, таких как нарушение мозгового кровообращения и черепно-мозговые травмы, или хронического типа, таких как аутоиммунные заболевания (рассеянный склероз), болезнь Альцгеймера, болезнь Паркинсона и любое другое заболевание, при котором применение нейропротекторных/нейротрофных факторов должно иметь терапевтический эффект.
Соединения согласно изобретению можно также использовать для получения лекарственных средств, предназначенных для профилактики и/или лечения тревоги, эпилепсии и нарушений сна. Действительно, лиганды сайтов р или РВR стимулируют продуцирование нейростероидов, таких как прегненолон, дегидроэпиандростерон и 3-альфагидрокси-5-альфапрегнан-20-он, способствуя переходу холестерина извне внутрь митохондриальной мембраны. Эти нейростероиды модулируют активность макромолекулярного комплекса GABAA-канал хлорид и таким образом могут продуцировать активность, подавляющую тревогу, противосудорожную и седативную.
Соединения согласно изобретению можно также использовать при лечении острой или хронической почечной недостаточночти, гломерулонефрита, диабетической нефропатии, ишемии и сердечной недостаточночти, инфаркта миокарда, ишемии нижних конечностей, вазоспазма коронарных сосудов, стенокардии, патологий, связанных с сердечными клапанами, воспалительных заболеваний сердца, побочных эффектов, связанных с кардиотоксическими препаратами или с последствиями операций на сердце, атеросклероза и его тромбоэмболических осложнений, рестеноза, отторжения трансплантатов, состояний, связанных с пролиферацией или неправильной миграцией клеток гладкой мускулатуры.
Кроме того, опубликованные новые данные показывают, что рецептор бензодиазепинов периферического типа, по-видимому, играет фундаментальную роль в регуляции клеточной пролиферации и в процессах канцеризации. Обычно по сравнению с нормальными тканями повышенная плотность рецепторов бензодиазепинов периферического типа наблюдается в различных видах опухолей и рака.
В человеческих астоцитомах уровень экспрессии рецептора бензодиазепинов периферического типа коррелируется со степенью злокачественности опухоли, индексом пролиферации и выживаемостью пациентов. В опухолях мозга человека увеличение количества рецепторов бензодиазепинов периферического типа используют как критерий диагностики при медицинской визуализации и в качестве терапевтической мишени для конъюгатов, образованных из лиганда рецептора бензодиазепинов периферического типа и цитостатического препарата. Повышенная плотность рецепторов бензодиазепинов периферического типа также наблюдается в карциномах яичников и в злокачественных опухолях молочной железы. Относительно последних было показано, что уровень экспрессии рецепторов бензодиазепинов периферического типа связан с агрессивным потенциалом опухоли; к тому же присутствие агониста рецептора бензодиазепинов периферического типа стимулирует рост раковой линии молочной железы.
Совокупность этих результатов, которая указывает на функцию делеции рецептора бензодиазепинов периферического типа в процессах канцеризации, является основополагающей для поиска синтетических специфических лигандов рецептора бензодиазепинов периферического типа, способных блокировать его действие.
Таким образом, соединения можно использовать для лечения опухолей и рака.
Рецепторы бензодиазепинов периферического типа присутствуют также на уровне кожи, и в этой связи соединения согласно изобретению можно применять для профилактики или лечения кожных стрессов.
Под кожным стрессом понимают различные ситуации, которые могут вызвать нарушения, в частности, на уровне эпидермиса независимо от агента, который вызывает этот стресс. Этот агент может быть внутренним и/или внешним по отношению к организму, таким как химический или содержащий свободные радикалы агент, или внешним, таким как ультрафиолетовое излучение.
Таким образом, соединения, применяемые согласно изобретению, предназначены для профилактики или лечения кожных раздражений, лишая, эритемы, извращения чувствительности, ощущения жжения, кожного зуда и/или зуда слизистых, старения и могут также применяться при кожных нарушениях, таких как псориаз, заболевания, вызывающие зуд, герпес, фотодерматозы, атопические дерматиты, контактные дерматиты, лихен, пруриго, зуд, укусы насекомых, при фиброзах и других нарушениях созревания коллагенов, при иммунологических нарушениях или при дерматологических заболеваниях, таких как экзема.
Соединения согласно изобретению можно также использовать для профилактики и лечения хронических воспалительных заболеваний, в частности, ревматоидного полиартрита и легочных воспалительных заболеваний.
В соответствии с другим своим аспектом настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного вещества соединение согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения согласно изобретению или фармацевтически приемлемую соль, гидрат или сольват указанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают в соответствии с фармацевтической формой и требуемым способом введения из традиционных эксципиентов, известных специалисту.
В фармацевтических композициях согласно настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, местного, локального, интратрахеального, интраназального, чрескожного или ректального введения активное вещество указанной выше формулы (I), или возможно его соль, сольват или гидрат, можно вводить в форме для разового приема, в смеси с классическими фармацевтическими эксципиентами, животным или человеку для профилактики или лечения указанных нарушений или заболеваний.
К приемлемым формам для разового введения относятся формы для перорального введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и растворы или суспезии для перорального приема, формы для введения сублингвального, перорального, интратрахеального, внутриглазного, интраназального, путем ингаляции, формы для местного, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения или имплантаты. Для местного применения можно применять соединения согласно изобретению в составе кремов, гелей, мазей или лосьонов.
В качестве примера форма для разового введения соединения согласно изобретению в форме таблетки может содержать следующие компоненты:
| Соединение согласно изобретению |
50,0 мг |
| Маннит |
223,75 мг |
| Натриевая кроскарамеллоза |
6,0 мг |
| Кукурузный крахмал |
15,0 мг |
| Гидроксипропилметилцеллюлоза |
2,25 мг |
| Стеарат магния |
3,0 мг |
Указанные разовые формы имеют дозировку, обеспечивающую суточную дозу от 0,001 до 20 мг активного вещества на кг массы тела в соответствии с галеновой формой.
В отдельных случаях могут требоваться бульшие или меньшие дозировки, такие дозировки не выходят за рамки изобретения. В соответствии с традиционной практикой дозировка, требующаяся для каждого пациента, определяется врачом в зависимости от способа введения, массы тела и индивидуальной реакции данного пациента.
В соответствии с другим своим аспектом настоящее изобретение относится также к способу лечения указанных патологий, который включает в себя введение пациенту эффективной дозы соединения согласно изобретению или одной из его фармацевтически приемлемых солей или гидратов или сольватов.
Формула изобретения
1. Соединение, соответствующее формуле (I)
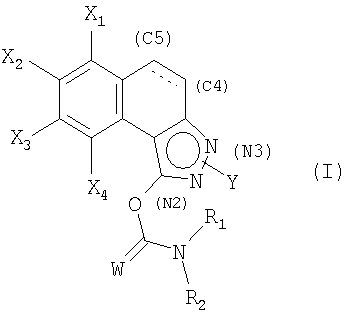
в которой
W обозначает атом кислорода или серы;
X1 и Х3 обозначают, каждый независимо друг от друга, атом водорода или С1-С6-алкокси;
Х2 обозначает атом водорода, галогена, C1-С6-алкильную или C1-C6-алкоксигруппу и
Х4 обозначает атом водорода,
Y находится в положении (N2) или (N3);
когда Y находится в положении (N2), Y обозначает C1-С6-алкильную, C1-С6-фторалкильную, фенильную, пиридинильную или пиразинильную группу;
когда Y находится в положении (N3), Y обозначает фенильную, пиридинильную или пиримидинильную группу,
при этом фенильная группа, возможно, замещена одним или несколькими атомами или группами, выбранными из атомов галогена, C1-С6-алкильной, С1-С6-алкоксильной групп;
связь в положении С4-С5 является двойной или простой;
R1 и R2 обозначают, каждый независимо друг от друга, фенильную и C1-С6-алкильную группу; причем по меньшей мере один из R1 и R2 обозначает С1-С6-алкильную группу; или R1 и R2 образуют с атомом азота, с которым они связаны, циклическую группу, содержащую от 4 до 7 звеньев и содержащую атом азота и возможно другой гетероатом, такой как азот или кислород, возможно, замещенный одной или несколькими C1-С6-алкильными группами;
или его фармацевтически приемлемые соли.
2. Соединение формулы (I) по п.1, отличающееся тем, что
W обозначает атом кислорода или серы;
X1 и Х3 обозначают, каждый независимо друг от друга, атом водорода или C1-С6-алкокси;
Х2 обозначает атом водорода, галогена, C1-С6-алкильную или C1-С6-алкоксигруппу и
Х4 обозначает атом водорода,
Y находится в положении (N2) или (N3);
когда Y находится в положении (N2), Y обозначает С1-С6-алкильную, C1-С6-фторалкильную, фенильную, пиридинильную или пиразинильную группу;
когда Y находится в положении (N3), Y обозначает фенильную, пиридинильную или пиримидинильную группу;
при этом фенильная группа, возможно, замещена одним или несколькими атомами или группами, выбранными из атомов галогена, С1-С6-алкильной и C1-С6-алкоксильной групп;
связь в положении С4-С5 является двойной или простой;
R1 и R2 обозначают, каждый независимо друг от друга, фенильную или C1-С6-алкильную группу; или R1 и R2 образуют с атомом азота, с которым они связаны, циклическую группу, содержащую от 4 до 7 звеньев и содержащую атом азота и возможно другой гетероатом, такой как азот или кислород, возможно, замещенный одной или двумя С1-С6-алкильными группами;
или его фармацевтически приемлемые соли.
3. Соединение формулы (I) по любому из пп.1 и 2, которое представляет собой
N,N-Диэтилкарбамат 7-фтор-2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-фтор-2-(4-фторфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-хлор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 8-метокси-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диметилкарбамат 2-(4-метилфенил)-4,5-дигидро-2Н-бензо [е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(4-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
Морфолинил-4-карбоксилат 2-(3-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диметилкарбамат 2-(3-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(3-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
Пирролидинил-1-карбоксилат 2-(3-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диизопропилкарбамат 2-(3-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-фенил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-фенил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N-Метил-N-фенилкарбамат 2-(3-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(2-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-этил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N-Метил-N-фенилкарбамат 2-этил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N-Метил-N-фенилкарбамат 2-(2,2′,2”-трифторэтил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N-Метил-N-фенилкарбамат 2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
Пирролидинил-1-карбоксилат 2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
Пиперидинил-1-карбоксилат 2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
Морфолинил-4-карбоксилат 2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диметилкарбамат 2-(4-хлорфенил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диизопропилкарбамат 2-(4-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N-Метил-N-фенилкарбамат 2-(4-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
Пирролидинил-1-карбоксилат 2-(4-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
Пиперидинил-1-карбоксилат 2-(4-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
Морфолинил-4-карбоксилат 2-(4-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
4-Метил-пиперазинил-1-карбоксилат 2-(4-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диметилкарбамат 2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
4-Метил-пиперазинил-1-карбоксилат 2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диметилкарбамат 2-фенил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диизопропилкарбамат 2-фенил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N-Метил-N-фенилкарбамат 2-фенил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
Пирролидинил-1-карбоксилат 2-фенил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкapбaмaт 7-хлор-2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N-Метил-N-пропилкарбамат 2-(4-фторфенил)-4,6-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(3-хлор-4-метилфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(3-хлор-4-фторфенил)-4,6-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(3-хлор-4-метилфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(2,4-дифторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-хлор-2-(пиридин-2-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-метокси-2-(4-фторфенил)-4,5-дигидро-2Н-бензо [е]индазол-1-ила;
N,N-Диэтилкарбамат 7-бром-2-(4-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(3-хлор-4-(фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-метил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкapбaмaт 2-(3-хлорфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(4-фторфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Метил-N-пропилкарбамат 2-(4-фторфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(3-хлор-4-фторфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 2-(3-хлор-4-метилфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкapбaмaт 7-хлор-2-(4-фторфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(3-хлор-4-фторфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(3-хлор-4-метилфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(2,4-дифторфенил)-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-метокси-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-метил-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-хлор-3-(пиридин-3-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-хлор-2-(пиридин-3-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-фтор-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-фтор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-хлор-3-(4-фторфенил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-3-(пиридин-2-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-хлор-2-(3-фторфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-3-(3-фторфенил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-бром-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-бром-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-хлор-3-(4-метилфенил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(4-метилфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(2-фторфенил-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-3-(4-хлорфенил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила;
N,N-Диэтилкapбaмaт 7-хлор-2-(4-хлорфенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-2-(4-метоксифенил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-3-(4-метоксифенил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила;
N,N-Диэтилкарбамат 7-хлор-3-(3-фторфенил)-3Н-бензо[е]индазол-1-ила;
N-Метил-N-фенилкарбамат 7-хлор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила;
N,N-Диизопропилкарбамат 7-хлор-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диизопропилкарбамат 7-хлор-4,5-дигидро-3-(пиридин-4-ил)-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 6-метокси-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диизопропилкарбамат 7-хлор-3-(пиридин-4-ил)-3Н-бензо[е]индазол-1-ила, гидрохлорид;
Пиперидинил-1-карбоксилат 7-хлор-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила, гидрохлорид;
Пиперидинил-1-карбоксилат 7-хлор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диизопропилкарбамат 7-хлор-2-(пиридин-3-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диизопропилкарбамат 7-хлор-3-(пиридин-3-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диизопропилкарбамат 7-хлор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
цис-2,6-Диметил-пиперидинил-1-карбоксилат 7-хлор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N-метил-N-трет-бутилкарбамат 7-хлор-2-(пиридин-4-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диизопропилкарбамат 7-хлор-3-(пиридин-3-ил)-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диизопропилкарбамат 7-хлор-3-(пиридин-2-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила;
N,N-Диизопропилкарбамат 7-фтор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диизопропилкарбамат 7-хлор-3-(пиримидин-2-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила;
N,N-Диизопропилкарбамат 7-хлор-2-(пиридин-2-ил)-4,5-дигидро-2Н-бензо[е]индазол-1-ила;
N,N-Диизопропилкарбамат 7-фтор-3-(пиридин-4-ил)-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диизопропилкарбамат 7-хлор-3-(пиридин-2-ил)-3Н-бензо[е]индазол-1-ила;
N-метил-N-трет-бутилкарбамат 7-хлор-3-(пиридин-4-ил)-4,5-дигидро-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N,N-Диэтилкарбамат 7-хлор-3-(пиридин-4-ил)-3Н-бензо[е]индазол-1-ила, гидрохлорид;
N-метил-N-фенилкарбамат 7-хлор-3-(пиридин-4-ил)-3Н-бензо[е]индазол-1-ила, гидрохлорид.
4. Способ получения соединения формулы (I) по любому из пп.1-3, отличающийся тем, что вводят во взаимодействие смесь, состоящую из позиционных изомеров общих формул (Va) и (Vb)
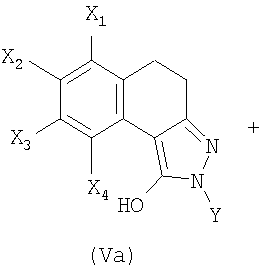 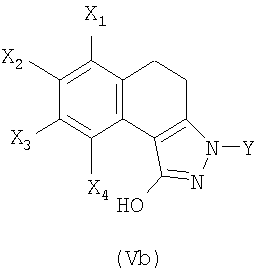
в которых X1, Х2, Х3, Х4 и Y являются такими, как определены в общей формуле (I) по п.1, и в которых группа Y находится соответственно в положении (N2) и (N3) пиразольного цикла,
и производное карбамоилхлорида общей формулы CIC(W)NR1R2, в которой W, R1 и R2 являются такими, как определены в общей формуле (I) по п.1, в присутствии основания
для получения после разделения соединений общих формул (Iа) и (Ib)
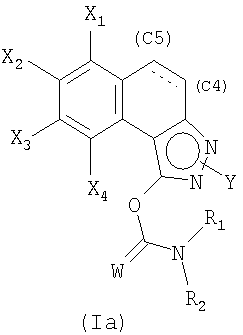 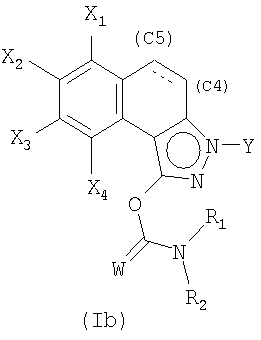
причем простую связь в положении С4-С5 затем, возможно, дегидрируют для образования двойной связи.
5. Способ получения соединения формулы (Iа)
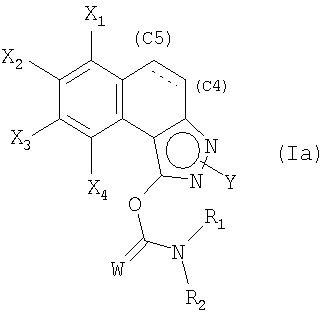
в которой
W обозначает атом кислорода или серы;
в которых X1, Х2, Х3, Х4 и Y являются такими, как определены в общей формуле (I) по п.1,
Y находится в положении (N2), Y обозначает C1-С6-алкильную, C1-С6-фторалкильную, фенильную, пиридинильную или пиразинильную группу;
при этом фенильная группа, возможно, замещена одним или несколькими атомами или группами, выбранными из атомов галогена, C1-С6-алкильной, C1-С6-алкоксильной групп;
связь в положении С4-С5 является двойной или простой;
R1 и R2 обозначают, каждый независимо друг от друга, фенильную и C1-С6-алкильную группу; или R1 и R2 образуют с атомом азота, с которым они связаны, циклическую группу, содержащую от 4 до 7 звеньев и содержащую атом азота и возможно другой гетероатом, такой как азот или кислород, возможно, замещенный одной или несколькими C1-С6-алкильными группами;
отличающийся тем, что вводят во взаимодействие соединение общей формулы (Va)
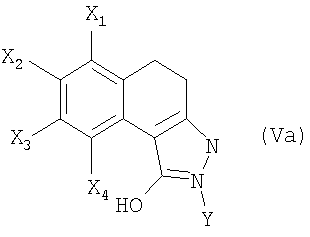
в которой
X1, Х2, Х3, Х4 и Y являются такими, как определены выше в общей формуле (Iа),
и производное карбамоилхлорида общей формулы CIC(W)NR1R2, в которой W, R1 и R2 являются такими, как определены выше в общей формуле (Iа), в присутствии основания,
причем простую связь в положении С4-С5 затем, возможно, дегидрируют для образования двойной связи.
6. Соединение формулы (Va)
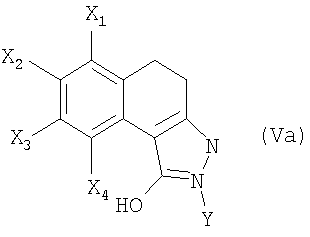
в которой
X1, Х3 и Х4 обозначают атом водорода;
Х2 обозначает атом водорода, галогена или C1-С6-алкоксигруппу и
Y обозначает C1-С6-алкильную, C1-С6-фторалкильную, фенильную, пиридинильную или пиразинильную группу;
при этом фенильная группа, возможно, замещена одним или несколькими атомами или группами, выбранными из атомов галогена, C1-С6-алкильной, C1-С6-алкоксильной групп.
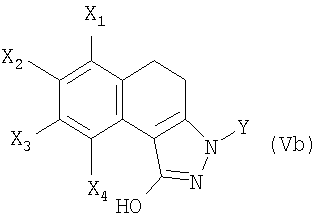
7. Соединение формулы (Vb)
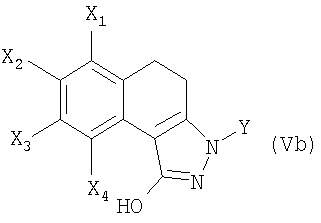
в которой X1 и Х3 обозначают, каждый независимо друг от друга, атом водорода или С1-С6-алкокси;
Х2 обозначает атом водорода, галогена, C1-С6-алкильную, или C1-С6-алкоксигруппу,
Х4 обозначает атом водорода;
Y обозначает фенильную, пиридинильную или пиримидинильную группу;
при этом фенильная группа, возможно, замещена одним или несколькими атомами или группами, выбранными из атомов галогена, C1-С6-алкильной, С1-С6-алкоксильной групп.
8. Лекарственное средство для профилактики и лечения патологии, в которой участвуют рецепторы бензодиазепинов периферического типа, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-3 или его фармацевтически приемлемую соль.
9. Фармацевтическая композиция для профилактики и лечения патологии, в которой участвуют рецепторы бензодиазепинов периферического типа, отличающаяся тем, что она содержит эффективное количество соединения формулы (I) по любому из пп.1-3 или его фармацевтически приемлемой соли, а также по меньшей мере один фамацевтически приемлемый эксципиент.
10. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для профилактики или лечения патологии, в которой участвуют рецепторы бензодиазепинов периферического типа.
11. Применение соединения формулы (I) по п.10 для получения лекарственного средства, предназначенного для профилактики или лечения периферических невропатий, нарушений двигательных нейронов, нейродегенеративных заболеваний центральной нервной системы, тревожных состояний, эпилепсии, нарушений сна, острой или хронической почечной недостаточности, гломерулонефрита, диабетической нефропатии, ишемии и сердечной недостаточности, инфаркта миокарда, ишемии нижних конечностей, коронарного вазоспазма, стенокардии, патологий, связанных с сердечными клапанами, воспалительных заболеваний сердца, побочных эффектов, связанных с кардиотоксическими препаратами или с последствиями операций на сердце, атеросклероза и его тромбоэмболических осложнений, рестеноза, отторжения трансплантатов, состояний, связанных с пролиферацией или неправильной миграцией клеток гладкой мускулатуры, опухолей и рака, кожных стрессов, хронических воспалительных заболеваний, в частности, ревматоидного полиартрита и легочных воспалительных заболеваний.
|
|