|
|
(21), (22) Заявка: 2005130486/04, 03.03.2004
(24) Дата начала отсчета срока действия патента:
03.03.2004
(30) Конвенционный приоритет:
18.04.2003 US 60/463,797
(43) Дата публикации заявки: 10.05.2006
(46) Опубликовано: 10.01.2010
(56) Список документов, цитированных в отчете о
поиске:
CARDELLINI M. et al.: “Derivati della imidazo[1,2-c]chinazolina ad azione inibitoria dell’aggregazione delle piastrine”, I1 Farmaco Edizione Scientifica, 1975, vol.30,  7, pp.536-543. US 3637693 A, 05.01.1972. EP 0655465 A1, 31.05.1995. JP 2000-229950 A, 13.03.2000. US 3340260 А, 05.09.1967. ЕР 1231211 А1, 14.08.2002. RU 2198879 C2, 20.02.2003. 7, pp.536-543. US 3637693 A, 05.01.1972. EP 0655465 A1, 31.05.1995. JP 2000-229950 A, 13.03.2000. US 3340260 А, 05.09.1967. ЕР 1231211 А1, 14.08.2002. RU 2198879 C2, 20.02.2003.
(85) Дата перевода заявки PCT на национальную фазу:
03.10.2005
(86) Заявка PCT:
US 2004/006451 20040303
(87) Публикация PCT:
WO 2004/078733 20040916
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ГОНСАЛЕС Хесус Э. III (US),
УИЛСОН Дин Митчелл (US),
ТЕРМИН Андреас Питер (US),
ГРОТЕНХЕЙС Петер Дидерик Ян (US),
ЧЖАН Юлянь (US),
ПЕЦОЛДТ Бенджамин Джон (US),
ФЭННИНГ Лев Тайлер Деви (US),
НЬЮБЕРТ Тимоти Доналд (US),
ТУНГ Роджер Д. (US),
МАРТИНБОРО Эстер (US),
ЦИММЕРМАНН Николе (US)
(73) Патентообладатель(и):
ВЕРТЕКС ФАРМАСЬЮТИКАЛЗ ИНКОРПОРЕЙТЕД (US)
|
(54) 4-АМИНОХИНАЗОЛИНОВЫЕ АНТАГОНИСТЫ СЕЛЕКТИВНЫХ НАТРИЕВЫХ И КАЛЬЦИЕВЫХ ИОННЫХ КАНАЛОВ
(57) Реферат:
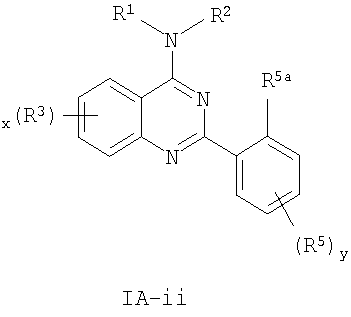
Настоящее изобретение относится к хиназолиновым соединениям формулы (IA-ii) или его фармацевтически приемлемым солям, полезным в качестве ингибиторов потенциалозависимых натриевых каналов и кальциевых каналов, где R1, R2, R3, R5a, R5, у и х определены в формуле изобретения. Изобретение также относится к фармацевтической композиции, включающей соединения изобретения, и к способам ингибирования одной или более из NaV1.2, NaV1.3, NaV1.8 или CaV2.2. Технический результат – 4-аминохиназолиновые антагонисты селективных натриевых и кальциевых ионных каналов. 3 н. и 14 з.п. ф-лы, 3 табл.
Информация о приоритете
В настоящей заявке заявляется приоритет по 35 U.S.С. § 119 на основании предварительных заявок США   60/451458, поданной 3 марта 2003 г., озаглавленной “Compositions Useful as Inhibitors of Voltage-Gated Sodium Channels”, и 60/463797, поданной 18 апреля 2003 г., озаглавленной “Compositions Useful as Inhibitors of Voltage-Gated Sodium Channels”, и все содержание каждой из данных заявок включается в настоящее описание для сведения. 60/451458, поданной 3 марта 2003 г., озаглавленной “Compositions Useful as Inhibitors of Voltage-Gated Sodium Channels”, и 60/463797, поданной 18 апреля 2003 г., озаглавленной “Compositions Useful as Inhibitors of Voltage-Gated Sodium Channels”, и все содержание каждой из данных заявок включается в настоящее описание для сведения.
Техническая область изобретения
Настоящее изобретение относится к соединениям, полезным в качестве ингибиторов ионных каналов. Изобретение также предоставляет фармацевтически приемлемые композиции, включающие соединения изобретения, и способы применения композиций в лечении разнообразных расстройств.
Предпосылки изобретения
Натриевые каналы являются центральными в отношении генерации потенциалов действия во всех возбудимых клетках, таких как нейроны и миоциты. Они играют ключевую роль в возбудимых тканях, включая головной мозг, гладкие мышцы желудочно-кишечного тракта, скелетные мышцы, периферическую нервную систему, спинной мозг и воздушные пути. Как таковые они играют ключевую роль в широком разнообразии болезненных состояний, таких как эпилепсия (см. Moulard, В. and D. Bertrand (2002), “Epilepsy and sodium channel blockers” Expert Opin. Ther. Patents 12(1): 85-91)), боль (см. Waxman, S. G., S. Dib-Hajj et al. (1999)  Sodium channels and pain Sodium channels and pain Proc Natl Acad Sci U S A96(14): 7635-9 и Waxman, S. G., T. R. Cummins, et al. (2000) Proc Natl Acad Sci U S A96(14): 7635-9 и Waxman, S. G., T. R. Cummins, et al. (2000)  Voltage-gated sodium channels and the molecular pathogenesis of pain: a rewiew Voltage-gated sodium channels and the molecular pathogenesis of pain: a rewiew J Rehabil Res Dev37(5): 517-28), миотония (см. Meola, G. аnd V. Sansone (2000) J Rehabil Res Dev37(5): 517-28), миотония (см. Meola, G. аnd V. Sansone (2000)  Therapy in myotonic disordеrs and in muscle channelopathies Therapy in myotonic disordеrs and in muscle channelopathies Neurol Sci21(5): S953-61 и Mankodi, A. and C. A. Thornton (2002) Neurol Sci21(5): S953-61 и Mankodi, A. and C. A. Thornton (2002)  Myotonic syndromes Myotonic syndromes Curr Opin Neurol15(5): 545-52), атаксия (см. Мeisler, M. H., J. A. Kearney et al. (2002) Curr Opin Neurol15(5): 545-52), атаксия (см. Мeisler, M. H., J. A. Kearney et al. (2002)  Mutations of volage-gated sodium channels in movement disorders and epilepsy Mutations of volage-gated sodium channels in movement disorders and epilepsy Novartis Found Symp241: 72-81), рассеянный склероз (см. Black, J. A., S. Dib-Hajj et al. (2000) Novartis Found Symp241: 72-81), рассеянный склероз (см. Black, J. A., S. Dib-Hajj et al. (2000)  Sensory neuron-sрecific sodium channel SNS is abnormally expressed in the brains of mice with experimental allergic encephalomyelitis and humans with multiple sclerosis Sensory neuron-sрecific sodium channel SNS is abnormally expressed in the brains of mice with experimental allergic encephalomyelitis and humans with multiple sclerosis Proc Natl Acad Sci U S A97(21): 11598-602, и Renganathan, M., M. Gelderblom et al. (2003) Proc Natl Acad Sci U S A97(21): 11598-602, и Renganathan, M., M. Gelderblom et al. (2003)  Expression of Na(v)1.8 sodium channels perturbs the firing patterns of cerebellar purkinje cells Expression of Na(v)1.8 sodium channels perturbs the firing patterns of cerebellar purkinje cells Brain Res959(2): 235-42), раздражимый или болезненно чувствительный кишечник (см. Su, X., R. E. Waсhtel et al. (1999) Brain Res959(2): 235-42), раздражимый или болезненно чувствительный кишечник (см. Su, X., R. E. Waсhtel et al. (1999)  Capsaicin sensitivity and voltage-gated sodium currents in colon sensory neurons from rat dorsal root ganglia Capsaicin sensitivity and voltage-gated sodium currents in colon sensory neurons from rat dorsal root ganglia Am J Physiol277(6 Pt 1): G1180-8, и Laird, J. M., V. Souslova et al. (2002) Am J Physiol277(6 Pt 1): G1180-8, и Laird, J. M., V. Souslova et al. (2002)  Deficits in visceral pain and referred hyperаlgesia in Navl.8 (SNS/PN3)- null mice Deficits in visceral pain and referred hyperаlgesia in Navl.8 (SNS/PN3)- null mice J Neurosci22(19): 8352-6), недержание мочи и висцеральная боль (см. Yoshimura, N.,S. Seki, et al. (2001) J Neurosci22(19): 8352-6), недержание мочи и висцеральная боль (см. Yoshimura, N.,S. Seki, et al. (2001)  The involvement of the tetrodotoxin-resistant sodium channel Na(v)l.8 (PN3/SNS) in a rat model of visceral pain The involvement of the tetrodotoxin-resistant sodium channel Na(v)l.8 (PN3/SNS) in a rat model of visceral pain J Neurosci21(21): 8690-6), а также множество психических дисфункций, таких как беспокойство и депрессия (см. Hurley, S. C. (2002) J Neurosci21(21): 8690-6), а также множество психических дисфункций, таких как беспокойство и депрессия (см. Hurley, S. C. (2002)  Lamotrigine update and its ise in mood disorders Lamotrigine update and its ise in mood disorders Ann Pharmacother 36(5): 860-73). Ann Pharmacother 36(5): 860-73).
Потенциалозависимые натриевые каналы включают семейство генов, состоящее из 9 различных подтипов (NaV1.1-NaV1.9). Как показано в таблице 1, эти подтипы показывают специфическую к ткани локализацию и функциональные различия (см. Goldin, A. L. (2001)  Resurgence of sodium channel research Resurgence of sodium channel research Annu Rev Physiol63: 871-94). Три члена из данного семейства генов (NaV1.8, 1.9, 1.5) являются устойчивыми к блокированию хорошо известным блокатором Na канала TTX, демонстрируя специфичность подтипа внутри данного семейства генов. Мутационный анализ идентифицировал глютамат 387 как критический остаток для ТТХ связывания (см. Noda, M., H. Suzuki et al. (1989) Annu Rev Physiol63: 871-94). Три члена из данного семейства генов (NaV1.8, 1.9, 1.5) являются устойчивыми к блокированию хорошо известным блокатором Na канала TTX, демонстрируя специфичность подтипа внутри данного семейства генов. Мутационный анализ идентифицировал глютамат 387 как критический остаток для ТТХ связывания (см. Noda, M., H. Suzuki et al. (1989)  A single point mutation confers tetrodotoxin and saxitoxin insensitivity on the sodium channеl II A single point mutation confers tetrodotoxin and saxitoxin insensitivity on the sodium channеl II FEBS Lett259(1): 213-6). FEBS Lett259(1): 213-6).
Таблица 1 (cокращения CNS=центральная нервная система, PNS=периферическая нервная система, DRG=дорзальный коренной ганглий, TG=тригеминальный ганглий):
Na
изоформа |
Ткань |
TTX IC50 |
Признаки |
| NаV1.1 |
CNS, PNS сома нейронов |
10 нМ |
Боль, эпилепсия, нейродегенерация |
| NаV1.2 |
CNS, аксоны
(в высокой концентрации) |
10 нМ |
Нейродегенерация, эпилепсия |
| NаV1.3 |
CNS, эмбриональная, поврежденные нервы |
15 нМ |
Боль |
| NаV1.4 |
Скелетная мускулатура |
25 нМ |
Миотония |
| NаV1.5 |
Сердце |
2 мкМ |
Аритмия, долгое QT |
| NаV1.6 |
CNS, широко распространенный, наиболее обильный |
6 нМ |
Боль, расстройства движения |
| NаV1.7 |
PNS, DRG, нейроэндокринные терминалы |
25 нМ |
Боль, нейроэндокринные расстройства |
| NаV1.8 |
PNS, малые нейроны в DRG и TG |
>50 мкМ |
Боль |
| NаV1.9 |
PNS, малые нейроны в DRG и TG |
1 мкМ |
Боль |
В общем, потенциалозависимые натриевые каналы (NaVs) являются ответственными за инициирование быстрого скачка возрастающих потенциалов действия в раздражимой ткани в нервной системе, что передает электрические сигналы, которые успокаивают и кодируют нормальные и аберрантные или отличающиеся от нормы болевые ощущения. Антагонисты NaV каналов могут ослаблять данные болевые сигналы и являются полезными для лечения широкого разнообразия болевых состояний, включая, но не ограничиваясь ими, острую, хроническую, воспалительную и нейропатическую боль. Было показано, что известные NaV антагонисты, такие как TTX, лидокаин (см. Mao, J. аnd L. L. Chen (2000)  Systemic lidocaine for neuropathic pain relief Systemic lidocaine for neuropathic pain relief Pain87(1): 7-17), бупивакаин, фенитоин (см. Jensen, T. S. (2002) Pain87(1): 7-17), бупивакаин, фенитоин (см. Jensen, T. S. (2002)  Аnticonvulsants in neuropathic pain: rationale and clinical evidence Аnticonvulsants in neuropathic pain: rationale and clinical evidence Eur J Pain6 (Suppl A): 61-8), ламотригин (см. Rozen, T. D. (2001) Eur J Pain6 (Suppl A): 61-8), ламотригин (см. Rozen, T. D. (2001)  Antiepileptic drugs in the management of cluster headache and trigeminal neuralgia Antiepileptic drugs in the management of cluster headache and trigeminal neuralgia Headache41 Suppl 1: S25-32 и Jensen, T. S. (2002) Headache41 Suppl 1: S25-32 и Jensen, T. S. (2002)  Anticonvulsants in neurоpathic pain: rationale and clinical evidence Anticonvulsants in neurоpathic pain: rationale and clinical evidence Eur J Pain6 (Suppl A): 61-8), и карбамазепин (см. Backonja, M. M. (2002) Eur J Pain6 (Suppl A): 61-8), и карбамазепин (см. Backonja, M. M. (2002)  Use of anticonvulsants for treatment of neuropathic pain Use of anticonvulsants for treatment of neuropathic pain Neurology59(5 Suppl 2): S14-7), являются полезными для ослабления боли у людей и животных моделей. Neurology59(5 Suppl 2): S14-7), являются полезными для ослабления боли у людей и животных моделей.
Гиперальгезия (крайняя чувствительность к чему-либо, причиняющему боль) развивается в присутствии повреждений ткани или воспалительных рефлексов, по крайней мере, частично, увеличение возбудимости высокопороговых первичных афферентных нейронов, иннервирующих участок повреждения. Активация чувствительных к напряжению натриевых каналов является критической для генерирования и распространения потенциалов нейронного действия. Имеется растущая масса свидетельств, указывающих на то, что модуляция NaV потоков является эндогенным механизмом, используемым для регулирования нейронной возбудимости (см. Goldin, A. L. (2001)  Resurgence of sodium channel research Resurgence of sodium channel research Annu Rev Physiol63: 871-94). Несколько кинетически и фармакологически отличных потенциалозависимых натриевых каналов найдено в нейронах дорзального корневого ганглия (DRG). Устойчивый к TTX поток является нечувствительным к микромолярным концентрациям тетродотоксина и демонстрирует медленную активационную и инактивационную кинетику и более деполяризованный активационный порог по сравнению с другими потенциалозависимыми натриевыми каналами. ТТХ-устойчивые натриевые потоки прежде всего ограничены субпопуляцией сенсорных нейронов, вероятно, вовлекаемых в ноцицепцию (болевую рецепцию). В частности, ТТХ-устойчивые натриевые потоки экспрессируются почти исключительно в нейронах, которые имеют малый диаметр клетки, и вызывают медленно проводящие аксоны с малым диаметром, и они отвечают на капсаицин. Огромная масса экспериментальных свидетельств показывает, что ТТХ-устойчивые натриевые каналы экспрессируются в С-волокнах и являются важными в передаче ноцицептичной информации к спинному мозгу. Annu Rev Physiol63: 871-94). Несколько кинетически и фармакологически отличных потенциалозависимых натриевых каналов найдено в нейронах дорзального корневого ганглия (DRG). Устойчивый к TTX поток является нечувствительным к микромолярным концентрациям тетродотоксина и демонстрирует медленную активационную и инактивационную кинетику и более деполяризованный активационный порог по сравнению с другими потенциалозависимыми натриевыми каналами. ТТХ-устойчивые натриевые потоки прежде всего ограничены субпопуляцией сенсорных нейронов, вероятно, вовлекаемых в ноцицепцию (болевую рецепцию). В частности, ТТХ-устойчивые натриевые потоки экспрессируются почти исключительно в нейронах, которые имеют малый диаметр клетки, и вызывают медленно проводящие аксоны с малым диаметром, и они отвечают на капсаицин. Огромная масса экспериментальных свидетельств показывает, что ТТХ-устойчивые натриевые каналы экспрессируются в С-волокнах и являются важными в передаче ноцицептичной информации к спинному мозгу.
Интратекальное введение антисенсорных олиго-дезоксинуклеотидов, нацеленное на уникальную область ТТХ-устойчивого натриевого канала NaV1.8, приводило в результате к значительному снижению PGE2-индуцированной гиперальгезии (см. Khasar, S. G., M. S. Gold еt al. (1998)  A tetrodotoxin-resistant sodium current mediates inflammatory pain in the rat A tetrodotoxin-resistant sodium current mediates inflammatory pain in the rat Neurо-Sci Lett256(1): 17-20). Совсем недавно Wood с коллегами генерировали нокаутированную мышиную линию, у которой не хватает функционального NaV1.8. Мутация дает анальгетический эффект в опытах по оценке ответной реакции животных на воспалительный агент каррагенан (см. Akopian, A.N., V. Souslova et al. (1999) Neurо-Sci Lett256(1): 17-20). Совсем недавно Wood с коллегами генерировали нокаутированную мышиную линию, у которой не хватает функционального NaV1.8. Мутация дает анальгетический эффект в опытах по оценке ответной реакции животных на воспалительный агент каррагенан (см. Akopian, A.N., V. Souslova et al. (1999)  The tetrоdоtoxin-resistant sodium channel SNS has a specialized function in pain pathways The tetrоdоtoxin-resistant sodium channel SNS has a specialized function in pain pathways Nat Neurosci2(6): 541-8). В дополнение к изложенному, у данных животных наблюдался дефицит как механо-, так и терморецепции. Анальгезия, показанная NaV1.8 нокаутными мутантами, согласуется с наблюдениями относительно роли ТТХ-устойчивых потоков в ноцицепции. Nat Neurosci2(6): 541-8). В дополнение к изложенному, у данных животных наблюдался дефицит как механо-, так и терморецепции. Анальгезия, показанная NaV1.8 нокаутными мутантами, согласуется с наблюдениями относительно роли ТТХ-устойчивых потоков в ноцицепции.
Иммуногистохимические эксперименты, эксперименты по in sity гибридизации и in vitro электрофизиологии – все показали, что натриевый канал NaV1.8 селективно локализован с мелкими сенсорными нейронами дорзального корневого ганглия и тригеминального ганглия (см. Akopian, A. N., L. Sivilotti et al. (1996) «A tetrodotoxin-resistant voltage-gated sodium channel expressed by sensory neurons» Nature379(6562): 257-62). Первостепенная роль данных нейронов состоит в детекции и трансмиссии ноцицептивных стимулов. Антисенсорное и иммуногистохимическое свидетельство также говорит о роли NaV1.8 в нейропатической боли (см. Lai, J., M. S. Gold et al. (2002) «Inhibition of neuropаthic рain by decreased expression of the tetrodotoxin-resistant sodium channel, NaV1.8» Pain95(1-2): 143-52, и Lai, J., J. C. Hunter et al. (2000) «Blockade of neuropathic pain by antisense targeting оf tetrodotoxin-resistant sodium channels in sensory neurons» Mеthods Enzymol314: 201-13.). NaV1.8 белок положительно регулируется среди неповрежденных С-волокон, прилегающих к повреждению нерва. Антисенсорная обработка предотвращает перераспределение NaV1.8 по нервам и обращает нейропатическую боль. Взятые вместе ген-нокаутные и антисенсорные данные подтверждают роль NaV1.8 в детекции и трансмиссии воспалительной и нейропатической боли.
При состояниях нейропатической боли имеет место ремоделирование распределения и подтипа натриевых каналов. В поврежденном нерве экспрессия NaV1.8 и NaV1.9 значительно снижается, тогда как экспрессия ТТХ чувствительной подъединицы NaV1.3 5-10-кратно увеличивается (см. Dib-Hajj, S. D., J. Fjell et al. (1999)  Plasticity of sodium channel expression in DRG neurons in the chronic constriсtion injury model of neuropathic pain. Plasticity of sodium channel expression in DRG neurons in the chronic constriсtion injury model of neuropathic pain. Pain83(3): 591-600). Временной курс увеличения в NaV1.3 соответствует внешнему виду аллодинии у животных моделей вследствие нервного повреждения. Биофизика NaV1.3 канала характеризуется тем, что она показывает очень быстрое восстановление готовности после инактивации, следующей за потенциалом действия. Это дает неослабевающие темпы высокого возбуждения, как это часто видно в поврежденном нерве (см. Cummins. T. R., F. Aglieco et al. (2001) Pain83(3): 591-600). Временной курс увеличения в NaV1.3 соответствует внешнему виду аллодинии у животных моделей вследствие нервного повреждения. Биофизика NaV1.3 канала характеризуется тем, что она показывает очень быстрое восстановление готовности после инактивации, следующей за потенциалом действия. Это дает неослабевающие темпы высокого возбуждения, как это часто видно в поврежденном нерве (см. Cummins. T. R., F. Aglieco et al. (2001)  NaV1.3 sodium channels: rapid repriming and slow closed-state inactivation display quantitative differences after expression in a mammalian cell line and in spinal sensory neurons NaV1.3 sodium channels: rapid repriming and slow closed-state inactivation display quantitative differences after expression in a mammalian cell line and in spinal sensory neurons J. Neurosci21(16): 5952-61). NaV1.3 экспрессируется в центральной и периферической системах человека. NaV1.9 является сходным с NaV1.8, так как он селективно локализуется с мелкими сенсорными нейронами дорзального корневого ганглия и тригеминального ганглия (см. Fang, X., L. Djouhri et al. (2002). J. Neurosci21(16): 5952-61). NaV1.3 экспрессируется в центральной и периферической системах человека. NaV1.9 является сходным с NaV1.8, так как он селективно локализуется с мелкими сенсорными нейронами дорзального корневого ганглия и тригеминального ганглия (см. Fang, X., L. Djouhri et al. (2002).  The presence and role of the tetrodotoxin-resistant sodium channel Na(v)1,9 (NaN) in nociceptive primary afferent neurons. The presence and role of the tetrodotoxin-resistant sodium channel Na(v)1,9 (NaN) in nociceptive primary afferent neurons. J Neurosci22(17): 7425-33). Он имеет медленную скорость инактивации и сдвинутую влево зависимость активации от напряжения (см. Dib-Hajj, S., J. A. Black et al. (2002) J Neurosci22(17): 7425-33). Он имеет медленную скорость инактивации и сдвинутую влево зависимость активации от напряжения (см. Dib-Hajj, S., J. A. Black et al. (2002)  NaN/NaV1.9: a sodium channel with unique properties NaN/NaV1.9: a sodium channel with unique properties Trends Neurosci25(5): 253-9). Эти два биофизические свойства позволяют NaV1.9 играть роль в установлении остающегося без изменений мембранного потенциала ноцицептивных нейронов. Остающийся без изменений мембранный потенциал NaV1.9 экспрессирующих клеток составляет в интервале -55 до -50 мВ по сравнению с -65мВ для большинства других периферических и центральных нейронов. Данная стойкая деполяризация является в большой части следствием ослабленной низкоуровневой активации NaV1.9 каналов. Данная деполяризация позволяет нейронам более легко достигать порога потенциалов возбуждающего действия в ответ на ноцицептивные стимулы. Соединения, которые блокируют NaV1.9 канал, могут играть важную роль в установлении начальной точки детекции болезненных стимулов. При хронических болевых состояниях нервы и нервные окончания могут становиться разбухшими и гиперчувствительными, проявляя возбуждение потенциала действия высокой частоты под влиянием слабой стимуляции или без всякой стимуляции. Данные патологические набухания нервов называются нейромами, и первичными Na каналами, экспрессированными в них, являются NaV1.8 и NaV1.7 (см. Kretschmer, T., L. T. Happel et al. (2002) Trends Neurosci25(5): 253-9). Эти два биофизические свойства позволяют NaV1.9 играть роль в установлении остающегося без изменений мембранного потенциала ноцицептивных нейронов. Остающийся без изменений мембранный потенциал NaV1.9 экспрессирующих клеток составляет в интервале -55 до -50 мВ по сравнению с -65мВ для большинства других периферических и центральных нейронов. Данная стойкая деполяризация является в большой части следствием ослабленной низкоуровневой активации NaV1.9 каналов. Данная деполяризация позволяет нейронам более легко достигать порога потенциалов возбуждающего действия в ответ на ноцицептивные стимулы. Соединения, которые блокируют NaV1.9 канал, могут играть важную роль в установлении начальной точки детекции болезненных стимулов. При хронических болевых состояниях нервы и нервные окончания могут становиться разбухшими и гиперчувствительными, проявляя возбуждение потенциала действия высокой частоты под влиянием слабой стимуляции или без всякой стимуляции. Данные патологические набухания нервов называются нейромами, и первичными Na каналами, экспрессированными в них, являются NaV1.8 и NaV1.7 (см. Kretschmer, T., L. T. Happel et al. (2002)  Accumulation of PN1 and PN3 sodium channels in painfull human neuroma- evidence from immunocytochemistry Accumulation of PN1 and PN3 sodium channels in painfull human neuroma- evidence from immunocytochemistry Acta Neurochir (Wien)144(8): 803-10; discussion 810). NaV1.6 и NaV1.7 также экспрессируются в нейронах дорзального корневого ганглия и способствуют малому ТТХ чувствительному компоненту, видному в данных клетках. NaV1.7, в частности, может поэтому быть потенциальной болевой мишенью в дополнение к его роли в нейроэндокринной возбудимости (см. Klugbauer, N., L. Lacinova еt al. (1995) Acta Neurochir (Wien)144(8): 803-10; discussion 810). NaV1.6 и NaV1.7 также экспрессируются в нейронах дорзального корневого ганглия и способствуют малому ТТХ чувствительному компоненту, видному в данных клетках. NaV1.7, в частности, может поэтому быть потенциальной болевой мишенью в дополнение к его роли в нейроэндокринной возбудимости (см. Klugbauer, N., L. Lacinova еt al. (1995)  Structure and functional expression of a new member of the tetrodotoxin- sensitive voltage-activated sodium channel family from human neuroendocrine cells” Embo J14(6): 1084-90). Structure and functional expression of a new member of the tetrodotoxin- sensitive voltage-activated sodium channel family from human neuroendocrine cells” Embo J14(6): 1084-90).
NaV1.1 (см. Sugawara, T., E. Mazaki-Miyazaki et al. (2001)  Nav1.1 mutations cause febrile seizures associated with afebrile partial seizures. Nav1.1 mutations cause febrile seizures associated with afebrile partial seizures. Neurology57 (4): 703-5) и NaV1.2 (см. Sugawara, T., Y. Tsurubuchi, et al. (2001) Neurology57 (4): 703-5) и NaV1.2 (см. Sugawara, T., Y. Tsurubuchi, et al. (2001)  A missense mutation of the Na+ channel alpha II subunit gene Na(v)1.2 in a patient with febrile and afebrile seizures causes channel dysfunction A missense mutation of the Na+ channel alpha II subunit gene Na(v)1.2 in a patient with febrile and afebrile seizures causes channel dysfunction Proc Natl Acad Sci U S A98 (11): 6384-9) связаны с состояниями эпилепсии, включая приступы лихорадки. Имеется свыше 9 генетических мутаций NaV1.1, связанных с приступами лихорадки (см. Meisler, M. H., J. A. Kearney, et al. (2002) Proc Natl Acad Sci U S A98 (11): 6384-9) связаны с состояниями эпилепсии, включая приступы лихорадки. Имеется свыше 9 генетических мутаций NaV1.1, связанных с приступами лихорадки (см. Meisler, M. H., J. A. Kearney, et al. (2002)  Mutations of voltage-gated sodium channels in movement disorders and epilepsy Mutations of voltage-gated sodium channels in movement disorders and epilepsy Novartis Found Symp241: 72-81). Novartis Found Symp241: 72-81).
Для лечения сердечной аритмии были разработаны и используются антагонисты NaV1.5. Генный дефект в NaV1.5, который продуцирует более крупный неинактивирующий компонент к току, связан с длинным QT у человека, и для лечения данного состояния используется орально доступный местный анестетик мексилитин (см. Wang, D. W., K. Yazawa et al. (1997)  Pharmacological targeting of long QT mutant sodium channels. Pharmacological targeting of long QT mutant sodium channels. J Clin Invest99(7): 1714-20). J Clin Invest99(7): 1714-20).
В настоящее время несколько блокаторов Na каналов используются или испытываются в клинике для лечения эпилепсии (см. Moulard, B. аnd D. Bertrand (2002)  Epilepsy and sodium channel blockers Epilepsy and sodium channel blockers Expert Opin. Ther. Patents12(1): 85-91); острой (см. Wiffen, P., S. Collins, et al. (2000) Expert Opin. Ther. Patents12(1): 85-91); острой (см. Wiffen, P., S. Collins, et al. (2000)  Anticonvulsant drugs for acute and chronic pain Anticonvulsant drugs for acute and chronic pain Cochrane Database Syst Rev 3), хронической (см. Wiffen, P., S. Collins, et al. (2000) Cochrane Database Syst Rev 3), хронической (см. Wiffen, P., S. Collins, et al. (2000)  Anticonvulsant drugs for acute and chronic pain Anticonvulsant drugs for acute and chronic pain Cochrane Database Syst Rev 3, и Guay, D. R. (2001) Cochrane Database Syst Rev 3, и Guay, D. R. (2001)  Ajuncive agents in the management оf chronic pain Ajuncive agents in the management оf chronic pain Pharmacotherapy21(9): 1070-81), воспалительной (см. Gold, M. S. (1999) Pharmacotherapy21(9): 1070-81), воспалительной (см. Gold, M. S. (1999)  Tetrodotoxin-resistant Na+ currents and inflammatory hyperalgesia. Tetrodotoxin-resistant Na+ currents and inflammatory hyperalgesia. Proc Natl Acad Sci U S A96(14): 7645-9) и нейропатической боли (см. Strichartz, G. R., Z. Zhou, et al. (2002) Proc Natl Acad Sci U S A96(14): 7645-9) и нейропатической боли (см. Strichartz, G. R., Z. Zhou, et al. (2002)  Therapeutic concentrations of local anaethetics unveil the potential role of sodium channels in neuropathic pain Therapeutic concentrations of local anaethetics unveil the potential role of sodium channels in neuropathic pain Novartis Found Symp241: 189-201, и Sandner-Kiesling, A., G. Rumpold Seitlinger, et al. (2002) Novartis Found Symp241: 189-201, и Sandner-Kiesling, A., G. Rumpold Seitlinger, et al. (2002)  Lamotrigine monotherapy for control of neuralgia after nerve section Lamotrigine monotherapy for control of neuralgia after nerve section Acta Anaesthesiol Scand46(10): 1261-4); сердечной аритмии (см. An, R. H., R. Bangalore, et al (1996) Acta Anaesthesiol Scand46(10): 1261-4); сердечной аритмии (см. An, R. H., R. Bangalore, et al (1996)  Lidocaine block of LQT-3 mutant human Na+ channels Lidocaine block of LQT-3 mutant human Na+ channels Circ Res79(1): 103-8, и Wang, D. W., K. Yazawa, et al. (1997) Circ Res79(1): 103-8, и Wang, D. W., K. Yazawa, et al. (1997)  Pharmacological targeting of long QT mutant sodium channels” J Clin Invest99(7): 1714-20); нейрозащиты (см. Taylor, C. P. аnd L. S. Narasimhan (1997) Pharmacological targeting of long QT mutant sodium channels” J Clin Invest99(7): 1714-20); нейрозащиты (см. Taylor, C. P. аnd L. S. Narasimhan (1997)  Sodium channels and therapy of central nervous system diseases Sodium channels and therapy of central nervous system diseases Adv Pharmacol39: 47-98) и в качестве анестетиков (см. Strichartz, G. R., Z. Zhou, et al. (2002) Adv Pharmacol39: 47-98) и в качестве анестетиков (см. Strichartz, G. R., Z. Zhou, et al. (2002)  Therapeutic concentrations of local anaesthetics unveil the potential role of sodium channels in neuropathic pain. Therapeutic concentrations of local anaesthetics unveil the potential role of sodium channels in neuropathic pain. Novartis Found Symp241: 189-201). Novartis Found Symp241: 189-201).
Кальциевые каналы являются мембранно-охватывающими, мульти-субъединичными белками, которые обеспечивают возможность выхода Са из наружной среды и одновременной деполяризации потенциала клеточной мембраны. Традиционно кальциевые каналы классифицируются на основе их функциональных характеристик, таких как низковольтажная или высоковольтажная активация, и их кинетики (L,T,N,P,Q). Способность клонировать и экспрессировать субъединицы кальциевых каналов ведет к улучшенному пониманию состава каналов, который дает данные функциональные ответные реакции. Имеется три важнейших типа субъединиц, которые образуют кальциевые каналы –  1, 1,  2 2 и и  . .  1 представляет субъединицу, содержащую канальные поры и сенсор напряжения, 1 представляет субъединицу, содержащую канальные поры и сенсор напряжения,  2 является в основном внеклеточным и представляет дисульфид, связанный с трансмембранной 2 является в основном внеклеточным и представляет дисульфид, связанный с трансмембранной  субъединицей, субъединицей,  является негликозилированной субъединицей, найденной связанной с цитоплазматической областью является негликозилированной субъединицей, найденной связанной с цитоплазматической областью  1 субъединицы Са канала. В настоящее время считают, что различные подтипы кальциевых каналов составляются из следующих характерных субъединиц: 1 субъединицы Са канала. В настоящее время считают, что различные подтипы кальциевых каналов составляются из следующих характерных субъединиц:
 L-тип, включающий субъединицы L-тип, включающий субъединицы  1С 1С 1D 1D 1F или 1F или  1S, 1S,  2 2 и и  3а 3а
 N-тип, включающий субъединицы N-тип, включающий субъединицы  1В, 1В,  2 2 , ,  1b 1b
 Р-тип, включающий субъединицы Р-тип, включающий субъединицы  1А, 1А,  2 2 , ,  4а 4а
 Q-тип, включающий субъединицы Q-тип, включающий субъединицы  1А (сплайс вариант) 1А (сплайс вариант)  2 2 , ,  4а 4а
 R-тип, включающий субъединицы R-тип, включающий субъединицы  1Е, 1Е,  2 2 , ,  1b 1b
 Т-тип, включающий субъединицы Т-тип, включающий субъединицы  1G, 1G,  1H или 1H или  1I 1I
Кальциевые каналы играют центральную роль в высвобождении нейротрансмиттера. Приток Са в пресинаптический терминал нервного процесса связывается с каскадом и продуцирует каскад белок-белковых взаимодействий (синтаксин 1А, SNAP-25 и синаптотагмин), который в конце концов заканчивается слиянием синаптического пузыря и высвобождением нейротрансмиттерного пакета. Блокада пресинаптических кальциевых каналов снижает приток Са и дает кубическое Х3 уменьшение высвобождения нейротрансмиттера.
Кальциевый канал N типа (CaV2.2) в высокой степени экспрессируется в пресинаптических нервных окончаниях дорзального корневого ганглия, так как он образует синапс с нейронами дорзального рога в слое I и II. Данные нейроны в свою очередь имеют большие числа Са каналов N типа в их пресинаптических терминалах, так как они функционально контактируют с нейронами второго и третьего порядка. Данный путь является очень важным в передаче болевой информации в головной мозг.
Боль может быть грубо разделена на три различных типа: острую, воспалительную и нейропатическую. Острая боль служит важной защитной функцией в поддержании организма в безопасности от стимулов, которые могут вызывать повреждение ткани. Сильные термические, механические или химические воздействия обладают потенциалом вызывать тяжелые повреждения организма, если их оставить без внимания. Острая боль служит для быстрого удаления индивидуума из причиняющей вред окружающей среды. Острая боль по своей природе обычно является длящейся недолго и интенсивной. Воспалительная боль, с другой стороны, может длиться в течение более длительных периодов времени, и ее интенсивность меняется более постепенно. Воспаление может происходить по многим причинам, включающим повреждение ткани, аутоиммунную ответную реакцию и патогенную инвазию. Воспалительная боль опосредуется  воспалительным супом воспалительным супом , который состоит из вещества Р, гистаминов, кислоты, простагландина, брадикинина, CGRP, цитокинов, АТР, и высвобождением нейротрансмиттера. Третий класс боли является нейропатической болью и включает нервное повреждение, которое приводит в результате к реорганизации нейронных белков и совершает цикл, который дает патологическое , который состоит из вещества Р, гистаминов, кислоты, простагландина, брадикинина, CGRP, цитокинов, АТР, и высвобождением нейротрансмиттера. Третий класс боли является нейропатической болью и включает нервное повреждение, которое приводит в результате к реорганизации нейронных белков и совершает цикл, который дает патологическое  с повышенной чувствительностью с повышенной чувствительностью состояние, которое может давать хроническую боль, длящуюся в течение многих лет. Данный тип боли не обеспечивает никакой адаптивной выгоды, и ее особенно трудно лечить существующими методами терапии. состояние, которое может давать хроническую боль, длящуюся в течение многих лет. Данный тип боли не обеспечивает никакой адаптивной выгоды, и ее особенно трудно лечить существующими методами терапии.
Боль, особенно нейропатическая и боль, с трудом поддающаяся лечению, в огромной мере является нерешенной медицинской проблемой. Миллионы индивидуумов страдают от сильной боли, которая недостаточно регулируется существующими терапевтическими средствами. Современные лекарства, используемые для лечения боли, включают NSAID, ингибиторы COX2, опиоиды, трициклические антидепрессанты и антиконвульсивные средства. Нейропатическую боль особенно трудно лечить, так как она не отвечает достаточно на опиоиды до тех пор, пока не будут достигнуты высокие дозы. Габапентин является в настоящее время терапевтическим средством, которому оказывается предпочтение, для лечения нейропатической боли, хотя он срабатывает только у 60% пациентов, в случае которых он обнаруживает умеренную эффективность. Данное лекарство является однако очень безопасным, а побочные действия обычно переносимы, хотя облегчение достигается при более высоких дозах.
Са канал N типа у человека был задействован путем интратекального вливания токсина зиконотида для лечения не поддающейся лечению боли, раковой боли, стойкой к опиоидам боли, и нейропатической и сильной боли. Данный токсин имеет 85% степень успеха для лечения боли у людей с большей силой действия, чем морфин. Орально доступный антагонист Са канала N типа составил бы гораздо большую долю на рынке средств от боли. Зиконотид вызывает дегрануляцию тучных клеток и дает дозозависимые центральные побочные эффекты. Они включают головокружение, нистагм, волнение и дисметрию. У некоторых пациентов при высоких дозах имеет место также ортостатическая гипотензия. Основной риск для данной мишени включает в себя побочные эффекты в ЦНС, наблюдаемые с зиконотидом при высокой дозировке. Они включают головокружение, нистагм, волнение и дисметрию. У некоторых пациентов при высоких дозах имеет место также ортостатическая гипотензия. Считается, что это может быть следствием вызываемой зиконотидом дегрануляции тучных клеток и/или его действия на симпатический ганглий, который как и спинномозговой ганглий также экспрессирует Са канал N типа. В зависимости от использования соединения, которые блокируют предпочтительно в более высокочастотном интервале >10 Гц, должны быть полезными в минимизации данных возможных побочных эффектов. Степень возбуждения у людей симпатических эфферентов находится в 0,3 Гц интервале. Нейроны CNS могут возбуждаться при более высоких частотах, но обычно это происходит только при коротких вспышках потенциалов действия. Даже с селективностью, придаваемой в зависимости от использования с внутренней присущей селективностью против кальциевого канала L типа, кальциевый канал все еще необходим, так как он вовлечен в сокращение сердечных и сосудистых гладких мышц.
К сожалению, как описывалось выше, эффективность используемых в настоящее время блокаторов натриевых каналов и блокаторов кальциевых каналов против болезненных состояний, описанных выше, в огромной степени ограничивается рядом побочных эффектов. Данные побочные эффекты включают различные нарушения CNS, такие как расплывчатое зрение, головокружение, тошнота и седативный эффект, также как и более возможно угрожающие жизни сердечные аритмии и сердечную недостаточность. Соответственно, остается потребность в разработке дополнительных антагонистов Na каналов и Са каналов, предпочтительно антагонистов более высокой силы действия и с меньшими побочными эффектами.
Краткое содержание изобретения
Было найдено, что соединения данного изобретения и их фармацевтически приемлемые композиции полезны в качестве ингибиторов потенциалозависимых натриевых каналов и кальциевых каналов. Эти соединения имеют общую формулу I:
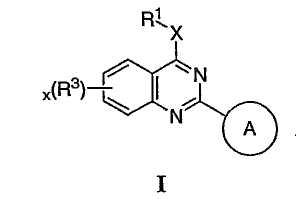
или представляют их фармацевтически приемлемые производные, где R1, X, R3, x и кольцо A имеют значения, определенные ниже.
Данные соединения и фармацевтически приемлемые композиции полезны для лечения или снижения тяжести широкого ряда болезней, расстройств или состояний, включающих, но не ограниченных ими, острую, хроническую, нейропатическую или воспалительную боль, артрит, мигрени, тригеминальную невралгию, герпетическую невралгию, общую невралгию, эпилепсию или эпилептические состояния, нейродегенеративные расстройства, психиатрические расстройства, такие как беспокойство и депрессия, миотонию, аритмию, расстройства движения, нейроэндокринные расстройства, атаксию, рассеянный склероз, синдром раздраженного кишечника, недержание, висцеральную боль, остеоартритную боль, постгерпетическую невралгию, диабетическую нейропатию, корешковую боль, ишиалгию, спинную боль, головную и шейную боль, сильную или непреходящую боль, ноцицептивную боль, боль при разрывах тканей, постхирургическую боль или раковую боль.
Подробное описание изобретения
I. Общее описание соединений изобретения:
Настоящее изобретение относится к соединениям формулы I, полезным в качестве ингибиторов потенциалозависимых натриевых каналов и кальциевых каналов:
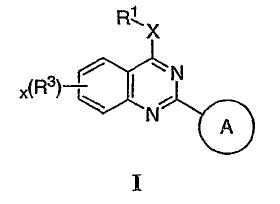
или к их фармацевтически приемлемым солям,
где Х представляет О или NR2; R1 и R2 представляют каждый независимо необязательно замещенную группу, выбранную из водорода, С1-6 алифатической группы или Су1, где Су1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, в котором Су1 связана непосредственно с атомом азота или связана через необязательно замещенную С1-4 алифатическую группу, где одно или более метиленовых звеньев в С1-4 алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; или R1 и R2 взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 3-12-членное моноциклическое или бициклическое насыщенное, частично ненасыщенное или полностью ненасыщенное кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода; где R1 и R2 или кольцо, образованное R1 и
R2, взятыми вместе, каждый необязательно и независимо замещены при одном или более замещаемых атомах углерода, азота или серы z числом независимых заместителей R4, где z представляет 0-5;
кольцо А представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное моноциклическое или бициклическое насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, в котором кольцо А необязательно замещено числом у независимых заместителей -R5, где у представляет 0-5, и дополнительно необязательно замещено числом q независимых случаев R5а, где q представляет 0-2;
х представляет 0-4;
каждый из R3, R4 и R5 представляет независимо Q-RX, где Q представляет связь или представляет С1-С6 алкилиденовую цепь, где вплоть до двух несмежных метиленовых звеньев Q необязательно и независимо замещены группой -NR-, -S-, -O-, -CS- -CO2-, -OCO-, -CO-, -COCO-, -CONR-, -NRCO-, -NRCO2, -SO2NR-, -NRSO2-, -CONRNR-, -NRCONR-, -OCONR-, -NRNR-, -NRSO2NR-, -SO-, -SO2-, -PO-, -PO2-, -OP(O)(OR)- или -POR-;
каждый из RX независимо выбран из -R’, =O, =NR’, галогена, -NO2, -CN, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2 -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, или -OPO(R’)2
каждый из R5a представляет независимо необязательно замещенную С1-С6 алифатическую группу галоген, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2 и
каждый из R представляет независимо водород или необязательно замещенную С1-6 алифатическую группу и каждый из R’ представляет независимо водород или необязательно замещенную С1-6 алифатическую группу, 3-8-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членную насыщенную, частично ненасыщенную или полностью ненасыщенную бициклическую кольцевую систему, имеющую 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы; или R и R’, два из R, или два из R’ взяты вместе с атомом(ами), к которому они присоединены, образуя необязательно насыщенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В некоторых воплощениях соединений, непосредственно описанных выше:
i) когда х представляет 1 и R3 представляет необязательно замещенный 6-фенил или 6-пиридил, и R1 представляет водород, тогда R2 не является Cy1, и
ii) моногидрохлорид 1-(4-амино-6,7-диметокси-2-хиназолинил)-4-(2-фуранилкарбонил)пиперазина и 1-(4-амино-6,7-диметокси-2-хиназолинил)-4-[(2,3-дигидро-1,4-бензодиоксин-2-ил)карбонил]пиперазин исключаются.
2. Соединения и определения:
Соединения данного изобретения включают соединения, описанные в общем выше, и далее иллюстрируются классами, подклассами и видами, раскрытыми в данном описании. В используемом здесь смысле следует применять следующие определения, если не указывается иное. Для целей данного изобретения химические элементы идентифицируются в соответствии с Периодической таблицей элементов в версии CAS, Handbook of Chemistry and Physics, 75th Ed. Дополнительно общие принципы органической химии описаны в «Organic Chemistry», Thomas Sorrell, University Science Books, Sausalito: 1999, и «March’s Advanced Organic Chemistry», 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley & Sons, New York: 2001, содержание которых целиком включается в данное описание в виде ссылки.
Как описано здесь, соединения изобретения могут быть необязательно замещены одним или более заместителями, такими, как в общем иллюстрируются выше, или показаны примерами классов, подклассов и видов изобретения. Следует понимать, что фраза «необязательно замещенный» используется взаимозаменяемо с фразой «замещенный или незамещенный». В общем термин «замещенный», предшествует ли ему термин  необязательно необязательно или нет, относится к замещению водородных радикалов в данной структуре радикалом указанного заместителя. Если не указано иное, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы, и, когда более чем одно положение в любой заданной структуре может быть замещено более чем одним заместителем, выбранным из указанной группы, заместитель может быть или одинаковым, или различным в каждом положении. Комбинациями заместителей, предусматриваемыми данным изобретением, предпочтительно являются те, которые получаются в результате образования стабильных или химически возможных соединений. Термин или нет, относится к замещению водородных радикалов в данной структуре радикалом указанного заместителя. Если не указано иное, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы, и, когда более чем одно положение в любой заданной структуре может быть замещено более чем одним заместителем, выбранным из указанной группы, заместитель может быть или одинаковым, или различным в каждом положении. Комбинациями заместителей, предусматриваемыми данным изобретением, предпочтительно являются те, которые получаются в результате образования стабильных или химически возможных соединений. Термин  стабильный стабильный , используемый здесь, относится к соединениям, которые по существу не изменяются, когда подвергаются действию условий, обеспечивающих возможность их получения, идентификации и предпочтительно их выделения, очистки и использования для одной или более целей, описанных здесь. Согласно некоторым воплощениям стабильным соединением или химически возможным соединением является соединение, которое по существу не меняется, когда хранится при температуре порядка 40оС или ниже, в отсутствие влаги или других химически активных условий в течение, по крайней мере, недели. , используемый здесь, относится к соединениям, которые по существу не изменяются, когда подвергаются действию условий, обеспечивающих возможность их получения, идентификации и предпочтительно их выделения, очистки и использования для одной или более целей, описанных здесь. Согласно некоторым воплощениям стабильным соединением или химически возможным соединением является соединение, которое по существу не меняется, когда хранится при температуре порядка 40оС или ниже, в отсутствие влаги или других химически активных условий в течение, по крайней мере, недели.
Термин  алифатическая алифатическая или или  алифатическая группа алифатическая группа , используемый здесь, обозначает неразветвленную (т.е. с нормальной цепью) или разветвленную, насыщенную или ненасыщенную углеводородную цепь, которая является полностью насыщенной или которая содержит одно или более ненасыщенных звеньев, или моноциклический углеводород или бициклический углеводород, который является полностью насыщенным или который содержит одно или более ненасыщенных звеньев, но который не является ароматическим (называемый здесь также как , используемый здесь, обозначает неразветвленную (т.е. с нормальной цепью) или разветвленную, насыщенную или ненасыщенную углеводородную цепь, которая является полностью насыщенной или которая содержит одно или более ненасыщенных звеньев, или моноциклический углеводород или бициклический углеводород, который является полностью насыщенным или который содержит одно или более ненасыщенных звеньев, но который не является ароматическим (называемый здесь также как  карбоцикл карбоцикл , ,  циклоалифатический циклоалифатический или или  циклоалкил циклоалкил ), который имеет одно положение для присоединения к остальной части молекулы. Если не указано иное, алифатические группы содержат 1-20 алифатических атомов углерода. Согласно некоторым воплощениям алифатические группы содержат 1-10 алифатических атомов углерода. В других воплощениях алифатические группы содержат 1-8 алифатических атомов углерода. В следующих воплощениях алифатические группы содержат 1-6 алифатических атомов углерода и в следующих далее воплощениях алифатические группы содержат 1-4 алифатических атома углерода. В некоторых воплощениях ), который имеет одно положение для присоединения к остальной части молекулы. Если не указано иное, алифатические группы содержат 1-20 алифатических атомов углерода. Согласно некоторым воплощениям алифатические группы содержат 1-10 алифатических атомов углерода. В других воплощениях алифатические группы содержат 1-8 алифатических атомов углерода. В следующих воплощениях алифатические группы содержат 1-6 алифатических атомов углерода и в следующих далее воплощениях алифатические группы содержат 1-4 алифатических атома углерода. В некоторых воплощениях  циклоалифатический(ая) циклоалифатический(ая) (или (или  карбоцикл карбоцикл или или  циклоалкил циклоалкил ) относится к моноциклическому С3-С8 углеводороду или бициклическому С8-С12 углеводороду, который является полностью насыщенным или который содержит одно или более звеньев с ненасыщением, но который не является ароматическим, который имеет одну точку присоединения к остальной части молекулы, где любое индивидуальное кольцо в указанной бициклической системе имеет 3-7 членов. Подходящие алифатические группы включают, но не ограничиваются указанными, линейные или разветвленные, насыщенные или ненасыщенные алкильные, алкенильные, алкинильные группы и гибриды их, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил. ) относится к моноциклическому С3-С8 углеводороду или бициклическому С8-С12 углеводороду, который является полностью насыщенным или который содержит одно или более звеньев с ненасыщением, но который не является ароматическим, который имеет одну точку присоединения к остальной части молекулы, где любое индивидуальное кольцо в указанной бициклической системе имеет 3-7 членов. Подходящие алифатические группы включают, но не ограничиваются указанными, линейные или разветвленные, насыщенные или ненасыщенные алкильные, алкенильные, алкинильные группы и гибриды их, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил.
Термин  гетероалифатическая(ий) гетероалифатическая(ий) , используемый здесь, обозначает алифатические группы, в которых один или два атома углерода независимо замещены одним или более атомами из кислорода, серы, азота, фосфора или кремния. Гетероалифатические группы могут быть замещенными или незамещенными, разветвленными или неразветвленными, циклическими или ациклическими и включают , используемый здесь, обозначает алифатические группы, в которых один или два атома углерода независимо замещены одним или более атомами из кислорода, серы, азота, фосфора или кремния. Гетероалифатические группы могут быть замещенными или незамещенными, разветвленными или неразветвленными, циклическими или ациклическими и включают  гетероцикл(ическую) гетероцикл(ическую) , ,  гетероциклил(ьную) гетероциклил(ьную) , ,  гетероциклоалифатическую гетероциклоалифатическую или или  гетероциклическую гетероциклическую группы. группы.
Термин  гетероцикл гетероцикл , ,  гетероциклил гетероциклил , ,  гетероциклоалифатический(ая) гетероциклоалифатический(ая) или или  гетероциклический(ая) гетероциклический(ая) используемый здесь, обозначает неароматическую, моноциклическую, бициклическую или трициклическую кольцевые системы, в которых один или более кольцевых членов являются независимо выбранным гетероатомом. В некоторых воплощениях используемый здесь, обозначает неароматическую, моноциклическую, бициклическую или трициклическую кольцевые системы, в которых один или более кольцевых членов являются независимо выбранным гетероатомом. В некоторых воплощениях  гетероцикл(ическая) гетероцикл(ическая) , ,  гетероциклил(ьная) гетероциклил(ьная) , ,  гетероциклоалифатическая гетероциклоалифатическая или или  гетероциклическая гетероциклическая группа имеет три-четырнадцать кольцевых членов, в которой один или более кольцевых членов является гетероатомом, независимо выбранным из кислорода, серы, азота или фосфора, и каждое кольцо в системе содержит 3-7 кольцевых членов. группа имеет три-четырнадцать кольцевых членов, в которой один или более кольцевых членов является гетероатомом, независимо выбранным из кислорода, серы, азота или фосфора, и каждое кольцо в системе содержит 3-7 кольцевых членов.
Термин  гетероатом гетероатом обозначает один или более атомов из кислорода, серы, азота, фосфора или кремния (включая любую окисленную форму азота, серы, фосфора или кремния; кватернизованную форму любого основного азота или замещаемого азота гетероциклического кольца, например N (в виде 3,4-дигидро-2Н-пирролила), NH (в виде пирролидинила) или NR+ (в виде N-замещенного пирролидинила)). обозначает один или более атомов из кислорода, серы, азота, фосфора или кремния (включая любую окисленную форму азота, серы, фосфора или кремния; кватернизованную форму любого основного азота или замещаемого азота гетероциклического кольца, например N (в виде 3,4-дигидро-2Н-пирролила), NH (в виде пирролидинила) или NR+ (в виде N-замещенного пирролидинила)).
Термин «ненасыщенный», используемый здесь, обозначает, что фрагмент имеет одно или более звеньев с ненасыщением.
Термин «алкокси» или «тиоалкил», используемый здесь, относится к алкильной группе, как определено ранее, присоединенной к главной углеродной цепи через атом кислорода («алкокси») или серы («тиоалкил»).
Термин «галогеналкил», «галогеналкенил» и «галогеналкокси» обозначает алкил, алкенил или алкокси, и данный радикал может быть замещен одним или более атомами галогена. Термин «галоген» обозначает F, Cl, Br или I.
Термин «арил», используемый сам по себе или как часть более крупного фрагмента, как в случае «аралкила», «аралкокси» или «арилоксиалкила», относится к моноциклической, бициклической и трициклической кольцевым системам, имеющим всего от пяти до четырнадцати кольцевых членов, где, по крайней мере, одно кольцо в системе является ароматическим и где каждое кольцо в системе содержит 3-7 кольцевых членов. Термин «арил» может использоваться взаимозаменяемо с термином «арильное кольцо». Термин «арил» относится также к гетероарильным кольцевым системам, как они определены здесь ниже.
Термин «гетероарил», используемый сам по себе или как часть более крупного фрагмента, как в случае «гетероаралкила» или «гетероарилалкокси»», относится к моноциклической, бициклической и трициклической кольцевым системам, имеющим всего от пяти до четырнадцати кольцевых членов, где, по крайней мере, одно кольцо в системе является ароматическим, по крайней мере, одно кольцо в системе содержит один или более гетероатомов и где каждое кольцо в системе содержит 3-7 кольцевых членов. Термин «гетероарил» может использоваться взаимозаменяемо с термином «гетероарильное кольцо» или термином «гетероароматическое».
Арильная (включая аралкил, аралкокси, арилоксиалкил и аналогичные) или гетероарильная (включая гетероаралкил и гетероарилалкокси и аналогичные) группа может содержать один или более заместителей и, таким образом, может быть «необязательно замещенной». Если иное не определено выше и в данном описании подходящие заместители у ненасыщенного атома углерода арильной или гетероарильной группы обычно выбираются из галогена; -Ro; –ORo; -SRo; фенила (Ph), необязательно замещенного радикалом Ro; -O(Ph), необязательно замещенного Ro; -(CH2)1-2(Ph), необязательно замещенного Ro; -CH=CH(Ph), необязательно замещенного Ro; -NO2; -CN; -N(Ro)2; -NRoC(O)Ro; -NRoC(S)Ro; -NRoC(O)N(Ro)2; -NRoC(S)N(Ro)2; -NRoCO2Ro; -NRoNRoC(O)Ro; -NRoNRoC(O)N(Ro)2; -NRoNRoCO2Ro; -С(О)С(О)Ro; -C(O)CH2C(O)Ro; -CO2Ro; -C(O)Ro; -C(S)Rо; -C(O)N(Ro)2; -C(S)N(Ro)2; -OC(O)N(Ro)2; -OC(O)Ro; -C(O)N(ORo)Ro; -C(NORo)Ro; -S(O)2Ro; -S(O)3Ro; -SO2N(Ro)2; -S(O)Ro; -NRoSO2N(Ro)2; -NRoSO2Ro; -N(ORo)Ro; -C(=NH)-N(Ro)2; -P(O)2Ro; -PO(Ro)2; -OPO(Ro)2; -(CH2)0-2NHC(O)Ro; фенила (Ph), необязательно замещенного радикалом Ro; -O(Ph), необязательно замещенного Ro; -(CH2)1-2(Ph), необязательно замещенного Ro; или -CH=CH(Ph), необязательно замещенного Ro, где каждый из Ro независимо выбран из водорода, необязательно замещенного С1-6 алифатического, ненасыщенного 5-6-членного гетероарила или гетероциклического кольца, фенила, -О(Ph) или СН2(Ph), или, несмотря на определения выше, два независимых случая из Ro у одного и того же заместителя или различных заместителей, взяты вместе с атомом(ами), к которому присоединена каждая Ro группа, образуя необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Необязательные заместители у алифатической группы Ro выбраны из NH2, NH(С1-4алифатической) группы, NH(С1-4алифатической)2 группы, галогена, С1-4алифатической группы, ОН, О(С1-4алифатической) группы, NО2, СN, СО2Н,
СО2(С1-4алифатической) группы, О(галогенС1-4алифатической) группы или галогенС1-4алифатической группы, где каждая из предшествующих С1-4алифатических групп группы Ro является незамещенной.
Алифатическая или гетероалифатическая группа или неароматическое гетероциклическое кольцо могут содержать один или более заместителей и, таким образом, могут быть  необязательно замещенными необязательно замещенными . Если иное не определено выше и в данном описании подходящие заместители у насыщенного углерода алифатической или гетероалифатической группы или неароматического гетероциклического кольца выбираются из заместителей, перечисленных выше для ненасыщенного углерода арильной или гетероарильной группы, и дополнительно включают следующие =O, =S, =NNHR*, =NN(R*)2, =NNHC(O)R*, =NNHCO2(алкил), =NNHSO2(алкил) или =NR*, где каждый из R* независимо выбран из водорода или необязательно замещенной С1-6 алифатической группы. . Если иное не определено выше и в данном описании подходящие заместители у насыщенного углерода алифатической или гетероалифатической группы или неароматического гетероциклического кольца выбираются из заместителей, перечисленных выше для ненасыщенного углерода арильной или гетероарильной группы, и дополнительно включают следующие =O, =S, =NNHR*, =NN(R*)2, =NNHC(O)R*, =NNHCO2(алкил), =NNHSO2(алкил) или =NR*, где каждый из R* независимо выбран из водорода или необязательно замещенной С1-6 алифатической группы.
Если иное не определено выше и в данном описании необязательные заместители у азота неароматического гетероциклического кольца обычно выбираются из -R+,
-N(R+)2, -C(O)R+, -CO2R+, -C(O)C(O)R+, -C(O)CH2C(O)R+, -SO2R+, -SO2N(R+)2, -C(=S)N(R+1)2, -C(=NH)-N(R+)2 или -NR+SO2R+, где R+ представляет водород, необязательно замещенную С1-6 алифатическую группу, необязательно замещенный фенил, необязательно замещенный -О(Рh), необязательно замещенный -СН2(Рh), необязательно замещенный -(СН2)1-2(Рh), необязательно замещенный -СН=СН(Рh) или незамещенное 5-6-членное гетероарильное или гетероциклическое кольцо, имеющее 1-4 гетероатома, независимо выбранных их кислорода, азота или серы, или, несмотря на определения выше, два независимых случая из R+ у одного и того же заместителя или различных заместителей, взятые вместе с атомом(ами), к которому присоединена каждая R+ группа, образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное, или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Необязательные заместители у алифатической группы или фенильного кольца группы R+ выбраны из -NH2, -NH(С1-4алифатической) группы, -N(С1-4алифатической)2 группы, галогена, С1-4алифатической группы, -ОН, -О(С1-4алифатической) группы, -NО2, -СN, -СО2Н, -СО2(С1-4алифатической) группы, -О(галогенС1-4алифатической) группы или галоген(С1–4алифатической) группы, где каждая из предшествующих С1-4алифатических групп группы R+ является незамещенной.
Термин  алкилиденовая цепь алкилиденовая цепь относится к прямой или разветвленной углеродной цепи, которая может быть полностью насыщенной или иметь одно или более звеньев с ненасыщением и имеет две точки присоединения к остальной части молекулы. относится к прямой или разветвленной углеродной цепи, которая может быть полностью насыщенной или иметь одно или более звеньев с ненасыщением и имеет две точки присоединения к остальной части молекулы.
Как подробно говорилось выше, в некоторых воплощениях два независимых заместителя из Rо (или R+, R, R’ или любой другой переменной, определенных аналогично выше), взятые вместе с атомом(ами), к которому они присоединены, образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Примеры колец, которые образуются, когда два независимых заместителя из Rо (или R+, R, R’ или любой другой переменной, определенной аналогично выше) взяты вместе с атомом(ами), к которому присоединена каждая переменная, включают, но не ограничиваются ими, следующие: а) два независимых заместителя из Rо (или R+, R, R’ или любой другой переменной, определенной аналогично выше), которые присоединены к одному и тому же атому и взяты вместе с данным атомом, образуя кольцо, например, N(Rо)2, когда оба заместителя Rо взяты вместе с атомом азота, образуя пиперидин-1-ильную, пиперазин-1-ильную или морфолин-4-ильную группу и b) два независимых заместителя из Rо (или R+, R, R’ или любой другой переменной, определенной аналогично выше), которые присоединены к различным атомам и взяты вместе с обоими из данных атомов, образуя кольцо, например, когда фенильная группа замещена двумя заместителями из ORo 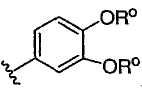 , данные два заместителя Rо взяты вместе с атомами кислорода, к которым они присоединены, образуя сконденсированное 6-членное кислородсодержащее кольцо , данные два заместителя Rо взяты вместе с атомами кислорода, к которым они присоединены, образуя сконденсированное 6-членное кислородсодержащее кольцо 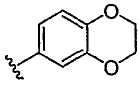 . Следует понимать, что может образовываться множество других колец, когда два независимых заместителя из Rо (или R+, R, R’ или любой другой переменной, определенной аналогично выше) взяты вместе с атомом или атомами, к которым присоединена каждая из переменных, и примеры, подробно описанные выше, не предназначены для ограничения ими. . Следует понимать, что может образовываться множество других колец, когда два независимых заместителя из Rо (или R+, R, R’ или любой другой переменной, определенной аналогично выше) взяты вместе с атомом или атомами, к которым присоединена каждая из переменных, и примеры, подробно описанные выше, не предназначены для ограничения ими.
Если не указано иное, имеется также в виду, что структуры, изображенные здесь, включают все изомерные (например, энантиомерные, диастереомерные и геометрические (или конформационные)) формы структуры, например R и S конфигурации для каждого асимметричного центра, (Z) и (E) изомеры с двойной связью и (Z) и (E) конформационные изомеры. Следовательно, объемом изобретения охватываются отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси настоящих соединений. Если не указано иное, объемом изобретения охватываются все таутомерные формы соединений изобретения. Кроме того, если не указано иное, имеется в виду, что структуры, изображенные здесь, включают соединения, которые отличаются только присутствием одного или более изотопно обогащенных атомов. Например, соединения, имеющие настоящие структуры за исключением замещения водорода дейтерием или тритием, или замещения углерода 13С- или 14С-обогащенным углеродом, охватываются объемом изобретения. Такие соединения полезны, например, в качестве аналитических средств или зондов или проб в биологических анализах.
3. Описание типичных соединений:
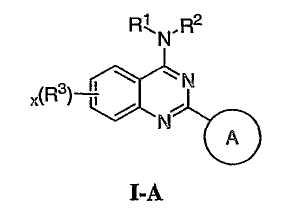
Как описано в общем выше, для соединений изобретения Х представляет О или NR2. Соответственно, в некоторых воплощениях Х представляет NR2, и соединения имеют структуру формулы I-A:
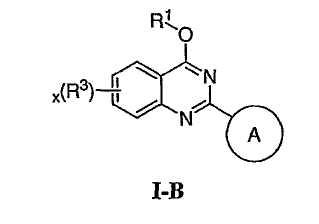
В других воплощениях Х представляет О, и соединения имеют структуру формулы I-B:
В некоторых воплощениях для соединений формулы I-A один из R1 или R2 представляет водород, а другой из R1 и R2 выбран из необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR-, или -NRSO2– или представляет Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-.
В еще других воплощениях R1 и R2 каждый независимо выбран из Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR-, или -NRSO2-; или из необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-.
В других воплощениях для соединений формулы I-A один из R1 или R2 представляет водород, а другой из R1 или R2 представляет необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-. Согласно другим воплощениям необязательно замещенная С1-4алифатическая группа замещена группой Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 необязательно замещен 0-5 независимыми заместителями -R5. Согласно следующим воплощениям один из R1 или
R2 представляет водород или С1-С4алкил, а другой из R1 и R2 представляет -СН2-Су1.
В некоторых дополнительных воплощениях для соединений формулы I-В R1 представляет необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-.
Согласно другим воплощениям для соединений формулы I-A ни R1, ни R2 не является водородом, и R1 и R2 каждый независимо выбран из Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR-, или -NRSO2-; или из необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-. Согласно другим воплощениям и R1, и R2 представляют необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-.
Согласно некоторым воплощениям для соединений формулы I, I-A или I-В Cy1 выбран из:
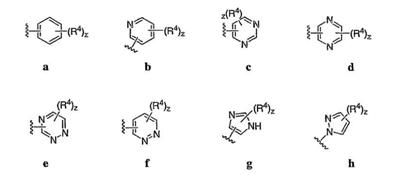
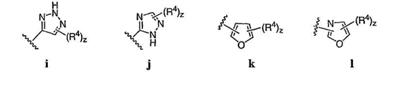
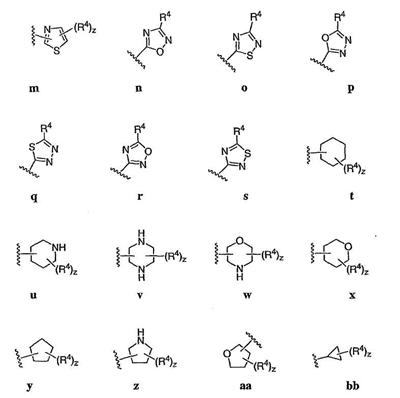
где R4 имеет значения, определенные ранее, и z представляет 0-4. Другие примеры колец включают кольца, показанные ниже в таблице 2.
Согласно другим воплощениям для соединений формулы I, I-A или I-В примерами групп R1 и R2 являются необязательно замещенный метил, этил, циклопропил, н-пропил, пропенил, циклобутил, (СО)ОСН2СН3, (СН2)2ОСН3, СН2(СО)ОСН2СН3, СН2(СО)ОСН3,
СН(СН3)СН2СН3 или н-бутил. Другие примеры R1 и R2 групп включают группы, показанные ниже в таблице 2.
Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 3-12-членное гетероциклильное кольцо, имеющее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы. Согласно некоторым предпочтительным воплощениям R1 и R2 взяты вместе с атомом азота, к которому они присоединены, и образуют группу, выбранную из:
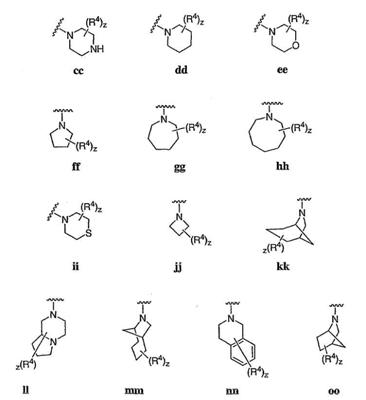
где кольцо, образованное R1 и R2, взятыми вместе, необязательно замещено у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4 и z представляет 0-5.
Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), пирролидин-1-ил (ff), пиперидин-1-ил (dd), пиперазин-1-ил (cc) или морфолин-4-ил (ee). Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), пирролидин-1-ил (ff), пиперидин-1-ил (dd) или пиперазин-1-ил (сс). Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj). Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff). Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd). Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (cc).
Согласно некоторым воплощениям z представляет 0-2. Согласно другим воплощениям z представляет 0 и кольцо является незамещенным. Предпочтительные
R4 группы, когда они присутствуют, каждая представляет независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CН2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6 алкила или гетероциклоалифатического С1-С6 алкила. Другими примерами R4 групп являются Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенная группа, выбранная из пиперидинила, пиперазинила, морфолино, С1-4 алкокси, фенила, фенилокси, бензила, бензилокси, -CH2 циклогексила, пиридила, -CH2 пиридила или -CH2 тиазолила. Еще другие примеры R4 групп включают группы, показанные ниже в таблице 2.
Согласно некоторым воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 или 2, и, по крайней мере, один из R4 представляет -NRSO2R’, -NRCOOR’, -NRCOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRSO2R’. Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOR’. Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff), где z представляет 1 или 2 и R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’ или -CH2OR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 или 2 и по крайней мере, один из заместителей R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’, или CH2OR’, -NRCO2R’, -NRCOOR’ или -OCON(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет F, CF3, CH3, -CH2CH3, -OR’ или -CH2OR’. Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет -NRSO2R’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и
R4 представляет -NRCOOR’. Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 или 2, и, по крайней мере, один из заместителей R4 представляет -SOR’, -CON(R’)2, -SO2N(R’)2, -COR’ или -COOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -SOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -СОOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -СON(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -SO2N(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -COR’.
Как описано в общем выше, для соединений формулы I, I-A или I-В хиназолиновое кольцо может быть замещено независимыми заместителями R3 в количестве вплоть до четырех. В некоторых воплощениях х представляет 0-2. В других воплощениях х представляет 1 или 2. В еще других воплощениях х представляет 1 и R3 является замещенным в 6- или положении 7 хиназолинового кольца. Когда хиназолиновое кольцо является замещенным (х представляет 1-4), R3 группы представляют галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, -COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила. Согласно еще другим воплощениям, каждый заместитель R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси. Согласно другим воплощениям х представляет 1 или 2 и каждая R3 группа представляет независимо галоген, CN, необязательно замещенный С1-С6алкил, OR’, N(R’)2, CON(R’)2 или NRCOR’. Согласно другим воплощениям х представляет 1 или 2 и каждая R3 группа представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3,
-NH2, -OCH2CH3 или -CN. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно следующим далее воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим далее воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно другим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. Согласно другим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 NRCOR’. Другие примеры R3 групп включают группы, показанные ниже в таблице 2.
Как описано в общем выше, для соединений формулы I, I-A или I-В кольцо А представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где кольцо А необязательно замещено у числом независимых заместителей -R5, где у представляет 0-5, и дополнительно необязательно замещено числом q независимых заместителей -R5а, где q представляет 0-2.
Согласно некоторым воплощениям кольцо А выбрано из:
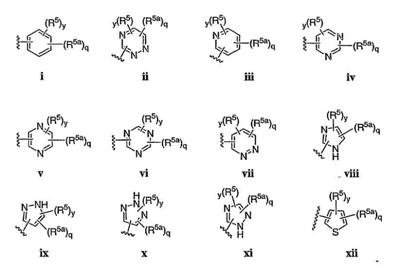
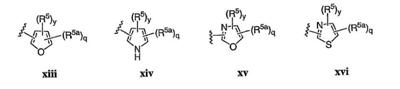
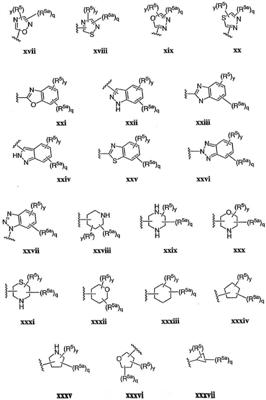
Согласно некоторым воплощениям кольцо А выбрано из необязательно замещенного фенила, 2-пиридила, 3-пиридила, 4-пиридила или пиррол-1-ила.
Согласно некоторым воплощениям у представляет 0-5, q представляет 0-2, R5 и R5а группы, когда они присутствуют, представляют каждая независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -NRCOR’, -CON(R’)2, -S(O)2N(R’)2, -OCOR’, -COR’, -CO2R’, -OCON(R’)2, -NR’SO2R’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, -OPO(R’)2 или необязательно замещенную группу, выбранную из С1-С6алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Согласно другим воплощениям у представляет 0-5, q представляет 1 или 2 и каждый из R5а представляет независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси.
Согласно следующим воплощениям у представляет 0, q представляет 1 и R5a представляет F. Согласно еще одним воплощениям у представляет 0, q представляет 1 и R5a представляет OR’. Согласно еще одним воплощениям у представляет 0, q представляет 1 и R5a представляет OН. Согласно еще одним воплощениям у представляет 0, q представляет 2 и один из заместителей R5a представляет OR’, а другой из заместителей R5a представляет F. Согласно еще одним воплощениям у представляет 0, q представляет 2 и один из заместителей R5a представляет OН, а другой из заместителей R5a представляет F.
Согласно следующим далее воплощениям кольцо А представляет фенил, у представляет 0, q представляет 1 и R5a является F, замещенным в положении 2 фенильного кольца. Согласно еще одним воплощениям кольцо А представляет фенил, у представляет 0, q представляет 1 и R5a представляет OR’, замещенный в положении 2 фенильного кольца. Согласно еще одним воплощениям кольцо А представляет фенил, у представляет 0, q представляет 1 и R5a является ОН замещенным в положении 2 фенильного кольца. Согласно еще одним воплощениям кольцо А представляет фенил, у представляет 0, q представляет 2 и один из R5a представляет OR’, а другой из R5a представляет F, где OR’ является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца. Согласно еще одним воплощениям кольцо А представляет фенил, у представляет 0, q представляет 2, и один из R5a представляет OН, а другой из R5a представляет F, где ОН является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца.
Другие примеры R5 и R5а групп включают группы, показанные ниже в таблице 2.
Что касается соединений, описанных в общем в данном разделе выше, отмечается, что соединения являются полезными в качестве ингибиторов ионных каналов, предпочтительно потенциалозависимых натриевых каналов и кальциевых каналов N-типа. В некоторых примерах воплощений соединения изобретения полезны в качестве ингибиторов NaV1.8. Согласно другим воплощениям соединения изобретения полезны в качестве ингибиторов NaV1.8 и CaV2.2. В других еще воплощениях соединения изобретения являются полезными в качестве ингибиторов CaV2.2. Согласно еще другим воплощениям соединения изобретения полезны в качестве двойных ингибиторов NaV1.8 и TTX-чувствительных ионных каналов, таких как NaV1.3 или NaV1.7.
Некоторые дополнительные воплощения соединений, в общем описанных выше, описываются более подробно ниже.
I. Соединения формулы IA:
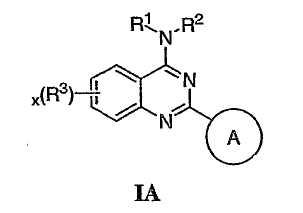
или их фармацевтически приемлемые соли, где
R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 3-12-членное моноциклическое или бициклическое насыщенное, частично ненасыщенное или полностью ненасыщенное кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода, где кольцо, образованное R1 и R2, взятыми вместе, является необязательно замещенным у одного или более замещаемых атомов углерода, азота или серы z числом независимых заместителей -R4, где z представляет 0-5;
кольцо А представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где кольцо А необязательно замещено числом у независимых заместителей -R5, где у представляет 0-5, и дополнительно необязательно замещено числом q независимых заместителей R5а, где q представляет 0-2;
х представляет 0-4;
каждый заместитель из R3, R4 и R5 представляет независимо Q-RX, где Q представляет связь или представляет С1-С6алкилиденовую цепь, где вплоть до двух несмежных метиленовых звеньев Q необязательно и независимо заменены группой -NR-, -S-, -O-, -CS- -CO2-, -OCO-, -CO-, -COCO-, -CONR-, -NRCO-, -NRCO2, -SO2NR-, -NRSO2-, -CONRNR-, -NRCONR-, -OCONR-, -NRNR-, -NRSO2NR-, -SO- -SO2-, -PO-, -PO2-, -OP(O)(OR)- или -POR-; и каждый из RX независимо выбран из -R’, галогена, =O, =NR’, -NO2, -CN, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2;
каждый из R5a представляет независимо необязательно замещенную С1-С6 алифатическую группу, галоген, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2 и
каждый из R представляет независимо водород или необязательно замещенную С1-6 алифатическую группу и каждый из R’ представляет независимо водород или необязательно замещенную С1-6 алифатическую группу 3-8-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членную насыщенную, частично ненасыщенную или полностью ненасыщенную бициклическую кольцевую систему, имеющую 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы; или R и R’, два из R или два из R’ взяты вместе с атомом(ами), к которому они присоединены, образуя необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В некоторых воплощениях соединений, описанных непосредственно выше:
а. когда R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 4-членное моноциклическое насыщенное или частично ненасыщенное кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода, тогда (4S)-3-[(3R,4R)-2-оксо-1-(2-фенил-4-хиназолинил)-4-[2-(3-пиридинил)этенил]-3-азетидинил]-4-фенил-2-оксазолидинон исключается;
b. когда R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 5-членное моноциклическое насыщенное или частично ненасыщенное кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода тогда:
i. кольцо А не является необязательно замещенным гексагидро-1Н-1,4-диазепин-1-илом и
ii. (R)-2-метокси-5-[2-[[1-(2-фенил-4-хиназолинил)-3-пирролидинил]амино]этил-]бензолсульфонамид, бис(трифторацетат) и (S)-2-метокси-5-[2-[[1-(2-фенил-4-хиназолинил)-3-пирролидинил]амино]этил]бензолсульфонамид, бис(трифторацетат) исключаются;
iii. 1-(2-фенил-4-хиназолинил)-3-пирролидинамин и (S)-1-(2-фенил-4-хиназолинил)-, (R)-3-пирролидинамин исключаются;
iv. когда R1 и R2, взятые вместе, представляют незамещенный пирролидин-1-ил, кольцо А представляет незамещенный фенил, и х равен 1, тогда R3 не является 6-ОМе или 6-ОН;
v. когда R1 и R2, взятые вместе, представляют незамещенный пирролидин-1-ил, кольцо А представляет незамещенный фенил, и х равен 2, тогда две R3 группы не являются 6-ОМе и 7-ОМе;
vi. когда R1 и R2, взятые вместе, представляют незамещенный пирролидин-1-ил, тогда кольцо А не является незамещенным пирролидин-1-илом, необязательно замещенным пиперазин-1-илом, незамещенным морфолин-1-илом или незамещенным пиперидин-1-илом;
vii. когда R1 и R2, взятые вместе, представляют пирролидин-1-ил, х равен 0 и кольцо А представляет незамещенный фенил, тогда пирролидин-1-ильная группа не является замещенной в положении 3 группой -ОН или 2-метокси-фенокси;
viii. когда R1 и R2, взятые вместе, представляют незамещенный пирролидин-1-ил, и х равен 0, тогда кольцо А не является 2,3-ксилилом, 3-метилфенилом, незамещенным фенилом, 4-бромфенилом, 4-хлорфенилом, 3-нитрофенилом, незамещенным пирид-3-илом, 2,4-дихлорфенилом, 3,4-дихлорфенилом, 4-пропоксифенилом, 3-метилфенилом, 3,4,5-триметоксифенилом, 2-хлорфенилом, незамещенным пирид-4-илом, 2-гидроксифенилом или 4-(1,1-диметилэтил)фенилом;
с. когда R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 6-членное моноциклическое или бициклическое насыщенное или частично ненасыщенное кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода, тогда:
i. когда R1 и R2, взятые вместе, образуют незамещенное морфолиновое кольцо и кольцо А представляет незамещенный фенил, тогда х не равен 0, или, если х равен 1 или 2, тогда R3 не представляет 6-фтор, 6,7-диметокси, 6-нитро, 6-AcHN-, 6-метокси, 6-NH2, 6-OCHN-, 6-OH, -6-AcMeN-, -6-TsHN-, 6-Me2N-, -7-OH, 6-аминотиазол-2-ил, 6-NHCOCOOEt или 6-(4-фениламинотиазол-2-ил);
ii. когда R1 и R2, взятые вместе, образуют незамещенное морфолиновое кольцо и кольцо А представляет незамещенный циклогексил, незамещенный пирид-3-ил, незамещенный 2-фурил, 2-фторфенил, 3-тиенил, бензофуран, пиридазин, фенил, замещенный в одном или более из 3, 4 или 5-положений фенильного кольца, и х равен 1 или 2, тогда R3 не представляет 6-NH2, 6-OHCHN-, 6-OH, 7-OH, 6-MsHN-, 6-АсНN-, 6-фтор или 6-ОМе;
iii. когда R1 и R2, взятые вместе, образуют пиперид-4-он, пиперид-4-ол или тиоморфолино, или диметилзамещенное морфолиновое кольцо, кольцо А представляет незамещенный фенил и х равен 1, тогда R3 не является 6-ОН;
iv. когда х равен 0 и А представляет незамещенный фенил, 3,4,5-триметоксифенил или 3,4-диметоксифенил, тогда R1 и R2, взятые вместе, не являются необязательно замещенным пиперидинилом или необязательно замещенным пиперазинилом;
v. когда х равен 2 или 3 и R3 представляет 6,7-диОМе или 6,7,8-триОМе, тогда R1 и R2, взятые вместе, не являются необязательно замещенным пиперидин-1-илом, пиперазин-1-илом или морфолин-1-илом;
vi. когда х равен 0 и кольцо А представляет незамещенный фенил, тогда R1 и R2, взятые вместе, не являются необязательно замещенным или сконденсированным пиперазинилом;
vii когда х равен 0 и кольцо А представляет фенил, необязательно замещенный в одном или более из 3-, 4- или 5-положений фенильного кольца, тогда R1 и R2, взятые вместе, не являются необязательно замещенным пиперазин-1-илом или морфолин-1-илом;
viii. когда х равен 0 и кольцо А представляет 2-F-фенил, тогда R1 и R2, взятые вместе, не являются 4-(2-Cl-фенил)-пиперазин-1-илом, 4-(3-Cl-фенил)пиперазин-1-илом или незамещенным морфолин-1-илом;
ix. когда х равен 0 и кольцо А представляет 2-Cl-фенил, тогда R1 и R2, взятые вместе, не являются незамещенным морфолин-1-илом, 4-Ме-пиперазин-1-илом, 4-Et-пиперазин-1-илом, 4-фенилпиперазин-1-илом или 4-CH2Ph2-пиперазин-1-илом;
x. когда х равен 0 и кольцо А представляет 2-ОН-фенил, тогда R1 и R2, взятые вместе, не являются незамещенным морфолин-1-илом, 4-(2-ОМе-фенил)пиперазин-1-илом, 4-CH2Ph-пиперазин-1-илом, 4-Et-пиперазин-1-илом или 4-Ме-пиперазин-1-илом;
xi. когда х равен 0, х равен 1 и R3 представляет 6-Br или х представляет 2 и R3 представляет 6,7-диОМе и кольцо А является необязательно замещенным 2- или 3-тиенилом, тогда R1 и R2, взятые вместе, не являются 4-Ph-пиперазин-1-илом, 4-(3-СF3-фенил)пиперазин-1-илом, 4-(2-ОEt-фенил)пиперазин-1-илом, 4-Ме-пиперазинилом или незамещенным морфолин-1-илом;
xii. когда х равен 0 и кольцо А представляет незамещенный пирид-3-ил или пирид-4-ил, тогда R1 и R2, взятые вместе, не являются необязательно замещенным морфолин-1-илом или необязательно замещенным пиперазин-1-илом;
xiii. когда х равен 0 и кольцо А представляет необязательно замещенный 1Н-имидазол-2-ил или 1Н-имидазол-1-ил, тогда R1 и R2, взятые вместе, не являются, незамещенным морфолин-1-илом, 4-Ме-пиперазин-1-илом или 4-СН2СН2ОН-пиперазин-1-илом;
xiv. когда х равен 0 и кольцо А представляет 5-NO2-тиазол-2-ил, тогда R1 и R2, взятые вместе, не являются 4-Ме-пиперазин-1-илом;
xv. когда х равен 0 и кольцо А представляет 5-NO2-2-фуранил, тогда R1 и R2, взятые вместе, не являются 4-СН2СН2ОН-пиперазин-1-илом, 4-Ме-пиперазин-1-илом или незамещенным морфолин-1-илом;
xvi когда х равен 1, R3 представляет 6-ОН и кольцо А представляет незамещенный фенил, тогда R1 и R2, взятые вместе, не являются незамещенным морфолин-1-илом или 4-Ме-пиперазин-1-илом;
xvii. когда х равен 0 и R1 и R2, взятые вместе, представляют незамещенный пиперидинил, тогда кольцо А не представляет 2-ОН-фенил, 4-ОМе-фенил, 4-фторфенил, 4-NO2-фенил, пирид-3-ил, пирид-4-ил, 2-хлорфенил, 4-ОnPr-фенил, 3,4-дихлорфенил, 2-F-фенил, 4-Br-фенил, 4-Cl-фенил, 3-NO2-фенил или 2,4-дихлорфенил;
xviii. когда х равен 0, кольцо А представляет 4-Br-фенил, 2-F-фенил, 2-Cl-фенил, 4-Cl-фенил, 4-OnPr-фенил, 2,4-дихлорфенил, 3,4-дихлорфенил, 4-Me-фенил, 3-Ме-фенил, пирид-3-ил, пирид-4-ил, 2-ОН-фенил, 4-NO2-фенил, 4-tBu-фенил, тогда R1 и R2, взятые вместе, не являются 2-Ме-пиперидин-1-илом, 4-СН2-Ph-пиперидин-1-илом, 4-метилпиперидин-1-илом, 3-COOEt-пиперидин-1-илом, 4-COOEt-пиперидин-1-илом, 2-Et-пиперидин-1-илом, 3-Ме-пиперидин-1-илом, 3,5-диметилпиперидин-1-илом, 4-СОNН2-пиперидин-1-илом, (4-пиперидинил, 4-карбоксамид)пиперидин-1-илом, 1,4-диокса-8-азаспиро[4,5]деканом, 3,4-дигидро-2(1Н)-изохинолинилом или пиперидин-4-оном;
xix. когда х равен 1, R3 представляет 6-Br, 6-Cl, 6-OH, 6-OМe или 6-Ме и кольцо А представляет 4-бромфенил, 4-СН2Р(О)(ОН)(ОЕt)фенил или незамещенный фенил, тогда R1 и R2, взятые вместе, не являются необязательно замещенным пиперидинилом;
xx. когда х равен 2, R3 представляет 6,7-диметокси и А представляет незамещенный фенил, тогда R1 и R2, взятые вместе, не являются 1,4-диокса-8-азаспиро[4,5]деканом или 3,4-дигидро-2(1Н)-изохинолинилом;
xxi. когда х равен 3, три заместителя из R3 представляют 5-ОАс, 6-ОАс и 8-пиперидинил и кольцо А представляет незамещенный фенил, тогда R1 и R2, взятые вместе, не являются незамещенным пиперидинильным кольцом;
xxii. когда х равен 3, три из R3 представляют 6-Ме, 7-СООЕt и 8-Ме, кольцо А представляет 2-хлорфенил, тогда R1 и R2, взятые вместе, не являются 4-фенилпиперидин-1-илом, 4-(4-хлорфенил)-пиперазин-1-илом, незамещенным пиперазин-1-илом, 4-СН2Ph-пиперазин-1-илом, 4-(2-хлорфенил)пиперазин-1-илом или 4-СООЕt-пиперазин-1-илом;
с. когда R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 7-членное моноциклическое или бициклическое насыщенное или частично ненасыщенное кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода, тогда:
i. бензолсульфонамид, 2-метокси-5-[2-[5-(2-фенил-4-хиназолинил)-2,5-диазабицикло[2,2,1]гепт-2-ил]этил]- и бис(трифторацетат) 2,5- диазабицикло[2,2,1]гептан, 2-(2-фенил-4-хиназолинил)- исключаются;
ii. когда х равен 2, оба заместителя из R3 представляют ОМе и кольцо А представляет 4-хлорфенил, тогда R1 и R2, взятые вместе, не являются незамещенным гексагидро-1Н-азепин-1-илом;
iii. когда х равен 0 и R1 и R2, взятые вместе, представляют незамещенный гексагидро-1Н-азепин-1-ил, тогда кольцо А не является незамещенным фенилом, 4-фторфенилом, 4-нитрофенилом, пирид-4-илом, 3,4-дихлорфенилом, 2-хлорфенилом, 2,4-дихлорфенилом, 2,4-дихлорфенилом, 3-нитрофенилом, 4-хлорфенилом, 4-OnPr-фенилом, 3-Ме-фенилом, 3,4-Оме-фенилом, 3,4,5-Оме-фенилом, пирид-3-илом или 2-ОН-фенилом;
d. когда R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 8-членное моноциклическое или бициклическое насыщенное или частично ненасыщенное кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода, тогда
i. 2-метокси-5-[2-[8-(2-фенил-4-хиназолинил)-3,8-диазабицикло[3.2.1]окт-3-ил]этил]бензолсульфонамид, бис(трифторацетат), 3-(фенилметил)-8-(2-фенил-4-хиназолинил)- 3,8-диазабицикло[3.2.1]октана, 8-(2-фенил-4-хиназолинил)-3,8-диазабицикло[3.2.1]октан; моногидрохлорид 2-(3-метилфенил)-4-(1,3,3-триметил-6-азабицикло[3.2.1]окт-6-ил)хиназолина; моногидрохлорид 2-(4-нитрофенил)-4-(1,3,3-триметил-6-азабицикло[3.2.1]окт-6-ил)хиназолина; 2-(3-метилфенил)-4-(1,3,3-триметил-6-азабицикло[3.2.1]окт-6-ил)хиназолин; 2-(4-метилфенил)-4-(1,3,3-триметил-6-азабицикло[3.2.1]окт-6-ил)хиназолин и 2-(4-нитрофенил)-4-(1,3,3-триметил-6-азабицикло[3.2.1]окт-6-ил)-хиназолин исключаются, и
е. когда R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 9-членное моноциклическое или бициклическое насыщенное или частично ненасыщенное кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода, тогда
1-[4-(1,3-дигидро-1,3-диоксо-2H-изоиндол-2-ил)-6,7-диметокси-2-хиназолинил]-4-(2-фуранилкарбонил)пиперазин исключается.
Согласно другим воплощениям для соединений, описанных непосредственно выше, кольцо, образованное R1 и R2, взятыми вместе, выбирается из:
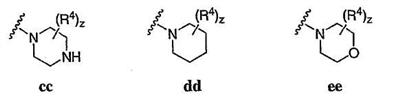
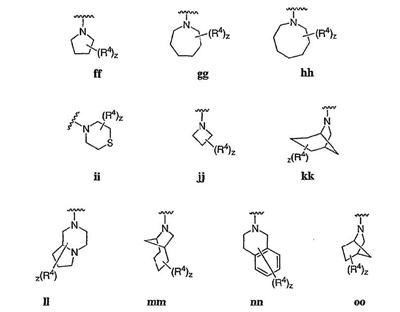
где кольцо, образованное R1 и R2, взятыми вместе, является необязательно замещенным у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4 и z равен 0-5.
Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), пирролидин-1-ил (ff), пиперидин-1-ил (dd), пиперазин-1-ил (cc) или морфолин-4-ил (ee). Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), пирролидин-1-ил (ff), пиперидин-1-ил (dd) или пиперазин-1-ил (сс). Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj). Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff). Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd). Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (cc).
Для соединений, описанных непосредственно выше, z представляет 0-5 и R4 группы, когда они присутствуют, каждая представляет независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CН2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6 алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6 алкила или гетероциклоалифатического С1-С6 алкила.
Согласно дополнительным другим воплощениям z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3,
-COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила.
Согласно некоторым воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 или 2, и, по крайней мере, один заместитель из R4 представляет -NRSO2R’, -NRCOOR’ или -NRCOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRSO2R’. Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет – NRCOOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOR’. Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff), где z представляет 1 или 2 и R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’ или -CH2OR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 или 2, и, по крайней мере один заместитель из R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’, -CH2OR’, -NRSO2R’, -NRCOOR’ или -OCON(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1, и R4 представляет F, CF3, CH3, -CH2CH3, -OR’ или CH2OR’. Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1, и R4 представляет -NRSO2R’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1, и R4 представляет -NRCOOR’. Согласно еще другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 или 2, и, по крайней мере, один заместитель из R4 представляет -SOR’, -CON(R’)2, -SO2N(R’)2, -COR’ или -COOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1, и R4 представляет -SOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -СОOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -СON(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -SO2N(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -COR’.
Для соединений, описанных непосредственно выше, согласно некоторым воплощениям х представляет 0-4 и R3 группы, когда они присутствуют, каждая независимо представляет галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, -COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арил С1-С6 алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6 алкила или гетероциклоалифатического С1-С6алкила.
Согласно другим воплощениям х представляет 1 или 2 и каждый из R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси.
Согласно следующим воплощениям х представляет 1 или 2 и каждая R3 группа представляет независимо галоген, CN, необязательно замещенный С1-С6алкил, OR’, N(R’)2, CON(R’)2 или NRCOR’.
Согласно следующим воплощениям х представляет 1 или 2 и каждая R3 группа представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN.
Согласно следующим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN.
Согласно следующим далее воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN.
Согласно дальнейшим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Согласно дальнейшим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Для соединений, описанных непосредственно выше, согласно некоторым воплощениям кольцо А представляет группу, выбранную из:
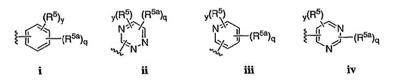
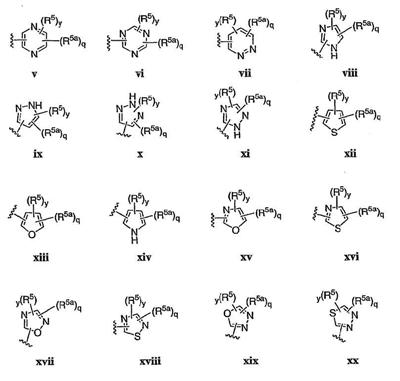
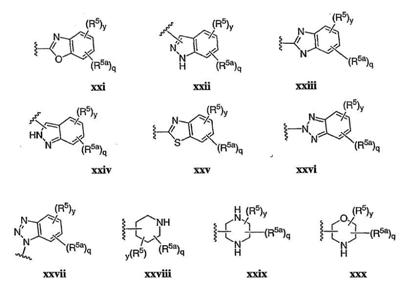
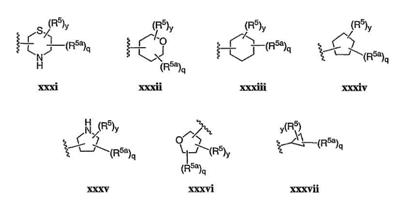
Согласно другим воплощениям кольцо А представляет необязательно замещенный фенил, 2-пиридил, 3-пиридил, 4-пиридил или пиррол-1-ил.
Для соединений, описанных непосредственно выше, согласно некоторым воплощениям у представляет 0-5, q представляет 0-2, R5 и R5а группы, когда они присутствуют, представляют каждая независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -NRCOR’, -CON(R’)2, -S(O)2N(R’)2, -OCOR’, -COR’, -CO2R’, -OCON(R’)2, -NR’SO2R’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, -OPO(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6 алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Согласно другим воплощениям у представляет 0-5, q представляет 1 или 2 и каждый из R5а представляет независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2,
-N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси.
Согласно следующим воплощениям у представляет 0, q представляет 1 и R5a представляет F. Согласно еще одним воплощениям у представляет 0, q представляет 1 и R5a представляет OR’. Согласно еще одним воплощениям у представляет 0, q представляет 1 и R5a представляет OН. Согласно еще одним воплощениям у представляет 0, q представляет 2 и один из R5a представляет OR’, а другой из R5a представляет F. Согласно еще одним воплощениям у представляет 0, q представляет 2 и один из R5a представляет OН, а другой из R5a представляет F.
Согласно другим воплощениям кольцо А представляет необязательно замещенный фенил, и соединения имеют структуру IA-i:
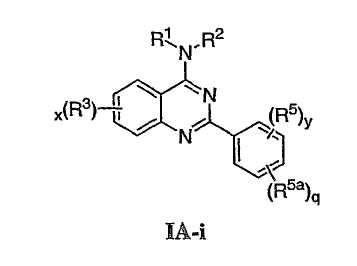
где y представляет 0-5;
q представляет 0-2 и
каждый заместитель из R5a представляет независимо необязательно замещенную С1-С6 алифатическую группу, галоген, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2.
Согласно некоторым примерам воплощений кольцо, образованное R1 и R2, взятыми вместе, выбирается из:
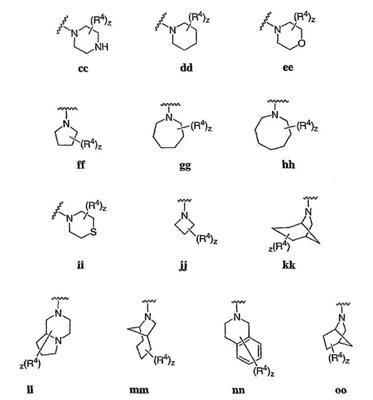
где кольцо, образованное R1 и R2, взятыми вместе, является необязательно замещенным у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4 и z равен 0-5.
Согласно другим воплощениям для соединений формулы IА-i R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), пирролидин-1-ил (ff), пиперидин-1-ил (dd), пиперазин-1-ил (cc) или морфолин-4-ил (ee). Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), пирролидин-1-ил (ff), пиперидин-1-ил (dd) или пиперазин-1-ил (сс). Согласно еще другим воплощениям для соединений формулы
IA-i R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj). Согласно еще другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff). Согласно еще другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd). Согласно следующим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (cc).
Для соединений формулы IA-i z представляет 0-5 и R4 группы, когда они присутствуют, каждая представляет независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CН2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила. Согласно другим воплощениям z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3,
-CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила, или -CH2тиазолила.
Согласно некоторым воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 или 2, и, по крайней мере, один из R4 представляет -NRSO2R’, -NRCOOR’ или -NRCOR’. Согласно некоторым другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRSO2R’. Согласно другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOOR’. Согласно некоторым другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOR’. Согласно еще другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff), где z представляет 1 или 2 и R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’, или -CH2OR’. Согласно еще одним воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 или 2 и по крайней мере один из R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’ или -CH2OR’, -NRSO2R’, -NRCOOR’ или -OCON(R’)2. Согласно некоторым другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет F, CF3, CH3, -CH2CH3, -OR’ или -CH2OR’. Согласно другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет -NRSO2R’. Согласно некоторым другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет -NRCOOR’. Согласно еще другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 или 2 и, по крайней мере, один из R4 представляет -SOR’, -CON(R’)2, -SO2N(R’)2, -COR’ или -COОR’. Согласно некоторым другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -SOR’. Согласно некоторым другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -СОOR’. Согласно некоторым другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -СON(R’)2. Согласно некоторым другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -SO2N(R’)2. Согласно некоторым другим воплощениям для соединений формулы IA-i R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -COR’.
Согласно некоторым воплощениям для соединений формулы IA-i х представляет 0-4 и R3 группы, когда они присутствуют, каждая независимо представляет галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -COOR’, -NRCOR’, -CON(R’)2, OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6 алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Согласно некоторым другим воплощениям х представляет 1 или 2 и каждый из R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси.
Согласно следующим воплощениям х представляет 1 или 2 и каждая R3 группа представляет независимо галоген, CN, необязательно замещенный С1-С6алкил, OR’, N(R’)2, CON(R’)2 или NRCOR’.
Согласно следующим воплощениям х представляет 1 или 2 и каждая R3 группа представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN.
Согласно следующим далее воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN.
Согласно следующим далее воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN.
Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Согласно другим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Согласно некоторым воплощениям для соединений формулы IA-i y представляет 0-5, q представляет 0-2 и R5 и R5а группы, когда они присутствуют, представляют каждая независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -NRCOR’, -CON(R’)2, -S(O)2N(R’)2, -OCOR’, -COR’, -CO2R’, -OCON(R’)2, -NR’SO2R’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, -OPO(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Согласно другим воплощениям у представляет 0-5, q представляет 1 или 2 и каждый из R5а представляет независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2,
-N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси.
Согласно следующим воплощениям, когда кольцо А представляет фенил, у представляет 0, q представляет 1 и R5a является фтор замещенным в положении 2 фенильного кольца. Согласно еще одним воплощениям, когда кольцо А представляет фенил, у представляет 0, q представляет 1 и R5a является OR’, замещенным в положении 2 фенильного кольца. Согласно еще одним воплощениям, когда кольцо А представляет фенил, у представляет 0, q представляет 1 и R5a является OН, замещенным в положении 2 фенильного кольца. Согласно еще одним воплощениям, когда кольцо А представляет фенил, у представляет 0, q представляет 2 и один из R5a представляет OR’, а другой из R5a представляет F, где OR’ является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца. Согласно еще одним воплощениям, когда кольцо А представляет фенил, у представляет 0, q представляет 2 и один из R5a представляет ОН, а другой из R5a представляет F, где OН является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца.
Согласно другим воплощениям для соединений формулы IA-i q равен 1 и R5a находится в положении 2 фенильного кольца, и соединения имеют структуру IA-ii:
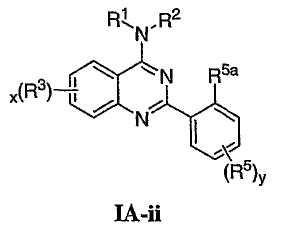
где
а) кольцо, образованное R1 и R2, взятыми вместе, выбирается из:
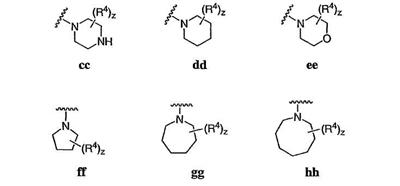
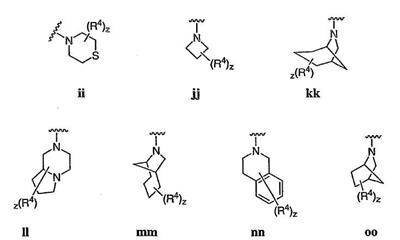
где кольцо, образованное R1 и R2, взятыми вместе, является необязательно замещенным у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4 и z равен 0-5;
b) где z представляет 0-5 и R4 группы, когда они присутствуют, каждая независимо представляет галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CН2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
с) где х представляет 0-4 и R3 группы, когда они присутствуют, каждая независимо представляет галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CН2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2, или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6 алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
d) где y представляет 0-5 и R5 группы, когда они присутствуют, представляют каждая независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -NRCOR’, -CON(R’)2, -S(O)2N(R’)2, -OCOR’, -COR’, -CO2R’, -OCON(R’)2, -NR’SO2R’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, -OPO(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила, или гетероциклоалифатического С1-С6алкила, и
е) R5а представляет Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси.
Согласно другим воплощениям для соединений формулы IA-ii q равен 1 и R5a находится в положении 2 фенильного кольца, и соединения имеют структуру IA-ii:
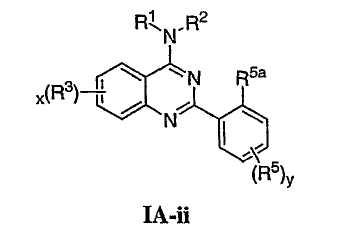
где
а) R1 и R2, взятые вместе, представляют необязательно замещенное кольцо, выбранное из азетидин-1-ила (jj), пирролидин-1-ила (ff), пиперидин-1-ила (dd) или пиперазин-1-ила (cc);
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2,
-SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила, или -CH2тиазолила;
с) х представляет 1 или 2 и каждый из R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси;
d) где у представляет 0-4 и R5 группы, когда они присутствуют, представляют каждая независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, -OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси и
е) R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3, -CH2OH, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) или -COCH3.
Согласно другим воплощениям для соединений формулы IA-ii х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил),
-OCH3, -NH2, -OCH2CH3 или -CN. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно другим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Согласно другим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Согласно следующим воплощениям R5а представляет Cl, F, CF3, Me, Et, OR’, -OH, -OCH3, -OCH2CH3.
Согласно следующим далее воплощениям R5а представляет OR’. Согласно еще одним воплощениям R5а представляет F.
Согласно другим примерам воплощений соединения имеют формулу IA-ii:
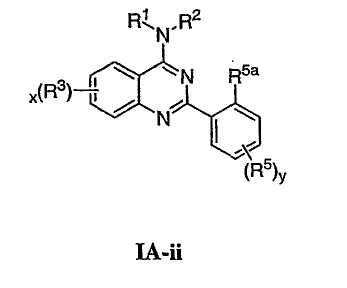
где
а) R1 и R2, взятые вместе, представляют необязательно замещенное кольцо, выбранное из азетидин-1-ила (jj), пирролидин-1-ила (ff), пиперидин-1-ила (dd) или пиперазин-1-ила (cc);
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3,
-SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила;
с) х представляет 1 и каждый из R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -OH или -OCH3;
d) у представляет 0 или 1 и R5 группы, когда они присутствуют, представляют каждая независимо Cl, Br, F, CF3, Me, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2 и
е) R5а представляет F, -OR’ или NHSO2R’.
Согласно другим воплощениям для соединений, описанных непосредственно выше, х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно другим воплощениям х представляет 1, и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим далее воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. Согласно следующим далее воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Согласно еще одним воплощениям R5а представляет OR’, х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно еще одним воплощениям R5а представляет OR’, х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Согласно другим воплощениям R5а представляет OН, х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно другим воплощениям R5а представляет OН, х представляет 1, и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Согласно еще одним воплощениям R5а представляет F, х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно еще одним воплощениям R5а представляет F, х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Согласно следующим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj). Согласно другим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff). Согласно другим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd). Согласно другим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (cc).
Согласно другим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 или 2, и по крайней мере один R4 представляет -NRSO2R’, -NRCOOR’ или -NRCOR’. Согласно другим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRSO2R’. Согласно следующим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOOR’. Согласно следующим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOR’. Согласно следующим далее воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff), где z представляет 1 или 2 и R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’ или CH2OR’. Согласно следующим далее воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 или 2 и, по крайней мере, один R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’ или CH2OR’, -NRSO2R’, -NRCOOR’ или -OCON(R’)2. Согласно еще одним воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет F, CF3, CH3, -CH2CH3, -OR’ или CH2OR’. Согласно еще одним воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет -NRSO2R’. Согласно другим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет -NRCOOR’. Согласно другим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (cc), где z представляет 1 или 2 и, по крайней мере, один R4 представляет -SOR’, -CON(R’)2, -SO2N(R’)2, -CОR’ или COOR’. Согласно другим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -SOR’. Согласно следующим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -CОOR’. Согласно следующим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -CОN(R’)2. Согласно следующим далее воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет – SO2N(R’)2. Согласно некоторым другим воплощениям для соединений формулы IA-ii R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -CОR’.
В отношении соединений, описанных в данном разделе в общем выше, отмечается, что соединения являются полезными в качестве ингибиторов ионных каналов, предпочтительно потенциалозависимых натриевых каналов и кальциевых каналов N-типа. В некоторых примерах воплощений соединения изобретения полезны в качестве ингибиторов NaV1.8. В других воплощениях соединения изобретения полезны в качестве ингибиторов NaV1.8 и CaV2.2. В других еще воплощениях соединения изобретения полезны в качестве ингибиторов CaV2.2. В еще других воплощениях соединения изобретения полезны в качестве двойных ингибиторов NaV1.8 и ТТХ-чувствительных ионных каналов, таких как NaV1.3 или NaV1.7.
II. Соединения формулы IA-ii:
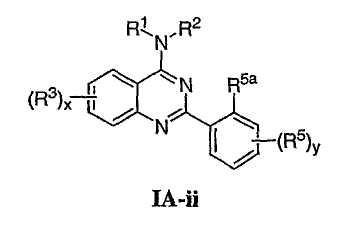
где R1 и R2 представляют каждая независимо необязательно замещенную группу, выбранную из С1-6алифатической группы, Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-,
-NRCO-, -CONR-, SO2NR- или -NRSO2-, где R1 и R2 являются каждый необязательно и независимо замещенными у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4, где z представляет 0-5;
х представляет 0-4;
у представляет 0-4;
каждый из R3, R4 и R5 представляет независимо Q-RX, где Q представляет связь или представляет С1-С6алкилиденовую цепь, где вплоть до двух несмежных метиленовых звеньев группы Q необязательно и независимо заменены группой -NR-, -S-, -O-, -CS- -CO2-, -OCO-, -CO-, -COCO-, -CONR-, -NRCO-, -NRCO2, -SO2NR-, -NRSO2-, -CONRNR-, -NRCONR-, -OCONR-, -NRNR-, -NRSO2NR-, -SO-, -SO2-, -PO-, -PO2-, -OP(O)(OR)- или -POR-; и каждый из RX независимо выбран из -R’, =O, =NR’, галогена, -NO2, -CN, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2;
R5a представляет необязательно замещенную С1-С6 алифатическую группу, галоген, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2 и
каждый из R представляет независимо водород или необязательно замещенную С1-6 алифатическую группу и каждый из R’ представляет независимо водород или необязательно замещенную С1-6 алифатическую группу, 3-8-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членную насыщенную, частично ненасыщенную или полностью ненасыщенную бициклическую кольцевую систему, имеющую 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы, или R и R’, два из R или два из R’, взяты вместе с атомом(ами), к которому они присоединены, образуя необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В некоторых воплощениях для соединений, непосредственно описанных выше,
а. когда х равен 0, R1 представляет водород и R5a представляет Cl, Me, CF3, Br или F, тогда R2 не является группой -(CH2)2-4-Cy1, -SO2CH2Cy1 или -CH2SO2Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-8-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы;
b. когда х равен 0 и R5a представляет Cl, Me, NO2 или OH, тогда:
i. когда R1 представляет водород, R2 не является группой Me iBu, nBu, -COCH3, -CH2COOEt, -CH2COOMe, -CH2CH2OH, iPr, -CH2-пиридил, -CH2Ph, -(CH2)3NH2, -(CH2)2-морфолинил или -CH2CH2Ph;
ii. R1 и R2 не являются одновременно Et или Me и
iii. когда R1 представляет Et, тогда R2 не является группой 4-Ме-фенил, 4-ОМе-фенил или 2-Ме-фенил;
c. когда х равен 1 и R3 представляет 6-Cl, 7-F или x равен 0 и R5a представляет -OРrn или Cl, тогда, когда R1 представляет водород, R2 не является группой -(СН2)2-морфолино, -СН2(бензофуран) и
d. когда х равен 2 и один из R3 представляет 6-OМe, а другой R3 представляет 7-OМe и R5a представляет F, тогда, когда R1 представляет водород, R2 не является группой -(CH2)3N(CH3)2.
В некоторых других воплощениях для соединений, непосредственно описанных выше,
а) один из R1 или R2 представляет водород, а другой из R1 и R2 выбран из:
i. Cy1, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-, или
ii. необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-, или
b) R1 и R2 каждый независимо выбран из Cy1, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-, или необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-.
В других воплощениях Cy1 представляет:
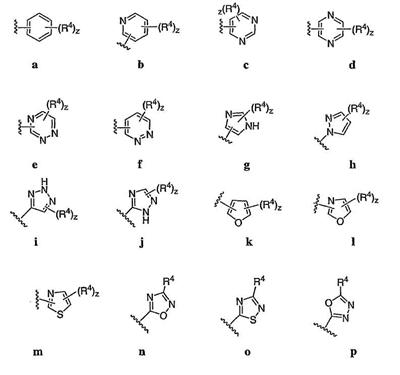
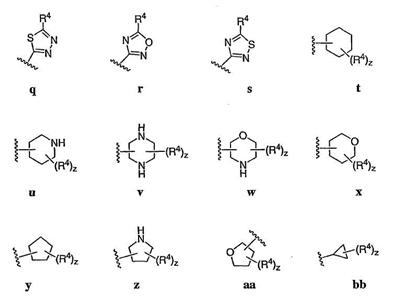
В еще одних воплощениях для соединений, непосредственно описанных выше, R1 представляет водород или необязательно замещенную С1-4алифатическую группу и R2 представляет -CHR-Cy1, где R представляет водород или С1-4алкил, и Cy1 представляет:
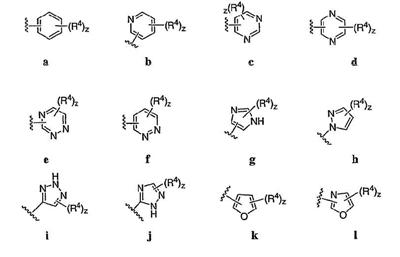
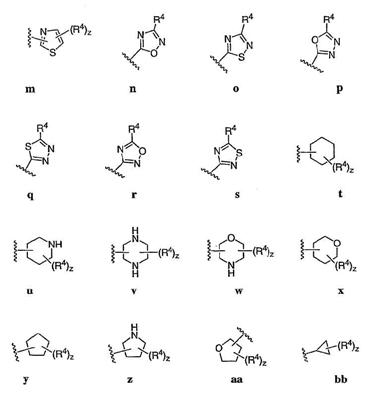
В других воплощениях R1 и R2 представляют каждый независимо необязательно замещенную С1-4алифатическую группу, и каждый независимо выбран из необязательно замещенного метила, этила, циклопропила, н-пропила, пропенила, циклобутила, (СО)ОСН2СН3, (СН2)2ОСН3, СН2(СО)ОСН2СН3, СН2(СО)ОСН3,
СН(СН3)СН2СН3 или н-бутила.
Для соединений, описанных непосредственно выше, z представляет 0-5 и R4 группы, когда они присутствуют, каждая представляет независимо галоген, CN, NO2, -N(R’)2, CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CН2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Согласно другим воплощениям z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила.
Согласно еще одним воплощениям для соединений, непосредственно описанных выше, х представляет 0-4 и R3 группы, когда они присутствуют, представляют каждая независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6 алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Согласно следующим воплощениям для соединений, непосредственно описанных выше, х представляет 1 или 2 и каждый из R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси.
Согласно следующим воплощениям х представляет 1 или 2 и каждая R3 группа представляет независимо галоген, CN, необязательно замещенный С1-С6алкил, OR’, N(R’)2, CON(R’)2 или NRCOR’.
Согласно следующим воплощениям х представляет 1 или 2 и каждая R3 группа представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN.
Согласно следующим далее воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN.
Согласно следующим далее воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN.
Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3.
Согласно другим воплощениям R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Согласно другим воплощениям х равен 1 и R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Для соединений, описанных непосредственно выше, у представляет 0-4, q представляет 0-2 и R5 и R5а группы, когда они присутствуют, представляют каждая независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -NRCOR’, -CON(R’)2, -S(O)2N(R’)2, -OCOR’, -COR’, -CO2R’, -OCON(R’)2, -NR’SO2R’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, -OPO(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Согласно другим воплощениям у представляет 0-4, q представляет 1 или 2 и каждый из R5а представляет независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2,
-N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси.
Согласно следующим воплощениям у представляет 0 и R5a представляет F. Согласно еще одним воплощениям у представляет 0, q представляет 1 и R5a представляет OR’. Согласно еще одним воплощениям у представляет 0, q представляет 1 и R5a представляет OН. Согласно еще одним воплощениям у представляет 1, R5a представляет OR’ и R5 представляет F, где OR’ является замещенным в положении 2 фенильного кольца, и F является замещенным в положении 6 фенильного кольца. Согласно еще одним воплощениям у представляет 1, R5a представляет ОН и R5 представляет F, где OН является замещенным в положении 2 фенильного кольца, и F является замещенным в положении 6 фенильного кольца.
Согласно следующим воплощениям для соединений формулы IA-ii, непосредственно описанных выше,
а) один из R1 или R2 представляет водород, а другой из R1 и R2 выбран из Cy1,
где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе являются необязательно замененными группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-, или необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе являются необязательно замененными группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; или R1 и R2 каждый независимо выбран из необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; или Cy1, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-;
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2,
-SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2,
-C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила, или -CH2тиазолила;
с) х представляет 0, 1 или 2 и каждый из R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси;
d) где у равен 0-4, и R5 группы, когда они присутствуют, представляют каждая независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3,
-SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси и
е) R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3, -CH2OH, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) или -COCH3.
Согласно другим воплощениям для соединений, непосредственно описанных выше, х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно еще одним воплощениям х представляет 1, и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Согласно другим воплощениям х равен 1, и R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Согласно другим воплощениям R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3.
Согласно другим воплощениям у представляет 0 и R5a представляет F. Согласно следующим воплощениям у представляет 0, q представляет 1 и R5a представляет OR’. Согласно следующим воплощениям у представляет 0, q представляет 1 и R5a представляет OН. Согласно другим воплощениям у представляет 1, R5a представляет OR’ и R5 представляет F, где OR’ является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца. Согласно другим воплощениям у представляет 1, R5a представляет ОН и R5 представляет F, где OН является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца.
Согласно другим воплощениям для соединений формулы IA-ii, непосредственно описанным выше,
а) один из R1 или R2 представляет водород, а другой из R1 и R2 выбран из Cy1,
где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-, или необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; или R1 и R2 каждый независимо выбран из необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; или Cy1, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в
С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; и Cy1 выбран из:

или R1 и R2 представляют каждый независимо необязательно замещенную С1-4алифатическую группу, и каждый независимо выбран из необязательно замещенного метила, этила, циклопропила, н-пропила, пропенила, циклобутила, (СО)ОСН2СН3, (СН2)2ОСН3, СН2(СО)ОСН2СН3, СН2(СО)ОСН3, СН(СН3)СН2СН3 или н-бутила;
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила;
с) х представляет 0, 1 или 2 и каждый из R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси;
d) где у равен 0-4, и R5 группы, когда они присутствуют, представляют каждая независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси и
е) R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3, -CH2OH, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) или -COCH3.
Согласно еще одним воплощениям для соединений, непосредственно описанных выше, х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил) -OCH3, -NH2, -OCH2CH3 или -CN. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим воплощениям х представляет 1, и R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. Согласно следующим воплощениям х равен 1, и R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. Согласно еще одним воплощениям R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3.
Согласно другим воплощениям у представляет 0 и R5a представляет F. Согласно другим воплощениям у представляет 0, q представляет 1 и R5a представляет OR’. Согласно другим воплощениям у представляет 0, q представляет 1 и R5a представляет OН. Согласно еще одним воплощениям у представляет 1, R5a представляет OR’ и R5 представляет F, где OR’ является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца. Согласно еще одним воплощениям у представляет 1, R5a представляет ОН и R5 представляет F, где OН является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца.
Для соединений, описанных в общем в данном разделе выше, отмечается, что соединения являются полезными в качестве ингибиторов ионных каналов, предпочтительно потенциалозависимых натриевых каналов и кальциевых каналов N-типа. В некоторых примерах воплощений соединения изобретения полезны в качестве ингибиторов NaV1.8. Согласно другим воплощениям соединения изобретения полезны в качестве ингибиторов NaV1.8 и CaV2.2. В других еще воплощениях соединения изобретения являются полезными в качестве ингибиторов CaV2.2. Согласно еще другим воплощениям соединения изобретения полезны в качестве двойных ингибиторов NaV1.8 и TTX-чувствительных ионных каналов, таких как NaV1.3 или NaV1.7.
III. Соединения формулы IA-i:
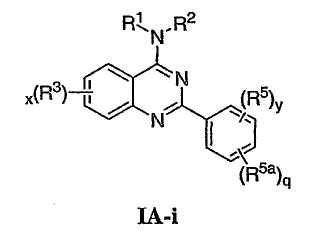
или их фармацевтически приемлемые соли,
где R1 и R2 представляют каждая независимо необязательно замещенную группу, выбранную из С1-6алифатической группы, Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в
С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; где R1 и R2 являются каждый необязательно и независимо замещенным у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4, где z представляет 0-5;
х представляет 1 и R3 является замещенным или в 6- или положении 7 хинолинового кольца;
у представляет 0-4;
q представляет 0, 1 или 2;
каждый из R3, R4 и R5 представляет независимо Q-RX, где Q представляет связь или представляет С1-С6 алкилиденовую цепь, где вплоть до двух несмежных метиленовых звеньев группы Q необязательно и независимо заменены группами -NR-, -S-, -O-, -CS- -CO2-, -OCO-, -CO-, -COCO-, -CONR-, -NRCO-, -NRCO2, -SO2NR-, -NRSO2-, -CONRNR-, -NRCONR-, -OCONR-, -NRNR-, -NRSO2NR-, -SO-, -SO2-, -PO-, -PO2-, -OP(O)(OR)-, или -POR-; и каждый из RX независимо выбран из -R’, =O, =NR’, галогена, -NO2, -CN, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2
каждый из R5a представляет независимо необязательно замещенную С1-С6 алифатическую группу, галоген, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2 и
каждый из R представляет независимо водород или необязательно замещенную С1-6 алифатическую группу и каждый из R’ представляет независимо водород или необязательно замещенную С1-6 алифатическую группу, 3-8-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членную насыщенную, частично ненасыщенную или полностью ненасыщенную бициклическую кольцевую систему, имеющую 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы, или R и R’, два из R или два из R’, взяты вместе с атомом(ами), к которому они присоединены, образуя необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В некоторых воплощениях для соединений, непосредственно описанных выше,
а) когда R3 находится в положении 7 хиназолинового кольца, тогда
i) когда R3 представляет Cl или Me, кольцо A представляет незамещенный нафтил, и R1 представляет водород, тогда R2 не является группой -(CH2)3NMe2;
ii) когда R3 представляет Cl, сумма q и y равна 1 и фенильное кольцо замещено в 4-положении Br, и R1 представляет водород, тогда R2 не является Cy1, где Cy1 связан с атомом азота через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-;
iii) когда R3 представляет Cl или OMe, сумма q и y равна 1 и фенильное кольцо замещено в 4-положении группой или OМe или Cl и R1 представляет водород, тогда R2 не является группой -CH(CH3)(CH2)3N(Et)2;
iv) когда R3 представляет Me, OМe или NO2, q и y равны 0, тогда R1 и R2 оба не являются метилами;
v) когда R3 представляет OМe, q и y равны 0 и R1 представляет водород, тогда R2 не является -SO2(4-Me-фенил);
vi) когда R3 представляет F, сумма q и y равна 1, фенильное кольцо замещено в положении 2 Cl и R1 представляет водород, тогда R2 не является группой (-CH2)морфолино, и
b) когда R3 находится в положении 6 хиназолинового кольца, тогда:
i) когда R3 представляет NH2, Me, Cl, Br, -NHAc, сумма q и y равна 1, фенильное кольцо замещено в 4-положении F или кольцо А представляет нафтил и R1 представляет водород, тогда R2 не является группой (-CH3)3-4N(R’)2;
ii) когда R3 представляет -OCH2Ph или OH и q и y равны 0, тогда, когда R1 представляет водород, R2 не является группой Me, nBu или -(СН2)морфолино или R1 и R2 одновременно не являются Me или Et;
iii) когда R3 представляет Me или Cl, и сумма q и y равна 1, тогда фенильное кольцо не замещено в 4-положении бромом;
iv) когда R3 представляет Cl, q и y равны 0 и R1 представляет водород, тогда R2 не является группой -SO2(4-Me-фенил);
v) когда R3 представляет ОМе, q и y равны 0 и R1 представляет водород, тогда R2 не является группой -СН2СН2ОН или -СН2СН2пирролидинил;
vi) когда R3 представляет Cl или Br, сумма q и y равна 1 и фенильное кольцо замещено в 4-положении группой -СН2РО(ОR’)2, тогда R1 не является водородом, когда R2 представляет -Ме или R1 и R2 одновременно не являются Me или Et;
vii) когда R3 представляет ОН и q и y равны 0, тогда R1 и R2 одновременно не являются -СН2СН2ОМе;
viii) когда R3 представляет Cl, сумма q и y равна 1 фенильное кольцо замещено в положении 2 группой OnPr и R1 представляет водород, тогда R2 не является -СН2(1,3-бензодиоксолом);
ix) когда R3 представляет ОМе, ОН, Br, Cl, NO2, Me, и q и y равны 0, тогда, когда R1 представляет водород, R2 не является Ме, -СН2СН2СООМе, -СН2СООМе или -(СН2)3СН3, или R1 и R2 не являются одновременно Ме; и
x) когда R3 представляет Cl, сумма q и y равна 1 и фенильное кольцо замещено в 4-положении Cl, тогда R1 и R2 не являются одновременно Ме или iPr.
В некоторых других воплощениях для соединений, непосредственно описанных выше:
а) один из R1 или R2 представляет водород, а другой из R1 и R2 выбран из:
i) Cy1, где Cy1 связан непосредственно с атомом азота или присоединен через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2– или
ii) необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; или
b) R1 и R2 каждый независимо выбраны из Cy1, где Cy1 связан непосредственно с атомом азота или присоединен через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR-, или -NRSO2– или необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO-, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-.
В следующих воплощениях Cy1 представляет:
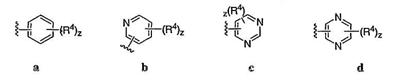
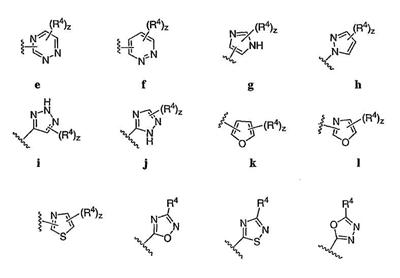
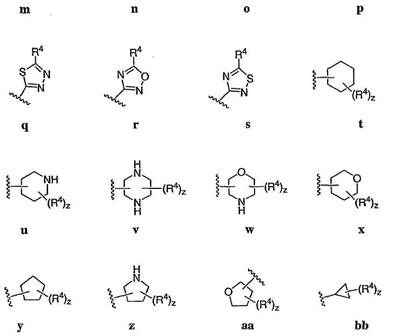
В других воплощениях R1 представляет водород или необязательно замещенную С1-С4алифатическую группу и R2 представляет -CHR-Cy1, где R представляет водород или С1-С4алкил и Су1 представляет:
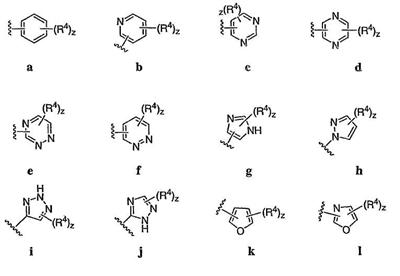
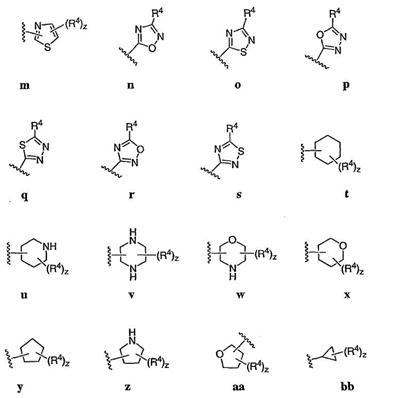
В других воплощениях R1 и R2 группы каждая неазависимо представляют необязательно замещенную С1-С4алифатическую группу и каждая независимо выбрана из необязательно замещенной метильной, этильной, циклопропильной, н-пропильной, пропенильной, циклобутильной, (СО)ОСН2СН3, (СН2)2ОСН3, СН2(СО)ОСН2СН3, СН2(СО)ОСН3, СН(СН3)СН2СН3 или н-бутильной группы.
В следующих воплощениях для соединений описанных непосредственно выше, z представляет 0-5 и R4 группы, когда они присутствуют, каждая представляет независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CН2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила, или гетероциклоалифатического С1-С6алкила.
В следующих воплощениях z представляет 0-5 и R4 группы каждая представляет независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3, или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила.
В следующих далее воплощениях, для соединений описанных непосредственно выше, R3 группа представляет галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
В других воплощениях R3 представляет Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси.
В следующих воплощениях R3 группа представляет галоген, CN, необязательно замещенный С1-С6алкил, OR’, N(R’)2, CON(R’)2 или NRCOR’. В следующих далее воплощениях R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3,
-NH2, -OCH2CH3 или -CN. В следующих далее воплощениях, R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил),
-OCH3, -NH2, -OCH2CH3 или -CN. В следующих далее воплощениях R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. В других воплощениях R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. В других воплощениях R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. В других воплощениях R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 NRCOR’. В других воплощениях R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
В других воплощениях для соединений, описанных непосредственно выше, у представляет 0-5, q представляет 0-2 и R5 и R5а группы, когда они присутствуют, представляют каждая независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -NRCOR’, -CON(R’)2, S(O)2N(R’)2, -OCOR’, -COR’, -CO2R’, -OCON(R’)2, -NR’SO2R’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, -OPO(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
В других воплощениях у представляет 0-5, q представляет 1 или 2 и каждый R5а представляет независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси.
В других воплощениях у представляет 0 и R5a представляет F. Еще в другом воплощении у представляет 0, q представляет 1 и R5a представляет OR’. В других воплощениях у представляет 0, q представляет 1 и R5a представляет OН. В другом воплощении у представляет 1, R5a представляет OR’ и R5 представляет F, где OR’ является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца. В другом воплощении у представляет 1, R5a представляет OН и R5 представляет F, где ОН является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца.
В следующих воплощениях R3 является замещенным в положении 6 хиназолинового кольца, q представляет 1, а y представляет 0, и соединения имеют формулу III:
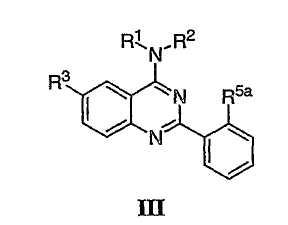
В некоторых воплощениях соединений, описанных выше:
а) R1 и R2 каждый независимо представляют необязательно замещенную группу, выбранную из С1-6алифатической группы, Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, независимо выбранных иэ азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 присоединен непосредственно к атому азота или присоединен через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, SO2NR- или -NRSO2-, где R1 и R2 каждый необязательно и независимо является необязательно замещенными у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4, где z равен 0-5;
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила;
с) R3 представляет Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CONHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси;
d) R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3, -CH2OH, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) или -COCH3.
В некоторых других воплощениях для соединений, описанных непосредственно выше, R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. В более других воплощениях R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. В других воплощениях R3 представляет -CON(R’)2 или NRCOR’. В других воплощениях R5a представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3.
В еще одних воплощениях y представляет 0, а R5a представляет F. В еще одних воплощениях у представляет 0, q представляет 1, а R5a представляет OR’. В следующих воплощениях y представляет 0, q представляет 1, а R5a представляет OH.
В некоторых других воплощениях для соединений, непосредственно описанных выше:
а) Су1 представляет:
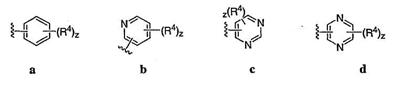
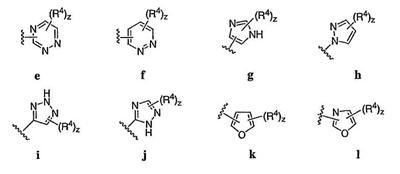
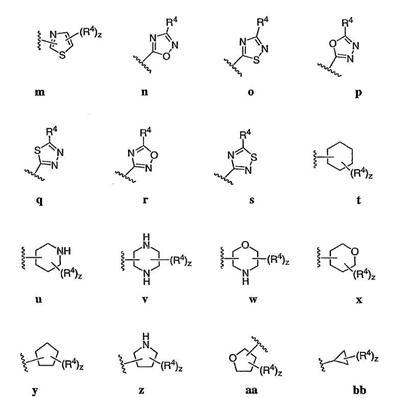
или R1 и R2 представляют каждый независимо необязательно замещенную С1-4алифатическую группу и каждый независимо выбран из необязательно замещенного метила, этила, циклопропила, н-пропила, пропенила, циклобутила, (СО)ОСН2СН3, (СН2)2ОСН3, СН2(СО)ОСН2СН3, СН2(СО)ОСН3, СН(СН3)СН2СН3 или н-бутила;
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила;
с) R3 представляет Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси, и
d) R5a представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3, -CH2OH, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) или -COCH3.
В некоторых воплощениях для соединений, описанных непосредственно выше, R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. В других воплощениях R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. В других воплощениях R3 представляет -CON(R’)2 или NRCOR’. В еще одних воплощениях R5a представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3. В еще одних воплощениях, y представляет 0, а R5a представляет F. В следующих воплощениях у представляет 0, q представляет 1, а R5a представляет OR’. В следующих воплощениях y представляет 0, q представляет 1, а R5a представляет OH.
В других воплощениях R3 является замещенной в положении 7 хиназолинового кольца, q представляет 1, а y представляет 0, и соединение имеет формулу IV:
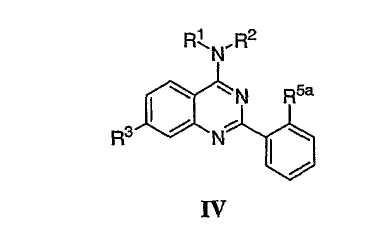
а) где R1 и R2 представляют каждая независимо необязательно замещенную группу, выбранную из С1-6алифатической группы, Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-, где R1 и R2 являются каждый необязательно и независимо замещенным у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4, где z представляет 0-5;
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила;
с) R3 представляет Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси, и
d) R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3, -CH2OH, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) или -COCH3.
В некоторых воплощениях для соединений, непосредственно описанных выше, R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3 -NH2, -OCH2CH3 или -CN. В других воплощениях R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. В еще одних воплощениях R3 представляет -CON(R’)2 или NRCOR’. В еще одних воплощениях R5a представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3. В следующих воплощениях y представляет 0, а R5a представляет F. В следующих воплощениях у представляет 0, q представляет 1, а R5a представляет OR’. В следующих далее воплощениях y представляет 0, q представляет 1, а R5a представляет OH.
В некоторых других воплощениях для соединений, непосредственно описанных выше:
а) Су1 представляет:
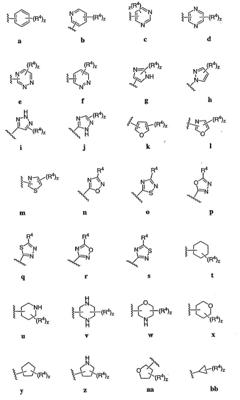
или R1 или R2 представляют каждый независимо необязательно замещенную С1-4алифатическую группу и каждый независимо выбран из необязательно замещенного метила, этила, циклопропила, н-пропила, пропенила, циклобутила, (СО)ОСН2СН3, (СН2)2ОСН3, СН2(СО)ОСН2СН3, СН2(СО)ОСН3, СН(СН3)СН2СН3 или н-бутила;
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3, или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила;
с) R3 представляет Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси, и
d) R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3, -CH2OH, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) или -COCH3.
В некоторых других воплощениях для соединений, непосредственно описанных выше, R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. В других воплощениях R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. В других воплощениях R3 представляет -CON(R’)2 или NRCOR’. В еще более других воплощениях R5a представляет Cl, F, CF3, Me, Et, -OH, -OCH3 или -OCH2CH3. В других воплощениях y представляет 0, а R5a представляет F. Еще в других воплощениях у представляет 0, q представляет 1, а R5a представляет OR’. В других воплощениях y представляет 0, q представляет 1, а R5a представляет OH.
Для соединений, описанных в общем в данном разделе выше, отмечается, что соединения являются полезными в качестве ингибиторов ионных каналов, предпочтительно потенциалозависимых натриевых каналов и кальциевых каналов N-типа. В некоторых примерах воплощений соединения изобретения полезны в качестве ингибиторов NaV1.8. Согласно другим воплощениям соединения изобретения полезны в качестве ингибиторов NaV1.8 и CaV2.2. В других еще воплощениях соединения изобретения являются полезными в качестве ингибиторов CaV2.2. Согласно еще другим воплощениям соединения изобретения полезны в качестве двойных ингибиторов NaV1.8 и TTX-чувствительных ионных каналов, таких как NaV1.3 или NaV1.7.
IV. Соединения формулы V:
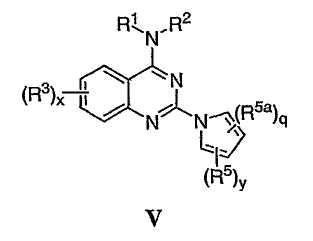
где R1 и R2 представляют каждая независимо необязательно замещенную группу, выбранную из С1-6алифатической группы, Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, SO2NR- или -NRSO2-, или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 3-12-членное насыщенное или частично ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода, где R1 и R2 или кольцо, образованное R1 и R2, взятыми вместе, являются каждый необязательно и независимо замещенным у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4, где z представляет 0-5;
х представляет 0-4;
у представляет 0-2;
каждый из R3, R4 и R5 представляет независимо Q-RX, где Q представляет связь или представляет С1-С6 алкилиденовую цепь, где вплоть до двух несмежных метиленовых звеньев группы Q необязательно и независимо заменены группами -NR-, -S-, -O-, -CS- -CO2-, -OCO-, -CO-, -COCO-, -CONR-, -NRCO-, -NRCO2, -SO2NR-, -NRSO2-, -CONRNR-, -NRCONR-, -OCONR-, -NRNR-, -NRSO2NR-, -SO-, -SO2-, -PO-, -PO2-, -OP(O)(OR)-, или -POR-; и каждый из RX независимо выбран из -R’, =O, =NR’, галогена, -NO2, -CN, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, или -OPO(R’)2;
R5a представляет необязательно замещенную С1-С6 алифатическую группу, галоген, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, или -OPO(R’)2 и
каждый из R представляет независимо водород или необязательно замещенную С1-6 алифатическую группу и каждый из R’ представляет независимо водород или необязательно замещенную С1-6 алифатическую группу, 3-8-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членную насыщенную, частично ненасыщенную или полностью ненасыщенную бициклическую кольцевую систему, имеющую 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы, или R и R’, два из R или два из R’, взяты вместе с атомом(ами), к которому они присоединены, образуя необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В некоторых воплощениях для соединений, непосредственно описанных выше, когда х представляет 1 и R3 представляет 6-ОМе, R1 представляет водород и у и q оба представляют 0, тогда R2 не является -CH2CH2OCH2CH2OH группой или монометансульфонатной солью.
В некоторых других воплощениях для соединений, непосредственно описанных выше:
а) один из R1 или R2 представляет водород, а другой из R1 и R2 выбран из:
i) Cy1, где Cy1 связан непосредственно с атомом азота или присоединен через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-, или
ii) необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-, или
b) R1 и R2 каждый независимо выбран из Cy1, где Cy1 связан непосредственно с атомом азота или присоединен через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR-, или -NRSO2-, или необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO-, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-.
В других воплощениях Су1 представляет:
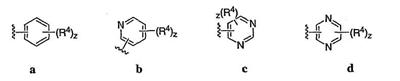
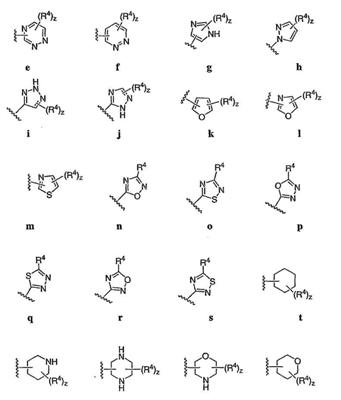
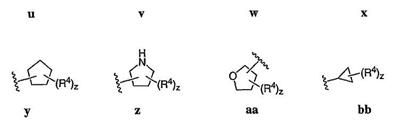
В других воплощениях R1 представляет водород или необязательно замещенную С1-С4алифатическую группу и R2 представляет -CHR-Cy1, где R представляет водород или С1-С4алкил, и Су1 представляет:
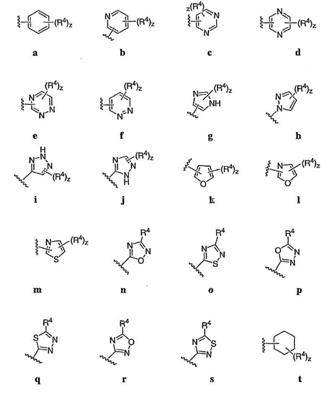
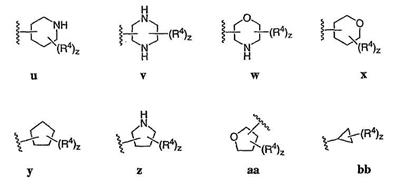
В других воплощениях R1 и R2 группы каждая неазависимо представляют необязательно замещенную С1-С4алифатическую группу и каждая независимо выбрана из необязательно замещенной метильной, этильной, циклопропильной, н-пропильной, пропенильной, циклобутильной, (СО)ОСН2СН3, (СН2)2ОСН3, СН2(СО)ОСН2СН3, СН2(СО)ОСН3, СН(СН3)СН2СН3 или н-бутильной группы.
В следующих воплощениях для соединений, описанных непосредственно выше, группы R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 3-12-членное гетероциклическое кольцо, имеющее 1-3 гетероатома, независимо выбранных из азота или кислорода, и образуют 3-12-членное гетероциклическое кольцо, выбранное из:
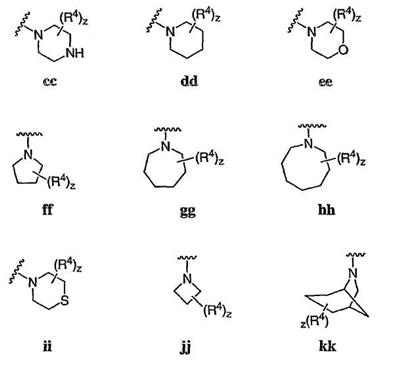
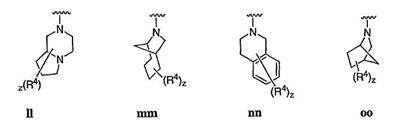
где кольцо, образованное R1 и R2, взятыми вместе, является необязательно замещенным у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4, и z равен 0-5.
Согласно другим воплощениям для соединений формулы I-А, R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), пирролидин-1-ил (ff), пиперидин-1-ил (dd), пиперазин-1-ил (cc) или морфолин-4-ил (ee). Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), пирролидин-1-ил (ff), пиперидин-1-ил (dd) или пиперазин-1-ил (сс). Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj). Согласно еще одним воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff). Согласно еще одним воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd). Согласно следующим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (cc).
Для соединений, описанных непосредственно выше, z представляет 0-5 и R4 группы, когда они присутствуют, каждая представляет независимо галоген, CN, NO2, -N(R’)2, CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CН2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, -COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Согласно дополнительным другим воплощениям z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила.
Согласно некоторым воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 или 2 и, по крайней мере, один из R4 представляет -NRSO2R’, -NRCOOR’ или -NRCOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRSO2R’. Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOR’. Согласно еще одним воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff), где z представляет 1 или 2 и R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’ или -CH2OR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 или 2 и по крайней мере один из R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’, -CH2OR’, -NRSO2R’, -NRCOOR’ или -OCON(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет F, CF3, CH3, -CH2CH3, -OR’ или -CH2OR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет -NRSO2R’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет -NRCOOR’. Согласно еще одним воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 или 2 и, по крайней мере, один из R4 представляет -SOR’, -CON(R’)2, -SO2N(R’)2, -COR’ или -COOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -SOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и
R4 представляет -СОOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -СON(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -SO2N(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -COR’.
Согласно другим воплощениям х представляет 0-4 и R3 группы, когда они присутствуют, каждая независимо представляют галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, -COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила. Согласно еще другим воплощениям х представляет 1 или 2 и каждый из R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси.
Согласно еще одним воплощениям х представляет 1 или 2 и каждая R3 группа представляет независимо галоген, CN, необязательно замещенный С1-С6алкил, OR’, N(R’)2, CON(R’)2 или NRCOR’. Согласно еще одним воплощениям х представляет 1 или 2, и каждая R3 группа представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно следующим воплощениям х представляет 1, R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно следующим воплощениям х представляет 1, и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим далее воплощениям х представляет 1, R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. Согласно следующим далее воплощениям х представляет 1, R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Для соединений, описанных непосредственно выше, согласно еще одним воплощениям у представляет 0-2, q представляет 0-2, R5 и R5а группы, когда они присутствуют, представляют каждая независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -NRCOR’, -CON(R’)2, S(O)2N(R’)2, -OCOR’, -COR’, -CO2R’, -OCON(R’)2, -NR’SO2R’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, -OPO(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Согласно другим воплощениям у представляет 0-2, q представляет 1 или 2 и каждый из R5а представляет независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси.
Согласно другим воплощениям у представляет 0, q представляет 1 и R5a представляет F. Согласно еще одним воплощениям у представляет 0, q представляет 1 и R5a представляет OR’. Согласно другим воплощениям у представляет 0, q представляет 1 и R5a представляет OН. Согласно еще одним воплощениям у представляет 0, q представляет 2 и один из R5a представляет OR’, а другой из R5a представляет F. Согласно еще одним воплощениям у представляет 0, q представляет 2 и один из R5a представляет OН, а другой из R5a представляет F.
Согласно другим воплощениям:
а) R1 и R2, взятые вместе, представляют необязательно замещенное кольцо, выбранное из азетидин-1-ила (jj), пирролидин-1-ила (ff), пиперидин-1-ила (dd) или пиперазин-1-ила (cc); один из R1 или R2 представляет водород, а другой из R1 и R2 выбран из Cy1, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-, или необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; или R1 и R2 каждый независимо выбран из необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; или Cy1, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группами -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-;
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила;
с) х представляет 0, 1 или 2 и каждый из R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси;
d) где у равен 0-2, и R5 группы, когда они присутствуют, представляют каждая независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси и
е) R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3, -CH2OH, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) или -COCH3.
Согласно другим воплощениям для соединений формулы I-А R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj). Согласно еще одним воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff). Согласно еще одним воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd). Согласно следующим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (cc).
Согласно некоторым воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 или 2 и, по крайней мере, один из R4 представляет -NRSO2R’, -NRCOOR’ или -NRCOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRSO2R’. Согласно другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный азетидин-1-ил (jj), где z представляет 1 и R4 представляет -NRCOR’. Согласно еще одним воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пирролидин-1-ил (ff), где z представляет 1 или 2 и R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’ или CH2OR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 или 2 и по крайней мере один из R4 представляет Cl, Br, F, CF3, CH3, -CH2CH3, -OR’, -CH2OR’, -NRSO2R’, -NRCOOR’ или -OCON(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет F, CF3, CH3, -CH2CH3, -OR’ или -CH2OR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет -NRSO2R’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперидин-1-ил (dd), где z представляет 1 и R4 представляет -NRCOOR’. Согласно еще одним воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 или 2 и, по крайней мере, один из R4 представляет -SOR’, -CON(R’)2, -SO2N(R’)2, -COR’ или -COOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и
R4 представляет -SOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -СОOR’. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -СON(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -SO2N(R’)2. Согласно некоторым другим воплощениям для соединений формулы I-A R1 и R2, взятые вместе, представляют необязательно замещенный пиперазин-1-ил (сс), где z представляет 1 и R4 представляет -COR’.
Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно другим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. Согласно другим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. Согласно другим воплощениям R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3. Согласно другим воплощениям у представляет 0, q представляет 1 и R5a представляет F. Согласно еще одним воплощениям у представляет 0, q представляет 1 и R5a представляет OR’. Согласно следующим воплощениям у представляет 0, q представляет 1 и R5a представляет OН. Согласно другим воплощениям у представляет 0, q представляет 2 и один из R5a представляет OR’, а другой из R5a представляет F. Согласно следующим воплощениям у представляет 0, q представляет 2 и один из R5a представляет OН, а другой из R5a представляет F.
В некоторых воплощениях для соединений, непосредственно описанных выше:
а) Су1 представляет:
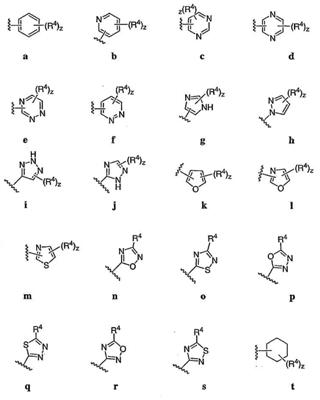
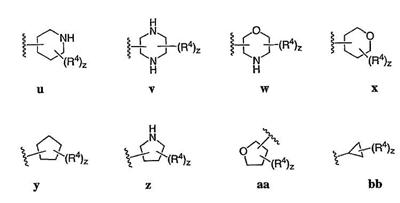
или R1 и R2 представляют каждый независимо необязательно замещенную С1-4алифатическую группу и каждый независимо выбран из необязательно замещенного метила, этила, циклопропила, н-пропила, пропенила, циклобутила, (СО)ОСН2СН3, (СН2)2ОСН3, СН2(СО)ОСН2СН3, СН2(СО)ОСН3, СН(СН3)СН2СН3 или н-бутила;
b) z представляет 0-5 и R4 группы представляют каждая независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, -CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила;
с) х представляет 0, 1 или 2, и каждое положение R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, -CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси;
d) у представляет 0-5, R5 группы, когда они присутствуют, каждая независимо представляет Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси и
е) R5a представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3, -CH2OH, -SO2NH2, -SO2NHC(CH3)2, OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил) или -COCH3.
Согласно другим воплощениям для соединений, непосредственно описанным выше, х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно другим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно еще одним воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. Согласно следующим воплощениям х представляет 1 и R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. Согласно другим воплощениям R5а представляет Cl, F, CF3, Me, Et, -OH, -OCH3, -OCH2CH3. Согласно другим воплощениям у представляет 0, q представляет 1, и R5a представляет F. Согласно другим воплощениям у представляет 0, q представляет 1 и R5a представляет OR’. Согласно другим воплощениям у представляет 0, q представляет 1 и R5a представляет OН. Согласно еще одним воплощениям у представляет 0, q представляет 2 и один из R5a представляет OR’, а другой из R5a представляет F. Согласно еще одним воплощениям у представляет 0, q представляет 2 и один из R5a представляет OН, а другой из R5a представляет F.
Для соединений, описанных в общем в данном разделе выше, отмечается, что соединения являются полезными в качестве ингибиторов ионных каналов, предпочтительно потенциалозависимых натриевых каналов и кальциевых каналов N-типа. В некоторых примерах воплощений соединения изобретения полезны в качестве ингибиторов NaV1.8. Согласно другим воплощениям соединения изобретения полезны в качестве ингибиторов NaV1.8 и CaV2.2. В других воплощениях соединения изобретения являются полезными в качестве ингибиторов CaV2.2. Согласно еще одним воплощениям соединения изобретения полезны в качестве двойных ингибиторов NaV1.8 и TTX-чувствительных ионных каналов, таких как NaV1.3 или NaV1.7.
V. Соединения формулы I-B-i:
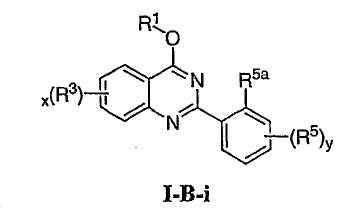
или их фармацевтически приемлемые соли,
где группа R1 выбрана из С1-6алифатической группы, Cy1, где Cy1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, где Cy1 связан непосредственно с атомом азота или связан через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; где R1 является необязательно замещенной у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4, где z представляет 0-5;
х представляет 0-4;
у представляет 0-4;
каждый из R3, R4 и R5 представляет независимо Q-RX, где Q представляет связь или представляет С1-С6 алкилиденовую цепь, где вплоть до двух несмежных метиленовых звеньев группы Q необязательно и независимо заменены группами -NR-, -S-, -O-, -CS- -CO2-, -OCO-, -CO-, -COCO-, -CONR-, -NRCO-, -NRCO2, -SO2NR-, -NRSO2-, -CONRNR-, -NRCONR-, -OCONR-, -NRNR-, -NRSO2NR-, -SO-, -SO2-, -PO-, -PO2-, -OP(O)(OR)-, или -POR-, и каждый из RX независимо выбран из -R’, =O, =NR’, галогена, -NO2, -CN, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2;
каждый из R5a представляет независимо необязательно замещенную С1-С6 алифатическую группу, галоген, -OR’, -SR’, -N(R’)2, -NR’COR’, -NR’CON(R’)2, -NR’CO2R’, -COR’, -CO2R’, -OCOR’, -CON(R’)2, -OCON(R’)2, -SOR’, -SO2R’, -SO2N(R’)2, -NR’SO2R’, -NR’SO2N(R’)2, -COCOR’, -COCH2COR’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2 или -OPO(R’)2 и
каждый из R представляет независимо водород или необязательно замещенную С1-6 алифатическую группу и каждый из R’ представляет независимо водород или необязательно замещенную С1-6 алифатическую группу, 3-8-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членную насыщенную, частично ненасыщенную или полностью ненасыщенную бициклическую кольцевую систему, имеющую 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы или R и R’, два из R или два из R’, взяты вместе с атомом(ами), к которому они присоединены, образуя необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Для соединений, непосредственно описанных выше, в некоторых воплощениях:
а) когда R5a представляет Me, Cl или ОMе и х представляет 0, тогда R1 не представляет Et или Ме;
b) когда R5a представляет Cl, х представляет 3 и три положения группы R3 представляют 6-Ме, 7-СООЕt и 8-Ме, тогда R1 не представляет -(СН2)2пиперидин-1-ил;
с) когда R5a представляет Me, х представляет 1 и R3 представляет NO2, тогда R1 не представляет Et;
d) когда R5a представляет OH, NHMe или N(NО)Mе и х представляет 0, тогда R1 не представляет Et или Ме или -СН2СН=СН2;
е) когда R5a представляет NH2 и х представляет 0, тогда R1 не представляет -COCH3;
f) когда R5a представляет Cl или Mе и у представляет 0 или 1 и когда у представляет 1, R5 представляет 4-Cl и х представляет 0, тогда R1 не представляет 4-CN-фенил, 4-Ме-фенил, 4-ОМе-фенил, 4-Cl-фенил, 4-NO2-фенил, -СH2СH2NHMe, Et, Ме, 4-COOMe-фенил, -СH2Ph, iPr, 2-Me-фенил, 4-фенил-фенил или -СH2СH=СH2.
В некоторых других воплощениях для соединений, непосредственно описанных выше:
а) R1 выбран из:
i) Cy1, где Cy1 связан непосредственно с атомом азота или присоединен через необязательно замещенную С1-4алифатическую группу, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, SO2NR- или -NRSO2-; или
ii) необязательно замещенной С1-4алифатической группы, где одно или более метиленовых звеньев в С1-4алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, SO2NR- или -NRSO2-.
В некоторых воплощениях для соединений, непосредственно описанных выше, Су1 представляет:
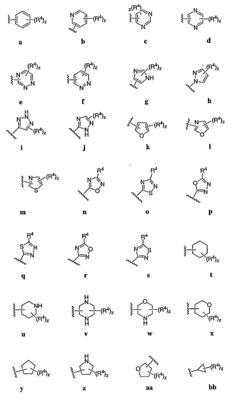
В других воплощениях R1 представляет -CHR-Cy1, где R представляет водород или
С1-С4алкил и Су1 представляет:
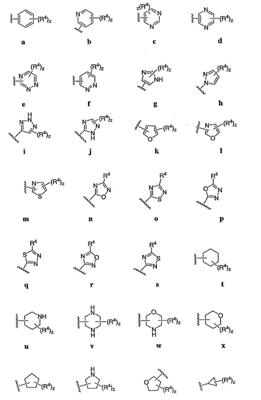

В еще одних других воплощениях R1 представляет необязательно замещенную
С1-С4алифатическую группу и каждая независимо выбрана из необязательно замещенной метильной, этильной, циклопропильной, н-пропильной, пропенильной, циклобутильной, (СО)ОСН2СН3, (СН2)2ОСН3, СН2(СО)ОСН2СН3, СН2(СО)ОСН3, СН(СН3)СН2СН3 или н-бутильной группы.
В других воплощениях z представляет 0-5 и R4 группы, когда они присутствуют, каждая независимо представляет галоген, CN, NO2, -N(R’)2, CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CН2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, -COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
В еще одних воплощениях z представляет 0-5 и R4 группы, каждая представляет независимо Cl, Br, F, CF3, CH3, -CH2CH3, CN, -COOH, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(CH2)3СН3, -SO2CH(CH3)2, -SO2N(CH3)2, -SO2CH2CH3, -C(O)OСH2CH(CH3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -C(O)C(CH3)3, -COO(CH2)2CH3, -С(O)NHCH(CH3)2, -C(O)CH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, бензилокси, CH2циклогексила, пиридила, -CH2пиридила или -CH2тиазолила.
В других воплощениях R3 группа представляет галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -COOR’, -NRCOR’, -CON(R’)2, -OCON(R’)2, -COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2 или необязательно замещенную группу, выбранную из С1-С6алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Еще в одних воплощениях R3 представляет Cl, Br, F, CF3, -OCF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -NHCOCH(CH3)2, -SO2NH2, CONH(циклопропил), -CONHCH3, -CОNHCH2CH3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, фенила, фенилокси, бензила или бензилокси.
В следующих воплощениях R3 группа представляет галоген, CN, необязательно замещенный С1-С6алкил, OR’, N(R’)2, CON(R’)2 или NRCOR’. В следующих воплощениях R3 представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. В следующих далее воплощениях, R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. В следующих далее воплощениях R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -OCH3, -NH2, -OCH2CH3 или -CN. В следующих далее воплощениях R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. В других воплощениях R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -CH3, -CH2CH3, -F, -CF3, -OCF3, -OCH3 или -OCH2CH3. В других воплощениях R3 находится в положении 6 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’. В других воплощениях R3 находится в положении 7 хиназолинового кольца и представляет -CON(R’)2 или NRCOR’.
Еще в одних воплощениях для соединений, описанных непосредственно выше, у представляет 0-5, q представляет 0-2 и R5 и R5а группы, когда они присутствуют, представляют каждая независимо галоген, CN, NO2, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -SR’, -CH2SR’, -NRCOR’, -CON(R’)2, S(O)2N(R’)2, -OCOR’, -COR’, -CO2R’, -OCON(R’)2, -NR’SO2R’, -OP(O)(OR’)2, -P(O)(OR’)2, -OP(O)2OR’, -P(O)2OR’, -PO(R’)2, -OPO(R’)2 или необязательно замещенную группу, выбранную из С1-С6 алифатической группы, арила, гетероарила, циклоалифатической группы, гетероциклоалифатической группы, арилС1-С6алкила, гетероарилС1-С6алкила, циклоалифатического С1-С6алкила или гетероциклоалифатического С1-С6алкила.
Еще в одних воплощениях у представляет 0-5, q представляет 1 или 2 и каждое положение R5а представляет независимо Cl, Br, F, CF3, Me, Et, CN, -COOH, -NH2, -N(CH3)2, -N(Et)2, -N(iPr)2, -O(CH2)2OCH3, -CONH2, -COOCH3, -OH, -OCH3, -OCH2CH3, -CH2OH, -NHCOCH3, -SO2NH2, -SO2NHC(CH3)2, -OCOC(CH3)3, -OCOCH2C(CH3)3, -O(CH2)2N(CH3)2, 4-CH3-пиперазин-1-ил, OCOCH(CH3)2, OCO(циклопентил), -COCH3, необязательно замещенный фенокси или необязательно замещенный бензилокси.
В следующих воплощениях у представляет 0, R5a представляет F. В других воплощениях у представляет 0, q представляет 1 и R5a представляет OR’. В еще одних других воплощениях у представляет 0, q представляет 1 и R5a представляет OН. Еще в одних воплощениях у представляет 1, R5a представляет OR’ и R5 представляет F, где OR’ является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца. Еще в одних воплощениях у представляет 0, q представляет 1, R5a представляет OН и R5 представляет F, где ОН является замещенным в положении 2 фенильного кольца и F является замещенным в положении 6 фенильного кольца.
Для соединений, описанных в общем в данном разделе выше, отмечается, что соединения являются полезными в качестве ингибиторов ионных каналов, предпочтительно потенциалозависимых натриевых каналов и кальциевых каналов N-типа. В некоторых примерах воплощений соединения изобретения полезны в качестве ингибиторов NaV1.8. Согласно другим воплощениям соединения изобретения полезны в качестве ингибиторов NaV1.8 и CaV2.2. В других еще воплощениях соединения изобретения являются полезными в качестве ингибиторов CaV2.2. Согласно еще одним воплощениям соединения изобретения полезны в качестве двойных ингибиторов NaV1.8 и TTX-чувствительных ионных каналов, таких как NaV1.3 или NaV1.7.
Типичные примеры соединений, как описано здесь и выше, представлены далее ниже в таблице 2 (см. в конце описания).
4. Общая методология синтеза:
Соединения данного изобретения могут быть получены в основном способами, известными в данной области для аналогичных соединений, как показано в общей схеме ниже и препаративных примерах, которые следуют.
Схема А ниже отображает общие условия синтеза соединений формулы IA, где Х представляет NR2. В основном, полезное промежуточное соединение iii может получаться путем конденсации бензоилхлорида с антраниламидом.
Схема А:
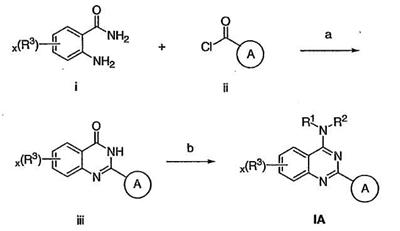
Реакция соединений i и ii (стадия а) с использованием К2СО3 и простого эфира при кипении с обратным холодильником и последующая обработка 5% водным NaOH при кипении с обратным холодильником дает промежуточное соединение iii. Реакция промежуточного соединения iii с POCl3 для получения 4-хлорпроизводного и последующее взаимодействие с i) N,N-диметиланилином в бензоле при кипении с обратным холодильником; ii) BBr3, CH2Cl2 при -78ºC и iii) R1R2NH в смеси ТГФ/CH2Cl2 при комнатной температуре дает требуемый продукт IA.
Схема В:
Схема В отображает альтернативный синтез для соединений формулы IA:
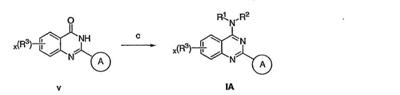
Реакция соединений i и ii (стадия а) с использованием триэтиламина и 1,4-диоксана в условиях окружающей среды дает промежуточное соединение iii. Реакционную смесь промежуточного соединения iii (стадия b) с 0,5М раствором аммиака в 1,4-диоксане, триэтиламином и реагентом ВОР перемешивают при температуре окружающей среды в течение 16 часов, что дает промежуточное соединение iv. Обработка промежуточного соединения iv 5% водным NaOH при кипении с обратным холодильником дает промежуточное соединение v. Обработка промежуточного соединения v POCl3 для получения 4-хлорпроизводного и последующее взаимодействие с i) N,N-диметиланилином в бензоле при кипении с обратным холодильником; ii) BBr3, CH2Cl2 при -78ºC и iii) R1R2NH в смеси ТГФ/CH2Cl2 при комнатной температуре дает требуемый продукт IA.
Схема С:
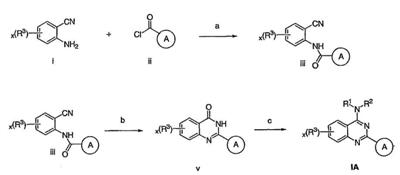
Реакция соединений i и ii (стадия а) с использованием пиридина дает промежуточное соединение iii. Обработка промежуточного соединения iii 5% водным NaOH при кипении с обратным холодильником дает промежуточное соединение iv. Реакция промежуточного соединения iv с POCl3 для получения 4-хлорпроизводного и последующее взаимодействие с i) N,N-диметиланилином в бензоле при кипении с обратным холодильником; ii) BBr3, CH2Cl2 при -78ºC и iii) R1R2NH в смеси ТГФ/CH2Cl2 при комнатной температуре дает требуемый продукт IA.
Схемы D и Е ниже отображают синтез разновидности полезных антранилимидов.
Схема D:
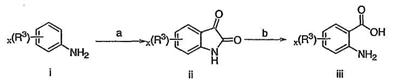
Реакция соединения i (стадия а) с хлоральгидратом в присутствии гидрохлорида гидроксиламина дает изатин ii. Обработка соединения ii основной перекисью водорода дает соединение iii (стадия b), как показано в схеме D.
Схема Е:
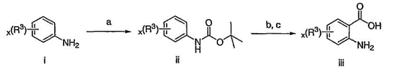
Реакция соединения i (стадия а) с Вос ангидридом дает соединение ii. Последующее замещение металлом водорода, соединенного с углеродным атомом соединения ii, с помощью бутиллития при низкой температуре и взаимодействие с СО2 дает N-защищенную антраниловую кислоту (стадия b). Удаление Вос с помощью TFA (трифторуксусная кислота) дает антраниловую кислоту iii, как показано в схеме Е.
Схема F:
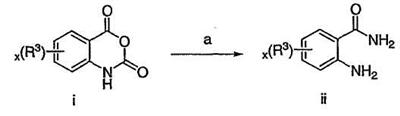
Реакция изатинового ангидрида i (стадия а) с водным гидроксидом аммония дает соединение ii, как показано в схеме F.
Схема G:
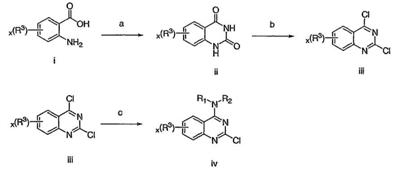
Стадия а.
i) Обработка соединения i АсОН и КОСN в водной среде при температуре от 0ºС до комнатной температуры в течение 24 часов и последующая реакция с ii) NaOH с последующим подкислением соляной кислотой дает промежуточное соединение ii (стадия b). Обработка соединения ii POCl3 и триэтиламином при кипении с обратным холодильником дает промежуточное соединение iii (стадия с). Обработка соединения iii мR1R2NH в смеси ТГФ/CH2Cl2 при температуре от 0ºС до комнатной температуры дает промежуточное соединение iv.
Схема H:
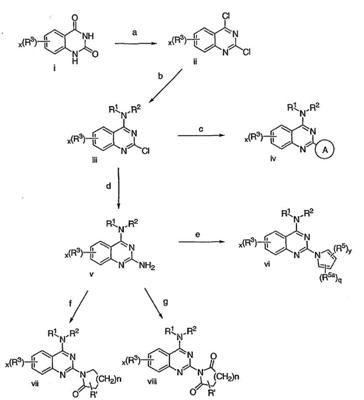
Реакция промежуточного соединения i (стадия а) с POCl3 дает 2,4-дихлорпроизводное ii. Реакция промежуточного соединения ii (стадия b) с R1-NH-R2 и Et3N в CH2Cl2 дает амин iii. Реакция промежуточного соединения iii (стадия с) с NH- содержащим гетероциклом, NaH и ТГФ приводит к соединению iv. Реакция промежуточного соединения iii (стадия d) с LiHMDS, Pd2(dba)3, 2-(дициклогексил)фосфинобифенилом и ТГФ дает диамин v. Реакция промежуточного соединения v (стадия е) с замещенным 2,5-диметокситетрагидрофураном в АсОН дает соединение vi. Реакция промежуточного соединения v (стадия f) с СlCO-CH2-(CH2)n-CH2-Cl, Et3N и п-диоксаном дает соединение vii. Реакция промежуточного соединения iii (стадия g) с циклическим ангидридом и п-диоксаном приводит к соединению viii.
Схема I:
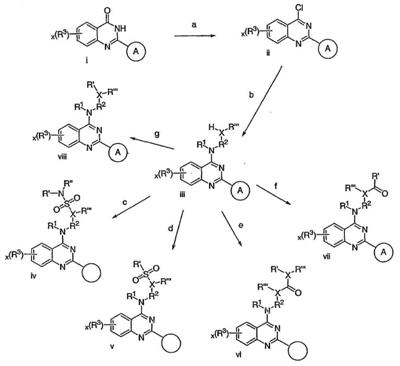
Реакция промежуточного соединения i (стадия а) с POCl3 и последующая обработка BBr3, CH2Cl2 при -78ºС дает 4-хлорпроизводное ii. Реакция промежуточного соединения ii (стадия b) с R’-NH-R2-X(R”’)H и Et3N в CH2Cl2 дает соединение iii. По реакции промежуточного соединения iii (стадия с) с R’N(R”)X-SO2Cl и Et3N в CH2Cl2 образуется соединение iv. Реакция промежуточного соединения iii (стадия d) с R’-SO2Cl и Et3N в CH2Cl2 дает соединение v. Реакция промежуточного соединения iii (стадия e) с R’-CO2Cl и Et3N в CH2Cl2 или с фосгеном, и R'(R”)XH образует соединение vi. Реакция промежуточного соединения iii (стадия f) с R’COCl и Et3N в CH2Cl2 дает соединение vii. Реакция промежуточного соединения iii (стадия g) с электрофилами в присутствии Et3N (органические галогенидные электрофилы) или NaBH(OAc)3 (альдегидные или кетоновые электрофилы) дает соединение viii.
Схема J:
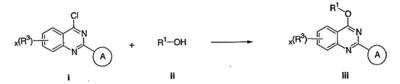
Взаимодействие соединений i и ii в дихлорметане в условиях микроволнового облучения при 150ºС дает продукт iii.
Схема K:
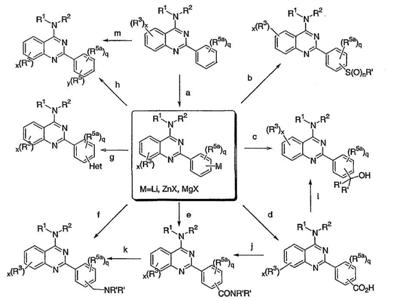
Условия: (а) для M=Li: втор-BuLi, TMEDA, ТГФ, -78ºС; для M=ZnX: i. втор-BuLi, TMEDA, ТГФ, -78ºС; ii. ZnCl2; для M=MgX: Mg, ТГФ, кипячение с обратным холодильником. (b) i. RSSR; ii. H2O2 (n=1) или KMnO4 (n=2). (c) R1R2C=O, ТГФ, от -78ºС до комнатной температуры. (d) CO2, ТГФ, от -78ºС до комнатной температуры. (e) для R1=H: R2NCO; другие: R1R2COCl, ТГФ. (f) i. H2C=O; ii. PBr3; iii. R1R2NH. (g) Het-OTf, Ni(acac)2, PPh3, MeMgBr, ТГФ, комнатная температура. (h) i. B(OMe)3; ii. ArX (X=галоген), Pd(PPh3)4, NaOEt, толуол, 80ºС. (i) i. SOCl2, CH2Cl2; ii. R1Sn(R)3, Pd(PPh3)4, толуол; iii. R1MgX, ТГФ. (j) i. SOCl2, CH2Cl2; ii. R1R2NH, ТГФ. (k) LiAlH4, ТГФ.
Схема L:
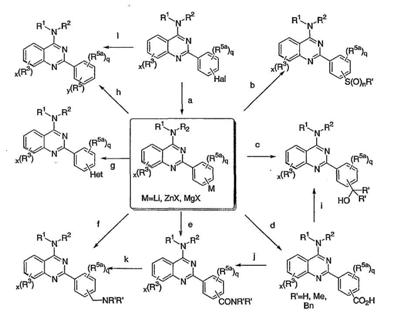
Условия: (а) для M=Li: втор-BuLi, TMEDA, ТГФ, -78ºС; для M=ZnX: i. втор-BuLi, TMEDA, ТГФ, -78ºС; ii. ZnCl2; для M=MgX: Mg, ТГФ, кипячение с обратным холодильником. (b) i. RSSR; ii. H2O2 (n=1) или KMnO4 (n=2). (c) R1R2C=O, ТГФ, от -78ºС до комнатной температуры. (d) CO2, ТГФ, от -78ºС до комнатной температуры. (e) Для R1=H: R2NCO; другие: R1R2COCl, ТГФ. (f) i. H2C=O; ii. PBr3; iii. R1R2NH. (g) Het-OTf, Ni(acac)2, PPh3, MeMgBr, ТГФ, комнатная температура. (h) Для R1=арил:
i. B(OMe)3; ii. ArX (X=галоген), Pd(PPh3)4, NaOEt, толуол, 80ºС. Для R1=алкил: R1I, ТГФ, от -78ºС до комнатной температуры. (i) i. SOCl2, CH2Cl2; ii. R1Sn(R)3, Pd(PPh3)4, толуол; iii. R2MgX, ТГФ. (j) i. SOCl2, CH2Cl2; ii. R1R2NH, ТГФ. (k) LiAlH4, ТГФ. (l) ArXB(OR)2, Pd(PPh3)4, NaOEt, толуол, 80ºС.
Схема M:
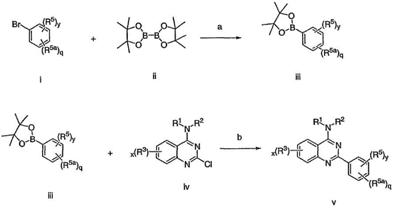
Обработка соединения i соединением ii при катализе палладием (стадия а)
Pd(dppf)Cl2, KOAc в ДМСО или ДМФ при 84ºС в течение 2-6 часов дает промежуточное соединение iii. Реакция промежуточного соединения iii с соединением iv с использованием условий катализируемого палладием перекрестного сочетания (стадия b) Pd(dppf)Cl2 или (Ph3P)4Pd, K2CO3, ДМФ:H2O (4:1) в условиях микроволнового облучения при 170ºС в течение 6 минут дает соединение v.
Схема N:
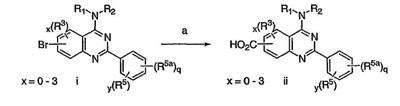
Обработка соединения i трет-бутиллитием при -78ºС с последующим добавлением твердого СО2 и нагреванием до комнатной температуры дают карбоксилатное соединение ii. Карбоксилат в соединении ii может сохраняться или использоваться для характерных реакций функциональной группы.
Схема O:
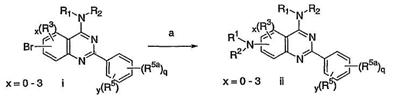
Катализируемое палладием перекрестное сочетание соединения i с соответствующим амином в толуоле (80ºС) дает соединение ii.
Схема P:
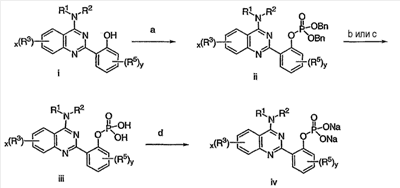
а) Дибензилфосфит, DMAP, DIEA, CCl4, CH3CN, от 0ºС до комнатной температуры; b) TMSBr, CH2Cl2, при комнатной температуре; c) H2,Pd/C, MeOH; d) NaOMe, MeOH, при комнатной температуре.
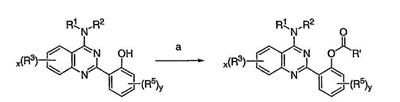
Условия: (а) R4COCl, пиридин, CH2Cl2, 0ºC, затем при комнатной температуре.
Схема Q:
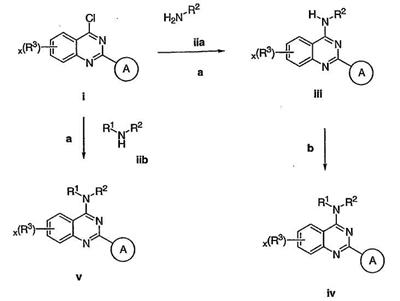
Реакция соединения i с соединением iiа или iib (стадия а), обработка триэтиламином в смеси ТГФ/CH2Cl2 при комнатной температуре дает соединения iii и v соответственно. Обработка соединения iii (стадия b) i) NaH в ТГФ при 0ºС, затем взаимодействие с электрофилами при от 0ºС до комнатной температуры дает соединение iv.
Несмотря на то, что некоторые воплощения примеров отображены и описаны здесь и выше, следует отметить, что соединения изобретения могут быть получены в соответствии с методами, описанными в целом выше с использованием соответствующих исходных веществ, и в соответствии с методами известными в данной области. Например, в некоторых воплощениях, соединениях, как описано здесь, в которых R1 представляет водород и R2 представляет пиразолил, процедуры примеров и соединения могут быть обнаружены в WO 02/22607, WO 02/22604, WO 02/066461, WO 02/22601, WO 02/22603, WO 02/22608, WO 02/22605 или WO 02/22602.
5. Применения, готовая форма и введение
Фармацевтически приемлемые композиции
Как описано выше, настоящее изобретение предоставляет соединения, которые являются ингибиторами потенциалозависимых натриевых ионных каналов и/или кальциевых каналов, и таким образом настоящие соединения являются полезными для лечения заболеваний, расстройств и состояний, включающих, не ограничиваясь перечисленными, острую, хроническую, нейропатическую или воспалительную боль, артрит, мигрени, тригеминальную невралгию, невралгию при опоясывающем лишае, общие невралгии, эпилепсию или эпилептические состояния, нейродегенеративные расстройства, психиатрические расстройства, такие как беспокойство и депрессия, миотонию, аритмию, расстройства движения, нейроэндокринные расстройства, атаксию, рассеянный склероз, синдром раздраженного кишечника и недержание. Соответственно, согласно еще одному аспекту настоящего изобретения предоставляются фармацевтически приемлемые композиции, причем данные композиции включают любое из соединений, описанных здесь, и необязательно включают фармацевтически приемлемый носитель, адъювант или средство переноса. Согласно некоторым воплощениям данные композиции необязательно далее включают один или более дополнительных терапевтических агентов.
Очевидно, понятно также, что некоторые из соединений настоящего изобретения могут существовать в свободной форме для лечения или, когда это уместно, в виде их фармацевтически приемлемых производных. Согласно настоящему изобретению фармацевтически приемлемые производные включают, но не ограничиваются ими, фармацевтически приемлемые соли, сложные эфиры, соли таких эфиров или любой другой аддукт или производное, которое после введения пациенту, нуждающемуся в нем, способно давать непосредственно или косвенно соединение, описанное здесь иначе, или метаболит или его остаток.
Использованный здесь термин  фармацевтически приемлемая соль фармацевтически приемлемая соль относится к тем солям, которые, по медицинскому признанию, являются подходящими для применения в контакте с тканями человека или более низших животных без чрезмерной токсичности, раздражения, аллергического ответа и аналогичных реакций и соизмеримы с разумным соотношением польза или выгода/риск. относится к тем солям, которые, по медицинскому признанию, являются подходящими для применения в контакте с тканями человека или более низших животных без чрезмерной токсичности, раздражения, аллергического ответа и аналогичных реакций и соизмеримы с разумным соотношением польза или выгода/риск.  Фармацевтически приемлемая соль Фармацевтически приемлемая соль обозначает любую нетоксичную соль или соль сложного эфира соединения данного изобретения, которая после введения реципиенту способна давать или непосредственно, или косвенно соединение данного изобретения или ингибиторно активный метаболит или его остаток. Используемый здесь термин обозначает любую нетоксичную соль или соль сложного эфира соединения данного изобретения, которая после введения реципиенту способна давать или непосредственно, или косвенно соединение данного изобретения или ингибиторно активный метаболит или его остаток. Используемый здесь термин  ингибиторно активный метаболит или его остаток ингибиторно активный метаболит или его остаток обозначает, что данный метаболит или его остаток также является ингибитором потенциалозависимых каналов ионов натрия или кальциевых каналов. обозначает, что данный метаболит или его остаток также является ингибитором потенциалозависимых каналов ионов натрия или кальциевых каналов.
Фармацевтически приемлемые соли хорошо известны в данной области техники. Например, S. M. Berge et al. описывают подробно фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, введенном сюда для сведения. Фармацевтически приемлемые соли соединений данного изобретения включают соли, являющиеся производными подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых, нетоксичных кислотно-аддитивных солей являются соли аминогруппы, полученные из неорганических кислот, таких как хлористоводородная кислота, бромистоводородная, фосфорная, серная и перхлорная кислоты, или с органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, лимонная, янтарная или малоновая кислоты, или с использованием других методов, используемых в данной области техники, таких как ионообмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валератная соль и аналогичные. Соли, производные соответствующих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммонийные и
N+(C1-4алкил)4 соли. Данное изобретение охватывает также кватернизацию любых содержащих основный азот групп соединений, описанных здесь. С помощью такой кватернизации могут быть получены водо- или маслорастворимые или диспергируемые продукты. Характерные представители солей щелочных и щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и аналогичные. Далее, фармацевтически приемлемые соли включают, когда это соответствует, нетоксичные аммониевые, четвертичные аммониевые и аминовые катионы, образуемые с использованием противоионов, такие как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
Как описано выше, фармацевтически приемлемые композиции настоящего изобретения дополнительно включают фармацевтически приемлемый носитель, адъювант или средство, которое, как оно используется здесь, включает любые и все растворители, разбавители или другие жидкие средства, вспомогательные дисперсионные или суспензионные агенты, поверхностно-активные агенты, изотонические агенты, загущающие или эмульгирующие агенты, консервирующие агенты, твердые связующие, смазочные агенты и аналогичные, подходящие для конкретной желаемой дозировочной формы. В Remington’s Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co, Easton, Pa., 1980) раскрываются разнообразные носители, используемые при приготовлении фармацевтически приемлемых композиций, и известные приемы для их получения. За исключением случаев, когда какая-либо среда носителя является несовместимой с соединениями изобретения, таких как получение нежелательного биологического эффекта или иное взаимодействие пагубным образом с любым другим компонентом(ами) фармацевтически приемлемой композиции, подразумевается, что его использование охватывается объемом данного изобретения. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются ими, ионообменники, окись алюминия или глинозем, стеарат алюминия, лецитин, сывороточные белки, такие как альбумин сыворотки человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота или сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, кислый динатрийфосфат, кислый фосфат калия, хлорид натрия, соли цинка, коллоидный кремнезем, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, полиэтилен-полиоксипропилен-блок-полимеры, шерстяной жир, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный и картофельный крахмал; целлюлозу и ее производные, такие как натриевая карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксиципиенты, такие как масло какао и суппозиторные воски; масла, такие как арахисовое масло, хлопковое масло; подсолнечное масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; свободную от пирогенов воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные совместимые смазочные агенты, такие как лаурилсульфат натрия и стеарат магния, а также подкрашивающие агенты, агенты, способствующие высвобождению, покрывные агенты, подсластители, вкусовые и ароматизирующие агенты, консервирующие агенты и антиоксиданты также могут присутствовать в композиции, согласно суждению фармацевта.
Использование соединений и фармацевтически приемлемых композиций
Согласно еще одному аспекту предоставляется способ лечения или уменьшения тяжести острой, хронической, нейропатической или воспалительной боли, артрита, мигреней, тригеминальной невралгии, герпетической невралгии, общих невралгий, эпилепсии или эпилептических состояний, нейродегенеративных расстройств, психиатрических расстройств, таких как беспокойство и депрессия, миотонии, аритмии, расстройств движения, нейроэндокринных расстройств, атаксии, рассеянного склероза, синдрома раздраженного кишечника, недержания, висцеральной боли, остеоартритной боли, постгерпетической невралгии, диабетической нейропатии, корешковой боли, ишиалгии, спинной боли, головной или шейной боли, тяжелой или резистентной боли, ноцицептивной боли, боли при разрыве тканей, постхирургической боли или раковой боли, включающий введение эффективного количества соединения или фармацевтически приемлемой композиции, включающей соединение, субъекту, нуждающемуся в этом. В некоторых воплощениях представляется способ лечения или уменьшения тяжести острой, хронической или воспалительной боли, включающий введение эффективного количества соединения или фармацевтически приемлемой композиции субъекту, нуждающемуся в этом. В некоторых других воплощениях представляется способ лечения или уменьшения тяжести корешковой боли, ишиалгии, спинной боли, головной боли или шейной боли, включающий введение эффективного количества соединения или фармацевтически приемлемой композиции субъекту, нуждающемуся в этом. В еще некоторых других воплощениях представляется способ лечения или уменьшения тяжести сильной или трудноизлечимой боли, острой боли, постхирургической боли, спинной боли или раковой боли, включающий введение эффективного количества соединения или фармацевтически приемлемой композиции субъекту, нуждающемуся в этом.
Согласно некоторым воплощениям настоящего изобретения  эффективным количеством эффективным количеством соединения или фармацевтически приемлемой композиции является количество, эффективное для лечения или уменьшения тяжести одной или более острой, хронической, нейропатической или воспалительной боли, артрита, мигреней, тригеминальной невралгии, герпетической невралгии, общих невралгий, эпилепсии или эпилептических состояний, нейродегенеративных расстройств, психиатрических расстройств, таких как беспокойство и депрессия, миотонии, аритмии, расстройств движения, нейроэндокринных расстройств, атаксии, рассеянного склероза, синдрома раздраженного кишечника, недержания, висцеральной боли, остеоартритной боли, постгерпетической невралгии, диабетической нейропатии, корешковой боли, ишиалгии, спинной боли, головной или шейной боли, тяжелой или резистентной боли, ноцицептивной боли, боли при разрыве тканей, постхирургической боли или раковой боли. соединения или фармацевтически приемлемой композиции является количество, эффективное для лечения или уменьшения тяжести одной или более острой, хронической, нейропатической или воспалительной боли, артрита, мигреней, тригеминальной невралгии, герпетической невралгии, общих невралгий, эпилепсии или эпилептических состояний, нейродегенеративных расстройств, психиатрических расстройств, таких как беспокойство и депрессия, миотонии, аритмии, расстройств движения, нейроэндокринных расстройств, атаксии, рассеянного склероза, синдрома раздраженного кишечника, недержания, висцеральной боли, остеоартритной боли, постгерпетической невралгии, диабетической нейропатии, корешковой боли, ишиалгии, спинной боли, головной или шейной боли, тяжелой или резистентной боли, ноцицептивной боли, боли при разрыве тканей, постхирургической боли или раковой боли.
Соединения и композиции согласно способу настоящего изобретения могут вводиться с использованием любого количества и любого способа введения эффективного для лечения или уменьшения тяжести одной или более острой, хронической, нейропатической или воспалительной боли, артрита, мигреней, тригеминальной невралгии, герпетической невралгии, общих невралгий, эпилепсии или эпилептических состояний, нейродегенеративных расстройств, психиатрических расстройств, таких как беспокойство и депрессия, миотонии, аритмии, расстройств движения, нейроэндокринных расстройств, атаксии, рассеянного склероза, синдрома раздраженного кишечника, недержания, висцеральной боли, остеоартритной боли, постгерпетической невралгии, диабетической нейропатии, корешковой боли, ишиалгии, спинной боли, головной или шейной боли, тяжелой или резистентной боли, ноцицептивной боли, боли при разрыве тканей, постхирургической боли или раковой боли. Точное требуемое количество будет меняться от субъекта к субъекту в зависимости от вида, возраста и общего состояния субъекта, тяжести заболевания, конкретного агента, способа его введения и аналогичных факторов. Соединения изобретения предпочтительно формируются в виде форм дозированных единиц или единичных доз для легкости введения и единообразия дозы. Выражение  форма дозированных единиц или единичная доза форма дозированных единиц или единичная доза , используемое здесь, относится к физически дискретной единице агента, соответствующей для подвергаемого лечению пациента. Должно быть понятно, однако, что общая суточная доза использования соединений и композиций настоящего изобретения устанавливается лечащим врачом с учетом известных суждений медиков. Конкретный эффективный уровень доз для любого конкретного пациента или организма зависит от широкого разнообразия факторов, включающих подвергаемое лечению расстройство, тяжесть расстройства, конкретно применяемое активное соединение; применяемой конкретной композиции; возраста, веса тела, общего состояния здоровья, пола и питания пациента; времени введения, способа введения и степени экскреции конкретно применяемого соединения; длительности лечения; лекарств, применяемых в сочетании или одновременно с конкретно применяемым соединением, и аналогичных факторов, хорошо известных в области медицины. Термин , используемое здесь, относится к физически дискретной единице агента, соответствующей для подвергаемого лечению пациента. Должно быть понятно, однако, что общая суточная доза использования соединений и композиций настоящего изобретения устанавливается лечащим врачом с учетом известных суждений медиков. Конкретный эффективный уровень доз для любого конкретного пациента или организма зависит от широкого разнообразия факторов, включающих подвергаемое лечению расстройство, тяжесть расстройства, конкретно применяемое активное соединение; применяемой конкретной композиции; возраста, веса тела, общего состояния здоровья, пола и питания пациента; времени введения, способа введения и степени экскреции конкретно применяемого соединения; длительности лечения; лекарств, применяемых в сочетании или одновременно с конкретно применяемым соединением, и аналогичных факторов, хорошо известных в области медицины. Термин  пациент пациент , используемый здесь, означает животное, предпочтительно млекопитающее, и наиболее предпочтительно человек. , используемый здесь, означает животное, предпочтительно млекопитающее, и наиболее предпочтительно человек.
Фармацевтически приемлемые композиции данного изобретения могут вводиться людям и другим животным орально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (например, с помощью порошков, мазей или капель), буккально, в виде оральных или назальных спреев или аналогичных в зависимости от тяжести подвергаемой лечению инфекции. Согласно некоторым воплощениям соединения изобретения могут вводиться орально или парентерально на дозировочном уровне примерно 0,01 мг/кг – 50 мг/кг и предпочтительно примерно от 1 мг/кг до 25 мг/кг веса тела субъекта в день, один и более раз в день, для получения желаемого терапевтического эффекта.
Жидкие дозировочные формы для орального введения включают, но не ограничиваются ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области техники, например воду или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, земляного ореха, кукурузное, масло проростков, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сорбитановые сложные эфиры жирных кислот, и их смеси. Кроме инертных разбавителей оральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, вкусовые и ароматизирующие агенты.
Инъецируемые препараты, например стерильные инъецируемые водные или маслянистые суспензии, могут приготавливатьтся в соответствии с известными приемами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильным инъецируемым препаратом может быть также стерильный инъецируемый раствор, суспензия или эмульсия в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Среди приемлемых средств переноса и растворителей, которые можно применять, находятся вода, раствор Рингера, U.S.Р. и изотонический раствор хлорида натрия. Кроме того, в качестве растворяющей или суспендирующей среды обычно применяют стерильные, фиксированные масла. Для данной цели можно применять любое пресное фиксированное масло, включая синтетические моно- или диглицериды. Кроме того, при приготовлении инъецируемых композиций используют жирные кислоты, такие как олеиновая кислота.
Инъецируемые готовые формы могут быть стерилизованы, например, фильтрованием через бактериостатический фильтр или включением стерилизующих агентов в форме стерильных твердых композиций, которые могут перед использованием растворяться или диспергироваться в стерильной воде или другой стерильной инъецируемой среде.
Для того чтобы продлить действие соединения настоящего изобретения, часто желательно замедлить абсорбцию соединения от подкожной или внутримышечной инъекции. Это может достигаться использованием жидкой суспензии кристаллического или аморфного материала с плохой водорастворимостью. Скорость абсорбции соединения зависит тогда от его степени растворимости, что в свою очередь может зависеть от размера кристаллов и кристаллической формы. Альтернативно задержанная абсорбция формы вводимого парентерально соединения достигается растворением или суспендированием соединения в масляном носителе. Инъецируемые формы производятся формированием микроинкапсулированных матриц соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения и полимера и природы применяемого конкретно полимера может регулироваться скорость высвобождения соединения. Примеры других биоразлагаемых полимеров включают сложные поли(ортоэфиры) и поли(ангидриды). Инъецируемые готовые формы для хранения приготавливаются также путем захвата соединения липосомами или микроэмульсиями, которые совместимы с тканями тела.
Композициями для ректального или вагинального введения являются предпочтительно суппозитории, которые могут получаться с помощью смешения соединений данного изобретения с подходящими нераздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или суппозиторный воск, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела и, следовательно, расплавляются в прямой кишке или вагинальной полости и высвобождают активное соединение.
Твердые дозированные формы для орального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное соединение смешано с, по крайней мере, одним инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат и/или а) наполнителями или экстендерами, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и камедь акации, c) увлажнителями, такими как глицерин, d) дезинтегрирующими агентами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) агентами, задерживающими растворение, такими как парафин, f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, g) смачивающими агентами, такими как, например, цетиловый спирт и моностеарат глицерина, h) абсорбентами, такими как каолин и бентонитная глина, и i) смазочными агентами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль дозированная форма может также включать буферирующие агенты.
Твердые композиции аналогичного типа могут также применяться в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также полиэтиленгликолей с высокой молекулярной массой и аналогичными. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул могут приготавливаться с покрытиями и скорлупой, такими как энтерические покрытия и другие покрытия, хорошо известные в области техники изготовления фармацевтических готовых форм. Они могут необязательно содержать замутняющие агенты и могут также быть в композиции, из которой они высвобождают активный ингредиент(ы) только или предпочтительно в определенной части кишечного тракта, необязательно замедленным образом. Примеры внедряющих композиций, которые могут использоваться, включают полимерные вещества и воски. Твердые композиции похожего типа могут также применяться в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также полиэтиленгликолей с высоким молекулярным весом и аналогичных.
Активные соединения могут быть также в микроинкапсулированной форме с одним или более эксципиентами, отмеченными выше. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул могут приготавливаться с покрытиями и скорлупой, такими как энтерические покрытия, покрытия, контролирующие высвобождение, и другие покрытия, хорошо известные в области техники изготовления фармацевтических готовых форм. В таких твердых дозированных формах активное соединение может быть смешано с, по крайней мере, одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы могут также включать, в качестве обычной практики, дополнительные вещества, иные, чем инертные разбавители, например таблетирующие смазочные агенты и другие таблетирующие вспомогательныне средства, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль дозированные формы могут также включать буферирующие агенты. Они могут необязательно содержать замутняющие агенты и могут также быть в композиции, из которой они высвобождают активный ингредиент(ы) только или предпочтительно в определенной части кишечного тракта, необязательно замедленным образом. Примеры внедряющих композиций, которые могут использоваться, включают полимерные вещества и воски.
Дозированные формы для местного или трансдермального введения соединения данного изобретения включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингаляционные средства или повязки. Активное соединение может смешиваться в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервирующими агентами или буферами, если может потребоваться. Офтальмические готовые формы, ушные капли и глазные капли также предусматриваются в объеме данного изобретения. В дополнение к изложенному настоящее изобретение охватывает использование трансдермальных повязок, которые имеют дополнительное преимущество обеспечения регулируемой доставки соединения в тело. Такие дозированные формы приготавливаются растворением или диспергированием соединения в соответствующей среде. Могут также использоваться усилители абсорбции для увеличения растекания соединения по коже. Степень может регулироваться или предоставлением регулирующей скорость мембраны, или диспергированием соединения в полимерной матрице или геле.
Как описано в общем выше, соединения изобретения являются полезными в качестве ингибиторов потенциалозависимых натриевых ионных каналов или кальциевых каналов, предпочтительно кальциевых каналов N-типа. Согласно одному воплощению соединения и композиции изобретения являются ингибиторами одного или более NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8, NaV1.9 или СаV2.2 и, таким образом, без относительно к какой-либо конретной теории, соединения и композиции являются особенно полезными для лечения или уменьшения тяжести заболевания, состояния или расстройства, когда в заболевание, состояние или расстройство вовлечена активизация или гиперактивность одного или более из NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8, NaV1.9 или СaV2.2. Когда в конкретное заболевание, состояние или расстройство вовлечена активизация или гиперактивность NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8, NaV1.9 или СaV2.2, данное заболевание, состояние или расстройство может также называться  NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8 или NaV1.9-опосредованное заболевание, состояние или расстройство NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8 или NaV1.9-опосредованное заболевание, состояние или расстройство или или  СаV2.2-опосредованное заболевание, состояние или расстройство СаV2.2-опосредованное заболевание, состояние или расстройство . Соответственно, согласно другому аспекту настоящее изобретение предоставляет способ лечения или уменьшения тяжести заболевания, состояния или расстройства, когда в данное состояние заболевания вовлечена активизация или гиперактивность одного или более из NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8, NaV1.9 или СaV2.2. . Соответственно, согласно другому аспекту настоящее изобретение предоставляет способ лечения или уменьшения тяжести заболевания, состояния или расстройства, когда в данное состояние заболевания вовлечена активизация или гиперактивность одного или более из NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8, NaV1.9 или СaV2.2.
Активность соединения, используемого в данном изобретении в качестве ингибитора NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8, NaV1.9 или СaV2.2, может быть оценена в соответствии с методами, описанными в общем здесь в примерах, или в соответствии с методами, доступными обычному специалисту в данной области.
Согласно некоторым примерам воплощений соединения изобретения являются полезными в качестве ингибиторов NaV1.8. Согласно другим воплощениям соединения изобретения являются полезными в качестве ингибиторов NaV1.8 и СaV2.2. Согласно другим воплощениям соединения изобретения являются полезными в качестве ингибиторов СaV2.2. Согласно еще одним воплощениям соединения изобретения являются полезными в качестве двойных ингибиторов NaV1.8 и ТТХ-чувствительных ионных каналов, таких как NaV1.3 и NaV1.7.
Очевидно понятно также, что соединения и фармацевтически приемлемые композициии настоящего изобретения могут применяться в комбинационной терапии, то есть соединения и фармацевтически приемлемые композиции могут вводиться параллельно, до или после одного или более других желаемых терапевтических средств или медицинских процедур. Конкретное сочетание терапий (терапевтических средств или процедур) в режиме сочетания следует принимать во внимание с учетом совместимости желаемых терапевтических средств и/или процедур и достигаемого желательного терапевтического эффекта. Очевидно понятно также, что применяемые методы терапии могут достигать желаемого эффекта для одного и того же расстройства (например, соединение изобретения может вводиться параллельно с еще одним агентом для лечения того же расстройства) или они могут достигать различных эффектов (например, контроля любых пагубных действий). Как они используются здесь, дополнительные терапевтические агенты, которые обычно вводятся для лечения или профилактики какого-либо конкретного заболевания или состояния, известны как  подходящие или соответствующие для подвергаемого лечению заболевания или состояния подходящие или соответствующие для подвергаемого лечению заболевания или состояния . Например, примеры дополнительных терапевтических агентов включают, но не ограничиваются ими, неопиоидные анальгетики (индолы, такие как этодолак, индометацин, сулиндак, толметин; нафтилалканоны, такие как набуметон; оксикамы, такие как пироксикам; пара-аминофенольные производные, такие как ацетаминофен; пропионовые кислоты, такие как фенопрофен, флурбипрофен, ибупрофен, кетопрофен, напроксен, напроксен натрий, оксапрозин; салицилаты, такие как аспирин, холин-магний-трисалицилат, дифлунизал; фенаматы, такие как меклофенамовая кислота, мефенамовая кислота; пиразолы (такие как фенилбутазон) или опиоидные (наркотические) агонисты (такие как кодеин, фентанил, гидроморфон, леворфанол, миперидин, метадон, морфин, оксикодон, оксиморфон, пропоксифен, бупренорфин, буторфанол, дезоцин, налбуфин и пентазоцин). Дополнительно в сочетании с введением одного или более соединений изобретения могут использоваться нелекарственные анальгетические приемы. Например, могут также использоваться анестезиологические (интраспинальное вливание, невральная блокада), нейрохирургические (невролиз CNS путей), нейростимуляторные (чрескожная электростимуляция нерва, стимуляция дорзального столба), физиотерапевтические (физиотерапия, ортопедические аппараты, диатермия) или психологические методы (когнитивные методы – гипноз, биологическая обратная связь или поведенческие методы). Дополнительные соответствующие терапевтические агенты или подходы описаны в общем в The Merck Manual, Seventeenth Edition, Ed. Mark H. Beers and Robert Berkow, Merck Research Laboratories, 1999, и Food and Drug Administration website, www.fda.gov, содержание которых целиком включено в описание для сведения. . Например, примеры дополнительных терапевтических агентов включают, но не ограничиваются ими, неопиоидные анальгетики (индолы, такие как этодолак, индометацин, сулиндак, толметин; нафтилалканоны, такие как набуметон; оксикамы, такие как пироксикам; пара-аминофенольные производные, такие как ацетаминофен; пропионовые кислоты, такие как фенопрофен, флурбипрофен, ибупрофен, кетопрофен, напроксен, напроксен натрий, оксапрозин; салицилаты, такие как аспирин, холин-магний-трисалицилат, дифлунизал; фенаматы, такие как меклофенамовая кислота, мефенамовая кислота; пиразолы (такие как фенилбутазон) или опиоидные (наркотические) агонисты (такие как кодеин, фентанил, гидроморфон, леворфанол, миперидин, метадон, морфин, оксикодон, оксиморфон, пропоксифен, бупренорфин, буторфанол, дезоцин, налбуфин и пентазоцин). Дополнительно в сочетании с введением одного или более соединений изобретения могут использоваться нелекарственные анальгетические приемы. Например, могут также использоваться анестезиологические (интраспинальное вливание, невральная блокада), нейрохирургические (невролиз CNS путей), нейростимуляторные (чрескожная электростимуляция нерва, стимуляция дорзального столба), физиотерапевтические (физиотерапия, ортопедические аппараты, диатермия) или психологические методы (когнитивные методы – гипноз, биологическая обратная связь или поведенческие методы). Дополнительные соответствующие терапевтические агенты или подходы описаны в общем в The Merck Manual, Seventeenth Edition, Ed. Mark H. Beers and Robert Berkow, Merck Research Laboratories, 1999, и Food and Drug Administration website, www.fda.gov, содержание которых целиком включено в описание для сведения.
Количество дополнительного терапевтического агента, присутствующего в композициях данного изобретения, составляет не более, чем количество, которое обычно вводилось бы в композицию, включающую данный терапевтический агент в качестве единственного активного агента. Предпочтительно количество дополнительного терапевтического агента в описанных сейчас композициях будет составлять примерно от 50% до 100% количества, обычно присутствующего в композиции, включающей данный агент в качестве единственного терапевтически активного агента.
Соединения данного изобретения или их фармацевтически приемлемые композиции могут также быть включены в композиции для покрытия имплантируемых медицинских средств, таких как протезы, искусственные клапана, сосудистые трансплантаты, стенты и катетеры. Соответственно, согласно еще одному аспекту настоящее изобретение включает композицию для покрытия имплантируемых средств, включающую соединение настоящего изобретения, описанную в общем выше и в классах и подклассах в данном описании, и носитель, подходящий для покрытия указанного имплантируемого средства. Согласно еще одному аспекту настоящее изобретение включает имплантируемое средство, покрытое композицией, включающей соединение настоящего изобретения, описанное в общем выше и в классах и подклассах в данном описании, и носитель, подходящий для покрытия указанного имплантируемого средства. Подходящие покрытия и общее изготовление имплантируемых средств с покрытием раскрываются в патентах США 6099562; 5886026 и 5304121. Покрытиями в типичном случае являются биосовместимые полимерные материалы, такие гидрогельные полимеры, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, этиленвинилацетат и их смеси. Покрытия могут быть необязательно дополнительно покрыты подходящим верхним покрытием из фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их сочетаний для придания характеристик регулируемого высвобождения в композиции.
Еще один аспект изобретения относится к ингибированию активности NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8, NaV1.9 или СaV2.2 в биологическом образце или у пациента, данный метод включает введение пациенту или введение в контакт указанного биологического образца с соединением формулы I или композицией, включающей указанное соединение. Термин  биологический образец биологический образец , используемый здесь, включает, без ограничения, культуры клеток или их экстракты; материал биопсии, полученный от млекопитающего, или его экстракты и кровь, слюну, мочу, фекалии, сперму, слезы или другие жидкости тела или их экстракты. , используемый здесь, включает, без ограничения, культуры клеток или их экстракты; материал биопсии, полученный от млекопитающего, или его экстракты и кровь, слюну, мочу, фекалии, сперму, слезы или другие жидкости тела или их экстракты.
Ингибирование активности одного или более NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8, NaV1.9 или СaV2.2 в биологическом образце полезно для широкого ряда целей, которые известны специалистам в данной области. Примеры таких целей включают, но не ограничиваются ими, исследование натриевых ионных каналов при биологических и патологических явлениях и сравнительную оценку новых ингибиторов натриевых ионных каналов.
Для того чтобы изобретение, описанное здесь, могло быть более полностью понятно, приводятся следующие примеры. Следует понимать, что данные примеры представлены только для иллюстративных целей и не должны никоим образом рассматриваться как ограничивающие данное изобретение.
ПРИМЕРЫ
СИНТЕЗ СОЕДИНЕНИЙ ПРИМЕРОВ ИЗОБРЕТЕНИЯ
Пример 1:
В 2-литровой трехгорлой круглодонной колбе, снабженной верхней мешалкой и обратным холодильником, в 1 л безводного эфира суспендировали антраниламид 1 (20,0 г, 147 ммоль) и карбонат калия (28,4 г, 206 ммоль) и нагревали до кипения с обратным холодильником. К нагреваемой с обратным холодильником смеси медленно добавили хлористый о-анизоил (32,5 г, 191 ммоль). Через 3 часа кипения с обратным холодильником реакционной смеси давали возможность остыть до комнатной температуры, эфир удаляли при пониженном давлении, полученный остаток фильтровали и промывали водой. Полученное твердое вещество затем суспендировали в 600 мл 5% водного раствора NaOH и кипятили в течение 1 часа. Реакционной смеси давали возможность остыть до комнатной температуры, затем ее нейтрализовали уксусной кислотой, после чего хиназолинон 2 осаждался. Продукт 2 отфильтровали, промывали водой и сушили в течение ночи в вакууме, получая 27 г (73%) чистого соединения 2.
ЖХ/МС (10-99%) M/Z 253,0 время удерживания 3,22 мин; 1H-ЯМР (ДМСО)  3,86 (c, 3H), 7,09 (т, 1H), 7,18 (д, 1H), 7,53 (м, 2H), 7,70 (м, 2H), 7,80 (м, 1H), 8,14 (д, 1H), 12,11 (c, 1H); 13C-ЯМР (ДМСО) 3,86 (c, 3H), 7,09 (т, 1H), 7,18 (д, 1H), 7,53 (м, 2H), 7,70 (м, 2H), 7,80 (м, 1H), 8,14 (д, 1H), 12,11 (c, 1H); 13C-ЯМР (ДМСО)  55,75, 111,86, 120,89, 120,97, 122,74, 125,75, 126,45, 127,26, 130,41, 132,13, 134,32, 148,97, 152,48, 157,12, 161,35. 55,75, 111,86, 120,89, 120,97, 122,74, 125,75, 126,45, 127,26, 130,41, 132,13, 134,32, 148,97, 152,48, 157,12, 161,35.
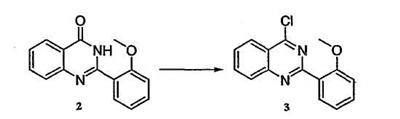
Хиназолинон 2 (20,0 г, 79,3 ммоль) суспендировали в 500 мл безводного бензола в 1-литровой круглодонной колбе, снабженной обратным холодильником. Добавляли N,N-диметиланилин (14,4 г, 119 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 30 минут в среде азота. После охлаждения до комнатной температуры добавляли оксохлорид фосфора (12,2 г, 79,3 ммоль) и затем реакционную смесь нагревали с обратным холодильником в течение дополнительных 3 часов в среде азота. Смесь охлаждали до комнатной температуры, выливали на лед и нейтрализовали насыщенным водным раствором бикарбоната натрия. Раствор затем экстрагировали 4 раза толуолом и объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали в вакууме до красновато-коричневого твердого вещества. Полученный 4-хлорхиназолин 3 очищали флэш-хроматографией (40% гексаны, 60% дихлорметан), давая 20 г (93%) 3 в виде желтого твердого вещества.
ЖХ/МС (40-99%) M/Z 271,4 время удерживания 2,49 мин;
1Н-ЯМР (CDCl3)  3,89 (c, 3H), 7,06 (д, 1H), 7,09 (д, 1H), 7,45 (м, 1H), 7,71 (м, 1H), 7,80 (м, 1H), 7,95 (м, 1H), 8,17 (д, 1H), 8,30 (д, 1H); 13C-ЯМР (CDCl3) 3,89 (c, 3H), 7,06 (д, 1H), 7,09 (д, 1H), 7,45 (м, 1H), 7,71 (м, 1H), 7,80 (м, 1H), 7,95 (м, 1H), 8,17 (д, 1H), 8,30 (д, 1H); 13C-ЯМР (CDCl3)  56,3 (д), 112,15 (д), 121,0 (c), 122,29 (c), 125,97 (c), 126,76 (c), 127,25 (д), 128,71 (д), 132,10 (м), 135,26 (c), 151,16 (c), 158,19 (c), 161,02 (c), 162,58 (c). 56,3 (д), 112,15 (д), 121,0 (c), 122,29 (c), 125,97 (c), 126,76 (c), 127,25 (д), 128,71 (д), 132,10 (м), 135,26 (c), 151,16 (c), 158,19 (c), 161,02 (c), 162,58 (c).
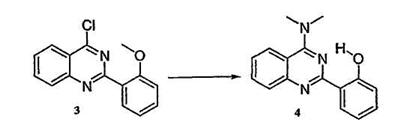
В 500-мл двухгорлую круглодонную колбу, снабженную капельной воронкой, в атмосфере азота загружали 4-хлорхиназолин 3 (5,00 г, 18,5 ммоль) и 80 мл безводного дихлорметана. Смесь охлаждали до -78ºС и через капельную воронку, по каплям, добавляли 92 мл 1М трехбромистого бора в дихлорметане. Охлаждающую баню удаляли и реакционную смесь оставляли для перемешивания в течение 3 часов при комнатной температуре. Затем смесь охлаждали до 0ºС и медленно нейтрализовали насыщенным водным раствором бикарбоната натрия, 3 раза экстрагировали дихлорметаном, объединенные органические растворы сушили над сульфатом магния, фильтровали и концентрировали в вакууме, получая желтое твердое вещество. Остаток сразу же растворяли в 30 мл смеси 2:1 безводный ТГФ/CH2Cl2, затем обрабатывали 2М раствором диметиламина в ТГФ (46,3 мл, 92,5 ммоль). Через 30 минут растворитель удаляли при пониженном давлении, остаток распределяли между дихлорметаном и водой, водный раствор экстрагировали 4 раза дихлорметаном. Объединенные органические растворы сушили над сульфатом магния, фильтровали и концентрировали в вакууме до оранжевого твердого вещества. Перекристаллизация из этанола давала 2,61 г (53%) желтого кристаллического вещества 4.
ЖХ/МС (10-99%) M/Z 266,0 время удерживания 2,59 мин; 1Н-ЯМР (ДМСО)  3,32 (c,), 3,45 (c, 6H), 6,93 (м, 2H), 7,35 (м, 1H), 7,46 (м, 1H), 7,78 (м, 2H), 8,21 (д, 1H), 8,43 (д, 1H); 13C-ЯМР (ДМСО) 3,32 (c,), 3,45 (c, 6H), 6,93 (м, 2H), 7,35 (м, 1H), 7,46 (м, 1H), 7,78 (м, 2H), 8,21 (д, 1H), 8,43 (д, 1H); 13C-ЯМР (ДМСО)  41,62, 113,77, 117,18, 118,25, 118,97, 124,75, 126,15, 126,51, 128,96, 132,36, 133,11, 149,09, 159,22, 160,74, 161,69. 41,62, 113,77, 117,18, 118,25, 118,97, 124,75, 126,15, 126,51, 128,96, 132,36, 133,11, 149,09, 159,22, 160,74, 161,69.
Соль HCl:
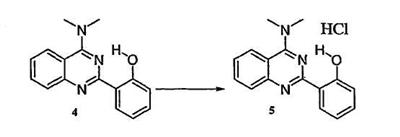
В 250-мл круглодонную колбу загружали хиназолин 4 (1,0 г, 3,8 ммоль), 100 мл безводного эфира, 11 мл безводного метанола, затем колбу закрывали мембраной и помещали в ультразвуковую установку с температурой бани 43ºС. После завершения растворения соединения 4 добавляли эфирный раствор HCl (1,9 мл, 3,8 ммоль), вызывая немедленное осаждение соединения 5. Растворитель удаляли в вакууме, соль дважды ресуспендировали в безводном эфире, концентрировали и сушили в вакууме. После сушки в вакууме в течение ночи получали 1,13 г (98%) соединения 5 в виде бледно-желтого твердого вещества.
M/Z 266,0 время удерживания 2,59 мин; 1Н-ЯМР (ДМСО)  3,59 (c, 6H), 7,02 (м, 1H), 7,19 (д, 1H), 7,49 (м, 1H), 7,64 (м, 1H), 7,96 (м, 1H), 8,05 (д, 1H), 8,20 (д, 1H), 8,35 (д, 1H); 13C-ЯМР (ДМСО) 3,59 (c, 6H), 7,02 (м, 1H), 7,19 (д, 1H), 7,49 (м, 1H), 7,64 (м, 1H), 7,96 (м, 1H), 8,05 (д, 1H), 8,20 (д, 1H), 8,35 (д, 1H); 13C-ЯМР (ДМСО) 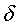 42,37, 112,07, 117,19, 119,23, 121,09, 126,15, 127,48, 130,45, 134,01, 134,67, 155,37, 158,61, 160,97. 42,37, 112,07, 117,19, 119,23, 121,09, 126,15, 127,48, 130,45, 134,01, 134,67, 155,37, 158,61, 160,97.
Пример 2: Синтез 2-(2-метоксифенил)-7-трифторметил-3Н-хиназолин-4-она
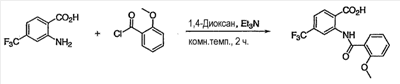
2-(2-Метоксибензоиламино)-4-трифторметилбензойная кислота
2-Амино-4-трифторбензойную кислоту (3,84 г, 18,73 ммоль) растворяли в 30 мл безводного 1,4-диоксана с последующим медленным добавлением хлористого о-анизоила (3,3 мл, 24,35 ммоль), затем триэтиламина (7,85 мл, 56,19 ммоль) и перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. Растворитель удаляли при пониженном давлении и органический слой распределяли между водой и EtOAc, рН доводили до 3 соляной кислотой. Органический слой отделяли, сушили над сульфатом магния, фильтровали и концентрировали с получением не совсем белого твердого вещества. Выделяли 6,35 г, 100% выход. ЖХ/МС (10-99%) M/Z 339,9, время удерживания 3,58 мин.
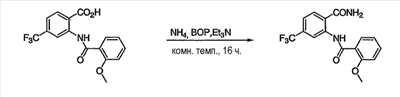
2-(2-Метоксибензоиламино)-4-трифторметилбензамид
2-(2-Метоксибензоиламино)-4-трифторметилбензойную кислоту (7,04 г, 20,77 ммоль) суспендировали в 0,5М растворе аммиака в 1,4-диоксане (125 мл, 62,31 ммоль) с последующим добавлением триэтиламина (5,78 мл, 41,54 ммоль) и затем ВОР реагента (12 г, 27,0 ммоль), смесь перемешивали при комнатной температуре в течение 16 часов. Продукт выделяли вакуумным фильтрованием и промывали водой. Желаемый продукт сушили в лиофилизаторе в течение 24 часов. Выделяли 3,8 г в виде белого твердого вещества. ЖХ/МС (10-99%) M/Z 339,1, время удерживания 2,93 мин.
2-(2-Метоксифенил)-7-трифторметил-3Н-хиназолин-4-он
2-(2-Метоксибензоиламино)-4-трифторметилбензамид (3,8 г, 11,24 ммоль) суспендировали в 145 мл 5% водного раствора NaOH, затем смесь нагревали с обратным холодильником в течение 3 часов при 120ºС. Реакционную смесь охлаждали до комнатной температуры и рН доводили до 4, при этом желаемый продукт выпадал в осадок из раствора. Твердое вещество выделяли вакуумным фильтрованием в виде белого твердого вещества и сушили на лиофилизаторе в течение 24 часов. Белое твердое вещество 2,7 г, 75% выход. ЖХ/МС (10-99%) M/Z 321,1, время удерживания 3,25 мин.
Синтез 2-(2-Метоксифенил)-7-метил-3Н-хиназолин-4-она

N-(2-Циано-5-метилфенил)-2-метоксибензамид
2-Амино-4-метилантронитрил (50,0 г, 378,3 ммоль) растворяли в 1 л безводного пиридина и охлаждали до 0ºС. В течение 40 мин по каплям добавляли хлористый о-анизоил (63,0 мл, 453,96 ммоль), реакционную смесь оставляли нагреться до комнатной температуры и перемешивали в атмосфере азота в течение 16 часов. Реакционную смесь выливали на 2 л льда и продукт образовывал осадок. Продукт выделяли вакуумным фильтрованием и сушили в течение 3 дней, получали желаемый продукт в виде хлопьев рыжевато-коричневого твердого вещества. Выделяли 92,0 г, 91% выход. ЖХ/МС (10-99%) M/Z 267,2, время удерживания 3,34 мин.
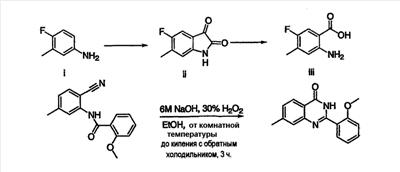
2-(2-Метоксифенил)-7-метил-3Н-хиназолин-4-он
N-(2-Циано-5-метилфенил)-2-метоксибензамид (47,0 г, 176,5 ммоль) суспендировали в 1 л этанола с последующим добавлением 6М водного раствора NaOH (326 мл) и затем 30% раствора Н2О2 (100 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 часов, охлаждали до комнатной температуры и выливали на равный объем льда. рН раствора доводили до 3,5, и продукт осаждался из раствора. Желаемый продукт выделяли вакуумным фильтрованием и сушили в лиофилизаторе в течение 24 часов. Выделяли 22,4 г, 48% выход. ЖХ/МС (10-99%) M/Z 267,0, время удерживания 2,54 мин.
5-Фтор-4-метиламинобензойная кислота
2-Амино-5-фтор-4-метилбензойная кислота
Хлоралгидрат (76 г) растворяли в 1 л воды и далее добавляли 1 кг Na2SO4, 94,1 г H2NOH HCl и 51,3 г 4-фтор-3-метиланилина в 250 мл 5% водной HCl. Суспензию нагревали до кипения и поддерживали кипящей 1 минуту. После охлаждения до комнатной температуры твердое вещество отфильтровывали и промывали дважды теплой водой (40ºС). Выход после высушивания в течение ночи при 60ºС в вакууме составлял 275 г вещества, которое использовали без дальнейшей очистки и сушки. 275 г сырого продукта медленно вливали в 500 мл концентрированной H2SO4 при 50ºС так, чтобы температура держалась ниже 75ºС. После завершения добавления темный фиолетовый раствор нагревали до 85ºС в течение 15 минут. После охлаждения до комнатной температуры раствор вливали в 2 л ледяной воды и оставляли стоять в течение получаса. Красное твердое вещество отфильтровали и дважды промывали холодной водой. Далее, твердое вещество сушили в вакууме при 70ºС. Выход 69,9 г (количественно из 4-фтор-3-метиланилина) смеси двух региоизомеров: 5-фтор- и 3-фтор-3-метилизатина в соотношении примерно 55:45. Смесь изатинов (69,4 г) растворяли в 1 л 1н. водного NaOH и затем, по каплям, добавляли 100 мл 30% водной Н2О2, при поддержании температуры ниже 30ºС. После завершения добавления смесь нагревали до 45ºС до тех пор, пока не прекращалось выделение газа. Раствор охлаждали до комнатной температуры, фильтровали и подкисляли ледяной уксусной кислотой. Образовывался осадок, который отфильтровывали, дважды промывали водой и сушили на воздухе при 45ºС. Выход 29,4 г 5-фтор-4-метиламинобензойной кислоты iii. HCl и 51,3 г 4-фтор-3-метиланилина в 250 мл 5% водной HCl. Суспензию нагревали до кипения и поддерживали кипящей 1 минуту. После охлаждения до комнатной температуры твердое вещество отфильтровывали и промывали дважды теплой водой (40ºС). Выход после высушивания в течение ночи при 60ºС в вакууме составлял 275 г вещества, которое использовали без дальнейшей очистки и сушки. 275 г сырого продукта медленно вливали в 500 мл концентрированной H2SO4 при 50ºС так, чтобы температура держалась ниже 75ºС. После завершения добавления темный фиолетовый раствор нагревали до 85ºС в течение 15 минут. После охлаждения до комнатной температуры раствор вливали в 2 л ледяной воды и оставляли стоять в течение получаса. Красное твердое вещество отфильтровали и дважды промывали холодной водой. Далее, твердое вещество сушили в вакууме при 70ºС. Выход 69,9 г (количественно из 4-фтор-3-метиланилина) смеси двух региоизомеров: 5-фтор- и 3-фтор-3-метилизатина в соотношении примерно 55:45. Смесь изатинов (69,4 г) растворяли в 1 л 1н. водного NaOH и затем, по каплям, добавляли 100 мл 30% водной Н2О2, при поддержании температуры ниже 30ºС. После завершения добавления смесь нагревали до 45ºС до тех пор, пока не прекращалось выделение газа. Раствор охлаждали до комнатной температуры, фильтровали и подкисляли ледяной уксусной кислотой. Образовывался осадок, который отфильтровывали, дважды промывали водой и сушили на воздухе при 45ºС. Выход 29,4 г 5-фтор-4-метиламинобензойной кислоты iii.
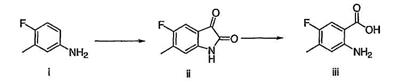
2-Амино-5-трифторметилбензойная кислота
4-(Трифторметил)анилин (25 г, 0,15 моль) растворяли в ТГФ (275 мл), затем обрабатывали Вос ангидридом (41 г, 0,19 моль), ET3N (19 г, 0,19 моль) и 4-(диметиламино)пиридином (0,1 г, 0,8 ммоль). Смесь нагревали с обратным холодильником в течение 3 часов, растворитель удаляли в вакууме, органический остаток растворяли в этилацетате, промывали 1М NaOH, затем 1М HCl, а затем сушили и концентрировали. Полученный продукт перекристаллизовывали из гептана, получая 39 г конечного продукта в виде белого твердого вещества. Твердое вещество (0,15 моль) растворяли в ТГФ (350 мл) и охлаждали до -78ºС в атмосфере азота, затем по каплям обрабатывали BuLi (1,6М в гексане, 282 мл, 0,45 моль). Через 1 час раствор нагревали до 0ºС и выдерживали так в течение 1,5 часов. Смесь выливали на избыток твердого СО2 и перемешивали в течение ночи при комнатной температуре. После распределения против 1М HCl ТГФ слой выпаривали и остаток растворяли в этилацетате, промывали 1М HCl, затем сушили и концентрировали. Твердый продукт растирали с гексаном, получая конечный продукт в виде белого твердого вещества (15,8 г). ЖХ/МС время удерживания 2,70 мин, M/Z (obs, М-Н)=304,1. Окончательно Вос антранилат (11,3 г) растворяли в СH2Cl2 (26 мл) и обрабатывали TFA (21 мл). После перемешивания при комнатной температуре в течение 2 часов раствор сушили в вакууме, полученный остаток растворяли в толуоле (100 мл), концентрировали досуха и процесс растворения/высушивания повторяли еще дважды, получая желаемый продукт в виде белого твердого вещества (10,8 г). ЖХ/МС время удерживания 1,2 мин, M/Z (obs, М-Н)=204,0.

2-Амино-5-бромбензамид
Изатиновый ангидрид (15 г, 0,062 моль) объединяли с 1М водным NH4OH (340 мл) и перемешивали в течение 2 дней при комнатной температуре. Твердый продукт отфильтровывали и сушили в вакууме (6,6 г). ЖХ/МС время удерживания 2,47 мин, M/Z obs=215,2.
К суспензии бензоиленмочевины 1 (10,0 г, 61,7 ммоль) и оксохлорида фосфора (20 мл), перемешиваемой в 500-мл трехгорлой круглодонной колбе, снабженной магнитной мешалкой и обратным холодильником, в один прием добавляли N,N-диметиланилин (7,80 мл, 61,7 ммоль). Суспензию нагревали при кипении с обратным холодильником в течение 3 часов и медленно образовывался светло-красный раствор. Раствор концентрировали при пониженном давлении и остаток выливали на лед (100 г). Раствор подщелачивали до рН 9,0 концентрированным водным раствором бикарбоната натрия. Смесь распределяли между CH2Cl2 и Н2О. Органическую часть сушили (MgSO4) и выпаривали досуха при пониженном давлении. Остаток растворяли в безводном ТГФ (75 мл) и охлаждали до 0ºС. В течение 30 мин при перемешивании по каплям добавляли диметиланилин (67,7 мл, 135 ммоль, 2,0М в ТГФ). Раствор затем перемешивали при 0ºС в течение 1 часа. Раствор концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле с использованием смеси (70% гексан, 30% этилацетат), получая соединение 2 (7,90 г, 38,1 ммоль, 62% выход) в виде белого твердого вещества.
1Н-ЯМР (CDCl3)  3,43 (c, 6H), 7,40 (т, 1H), 7,69 (т, 1H), 7,78 (д, 1H), 8,02 (д, 1H); М+1 (obc)=208,0; Rt=2,26. 3,43 (c, 6H), 7,40 (т, 1H), 7,69 (т, 1H), 7,78 (д, 1H), 8,02 (д, 1H); М+1 (obc)=208,0; Rt=2,26.
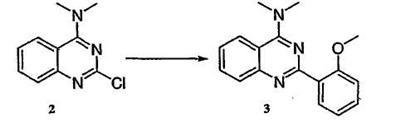
В 5-мл микроволновый реакционный сосуд загружали смесь соединения 2 (100 мг, 0,48 ммоль), 2-метоксифенилбороновой кислоты (96 мг, 0,63 ммоль), тетракис(трифенилфосфин)палладия(0) (55 мг, 0,048 ммоль), карбоната натрия (1,20 мл, 0,48 ммоль, 0,40М водный раствор) и ацетонитрила (1,20 мл). Сосуд закупоривали и нагревали с перемешиванием при 170ºС в течение 10 минут с помощью микроволнового излучения. Органическую часть концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле с использованием смеси (80% гексан, 20% этилацетат), получая соединение 3 (120 мг, 0,43 ммоль, 89% выход) в виде белого твердого вещества.
1Н-ЯМР (CDCl3) 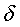 3,32 (c, 6H), 3,81 (c, 3Н), 6,89-7,02 (м, 2H), 7,28-7,34 (м, 2H), 7,62 (т, 1H), 7,75 (д, 1H), 7,89 (д, 1H), 7,95 (д, 1H); М+1 (obc)=280,2; Rt=2,46. 3,32 (c, 6H), 3,81 (c, 3Н), 6,89-7,02 (м, 2H), 7,28-7,34 (м, 2H), 7,62 (т, 1H), 7,75 (д, 1H), 7,89 (д, 1H), 7,95 (д, 1H); М+1 (obc)=280,2; Rt=2,46.
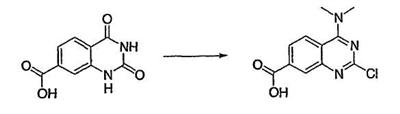
Метиловый эфир 2-хлор-4-диметиламинохиназолин-7-карбоновой кислоты
Суспензию метилового эфира 2,4-диоксо-1,2,3,4-тетрагидрохиназолин-7-карбоновой кислоты (12,2 г, 55,4 ммоль), N,N-диметиланилина (14,0 мл, 110,8 ммоль) и POCl3 (25 мл), при перемешивании в атмосфере азота, нагревали при 100ºС в течение 15 минут. Раствор выпаривали досуха при пониженном давлении и остаточное масло выливали в смесь лед-вода (800 мл). Смесь делали сильно щелочной добавлением 50% водного раствора NaOH при 0ºС. Смесь распределяли между CH2Cl2 и Н2О и органическую часть выпаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле с использованием смеси 70% гексана/30% этилацетата, получая промежуточный хлорид в виде белого твердого вещества (5,1 г, 19,8 ммоль). Полученное промежуточное соединение растворяли в CH2Cl2 (100 мл). Раствор охлаждали до 0ºС с последующим добавлением Et3N (5,5 мл, 39,6 ммоль) и гидрохлорида диметиламина (1,6 г, 19,8 ммоль). Смесь затем перемешивали при 0ºС в течение 30 минут. Смесь выпаривали досуха и полученный остаток очищали хроматографией на силикагеле с использованием смеси 70% гексана/30% этилацетата, давая желаемый амин в виде белого твердого вещества (3,3 г, 12,4 ммоль, 11% выход). ЖХ/МС (10-99%) M/Z 268,0, время удерживания 2,85 мин.

6-Фтор-N4,N4-диметилхиназолин-2,4-диамин
Смесь (2-хлор-6-фторхиназолин-4-ил)диметиламина (50 мг, 0,22 ммоль), бис(триметилсилил)амида лития (260 мкл, 0,26 ммоль, 1,0М в гексане), Pd2(dba)3 (20 мг, 0,022 ммоль), 2-(дициклогексил)фосфинобифенила (19 мг, 0,053 ммоль) и ТГФ (1,0 мл) при перемешивании нагревали в закупоренной трубке с помощью микроволнового излучения при 65ºС в течение 1,5 часов. Добавлялся 1,0н. водный раствор HCl (3,0 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Смесь распределяли между Н2О и EtOAc. Органическую часть выпаривали досуха при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле с использованием смеси 95% CH2Cl2/5% МеОН, получая требуемый амин в виде рыжевато-коричневого твердого вещества (40 мг, 19,4 ммоль, 88% выход). ЖХ/МС (10-99%) M/Z 206,9, время удерживания 1,18 мин.
1-(4-Диметиламино-6-фторхиназолин-2-ил)пирролидин-2,5-дион
Смесь 6-фтор-N4,N4-диметилхиназолин-2,4-диамина (30,0 мг, 0,13 ммоль), янтарного ангидрида (12 мг, 0,12 ммоль) и п-диоксана (500 мкл) при перемешивании нагревали в закупоренной трубке с помощью микроволнового излучения при 170ºС в течение 20 минут. Смесь очищали с помощью ВЭЖХ, получая требуемый сукцинат в виде соли TFA (40 мг, 0,10 ммоль, 76% выход). ЖХ/МС(10-99%) M/Z 289,3, время удерживания 2,01 мин.
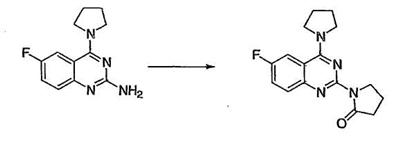
1-(6-Фтор-4-пирролидин-1-илхиназолин-2-ил)пирролидин-2-он
Смесь 6-фтор-4-пирролидин-1-илхиназолин-2-иламина (30,0 мг, 0,14 ммоль), 4-хлорбутирилхлорида (17 мкл, 0,15 ммоль), Et3N (42 мкл, 0,30 ммоль) и п-диоксана (500 мкл) при перемешивании нагревали в закупоренной трубке с помощью микроволнового излучения при 170ºС в течение 20 минут. Смесь очищали с помощью ВЭЖХ, получая требуемый лактам в виде соли TFA (45 мг, 0,11 ммоль, 81% выход). ЖХ/МС (10-99%) M/Z 301,2, время удерживания 2,24 мин.
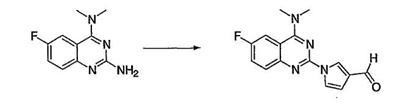
1-(4-Диметиламино-6-фторхиназолин-2-ил)-1Н-пиррол-3-карбальдегид
Смесь 6-фтор-N4,N4-диметилхиназолин-2,4-диамина (20,0 мг, 0,10 ммоль), 2,5-диметокси-3-тетрагидрофуранкарбоксальдегида (43 мкл, 0,30 ммоль) и АсОН (500 мкл) при перемешивании нагревали при 90ºС в течение 30 минут. Смесь выпаривали досуха и полученный остаток очищали хроматографией на силикагеле с использованием смеси 70% гексана/30% этилацетата, получая требуемый альдегид в виде белого твердого вещества (15 мг, 0,05 ммоль, 50% выход). ЖХ/МС (10-99%) M/Z 285,1, время удерживания 3,23 мин.
(6-Метокси-2-пиррол-1-илхиназолин-4-ил)диметиламин
К раствору пиррола (310 мг, 4,6 ммоль) и ДМФ (диметилформамид) (5,0 мл) при перемешивании в атмосфере азота добавляли NaH (170 мг, 4,2 ммоль, 60% в минеральном масле). Смесь перемешивали при комнатной температуре 10 минут. К данному раствору добавляли (2-хлор-6-метоксихиназолин-4-ил)диметиламин (1,0 г, 4,2 ммоль). Смесь нагревали в закупоренной трубке с помощью микроволнового излучения при 220ºС в течение 20 минут. Смесь выпаривали досуха и полученный остаток очищали хроматографией на силикагеле с использованием смеси 70% гексана/30% этилацетата, получая требуемый альдегид в виде белого твердого вещества (15 мг, 0,05 ммоль, 50% выход). ЖХ/МС (10-99%) M/Z 269,0, время удерживания 2,39 мин.
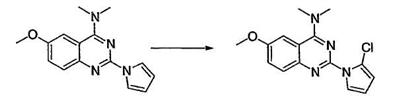
[2-(2-Хлорпиррол-1-ил)-6-метоксихиназолин-4-ил]диметиламин
При перемешивании к раствору (6-метокси-2-пиррол-1-илхиназолин-4-ил)диметиламина (25 мг, 0,09 ммоль) и ТГФ (2,0 мл) в атмосфере азота добавляли N-хлорсукцинимид (13 мг, 0,09 ммоль). Раствор перемешивали при комнатной температуре в течение 17 часов. Смесь очищали с помощью ВЭЖХ, получая требуемый хлорпиррол в виде соли TFA (23 мг, 0,06 ммоль, 62% выход). ЖХ/МС (10-99%) M/Z 303,0, время удерживания 2,71 минуты.
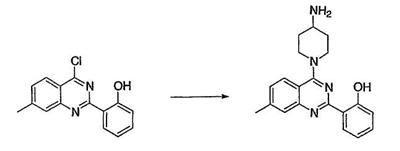
2-[4-(4-Аминопиперидин-1-ил)-7-метилхиназолин-2-ил]фенол
При перемешивании к раствору 2-(4-хлор-7-метилхиназолин-2-ил)фенола (100 мг, 0,35 ммоль), Et3N (72 мкл, 0,52 ммоль) и CH2Cl2 (300 мкл) в атмосфере азота добавляли 4-аминопиперидин (54 мкл, 0,52 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Смесь выпаривали досуха при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле с использованием смеси 98% CH2Cl2/2% МеОН, получая требуемый амин в виде белого твердого вещества (11 мг, 0,31 ммоль, 89% выход). ЖХ/МС (10-99%) M/Z 349,3, время удерживания 2,22 мин.
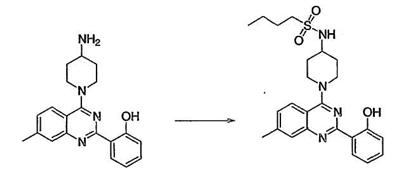
{1-[2-(2-Гидроксифенил)-7-метилхиназолин-4-ил]пиперидин-4-ил}амид этансульфоновой кислоты
При перемешивании к раствору 2-[4-(4-аминопиперидин-1-ил)-7-метилхиназолин-2-ил]фенола (30 мг, 0,09 ммоль), Et3N (25 мкл, 0,18 ммоль) и CH2Cl2 (500 мкл) в атмосфере азота добавляли этансульфонилхлорид (10 мкл, 0,09 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов. Смесь очищали с помощью ВЭЖХ, получая требуемый сульфонамид в виде соли TFA (33 мг, 0,06 ммоль, 68% выход). ЖХ/МС (10-99%) M/Z 427,3, время удерживания 2,80 мин.
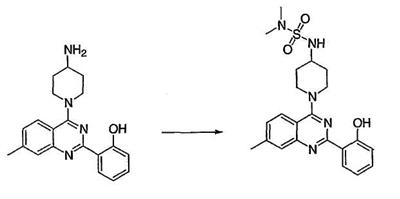
3-{1-[2-(2-Гидроксифенил)-7-метилхиназолин-4-ил]пиперидин-4-ил}-1,1-диметилсульфонилмочевина
При перемешивании к раствору 2-[4-(4-аминопиперидин-1-ил)-7-метилхиназолин-2-ил]фенола (35 мг, 0,11 ммоль), Et3N (30 мкл, 0,22 ммоль) и CH2Cl2 (300 мкл) в атмосфере азота добавляли диметилсульфамоилхлорид (12 мкл, 0,11 ммоль). Смесь перемешивали при комнатной температуре в течение 17 часов. Смесь очищали с помощью ВЭЖХ, получая требуемую сульфонилмочевину в виде соли TFA (44 мг, 0,08 ммоль, 71% выход). ЖХ/МС (10-99%) M/Z 442,4, время удерживания 2,84 мин.
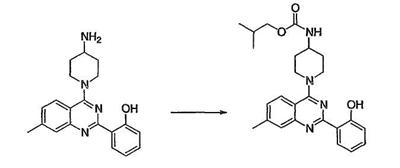
Изобутиловый эфир {1-[2-(2-гидроксифенил)-7-метилхиназолин-4-ил]пиперидин-4-ил}карбаминовой кислоты
При перемешивании к раствору 2-[4-(4-аминопиперидин-1-ил)-7-метилхиназолин-2-ил]фенола (30 мг, 0,09 ммоль), Et3N (25 мкл, 0,18 ммоль) и CH2Cl2 (300 мкл) в атмосфере азота добавляли изобутилхлорформиат (12 мкл, 0,09 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа. Смесь очищали с помощью ВЭЖХ, получая требуемый карбамат в виде соли TFA (27 мг, 0,05 ммоль, 58% выход). ЖХ/МС (10-99%) M/Z 435,2, время удерживания 3,21 мин.
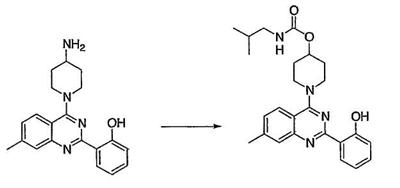
1-[2-(2-Гидроксифенил)-7-метилхиназолин-4-ил]пиперидин-4-ильный эфир изобутилкарбаминовой кислоты
При перемешивании к раствору 1-[2-(2-метоксифенил)-7-метилхиназолин-4-ил]пиперидин-4-ола (100 мг, 0,30 ммоль) и ТГФ (500 мкл) в атмосфере азота добавляли фосген (317 мкл, 0,60 ммоль, 20% в толуоле). Смесь перемешивали при комнатной температуре в течение 15 минут. В течение 2 мин по каплям добавляли изобутиламин (300 мкл, 3,0 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Смесь выпаривали досуха и полученный остаток очищали хроматографией на силикагеле с использованием смеси 97% CH2Cl2/3% МеОН, получая требуемое промежуточное карбаматное соединение в виде прозрачного масла (90 мг, 0,20 ммоль). При перемешивании к раствору промежуточного карбаматного соединения (90 мг, 0,20 ммоль) и CH2Cl2 (15 мл) в атмосфере азота при -78ºС в течение 2 минутного периода, по каплям добавляли ВВr3 (60 мл, 0,60 ммоль 1,0М в CH2Cl2). Смеси затем давали возможность нагреться до комнатной температуры и затем ее нагревали при 50ºС в течение 15 минут. Смесь вливали в насыщенный водный раствор NaHCO3 (80 мл) и органическую часть выпаривали досуха. Остаток очищали с помощью ВЭЖХ, получая требуемый карбамат в виде соли TFA (66 мг, 0,12 ммоль, 39% выход). ЖХ/МС (10-99%) M/Z 435,3, время удерживания 3,08 мин.
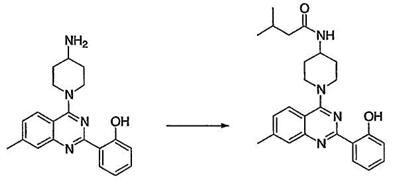
N-{1-[2-(2-Гидроксифенил)-7-метилхиназолин-4-ил]пиперидин-4-ил}-3-метилбутирамид
При перемешивании к раствору 2-[4-(4-аминопиперидин-1-ил)-7-метилхиназолин-2-ил]фенола (35 мг, 0,11 ммоль), Et3N (30 мкл, 0,22 ммоль) и CH2Cl2 (300 мкл) в атмосфере азота добавляли изовалерилхлорид (14 мкл, 0,11 ммоль). Смесь перемешивали при комнатной температуре в течение 17 часов. Смесь очищали с помощью ВЭЖХ, получая требуемый сульфонамид в виде соли TFA (37 мг, 0,07 ммоль, 59% выход). ЖХ/МС(10-99%) M/Z 419,3, время удерживания 2,77 мин.
Синтез 2-(4-Этоксихиназолин-2-ил)фенола
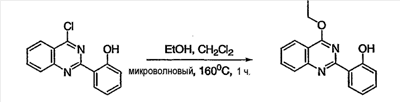
2-(4-Этоксихиназолин-2-ил)фенол
2-(4-Хлорхиназолин-2-ил)фенол (50 мг, 0,196 ммоль) помещали в микроволновую трубку, снабженную мешалкой, и растворяли в 0,5 мл безводного дихлорметана с последующим добавлением 2 мл безводного этанола. Трубку закупоривали пробкой и нагревали при температуре от 160ºС до 200ºС в течение 1 часа в микроволновой печи СЕМ. Растворитель удаляли при пониженном давлении, органический слой ресуспендировали в ДМСО и очищали с помощью ВЭЖХ по Гилсону. Требуемое соединение концентрировали до белого твердого вещества в виде соли TFA. ЖХ/МС (10-99%) M/Z 267,2, время удерживания 2,57 мин.
Синтез 2-(4-диметиламинохиназолин-2-ил)-6-метилфенола

[2-(2-Метокси-3-метилфенил)хиназолин-4-ил]диметиламин
При перемешивании к раствору [2-(2-метоксифенил)хиназолин-4-ил]диметиламина (200 мг, 0,72 ммоль) в безводном ТГФ в атмосфере аргона при -78ºС по каплям добавляли 1,6М раствор н-BuLi в гексанах (0,671 мл, 1,074 ммоль). Через 10 минут добавляли MeI (0,076 мл, 1,22 ммоль) и реакционную смесь оставляли нагреваться до комнатной температуры. Через 10 минут при комнатной температуре реакционную смесь гасили насыщенным водным раствором NH4Cl и распределяли между водой и этилацетатом. Органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали до желтого масла. Очищали флэш-хроматографией смесью 10% этилацетата/90% гексана, получая продукт в виде белого твердого вещества. Выделяли 146 мг, 50% выход. ЖХ/МС (10-99%) M/Z 294,0, время удерживания 3,23 мин.
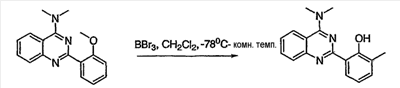
2-(4-Диметиламинохиназолин-2-ил)-6-метилфенола
При перемешивании к раствору [2-(2-метоксифенил)хиназолин-4-ил]диметиламина (54 мг, 0,184 ммоль) в CH2Cl2, при -78ºС в атмосфере азота, добавляли ВВr3 (0,92 мл, 0,92 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и затем нагревали при 45ºС в течение 4 часов. Реакционную смесь оставляли остывать до комнатной температуры и затем гасили водным раствором NaHCO3 до рН 8. Органический слой отделяли, сушили над сульфатом магния, фильтровали и концентрировали до желтого твердого вещества. Очищали с помощью ВЭЖХ по Гилсону и требуемый продукт выделяли в виде соли TFA. ЖХ/МС (10-99%) M/Z 280,2, время удерживания 2,55 мин.
Синтез 2-(4-диметиламинохиназолин-2-ил)-4-морфолин-4-илфенола
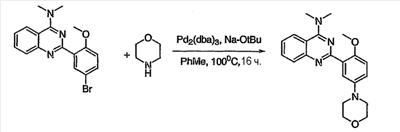
[2-(2-Метокси-5-морфолин-4-илфенил)хиназолин-4-ил]диметиламин
В трубку, снабженную мешалкой, загружали Pd2(dba)3 (51,1 мг, 0,0558 ммоль), бифенил-2-илди-трет-бутилфосфан (67 мг, 0,223 ммоль), NaOtBu (80 мг, 0,837 ммоль) в 2 мл безводного толуола, так же добавляли 4-бром-2-(4-диметиламинохиназолин-2-ил)фенол (200 мг, 0,558 ммоль) и морфолин (0,073 мл, 0,837 ммоль). Реакционную трубку закупоривали винтовой пробкой и нагревали при 100ºС на масляной бане в течение 16 часов. Смесь очищали флэш-хроматографией смесью 30%-60% этилацетат/гексаны, подавая продукт в виде белого твердого вещества. Выделяли 100 мг, 49% выход. ЖХ/МС (10-99%) M/Z 365,0, время удерживания 2,07 мин.
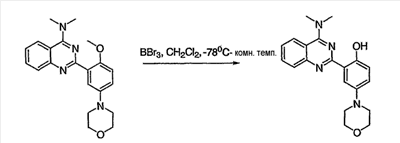
2-(4-Диметиламинохиназолин-2-ил)-4-морфолин-4-илфенол
При перемешивании к раствору [2-(2-метокси-5-морфолин-4-илфенил)хиназолин-4-ил]диметиламина (109 мг, 0,299 ммоль) в CH2Cl2, при -78ºС в атмосфере азота, добавляли ВВr3 (1,5 мл, 1,5 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и затем нагревали при 40ºС в течение 2 часов. Реакционную смесь гасили водным раствором NaHCO3 до рН 8. Органический слой отделяли, сушили над сульфатом магния, фильтровали и концентрировали до желтого твердого вещества. Очищали с помощью ВЭЖХ по Гилсону и требуемый продукт выделялся в виде соли TFA. ЖХ/МС (10-99%) M/Z 351,4, время удерживания 1,89 мин.
Синтез 2-(4-диметиламинохиназолин-2-ил)-4-метилфенола

[2-(2-Метокси-5-метилфенил)хиназолин-4-ил]диметиламин
При перемешивании к раствору [2-(5-бром-2-метоксифенил)хиназолин-4-ил]диметиламина (200 мг, 0,558 ммоль) в безводном ТГФ, в атмосфере аргона при -78ºС, по каплям добавляли 1,6М раствор н-BuLi в гексане (0,76 мл, 1,23 ммоль). Через 10 минут добавляли MeI (0,054 мл, 1,23 ммоль) и реакционную смесь оставляли нагреваться до комнатной температуры. Через 10 минут при комнатной температуре реакционную смесь гасили насыщенным водным раствором NH4Cl и распределяли между водой и этилацетатом. Органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали до желтого масла. Очищали флэш-хроматографией смесью 30% этилацетата/70% гексана, получая продукт в виде белого твердого вещества. Выделялось 146 мг, 89% выход. ЖХ/МС (10-99%) M/Z 294,4, время удерживания 2,64 мин.
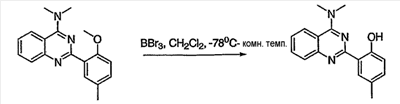
2-(4-Диметиламинохиназолин-2-ил)-4-метилфенол
При перемешивании к раствору [2-(2-метокси-5-метилфенил)хиназолин-4-ил]диметиламина (146 мг, 0,498 ммоль) в CH2Cl2 при -78ºС в атмосфере азота добавляли ВВr3 (2,49 мл, 2,49 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры в течение 2 часов. Реакционную смесь гасили водным раствором NaHCO3 до рН 8. Органический слой отделяли, сушили над сульфатом магния, фильтровали и концентрировали до желтого твердого вещества. Очищали с помощью ВЭЖХ по Гилсону и требуемый продукт выделяли в виде соли TFA. ЖХ/МС (10-99%) M/Z 280,2, время удерживания 2,65 мин.
Синтез 2-(2′-метилсульфонилфенил)-4-диметиламинохиназолина
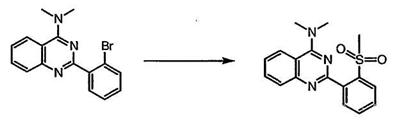
2-(2′-Метилсульфонилфенил)-4-диметиламинохиназолин
В 2-мл реакционный сосуд Personal Chemistry Microwave, снабженный мешалкой, загружали 2-(2′-бромфенил)-4-диметиламинохиназолин (0,020 г, 61 ммоль), йодид меди(I) (0,017 г, 91 ммоль), метансульфинат натрия (0,010 г, 97 ммоль) и 0,5 мл ДМФ. Данная смесь подвергалась микроволновому облучению при 180ºС в течение 10 минут. После охлаждения добавляли воду и эфир и осуществляли экстракцию. Эфирный слой затем фильтровали через целит и затем снова один раз экстрагировали с использованием приблизительно 20% NH4OH для удаления дополнительной меди. После концентрирования продукт снова растворяли в 50/50 растворе ДМСО/МеОН. Очистку проводили с помощью ЖХ/МС, получая соль TFA. ЖХ/МС (10-99%) M/Z 328,3, время удерживания 3,03 мин.
Синтез 2-(2′-анилино)-4-диметиламинохиназолина

2-(2′-Анилино)-4-диметиламинохиназолин
Порошок цинка (1,18 г, 18,0 ммоль) добавлялся к раствору 2-(2′-нитрофенил)-4-диметиламинохиназолина (0,530 г, 1,80 ммоль) в уксусной кислоте (10,9 мл, 190 ммоль) при 0ºС. Реакционная смесь затвердевала, но перемешивание возобновляли после удаления ледяной бани. Реакционную смесь перемешивали в течение 3 часов при комнатной температуре. Затем добавляли деионизированную воду (приблизительно 10 мл), и образовывался раствор с последующим образованием осадка. Данный раствор слегка подщелачивали водным NaHCO3. Продукт трижды экстрагировали этилацетатом, сушили сульфатом магния, фильтровали и концентрировали. Приблизительно 20 мг продукта повторно растворяли в 50/50 растворе ДМСО/МеОН и очищали с помощью ЖХ/МС, получая соль бис-трифторуксусной кислоты. ЖХ/МС (10-99%) M/Z 265,0, время удерживания 2,81 мин.
Синтез 2-(2′-этилсульфанилфенил)-4-диметиламинохиназолина

2-(2′-Этилсульфанилфенил)-4-диметиламинохиназолин
Карбонат калия (0,052 г, 0,374 ммоль) и этантиол (0,055 мл, 0,748 ммоль) добавляли к раствору 2-(2′-фторфенил)-4-диметиламинохиназолина (0,020 г, 0,0748 ммоль) в N,N-диметилформамиде (1 мл) в микроволновом реакционном сосуде с мешалкой. Данную смесь облучали в микроволновом реакторе при 135ºС в течение 1,5 часов. Полученную смесь фильтровали и затем очищали с помощью ЖХ/МС, получая соль трифторуксусной кислоты. ЖХ/МС (10-99%) M/Z 310,2, время удерживания 3,27 мин.
Синтез 2-(2′-цианофенил)-4-диметиламинохиназолина

2-(2′-Цианофенил)-4-диметиламинохиназолин
В круглодонную колбу загружали 2-(2′-бромфенил)-4-диметиламинохиназолин (0,010 г, 0,0305 ммоль), цианид калия (0,0040 г, 0,0609 ммоль), тетракис(трифенилфосфин)палладий(0) (0,0018 г, 0,00152 ммоль), йодид меди(I) (0,00058 г, 0,00305 ммоль) и ацетонитрил (0,50 мл) и ее нагревали до кипения с обратным холодильником в течение ночи. После охлаждения до комнатной температуры добавляли этилацетат и смесь фильтровали через целит. Затем проводили экстракцию с использованием гидроксида аммония (приблизительно 20%) для удаления дополнительной меди. После концентрирования продукт снова растворяли в 50/50 растворе ДМСО/МеОН и очищали с помощью ЖХ/МС, получая соль TFA. ЖХ/МС (10-99%) M/Z 275,2, время удерживания 2,85 мин.
Синтез 2-(2′-изопропенилфенил)-4-диметиламинохиназолина

2-(2′-Изопропенилфенил)-4-диметиламинохиназолин
0,5М раствор изопропенилмагнийбромида (0,898 мл, 0,449 ммоль) добавляли к раствору 2-(2′-фторфенил)-4-диметиламинохиназолина (0,040 г, 0,150 ммоль) в диметиловом эфире этиленгликоля (1 мл) в микроволновом сосуде, снабженном мешалкой. Образец облучали в микроволновом реакторе в течение 5 минут при 170ºС. Затем добавляли деионизированную воду (приблизительно 2 мл). Экстракцию осуществляли эфиром. После концентрирования, продукт повторно растворяли в 50/50 растворе ДМСО/МеОН и очищали с помощью ЖХ/МС, давая соль TFA. ЖХ/МС (10-99%) M/Z 289,8, время удерживания 3,23 мин.
Синтез 2-(2′-гидроксифенил)-4-диметиламино-6-метоксихиназолина
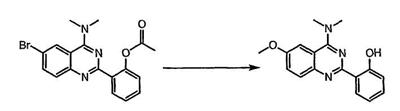
2-(2′-Гидроксифенил)-4-диметиламино-6-метоксихиназолин
В реакционный сосуд для микроволнового реактора, снабженный мешалкой, загружали 2-(2′-ацетоксифенил)-4-диметиламино-6-бромхиназолин (0,100 г, 0,259 ммоль), йодид меди(I) (0,0245 г, 0,129 ммоль), N,N-диметилформамид (0,90 мл) и 0,5М раствор метоксида натрия (1,04 мл, 0,518 ммоль) в метаноле. Образец облучали в микроволновом реакторе в течение 20 минут при 150ºС. После охлаждения образец разбавляли эфиром и затем фильтровали через целит. Далее проводили экстрагирование с использованием гидроксида аммония (приблизительно 20%) для удаления дополнительной меди. После концентрирования продукт снова растворяли в 50/50 растворе ДМСО/МеОН и очищали с помощью ЖХ/МС (20-99%), получая соль TFA. Приблизительный выход 60% (посредством ЖХ/МС). ЖХ/МС (10-99%) M/Z 296,4, время удерживания 2,31 мин.
Синтез метилового эфира 4-фтор-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензойной кислоты

Метиловый эфир 3-бром-4-фторбензойной кислоты
3-Бром-4-фторбензойную кислоту (2,5 г, 11,42 ммоль) помещали в 100-мл круглодонную колбу, снабженную мешалкой, которую закупоривали мембраной и в атмосфере азота растворяли в 9 мл безводного ТГФ и 3 мл безводного МеОН. К раствору кислоты при перемешивании по каплям добавляли 2,0М раствор TMSдиазометана в эфире (6,28 мл, 12,56 ммоль). Превращение кислоты в сложный эфир завершалось через 20 минут согласно анализу ЖХ/МС. Растворитель удаляли при пониженном давлении и продукт использовали без дальнейшей очистки. Выделяли прозрачное масло (2,66 г, 100% выход) ЖХ/МС (10-99%) M/Z 234, время удерживания 3,09 мин.
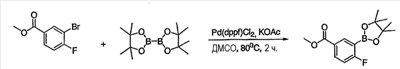
Метиловый эфир 4-фтор-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензойной кислоты
В круглодонную колбу, снабженную мешалкой, добавляли метиловый эфир 3-бром-4-фторбензойной кислоты (1,66 г, 7,12 ммоль), бис(пинаколято)дибор (2,2 г, 8,5 ммоль), ацетат калия (2,1 г, 21,3 ммоль) и комплекс [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (0,35 г, 0,43 ммоль) с дихлорметаном (1:1). Реакционную колбу закупоривали пробкой, откачивали воздух и обеспечивали атмосферу азота, с последующим добавлением 20 мл безводного ДМСО. Реакционная смесь нагревалась при 80ºС в масляной бане в течение 2 часов. Реакционную смесь оставляли остывать до комнатной температуры и распределяли между этилацетатом и водой. Органический слой отделяли и водный слой экстрагировали еще два раза. Все органические вещества объединяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до черного масла. Продукт очищали флэш-хроматографией с использованием градиента этилацетат/гексаны 0-60%, получая желаемый продукт в виде белого твердого вещества (1,48 г, 74% выход). ЖХ/МС (10-99%) M/Z 281,4, время удерживания 2,73 мин.
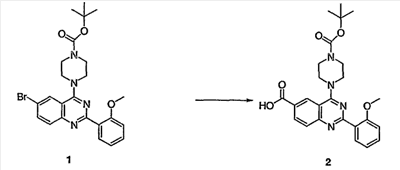
Хиназолин 1 (1,5 г, 3,0 ммоль) растворяли в ТГФ (150 мл). После охлаждения до -78ºС по каплям добавляли трет-бутиллитий (1,7М в гептане, 1,76 мл). После перемешивания в течение 10 минут при -78ºС к раствору добавляли СО2 (дробленый) и раствор нагревали до комнатной температуры и перемешивали в течение 30 минут. Реакционную смесь гасили водой (100 мл), разбавляли этилацетатом (100 мл). Органический слой сушили, концентрировали, очищали флэш-хроматографией (1%-10% МеОН/DCM), получая соединение 2 (600 мг, 43% выход).
Синтез 2-(2′-гидроксифенил)-4-диметиламино-6-морфолинохиназолина
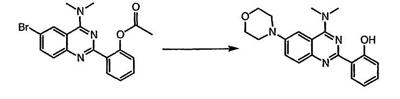
2-(2′-Гидроксифенил)-4-диметиламино-6-морфолинохиназолин
В сухую реакционную трубку с завинчивающейся пробкой в атмосфере азота загружали трис(дибензилиденацетон)дипалладий(0) (0,012 г, 13,0 ммоль), 2,2′-бис(дифенилфосфино)-1,1′-бинафтил (0,024 г, 38,8 ммоль), карбонат цезия (0,097 г, 298 ммоль), толуол (0,25 мл), 2-(2′-ацетоксифенил)-4-диметиламино-6-бромхиназолин (0,050 г, 129 ммоль) и морфолин (23 мкл, 259 ммоль) в указанном порядке. Данную смесь затем нагревали до 80ºС в течение 24 часов. После охлаждения смесь разбавляли эфиром, фильтровали через целит и силикагель и концентрировали. Продукт повторно растворяли в 50/50 растворе ДМСО/МеОН и очищали с помощью ЖХ/МС, получая соль бис-TFA. ЖХ/МС (10-99%) M/Z 351,0, время удерживания 2,75 мин.
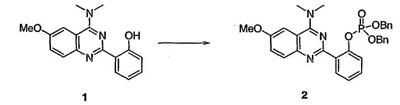
Хиназолин 1 (0,2 г, 0,62 ммоль) растворяли в СH3CN (5 мл). После охлаждения до -10ºС (лед/NaCl) добавляли CCl4, DIEA и DMAP. После перемешивания в течение 10 минут к смеси медленно, в течение 10 минут, добавляли раствор дибензилфосфита в
CH3CN (2 мл). Перемешивание проводили при -10ºС в течение 2 часов, затем при комнатной температуре в течение 24 часов. Смесь гасили добавлением 0,5М K2HPO4, разбавляли водой (15 мл), экстрагировали дихлорметаном (30 мл), сушили, концентрировали, очищали флэш-хроматографией (100% DCM), получая соединение 2 (168 мг, 47% выход) в виде бесцветного масла. ЖХ/МС (10-99%) M/Z 586,0, время удерживания 2,54 мин.
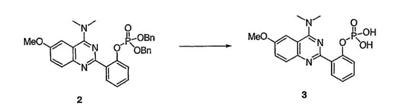
К раствору хиназолина 2 (0,168 г, 0,29 ммоль) в DCM (дихлорметан) (1,5 мл) добавляли TMSBr (0,079 мл, 0,61 ммоль) при 0ºС. Реакционную смесь перемешивали в течение 1 часа при 0ºС, а затем в течение 1 часа при комнатной температуре. Реакционную смесь гасили водой (3 мл) и перемешивали 15 минут. Водный слой промывали этилацетатом (5 мл) и сушили в лиофилизаторе в течение ночи, получая требуемый продукт 3 в виде белой пены (0,14 г, 100% выход). ЖХ/МС (10-99%) M/Z 406,0, время удерживания 3,32 мин.

К раствору хиназолина 3 (0,14 г, 0,36 ммоль) в МеОН (3 мл) добавляли NaOMe (1,44 мл, 0,72 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали с использованием ротационного испарителя (25ºС), затем остаток растворяли в воде (75 мл) и промывали этилацетатом (3×50 мл). Водную фазу сушили лиофилизатором, получая конечный продукт 4 (0,14 г, 98% выход) в виде твердого вещества. ЖХ/МС (10-99%) M/Z 406,0, время удерживания 3,32 мин.
2-{7-Метил-4-[метил-(5-метил-[1,3,4]оксадиазол-2-илметил)амино]хиназолин-2-ил}фенол
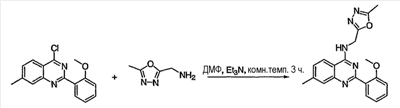
[2-(2-Метоксифенил)-7-метилхиназолин-4-ил]-(5-метил-[1,3,4]оксадиазол-2-илметил)амин
4-Хлор-2-(2-метоксифенил)-7-метилхиназолин (400 мг, 1,48 ммоль) растворяли в 10 мл безводного ДМФ с последующим добавлением С-(5-метил[1,3,4]оксадиазол-2-ил)метиламиноксалата (234 мг, 1,48 ммоль), затем триэтиламина (413 мкл, 2,96 ммоль). Через 6 часов реакция завершалась, смесь распределяли между этилацетатом и водой. Органическую фазу отделяли, сушили сульфатом магния, фильтровали и концентрировали с получением масла. Очищали флэш-хроматографией 60% этилацетата/40% гексана, получая требуемый продукт в виде белого твердого вещества. Выделяли 290 мг, 56% выход. ЖХ/МС (10-99%) M/Z 348,4, время удерживания 2,17 мин.
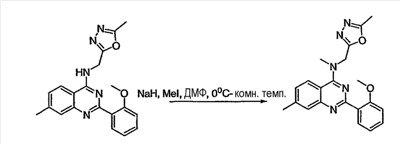
[2-(2-Метоксифенил)-7-метилхиназолин-4-ил]метил-(5-метил-[1,3,4]оксадиазол-2-илметил)амин
При перемешивании в атмосфере азота при 0ºС к суспензии свежепромытого гидрида натрия (42 мг, 1,04 ммоль) в безводном ДМФ добавляли [2-(2-метоксифенил)-7-метилхиназолин-4-ил]-(5-метил[1,3,4]оксадиазол-2-илметил)амин (180 мг, 0,518 ммоль, в 5 мл ДМФ). Через 30 минут при 0ºС добавляли MeI (74 мкл, 1,19 ммоль) и реакционную смесь оставляли нагреваться до комнатной температуры. Через 1 час реакционную смесь гасили водой и экстрагировали 3 раза этилацетатом. Органические вещества объединяли, сушили над сульфатом магния, фильтровали и концентрировали до желтого масла. Очищали флэш-хроматографией 50/50 этилацетат/гексан, получая требуемый продукт в виде прозрачного масла. Выделяли 128 мг, 66% выход. ЖХ/МС (10-99%) M/Z 376,1, время удерживания 2,06 мин.
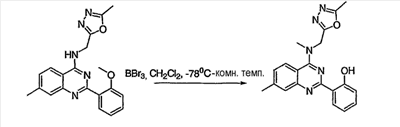
2-{7-Метил-4-[метил-(5-метил-[1,3,4]оксадиазол-2-илметил)амино]хиназолин-2-ил}фенол
При перемешивании в атмосфере азота при -78ºС к раствору [2-(2-метоксифенил)-7-метилхиназолин-4-ил]метил-(5-метил[1,3,4]оксадиазол-2-илметил)амина (128 мг, 0,341 ммоль) в безводном СН2Cl2 по каплям добавляли BBr3 (1,71 мл, 1,71 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и через 3 часа смесь гасили насыщенным водным раствором NaHCO3 до рН 8. Органические вещества отделяли, сушили над сульфатом магния, фильтровали и концентрировали до светло-желтого масла. Очищали с помощью ВЭЖХ по Гилсону и соединение выделяли в виде соли TFA. ЖХ/МС (10-99%) M/Z 362,3, время удерживания 2,12 мин.
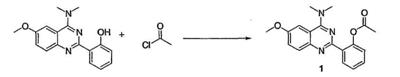
К раствору хиназолина (187 мг, 0,63 ммоль) в СН2Cl2 (5 мл) добавляли пиридин (0,11 мл, 1,36 ммоль) при комнатной температуре. После охлаждения до 0ºС добавляли раствор ацетилхлорида (50 мкл, 0,70 ммоль) в СН2Cl2 (5 мл), перемешивание продолжали 45 минут при комнатной температуре и растворитель удаляли в вакууме. Хроматография на силикагеле (гексан/этилацетат/NЕt3, 2:1:0,05) давала соединение 1 в виде белого твердого вещества (90 мг, 42%). Соединение 1: ЖХ/МС (10-99%) M/Z=338 [M+H]+, время удерживания 3,28 мин.
Другие соединения общей формулы I получали с помощью методов, в основном аналогичных описанным выше. Данные исследования этих соединений приведены в таблице 3 ниже, и номера соединений соответствуют соединениям, отображенным в таблице 2.
Таблица 3
Данные исследований образцов для соединений формулы I |
Соед. |
LC_MASS_РLUS |
| 15 |
308,40 |
| 16 |
306,00 |
| 164 |
320,00 |
| 194 |
389,20 |
| 195 |
404,20 |
| 198 |
302,00, 302,20, 302,00 |
| 202 |
328,20, 328,20, 328,00 |
| 241 |
268,30 |
| 250 |
346,00 |
| 252 |
310,00 |
| 253 |
344,00 |
| 254 |
319,00 |
| 255 |
333,00 |
| 256 |
348,00 |
| 257 |
319,00 |
| 258 |
289,80 |
| 259 |
249,80, 250,40 |
| 260 |
386,20 |
| 261 |
357,00 |
| 262 |
275,20 |
| 263 |
358,00 |
| 264 |
325,00 |
| 265 |
296,60, 296,40, 296,40 |
| 266 |
345,20 |
| 267 |
310,20, 310,00 |
| 268 |
351,00 |
| 269 |
310,00 |
| 270 |
340,10 |
| 271 |
298,10 |
| 272 |
314,00 |
| 273 |
328,20 |
| 274 |
284,00 |
| 275 |
300,10 |
| 276 |
328,10 |
| 277 |
286,90 |
| 278 |
306,00 |
| 279 |
280,20 |
| 280 |
380,00 |
| 281 |
334,00, 334,00 |
| 282 |
336,00 |
| 283 |
351,00 |
| 284 |
336,00, 336,00 |
| 285 |
322,00, 322,00, 322,00, 322,00 |
| 286 |
307,00 |
| 287 |
378,00 |
| 288 |
405,00 |
| 289 |
349,00 |
| 290 |
292,00 |
| 291 |
322,00 |
| 292 |
342,00 |
| 293 |
294,00 |
| 294 |
358,20 |
| 295 |
374,00 |
| 296 |
382,40 |
| 297 |
256,80 |
| 298 |
239,00 |
| 299 |
339,80 |
| 300 |
279,00 |
| 301 |
386,00 |
| 302 |
307,20 |
| 303 |
318,00 |
| 304 |
296,20 |
| 305 |
278,00 |
| 306 |
291,80 |
| 307 |
239,00 |
| 308 |
289,00 |
| 309 |
270,00 |
| 310 |
402,20 |
| 311 |
342,00 |
| 312 |
342,00 |
| 313 |
320,20 |
| 314 |
309,00 |
| 315 |
399,00 |
| 316 |
318,00 |
| 317 |
332,00 |
| 318 |
332,00 |
| 319 |
315,00 |
| 320 |
329,00 |
| 321 |
343,00 |
| 322 |
357,00 |
| 323 |
342,00 |
| 324 |
342,00 |
| 325 |
368,00, 368,10 |
| 326 |
352,00 |
| 327 |
369,80 |
| 328 |
456,20 |
| 329 |
381,80 |
| 330 |
384,00 |
| 331 |
395,80 |
| 332 |
322,00, 322,20 |
| 333 |
284,00 |
| 334 |
334,00 |
| 335 |
280,00 |
| 336 |
296,00 |
| 337 |
306,00 |
| 338 |
286,80 |
| 339 |
286,80 |
| 340 |
329,40 |
| 341 |
356,20 |
| 342 |
329,40 |
| 343 |
463,20 |
| 344 |
491,60 |
| 345 |
353,20 |
| 346 |
315,80 |
| 347 |
359,00 |
| 348 |
402,20 |
| 349 |
341,80 |
| 350 |
359,80 |
| 351 |
384,80 |
| 352 |
371,80 |
| 353 |
369,60 |
| 354 |
343,00 |
| 355 |
441,00 |
| 356 |
353,80 |
| 357 |
314,00 |
| 358 |
320,00 |
| 359 |
323,00 |
| 360 |
289,00 |
| 361 |
322,20 |
| 362 |
400,00 |
| 363 |
386,00 |
| 364 |
390,00 |
| 365 |
306,00 |
| 366 |
385,80 |
| 367 |
370,00 |
| 368 |
374,00 |
| 369 |
320,00 |
| 370 |
320,00 |
| 371 |
322,00 |
| 372 |
320,00 |
| 373 |
308,00, 308,00 |
| 374 |
340,00 |
| 375 |
356,00 |
| 376 |
280,20, 280,00 |
| 377 |
300,40, 300,00 |
| 378 |
282,00 |
| 379 |
326,20 |
| 380 |
351,20 |
| 381 |
338,20 |
| 382 |
336,20 |
| 383 |
309,20 |
| 384 |
407,40 |
| 385 |
334,20 |
| 386 |
323,40 |
| 387 |
380,20 |
| 388 |
294,00 |
| 389 |
350,00 |
| 390 |
345,00 |
| 391 |
326,00 |
| 392 |
352,80 |
| 393 |
323,00 |
| 394 |
286,00 |
| 395 |
344,00 |
| 396 |
340,00 |
| 397 |
326,00 |
| 398 |
314,00 |
| 399 |
312,00 |
| 400 |
343,20 |
| 401 |
354,00 |
| 402 |
340,00 |
| 403 |
282,00 |
| 404 |
285,00 |
| 405 |
283,20 |
| 406 |
292,00 |
| 407 |
464,00 |
| 408 |
298,00 |
| 409 |
273,00 |
| 410 |
326,20 |
| 411 |
326,20 |
| 412 |
356,00 |
| 413 |
359,20 |
| 414 |
355,00 |
| 415 |
338,00 |
| 416 |
370,00 |
| 417 |
328,00 |
| 418 |
298,20 |
| 419 |
279,80 |
| 420 |
281,80 |
| 421 |
340,90 |
| 422 |
269,30, 269,20 |
| 423 |
303,00 |
| 424 |
372,80 |
| 425 |
272,80 |
| 426 |
307,00 |
| 427 |
322,20 |
| 428 |
324,20 |
| 429 |
284,00, 285,00 |
| 430 |
286,00 |
| 431 |
429,00 |
| 432 |
439,00 |
| 433 |
443,00 |
| 434 |
456,00 |
| 435 |
486,00 |
| 436 |
326,20 |
| 437 |
328,00 |
| 438 |
253,00 |
| 439 |
257,00 |
| 440 |
299,20 |
| 441 |
273,00 |
| 442 |
414,40 |
| 443 |
286,00 |
| 444 |
302,20 |
| 445 |
330,00 |
| 446 |
328,20 |
| 447 |
355,40 |
| 448 |
412,00 |
| 449 |
286,00 |
| 450 |
338,20, 338,00 |
| 451 |
352,20 |
| 452 |
267,00 |
| 453 |
326,20 |
| 454 |
284,20 |
| 455 |
309,20 |
| 456 |
399,20 |
| 457 |
312,00 |
| 458 |
340,20 |
| 459 |
302,00 |
| 460 |
316,00 |
| 461 |
344,00 |
| 462 |
328,00 |
| 463 |
378,00 |
| 464 |
316,00 |
| 465 |
327,80 |
| 466 |
371,80, 371,60 |
| 467 |
355,60 |
| 468 |
356,80 |
| 469 |
359,00 |
| 470 |
435,20 |
| 471 |
368,00 |
| 472 |
344,00 |
| 473 |
282,20 |
| 474 |
281,20 |
| 475 |
355,00 |
| 476 |
302,20 |
| 477 |
316,20 |
| 478 |
344,20 |
| 479 |
328,20 |
| 480 |
378,00 |
| 481 |
316,20 |
| 482 |
282,00 |
| 483 |
286,00 |
| 484 |
328,00 |
| 485 |
324,20 |
| 486 |
353,80 |
| 487 |
377,80 |
| 488 |
365,00 |
| 489 |
339,80 |
| 490 |
267,00 |
| 491 |
281,00 |
| 492 |
310,20 |
| 493 |
352,20 |
| 494 |
342,00 |
| 495 |
328,00 |
| 496 |
402,20, 402,40 |
| 497 |
439,20 |
| 498 |
421,00 |
| 499 |
367,00 |
| 500 |
397,20 |
| 501 |
365,00 |
| 502 |
270,00 |
| 508 |
290,90 |
| 516 |
403,40 |
| 517 |
403,40 |
| 518 |
403,60 |
| 519 |
403,40 |
| 520 |
408,40 |
| 521 |
409,20 |
| 522 |
432,40 |
| 523 |
432,20 |
| 524 |
431,40 |
| 525 |
432,40 |
| 526 |
432,40 |
| 527 |
437,40 |
| 528 |
437,40 |
| 529 |
446,40 |
| 530 |
452,40 |
| 531 |
463,00 |
| 532 |
370,00 |
| 533 |
382,20 |
| 534 |
384,20 |
| 535 |
398,20 |
| 536 |
437,40 |
| 537 |
439,40 |
| 538 |
439,40 |
| 539 |
439,20 |
| 540 |
377,40 |
| 541 |
384,00 |
| 542 |
386,00 |
| 543 |
391,20 |
| 544 |
391,20 |
| 545 |
397,40 |
| 546 |
397,40 |
| 547 |
397,40 |
| 548 |
411,40 |
| 549 |
368,20 |
| 550 |
420,20 |
| 551 |
441,40 |
| 552 |
446,00 |
| 553 |
449,40 |
| 554 |
394,00 |
| 555 |
450,20 |
| 556 |
330,00 |
| 557 |
332,20 |
| 558 |
334,00 |
| 559 |
346,00 |
| 560 |
348,00 |
| 561 |
372,00 |
| 562 |
383,20 |
| 563 |
383,20 |
| 564 |
383,20 |
| 565 |
383,20 |
| 566 |
387,80 |
| 567 |
388,80 |
| 568 |
403,40 |
| 569 |
412,00 |
| 570 |
412,00 |
| 571 |
412,00 |
| 572 |
349,20 |
| 573 |
361,00 |
| 574 |
375,20 |
| 575 |
389,20 |
| 576 |
411,20 |
| 577 |
411,20 |
| 586 |
281,00 |
| 587 |
342,40 |
| 588 |
356,00 |
| 589 |
358,20 |
| 590 |
365,20, 365,20 |
| 591 |
369,20, 369,20 |
| 592 |
370,00 |
| 593 |
372,40 |
| 594 |
383,20, 383,20, 383,20, 383,20 |
| 595 |
384,00 |
| 596 |
391,20 |
| 597 |
397,40 |
| 598 |
337,80 |
| 599 |
350,00 |
| 600 |
352,00 |
| 601 |
376,00 |
| 602 |
387,20 |
| 603 |
391,80 |
| 604 |
393,00 |
| 605 |
416,00 |
| 606 |
416,20 |
| 607 |
416,00 |
| 608 |
353,00 |
| 609 |
415,20 |
| 610 |
415,20 |
| 611 |
416,20 |
| 612 |
421,00 |
| 613 |
430,20 |
| 614 |
431,20 |
| 615 |
436,20 |
| 616 |
447,00 |
| 617 |
459,20 |
| 618 |
493,00 |
| 619 |
353,80 |
| 620 |
353,80 |
| 621 |
365,80 |
| 622 |
367,80 |
| 623 |
367,80 |
| 624 |
367,80 |
| 625 |
383,00 |
| 626 |
409,40 |
| 627 |
421,00 |
| 628 |
423,20 |
| 629 |
423,20 |
| 630 |
423,20 |
| 631 |
429,20, 429,00 |
| 632 |
430,00 |
| 633 |
435,20 |
| 634 |
437,00 |
| 635 |
437,40 |
| 636 |
479,20 |
| 637 |
361,00 |
| 638 |
362,20 |
| 639 |
364,80 |
| 640 |
366,00 |
| 641 |
366,00 |
| 642 |
367,20 |
| 643 |
367,80 |
| 644 |
368,00 |
| 645 |
370,00 |
| 646 |
375,20 |
| 647 |
375,20 |
| 648 |
375,20 |
| 649 |
375,20 |
| 650 |
375,20 |
| 651 |
381,00 |
| 652 |
381,00 |
| 653 |
381,20 |
| 654 |
381,20 |
| 655 |
381,20 |
| 656 |
388,20 |
| 657 |
395,00 |
| 658 |
395,20 |
| 659 |
418,00 |
| 660 |
352,00 |
| 661 |
365,80 |
| 662 |
365,80 |
| 663 |
385,80 |
| 664 |
404,20 |
| 665 |
404,00 |
| 666 |
406,00 |
| 667 |
425,20 |
| 668 |
430,20 |
| 669 |
430,20 |
| 670 |
446,00 |
| 671 |
429,40 |
| 672 |
433,20 |
| 673 |
457,20 |
| 674 |
430,00 |
| 675 |
418,20 |
| 676 |
436,20 |
| 677 |
378,00 |
| 678 |
269,80 |
| 679 |
411,20 |
| 680 |
427,20 |
| 681 |
399,80 |
| 682 |
420,20 |
| 683 |
420,00 |
| 684 |
434,20 |
| 685 |
454,20 |
| 686 |
399,80 |
| 687 |
414,20 |
| 688 |
420,00 |
| 689 |
432,00 |
| 690 |
367,80, 367,80 |
| 691 |
323,00 |
| 692 |
324,00 |
| 693 |
326,00 |
| 694 |
326,00 |
| 695 |
326,00 |
| 696 |
338,00 |
| 697 |
340,00 |
| 698 |
342,00 |
| 699 |
342,00 |
| 700 |
349,00 |
| 701 |
353,20 |
| 702 |
353,00 |
| 703 |
353,00 |
| 704 |
353,20 |
| 705 |
353,20 |
| 706 |
354,00 |
| 707 |
354,00 |
| 708 |
356,00 |
| 709 |
355,80 |
| 710 |
355,80 |
| 711 |
367,00 |
| 712 |
367,20 |
| 713 |
367,20 |
| 714 |
367,20 |
| 715 |
368,00 |
| 716 |
367,80 |
| 717 |
371,80, 373,10 |
| 718 |
375,00 |
| 719 |
381,00 |
| 720 |
382,00 |
| 721 |
382,20 |
| 722 |
383,20 |
| 723 |
385,00 |
| 724 |
389,20 |
| 725 |
390,00 |
| 726 |
393,20 |
| 727 |
393,20 |
| 728 |
397,20 |
| 729 |
400,20 |
| 730 |
403,40 |
| 731 |
404,20 |
| 732 |
407,40 |
| 733 |
411,20 |
| 734 |
413,20 |
| 735 |
415,40 |
| 736 |
416,20 |
| 737 |
419,00 |
| 738 |
419,20 |
| 739 |
421,00 |
| 740 |
423,20 |
| 741 |
428,20 |
| 742 |
429,40 |
| 743 |
430,20 |
| 744 |
431,40 |
| 745 |
431,20 |
| 746 |
441,40 |
| 747 |
446,00 |
| 748 |
450,20 |
| 749 |
432,00 |
| 750 |
470,20 |
| 751 |
352,00 |
| 752 |
352,00 |
| 753 |
352,00 |
| 754 |
374,00 |
| 755 |
373,80 |
| 756 |
374,00 |
| 757 |
378,00 |
| 758 |
378,00 |
| 759 |
378,00 |
| 760 |
416,20 |
| 761 |
429,20 |
| 762 |
432,00 |
| 763 |
441,40 |
| 764 |
470,20 |
| 765 |
477,00 |
| 766 |
326,00 |
| 767 |
366,00 |
| 768 |
365,80 |
| 769 |
388,20 |
| 770 |
326,00 |
| 771 |
352,20 |
| 772 |
364,20 |
| 773 |
380,80 |
| 774 |
397,20 |
| 775 |
407,40 |
| 776 |
413,20 |
| 777 |
415,20 |
| 778 |
421,00 |
| 779 |
429,20 |
| 780 |
350,00 |
| 781 |
283,80 |
| 782 |
294,00 |
| 783 |
296,00 |
| 784 |
298,00 |
| 785 |
312,00 |
| 786 |
314,00 |
| 787 |
314,00 |
| 788 |
324,00 |
| 789 |
328,00 |
| 790 |
340,00 |
| 791 |
343,80 |
| 792 |
310,00 |
| 793 |
347,00 |
| 794 |
347,00 |
| 795 |
351,00 |
| 796 |
373,80 |
| 797 |
326,00 |
| 798 |
326,00 |
| 799 |
326,20 |
| 800 |
338,00 |
| 801 |
372,00 |
| 802 |
372,00 |
| 803 |
381,80 |
| 804 |
377,20 |
| 805 |
377,20 |
| 806 |
377,20 |
| 807 |
384,00 |
| 808 |
391,00 |
| 809 |
391,20 |
| 810 |
414,40 |
| 811 |
348,00 |
| 812 |
362,00 |
| 813 |
362,00 |
| 814 |
381,80 |
| 815 |
399,80 |
| 816 |
399,80 |
| 817 |
402,00 |
| 818 |
425,80 |
| 819 |
426,00 |
| 820 |
442,00 |
| 821 |
474,20 |
| 822 |
425,20 |
| 823 |
425,20 |
| 824 |
429,20 |
| 825 |
453,00 |
| 826 |
426,00 |
| 827 |
373,80 |
| 828 |
407,40 |
| 829 |
413,00 |
| 830 |
423,20 |
| 831 |
395,80 |
| 832 |
416,00 |
| 833 |
416,00 |
| 834 |
430,00 |
| 835 |
395,80 |
| 836 |
410,00 |
| 837 |
409,80 |
| 838 |
416,00 |
| 839 |
364,00, 364,00 |
| 840 |
439,20 |
| 841 |
319,00 |
| 842 |
319,80 |
| 843 |
321,80 |
| 844 |
321,80 |
| 845 |
322,00 |
| 846 |
334,00 |
| 847 |
336,20 |
| 848 |
337,80 |
| 849 |
337,80 |
| 850 |
344,80 |
| 851 |
349,20, 349,00 |
| 852 |
349,20 |
| 853 |
349,20 |
| 854 |
350,00 |
| 855 |
350,00 |
| 856 |
352,20 |
| 857 |
353,00 |
| 858 |
352,00 |
| 859 |
352,00 |
| 860 |
363,00 |
| 861 |
363,00 |
| 862 |
363,00 |
| 863 |
363,20 |
| 864 |
363,80, 364,00 |
| 865 |
364,00 |
| 866 |
363,80 |
| 867 |
370,80 |
| 868 |
373,20 |
| 869 |
377,00 |
| 870 |
378,00 |
| 871 |
379,20 |
| 872 |
385,20 |
| 873 |
385,80 |
| 874 |
385,80 |
| 875 |
389,20 |
| 876 |
389,20 |
| 877 |
392,80, 393,20, 393,30 |
| 878 |
396,20 |
| 879 |
398,20, 398,20 |
| 880 |
399,00 |
| 881 |
284,30 |
| 882 |
412,20 |
| 883 |
417,40 |
| 884 |
417,20 |
| 885 |
432,20 |
| 886 |
417,40 |
| 887 |
419,20 |
| 888 |
357,00 |
| 889 |
364,40 |
| 890 |
371,00 |
| 891 |
348,00, 348,20 |
| 892 |
360,20 |
| 893 |
386,20 |
| 894 |
393,20 |
| 895 |
409,00 |
| 896 |
417,40 |
| 897 |
425,00 |
| 898 |
346,00 |
| 899 |
412,40 |
| 900 |
426,20 |
| 901 |
427,40 |
| 902 |
443,20 |
| 903 |
455,20 |
| 904 |
489,20 |
| 905 |
350,20 |
| 906 |
350,20 |
| 907 |
362,00 |
| 908 |
364,00 |
| 909 |
364,00 |
| 910 |
364,00 |
| 911 |
378,60 |
| 912 |
405,60 |
| 913 |
419,40 |
| 914 |
419,20 |
| 915 |
425,00 |
| 916 |
431,40 |
| 917 |
433,40 |
| 918 |
433,40 |
| 919 |
475,20 |
| 920 |
358,20 |
| 921 |
361,00 |
| 922 |
362,00 |
| 923 |
362,00 |
| 924 |
363,20 |
| 925 |
364,00 |
| 926 |
366,00 |
| 927 |
371,20 |
| 928 |
371,40 |
| 929 |
371,20 |
| 930 |
377,20 |
| 931 |
377,20 |
| 932 |
368,00, 368,00 |
| 933 |
400,20 |
| 934 |
400,00 |
| 935 |
403,40 |
| 936 |
407,60 |
| 937 |
409,20 |
| 938 |
411,20 |
| 939 |
412,00 |
| 940 |
415,20 |
| 941 |
417,00 |
| 942 |
419,20 |
| 943 |
424,40 |
| 944 |
425,20 |
| 945 |
426,00 |
| 946 |
427,00 |
| 947 |
427,60 |
| 948 |
437,20 |
| 949 |
442,20 |
| 950 |
446,00 |
| 951 |
348,00 |
| 952 |
348,00 |
| 953 |
348,00 |
| 954 |
370,00 |
| 955 |
370,00 |
| 956 |
370,00 |
| 957 |
374,00 |
| 958 |
374,20 |
| 959 |
374,00 |
| 960 |
412,40 |
| 961 |
425,00, 425,00 |
| 962 |
430,00 |
| 963 |
437,60 |
| 964 |
440,00 |
| 965 |
466,40 |
| 966 |
473,00 |
| 967 |
364,20, 364,00 |
| 968 |
290,20 |
| 969 |
292,00 |
| 970 |
306,20 |
| 971 |
308,60 |
| 972 |
310,00 |
| 973 |
324,20 |
| 974 |
336,00 |
| 975 |
340,00 |
| 976 |
306,60 |
| 977 |
343,00 |
| 978 |
347,00 |
| 979 |
370,00 |
| 980 |
322,20 |
| 981 |
322,40, 322,00 |
| 982 |
356,00 |
| 983 |
368,40 |
| 984 |
368,00 |
| 985 |
378,20 |
| 986 |
405,60 |
| 987 |
409,40 |
| 988 |
416,20 |
| 989 |
420,00 |
| 990 |
423,40 |
| 991 |
427,40 |
| 992 |
429,20 |
| 993 |
431,40 |
| 994 |
435,40 |
| 995 |
439,20 |
| 996 |
445,20 |
| 997 |
447,00 |
| 998 |
466,40 |
| 999 |
432,40 |
| 1000 |
369,00 |
| 1001 |
381,00 |
| 1002 |
409,20 |
| 1003 |
431,60 |
| 1004 |
432,40 |
| 1005 |
509,40 |
| 1006 |
384,00 |
| 1007 |
384,00 |
| 1008 |
425,40 |
| 1009 |
445,20 |
| 1010 |
451,20 |
| 1011 |
452,40 |
| 1012 |
495,40 |
| 1013 |
381,00 |
| 1014 |
382,00 |
| 1015 |
411,20 |
| 1016 |
444,40 |
| 1017 |
457,40 |
| 1018 |
384,00 |
| 1019 |
352,40 |
| 1020 |
368,00 |
| 1021 |
391,20 |
| 1022 |
391,20 |
| 1023 |
328,40 |
| 1024 |
434,40 |
| 1025 |
382,00 |
| 1026 |
358,20 |
| 1027 |
369,20 |
| 1028 |
369,20 |
| 1029 |
383,20 |
| 1030 |
340,20 |
| 1031 |
409,40 |
| 1032 |
420,40 |
| 1033 |
368,00 |
| 1034 |
445,20 |
| 1035 |
330,40 |
| 1036 |
340,00 |
| 1037 |
356,00 |
| 1038 |
359,80 |
| 1039 |
363,20 |
| 1040 |
367,00 |
| 1041 |
390,00 |
| 1042 |
342,00 |
| 1043 |
342,60 |
| 1044 |
388,40 |
| 1045 |
343,80 |
| 1048 |
455,00 |
| 1049 |
338,00 |
| 1050 |
324,20 |
| 1051 |
433,60 |
| 1052 |
427,00 |
| 1053 |
443,20 |
| 1054 |
398,20 |
| 1055 |
435,20 |
| 1056 |
415,20 |
| 1057 |
417,40 |
| 1058 |
393,00 |
| 1059 |
361,00 |
| 1060 |
422,00 |
| 1065 |
385,20 |
| 1066 |
353,10 |
| 1067 |
354,10 |
| 1068 |
367,10 |
| 1069 |
380,90 |
| 1070 |
388,30 |
| 1071 |
353,10 |
| 1072 |
368,10 |
| 1073 |
410,00 |
| 1074 |
383,90 |
| 1075 |
429,10 |
| 1083 |
352,00, 351,90, 352,30, 352,20, 352,30, 352,30, 352,00 |
| 1084 |
350,00 |
| 1085 |
363,00 |
| 1086 |
377,00 |
| 1087 |
384,00, 384,00 |
| 1088 |
380,00 |
| 1089 |
362,00 |
| 1090 |
410,00 |
| 1091 |
426,00 |
| 1092 |
370,00 |
| 1101 |
293,00 |
| 1102 |
307,00 |
| 1103 |
334,00 |
| 1106 |
374,10, 374,00 |
| 1107 |
379,30 |
| 1108 |
421,10, 421,00, 421,00 |
| 1109 |
435,50 |
| 1110 |
407,50 |
| 1111 |
399,30 |
| 1112 |
413,30 |
| 1113 |
427,30 |
| 1114 |
391,30 |
| 1115 |
405,50 |
| 1116 |
377,30 |
| 1117 |
441,50, 441,00 |
| 1118 |
410,90 |
| 1119 |
335,90 |
| 1120 |
355,80, 355,90 |
| 1121 |
394,90 |
| 1122 |
407,50 |
| 1123 |
343,00, 341,90 |
| 1124 |
427,10 |
| 1125 |
396,00 |
| 1127 |
461,30 |
| 1128 |
393,80 |
| 1133 |
443,00 |
| 1134 |
419,80 |
| 1135 |
453,00 |
| 1136 |
378,00 |
| 1137 |
463,00, 463,00 |
| 1138 |
457,00 |
| 1141 |
504,00 |
| 1142 |
420,20 |
| 1143 |
422,20 |
| 1144 |
436,00 |
| 1145 |
448,20 |
| 1146 |
370,10 |
| 1147 |
457,50 |
| 1148 |
463,10, 463,10 |
| 1151 |
435,80 |
| 1152 |
450,00 |
| 1153 |
407,60 |
| 1155 |
518,10 |
| 1156 |
482,00 |
| 1157 |
485,50 |
| 1158 |
432,20 |
| 1159 |
473,10 |
| 1160 |
432,20 |
| 1161 |
468,50 |
| 1162 |
393,80 |
| 1163 |
444,00 |
| 1164 |
450,00 |
| 1165 |
511,00 |
| 1166 |
467,00 |
| 1167 |
363,30 |
| 1168 |
463,00 |
| 1169 |
482,00 |
| 1170 |
415,00 |
| 1171 |
467,00 |
| 1172 |
511,00 |
| 1173 |
491,00 |
| 1174 |
495,00 |
| 1175 |
365,90 |
| 1176 |
380,30 |
| 1179 |
321,80 |
| 1180 |
560,00 |
| 1181 |
337,20 |
| 1182 |
280,00 |
| 1183 |
259,20 |
| 1184 |
500,20, 500,20, 500,20 |
| 1185 |
353,00 |
| 1186 |
526,80 |
| 1190 |
350,20 |
| 1191 |
392,00 |
| 1192 |
376,00 |
| 1193 |
404,20 |
| 1194 |
462,20 |
| 1195 |
427,20 |
| 1196 |
407,40 |
| 1197 |
391,10 |
Методы:
(А) 4-канальный ЖХ/МС Micromass MUC LCT, насос Waters 60F, автоматический пробоотборник Gilson 215 4, инъекционный модуль Gilson 849, объемный расход 1,5 мл/мин/колонка, градиент 10-99% CH3CN (0,035% TFA)/H2O (0,05% TFA), колонки Phenomenex Luna 5 C18 (50×4,60 мм), УФ-детектор Waters MUX UV-2488, детекторы Cedex 75 ELSD. C18 (50×4,60 мм), УФ-детектор Waters MUX UV-2488, детекторы Cedex 75 ELSD.
(B) PESciex API-150-EX ЖХ/МС, насосы Shimadzu LC-8A, автоматический пробоотборник Gilson 215, инъекционный модуль Gilson 819, объемный расход 3,0 мл/мин, градиент 10-99% CH3CN (0,035% TFA)/H2O (0,05% TFA), колонка Phenomenex Luna 5 C18 (50×4,60 мм), детектор Shimadzu SPD-10A UV/Vis, детектор Cedex 75 ELSD. C18 (50×4,60 мм), детектор Shimadzu SPD-10A UV/Vis, детектор Cedex 75 ELSD.
(С) PESciex API-150-EX ЖХ/МС, насосы Shimadzu LC-8A, автоматический зондовый пробоотборник Gilson 215, инъекционный модуль Gilson 819, объемный расход 3,0 мл/мин, градиент 40-99% CH3CN (0,035% TFA)/H2O (0,05% TFA), колонка Phenomenex Luna 5 C18 (50×4,60 мм), детектор Shimadzu SPD-10A UV/Vis, детектор Cedex 75 ELSD. C18 (50×4,60 мм), детектор Shimadzu SPD-10A UV/Vis, детектор Cedex 75 ELSD.
АНАЛИЗЫ ДЛЯ ОПРЕДЕЛЕНИЯ И ИЗМЕРЕНИЯ СВОЙСТВ СОЕДИНЕНИЙ ИНГИБИРОВАТЬ NaV
(А) Оптические методы оценки ингибиторных свойств соединений в отношении NaV
Соединения изобретения полезны в качестве антагонистов потенциалозависимых натриевых ионных каналов. Антагонистические свойства испытуемых соединений оценивались следующим образом. Клетки, экспрессирующие NаV, представляющие интерес, помещали на микротитровальные планшеты. После инкубационного периода клетки окрашивали флуоресцентными красителями, чувствительными к трансмембранному потенциалу. В микротитровальные планшеты добавляли испытуемые соединения. Клетки стимулировали или химическими, или электрическими средствами для того, чтобы вызвать изменение NaV зависимого мембранного потенциала от неблокированных каналов, которое определяли и измеряли с помощью трансмембранных потенциалчувствительных красителей. Антагонисты детектировали по понижению мембранного потенциала в ответ на стимул. Для оптического анализа мембранного потенциала использовали потенциалчувствительные сенсоры FRET, описанные Gonzalez и Tsien (см. Gonzalez, J. E. and R. Y. Tsien (1995)  Voltage sеnsing by fluorescence resonаnce energy transfer in single cells Voltage sеnsing by fluorescence resonаnce energy transfer in single cells Biophys J69(4): 1272-80, и Gonzalez, J. E. and R. Y. Tsien (1997) Biophys J69(4): 1272-80, и Gonzalez, J. E. and R. Y. Tsien (1997)  Improved indicators of cell membrane potential that use fluorescence resonance energy transfer Improved indicators of cell membrane potential that use fluorescence resonance energy transfer Chem Biol4(4): 269-77) в сочетании с контрольно-измерительным прибором для измерения изменений флуоресценции, такого как Voltage/Ion Probe Reader (VIPR®) (см. Gonzalez, J. E., K. Oades et al. (1999) Chem Biol4(4): 269-77) в сочетании с контрольно-измерительным прибором для измерения изменений флуоресценции, такого как Voltage/Ion Probe Reader (VIPR®) (см. Gonzalez, J. E., K. Oades et al. (1999)  Cell-based assays and instrumentaion for screening ion-channel targets Cell-based assays and instrumentaion for screening ion-channel targets Drug Discov Today4(9): 431-439). Drug Discov Today4(9): 431-439).
(В) Метод VIPR® оптического анализа мембранного потенциала с химическим стимулированием
Обработка клеток и нагружение красителем
За 24 часа до анализа на VIPR СНО клетки, эндогенно экспрессирующие потенциалозависимый NaV типа NaV1.2, высевали на 96-луночные покрытые полилизином планшеты в количестве 60000 клеток на лунку. Другие подтипы выполнялись аналогичным образом на представляющей интерес линии клеток, экспрессирующих NaV.
1) В день анализа среду откачивали разрежением и клетки промывали дважды 225 мкл промывочного раствора #2 (BS#2).
2) Приготавливали 15 мкМ CC2-DMPE раствор смешением 5мМ кумаринового базового раствора с 10% плуроник 127, 1:1, а затем растворением смеси в соответствующем объеме BS#2.
3) После того как промывочный раствор удаляли из 96-луночных планшетов, клетки погружали в 80 мкл CC2-DMPE раствора. Планшеты инкубировали в темноте в течение 30 минут при комнатной температуре.
4) Пока клетки окрашивались кумарином, приготавливали 15 мкл раствор оксолона в BS#2. Помимо DiSBAC2(3), данный раствор должен содержать 0,75 мМ ABSCl и 30 мкл вератридина (полученного из 10 мМ базового EtOH, Sigma #V-5754).
5) Через 30 минут CC2-DMPE удаляли и клетки промывали дважды 225 мкл BS#2. Как и прежде остаточный объем должен быть 40 мкл.
6) После удаления промывочной ванны клетки погружали в 80 мкл раствора DiSBAC2(3), после чего для достижения желаемой концентрации в опыте в каждую лунку планшета добавляли испытуемое соединение, растворенное в ДМСО, с добавлением лекарства и тщательно смешивали. Объем в лунке должен быть грубо 121 мкл. Клетки затем инкубировали в течение 20-30 минут.
7) После того как инкубирование завершено, клетки готовы для анализа на VIPR® по протоколу после добавления натрия. Добавляли 120 мкл промывочного раствора #1 для стимуляции NaV зависимой деполяризации. В качестве положительного контрольного антагониста для блокирования NaV каналов использовали 200 мкл тетракаина.
Данные анализа VIPR®
Данные анализировали и приводили в виде нормализованных соотношений интенсивностей испускания с вычетом фона, измеренных в 460 нм и 580 нм каналах. Интенсивности фона затем вычитаются из каждого анализируемого канала. Интенсивности фона получают путем измерения интенсивностей испускания в те же периоды времени от идентично обработанных аналитических лунок, в которых нет клеток. Ответная реакция как функция времени затем приводится в виде соотношений, полученных с использованием следующей формулы:

Данные затем преобразуются путем вычисления соотношений начальной (Ri) и конечной (Rf) реакций. Эти соотношения представляют средние величины соотношений в течение части или всего предстимуляционного периода и во время точек взятия проб в течение стимуляционного периода. Затем вычисляется ответная реакция на стимул R=Rf/Ri. Для временных окон анализа после добавления Na+ базисная линия составляет 2-7 сек, и выборка конечной ответной реакции производится через 15-24 сек.
Контрольные ответные реакции получают с помощью выполнения анализов в присутствии соединения с желаемыми свойствами (положительный контроль), такого как тетракаин, и в отсутствие фармакологических агентов (отрицательный контроль). Ответы на отрицательный (N) и положительный (P) контроли вычисляются, как выше. Активность А соединения антагониста определяется следующим образом: 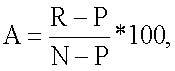 где R представляет пропорциональную ответную реакцию испытываемого соединения. где R представляет пропорциональную ответную реакцию испытываемого соединения.
Растворы [мМ]
Промывочный раствор #1: NaCl 160, KCl 4,5, CaCl2 2, MgCl2 1, HEPES 10, pH 7,4, с NaOH.
Промывочный раствор #2: ТМА-Cl 160, CaCl2 0,1, MgCl2 1, HEPES 10, pH 7,4, с КОН (конечная концентрация К 5 мМ). 5 мМ).
СС2-DMPE: приготовлен в виде 5 мМ базового раствора в ДМСО и хранился при -20оС.
DiSBAC2(3): приготовлен в виде 12 мМ базового раствора в ДМСО и хранился при -20оС.
ABSCl: приготовлен в виде 200 мМ базового раствора в дистиллированной воде и хранился при комнатной температуре.
Культура клеток
СНО клетки выращиваются в DMEM (среда Игла, модифицированная по Дульбекко; GibcoBRL #10569-010) с добавлением 10% FBS (фетальная бычья сыворотка, разбавленная; GibcoBRL #16140-071) и 1% Pen-Strep (пенициллин-стрептомицин; GibcoBRL#15140-122). Клетки выращиваются в емкостях с вентилируемыми крышками при 90% влажности и 10% СО2 до 100% слияния. Они обычно разделяются с помощью трипсинизации 1:10 или 1:20 в зависимости от плановых нужд и выращиваются в течение 2-3 дней перед следующим разделением.
C) Метод VIPR® оптического анализа мембранного потенциала с электрической стимуляцией
Следующее ниже является примером того, как измеряется активность ингибирования NaV1.3 с использованием метода оптического мембранного потенциала #2. Другие подтипы выполняются аналогичным образом на линии представляющих интерес клеток, экспрессирующих NaV.
Клетки НЕК293, экспрессирующие NaV1.3, помещаются на 96-луночные микротитровальные планшеты. После соответствующего инкубационного периода клетки окрашиваются потенциалчувствительными красителями СС2-DMPE/DiSBAС2(3) следующим образом.
Реагенты:
100 мг/мл плуроник F-127 (Sigma #P2443) в безводном ДМСО
10 мМ DiSBAС2(3) (Aurora #00-100-010) в безводном ДМСО
10 мМ CC2-DMPE (Aurora #00-100-008) в безводном ДМСО
200 мМ ABSCl в воде
Сбалансированный солевой раствор Хэнка (Hyclone #SH30268.02) с добавлением 10 мМ HEPES (Gibco #15630-080)
Протокол погружения:
2Х СС2-DMPE=20 мкМ CC2-DMPE: 10 мМ CC2-DMPE перемешивают с эквивалентным объемом 10% плуроника с последующим перемешиванием в требуемом количестве HBSS, содержащем 10 мМ HEPES. Каждая планшета с клетками требует 5 мл 2Х СС2-DMPE. В лунки, содержащие промытые клетки, добавляется 50 мкл 2Х СС2-DMPE, давая в результате 10 мкМ конечную концентрацию окрашивания. Клетки окрашивают в течение 30 минут в темноте при комнатной температуре.
2X DISBAC2(3) с ABSCl=6 мкМ DISBAC2(3) и 1 мМ ABSCl: Требуемое количество 10 мМ DISBAC2(3) добавляют в 50 мл конический тюбик и смешивают с 1 мкл 10% плуроника на каждый миллилитр раствора для совместного составления и перемешивания. Затем добавляют HBSS/HEPES для получения 2Х раствора. Наконец добавляют ABSCl.
Для сольватирования соединения на планшетах может использоваться 2X DiSBAC2(3) раствор. Следует заметить, что планшеты с соединением получают с 2Х концентрацией лекарства. Окрашенные планшеты снова промывают, оставляя остаточный объем 50 мкл. Добавляют 50 мкл/лунку 2X DiSBAC2(3) w/ABSCl. Окрашивают в течение 30 минут в темноте при комнатной температуре.
Прибор для электростимуляции и методы использования описаны в ION Channel Assay Methods PCT/US01/21652, приведенной здесь для сведения. Прибор включает манипулятор для микротитровальной планшеты, оптическую систему для возбуждения кумаринового красителя с одновременной регистрацией испускания кумарина и оксонола, генератор формы волны, усилитель регулируемого тока или напряжения и приспособления для введения электродов в лунку. Под интегрированным или объединенным компьютерным контролем данный прибор проходит запрограммированные пользователем протоколы электрического стимула по отношению к клеткам внутри лунок микротитровального планшета.
Реагенты
Аналитический буфер #1
140 мМ NaCl, 4,5 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, 10 мМ HEPES, 10 мМ глюкоза, рН 7,40, 330 mOsm
Исходный плуроник (1000Х): 100 мг/мл плуроника 127 в безводном ДМСО
Исходный оксонол (3333Х): 10 мМ DiSBAC2(3) в безводном ДМСО
Исходный кумарин (1000Х): 10 мМ CC2-DMPE в безводном ДМСО
Исходный ABSCl (400Х): 200 мМ ABSCl в воде
Протокол анализа
1. Ввести или использовать элетроды в каждой анализируемой лунке.
2. Использовать усилитель регулируемого тока для подачи стимуляционных волновых импульсов в течение 3 сек. Проводится двухсекундная предстимуляционная регистрация для получения нестимулированных интенсивностей. Проводится пятисекундная постстимуляционная регистрация для оценки релаксации до состояния покоя.
Анализ данных
Данные анализируются и приводятся в виде нормализованных соотношений интенсивностей испускания с вычетом фона, измеренных в 460 нм и 580 нм каналах. Интенсивности фона затем вычитаются из каждого анализируемого канала. Интенсивности фона получают путем измерения интенсивностей испускания в те же периоды времени от идентично обработанных аналитических лунок, в которых нет клеток. Ответная реакция как функция времени затем приводится в виде соотношений, полученных с использованием следующей формулы:

Данные затем преобразуются путем вычисления соотношений начальной (Ri) и конечной (Rf) реакций. Эти соотношения представляют средние величины соотношений в течение части или всего предстимуляционного периода и во время точек взятия проб в течение стимуляционного периода. Затем вычисляется ответная реакция на стимул R=Rf/Ri.
Контрольные ответные реакции получают путем проведения анализов в присутствии соединения с желаемыми свойствами (положительный контроль), такого как тетракаин, и в отсутствие фармакологических агентов (отрицательный контроль). Ответы на отрицательный (N) и положительный (P) контроли вычисляются, как выше. Активность А соединения антагониста определяется следующим образом: 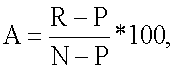 где R представляет пропорциональную ответную реакцию испытываемого соединения. где R представляет пропорциональную ответную реакцию испытываемого соединения.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ АНАЛИЗЫ НА NaV АКТИВНОСТЬ И ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ ИСПЫТУЕМЫХ СОЕДИНЕНИЙ
Для оценки эффективности и селективности блокаторов натриевых каналов в нейронах дорзального корневого ганглия использовалась электрофизиология фиксации потенциала. Нейроны крыс выделяли из дорзальных корневых ганглиев и содержали в культуре в течение 2-10 дней в присутствии NGF (50 нг/мл) (культуральная среда состояла из NeurobasalA с добавлением В27, глутамина и антибиотиков). Нейроны малого диаметра (ноцицепторы, 8-12 мкм в диаметре) идентифицировали визуально и зондировали тонкоконечными стеклянными электродами, соединенными с усилителем (Axon Instruments). Для оценки IC50 (ИК50) соединений, содержащихся в клетках, при -60 мВ использовался способ  фиксации потенциала фиксации потенциала . В дополнение для испытания эффективности соединений на блокирующее действие на генерирование потенциала в ответ на текущие инъекции применялся способ . В дополнение для испытания эффективности соединений на блокирующее действие на генерирование потенциала в ответ на текущие инъекции применялся способ  токопроводящего зажима токопроводящего зажима . Результаты данных экспериментов способствуют определению профиля эффективности соединений. . Результаты данных экспериментов способствуют определению профиля эффективности соединений.
Анализ ФИКСАЦИИ ПОТЕНЦИАЛА на DRG нейронах
Регистрировались ТТХ-устойчивые натриевые потоки от соматы DRG (дорзальный корневой ганглий) с использованием цельноклеточной разновидности метода фиксации потенциала. Регистрация проводилась при комнатной температуре (примерно 22оС) с толстостенными электродами из борсиликатного стекла (WPI; сопротивление 3-4 М ) с использованием усилителя Axopatch 200В (Axon Instruments). После установления конфигурации цельных клеток перед началом регистрации давали приблизительно 15 минут для уравновешивания пипеточного раствора в клетках. Токи фильтровали при медленном прохождении между 2-5 кГц и отбирали образцы при 10 кГц. На протяжении эксперимента серийное сопротивление компенсировалось на 60-70% и непрерывно контролировалось. Потенциал соединения жидкости (-7 мВ) между внутриклеточным пипеточным раствором и наружным регистрирующим раствором не принимался в расчет для анализа данных. Испытуемые растворы применялись к клеткам с помощью приводимой в движение силой тяжести системы быстрой перфузии (SF-77; Warner Instruments). ) с использованием усилителя Axopatch 200В (Axon Instruments). После установления конфигурации цельных клеток перед началом регистрации давали приблизительно 15 минут для уравновешивания пипеточного раствора в клетках. Токи фильтровали при медленном прохождении между 2-5 кГц и отбирали образцы при 10 кГц. На протяжении эксперимента серийное сопротивление компенсировалось на 60-70% и непрерывно контролировалось. Потенциал соединения жидкости (-7 мВ) между внутриклеточным пипеточным раствором и наружным регистрирующим раствором не принимался в расчет для анализа данных. Испытуемые растворы применялись к клеткам с помощью приводимой в движение силой тяжести системы быстрой перфузии (SF-77; Warner Instruments).
Взаимозависимость доза-ответ определялась по методу фиксации потенциала (напряжения) при повторной деполяризации клеток от экспериментального удельного потенциала удерживания до опытного потенциала +10 мВ каждые 60 секунд. Перед переходом к следующей опытной концентрации блокирующие эффекты наносились на плоскость.
Растворы
Bнутриклеточный раствор (в мМ): Cs-F (130), NaCl (10), MgCl2 (1), EGTA (1,5), CaCl2(0,1), HEPES (10), глюкоза (2), рН=7,42, 290 mOsm.
Bнеклеточный раствор (в мМ): NaCl (138), CaCl2(1,26), KCl (5,33), KH2PO4 (0,44), MgCl2 (0,5), MgSO4 (0,41), NaHCO3 (4), Na2HPO4 (0,3), глюкоза (5,6), HEPES (10), CdCl2 (0,4), NiCl2 (0,1), TTX (0,25×10-3).
Анализ ТОКОПРОВОДЯЩИМ ЗАЖИМОМ на активность соединений по ингибированию NaV канала
Клетки замыкали по току токопроводящим зажимом в цельноклеточную конфигурацию с помощью усилителя Multiplamp 700А (Axon Inst). Борсиликатные пипетки (4-5 Мohm) заполнялись (в мМ): 150 К-глюконатом, 10 NaCl, 0,1 EGTA, 10 Hepes, 2 MgCl2 (забуференным до pH 7,34 с помощью KOH). Клетки промывали в (в мМ): 140 NaCl, 3 KCl, 1 MgCl, 1 CaCl2 и 10 Hepes. Перед закупориванием пипеточный потенциал доводили до нуля; в течение процесса потенциалы соединения жидкости не корректировались. Регистрацию производили при комнатной температуре.
После данных процедур было найдено, что характерные представители соединений настоящего изобретения обладают желаемой активностью и селективностью в отношении потенциалозависимого натриевого канала.
АНАЛИЗЫ ОПРЕДЕЛЕНИЯ И ИЗМЕРЕНИЯ СВОЙСТВ СОЕДИНЕНИЙ ПО ИНГИБИРОВАНИЮ СаV
А) Оптические методы анализирования СаV ингибирующих свойств соединений
Соединения изобретения являются полезными в качестве антагонистов потенциалозависимых кальциевых ионных каналов. Антагонистические свойства испытуемых соединений оценивались следующим образом. Клетки, экспрессирующие СаV, представляющие интерес, помещались на микротитровальные планшеты. После инкубационного периода клетки окрашивались флуоресцентными красителями, чувствительными к трансмембранному потенциалу. В микротитровальные планшеты добавлялись испытуемые соединения. Клетки стимуливались электрическими средствами для того, чтобы вызвать изменение СaV зависимого мембранного потенциала от неблокированных каналов, которое детектировалось и измерялось с помощью трансмембранных потенциалчувствительных красителей. Антагонисты детектировались как ответная реакция с пониженным мембранным потенциалом на стимул. Для оптического анализа мембранного потенциала использовались потенциалчувствительные сенсоры FRET, описанные авторами Gonzalez и Tsien (см. Gonzalez, J. E. and R. Y. Tsien (1995)  Voltage sеnsing by fluorescence resonsnce energy transfer in single cells Voltage sеnsing by fluorescence resonsnce energy transfer in single cells Biophys J69(4): 1272-80, и Gonzalez, J. E. and R. Y. Tsien (1997) Biophys J69(4): 1272-80, и Gonzalez, J. E. and R. Y. Tsien (1997)  Improved indicators of cell membrane potential that use fluorescence resonance energy transfer Improved indicators of cell membrane potential that use fluorescence resonance energy transfer Chem Biol4(4): 269-77), в сочетании с контрольно-измерительным инструментом для измерения изменений флуоресценции, таким как Voltage/Ion Probe Reader (VIPR®) (см. Gonzalez, J. E., K. Oades et al. (1999) Chem Biol4(4): 269-77), в сочетании с контрольно-измерительным инструментом для измерения изменений флуоресценции, таким как Voltage/Ion Probe Reader (VIPR®) (см. Gonzalez, J. E., K. Oades et al. (1999)  Cell-based assays and instrumentation for screening ion-channel targets Cell-based assays and instrumentation for screening ion-channel targets Drug Discov Today4(9): 431-439). Drug Discov Today4(9): 431-439).
Метод VIPR® оптического анализа мембранного потенциала с электрической стимуляцией
Следующее ниже является примером того, как измеряется активность ингибирования СaV2.2 с использованием метода оптического мембранного потенциала. Другие подтипы выполняются аналогичным образом на линии представляющих интерес клеток, экспрессирующих СaV.
Клетки НЕК293, стабильно экспрессирующие СaV2.2, помещаются на 96-луночные микротитровальные планшеты. После соответствующего инкубационного периода клетки окрашиваются потенциалчувствительными красителями СС2-DMPE/DiSBAC2(3) следующим образом.
Реагенты:
100 мг/мл Плуроник F-127 (Sigma #P2443) в безводном ДМСО
10 мМ DiSBАС6(3) (Aurora #00-100-010) в безводном ДМСО
10 мМ CC2-DMPE (Aurora #00-100-008) в безводном ДМСО
200 мМ Кислотный Желтый 17 (Aurora #VABSC) в воде
370 мМ хлорид бария (Sigma Cat# B6394) в воде
Раствор Х
160 мМ NaCl (Sigma Cat# S-9888)
4,5 мМ KCl (Sigma Cat# P-5405)
1 мМ MgCl2 (Fluka Cat# 63064)
10 мМ HEPES (Sigma Cat# H-4034)
рН 7,4 с использованием NaOH
Протокол погружения
2Х СС2-DMPE=20 мкМ CC2-DMPE: 10 мМ CC2-DMPE подвергается вращению с эквивалентным объемом 10% плуроника с последующим вращением в требуемом количестве HBSS, содержащем 10 мМ HEPES. Каждый планшет с клетками требует 5 мл 2Х СС2-DMPE. В лунки, содержащие промытые клетки, добавляется 50 мкл 2Х СС2- DMPE, давая в результате 10 мкМ конечную концентрацию окрашивания. Клетки окрашиваются в течение 30 минут в темноте при комнатной температуре.
2X СС2DMPE & DISBAC6(3)=8 мкМ СС2DMPE & 2,5 мкМ DISBAC6(3): Подвергают вращению вместе оба красителя с эквивалентным объемом 10% плуроника (в ДМСО). Производят вращение в требуемом объеме Раствора Х с бета-циклодекстрином. Каждый 96-луночный планшет с клетками требует 5 мл 2XCC2DMPE. Промывают планшет ELx405 с Раствором Х, оставляя остаточный объем 50 мкл/лунку. Добавляют 50 мкл 2XСС2DMPE & DISBAC6(3) в каждую лунку. Окрашивают в течение 30 минут в темноте при комнатной температуре.
1.5X AY17=750 мкМ AY17 с 15 мМ BaCl2: Добавляют Кислотный Желтый 17 в сосуд, содержащий Раствор Х. Хорошо смешивают. Дают раствору отстаиваться в течение 10 минут. Медленно смешивают с 370 мМ ВаС12. Данный раствор можно использовать для сольватирования соединения на планшетах. Заметьте, что планшеты с соединением изготавливаются с 1,5Х концентрацией лекарства, а не с обычной 2Х. Промывают окрашенную СС2 планшету снова, оставляя остаточный объем 50 мкл. Добавляют 100 мкл/лунку раствора AY17. Окрашивают в течение 15 минут в темноте при комнатной температуре. Проводят работу с планшетой на оптическом считывающем устройстве.
Прибор для электростимуляции и методы использования описаны в ION Channel Assay Methods PCT/US01/21652, приведенной здесь для сведения. Прибор включает манипулятор для микротитровальной планшеты, оптическую систему для возбуждения кумаринового красителя с одновременной регистрацией испускания кумарина и оксонола, генератор формы волны, усилитель регулируемого тока или напряжения и приспособление для вставления электродов в лунку. Под интегрированным или объединенным компьютерным контролем данный прибор проходит запрограммированные пользователем протоколы электрического стимула по отношению к клеткам внутри лунок микротитровальной планшеты.
Протокол анализа
Ввести или использовать электроды в каждой анализируемой лунке.
Используют усилитель регулируемого тока для подачи стимуляционных волновых импульсов в течение 3-5 сек. Проводится двухсекундная предстимуляционная регистрация для получения нестимулированных интенсивностей. Проводится пятисекундная постстимуляционная регистрация для оценки релаксации до состояния покоя.
Анализ данных
Данные анализируются и приводятся в виде нормализованных соотношений интенсивностей испускания с вычетом фона, измеренных в 460 нм и 580 нм каналах. Интенсивности фона затем вычитаются из каждого анализируемого канала. Интенсивности фона получают путем измерения интенсивностей испускания в те же периоды времени от идентично обработанных аналитических лунок, в которых нет клеток. Ответная реакция как функция времени затем приводится в виде соотношений, полученных с использованием следующей формулы:

Данные затем преобразуются путем вычисления соотношений начальной (Ri) и конечной (Rf) реакций. Эти соотношения представляют средние величины соотношений в течение части или всего предстимуляционного периода и во время точек взятия проб в течение стимуляционного периода. Затем вычисляется ответная реакция на стимул R=Rf/Ri.
Контрольные ответные реакции получают путем проведения анализов в присутствии соединения с желаемыми свойствами (положительный контроль), такого как мибефрадил, и в отсутствие фармакологических агентов (отрицательный контроль). Ответы на отрицательный (N) и положительный (P) контроли вычисляются, как выше. Активность А соединения антагониста определяется следующим образом: 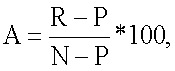 где R представляет пропорциональную ответную реакцию испытуемого соединения. где R представляет пропорциональную ответную реакцию испытуемого соединения.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ АНАЛИЗЫ НА СaV АКТИВНОСТЬ И ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ ИСПЫТУЕМЫХ СОЕДИНЕНИЙ
Для оценки эффективности и селективности блокаторов кальциевых каналов, экспрессированных в НЕК293 клетках, использовалась электрофизиология фиксации потенциала. Клетки НЕК293, экспрессирующие СаV2.2, идентифицировались визуально и зондировались тонкоконечными стеклянными электродами, соединенными с усилителем (Axon Instruments). Для оценки IC50 (ИК50) соединений, содержащихся в клетках, при -100 мВ использовалcя способ  фиксации потенциала фиксации потенциала . Результаты данных экспериментов способствуют определению профиля эффективности соединений. . Результаты данных экспериментов способствуют определению профиля эффективности соединений.
Анализ ФИКСАЦИИ ПОТЕНЦИАЛА в НЕК293 клетках, экспрессирующих СаV2.2
Регистрировались потоки СаV2.2 из НЕК293 клеток с использованием цельноклеточной разновидности приема фиксации потенциала. Регистрация проводилась при комнатной температуре (примерно 22оС) с толстостенными электродами из борсиликатного стекла (WPI; сопротивление 3-4 М ) с использованием усилителя Axopatch 200В (Axon Instruments). После установления конфигурации цельных клеток перед началом регистрации давали приблизительно 15 минут для уравновешивания пипеточного раствора в клетках. Потоки фильтровались при медленном прохождении между 2-5 кГц и отбирались образцы при 10 кГц. На протяжении эксперимента серийное сопротивление компенсировалось на 60-70% и непрерывно контролировалось. Потенциал соединения жидкости (-7 мВ) между внутриклеточным пипеточным раствором и наружным регистрирующим раствором не принимался в расчет для анализа данных. Испытуемые растворы применялись к клеткам с помощью приводимой в движение силой тяжести системы быстрой перфузии (SF-77; Warner Instruments). ) с использованием усилителя Axopatch 200В (Axon Instruments). После установления конфигурации цельных клеток перед началом регистрации давали приблизительно 15 минут для уравновешивания пипеточного раствора в клетках. Потоки фильтровались при медленном прохождении между 2-5 кГц и отбирались образцы при 10 кГц. На протяжении эксперимента серийное сопротивление компенсировалось на 60-70% и непрерывно контролировалось. Потенциал соединения жидкости (-7 мВ) между внутриклеточным пипеточным раствором и наружным регистрирующим раствором не принимался в расчет для анализа данных. Испытуемые растворы применялись к клеткам с помощью приводимой в движение силой тяжести системы быстрой перфузии (SF-77; Warner Instruments).
Взаимозависимость доза-ответ определялась по методу фиксации потенциала (напряжения) при повторной деполяризации клеток от экспериментального удельного потенциала удерживания до опытного потенциала +20 мВ в течение 50 мин при частотах 0,1, 1,5, 10, 15 и 20 Гц. Перед переходом к следующей опытной концентрации блокирующие эффекты наносились на плоскость.
Растворы
Bнутриклеточный раствор (в мМ): Cs-F (130), NaCl (10),
MgCl2 (1), EGTA (1,5), CaCl2 (0,1), HEPES (10), глюкоза (2), рН=7,42, 290 mOsm.
Bнеклеточный раствор (в мМ): NaCl (138), ВaCl2 (10), KCl (5,33), KH2PO4 (0,44), MgCl2 (0,5), MgSO4 (0,41), NaHCO3 (4), Na2HPO4 (0,3), глюкоза (5,6), HEPES (10).
После данных методик было найдено, что характерные представители соединений настоящего изобретения обладают желаемой активностью и селективностью в отношении модуляции кальциевых каналов N-типа.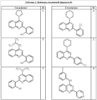 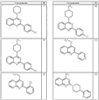 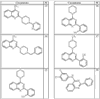 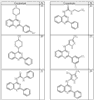 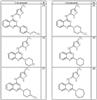 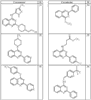 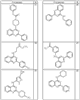 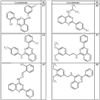 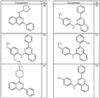 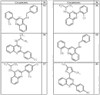 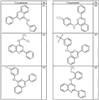 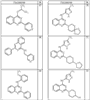 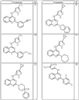 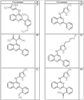 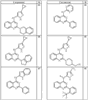 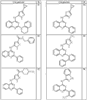 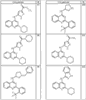 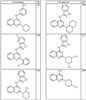 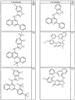 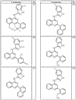 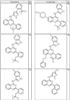  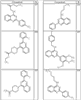 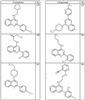 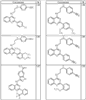 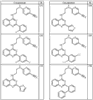 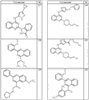 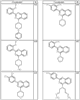 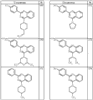  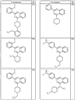 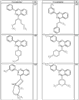 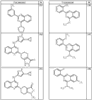 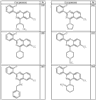 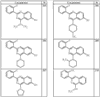 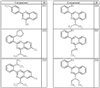 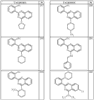 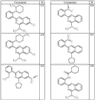 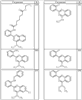 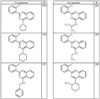 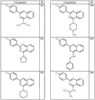 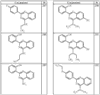 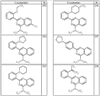 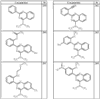 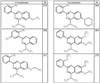 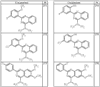 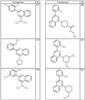 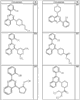 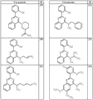 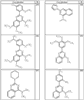 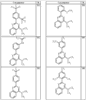 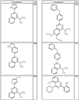 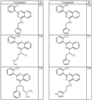 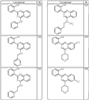 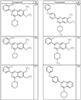 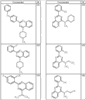 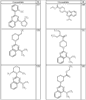 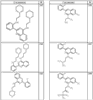 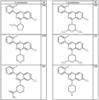 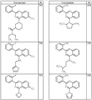 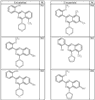 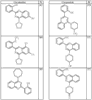 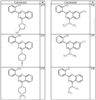 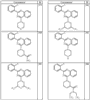 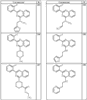 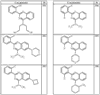 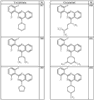 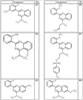 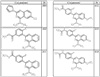 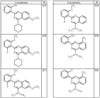 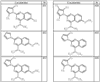 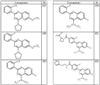 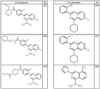 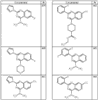 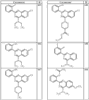 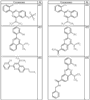 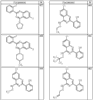 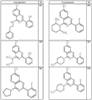 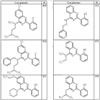 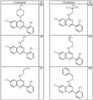 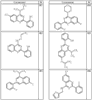 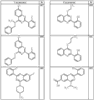   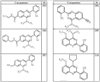 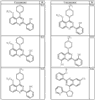 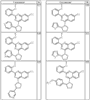  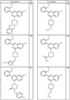 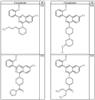  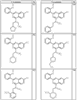 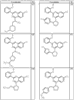 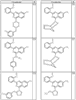  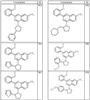 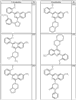 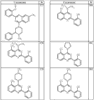 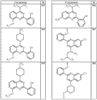 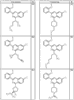 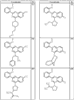 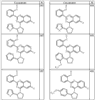 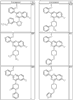  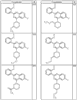   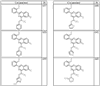 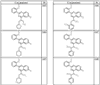 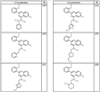 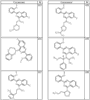 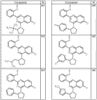 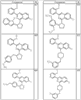 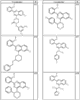 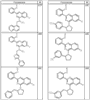 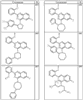 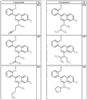 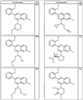 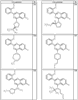 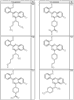 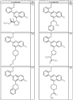 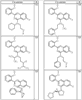     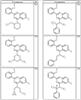 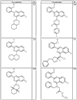 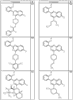 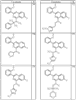 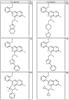 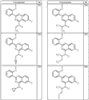 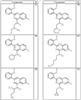 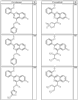   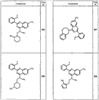 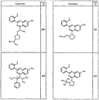 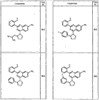 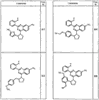 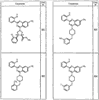 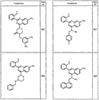 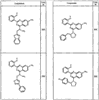 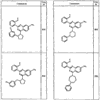 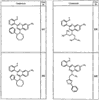 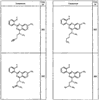 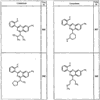 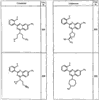 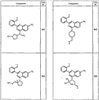 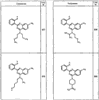 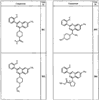 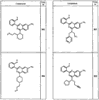 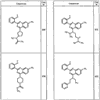  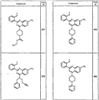 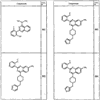 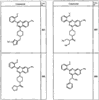 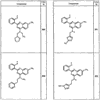 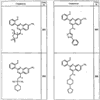 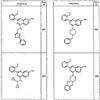 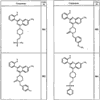 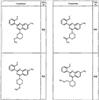 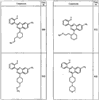 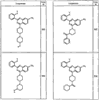 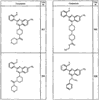 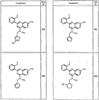 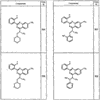 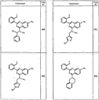 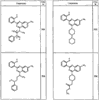 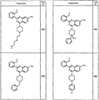 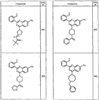 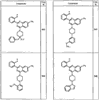 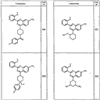 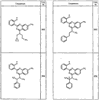 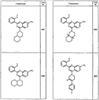 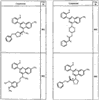 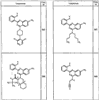 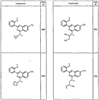 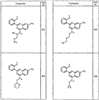 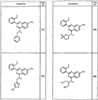 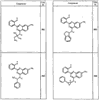 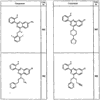 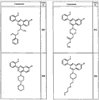 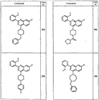 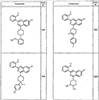 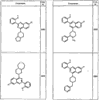 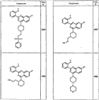 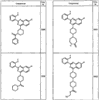 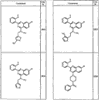 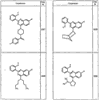 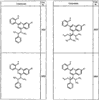 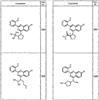 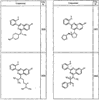 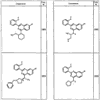 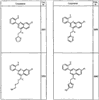 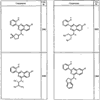 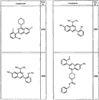 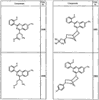 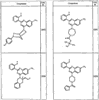 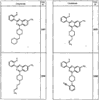 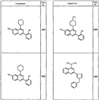 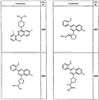 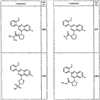 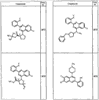 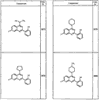 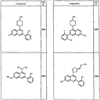 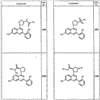 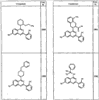 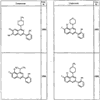 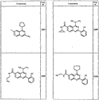 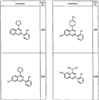 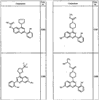 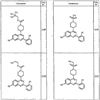 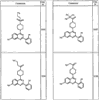 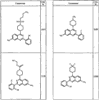 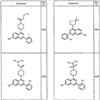 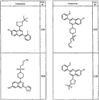 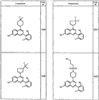 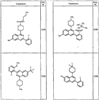 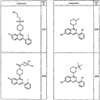 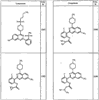 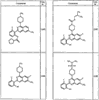 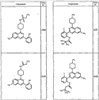 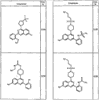 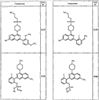 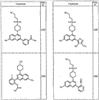 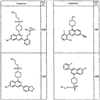 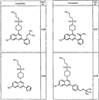  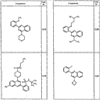 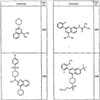 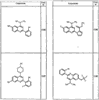  
Формула изобретения
1. Соединение формулы IA-ii:
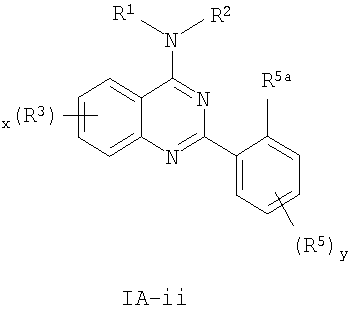
или его фармацевтически приемлемая соль,
где а) кольцо, образованное R1 и R2, взятыми вместе, выбрано из
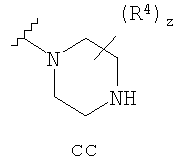 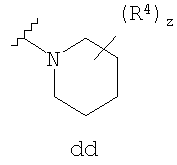 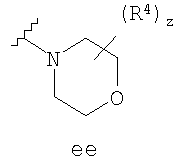
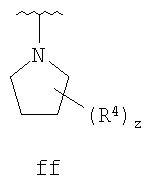 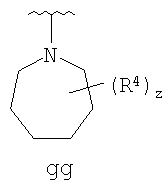 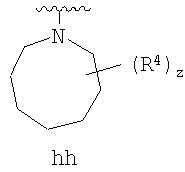
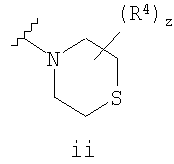 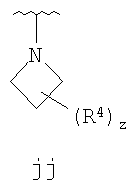 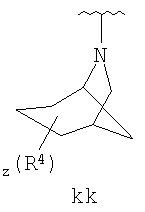
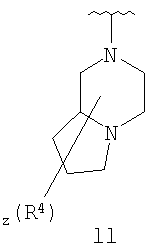 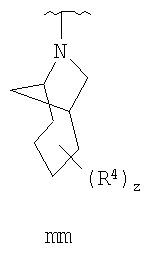 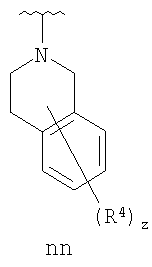 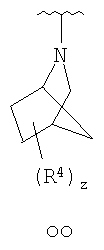
и кольцо, образованное R1 и R2, взятыми вместе, является необязательно замещенным у одного или более замещаемых атомов углерода, азота или серы числом z независимых заместителей -R4, и z равен 0-2;
b) где z представляет 0-2, и R4 группы, когда они присутствуют, каждая независимо представляет галоген, -N(R’)2, -CH2N(R’)2, -OR’, -CH2OR’, -COOR’, -NR’COR’, -CON(R’)2, -OCON(R’)2, COR’, -NHCOOR’, -SO2R’, -SO2N(R’)2, или необязательно замещенную группу, выбранную из C1-С6алифатической группы, фенила, фенил C1-С6алкила, 5-6-членного гетероарильного кольца, содержащего 1-2 гетероатомов, выбранных из азота, серы или кислорода, 5-6 членного гетероарилС1-С6алкила, содержащего 1-2 гетероатома, выбранных из азота или серы, 5-9-членного моноциклического или бициклического гетероциклического кольца, содержащего 1-3 гетероатома, выбранных из азота, кислорода или серы, С6-циклоалифатической группы, 5-7-членной гетероциклоалифатической группы, содержащей 1-3 гетероатома, выбранных из азота или кислорода, C6-циклоалифатического C1-С6алкила или С5-6-гетероциклоалифатического C1-С6алкила, содержащего 1 атом азота, и где каждый заместитель R’ представляет собой независимо водород или С1-С6алифатическую группу, необязательно замещенную 1-3 атомами галогена, 5-6-членное насыщенное или полностью ненасыщенное моноциклическое кольцо, имеющее 0-2 гетероатома, независимо выбранных из азота, кислорода или серы, необязательно замещенное 1-2 С1-С2алкильными, С1-С2алкокси, галогено, трифторметильными, этоксикарбонильными, циано, оксо или гидроксильными группами; или 9-членную полностью ненасыщенную бициклическую кольцевую систему, или две группы R’, взятые вместе с атомом(ами), к которым они прикреплены, образуют необязательно замещенное 9-членное полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 атома азота;
с) где х равен 1, и R3 представляет собой галоген, CN, NO2, -OR’, -NR’COR’, -CON(R’)2, или C1-С6 алифатическую группу, необязательно замещенную 1-3 атомами галогена, где каждый заместитель R’ представляет собой независимо водород, C1-С6алифатическую группу или C1-С6алифатическую группу, замещенную 1-3 атомами галогена;
d) где у представляет 0-3, и R5 группы, когда они присутствуют, представляют, каждая независимо, R’, галоген, CN, NO2, -N(R’)2, -OR’, -NR’COR’, -CON(R’)2, -S(O)2N(R’)2, -OCOR’, -OCON(R’)2, -NR’SO2R’, или -OP(O)(OR’)2, где каждый заместитель R’ представляет собой независимо водород или C1-С6алифатическую группу, 3-6-членное насыщенное или полностью ненасыщенное моноциклическое кольцо;
e) R5a представляет Cl, Br, F, Me, Et, CN, -ОН, -ОСН3, -NHCOCH3, -SO2NH2, -SO2NHC(СН3)3, ОСОС(СН3)3, -ОСОСН2С(СН3)3, -ОСОСН(СН3)2, ОСО(циклопентил) или -СОСН3; и
при условии, что:
когда R1 и R2, взятые вместе, образуют незамещенное морфолиновое кольцо, и фенильное кольцо, замещенное R5a и (R5)y, представляет собой 2-фторфенил, тогда R3 не представляет собой 6-NH2, 6-OHCHN-, 6-ОН, 7-ОН, 6-MsHN-, 6-AcHN-, 6-фтор или 6-ОМе.
2. Соединение по п.1,
где a) R1 и R2, взятые вместе, представляют необязательно замещенное кольцо, выбранное из азетидин-1-ила (jj), пирролидин-1-ила (ff), пиперидин-1-ила (dd) или пиперазин-1-ила (сс);
b) z представляет 0-2, и R4 группы, если присутствуют, представляют, каждая независимо, Cl, Br, F, CF3, СН3, -СН2СН3, -СООН, -N(СН3)2, -N(Et)2, -N(iPr)2, -CONH2, -СООСН3, -ОН, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(СН2)3СН3, -SO2CH(СН3)2, -SO2N(СН3)2, -SO2CH2CH3, -С(O)ОСН2СН(СН3)2, -С(O)NHCH2CH(СН3)2, -NHCOOCH3, -С(O)С(СН3)3, -СОО(СН2)2СН3, -C(O)NHCH(CH3)2, -С(O)СН2СН3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, -СН2циклогексила, пиридила, -СН2пиридила или -СН2тиазолила;
c) х представляет 1, и R3 представляет Cl, Br, F, CF3, -OCF3, Me, Et, CN, -CONH2, -ОН, -NHCOCH3, -NHCOCH(СН3)2, -CONH(циклопропил), -CONHCH3, или -CONHCH2CH3;
d) где у представляет 0-3, и R5 группы, когда они присутствуют, представляют, каждая независимо, Cl, Br, F, Me, Et, CN, -NH2, -N(СН3)2, -N(Et)2, -N(iPr)2, -CONH2, -ОН, -ОСН3, -ОСН2СН3, -NHCOCH3, -SO2NH2, -SO2NHC(СН3)3, -ОСОС(СН3)3 или -ОСОСН2С(СН3)3; и
e) R5a представляет Cl, F, Me, Et, -ОН, -ОСН3, -SO2NH2, -SO2NHC(СН3)3, -ОСОС(СН3)3, -ОСОСН2С(СН3)3, ОСОСН(СН3)2, ОСО(циклопентил) или -СОСН3.
3. Соединение по п.2, где R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -СН3, -СН2СН3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -ОСН3, -ОСН2СН3 или -CN.
4. Соединение по п.2, где R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -СН3, -СН2СН3, -F, -CF3, -OCF3, -CONHCH3, -CONHCH2CH3, -CONH(циклопропил), -ОСН3, -ОСН2СН3 или -CN.
5. Соединение по п.2, где R3 находится в положении 6 хиназолинового кольца и представляет -Cl, -СН3, -СН2СН3, -F, -CF3, -OCF3, -ОСН3 или -ОСН2СН3.
6. Соединение по п.2, где R3 находится в положении 7 хиназолинового кольца и представляет -Cl, -СН3, -СН2СН3, -F, -CF3, -OCF3, -ОСН3 или -ОСН2СН3.
7. Соединение по п.2, где R5a представляет Cl, F, Me, Et, -ОН или -ОСН3.
8. Соединение по п.2, где R5a представляет ОН.
9. Соединение по п.2, где R5a представляет F.
10. Соединение по п.2,
где a) R1 и R2, взятые вместе, представляют необязательно замещенное кольцо, выбранное из азетидин-1-ила (jj), пирролидин-1-ила (ff), пиперидин-1-ила (dd) или пиперазин-1-ила (сс);
b) z представляет 0-2, и R4 группы, если присутствуют, представляют, каждая независимо, Cl, Br, F, CF3, СН3, -СН2СН3, -СООН, -N(СН3)2, -N(Et)2, -N(iPr)2, -CONH2, -СООСН3, -ОН, -CH2OH, -NHCOCH3, -SO2NH2, -SO2(СН2)3СН3, -SO2CH(СН3)2, -SO2N(СН3)2, -SO2CH2CH3, С(O)ОСН2СН(СН3)2, -C(O)NHCH2CH(CH3)2, -NHCOOCH3, -С(O)С(СН3)3, -СОО(СН2)2СН3, -C(O)NHCH(CH3)2, -С(O)СН2СН3 или необязательно замещенную группу, выбранную из пиперидинила, пиперазинила, морфолино, С1-4алкокси, фенила, фенилокси, бензила, -СН2циклогексила, пиридила, -СН2пиридила или -СН2тиазолила;
c) R3 представляет независимо Cl, Br, F, CF3, -OCF3, Me, Et, CN, -ОН или -ОСН3;
d) у представляет 0 или 1, и R5 группы, когда они присутствуют, представляют, каждая независимо, Cl, Br, F, Me, -ОН, -ОСН3, -OCH2CH3, -NHCOCH3, -SO2NH2, -SO2NHC(СН3)3; и
e) R5a представляет F или ОН.
11. Соединение по п.1, где указанное соединение выбирают из любого из следующих соединений: 200, 202-204, 206-209, 225, 312, 323-324, 349-355, 357, 361-363, 365-367, 415-416, 427-428, 436, 442, 447-448, 457-458, 465-468, 475, 484, 489, 496, 498-501, 510-523, 525-530, 532-539, 549-550, 552-553, 555, 557-572, 577, 581-582, 584-585, 588, 591-592, 594-595, 597-608, 610-615, 618-631, 633-636, 660-666, 668-672, 675, 676, 681-686, 689, 697, 701, 706-707, 711-713, 715-716, 719-720, 726-728, 730, 732, 733, 735-741, 743-745, 747-752, 764, 767-768, 811-824, 831-834, 837-838, 847, 851, 854-855, 860-862, 865-866, 869-870, 875-877, 880, 882-887, 899, 900-901, 904-919, 932, 935-943, 945-952, 963, 965, 987, 990-995, 997-998, 1000-1001, 1003-1012, 1016-1017, 1019-1020, 1025, 1027, 1031, 1033, 1045, 1054, 1056-1058, 1060-1063, 1065-1074, 1078-1081, 1083-1086, 1089-1091, 1103, 1105-1117, 1119-1125, 1127-1141, 1143-1145, 1150-1154, 1156-1160, 1167-1168, 1171, 1173-1174, 1176-1177, 1179, 1185, 1187 и 1190-1193, 1195, 1196, а именно:
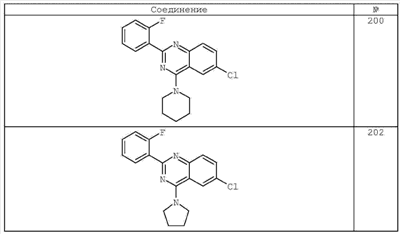
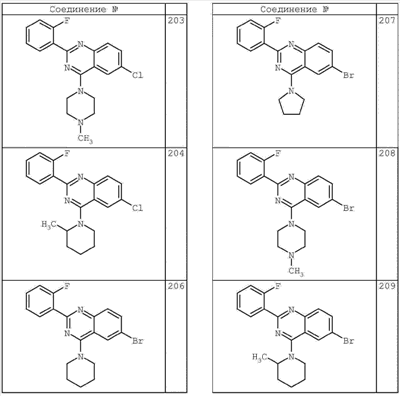
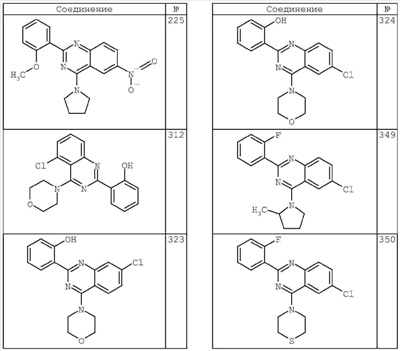
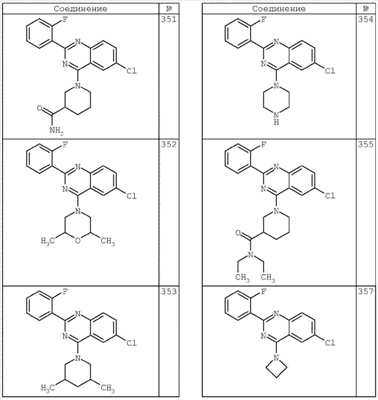
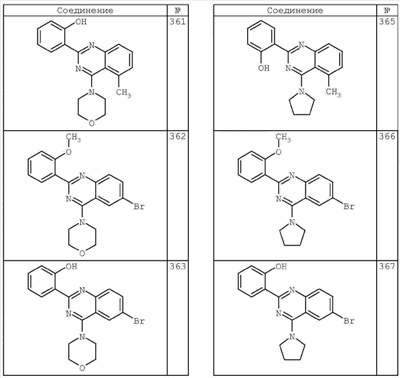
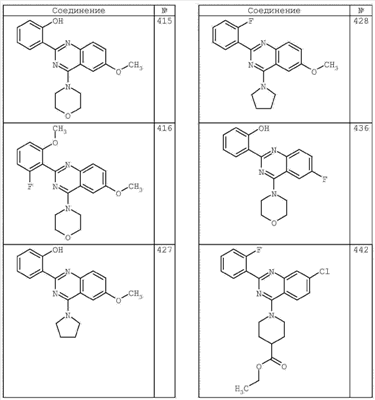
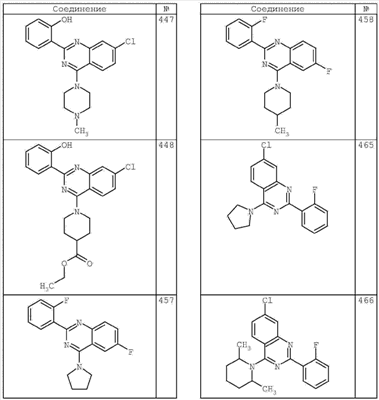
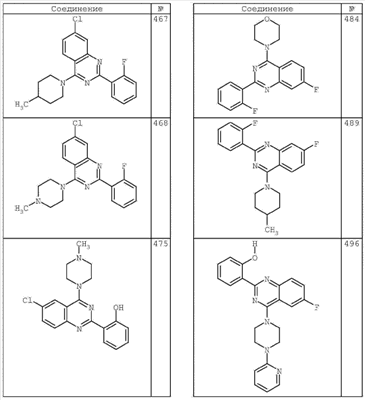
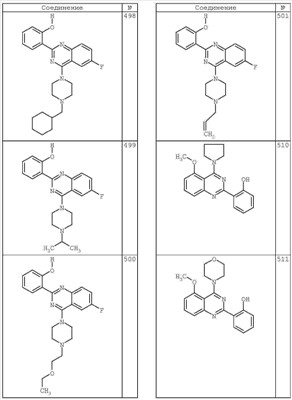
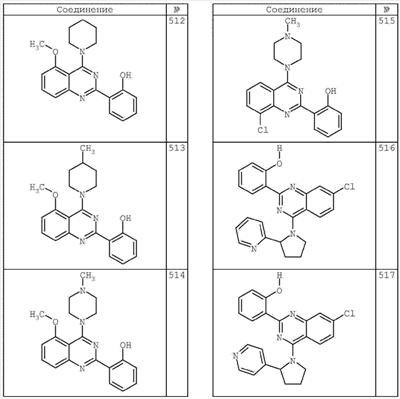
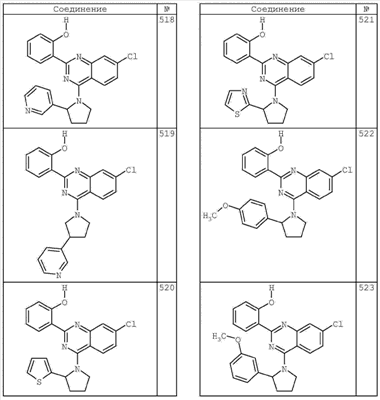
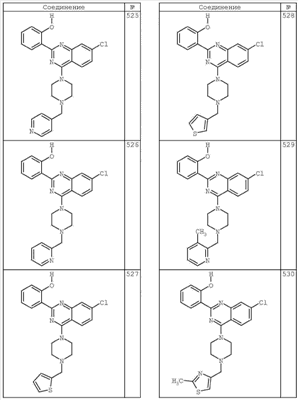
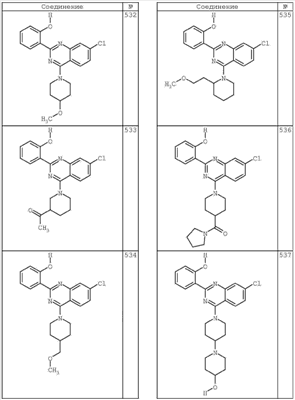
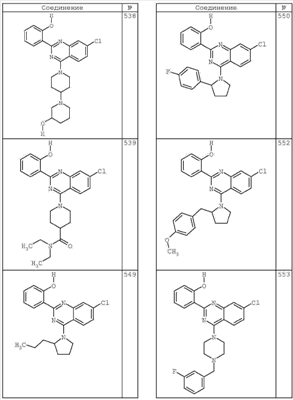
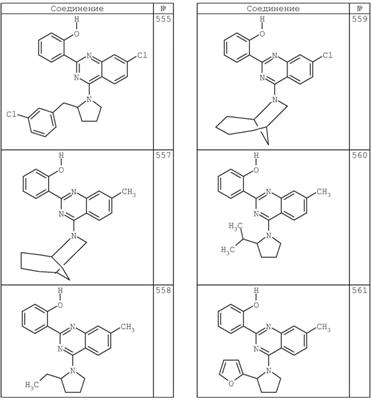
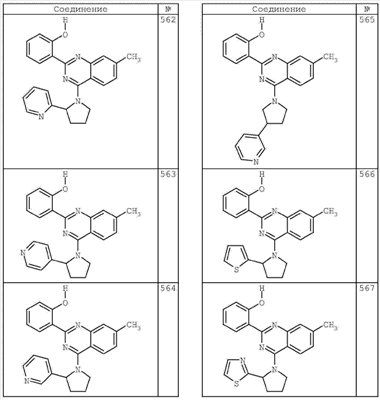
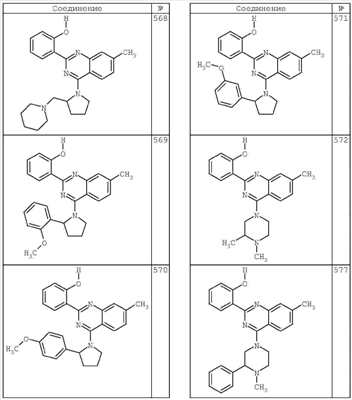
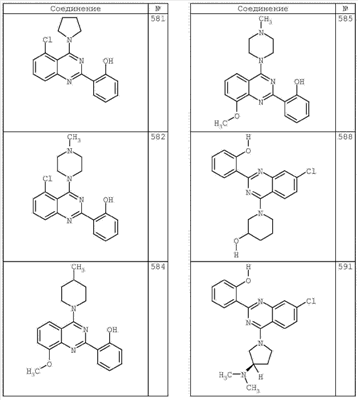
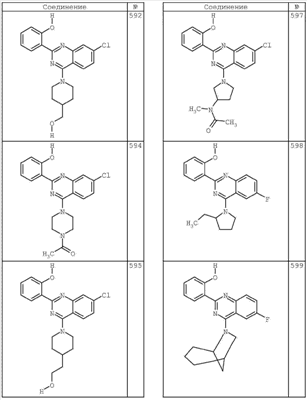

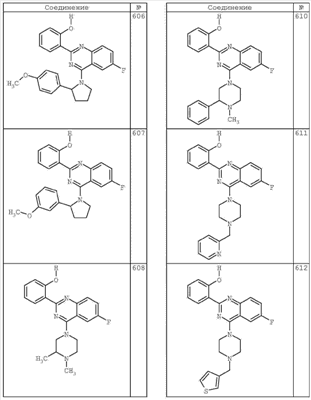
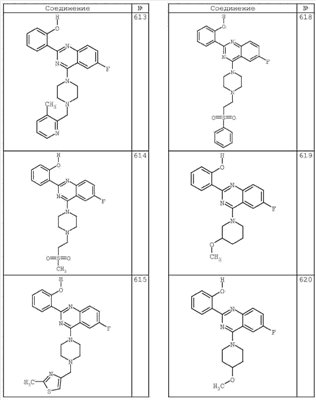
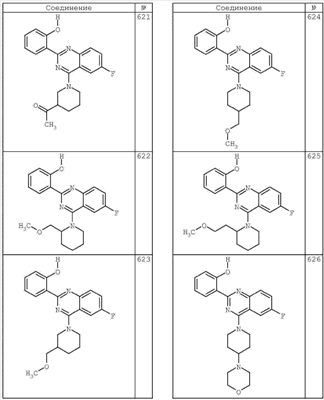
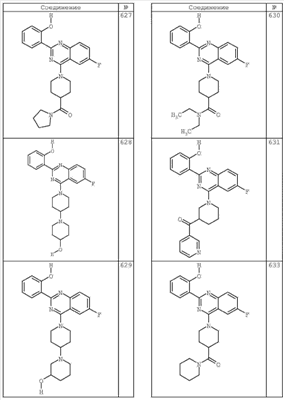
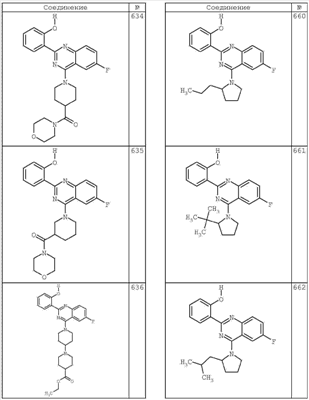
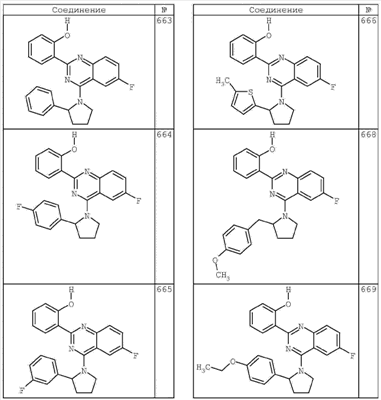
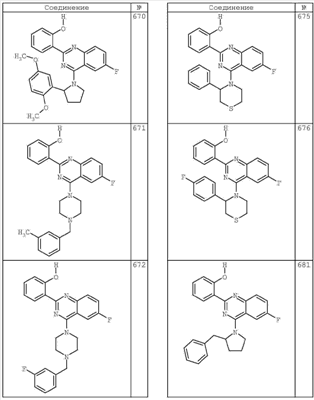
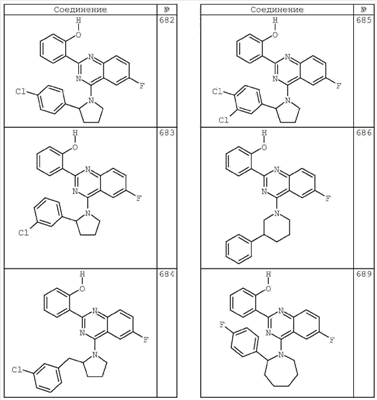
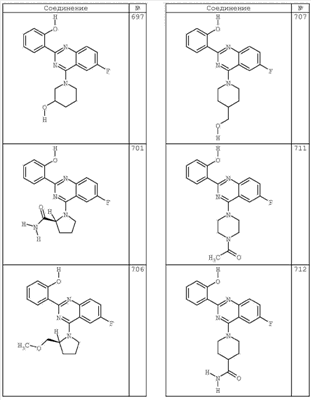
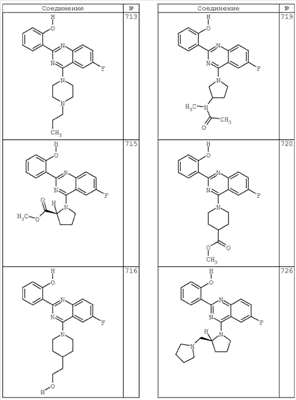
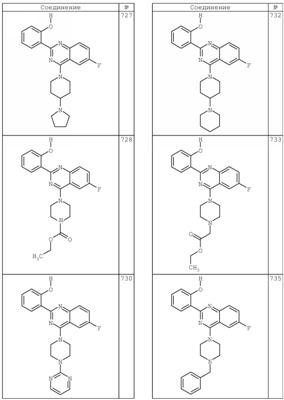
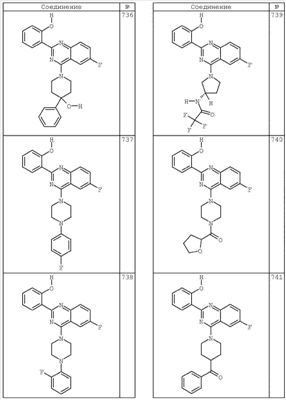
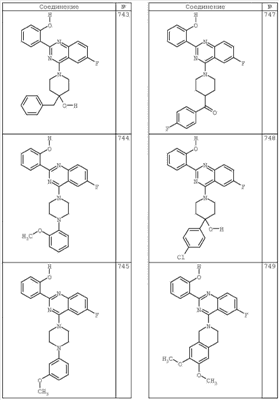
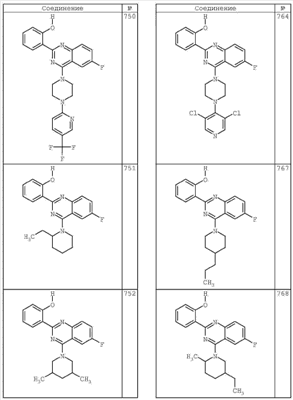
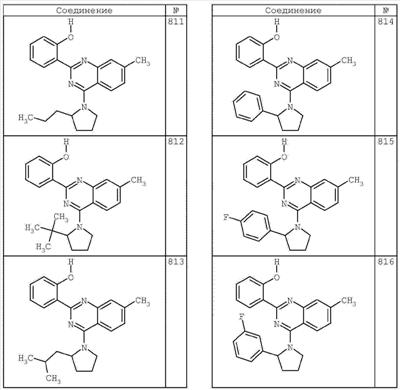
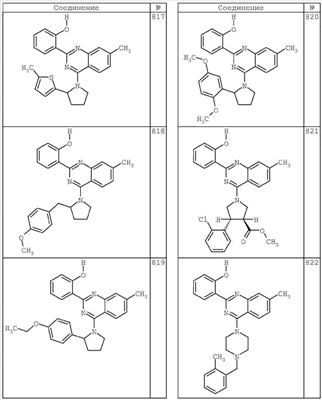
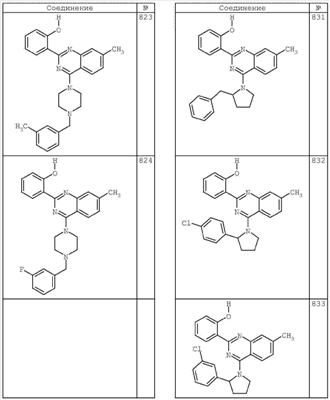
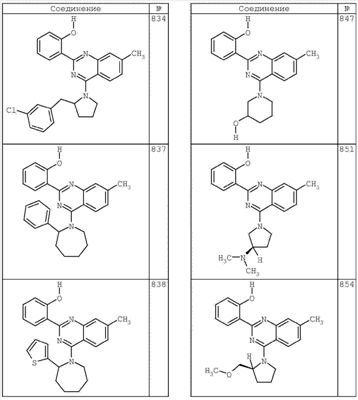
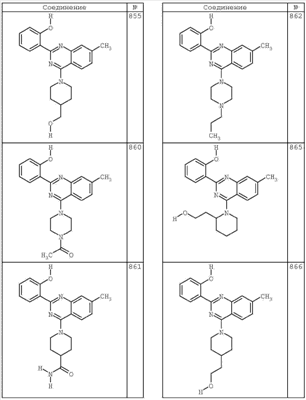
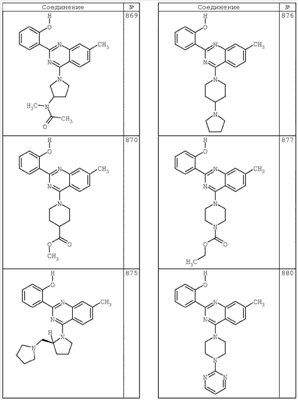
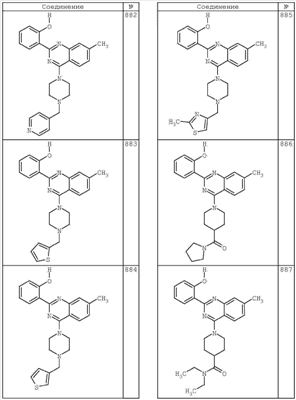
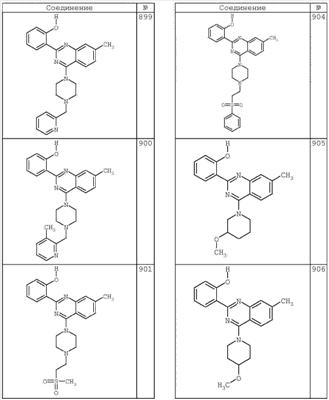
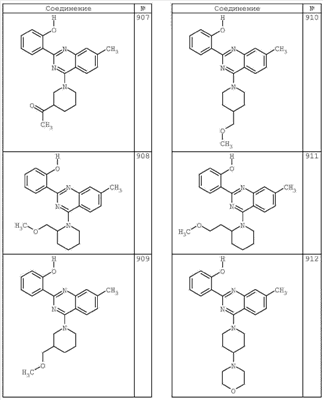
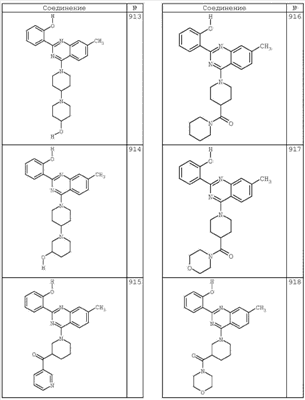
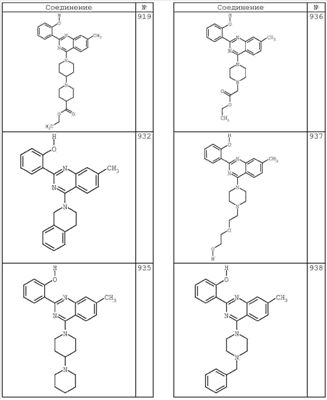
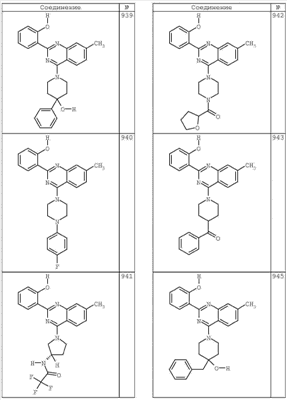
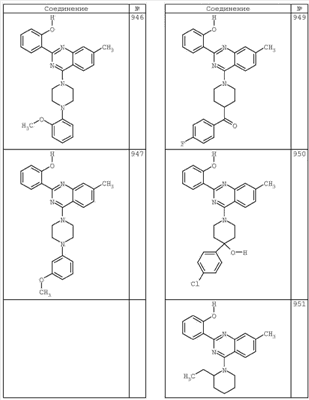
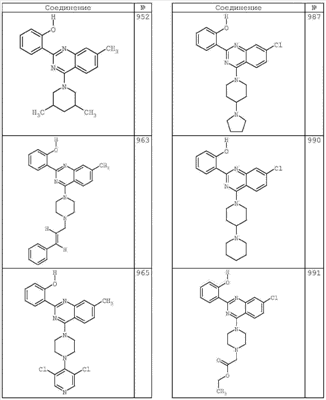
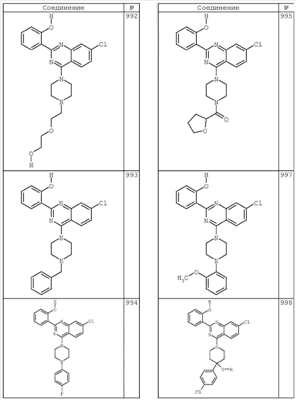
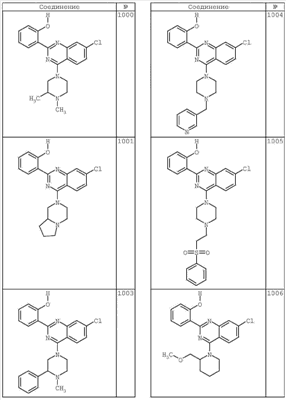
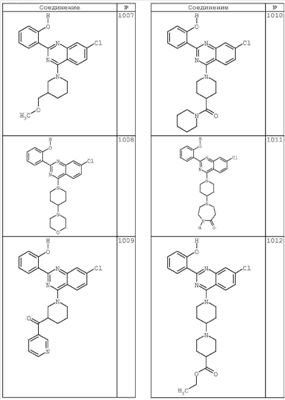
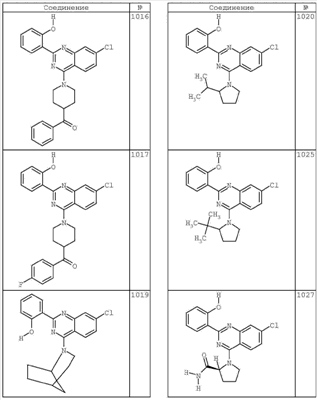
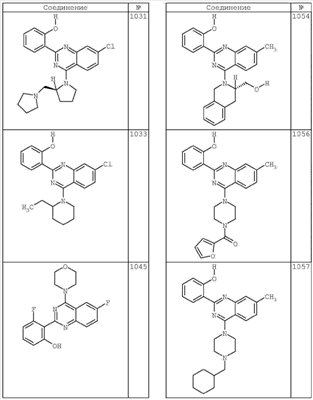
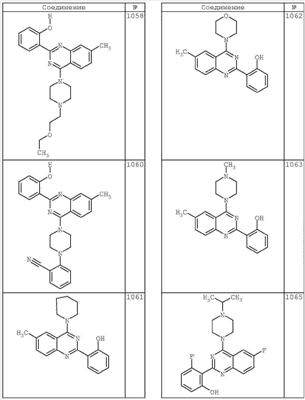
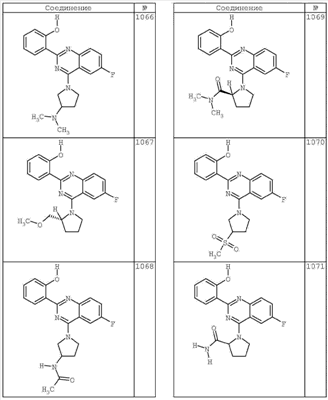
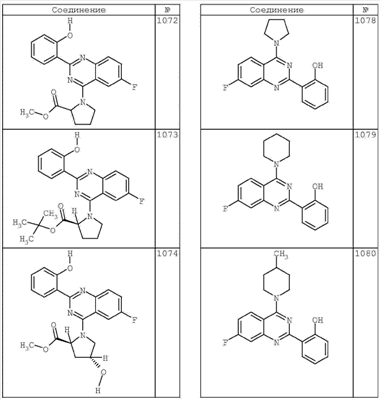
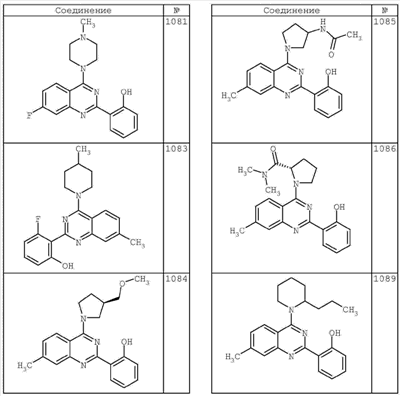
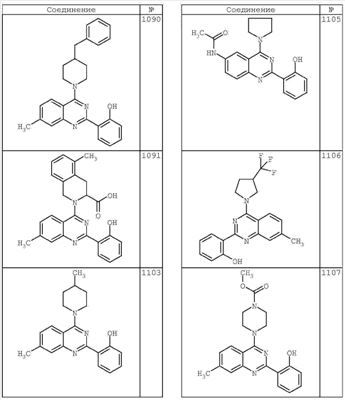
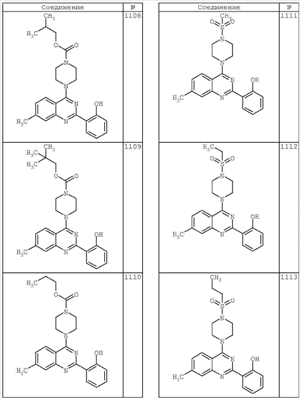
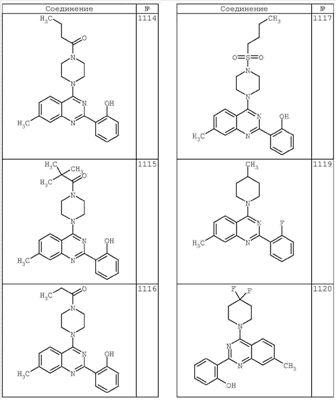
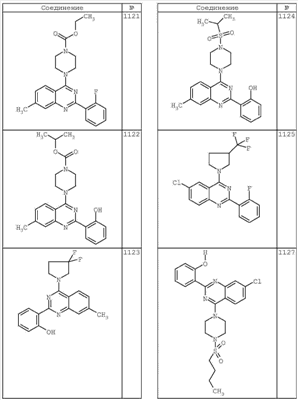
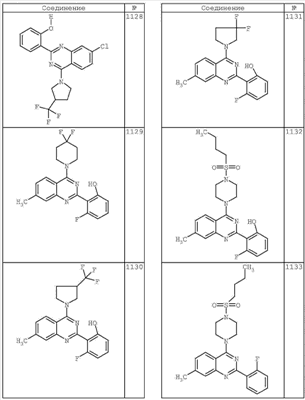
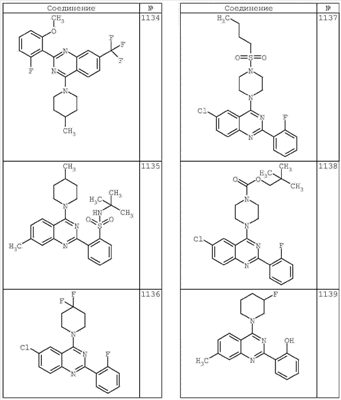
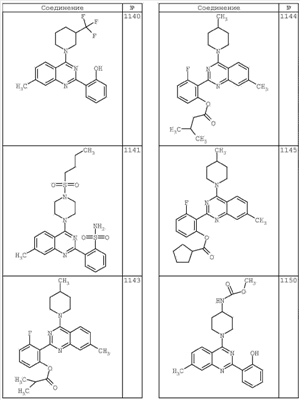
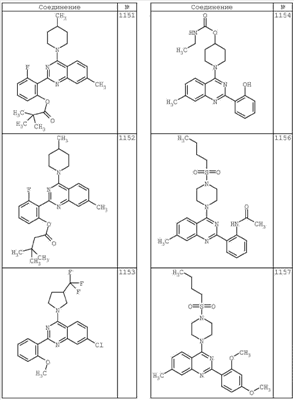
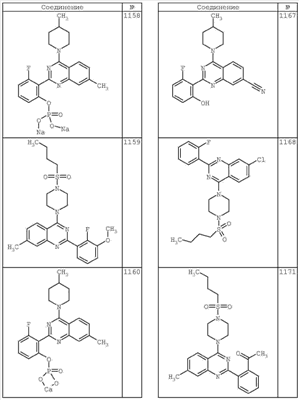
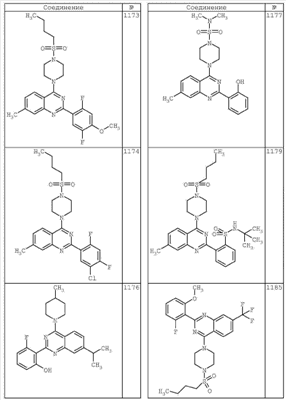
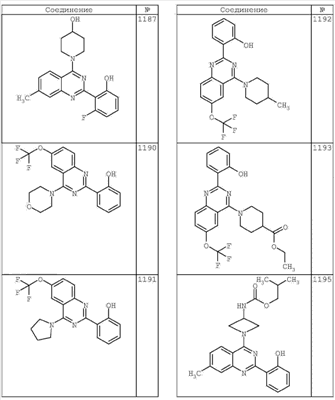
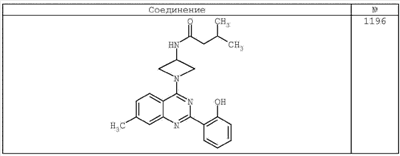
12. Фармацевтическая композиция, обладающая антагонистической активностью в отношении потенциалозависимых натриевых или кальциевых ионных каналов, включающая эффективное количество соединения по любому из пп.1-11, и фармацевтически приемлемый носитель, средство переноса или разбавитель.
13. Способ ингибирования одной или более из NaV1.2, NaV1.3, NaV1.8 или CaV2.2 активности в биологическом образце, который включает введение в контакт указанного биологического образца с соединением по любому из пп.1-11.
14. Способ по п.13, включающий ингибирование NaV1.3 или NaV1.8 активности.
15. Способ по п.13, включающий ингибирование CaV2.2 активности.
16. Способ по п.13, включающий ингибирование NaV1.8 или CaV2.2 активности.
17. Способ по п.13, включающий ингибирование NaVl.8 активности.
РИСУНКИ
|
|