Патент на изобретение №2378259
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) НОВЫЕ ПРОИЗВОДНЫЕ АМИНОИНДАЗОЛОВ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
(57) Реферат:
Изобретение относится к соединениям формулы (I), а также их фармацевтически приемлемым солям, фармацевтической композиции на их основе, обладающим ингибирующей активностью в отношении фосфорилирования протеина Tau, и к способам получения соединений. В формуле (I) R5 обозначает арил, арил(С1-С6)алкил; R6 обозначает галоген; R3 означает (С1-С6)алкил, возможно замещенный заместителями, выбираемыми из галогена, ОН, NH2, азетидина; или моноциклический арил или гетероарил, такой как тиофен и пиридин, возможно замещенные заместителями, выбранными из NO2, CN, (С1-С6)алкокси, (С1-С6)алкила; или CONR1R2, SO2Ra, C(=NH)R1b, COOR1c; R1, R2 независимо друг от друга обозначают атом водорода, возможно замещенный одним атомом галогена (С1-С6)алкил, моноциклический арил или моноциклический 5- или 6-членный гетероарил, включающий от 1 до 2 гетероатомов, таких как S, О, N, возможно замещенных одним или несколькими заместителями, выбранными из галогена, (С1-С6)алкила, (С1-С6)алкоксила, трифторметила, N(СН3)2; или R1 и R2 могут образовывать 5- или 6-членный цикл, необязательно включающий гетероатом, такой как N; R1a обозначает арил, возможно замещенный (С1-С6)алкоксилом; R1b обозначает (С1-С6)алкил, возможно замещенный арил или 6-членный гетероарил, содержащий 1 или 2 атома N, где заместитель представляет собой (С1-С6)алкоксил; R1c обозначает (С1-С6)алкил, (С2-С6)алкенил; и их фармацевтически приемлемые соли. Технический результат – производные аминоиндазолов в качестве ингибитора киназы. 6 н. и 2 з.п. ф-лы.
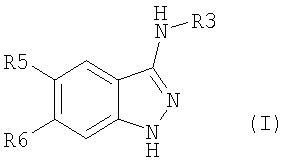
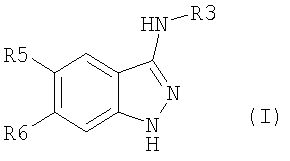
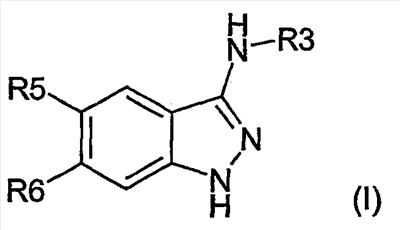
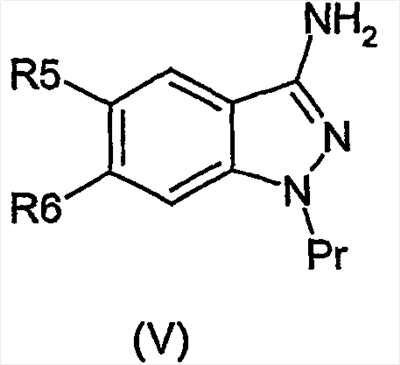
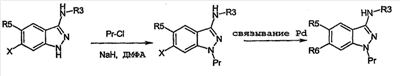
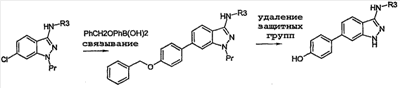
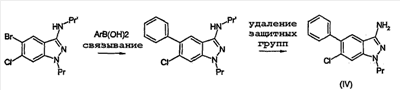
Настоящее изобретение относится к применению производных формулы (I): или их фармацевтически приемлемых солей в качестве ингибитора киназы. Объектом изобретения являются применение производных аминоиндазолов формулы (I) и их фармацевтически приемлемых солей для получения фармацевтических композиций, предназначенных для предупреждения и лечения заболеваний, которые могут возникать в результате анормальной активности киназ, как, например, таковых, принимающих активное участие в нейродегенеративных заболеваниях, болезни Альцгеймера, болезни Паркинсона, лобно-теменной деменции, кортикобазальной дегенерации, болезни Пика, цереброваскулярных осложнениях, черепно-мозговых и позвоночных травмах и периферических невропатиях, ожирении, болезнях обмена веществ, диабете типа II, эссенциальной гипертензии, атеросклеротических сердечно-сосудистых заболеваниях, синдроме поликистозных яичников, синдроме Х, иммунодефиците и раке; фармацевтические композиции, содержащие новые производные аминоиндазолов и их фармацевтически приемлемые соли и новые производные аминоиндазолов и их фармацевтически приемлемые соли. Настоящее изобретение относится к производным формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, CSNR1R2, COOR1, SO2R1, C(=NH)R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)ОR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, гетероциклического остатка, формила, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила; R5, R6, независимо друг от друга, выбирают из следующих радикалов: атом галогена, CN, NO2, NH2, OH, COOH, C(O)OR8, -O-C(O)R8, NR8R9, NHC(O)R8, C(O)NR8R9, NHC(S)R8, C(S)NR8R9, SR8, S(O)R8, SO2R8, NHSO2R8, SO2NR8R9, -O-SO2R8, -SO2-O-R8, трифторметил, трифторметоксигруппа, (С1-С6)алкил, (С1-С6)алкоксил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, гетероциклический остаток, циклоалкил, алкенил, алкинил, адамантил, полициклоалкилы, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)OR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; R1, R2, R8, R9, R10, R11, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, трифторметила, трифторметоксигруппы; R1 и R2, или R8 и R9, или R10 и R11 могут образовывать 5- или 6-членный цикл, включающий или нет гетероатом, такой как O, S, N; и когда R3 означает 6-членный азотсодержащий гетероарил, или тиазолил, или имидазолил, или оксазолил, тогда по меньшей мере один из R5, R6 означает арил, который может быть замещен одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)ОR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; их рацематам, энантиомерам, диастереоизомерам и их смесям, их таутомерам и их фармацевтически приемлемым солям. В особенности, настоящее изобретение относится к производным формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, CSNR1R2, COOR1, SO2R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)ОR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, формила, оксогруппы, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)-алкила; R5 означает арил, возможно замещенный одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)OR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; R6 означает атом галогена, метил, циклопропил, CN, OH, метоксигруппу, трифторметил, этиленил, ацетиленил, трифторметокигруппу, NO2, NH2, N(СН3)2; R1, R2, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, оксогруппы, трифторметила, трифторметоксигруппы; R1 и R2 могут образовывать 5- или 6-членный цикл, включающий или нет гетероатом, такой как O, S, N; их рацематам, энантиомерам, диастереоизомерам и их смесям, их таутомерам и их фармацевтически приемлемым солям. Предпочтительно, настоящее изобретение относится к производным формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, CSNR1R2, COOR1, SO2R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)ОR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, формила, оксогруппы, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила; R5 означает арил, возможно замещенный одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)OR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; R6 означает атом галогена, метил, циклопропил, CN, OH, метоксигруппу, трифторметил, этиленил, ацетиленил, трифторметоксигруппу, NO2, NH2, N(СН3)2; R1, R2, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)-алкила, (С1-С6)-алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, оксогруппы, трифторметила, трифторметоксигруппы; R1 и R2 могут образовывать 5- или 6-членный цикл, включающий или нет гетероатом, такой как O, S, N; их рацематам, энантиомерам, диастереоизомерам и их смесям, их таутомерам и их фармацевтически приемлемым солям. Предпочтительно, настоящее изобретение относится к производным формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, COOR1, SO2R1, C(=NH)R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)OR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, формила, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила; R5 означает фенил; R6 означает хлор; R1, R2, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, трифторметила, трифторметоксигруппы; их изомерам, их смесям, их рацематам, энантиомерам, диастереоизомерам, таутомерам, а также их фармацевтически приемлемым солям. В вышеприведенных и в нижеследующих определениях (С1-С6)алкильные радикалы содержат 1-6 атомов углерода в линейной или разветвленной цепи; алкенильные радикалы содержат 2-6 атомов углерода и от одной до трех двойных связей, сопряженных или нет, в линейной или разветвленной цепи; алкинильные радикалы содержат 2-6 атомов углерода и 1-3 тройные связи, сопряженные или нет, в линейной или разветвленной цепи; арильные радикалы выбирают среди фенила, нафтила или инденила; гетероарильные радикалы являются 3-10-членными, возможно содержащими один или несколько гетероатомов, выбираемых среди кислорода, серы и азота, как, в частности, тиазолил, тиенил, пирролил, пиридинил, фурил, имидазолил, оксазолил, пиразинил, тетразолил, оксадиазолил, тиадиазолил, изоксадиазолил, изотиадиазолил, изотиазолил, изоксазолил, триазолил, пиразолил, индолил; галоген представляет собой хлор, иод, фтор, бром; полициклоалкильные радикалы выбирают среди адамантила, хинуклидинила, борнанила, норборнанила, борненила, норборненила; гетероарильные радикалы, конденсированные с (С1-С10)циклоалкилом, выбирают среди инданила, изохроманила, хроманила, 1,2,3,4-тетрагидроизохинолила, 1,2,3,4-тетрагидрохинолила; гетероциклические остатки содержат от одного до двух гетероатомов, выбираемых среди кислорода, серы, азота, и представляют собой, в частности, пиперидинил, морфолинил, пирролидинил, имидазолидинил, пиразолидинил, изотиазолидинил, тиазолидинил, изоксазолидинил, оксазолидинил, пиперазинил, азетидинил, 2-пиперидон, 3-пиперидон, 4-пиперидон, 2-пирролидон, 3-пирролидон. Соединения формулы (I) содержат один или несколько асимметрических атомов углерода и, следовательно, могут находиться в форме изомеров, рацемата, энантиомеров и диастереоизомеров; они, а также их смеси, также составляют часть изобретения. Из соединений формулы (I), пригодных согласно изобретению, можно назвать следующие соединения: N-(бицикло[2,2,1]гепт-5-ен-2-илметил)-6-хлор-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(3,3-диметилбутил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(3-фенилпропил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(циклопропилметил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(циклопентилметил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[3-(метилтио)пропил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(фенилэтил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(циклогексилметил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-пропил-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(2,2,3,3,4,4,4-гептафторбутил)-5-фенил-1Н-индазол-3-амингидрат; 6-хлор-N-(4,4,4-трифторбутил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[(4-метоксифенил)метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(фенилметил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[(4-цианофенил)метил]-5-фенил-1Н-индазол-3-амин; N-[(4-хлорфенил)метил]-6-хлор-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[(3-метоксифенил)метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[[4-(трифторметокси)фенил]метил]-5-фенил-1Н-индазол-3-амин; N-[4-[[[6-хлор-5-фенил-1Н-индазол-3-ил]амино]метил]фенил]ацетамид; 6-хлор-N-[(3,5-дихлорфенил)метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[[4-(трифторметил)фенил]метил]-1Н-индазол-3-амин; 6-хлор-N-[(4-фторфенил)метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[3-(4-метилфенокси)фенилметил]-5-фенил-1Н-индазол-3-амин; N-[2,2,3,3,4,4,4-гептафторбутил]-6-хлор-5-фенил-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[[3,5-бис-(трифторметил)фенил]метил]-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[[3-(трифторметил)фенил]метил]-1Н-индазол-3-амин; 6-хлор-N-[(6-метокси-2-нафталинил)метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[(пентафторфенил)метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[[4-(метилтио)фенил]метил]-5-фенил-1Н-индазол-3-амин; N-[(4-хлор-3-фторфенил)метил]-6-хлор-5-фенил-1Н-индазол-3-амин; 6-хлор-5-фенил-N-(3,3,3-трифторпропил)-1Н-индазол-3-амин; 6-хлор-5-фенил-N-(3-тиенилметил)-1Н-индазол-3-амин; N-(бицикло[2,2,1]гепт-5-ен-2-илметил)-6-хлор-5-фенил-1Н-индазол-3-амин; N-([1,1′-бифенил]-4-илметил)-6-хлор-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[[4-(диметиламино)фенил]метил]-5-фенил-1Н-индазол-3-амин; N-([2,2′-битиофен]-5-илметил)-6-хлор-5-фенил-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[[1-(фенилметил)-1Н-имидазол-2-ил]метил]-1Н-индазол-3-амин; 6-хлор-N-[[1-метил-1Н-имидазол-2-ил]метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[(1-метил-1Н-индол-3-ил)метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[(5-метил-2-фуранил)метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-5-фенил-N-(1Н-пиррол-2-илметил)-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[(1Н-имидазол-2-ил)метил]-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[(1Н-имидазол-4-ил)метил]-1Н-индазол-3-амин; 6-хлор-5-фенил-N-(1Н-пиразол-3-илметил)-1Н-индазол-3-амин; 6-хлор-N-[[2-метил-1Н-имидазол-4-ил]метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[(3,5-диметил-1-фенил-1Н-пиразол-4-ил)метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[[2-фенил-1Н-имидазол-4-ил]метил]-1Н-индазол-3-амин; 6-хлор-N-[[5-(4-хлорфенил)-2-фуранил]метил]-5-фенил-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[(1-метил-1Н-пиррол-2-ил)метил]-1Н-индазол-3-амин; 4-[5-[[[6-хлор-5-фенил-1Н-индазол-3-ил]амино]метил]-2-фуранил]бензолсульфонамид; 6-хлор-5-фенил-N-(3-тиенилметил)-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[[2-фенил-1Н-имидазол-4-ил)метил]-1Н-индазол-3-амин; этил-2-[[[6-хлор-5-фенил-1Н-индазол-3-ил]амино]метил]-5-(метилтио)-1Н-имидазол-4-карбоксилат; 6-хлор-5-фенил-N-[[5-[4-(трифторметил)фенил]-2-фуранил]метил]-1Н-индазол-3-амин; 6-хлор-5-фенил-N-[2-(1-пиперидинил)этил]-1Н-индазол-3-амин; 6-хлор-N-[2-(4-морфолинил)этил]-5-фенил-1Н-индазол-3-амин; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-(3,5-дихлорфенил)мочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-(2-пропенил)мочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-(фенилметил)мочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-(4-феноксифенил)мочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-[(4-метоксифенил)метил]мочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-[4-(трифторметил)фенил]мочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-(4-метоксифенил)мочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-циклогексилмочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-пропилмочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-(4-хлорфенил)мочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-(4-фторфенил)мочевина; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-N’-трицикло[3.3.1.13,7]дец-1-илмочевина; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-(4-метилфенил)мочевина; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-4-метилбензолсульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]метансульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-2-пропансульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-2,2,2-трифторэтансульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-2-тиофенсульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]бензолсульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-4-(трифторметил)бензолсульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-5-(3-изоксазолил)-2-тиофенсульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-4-фторбензолсульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-4-метоксибензолсульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]бензолметансульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-1-метил-1Н-имидазол-4-сульфонамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-4-(1,1-диметилэтил)бензолсульфонамид; N-[4-[[(6-хлор-5-фенил-1Н-индазол-3-ил)амино]сульфонил]фенил]ацетамид; N-[6-хлор-5-фенил-1Н-индазол-3-ил]-4-метилбензолметансульфонамид; 6-хлор-N-(пентафторфенил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(3,4-дифторфенил)-5-фенил-1Н-индазол-3-амин; 6-хлор-5-фенил-N-(2,3,5,6-тетрафторфенил)-1Н-индазол-3-амин; 6-хлор-5-фенил-N-(2,4,6-трифторфенил)-1Н-индазол-3-амин; 6-хлор-N-(4-фторфенил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[3-(трифторметил)фенил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[4-(трифторметил)фенил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-[3-фтор-5-(трифторметил)фенил]-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(4-нитрофенил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(3-нитрофенил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(3-метоксифенил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(4-метоксифенил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N,5-дифенил-1Н-индазол-3-амин; 6-хлор-N-(1-пиридинил)-5-фенил-1Н-индазол-3-амин; 6-хлор-N-(2-пиридинил)-5-фенил-1Н-индазол-3-амин; их изомеры, их смеси, их рацематы, энантиомеры, диастереоизомеры, таутомеры, а также их фармацевтически приемлемые соли; и, в особенности, следующие соединения: N-бутил-6-хлор-5-фенил-1Н-индазол-3-амин; 3-(6-хлор-5-фенил-1Н-индазол-3-иламино)тиофен-2-карбонитрил; (6-хлор-5-фенил-1Н-индазол-3-ил)пиридин-2-иламин; (6-хлор-5-фенил-1Н-индазол-3-ил)-(5-нитропиридин-2-ил)амин; (6-хлор-5-фенил-1Н-индазол-3-ил)-(6-метоксипиридин-2-ил)амин; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-фенилмочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(4-этоксифенил)мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(3,4-дихлорфенил)мочевина; метиловый эфир 3-[3-(6-хлор-5-фенил-1Н-индазол-3-ил)уреидо]пропионовой кислоты; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(4-диметиламинофенил)мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-изопропилмочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-циклогексилмочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(3-трифторметилфенил)мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(2-тиофен-2-илэтил)мочевина; 1-бензо[1,3]диоксол-5-ил-3-(6-хлор-5-фенил-1Н-индазол-3-ил)мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(3,5-диметилизоксазол-4-ил)мочевина; 1-бензил-3-(6-хлор-5-фенил-1Н-индазол-3-ил)мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-фенетилтиомочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-[3-(4-метилпиперазин-1-ил)пропил]мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(3-имидазол-1-илпропил)мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(2-гидроксиэтил)мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-[3-(4-метилпиперазин-1-ил)пропил]мочевина; (6-хлор-5-фенил-1Н-индазол-3-ил)амид пирролидин-1-карбоновой кислоты; метиловый эфир (6-хлор-5-фенил-1Н-индазол-3-ил)карбаминовой кислоты; (6-хлор-5-фенил-1Н-индазол-3-ил)мочевина; бензиловый эфир (6-хлор-5-фенил-1Н-индазол-3-ил)карбаминовой кислоты; аллиловый эфир (6-хлор-5-фенил-1Н-индазол-3-ил)карбаминовой кислоты; изобутиловый эфир (6-хлор-5-фенил-1Н-индазол-3-ил)карбаминовой кислоты; (6-хлор-5-фенил-1Н-индазол-3-ил)амид пиперидин-1-карбоновой кислоты; 1-(3-азетидин-1-илпропил)-3-(6-хлор-5-фенил-1Н-индазол-3-ил)мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(3-хлорпропил)мочевина; 1-(6,7-дифтор-5-фенил-1Н-индазол-3-ил)-3-(3-имидазол-1-ил-пропил)мочевина; 1-(3-аминопропил)-3-(6-хлор-5-фенил-1Н-индазол-3-ил)мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-[4-(4-пиридин-3-илимидазол-1-ил)бутил]мочевина; 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(2-пирролидин-1-илэтил)мочевина; (6-хлор-5-фенил-1Н-индазол-3-ил)амид 2,5-диметилпирролидин-1-карбоновой кислоты; N-(6-хлор-5-фенил-1Н-индазол-3-ил)ацетамидин; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-6-метоксипиразин-2-карбоксамидин; N-(6-хлор-5-фенил-1Н-индазол-3-ил)бензамидин; N-(6-хлор-5-фенил-1Н-индазол-3-ил)пиридин-2-карбоксамидин; N-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-метоксибензолсульфонамид; их изомеры, их смеси, их рацематы, энантиомеры, диастереоизомеры, таутомеры, а также их фармацевтически приемлемые соли. Изобретение относится также к фармацевтическим композициям, содержащим в качестве действующего начала производное формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, CSNR1R2, COOR1, SO2R1, C(=NH)R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)ОR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, гетероциклического остатка, формила, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила; R5, R6, независимо друг от друга, выбирают из следующих радикалов: атом галогена, CN, NO2, NH2, OH, COOH, C(O)OR8, -O-C(O)R8, NR8R9, NHC(O)R8, C(O)NR8R9, NHC(S)R8, C(S)NR8R9, SR8, S(O)R8, SO2R8, NHSO2R8, SO2NR8R9, -O-SO2R8, -SO2-O-R8, трифторметил, трифторметоксигруппа, (С1-С6)алкил, (С1-С6)алкоксил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, гетероциклический остаток, циклоалкил, алкенил, алкинил, адамантил, полициклоалкилы, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)OR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; R1, R2, R8, R9, R10, R11, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, трифторметила, трифторметоксигруппы; R1 и R2, или R8 и R9, или R10 и R11 могут образовывать 5- или 6-членный цикл, включающий или нет гетероатом, такой как O, S, N; и когда R3 означает 6-членный азотсодержащий гетероарил, или тиазолил, или имидазолил, или оксазолил, тогда по меньшей мере один из R5, R6 означает арил, который, в случае необходимости, замещен одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)ОR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; его рацемат, его энантиомеры, диастереоизомеры и их смеси, его таутомеры и его фармацевтически приемлемые соли. В особенности, настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве действующего начала производное формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, CSNR1R2, COOR1, SO2R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)ОR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, формила, оксогруппы, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила; R5 означает арил, возможно замещенный одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)OR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; R6 означает атом галогена, метил, циклопропил, CN, OH, метоксигруппу, трифторметил, этиленил, ацетиленил, трифторметокигруппу, NO2, NH2, N(СН3)2; R1, R2, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, оксогруппы, трифторметила, трифторметоксигруппы; R1 и R2 могут образовывать 5- или 6-членный цикл, включающий или нет гетероатом, такой как O, S, N; его рацемат, его энантиомеры, диастереоизомеры и их смеси, его таутомеры и его фармацевтически приемлемые соли. Предпочтительно, настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве действующего начала производное формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, COOR1, SO2R1, C(=NH)R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)OR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, формила, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила; R5 означает фенил; R6 означает хлор; R1, R2, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, трифторметила, трифторметоксигруппы; его изомеры, их смеси, его рацемат, его энантиомеры, диастереоизомеры, таутомеры, а также его фармацевтически приемлемые соли. Настоящее изобретение относится также к применению в качестве лекарственного средства производных аминоиндазолов формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, CSNR1R2, COOR1, SO2R1, C(=NH)R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)ОR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, гетероциклического остатка, формила, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила; R5, R6, независимо друг от друга, выбирают из следующих радикалов: атом галогена, CN, NO2, NH2, OH, COOH, C(O)OR8, -O-C(O)R8, NR8R9, NHC(O)R8, C(O)NR8R9, NHC(S)R8, C(S)NR8R9, SR8, S(O)R8, SO2R8, NHSO2R8, SO2NR8R9, -O-SO2R8, -SO2-O-R8, трифторметил, трифторметоксигруппа, (С1-С6)алкил, (С1-С6)алкоксил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, гетероциклический остаток, циклоалкил, алкенил, алкинил, адамантил, полициклоалкилы, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)OR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; R1, R2, R8, R9, R10, R11, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, трифторметила, трифторметоксигруппы; R1 и R2, или R8 и R9, или R10 и R11 могут образовывать 5- или 6-членный цикл, включающий или нет гетероатом, такой как O, S, N; и когда R3 означает 6-членный азотсодержащий гетероарил, или тиазолил, или имидазолил, или оксазолил, тогда по меньшей мере один из R5, R6 означает арил, который может быть замещен одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)ОR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; их рацематов, энантиомеров, диастереоизомеров и их смесей, их таутомеров и их фармацевтически приемлемых солей. В особенности, настоящее изобретение относится к применению в качестве лекарственного средства производных аминоиндазолов формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, CSNR1R2, COOR1, SO2R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)ОR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, формила, оксогруппы, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила; R5 означает арил, возможно замещенный одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)OR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; R6 означает атом галогена, метил, циклопропил, CN, OH, метоксигруппу, трифторметил, этиленил, ацетиленил, трифторметокигруппу, NO2, NH2, N(СН3)2; R1, R2, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, оксогруппы, трифторметила, трифторметоксигруппы; R1 и R2 могут образовывать 5- или 6-членный цикл, включающий или нет гетероатом, такой как O, S, N; их рацематов, энантиомеров, диастереоизомеров и их смесей, их таутомеров и их фармацевтически приемлемых солей. Предпочтительно, настоящее изобретение относится к применению в качестве лекарственного средства производных аминоиндазолов формулы (I), в которой: R3 означает (С1-С6)алкил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, конденсированный с (С1-С10)циклоалкилом арил или гетероарил, гетероциклический остаток, гетероциклоалкил, циклоалкил, адамантил, полициклоалкилы, алкенил, алкинил, CONR1R2, COOR1, SO2R1, C(=NH)R1, C(=NH)NR1, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)OR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, формила, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила; R5 означает фенил; R6 означает хлор; R1, R2, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, трифторметила, трифторметоксигруппы; их изомеров, их смесей, их рацематов, энантиомеров, диастереоизомеров, таутомеров, а также их фармацевтически приемлемых солей. Производные формулы (I) могут быть получены из соответствующих 3-амино-производных формулы (V), в которых азот в положении 1, в случае необходимости, защищен с помощью группы Pr. Pr означает триметилсилилэтоксиметил, тозил, мезил, бензил или группы, известные для защиты группы NH- ароматических гетероциклов, как указываемые в руководстве T.W. GREENE «Protective groups in organic Synthesis», J. Wiley-Interscience Publication (1999). 3-амино-1Н-индазолы формулы (II) могут быть получены путем реакции 2-фторбензонитрила с гидразингидратом или гидразингидрохлоридом при кипячении с обратным холодильником в течение 2-18 часов в спирте типа этанола или н-бутанола (согласно R.F. KALTENBACH, Bioorg. Med. Chem. Lett., 9 (15), 2259-2262 (1999)): Соединения, в которых R5, R6, независимо друг от друга, выбирают среди следующих радикалов: атом водорода, атом галогена, CN, NO2, NH2, OH, COOH, C(O)OR8, -O-C(O)R8, NR8R9, NHC(O)R8, C(O)NR8R9, NHC(S)R8, C(S)NR8R9, SR8, S(O)R8, SO2R8, NHSO2R8, SO2NR8R9, -O-SO2R8, -SO2-O-R8, трифторметил, трифторметоксигруппа, (С1-С6)алкил, (С1-С6)алкоксил, арил, арил(С1-С6)алкил, гетероарил, гетероарил(С1-С6)алкил, циклоалкил, алкенил, алкинил, адамантил, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR10, COOH, C(O)OR10, -O-C(O)R10, NR10R11, NHC(O)R10, C(O)NR10R11, NHC(S)R10, C(S)NR10R11, SR10, S(O)R10, SO2R10, NHSO2R10, SO2NR10R11, -O-SO2R10, -SO2-O-R10, арила, гетероарила, формила, трифторметила, трифторметоксигруппы, (С1-С6)алкила; могут быть получены путем реакций, используемых в химии палладия: Suzuki (A. SUZUKI, Pure Appl. Chem., 63, 419-422 (1991)), Stille (J. STILLE, Angew. Chem. Int. Ed., 25, 508-524 (1986)), Heck (R.F. HECK, Org. React., 27, 345-390 (1982)), Sonogashira (K. SONOGASHIRA, Synthesis, 777 (1977)), Buckwald (S.L. BUCKWALD, Acc. Chem. Re., 31, 805 (1998)), исходя из соответствующих галогенпроизводных. Для этого необходимо защищать реакционно-способные функциональные группы. Так, функциональные группы ОН, SH, COOH, NH2 должны быть защищены перед введением в реакцию связывания. Защитные группы вводят согласно любым, известным специалисту способам и, в частности, описанным в руководстве T.W. GREENE «Protective groups in Organic Synthesis», J. Wiley-Interscience Publication (1999). Предпочтительной является защита азота в положении 1 с помощью групп, таких как третбутоксикарбонил, или кремнийсодержащих производных. Предпочтительно выбирают силилированную группу, как третбутилдиметилсилил, триизопропилсилил, которые могут быть удалены с помощью фторанионов или с помощью уксусной кислоты, и, в особенности, триметилсилилэтоксиметил, отщепляемый с помощью тетрабутиламмонийфторида при кипячении с обратным холодильником в растворителях, таких как тетрагидрофуран, диоксан (J.P. WHITTEN, J. Org. Chem., 51, 1891 (1986); B.H. LIPSHUTZ, Tetrahedron Lett., 4095 (1986)), или с помощью 2н раствора хлороводорода в метаноле или этаноле при кипячении с обратным холодильником. Производные, защищенные в положении 1 триметилсилилэтоксиметильной группой, получают путем введения во взаимодействие исходных соединений с триметилсилилэтоксиметилхлоридом в присутствии гидрида натрия в растворителе, таком как диметилформамид, при комнатной температуре (J.P. WHITTEN, J. Org. Chem., 51, 1891 (1986); M.P. EDWARDS, Tetrahdron, 42, 3723 (1986)). Точно также, азотсодержащую функциональную группу 1-NH индазола защищают с помощью групп, таких как тозил, карбаматная группа, бензил, или групп силилированных производных. Например, в случае, когда желают осуществить связывание палладия с галогенированным в положении 6 производным, нужно защищать азот в положении 1, как показано ниже (Х=Cl, Br, I): Удаление защитной группы осуществляют согласно способам, известным специалисту и описанным в руководстве T.W. GREENE «Protective groups in Organic Synthesis», J. Wiley-Interscience Publication (1999). Например, если защитной группой в положении 1 является триметилсилилэтоксиметил, то он может быть удален путем введения во взаимодействие с тетрабутиламмонийфторидом, как показано ниже: Когда одна из групп R5, R6, участвующая в реакции связывания, используемой в химии палладия, сама содержит реакционно-способную функциональную группу, такую как гидроксил, аминогруппа, тиольная группа, кислотная группа, или, как правило, включает гетероатом, эти последние также необходимо защищать до осуществления связывания с палладием. Так, например, фенольную группу вводят в защищенной форме (как, например, О-бензил), когда исходят из производного, содержащего хлор и защищенный, как указано раньше, азот в положении 1: Бензильную группу затем удаляют, например, путем обработки триметилсилилиодидом при кипячении с обратным холодильником в ацетонитриле. Защиту также можно осуществлять с помощью триметилсилилэтоксиметильной группы, отщепляемой с помощью тетрабутиламмонийфторида при кипячении с обратным холодильником в растворителях, таких как тетрагидрофуран, диоксан (J.P. WHITTEN, J. Org. Chem., 51, 1891 (1986); B.H. LIPSHUTZ, Tetrahedron Lett., 4095 (1986)), или с помощью 2н раствора хлороводорода в метаноле или этаноле при кипячении с обратным холодильником. Когда R5 и R6, независимо друг от друга, означают арил и атом галогена, арильную группу вводят исходя из связи палладия в положении, занимаемом атомом брома, причем азот в положениях 1 и 3 защищают соответствующим образом. Предпочтительно, Pr означает триметилсилилэтоксиметил и Pr’ означает н-бутилкарбоксил, который вместе с азотом образует н-бутиламид. Стадию удаления защитной группы амида осуществляют в присутствии этаноламина при кипячении с обратным холодильником в течение недели в диметилформамиде. Это отщепление также может быть реализовано с помощью хлорида двухвалентного олова в этаноле (R.J. Griffin, J. Chem. Soc. Perkin I, 1811-1819 (1992)), или же с помощью метилата натрия в метаноле (Y. Furukawa, Chem. Pharm. Bull., 16, 1076 (1968)), или с помощью любого другого алкоголята в соответствующем спирте. Соединения формулы (II) являются исходными соединениями для получения большого разнообразия продуктов, получаемых путем реакции первичной аминогруппы 3-аминоиндазола в случае всех классических реакций этой функциональной группы, таких как алкилирование, ацилирование, реакции с карбонилированными производными с последующим восстановлением, сульфирование, превращение в мочевины или карбаматы, арилирование (реакции Castro или Buchwald) и т.д. Восстановления аминогрупп производных общей формулы (I), где R3 означает Н, когда Pr означает триметилсилилэтоксиметил, могут быть осуществлены с помощью производных бора, таких как триацетоксиборгидрид натрия, в дихлорметане в присутствии альдегида типа R1CHO в условиях, описанных в руководстве «Organic Reactions», том 59, 1-714 (E. Baxter, A. Reitz), или с помощью других восстановителей, обычно используемых для восстановления иминов, с образованием продуктов, где R3 означает (С1-С6)алкил, арил(С1-С6)алкил, гетероарил(С1-С6)алкил, гетероциклоалкил, циклоалкил, полициклоалкилы, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, CN, NO2, NH2, OH, OR1, COOH, C(O)ОR1, -O-C(O)R1, NR1R2, NHC(O)R1, C(O)NR1R2, SR1, S(O)R1, SO2R1, NHSO2R1, SO2NR1R2, C(S)NR1R2, NHC(S)R1, -O-SO2R1, -SO2-O-R1, арила, гетероарила, формила, трифторметила, трифторметилсульфанила, трифторметоксигруппы, (С1-С6)алкила. Реакции конденсации при использовании производных общей формулы (I), где R3 означает Н, с изоцианатами типа OCNR1, в частности, могут быть осуществлены в тетрагидрофуране и согласно примерам, описанным в книге «Comprehensive Organic functionnal Group Transformations», том 6 (Katritzky, Meth-Cohn, Rees, 1995), с образованием продуктов, где R3 означает CONR1R2; R1, R2, независимо друг от друга, означают атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, трифторметила, трифторметоксигруппы. Сульфирование производных общей формулы (I), где R3 означает Н, может быть осуществлено, исходя из сульфонилхлорида типа R1SO2Cl в присутствии основания (в частности, в присутствии третичных аминов, таких как триэтиламин, или ароматических соединений, таких как пиридин) в обычном растворителе, таком как, например, дихлорметан, с образованием продуктов, где R3 означает SO2R1 и R1 означает атом водорода, (С1-С6)алкил, арил, алкенил, алкинил, гетероарил, причем они сами могут быть замещены одним или несколькими заместителями, выбираемыми среди галогена, (С1-С6)алкила, (С1-С6)алкоксила, CN, NO2, NH2, OH, COOH, COOалкила, CONH2, формила, трифторметила, трифторметоксигруппы. Соединение формулы (IV), где Pr означает триметилсилилэтоксиметил, представляет собой 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазол, и его получают следующим образом: 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазол К 2,4 г N-[[5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазол-3-ил]]бутанамида, описанного ниже, в 75 см3 диметилформамида добавляют 1,63 см3 этаноламина, затем 2,24 г карбоната калия и кипятят с обратным холодильником в течение недели. Реакционную среду концентрируют досуха при пониженном давлении и обрабатывают с помощью 250 см3 этилацетата и 100 см3 воды. Органическую фазу декантируют и промывают последовательно 2 раза по 100 см3 воды и 75 см3 рассола. Органическую фазу сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2 кПа, 50°С). Полученное сырое масло очищают хроматографией под давлением аргона 50 кПа на колонке с силикагелем (гранулометрия 40-60 мкм; диаметр 4 см), элюируя смесью циклогексана и этилацетата (в соотношении 80:20 по объемам) и собирая фракции по 35 см3. Фракции, содержащие целевой продукт, объединяют и выпаривают при пониженном давлении (2 кПа; 50°С). После высушивания (90 Па, 45°С) получают 0,43 г 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазола в виде масла желтого цвета. 1Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6, (в м.д.): -0,05 (9Н, с); 0,83 (2Н, т, J=8 Гц); 3,52 (2Н, т, J=8 Гц); 5,49 (2Н, с); 5,75 (2Н, уш. с); от 7,30 до 7,55 (5Н, м); 7,77 (1Н, с); 7,81 (1Н, с). N-[[5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазол-3-ил]]бутанамид получают следующим образом: К 2 г N-[[5-бром-6-хлор-1-[(2-триметилсилилэтокси)метил]индазол-3-ил]]бутанамида, описываемого ниже, в 180 см3 диоксана добавляют 821 мг фенилбороновой кислоты, 1,14 г карбоната натрия в 30 см3 дистиллированной воды и, наконец, 347 мг тетракис(трифенилфосфин)палладия. Кипятят с обратным холодильником в течение 90 минут, затем выдерживают до возврата температуры к 20°С для добавления 100 см3 этилацетата и 100 см3 дистиллированной воды. Органическую фазу промывают с помощью 100 см3 водного насыщенного раствора хлорида натрия, затем декантируют и сушат над сульфатом магния. После фильтрации через фильтр из пористого стекла фильтрат концентрируют досуха при пониженном давлении (2 кПа, 50°С). Остаток очищают хроматографией под давлением аргона 50 кПа на колонке с силикагелем (гранулометрия 40-60 мкм; диаметр 4,5 см), элюируя смесью циклогексана и этилацетата (в соотношении 80:20 по объемам) и собирая фракции по 35 см3. Фракции, содержащие целевой продукт, объединяют и выпаривают при пониженном давлении (2 кПа; 50°С). После высушивания (90 Па, 45°С), таким образом, получают 2 г N-[[5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазол-3-ил]]бутанамида в виде масла желтого цвета. 1Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6, (в м.д.): -0,05 (9Н, с); 0,85 (2Н, т, J=8 Гц); 0,92 (3Н, т, J=7,5 Гц); 1,63 (2Н, м); 2,38 (2Н, т, J=7,5 Гц); 3,56 (3Н, т, J=8 Гц); 5,70 (2Н, с); от 7,30 до 7,55 (5Н, м); 7,91 (1Н, с); 7,99 (1Н, с); 10,59 (1Н, с уш.). N-[[5-бром-6-хлор-1-[(2-триметилсилилэтокси)метил]индазол-3-ил]бутанамид получают следующим образом: К 1 г N-[[6-хлор-1-[(2-триметилсилилэтокси)метил]индазол-3-ил]]бутанамида, описываемого ниже, в 15 см3 хлороформа добавляют 0,22 см3 пиридина, затем добавляют 0,14 см3 брома. Перемешивают в течение 24 часов при температуре 20°С, после этого добавляют 50 см3 дихлорметана и 50 см3 водного насыщенного раствора сульфата натрия. После перемешивания в течение 10 минут нерастворимую часть удаляют путем фильтрования через стеклянный пористый фильтр и органическую фазу промывают с помощью 50 см3 водного насыщенного раствора хлорида натрия. Органическую фазу декантируют, сушат над сульфатом магния, фильтруют и выпаривают досуха при пониженном давлении (2 кПа; 50°С). Остаток очищают хроматографией под давлением аргона 50 кПа на колонке с силикагелем (гранулометрия 40-60 мкм; диаметр 3,5 см), элюируя смесью этилацетата и циклогексана (в соотношении 20:80 по объемам) и собирая фракции по 35 см3. Фракции, содержащие целевой продукт, объединяют и выпаривают при пониженном давлении (2 кПа; 50°С). После высушивания (90 Па, 45°С) получают 0,94 г N-[[5-бром-6-хлор-1-[(2-триметилсилилэтокси)метил]индазол-3-ил]]бутанамида в виде твердого вещества белого цвета, плавящегося при температуре 130°С. 1Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6, (в м.д.): -0,08 (9Н, с); 0,82 (2Н, т, J=8 Гц); 0,95 (3Н, т, J=7,5 Гц); 1,66 (2Н, м); 2,40 (2Н, т, J=7,5 Гц); 3,52 (3Н, т, J=8 Гц); 5,66 (2Н, с); 8,13 (1Н, с); 8,34 (1Н, с); 10,67 (1Н, с уш.). N-[[6-хлор-1-[(2-триметилсилилэтокси)метил]индазол-3-ил]]бутанамид получают следующим образом: К 606 мг 60%-ного гидрида натрия в 20 см3 диметилформамида добавляют 3 г N-(6-хлор-1Н-индазол-3-ил)бутанамида в виде раствора в 40 см3 диметилформамида. После охлаждения до температуры 5°С добавляют 2,68 см3 2-(триметилсилил)этоксиметилхлорида в 10 см3 диметилформамида. Выдерживают для возврата температуры к 21°С и перемешивают в течение 2 часов. Реакционную среду затем выпаривают при пониженном давлении (2 кПа; 45°С). Остаток обрабатывают с помощью 200 см3 этилацетата и 100 см3 дистиллированной воды. Снова промывают 2 раза по 100 см3 дистиллированной воды и с помощью 100 см3 водного насыщенного раствора хлорида натрия. Органическую фазу сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр, затем выпаривают при пониженном давлении (2 кПа; 50°С). Остаток очищают хроматографией под давлением аргона 50 кПа на колонке с силикагелем (гранулометрия 40-60 мкм; диаметр 4,5 см), элюируя смесью циклогексана и этилацетата (в соотношении 80:20 по объемам) и собирая фракции по 100 см3. Фракции, содержащие целевой продукт, объединяют и выпаривают при пониженном давлении (2 кПа; 50°С). После высушивания (90 Па; 50°С) получают 3 г N-[[6-хлор-1-[(2-триметилсилилэтокси)метил]индазол-3-ил]]бутанамида в виде масла желтого цвета. 1Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6, (в м.д.): -0,08 (9Н, с); 0,83 (2Н, т уш., J=8 Гц); 0,96 (3Н, т, J=7,5 Гц); 1,67 (2Н, м); 2,40 (2Н, т, J=7,5 Гц); 3,53 (2Н, т, J=8 Гц); 5,66 (2Н, с); 7,16 (1Н, дд, J=9 и 2 Гц); 7,86 (1Н, д, J=2 Гц); 7,88 (1Н, д, J=9 Гц); 10,53 (1Н, массив). N-(6-хлор-1Н-индазол-3-ил)бутанамид К 750 мг 3-амино-6-хлор-1Н-индазола в 10 см3 пиридина, после охлаждения реакционной среды до температуры 3°С, добавляют 0,47 см3 бутирилхлорида. Затем выдерживают в течение 14 часов при возврате среды к температуре 19°С. Реакционную среду выпаривают досуха при пониженном давлении (2 кПа; 40°С). Остаток обрабатывают с помощью 50 см3 этилацетата, 50 см3 тетрагидрофурана и 50 см3 дистиллированной воды. Органическую фазу снова промывают с помощью 50 см3 дистиллированной воды и с помощью 50 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр и выпаривают при пониженном давлении. Полученный остаток очищают хроматографией под давлением аргона 50 кПа на колонке с силикагелем (гранулометрия 40-60 мкм; диаметр 2,5 см), элюируя смесью циклогексана и этилацетата (в соотношении 70:30 по объемам) и собирая фракции по 25 см3. Фракции, содержащие целевой продукт, объединяют и выпаривают при пониженном давлении (2 кПа; 40°С). После высушивания (90 Па; 45°С) получают 200 мг N-(6-хлор-1Н-индазол-3-ил)бутанамида в виде твердого вещества белого цвета, плавящегося при температуре 230°С. 1Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6, (в м.д.): 0,98 (3Н, т, J=7 Гц); 1,67 (2Н, м); 2,40 (2Н, т, J=7 Гц); 7,08 (1Н, дд, J=9 и 2 Гц); 7,52 (2Н, д, J=2 Гц); 7,84 (1Н, д, J=9 Гц); 10,39 (1Н, массив); от 12,50 до 13,00 (1Н, массив уш.). 3-амино-6-хлор-5-фенил-1Н-индазол получают из 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазола. К 108,3 мг 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазола в 4,7 мл метанола добавляют 300 мкл 2н HCl. Реакционную смесь подвергают воздействию микроволнового излучения в течение 150 секунд при температуре 140°С. Выливают в насыщенный раствор КН2РО4 и экстрагируют этилацетатом. Органические фазы сушат над безводным сульфатом магния, фильтруют и концентрируют. Полученный сырой продукт очищают на диоксиде кремния и получают 63,5 мг 3-амино-6-хлор-5-фенил-1Н-индазола. Соединения формулы (I) выделяют, и они могут быть очищены обычными известными способами, например кристаллизацией, хроматографией или экстракцией. Соединения формулы (I), в случае необходимости, могут быть превращены в аддитивные соли неорганической или органической кислоты путем воздействия такой кислоты в органическом растворителе, таком как спирт, кетон, простой эфир или хлорированный растворитель. Эти соли также составляют часть изобретения. В качестве примеров фармацевтически приемлемых солей могут быть указаны следующие соли: бензолсульфонат, гидробромид, гидрохлорид, цитрат, этансульфонат, фумарат, глюконат, иодат, малеат, изетионат, метансульфонат, метилен-бис- Соединения формулы (I) являются ингибиторами киназы и, таким образом, пригодны для предупреждения и лечения нейродегенеративных заболеваний, болезни Альцгеймера, болезни Паркинсона, лобно-теменной деменции, кортикобазальной дегенерации, болезни Пика, цереброваскулярных осложнений, черепно-мозговых и позвоночных травм и периферических невропатий, ожирения, эссенциальной гипертензии, атеросклеротических сердечно-сосудистых заболеваний, синдрома поликистозных яичников, синдрома Х, иммунодефицита и рака. Их активности определяли путем измерения ингибирования фосфорилирования протеина tau в срезах коры головного мозга взрослой крысы. Срезы коры головного мозга толщиной 300 мкм приготовляли при использовании самцов крыс OFA (Iffa-Credo) в возрасте 8-10 недель, умерщвленных путем декапитации. Их инкубировали в 5 мл модифицированной по способу Дульбекко среды Игла (DMEM), содержащей пируват и глюкозу в концентрации 4,5 г/л, при температуре 37°С в течение 40 минут. Срезы затем промывали 2 раза с помощью среды, распределяли в микропробирки (50 мкл в 500 мкл среды с тестируемыми соединениями или без них) и инкубировали при температуре 37°С при перемешивании. Спустя два часа эксперимент прекращали путем центрифугирования. Срезы лизировали, обрабатывали ультразвуком и центрифугировали с ускорением 18300 g в течение 15 минут при температуре 4°С. Концентрацию протеинов в супернатанте определяли на имеющемся в продаже приборе для количественного определения (ВСА Protein Assay, Pierce), основанного на методе Lowry. Образцы, предварительно денатурированные в течение 10 минут при температуре 70°С, разделяли на вертикальном геле 4-12% Bis-Tris в присутствии буфера MOPS-SDS и подвергали электроблоттингу на нитроцеллюлозной мембране. Иммуномаркировку осуществляли с помощью моноклонального антитела AD2, которое специфически распознает фосфорилированные эпитопы Ser396/404 протеина tau. Иммунореакционноспособные протеины визуализировали путем добавления второго антитела, направленного против IgG мыши и связанного с пероксидазой, и хемилюминесцентного субстрата. Полученные авторадиограммы, наконец, количественно оценивали с помощью пакета программ «GeneTools» Syngene (GeneGnome, Ozyme) для определения полумаксимальной ингибирующей концентрации (CI50). Соединения формулы (I) обладают представляющей интерес активностью, и, в частности, некоторые соединения имеют CI50 ниже 100 мкмоль. Условия анализа продуктов согласно жидкостной хроматографии/масс-спектрометрии (LC/MS) реализовали в приборе Waters Alliance 2695 для части жидкостной хроматографии и Waters-Micromass Platform II для масс-спектральной части. Следующие примеры поясняют изобретение, не ограничивая его объема охраны. Пример А1 N-Бутил-6-хлор-5-фенил-1Н-индазол-3-амин Стадия 1: 24 мг н-бутиральдегида и 113 мг триацетоксиборгидрида натрия добавляют к раствору 100 мг 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазола в 5 см3 дихлорметана. После выдерживания в течение 3 часов при комнатной температуре реакционную среду гидролизуют, затем экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, фильтруют и выпаривают.Очистка сырого продукта хроматографией на диоксиде кремния (элюирующее средство: этилацетат/гексан (в соотношении 80:20 об./об.)) позволяет получить 21 мг бутил[6-хлор-5-фенил-1-(2-триметилсиланилэтоксиметил)-1Н-индазол-3-ил]амина (твердое вещество желтого цвета). Масс-спектр: 432 [M+H]+; время удерживания: 5,26 минут. 1Н-ЯМР [ДМСО-d6], Стадия 2: 0,7 мл 2н HCl добавляют к раствору 21 мг бутил[6-хлор-5-фенил-1-(2-триметилсиланилэтоксиметил)-1Н-индазол-3-ил]амина в 0,3 см3 метанола. Реакционную среду перемешивают при комнатной температуре в течение 48 часов, в течение 1 часа кипятят с обратным холодильником, затем выпаривают. Полученное твердое вещество высушивают в вакууме, получая 16 мг N-бутил-6-хлор-5-фенил-1Н-индазол-3-амина (твердое вещество желтого цвета). Масс-спектр: 300 [M+H]+; время удерживания: 4,25 минут. 1Н-ЯМР [ДМСО-d6], Пример А2 3-(6-хлор-5-фенил-1Н-индазол-3-иламино)тиофен-2-карбонитрил К 52 мг 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазола в 0,5 мл 1-метил-2-пирролидона (NMP) добавляют 38 мг 2-дициклогексилфосфино-2′-(N,N-диметиламино)бифенила, 20 мг трис(дибензилиденацетон)дипалладия-(0) (Pd2dba3), 52 мг 2-циано-3-бромтиофена, 23 мг третбутилата натрия. Реакционную смесь подвергают воздействию микроволнового излучения в течение 3 минут при температуре 140°С. После обычных обработок сырой продукт обрабатывают с помощью 2н раствора хлороводорода в метаноле, получая, после очистки, 8,4 мг 3-(6-хлор-5-фенил-1Н-индазол-3-иламино)тиофен-2-карбонитрила. Масс-спектр: 351 [M+H]+; время удерживания: 4,19 минут. 1Н-ЯМР [ДМСО-d6], Примеры А3 – А5 Соединения нижеуказанных примеров получают по эквивалентной методике согласно примеру А2.
Пример В1 N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-фенилмочевина Стадия 1: 39 мкл фенилизоцианата добавляют к раствору 102,2 мг 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазола в 2,5 см3 тетрагидрофурана. Реакционную среду перемешивают в течение 24 часов при комнатной температуре, затем выпаривают. Очистка сырого продукта хроматографией на диоксиде кремния (элюирующее средство: дихлорметан/ацетон (в соотношении 98:2 об./об.)) позволяет получить 122,5 мг 1-[6-хлор-5-фенил-1-(2-триметилсиланилэтоксиметил)-1Н-индазол-3-ил]-3-фенилмочевины (бесцветное твердое вещество). Масс-спектр: 493 [M+H]+; время удерживания: 6,02 минут. 1Н-ЯМР [ДМСО-d6], Стадия 2: 1 мл 2н HCl добавляют к раствору 106 мг 1-[6-хлор-5-фенил-1-(2-триметилсиланилэтоксиметил)-1Н-индазол-3-ил]-3-фенилмочевины в 12 см3 метанола. Реакционную среду перемешивают при комнатной температуре в течение 48 часов, кипятят с обратным холодильником в течение 5 часов, затем выпаривают. Полученное твердое вещество высушивают в вакууме, получая 82 мг N-(6-хлор-5-фенил-1Н-индазол-3-ил)-N’-фенилмочевины (бесцветное твердое вещество). Масс-спектр: 363 [M+H]+; время удерживания: 5,15 минут. 1Н-ЯМР [ДМСО-d6], Пример В2 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(4-этоксифенил)мочевина К 80 мг 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазола в 1 мл тетрагидрофурана добавляют 36,4 мг 4-этоксифенилизоцианата. Нагревают при температуре 50°С в течение 1 часа, затем гидролизуют в насыщенном растворе КН2РО4 и экстрагируют дихлорметаном. После высушивания и выпаривания сырой продукт очищают хроматографией на диоксиде кремния при использовании смеси этилацетата и гексана. Из полученного продукта удаляют защитную группу путем кипячения с обратным холодильником в течение 3 часов в 2 мл смеси метанола и 2н HCl в соотношении 1:1. Получают 62,5 мг 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-(4-этоксифенил)мочевины. Масс-спектр: 407 [M+H]+; время удерживания: 4,36 минут. 1Н-ЯМР [ДМСО-d6], Примеры В3-В13 Продукты В3-В13 получают по эквивалентной для получения продукта В2 методике.
Пример С1 1-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-[3-(4-метилпиперазин-1-ил)пропил]мочевина Стадия 1: к 387,8 мг 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазола в 2 мл дихлорметана добавляют последовательно 62 мкл пиридина и 125 мкл этилхлорформиата. По истечении 75 минут реакция заканчивается. После гидролиза, экстракции и выпаривания получают 571 мг сырого карбамата: этилового эфира (6-хлор-5-фенил-1Н-индазол-3-ил)карбаминовой кислоты. Стадия 2: к 106 мг вышеполученного карбамата в 2,5 мл трифтортолуола добавляют 377 мг 3-аминопропил-1-метилпиперазина и реакцию проводят под воздействием микроволнового излучения в течение 20 минут при температуре 200°С. После очистки с помощью препаративной жидкостной хроматографии с масс-спектрометрией (ацетонитрил/буфер, рН 9) получают 60 мг 1-[6-хлор-5-фенил-1-(2-триметилсиланилэтоксиметил)-1Н-индазол-3-ил]-3-[3-(4-метилпипериазин-1-ил)пропил]мочевины. Стадия 3: вышеполученное соединение обрабатывают с помощью 2 мл смеси метанола и 2н HCl в соотношении 1:1 и кипятят с обратным холодильником в течение 3 часов. 1Н-ЯМР [ДМСО-d6], Примеры С2 – С19 Продукты С2-С19 получают по эквивалентной для получения продукта С1 методике.
Пример D1 N-(6-хлор-5-фенил-1Н-индазол-3-ил)ацетамидин К 50 мг 3-амино-6-хлор-5-фенил-1Н-индазола в 3 мл ацетонитрила и 12 мг уксусной кислоты добавляют 33 мг метилацетилимидата. Реакционную смесь подвергают воздействию микроволнового излучения в течение 5 минут при температуре 180°С. После обычных обработок и очистки на диоксиде кремния получают 35 мг N-(6-хлор-5-фенил-1Н-индазол-3-ил)ацетамидина. Примеры D2 – D4 Нижеуказанные продукты получают по эквивалентной для получения продукта D1 методике.
Пример Е1 N-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-метоксибензолсульфонамид Стадия 1: 0,236 см3 пиридина и 26,5 мг 3-метоксифенилсульфонилхлорида добавляют к раствору 54,1 мг 3-амино-5-фенил-6-хлор-1-[(2-триметилсилилэтокси)метил]индазола в 2 см3 дихлорметана. Реакционную среду перемешивают в течение 24 часов при комнатной температуре, затем выпаривают. Очистка сырого продукта хроматографией на силикагеле (элюиующее средство: дихлорметан/ацетон (в соотношении 98:2 об./об.)) позволяет получить 70 мг 1N-[6-хлор-5-фенил-1-(2-триметилсиланилэтоксиметил)-1Н-индазол-3-ил]-3-метоксибензолсульфонамида (бесцветная пена). Масс-спектр: 546 [M+H]+; время удерживания: 4,24 минуты. 1Н-ЯМР [ДМСО-d6], Стадия 2: 1 см3 2н HCl добавляют к раствору 10,8 мг 1N-[6-хлор-5-фенил-1-(2-триметилсиланилэтоксиметил)-1Н-индазол-3-ил]-3-метоксибензолсульфонамида в 1 см3 метанола. Реакционную среду перемешивают при комнатной температуре в течение 48 часов, кипятят с обратным холодильником в течение 1 часа, затем выпаривают.Полученное твердое вещество высушивают в вакууме, получая 8 мг N-(6-хлор-5-фенил-1Н-индазол-3-ил)-3-метоксибензолсульфонамида (бесцветное твердое вещество). Масс-спектр: 414 [M+H]+; время удерживания: 4,04 минуты. 1Н-ЯМР [ДМСО-d6], Фармацевтические композиции согласно изобретению образованы соединением формулы (I) или солью такого соединения, в чистом состоянии или в виде композиции, в которой оно ассоциировано с любым другим фармацевтически приемлемым продуктом, который может быть инертным или физиологически активным. Лекарственные средства согласно изобретению можно вводить перорально, парентерально, ректально или локально. В качестве твердых композиций для введения перорально могут быть использованы таблетки, пилюли, порошки (желатиновые капсулы, крахмальные облатки) или гранулы. В этих композициях действующее начало согласно изобретению смешано в токе аргона с одним или несколькими инертными разбавителями, такими как крахмал, целлюлоза, сахароза, лактоза или диоксид кремния. Эти композиции также могут включать вещества, отличные от разбавителей, например одно или несколько смазывающих веществ, таких как стеарат магния или тальк, краситель, защитное покрытие (драже) или лак. В качестве жидких композиций для перорального введения можно использовать фармацевтически приемлемые растворы, суспензии, эмульсии, сиропы и эликсиры, содержащие инертные разбавители, такие как вода, этанол, глицерин, растительные масла или парафиновое масло. Эти композиции могут включать вещества, отличные от разбавителей, например смачиватели, подсластители, загустители, ароматизаторы или стабилизаторы. Стерильные композиции для парентерального введения могут представлять собой предпочтительно водные или неводные растворы, суспензии или эмульсии. В качестве растворителя или эксципиента можно использовать воду, пропиленгликоль, полиэтиленгликоль, растительные масла, в особенности оливковое масло, пригодные для инъекций органические сложные эфиры, как, например, этилолеат, или другие приемлемые органические растворители. Эти композиции также могут содержать добавки, в частности смачиватели, изотонизирующие компоненты, эмульгаторы, диспергаторы и стабилизаторы. Стерилизация может быть осуществлена несколькими способами, например путем асептизирующей фильтрации, путем включения в композицию стерилизующих агентов, путем облучения или путем нагревания. Они также могут быть получены в виде твердых стерильных композиций, которые в момент употребления могут быть растворены в стерильной воде или любой другой стерильной среде для инъекций. Композиции для ректального введения представляют собой суппозитории или ректальные капсулы, которые содержат, кроме активного продукта, эксципиенты, такие как масло какао, полусинтетические глицериды или полиэтиленгликоли. Композициями для локального применения могут быть, например, кремы, лосьоны, примочки для глаз, жидкости для полоскания полости рта и аппликации на десны, капли в нос или аэрозоли. Объектом изобретения являются аминоиндазолы формулы (I) и их фармацевтически приемлемые соли, используемые для получения фармацевтических композиций, предназначенных для предупреждения и лечения заболеваний, которые могут возникать в результате анормальной активности киназ, например киназ, принимающих участие в нейродегенеративных заболеваниях, болезни Альцгеймера, болезни Паркинсона, лобно-теменной деменции, кортикобазальной дегенерации, болезни Пика, цереброваскулярных осложнениях, черепно-мозговых и позвоночных травмах и периферических невропатиях, ожирении, болезнях обмена веществ, диабете типа II, эссенциальной гипертензии, атеросклеротических сердечно-сосудистых заболеваниях, синдроме поликистозных яичников, синдроме Х, иммунодефиците и раке. В качестве анормальной активности киназы можно назвать, например, таковую Р13К, AkT, GSK3- В терапии человека соединения согласно изобретению особенно пригодны для лечения и/или предупреждения нейродегенеративных заболеваний, болезни Альцгеймера, болезни Паркинсона, лобно-теменной деменции, кортикобазальной дегенерации, болезни Пика, цереброваскулярных осложнений, черепно-мозговых и позвоночных травм и периферических невропатиий, ожирения, болезней обмена веществ, диабета типа II, эссенциальной гипертензии, атеросклеротических сердечно-сосудистых заболеваний, синдрома поликистозных яичников, синдрома Х, иммунодефицита и рака. Дозы зависят от искомого эффекта, продолжительности лечения и используемого пути введения; они обычно составляют от 5 мг до 1000 мг в сутки перорально для взрослого с разовыми дозами от 1 мг до 250 мг активного вещества. В общем, врач определяет соответствующую дозировку в зависимости от возраста, массы и всех других факторов, присущих пациенту. Следующие примеры иллюстрируют композиции согласно изобретению. ПРИМЕР А Приготовляют, согласно обычной методике, желатиновые капсулы с дозами 50 мг действующего начала, имеющие следующий состав:
ПРИМЕР В Приготовляют, согласно обычной методике, таблетки с дозами 50 мг действующего начала, имеющие следующий состав:
ПРИМЕР С Готовят раствор для инъекций, содержащий 10 мг активного продукта, следующего состава:
Настоящее изобретение относится также к способу предупреждения и лечения заболеваний, в случае которых происходит фосфорилирование протеина Tau, путем введения соединения формулы (I) и его фармацевтически приемлемых солей.
Формула изобретения
1. Соединения формулы (I) 2. Соединение по п.1, отличающееся тем, что его выбирают из группы, состоящей из: 3. Соединение по любому из пп.1 или 2, используемое для получения лекарственного средства, ингибирующего фосфорилирование протеина Таu. 4. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении протеина Таu, отличающаяся тем, что она содержит, в фармацевтически приемлемой среде, соединение по любому из пп.1 и 2. 5. Способ получения соединений формулы (I), таких как указанные в п.1, и где R3 означает (С1-С6)алкил, и R1 обозначает (С1-С6)алкил исходя из производного формулы (I), где R3 означает Н, производного R1CHO и триацетоксиборгидрида натрия в дихлорметане. 6. Способ получения соединений формулы (I), таких как указанные в п.1, и где R3 означает CONR1R2; R1, R2, независимо друг от друга, обозначают атом водорода, возможно замещенный одним атомом галогена (С1-С6)алкил, моноциклический арил или моноциклический 5- или 6-членный гетероарил, включающий от 1 до 2 гетероатомов, таких как S, О, N, возможно замещенные одним или несколькими заместителями, выбранными из галогена, (С1-С6)алкила, (С1-С6)алкоксила, трифторметила; исходя из OCNR1 и производного формулы (I), где R3 означает Н, в тетрагидрофуране. 7. Способ получения соединений формулы (I), таких как указанные в п.1, и где R3 означает SO2R1, и R1 обозначает моноциклический арил, возможно замещенный (С1-С6)алкоксилом; исходя из сульфонилхлорида R1SO2Cl и производного формулы (I), где R3 означает Н, в дихлорметане в присутствии основания. 8. Соединения, выбранные из группы, состоящие из:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



 -оксинафтоат, нитрат, оксалат, памоат, фосфат, салицилат, сукцинат, сульфат, тартрат, теофиллинацетат и п-толуолсульфонат.
-оксинафтоат, нитрат, оксалат, памоат, фосфат, салицилат, сукцинат, сульфат, тартрат, теофиллинацетат и п-толуолсульфонат. , м.д.: 7,83 (1Н, с); 7,73 (1Н, с); 7,35-7,50 (5Н, м); 6,25 (1Н, т, J=6 Гц); 5,49 (2Н, с); 3,52 (2Н, т, J=8 Гц); 3,24 (2Н, м); 1,60 (2Н, м); 1,39 (2Н, м); 0,91 (3Н, т, J=7 Гц); 0,81 (2Н, т, J=8 Гц); -0,07 (9Н, с).
, м.д.: 7,83 (1Н, с); 7,73 (1Н, с); 7,35-7,50 (5Н, м); 6,25 (1Н, т, J=6 Гц); 5,49 (2Н, с); 3,52 (2Н, т, J=8 Гц); 3,24 (2Н, м); 1,60 (2Н, м); 1,39 (2Н, м); 0,91 (3Н, т, J=7 Гц); 0,81 (2Н, т, J=8 Гц); -0,07 (9Н, с).