Патент на изобретение №2378256
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ХИНОЛИН В КАЧЕСТВЕ АЛЛОСТЕРИЧЕСКОГО ЭНХАНСЕРА РЕЦЕПТОРОВ ГАМК-В
(57) Реферат:
Настоящее изобретение относится к соединениям формулы (I),
Настоящее изобретение относится к соединениям формулы I
где R1 представляет собой водород, C1-C7 алкил, C1-C7 галоалкил, ди(С1-С7)алкиламино, С3-C8 циклоалкил, или 5- или 6-членный гетероциклоалкил; R2 представляет собой C1-C7 алкил, арил, C1-C7 алкокси(С1-С7)алкил, C1-C7 галоалкил или С3-С8 циклоалкил; R3, R4 каждый независимо представляют собой водород, галоген, гидрокси, С1-С7 алкокси, C1-C7 галоалкокси, ди(С1-С7)алкиламино, C1-C7 алкилсульфонил, или 5- или 6-членный гетероциклоалкил; R5 представляет собой водород, галоген, C1-C7 алкил, C1-C7 алкокси, C1-C7 галоалкокси, или арилокси, или представляет собой -NR7R8, где R7 и R8 представляют собой С1-С7 алкилы, или R7 и R8 могут вместе с атомом азота, к которому они присоединены, образовывать 4-8-членную гетероциклоалкильную группу, которая может быть замещена одним или более чем одним заместителем(ями), выбранными из группы, состоящей из галогена, C1-C7 алкила, C1-C7 алкокси, гидрокси, фенила и ди(С1-С7)алкиламиногруппы; R6 представляет собой водород, или вместе с R5 может образовывать 5- или 6-членную гетероциклоалкильную группу, которая может быть замещена одним или более чем одним галогеном; и их фармацевтически приемлемые соли присоединения кислоты, за исключением следующих соединений: 1-(6-Хлор-2-метил-4-фенил-хинолин-3-ил)-этанон; 1-(6-Бром-4-фенил-2-пиперидин-1-ил-хинолин-3-ил)-этанон; 1-[4-(4-Хлор-фенил)-2-метил-хинолин-3-ил]-этанон; 1-(6-Бром-2-метил-4-фенил-хинолин-3-ил)-этанон; 1-(2,6-Диметил-4-фенил-хинолин-3-ил)-этанон; и 1-(2-Метил-4-фенил-6-трифторметокси-хинолин-3-ил)-этанон. Эти шесть соединений, исключенных из объема формулы I, известны из химических библиотек. Указанные шесть соединений никогда не описывались в связи с рецепторами ГАМКB. Соединения формулы I и их соли отличают ценные терапевтические свойства. Было найдено, что эти соединения активны по отношению к рецептору ГАМКB.
Нативные ГАМКB рецепторы представляют собой гетеромерные структуры, состоящие из двух типов субъединиц, ГАМКBR1 и ГАМКBR2 субъединиц (Kauрmann et al., Nature, 386, 239-246, 1997 and Nature, 396, 683-687, 1998). Структура ГАМКBR1 и R2 показывает, что они принадлежат семейству рецепторов, сопряженных с G-белком (GPCR), называемых семейством 3. Другие члены семейства 3 рецепторов GPCR включают метаботропный глутамат (mGlu1-8), кальций-чувствительный, вомероназальный, феромонный и предполагаемый вкусовой рецепторы (Pin et al., Pharmaco. Ther. 98, 325-354, 2003). Рецепторы семейства 3 (включая ГАМКB рецепторы) характеризуются двумя отчетливо изолированными топологическими доменами: исключительно длинным внеклеточным амино-концевым доменом (ATD, 500-600 аминокислот), который содержит модуль венериной мухоловки для связывания агониста (ортостерический сайт) (Galvez et al., J. Biol. Chem., 275, 41166-41174, 2000) и 7ТМ спиральными сегментами с внутриклеточным карбоксил-концевым доменом, который вовлечен в активацию рецептора и взаимодействие с G-белком. Механизм активации рецептора агонистом в гетеродимере ГАМКBR1R2 уникален среди рецепторов GPCR. В гетеромере только субъединица ГАМКBR1 связывается с ГАМК, в то время как ГАМКBR2 отвечает за взаимодействие с G-белком и его активацию. (Havlickova et al., Mol. Pharmacol. 62, 343-350, 2002; Kniazeff et al., J. Neurosci., 22, 7352-7361, 2002). Schuler et al., Neuron, 31, 47-58, 2001 уже показали наличие спонтанных судорог и гипералгези у мышей с “нокаутом” по ГАМКBR1. Эти “нокаут”-мыши утратили все биохимические и электрофизиологические ГАМКB ответы. Интересно отметить, что ГАМКBR1 “нокаут”-мыши испытывали наибольшую тревожность в двух моделях, а именно в черно-белой камере (уменьшенное время нахождения на свету) и испытаниях на лестнице (уменьшенные ступени и шаги для подъема). Они показали явное ухудшение модели выполнения теста пассивного избегания, что указывало на заторможенные процессы в памяти. ГАМКBR1 “нокаут”-мыши также показали увеличенную гиперподвижность и гиперактивность в новой обстановке. Ген ГАМКBR1 картирован на хромосоме 6р21.3 и находится в пределах области HLA класса I, связанной с шизофренией, эпилепсией и дислексией (Peters et al., Neurogenetics, 2, 47-54, 1998). Mondabon et al., Am. J. Med. Genet 122B/1, 134, 2003 сообщили о слабой связи Ala20Val полиморфизма гена ГАМКBR1 с шизофренией. Кроме того, Gassmann et al., J Neurosci. 24, 6086-6097, 2004 показали, что ГАМКBR2 “нокаут”-мыши страдают от спонтанных судорог, гипералгезии, гиперподвижности и серьезного ухудшения памяти по сравнению с ГАМКBR1 “нокаут”-мышами. Следовательно, гетеромерные ГАМКB R1R2 рецепторы отвечают за эти фенотипы. Баклофен (Лиоресал Urwyler et al., Mol. Pharmacol., 60, 963-971, 2001 сообщили о новом классе лигандов ГАМКB рецептора, названных положительными аллостерическими модуляторами, соединении CGP7930 [2,6-ди-трет-бутил-4-(3-гидрокси-2,2-диметил-пропил)-феноле] и его альдегидном аналоге CGP13501. Эти лиганды сами не оказывают никакого эффекта на ГАМКB рецепторы, но совместно с эндогенным ГАМКB они увеличивают силу и максимальную эффективность ГАМК в ГAMKBR1R2 (Pin et al., Mol. Pharmacol., 60, 881-884, 2001). Интересно отметить, что последние исследования CGP7930 (Binet et al., J Biol Chem., 279, 29085-29091, 2004) показали, что этот положительный модулятор напрямую активирует семь трансмембранных доменов (7TMD) субъединицы ГАМКBR2. Mombereau et al., Neuropsychopharmacology, 1-13, 2004 недавно сообщили об анксиолитических эффектах при остром и хроническом лечении с помощью положительного модулятора ГАМКB рецептора, GS39783 (N,N-дициклопентил-2-метилсульфанил-5-нитро-пиримидин-4,6-диамина) (Urwyler et al., J. Pharmacol. Exp.Ther., 307, 322-330, 2003) в тестовых моделях тревожности «черно-белая камера» и «приподнятая площадка». После хронического лечения (21 день) с помощью GS39783 (10 мг/кг, перорально, один раз в день) толерантность не наблюдалось. Поскольку энхансеры ГАМКB не оказывают никакого влияния на деятельность рецептора в отсутствии ГАМК, но действительно увеличивают аллостерически сродство ГАМКB рецептора к эндогенной ГАМК, ожидается, что эти лиганды должны иметь улучшенный профиль побочного эффекта по сравнению с Баклофеном. Действительно, GS39783 при дозировке 0,1-200 мг/кг перорально не оказывал никакого влияния на спонтанную двигательную деятельность, тест “rotarod” («вращающийся стержень»), температуру тела и тяговый тест по сравнению с Баклофеном, который показал эти побочные эффекты при дозировке 2,5-15 мг/кг перорально. GS39783 не оказывал никакого влияния на мыслительную деятельность, что определялось поведенческим тестом на пассивное избегание у мышей и крыс. Кроме того, GS39783 проявило эффекты, подобные анксиолитическим, в испытательных парадигмах приподнятый крестообразный лабиринт (крыса), приподнятая площадка (мыши и крысы) и гипертермия под действием стресса (мыши). Поэтому GS39783 представляет новый транквилизатор без побочных эффектов, связанных с Баклофеном или бензодиазепинами (Cryan et al., J Pharmacol Exp Ther., 310, 952-963, 2004). Доклинические исследования соединений CGP7930 и GS39783 показали, что оба соединения эффективны при летальном исходе самоприменения кокаина крысами (Smith et al., Psychopharmacology, 173, 105-111, 2004). Позитивный модулятор CGP7930 также был доклинически изучен при лечении гастроэзофагеальной рефлюксной болезни (ГЭРБ, GERD), и было найдено, что он эффективен (WO 03/090731, применение позитивных модуляторов ГАМКB рецепторов при желудочно-кишечных заболеваниях). О позитивных аллостерических модуляторах сообщалось для других сопряженных с G-белком рецепторов (GPCR) семейства 3, включая mGlu1 рецептор (Knoflach et al., Proc. Natl. Acad. Sci., USA, 98, 13402-13407, 2001; Wichmann et al., Farmaco, 57, 989-992, 2002), кальций-чувствительного рецептора (NPS R-467 и NPS R-568) (Hammerland et al., Mol. Pharmacol., 53, 1083-1088, 1998) (US 6313146), mGlu2 рецептора [LY487379, N-(4-(2-метоксифенокси)-фенил-N-(2,2,2-трифторэтилсульфонил)-пирид-3-илметиламин и его аналоги] (WO 01/56990, Потенцирующие средства рецепторов глутамата) и mGlu5 рецептора (СРРНА,N-{4-хлор-2-[(1,3-диоксо-1,3-дигидро-2Н-изоиндол-2-ил)метил]фенил}-2-гидроксибензамид) (O’Brien et al., J. Pharmaco. Exp. Ther., 27, Jan. 27, 2004). Интересно отметить, что было показано, что эти позитивные модуляторы связаны с новым аллостерическим сайтом, расположенным в области 7TMD, таким образом увеличивая сродство агониста путем стабилизации активного состояния области 7TMD (Knoflach et al., Proc. Natl. Acad. Sci., USA 98, 13402-13407, 2001; Schaffhauser et al., Mol. Pharmacol., 64, 798-810, 2003). Кроме того, NPS R-467, NPS R-568 (Tecalcet) и родственные соединения представляют первые позитивные аллостерические модуляторы, которые вошли в клиническую практику благодаря их аллостерическому способу действия. Объекты по изобретению представляют собой соединения формулы I и их фармацевтически приемлемые соли присоединения кислоты, получение соединений формулы I и их солей, лекарства, содержащие соединения формулы I или их фармацевтически приемлемые соли присоединения кислоты. Дополнительным объектом настоящего изобретения является применение соединений формулы I или соединений, выбранных из группы, состоящей из: 1-(6-Хлор-2-метил-4-фенил-хинолин-3-ил)-этанона; 1-(6-Бром-4-фенил-2-пиперидин-1-ил-хинолин-3-ил)-этанона; 1-[4-(4-Хлор-фенил)-2-метил-хинолин-3-ил]-этанона; 1-(6-Бром-2-метил-4-фенил-хинолин-3-ил)-этанона; 1-(2,6-Диметил-4-фенил-хинолин-3-ил)-этанона; и 1-(2-Метил-4-фенил-6-трифторметокси-хинолин-3-ил)-этанона, и их приемлемых солей присоединения кислоты для изготовления лекарств, полезных при контроле или предотвращении болезней, особенно болезней и расстройств, таких как упомянутые ранее, например тревожности, депрессии, эпилепсии, шизофрении, нарушений мыслительной деятельности (когнитивных расстройств), спастичности и ригидности скелетной мышцы, повреждения спинного мозга, рассеянного склероза, амиотрофического латерального склероза, церебрального паралича, невропатической боли и тяги к кокаину и никотину, психоза, расстройства панического типа, посттравматических стрессовых расстройств или желудочно-кишечных заболеваний, и, соответственно, для изготовления соответствующих лекарств. Следующие определения общих терминов, используемых в настоящем описании, применяются независимо от того, появляются ли рассматриваемые термины по отдельности или в комбинации. Используемый здесь термин “Арил” обозначает одновалентный циклический ароматический углеводородный фрагмент. Предпочтительные арилы включают (без ограничения ими) произвольно замещенный фенил или нафтил, а также те арильные группы, которые конкретно проиллюстрированы здесь примерами ниже. Примерами заместителей для арильных групп являются гидрокси, галоген, C1-C7 алкил, C1-C7 галоалкил, C1-C7 алкокси, C1-C7 галоалкокси, C1-C7 алкоксиалкил, C1-С7 алкилсульфонил, ди (С1-С7)алкиламино или С3-С8 циклоалкил. “Арилокси” обозначает арильную группу, где арильная группа определена выше, и эта арильная группа присоединена через атом кислорода. Предпочтительной арилокси группой является PhO-. “C1-C7 алкил” обозначает группу с прямой или разветвленной цепью атомов углерода, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил, н-гексил, а также группы, конкретно проиллюстрированные здесь примерами ниже. “C1-C7 галоалкил” обозначает C1-C7 алкильную группу, как определено выше, которая замещена одним или более чем одним галогеном. Примеры С1-С7 галоалкила включают (без ограничения ими) метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил или н-гексил, замещенные одним или более чем одним атомом(ами) хлора, фтора, брома или иода, а также те группы, которые конкретно проиллюстрированы здесь примерами ниже. Предпочтительными С1-С7 галоалкилами являются дифтор- или трифтор-метил или этил. “C1-C7 алкокси” обозначает группу, где алкильная группа определена выше, и эта алкильная группа присоединена через атом кислорода. Предпочтительными алкокси группами являются МеО- и ЕtO-, а также те группы, которые конкретно проиллюстрированы здесь примерами ниже. “С1-С7 галоалкокси” обозначает C1-C7 алкокси группу, как определено выше, которая замещена одним или более чем одним галогеном. Примеры C1-C7 галоалкокси включают (без ограничения ими) метокси или этокси, замещенные одним или более чем одним атомом(ами) Cl, F, Вr или I, а также те группы, которые конкретно проиллюстрированы здесь примерами ниже. Предпочтительными C1-C7 галоалкокси группами являются дифтор- или трифтор- метокси или этокси группы. “Галоген” обозначает хлор, иод, фтор и бром. “C1-C7 алкоксиалкил” обозначает C1-C7 алкильную группу, как определено здесь выше, которая замещена С1-С7 алкоксигруппой, как определено здесь выше. “C1-C7 алкилсульфонил” обозначает сульфонильную группу, замещенную C1-C7 алкильной группой, как определено здесь выше. Примеры C1-C7 алкилсульфонила включают (без ограничения ими) метилсульфонил и этилсульфонил, а также те группы, которые конкретно проиллюстрированы здесь примерами ниже. “Ди(С1-С7)алкиламино” обозначает -NR7R8 группу, где R7 и R8 являются C1-C7 алкильными группами, как определено здесь выше. Примеры ди(С1-С7)алкиламино групп включают (без ограничения ими) ди(метил)амино, ди(этил)амино, метилэтиламино, а также те группы, которые конкретно проиллюстрированы здесь примерами ниже. “Гидрокси” обозначает -ОН группу. “С3-С8 циклоалкил” обозначает насыщенное углеродное кольцо, имеющее от 3 до 8 атомов углерода в качестве членов кольца, и включает (без ограничения ими) циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, а также те группы, которые конкретно проиллюстрированы здесь примерами ниже. “4-8-членные гетероцикпоалкилы” обозначают насыщенное кольцо с одним или двумя циклами, включающее от 1 до 7 атомов углерода в качестве членов кольца, причем атомы других остальных членов кольца выбраны из одного или более чем одного атома О, N и S. Предпочтительные 4-8-членные гетероциклоалкильные группы являются 5- или 6-членными гетероциклоалкильными группами. Примеры 4-8 и 5- или 6-членных гетероцикпоалкильных групп включают (без ограничения ими) необязательно замещенные азетидинил, пиперидинил, пиперазинил, гомопиперазинил, азепинил, пирролидинил, пиразолидинил, имидазолинил, имидазолидинил, пиридинил, пиридазинил, пиримидинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, хинуклидинил, хинолинил, изохинолинил, бензимидазолил, тиадиазолилидинил, бензотиазолидинил, бензоазолилидинил, дигидрофурил, тетрагидрофурил, дигидропиранил, тетрагидропиранил, тиоморфолинил, тиоморфолинилсульфоксид, тиоморфолинилсульфонил, дигидрохинолинил, дигидроизохинолинил, тетрагидрохинолинил, тетрагидроизохинолинил, 1-оксо-тиоморфолинил, 1,1-диоксо-тиоморфолинил, 1,4-диазепанил, 1,4-оксазепанил и 8-окса-3-аза-бицикло[3.2.1]окт-3-ил, а также те группы, которые конкретно проиллюстрированы здесь примерами ниже. “R6 вместе с R5 образуют 5- или 6-членную гетероциклоалкильную группу”, обозначает 5- или 6-членные гетероциклоалкильные группы, как определено выше, которые сконденсированы с группой хинолина через R5 и R6. Пример такой группы включает (без ограничения ей) следующую группу:
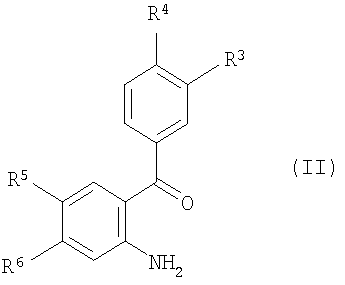
Термин “фармацевтически приемлемые соли присоединения кислоты” охватывает соли неорганических и органических кислот, которые включают (без ограничения ими) соляную кислоту, азотную кислоту, серную кислоту, фосфорную кислоту, лимонную кислоту, муравьиную кислоту, фумаровую кислоту, малеиновую кислоту, уксусную кислоту, янтарную кислоту, винную кислоту, метансульфокислоту, п-толуолсульфокислоту и т.п. Предпочтительные группы для R1 могут быть выбраны из группы, состоящей из метила, этила, пропила, изопропила, бутила, изобутила и трет-бутила. Предпочтительные группы для R2 могут быть выбраны из группы, состоящей из метила, этила, пропила, изопропила, бутила, изобутила, трет-бутила, циклопропила, циклобутила, циклопентила, циклогексила, фенила, CHF2 и СF3. Предпочтительные группы для R3 могут быть выбраны из группы, состоящей из водорода, Cl и F. Предпочтительные группы для R4 могут быть выбраны из группы, состоящей из водорода, метокси, метилсульфонил, Cl и F. Предпочтительные группы для R5 могут быть выбраны из группы, состоящей из Вr, метила, этила, пропила, изопропила, бутила, изобутила, и трет-бутила, СF3О, РhО, метокси, метилсульфонила, Cl, F или I и, если R5 является -NR7R8, то R7 и R8 вместе с атомом азота, с которым они соединены, могут образовывать группу, выбранную из группы, состоящей из пиперидин-1-ида, морфолин-4-ила, пирролидин-1-ила, пиперазин-1-ила, пирролидин-1-ила, азетидин-1-ила, и азепан-1-ила, которые могут быть замещены одним или более чем одним фтором, метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, трет-бутилом, гидрокси, метокси-группами, фенилом, диметиламиногруппой и 1,4-оксазепанилом и 8-окса-3-аза-бицикло[3.2.1]окт-3-илом. Более предпочтительные группы для R5 могут быть выбраны из группы, состоящей из Вr, I, метила, этила, пропила, изопропила, бутила, изобутила, и трет-бутила, СF3О, РhО, метокси, метилсульфонил, Cl или F, и если R5 является -NR7R8, то R7 и R8 вместе с атомом азота, с которым они соединены, могут образовывать группу, выбранную из группы, состоящей из пиперидин-1-ила, 3,3-дифтор-пиперидин-1-ила, 4-гидрокси-4-метил-пиперидин-1-ила, 4-метокси-пиперидин-1-ила, морфолин-4-ила, пирролидин-1-ила, 2-метил-пирролидин-1-ила, 4-метил-пиперазин-1-ила, 3-гидрокси-пирролидин-1-ила, 3-гидрокси-азетидин-1-ила, 4-гидрокси-4-фенил-пиперидин-1-ила, 3,3-диметиламин-пирролидин-1-ила, азепан-1-ила и 1,4-оксазепанила и 8-окса-3-аза-бицикло[3.2.1]окт-3-ила. Предпочтительными соединениями по изобретению являются такие соединения формулы I, где R1 представляет собой C1-C7 алкил; R2 представляет собой C1-C7 алкил, фенил, C1-C7 галоалкил или С3-С8 циклоалкил; R3, R4 каждый независимо представляют собой водород, галоген, C1-C7 алкокси, C1-C7 алкилсульфонил; R5 представляет собой галоген, C1-C7 галоалкокси, арилокси, или -NR7R8, где R7, R8 представляют собой C1-C7 алкил, или R7 и R8 могут, вместе с атомом азота, к которому они присоединены, образовывать 4-8-членную гетероциклоалкильную группу, которая может быть замещена одним или более чем одним заместителем(ями), выбранными из группы, состоящей из галогена, С1-С7 алкила, гидрокси, C1-C7 алкокси, фенила и ди(С1-С7)алкиламиногруппы; R6 представляет собой водород или вместе с R5 может образовывать 5- или 6-членную гетероциклоалкильную группу, которая может быть замещена одним или более чем одним галогеном. Также предпочтительными соединениями по изобретению являются такие соединения формулы I, где R2 является C1-C7 алкилом, например следующие соединения: 1-(6-Бром-2-этил-4-фенил-хинолин-3-ил)-пропан-1-он; 1-(6-Бром-2-изобутил-4-фенил-хинолин-3-ил)-этанон; 1-(6-Бром-2-метил-4-фенил-хинолин-3-ил)-3-метил-бутан-1-он; 1-[4-(4-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон; 1-(6-Бром-2-изопропил-4-фенил-хинолин-3-ил)-2-метил-пропан-1-он; 1-[4-(3,4-Дихлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон; 1-[4-(4-Хлор-фенил)-2-метил-6-фенокси-хинолин-3-ил]-этанон; и 1-[4-(3-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон. Другими предпочтительными соединениями являются такие соединения формулы I, где R2 является C1-C7 галоалкилом, например следующие соединения: 1-(6-Бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанон; 1-(6-Бром-2-метил-4-фенил-хинолин-3-ил)-2,2-дифтор-этанон; 2,2,2-Трифтор-1-(2-метил-4-фенил-6-трифторметокси-хинолин-3-ил)-этанон; 1-[4-(3-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-2,2,2-трифтор-этанон; 1-[4-(4-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-2,2,2-трифтор-этанон; 2,2,2-Трифтор-1-[4-(4-метокси-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон; 1-(6-трет-Бутил-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанон; 1-(2,2-Дифтор-6-метил-8-фенил-[1,3]диоксоло[4,5-g]хинолин-7-ил)-2,2,2-трифтор-этанон; 1-[4-(3,4-Дифтор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-2,2,2-трифтор-этанон; 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(3-фтор-4-метокси-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-(2-метил-4-фенил-6-пиперидин-1-ил-хинолин-3-ил)-этанон; 2,2,2-Трифтор-1-(2-метил-6-морфолин-4-ил-4-фенил-хинолин-3-ил)-этанон; 2,2,2-Трифтор-1-(2-метил-4-фенил-6-пирролидин-1-ил-хинолин-3-ил)-этанон; 2,2,2-Трифтор-1-[2-метил-6-(2-метил-пирролидин-1-ил)-4-фенил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[2-метил-6-(4-метил-пиперазин-1-ил)-4-фенил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[6-(3-гидрокси-пирролидин-1-ил)-2-метил-4-фенил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[6-(3-гидрокси-азетидин-1-ил)-2-метил-4-фенил-хинолин-3-ил]-этанон; 1-[6-Бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон; 1-[6-Бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон; 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-2-метил-6-пиперидин-1-ил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-2-метил-6-пиперидин-1-ил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-2-метил-6-морфолин-4-ил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-2-метил-6-пирролидин-1-ил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-2-метил-6-пирролидин-1-ил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-6-(3-гидрокси-пирролидин-1-ил)-2-метил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[6-(4-гидрокси-4-фенил-пиперидин-1-ил)-2-метил-4-фенил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[6-(4-гидрокси-4-фенил-пиперидин-1-ил)-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-6-(4-гидрокси-4-фенил-пиперидин-1-ил)-2-метил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-6-(3-гидрокси-азетидин-1-ил)-2-метил-хинолин-3-ил]-этанон; 1-[6-Азепан-1-ил-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон; 1-(6-Азепан-1-ил-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанон; 1-[6-(3-Диметиламино-пирролидин-1-ил)-2-метил-4-фенил-хинолин-3-ил]-2,2,2-трифтор-этанон; 1-[6-(3-Диметиламино-пирролидин-1-ил)-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон; 1-[6-(3-Диметиламино-пирролидин-1-ил)-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон; 2,2,2-Трифтор-1-[6-иод-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[6-(4-гидрокси-4-метил-пиперидин-1-ил)-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-этанон; 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-6-(4-метокси-пиперидин-1-ил)-2-метил-хинолин-3-ил]-этанон; 1-[6-(3,3-Дифтор-пиперидин-1-ил)-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон; и 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-2-метил-6-(8-окса-3-аза-бицикло[3.2.1]окт-3-ил)-хинолин-3-ил]-этанон. Кроме того, другими предпочтительными соединениями по изобретению являются такие соединения, где R2 представляет собой С3-С8 циклоалкил, например следующие соединения: [6-Бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-циклопропил-метанон; Циклопропил-[4-(4-метансульфонил-фенил)-2-метил-6-морфолин-4-ил-хинолин-3-ил]-метанон; Циклопропил-[4-(4-метансульфонил-фенил)-2-метил-6-пиперидин-1-ил-хинолин-3-ил]-метанон; [(6-Бром-2-метил-4-фенил-хинолин-3-ил)-циклопропил-метанон; [6-Бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-циклопропил-метанон; Циклопропил-(2-метил-4-фенил-6-пиперидин-1-ил-хинолин-3-ил)-метанон; и Циклопропил-(2-метил-6-морфолин-4-ил-4-фенил-хинолин-3-ил)-метанон. Кроме того, другими предпочтительными соединениями по изобретению являются такие соединения формулы I, где R2 представляет собой фенил, например следующие соединения: (6-Бром-2-метил-4-фенил-хинолин-3-ил)-фенил-метанон; и [4-(3-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-фенил-метанон. Вышеупомянутые соединения формулы I могут быть изготовлены в соответствии со следующим способом по изобретению, включающим стадию взаимодействия соединения формулы II
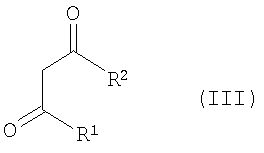
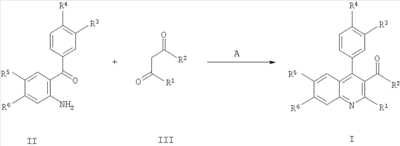
с соединением формулы
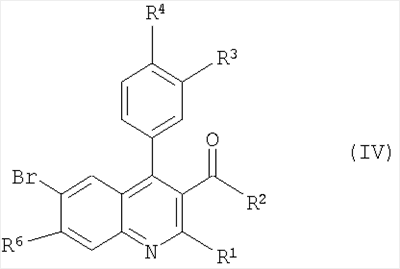
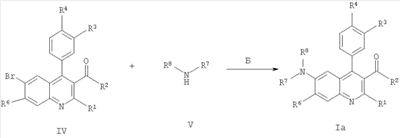
где R1-R6 такие, как определено в формуле I, с образованием соединения формулы I; и, при желании, превращение полученного соединения формулы I в фармацевтически приемлемую соль присоединения кислоты. Вышеупомянутые соединения формулы 1 могут быть изготовлены в соответствии с настоящим изобретением по следующему альтернативному способу, включающему стадию взаимодействия соединения формулы IV с соединением формулы V
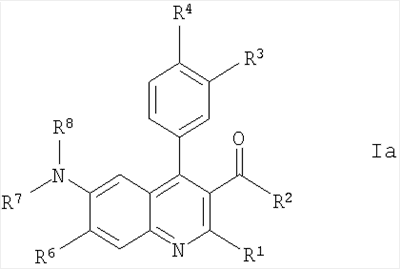
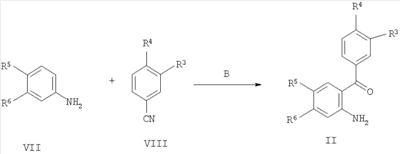
с образованием соединения формулы Iа; где R1-R8 определены в формуле I; и, при желании, превращение полученного соединения формулы Ia в фармацевтически приемлемую соль присоединения кислоты. Понятно, что соединения формулы Ia соответствуют соединениям формулы I, когда R5 представляет собой -NR7R8, a R7 и R8 являются такими же, как определено в формуле I. Изобретение также охватывает соединение формулы I или Ia всякий раз, когда оно получается согласно вышеупомянутым способам. Далее получение соединений формулы I описано более подробно: В схемах 1 и 2 описаны способы получения соединений формулы I или Ia. Получение соединений формулы I описано подробно далее в рабочих примерах 1-46. СХЕМА 1 А) кат. (NaAuCl4 2H2O) Способ А В соответствии с методикой, разработанной A.Arcadi, M.Chiarini, S.Di Giuseppe, and F.Marinelli, Synlett 203-206 (2003), 2-аминобензофенон II реагирует с 1,3-дионом III и натрий тетрахлораурат (III) дигидратом в качестве катализатора. Остаток может быть очищен обычными способами. СХЕМА 2 Б) кат. Pd2dba3 СHCl4, рац-BINAP, Cs2CO3 Способ Б Следуя методологии, разработанной J.P.Wolfe and S.L.Buchwald (J. Org. Chem. 2000, 65, 1144-1157), комплекс трис(дибензилиденацетон)дипалладий-хлороформ добавляют к рац-2,2′-бис(дифенилфосфино)-1,1′-бинафтилу, карбонату цезия, 2-амино-4-бром-бензохинону IV и амину V. Остаток может быть очищен обычными способами. Одна часть сырья, используемого в общих методиках схем 1 и 2, коммерчески доступна (например, некоторые из бензофенонов формулы IV, все 1,3-дикетоны формулы III и все амины формулы V). Однако коммерчески недоступная часть указанного сырья может быть приготовлена согласно общей методике способа В для соединений формулы II, как описано далее в схеме 3, или согласно общей методике способа А с получением подходящих соединений формулы IV, как описано выше в схеме 1. Если не оговорено особо, промежуточные соединения, описанные в них, являются новыми: СХЕМА 3 В) ВСl3, СаСl3 Способ В Следуя методике, разработанной Т.Sugasawa, Т.Toyoda, M.Adachi, and К.Sasakura, J. Am. Chem. Soc. 100, 4842-4852 (1978) и усовершенствованной A.W.Douglas, N.L.Abramson, I.N.Houpis, S.Karady, A.Molina, L.C.Xavier, N.Yasuda, Tetrahedron Lett. 35, 6807-6810 (1994), хлорид галлия (III) или хлорид алюминия (III) смешивают с хлорированным растворителем. Затем к холодной смеси добавляют анилин VII, бор трихлорид и бензонитрил VIII. Сырой продукт может быть очищен обычными способами. Получение соединений формулы II описано подробно далее в рабочих примерах А1-А16. Как упомянуто ранее, соединения формулы I и их фармацевтически приемлемые соли присоединения обладают ценными фармакологическими свойствами. Было обнаружено, что соединения по настоящему изобретению проявляют сродство к ГАМКB рецептору. Соединения исследовали в соответствии с тестами, приведенными ниже. Анализ внутриклеточной мобилизации Са2+ Клетки яичника китайского хомячка (линия СНО), устойчиво экспрессирующие ГАМКBR1аR2а и G
Соединения формулы I, а также их фармацевтически приемлемые соли присоединения кислоты, могут использоваться как лекарственные средства, например в форме фармацевтических лекарственных препаратов. Фармацевтические лекарственные препараты могут назначаться орально, например, в форме таблеток, покрытых таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако назначение может также быть осуществлено ректально, например в форме суппозиториев, или парентерально, например в форме растворов для инъекций. Соединения формулы 1 и их фармацевтически приемлемые соли присоединения кислоты могут быть переработаны с фармацевтически инертными, неорганическими или органическими наполнителями (эксципиентами) для производства таблеток, покрытых таблеток, драже и твердых желатиновых капсул. В качестве таких наполнителей могут использоваться лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли и т.д., например, для таблеток, драже и твердых желатиновых капсул. Подходящими наполнителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы. Подходящие наполнители для производства растворов и сиропов включают (без ограничения ими) воду, полиолы, сахарозу, инвертированный сахар, глюкозу. Подходящие наполнители для растворов для инъекций включают (без ограничения ими) воду, спирты, полиолы, глицерин, растительные масла. Подходящие наполнители для суппозиториев включают (без ограничения ими) природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы. Кроме того, фармацевтические лекарственные препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, отдушки, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать еще и другие терапевтически ценные вещества. Дозировка может измениться в широких пределах и, конечно, должна подбираться по требованиям в каждом отдельном случае. Вообще, в случае орального применения суточная дозировка приблизительно 10-1000 мг на человека соединения общей формулы I должна быть соответствующей, хотя, если необходимо, вышеупомянутый верхний предел может также быть превышен. Состав таблетки (Влажное гранулирование)
Методика получения 1. Смешать поз.1, 2, 3 и 4 и гранулировать с помощью чистой воды. 2. Высушить гранулы при 50°С. 3. Пропустить гранулы через подходящее помольное оборудование. 4. Добавить поз.5 и перемешивать в течение трех минут; прессовать на подходящем прессе. Состав капсулы
Методика получения 1. Смешивать поз.1, 2 и 3 в подходящем смесителе в течение 30 минут. 2. Добавить поз.4 и 5 и смешивать в течение 3 минут. 3. Заполнить подходящую капсулу. ПРИМЕРЫ Синтез промежуточных соединений формулы II Пример А1 (2-Амино-5-трет-бутил-фенил)-фенил-метанон Соединение, указанное в заголовке, получали по общей методике способа В. В стеклянную колбу, снабженную якорем для магнитной мешалки, резиновой пробкой с мембраной, термометром, холодильником с насадкой Хикмана (“с воротничком”), барботером, продуваемую азотом и связанную с промывной склянкой, содержащей 30% NaOH, добавляли в один прием содержимое свежей ампулы хлорида галлия (III) (5 г, 29 ммоль) и затем растворяли путем добавления 1,2 дихлорэтана (80 мл). Этот раствор охлаждали во льду, затем медленно добавляли 4-трет-бутиланилин (36 ммоль), поддерживая температуру ниже 5°С. Затем раствор охлаждали до -10°С, и 1 М свежий раствор трихлорида бора в дихлорметане (27 мл) добавляли через шприц, снабженный тефлоновым краном, поддерживая температуру ниже -5°С. Наконец, добавляли бензонитрил (24 ммоль), и смеси давали согреться до 20°С. Холодильник с насадкой Хикмана заменяли на обычный дефлегматор, и реакционную смесь нагревали на масляной бане (90°С) в течение 1-2 ч, чтобы отогнать весь дихлорметан (собирали в общем приблизительно 50 мл дистиллята), до тех пор, пока температура паров не достигла 80°С. Нагревание с дефлегматором продолжали в течение 14 ч. Реакционную смесь охлаждали во льду и медленно гидролизовали водой (40 мл), а затем нагревали до 60-80°С в течение 20-30 мин, чтобы гидролизовать имин. Реакционную смесь снова охлаждали и затем экстрагировали дихлорметаном и водой. Сырой продукт очищали с помощью хроматографии на силикагеле в смеси гептан/этилацетат (4:1), и очищенный продукт (выход 40%) анализировали с помощью масс-спектрометрии (МС): m/z=254 (М+Н). Пример А2 (2-Амино-5-бром-фенил)-(4-фтор-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-броманилина и 4-метилсульфонил бензонитрила, следуя методике из примера А1. Выход 37%; МС: m/z=294 (М). Пример A3 (2-Амино-5-трифторметокси-фенил)-(4-хлор-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-(трифторметокси)анилина и 4-хлор бензонитрила, следуя методике из примера А1, за исключением того, что использовали алюминий (III) хлорид, время реакции было 4 ч, и для хроматографии использовали гептан/этилацетат (2:1). Выход 18%; МС: m/z=315(M). Пример А4 (2-Амино-5-трифторметокси-фенил)-(3,4-дихлор-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-(трифторметокси)анилина и 3,4-дихлорбензонитрила, следуя методике из примера A3, за исключением того, что время реакции было 16 ч. Выход 15%; МС: m/z=408 (М+ОАс). Пример А5 (2-Амино-5-фенокси-фенил)-(4-хлор-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-феноксианилина и 4-хлор бензонитрила, следуя методике из примера A3, за исключением того, что время реакции было 14 ч, и для хроматографии использовали градиент смеси гептан/этилацетат. Выход 38%; МС: m/z=324 (М+Н). Пример А6 (2-Амино-5-трифторметокси-фенил)-фенил-метанон Соединение, указанное в заголовке, известно из FR 7666, и его получали взаимодействием 4-(трифторметокси)анилина и бензонитрила, следуя методике из примера А1, за исключением того, что время реакции было 16 ч и для хроматографии использовали гептан/этилацетат (5:1). Выход 40%; МС: m/z=282 (М+Н). Пример А7 (2-Амино-5-трифторметокси-фенил)-(3-хлор-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-(трифторметокси)анилина и 3-хлор-бензонитрила, следуя методике из примера А1. Выход 19%; МС: m/z=315 (М). Пример А8 (2-Амино-5-трифторметокси-фенил)-(4-метокси-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-феноксианилина и 4-метокси бензонитрила, следуя методике из примера А1, за исключением того, что время реакции было 19 ч, и для хроматографии использовали градиент гептан/этилацетат. Выход 19%; МС: m/z=312 (М+Н). Пример А9 (2-Амино-5-трифторметокси-фенил)-(4-фтор-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-(трифторметокси)анилина и 4-фторбензонитрила, следуя методике из примера А1. Выход 26%; МС: m/z=299 (М). Пример А10 (6-Амино-2,2-дифтор-бензо[1,3]диоксол-5-ил)-фенил-метанон Соединение, указанное в заголовке, получали взаимодействием 2,2-дифтор-5-аминобензодиоксола и бензонитрила, следуя методике из примера А1. Выход 1,5%; МС: m/z=366 (М+ОАс). Пример А11 (2-Амино-5-трифторметокси-фенил)-(3-трифторметокси-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-(трифторметокси)анилина и 3-(трифторметокси)бензонитрила, следуя методике из примера А1. Выход 29%; МС: m/z=365 (М). Пример А12 (2-Амино-5-трифторметокси-фенил)-(3,4-дифтор-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-(трифторметокси)анилина и 3,4-дифторбензонитрила, следуя методике из примера А1. Выход 36%; МС: m/z=317 (М). Пример А13 (2-Амино-5-трифторметокси-фенил)-(4-метансульфонил-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-(трифторметокси)анилина и 4-метилсульфонилбензонитрила, следуя методике из примера А1. Выход 71%; МС: m/z=359 (М). Пример А14 (2-Амино-5-трифторметокси-фенил)-(3-фтор-4-метокси-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-(трифторметокси)анилина и 3-метоксибензонитрила, следуя методике из примера А1. Выход 19%; МС: m/z=329 (М). Пример А15 (2-Амино-5-бром-фенил)-(4-метансульфонил-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-броманилина и 4-метилсульфонилбензонитрила, следуя методике из примера А1. Выход 51%; МС: m/z=355 (М+Н). Пример А16 (2-Амино-5-бром-фенил)-фенил-метанон Соединение, указанное в заголовке, известно из US 20040127536 А1, и его получали согласно способу, разработанному D.Roche, К.Prasad, О.Repic, Т.J.Blacklock, Tetrahedron Lett. 41, 2083-2085 (2000). 2-Аминобензофенон (30 г, 152 ммоль) суспендировали в уксусной кислоте (300 мл). Добавляли калий бромид (19,9 г, 167 ммоль), натрий перборат тетрагидрат (28 г, 183 ммоль) и аммоний молибдат тетрагидрат (1,5 г), и перемешивание продолжали в течение 3 часов при 0°С. Образовавшийся плотный желтый осадок разбавляли ледяной водой (300 мл) и затем отфильтровывали, промывали ледяной водой и сушили. Получали 40,3 г (96%) желтого твердого вещества. МС: m/z=276 (М). Пример А17 (2-Амино-5-иод-фенил)-(4-метансульфонил-фенил)-метанон Соединение, указанное в заголовке, получали взаимодействием 4-иоданилина и 4-метилсульфонилбензонитрила, следуя методике из примера А1. Выход 31%; МС: m/z=402 (М+Н). Синтез соединений формулы 1 по изобретению Пример 1 1-(6-Бром-2-этил-4-фенил-хинолин-3-ил)-пропан-1-он Соединение, указанное в заголовке, получали в соответствии с общей методикой способа А. (2-Амино-5-бром-фенил)-фенил-метанон [пример А16] (в масштабе 0,1-1 г), 3,5-гептандион (1,5 экв) и натрий тетрахлораурат (III) дигидрат (0,025 экв) нагревали параллельно в реакционной станции “carousel” фирмы Radley в атмосфере азота в спирте (10% м/м раствор (2-амино-5-бром-фенил)-фенил-метанона), и реакцию проводили в течение 24 ч. Реакционную смесь упаривали до сухого состояния, и остаток очищали с помощью хроматографии на силикагеле в смеси гептан/этилацетат (20:1). Выход: 37%. МС: m/z=368 (М). Пример 2 (6-Бром-2-метил-4-фенил-хинолин-3-ил)-фенил-метанон Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-фенил-метанона [пример А16] и 1-фенил-1,3-бутандиона, за исключением того, что остаток очищали самопроизвольной кристаллизацией из реакционной смеси. Выход: 61%; МС: m/z=402 (М+Н). Пример 3 1-(6-Бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-фенил-метанона [пример А16] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что использовали гептан/этилацетат (10:1). Выход: 50%; МС: m/z=392/394 (М). Пример 4 1-(6-Бром-2-изобутил-4-фенил-хинолин-3-ил)-этанон Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-фенил-метанона [пример А16] и 6-метил-2,4-гептандиона в соответствии с методикой примера 1. Выход: 9%. МС: m/z=381 (М). Пример 5 1-(6-Бром-2-метил-4-фенил-хинолин-3-ил)-3-метил-бутан-1-он Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-фенил-метанона [пример А16] и 6-метил-2,4-гептандиона в соответствии с методикой примера 1. Выход: 55%. МС: m/z=381 (М). Пример 6 1-(6-Бром-2-метил-4-фенил-хинолин-3-ил)-2,2-дифтор-этанон Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-фенил-метанона [пример А16] и 1,1-дифторацетилацетона в соответствии с методикой примера 1, за исключением того, что остаток очищали с помощью хроматографии на аминированном силикагеле смесью гептан/этилацетат (5:1). Выход: 36%. МС: m/z=377 (М). Пример 7 1-[4-(4-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(4-хлор-фенил)-метанона [пример A3] и ацетилацетона в соответствии с методикой примера 1, за исключением того, что использовали гептан/этилацетат (1:2). Выход: 61%. МС: m/z=379 (М). Пример 8 1-(6-Бром-2-изопропил-4-фенил-хинолин-3-ил)-2-метил-пропан-1-он Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-фенил-метанона [пример А16] и 2,6-диметил-3,5-гептандиона в соответствии с методикой примера 1, за исключением того, что время реакции было 96 ч, и остаток очищали с помощью хроматографии на аминированном силикагеле смесью гептан/этилацетат (85:15). Выход: 46%. МС: m/z=395/397 (М). Пример 9 1-[4-(3,4-Дихлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 2-амино-5-трифторметокси-фенил)-(3,4-дихлор-фенил)-метанона [пример А4] и ацетилацетона в соответствии с методикой примера 1, за исключением того, что использовали гептан/этилацетат (1:2). Выход: 59%. МС: m/z=414 (М). Пример 10 1-[4-(4-Хлор-фенил)-2-метил-6-фенокси-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из (2-амино-5-фенокси-фенил)-(4-хлор-фенил)-метанона [пример А5] и ацетилацетона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16,5 ч, и остаток очищали самопроизвольной кристаллизацией из реакционной смеси. Выход: 42%; МС: m/z=387 (М). Пример 11 2,2,2-Трифтор-1-(2-метил-4-фенил-6-трифторметокси-хинолин-3-ил)-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-фенил-метанона [пример А6] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что время реакции было 44 ч и использовали гептан/этилацетат (10:1). Выход: 63%; МС: m/z=399 (М). Пример 12 1-[4-(3-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(3-хлор-фенил)-метанона [пример А7] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 60 ч, и использовали гептан/этилацетат (1:2). Выход: 58%; МС: m/z=433 (М). Пример 13 [4-(3-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-фенил-метанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(3-хлор-фенил)-метанона [пример А7] и бензоилацетона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, и использовали гептан/этилацетат (1:2). Выход: 57%; МС: m/z=441 (М). Пример 14 1-[4-(4-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(4-хлор-фенил)-метанона [пример A3] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 34%; МС: m/z=433 (М). Пример 15 1-[4-(3-Хлор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(3-хлор-фенил)-метанона [пример А7] и ацетилацетона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, и использовали гептан/этилацетат (1:2). Выход: 55%; МС: m/z=380 (М+Н). Пример 16 2,2,2-Трифтор-1-[4-(4-метокси-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(4-метокси-фенил)-метанона [пример А8] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 17 ч, и использовали градиент гептан/этилацетат. Выход: 58%; МС: m/z=429 (М). Пример 17 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(4-фтор-фенил)-метанона [пример А9] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 96%; МС: m/z=417 (М). Пример 18 1-(6-трет-Бутил-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трет-бутил-фенил)-фенил-метанона [пример А1] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 37%; МС: m/z=372 (М+Н). Пример 19 1-(2,2-Дифтор-6-метил-8-фенил-[1,3]диоксоло[4,5-g]хинолин-7-ил)-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из (6-амино-2,2-дифтор-бензо[1,3]диоксол-5-ил)-фенил-метанона [пример А10] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 30%; МС: m/z=396 (М+Н). Пример 20 1-[4-(3,4-Дифтор-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(3,4-дифтор-фенил)-метанона [пример А12] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 36%; МС: m/z=435 (М). Пример 21 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из (2-амино-6-трифторметокси-фенил)-(4-метансульфонил-фенил)-метанона [пример А13] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 45%; МС: m/z=477 (М). Пример 22 2,2,2-Трифтор-1-[4-(3-фтор-4-метокси-фенил)-2-метил-6-трифторметокси-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(4-метансульфонил-фенил)-метанона [пример А14] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 62%; МС: m/z=477 (М). Пример 23 1-[6-Бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-(4-метансульфонил-фенил)-метанона [пример А15] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 55%; МС: m/z=473 (М+Н). Пример 24 1-[6-Бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-(4-фтор-фенил)-метанона [пример А2] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 80%; МС: m/z=411/413 (М). Пример 25 2,2,2-Трифтор-1-(2-метил-4-фенил-6-пиперидин-1-ил-хинолин-3-ил)-этанон Соединение, указанное в заголовке, получали в соответствии с общей методикой способа Б. Следуя методологии, разработанной J.P.Wolfe and S.L.Buchwald (J. Org. Chem. 2000, 65, 1144-1157), в толстостенный стеклянный сосуд с закручивающейся крышкой (50 мл), снабженный якорем для магнитной мешалки и продутый током аргона, помещали комплекс трис(дибензилиденацетон)дипалладий – хлороформ (0,01 ммоль), рац-2,2′-бис(дифенилфосфино)-1,1′-бинафтил (0,02 ммоль), диоксан (7,5 мл) и трет-бутанол (7,5 мл) и затем перемешивали в течение 1 минуты перед добавлением карбоната цезия (1,4 ммоль), 1-(6-бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанона [пример 3] (1 ммоль), и пиперидина (1,2 ммоль). Стеклянный сосуд помещали в предохранительную гильзу, плотно закрывали с помощью навинчивающейся крышки и нагревали при перемешивании в масляной бане при 120°С в течение 2 ч. Перед тем как открыть, стеклянный сосуд охлаждали во льду, реакционную смесь разбавляли гептаном (5 мл), отфильтровывали через слой фильтрующего материала Decalite и промывали гептаном. Фильтрат упаривали и остаток очищали с помощью хроматографии на силикагеле в смеси гептан/этилацетат (4:1). Выход: 74%; МС: m/z=399 (М+Н). Пример 26 2,2,2-Трифтор-1-(2-метил-6-морфолин-4-ил-4-фенил-хинолин-3-ил)-этанон Соединение, указанное в заголовке, получали из 1-(6-бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанона [пример 3] и морфолина в соответствии с методикой примера 25. Выход: 49%; МС: m/z=401 (М+Н). Пример 27 2,2,2-Трифтор-1-(2-метил-4-фенил-6-пирролидин-1-ил-хинолин-3-ил)-этанон Соединение, указанное в заголовке, получали из 1-(6-бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанона [пример 3] и пирролидина в соответствии с методикой примера 25. Выход: 56%; МС: m/z=385 (М+Н). Пример 28 2,2,2-Трифтор-1-[2-метил-6-(2-метил-пирролидин-1-ил)-4-фенил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-(6-бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанона [пример 3] и 2-метилпирролидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 21%; МС: m/z=399 (М+Н). Пример 29 2,2,2-Трифтор-1-[2-метил-6-(4-метил-пиперазин-1-ил)-4-фенил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-(6-бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанона [пример 3] и N-метилпиперазина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 73%; МС: m/z=414 (М+Н). Пример 30 2,2,2-Трифтор-1-[6-(3-гидрокси-пирролидин-1-ил)-2-метил-4-фенил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-(6-бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанона [пример 3] и 3-пирролидинола в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 92%; МС: m/z=401 (М+Н). Пример 31 2,2,2-Трифтор-1-[6-(3-гидрокси-азетидин-1-ил)-2-метил-4-фенил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-(6-бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанона [пример 3] и азетидин-3-ола в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 22%; МС: m/z=387 (М+Н). Пример 32 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-2-метил-6-пиперидин-1-ил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 23] и пиперидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 36%; МС: m/z=277 (М+Н). Пример 33 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-2-метил-6-пиперидин-1-ил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 24] и пиперидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 84%; МС: m/z=417 (М+Н). Пример 34 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-2-метил-6-морфолин-4-ил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 24] и морфолина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 75%; МС: m/z=419 (М+Н). Пример 35 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-2-метил-6-пирролидин-1-ил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 23] и пирролидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 51%; МС: m/z=463 (М+Н). Пример 36 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-2-метил-6-пирролидин-1-ил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 24] и пирролидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 64%; МС: m/z=403 (М+Н). Пример 37 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-6-(3-гидрокси-пирролидин-1-ил)-2-метил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 24] и 3-пирролидинола в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 39%; МС: m/z=419 (М+Н). Пример 38 2,2,2-Трифтор-1-[6-(4-гидрокси-4-фенил-пиперидин-1-ил)-2-метил-4-фенил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 24] и 4-гидрокси-4-фенилпиперидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 29%; МС: m/z=491 (М+Н). Пример 39 2,2,2-Трифтор-1-[6-(4-гидрокси-4-фенил-пиперидин-1-ил)-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 23] и 4-гидрокси-4-фенилпиперидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 17%; МС: m/z=569 (М+Н). Пример 40 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-6-(4-гидрокси-4-фенил-пиперидин-1-ил)-2-метил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 24] и 4-гидрокси-4-фенилпиперидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 32%; МС: m/z=509 (М+Н). Пример 41 2,2,2-Трифтор-1-[4-(4-фтор-фенил)-6-(3-гидрокси-азетидин-1-ил)-2-метил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 24] и азетидин-3-ола в соответствии с методикой примера 25, за исключением того, что время реакции было 12 ч. Выход: 12%; МС: m/z=405 (М+Н). Пример 42 1-[6-Азепан-1-ил-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 24] и азепана в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 32%; МС: m/z=431 (М+Н). Пример 43 1-(6-Азепан-1-ил-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из 1-(6-бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанона [пример 3] и азепана в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч. Выход: 14%; МС: m/z=413 (М+Н). Пример 44 1-[6-(3-Диметиламино-пирролидин-1-ил)-2-метил-4-фенил-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из 1-(6-бром-2-метил-4-фенил-хинолин-3-ил)-2,2,2-трифтор-этанона [пример 3] и 3-(диметиламино)пирролидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч, и использовали этилацетат/метанол (9:1). Выход: 37%; МС: m/z=428 (М+Н). Пример 45 1-[6-(3-Диметиламино-пирролидин-1-ил)-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 23] и 3-(диметиламино)пирролидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч, и использовали этилацетат/метанол (9:1). Выход: 47%; МС: m/z=506 (М+Н). Пример 46 1-[6-(3-Диметиламино-пирролидин-1-ил)-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 24] и 3-(диметиламино)пирролидина в соответствии с методикой примера 25, за исключением того, что время реакции было 16 ч, и использовали этилацетат/метанол (9:1). Выход: 44%; МС: m/z=446 (М+Н). Пример 47 2,2,2-Трифтор-1-[6-иод-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из (2-амино-5-иод-фенил)-(4-метансульфонил-фенил)-метанона [пример А17] и 1,1,1-трифтор-2,4-пентандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 55%; МС: m/z=519 (М). Пример 48 2,2,2-Трифтор-1-[6-(4-гидрокси-4-метил-пиперидин-1-ил)-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 23] и 4-метил-пиперидин-4-ола в соответствии с методикой примера 25. Выход: 14%; МС: m/z=507 (М+Н). Пример 49 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-6-(4-метокси-пиперидин-1-ил)-2-метил-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 23] и 4-метокси-пиперидина в соответствии с методикой примера 25. Выход: 14%; МС: m/z=507 (М+Н). Пример 50 [6-Бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-циклопропил-метанон Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-(4-метансульфонил-фенил)-метанона [пример А15] и 1-циклопропил-1,3-бутандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 47%; МС: m/z=443 (М+Н). Пример 51 Циклопропил-[4-(4-метансульфонил-фенил)-2-метил-6-морфолин-4-ил-хинолин-3-ил]-метанон В пробирку в атмосфере аргона помещали комплекс трис(дибензилиденацетон)дипалладий-хлороформ (5 мг), 2-дициклогексил-фосфино-2′,4′,6′-триизопропилбифенил (5 мг) и карбонат цезия (110 мг, 0,33 ммоль). Добавляли [6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-циклопропил-метанон [пример 50] (100 мг, 0,22 ммоль) в трет-бутаноле (5 мл), а затем морфолин (24 мг, 0,27 ммоль). Пробирку запаивали и нагревали при 110°С в течение 6 часов. Реакционную смесь охлаждали до 20°С, разбавляли гептаном, фильтровали через Celite и очищали непосредственно с помощью флэш-хроматографии на силикагеле в смеси гептан/этилацетат 80:20 с образованием желтого твердого вещества (52 мг, 51%). МС: m/z=451 (М+Н). Пример 52 1-[6-(3,3-Дифтор-пиперидин-1-ил)-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 23] и гидрохлорида 3,3-дифторпиперидина в соответствии с методикой примера 51. Выход: 50%; МС: m/z=513 (М+Н). Пример 53 2,2,2-Трифтор-1-[4-(4-метансульфонил-фенил)-2-метил-6-(8-окса-3-аза-бицикло[3.2.1]окт-3-ил)-хинолин-3-ил]-этанон Соединение, указанное в заголовке, получали из 1-[6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-2,2,2-трифтор-этанона [пример 23] и 8-окса-3-аза-бицикпо[3.2.1]октана в соответствии с методикой примера 51. Выход: 61%; МС: m/z=505 (М+Н). Пример 54 Циклопропил-[4-(4-метансульфонил-фенил)-2-метил-6-пиперидин-1-ил-хинолин-3-ил]-метанон Соединение, указанное в заголовке, получали из [6-бром-4-(4-метансульфонил-фенил)-2-метил-хинолин-3-ил]-циклопропил-метанона [пример 50] и пиперидина в соответствии с методикой примера 51. Выход: 39%; МС: m/z=449 (М+Н). Пример 55 [(6-Бром-2-метил-4-фенил-хинолин-3-ил)-циклопропил-метанон Соединение, указанное в заголовке, получали из (2-амино-5-бром-фенил)-фенил-метанона [пример А16] и 1-циклопропил-1,3-бутандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 75%; МС: m/z=366 (М). Пример 56 [6-Бром-4-(4-фтор-фенил)-2-метил-хинолин-3-ил]-циклопропил-метанон Соединение, указанное в заголовке, получали из (2-амино-5-трифторметокси-фенил)-(4-фторфенил)-метанона [пример А9] и 1-циклопропил-1,3-бутандиона в соответствии с методикой примера 1, за исключением того, что растворителем являлся изопропанол, время реакции было 16 ч, и использовали гептан/этилацетат (1:2). Выход: 76%; МС: m/z=384 (М). Пример 57 Циклопропил-(2-метил-4-фенил-6-пиперидин-1-ил-хинолин-3-ил)-метанон Соединение, указанное в заголовке, получали из [(6-бром-2-метил-4-фенил-хинолин-3-ил)-циклопропил-метанона [пример 55] и пиперидина в соответствии с методикой примера 51. Выход: 64%; МС: m/z=371 (М+Н). Пример 58 Циклопропил-(2-метил-6-морфолин-4-ил-4-фенил-хинолин-3-ил)-метанон Соединение, указанное в заголовке, получали из [(6-бром-2-метил-4-фенил-хинолин-3-ил)-циклопропил-метанона [пример 55] и морфолина в соответствии с методикой примера 51. Выход: 67%; МС: m/z=373 (М+Н).
Формула изобретения
1. Соединения формулы I 2. Соединения формулы I по п.1, где 3. Соединения формулы I по п.1, где R2 представляет собой C1-С7алкил. 4. Соединения формулы I по п.3, где эти соединения выбраны из группы, состоящей из: 5. Соединения формулы I по п.1, где R2 представляет собой C1-C7 галоалкил. 6. Соединения формулы I по п.5, где эти соединения выбраны из группы, состоящей из: 7. Соединения формулы I по п.1, где R2 представляет собой циклоалкил. 8. Соединения формулы I по п.7, где соединения выбраны из группы, состоящей из: 9. Соединения формулы I по п.1, где R2 представляет собой фенил. 10. Соединения формулы I по п.9, где эти соединения выбраны из группы, состоящей из: 11. Лекарство, обладающее активностью аллостерического энхансера рецепторов ГАМК-В, содержащее соединение формулы I по любому из пп.1-10. 12. Лекарство по п.11, где это лекарство полезно для контроля или предотвращения заболеваний, особенно заболеваний и расстройств, включающих тревожность, депрессию, эпилепсию, шизофрению, нарушения мыслительной деятельности, спастичность и ригидность скелетной мышцы, повреждения спинного мозга, рассеянный склероз, амиотрофический латеральный склероз, церебральный паралич, невропатическую боль и тягу к кокаину и никотину, психоз, расстройство панического типа, посттравматические стрессовые расстройства или желудочно-кишечные заболевания. 13. Применение соединения формулы I по любому из пп.1-10 или соединения, выбранного из группы, состоящей из: 14. Применение по п.13, где это лекарство полезно для контроля или предотвращения заболеваний, включающих тревожность, депрессию, эпилепсию, шизофрению, нарушения мыслительной деятельности, спастичность и ригидность скелетной мышцы, повреждения спинного мозга, рассеянный склероз, амиотрофический латеральный склероз, церебральный паралич, невропатическую боль и тягу к кокаину и никотину, психоз, расстройство панического типа, посттравматические стрессовые расстройства или желудочно-кишечные заболевания.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 554
554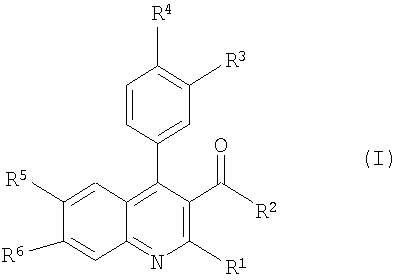 где R1 представляет собой водород, C1-C7 алкил; R2 представляет собой C1-C7 алкил, арил, C1-C7 галоалкил или С3-C8 циклоалкил; R3, R4 каждый независимо представляют собой водород, галоген, C1-C7 алкокси, C1-C7 алкилсульфонил; R5 представляет собой водород, галоген, C1-C7 алкил, C1-C7 галоалкокси, или арилокси, или представляет собой -NR7R8, где R7 и R8 представляют собой C1-C7 алкилы, или R7 и R8 могут вместе с атомом азота, к которому они присоединены, образовывать 4-7-членную гетероциклоалкильную группу, которая может быть замещена одним или более чем одним заместителем(ями), выбранными из группы, состоящей из галогена, C1-C7 алкила, C1-C7 алкокси, гидрокси, фенила и ди(C1-C7)алкиламино; R6 представляет собой водород или вместе с R5 может образовывать 5- или 6-членную гетероциклоалкильную группу, которая может быть замещена одним или более чем одним галогеном; и их фармацевтически приемлемые соли присоединения кислоты, за исключением ряда соединений, указанных в п.1 формулы изобретения. А также к лекарству на основе этих соединений, которое обладает активностью аллостерического энхансера рецепторов ГАМК-В и применению соединений формулы I для получения лекарств, полезных при лечении расстройств ЦНС, включающих тревожность и депрессию. Технический результат: получены и описаны новые соединения, которые могут быть использованы для получения лекарств, полезных при лечении расстройств ЦНС, включающих тревожность и депрессию. 3 н. и 11 з.п. ф-лы, 1 табл.
где R1 представляет собой водород, C1-C7 алкил; R2 представляет собой C1-C7 алкил, арил, C1-C7 галоалкил или С3-C8 циклоалкил; R3, R4 каждый независимо представляют собой водород, галоген, C1-C7 алкокси, C1-C7 алкилсульфонил; R5 представляет собой водород, галоген, C1-C7 алкил, C1-C7 галоалкокси, или арилокси, или представляет собой -NR7R8, где R7 и R8 представляют собой C1-C7 алкилы, или R7 и R8 могут вместе с атомом азота, к которому они присоединены, образовывать 4-7-членную гетероциклоалкильную группу, которая может быть замещена одним или более чем одним заместителем(ями), выбранными из группы, состоящей из галогена, C1-C7 алкила, C1-C7 алкокси, гидрокси, фенила и ди(C1-C7)алкиламино; R6 представляет собой водород или вместе с R5 может образовывать 5- или 6-членную гетероциклоалкильную группу, которая может быть замещена одним или более чем одним галогеном; и их фармацевтически приемлемые соли присоединения кислоты, за исключением ряда соединений, указанных в п.1 формулы изобретения. А также к лекарству на основе этих соединений, которое обладает активностью аллостерического энхансера рецепторов ГАМК-В и применению соединений формулы I для получения лекарств, полезных при лечении расстройств ЦНС, включающих тревожность и депрессию. Технический результат: получены и описаны новые соединения, которые могут быть использованы для получения лекарств, полезных при лечении расстройств ЦНС, включающих тревожность и депрессию. 3 н. и 11 з.п. ф-лы, 1 табл. -Аминомасляная кислота (ГАМК) – самый широко распространенный тормозящий нейромедиатор, активирует как ионотропные ГАМКA/C, так и метаботропные ГАМКB рецепторы (Hill and Bowery, Nature, 290, 149-152, 1981). ГАМКB рецепторы, которые присутствуют в большинстве областей мозга млекопитающих на пресинаптических терминалах и постсинаптических нейронах, вовлечены в тонкую настройку тормозной синаптической передачи. Пресинаптические ГАМКB рецепторы путем модуляции высоковольтных активированных Са2+ каналов (P/Q-и N-типа) тормозят высвобождение многих нейромедиаторов. Постсинаптические ГАМКB рецепторы активируют связанные с G-белком каналы, повышающие внутреннюю концентрацию К+ (GIRK), и регулируют аденилилциклазу (Billinton et al., Trends Neurosci., 24, 277-282, 2001; Bowery et al., Pharmacol. Rev.. 54, 247-264, 2002). Поскольку ГАМКB рецепторы стратегически расположены таким образом, чтобы модулировать деятельность различных нейромедиаторных систем, то, следовательно, лиганды ГАМКB рецептора могут иметь терапевтический потенциал при лечении тревожности, депрессии, эпилепсии, шизофрении и когнитивных расстройств (Vacher and Bettler, Curr. Drug Target, CNS Neurol. Disord. 2, 248-259, 2003; Bettler et al., Physiol Rev. 84, 835-867, 2004).
-Аминомасляная кислота (ГАМК) – самый широко распространенный тормозящий нейромедиатор, активирует как ионотропные ГАМКA/C, так и метаботропные ГАМКB рецепторы (Hill and Bowery, Nature, 290, 149-152, 1981). ГАМКB рецепторы, которые присутствуют в большинстве областей мозга млекопитающих на пресинаптических терминалах и постсинаптических нейронах, вовлечены в тонкую настройку тормозной синаптической передачи. Пресинаптические ГАМКB рецепторы путем модуляции высоковольтных активированных Са2+ каналов (P/Q-и N-типа) тормозят высвобождение многих нейромедиаторов. Постсинаптические ГАМКB рецепторы активируют связанные с G-белком каналы, повышающие внутреннюю концентрацию К+ (GIRK), и регулируют аденилилциклазу (Billinton et al., Trends Neurosci., 24, 277-282, 2001; Bowery et al., Pharmacol. Rev.. 54, 247-264, 2002). Поскольку ГАМКB рецепторы стратегически расположены таким образом, чтобы модулировать деятельность различных нейромедиаторных систем, то, следовательно, лиганды ГАМКB рецептора могут иметь терапевтический потенциал при лечении тревожности, депрессии, эпилепсии, шизофрении и когнитивных расстройств (Vacher and Bettler, Curr. Drug Target, CNS Neurol. Disord. 2, 248-259, 2003; Bettler et al., Physiol Rev. 84, 835-867, 2004).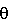 ,
,  -хлорфенил ГАМК), селективный агонист ГАМКB рецептора с ЕС50=210 нм по нативному рецептору, является единственным лигандом, который использовался с 1972 года в клиническом исследовании для лечения спастичности и ригидности скелетной мышцы у пациентов с повреждением спинного мозга, рассеянным склерозом, амиотрофическим латеральным склерозом и церебральным параличом. Большинство доклинических и клинических исследований баклофена и агонистов ГАМКB рецептора проводилось для лечения невропатической боли и тяги к кокаину и никотину (Misgeld et al., Prog. Neurobiol. 46, 423-462, 1995; Enna et al., Life Sci, 62, 1525-1530, 1998; McCarson and Enna, Neuropharmacology, 38, 1767-1773, 1999; Brebner et al., Neuropharmacology, 38, 1797-1804, 1999; Paterson et at., Psychopharmacology, 172, 179-186, 2003). Было показано, что у пациентов с расстройством панического типа Баклофен значительно эффективнее при уменьшении количества острых тревожных состояний с реакцией паники и симптомов беспокойства, что определяли по шкале тревожности Гамильтона, шкале тревожности Цунга и по субшкале нервозности Кац-Р (Katz-R) (Breslow et al., Am. J. Psychiatry, 146, 353-356, 1989). При исследовании небольшой группы ветеранов с хроническим боевым посттравматическим стрессовым расстройством (ПТСР) было найдено, что Баклофен эффективен и хорошо переносится при лечении. Это привело к существенным улучшениям общих признаков ПТСР, наиболее значительными из которых являются избегание, эмоциональное онемение и признаки гипервозбуждения, а также уменьшение сопутствующих тревожности и депрессии (Drake et al., Ann. Pharmacother. 37, 1177-1181, 2003). В доклиническом изучении Баклофен был способен обратить снижение предымпульсного торможения (PPI) реакции вздрагивагия на звук, индуцированное дизоцилпином, но не апоморфином в модели психоза PPI крысы. (Bortolato et al., Psychopharmacology, 171, 322-330, 2004). Поэтому агонист ГАМКB рецептора имеет потенциал в фармакологической терапии психотических расстройств. Но Баклофен имеет множество побочных эффектов, включая плохое проникновение через гематоэнцефалический барьер, очень короткую продолжительность действия и узкое терапевтическое окно (мышечное расслабление, седация и переносимость), которые ограничивают его полезность.
-хлорфенил ГАМК), селективный агонист ГАМКB рецептора с ЕС50=210 нм по нативному рецептору, является единственным лигандом, который использовался с 1972 года в клиническом исследовании для лечения спастичности и ригидности скелетной мышцы у пациентов с повреждением спинного мозга, рассеянным склерозом, амиотрофическим латеральным склерозом и церебральным параличом. Большинство доклинических и клинических исследований баклофена и агонистов ГАМКB рецептора проводилось для лечения невропатической боли и тяги к кокаину и никотину (Misgeld et al., Prog. Neurobiol. 46, 423-462, 1995; Enna et al., Life Sci, 62, 1525-1530, 1998; McCarson and Enna, Neuropharmacology, 38, 1767-1773, 1999; Brebner et al., Neuropharmacology, 38, 1797-1804, 1999; Paterson et at., Psychopharmacology, 172, 179-186, 2003). Было показано, что у пациентов с расстройством панического типа Баклофен значительно эффективнее при уменьшении количества острых тревожных состояний с реакцией паники и симптомов беспокойства, что определяли по шкале тревожности Гамильтона, шкале тревожности Цунга и по субшкале нервозности Кац-Р (Katz-R) (Breslow et al., Am. J. Psychiatry, 146, 353-356, 1989). При исследовании небольшой группы ветеранов с хроническим боевым посттравматическим стрессовым расстройством (ПТСР) было найдено, что Баклофен эффективен и хорошо переносится при лечении. Это привело к существенным улучшениям общих признаков ПТСР, наиболее значительными из которых являются избегание, эмоциональное онемение и признаки гипервозбуждения, а также уменьшение сопутствующих тревожности и депрессии (Drake et al., Ann. Pharmacother. 37, 1177-1181, 2003). В доклиническом изучении Баклофен был способен обратить снижение предымпульсного торможения (PPI) реакции вздрагивагия на звук, индуцированное дизоцилпином, но не апоморфином в модели психоза PPI крысы. (Bortolato et al., Psychopharmacology, 171, 322-330, 2004). Поэтому агонист ГАМКB рецептора имеет потенциал в фармакологической терапии психотических расстройств. Но Баклофен имеет множество побочных эффектов, включая плохое проникновение через гематоэнцефалический барьер, очень короткую продолжительность действия и узкое терапевтическое окно (мышечное расслабление, седация и переносимость), которые ограничивают его полезность.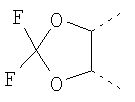
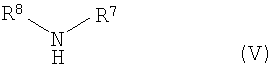
 16 человека, при плотности 5×104 клеток/на лунку высевали в 96-луночный темный планшет с чистым дном, обработанный поли-D-лизином (BD Biosciences, Palo Alto, CA). Через 24 часа в ячейки загружали в течение 90 мин при 37°С 4 мкМ раствор Flou-4-ацетоксиметилового эфира (Catalog No. F-14202, Molecular Probes, Eugene, OR) в загрузочном буфере (1×HBSS, 20 мМ HEPES, 2,5 мМ Пробеницид). Сбалансированный солевой раствор Хэнка (HBSS) (10Х) (catalog No. 14065-049) и HEPES (1M) (catalog No. 15630-056) закупали у Invitrogen, Carlsbad, CA. Пробеницид (250 мМ) (catalog No. P8761) был от Sigma, Buchs, Switzerland. Клетки промывали пять раз загрузочным буфером для удаления избытка красителя и измеряли внутриклеточную мобилизацию кальция [Са2+]i с использованием флуорометрического планшетного ридера (FLIPR, Molecular Devices, Menlo Park, CA), как описано ранее (Porter et al., Br. J. Pharmacol., 128, 13-20, 1999). Энхансеры вносили за 15 мин до внесения ГАМК. Для анализа сдвига ГАМК кривые концентрация-отклик ГАМК (0,0003-30 мкМ) определяли в отсутствие и в присутствии 10 мкМ энхансера (усиливающего агента). Сдвиг ГАМК определяли как Log [EC50 ГАМК + 10 мкМ энхансера)/ЕС50 только ГАМК)]. Максимальный усиливающий эффект в процентах (% Emax) и силу (значение ЕС50) каждого усиливающего агента определяли из кривой концентрация-отклик усиливающего агента (0,001-30 мкм) в присутствии 10 нМ ГАМК (ЕС10). Отклики измеряли как пиковое увеличение флуоресценции минус базисное значение, нормированное по максимальному стимулирующему эффекту, вызванному только 10 мкМ ГАМК (принято за 100%) и только 10 нМ ГАМК (принято за 0%). Данные хорошо соответствовали уравнению Y=100+(Max-100)/ (1+(EC50/[drug])n), где Max является максимальным эффектом, ЕС50 является концентрацией, вызывающей эффект, соответствующий половине максимума, и n является наклоном Хилла.
16 человека, при плотности 5×104 клеток/на лунку высевали в 96-луночный темный планшет с чистым дном, обработанный поли-D-лизином (BD Biosciences, Palo Alto, CA). Через 24 часа в ячейки загружали в течение 90 мин при 37°С 4 мкМ раствор Flou-4-ацетоксиметилового эфира (Catalog No. F-14202, Molecular Probes, Eugene, OR) в загрузочном буфере (1×HBSS, 20 мМ HEPES, 2,5 мМ Пробеницид). Сбалансированный солевой раствор Хэнка (HBSS) (10Х) (catalog No. 14065-049) и HEPES (1M) (catalog No. 15630-056) закупали у Invitrogen, Carlsbad, CA. Пробеницид (250 мМ) (catalog No. P8761) был от Sigma, Buchs, Switzerland. Клетки промывали пять раз загрузочным буфером для удаления избытка красителя и измеряли внутриклеточную мобилизацию кальция [Са2+]i с использованием флуорометрического планшетного ридера (FLIPR, Molecular Devices, Menlo Park, CA), как описано ранее (Porter et al., Br. J. Pharmacol., 128, 13-20, 1999). Энхансеры вносили за 15 мин до внесения ГАМК. Для анализа сдвига ГАМК кривые концентрация-отклик ГАМК (0,0003-30 мкМ) определяли в отсутствие и в присутствии 10 мкМ энхансера (усиливающего агента). Сдвиг ГАМК определяли как Log [EC50 ГАМК + 10 мкМ энхансера)/ЕС50 только ГАМК)]. Максимальный усиливающий эффект в процентах (% Emax) и силу (значение ЕС50) каждого усиливающего агента определяли из кривой концентрация-отклик усиливающего агента (0,001-30 мкм) в присутствии 10 нМ ГАМК (ЕС10). Отклики измеряли как пиковое увеличение флуоресценции минус базисное значение, нормированное по максимальному стимулирующему эффекту, вызванному только 10 мкМ ГАМК (принято за 100%) и только 10 нМ ГАМК (принято за 0%). Данные хорошо соответствовали уравнению Y=100+(Max-100)/ (1+(EC50/[drug])n), где Max является максимальным эффектом, ЕС50 является концентрацией, вызывающей эффект, соответствующий половине максимума, и n является наклоном Хилла.