Патент на изобретение №2378245
|
|||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ СПИРО[3,4]ОКТАН-6-ОЛА
(57) Реферат:
Настоящее изобретение относится к способу получения нового соединения – спиро[3,4]октан-6-ола общей формулы (1), который может найти применение в тонком органическом синтезе, в производстве лакокрасочных материалов, высокоэффективных противозадирных и противоизносных присадок к маслам, а также биологически активных веществ. Способ заключается в том, что метиленциклобутан подвергают взаимодействию с триэтилалюминием (AlEt3) в присутствии катализатора цирконацендихлорида (Cp2ZrCl2) при мольном соотношении метиленциклобутан: AlEt3:Cp2ZrCl2=10:(10-14):(0.4-0.6) в атмосфере аргона при комнатной температуре и атмосферном давлении в гексане в течение 4 ч с последующим добавлением к реакционной массе при температуре -15°С катализатора хлорида меди (CuCl) в эквимольном к Cp2ZrCl2 количестве и этилформиата в трехкратном избытке по отношению к AlEt3, после чего реакционную массу перемешивают при комнатной температуре с последующим щелочным гидролизом реакционной массы. 1 табл.
Предлагаемое изобретение относится к органической химии, в частности к способу получения спиро[3,4]октан-6-ола формулы (1):
Циклоалканолы могут найти применение в тонком органическом синтезе, в частности при получении спиро[3.4]окта-5,7-диена ([1] I.Erden, E.M.Sorenson, A convenient synthesis of spiro[3.4]oct-5,7-diene, Tet.Lett, V.27, 1983, 2731-2732) и диспиро[2.1.3.2.]декана ([2] J.E.Baldwin and R.ShukIa, Two synthesis of dispiro[2.1.3.2.]decane, Org.Lett, 1999, V.1,
Известным способом не может быть получен спиро[3,4]октан-6-ол формулы (1). Известен способ ([2] У.М.Джемилев, А.Г.Ибрагимов, Л.О.Хафизова, Р.Р.Гилязев, В.А.Дьяконов. Синтез и превращения металлоциклов. Новый метод синтеза циклопентанолов на основе алюминациклопентанов. Изв. АН. Сер. хим., 2004, Известный способ не позволяет получать спиро[3,4]октан-6-ол формулы (1). Предлагается новый способ получения спиро[3,4]октан-6-ола (1). Сущность способа заключается во взаимодействии метиленциклобутана с триэтилалюминием (Et3Al) в присутствии катализатора цирконацендихлорида (Cp2ZrCl2), взятых в мольном соотношении метиленциклобутан: EtsAl:Cp2ZrCl2=10:(10-14):(0.4-0.6), предпочтительно 10:12:0.5, атмосфере аргона при комнатной температуре (20-21°С) и атмосферном давлении в алифатическом растворителе (гексан) в течение 4 ч с последующим добавлением к реакционной массе при температуре -15°С катализатора хлорида меди (CuCl) в эквимольном к Cp2ZrCl2 количестве и этилформиата в трехкратном избытке по отношению к AlEt3 с последующим перемешиванием реакционной массы при комнатной температуре (20-21°С) в течение 4-6 ч, предпочтительно 5 ч. Общий выход спиро[3,4]октан-6-ола (1) составляет после щелочного (NaOH/H2O) гидролиза реакционной массы 68-91%. Реакция протекает по схеме: Спиро[3,4]октан-6-ол (1) образуется только лишь с участием AlEt3, метиленциклобутана и циркониевого катализатора Cp2ZrCl2. В присутствии других соединений алюминия (например, Bu2 Проведение указанной реакции в присутствии катализатора Cp2ZrCl2 или CuCl больше 6 мол.% по отношению к метиленциклобутану не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Cp2ZrCl2 и CuCl менее 4 мол.% снижает выход спиро[3,4]октан-6-ола (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при комнатной температуре (20-21°С). При более высокой температуре (например, 60°С) не наблюдается существенного увеличения выхода целевого продукта, а при меньшей температуре (например, 10°С) снижается скорость реакции. Изменение соотношения исходных реагентов в сторону увеличения их содержания по отношению к исходному метиленциклобутану не приводит к существенному повышению выхода целевого продукта(1). Реакции проводили с использованием алифатических растворителей (гексан). В других растворителях (например, эфирных) реакция не идет. Существенные отличия предлагаемого способа В известном способе в качестве исходного непредельного соединения используются Предлагаемый способ обладает следующими преимуществами: 1. Способ позволяет получать с высокой региоселективностью спиро[3,4]октан-6-ол общей формулы (1). Способ поясняется следующими примерами. ПРИМЕР 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 2 мл гексана, 10 ммолей метиленциклобутана, 0.5 ммоля катализатора Cp2ZrCl2, при температуре ~0°С 12 ммоля AlEt3, перемешивают 4 ч при комнатной температуре (20-21°С), затем при температуре -15°С добавляют 0.5 ммоля катализатора CuCl и 36 ммолей этилформиата, перемешивают 5 ч при температуре 20-21°С, реакционную массу гидролизуют водным раствором (8-10%) NaOH. Из органического слоя выделяют спиро[3,4]октан-6-ол с выходом 80%. Спектральные характеристики спиро[3,4]октан-6-ола (1):
Другие примеры, подтверждающие способ, приведены в табл.1.
Опыты проводили в гексане при комнатной (20-21°С) температуре.
Формула изобретения
Способ получения спиро[3,4]октан-6-ола (1),
|
|||||||||||||||||||||||||||||||||||||||||||

 1, с.130-133. RU 2219157 C1, 20.12.2003. US 5104851 A, 14.04.1992.
1, с.130-133. RU 2219157 C1, 20.12.2003. US 5104851 A, 14.04.1992.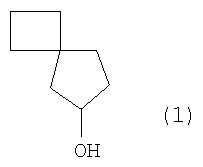
 -олефинами, окисью углерода (СО) и водой по схеме:
-олефинами, окисью углерода (СО) и водой по схеме: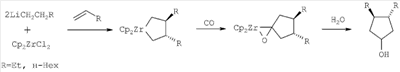

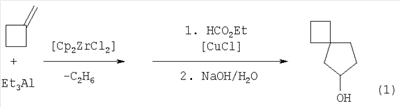
 iAlCl, Bu3
iAlCl, Bu3 , м.д.) спиро[3,4]октан-6-ола (1): 16.4, 34.50, 34.84, 37.63, 45.54, 49.32, 73.16
, м.д.) спиро[3,4]октан-6-ола (1): 16.4, 34.50, 34.84, 37.63, 45.54, 49.32, 73.16 :AlEt3:Cp2ZrCl2:HCO2Et:CuCl, ммоль
:AlEt3:Cp2ZrCl2:HCO2Et:CuCl, ммоль