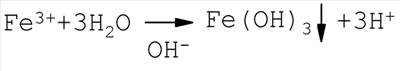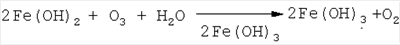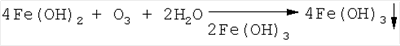Патент на изобретение №2378203
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ОЧИСТКИ ПРИРОДНЫХ ВОД ОТ ЖЕЛЕЗА
(57) Реферат:
Изобретение относится к области подготовки питьевой воды, в частности к каталитической очистке природных вод от соединений железа. Способ очистки природных вод от железа включает предварительное озонирование воды в присутствии катализатора с последующей фильтрацией взвешенной фазы через фильтр, причем в качестве фильтра используют гранулированный мрамор, активированный трехвалентным гидроксидом железа. Изобретение позволяет увеличить верхний предел концентрации исходного содержания железа в очищаемой воде, снизить энергозатраты на обезжелезивание природных вод; увеличить скорость окисления железа (II). 2 з.п. ф-лы, 2 табл.
Изобретение относится к области водоподготовки питьевой воды, в частности к каталитической очистке природных вод от соединений железа. Анализ современного уровня техники в этой области показывает, что известные способы обезжелезивания воды (аэрация, известкование, катионирование) малоэффективны в случае присутствия железа в высоких концентрациях ( Наиболее близким аналогом по технической сущности к заявленному способу очистки природных вод от железа является способ, заключающейся в предварительном озонировании воды до остаточных концентраций железа 1,0-1,2 мг/л с последующей фильтрацией через фильтр (песчаный), при этом достигалось практически полное обезжелезивание воды [3]. Недостатками указанного способа являются: возможность применения способа при исходной концентрации содержания железа в очищаемой воде < 15 мг/л, остающиеся существенными дозы озона – 0,11-0,17 мг О3/мг Fe, что ограничивает применение способа для природных вод с высоким содержанием железа (20 мг/л и более); неудовлетворительная емкость фильтрующей загрузки (грязеемкость), что требует частой регенерации фильтров; длительность выхода фильтров на стационарный режим работы, которая составляет 12,5% от времени фильтроцикла, что в целом усложняет и удорожает процесс обезжелезивание воды. Техническая задача, решаемая заявляемым изобретением, состоит в том, чтобы увеличить верхний предел концентрации исходного содержания железа в очищаемой воде (до 20 мг/л и выше), снизить энергозатраты на обезжелезивание природных вод за счет уменьшения дозы озона; увеличить эффективность обезжелезивания воды в расчете на единицу объема фильтрующей загрузки. Технический результат, который может быть получен в результате осуществления изобретения, достигается способом очистки природных вод от железа, включающим предварительное озонирование с последующей фильтрацией взвешенной фазы через фильтр, при этом озонирование ведут в присутствии катализатора, а последующее отделение образовавшейся взвешенной фазы трехвалентного гидроксида железа осуществляют путем фильтрации через зернистую загрузку. А также тем, что в качестве катализатора используют пероксид водорода в концентрации 2,0-3,0 мг/л. А также тем, что в качестве зернистой загрузки используется мраморная крошка фракции 1-3 мм, активированная трехвалентным гидроксидом железа. А также тем, что применяют озонирование в качестве кратковременной инициирующей стадии, а полное окисление завершается в объеме фильтрующей загрузки. Для решения поставленной задачи в заявляемом способе использовано окисление двухвалентного железа методом озонирования в присутствии пероксида водорода в качестве катализатора с последующим фильтрованием очищаемой воды через контактный фильтр, заполненный мраморной крошкой, активированной гидроксидом железа (III). Введение в реакционный объем пероксида водорода не только увеличивает окислительный потенциал реагентов, но и поддерживает его постоянно высоким в течение всего времени окисления Fe2+ в Fe3+. Каталитическое действие пероксида водорода может быть объяснено протеканием следующей схемы процессов. На первой стадии взаимодействие Н2O2 и озона приводит к образованию высокореакционных радикалов: H2O2+O3 Образовавшиеся радикалы окисляют катионы Fe2+: F2++HO2 Гидролиз пероксид-аниона НО2- вновь приводит к образованию Н2O2: HO2-+H2O В качестве фильтрующей загрузки выбран гранулированный мрамор, так как он поддерживает в воде при фильтрации гарантированную слабощелочную среду, способствующую более полному образованию при гидролизе Fe3+ взвешенной фазы Fе(ОН)3: Кроме того, мраморная крошка (фракция 1-3 мм) в сравнении с песчаными фильтрами имеет значительно больший объем межпорового пространства, что увеличивает грязеемкость фильтров и, соответственно, удлиняет время фильтроцикла. Перед эксплуатацией гранулированный мрамор предварительно активируется гидроксидом железа (III), для чего его кипятят в течение 5 минут в растворе FеСl3. В этом случае мраморная крошка выступает не только в качестве фильтрующей загрузки, но в ее объеме протекает эффективное каталитическое доокисление соединений железа (II): При достижении в воде на выходе из фильтра содержания железа выше санитарно-гигиенических норм фильтр подвергают регенерации, которую осуществляют противоточной воздушной промывкой. Анализ экспериментальных данных показал, что на протяжении всего времени озонолиза (~1 ч) в присутствии H2O2 механизм реакции окисления Fe(II) оставался неизменным, о чем свидетельствует линейность полученных кинетических зависимостей в координатах формального уравнения первого порядка. Кроме того, введение в реакционный объем H2O2 в концентрации, например, 1 мг/л увеличивает скорость окисления более чем на порядок (см. табл.1), в то время как по уравнению реакции: 2Fe2++H2O2 эффективность окисления должна возрасти для С (Fe)=30 мг/л не более чем на 20%. Совокупность данных фактов позволяет говорить о каталитическом действии Н2O2 на озонолиз растворов Fe (II). Отличительной и существенной особенностью предлагаемого способа является то, что введение при озонировании в реакционный объем пероксида водорода значительно увеличивает скорость окисления железа (II), при этом требуется лишь кратковременная обработка озоном для инициирования процесса окисления, а полное окисление с одновременным отделением образовавшейся взвешенной фазы Fе(ОН)3 протекает в объеме фильтрующей загрузки – активированного гранулированного мрамора. Нижеприведенные примеры являются не ограничивающими сущность заявляемого решения и иллюстрируют преимущества и воспроизводимость заявленного способа. Пример 1. Экспериментальные исследования проводились на модельных растворах, приготовленных на дистиллированной воде с исходным содержанием Fe2+ – 20-30 мг/л. Процесс окисления Fe2+ в Fe3+ заключался в следующем. В барботажную камеру диаметром 5 см и объемом 500 мл заливался раствор Fe2+, добавлялся до необходимой концентрации пероксид водорода и при фиксированной скорости (V=14,2 л/ч) подавался диспергированный озонированный воздух (концентрация озона – 1 мг/л). Через определенные интервалы времени проводился отбор проб и анализ остаточной концентрации Fe2+. Так как кинетика окисления Fe2+ в Fe3+ удовлетворительно описывается формальным уравнением кинетики первого порядка, то в качестве критерия каталитической активности было выбрано сопоставление констант скорости реакций окисления k в присутствии Н2O2 по отношению к прямому озонированию. Рассчитанные по результатам экспериментов константы скорости в зависимости от концентрации добавленного Н2О2 приведены в табл.1, из данных которой следует, что оптимальная концентрация Н2О2 для исследованного содержания Fe(II) составляет 2,0-3,0 мг/л; скорость окисления Fe(II) в присутствии H2O3 возрастает в 15-20 раз.
Пример 2. В барботажную камеру заливалось 500 мл раствора Fe2+ с концентрацией 24 мг/л, добавляли H2O2 в концентрации 2,5 мг/л и подавали в течение определенного времени диспергированный озонированный воздух (Vвозд=60 л/ч, с(O3)=0,162 мг/л). После завершения озонирования вода подавалась в контактный фильтр, заполненный гранулированным мрамором, активированным Fе(ОН)3 (объем загрузки 180 см3, фракция 1-3 мм, высота слоя 36 см, скорость фильтрования 0,6 м/ч) в котором завершался процесс окисления двухвалентного железа и происходило отделение взвешенной фазы образовавшегося гидроксида железа (III). В воде на выходе из фильтра измерялась концентрация общего железа. Зависимость концентрации железа в фильтрате от времени предварительного озонирования приведена в табл.2, из данных которой следует, что для практически полного обезжелезивания для данной исходной концентрации железа достаточно дозы озона – 0,054 мг О3/мг Fe, что в 2-3 раза меньше в сравнении с прототипом – 0,11-0,17 мг О3/мг Fe.
Таким образом, заявляемый способ осуществим и позволяет: – увеличить скорость окисления железа (II) методом озонирования за счет введения в реакционный объем пероксида водорода в качестве катализатора; – уменьшить в 2-3 раза расход озона при использовании комплексной технологии, включающей стадию предварительного озонирования в присутствии пероксида водорода с последующим доокисления железа (II) и отделением образовавшегося гидроксида железа (III) в объеме гранулированного мрамора, активированного Fe(OH)3; – обеспечить возможность обезжелезивания природных вод с высоким содержанием двухвалентного железа (20 мг/л и выше). Литература 1. Л.В.Можаев, И.Н.Помозов, В.К.Романов. Озонирование в водоподготовке. История и практика применения. / «Сантехника, отопление, канализация», 2. В.Ф.Кожинов. Установки для озонирования воды. М.: Стройиздат, 1968, с.49-50. 3. В.Л.Драгинский, Л.П.Алексеева, В.Г.Самойлович. Озонирование в процессах очистки воды. М.: ДеЛи принт, 2007, с.184-202.
Формула изобретения
1. Способ очистки природных вод от железа, включающий предварительное озонирование в присутствии катализатора с последующей фильтрацией взвешенной фазы через фильтр, отличающийся тем, что в качестве фильтра используют гранулированный мрамор, активированный трехвалентным гидроксидом железа. 2. Способ по п.1, отличающийся тем, что в качестве катализатора используют пероксид водорода в концентрации 2,0-3,0 мг/л. 3. Способ по п.1, отличающийся тем, что размер гранул мрамора составляет 1-3 мм.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 735
735 20 мг/л) и в форме коллоидных частиц (сульфидов и комплексных соединений с гуматами и фульвокислотами). Для окисления комплексных соединений железа необходимы более сильные окислители, чем кислород воздуха, наиболее эффективным из которых является озон. Однако прямое обезжелезивание воды методом озонирования, существенно сокращая время обработки, требует значительного расхода озона – от 0,44 мг О3/мг Fe [1] до 1 мг О3/мг Fe [2], что приводит к высоким энергозатратам и, соответственно, к высокой стоимости очистки.
20 мг/л) и в форме коллоидных частиц (сульфидов и комплексных соединений с гуматами и фульвокислотами). Для окисления комплексных соединений железа необходимы более сильные окислители, чем кислород воздуха, наиболее эффективным из которых является озон. Однако прямое обезжелезивание воды методом озонирования, существенно сокращая время обработки, требует значительного расхода озона – от 0,44 мг О3/мг Fe [1] до 1 мг О3/мг Fe [2], что приводит к высоким энергозатратам и, соответственно, к высокой стоимости очистки. HO2
HO2
 +OH
+OH