|
|
(21), (22) Заявка: 2005134238/15, 01.04.2004
(24) Дата начала отсчета срока действия патента:
01.04.2004
(30) Конвенционный приоритет:
04.04.2003 US 60/460,532
(43) Дата публикации заявки: 10.03.2006
(46) Опубликовано: 10.01.2010
(56) Список документов, цитированных в отчете о
поиске:
US 6436174 В1, 20.08.2002. US 4336233 A, 22.06.1982. US 5277885 A, 11.01.1994. US 4217237 A, 12.08.1980. SU 147745 A1, 07.05.1989. US 4100257 A, 11.07.1978. GB 1063517 A, 30.03.1967. AXMETOB Н.С. Неорганическая химия. – М.: Высшая школа, 1975, с.211-213. КРАТКАЯ ХИМИЧЕСКАЯ ЭНЦИКЛОПЕДИЯ. / Под ред. И.Л. Кнунянца. – М.: Советская энциклопедия, 1967, т.5, с.1034, 1035.
(85) Дата перевода заявки PCT на национальную фазу:
07.11.2005
(86) Заявка PCT:
US 2004/009962 20040401
(87) Публикация PCT:
WO 2004/089512 20041021
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
РОШЕЛЛЬ Гари (US),
КАЛЛИНЭЙН Джон (US)
(73) Патентообладатель(и):
БОРД ОФ РИДЖЕНТС, ДЗЕ ЮНИВЕРСИТИ ОФ ТЕХАС СИСТЕМ (US)
|
(54) СМЕСИ ПОЛИАМИНА/ЩЕЛОЧНОЙ СОЛИ ДЛЯ УДАЛЕНИЯ ДВУОКИСИ УГЛЕРОДА ИЗ ГАЗОВЫХ ПОТОКОВ
(57) Реферат:
Изобретение может быть использовано в химической промышленности и для защиты атмосферы от газовых выбросов. Способ удаления CO2 из газового потока включает его взаимодействие с органической композицией и последующую регенерацию CO2-насыщенного раствора. Композиция содержит пиперазиновое производное, имеющее концентрацию, по меньшей мере, 3,0 эквивалента/кг воды, калиевую соль, имеющую концентрацию, по меньшей мере, 1,0 эквивалент/кг воды, и воду. Отношение эквивалентов щелочной соли к эквивалентам пиперазинового производного составляет 0,3-3,0. Указанная композиция не содержит одноатомного или многоатомного спирта. Технический результат – эффективное удаление СО2 из газовых потоков, снижение расходов на очистку за счет достижения более высокой концентрации и емкости поглощающего раствора. 2 н. и 11 з.п. ф-лы, 5 ил., 2 табл.
Уровень техники
Настоящая заявка заявляет приоритет временной заявки на патент США, серийный  60/460,532, зарегистрированной 4 апреля 2003 года, и включает ее в себя в качестве ссылки. Настоящее изобретение относится в целом к области очистки газов. Более конкретно, оно предусматривает множество композиций и способов для использования при удалении CO2 из газовых потоков. 60/460,532, зарегистрированной 4 апреля 2003 года, и включает ее в себя в качестве ссылки. Настоящее изобретение относится в целом к области очистки газов. Более конкретно, оно предусматривает множество композиций и способов для использования при удалении CO2 из газовых потоков.
Воздействие выбросов CO2 на глобальный климат вызывает необходимость в разработке экономически эффективной технологии для улавливания CO2, образующегося при сгорании природного топлива и из других точечных источников. Уже осуществленные широкие программы начинают демонстрировать экономическую и техническую возможность понижения уровня CO2 посредством таких подходов, как нагнетание в подземные резервуары (Bergman, P.D., E.M. Winter and Z-Y. Chen. “Disposal of Power Plant CO2 in Depleted Oil and Gas Reservoirs in Texas”, presented at Third International Conference on Carbon Dioxide Removal, Cambridge, MA, Sept 9-11, 1996) и захоронение в глубине океана (Fujioka, Y. et al. “Cost Comparison of Various CO2 Ocean Disposal Options”, presented at Third International Conference on Carbon Dioxide Removal, Cambridge, MA, Sept 9-11, 1996).
При сгорании топлива в мобильных и стационарных источниках CO2 выбрасывается в больших количествах. Улавливание/понижение уровня CO2 будет наиболее эффективным, если применяется к большим стационарным источникам. Самые большие обособленные источники CO2 представляют собой обычные тепловые угольные электростанции, которые дают от 30 до 40% выбросов CO2 в США. Технология, разработанная для таких источников, должна также быть применима к улавливанию CO2 из газовых и нефтяных бойлеров, энергетических установок с комбинированным циклом, установок на газифицированном угле и водороде. Поглощение/очистка является пригодной как для уже существующих, так и для новых бойлеров. Конкретно, она может использоваться вместе с существующими угольными бойлерами, в особенности если они уже имеют скрубберы для уменьшения количества примеси SO2. Однако этот способ может быть дорогостоящим, потенциально повышая стоимость электричества на 50%; по этой причине являются желательными усовершенствования технологии для понижения стоимости работы.
Использование органических растворителей или водных растворов органических растворителей для процесса поглощения/очистки является хорошо известным. Поглощение/очистка с помощью алканоламинов является одной из проверенных и эффективных технологий для улавливания CO2 из газа. Первое поколение этой технологии использует водные растворы моноэтаноламина (MEA). Потребление энергии этой системой является высоким, как правило, отнимая от 15 до 30% выходной мощности установки (Herzog, H., E. Drake, & E. Adams. “CO2 Capture, Reuse, and Storage Technologies for Mitigating Global Climate Change”. Final rept, DOE Order No. DE-AF22-96PC01257, 1997). Усовершенствования этой технологии обеспечивают другие алканоламиновые растворители для обработки CO2 в различных областях промышленности. Моноэтаноламин (MEA), диэтаноламин (DEA) и затрудненный амин AMP по отдельности используются в водном растворе. Типичные смеси растворителей включают раствор метилдиэтаноламина (MDEA) с промотором в виде пиперазина или других вторичных аминов.
Карбонат калия и другие растворители обычно содержат в качестве промоторов DEA или другие реакционноспособные амины. Эти амины предусматриваются в каталитических количествах и используются для улучшения характеристик поглощения растворителя. Патенты, описывающие эти растворители и способы, включают в себя патенты США  4094957, 4112050, 4217237, 4336233, 4581209, 5853680, 6036931, 6337059 и 6416568. 4094957, 4112050, 4217237, 4336233, 4581209, 5853680, 6036931, 6337059 и 6416568.
Патент США  4336233, который предусматривает систему растворителей, объединяющую MDEA и пиперазин в качестве ускорителя поглощения, отмечает, что пиперазин может использоваться и сам по себе, в водной системе. Подобным же образом патент США 4336233, который предусматривает систему растворителей, объединяющую MDEA и пиперазин в качестве ускорителя поглощения, отмечает, что пиперазин может использоваться и сам по себе, в водной системе. Подобным же образом патент США  6337059 предусматривает систему растворителей с более чем 1 M пиперазина и MDEA, где повышенные концентрации пиперазина улучшают характеристики поглощения растворителя. Однако концентрация пиперазина, большая примерно чем 1,3 M, не используется, поскольку пиперазин выпадает из раствора в осадок. В дополнение к этому пиперазин является очень летучим, практически ограничивая этот растворитель. 6337059 предусматривает систему растворителей с более чем 1 M пиперазина и MDEA, где повышенные концентрации пиперазина улучшают характеристики поглощения растворителя. Однако концентрация пиперазина, большая примерно чем 1,3 M, не используется, поскольку пиперазин выпадает из раствора в осадок. В дополнение к этому пиперазин является очень летучим, практически ограничивая этот растворитель.
Патент США  6436174 предусматривает систему растворителей, в которой определенные концентрации азотного гетероцикла, такого как пиперазин, могут использоваться в сочетании с одноатомным или многоатомным спиртом. Это описание обнаруживает, что растворимость азотного гетероцикла в присутствии одноатомного или многоатомного спирта, как правило, является значительно более высокой, чем растворимость одного лишь азотного гетероцикла. Однако патент США 6436174 предусматривает систему растворителей, в которой определенные концентрации азотного гетероцикла, такого как пиперазин, могут использоваться в сочетании с одноатомным или многоатомным спиртом. Это описание обнаруживает, что растворимость азотного гетероцикла в присутствии одноатомного или многоатомного спирта, как правило, является значительно более высокой, чем растворимость одного лишь азотного гетероцикла. Однако патент США  6436174 не говорит о том, что система растворителей с высокой концентрацией щелочной соли будет увеличивать растворимость полиамина, и не приводит пригодных для использования диапазонов компонентов растворителей, которые были бы эффективными при создании растворителей, которые могут эффективно удалять CO2 из газового потока. 6436174 не говорит о том, что система растворителей с высокой концентрацией щелочной соли будет увеличивать растворимость полиамина, и не приводит пригодных для использования диапазонов компонентов растворителей, которые были бы эффективными при создании растворителей, которые могут эффективно удалять CO2 из газового потока.
Было бы преимуществом создание органического растворителя для удаления CO2 из газовых потоков, имеющего более высокие скорости реакции, приемлемую летучесть и низкую теплоту поглощения, что даст возможность для понижения стоимости способа поглощения/очистки. Также было бы преимуществом создание растворителя, который ближе подходит к обратимому поглощению и обратимой очистке, который в особенности облегчит работу при высоких концентрациях CO2.
Варианты осуществления настоящего изобретения предполагают способ удаления CO2 из газового потока, включающий взаимодействие газового потока с раствором, в котором раствор получают посредством объединения первичного или вторичного полиамина, имеющего концентрацию амина, по меньшей мере, 3,0 эквивалента/кг воды, щелочной соли, имеющей концентрацию, по меньшей мере, 1,0 эквивалент/кг воды, и воды; в результате такого взаимодействия CO2 удаляют из газового потока; и регенерацию раствора.
В другом варианте осуществления предусматривается композиция, которую получают путем объединения пиперазинового производного, имеющего концентрацию, по меньшей мере, 3,0 эквивалента/кг воды; и калиевой соли, имеющей концентрацию, по меньшей мере, 1,0 эквивалент/кг воды, воды, где отношение эквивалентов щелочной соли к эквивалентам пиперазинового производного составляет 0,3-3,0. Пиперазиновое производное может представлять собой пиперазин. Калиевая соль может представлять собой щелочную соль калия, такую как карбонат калия, бикарбонат калия, бисульфид калия или гидроксид калия. Отношение эквивалентов щелочной соли к эквивалентам пиперазинового производного может составлять 0,5-2,0, 0,8-1,3 или 0,9-1,1. Концентрации пиперазинового производного и щелочной соли предпочтительно находятся в пределах между 3,0 и 8,0 эквивалентами/кг H2O или между 4,0 и 6,0 эквивалентами/кг H2O. В одном из вариантов осуществления концентрация пиперазинового производного составляет приблизительно 5,0 эквивалентов/кг H2O, и концентрация щелочной соли составляет приблизительно 5,0 эквивалентов/кг H2O. Кроме того, композиция может содержать антиоксидант, ингибитор коррозии, флоккулирующую добавку или их смесь.
Еще один вариант осуществления настоящего изобретения включает способ удаления CO2 из газового потока, включающий взаимодействие газового потока с раствором, где раствор получают посредством объединения первичного или вторичного полиамина, имеющего концентрацию амина, по меньшей мере, 5,1 эквивалента/кг воды, щелочной соли, имеющей концентрацию, по меньшей мере, 5,1 эквивалента/кг воды, и воды; в результате такого взаимодействия CO2 удаляют из газового потока; и регенерацию раствора. Концентрация полиамина и концентрация щелочной соли могут составлять, по меньшей мере, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5 или 8,0 эквивалентов/кг воды. Предпочтительно концентрации составляют, по меньшей мере, 5,5, 6,0, или 6,5 эквивалентов/кг воды. Концентрация полиамина и концентрация щелочной соли предпочтительно являются приблизительно равными; концентрации могут составлять приблизительно 5,1, 5,5, 6,0, 6,5, 7,0, 7,5, 8 или более эквивалентов/кг H2O как для полиамина, так и для щелочной соли. Концентрации будут ограничиваться растворимостью компонентов при данной температуре.
Другой вариант осуществления настоящего изобретения включает способ удаления CO2 из газового потока, включающий взаимодействие газового потока с раствором, в котором раствор получают путем объединения первичного или вторичного полиамина, имеющего концентрацию амина, по меньшей мере, 3,0 эквивалента/кг воды, щелочной соли, имеющей концентрацию, по меньшей мере, 1,0 эквивалент/кг воды, и воды; при этом раствор содержит менее чем 1% одноатомного или многоатомного спирта; в результате такого взаимодействия CO2 удаляют из газового потока; и регенерацию раствора. В одном из вариантов осуществления к раствору добавляют менее чем 1 мас.% спирта. В другом варианте осуществления спирт не добавляют.
Другой вариант осуществления настоящего изобретения включает способ удаления CO2 из газового потока, включающий взаимодействие газового потока с раствором, в котором раствор получают путем объединения пиперазинового производного, имеющего концентрацию амина 3,0-10,0 эквивалентов/кг воды, щелочной соли, имеющей концентрацию 1,0-10,0 эквивалентов/кг воды, и воды; где концентрация пиперазинового производного и концентрация щелочной соли являются приблизительно равными; в результате такого взаимодействия CO2 удаляют из газового потока; и регенерацию раствора. Предпочтительно концентрация амина и концентрации щелочной соли находятся в пределах между 3,0 и 8,0 эквивалентами/кг воды.
Полиамин может представлять собой пиперазиновое производное, такое как пиперазин, аминоэтилпиперазин, гидроксиэтилпиперазин, 3-(3-пирролидил)пиперидин, 2-(3-пирролидил)пиперазин, 3-(3-пиперидил)-пиперидин, 3-(2-пиперазинил)пиперидин или 2-(2-пиперазинил)пиперазин. Полиамин может представлять собой этилендиамин, диметил этилендиамин, пиразолидин, имидазолидин, 2-(2-пирролидил)пирролидин, 2-(2-имидазолидил)имидазолидин. Предпочтительно аминовые остатки полиамина не являются стерически затрудненными; предпочтительно, по меньшей мере, один амин не является стерически затрудненным, или, по меньшей мере, два амина не являются стерически затрудненными, или три или более остатков аминов на полиамине не являются стерически затрудненными, никакие амины, расположенные на полиамине, не являются стерически затрудненными. Щелочная соль может представлять собой карбонат калия, карбонат натрия, карбонат лития, бикарбонатную соль, бисульфидную соль или гидроксидную соль.
Температура раствора, когда он вступает в контакт с газовым потоком, может находиться в пределах приблизительно между 25°C-120°C или более предпочтительно приблизительно 40°C-80°C. Константа скорости для реакции CO2 с пиперазиновым производным (KPZ) может составлять, по меньшей мере, 25 м3/моль·с при 25°C или, по меньшей мере, 50 м3/моль·с при 25°C.
Регенерация может включать нагрев раствора, обогащенного CO2, который может осуществляться при температуре приблизительно 50°C-150°C, приблизительно 60°C-130°C или приблизительно 100°C-130°C. Добавка, такая как противовспенивающий агент, антиоксидант, ингибитор коррозии (например, оксид ванадия или хромат), флоккулирующая добавка, или смесь двух или более добавок могут включаться в качестве части раствора.
Отношение эквивалентов щелочной соли к эквивалентам полиамина предпочтительно находится в пределах между 0,3-3,0, 0,5-2,0, 0,8-1,3 или более предпочтительно между 0,9-1,1. Концентрации полиамина и щелочной соли предпочтительно находятся в пределах между 3,0 и 8,0 эквивалентами/кг H2O или 4,0 и 6,0 эквивалентами/кг H2O. Концентрация полиамина и концентрация щелочной соли может составлять, по меньшей мере, 2,3 м. В одном из вариантов осуществления концентрация полиамина составляет приблизительно 5,0 эквивалентов/кг H2O, и концентрация щелочной соли составляет приблизительно 5,0 эквивалентов/кг H2O.
В другом варианте осуществления способ удаления CO2 из газового потока может дополнительно включать применение системы водной промывки, которая собирает полиамин из обработанного газового потока. Регенерация раствора может осуществляться в вакуумной десорбционной колонне, и раствор может возвращаться для контакта с газовым потоком после регенерации.
В одном из вариантов осуществления скорость удаления CO2 посредством растворителя из газового потока превышает, по меньшей мере, в 1,5 раза скорость удаления CO2 в способе, использующем водный раствор 5,0 M моноэтаноламина.
Другие компоненты газового потока, такие как H2S или COS, также могут удаляться с помощью способа по настоящему изобретению. Газовый поток может происходить от угольной тепловой электростанции, или он может представлять собой топочный газ, природный газ, газообразный водород, синтетический газ или поток уходящего газа.
Следующие далее чертежи составляют часть настоящего описания и включаются сюда для дальнейшей демонстрации определенных аспектов настоящего изобретения. Настоящее изобретение может быть понято лучше посредством ссылок на один или несколько из этих чертежей в сочетании с подробным описанием конкретных вариантов осуществления, представленных здесь.
Фиг.1 – сравнение скоростей поглощения CO2 в аминовых растворителях при 60°C в некотором диапазоне давлений паров CO2.
Фиг.2 – сравнение скорости поглощения пиперазинового растворителя по настоящему изобретению и других аминовых растворителей.
Фиг.3 – сравнение скорости поглощения CO2 пиперазинового растворителя по настоящему изобретению и других растворителей с промотором, карбонатом калия.
Фиг.4 – теплота поглощения для растворителей, имеющих различные концентрации K+и PZ.
Фиг.5 – емкость растворителей K+/PZ в рабочем диапазоне от 300 до 8000 Па по сравнению с емкостью MEA.
Варианты осуществления настоящего изобретения включают новый растворитель и способ применения для удаления CO2 из топочного газа, природного газа, газообразного водорода, синтетического газа и других потоков технологических и уходящих газов. Растворитель может содержать щелочную соль, такую как карбонат калия, и полиамин, такой как пиперазин (PZ), с отношением щелочная соль/полиамин приблизительно от 0,5 до 2 или более предпочтительно от 1 до 2, с общей концентрацией, ограниченной растворимостью полиамина или щелочной соли в твердом состоянии, и она будет составлять, по меньшей мере, 3,0 эквивалента PZ/кг H2O. Никаких дополнительных спиртов для увеличения растворимости PZ не требуется. Этот химический растворитель предназначен для увеличения скорости удаления CO2 с целью улучшения эффективности способа удаления.
Как здесь используется, термин “синтетический газ” относится к газам, содержащим как газообразный водород, так и газообразную моноокись углерода. Молярное отношение водорода к моноокиси углерода может, но не обязательно, составлять примерно один к одному. Другие материалы примесей, такие как азот, двуокись углерода, сероводород и COS, часто находятся в синтетическом газе.
Как используется здесь в описании, неопределенное единственное число может означать один или несколько. Как используется здесь в формуле изобретения, когда оно используется в сочетании со словом “содержащий”, неопределенное единственное число означает один или более чем один, если только явно не указывается иного.
Как здесь используется, “другой” может означать, по меньшей мере, второй или более. Как здесь используются, термины “приблизительно” и “примерно” оба означают в пределах 20% от указанного значения, более конкретно в пределах 10% от указанного значения.
Множество щелочных солей может использоваться при получении растворителя по настоящему изобретению. Могут использоваться щелочные металлы, включая, но не ограничиваясь этим, калий, натрий и литий. Они могут формировать любую из множества солей. Эти соли включают, но не ограничиваясь этим, карбонатные, бикарбонатные, гидроксидные и бисульфидные соли. Одной из предпочтительных солей является карбонат калия. Другие щелочные соли включают бикарбонат калия, гидроксид калия и бисульфид калия. Подобным же образом могут использоваться соли лития и натрия, такие как карбонат натрия и карбонат лития.
Альтернативно смесь двух или более солей может использоваться в растворителе вместо отдельной щелочной соли. Например, карбонат калия может объединяться с карбонатом натрия при отношении 1/10, 1/5, 3/10, 2/5, 1/1, 3/5, 7/10, 4/5, 9/10, 10/9, 5/4, 10/7, 5/3, 5/2, 5/1, 10/1 или при любом отношении в пределах между ними. Если используется смесь солей, предпочтительное отношение концентрации соли к полиамину берется по отношению к общей концентрации щелочной соли.
Одним из преимуществ растворителя на основе карбоната калия является то, что, поскольку сульфат и хлорид калия могут использоваться в качестве удобрения, будет проще использовать отработанный растворитель на основе карбоната калия. По этой причине этот растворитель является более стойким к утечкам SO2 и HCl из существующей системы десульфуризации топочного газа.
Множество циклических или линейных, первичных или вторичных полиаминов может использоваться в качестве одного из компонентов растворителя по настоящему изобретению. Полиамин может представлять собой пиперазиновое производное, такое как пиперазин, аминоэтилпиперазин и гидроксиэтилпиперазин. Другие примеры полиаминов, которые могут использоваться в настоящем изобретении, включают, но не ограничиваясь этим, этилендиамин, диметил этилендиамин, пиперазин, пиразолидин, имидазолидин, 2-(2-пирролидил)пирролидин, 2-(2-имидазолидил)имидазолидин, 3-(3-пирролидил)пиперидин, 2-(3-пирролидил)пиперазин, 3-(3-пиперидил)пиперидин, 3-(2-пиперазинил)пиперидин и 2-(2-пиперазинил)пиперазин.
Является предпочтительным, хотя и необязательным, чтобы амины по настоящему изобретению были не затрудненными стерически. Одним из преимуществ настоящего изобретения является потенциально высокая скорость взаимодействия CO2 с растворителем. Если одна или несколько функциональных аминных групп полиамина являются стерически затрудненными посредством групп заместителей, скорость взаимодействия и поглощения CO2 может значительно уменьшиться.
Смесь из двух или более полиаминов может использоваться в растворителе вместо одного полиаминового соединения. Например, пиперазин может объединяться с аминоэтилпиперазином или другим полиамином при отношении 1/20, 1/10, 1/5, 3/10, 2/5, 1/1, 3/5, 7/10, 4/5, 9/10, 10/9, 5/4, 10/7, 5/3, 5/2, 5/1, 10/1, 20/1 или при любом отношении в пределах между ними. Если используется смесь полиаминов, предпочтительное отношение концентраций соли и полиамина берется по отношению к общей концентрации аминовых групп.
Полиамины, описанные здесь, могут быть закуплены во множестве коммерческих источников, как известно в данной области, или синтезироваться посредством стандартных химических технологий, известных в данной области. Пиперазин может быть получен, например, посредством взаимодействия моноэтаноламина с аммонием или посредством взаимодействия этиленоксида и NH3, а затем циклизации побочного продукта этаноламина.
Варианты осуществления настоящего изобретения предусматривают использование, по меньшей мере, 3,0 эквивалентов/кг H2O для полиамина и, по меньшей мере, 0,5 эквивалента/кг H2O для щелочной соли. В предпочтительном варианте осуществления растворитель будет представлять собой либо смесь по существу равных количеств двух компонентов, либо смесь, имеющую отношение щелочной соли к полиамину до 2 к 1. В более предпочтительном варианте осуществления растворитель будет содержать смесь по существу равных количеств двух компонентов при концентрации, по меньшей мере, 3,0 эквивалентов/кг H2O. Это должно отличаться от систем, которые используют “промоторы”, которые представляют собой меньшие каталитические количества аминов, предназначенных для улучшения характеристик поглощения в концентрированном растворе, содержащем менее реакционноспособный амин или карбонат калия. Примеры технологии промоторов приводятся в патенте США  4336233, BASF, который предлагает 0,05-0,8 M водный раствор PZ, более предпочтительно 0,05-0,4 M PZ, в качестве промотора в растворителе, содержащем MDEA. 4336233, BASF, который предлагает 0,05-0,8 M водный раствор PZ, более предпочтительно 0,05-0,4 M PZ, в качестве промотора в растворителе, содержащем MDEA.
Количество щелочной соли и полиамина в растворе ограничивается растворимостью обоих компонентов. Как чистый карбонат калия, так и чистый пиперазин представляют собой твердые продукты, что приводит к возникновению пределов растворимости твердых продуктов в водных растворах. При 25°C растворимость калия в растворе, обогащенном CO2, составляет 3,6 м, а растворимость PZ в воде составляет приблизительно 2 м. При ограничении растворимости твердого продукта возникающие в результате более низкие концентрации могут приводить к низким скоростям реакции и низкой емкости раствора, делая растворитель непривлекательным. Посредством объединения PZ и карбоната калия в водном растворе растворимость твердого продукта увеличивается вплоть до 3,6МPZ, делая возможной более высокую общую концентрацию растворенного вещества и потенциально увеличивая скорость поглощения и емкость. При более высоких температурах растворимость увеличивается еще больше и делает возможным использование более концентрированных растворов. Предполагалось, что концентрации PZ, большие чем 1,3 м, не могут использоваться в окружающей среде, обогащенной CO2 (в отсутствие щелочной соли), из-за образования пиперазин карбамата, который выпадает из раствора в осадок (патент США  4336233). Однако более высокие концентрации щелочных солей и полиаминов являются возможными без осаждения твердых продуктов. Более высокие концентрации реагентов увеличивают емкость растворителя и уменьшают остающиеся требования к энергии, связанные со скрытой теплотой растворителя. Более высокая концентрация полиамина также повышает скорости поглощения CO2. 4336233). Однако более высокие концентрации щелочных солей и полиаминов являются возможными без осаждения твердых продуктов. Более высокие концентрации реагентов увеличивают емкость растворителя и уменьшают остающиеся требования к энергии, связанные со скрытой теплотой растворителя. Более высокая концентрация полиамина также повышает скорости поглощения CO2.
Концентрация K2CO3 в растворителе без PZ ограничивается осаждением KHCO3. Доступные данные говорят о том, что обогащенный раствор с парциальным давлением CO2 0,1 атм будет ограничен 30 мас.% K2CO3 при 40°C и 35 мас.% при 60°C (Bocard, J.P. and B.J. Mayland. “New Charts for Hot Carbonate Process”, Hydroc. Proc. & Pet. Ref, 41(4), 128, 1962; Tosh, J.S. et al. “Equilibrium Study of the system potassium carbonate, potassium bicarbonate, carbon dioxide, and water”, USBM RI 5484, 1959). Понятно, что работа вблизи предела растворимости может потребовать точного контроля процесса.
Ниже 40°C стабильный твердый продукт PZ представляет собой PZ·6H2O с растворимостью 1,8 M PZ при 25°C. Выше 40°C стабильная фаза представляет собой безводный PZ с растворимостью 7,4 M при 40°C. Возможно, что высокие концентрации соли, такой как K+CO3 –/HCO3 –/HCO3 –, будут понижать растворимость свободного PZ почти в 2 раза. Но менее чем 25% от общего количества PZ будет присутствовать в виде свободного PZ в обедненном растворителе. По этой причине, даже если осаждение PZ·6H2O ниже 40°C ограничивает композицию растворителя, могут использоваться концентрации до 3 M PZ. Водный раствор, который содержит только PZ, может использоваться в качестве поглощающего растворителя, однако он будет иметь ограниченную применимость, поскольку при концентрациях выше примерно 1,3 M, пиперазин осаждается в присутствии CO2, как карбамат. Растворимость пиперазина в воде при 20°C составляет только 1,5 M. Патент США –, будут понижать растворимость свободного PZ почти в 2 раза. Но менее чем 25% от общего количества PZ будет присутствовать в виде свободного PZ в обедненном растворителе. По этой причине, даже если осаждение PZ·6H2O ниже 40°C ограничивает композицию растворителя, могут использоваться концентрации до 3 M PZ. Водный раствор, который содержит только PZ, может использоваться в качестве поглощающего растворителя, однако он будет иметь ограниченную применимость, поскольку при концентрациях выше примерно 1,3 M, пиперазин осаждается в присутствии CO2, как карбамат. Растворимость пиперазина в воде при 20°C составляет только 1,5 M. Патент США  4336233. 4336233.
По этой причине является преимущественным объединение полиамина и щелочной соли при относительно высоких концентрациях. Полиамин будет иметь концентрацию, по меньшей мере, 1,5 м, или 3,0 эквивалента на кг воды, для диамина, м, или 1,0 эквивалента на кг воды, для двухвалентной соли. В предпочтительном варианте осуществления отношение полиамина к щелочи будет составлять приблизительно 1 к 1, например 3,6 эквивалента PZ/кг воды и 3,6 эквивалента калия/кг воды. Подобным же образом оба компонента могут иметь концентрацию 1,5 эквивалента/кг воды, или же оба компонента могут иметь концентрации 5,0 эквивалентов/кг воды. Это отношение, один к одному, щелочной соли к аминовому остатку обеспечивает эффект растворимости обоих компонентов и сольватацию CO2. Другие отношения 1:1 щелочной соли к аминовому остатку включают, но не ограничиваясь этим, 2:2, 2,5:2,5, 3:3, 3,5:3,5, 4:4, 4,5:4,5, 5,5:5,5, 6:6, 6,5:6,5, 7:7, 7,5:7,5, 8:8, 8,5:8,5, 9:9 эквивалентов/кг воды. Другие отношения концентраций могут также использоваться; например, может использоваться избыток соли для растворителя, имеющего 3,0 эквивалента/кг воды карбоната калия и 1,5 эквивалента/кг воды PZ. Отношения концентраций, предусматриваемые в настоящем изобретении, включают, но не ограничиваясь этим, отношения эквивалентов соль/амин, приблизительно равные 3:1, 2,9:1, 2,8:1, 2,7:1, 2,6:1, 2,5:1, 2,4:1, 2,3:1, 2,2:1, 2,1:1, 2:1, 1,9:1, 1,5:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1:1, 1:1,1, 1:1,2, 1:1,3, 1:1,4, 1:1,5, 1:1,6, 1:1,7, 1:1,5, 1:1,9, 1:2, 1:2,1, 1:2,2, 1:2,3, 1:2,4, 1:2,5, 1:2,6, 1:2,7, 1:2,8, 1:2,9 и 1:3. Другие рассматриваемые диапазоны включат 4:1, 3,9:1, 3,8:1, 3,7:1, 3,6:1, 3,5:1, 3,4:1, 3,3:1, 3,2:1, 3,1:1, 1:3,1, 1:3,2, 1:3,3; 1:3,4; 1:3,5; 1:3,6, 1:3,7, 1:3,8, 1:3,9 и 1:4.
В отсутствие полиамина CO2 взаимодействует с карбонатом с получением бикарбоната. Теплота этой реакции составляет примерно 5 ккал/гмоль:
CO2(г)+CO3 =+H2O =+H2O 2HCO3 2HCO3 – –
Посредством объединения полиамина, такого как пиперазин, и двуокиси углерода пиперазин подвергается равновесным реакциям, как показано в следующих уравнениях реакции.
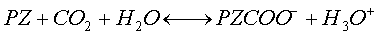

В этой реакции PZ (C4N2H10) взаимодействует с CO2 с получением PZ-карбамата (PZCOO–) и PZ-дикарбамата (PZ(COO–)2). В пределе реакции стехиометрия должна представлять собой:
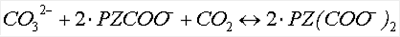
Свободный пиперазин не показан как присутствующий, внося вклад в летучесть при этой реакции. Однако свободный пиперазин будет присутствовать в растворе, но в меньших количествах, когда к раствору добавляется CO2 или CO3 2-. Добавление карбоната калия должно как добавлять CO3 2-. Добавление карбоната калия должно как добавлять CO3 2- к раствору, так и поставлять диссоциированный катион для объединения с анионными частицами пиперазина. 2- к раствору, так и поставлять диссоциированный катион для объединения с анионными частицами пиперазина.
Карбонат будет исполнять роль буфера, давая следующие общие реакции:
CO2(г)+CO3 2-+PZ 2-+PZ PZCOO–+HCO3 PZCOO–+HCO3 – –
CO2(г)++CO3 2-+PZ-COO– 2-+PZ-COO– PZ(COO–)2+HCO3 PZ(COO–)2+HCO3 – –
В растворах с большими концентрациями PZ, где эти реакции будут доминировать, теплота поглощения CO2 будет достигать 20 ккал/гмоль. По этой причине ожидаемая теплота поглощения в растворителях, содержащих как щелочную соль K2CO3, так и полиамин PZ, будет изменяться примерно от 10 до 20 ккал/гмоль в зависимости от концентрации PZ. Преимуществом системы растворителей, содержащей полиамин и щелочную соль, является возможность плавного изменения теплоты поглощения посредством изменения отношения соли/полиамина. Для сравнения, теплота поглощения CO2 в растворителях MEA составляет примерно 22 ккал/гмоль.
Хотя реакции, приведенные выше, являются специфическими для PZ, другие полиамины будут взаимодействовать подобным же образом, при этом каждая аминовая группа взаимодействует с CO2 с получением карбамата, дикарбамата, трикарбамата и т.п.
Воздействие нового растворителя на скорости поглощения CO2 при 60°C показаны на фиг.1. Растворители с отношениями K+/PZ от одного до двух дают скорости поглощения, которые являются в 1,5-5 раз более высокими, чем у других обычных растворителей (5,0 M MEA) и у других растворителей с меньшим количеством пиперазина в качестве промотора.
Хотя механизм реакции пиперазина является типичным для других аминов, присутствие карбоната калия в растворе значительно повышает скорости реакции, как показывают значения удельных констант скорости в таблице 1. Выражение скорости для вычислений в таблице 1 дается как:
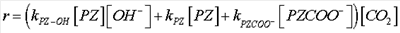
Также очевидным является поведение с увеличением скорости в присутствии основания, такого как гидроксид или карбонат. Обе характеристики являются преимуществами, поскольку более высокие скорости поглощения будут приводить к меньшему потреблению энергии, и/или капитальные вложения могут быть уменьшены. Скорость поглощения может увеличиваться в три раза по сравнению с другими аминовыми растворителями.
Таблица 1
Удельные константы скорости для реакции пиперазин-CO2 в присутствии калия и без него |
 |
kPZ-OH (м3/моль2·с) |
kPZ (м3/моль·с) |
kPZCOO–(м3/моль·с) |
| Без K+ |
0,0 |
54 |
47 |
| С K+ |
2,6 |
290 |
47 |
| *kMEA=м3/моль·с |
Благодаря увеличению скоростей поглощения в настоящем изобретении по сравнению со способами, известными в данной области, несколько возможностей оптимизации стоимости являются доступными для использования вместе с настоящим изобретением. Во-первых, более высокие скорости дают возможность для работы ближе к равновесию. Это дает потенциальную возможность для уменьшения потребления энергии в три раза. Во-вторых, высота башни может быть уменьшена с уменьшением количества насадки, необходимой в колонне. Это также уменьшает перепад давления в колонне и, как следствие, понижает затраты на энергию. Наконец, некоторое оптимальное сочетание предыдущих двух случаев может рассматриваться с целью уменьшения как капитальных вложений, так и стоимости работы.
Даже при образовании ионных частиц в растворителе по-прежнему будет оставаться некоторое количество свободного пиперазина. Летучесть будет доставлять проблемы, если не принять ее во внимание. Эта проблема может быть уменьшена или исключена посредством использования системы водной промывки. Большинство способов с участием аминов уже содержат тарелки для водной промывки, для сбора аминов из обработанного газа в абсорбере и десорбционной колонне.
Разрушение пиперазина в растворе, как предполагается, также является значительным. Ожидается, что полимеризация карбамата, один из механизмов для разрушения, будет осуществляться при более низких скоростях, чем в MEA и других аминовых растворителях. Потенциальная возможность окислительного разрушения также имеется, и она может быть или не быть более медленной, чем в MEA.
Современный способ для улавливания CO2 из топочного газа представляет собой поглощение/очистку с помощью 15-30 мас.% водного раствора MEA. От 90 до 99% CO2 удаляется в абсорбере с 40-60 футами насыпной насадки при атмосферном давлении. Перепад давления и капитальные затраты на абсорбер являются большими и могут быть значительно понижены посредством повышения скорости поглощения CO2. Температура для способа поглощения может находиться в пределах между 25°C и 120°C, более предпочтительно между 40°C и 80°C.
Способы поглощения/очистки, известные в данной области, такие как те, которые предусматриваются Exxon и UOP, предусматривают технологии с изотермическим поглощением/очисткой при 90-120°C. Десорбционная колонна, как правило, работает при давлении чуть выше атмосферного. Эти системы используют изотермическую регенерацию с изменением давления вместо изменения температуры, поскольку теплота десорбции CO2 (5 ккал/моль) является меньшей, чем теплота испарения воды (10 ккал/моль). Повышение температуры в разделителе не увеличит летучесть CO2 по сравнению с водой. Растворитель в этих системах регенерируется в разделителе с 40-60 футами насадки при давлении вблизи атмосферного при 110-130°C. Потребность в умеренном уровне тепла (пар 30-60 фунт/кв.дюйм) для приведения в действие ребойлера является большой, достигая 20-30% потребления тепла для энергетической установки.
Как правило, способ удаления CO2 состоит из колонны абсорбера, в которой газовый поток, обогащенный CO2, вступает в контакт с циркулирующим химическим растворителем в пределах приблизительно между 40 и 100°C. Растворитель после поглощения CO2 проходит в десорбционную колонну, где CO2 в растворе удаляется посредством нагрева приблизительно до 50-150°C, более предпочтительно в пределах между 60°C и 130°C, а наиболее предпочтительно между 100°C и 130°C. Затем растворитель возвращается в абсорбер как раствор, обедненный CO2.
Сочетание карбоната калия и пиперазина в качестве растворителя для этого способа дает гибкость и преимущества по сравнению с современными растворителями, используемыми в данной области. Смеси K+/PZ являются эффективными для получения хороших скоростей поглощения CO2; скорости могут быть в два-три раза выше, чем для 5,0 M MEA. Смесь также улучшает растворимость твердых продуктов обоих компонентов и может понизить летучесть пиперазина.
Могут использоваться различные способы очистки, включая очистку с рекомпрессией паров, очистку с помощью выходящего из турбины пара и многостадийную очистку. В одном из вариантов осуществления улавливание CO2 из топочного газа с использованием растворителя по настоящему изобретению использует изотермическую работу с помощью вакуумной десорбционной колонны. Низкое давление абсорбера (1 атм) не дает возможности для работы при температуре, большей чем 50 или 60°C, без необходимости в дополнительном тепле для испарения больших количеств воды. Растворитель будет эффективно катализировать поглощение и десорбцию CO2 при этой более низкой температуре.
Поглощение и очистка могут осуществляться при атмосферном давлении или при давлениях выше атмосферного. Давление десорбционной колонны может устанавливаться с целью сведения к минимуму потребления энергии системы и может определяться посредством моделирования. Это моделирование будет также оптимизировать количество насадки в абсорбере и десорбционной колонне. Поскольку температура и давление десорбционной колонны понижаются, скорость реакции с получением CO2 будет также понижаться и способность десорбционной колонны к массопереносу будет понижаться.
Способ также может включать одностадийную или двухстадийную стадию промывки для сбора полиамина. Промывка может представлять собой водную промывку и может осуществляться в колонне абсорбера или в десорбционной колонне.
Поглощение и десорбция CO2 в растворителях со щелочными солями и полиаминами определяется, прежде всего, диффузией CO2 в пленке жидкости с быстрой реакцией вблизи границы раздела газа и жидкости. Скорость является в основном независимой от коэффициентов массопереноса газа и жидкой пленки и зависит от площади контакта газа и жидкости. Поток зависит от квадратного корня кинетики реакции в этом случае для частиц PZ и PZCOO–.
Постоянные скорости kPZ и kPZCOO определяются по измерениям в воде и в 50% MDEA. Эти значения превышают в 5-10 раз сравнимую константу скорости для MEA. Удвоение концентраций частиц PZ увеличивает скорости поглощения CO2 приблизительно на 40%. Эффективный коэффициент массопереноса газовой пленки сильно зависит от нагрузки и уменьшается в 4 раза от условий обеднения (0,003 атм) до обогащения (0,06 атм). определяются по измерениям в воде и в 50% MDEA. Эти значения превышают в 5-10 раз сравнимую константу скорости для MEA. Удвоение концентраций частиц PZ увеличивает скорости поглощения CO2 приблизительно на 40%. Эффективный коэффициент массопереноса газовой пленки сильно зависит от нагрузки и уменьшается в 4 раза от условий обеднения (0,003 атм) до обогащения (0,06 атм).
При низкой концентрации CO2 и высокой концентрации свободного амина скорость поглощения CO2 будет контролироваться только площадью контакта газ/жидкость. При более высокой концентрации CO2 и пониженной концентрации свободного амина поглощение CO2 будет в большей степени регулироваться диффузией полиамина в жидкой пленке.
Дополнительные измерения поглощения/десорбции CO2 могут осуществляться в колонне со смачиваемыми стенками с растворителями, содержащими щелочные соли и полиамины, в широком диапазоне условий. Устройство описывается Mshewa M.M. “CO2 Desorption/Absorbtion with Aqueous Mixtures of MDEA and DEA at 40 to 120°C”, Ph.D. Dissertation, 1995; Pacheco M. and G.T. Rochelle. “Rate-based Modeling of Reactive Absorbtion of CO2 and H2S into Aqueous Methyldiethanolamine”, Ind. Eng. Chem. Res., 37(10), 4107-4117, 1998; Pacheco M. “Mass Transfer, Kinetics and Rate-based Modeling of Reactive Absorbtion”, Ph.D. Dissertation, May 1998; Pacheco M., S. Kaganoi and G.T. Rochelle. “CO2 Absorbtion into Aqueous Mixtures of Diglycolamine and Methyldiethanolamine”, Submitted to Chem. Eng. Sci., July 5, 1999; Bishnoi S. and G.T. Rochelle. “Absorbtion of Carbon Dioxide into Aqueous Piperazine: Reaction Kinetics, Mass Transfer and Solubility”, presented at 49th Annual CSChE Conference, Saskatoon, Saskatchewan, October 3-6, 1999; и Bishnoi Sanjay. “Carbon Dioxide Absorbtion and Solution Equilibrium in Piperazine Activated Methyldiethanolamine”. Doctor of Philosophy Dissertation, The University of Texas at Austin, 2000. Эта система используется для измерения PZ/MDEA (Bishnoi Sanjay. “Carbon Dioxide Absorbtion and Solution Equilibrium in Piperazine Activated Methyldiethanolamine”. Doctor of Philosophy Dissertation, The University of Texas at Austin, 2000) и PZ/MEA (Dang Hongyi. “CO2 Absorbtion Rate and Solubility in Monoethanolamine/Piperazine/Water”. Master of Science Thesis, The University of Texas at Austin, 2001). Колонна со смоченной стенкой конструируется из трубы из нержавеющей стали с хорошо определенной площадью поверхности (38,5 см2) и с характерным коэффициентом массопереноса жидкой пленки, сходным с башней с насадкой. Скорость поглощения определяется из материального баланса газовой фазы с использованием измеренной концентрации газа на входе и на выходе. Растворимость измеряют посредством приближения к равновесию с помощью измерений как поглощения, так и десорбции. Рабочие условия могут изменяться от 25 до 120°C, общего давления от 1 до 7 атм и молярной доли CO2 от 0,001 до 1.
Полиамин в растворителе будет подвергаться некоторой степени окислительного разрушения. Для PZ этот способ вызывает образование этилендиамина, формиата, гликолята и других фрагментов аминов и органических кислот. Для уменьшения величины окислительного разрушения растворителя в систему растворителей могут добавляться антиоксиданты, или может использоваться вакуумная десорбционная колонна. Любой антиоксидант, известный в данной области, может использоваться в настоящем изобретении. Обычные концентрации антиоксидантов находятся в пределах примерно от 0,01 до 5 мас.%.
Другие дополнительные агенты также могут добавляться к растворителю по настоящему изобретению. Эти агенты могут действовать, например, как противовспенивающий агент, флоккулирующая добавка или ингибитор коррозии. Типичные концентрации для этих добавок находятся в пределах примерно от 0,01 до 5 мас.%. Эти агенты хорошо известны в данной области и могут включать, например, оксиды ванадия (например, V2O3), хроматы (например, K2Cr2O7), ангидриды мышьяка, селенистая кислота, теллуристая кислота, протиды и аминокислоты.
Летучесть полиамина PZ в растворителе по настоящему изобретению является низкой, поскольку она составляет менее чем 20% от той, которую будет иметь свободный PZ в обедненном растворе. Это увеличивает безопасность растворителя. Любое воздействие на окружающую среду может быть сведено к минимуму посредством использования водной промывки в верхней части абсорбера.
Здесь используются различные способы для описания концентраций растворов, включая молярность (моли растворенного вещества/литр раствора, M), моляльность (моли растворенного вещества/кг растворителя, м), процент массовый и эквиваленты/кг H2O. При низких концентрациях в растворе молярность и моляльность будут по существу такими же, как и эквиваленты/кг H2O, когда компонент имеет один эквивалент реакционноспособного компонента (например, моноамина). 1,5 м K2CO3 составляет приблизительно 20 мас.% K2CO3. Например, 1,8 м K2CO3 имеет 3,6 эквивалента K+/кг H2O и 1,8 м трехфункционального амина, диэтилентриамин имеет 5,4 эквивалентов амина/кг H2O.
ПРИМЕРЫ
Следующие далее примеры включаются для демонстрации предпочтительных вариантов осуществления изобретения. Специалисты в данной области заметят, что технологии, описанные в примерах, которые следуют репрезентативным технологиям, обнаруженным авторами, хорошо функционируя при осуществлении настоящего изобретения, могут, таким образом, рассматриваться как составляющие предпочтительные способы для его осуществления. Однако специалисты в данной области в свете настоящего описания должны заметить, что множество изменений может быть сделано в конкретных вариантах осуществления, которые описаны, при этом по-прежнему получая подобный или сходный результат без отклонения от духа и рамок настоящего изобретения.
Пример 1 – Смеси растворителей
Существуют, по меньшей мере, три характеристики, которые определяют полезность и эффективность смеси растворителей: скорость поглощения CO2, теплота поглощения CO2 и емкость. Таблица 2 приводит сводку этих характеристик для нескольких систем по сравнению со стандартной технологией 7 м MEA и освещает преимущества настоящего изобретения. Приводимые значения исходят из экспериментальных данных и модельных представлений из Bishnoi Sanjay. “Carbon Dioxide Absorbtion and Solution Equilibrium in Piperazine Activated Methyldiethanolamine”. Doctor of Philosophy Dissertation, The University of Texas at Austin, 2000 и J.T. Cullinane. “Carbon Dioxide Absorbtion in Aqueous Mixtures of Potassium Carbonate and Piperazin”. M.S. Thesis, The University of Texas at Austin, May 2002.
| Таблица 2 |
| Растворитель |
Скоростьa×1010
(моль/Па·см2·с) |
– Habs Habs b b
(ккал/моль CO2) |
 Нагрузкас Нагрузкас
(моль CO2/кг H2O) |
Летучестьd
(Па) |
| 7 м MEA |
0,46 |
21,9 |
0,79 |
14,8 |
| 1,8 м PZ |
0,87 |
19,1 |
0,40 |
6,1 |
3,6 м
K+/0,6 м PZ |
0,38 |
9,5 |
0,48 |
0,4 |
5,0 м
K+/2,5 м PZ |
0,69 |
15,0 |
0,65 |
1,4 |
a. Скорость при PCO2*=3000 Па и 40°C
b. Теплота поглощения CO2 при 80°C
c. Изменения нагрузки при 40°C в пределах PCO2* между 300 и 3000 Па
d. Давление паров жидкого амина при 40°C, PCO2*=300 Па и коэффициенте активности 1 |
Пример 2 – Преимущества в скорости поглощения
Важность высокой скорости поглощения не может быть недооценена, поскольку она ответственна за определение скоростей растворителя и высоты колонны. Увеличение скорости поглощения CO2 дает возможность для понижения скорости потока жидкости, которая уменьшает энергию, необходимую для работы способа. Альтернативно может быть уменьшена высота колонны с уменьшением перепада давления на колонне и связанного с ним потребления энергии.
Фиг.1 показывает заметное отличие между растворами, использующими каталитические количества пиперазина, и растворами, использующими большие количества его, при 60°C. Обобщая воздействия композиции растворителя на скорость, трех-шестикратное увеличение концентрации пиперазина приводит к увеличению скорости поглощения в два-три раза. Также растворители с отношениями K+/PZ от одного до двух дают скорости, существенно улучшенные по сравнению с растворителями с отношениями от трех до шести. При конкретной демонстрации этих эффектов раствор 5,0 м K+/2,5 м PZ поглощает CO2 в 2,5 раза быстрее, чем раствор 3,6 м K+/0,6 м PZ, при 4000 Па. Наиболее эффективные растворители содержат >1,5 м PZ и имеют отношение щелочная соль/полиамин от 2 до 1.
Сравнение скорости поглощения по настоящему изобретению и других растворителей, известных специалистам в данной области, представлено на фиг.2 и фиг.3. При 60°C концентрированные растворители с отношением K+/PZ от одного до двух дают скорости поглощения, которые являются в 1,2-5 раз большими, чем у 5,0 М MEA. Опять же, сравнивая предпочтительную композицию по настоящему изобретению с другими растворителями, скорость поглощения в 5,0 м K+/2,5 м PZ в 1,4 раза больше, чем поглощение в 5,0 M MEA, при 4000 Па. Другие отношения концентраций дают растворитель со скоростями, сравнимыми с 5,0 M MEA. Подобным же образом настоящее изобретение превосходит по своим характеристикам (по отношению к скорости) MDEA с PZ в качестве промотора при 40°C. Растворители, содержащие K+и DEA или затрудненные амины, как показано, являются даже менее эффективными, чем каталитические количества пиперазина в карбонате калия.
Пример 3 – Гибкость теплоты поглощения
Дополнительное преимущество настоящего изобретения демонстрируется на фиг.4. Теплота поглощения, подобно скорости поглощения, зависит от концентрации пиперазина. Более высокая теплота поглощения указывает на большее потребление энергии, необходимое для регенерации растворителя. Низкая теплота поглощения является более благоприятной при обычных рабочих условиях.
На фиг.4 можно увидеть множество композиций растворителей каждый с различными характеристиками. Для одного экстремума растворитель может содержать большие концентрации PZ и иметь большие скорости и высокую теплоту поглощения (~20 ккал/моль CO2). Работа в этом режиме приводила бы к скорости поглощения, в 1,5-5 раз большей, чем для 5,0 M MEA, и к сравнимой теплоте поглощения. Для другого экстремума растворитель может содержать меньше PZ и иметь скорости, сравнимые с 5,0 M MEA, но теплоту поглощения, меньшую в два раза. Эта гибкость рабочих характеристик приводит к получению растворителя, который может быть “настроен” на конкретные операции и рабочие условия.
Пример 4 – Сравнение емкости
Емкость представляет собой третью важную характеристику, которая определяет рабочие параметры растворителя. Определяемая как изменение нагрузки при данном изменении парциального давления, емкость устанавливает способность растворителя к поглощению CO2 в данном рабочем диапазоне.
Фиг.5 показывает, что емкость растворителей K+/PZ в рабочем диапазоне, представляющем интерес, от ~300 до 8000 Па сравнима с 5,0 M MEA. Модельные предсказания, показанные линиями на фиг.5, показывают, что увеличение концентраций калия будет приводить к улучшению емкости. Конкретно, емкость 5,0 м K+/2,5 м PZ является на 50% лучшей, чем 3,6 м K+/0,6 м PZ, и приближается к емкости 7,0 м MEA. Это демонстрирует преимущества растворителя предпочтительной композиции, содержащей >3,6 м K+.
Пример 5 – Применения способа
Применение моноэтаноламина (MEA) вычисляется Freguia (MS thesis, 2002). Обрабатывают топочный газ из угольной тепловой энергетической установки. Абсорбер имеет 7 м в диаметре и использует 15 м насадки Cascade Mini Ring #2 (CMR#2). Перепад давления в абсорбере составляет 10 кПа. Простая десорбционная колонна с ребойлером имеет 4,5 м в диаметре с 10 м насадки CMR#2 и работает при 1,6 атм. Топочный газ, содержащий 12,6% CO2 и 7,8% H2O, вводится в абсорбер при 55°C со скоростью 11000 кмоль/ч. Растворитель представляет собой 30 мас.% MEA (7 гмоль/кг H2O) и вводится в абсорбер при 40°C со скоростью 193 кг H2O/с при нагрузке CO2 0,21 моль/моль MEA. Обогащенная нагрузка представляет собой 0,46 гмоль CO2/гмоль MEA при давлении паров CO2 2,5 кПа. Перед введением в десорбционную колонну растворитель предварительно нагревают посредством поперечного обмена до 109°C. 90% CO2 удаляют (0,34 кмоль/с) в абсорбере при мощности ребойлера 70000 кВт.
Растворитель MEA заменяют в той же системе растворителем, содержащим 5 гмоль K+/кг H2O и 2,5 гмоль пиперазина/кг H2O. Поскольку CO2 взаимодействует с растворителем быстрее, обогащенная нагрузка представляет собой 2 гмоль CO2/гмоль пиперазина при давлении паров CO2 8 кПа. 90% CO2 удаляется в абсорбере, и потребление ребойлера уменьшается до 60000 кВт. Обедненная нагрузка для абсорбера представляет собой 1,3 гмоль CO2/гмоль пиперазина.
Для растворителя, содержащего 5 гмоль K+и 2,5 гмоль пиперазина на кг H2O, высота насадки в абсорбере уменьшается до 5 м. Перепад давления в абсорбере уменьшается до 3,3 кПа. Поскольку пиперазиновый растворитель поглощает CO2 в 3 раза быстрее, чем MEA, 90% удаление CO2 достигается при тепловом потреблении ребойлера 70000 кВт. Обедненная нагрузка представляет собой 1,3 гмоль CO2/гмоль пиперазина. Обогащенная нагрузка представляет собой 1,85 гмоль CO2/гмоль пиперазина для давления паров CO2 2,5 кПа.
Все способы, описанные и заявляемые здесь, могут быть проделаны и осуществлены без излишних экспериментов в свете настоящего описания. Хотя композиции и способы по настоящему изобретению описываются с точки зрения предпочтительных вариантов осуществления, специалистам в данной области будет понятно, что изменения могут применяться к способам и на стадиях или на последовательности стадий способа, описанного здесь, без отклонения от концепции, духа и рамок настоящего изобретения. Более конкретно, будет понятно, что определенные агенты, которые являются родственными как химически, так и физиологически, могут заменить агенты, описанные здесь, в то время как должны быть достигнуты такие же или сходные результаты. Все такие сходные замены и модификации, очевидные специалистам в данной области, как предполагается, находятся в пределах духа, рамок и концепции настоящего изобретения, как определяется прилагаемой формулой изобретения.
Формула изобретения
1. Композиция, предназначенная для удаления CO2 из газового потока, содержащая:
пиперазиновое производное, имеющее концентрацию, по меньшей мере, 3,0 эквивалента/кг воды,
калиевую соль, имеющую концентрацию, по меньшей мере, 1,0 эквивалента/кг воды, и воду,
в которой отношение эквивалентов щелочной соли к эквивалентам пиперазинового производного составляет 0,3-3,0 и которая не содержит одноатомного или многоатомного спирта.
2. Композиция по п.1, в которой пиперазиновое производное представляет собой пиперазин.
3. Композиция по п.1, в которой соль калия представляет собой карбонат калия, бикарбонат калия, бисульфид калия или гидроксид калия.
4. Композиция по п.1, в которой отношение эквивалентов щелочной соли к эквивалентам пиперазинового производного составляет 0,5-2,0.
5. Композиция по п.1, в которой концентрация пиперазинового производного составляет, по меньшей мере, 5,1 эквивалента/кг H2O, a концентрация щелочной соли равна приблизительно 5,1 эквивалента/кг H2O.
6. Композиция по п.1, дополнительно содержащая противовспенивающий агент, антиоксидант, ингибитор коррозии, флоккулирующую добавку или их смесь.
7. Способ удаления CO2 из газового потока, включающий: взаимодействие газового потока с раствором, который получают путем объединения, по меньшей мере:
пиперазинового производного, имеющего концентрацию амина 3,0-10,0 эквивалентов/кг воды,
щелочной соли, имеющей концентрацию 3,0-10,0 эквивалентов/кг воды, и воды;
где указанный раствор не содержит одноатомного спирта;
в котором концентрация пиперазинового производного и концентрация щелочной соли являются приблизительно равными;
при этом указанное взаимодействие приводит к удалению CO2 из газового потока; и регенерацию раствора.
8. Способ по п.7, в котором пиперазиновое производное представляет собой пиперазин, аминоэтилпиперазин, гидроксиэтилпиперазин, 2-(3-пирролидил)пиперазин, 3-(3-пиперидил)пиперидин, 3-(2-пиперазинил)пиперидин, 3-(3-пирролидил)пиперидин или 2-(2-пиперазинил)пиперазин.
9. Способ по п.7, в котором щелочная соль представляет собой карбонат калия, карбонат натрия, карбонат лития, бикарбонатную соль, бисульфидную соль или гидроксидную соль.
10. Способ по п.7, в котором газовый поток взаимодействует с раствором при температуре приблизительно 25-120°С.
11. Способ по п.7, в котором константа скорости реакции СО2 с пиперазиновым производным (KPz) составляет, по меньшей мере, 25 м3/моль-с при 25°С.
12. Способ по п.7, в котором раствор дополнительно содержит добавку.
13. Способ по п.7, в котором скорость осуществляемого посредством растворителя удаления CO2 из газового потока превышает, по меньшей мере, в 1,5 раза скорость удаления CO2 в способе, использующем водный раствор 5,0 М моноэтаноламина.
РИСУНКИ
|
|