|
|
(21), (22) Заявка: 2008140394/15, 14.10.2008
(24) Дата начала отсчета срока действия патента:
14.10.2008
(46) Опубликовано: 10.01.2010
(56) Список документов, цитированных в отчете о
поиске:
Адрес для переписки:
107078, Москва, Красноворотский пр-д, 3, стр.1, к.18, ООО Патентно-правовая фирма “Искона-II”, Е.А.Гавриловой
|
(72) Автор(ы):
Алеева Гузэль Нуровна (RU),
Веретенникова Вера Константиновна (RU),
Бердникова Александра Васильевна (RU),
Селянская Лариса Николаевна (RU),
Трифонова Елена Анатольевна (RU)
(73) Патентообладатель(и):
Закрытое акционерное общество “Макиз-Фарма” (RU)
|
(54) ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ, ОБЛАДАЮЩАЯ АНТИДЕПРЕССАНТНЫМ ДЕЙСТВИЕМ
(57) Реферат:
Изобретение относится к медицине, а именно к фармацевтической промышленности, и касается композиции, обладающей антидепрессантным действием, содержащим лекарственное вещество на основе Азафена. Композиция содержит следующие компоненты, мг/табл.:
| Азафен |
155,4-158,7 |
| Метоцель |
80,0-100,0 |
| Целлюлоза микрокристаллическая |
98,7-102,0 |
| Аэросил |
3,7-14,8 |
| Коллидон 25 |
3,7-11,1 |
| Тальк |
5,55-11,1 |
| Магния стеарат |
1,85-3,7 |
Изобретение обеспечивает получение фармацевтической композиции, обладающей пролонгированным высвобождением активного фармацевтического ингредиента, что позволяет стабилизировать концентрацию препарата в организме человека в течение суток и за счет этого уменьшить кратность приема препарата в течение суток для достижения необходимого терапевтического эффекта. 1 з.п. ф-лы., 2 табл., 1 ил.
Изобретение относится к медицине и фармацевтической промышленности и касается композиции, обладающей антидепрессантным действием, в частности к композициям, содержащим лекарственное вещество на основе Азафена
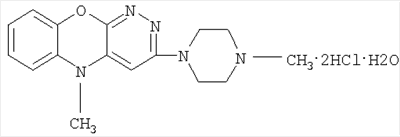
2-(4-метил-1-пиперазинил)-10-метил-3,4-диазафеноксазина дигидрохлорида.
Азафен относится к антидепрессантам трициклического строения, оказывает стимулирующее влияние на адренергические и, преимущественно, блокирующий эффект на серотонинергические системы. Не обладает холинолитической активностью, не оказывает кардиотоксического действия. В клинике психотропное действие азафена определяет сочетание тимоаналептических, активирующих и транквилизирующих свойств. Азафен показан при неглубоких и среднего уровня депрессивных состояниях различного генеза [Машковский М.Д. Лекарственные средства. 4.1, т.1, М.: Медицина, 1987, с.97-98].
В первую очередь азафен воздействует на аффективные расстройства, ослабляет депрессию и связанные с ней психические, вегетативные и соматические нарушения [Вертоградова О.П., Крыжановская В.В. Вопросы клиники и современной терапии психических заболеваний. М., 1971, с.451-454; Невзорова Т.А. Новые лекарственные препараты. Экспресс информация  1, 1974, с.37-3 8]. 1, 1974, с.37-3 8].
К числу ценных свойств азафена относится его способность нормализовать сон. Причем в отличие от препаратов с выраженным седативным действием, азафен не вызывает последующей сонливости.
Азафен хорошо всасывается при введении внутрь крысам-самцам, максимальные концентрации определяются через 30 мин – 1 ч; при внутривенном введении – через 5 мин; препарат обнаруживается в количестве в печени и почках, в меньшем – в сердце и мозге. В промежутки времени (15, 60, 120 мин) концентрация препарата в органах постепенно снижается. [Синюхин В.Н. Всасывание и распределение по органам нового антидепрессанта азафена. Фармакология и токсикология, 1973, т.36,  4, с.409-411]. 4, с.409-411].
Наиболее близкой известной фармацевтической композицией к предложенной является фармацевтическая композиция на основе азафена для лечения депрессивных расстройств легкой и средней степени тяжести, имеющая следующий состав, г/ табл.:
| Азафен |
0,0250 |
| Сахар |
0,0400 |
| Крахмал картофельный |
0,0340 |
| Кальция стеарат |
0,0010 |
Масса таблетки 0,100 г. (Справочник ВИДАЛЬ, «Лекарственные препараты в России»).
Описанная фармацевтическая композиция не обладает пролонгированным действием, для достижения максимального терапевтического эффекта требуется достаточно длительное время и многократный прием препарата, что увеличивает риск пропуска дозы.
Продление времени высвобождения активного компонента, обеспечиваемое предложенным составом, позволяет стабилизировать концентрацию препарата в организме человека в течение суток (предупреждает чрезмерное падение концентрации в конце интервала дозирования и резкий рост после приема последующих доз препарата). Это позволяет уменьшить кратность приема препарата в течение суток для достижения необходимого терапевтического эффекта.
Целью изобретения является получение улучшенной фармацевтической композиции, обладающей антидепрессантным действием, а также имеющей пролонгированный срок действия.
Указанная цель достигается тем, что фармацевтическая композиция, обладающая антидепрессантным действием, содержит лекарственное вещество «Азафен», Метоцель К4М, целлюлозу микрокристаллическую, коллидон 25, аэросил, магния стеарат и тальк при следующем содержании компонентов (в расчете на таблетку):
| Таблица 1 |
Наименование
компонентов |
Количество |
Функциональное
назначение |
| мг |
% |
Азафен (пипофезин),
в пересчете на 100% |
155,4-158,7
150 |
42,0-42,89 |
Активный
фармацевтический |
| Метацель К4М |
80,0-100,0 |
21,60-27,00 |
Связующее (для
создания матрицы высвобождения) |
| Премиум ЕР |
 |
 |
Целлюлоза
микрокристаллическая |
98,7-102,0 |
27,00-27,57 |
Разбавитель |
| Аэросил А-200 |
3,7-14,8 |
1,00-4,00 |
Скользящее |
| Коллидон 25 |
3,7-11,1 |
1,00-3,00 |
Связующее |
| Тальк |
5,55-11,1 |
1,00-3,00 |
Скользящее |
| Магния стеарат |
1,85-3,70 |
0,50-1,00 |
Смазывающее |
| ИТОГО |
370,00 |
100,00 |
 |
В качестве действующего активного компонента композиция содержит Азафен (Azaphenum), имеющий химическое название 2-(4-метил-1-пиперазинил)-10-метил-3,4-диазафеноксазин (в виде дигидрохлорида).
В качестве вещества для создания матрицы, т.е. вещества, регулирующего высвобождение, используют Метацель К4М Премиум ЕР (гидроксипропилметилцеллюлоза К4М).
В качестве скользящих веществ используют тальк и аэросил, суммарное содержание их 2-3%.
В качестве смазывающих используют магния стеарат или кальция стеарат или их смесь в суммарном содержании до 1%.
Предпочтительно используют магния стеарат в количестве 0,5-1,0%, тальк и аэросил в суммарном количестве 3,0%.
Аэросил (коллоидный оксид кремния) является компонентом, улучшающим распределение компонентов в массе технологической смеси.
Микрокристаллическая целлюлоза (КМЦ) представляет собой многоцелевой компонент, обеспечивающий необходимые прочностные характеристики готовой лекарственной формы и корректирующий модифицированное высвобождение.
В заявленной композиции содержание вспомогательных веществ подобрано таким образом, чтобы добиться постепенного высвобождения активного вещества, что и обуславливает его пролонгированное действие.
Технический результат изобретения заключается в получении отечественной лекарственной формы лекарственного средства с модифицированным высвобождением с использованием метацеля К4М Премиум ЕР, который позволяет легкорастворимому азафену равномерно распределиться в полимерном носителе и обеспечивать пролонгированное высвобождение активного фармацевтического ингредиента, а также упрощенной технологии производства ГЛС за счет оптимизации состава и последовательности проводимых операций и технологических параметров и прочностных характеристик.
Заявленную фармацевтическую композицию получают следующим способом.
Все сырье, используемое в технологическом процессе, просеивают через металлическое сито с размером отверстий 1 мм. Просеянные и взвешенные компоненты смешивают и увлажняют 3%-ным раствором коллидона 25.
Грануляцию и сушку ведут в псевдоожиженном слое до остаточной влажности 1-2%.
Сухой гранулят просеивают через металлическое сито с размером отверстий сетки 1 мм.
Опудривают гранулят в V-образном смесителе. Перемешивают в течение 3-5 минут со скоростью вращения 14 об/мин.
Готовую массу таблетируют на таблетпрессе. Форма таблеток – двояковыпуклая, радиус кривизны 1,25.
Следующие примеры описывают экспериментальные способы и процедуры приготовления и применения фармацевтических композиций изобретения.
Пример 1.
Берут следующие ингредиенты, г:
| Азафен |
155,40 |
| Метацель К4М |
80,00 |
| Целлюлоза микрокристаллическая РН 102 |
119,80 |
| Аэросил А-200 |
3,70 |
| Коллидон 25 |
3,70 |
| Тальк |
5,55 |
| Магния стеарат |
1,85 |
| ИТОГО |
370,00 |
Просеивают взвешенные исходные компоненты через металлическое сито с размером отверстий 1 мм.
В емкость с отвешенным коллидоном 25 добавляют воду очищенную, тщательно перемешивают до смачивания порошка и добавляют воду очищенную с температурой 50-60°C до необходимого количества. Перемешивают до получения прозрачного раствора.
Раствор фильтруют через капроновое сито  73. 73.
Смешивают в течение 2-х минут азафен и аэросил и просеивают через сито с размером отверстий 1 мм.
Загружают в установку псевдоожиженного слоя в следующей последовательности: микрокристаллическую целлюлозу, смесь азафена с аэросилом, метацель К4М и перемешивают в течение 4-5 минут до температуры в слое 40-42°C. Включают насос и гранулируют смесь 3% раствором коллидона 25.
Режим грануляции:
Количество приточного воздуха 900-1100 м3/ч,
Температура приточного воздуха 60-75°C,
Спрей 0,5 бар
Микроклимат 0,3 бара,
Скорость работы насоса 0,2-0,25 л/мин,
Температура в слое 26-28°C,
Частота встряхивания фильтров 1,0 с
Диаметр отверстия сопла форсунки 1,2 мм.
Полученный гранулят подсушивают до остаточной влажности 1,5-2,5%.
Сухой гранулят просеивают через металлическое сито с размером отверстий сетки 1 мм.
Опудривают полученный гранулят в смесителе V-образного типа.
Готовую массу таблетируют на прессе до твердости 16-24 единиц силы Кобба с окончательным весом 3,0 г/таблетку. Форма таблеток – двояковыпуклая с радиусом кривизны 1,25.
Полученные таблетки имеют следующий состав:
| Азафен |
155,4 мг (42%) |
| Метацель К4М Премиум ЕР |
80,0 мг (21,6%) |
| Целлюлоза микрокристаллическая |
119,8 мг (32,4%) |
| Аэросил А-200 |
3,7 мг (1,0%) |
| Коллидон 25 |
3,7 мг (1,0%) |
| Тальк |
5,55 мг (1,5%) |
| Магния стеарат |
1,85 мг (0,5%) |
| Итого |
370,0 мг (100,0%) |
Пример 2.
Таблетки получают аналогично примеру 1, но ингредиенты берут в следующих количествах:
| Азафен |
158,70 г |
| Метацель К4М Премиум ЕР |
100,00 г |
| Целлюлоза микрокристаллическая РН 102 |
85,40 г |
| Аэросил А-200 |
7,40 г |
| Коллидон 25 |
11,10 г |
| Тальк |
3,70 г |
| Магния стеарат |
3,70 г |
| ИТОГО |
370,00 |
Полученные таблетки имеют следующий состав:
| Азафен (пипофезин) |
158,7 мг (42,89%) |
| Метацель К4М Премиум ЕР |
100,0 мг (27,03%) |
| Целлюлоза микрокристаллическая |
85,4 мг (23,08%) |
| Аэросил А-200 |
7,4 мг (2,0%) |
| Коллидон 25 |
11,1 мг (3,0%) |
| Тальк |
3,7 мг (1,0%) |
| Магния стеарат |
3,7 мг (1,0%) |
| Итого |
370,0 мг (100,0%) |
Пример 3.
Таблетки получают, как описано в примере 2, но ингредиенты берут в следующих количествах:
| Азафен |
158,00 г |
| Метацель К4М Премиум ЕР |
90,70 г |
| Целлюлоза микрокристаллическая РН 102 |
99,40 г |
| Аэросил А-200 |
5,50 г |
| Коллидон 25 |
5,60 г |
| Тальк |
7,10 г |
| Магния стеарат |
3,70 г |
| ИТОГО |
370,00 |
Получают таблетки следующего состава:
| Азафен (пипофезин) |
158,0 мг (42,70%) |
| МетацельК4М Премиум ЕР |
90,7 мг (24,52%) |
| Целлюлоза микрокристаллическая |
99,4 мг (26,86%) |
| Аэросил А-200 |
5,5 мг (1,49%) |
| Коллидон 25 |
5,6 мг (1,51%) |
| Тальк |
7,1 мг (1,92%) |
| Магния стеарат |
3,7 мг (1,0%) |
| Итого |
370,0 мг (100,0%) |
Оценку сравнительной биологической доступности таблеток АЗАФЕНА пролонгированного и АЗАФЕНА проводили на кроликах.
На первом этапе решалась задача разработки простого, надежного метода количественного определения азафена в сыворотке крови с применением обращеннофазной высокоэффективной жидкостной хроматографии (ВЭЖХ).
Способ введения и дозы.
Сравниваемые препараты давали однократно в дозе 54,5 мг/кг, внутрижелудочно.
Испытания препаратов осуществляли по открытой, рандомизированной и перекрестной схемам. Каждый кролик попеременно получал тестируемый препарат (одну таблетку 150 мг) и препарат сравнения (6 таблеток по 25 мг) однократно. Интервал времени между приемом препаратов 10 дней.
Отбор проб. Пробы крови в объеме 1,5 мл отбирали из ушной вены кроликов в полипропиленовые пробирки до применения препарата (нулевая проба) и спустя 0,5, 1, 2, 3, 4, 6, 8 (24) часов после приема азафена (азафена пролонгированного). После центрифугирования при 14 тыс. об/мин отбирали 0,5 мл сыворотки, замораживали и хранили до анализа при температуре – 20°C.
Метод количественного анализа. Для определения неизмененного азафена использовали метод высокоэффективной жидкостной хроматографии. Хроматографическая система «GILSON». Колонка Phenomenex (LUNA)C18, 5 мкм (150×4,6 мм). Элюент 30% ацетонитрила/70% раствор фосфорной кислоты (pH 2,5), доведенный триэтиламином до pH 7. Скорость потока элюента – 1 мл/мин. Объем вводимой пробы (инжектор Rheodyne, петля) 50 мкл. Флуоресцентный детектор при длине волны возбуждения 350 нм, испускания 470 нм. Время выхода азафена из хроматографической колонки – 6 мин.
Методика извлечения препарата. К 100 мкл сыворотки добавляли 200 мкл метанола (для разрушения комплекса препарата с белками) и интенсивно перемешивали в течение 1 мин. После центрифугирования в течение 10 мин (при 11,5 тыс. об/мин) 50 мкл органического раствора вносили в хроматографическую колонку. Предел обнаружения 1 нг/100 мкл сыворотки.
Концентрацию препарата в сыворотке рассчитывали с помощью абсолютной калибровки с использованием хроматографической интегрирующей системы МультиХром. Калибровка линейна в диапазоне 0.001-1 мкг/100 мкл сыворотки.
Полученный калибровочный график описывается линейным уравнением вида Y(мкг/100 мкл Св)=aX+b, где a=0,00022; b=0,00015; r=0,999.
Результаты исследования
С целью оценки биологической доступности исследуемых лекарственных форм были определены концентрации неизмененного азафена в сыворотке крови кроликов и рассчитаны основные фармакокинетические параметры, позволяющие количественно охарактеризовать относительную степень всасывания действующего вещества (f), величины площадей под фармакокинетическими кривыми зависимости “концентрация – время” (AUCо-зо), время достижения максимальной концентрации
(Тмакс) и значения максимальных концентраций (Смакс.)- Оценку параметра (f) – относительной степени всасывания – рассчитывали как отношение площадей AUC0- под фармакокинетическими кривыми при введении тест- и референс-препаратов. под фармакокинетическими кривыми при введении тест- и референс-препаратов.
Ниже, на чертеже представлены концентрации азафена (мкг/мл) в сыворотке крови кроликов при приеме сравниваемых лекарственных форм, рассчитаны средние значения, стандартные ошибки и доверительные (95%) интервалы, в приложении – индивидуальные кинетические кривые.
Основные фармакокинетические параметры.
В таблице 2 приведены рассчитанные по концентрационным кривым основные фармакокинетические параметры Смакс., Тмакс., MRT, AUC и др. отражающие степень, скорость всасывания и элиминацию препарата при применении сравниваемых лекарственных форм азафена.
Формула изобретения
1. Фармацевтическая композиция, обладающая антидепрессантным действием, включающая в качестве активного компонента азафен и вспомогательные добавки, отличающаяся тем, что в качестве вспомогательных веществ она содержит метацель, целлюлозу микрокристаллическую, коллидон, аэросил, магния стеарат и тальк при следующем содержании компонентов, мг/табл.:
| Азафен |
155,4-158,7 |
| Метацель |
80,0-100,0 |
| Целлюлоза микрокристаллическая |
98,7-102,0 |
| Аэросил |
3,7-14,8 |
| Коллидон |
25 3,7-11,1 |
| Тальк |
5,55-11,1 |
| Магния стеарат |
1,85-3,7 |
2. Фармацевтическая композиция по п.1 в форме таблетки.
РИСУНКИ
|
|