|
|
(21), (22) Заявка: 2006121446/15, 10.11.2004
(24) Дата начала отсчета срока действия патента:
10.11.2004
(30) Конвенционный приоритет:
18.11.2003 DE 10353832.1
11.03.2004 DE 102004012045.5
(43) Дата публикации заявки: 10.01.2008
(46) Опубликовано: 10.01.2010
(56) Список документов, цитированных в отчете о
поиске:
RU 2167876 С2, 27.01.2001. ЕР 1245232 А1, 02.10.2002. US 2001033864 A1, 25.11.2001.
(85) Дата перевода заявки PCT на национальную фазу:
19.06.2006
(86) Заявка PCT:
EP 2004/012683 20041110
(87) Публикация PCT:
WO 2005/049024 20050602
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, “ЕВРОМАРКПАТ”, пат.пов. И.А.Веселицкой, рег.  11 11
|
(72) Автор(ы):
БРАУНС Ульрих (DE),
ФРИДЛЬ Томас (DE),
ЛАНДЕРЕР Забине (DE)
(73) Патентообладатель(и):
БЁРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE)
|
(54) ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА
(57) Реферат:
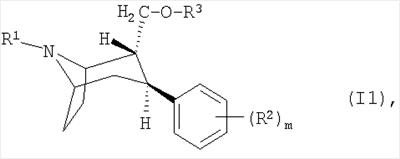
Настоящее изобретение относится к области лекарственных средств, в частности к твердой лекарственной форме, содержащей действующее вещество из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров 2,3-двузамещенным тропановым скелетом формулы (I1), которую получают путем нанесения распылением раствора действующего вещества на носитель, содержащая следующие компоненты: 0,01-5,00 мас.% действующего вещества, 80,00-95,00 мас.% одного или нескольких носителей, выбранных из группы, включающей углеводы и связующие, обеспечивающие связывание компонентов в сухом состоянии, 1,00-10,00 мас.% одного или нескольких вспомогательных веществ, выбранных из группы, включающей производные целлюлозы и соли жирных кислот, 0-10,00 мас.% пленочного покрытия, в состав которого входят преимущественно один или несколько пленкообразователей, одно или несколько веществ, повышающих эластичность, один или несколько пигментов и необязательно один или несколько красителей. Также изобретение относится к способу получения указанной лекарственной формы и ее применению. Указанная лекарственная форма обладает повышенной однородностью действующего вещества, стабильностью и биосовместимостью.
3 н. и 14 з.п. ф-лы, 2 ил., 6 табл.
Предпосылки создания изобретения
1. Область техники, к которой относится изобретение
Настоящее изобретение относится к твердой лекарственной форме, содержащей один либо несколько твердых носителей и/или вспомогательных веществ и действующее вещество из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом, к ее получению и применению в качестве средства, предназначенного для лечения или предупреждения заболеваний или расстройств центральной нервной системы.
2. Уровень техники
Ингибиторы обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом представляют собой соединения с фармакологически ценными свойствами. Так, например, при лечении заболеваний центральной нервной системы, таких как деменция, связанная с болезнью Альцгеймера, или болезнь Паркинсона, они могут проявлять высокую терапевтическую эффективность.
Подобные соединения известны, например, из заявок WO 93/09814 и WO 97/30997, где, помимо прочего, предлагаются также различные лекарственные формы таких соединений.
Благодаря исключительно высокому потенциалу эффективности этих соединений существует потребность в лекарственных формах с высокой стабильностью и низким содержанием действующего вещества. Вследствие низкой концентрации действующего вещества к процессу получения таких лекарственных форм предъявляются высокие требования касательно однородности содержания в них действующего вещества. Однако достичь требуемой высокой однородности содержания действующего вещества с помощью традиционных методов, таких как непосредственное таблетирование или мокрое гранулирование, удается лишь с большими трудностями.
С учетом вышеизложенного в основу настоящего изобретения была положена задача предложить твердую лекарственную форму ингибиторов обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом, отличающуюся высокой стабильностью, быстрым растворением in vitro и хорошей биосовместимостью, а также высокой однородностью содержания в ней действующего вещества.
При создании изобретения неожиданно было установлено, что недостатки, присущие полученным обычным путем лекарственным формам, прежде всего касательно однородности содержания в них действующего вещества, удается устранить, если раствор действующего вещества, выбранного из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом, наносить распылением на соответствующий носитель и/или если лекарственная форма, соответственно распыляемый раствор содержит связующее, обеспечивающее связывание компонентов во влажном состоянии.
Краткое описание изобретения
Объектом изобретения в соответствии с вышеизложенным является твердая лекарственная форма, в состав которой входят один либо несколько носителей и/или вспомогательных веществ и действующее вещество, выбранное из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом, и которая
(а) получена путем нанесения распылением раствора действующего вещества на по меньшей мере один носитель и
(б) необязательно содержит одно либо несколько связующих, обеспечивающих связывание компонентов во влажном состоянии, предпочтительно в распыляемом растворе.
Еще одним объектом изобретения является способ получения подобных лекарственных форм, заключающийся в том, что
(а) действующее вещество, выбранное из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом, растворяют в соответствующем растворителе, необязательно в присутствии вспомогательного вещества,
(б) полученный раствор наносят распылением на один либо несколько твердых носителей,
(в) при необходимости добавляют другие носители и вспомогательные вещества,
(г) полученную смесь формуют и при необходимости прессуют и
(д) необязательно наносят пленочное покрытие.
Изобретение относится далее к применению предлагаемой в нем лекарственной формы в качестве средства, предназначенного для лечения или предупреждения заболеваний или расстройств центральной нервной системы из группы, включающей депрессии, любую форму деменции, болезнь Паркинсона и ожирение.
Краткое описание чертежей
На фиг.1 показана характеристика растворения предлагаемой в изобретении лекарственной формы в виде филмтаблетки, содержащей и не содержащей связующее, обеспечивающее связывание компонентов во влажном состоянии, и без него, а также содержащей 1 мг соединения формулы IA при значении рН 1,2.
На фиг.2 показана характеристика растворения предлагаемой в изобретении лекарственной формы в виде филмтаблетки, содержащей и не содержащей связующее, обеспечивающее связывание компонентов во влажном состоянии, а также содержащей 1 мг соединения формулы IA при значении рН 6,8.
Подробное описание изобретения
Как правило, под ингибиторами обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом имеются в виду таковые формулы (I), описанные, например, в заявках WO 93/09814 и WO 97/30997:
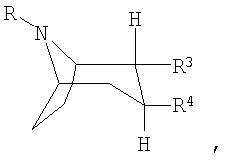 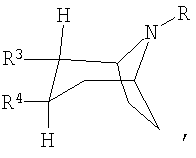 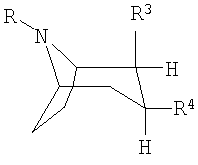 или или 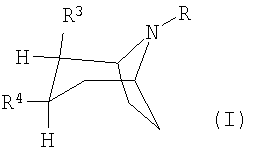
или их фармацевтически приемлемые кислотно-аддитивные соли или их N-оксиды, при этом
R представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил или 2-гидроксиэтил,
R3 представляет собой
– группу CH2-X-R’, в которой Х обозначает О, S или NR , где , где
R представляет собой водород или алкил, а представляет собой водород или алкил, а
R’ обозначает алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил или -СО-алкил,
– гетероарил, который может быть одно- либо многозамещен алкилом, циклоалкилом или циклоалкилалкилом,
– фенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, фенилфенил,
– пиридил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил,
– тиенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил,
– бензил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, или
– группу (CH2)nCO2R11, COR11 или CH2R12, в которой
R11 представляет собой алкил, циклоалкил, циклоалкилалкил, фенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, фенилфенил, пиридил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, тиенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, или бензил,
n обозначает 0 или 1 и
R12 представляет собой O-фенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, O-СО-фенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, или группу CH=NOR’, в которой R’ обозначает водород либо алкил, циклоалкил, циклоалкилалкил, алкенил, алкинил или арил, каждый из которых в свою очередь может быть замещен группой -СООН, -СОО-алкилом либо -СОО-циклоалкилом, или обозначает фенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу и нитрогруппу, и
R4 представляет собой фенил, 3,4-метилендиоксифенил, бензил, нафтил или гетероарил, каждый из которых может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил.
Предпочтительными являются соединения формулы (I), где R3 представляет собой 1,2,4-оксадиазол-3-ил, который в положении 5 может быть замещен алкилом, циклоалкилом или циклоалкилалкилом, фенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, фенилфенил или бензил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, или R3 представляет собой 1,2,4-оксадиазол-5-ил, который в положении 3 может быть замещен алкилом, циклоалкилом или циклоалкилалкилом, фенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил, фенилфенил или бензил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил.
Согласно другому предпочтительному варианту осуществления изобретения в соединениях общей формулы (I) R3 представляет собой группу СН2-X-R’, в которой Х обозначает О, S или NR , где R , где R представляет собой водород или алкил, и R’ обозначает алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил или -СО-алкил. представляет собой водород или алкил, и R’ обозначает алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил или -СО-алкил.
К предпочтительным относятся далее соединения формулы (I), в которых R3 представляет собой группу CH=NOR’, в которой R’ представляет собой водород либо алкил, циклоалкил, циклоалкилалкил, алкенил, алкинил или арил, каждый из которых может быть замещен заместителями, выбранными из группы, включающей -СООН, -СОО-алкил, -СОО-циклоалкил и фенил, который может быть одно- либо многозамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу и нитрогруппу.
Предпочтительны далее те соединения формулы (I), в которых R4 представляет собой фенил, который может быть одно- либо двузамещен заместителями, выбранными из группы, включающей галоген, СF3, CN, алкоксигруппу, алкил, алкенил, алкинил, аминогруппу, нитрогруппу и гетероарил.
Особенно предпочтительными являются соединения формулы (I), в которых R4 представляет собой фенил, одно- либо двузамещенный хлором.
К предпочтительным относятся, кроме того, такие 2,3-двузамещенные производные тропана с ингибирующей обратный захват моноаминовых нейротрансмиттеров активностью, которые имеют (1R,2R,3S)-конфигурацию.
Особенно предпочтительны соединения формулы (I), в которых R3 представляет собой группу -СН2-Х-R’, в которой Х обозначает О или S, а R’ представляет собой метил, этил, пропил или циклопропилметил, или R3 представляет собой группу -CH=NOR’, в которой R’ представляет собой водород или алкил, либо R3 представляет собой 1,2,4-оксадиазол-5-ил, который в положении 3 может быть замещен алкилом.
Предпочтительными значениями R являются далее водород, метил, этил или пропил.
К предпочтительным относятся также соединения формулы (I), в которых R4 представляет собой 3,4-дихлорфенил.
Предпочтительны помимо названных соединения формулы (II)

в которых
R1 представляет собой атом водорода или С1-С6алкильную группу, прежде всего водород, метил или этил,
R2 представляет собой атом галогена, СF3 или цианогруппу, прежде всего фтор, хлор или бром,
R3 представляет собой атом водорода, С1-С6алкильную группу или С3-С6циклоалкил-С1-С3алкильную группу, прежде всего метил, этил или пропил, и
m обозначает 0 или целое число от 1 до 3, прежде всего 1 или 2, или их таутомеры, фармацевтически приемлемые соли, сольваты или физиологически функциональные производные.
Под используемым в предшествующей и последующей части описания понятием “C1-С6алкил” подразумеваются метальные и этильные группы, а также пропильные, бутильные, пентильные и гексильные группы с прямой и разветвленной цепью. Особенно предпочтительными алкильными группами являются метил, этил, н-пропил, изопропил и трет-бутил.
Под используемым в предшествующей и последующей части описания понятием “С3-С6циклоалкил” подразумеваются циклические пропильные, бутильные, пентильные и гексильные группы, такие как циклопропил и циклогексил.
Под используемым в предшествующей и последующей части описания понятием “галоген” подразумеваются фтор, хлор, бром и иод, особенно предпочтительны из которых фтор и хлор.
Под используемым в предшествующей и последующей части описания под понятием “физиологически функциональные производные” подразумеваются производные соединений формулы (I), получаемые в соответствующих физиологических условиях, такие, например, как N-оксиды.
Под используемым в предшествующей и последующей части описания понятием “фармацевтически приемлемые кислотно-аддитивные соли” подразумеваются кислотно-аддитивные соли, образуемые с соляной кислотой, бромноватой кислотой, серной кислотой, фосфорной кислотой, метансульфоновой кислотой, уксусной кислотой, фумаровой кислотой, сукциновой кислотой, молочной кислотой, лимонной кислотой, винной кислотой и малеиновой кислотой, особенно предпочтительны соли соляной кислоты, бромноватой кислоты, серной кислоты, фосфорной кислоты, уксусной и лимонной кислоты. Наиболее предпочтительной является соль лимонной кислоты.
Согласно одному из вариантов к особенно предпочтительным соединениям формулы (I) относятся соединения, выбранные из группы, включающей
(1R,2R,3S)-2-(3-циклопропил-1,2,4-оксадиазол-5-ил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-(3-фенил-1,2,4-оксадиазол-5-ил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-(3-фенил-1,2,4-оксадиазол-5-ил)-3-(4-метилфенил)тропан,
(1R,2R,3S)-2-(3-бензил-1,2,4-оксадиазол-5-ил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-(3-(4-фенилфенил)-1,2,4-оксадиазол-5-ил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-(3-фенил-1,2,4-оксадиазол-5-ил)-3-(2-нафтил)тропан,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-альдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-метилальдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-бензилальдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-этоксикарбонилметилальдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-метоксикарбонилметилальдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-(1-этоксикарбонил-1,1-диметилметил)альдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-карбоксиметил-2-альдоксим,
(1R,2R,3S)-N-норметил-3-(3,4-дихлорфенил)тропан-2-O-метилальдоксим,
(1R,2R,3S)-N-норметил-3-(3,4-дихлорфенил)тропан-2-O-бензилальдоксим,
(1R,2R,3S)-3-(4-метилфенил)тропан-2-O-метилальдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-(1,1-диметилэтил)альдоксим,
(1R,2R,3S)-3-(4-хлорфенил)тропан-2-O-альдоксим,
гидрохлорид (1R,2R,3S)-3-(4-хлорфенил)тропан-2-O-метилальдоксима,
(1R,2R,3S)-3-(4-хлорфенил)тропан-2-O-метоксикарбонилметилальдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-(2-пропинил)альдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-(2-метилпропил)альдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-циклопропилметилальдоксим,
(1R,2R,3S)-3-(3,4-дихлорфенил)тропан-2-O-этилальдоксим,
(1R,2R,3S)-2-метоксиметил-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-изопропоксиметил-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-этоксиметил-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-этоксиметил-3-(3,4-дихлорфенил)нортропан,
(1R,2R,3S)-2-циклопропилметилоксиметил-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-метоксиметил-3-(4-хлорфенил)тропан,
(1R,2R,3S)-Н-норметил-2-метоксиметил-3-(4-хлорфенил)тропан,
(1R,2R,3S)-2-этоксиметил-3-(4-хлорфенил)тропан,
(1R,2R,3S)-N-норметил-2-метоксиметил-3-(3,4-дихлорфенил)тропан;
(1R,2R,3S)-N-норметил-2-этоксиметил-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-N-норметил-2-этоксиметил-3-(4-хлорфенил)тропан,
(1R,2R,3S)-N-норметил-2-циклопропилметилоксиметил-3-(4-хлорфенил)тропан,
(1R,2R,3S)-2-циклопропилметилоксиметил-3-(4-хлорфенил)тропан,
(1R,2R,3S)-2-этилтиометил-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-гидроксиметил-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-гидроксиметил-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-N-норметил-Н-(трет-бутоксикарбонил)-2-гидроксиметил-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-гидроксиметил-3-(4-хлорфенил)тропан,
(1R,2R,3S)-2-(3-(2-фуранил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-(3-(3-пиридил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-N-норметил-N-аллил-2-(3-(4-пиридил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-N-норметил-N-этил-2-(3-(4-пиридил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-N-норметил-N-(2-гидроксиэтил)-2-(3-(4-пиридил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-N-норметил-2-(3-(4-пиридил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-N-норметил-N-аллил-2-(3-(3-пиридил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-N-норметил-N-аллил-2-(3-(2-пиридил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-(3-(2-тиенил)-1,2,4-оксадиазол-5-ил)-3-(4-хлорфенил)тропан,
(1R,2R,3S)-2-(3-(2-тиенил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-(3-(4-пиридил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-(3-(2-пиридил)-1,2,4-оксадиазол-5-ил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-(3-(4-пиридил)-1,2,4-оксадиазол-5-ил)-3-(4-хлорфенил)тропан,
(1R,2R,3S)-2-(3-(3-пиридил)-1,2,4-оксадиазол-5-ил)-3-(4-хлорфенил)тропан,
(1R,2R,3S)-2-(3-(2-пиридил)-1,2,4-оксадиазол-5-ил)-3-(4-хлорфенил)тропан,
(1R,2R,3S)-2-(3-фенил-1,2,4-оксадиазол-5-ил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-(3-фенил-1,2,4-оксадиазол-5-ил)-3-(4-метилфенил)тропан,
(1R,2R,3S)-2-(3-бензил-1,2,4-оксадиазол-5-ил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-(3-(4-фенилфенил)-1,2,4-оксадиазол-5-ил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-(3-фенил-1,2,4-оксадиазол-5-ил)-3-(2-нафтил)тропан,
(1R,2R,3S)-2-(4-хлорфеноксиметил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-(4-хлорфеноксиметил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-(4-хлорфеноксиметил)-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-(4-хлорфеноксиметил)-3-(4-метилфенил)тропан,
(1R,2R,3S)-2-(4-бензоилоксиметил)-3-(4-фторфенил)тропан,
(1R,2R,3S)-2-карбометокси-3-(2-нафтил)тропан,
(1R,2R,3S)-2-карбометокси-3-(3,4-дихлорфенил)тропан,
(1R,2R,3S)-2-карбометокси-3-бензилтропан,
(1R,2R,3S)-2-карбометокси-3-(4-хлорфенил)тропан,
(1R,2R,3S)-2-карбометокси-3-(4-метилфенил)тропан,
(1R,2R,3S)-2-карбометокси-3-(1-нафтил)тропан,
(1R,2R,3S)-2-карбометокси-3-(4-фенилфенил)тропан,
(1R,2R,3S)-2-карбометокси-3-(4-отретп-бутилфенил)тропан,
(1R,2R,3S)-2-(4-фторбензоил)-3-(4-фторфенил)тропан
и их фармацевтически приемлемые соли.
Наиболее предпочтительным является соединение формулы (IA)
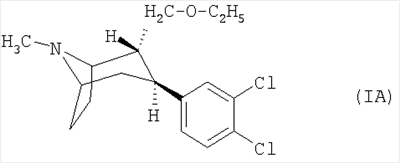
или его фармацевтически приемлемая соль, прежде всего цитрат.
Предпочтительно предлагаемая в изобретении лекарственная форма содержит до 5,00 мас.%, более предпочтительно от 0,01 до 3,00 мас.%, прежде всего от 0,10 до 1,50 мас.%, наиболее предпочтительно от 0,10 до 0,80 мас.%, действующего вещества из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом, при этом процентные данные указаны в пересчете на конкретно используемую соль этого действующего вещества.
Предпочтительной является далее лекарственная форма, получаемая путем распыления раствора действующего вещества, при этом в состав растворителя входят вода, спирт и необязательно связующее, обеспечивающее связывание компонентов во влажном состоянии. Соотношение между спиртом и водой может составлять в этих случаях от 100:0 до 0:100 (мас.%), предпочтительно от 20:80 до 80:20 (мас.%), особенно предпочтительно от 40:60 до 60:40 (мас.%).
К предпочтительным связующим, обеспечивающим связывание компонентов во влажном состоянии, относятся поливинилпирролидон (повидон), сополимеры винилпирролидона с другими виниловыми производными (коповидоны), производные целлюлозы, такие как метилгидроксипропилцеллюлоза, метилцеллюлоза или гидроксипропилцеллюлоза, прежде всего гидроксипропилцеллюлоза (ГПЦ).
Согласно другому предпочтительному варианту действующее вещество при распылении его раствора осаждается на носителе преимущественно в кристаллической форме.
Особенно важное значение при этом придается согласно изобретению носителям, в качестве которых целесообразно использовать углеводы, такие как лактоза или манноза, прежде всего высокодисперсная лактоза и моногидрат лактозы, а также сахароспирты, такие как маннит, сорбит или ксилит, прежде всего маннит. Для использования в предлагаемой в изобретении лекарственной форме эти носители зарекомендовали себя с самой положительной стороны. Одним из предпочтительных объектов настоящего изобретения является в соответствии с этим содержащая по меньшей мере одно соединение формулы (I) лекарственная форма, в состав которой наряду с действующим веществом входит в качестве носителя лактоза, прежде всего высокодисперсная лактоза и моногидрат лактозы.
Согласно изобретению массовое соотношение между содержащимися в таблетке лактозой и действующим веществом составляет от примерно 200:1 до примерно 20:1. В предпочтительном варианте это соотношение между лактозой и действующим веществом составляет от примерно 150:1 до примерно 50:1. На массовую долю лактозы в пересчете на общую массу предлагаемой в изобретении таблетки предпочтительно приходится от 50 до 80 мас.%, более предпочтительно от 55 до 75 мас.%.
Предпочтительны далее лекарственные формы, носители в которых выбраны из группы, включающей углеводы и связующие, обеспечивающие связывание компонентов в сухом состоянии.
Под используемым в предшествующей и последующей части описания понятием “связующие, обеспечивающие связывание компонентов в сухом состоянии”, имеются в виду такие вспомогательные вещества, которые способны связывать между собой другие компоненты. Предпочтительные согласно изобретению связующие такого типа выбраны из группы, включающей порошковую целлюлозу, микрокристаллическую целлюлозу, сорбит, крахмал, поливинилпирролидон (повидон), сополимеры винилпирролидона с другими виниловыми производными (коповидоны), производные целлюлозы, прежде всего метилгидроксипропилцеллюлозу, например, Methocel Е 5 Р, и смеси этих соединений. Предпочтительны в качестве указанных связующих порошковая целлюлоза, особенно микрокристаллическая целлюлоза и/или коповидоны. Наиболее предпочтительной из них является микрокристаллическая целлюлоза.
Такая особенно предпочтительная комбинация носителей из микрокристаллической целлюлозы, безводной лактозы и моногидрата лактозы позволяет получать таблетки с высокой механической прочностью и одновременно быстрым высвобождением действующего вещества и тем самым хорошей биодоступностью.
При добавлении к предлагаемой в изобретении лекарственной форме одного из вышеназванных связующих, обеспечивающих связывание компонентов в сухом состоянии, массовое соотношение между лактозой и таким связующим составляет предпочтительно от примерно 5:1 до примерно 1:2, более предпочтительно от примерно 3:1 до примерно 1:1, особенно предпочтительно от примерно 2,5:1 до примерно 1,5:1.
К предпочтительным относятся далее лекарственные формы, вспомогательные вещества в составе которых выбраны из группы, включающей связующие, обеспечивающие связывание компонентов во влажном состоянии, смазывающие вещества, вещества, способствующие распаду, антиадгезивы и смачиватели.
Согласно изобретению указанные вещества, способствующие распаду, в определенных случаях могут обозначаться и как разрыхлители. Эти вещества предпочтительно согласно изобретению выбирать из группы, включающей натрийкрахмалгликолят, поперечносшитый поливинилпирролидон (кросповидон), натриевую соль кроскармеллозы (натриевую соль карбоксиметилового эфира целлюлозы, поперечносшитую), карбоксиметилцеллюлозу, высушенный кукурузный крахмал и смеси этих веществ. Особенно предпочтительно согласно изобретению использовать натрийкрахмалгликолят, кросповидон и наиболее предпочтительно натриевую соль кроскармеллозы. При использовании вышеназванных веществ, способствующих распаду, на их массовую долю в пересчете на общую массу предлагаемой в изобретении таблетки приходится от примерно 0,5 до примерно 10 мас.%, особенно предпочтительно от примерно 1,0 до примерно 5,0 мас.%.
В качестве смазывающих веществ согласно изобретению можно использовать среди прочих диоксид кремния, тальк, стеариновая кислота, стеарилфумарат натрия, стеарат магния и глицерилтрибегенат. Согласно изобретению предпочтительно использовать стеарат магния растительного происхождения. При использовании вышеназванных веществ, способствующих текучести или регулированию текучести, соответственно смазывающих веществ на их массовую долю в пересчете на общую массу предлагаемой в изобретении лекарственной формы приходится от примерно 0,1 до примерно 10 мас.%, предпочтительно от примерно 0,5 до примерно 5 мас.%, особенно предпочтительно от 0,6 до 1,0 мас.%.
Согласно одному из предпочтительных вариантов осуществления изобретения предлагаемая в нем лекарственная форма представляет собой таблетку, прежде всего филмтаблетку (таблетку с пленочным покрытием).
Как правило, в состав пленочного покрытия входят в основном один или несколько пленкообразователей, одно или несколько веществ для повышения эластичности, так называемых пластификаторов, один или несколько антиадгезивов, один или несколько пигментов и необязательно один или несколько красителей.
Предпочтительной является филмтаблетка, в состав пленочного покрытия которой в пересчете на общую массу пленочного покрытия входят в основном 35-65 мас.% по меньшей мере одного пленкообразователя, прежде всего ГПМЦ (гидроксипропилметилцеллюлозы), 3,5-10 мас.% по меньшей мере одного вещества для повышения эластичности, прежде всего ПЭГ (полиэтиленгликоля), 5-20 мас.% по меньшей мере одного средства для нанесения покрытия, прежде всего из числа силикатов, 10-40 мас.% по меньшей мере одного пигмента, прежде всего диоксида титана, и 0-10 мас.% по меньшей мере одного красителя, прежде всего из числа оксидов железа.
Предпочтительной является лекарственная форма, отличающаяся тем, что она содержит в основном следующие компоненты:
1) действующее вещество из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом, предпочтительно соединение формулы (I), прежде всего соединение формулы (IA),
2) один или несколько носителей, выбранных из группы, включающей углеводы и связующие, обеспечивающие связывание компонентов в сухом состоянии, предпочтительно лактозу и целлюлозу,
3) одно или несколько вспомогательных веществ, выбранных из группы, включающей производные целлюлозы и соли жирных кислот, предпочтительно КМЦ, поперечносшитую Na-КМЦ и стеарат магния,
4) пленочное покрытие, в состав которого входят в основном один или несколько пленкообразователей, одно или несколько веществ для повышения эластичности, один или несколько антиадгезивов, один или несколько пигментов и необязательно один или несколько красителей.
Особенно предпочтительна лекарственная форма в виде филмтаблетки, содержащей в основном следующие компоненты:
1) 0,01-5,00 мас.% действующего вещества из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом, прежде всего 0,02-3,00 мас.% действующего вещества формулы (I),
2) 80,00-95,00 мас.% одного или нескольких носителей, выбранных из группы, включающей углеводы и связующие, обеспечивающие связывание компонентов в сухом состоянии, прежде всего из группы, включающей
а. 27,5-32,5 мас.% безводной лактозы,
б. 27,5-32,5 мас.% моногидрата лактозы,
в. 25,0-30,0 мас.% микрокристаллической целлюлозы,
3) 1,00-10,00 мас.% одного или нескольких вспомогательных веществ, выбранных из группы, включающей производные целлюлозы и соли жирных кислот, прежде всего 2,00-8,00 мас.% одного или нескольких вспомогательных веществ, выбранных из группы, включающей ГПЦ, поперечносшитую Na-КМЦ и стеарат магния,
4) 0-10,00 мас.% пленочного покрытия, в состав которого входят в основном один или несколько пленкообразователей, один или несколько пластификаторов, 1,00-5,00 мас.% пленочного покрытия, содержащего ГПМЦ, МГПЦ, ПЭГ, один или несколько силикатов, диоксид титана и один или несколько оксидов железа, один или несколько пигментов и необязательно один или несколько красителей, прежде всего 1,00-5,00 мас.% пленочного покрытия, содержащего ГПМЦ, МГПЦ, ПЭГ, один или несколько силикатов, диоксид титана и один или несколько оксидов железа.
Для получения предлагаемой в изобретении лекарственной формы действующее вещество растворяют в растворителе, необязательно в присутствии связующего, обеспечивающего связывание компонентов во влажном состоянии, полученный раствор распылением наносят на носители, прежде всего высокодисперсную безводную лактозу, моногидрат лактозы и микрокристаллическую целлюлозу, служащие связующими, перемешивают, просеивают и затем сушат. Полученный продукт при необходимости смешивают еще с один носителем, прежде всего микрокристаллической целлюлозой и/или лактозой, с веществом, способствующим распаду, прежде всего поперечносшитой Na-КМЦ, и с добавкой, повышающей текучесть, прежде всего стеаратом магния. В завершение из полученной таким путем смеси в соответствующей таблетировочной машине прессуют предлагаемые в изобретении таблетки.
Усилия прессования, необходимые для изготовления таблеток с соответствующим сопротивлением разрушению и тем самым с требуемым временем распада, зависят от формы и размеров используемых пуансонов. В предпочтительном варианте усилие прессования должно составлять от 2 до 30 кН, прежде всего от 5 до 26 кН. Увеличение усилия прессования может привести к получению таблеток с замедленным высвобождением из них действующего вещества. Более низкие усилия прессования могут обусловить снижение механической прочности таблеток. Сердцевина таблеток может иметь самую разную форму, предпочтительны при этом круглая двояковыпуклая или двояковогнутая и овальная либо продолговатая форма.
Затем приготавливают раствор пленкообразователя и пластификатора в воде, присутствующие в растворе нерастворимые антиадгезивы и пигменты диспергируют и полученную в результате суспензию наносят на таблетки.
Ниже предлагаемые в изобретении лекарственные формы более подробно поясняются на примерах. В этих примерах рассматриваются лишь некоторые возможные варианты осуществления изобретения, которые не ограничивают его объем.
Пример 1
В этом примере проиллюстрировано изготовление следующих филмтаблеток (таблеток с пленочным покрытием):
I. Состав
 |
Компоненты |
Количество, в мг, на одну таблетку |
Количество, в мг, на пленочное покрытие |
Общее количество летучих компонентов, в мг |
| (01) |
Соединение формулы (IА), цитрат |
1,585 |
 |
 |
| (02) |
Лактоза высокодисперсная |
79,415 |
 |
 |
| (03) |
Моногидрат лактозы |
78,000 |
 |
 |
| (04) |
Целлюлоза микрокристаллическая, тип 101 |
72,000 |
 |
 |
| (05) |
Гидроксипропилцеллюлоза (продукт Klucel EF Pharm) |
2,400 |
 |
 |
| (06) |
Na-карбоксиметилцеллюлоза (продукт Ac-Di-Sol) |
4,800 |
 |
 |
| (07) |
Стеарат магния растительного происхождения |
1,800 |
 |
 |
| (08) |
Гипромеллоза (продукт Methocel E5 Premium) |
 |
2,500 |
 |
| (09) |
Макрогол 6000 |
 |
0,250 |
 |
| (10) |
Диоксид титана |
 |
1,250 |
 |
| (11) |
Тальк |
 |
0,750 |
 |
| (12) |
Желтый оксид железа 17015 |
 |
0,125 |
 |
| (13) |
Красный оксид железа 17009 |
 |
0,125 |
 |
| (14) |
Этанол, 96%-ный |
26,880 |
 |
26,880 |
| (15) |
Вода очищенная |
17,920 |
34,000 |
51,920 |
 |
 |
240,000 |
5,000 |
78,800 |
II. Описание продукта
 |
Таблетки |
Филмтаблетка |
| Форма |
круглые, выпуклые (радиус выпуклости 13,5 мм), с фасеткой |
круглая, выпуклая (радиус выпуклости 13,5 мм), с фасеткой |
| Цвет |
белые |
желтовато-красная |
| Номинальная масса |
240 мг |
245 мг |
| Диаметр |
примерно 9,0 мм |
примерно 9,0 мм |
| Толщина |
примерно 3,5 мм |
примерно 3,6 мм |
| Сопротивление разрушению |
примерно 75 И |
примерно 100 Н |
| Время распада |
измеренные значения: менее 5 мин |
измеренные значения: менее 5 мин |
III. Изготовление
А) Таблетки
1 партия: конечная смесь и таблетки: 15000 г, соответствует 62500 таблеткам.
1. Жидкость для гранулирования
В соответствующий реактор при КТ загружают
| (15) очищенную воду и |
1120,000 г |
| (14) этанол, 96%-ный, PAR INT. |
1680,000 г |
Затем последовательно при интенсивном перемешивании добавляют
| (05) гидроксипропилцеллюлозу (продукт Klucel EF Pharm), INT, и |
150,000 г |
| (01) соединение формулы (IA) в виде цитрата и эти компоненты растворяют. |
99,063 г |
| Содержание твердых веществ: 249,063 г |
 |
 |
3049,063 г |
Используемое оборудование и технологические параметры
| Смеситель: |
SPN-смеситель |
| Частота вращения/продолжительность: |
примерно 250-450 об/мин |
2. Гранулят
В соответствующий гранулятор загружают
| (02) высокодисперсную лактозу, INT, |
4963,437 г |
| (03) моногидрат лактозы (таблеттозу), INT, и |
4875,000 г |
| (04) микрокристаллическую целлюлозу, тип 101, INT, |
4500,000 г |
| перемешивают до образования гомогенной смеси и смесь увлажняют полученной на стадии 1 жидкостью для гранулирования. |
3049,063 г |
| Содержание твердых веществ: 249,063 г |
 |
| Затем гранулируют и в завершение сушат. |
 |
 |
14587,500 г |
Используемое оборудование и технологические параметры
Смеситель интенсивного действия: Zanchetta Roto P 50
В процессе сушки и охлаждения смеситель должен работать в периодическом режиме, т.е. 1-минутное перемешивание, затем 2-минутная пауза.
3. Просеивание в сухом состоянии
Высушенный гранулят измельчают с помощью соответствующей просеивающей машины.
Используемое оборудование и технологические параметры
| Просеивающая машина: |
Comil 197 S |
| Размер отверстий сита: |
RS 2007 |
| Дистанционное кольцо: |
DR 125 |
4. Конечная смесь
Используемое оборудование и технологические параметры
| Гравитационный смеситель |
Servolift Kubus, 60 л |
| Скорость перемешивания |
10 об/мин |
| Число оборотов |
100 об (продукт Ac-Di-Sol, INT) |
 |
30 об (стеарат магния, INT) |
5. Таблетки
| В соответствующей таблетировочной машине из полученной на стадии 4 смеси |
15000,000 г |
| прессуют таблетки заданной массы: 240 мг. |
 |
Используемое оборудование и технологические параметры
| Таблетировочная машина |
Korsch EK0 |
| Пуансон и матрица |
диаметр 9 мм, радиус выпуклости 13,5 мм, двояковыпуклые с фасеткой + BI-Logo |
| Скорость прессования |
стадия 4 |
| Усилие прессования |
примерно 11-12 кН |
Б) Таблетки с пленочным покрытием (филмтаблетки)
| 1 партия |
2640 г, соответствует 11000 таблеткам |
 |
2695 г, соответствует 11000 филмтаблеткам |
6. Суспензия для нанесения покрытия/раствор
7. Суспензия для нанесения покрытия/дисперсия
| (15) Очищенная вода |
112,200 г |
| (10) Диоксид титана, INT |
13,750 г |
| (11) Тальк, INT |
8,250 г |
| (12) Желтый оксид железа 17015, INT |
1,375 г |
| (13) Красный оксид железа 17009, INT |
1,375 г |
| В соответствующую смесительную емкость заливают очищенную воду (15), при комнатной температуре с помощью высокоскоростной мешалки типа Ultra-Turrax суспендируют в ней компоненты (10), (11), (12) и (13) и перемешивают в течение 30 мин |
 |
| Содержание твердых веществ: 24,750 г |
 |
 |
136,950 г |
8. Суспензия для нанесения покрытия
9. Нанесение пленочного покрытия
Пример 2
Аналогично примеру 1 изготавливают соответствующие таблетки без покрытия, за исключением того, что для нанесения на носитель используют раствор действующего вещества формулы (IA) в виде цитрата, растворенного в воде и этаноле, но без добавления гидроксипропилцеллюлозы.
Пример 3
I. Состав
 |
Компоненты |
Количество, в мг, на одну таблетку |
Количество, в мг, на пленочное покрытие |
Общее количество летучих компонентов, в мг |
| (01) |
Соединение формулы (IА), цитрат |
0,198 |
 |
 |
| (02) |
Лактоза высокодисперсная |
30,427 |
 |
 |
| (03) |
Моногидрат лактозы |
29,000 |
 |
 |
| (04) |
Гидроксипропилцеллюлоза (продукт Klucel EF Pharm) |
0,900 |
 |
 |
| (05) |
Целлюлоза микрокристаллическая, тип 101 |
27,000 |
 |
 |
| (06) |
Na-карбоксиметилцеллюлоза (продукт Ac-Di-Sol) |
1,800 |
 |
 |
| (07) |
Стеарат магния растительного происхождения |
0,675 |
 |
 |
| (08) |
Гипромеллоза (продукт Methocel E5 Premium) |
 |
1,500 |
 |
| (09) |
Макрогол 6000 |
 |
0,125 |
 |
| (10) |
Диоксид титана |
 |
0,624 |
 |
| (11) |
Тальк |
 |
0,375 |
 |
| (12) |
Желтый оксид железа 17015 |
 |
0,063 |
 |
| (13) |
Красный оксид железа 17009 |
 |
0,063 |
 |
| (14) |
Этанол 96%-ный |
4,667 |
 |
4,667 |
| (15) |
Вода очищенная |
3,120 |
18,709 |
21,829 |
 |
 |
90,000 |
2,500 |
26,496 |
II. Описание продукта
 |
Таблетки |
Филмтаблетка |
| Форма |
круглые, выпуклые (радиус выпуклости 9 мм), с фасеткой |
круглая, выпуклая (радиус выпуклости 9 мм), с фасеткой |
| Цвет |
белые |
желтовато-красная |
| Номинальная масса |
90 мг |
92,5 мг |
| Диаметр |
примерно 6,0 мм |
примерно 6,1 мм |
| Толщина |
примерно 2,9 мм |
примерно 3,0 мм |
| Сопротивление разрушению |
примерно 45 Н |
примерно 60 Н |
| Время распада |
измеренные значения: менее 5 мин |
измеренные значения: менее 5 мин |
III. Изготовление
А) Таблетки
1 партия: конечная смесь и таблетки: 18000 г, соответствует 200000 таблеткам.
1.Жидкость для гранулирования
В соответствующий реактор при КТ загружают
| (15) очищенную воду и |
664,092 г |
| (14) этанол 96%-ный, PAR INT |
993,422 г |
Затем последовательно при интенсивном перемешивании добавляют
Используемое оборудование и технологические параметры
| Смеситель |
SPN-смеситель |
| Частота вращения/продолжительность |
примерно 250-450 об/мин |
2. Гранулят
В соответствующий гранулятор загружают
Используемое оборудование и технологические параметры
Смеситель интенсивного действия: Zanchetta Roto P 50
 |
Скорость смешения (об/мин) |
Измельчитель (об/мин) |
Температура нагревательной рубашки (°С) |
Конечная температура продукта (°С) |
| Технологическая операция |
Продолжительность (мин) |
250 |
– |
КТ |
– |
| Предварительное смешение |
3 |
200-250 |
– |
КТ |
– |
| Увлажнение |
Примерно 5 |
200-250 |
– |
КТ |
– |
| Промывка |
примерно 1 |
200-250 |
– |
КТ |
– |
| Смешение во влажном состоянии |
1 |
250 |
1000 |
КТ |
– |
| Сушка |
примерно 50 |
5 |
– |
до примерно 80 |
примерно 48 |
| Охлаждение |
15 |
5 |
– |
до примерно25 |
менее 40 |
 |
| Распылительная головка |
1,1 мм |
| Давление распыления |
примерно 2 бара |
| Угол поворота |
100° (при сушке и охлаждении) |
В процессе сушки и охлаждения смеситель должен работать в непрерывном режиме, 5 об/мин.
3. Просеивание в сухом состоянии
Высушенный гранулят измельчают с помощью соответствующей просеивающей машины.
Используемое оборудование и технологические параметры
| Просеивающая машина |
Comil 197 S |
| Размер отверстий сита |
RS 2007 |
| Дистанционное кольцо |
DR 125 |
4. Конечная смесь
| В соответствующем гравитационном смесителе просеянный в сухом состоянии гранулят со стадии 3 смешивают с |
12105,000 г |
| (05) микрокристаллической целлюлозой, тип 101, INT, и |
5400,000 г |
| (07) поперечносшитой Na-карбоксиметилцеллюлозой (продукт Ac-Di-Sol), INT. |
360,000 г |
| Затем добавляют |
 |
| (06) стеарат магния растительного происхождения, INT, предварительно просеянный через сито с размером отверстий 0,5 мм, и все эти компоненты перемешивают до образования гомогенной смеси. |
135,000 г |
 |
18000,000 г |
Используемое оборудование и технологические параметры
| Гравитационный смеситель |
Servolift Kubus, 60 л |
| Скорость перемешивания |
10 об/мин |
| Число оборотов |
100 об (продукт Ac-Di-Sol, INT, МКЦ) |
 |
30 об (стеарат магния, INT) |
5. Таблетки
| В соответствующей таблетировочной машине из полученной на стадии 4 смеси прессуют таблетки заданной массы: 90 мг. |
18000,000 г |
Используемое оборудование и технологические параметры
| Таблетировочная машина |
Fette P1200 |
| Пуансон и матрица |
диаметр 6 мм, радиус выпуклости 9 мм, двояковыпуклые с фасеткой + BI-Logo |
| Скорость прессования |
150000 таблеток/ч |
| Усилие прессования |
примерно 7-9 кН |
Б) Таблетки с пленочным покрытием (филмтаблетки)
| 1 партия |
2640 г, соответствует 29333 таблеткам |
 |
2713 г, соответствует 29333 филмтаблеткам |
6. Суспензия для нанесения покрытия/раствор
7. Суспензия для нанесения покрытия/дисперсия
| (15) Очищенная вода |
164,623 г |
| (10) Диоксид титана, INT |
18,304 г |
| (11) Тальк, INT |
11,000 г |
| (12) Желтый оксид железа 17015, INT |
1,848 г |
| (13) Красный оксид железа 17009, INT |
1,848 г |
| В соответствующую смесительную емкость заливают очищенную воду (15), при комнатной температуре с помощью высокоскоростной мешалки типа Ultra-Turrax суспендируют в ней компоненты (10), (11), (12) и (13) и перемешивают в течение 30 мин |
 |
| Содержание твердых веществ 33,000 г |
 |
 |
197,623 г |
8. Суспензия для нанесения покрытия
9. Нанесение пленочного покрытия
Пример 4: Исследование скорости растворения
Таблетки из примеров 1 и 2 растворяют в 900 мл моделирующей желудочный сок жидкости с рН 1,2, соответственно моделирующей кишечную флору жидкости с рН 6,8 (0,05-молярный фосфатный буфер) при скорости перемешивания 50 об/мин, соответственно 75 об/мин. Содержание растворенного соединения формулы (IA) определяют с помощью ЖХВР (жидкостной хроматографии высокого разрешения).
Временная зависимость скорости растворения показана на фиг.1 и фиг.2.
При этом
– – – |
соответствует примеру 1 с использованием связующего, связывающего компоненты во влажном состоянии, а |
– – – |
соответствует примеру 2 без использования связующего, связывающего компоненты во влажном состоянии. |
Формула изобретения
1. Твердая лекарственная форма, содержащая действующее вещество из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров формулы (II)
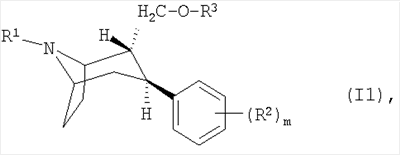
в которой R1 представляет собой атом водорода или C1-С6алкильную группу,
R2 представляет собой атом галогена, СF3 или цианогруппу,
R3 представляет собой атом водорода, C1-С6алкильную группу или
С3-С6циклоалкил-С1-С3алкильную группу и
m обозначает 0 или целое число от 1 до 3, или его таутомер,
фармацевтически приемлемую соль, сольват или
физиологически функциональное производное, отличающаяся тем, что ее получают путем нанесения распылением раствора этого действующего вещества на по меньшей мере один носитель, и что она содержит в основном следующие компоненты:
1) 0,01-5,00 мас.% действующего вещества,
2) 80,00-95,00 мас.% одного или нескольких носителей, выбранных из группы, включающей углеводы и связующие, обеспечивающие связывание компонентов в сухом состоянии,
3) 1,00-10,00 мас.% одного или нескольких вспомогательных веществ, выбранных из группы, включающей производные целлюлозы и соли жирных кислот,
4) 0-10,00 мас.% пленочного покрытия, в состав которого входят преимущественно один или несколько пленкообразователей, одно или несколько веществ, повышающих эластичность, один или несколько пигментов и необязательно один или несколько красителей.
2. Лекарственная форма по п.1, отличающаяся тем, что действующее вещество представляет собой соединение формулы (IA)

или его фармацевтически приемлемую соль.
3. Лекарственная форма по п.1 или 2, получаемая путем нанесения распылением раствора действующего вещества на носитель, при этом растворитель содержит воду, спирт и необязательно связующее, обеспечивающее связывание компонентов во влажном состоянии.
4. Лекарственная форма по п.1 или 2, отличающаяся тем, что связующее, обеспечивающее связывание компонентов во влажном состоянии, представляет собой гидроксипропилцеллюлозу (ГПЦ).
5. Лекарственная форма по п.1 или 2, отличающаяся тем, что действующее вещество при распылении его раствора осаждается на носителе преимущественно в кристаллической форме.
6. Лекарственная форма по п.1 или 2, отличающаяся тем, что носитель выбран из группы, включающей углеводы и связующие, обеспечивающие связывание компонентов в сухом состоянии.
7. Лекарственная форма по п.1 или 2, отличающаяся тем, что носитель выбран из группы, включающей преимущественно лактозу и целлюлозу.
8. Лекарственная форма по п.1 или 2, отличающаяся тем, что носитель выбран из группы, включающей преимущественно безводную лактозу, моногидрат лактозы и микрокристаллическую целлюлозу.
9. Лекарственная форма по п.1 или 2, отличающаяся тем, что вспомогательные вещества преимущественно выбраны из группы, включающей связующие, обеспечивающие связывание компонентов во влажном состоянии, смазывающие вещества, вещества, способствующие распаду, антиадгезивы и смачиватели.
10. Лекарственная форма по п.1 или 2, отличающаяся тем, что вспомогательные вещества преимущественно выбраны из группы, включающей производные целлюлозы и соли жирных кислот.
11. Лекарственная форма по п.1 или 2, отличающаяся тем, что вспомогательные вещества преимущественно выбраны из группы, включающей гидроксипропилцеллюлозу (ГПЦ), натриевую соль сшитой карбоксиметилцеллюлозы (кроскармеллозу) и стеарат магния.
12. Лекарственная форма по п.1 или 2, отличающаяся тем, что она представляет собой филмтаблетку.
13. Лекарственная форма по п.12, отличающаяся тем, что в состав пленочного покрытия филмтаблетки входят преимущественно один или несколько пленкообразователей, одно или несколько веществ для повышения эластичности, один или несколько антиадгезивов, один или несколько пигментов и необязательно один или несколько красителей.
14. Лекарственная форма по п.11 или 12, отличающаяся тем, что в состав пленочного покрытия входят гидроксипропилметилцеллюлоза (ГПМЦ), метилгидроксипропилцеллюлоза (МГПЦ), полиэтиленгликоль (ПЭГ), один или несколько силикатов, диоксид титана и один или несколько оксидов железа.
15. Лекарственная форма по п.1 или 2, отличающаяся тем, что она содержит в основном следующие компоненты:
1) 0,02-3,00 мас.% действующего вещества формулы (I),
2) носитель, содержащий 27,5-32,5 мас.% безводной лактозы, 27,5-32,5 мас.% моногидрата лактозы и 25,0-30,0 мас.% микрокристаллической целлюлозы,
3) 2,00-8,00 мас.% одного или нескольких вспомогательных веществ, выбранных из группы, включающей ГПЦ, КМЦ и стеарат магния,
4) 1,00-5,00 пленочного покрытия, в состав которого входят ГПМЦ, ПЭГ, один или несколько силикатов, диоксид титана и один или несколько оксидов железа.
16. Способ получения лекарственной формы по пп.1-15, отличающийся тем, что
(а) действующее вещество, выбранное из группы ингибиторов обратного захвата моноаминовых нейротрансмиттеров с 2,3-двузамещенным тропановым скелетом, растворяют в соответствующем растворителе, необязательно в присутствии вспомогательного вещества,
(б) полученный раствор наносят распылением на один либо несколько твердых носителей,
(в) при необходимости добавляют другие носители и вспомогательные вещества,
(г) полученную смесь формуют и при необходимости прессуют и
(д) необязательно наносят пленочное покрытие.
17. Применение лекарственной формы по пп.1-15 в качестве средства для лечения или предупреждения заболеваний или расстройств центральной нервной системы из группы, включающей депрессии, любую форму деменции, болезнь Паркинсона и ожирение.
РИСУНКИ
|
|