|
|
(21), (22) Заявка: 2007107410/15, 25.07.2005
(24) Дата начала отсчета срока действия патента:
25.07.2005
(30) Конвенционный приоритет:
29.07.2004 EP 04291943.1
(43) Дата публикации заявки: 10.09.2008
(46) Опубликовано: 10.01.2010
(56) Список документов, цитированных в отчете о
поиске:
ЕР 1260216 А1, 27.11.2002. WO 98/30208 A1, 16.07.1998. WO 95/20947 А1, 10.08.1995. EP 0546593 A1, 16.06.1993. US 5320853 A, 14.06.1994. WO 81/01652 A, 25.06.1981. WO 03/063825 A, 07.08.2003.
(85) Дата перевода заявки PCT на национальную фазу:
28.02.2007
(86) Заявка PCT:
EP 2005/008719 20050725
(87) Публикация PCT:
WO 2006/010640 20060202
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
БРЮЭЛЬ Жан-Люк (FR),
КЮИН Ален (FR),
РОЖЕ Бенедикт (FR)
(73) Патентообладатель(и):
САНОФИ-АВЕНТИС (FR)
|
(54) ФАРМАЦЕВТИЧЕСКАЯ МНОГОСЛОЙНАЯ ТАБЛЕТКА ДЛЯ КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ АКТИВНЫХ ИНГРЕДИЕНТОВ С РАСТВОРИМОСТЬЮ, В ВЫСОКОЙ СТЕПЕНИ ЗАВИСЯЩЕЙ ОТ pH
(57) Реферат:
Настоящее изобретение относится к фармацевтической многослойной таблетке с контролируемым высвобождением, представляющей собой трехслойную таблетку. Указанная таблетка содержит один слой первого типа и два слоя второго типа. Слой первого типа содержит фармацевтически приемлемый эксципиент, образующий матрицу, и активный ингредиент с растворимостью, в высокой степени зависящей от рН. Слой второго типа содержит фармацевтически приемлемый, поддерживающий рН эксципиент, и эксципиент, образующий матрицу. Указанные два слоя второго типа являются идентичными или не являются идентичными. Новая дозированная форма в соответствии с изобретением позволяет получить постоянное значение микрорН и скорость высвобождения активного ингредиента с уменьшенной зависимостью от рН внешней среды. 14 з.п. ф-лы, 7 ил., 1 табл.
Настоящее изобретение относится к новой фармацевтической многослойной таблетке с контролируемым высвобождением для контролируемого высвобождения активных ингредиентов с растворимостью, в высокой степени зависящей от pH.
Множество активных ингредиентов при изготовлении в виде общепринятых дозированных форм с немедленным высвобождением, таблеток, капсул, драже без покрытия необходимо вводить несколько раз каждый день. В таких случаях часто является предпочтительным изготовление активного ингредиента в качестве препаративной формы с контролируемым высвобождением, так чтобы активный ингредиент высвобождался постепенно при прохождении через желудочно-кишечный тракт и, таким образом, медленно всасывался в сосудистую систему. Количество введений в сутки, таким образом, часто можно снизить от трех или четырех до двух и от двух введений до одного. Такая форма обладает дополнительным возможным преимуществом, что уровень активного ингредиента в плазме является более постоянным, чем в случае форм с немедленным высвобождением, и, таким образом, можно наблюдать снижение побочных эффектов вследствие чрезмерно высоких максимальных уровней после введения дозы и можно добиваться лучшего распределения лекарственного средства.
Специалисту в данной области доступен ряд способов для достижения такого медленного и регулярного высвобождения из дозированной формы. Высвобождение лекарственного средства может быть замедлено: (i) медленной диффузией через мембрану, покрывающую дозированную форму, или (ii) медленной диффузией через матрицу, как правило, образованную полимером или воскообразным веществом, или их сочетанием. Скорость высвобождения в случае (ii) также может быть изменена разрушением дозированной формы, как правило, матрицы таблетки, в процессе ее прохождения через желудочно-кишечный тракт. Таким образом, высвобождение активного ингредиента из такой матричной препаративной формы может происходить посредством диффузии, или разрушения поверхности, или их сочетания.
Недостатком, часто наблюдаемым в случае таблетки с матрицей в форме как гидрофильного полимера, так и липидного эксципиента, является то, что со временем скорость растворения замедляется. Высвобождение происходит либо в соответствии с профилем первого порядка, и скорость снижается экспоненциально, либо оно происходит по соотношению, впервые предложенному T. Higuchi, где количество высвобожденного вещества пропорционально квадратному корню из времени от начала высвобождения (Mechanism of Sustained-Action Medication: Theoretical Analysis of Rate of Release of Solid Drugs Dispersed in Solid Matrixes, J.Pharm.Sci.12, 1145-9, 1963). В любом случае с течением времени скорость быстро снижается, в то время как предпочтительной является постоянная скорость.
На основании способов, применяемых для обеспечения более постоянной скорости высвобождения со временем, был разработан один успешный способ, который состоит в получении таблетки с несколькими слоями. Одной из наиболее простых форм является форма, где таблетка состоит из трех слоев. Внутренний слой представляет собой гидрофильную матрицу, содержащую производное целлюлозы, и активный ингредиент. Наружные слои содержат гидрофильные полимеры. Наружные слои набухают при контакте с жидкостями желудка и кишечника и затем разрушаются. Это разрушение увеличивает обнажение поверхности внутреннего слоя, облегчая высвобождение, и компенсирует замедление высвобождения со временем, в норме наблюдаемое для матричной таблетки.
Ряд вариантов этого способа описан в US 4839177, US 5422123 и WO 98/08515. В другом способе, описанном в EP 0598309, таблетка может быть изготовлена в виде двух гидрофильных матричных дисков, содержащих активный ингредиент, разделенных способным к разрушению диском, не содержащим активный ингредиент. Наружные слои набухают с формированием матрицы, через который активный ингредиент медленно диффундирует. Разрушение центрального диска увеличивает обнаженную поверхность наружных слоев до тех пор, пока в конечном итоге таблетка не разделится на две части, с увеличением поверхности и скорости высвобождения, что также компенсирует замедление высвобождения из матричной таблетки.
Проблемы, связанные с изготовлением активных ингредиентов с растворимостью, в высокой степени зависящей от pH, в матричных таблетках являются общими и остаются в случае многослойных таблеток по причинам, разъясненным ниже.
В частности, активные ингредиенты с основными свойствами или их соли (т.е. соли оснований) обладают зависящей от pH растворимостью, т.е. низкой растворимостью при pH 7 (нейтральном), но значительно более высокой в кислых условиях желудка человека. Несмотря на то что они могут быть высокорастворимыми при кислых pH многие из них слаборастворимы или практически нерастворимы при нейтральных значениях pH.
Классическая формула, связывающая относительную растворимость активных ингредиентов, в высокой степени зависящую от pH, c одной основной группой в молекуле и pH, состоит в следующем:

где S представляет собой относительную растворимость, и S0 представляет собой растворимость непротонированного основания. Растворимость при pH 7 и pH 2 может отличаться на коэффициент 105. Кроме того, растворимость в среде с pH 5,5 может быть выше на вплоть до 2 порядков величины, чем растворимость при pH 7,5, оба значения обычно выявляются в тонком кишечнике и толстом кишечнике.
Активные ингредиенты с кислотными свойствами также могут обладать растворимостью, в высокой степени зависящей от pH. Растворимость незаряженных кислот часто низкая при низких значениях pH, ниже pKa кислоты, но она повышается при повышении значения pH выше pKa. Формула, соответствующая формуле, приведенной выше для активных ингредиентов с основными свойствами, связывает относительную растворимость активных ингредиентов с кислотными свойствами с одной кислотной группой в молекуле и pH следующим образом:
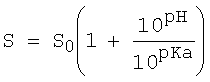
где S представляет собой относительную растворимость, и S0 представляет собой растворимость недиссоциированной кислоты.
Таким образом, скорость высвобождения из дозированной формы зависит от растворимости активного ингредиента при локальном значении pH в дозированной форме.
Поскольку для высвобождения активного ингредиента матрица таблетки должна быть проницаемой, то на локальное значение pH в дозированной форме (которое авторы настоящего изобретения называют “микроpH”) будут влиять свойства окружающей ее биологической жидкости.
Более того, активный ингредиент высвобождается из дозированной формы в биологических жидкостях желудочно-кишечного тракта человека. Из формы с контролируемым медленным высвобождением активный ингредиент может высвобождаться на протяжении большей части всей длины желудочно-кишечного тракта. Условия высвобождения сильно отличаются в зависимости от того, находится ли дозированная форма в желудке, тонком кишечнике или толстом кишечнике, и значение pH среды, окружающей дозированную форму (которое авторы настоящего изобретения называют “внешними условиями pH”), будет варьироваться от кислого до нейтрального.
Таким образом, после того как дозированная форма выходит из желудка, высвобождение активного ингредиента с основными свойствами может замедлиться или практически остановиться, и, таким образом, в таких случаях этот простой способ обеспечения контролируемого высвобождения дозированной формы включением в матрицу активного ингредиента с растворимостью, зависящей от pH, не действует. По указанным причинам многослойные таблетки типа, описанного U. Conte, L. Maggi, P. Colombo and A. La Manna, (Multi-layered hydrophilic matrixes as constant release devices (Geomatrix systems); J. Controlled Release 26:39-47 (1993)), не обеспечивают постоянной скорости высвобождения, не зависящей от pH.
По этой причине обычно при изготовлении активного ингредиента в форме с непрерывным высвобождением активный ингредиент включают в состав в форме соли, таким образом, скорость растворения остается постоянной независимо от значения pH. Однако в случае активного ингредиента с основными свойствами катионы могут диффундировать в дозированную форму с активным ингредиентом из жидкости кишечника, что приведет к тому, что микроpH в дозированной форме с активным ингредиентом повышается и свободное основание осаждается. Одним из способов решения этой проблемы и, таким образом, поддержания постоянной скорости высвобождения является добавление одной или нескольких кислот, как правило, органических кислот, или солей многоосновных органических кислот к активному ингредиенту в дозированной форме, стехиометрически в избытке по отношению к активному ингредиенту, для сохранения низкого значения pH в дозированной форме. Таким образом, значение микроpH в дозированной форме с активным ингредиентом остается постоянным и низким. Этот подход пригоден для активного ингредиента, включенного в дозированную форму как в качестве свободного основания, так и в качестве соли. Этот подход применяли для простых матричных таблеток, гидрофильных матриц (K.Ventouras and P.Buri, Role of the actification of hydrophilic matrices on the release of poorly soluble active substances in intestinal fluid, Pharm. Acta HeIv., 52, 314-320 (1978)), восковых матриц (WO 97/32584) и покрытых драже (US 5616345).
Аналогичные эффекты наблюдались в случае активного ингредиента с кислотными свойствами, изготовленного для непрерывного высвобождения. Активный ингредиент с кислотными свойствами может высвобождаться очень медленно в кислых условиях в желудке, а затем быстро после выхода из желудка. Если активный ингредиент с кислотными свойствами включен в состав в качестве соли, ионы гидрония H3O+могут диффундировать в дозированную форму из желудочного сока и вызывать кристаллизацию свободной кислоты в дозированной форме. Для поддержания значения микроpH на более высоком уровне, чем pKa активного ингредиента, в дозированную форму можно добавлять основание.
Альтернативным подходом обеспечения независимости значения микроpH в дозированной форме от внешних условий pH является изготовление активного ингредиента с кислотными свойствами в качестве свободной кислоты и включение в состав кислоты. Аналогично, активный ингредиент с основными свойствами может быть изготовлен в качестве свободного основания и эксципиента с основными свойствами, добавленного в состав. При таком подходе скорость растворения может быть значительно замедленной.
С учетом вышеизложенного, известным способом обеспечения не зависящей от pH скорости высвобождения или снижения ингибиторного эффекта повышения pH на скорость высвобождения для многослойных таблеток является добавление либо фармацевтически приемлемой кислоты, либо основания в слой, содержащий активный ингредиент либо с основными, либо с кислотными свойствами.
Однако первым недостатком всех этих подходов является то, что часто необходимо добавлять большое количество кислоты или основания для поддержания микрорН. Вторым недостатком является то, что фармацевтически активные ингредиенты часто химически несовместимы с кислотой или основанием в твердых дозированных формах.
Более конкретно, ситуации, при которых может быть сложным изготовление для контролируемого высвобождения, используя предшествующую область, активного ингредиента с кислотными или основными свойствами с растворимостью, в высокой степени зависящей от pH, представляют собой ситуации, при которых выполняется одно или несколько из следующих условий:
(i) растворимость незаряженной молекулы активного ингредиента с растворимостью, в высокой степени зависящей от pH, составляет менее 10 мг/л,
(ii) общая масса активного ингредиента с растворимостью, в высокой степени зависящей от pH, в многослойной таблетке составляет менее 20 мг,
(iii) высвобождение активного ингредиента с растворимостью, в высокой степени зависящей от pH, должно происходить на протяжении периода времени более 8 часов,
(iv) активный ингредиент с растворимостью, в высокой степени зависящей от pH, является совместимым с сильными кислотами, то есть, например, если наличие сильной кислоты приводит к деградации активного ингредиента или эксципиента для контролируемого высвобождения лекарственного средства.
Существует значительное число таких активных ингредиентов, и большая часть вновь синтезированных активных ингредиентов является высоколипофильной и, таким образом, обладает низкой растворимостью при нейтральных значениях pH. Кроме того, предпочтительно, чтобы доза активного ингредиента была низкой и чтобы в случае перорального введения активного ингредиента ее вводили один раз или максимум дважды в сутки.
Далее, неожиданно обнаружили, что новая дозированная форма может решить указанные выше проблемы достижения контролируемого высвобождения активных ингредиентов с основными или кислотными свойствами с растворимостью, в высокой степени зависящей от pH. В частности, новая дозированная форма в соответствии с этим изобретением позволяет преимущественно получить постоянное значение микроpH и скорость высвобождения с явно уменьшенной зависимостью pH внешней среды.
Таким образом, настоящее изобретение относится к фармацевтической многослойной таблетке с контролируемым высвобождением, содержащей по меньшей мере два слоя, по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, характеризующейся тем, что указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, и указанный по меньшей мере один поддерживающий pH фармацевтически приемлемый эксципиент соответственно находятся в по меньшей мере одном отдельном слое.
В соответствии с настоящим изобретением, термин “активный ингредиент с растворимостью, в высокой степени зависящей от pH”, означает любой фармацевтически активный ингредиент (с основными или кислотными свойствами) с соответствующей растворимостью в среде для растворения при pH 7 и в такой же среде для растворения, но с pH 2, которая отличается на коэффициент, равный по меньшей мере 10, более конкретно – на коэффициент, равный по меньшей мере 100.
Под термином “отдельный слой” следует понимать, что в соответствии с предпочтительным вариантом осуществления настоящего изобретения в слое(ях), содержащем по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, по существу нет фармацевтически приемлемого поддерживающего pH эксципиента (таким образом, понятно, что любой фармацевтически приемлемый поддерживающий pH эксципиент, как определено ниже, не должен находиться в количестве, превышающем 0,1% от общей массы многослойной таблетки в слое(ях), содержащем указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH) и, соответственно, что в слое(ях), содержащем по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент, по существу нет активного ингредиента с растворимостью, в высокой степени зависящей от pH (таким образом, понятно, что любой ингредиент с растворимостью, в высокой степени зависящей от pH, не должен находиться в соотношении, превышающем 0,1% от общей массы активного ингредиента с растворимостью, в высокой степени зависящей от pH, в многослойной таблетке в слое(ях), содержащем указанный по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент).
Более того, в соответствии с настоящим изобретением термин “поддерживающий pH эксципиент” означает любую кислоту, или ее кислую соль и любое основание или его основную соль, известные специалисту в данной области, или их смесь, подобранную для получения постоянного значения микроpH и скорости высвобождения с уменьшенной зависимостью от pH внешней среды. В зависимости от требуемой скорости высвобождения, поддерживающий pH эксципиент будет либо кислотным, либо основным, как разъяснено выше.
Фармацевтические композиции в соответствии с этим изобретением содержат отдельную часть с поддерживающим pH эксципиентом. Вариант осуществления в соответствии с настоящим изобретением состоит во включении поддерживающего pH эксципиента в отдельный слой или слои многослойной таблетки. Настоящее изобретение относится к многослойным таблеткам с контролируемым высвобождением, характеризующимся следующим:
– по меньшей мере первый слой содержит активный ингредиент с растворимостью, в высокой степени зависящей от pH, с одним или несколькими эксципиентами, способными образовывать нераспадающуюся набухающую и/или разрушающуюся матрицу, и, при необходимости, дополнительные эксципиенты, выступающие в качестве разбавителей, связующих веществ, смазывающих веществ, и другие вспомогательные вещества для таблеток, такие как вещества, способствующие скольжению;
– по меньшей мере второй слой, находящийся рядом с первым, содержащий один или несколько поддерживающих pH эксципиентов с эксципиентами, которые могут образовывать нераспадающуюся набухающую и/или разрушающуюся матрицу. Эксципиенты во втором слое (за исключением поддерживающего pH эксципиента) могут быть одинаковыми с эксципиентами в первом слое или отличаться от них.
Таким образом, в частности, настоящее изобретение относится к фармацевтической многослойной таблетке с контролируемым высвобождением, характеризующейся содержанием:
– по меньшей мере одного слоя первого типа, содержащего указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, и
– по меньшей мере одного слоя второго типа, находящегося рядом с указанным по меньшей мере одним слоем первого типа, содержащего указанный по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу.
Таким образом, в соответствии с вышеизложенным, настоящее изобретение, более конкретно, относится к фармацевтической многослойной таблетке с контролируемым высвобождением, содержащей по меньшей мере два слоя, по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, характеризующейся тем, что по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, и указанный по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент соответственно находятся в по меньшей мере одном отдельном слое, где указанная фармацевтическая многослойная таблетка с контролируемым высвобождением содержит:
– по меньшей мере один слой первого типа, содержащий указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, и
– по меньшей мере один слой второго типа, находящийся рядом с указанным по меньшей мере одним слоем первого типа, содержащий указанный по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу.
Как уже было указано выше, следует понимать, что в соответствии с предпочтительным вариантом осуществления настоящего изобретения в указанном по меньшей мере одном слое первого типа, содержащем указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, по существу нет фармацевтически приемлемого поддерживающего pH эксципиента (таким образом, понятно, что любой фармацевтически приемлемый поддерживающий pH эксципиент не должен находиться в количестве, превышающем 0,1% от общей массы многослойной таблетки, в указанном по меньшей мере одном слое первого типа, содержащем указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH) и, соответственно, что в указанном по меньшей мере одном слое второго типа, содержащем по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент, по существу нет активного ингредиента с растворимостью, в высокой степени зависящей от pH (таким образом, понятно, что любой активный ингредиент с растворимостью, в высокой степени зависящей от pH, не должен находиться в количестве, превышающем 0,1% от общей массы активного ингредиента с растворимостью, в высокой степени зависящей от pH, в многослойной таблетке в указанном по меньшей мере одном слое второго типа, содержащем указанный по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент).
Таким образом, в соответствии с вышеуказанным, настоящее изобретение, более конкретно, относится к фармацевтической многослойной таблетке с контролируемым высвобождением, содержащей по меньшей мере два слоя, по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, характеризующейся тем, что указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, и указанный по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент соответственно находятся в по меньшей мере одном отдельном слое, где фармацевтическая многослойная таблетка с контролируемым высвобождением содержит:
– по меньшей мере один слой первого типа, содержащий указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, и
– по меньшей мере один слой второго типа, находящийся рядом с указанным по меньшей мере одним слоем первого типа, содержащий указанный по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу,
и понятно, что в указанном по меньшей мере одном слое первого типа, содержащем указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, по существу нет фармацевтически приемлемого поддерживающего pH эксципиента и что в указанном по меньшей мере одном слое второго типа, содержащем по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент, по существу нет активного ингредиента с растворимостью, в высокой степени зависящей от pH.
Многослойные таблетки с двумя слоями: по одному из каждого из описанных выше слоев, и с тремя слоями: один, первого типа, в середине и два слоя второго типа, находящихся выше первого, являются предпочтительными. В многослойных таблетках из трех слоев два наружных слоя второго типа могут быть идентичными в композиции (качественно и/или количественно) или могут различаться между собой. Таким образом, конкретно, настоящее изобретение относится к фармацевтической многослойной таблетке с контролируемым высвобождением, характеризующейся тем, что она состоит из двухслойной таблетки, содержащей:
– один слой первого типа, содержащий указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, и
– один слой второго типа, находящийся рядом с указанным слоем первого типа, содержащий указанный по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу.
Настоящее изобретение, в частности, также относится к фармацевтической многослойной таблетке с контролируемым высвобождением, характеризующейся тем, что она состоит из трехслойной таблетки, содержащей:
– один слой первого типа, содержащий указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, и
– два слоя второго типа, находящихся рядом с указанным слоем первого типа, где каждый из них содержит по меньшей мере один фармацевтически приемлемый поддерживающий pH эксципиент и по меньшей мере один фармацевтически приемлемый образующий матрицу эксципиент, где эти два слоя второго типа в композиции являются или не являются идентичными (т.е. по качественному и количественному составу), где указанный слой первого типа находится между указанными двумя слоями второго типа.
Настоящее изобретение, в частности, также относится к фармацевтической многослойной таблетке с контролируемым высвобождением, характеризующейся тем, что она состоит из трехслойной таблетки, содержащей:
– два слоя первого типа, где каждый из них содержит указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, где эти два слоя первого типа в композиции являются или не являются одинаковыми (т.е. по качественному и количественному составу), и
– один слой второго типа, находящийся рядом с указанными двумя слоями первого типа, содержащий указанный по меньшей мере один фармацевтически приемлемый, поддерживающий pH эксципиент и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, где указанный слой второго типа находится между двумя слоями первого типа.
Указанный фармацевтически приемлемый, поддерживающий pH эксципиент может быть выбран среди всех фармацевтически приемлемых кислот, их кислых солей и их смесей, а также среди всех фармацевтически приемлемых оснований, их основных солей и их смесей, известных специалисту в данной области. Другими словами, указанный по меньшей мере один фармацевтически приемлемый, поддерживающий pH эксципиент выбран из группы, состоящей из фармацевтически приемлемых кислот, их кислых солей и их смесей, или из группы, состоящей из фармацевтически приемлемых оснований, их основных солей и их смесей.
В частности, если указанный поддерживающий pH эксципиент представляет собой по меньшей мере одну фармацевтически приемлемую кислоту, ее кислую соль или их смесь, то его выбирают из группы, состоящей из органических кислот, многоосновных органических кислот, неорганических кислот, их кислых солей и их смесей, и если указанный поддерживающий pH эксципиент представляет собой по меньшей мере одно фармацевтически приемлемое основание, его основную соль или их смесь, то его выбирают из группы, состоящей из органических оснований, неорганических оснований, их основных солей, основных солей органических многоосновных кислот и их смесей.
Более конкретно, если указанный по меньшей мере один фармацевтически приемлемый, поддерживающий pH эксципиент представляет собой фармацевтически приемлемую кислоту, его кислую соль или их смесь, то он обладает pKa менее 6,5, и если указанный по меньшей мере один фармацевтически приемлемый, поддерживающий pH эксципиент представляет собой фармацевтически приемлемое основание, его основную соль или их смесь, то сопряженная с ним кислота обладает pKa более 7,5.
Более конкретно, если указанный поддерживающий pH эксципиент представляет собой по меньшей мере одну фармацевтически приемлемую кислоту или ее кислую соль, то его выбирают из группы, состоящей из виннокаменной кислоты, лимонной кислоты, янтарной кислоты, фумаровой кислоты, яблочной кислоты, малоновой кислоты, адипиновой кислоты, глюконовой кислоты, их кислых солей, кислых солей фосфорной кислоты и их смесей, и если указанный поддерживающий pH эксципиент представляет собой по меньшей мере одно фармацевтически приемлемое основание или его основную соль, то его выбирают из группы, состоящей из тринатрийфосфата, трикалийфосфата, карбоната кальция, основных солей пирофосфорной кислоты, карбоната натрия, карбоната магния, оксида магния, алюмосиликата магния и их смесей.
Новая дозированная форма в соответствии с настоящим изобретением делает возможным использование избытка поддерживающего pH эксципиента, находящегося в количестве по меньшей мере 10% от общей массы таблетки, и физическое разделение поддерживающего pH эксципиента и активного ингредиента в процессе изготовления и хранения, вплоть до момента приема внутрь.
В частности, содержание указанного по меньшей мере одного поддерживающего pH эксципиента составляет между 5 и 50% и, более конкретно, между 8 и 25% от общей массы многослойной таблетки.
В соответствии с настоящим изобретением, термин “фармацевтически приемлемый эксципиент, образующий матрицу,” означает любой фармацевтически приемлемый эксципиент, способный образовывать нераспадающуюся, ненабухающую и/или неразрушающую матрицу в таблетке с матрицей, как хорошо известно специалисту в данной области.
В частности, указанный по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, выбран из группы, состоящей из гидрофильных полимеров, амфифильных полимеров, липидных эксципиентов и их смесей.
Более конкретно, указанный по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, выбран из группы, состоящей из гидроксипропилметилцеллюлозы (или “гипромеллозы”), гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, метилцеллюлозы, этилцеллюлозы, полиметакрилатов (включая сополимеры метакрилата), полиоксиэтилена, полиакриловой кислоты, поливинилацетата, сополимера полиоксиэтилена и полиоксипропилена, гидрогенизированного касторового масла, карнаубского воска и их смесей.
В соответствии с настоящим изобретением, указанный по меньшей мере один фармацевтически приемлемый, образующий матрицу эксципиент может быть одинаковым или отличаться в каждом из слоев первого и второго типа в многослойной таблетке.
В качестве возможного технического преимущества настоящего изобретения можно применять фармацевтически приемлемый эксципиент, образующий матрицу, который является нестабильным и/или несовместимым с кислотами в слое(ях), содержащем активный ингредиент с растворимостью, в высокой степени зависящей от pH. Действительно, определенные эксципиенты, образующие матрицу, используемые для контролируемого высвобождения активного ингредиента, являются нестабильными по отношению к кислоте, и, таким образом, профиль высвобождения может изменяться на протяжении периода времени, когда таблетка, содержащая такое образующее матрицу вещество, оказывается в контакте с кислотой. В частности, вследствие катализируемого кислотой гидролиза полимерного эксципиента, образующего матрицу, до более низкомолекулярных фрагментов профиль высвобождения лекарственного средства может стать более быстрым, и высвобождение лекарственного средства в дозированной форме лекарственного средства далее может стать неконтролируемым. Примерами образующих матрицу веществ, не стабильных по отношению к кислотам, являются производные целлюлозы, в частности гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, метилцеллюлоза и этилцеллюлоза.
Таким образом, в качестве конкретного варианта осуществления настоящего изобретения, указанный по меньшей мере один фармацевтически приемлемый, образующий матрицу эксципиент указанного слоя первого типа выбран из группы, состоящей из гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, метилцеллюлозы, этилцеллюлозы, полиметакрилатов, полиоксиэтилена, поливинилацетата, полиакриловой кислоты, сополимера полиоксиэтилена и полиоксипропилена, гидрогенизированного касторового масла, карнаубского воска и их смесей, и указанный по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу указанного слоя второго типа, выбран из группы, состоящей из полиметакрилатов (включая сополимеры метакрилата), полиоксиэтилена, поливинилацетата, полиакриловой кислоты, сополимера полиоксиэтилена и полиоксипропилена, гидрогенизированного касторового масла, карнаубского воска и их смесей.
Безусловно, как хорошо известно специалисту в данной области, многослойная таблетка по настоящему изобретению может дополнительно содержать по меньшей мере один фармацевтически приемлемый эксципиент, выбранный из группы, состоящей из разбавителей, связующих веществ, веществ для образования водных каналов, смазывающих веществ, веществ, способствующих скольжению, и их смесей. Примеры таких возможных дополнительных эксципиентов представлены в следующей таблице.
| Таблица 1 |
| Функция эксципиента |
Возможные эксципиенты для слоев первого и второго типа |
| Разбавители |
лактоза, маннит, микрокристаллическая целлюлоза, гидрофосфат кальция, трикальцийфосфат, прежелатинизированный крахмал, сшитый крахмал |
| Связующие вещества |
гидроксипропилметилцеллюлоза, метилцеллюлоза, повидон, поливиниловый спирт |
| Вещества для образования водных каналов |
кросповидон, карбоксиметилцеллюлоза натрия, натрия крахмала гликолят |
| Смазывающие вещества и вещества, способствующие скольжению |
стеариновая кислота и ее соли щелочных металлов, стеарилфумарат натрия, глицерил бегенат, коллоидный диоксид кремния, тальк |
Как будет понятно специалисту в данной области, каждый слой многослойной таблетки в соответствии с настоящим изобретением может содержать один или несколько таких приведенных выше дополнительных эксципиентов. Для получения желательного профиля высвобождения в испытании на растворимость эти и другие эксципиенты с такими же или дополнительными функциями можно объединять вместе, как будет известно специалисту в данной области.
В соответствии с настоящим изобретением, указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, представляет собой активный ингредиент с основными или кислотными свойствами.
В частности, указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, обладает по меньшей мере одним из следующих свойств:
(i) растворимость незаряженной молекулы активного ингредиента с растворимостью, в высокой степени зависящей от pH, составляет менее 10 мг/л,
(ii) общая масса активного ингредиента с растворимостью, в высокой степени зависящей от pH, в многослойной таблетке составляет менее 20 мг,
(iii) высвобождение активного ингредиента с растворимостью, в высокой степени зависящей от pH, должно происходить в течение периода времени более 8 часов,
(iv) активный ингредиент с растворимостью, в высокой степени зависящей от pH, является несовместимым с сильными кислотами, то есть, например, присутствие сильной кислоты приводит к деградации активного ингредиента или эксципиента для контролируемого высвобождения лекарственного средства.
Более конкретно, указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от pH, выбран из группы, состоящей из N-[2-[[(4-аминокарбонил)пиримидин-2-ил]амино]этил]-2-[[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил]пропил]амино]пиримидин-4-карбоксимида, 5-(8-амино-7-хлор-2,3-дигидро-1,4-бензодиоксин-5-ил)3-[1-(2-фенилэтил)пиперидин-4-ил]-1,3,4-оксадиазол-2(3H)-она, гидрохлоридной соли, 7-фтор-2-оксо-4-[2-[4(тиено[3,2-c]пиридин-4-ил)пиперазин-1-ил]этил]-1,2-дигидрохинолин-1-ацетамида, клопидогрела, мизоластина, правастатина, напроксена, ацетилсалициловой кислоты, диклофенака, золпидема и их солей.
В соответствии с настоящим изобретением, содержание указанного активного ингредиента с растворимостью, в высокой степени зависящей от pH, составляет между 0,1 и 30%, более конкретно, между 0,5 и 15% от общей массы многослойной таблетки. Многослойная таблетка в соответствии с настоящим изобретением, таким образом, может содержать, например, от 0,1 до 100 мг активного ингредиента с растворимостью, в высокой степени зависящей от pH.
Многослойная таблетка в соответствии с настоящим изобретением может быть получена следующими ниже способами, хорошо известными специалисту в данной области. Например, она может быть получена двумя стадиями: сначала изготавливают разные порошки, соответствующие композиции слоев первого или второго типа, как описано выше, и прессуют с получением многослойной таблетки. Порошки могут представлять собой простые смеси, и таблетка может быть сформирована непосредственным прессованием. Альтернативно, смесь эксципиентов для слоя первого или второго типа может быть гранулированной в соответствии с одним из способов или другими способами гранулирования, широко известными специалисту в области фармацевтических составов: гранулированием с помощью воды или другой жидкости, сухим гранулированием, гранулированием расплавлением.
Для обеспечения контролируемой скорости высвобождения такие грануляты в конце могут быть покрыты защитным полимерным или липидным покрытием, выбранным из этилцеллюлозы, полиметакрилатов, полиакриловой кислоты, гидрогенизированного касторового масла, карнаубского воска.
После получения двух типов порошков гранулированием или простым смешиванием их прессуют в устройстве для изготовления многослойных таблеток с получением разделенных на слои таблеток, состоящих из двух или более слоев.
На фигурах 1-7 в виде сплошной линии (закрашенные черные квадраты или закрашенные черные круги) представлено растворение в 0,01 M хлористоводородной кислоты (pH 2), и пунктирной линией (пустые квадраты или пустые круги) представлено растворение в 0,006 M буфера на основе фосфата калия (pH 6,8).
На фигуре 1 представлено процентное содержание растворенного активного ингредиента с растворимостью, в высокой степени зависящей от pH, в таблетке, описанной в примере 2, как функция времени.
На фигуре 2 представлено процентное содержание растворенного активного ингредиента с растворимостью, в высокой степени зависящей от pH, в таблетке, описанной в примере 3, как функция времени.
На фигуре 3 представлено процентное содержание растворенного активного ингредиента с растворимостью, в высокой степени зависящей от pH, в таблетке, описанной в примере 4, как функция времени.
На фигуре 4 представлено процентное содержание растворенного активного ингредиента с растворимостью, в высокой степени зависящей от pH, в таблетке, описанной в сравнительном примере 1, как функция времени.
На фигуре 5 представлено процентное содержание растворенного активного ингредиента с растворимостью, в высокой степени зависящей от pH, в таблетке, описанной в примере 5, как функция времени.
На фигуре 6 представлено процентное содержание растворенного активного ингредиента с растворимостью, в высокой степени зависящей от pH, в таблетке, описанной в сравнительном примере 2, как функция времени.
На фигуре 7 представлено процентное содержание растворенного активного ингредиента с растворимостью, в высокой степени зависящей от pH, в таблетке, описанной в примере 6, как функция времени.
Следующие ниже примеры предназначены для иллюстрации настоящего изобретения, и, таким образом, их не следует истолковывать, как ограничивающие объем настоящего изобретения.
Среди следующих ниже примеров некоторые были проведены с активным ингредиентом, описанным в примере 1 EP 577470, с химическим названием N-[2-[[4-аминокарбонил)пиримидин-2-ил]амино]этил]-2-[[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил]пропил]амино]пиримидин-4-карбоксимид, в форме его соли с метансульфонатом, пригодным для лечения доброкачественной гиперплазии простаты, в дальнейшем в данном документе называемым “лекарственное средство 1”.
Пример 1. Гранулят, содержащий лекарственное средство 1 и гидроксипропилметилцеллюлозу
Гранулят A получали из указанной ниже смеси (за исключением стеарата магния и аэросила) водным гранулированием с использованием смесителя-гранулятора Hobart. Гранулят затем сушили в печи при 50°C, отбирали по величине 0,8 мм, затем вводили смазку смешиванием с остальными составляющими.
| Лекарственное средство 1 |
11,6% |
| Гидроксипропилметилцеллюлоза (Methocel® K100M) |
10,0% |
| Маннит 60 |
20,0% |
| Микрокристаллическая целлюлоза (Avicel® PH101) |
54,0% |
| Повидон K29/32 |
3,2% |
| Коллоидный диоксид кремния (Aerosil® 200) |
0,2% |
| Стеарат магния |
1,0% |
 |
100,0% |
Пример 2. Трехслойная таблетка с янтарной кислотой в наружных слоях
Получали гранулят B, содержащий янтарную кислоту, как следует ниже. Способ был аналогичным способу по примеру 1.
| Гидроксипропилметилцеллюлоза (Methocel® K100M) |
35,0% |
| Лактоза 150M |
24,5% |
| Микрокристаллическая целлюлоза (Avicel® PH101) |
13,9% |
| Янтарная кислота |
20,0% |
| Повидон K29/32 |
5,0% |
| Оксид железа (желтый) |
0,4% |
| Коллоидный диоксид кремния (Aerosil® 200) |
0,2% |
| Стеарат магния |
1,0% |
 |
100% |
Трехслойные таблетки изготавливали с гранулятом A по примеру 1 в качестве внутреннего слоя с дозировкой 11,6 мг лекарственного средства 1 и с указанным выше гранулятом B, содержащим кислоту, для двух наружных слоев. Каждый слой содержал 100 мг гранулята. Прессование проводили с использованием альтернативного устройства для изготовления таблеток Frogerais A0 с использованием прессов размера 8R16. Каждый слой (100 мг для каждого слоя) наполняли вручную. Затем с использованием следующего ниже способа анализировали растворимость in vitro при pH 2 и pH 6,8.
Использовали устройство, описанное в European Pharmacopoeia. Проводили перемешивание с помощью лопастной мешалки (100 об/мин). С помощью перистальтического насоса постоянно проводили забор образцов среды для растворения и измеряли поглощение в УФ области с использованием двулучевого УФ спектрофотометра. Процентное содержание растворенного лекарственного средства 1 в каждый момент времени проведения измерения определяли сравнением с поглощением стандартного раствора с 11,6 мкг·мл-1 лекарственного средства 1 в среде для растворения. Среда для растворения представляла собой 500 мл 0,01 M хлористоводородной кислоты или 500 мл буфера на основе фосфата калия, pH 6,8, 0,006 M. Результаты представлены на фигуре 1.
Пример 3. Трехслойная таблетка с виннокаменной кислотой в наружных слоях
Гранулят C получали в точном соответствии со способом для гранулята B по примеру 2 и с таким же составом, за исключением того, что вместо янтарной кислоты использовали виннокаменную кислоту. Трехслойные таблетки с использованием гранулята A, содержащего лекарственное средство 1, для внутреннего слоя и гранулята C (с виннокаменной кислотой) для наружных слоев получали в соответствии с примером 2. Затем анализировали их растворимость in vitro при pH 2 и pH 6,8 с использованием способа растворения, как в примере 2.
Результаты представлены на фигуре 2.
Пример 4. Трехслойная таблетка с фумаровой кислотой в наружных слоях
Гранулят D получали в точном соответствии со способом для гранулята B по примеру 2 и с таким же составом, за исключением того, что вместо янтарной кислоты использовали фумаровую кислоту. Трехслойные таблетки с использованием гранулята A, содержащего лекарственное средство 1, для внутреннего слоя и гранулята D (содержащего фумаровую кислоту) для наружных слоев получали в соответствии с примером 2. Затем анализировали их растворимость in vitro при pH 2 и pH 6,8 с использованием способа растворения по примеру 2, за исключением того, что результаты корректировали с учетом поглощений в УФ области для фумаровой кислоты вычитанием профиля, полученного для растворения таблетки плацебо. Результаты представлены на фигуре 3.
Сравнительный пример 1. Трехслойная таблетка без кислоты
Гранулят E получали в точном соответствии со способом для гранулята B по примеру 2 со следующим составом:
| Гидроксипропилметилцеллюлоза (Methocel® K100M) |
35,0% |
| Лактоза 150M |
34,5% |
| Микрокристаллическая целлюлоза (Avicel® PH101) |
23,9% |
| Повидон K29/32 |
5,0% |
| Оксид железа (желтый) |
0,4% |
| Коллоидный диоксид кремния (Aerosil® 200) |
0,2% |
| Стеарат магния |
1,0% |
 |
100% |
Трехслойные таблетки с использованием гранулята A, содержащие лекарственное средство 1, для внутреннего слоя и гранулят E (без кислоты) для наружных слоев получали в соответствии с примером 2. Затем анализировали их растворимость in vitro при pH 2 и pH 6,8 с использованием способа растворения по примеру 2. Результаты представлены на фигуре 4: можно видеть, что при pH 2 растворимость очень сходна с растворимостью таблетки, содержащей кислоту (пример 2, фигура 1), но значительно замедлена при нейтральных значениях pH.
Эти примеры показывают, что для получения профилей растворимости, где скорость имеет свойство быть постоянной независимо от значения pH среды для растворения, для многослойных таблеток подбирают различные кислоты в качестве поддерживающего pH эксципиента.
Исследование стабильности показало улучшенные результаты для таблетки из приведенного выше примера 2 по сравнению с однослойной таблеткой, т.е. таблеткой, содержащей указанное лекарственное средство 1 и янтарную кислоту в одном и том же едином слое. В частности, для таблетки по примеру 2 не показано никакого неприемлемого желтого окрашивания через 13 недель хранения, как в случае с однослойной таблеткой, как полагают, вследствие проблемы в совместимости между лекарственным средством 1 и янтарной кислотой.
Пример 5. Трехслойная таблетка с двумя наружными слоями, содержащими виннокаменную кислоту, и внутренним слоем, содержащим тартрат золпидема
Гранулят G, не содержащий активный ингредиент, но содержащий гипромеллозу и виннокаменную кислоту, получали с использованием процесса, как для гранулята B по примеру 2, в соответствии с составом:
| Виннокаменная кислота |
12,0% |
| Гидроксипропилметилцеллюлоза (или “гипромеллоза”; Metholose®90SH4000SR) |
28,0% |
| Лактоза калибра 150 |
38,8% |
| Микрокристаллическая целлюлоза (Avicel® PH101) |
20,0% |
| Коллоидный диоксид кремния (Aerosil® 200) |
0,2% |
| Стеарат магния |
1,0% |
 |
100% |
Гранулят H, содержащий тартрат золпидема, получали таким же процессом, в соответствии с составом:
| Тартрат золпидема |
5,0% |
Гидроксипропилметилцеллюлоза
(или “гипромеллоза”; Metholose®90SH4000SR) |
12,0% |
| Лактоза калибра 150 |
61,8% |
| Микрокристаллическая целлюлоза (Avicel® PH101) |
20,0% |
| Коллоидный диоксид кремния (Aerosil® 200) |
0,2% |
| Стеарат магния |
1,0% |
 |
100% |
Трехслойные таблетки с использованием гранулята H для внутреннего слоя и гранулята G для наружных слоев получали в соответствии с примером 2. Затем анализировали их растворимость in vitro при pH 2 и pH 6,8 с использованием следующего ниже способа.
Использовали устройство, описанное в European Pharmacopoeia. Перемешивание проводили с помощью лопастной мешалки (100 об/мин). С помощью перистальтического насоса постоянно проводили забор образцов и измеряли поглощение в УФ области с помощью УФ спектрофотометра. Процентное содержание растворенного тартрата золпидема в каждый момент времени проведения измерений определяли сравнением с поглощением для стандартного раствора с 10,0 мкг·мл-1 тартрата золпидема в среде для растворения. Среда для растворения представляла собой 500 мл 0,01 M хлористоводородной кислоты или 500 мл буфера на основе фосфата калия, pH 6,8, 0,015 M. Результаты представлены на фигуре 5.
Сравнительный пример 2. Трехслойная таблетка с двумя наружными слоями без кислоты и внутренним слоем, содержащим тартрат золпидема
Гранулят I, содержащий гипромеллозу, но не содержащий ни активного вещества, ни кислоты, получали способом, как в случае гранулята B по примеру 2, в соответствии с составом:
Гидроксипропилметилцеллюлоза
(или “гипромеллоза”; Metholose®90SH4000SR) |
28,0% |
| Лактоза калибра 150 |
50,8% |
| Микрокристаллическая целлюлоза (Avicel® PH101) |
20,0% |
| Коллоидный диоксид кремния (Aerosil® 200) |
0,2% |
| Стеарат магния |
1,0% |
 |
100% |
Трехслойные таблетки с использованием гранулята H, содержащего тартрат золпидема, для внутреннего слоя и гранулята I (без кислоты) для наружных слоев получали в соответствии с примером 2. Затем анализировали их растворимость in vitro при pH 2 и pH 6,8 с использованием способа растворения, как в примере 4. Результаты представлены на фигуре 6.
Пример 6. Двухслойная таблетка со слоем, содержащим виннокаменную кислоту и coполимер метакрилата, и со вторым слоем, содержащим тартрат золпидема
Гранулят J, не содержащий активного ингредиента, но содержащий виннокаменную кислоту и сополимер метакрилата, получали способом, как в случае гранулята B по примеру 2, в соответствии с составом:
| Виннокаменная кислота |
12,0% |
| Сополимер метакрилата (Eudragit NE40D) |
12,0% |
| Лактоза калибра 150 |
54,8% |
| Микрокристаллическая целлюлоза (Avicel® PH101) |
20,0% |
| Коллоидный диоксид кремния (Aerosil® 200) |
0,2% |
| Стеарат магния |
1,0% |
 |
100% |
Гранулят K, содержащий тартрат золпидема и гипромеллозу, получали способом, как в случае гранулята A, в соответствии с составом:
| Тартрат золпидема |
5,0% |
Гидроксипропилметилцеллюлоза
(или “гипромеллоза”; Metholose®90SH4000SR) |
28,0% |
| Лактоза калибра 150 |
45,8% |
| Микрокристаллическая целлюлоза (Avicel® PH101) |
20,0% |
| Коллоидный диоксид кремния (Aerosil® 200) |
0,2% |
| Стеарат магния |
1,0% |
 |
100% |
Двухслойные таблетки с использованием гранулята K, содержащего продукт для первого слоя, и гранулята J для второго слоя получали в соответствии с примером 2. Затем анализировали их растворимость in vitro при pH 2 и pH 6,8 с использованием способа растворения, как в примере 5. Результаты представлены на фигуре 7.
Формула изобретения
1. Фармацевтическая многослойная таблетка с контролируемым высвобождением, состоящая из трехслойной таблетки, содержащей:
один слой первого типа, содержащий по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, и по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от рН, который является основным или кислотным активным ингредиентом, имеющим соответствующие растворимости в среде растворения при рН 7 и в такой же среде растворения при рН 2, которая отличается на коэффициент по меньшей мере 10;
два слоя второго типа, расположенных рядом с указанным слоем первого типа, каждый содержащий указанный по меньшей мере один фармацевтически приемлемый, поддерживающий рН эксципиент и по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, указанные два слоя второго типа являются идентичными или не являются идентичными в композиции;
по существу не содержит фармацевтически приемлемого поддерживающего рН эксципиента в слое, содержащем указанный по меньшей мере один активный ингредиент и по существу не содержит активного ингредиента с растворимостью зависящей в высокой степени от рН в слоях, содержащих по меньшей мере один фармацевтически приемлемый поддерживающий рН эксципиент;
где указанный слой первого типа расположен между указанными слоями второго типа и содержание указанного, по меньшей мере, поддерживающего рН эксципиента составляет от 5 до 50 мас.%, более конкретно от 8 до 25% от общей массы многослойной таблетки, или указанный слой второго типа расположен между указанными двумя слоями первого типа.
2. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что указанный по меньшей мере один фармацевтически приемлемый, поддерживающий рН эксципиент выбран из группы, состоящей из фармацевтически приемлемых кислот, их кислых солей и их смесей, или из группы, состоящей из фармацевтически приемлемых оснований, их основных солей и их смесей.
3. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что указанный по меньшей мере один фармацевтически приемлемый, поддерживающий рН эксципиент выбран из группы, состоящей из органических кислот, многоосновных органических кислот, неорганических кислот, их кислых солей и их смесей, или из группы, состоящей из органических оснований, неорганических оснований, их основных солей, основных солей органических многоосновных кислот, основных солей органических многоосновных кислот и их смесей.
4. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что если указанный по меньшей мере один фармацевтически приемлемый, поддерживающий рН эксципиент представляет собой фармацевтически приемлемую кислоту, ее кислую соль или их смесь, то они обладают рКа менее 6,5, и, если указанный по меньшей мере один фармацевтически приемлемый, поддерживающий рН эксципиент представляет собой фармацевтически приемлемое основание, его основную соль или их смесь, то сопряженная с ними кислота обладает рКа более 7,5.
5. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что указанный по меньшей мере один фармацевтически приемлемый, поддерживающий рН эксципиент выбран из группы, состоящей из винной кислоты, лимонной кислоты, янтарной кислоты, фумаровой кислоты, адипиновой кислоты, яблочной кислоты, малоновой кислоты, глюконовой кислоты, их кислых солей, кислых солей фосфорной кислоты, и их смесей, или из группы, состоящей из фосфата натрия, фосфата калия, карбоната кальция, основных солей пирофосфорной кислоты, карбоната натрия, карбоната магния, оксида магния, алюмосиликата магния и их смесей.
6. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что содержание указанного по меньшей мере одного фармацевтически приемлемого, поддерживающего рН эксципиента составляет от 5 до 50% от общей массы многослойной таблетки.
7. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что указанный по меньшей мере один фармацевтически приемлемый, образующий матрицу эксципиент выбран из группы, состоящей из гидрофильных полимеров, амфифильных полимеров, липидных эксципиентов и их смесей.
8. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.7, отличающаяся тем, что указанный по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, выбран из группы, состоящей из гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, метилцеллюлозы, этилцеллюлозы, полиметакрилатов, полиоксиэтилена, полиакриловой кислоты, поливинилацетата, сополимера полиоксиэтилена и полиоксипропилена, гидрогенизированного касторового масла, карнаубского воска и их смесей.
9. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что указанный по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, может быть одинаковым или различным в каждом слое первого и второго типа.
10. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что указанный по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, указанного слоя первого типа, выбран из группы, состоящей из гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, метилцеллюлозы, этилцеллюлозы, полиметакрилатов, полиоксиэтилена, поливинилацетата, полиакриловой кислоты, сополимера полиоксиэтилена и полиоксипропилена, гидрогенизированного касторового масла, карнаубского воска и их смесей, и указанный по меньшей мере один фармацевтически приемлемый эксципиент, образующий матрицу, указанного слоя второго типа выбран из группы, состоящей из полиметакрилатов, полиоксиэтилена, поливинилацетата, полиакриловой кислоты, сополимера полиоксиэтилена и полиоксипропилена, гидрогенизированного касторового масла, карнаубского воска и их смесей.
11. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что она дополнительно содержит по меньшей мере один фармацевтически приемлемый эксципиент, выбранный из группы, состоящей из разбавителей, связующих веществ, веществ, образующих водные каналы, смазывающих веществ, веществ, способствующих скольжению, и их смесей.
12. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от рН, обладает по меньшей мере одним из следующих свойств: (i) растворимость незаряженной молекулы активного ингредиента с растворимостью, в высокой степени зависящей от рН, составляет менее 10 мг/л,
(ii) общая масса активного ингредиента с растворимостью, в высокой степени зависящей от рН, в многослойной таблетке составляет менее 20 мг,
(iii) высвобождение активного ингредиента с растворимостью, в высокой степени зависящей от рН, должно происходить на протяжении периода времени более 8 ч,
(iv) активный ингредиент с растворимостью, в высокой степени зависящей от рН, является совместимым с сильными кислотами.
13. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что указанный по меньшей мере один активный ингредиент с растворимостью, в высокой степени зависящей от рН, выбран из группы, состоящей из N-[2-[[(4-аминокарбонил)пиримидин-2-ил] амино]этил]-2-[[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил]пропил]амино]пиримидин-4-карбоксимида, 5-(8-амино-7-хлор-2,3-дигидро-1,4-бензодиоксин-5-ил)-3-[1-(2-фенилэтил)пиперидин-4-ил]-1,3,4-оксадиазол-2(3Н)-она, гидрохлоридной соли, 7-фтор-2-оксо-4-[2-[4(тиено[3,2-с]пиридин-4-ил)пиперазин-1-ил]этил]-1,2-дигидрохинолин-1 -ацетамида, клопидогрела, мизоластина, правастатина, напроксена, ацетилсалициловой кислоты, диклофенака, золпидема и их солей.
14. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что содержание указанного по меньшей мере одного активного ингредиента с растворимостью, в высокой степени зависящей от рН, составляет от 0,1 до 30% от общей массы многослойной таблетки.
15. Фармацевтическая многослойная таблетка с контролируемым высвобождением по п.1, отличающаяся тем, что содержание указанного поддерживающего рН эксципиента составляет от 5 до 50 мас.%, более конкретно от 8 до 25 мас.% от общей массы многослойной таблетки.
РИСУНКИ
|
|