Патент на изобретение №2376985
|
||||||||||||||||||||||||||
(54) СРЕДСТВО ДЛЯ АКТИВАЦИИ СТВОЛОВЫХ КЛЕТОК
(57) Реферат:
Изобретение относится к лекарственным средствам и касается средства для активации стволовых клеток, содержащего активное начало химического происхождения и раствор хлорида натрия для инъекций, отличающегося тем, что в качестве активного начала оно содержит формальдегид при следующем соотношении компонентов, мас.%: формальдегид 0,00003-0,004, раствор хлорида натрия для инъекций 0,85-0,95% концентрации – остальное. Изобретение направлено на создание нетоксичного и не обладающего побочным действием средства для активации собственных стволовых клеток организма. 3 табл.
Изобретение относится к медицине, в частности лекарственным препаратам, направленным на активацию собственных стволовых клеток. Стволовые клетки человека используются в современной медицине при лечении многих заболеваний, в частности онкологических, кардиологических и ряда других. Стволовые клетки могут быть получены из костного мозга, а также из пуповинной и периферической крови и из эмбриональных тканей. Стволовые клетки подразделяются на мезенхимальные (они способны дифференцироваться в клетки тканей мезодермального происхождения), гематопоэтические (предшественники клеток крови), нейрональные (предшественники клеток нервной системы) и другие. Мезенхимальные стволовые клетки (МСК) часто используют в роли трансплантата, т.к. они активизируют собственные резервы организма, способствуют образованию цитокинов и факторов роста; МСК являются предшественниками остеобластов и способствуют формированию ремоделирующих единиц. В практике клеточной терапии широко распространены и применяются средства активации стволовых клеток, основанные на привнесении в организм новых стволовых клеток, а не на активации собственных. В частности, известно средство для активации стволовых клеток на основе гликопротеина (патент РФ Однако средство не активизирует собственные стволовые клетки. Процесс получения данного препарата длителен, требует больших трудозатрат. Известно также средство для активации стволовых клеток (препарат Филгастрим (Нейпоген) фирмы F.Hoffman-la Roshe), представляющее собой гликопротеин, состоящий из 175 аминокислот и имеющий молекулярную массу 187-189 кДа, полученный экспрессией человеческого гена 5gdl-g31 в геном E.coli. Средство содержит дополнительную аминокислоту – метионин. Филгастрим укорачивает время созревания нейтрофилов из клеток-предшественников с 5 до 1 дня, ускоряет выход зрелых нейтрофилов из костного мозга в кровь (В.Lord et al. Proc. of the National Academy of Sci. of USA, 1992, 86, p.9499-9503), усиливает хемотаксис нейтрофилов (S.P.Colgan et al, Experim.Hematology, 1992, 20, p.1229-1234). Его применяют при стандартной цитостатической химиотерапии, пересадке костного мозга, для мобилизации природного колониестимулирующего фактора, при хронических нейтропениях, для ускорения заживления ран и т.д. Однако применение Филгастрима вызывает осложнения: боли в костях, увеличение селезенки, кожные реакции и т.д. Кроме того, стоимость курса лечения Филгастримом достаточно высока и составляет 1500-3000 долларов США. Наиболее близким к заявляемому является препарат бортезомид (см. www.rlsnet.ru/mnn_bortezomib.html), представляющий собой модифицированную борную кислоту – обратимый высокоселективный ингибитор активности протеасомы 26S, присутствующей в ядре и цитозоле всех эукариотических клеток и катализирующей расщепление основных белков, участвующих в жизненном цикле клеток. Химическое название – [(1R)-3-Метил-1[[(2S)-1-оксо-3-фенил-2-[(пиразинилкарбонил)амино]пропил]амино]бутил], брутто-формула: C19H25BN4O4. In vivo бортезомид вызывает замедление роста многих экспериментальных моделей человеческих опухолей, включая множественную миелому. Препарат разводят 0,9% раствором NaCl до концентрации 1 мг/мл, вводят внутривенно. Основное назначение препарата – множественная миелома. Установлено также (cм.www.sciencedaily.com/releases/2008/01/080124173809. htm), что бортезомид уменьшает разрушение костной ткани, увеличивает активность остеобластов и формирование кости, оказывает прямое медикаментозное воздействие на мезенхимальные стволовые клетки. Таким образом, данный препарат активирует стволовые клетки, находящиеся в организме, усиливая его репаративные способности, в отличие от распространенной и широко применяемой на практике клеточной терапии, основанной на привнесении в организм новых стволовых клеток. Основным недостатком данного препарата является его высокая токсичность и множество побочных эффектов: со стороны органов кроветворения (тромбоцитопения, анемия), со стороны пищеварительной системы (тошнота, рвота, непроходимость кишечника, острый панкреатит, гепатит), со стороны нервной системы (головная боль, потеря сознания, нарушение функций вегетативной нервной системы, судороги), со стороны сердечно-сосудистой системы (снижение артериального давления, застойная сердечная недостаточность) и т.д. Изобретение направлено на решение задачи создания нетоксичного и не обладающего побочным действием средства для активации собственных стволовых клеток организма. Для решения поставленной задачи средство для активации стволовых клеток, содержащее активное начало химического происхождения и раствор хлорида натрия для инъекций, согласно изобретению содержит в качестве активного начала формальдегид при следующем соотношении компонентов, мас.%:
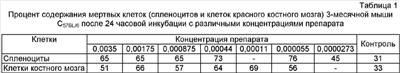
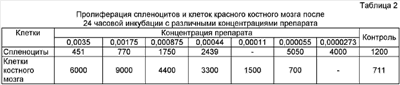
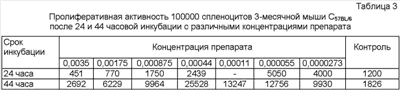
В известных авторам источниках патентной и научно-технической информации не описано нетоксичного и не обладающего побочными действиями средства для активации стволовых клеток организма, основанного не на привнесении стволовых клеток в организм, а на воздействии на собственные клетки организма, а именно на клетки селезенки и красного костного мозга. Известно иммуномодулирующее средство, содержащее формальдегид и хлорид натрия (см. патент РФ Однако данный препарат не активизирует стволовые клетки, а обладает только иммуномодулирующим действием. Авторами впервые выявлено действие препарата в данных концентрациях (0,00003-0,004 мас.%) усиливать аэробные процессы окисления, что, в свою очередь, ограничивает его действие на нормальные клетки и приводит к гибели онкологических клеток. Сказанное позволяет сделать вывод о наличии в заявляемом изобретении «изобретательского уровня». Водный раствор формальдегида – прозрачная бесцветная жидкость со своеобразным острым запахом, смешивающаяся с водой и спиртом во всех соотношениях. Формальдегид – представитель класса альдегидов НСОН. Представляет собой бесцветный газ с резким запахом, мол. массой 30,03, плотность его при 20°С равна 0,815, температура плавления 92°С, температура кипения 19,2°С. Хорошо растворим в воде, спирте. Легко полимеризуется, образуя при полимеризации в водной среде – параформальдегид, а в безводных средах (бутане, гексане) – полиоксиметилен. Изотонический раствор натрия хлорида для инъекций – бесцветная прозрачная жидкость солоноватого вкуса. Раствор стерилен, апирогенен. Хлорид натрия – кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Растворим в воде (1:3). Заявляемое средство представляет собой прозрачную бесцветную жидкость без запаха слегка солоноватого вкуса. Средство готовят следующим образом. Берут 37-40%-ный медицинский раствор формальдегида, добавляют его в стерильный 0,9-0,95%-ный раствор хлорида натрия для инъекций до получения 0,00003-0,003%-ного раствора формальдегида. Средство хранят в темном месте при температуре 15-35°С. Пример 1. Берут 0,01 мл 37%-ного медицинского раствора формальдегида, добавляют его в 99,99 мл стерильного 0,9%-ного (или 0,95%-ного) изотонического раствора хлорида натрия. Смесь растворов тщательно перемешивают. Конечная концентрация формальдегида в полученном средстве будет составлять 0,0037 мас.%. Пример 2. Берут 0,0001 мл 37%-ного медицинского раствора формальдегида, добавляют его в 99,9999 мл стерильного 0,9%-ного (или 0,95%-ного) изотонического раствора хлорида натрия. Смесь растворов тщательно перемешивают. Конечная концентрация формальдегида в полученном средстве будет равна 0,000037 мас.%. Пример 3. Берут 0,01 мл 40%-ного медицинского раствора формальдегида. Средство готовят в соответствии с вышеописанным в примере 2. Конечная концентрация формальдегида будет равна 0,004 мас.%. Пример 4. Берут 0,0001 мл 40%-ного медицинского раствора формальдегида, добавляют его в 99,9999 мл стерильного 0,95%-ного изотонического раствора хлорида натрия. Смесь растворов тщательно перемешивают. Конечная концентрация формальдегида в полученном средстве будет равна 0,00003 мас.%. Для доказательства активизации стволовых клеток проведены исследования по изучению пролиферативного действия препарата и токсического воздействия на клетки селезенки и красного костного мозга. В опытах использовали 3-месячных мышей линии C57BL/6 (самцы). Мышей забивали декапитацией, в стерильных условиях извлекали селезенку и красный костный мозг. Фрагменты селезенки тщательно гомогенизировали в стеклянном гомогенизаторе в среде 199, фильтровали через стерильную марлю и 3 раза отмывали средой 199 по 5 минут при 1500 об/мин. Клетки красного костного мозга извлекали с помощью шприца и среды 199 из бедренной кости. Затем их тщательно пипетировали и отмывали вышеуказанным способом. После этого спленоциты и кариоциты костного мозга переносили в полную культуральную среду (среда RPMJ-1640+10% FCS (fetal calf serum) + 2 мМ Л-глютамина + 25 мМ Hepes-буфера + 2 меркаптоэтанола + 4 г/мл гентамицина) и доводили до концентрации 1×106 ядерных клеток на 1 мл. После вышеозначенных процедур число живых клеток составляло 93-98%. Культивирование клеток проводили в стерильных условиях во влажной атмосфере с 5% СО2. Количество живых и мертвых клеток оценивали с помощью люминесцентного микроскопа после прибавления к клеточным суспензиям смеси растворов акридинового оранжевого (0,25 мг/мл) и этидиума бромида (0,25 мг/мл). Пролиферативную активность клеток оценивали после прибавления к ним на 4 часа (в конце инкубации) 1 мкКи 3Н-тимидина (уд. активность). При этом клетки после инкубации с тимидином переносились на стекловолокнистые фильтры, отмывались большим избытком воды, фиксировались 96° спиртом и затем высушивались на воздухе. После этого фильтры погружались в общепринятый толуоловый сцинтиллятор на основе POP и POPOP (по 3 пробы на одно разведение препарата). Радиоактивность проб подсчитывали с помощью В процессе культивирования клеток добавляли препарат в различных концентрациях и учитывали процент мертвых клеток после 24 часов инкубирования. Результаты по определению токсичности препарата в различных концентрациях представлены в таблице 1. Из таблицы 1 следует, что различные концентрации препарата (0,0035-0,0000273), как при добавлении к спленоцитам, так и кариоцитам, увеличивают количество мертвых клеток по сравнению с контролем в 1,4-2,5 раза. Результат изучения пролиферативной способности спленоцитов и кариоцитов представлен в таблице 2. Из таблицы 2 видно, что пролиферация спленоцитов по сравнению с контролем увеличивается в 1,5-4,2 раза, а кариоцитов от 2,1 до 12,7 раз. Изучалась пролиферативная активность спленоцитов в сравнительном аспекте после 24 и 44 часов инкубирования. При этом пролифертивную активность оценивали по числу импульсов/минуту 3Н-тимидина, введенного в культуру клеток на 4 часа. Результаты представлены в таблице 3. Из таблицы 3 следует, что при всех концентрациях препарата пролиферация клеток увеличивается с увеличением срока инкубирования по сравнению с контролем в 1,5-14 раз. Полученные результаты свидетельствуют о том, что препарат в условиях in vitro усиливает пролиферацию клеток селезенки и костного мозга. При этом частичная гибель клеток не является определяющим в процессе их размножения и не влияет на усиление пролиферации оставшихся нормальных клеток. Препарат был опробирован в рабочих концентрациях на ограниченном числе больных: с незаживающими трофическими язвами, послеоперационным свищем, при переломе. Препарат вводили внутримышечно 1 раз в неделю в течение 1-2 месяцев. Пример 1. Больной Н., 35 лет, с послеоперационным свищем. После проведения курса лечения в течение 2 месяцев произошло полное заживление раны без повторного операционного вмешательства. Пример 2. Больная С, 72 года – незаживающая трофическая язва. После проведенного курса в течение 1 месяца произошло очищение и полное заживление язвы. Пример 3. Больной К., 45 лет – перелом голеностопного сустава. После курса лечения в течение 1,5 месяцев произошло восстановление костной ткани без осложнений. Рентгенологически доказано ускорение восстановительного процесса. Таким образом, заявляемое средство в условиях in vitro и примененное на ограниченном количестве больных доказывает возможность его использования с целью активизации собственных стволовых клеток.
Формула изобретения
Средство для активации стволовых клеток, содержащее активное начало химического происхождения и раствор хлорида натрия для инъекций, отличающееся тем, что в качестве активного начала оно содержит формальдегид при следующем соотношении компонентов, мас.%:
|
||||||||||||||||||||||||||

 2272810 по кл. МПК С07К 16/28, опуб. 27.03.2006), содержащее в качестве гликопротеина поликлональные иммуноглобулины класса IgG со средней молекулярной массой 150 кДа, полученные как гуморальный иммунный ответ на комплекс антигенов CD34+ стволовых клеток. Данное средство действует на весь комплекс антигенных детерминант на поверхности и внутри стволовых клеток, что приводит к их активации.
2272810 по кл. МПК С07К 16/28, опуб. 27.03.2006), содержащее в качестве гликопротеина поликлональные иммуноглобулины класса IgG со средней молекулярной массой 150 кДа, полученные как гуморальный иммунный ответ на комплекс антигенов CD34+ стволовых клеток. Данное средство действует на весь комплекс антигенных детерминант на поверхности и внутри стволовых клеток, что приводит к их активации.
 -счетчика (число импульсов
-счетчика (число импульсов