|
|
(21), (22) Заявка: 2005126046/13, 15.01.2004
(24) Дата начала отсчета срока действия патента:
15.01.2004
(30) Конвенционный приоритет:
17.01.2003 GB 0301117.8
17.01.2003 GB 0301118.6
17.01.2003 GB 0301119.4
17.01.2003 GB 0301120.2
17.01.2003 GB 0301121.0
17.01.2003 GB 0301122.8
23.07.2003 US 60/489,441
24.12.2003 GB 0330016.7
(43) Дата публикации заявки: 27.01.2006
(46) Опубликовано: 27.12.2009
(56) Список документов, цитированных в отчете о
поиске:
WO 0005396, 03.02.2000. HILTON S. et. al. Studies on the reaction mechanism of a microbial lipase/acyltransferase using chemical modification and site-directed mutagenesis. J. Biol. Chem. 1991 Jan 15;266(2):997-1000. ROBERTSON DL, et.al. Influence of active site and tyrosine modification on the secretion and activity of the Aeromonas hydrophilalipase/acyltransferase. J. Biol. Chem 1994 Jan 21; 269(3): 2146-50. US 6066482, 23.05.2000. GARCIA RE, et.al. 1,2-diacyl-sn-glycerol:sterol acyl transferase from spinach leaves (Spinacia oleraceaL.), Methods Enzymol. 71,1981, p.768-772. ГРАЧЕВА И.М. и др. Технология ферментных препаратов.: Элевар, 2000, с.346-364.
(85) Дата перевода заявки PCT на национальную фазу:
17.08.2005
(86) Заявка PCT:
IB 2004/000655 20040115
(87) Публикация PCT:
WO 2004/064537 20040805
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
КРЭИЙ Арно де (DK),
МАДРИД Сусан Мампуста (DK),
МИККЕЛЬСЕН Йерн Дальгор (DK),
СЕЭ Йерн Борх (DK)
(73) Патентообладатель(и):
ДАНИСКО А/С (DK)
|
(54) СПОСОБ
(57) Реферат:
Изобретение относится к биотехнологии и представляет собой способ получения in situ в пищевом продукте эмульгатора, в котором в пищевой продукт добавляют липид-ацилтрансферазу. При этом липид-ацилтрансфераза является такой, которая способна переносить ацильную группу от липида к одному или к нескольким акцепторам ацила и включает фрагмент последовательности аминокислот GDSX, где Х представляет собой один или несколько из аминокислотных остатков L, А, V, I, F, Y, Н, Q, Т, N, М или S. Изобретение позволяет получать эмульгатор без увеличения содержания свободной жирной кислоты в пищевом продукте. 2 н. и 22 з.п. ф-лы, 73 ил., 36 табл.
Ссылки на родственные заявки
Ссылки сделаны на следующие родственные заявки: заявка США серийный номер 09/750990, поданная 20 июля 1999 года, и заявка США серийный номер 10/409391. Каждая из этих заявок и каждый из документов, цитированных в этих заявках (“цитированных в заявках документов”), и каждый документ, упомянутый или цитированный в цитированных в заявках документах, или в тексте, или во время рассмотрения дела по этим заявкам, а также все аргументы в поддержку патентоспособности, выдвинутые во время такого рассмотрения, настоящим включены сюда путем ссылки. Различные документы цитируются также в данном тексте (“цитированные здесь документы”). Каждый из цитированных здесь документов и каждый документ, цитированный или упомянутый в цитированных здесь документах, настоящим включен сюда путем ссылки.
Область изобретения
Настоящее изобретение относится к способу получения in situ эмульгатора внутри пищевого продукта посредством использования липид-ацилтрансферазы.
Настоящее изобретение относится также к способу получения in situ эмульгатора внутри пищевого продукта с применением липид-ацилтрансферазы, где способ является таким, что эмульгатор образуется без увеличения или без существенного увеличения содержания жирных кислот в пищевом продукте.
Настоящее изобретение относится также к способу получения in situ по меньшей мере двух эмульгаторов внутри пищевого продукта посредством использования липид-ациллтрансферазы.
Настоящее изобретение относится также к способу получения in situ эфира углевода, и/или эфира стерола, и/или эфира станола, и/или эфира протеина, и/или эфира глицерина, и/или эфира гидроксикислоты внутри пищевого продукта посредством использования липид-ацилтрансферазы.
Настоящее изобретение относится к пищевой ферментной композиции и/или к кормовой ферментной композиции, которая содержит липид-ацилтрансферазу, и к применению такой композиции в способах по настоящему изобретению.
Настоящее изобретение относится также к способу выявления подходящих липид-ацилтрансфераз в соответствии с настоящим изобретением и к выявленным таким образом липид-ацилтрансферазам.
Настоящее изобретение относится также к иммобилизированной липид-ацилтрансферазе.
Состояние области техники
Польза применения фосфолипаз и липаз (называемых липолитическими ферментами (ЕС.3,1.1.х), используемых в пищевых и/или кормовых промышленных приложениях, известна многие годы.
Например, в ЕР 0585988 заявлено, что добавление липазы в тесто приводит к улучшению эффекта устойчивости к зачерствеванию. Предполагается, что липаза, полученная из Rhizopus arrhizus, добавленная в тесто, может улучшить качество получаемого хлеба, когда используется в сочетании с кулинарным жиром/жиром. WO 94/04035 указывает, что улучшенная мягкость может быть достигнута при добавлении липазы к тесту без добавления в тесто какого-либо дополнительного жира/масла. Castello, P. ESEGP 89-10 Dec. 1999, Helsinki показывает, что экзогенные липазы могут модифицировать объем хлеба.
Липолитические ферменты гидролизуют одну или несколько жирных кислот из липидов, присутствующих в пищевом продукте, что может привести к образованию молекул сильных эмульгаторов внутри пищевого продукта, которое обеспечивает коммерчески ценные функции. Молекулы, которые содействуют наиболее важным характеристикам эмульгатора, являются продуктами частичного гидролиза, такими как лизофосфолипиды, лизогликолипиды и моноглицеридные молекулы. Полярные продукты гидролиза липидов, такие как лизофосфолипиды и лизогликолипиды, являются особо полезными. При изготовлении хлеба такие образованные in situ эмульгаторы могут дать функциональные возможности, эквивалентные таким эмульгаторам, как DATEM.
Однако активность липолитических ферментов дает в результате также накопление жирных кислот, которое приводит к вредной функциональности в пищевом продукте. Такая врожденная активность липолитических ферментов ограничивает их действенность.
В практике были предприняты многочисленные попытки разрешить эту проблему. Однако они приводили в результате к значительному увеличению содержания свободных жирных кислот в пищевом продукте, включая, в частности, но не ограничиваясь этим, хлебное тесто и яичный желток.
Фосфолипазы, в особенности фосфолипаза А2 (Е.С. 3.1.1.4), использовались в течение многих лет для обработки яиц или продуктов на основе яиц (см., например, US 4034124 и Dutihl & Grogert, 1981, J.Sci.Food Agric. 32, 451-458). Активность фосфолипазы во время обработки яиц или продуктов на основе яиц приводит в результате к накоплению полярного лизолецитина, который может действовать как эмульгатор. Обработка фосфолипазой яиц или продуктов на основе яиц может улучшить стабильность, термическую стабильность при тепловой обработке, такой как пастеризация, и привести в результате к значительному загущению. Продукты на основе яиц могут включать, но не ограничиваться этим, кекс, майонез, заправки для салата, соусы, мороженое и т.п. Применение фосфолипаз приводит в результате к накоплению свободных жирных кислот. Накопление свободных жирных кислот может привести к значительной потере вкуса. К тому же накопление свободных жирных кислот может привести к увеличенной восприимчивости к окислению и, следовательно, приводит к плохой сохранности, обесцвечиванию продукта и изменению других критических характеристик пищевого продукта, таких как вкус и текстура. В последнее время липолитические ферменты с более широкой специфичностью субстрата были предложены на рынок для обработки яичного желтка и связанных с ним пищевых продуктов. Они имеют преимущество в том, что в отличие от большинства фосфолипаз А2 они не произведены из сырья, полученного из млекопитающих. Однако они приводят к значительному накоплению свободных жирных кислот в результате гидролиза не только фосфолипидов, но и триглицеридов.
Как упоминалось выше, другой областью, в которой широко использовались липазы, является хлебопечение. Применение фосфолипаз в хлебопекарном производстве относится к началу 1980-х годов.
Субстратом для липаз в пшеничной муке являются 1,5-3% эндогенные пшеничные липиды, которые представляют собой сложную смесь полярных и неполярных липидов. Полярные липиды могут быть разделены на гликолипиды и фосфолипиды. Такие липиды образованы глицерином, этерифицированным двумя жирными кислотами, и полярной группой. Полярная группа придает таким липидам поверхностную активность. Ферментативное отщепление одной из жирных кислот в таких липидах приводит к липидам с намного большей поверхностной активностью. Хорошо известно, что эмульгаторы с высокой поверхностной активностью, такие как DATEM, являются весьма функциональными, когда добавлены в тесто.
Однако применение липаз (Е.С. 3.1.1.Х) в продуктах из теста может иметь вредное воздействие на активность дрожжей и/или отрицательно повлиять на объем хлеба. Отрицательное влияние на объем хлеба часто объясняют передозировкой. Передозировка может привести к снижению эластичности клейковины с получением теста, которое становится слишком жестким, что в результате приводит к пониженному объему хлеба. В дополнение или альтернативно такие липазы могут разлагать кулинарный жир, масло или молочный жир, добавленные в тесто, приводя к потере вкуса теста и выпеченного продукта. Передозировка и потеря вкуса приписываются накоплению жирных кислот в тесте.
В ЕР 1193314, ЕР 0977869, а также в WO 01/39602 сообщалось, что использование липолитических ферментов, активных в отношении гликолипидов, оказывалось особо выгодным при использовании в хлебопечении, поскольку было обнаружено, что продукты частичного гидролиза, лизогликолипиды обладают очень высокой эмульгирующей функциональностью, явно приводящей к более высокой пропорции положительной эмульгирующей функциональности по сравнению с вредным накоплением свободных жирных кислот. Однако было также обнаружено, что ферменты имеют значительную неселективную активность по отношению к триглицериду, что приводит к ненужному высокому содержанию свободной жирной кислоты.
О таких же наблюдениях сообщается в WO 00/32758, где описаны варианты липолитических ферментов с улучшенной активностью по отношению к фосфолипидам и/или гликолипидам в дополнение к вариантам, которые оказывают предпочтение жирным кислотам с длинной цепью, а не с короткой цепью. Эту последнюю особенность, описанную также в WO 01/39602, считали особенно важной для предотвращения потери вкуса, связанной с накоплением свободных жирных кислот с короткой цепью. Однако образовывалось значительное количество свободных жирных кислот.
Проблема высокой активности по отношению к триглицериду рассматривалась в WO 02/094123, где предложено применение липолитических ферментов, активных к полярным липидам (т.е. к гликолипидам и фосфолипидам) в тесте, но практически неактивных по отношению к триглицеридам или 1-моноглицеридам. Однако образовывалось значительное количество свободных жирных кислот.
Некоторые липолитические ферменты имеют низкую активность или отсутствие активности к лизо-формам полярных липидов (т.е. гликолипидов/фосфолипидов). Применение таких ферментов считалось предпочтительным, поскольку они гарантируют накопление высоко полярных лизолипидов, дающих в результате оптимальную функциональность. Однако свободные жирные кислоты накапливаются. Такая селективная функциональность является характерной для ферментов фосфолипазы А2 и гликолипаз, описанных в EP 0977869, EP 1193314 и WO 01/39602. Был получен вариант ферментов с менее селективными липолитическими ферментами, которые имеют более низкую активность по отношению к лизо-полярным липидам по сравнению с родительским ферментом (WO 03/060112). Однако образовывалось значительное количество свободных жирных кислот.
В WO 00/05396 описан способ получения пищевого продукта, содержащего эмульгатор, где пищевой материал вводят в контакт с таким ферментом, что эмульгатор образуется ферментом из эфира жирной кислоты, а второй функциональный ингредиент образуется из второго составляющего. В WO 00/05396 описано применение, в частности, фермента липазы или эстеразы. Нигде в WO 00/05396 нет указаний на конкретное применение ацилтрансферазы. Кроме того, в пищевых продуктах с высоким содержанием воды применение эстераз и липаз, предложенное в WO 00/05396, должно приводить к значительному накоплению свободных жирных кислот.
Недостаток, связанный с применением липаз, включая фосфолипазы и гликолипазы, может быть обусловлен образованием свободных жирных кислот, высвободившихся из липидов. В течение последней пары десятилетий применение липолитических ферментов в пищевых продуктах было ограничено балансом между вредным накоплением свободных жирных кислот и образованием лизолипидов, которое обеспечивает положительную функциональность. Хотя в этой области были предложены многочисленные стратегии, некоторые из которых обеспечили значительное улучшение функциональности, ни одна из них не решила полностью фундаментальную проблему, т.е. значительное накопление свободных жирных кислот в пищевом продукте, приготовленном с использованием in situ липолитических ферментов.
Присутствие высоких концентраций свободных жирных кислот (СЖК) в исходных материалах или пищевых продуктах обычно считают дефектом качества, и производители пищевых продуктов и покупатели должны обычно включать максимальное содержание СЖК в пищевые спецификации. Эффекты, получаемые при избыточных уровнях СЖК, могут быть органолептическими и/или функциональными дефектами.
Результатом липолиза является гидролитическая прогорклость с образованием характерного “мыльного” привкуса. Такой “мыльный” вкус является особенно острым при жирных кислотах с промежуточной длиной цепи (С8-С12), которые, хотя и не присутствуют в высоких концентрациях, могут быть важными составляющими, например, молочных продуктов или растительных масел. Более распространенный органолептический дефект обусловлен совместным действием липолитических ферментов и процессов окисления. Ненасыщенные жирные кислоты являются более подверженными окислению, когда они неэтерифицированы, чем когда они этерифицированы в ацильные липиды.
Функциональные дефекты пищевого продукта, вызванные высокими концентрациями СЖК, являются обнаруживаемыми, но не так легко объясняемыми. Не желая быть связанными теорией, гидролиз неизмененных липидов в карбоновые кислоты будет увеличивать [H+] и давать карбонильные группы, которые могут соединяться с другими соединениями или с ионами металлов. Свободные жирные кислоты также присоединяют протеины за счет гидрофобных взаимодействий и могут образовывать комплексы с крахмалом во время готовки. СЖК могут также мешать действию поверхностно-активных агентов, таких как полярные липиды и эмульгаторы (Lipid in Cereal Technology, P.J. Barnes, Academic Press 1983).
WO 03/100044 описывает класс ацилтрансфераз, известных как PDAT (или ATWAX). Такие ферменты используют моноглицерид или диглицерид как молекулу-акцептор и фосфатидилхолин (ФХ) как молекулу-донор для образования следующих продуктов: лизофосфатидилхолина и триацилглицерина и/или диацетилглицерина.
В одном варианте осуществления представленное изобретение относится к улучшениям при вводе протеинов сыворотки в пищевой продукт, обеспечивающих повышенные выходы без ухудшения качества – такого как текстура – пищевых продуктов.
Сырные композиции обычно готовят из молочных жидкостей способом, который включает обработку жидкости коагулирующим или свертывающим агентом. Коагулирующим агентом может быть энзим створаживания, кислота или подходящая бактериальная культура, или он может включать такую культуру. Получаемый творог обычно включает трансформированный казеин, жиры, включая натуральный масляный жир, и вкусовые вещества, которые появляются особенно, когда используют бактериальную культуру. Творог может быть сепарирован от жидкой сыворотки, которая содержит растворимые протеины, не затронутые коагуляцией и которые поэтому не вошли в творог.
Таким образом, сыворотка является побочным продуктом производства в промышленных способах получения пищевых продуктов, таких как сыры. Традиционно сыворотку выводят как отход, или используют как удобрение или как корм для скота, или перерабатывают в пищевые ингредиенты.
Неспособность протеинов сыворотки существенно удерживаться в твороге является существенным фактором, вносящим вклад в недостаточную эффективность обычного производства молочных продуктов, таких как сырные твороги, и в снижение общего выхода, относящегося к включению всех твердых протеинов, которые присутствуют в исходных молочных жидкостях, в получаемые сырные твороги.
Имелись многочисленные попытки включить протеины сыворотки в сыр, например тепловой обработкой молока, тепловой обработкой сыворотки или фильтрацией, такой как ультрафильтрация.
Имеется также несколько описаний применения специфических протеиназ для того, чтобы индуцировать агрегацию протеинов сыворотки. Было показано, что сериновая протеиназа, полученная из Bacillus licheniformis, имеет способность индуцировать агрегацию протеинов сыворотки (US 5523237).
Однако остается много трудностей, связанных с вводом протеинов сыворотки в такие процессы, как производство сыров. Например, введение протеина сыворотки в сыры связано с ухудшением вкуса продукта и ощущения во рту и, кроме того, имеет тенденцию мешать створаживанию и последующей переработке продукта. Протеиназы, о которых ранее сообщалось, что они могут быть добавлены в сырное молоко для гидролиза протеинов сыворотки, приводят к значительному гидролизу казеинов, как описано у Madsen, J.S. & Qvist, K.B. (1997) Hydrolysis of milk protein by a Bacillus licheniformis protease specific for acidic amino acid residues. J. Food Sci. 62, 579-582.
Таким образом, имеется потребность в способах и композициях, которые предназначены для улучшенного введения протеина сыворотки в пищевые продукты, с сохранением в то же время органолептических и других желаемых свойств. Такая оптимизация должна привести в результате к повышенной эффективности, более высоким выходам пищевых продуктов и к снижению общих материальных затрат.
Липаза:холестерин-ацилтрансферазы известны в течение некоторого времени (см., например, Buckley – Biochemistry, 1983, 22, 5490-5493). В частности, были найдены глицерофосфолипид: холестерин-ацилтрансферазы (GCAT), которые подобно лецитин:холестерин-ацилтрансферазам (LCAT) растительного и животного происхождения могут катализировать перенос жирной кислоты между фосфатидилхолином и холестерином.
Upton and Buckley (TIBS 20, May 1975 p. 178-179) и Brumlik and Buckley (J. of Bacteriology Apr. 1996 p. 2060-2064) сообщают о липаза/ацилтрансферазе из Aeromonas hydrophila, которая обладает способностью ацильного переноса к спиртовым акцепторам в водной среде.
Сущность и аспекты настоящего изобретения
Согласно первому аспекту настоящего изобретения предложен способ получения in situ эмульгатора в пищевом продукте, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы, как она определена здесь.
В следующем аспекте настоящее изобретение относится к способу получения in situ эмульгатора в пищевом продукте, где способ является таким, что эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте, и где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к способу получения в пищевом продукте in situ эмульгатора, и/или эфира стерола, и/или эфира станола, где способ является таким, что эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте, и где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к способу получения в пищевом продукте in situ эмульгатора, и/или эфира стерола, и/или эфира станола, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
Согласно другому аспекту настоящего изобретения предложен способ получения в пищевом продукте in situ по меньшей мере двух эмульгаторов, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
Согласно следующему аспекту настоящего изобретения предложен способ получения в пищевом продукте in situ по меньшей мере двух эмульгаторов, и/или эфира стерола, и/или эфира станола, где способ является таким, что эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте, и где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
Согласно следующему аспекту настоящего изобретения предложен способ получения в пищевом продукте in situ по меньшей мере двух эмульгаторов, и/или эфира стерола, и/или эфира станола, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В следующем аспекте настоящее изобретение относится к способу получения в пищевом продукте in situ эфира углевода, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к способу получения в пищевом продукте in situ эфира углевода вместе с эмульгатором, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к способу получения в пищевом продукте in situ эмульгатора и одного или нескольких соединений из эфира углевода, эфира стерола, эфира станола, эфира протеина, моноглицерида или диглицерида, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
Согласно следующему аспекту настоящего изобретения предложен способ получения пищевого продукта, включающего эмульгатор, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы, как определено здесь.
В следующем аспекте настоящее изобретение относится к способу получения пищевого продукта, включающего эмульгатор, где способ является таким, что эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте, и где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к способу получения пищевого продукта, включающего эмульгатор, и/или эфир стерола, и/или эфир станола, где способ является таким, что эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте, и где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к способу получения пищевого продукта, включающего эмульгатор, и/или эфир стерола, и/или эфир станола, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
Согласно следующему аспекту настоящего изобретения предложен способ получения пищевого продукта, включающего по меньшей мере два эмульгатора, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
Согласно следующему аспекту настоящего изобретения предложен способ получения пищевого продукта, включающего по меньшей мере два эмульгатора, и/или эфир стерола, и/или эфир станола, где способ является таким, что эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте, и где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
Согласно следующему аспекту настоящего изобретения предложен способ получения пищевого продукта, включающего по меньшей мере два эмульгатора, и/или эфир стерола, и/или эфир станола, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В следующем аспекте настоящее изобретение относится к способу получения пищевого продукта, включающего эфир углевода, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В следующем аспекте настоящее изобретение относится к способу получения пищевого продукта, включающего эфир углевода и эмульгатор, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к способу получения пищевого продукта, включающего эмульгатор и одно или несколько соединений из эфира углевода, эфира стерола, эфира станола, эфира протеина, моноглицерида или диглицерида, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к применению липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего эмульгатор, где эмульгатор образуется из составляющих пищевого материала с помощью липид-ацилтрансферазы.
В следующем аспекте настоящее изобретение относится к применению липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего эмульгатор, где эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте и где эмульгатор образуется из составляющих пищевого материала с помощью липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к применению липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего эмульгатор, и/или эфир стерола, и/или эфир станола, где эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте и где эмульгатор, и/или эфир стерола, и/или эфир станола образуется из составляющих пищевого материала с помощью липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к применению липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего эмульгатор, и/или эфир стерола, и/или эфир станола, где эмульгатор, и/или эфир стерола, и/или эфир станола образуется из составляющих пищевого материала с помощью липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к применению липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего по меньшей мере два эмульгатора, где два эмульгатора образуются из составляющих пищевого материала с помощью липид-ацилтрансферазы.
Согласно следующему аспекту настоящего изобретения предложено применение липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего по меньшей мере два эмульгатора, и/или эфир стерола, и/или эфир станола, где эмульгаторы образуются без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте и где один или оба из эмульгаторов и/или эфир стерола, и/или эфир станола образуются из составляющих пищевого материала с помощью липид-ацилтрансферазы.
Согласно следующему аспекту настоящего изобретения предложено применение липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего по меньшей мере два эмульгатора, и/или эфир стерола, и/или эфир станола, где один или оба из эмульгаторов, и/или эфир стерола, и/или эфир станола образуются из составляющих пищевого материала с помощью липид-ацилтрансферазы.
В следующем аспекте изобретение относится к применению липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего эфир углевода, где эфир углевода образуется из составляющих пищевого материала с помощью липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к применению липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего по меньшей мере эфир углевода и дополнительный эмульгатор, где эфир углевода и эмульгатор образуются из составляющих пищевого материала с помощью липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к применению липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего эмульгатор и одно или несколько соединений из эфира углевода, эфира стерола, эфира станола, эфира протеина, моноглицерида или диглицерида, где эмульгатор, и/или эфир углевода, и/или эфир стерола, и/или эфир станола, и/или эфир протеина, и/или моноглицерид, и/или диглицерид образуются из составляющих пищевого материала с помощью липид-ацилтрансферазы.
В соответствии со следующим аспектом настоящего изобретения предложен способ получения in situ эмульгатора, предпочтительно, лизолецитина и эфира стерола в пищевом продукте на основе яиц, где способ является таким, что эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте, и где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В соответствии со следующим аспектом настоящего изобретения предложен способ получения in situ эмульгатора, предпочтительно, лизолецитина и эфира стерола в пищевом продукте на основе яиц, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к способу получения пищевого продукта на основе яиц, включающего эмульгатор, предпочтительно, лизолецитин и эфир стерола в пищевом продукте на основе яиц, где эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте и где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В другом аспекте настоящее изобретение относится к способу получения пищевого продукта на основе яиц, включающего эмульгатор, предпочтительно, лизолецитин и эфир стерола в пищевом продукте на основе яиц и где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы.
В следующем аспекте настоящее изобретение относится к пищевому продукту, который может быть получен, и предпочтительно, который получен способом согласно настоящему изобретению.
В другом аспекте настоящее изобретение дополнительно относится к пищевой ферментной композиции и/или к кормовой ферментной композиции, которая содержит липид-ацилтрансферазу, и к применению такой композиции в способах по настоящему изобретению.
В соответствии со следующим аспектом настоящего изобретения предложен способ идентификации подходящей липид-ацилтрансферазы для применения в соответствии с настоящим изобретением, включающий стадии тестирования целевого фермента одним или несколькими способами из “Анализа трансферазы в низководной среде”, “Анализа трансферазы в сильно обводненном яичном желтке” или “Анализа трансферазы в забуференном субстрате” и выбора липид-ацилтрансферазы, если она является такой, которая имеет одну или несколько из следующих характеристик:
(а) при тестировании с использованием “Анализа трансферазы в низководной среде” при замерах после периода времени, выбранного из 30, 20 или 120 минут, имеет относительную трансферазную активность по меньшей мере 1%; (b) при тестировании с использованием “Анализа трансферазы в сильно обводненном яичном желтке” с 54% воды имеет относительную трансферазную активность до 100% или (c) при тестировании с использованием “Анализа трансферазы в забуференном субстрате” имеет по меньшей мере 2% ацилтрансферазную активность.
Настоящее изобретение также относится к липид-ацилтрансферазе, идентифицированной с использованием способа согласно настоящему изобретению.
В соответствии со следующим аспектом настоящее изобретение относится к иммобилизованному ферменту липид-ацилтрансферазы, как он определен здесь.
Подробные аспекты настоящего изобретения
Термин “липид-ацилтрансфераза”, как он использован здесь, означает фермент, который проявляет как липазную активность (обычно классифицируемую как Е.С. 3.1.1.х в соответствии с Рекомендациями по номенклатуре ферментов (1992) Номенклатурной комиссии Международного Союза по биохимии и молекулярной биологии), так и ацилтрансферазную активность (обычно классифицируемую как Е.С. 2.3.1.х), благодаря чему фермент способен переносить ацильную группу от липида к одному или нескольким акцепторным субстратам, таким как один или несколько из следующих: стерол, станол, углевод, протеин, субъединица протеина, глицерин.
Предпочтительно, липид-ацилтрансфераза для использования в способах и/или для применений по настоящему изобретению способна переносить ацильную группу от липида (как он определен здесь) к одному или нескольким из следующих акцепторных субстратов: стеролу, станолу, углеводу, протеину или его субъединице или глицерину.
Для некоторых аспектов “акцептором ацила” согласно настоящему изобретению может быть любое соединение, включающее гидроксильную группу (-ОН), такое как, например, многоатомные спирты, включая глицерин, стерол, станолы, углеводы, гидроксикислоты, включая фруктовые кислоты, лимонную кислоту, винную кислоту, молочную кислоту и аскорбиновую кислоту, протеины или их субъединицы, такие как, например, аминокислоты, гидролизаты протеинов и пептиды (частично гидролизованные протеины) и их смеси и производные. Предпочтительно, “акцептор ацила” согласно настоящему изобретению не является водой.
В одном варианте осуществления акцептор ацила, предпочтительно, не является моноглицеридом и/или диглицеридом.
В одном аспекте фермент, предпочтительно, способен переносить ацильную группу от липида к стеролу и/или станолу.
В одном аспекте фермент, предпочтительно, способен переносить ацильную группу от липида к углеводу.
В одном аспекте фермент, предпочтительно, способен переносить ацильную группу от липида к протеину или к его субъединице. Подходящими субъединицами протеина могут быть один или несколько из следующих: аминокислота, гидролизат протеина, пептид, дипептид, олигопептид, полипептид.
Предпочтительно, в протеине или субъединице протеина акцептором ацила могут быть один или несколько из следующих составляющих протеина или субъединицы протеина: серина, треонина, тирозина или цистеина.
Когда субъединицей протеина является аминокислота, обычно аминокислота может быть любой подходящей аминокислотой. Подходящей аминокислотой может быть одна или несколько из числа серина, треонина, тирозина или цистеина.
В одном аспекте фермент, предпочтительно, способен переносить ацильную группу от липида к глицерину.
В одном аспекте фермент, предпочтительно, способен переносить ацильную группу от липида к гидроксикислоте.
В одном аспекте фермент, предпочтительно, способен переносить ацильную группу от липида к многоатомному спирту.
В одном аспекте липид-ацилтрансфераза может как переносить ацильную группу от липида к стеролу и/или станолу, так и переносить ацильную группу к одному или нескольким из следующих соединений: углевод, протеин, субъединица протеина, глицерин.
Предпочтительно, липидным субстратом, на котором действует липид-ацилтрансфераза согласно настоящему изобретению, является один или несколько из следующих липидов: фосфолипид, такой как лецитин, например фосфатидилхолин, триглицерид, кардиолипин, диглицерид или гликолипид, такой как, например, дигалактозилдиглицерид (DGDG). Такой липидный субстрат может быть назван здесь “липидным донором ацила”. Термин “лецитин”, как он использован здесь, охватывает фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозитол, фосфатидилсерин и фосфатидилглицерин.
Для некоторых аспектов, предпочтительно, липидным субстратом, на котором действует липид-ацилтрансфераза, является фосфолипид, такой как лецитин, например фосфатидилхолин.
Для некоторых аспектов, предпочтительно, липидным субстратом является гликолипид, такой как, например, DGDG.
Предпочтительно, липидным субстратом является пищевой липид, иначе говоря, липидный компонент пищевого продукта.
Для некоторых аспектов, предпочтительно, липид-ацилтрансфераза согласно нестоящему изобретению является неспособной или практически неспособной воздействовать на триглицерид, и/или 1-моноглицерид, и/или на 2-моноглицерид.
Обычно липидный субстрат или липидный донор ацила может быть одним или несколькими липидами, присутствующими в одном или нескольких субстратах: жирах, включая лярд, талловое и сливочное масло, маслах, включая масла, экстрагированные из или производные пальмового масла, подсолнечного масла, масла бобов сои, сафлорового масла, масла хлопковых семян, масла земляного ореха, кукурузного масла, оливкового масла, арахисового масла, кокосового масла и рапсового масла. Лецитин из сои, рапсового масла или яичного желтка также является подходящим липидным субстратом. Липидный субстрат может быть липидом овса или другим материалом на растительной основе, содержащим галактолипиды.
В одном аспекте липидным донором ацила, предпочтительно, является лецитин (такой как фосфатидилхолин) яичного желтка.
Для некоторых аспектов настоящего изобретения липид может быть выбран из липидов, имеющих цепь жирной кислоты длиной от 8 до 22 атомов углерода.
Для некоторых аспектов настоящего изобретения липид может быть выбран из липидов, имеющих цепь жирной кислоты длиной от 16 до 22 атомов углерода, более предпочтительно, от 16 до 20 атомов углерода.
Для некоторых аспектов настоящего изобретения липид может быть выбран из липидов, имеющих цепь жирной кислоты длиной не более 14 атомов углерода, обычно из липидов, имеющих цепь жирной кислоты длиной от 4 до 14 атомов углерода, предпочтительно, от 4 до 10 атомов углерода, обычно от 4 до 8 атомов углерода.
Обычно липид-ацилтрансфераза согласно настоящему изобретению может проявлять одну или несколько из следующих липазных активностей: гликолипазную активность (Е.С. 3.1.1.26), триацилглицеринлипазную активность (Е.С. 3.1.1.3), фосфолипазную А2 активность (Е.С. 3.1.1.4) или фосфолипазную А1 активность (Е.С. 3.1.1.32). Термин “гликолипазная активность”, как он использован здесь, охватывает галактолипазную активность.
Обычно липид-ацилтрансфераза согласно настоящему изобретению может иметь по меньшей мере одну или несколько из следующих липазных активностей: гликолипазную активность (Е.С. 3.1.1.26), и/или фосфолипазную А1 активность (Е.С. 3.1.1.32), и/или фосфолипазную А2 активность (Е.С. 3.1.1.4).
Для некоторых аспектов липид-ацилтрансфераза согласно настоящему изобретению может иметь по меньшей мере гликолипазную активность (Е.С. 3.1.1.26).
Для некоторых аспектов, предпочтительно, липид-ацилтрансфераза согласно настоящему изобретению является способной переносить ацильную группу от гликолипида и/или фосфолипида к стеролу и/или станолу, образуя по меньшей мере эфир стерола и/или эфир станола.
Для некоторых аспектов, предпочтительно, липид-ацилтрансфераза согласно настоящему изобретению является способной переносить ацильную группу от гликолипида и/или фосфолипида к углеводу, образуя по меньшей мере эфир углевода.
Для некоторых аспектов, предпочтительно, липид-ацилтрансфераза согласно настоящему изобретению является способной переносить ацильную группу от гликолипида и/или фосфолипида к протеину, образуя по меньшей мере эфир протеина (или конденсат протеина и жирной кислоты).
Для некоторых аспектов, предпочтительно, липид-ацилтрансфераза согласно настоящему изобретению является способной переносить ацильную группу от гликолипида и/или фосфолипида к глицерину, образуя по меньшей мере диглицерид и/или моноглицерид.
Для некоторых аспектов, предпочтительно, липид-ацилтрансфераза согласно настоящему изобретению не проявляет триацетилглицеридной липазной активности (Е.С. 3.1.1.3).
В некоторых аспектах липид-ацилтрансфераза может быть способна переносить ацильную группу от липида к стеролу и/или станолу. Так, в одном варианте осуществления “акцептором ацила” согласно настоящему изобретению может быть или стерол, или станол, или сочетание и стерола, и станола.
В одном варианте осуществления подходящий стерол и/или станол может включать одну или несколько из следующих структурных элементов:
i) 3-бета-гидроксигруппа или 3-альфа-гидроксигруппа; и/или
ii) А:В кольцо в цис-положении, или А:В кольцо в транс-положении, или С5-С6 является ненасыщенным.
Подходящие стерольные акцепторы ацила включают холестерин и фитостеролы, например альфа-ситостерол, бета-ситостерол, стигмастерол, эргостерол, кампестрол, 5,6-дигидростерол, брассикастерол, альфа-спинастерол, бета-спинастерол, гамма-спинастерол, дельта-спинастерол, фукостерол, димостерол, аскостерол, серебистерол, эпистерол, анастерол, гипостерол, хондрилластерол, десмостерол, халиностерол, пориферастерол, клионастерол, глткозиды стерола и другие натуральные или синтетические изомерные формы и производные.
В одном аспекте настоящего изобретения, предпочтительно, более чем один стерол и/или станол может действовать как акцептор ацила, обычно более чем два стерола и/или станола могут действовать как акцептор ацила. Другими словами, в одном аспекте настоящего изобретения приемлемо может образоваться более чем один эфир стерола и/или эфир станола. Соответственно, когда акцептором ацила является холестерин, один или несколько дополнительных стеролов могут также действовать как акцепторы ацила. Так, в одном аспекте настоящее изобретение предлагает способ получения in situ и эфира холестерина, и по меньшей мере одного эфира стерола или станола в сочетании. Другими словами, липид-ацилтрансфераза для некоторых аспектов настоящего изобретения может переносить ацильную группу от липида и к холестерину, и к по меньшей мере одному дополнительному стеролу и/или по меньшей мере одному станолу.
В одном аспекте, предпочтительно, стерольным акцептором ацила является один или несколько из следующих соединений: альфа-ситостерол, бета-ситостерол, стигмастерол, эргостерол и кампестрол.
В одном аспекте, предпочтительно, стерольным акцептором ацила является холестерин. В том случае, когда холестерин является акцептором ацила для липид-ацилтрансферазы, количество холестерина в пищевом продукте уменьшается по сравнению с пищевым продуктом до того, как он подвергнут воздействию липид-ацилтрансферазы и/или по сравнению с эквивалентным пищевым продуктом, который не был обработан липид-ацилтрансферазой.
Подходящие станольные акцепторы ацила включают фитостанолы, например бета-ситостанол или ss-ситостанол.
В одном аспекте, предпочтительно, стерольным и/или станольным акцептором ацила являются стерол и/или станол, отличные от холестерина.
В некоторых аспектах пищевой продукт, приготовленный в соответствии с настоящим изобретением, может быть использован для снижения холестерина сыворотки крови и/или для снижения липопротеина низкой плотности. И холестерин сыворотки крови, и липопротеин низкой плотности связывают с некоторыми заболеваниями человека, такими, например, как атеросклероз и/или заболевания сердца. Таким образом, можно предполагать, что пищевые продукты, приготовленные в соответствии с настоящим изобретением, могут быть использованы для снижения риска таких заболеваний.
Так, в одном аспекте настоящее изобретение относится к применению пищевого продукта согласно настоящему изобретению для использования при лечении и/или профилактике атеросклероза и/или заболеваний сердца.
В следующем аспекте настоящее изобретение предлагает медикамент, включающий пищевой продукт согласно настоящему изобретению.
В следующем аспекте настоящее изобретение относится к способу лечения и/или профилактики заболеваний человека или животного, где способ включает введение пациенту эффективного количества пищевого продукта согласно настоящему изобретению.
Стерольный и/или станольный акцептор ацила могут естественным образом содержаться в пищевом продукте. Альтернативно, стерол и/или станол могут быть добавлены в пищевой продукт. В том случае, когда стерол и/или станол добавляют в пищевой продукт, стерол и/или стенол могут быть добавлены до, одновременно и/или после добавления липид-ацилтрансферазы согласно настоящему изобретению. Соответственно, настоящее изобретение может охватывать добавление экзогенных стеролов/станолов, в частности фитостеролов/фитостанолов, к пищевому продукту до или одновременно с добавлением фермента согласно настоящему изобретению.
Для некоторых аспектов один или несколько станолов, присутствующих в пищевом продукте, могут быть превращены в один или несколько станолов перед тем или одновременно с тем, как добавляют липид-ацилтрансферазу согласно настоящему изобретению. Может быть применен любой подходящий способ превращения стеролов в станолы. Например, конверсия может быть осуществлена химическим гидрированием. Конверсию можно проводить перед добавлением липид-ацилтрансферазы согласно настоящему изобретению или одновременно с добавлением липид-ацилтрансферазы согласно настоящему изобретению. Подходящие для конверсии стеролов в станолы ферменты описаны в WO 00/061771.
Соответственно, настоящее изобретение может быть использовано для получения эфиров фитостанолов in situ в пищевом продукте. Эфиры фитостанолов имеют повышенную растворимость в липидных мембранах, биодоступность и увеличенную полезность для здоровья (см., например, WO 92/99640).
В некоторых осуществлениях настоящего изобретения эфир станола и/или эфир стерола может быть вкусовым агентом и/или текстуризатором. В таких случаях настоящее изобретение охватывает получение in situ вкусовых агентов и/или текстуризаторов.
Для некоторых аспектов настоящего изобретения липид-ацилтрансфераза согласно настоящему изобретению может использовать в качестве акцептора ацила углевод. Углеводным акцептором ацила могут быть один или несколько из следующих соединений: моносахарид, дисахарид, олигосахарид или полисахарид. Предпочтительно, углеводом является один или несколько из следующих соединений: глюкоза, фруктоза, ангидрофруктоза, мальтоза, лактоза, сахароза, галактоза, ксилоза, ксилоолигосахариды, арабиноза, мальтоолигосахариды, тагатоза, микротецин, аскопирон Р, аскопирон Т, кортальцерон.
Углеводный акцептор ацила может естественным образом содержаться в пищевом продукте. Альтернативно, углевод может быть добавлен в пищевой продукт. В том случае, когда углевод добавляют в пищевой продукт, углевод может быть добавлен до, одновременно и/или после добавления липид-ацилтрансферазы согласно настоящему изобретению.
Эфиры углеводов могут работать как ценные эмульгаторы в пищевом продукте. Так, в том случае, когда фермент работает на перенос ацильной группы к сахару, изобретение охватывает образование in situ второго эмульгатора в пищевом продукте.
В некоторых осуществлениях липид-ацилтрансфераза может использовать в качестве акцептора ацила и стерол и/или станол, и углевод.
Применение липид-ацилтрансферазы, которая может переносить ацильную группу как к углеводу, так и к стеролу и/или станолу, является особо выгодным для пищевых продуктов, включающих яйца. В частности, присутствие сахаров, в особенности глюкозы, в яйцах и яичных продуктах часто рассматривается как нежелательное. Яичный желток может включать до 1% глюкозы. Обычно яйца или продукты на основе яиц могут быть обработаны оксидазой глюкозы для удаления части глюкозы или всей глюкозы. Однако в соответствии с настоящим изобретением такой нежелательный сахар может быть легко удален “этерификацией” сахара с образованием эфира сахара.
Для некоторых аспектов настоящего изобретения липид-ацилтрансфераза согласно настоящему изобретению может использовать в качестве акцептора ацила протеин. Обычно протеин может быть одним или несколькими из протеинов, находимых в пищевом продукте, например в молочном продукте или в мясном продукте. Только в качестве примера подходящими протеинами могут быть протеины, находимые в твороге или в сыворотке, такие как лактоглобулин. Другие подходящие протеины включают овальбумин из яиц, глиадин, глютенин, пуроиндолинпротеины переноса липидов из зерна и миозин из мяса.
Так, в соответствии с настоящим изобретением можно достичь одного или нескольких из следующих положительных качеств: образование in situ эмульгатора без увеличения свободных жирных кислот; уменьшение накопления свободных жирных кислот в пищевом продукте; снижение уровней свободного холестерина в пищевом продукте; увеличение эфиров стерола и/или эфиров стенола; снижение холестерина сыворотки крови и/или липопротеинов низкой плотности; увеличение эфиров углеводов; снижение нежелательных свободных сахаров.
Преимуществом настоящего изобретения является то, что эмульгатор (эмульгаторы) образуются in situ в пищевом продукте без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте. Образование свободных жирных кислот может быть вредным для пищевого продукта. В частности, свободные жирные кислоты были связаны с потерей запахов и потерей вкуса пищевых продуктов, а также другими вредными эффектами, включая, например, мыльный вкус сыра. Предпочтительно, способ согласно настоящему изобретению дает в результате образование in situ эмульгатора (эмульгаторов), где накопление свободных жирных кислот уменьшено и/или устранено. Не желая быть связанными теорией, в соответствии с настоящим изобретением жирные кислоты, которые выделены из липидов, переносятся липид-ацилтрансферазой к акцептору ацила, например стеролу и/или станолу. Таким образом, общий уровень свободных жирных кислот в пищевом продукте не увеличивается или увеличивается лишь в незначительной степени. Это резко отличается от ситуации, когда для образования эмульгаторов in situ используют липазы (Е.С. 3.1.1.х). В частности, применение липаз может привести к увеличению количества свободных жирных кислот в пищевом продукте, которое может быть вредным. В соответствии с настоящим изобретением накопление свободных жирных кислот уменьшено или устранено по сравнению с количеством свободных жирных кислот, которое должно было накопится, если бы фермент липаза, в частности фермент фосфолипаза А, был использован вместо липид-ацилтрансферазы в соответствии с настоящим изобретением.
Применение липид-ацилтрансферазы, которая может переносить ацильную группу к стеролу и/или станолу, может быть особенно полезным для пищевых продуктов, включающих яйца. В частности, было найдено, что после обработки липид-ацилтрансферазой, как она определена здесь, может быть получен продукт на основе яиц со значительно лучшими свойствами по сравнению с продуктами на основе яиц, обработанными обычными фосфолипазами, такими как, например, LipopanF® (Novozymes A/S, Denmark), Lecitase Ultra® (Novozymes A/S, Denmark), или Lipomod 22 L от Biocatalysts.
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению может быть характеризован следующими критериями:
(i) фермент обладает ацилтрансферазной активностью, которая может быть определена как активность переноса эфира, в результате чего ацильная часть первоначальной эфирной связи липидного донора ацила переносится к акцептору ацила, образуя новый эфир, и
(ii) фермент включает фрагмент аминокислотной последовательности GDSX, где X представляет один или несколько из следующих аминокислотных радикалов: L, A, V, I, F, Y, H, Q, T, N, M или S.
Предпочтительно, X фрагмента GDSX представляет L. Таким образом, предпочтительно, фермент согласно настоящему изобретению включает фрагмент последовательности аминокислот GSDL.
Фрагмент GSDL состоит из четырех сохраненных аминокислот. Предпочтительно, серин внутри фрагмента представляет каталитический серин фермента липид-ацилтрансферазы. Предпочтительно, серин фрагмента GSDX может быть в положении, соответствующем Ser-16 в липолитическом ферменте Aeromonas hydrophilla, описанном Brumlik & Buckley (Journal of Bacteriology Apr. 1996, Vol. 178, No. 7, p. 2060-2064).
Для того чтобы определить, имеет ли протеин фрагмент GSDX согласно настоящему изобретению, последовательность, предпочтительно, сравнивают с профилями скрытой марковской модели (профилями HMM) базы данных Pfam.
Pfam представляет собой базу данных по семействам доменов протеинов. Pfam содержит выверенные выравнивания кратных последовательностей для каждого семейства, а также профиль скрытой марковской модели (профиль НММ) для идентификации таких доменов в новых последовательностях. Введение в Pfam можно найти в Bateman A. et al. (2002) Nucleic Acid Res. 30; 276-280. Скрытые марковские модели используются в ряде баз данных, нацеленных на идентификацию протеинов, для обзора см. Bateman A. and Haft DH (2002) Brief Bioinform 3; 236-245.
Для подробного объяснения скрытых марковских моделей и того, как они использованы в базе данных Pfam, см. Durbin R., Eddy S. and Krogh A. (1998) Biological sequence analysis; probabilistic models of proteins and nucleic acids, Cambridge University Press, ISBN 0-521-62041-4. Пакет программ Hammer может быть получен из Washington University, St. Louis, USA.
Альтернативно, фрагмент GDSX может быть идентифицирован с использованием пакета программ Hammer, инструкции представлены в Durbin R., Eddy S. and Krogh A. (1998) Biological sequence analysis; probabilistic models of proteins and nucleic acids, Cambridge University Press, ISBN 0-521-62041-4 и в имеющихся там ссылках, и в профиле HMMER2, представленном в настоящей заявке.
Доступ к базе данных Pfam может быть осуществлен, например, через несколько серверов, которые в настоящее время размещены на следующих веб-сайтах:
Эта база данных предлагает возможность поиска, куда можно ввести белковую последовательность. Используя параметры по умолчанию базы данных, белковая последовательность будет затем анализироваться на присутствие доменов Pfam. Домен GDSX является признанным доменом в базе данных, и раз так, то его присутствие в любой запрашиваемой последовательности должно быть распознано. База данных должна вернуть выравнивание Pfam00657 консенсусной последовательности в запрашиваемую последовательность.
Множественное выравнивание, включающее Aeromonas salmonicida или Aeromonas hydrophila, может быть получено:
а) вручную
получить выравнивание целевого протеина к консенсусной последовательности Pfam00657 и получить выравнивание P10480 к консенсусной последовательности Pfam00657 после описанной выше процедуры;
или
b) из базы данных
После идентификации консенсусной последовательности Pfam00657 база данных предлагает показать выравнивание запрашиваемой последовательности к начальному выравниванию консенсусной последовательности Pfam00657. P10480 является частью этого начального выравнивания и указывается с помощью GCAT-AERHY. И запрашиваемая последовательность, и P10480 будут показаны на дисплее в одном и том же окне.
Референтная последовательность Aeromonas hydrophila:
Радикалы липазы Aeromonas hydrophila GDSX нумеруются в NCBI файле Р10480, номера в данном тексте относятся к номерам, приведенным в том файле, который используют в настоящем изобретении для определения специфических аминокислотных остатков, которые в предпочтительном варианте осуществления присутствуют в ферментах липид-ацилтрансферазы по изобретению.
Выравнивание Pfam представлено на фиг.33 и 34.
Следующие сохраненные радикалы могут быть распознаны и в предпочтительном варианте осуществления могут присутствовать в ферментах для применения в композициях и способах по изобретению.
Блок 1 – блок GDSX
| hid |
hid |
hid |
hid |
Gly |
Asp |
Ser |
hid |
| 28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
Блок 2 – блок GANDY
| hid |
Gly |
hid |
Asn |
Asp |
hid |
| 130 |
131 |
132 |
133 |
134 |
135 |
Блок 3 – блок HPT
| His |
 |
| 309 |
 |
где “hid” означает гидрофильный остаток, выбранный из Met, Ile, Leu, Val, Ala, Gly, Cys, His, Lys, Trp, Tyr, Phe.
Предпочтительно, фермент липид-ацилтрансфераза для применения в композициях/способах по изобретению может быть выровнен с использованием консенсусной последовательности Pfam00657.
Предпочтительно, положительная совместимость с профилем скрытой марковской модели (профилем НММ) семейства доменов pfam00657 показывает присутствие домена GDSX или GDSL согласно настоящему изобретению.
Предпочтительно, липид-ацилирансфераза для применения в композициях/способах по изобретению, когда она выравнена к консенсусной последовательности Pfam00657, имеет по меньшей мере больше одного, предпочтительно, больше двух из следующих блоков: блок GDSX, блок GANDY, блок HTP. Допустимо, когда липид-ацилтрансфераза имеет блок GDSX и блок GANDY. Альтернативно, фермент может иметь блок GDSX и блок HTP. Предпочтительно, фермент включает по меньшей мере блок GDSX.
Предпочтительно, фермент для применения в композициях/способах по изобретению, когда он выравнен к консенсусной последовательности Pfam00657, когда его сравнивают с референтной полипептидной последовательностью A.hydrophila, а именно SEQ ID No. 32, имеет по меньшей мере один, предпочтительно, больше одного, предпочтительно, больше двух, предпочтительно, больше трех, предпочтительно, больше четырех, предпочтительно, больше пяти, предпочтительно, больше шести, предпочтительно, больше семи, предпочтительно, больше восьми, предпочтительно, больше девяти, предпочтительно, больше десяти, предпочтительно, больше одиннадцати, предпочтительно, больше двенадцати, предпочтительно, больше тринадцати, предпочтительно, больше четырнадцати следующих остатков аминокислот: 28hid, 29hid, 30hid, 31hid, 32gly, 33Asp, 34Ser, 35hid, 130hid, 131Gly, 132Hid, 133Asn, 134Asp, 135hid, 309His.
Домен pfam00657 GDSX является уникальным идентификатором, который отличает протеины, обладающие указанным доменом, от других ферментов.
Консенсусная последовательность pfam00657 представлена на фиг.1 как SEQ ID No. 1. Она получена идентификацией семейства pfam00657 версии 6 базы данных, которая может также называться здесь как pfam00657.6.
Консенсусная последовательность может быть усовершенствована при использовании следующих версий базы данных Pfam.
Например, фиг.33 и 34 показывают pfam выравнивание семейства 00657 из версии 11 базы данных, которая может также называться здесь как pfam00657.11.
Присутствие блоков GDSX, GANDY и НРТ обнаружено в семействе pfam00657 обеих версий базы данных. Последующие версии базы данных Pfam могут быть использованы для идентификации семейства pfam00657.
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению может быть характеризован с использованием следующих критериев:
(i) фермент обладает ацилтрансферазной активностью, которая может быть определена как активность переноса эфира, в результате чего ацильная часть первоначальной эфирной связи липидного донора ацила переносится к акцептору ацила, образуя новый эфир;
(ii) фермент включает фрагмент последовательности аминокислот GDSX, где X представляет собой один или несколько из следующих аминокислотных радикалов: L, A, V, I, F, Y, H, Q, T, N, M или S;
(iii) фермент включает His-309 или включает гистидиновый радикал в положении His-309 в липолитическом ферменте Aeromonas hydrophila, показанном на фиг.2 (SEQ ID No. 2 или SEQ ID No. 32).
Предпочтительно, аминокислотным радикалом фрагмента GDSX является L.
В SEQ ID No. 2 или SEQ ID No. 32 первые 18 аминокислотных радикалов образуют сигнальную последовательность. His-309 последовательности полной длины, т.е. протеин, включающий сигнальную последовательность, приравнивается к His-291 зрелой части протеина, т.е. последовательности без сигнальной последовательности.
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению включает следующую каталитическую триаду: Ser-34, Asp-134 и His-309 или включает сериновый остаток, остаток аспарагиновой кислоты и остаток гистидина соответственно в положениях, соответствующих Ser-34, Asp-134 и His-309, в липолитическом ферменте Aeromonas hydrophila, показанном на фиг.2 (SEQ ID No. 2) или фиг.28 (SEQ ID No. 32). Как заявлено выше, в последовательности, показанной в SEQ ID No. 2 или SEQ ID No. 32, первые 18 аминокислотных радикалов образуют сигнальную последовательность. Ser-34, Asp-134 и His-309 последовательности полной длины, т.е. протеина, включающего сигнальную последовательность, приравниваются к Ser-16, Asp-116 и His-291 зрелой части протеина, т.е. последовательности без сигнальной последовательности. В консенсусной последовательности pfam00657, которая приведена на фиг.1 (SEQ ID No. 1), остатки активного сайта соответствуют Ser-7, Asp-157 и His-348.
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению может быть характеризован с использованием следующих критериев:
(i) фермент обладает ацилтрансферазной активностью, которая может быть определена как активность переноса эфира, в результате чего ацильная часть первоначальной эфирной связи первого липидного донора ацила переносится к акцептору ацила, образуя новый эфир;
(ii) фермент включает по меньшей мере Gly-32, Asp-33, Ser-34, Asp-134 и His-309 или включает остатки глицина, аспарагиновой кислоты, серина, аспарагиновой кислоты и гистидина в положениях, соответствующих Gly-32, Asp-33, Ser-34, Asp-134 и His-309 в липолитическом ферменте Aeromonas hydrophila, показанном на фиг.2 (SEQ ID No. 2) или фиг.28 (SEQ ID No. 32).
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению может быть получен, еще более предпочтительно, фермент получен из организмов из одного или нескольких из следующих родов: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobacterium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mezorhizobium, Ralstonia, Xanthomonas и Candida.
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению может быть получен, еще более предпочтительно, фермент получен из одного или нескольких из следующих организмов: Aeromonas hydrophila, Aeromonas salmonicida, Streptomyces coelicolor, Streptomyces rimosus, Mycobacterium, Streptococcus pyogenes, Lactococcus lactis, Streptococcus pyogenes, Streptococcus thermophilus, Lactobacillus helveticus, Desulfitobacterium dehalogenans, Bacillus sp., Campylobacter jejuni, Vibrionaceae, Xylella fastidiosa, Sulfolobus solfataricus, Saccharomyces cervisiae, Aspergillus terreus, Schizosaccharomyces pombe, Listeria innocua, Listeria monocitrogenes, Neisseria meningitides, Mezorhizobium loti, Ralstonia solanacearum, Xanthomonas campestris и Candida parapsilosis.
В одном аспекте, предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению является получаемым и, предпочтительно, полученным из одного или более из Aeromonas hydrophila или Aeromonas salmonicida.
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению включает одну или несколько из следующих последовательностей аминокислот:
(i) последовательность аминокислот, показанная как SEQ ID No. 2 (см. фиг.2);
(ii) последовательность аминокислот, показанная как SEQ ID No. 3 (см. фиг.3);
(iii) последовательность аминокислот, показанная как SEQ ID No. 4 (см. фиг.4);
(iv) последовательность аминокислот, показанная как SEQ ID No. 5 (см. фиг.5);
(v) последовательность аминокислот, показанная как SEQ ID No. 6 (см. фиг.6);
(vi) последовательность аминокислот, показанная как SEQ ID No. 12 (см. фиг.14);
(vii) последовательность аминокислот, показанная как SEQ ID No. 20 (см. фиг.16);
(viii) последовательность аминокислот, показанная как SEQ ID No. 22 (см. фиг.18);
(ix) последовательность аминокислот, показанная как SEQ ID No. 24 (см. фиг.20);
(x) последовательность аминокислот, показанная как SEQ ID No. 26 (см. фиг.22);
(xi) последовательность аминокислот, показанная как SEQ ID No. 28 (см. фиг.24);
(xii) последовательность аминокислот, показанная как SEQ ID No. 30 (см. фиг.26);
(xiii) последовательность аминокислот, показанная как SEQ ID No. 32 (см. фиг.28);
(xiv) последовательность аминокислот, показанная как SEQ ID No. 34 (см. фиг.30), или последовательность аминогрупп, которая имеет 75% или более идентичности с любой одной из последовательностей, показанных как SEQ ID No. 2; SEQ ID No. 3; SEQ ID No. 4; SEQ ID No. 5; SEQ ID No. 6; SEQ ID No. 12; SEQ ID No. 20; SEQ ID No. 22; SEQ ID No. 24; SEQ ID No. 26; SEQ ID No. 28; SEQ ID No. 30; SEQ ID No. 32; SEQ ID No. 34.
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению включает или последовательность аминокислот, показанную как SEQ ID No. 2, или SEQ ID No. 3, или SEQ ID No. 4, или SEQ ID No. 32, или SEQ ID No. 34, или включает последовательность аминокислот, которая имеет 75% или более, предпочтительно, 80% или более, предпочтительно, 85% или более, предпочтительно, 90% или более, предпочтительно, 95% или более идентичности с последовательностью аминокислот, показанной как SEQ ID No. 2, или с последовательностью аминокислот, показанной как SEQ ID No. 3, или с последовательностью аминокислот, показанной как SEQ ID No. 4, или с последовательностью аминокислот, показанной как SEQ ID No. 32, или с последовательностью аминокислот, показанной как SEQ ID No. 34.
Для целей настоящего изобретения степень идентичности основывается на числе элементов последовательности, которые являются одинаковыми. Степень идентичности в соответствии с настоящим изобретением может быть определена посредством компьютерных программ, известных в практике, таких как GAP GCG (Program Manual for the Wisconsin Package, Version 8, August 1994, Genetics Computer Group, 575 Science Drive, Madison, Wisconsin, US53711) (Needleman & Wunsch (1970), J. of Molecular Biology 48, 443-45), с использованием следующих установок для сравнения полипептидных последовательностей: погрешность создания GAP3,0 и погрешность расширения GAP 0,1.
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению включает 80% или более, предпочтительно, 85% или более, более предпочтительно, 90% или более, и еще более предпочтительно, 95% или более идентичности с любой одной из следующих последовательностей, показанных как SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No. 6, SEQ ID No. 12, SEQ ID No. 20, SEQ ID No. 22, SEQ ID No. 24, SEQ ID No. 26, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 32 или SEQ ID No. 34.
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению включает одну или несколько из следующих последовательностей аминокислот:
(a) последовательность аминокислот, показанная как остатки аминокислот 1-100 от SEQ ID No. 2 или SEQ ID No. 32;
(b) последовательность аминокислот, показанная как остатки аминокислот 101-200 от SEQ ID No. 2 или SEQ ID No. 32;
(c) последовательность аминокислот, показанная как остатки аминокислот 201-300 от SEQ ID No. 2 или SEQ ID No. 32; или
(d) последовательность аминокислот, которая имеет 75% или более, предпочтительно, 85% или более, более предпочтительно, 90% или более, и еще более предпочтительно, 95% или более идентичности с любой одной из последовательностей, определенных выше в (a) – (c).
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению включает одну или несколько из следующих последовательностей аминокислот:
(a) последовательность аминокислот, показанная как остатки аминокислот 28-39 от SEQ ID No. 2 или SEQ ID No. 32;
(b) последовательность аминокислот, показанная как остатки аминокислот 77-88 от SEQ ID No. 2 или SEQ ID No. 32;
(c) последовательность аминокислот, показанная как остатки аминокислот 126-136 от SEQ ID No. 2 или SEQ ID No. 32;
(d) последовательность аминокислот, показанная как остатки аминокислот 163-175 от SEQ ID No. 2 или SEQ ID No. 32;
(e) последовательность аминокислот, показанная как остатки аминокислот 304-311 от SEQ ID No. 2 или SEQ ID No. 32;
(f) последовательность аминокислот, которая имеет 75% или более, предпочтительно, 85% или более, более предпочтительно, 90% или более, и еще более предпочтительно, 95% или более идентичности с любой одной из последовательностей, определенных выше в (a) – (e).
Предпочтительно, фермент липид-ацилтрансфераза согласно настоящему изобретению включает последовательность аминокислот, полученную экспрессией или одну или несколько из следующих нуклеотидных последовательностей:
(a) нуклеотидную последовательность, показанную как SEQ ID No. 7 (см. фиг.9);
(b) нуклеотидную последовательность, показанную как SEQ ID No. 8 (см. фиг.10);
(c) нуклеотидную последовательность, показанную как SEQ ID No. 9 (см. фиг.11);
(d) нуклеотидную последовательность, показанную как SEQ ID No. 10 (см. фиг.12);
(e) нуклеотидную последовательность, показанную как SEQ ID No. 11 (см. фиг.13);
(f) нуклеотидную последовательность, показанную как SEQ ID No. 13 (см. фиг.15);
(g) нуклеотидную последовательность, показанную как SEQ ID No. 21 (см. фиг.17);
(h) нуклеотидную последовательность, показанную как SEQ ID No. 23 (см. фиг.19);
(i) нуклеотидную последовательность, показанную как SEQ ID No. 25 (см. фиг.21);
(j) нуклеотидную последовательность, показанную как SEQ ID No. 27 (см. фиг.23);
(k) нуклеотидную последовательность, показанную как SEQ ID No. 29 (см. фиг.25);
(l) нуклеотидную последовательность, показанную как SEQ ID No. 31 (см. фиг.27);
(m) нуклеотидную последовательность, показанную как SEQ ID No. 33 (см. фиг.29);
(n) нуклеотидную последовательность, показанную как SEQ ID No. 35 (см. фиг.31); или
(o) нуклеотидную последовательность, которая имеет 75% или более идентичности с любой одной из последовательностей, показанных как SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 13, SEQ ID No. 21, SEQ ID No. 23, SEQ ID No. 25, SEQ ID No. 27, SEQ ID No. 29, SEQ ID No. 31, SEQ ID No. 33 или SEQ ID No. 35.
Предпочтительно, нуклеотидная последовательность может иметь 80% или более, предпочтительно, 85% или более, более предпочтительно, 90% или более и еще более предпочтительно, 95% или более идентичности с любой одной из последовательностей, показанных как SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 13, SEQ ID No. 21, SEQ ID No. 23, SEQ ID No. 25, SEQ ID No. 27, SEQ ID No. 29, SEQ ID No. 31, SEQ ID No. 33 или SEQ ID No. 35.
В одном аспекте липид-ацилтрансфераза согласно настоящему изобретению может быть лецитин:холестерин ацилтрансферазами (LCAT) или их вариантом (например, вариантом, полученным молекулярной эволюцией).
Подходящие LCAT известны в практике и могут быть получены из одного или нескольких из следующих организмов, например из млекопитающих, мышей, крыс, цыплят, Drosophila melanogaster, Arabidospis и Oryza sativa, нематод, грибов и дрожжей.
В одном варианте осуществления фермент липид-ацилтрансфераза согласно настоящему изобретению может быть липид-ацилтрансферазой, которая может быть получена, предпочтительно, которая получена из штаммов E. coli ТОР 10 хранилище pPet12Aahydro и pPet12aASalmo, депонированных Danisco A/S of Langebrodgade 1, DK-1001 Copenhagen K, Denmark согласно Будапештскому договору о международном признании Депозитария микроорганизмов для целей процедуры патентования за National Collection of Industrial, Marine and Food Bacteria (NCIMB) 23 St. Machar Street, Aberdeen Scotland, GB от 23 декабря 2003 под инвентарными номерами NICMB 41204 и NICMB 41205 соответственно.
Предпочтительно, когда осуществляют способ согласно настоящему изобретению, продукт получают без увеличения или существенного увеличения свободных жирных кислот в пищевом продукте.
Термин “трансфераза”, как он использован здесь, является взаимозаменяемым с термином “липид-трансфераза”.
Соответственно, липид-трансфераза, как она определена здесь, катализирует одну или несколько из следующих реакций: интерэтерификацию, трансэтерификацию, алкоголиз, гидролиз.
Термин “интерэтерификация” относится к ферментативно катализируемому переносу ацильных групп между липидом-донором и липидом-акцептором, где липид-донор не является свободной ацильной группой.
Термин “трансэтерификация”, как он использован здесь, означает ферментативно катализируемый перенос ацильной группы от липида-донора (отличного от свободной жирной кислоты) к акцептору ацила (отличному от воды).
Термин “алкоголиз”, как он использован здесь, относится к ферментативному разложению ковалентной связи производных кислот реакцией со спиртом ROH так, что один из продуктов соединяется с Н спирта, а другой продукт соединяется с группой ОН спирта.
Термин “спирт”, как он использован здесь, относится к алкильному соединению, содержащему гидроксильную группу.
Термин “гидролиз”, как он использован здесь, относится к ферментативно катализируемому переносу ацильной группы от липида к ОН-группе молекулы воды. Перенос ацила, который является результатом гидролиза, требует отделения молекулы воды.
Термин “без увеличения или существенного увеличения свободных жирных кислот”, как он использован здесь, означает, что, предпочтительно, липид-ацилтрансфераза согласно настоящему изобретению имеет 100% трансферазную активность (т.е. переносит 100% ацильных групп от донора ацила на акцептор ацила, без гидролитической активности), однако фермент может перенести меньше чем 100% ацильных групп, присутствующих в доноре ацила, к акцептору ацила. В таком случае, предпочтительно, ацилтрансферазная активность насчитывает по меньшей мере 5%, более предпочтительно, по меньшей мере 10%, более предпочтительно, по меньшей мере 20%, более предпочтительно, по меньшей мере 30%, более предпочтительно, по меньшей мере 40%, более предпочтительно, по меньшей мере 50%, более предпочтительно, по меньшей мере 60%, более предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%, более предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 98% от общей ферментной активности. Процент трансферазной активности (т.е. трансферазная активность в процентах от общей ферментной активности) может быть определен по следующему протоколу.
Протокол определения % трансферазной активности
Пищевой продукт, к которому была добавлена липид-ацилтрансфераза согласно настоящему изобретению, может быть экстрагирован после ферментативной реакции смесью CHCl3:CH3OH 2:1, и органическую фазу, содержащую липидный материал, выделяют и анализируют методами ГЖХ и ЖХВД согласно методике, подробно описанной здесь ниже. По анализам определяли количество свободных жирных кислот и одного или нескольких из эфиров стеролов/станолов, эфиров углеводов, эфиров протеинов, диглицеридов или моноглицеридов. Контрольный пищевой продукт, к которому не добавляли фермент согласно настоящему изобретению, анализировали подобным образом.
Расчет
Из результатов анализов ГЖХ и ЖХВД может быть рассчитано увеличение содержания свободных жирных кислот и одного или нескольких из эфиров стеролов/станолов, эфиров углеводов, эфиров протеинов, диглицеридов или моноглицеридов.
 % жирной кислоты = % жирной кислоты (фермент) – % жирной кислоты (контроль); Mv жирной кислоты = средний молекулярный вес жирной кислоты; % жирной кислоты = % жирной кислоты (фермент) – % жирной кислоты (контроль); Mv жирной кислоты = средний молекулярный вес жирной кислоты;
А =  % стерольного эфира/Mv стерольного эфира (где % стерольного эфира/Mv стерольного эфира (где  % стерольного эфира = % эфира стерола/станола (фермент) – % эфира стерола/станола (контроль) и Mv стерольного эфира = средний молекулярный вес эфиров стерола/станола) – применимо, когда акцептором ацила является стерол и/или станол; % стерольного эфира = % эфира стерола/станола (фермент) – % эфира стерола/станола (контроль) и Mv стерольного эфира = средний молекулярный вес эфиров стерола/станола) – применимо, когда акцептором ацила является стерол и/или станол;
В =  % эфира углевода/Mv эфира углевода (где % эфира углевода/Mv эфира углевода (где  % эфира углевода = % эфира углевода (фермент) – % эфира углевода (контроль) и Mv эфира углевода = средний молекулярный вес эфира углевода) – применимо, когда акцептором ацила является углевод; % эфира углевода = % эфира углевода (фермент) – % эфира углевода (контроль) и Mv эфира углевода = средний молекулярный вес эфира углевода) – применимо, когда акцептором ацила является углевод;
С =  % эфира протеина/Mv эфира протеина (где % эфира протеина/Mv эфира протеина (где  % эфира протеина = % эфира протеина (фермент) – % эфира протеина (контроль) и Mv эфира протеина = средний молекулярный вес эфира протеина) – применимо, когда акцептором ацила является протеин; и % эфира протеина = % эфира протеина (фермент) – % эфира протеина (контроль) и Mv эфира протеина = средний молекулярный вес эфира протеина) – применимо, когда акцептором ацила является протеин; и
D = абсолютная величина диглицерида и/или моноглицерида/Mv ди/моноглицерида (где  % диглицерида и/или моноглицерида = % диглицерида и/или моноглицерида (фермент) – % диглицерида и/или моноглицерида (контроль) и Mv ди/моноглицерида = средний молекулярный вес диглицерида и/или моноглицерида) – применимо, когда акцептором ацила является глицерин. % диглицерида и/или моноглицерида = % диглицерида и/или моноглицерида (фермент) – % диглицерида и/или моноглицерида (контроль) и Mv ди/моноглицерида = средний молекулярный вес диглицерида и/или моноглицерида) – применимо, когда акцептором ацила является глицерин.
Трансферазную активность рассчитывают как процент от общей ферментативной активности.
 * – исключить, если требуется. * – исключить, если требуется.
Если содержание свободных жирных кислот в пищевом продукте возросло, то оно, предпочтительно, не возросло существенно, т.е. в значительной степени. Под этим подразумевается, что увеличение содержания свободных жирных кислот не повлияет отрицательно на качество пищевого продукта.
В некоторых аспектах настоящего изобретения термин “без существенного увеличения свободных жирных кислот”, как он использован здесь, означает, что количество свободных жирных кислот в пищевом продукте или композиции, обработанных липид-ацилтрансферазой согласно настоящему изобретению, меньше, чем количество свободных жирных кислот в пищевом продукте или композиции, когда был использован фермент, отличный от липид-ацилтрансферазы согласно настоящему изобретению, так, как, например, при сравнении с количеством свободной жирной кислоты, образовавшимся, когда был использован обычный фосфолипазный энзим, например Lipofan® (Novozymes A/S, Denmark).
Термин “in situ“, как он использован здесь, означает, что эмульгатор (эмульгаторы), и/или эфиры стерола/станола, и/или эфиры углеводов, и/или эфиры протеинов, и/или моно- или диглицериды образуются внутри пищевого продукта или части пищевого продукта. Это отличается от ситуации, где эмульгатор (эмульгаторы), и/или эфиры стерола/станола, и/или эфиры углеводов, и/или эфиры протеинов, и/или моно- или диглицериды образуются отдельно от пищевого продукта и добавляются как сформировавшиеся продукты к пищевому продукту во время его приготовления. Другими словами, термин “in situ“, как он использован здесь, означает, что путем добавления липид-ацилтрансферазы согласно настоящему изобретению к пищевому продукту или к пищевым ингредиентам/материалам, образующим пищевой продукт, эмульгатор (эмульгаторы), и/или эфиры стерола/станола, и/или эфиры углеводов, и/или эфиры протеинов, и/или моно- или диглицериды могут образоваться из компонентов пищевого продукта. Соответственно, компоненты пищевого продукта могут быть субстратом (субстратами) для фермента. Если необходимо, компоненты пищевого продукта могут быть дополнены одним или несколькими дополнительными компонентами, которые могут быть теми же компонентами, которые присутствуют в пищевом продукте, или могут быть дополнительными по отношению к компонентам, которые уже присутствуют в пищевом продукте. Во избежание сомнений в одном варианте осуществления способ согласно настоящему изобретению может быть способом образования эмульгатора, и/или эфира стерола, и/или эфира станола, и/или эфира углевода, и/или эфира протеина, и/или моно- или диглицерида in situ в пищевом продукте, а не являться способом приготовления эмульгатора, и/или эфира стерола, и/или эфира станола (например, в выделенной и очищенной форме) для последующего добавления к пищевому продукту.
В другом варианте осуществления липаза ацилтрансфераза может быть использована во время приготовления пищи, но не оставаться в пищевом продукте. Например, липаза ацилтрансфераза может быть иммобилизована, что позволяет ее повторное использование.
Предпочтительно, липид-ацилтрансфераза согласно настоящему изобретению способна переносить ацильную группу от липида к стеролу, и/или станолу, и/или углеводу, и/или протеину, и/или глицерину, когда присутствует в полярной среде, предпочтительно, в водной среде, предпочтительно, в содержащем воду пищевом продукте. Соответственно, водной средой может быть водный буфер или может быть водная фаза пищевого продукта. Термин “водная среда”, как он использован здесь, предпочтительно, означает среду, в которой отсутствует органический растворитель, предпочтительно, отсутствует полярный органический растворитель, более предпочтительно, отсутствует непищевой органический растворитель. В частности, термин “водная среда” может относиться к среде, в которую не были добавлены экзогенные органические растворители, предпочтительно, не были добавлены полярные растворители. Термин “органический растворитель”, как он использован здесь, не охватывает пищевые масла, предпочтительно, не охватывает пищевые масла, которые богаты неполярными липидами. В одном варианте осуществления термин “органический растворитель” может исключать пищевые органические растворители, такие как этанол, пропиленгликоль и/или глицерин. Подходящая водная среда согласно настоящему изобретению может включать менее 80% об. органических растворителей, меньше 70% об. органических растворителей, меньше 50% об. органических растворителей, меньше 30% об. органических растворителей, более предпочтительно, меньше 15% об. органических растворителей, более предпочтительно, меньше 5% об. органических растворителей. Предпочтительно, пищевой продукт может включать между 1% и 5% органического растворителя, например этанола. Однако, когда пищевой продукт включает такой органический растворитель, предпочтительно, он образуется эндогенно внутри пищевого продукта. Иначе говоря, когда пищевой продукт включает такой органический растворитель, предпочтительно, органический растворитель не является экзогенным органическим растворителем.
Предпочтительно, пищевой продукт согласно настоящему изобретению может быть “легкой пищей”, включающей кексы, пасты, кондитерские изделия, шоколад, молочные конфеты и т.п.
В одном аспекте пищевым продуктом согласно настоящему изобретению могут быть продукт из теста или выпеченный продукт, такой как хлеб, жареный продукт, легкая закуска, пирожные, пироги, шоколадные пирожные, булочки, лапша, предметы легкой закуски, такие как крекеры, грехемовские крекеры, соленые крендельки, картофельные чипсы и паста.
В следующем аспекте пищевым продуктом согласно настоящему изобретению может быть пищевой продукт растительного происхождения, такой как крупы, премиксы, масла, жиры, кокосовое масло, забеливатель кофе, заправки для салата, маргарин, пастообразные продукты, арахисовое масло, кулинарный жир, мороженое, кулинарные масла.
В другом аспекте пищевым продуктом согласно настоящему изобретению может быть молочный продукт, включая сливочное масло, молоко, сливки, сыр, такой как натуральный, переработанный сыр и имитационные сыры в различных формах (включая измельченные, в блоках, ломтиках или тертые), сливочный сыр, мороженое, замороженные десерты, йогурт, напитки из йогурта, жир масла, безводный молочный жир, другие молочные продукты. Фермент согласно настоящему изобретению может улучшить стабильность жира в молочных продуктах.
Особо предпочтительно, использование настоящего изобретения в сырах, поскольку образование свободных жирных кислот в сыре связано с “мыльным” вкусом. Так, использование липид-ацилтрансферазы согласно настоящему изобретению преимущественно дает сыр без “мыльного” вкуса.
В другом аспекте пищевым продуктом СЕИ может быть пищевой продукт, содержащий ингредиенты животного происхождения, такие как переработанный мясопродукт, кулинарные масла, кулинарные жиры.
В следующем аспекте пищевым продуктом согласно настоящему изобретению может быть напиток, фруктовый, смешанный фруктовый, овощной или вино. В некоторых случаях напиток может содержать до 20 г/л добавленных фитостеролов.
В другом аспекте пищевым продуктом согласно настоящему изобретению может быть корм для животных. Корм для животных может быть обогащен фитостеролом и/или фитостанолами, предпочтительно, бета-ситостеролом/станолом. Предпочтительно, корм для животных может быть кормом для домашней птицы. Если кормом для животных является корм для домашней птицы, настоящее изобретение может быть использовано для того, чтобы уменьшить содержание холестерина в яйцах, производимых домашней птицей, которую кормят пищевым продуктом согласно настоящему изобретению.
В одном аспекте, предпочтительно, пищевой продукт выбирают из одного или нескольких следующих пищевых продуктов: яиц, продуктов на основе яиц, включая майонез, заправку для салата, соусы, мороженое, яичный порошок, модифицированный яичный желток и изготовленные из них продукты.
Предпочтительно, пищевой продукт согласно настоящему изобретению является содержащим воду пищевым продуктом. Соответственно, пищевой продукт может содержать 10-98% воды, обычно 14-98%, предпочтительно, 18-98% воды, предпочтительно, 20-98% воды, предпочтительно, 40-98% воды, предпочтительно, 50-98% воды, предпочтительно, 70-98% воды, предпочтительно, 75-98% воды.
Для некоторых аспектов, предпочтительно, пищевой продукт согласно настоящему изобретению является не чистым полученным из растений маслом, таким как, например, оливковое масло, подсолнечное масло, арахисовое масло, рапсовое масло. Во избежание сомнений в некоторых аспектах настоящего изобретения пищевой продукт согласно настоящему изобретению может включать масло, но предпочтительно, пищевой продукт не состоит главным образом из масла или смеси масел. Для некоторых аспектов, предпочтительно, пищевой продукт включает меньше 95% липидов, предпочтительно, меньше 90% липидов, предпочтительно, меньше 85% липидов, предпочтительно, меньше 80% липидов. Таким образом, для некоторых аспектов настоящего изобретения масло может быть компонентом пищевого продукта, но предпочтительно, пищевой продукт не является маслом per se.
Формула настоящего изобретения должна истолковываться так, чтобы включать каждый из перечисленных выше пищевых продуктов.
В случае, когда образуется эфир углевода согласно настоящему изобретению, эфир углевода, предпочтительно, является эфиром олигосахарида, эфиром моносахарида или эфиром дисахарида.
Соответственно, эфир углевода, когда он образуется согласно настоящему изобретению, может быть одним или несколькими из следующих: эфир глюкозы, эфир фруктозы, эфир ангидрофруктозы, эфир мальтозы, эфир лактозы, эфир галактозы, эфир ксилозы, эфир ксилоолигосахарида, эфир арабинозы, эфир мальтоолигосахарида, эфир тагатозы, эфир сахарозы, эфир микротецина, эфир аскопирона Р, эфир аскопирона Т или эфир кортальцерона.
Предпочтительно, эфир углевода, когда он образуется согласно настоящему изобретению, является одним или несколькими из следующих: моноэфир углевода, моноэфир сахара, моноэфир олигосахарида, моноэфир трисахарида, моноэфир дисахарида, моноэфир моносахарида, моноэфир глюкозы, моноэфир фруктозы, моноэфир ангидрофруктозы, моноэфир мальтозы, моноэфир лактозы, моноэфир галактозы, моноэфир ксилозы, моноэфир ксилоолигосахарида, моноэфир арабинозы, моноэфир мальтоолигосахарида, моноэфир тагатозы, моноэфир сахарозы, моноэфир микротецина, моноэфир аскопирона Р, моноэфир аскопирона Т или моноэфир кортальцерона.
В одном варианте осуществления эфир микротецина, эфир аскопирона Р, эфир аскопирона Т и/или эфир кортальцерона могут действовать в качестве антимикробного агента. Альтернативно или в дополнение к этому эфир микротецина, эфир аскопирона Р, эфир аскопирона Т и/или эфир кортальцерона могут действовать в качестве одного или обоих из антиоксиданта и/или эмульгатора.
Предпочтительно, образование эфира углевода (если происходит) согласно настоящему изобретению является независимым от UDP-глюкозы.
Предпочтительно, пищевой продукт согласно настоящему изобретению не включает UDP-глюкозу или включает UDP-глюкозу лишь в незначительных количествах.
Подходящий эмульгатор согласно настоящему изобретению может быть, например, одним или несколькими из следующих: диглицерид, моноглицерид, такой как 1-моноглицерид или лизолецитин, например, такой как лизофосфатидилхолин, дигалактозил моноглицерид (DGMG). Эмульгатор, предпочтительно, образуется из липидного донора ацила вслед за удалением от указанного липидного донора ацила одной или нескольких ацильных групп. Термин “лизолецитин”, как он использован здесь, охватывает лизофосфатидилхолин, лизофосфатидилэтаноламин, лизофосфатидилинозитол, лизофосфатидилсерин и лизофосфатидилглицерин.
Когда одним из эмульгаторов является эфир углевода, вторым эмульгатором может быть, например, один или несколько из следующих: диглицерид, моноглицерид, такой как 1-моноглицерид, лизофосфатидилхолин или дигалактозилмоноглицерид (DGMG). Второй эмульгатор, предпочтительно, образуется из липидного донора ацила вслед за удалением от указанного липидного донора ацила одной или нескольких ацильных групп. Термин “лизофосфатидилхолин”, как он использован здесь, является синонимом термина “лизолецитин”, и эти термины могут использоваться здесь взаимозаменяемо.
Предпочтительно, вторым эмульгатором является DGMG. Обычно DGMG образуется “in situ” удалением ацильной группы от DGDG с переносом удаленной ацильной группы на углевод с образованием эфира углевода.
Когда одним из эмульгаторов является эфир протеина, и/или диглицерид, и/или моноглицерид, вторым эмульгатором может быть, например, один или несколько из следующих: диглицерид, моноглицерид, такой как 1-моноглицерид или лизолецитин, например, такой как лизофосфатидилхолин, дигалактозил моноглицерид (DGMG). Второй эмульгатор, предпочтительно, образуется из липидного донора ацила вслед за удалением от указанного липидного донора ацила одной или нескольких ацильных групп. Термин “лизофосфатидилхолин”, как он использован здесь, является синонимом термина “лизолецитин”, и эти термины могут использоваться здесь взаимозаменяемо.
В одном варианте осуществления липид-ацилтрансфераза может быть использована в способе получения пищевого продукта, такого как кулинарное масло, маргарин или паста для намазывания, благодаря тому что пищевой продукт содержит натуральный или введенный дополнительно глицерин, по меньшей мере один фосфолипид (например, лецитин) и/или гликолипид (например, дигалактозил-моноглицерид) и, необязательно, фитостерол или фитостанол.
Пищевой продукт, когда он используется как кулинарное масло или маргарин, может иметь улучшенные антипригарные свойства. В дополнение или альтернативно пищевой продукт может иметь одно или несколько из выгодных технических свойств, например улучшенную окислительную стабильность, улучшенные эмульгирующие свойства или быть полезным для здоровья.
В одном варианте осуществления липид-ацилтрансфераза по изобретению может быть использована при приготовлении маложирных пищевых продуктов, таких как маложирные пасты для намазывания, маложирные заправки для салатов, маложирный майонез, маложирные маргарины жира и т.д. В таких пищевых продуктах с низким содержанием жира содержание жира обычно понижено по сравнению с высокожирными эквивалентами путем добавления эмульгаторов и воды.
Было обнаружено, что липид-ацилтрансфераза, используемая в композициях и способах по изобретению, имеет уникальные свойства по сравнению с липолитическими ферментами в том, что она имеет явное предпочтение к переносу ацильных групп от липидов к акцепторам, отличным от воды, даже в присутствии значительного количества воды. Было обнаружено, что по сравнению с ранее использовавшимися ферментами липид-ацилтрансфераза, используемая по изобретению, имеет высокую относительную трансферазную активность в присутствии 6% воды, 54% воды, 73% воды, 89% воды и приблизительно 95% воды. Испытанные липолитические ферменты практически не имели значительной трансферазной активности при таких концентрациях воды.
Липазная и ацилтрансферазная активность фермента может быть оценена с использованием следующих анализов. Таким путем липид-ацилтрансфераза, имеющая определенные здесь ферментные характеристики, может быть получена/ идентифицирована.
Анализ трансферазы в забуференном субстрате (см. пример 12)
Ферменты, которые функционируют как липид-ацилтрансферазы, для применения в композициях и способах по изобретению могут быть рутинно идентифицированы с применением анализа, описанного здесь в примере 12. Этот анализ будет называться здесь далее “Анализ трансферазы в забуференном субстрате”. В примере 12 фермент липид-ацилтрансфераза из Aeromonas salmonicida в соответствии с настоящим изобретением анализировали и сравнивали с рядом липолитических ферментов, не охватываемых настоящим изобретением. Как можно видеть, было обнаружено, что из липолитических ферментов только LIPOPAN® F (Novozymes, Denmark) имел некоторую трансферазную активность, и то на очень низком уровне (1,3%).
Ферменты, пригодные для использования в композициях и способах по изобретению, могут быть рутинно идентифицированы при использовании “Анализ трансферазы в забуференном субстрате”. При использовании этого анализа, при котором имеется очень высокое содержание воды, приблизительно 95%, липид-ацилтрансферазами в соответствии с настоящим изобретением являются такие, которые имеют по меньшей мере 2% ацилтрансферазной активности (относительной трансферазной активности), предпочтительно, по меньшей мере 5% относительной трансферазной активности, предпочтительно, по меньшей мере 10% относительной трансферазной активности, предпочтительно, по меньшей мере 15%, 20%, 25%, 26%, 28%, 30%, 40%, 50%, 60% или 75% относительной трансферазной активности. Подходящая липид-ацилтрансфераза в соответствии с настоящим изобретением может иметь менее 28%, менее 30%, предпочтительно, менее 40%, 50%, 60%, 70%, 80%, 90% или 100% ацилтрансферазной активности.
Анализ трансферазы в сильно обводненном яичном желтке (см. пример 11)
Как альтернатива (или как дополнение) использованию “Анализа трансферазы в забуференном субстрате” (см. выше) липид-ацилтрансфераза для использования в соответствии с настоящим изобретением может быть идентифицирована с использованием “анализа трансферазы в сильно обводненном яичном желтке”, описанного здесь в примере 11.
В одном варианте осуществления липид-ацилтрансфераза, пригодная для применения в способах и композициях согласно настоящему изобретению, является той, которая при испытаниях с использованием “Анализа трансферазы в сильно обводненном яичном желтке” в яичном желтке с 54% воды имела до 100% относительной трансферазной активности. В действительности эксперименты с сильно обводненным яичным желтком показали, что в начале опыта начальная скорость трансферазы была рассчитана как соответствующая 100% трансферазной активности, т.е. гидролитическая активность не наблюдалась. Напротив, липолитические ферменты, использованные как контроль, т.е. LIPOPAN® F и фосфолипаза А2, не показали обнаруживаемой трансферазной активности в яичном желтке с 54% воды или в яичном желтке с обогащенным содержанием воды (а именно, яичном желтке с 73% воды или 89% воды). Предпочтительно, увеличение содержания воды не понижает значительно процент трансферазной активности липид-ацилтрансферазы для использования в способах или композициях согласно настоящему изобретению.
В предпочтительном варианте осуществления по результатам анализа трансферазы в сильно обводненном яичном желтке с содержанием воды 54% липид-ацилтрансфераза для использования в настоящем изобретении должна иметь начальный процент трансферазной активности (начальной относительной трансферазной активности), измеренный после расходования 10% молекулы-донора (т.е. фосфолипида) по меньшей мере 0,1% относительной трансферазной активности, предпочтительно, по меньшей мере 1% относительной трансферазной активности, предпочтительно, по меньшей мере 5% относительной трансферазной активности, предпочтительно, по меньшей мере 10% относительной трансферазной активности, предпочтительно, по меньшей мере 20% относительной трансферазной активности, предпочтительно, по меньшей мере 30% относительной трансферазной активности, предпочтительно, по меньшей мере 40% относительной трансферазной активности, предпочтительно, по меньшей мере 50% относительной трансферазной активности, предпочтительно, по меньшей мере 60% относительной трансферазной активности, предпочтительно, по меньшей мере 70% относительной трансферазной активности, предпочтительно, по меньшей мере 80% относительной трансферазной активности, предпочтительно, по меньшей мере 90% относительной трансферазной активности, предпочтительно, по меньшей мере 95% относительной трансферазной активности, предпочтительно, по меньшей мере 99% относительной трансферазной активности, предпочтительно, около 100% относительной трансферазной активности.
В предпочтительном варианте осуществления на основании анализа трансферазы в сильно обводненном яичном желтке с содержанием воды 54% и измерения после расходования 10% молекулы-донора (т.е. фосфолипида) липид-ацилтрансфераза для использования в композициях и способах по изобретению имеет обнаруживаемую трансферазную активность, т.е. относительную трансферазную активность между 0,1 и 100%, предпочтительно, по меньшей мере 1% относительной трансферазной активности, предпочтительно, по меньшей мере 5% относительной трансферазной активности, предпочтительно, по меньшей мере 10% относительной трансферазной активности, предпочтительно, по меньшей мере 20% относительной трансферазной активности, предпочтительно, по меньшей мере 20% относительной трансферазной активности, предпочтительно, по меньшей мере 30% относительной трансферазной активности, предпочтительно, по меньшей мере 40% относительной трансферазной активности, предпочтительно, по меньшей мере 45%, 50%, 60%, 70%, 80% или 90% относительной трансферазной активности. Подходящая липид-ацилтрансфераза в соответствии с настоящим изобретением может иметь при использовании анализа трансферазы в сильно обводненном яичном желтке с содержанием воды 54% и измерении после расходования 10% молекулы-донора (т.е. фосфолипида) процент ацилтрансферазной активности (относительную трансферазную активность) меньше 45%, 47%, 50%, 60%, 70%, 80%, 90% или 100%.
В предпочтительном варианте осуществления на основании анализа трансферазы в сильно обводненном яичном желтке с содержанием воды 73% и измерения после расходования 10% молекулы-донора (т.е. фосфолипида) липид-ацилтрансфераза для использования в композициях и способах по изобретению имеет обнаруживаемую трансферазную активность, т.е. относительную трансферазную активность между 0,1 и 100%, предпочтительно, по меньшей мере 1% относительной трансферазной активности, предпочтительно, по меньшей мере 5% относительной трансферазной активности, предпочтительно, по меньшей мере 10% относительной трансферазной активности, предпочтительно, по меньшей мере 20% относительной трансферазной активности, предпочтительно, по меньшей мере 20% относительной трансферазной активности, предпочтительно, по меньшей мере 30% относительной трансферазной активности, предпочтительно, по меньшей мере 40% относительной трансферазной активности, предпочтительно, по меньшей мере 45%, 50%, 60%, 70%, 80% или 90% относительной трансферазной активности. Подходящая липид-ацилтрансфераза в соответствии с настоящим изобретением может иметь при использовании анализа трансферазы в сильно обводненном яичном желтке с содержанием воды 73% и измерении после расходования 10% молекулы-донора (т.е. фосфолипида) процент ацилтрансферазной активности (относительную трансферазную активность) меньше 45%, 47%, 50%, 60%, 70%, 80%, 90% или 100%.
В предпочтительном варианте осуществления на основании анализа трансферазы в сильно обводненном яичном желтке с содержанием воды 89% и измерения после расходования 10% молекулы-донора (т.е. фосфолипида) липид-ацилтрансфераза для использования в композициях и способах по изобретению имеет обнаруживаемую трансферазную активность, т.е. относительную трансферазную активность от 0,1 до 100%, предпочтительно, по меньшей мере 1% относительной трансферазной активности, предпочтительно, по меньшей мере 5% относительной трансферазной активности, предпочтительно, по меньшей мере 10% относительной трансферазной активности, предпочтительно, по меньшей мере 20% относительной трансферазной активности, предпочтительно, по меньшей мере 20% относительной трансферазной активности, предпочтительно, по меньшей мере 30% относительной трансферазной активности, предпочтительно, по меньшей мере 40% относительной трансферазной активности, предпочтительно, по меньшей мере 45%, 50%, 60%, 70%, 80% или 90% относительной трансферазной активности. Подходящая липид-ацилтрансфераза в соответствии с настоящим изобретением может иметь при использовании анализа трансферазы в сильно обводненном яичном желтке с содержанием воды 89% и измерении после расходования 10% молекулы-донора (т.е. фосфолипида) процент ацилтрансферазной активности (относительную трансферазную активность) меньше 45%, 47%, 50%, 60%, 70%, 80%, 90% или 100%.
В предпочтительном варианте осуществления на основании анализа трансферазы в сильно обводненном яичном желтке липид-ацилтрансфераза для использования в композициях и способах по изобретению имеет значительную трансферазную активность (т.е. по меньшей мере 0,1% при обоих содержаниях воды) и имеет эквивалентную относительную трансферазную активность как в яичном желтке с содержанием воды 54%, так и в яичном желтке с содержанием воды 73%, измеренную после расходования 10% молекулы-донора (т.е. фосфолипида).
В предпочтительном варианте осуществления на основании анализа трансферазы в сильно обводненном яичном желтке липид-ацилтрансфераза для использования в композициях и способах по изобретению имеет значительную трансферазную активность (т.е. по меньшей мере 0,1% при обоих содержаниях воды) и имеет эквивалентную относительную трансферазную активность как в яичном желтке с содержанием воды 54%, так в яичном желтке с содержанием воды 89%, измеренную после расходования 10% молекулы-донора (т.е. фосфолипида).
В предпочтительном варианте осуществления на основании анализа трансферазы в сильно обводненном яичном желтке липид-ацилтрансфераза для использования в композициях и способах по изобретению имеет значительную трансферазную активность (т.е. по меньшей мере 0,1% при обоих содержаниях воды) и имеет эквивалентную относительную трансферазную активность как в яичном желтке с содержанием воды 73%, так в яичном желтке с содержанием воды 89%, измеренную после расходования 10% молекулы-донора (т.е. фосфолипида).
Термин “эквивалентная относительная трансферазная активность”, как он использован здесь, означает, что фермент имеет относительную трансферазную активность (% ацилтрансферазной активности), который по меньшей мере на 2% ниже, предпочтительно, по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% ниже в высокообводненном яичном желтке по сравнению с низкообводненным яичным желтком.
Анализ трансферазы в низководной среде
Как альтернатива (или как дополнение) анализу трансферазы в сильно обводненном яичном желтке и/или анализу трансферазы в забуференном растворе липид-ацилтрансфераза для применения в соответствии с настоящим изобретением может быть идентифицирована с использованием анализа трансферазы в низководной среде.
Для того чтобы определить, является ли фермент липид-ацилтрансферазой согласно настоящему изобретению, можно провести анализ трансферазы в низководной среде, а именно в масляной среде с 6% воды, как описано в примере 22. Этот пример иллюстрирует, что в масляной среде с содержанием воды 6% липид-ацилтрансфераза по изобретению имеет высокую относительную трансферазную активность, тогда как ранее известные липолитические ферменты имеют гидролитическую активность.
В одном варианте осуществления липид-ацилтрансферазой, пригодной для применения в способах и композициях согласно настоящему изобретению, является та, которая при испытании с использованием анализа трансферазы в низководной среде с замером в периоды времени, выбранные из 30, 20 или 120 минут, имеет относительную трансферазную активность по меньшей мере 1%, предпочтительно, по меньшей мере 2%, предпочтительно, по меньшей мере 5%, предпочтительно, по меньшей мере 10%, предпочтительно, по меньшей мере 20%, предпочтительно, по меньшей мере 30%, предпочтительно, по меньшей мере 40%, предпочтительно, по меньшей мере 50%, предпочтительно, по меньшей мере 60%, предпочтительно, по меньшей мере 70%, предпочтительно, по меньшей мере 75%. Подходящая липид-ацилтрансфераза в соответствии с настоящим изобретением может иметь меньше чем 30%, 40%, 50%, 60%, 70% или 80% активности, измеренной после периода времени в 10, 20, 30 или 120 минут, используя анализ трансферазы в низководной среде.
Как описано выше, липаза ацилтрансфераза по изобретению может быть идентифицирована с использованием или анализа трансферазы в забуференном субстрате, или анализа трансферазы в низководной среде, с использованием холестерина в качестве акцептора ацила. Конечно, специалист должен понимать, что при очевидных изменениях в аналитических методиках анализ трансферазы в забуференном субстрате или анализ трансферазы в низководной среде могут быть использованы для определения липид-ацилтрансферазной активности для любого липидного донора ацила, или любого акцептора ацила, или любой их комбинации. Специалист должен, если необходимо, просто заменить субстрат донора ацила (например, фосфолипид) альтернативным субстратом донора ацила (например, гликолипида, триглицерида) и/или заменить акцептор ацила (например, холестерин) альтернативным субстратом акцептора ацила (например, углевода, протеина, другого стерола, станола или глицерина).
Термин “высоководный”, как он использован здесь, означает любой субстрат или пищевой продукт с содержанием воды больше 2%, предпочтительно, больше 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90%.
Термин “низководный”, как он использован здесь, означает любой субстрат или пищевой продукт с содержанием воды меньше 6%, предпочтительно, меньше 5%, 4%, 3%, 2%, 1% или 0,5%.
Предпочтительно, способ и/или применение согласно настоящему изобретению могут быть осуществлены, например, в пищевом продукте при температуре 15-60°С, предпочтительно, при температуре 20-60°С, предпочтительно, 20-50°С, предпочтительно, 20-45°С, предпочтительно, 20-40°С. Для некоторых аспектов, например для теста, температура пищевого продукта в течение времени, в которое протекает реакция ацилтрансферазы, предпочтительно, находится между 20 и 40°С. Для других аспектов, например, относящихся к молочным продуктам, таким как сыр, подходящая температура пищевого продукта может быть между 30°С и 60°С. В еще других аспектах, например, относящихся к майонезу, подходящая температура пищевого продукта может быть между 20°С и 40°С, более предпочтительно, между 25°С и 30°С.
Предпочтительно, эмульгатор, образованный согласно настоящему изобретению, составляет меньше 5% мас. пищевого продукта.
Предпочтительно, эмульгатор, образованный согласно настоящему изобретению, составляет от 0,01 до 4% мас. пищевого продукта.
Предпочтительно, эмульгатор, образованный согласно настоящему изобретению, составляет от 0,01 до 2% мас. пищевого продукта.
Предпочтительно, эмульгатор, образованный согласно настоящему изобретению, составляет от 0,01 до 1% мас. пищевого продукта.
Предпочтительно, эмульгатор, образованный согласно настоящему изобретению, составляет от 0,01 до 0,5% мас. пищевого продукта.
Предпочтительно, эмульгатор, образованный согласно настоящему изобретению, составляет от 0,01 до 0,3% мас. пищевого продукта.
Способ согласно настоящему изобретению может включать инактивированный или дезактивированный фермент, чтобы получить пищевой продукт, включающий фермент в инактивированной или денатурированной форме. Обычно фермент может быть денатурирован или выпечкой, или пастеризацией.
Настоящее изобретение может дополнительно охватывать применение липид-ацилтрансферазы, как определено здесь, в пищевых и/или кормовых ферментных композициях и может охватывать пищевые и/или кормовые композиции, включающие липид-ацилтрансферазу, как она определена здесь. Такие композиции могут содержать один или несколько дополнительных ферментов, таких как перечисленные здесь. Альтернативно, ферментная композиция по изобретению может быть использована в сочетании с другими пищевыми ингредиентами/добавками, такими как перечисленные здесь, включая другие ферментные композиции. Путем ввода липид-ацилтрансферазы по изобретению в рецептуру пищевой и/или кормовой композиции фермент может быть стабилизирован, чтобы сделать возможным его длительное хранение (при подходящих условиях) перед применением в производстве пищевых и/или кормовых продуктов. Дополнительно ферментная композиция по настоящему изобретению содержит фермент в подходящей форме для безопасного использования “in situ” при приготовлении пищевых и/или кормовых продуктов или ингредиентов для применения при приготовлении пищи и корма. Такие композиции могут быть в жидкой, или полужидкой, или в твердой/гранулированной форме.
В одном варианте осуществления пищевая ферментная композиция может быть улучшающей тесто композицией. Улучшающая тесто композиция может включать другие полезные компоненты, такие как эмульгатор и/или другие ферменты, какие перечислены здесь.
Пищевые ферменты продаются как жидкие концентраты или как измельченные твердые вещества. Ввод в пищевую ферментную композицию минимизирует потери ферментативной активности во время транспортировки, хранения и использования. Ферменты часто подвергают воздействию влажной, горячей или окислительной среды в процессе производства пищи или напитка. Рецептуры улучшают стабильность путем противодействия основным силам дезактивации: денатурированию, дезактивации каталитическими сайтами и протеолизу. Денатурирование происходит путем физического свертывания третичной протеиновой структуры фермента под термическим или химическим напряжением. Как только фермент начинает свертываться, он становится значительно более уязвимым для деактивации и протеолиза. Для того чтобы минимизировать свертывание, составитель рецептуры может изменить окружение протеина так, чтобы привести к компактной структуре протеина, что наиболее эффективно делается путем “предпочтительного исключения” воды с поверхности протеина добавлением связывающих воду соединений, таких как сахара, многоатомные спирты и лиотропные соли. Наилучшими способами борьбы с активными сайтами являются обеспечение достаточных концентраций любых требуемых кофакторов, добавление обратимых ингибиторов и исключение окисляющих или реакционно-способных веществ из рецептуры.
Кроме стабильности ферментов, рецептура должна отвечать нескольким ключевым вторичным требованиям, включающим защиту от микробного загрязнения, избежание физического образования осадка или образования мути, минимизацию образования чувствительных пылей или аэрозолей и оптимизацию эстетического критерия, такого как цвет и запах. Многие из этих проблем в наибольшей степени рассматриваются, фокусируясь настолько далеко “вверх по течению”, насколько возможно, включая выбор сырьевых материалов при ферментации или процессе извлечения фермента.
Операции выделения продукта, такие как диафильтрация, адсорбция, хроматография, кристаллизация и экстракция, могут быть использованы для удаления загрязнений, ответственных за цвет, запах и выпадение осадка. Риск физического осаждения минимизируется путем составления композиции вблизи изоэлектрической точки фермента с гидрофильным растворителем, таким как глицерин или пропиленгликоль. Можно также эффективно добавить умеренные количества сольватирующих солей, чтобы избежать или высаливания, или “обратного всаливания”. Чтобы предотвратить микробное загрязнение, можно использовать сочетание фильтрации, подкисления и минимизации свободной воды; эффективными могут быть биоциды, но интервал приемлемых химикатов для борьбы с микробами или уничтожения микробов является ограниченным правилами здравоохранения и безопасности.
Двумя способами получения наиболее устойчивых к истиранию гранул на сегодня являются гранулирование при сильном сдвиге и нанесение покрытия распылением в псевдоожиженном слое, см., например, T. Becker: “Separation and Purification Processes for Recovery of Industrial Enzymes” in R.K. Singh, S.S.H. Rivzi (eds): Bioseparation Processes in Foods, Marcel-Decker, New York, pp. 427-445. Эти способы используют различные связующие, покрытия и морфологии частиц для получения некрошащихся частиц, которые хотя и защищают ферменты во время хранения, но дают возможность их легкого высвобождения в раствор во время использования.
Пищевые ферментные композиции, содержащие липид-ацилтрансферазу по изобретению, могут быть изготовлены с использованием стандартных методов приготовления форм, таких как распылительная сушка или приготовление жидких форм.
Липид-ацилтрансфераза по изобретению может быть экспрессирована в любой подходящий носитель. Например, липид-ацилтрансфераза по изобретению может быть экспрессирована в Bacillus subtilis и может быть очищена ультрафильтрацией и/или осаждением в этаноле, и/или центрифугированием и может быть впоследствии высушена распылительной сушкой с использованием крахмала (мальтодекстрина) в качестве носителя для фермента. Фермент распылительной сушки может быть стандартизирован к заданной PLU активности добавлением дополнительного носителя в форме порошка. Используемые методы являются хорошо известными и рутинными в практике.
Альтернативно, липид-ацилтрансфераза для использования в соответствии с настоящим изобретением, например полученная гетерологически липид-ацилтрансфераза по изобретению, будучи очищенной, может быть стабилизирована в подходящей жидкой форме, такой как формы на основе глицерина. Другие методы приготовления стабилизированных ферментных форм описаны в EР 0770037 и ЕР 0702712.
Ацилтрансфераза в форме порошка также может быть использована в сочетании с другими ферментами, какие перечислены здесь, для получения ферментных композиций с активностью, определенной спецификацией на продукт.
Обычно дозировка пищевых ферментных композиций составляет от 10 до 1000 г на 1000 кг пищевого продукта, предпочтительно, 50-200 г на 1000 кг пищевого продукта, предпочтительно, 75-125 г на 1000 кг пищевого продукта.
Предпочтительно, фермент согласно настоящему изобретению присутствует в пищевом продукте в неактивной форме или в денатурированной форме.
В одном варианте осуществления фермент согласно настоящему изобретению является, предпочтительно, не иммобилизованным, в частности, он не иммобилизован на твердом носителе.
В альтернативном варианте осуществления фермент может быть иммобилизованным.
Иммобилизованная липид-ацилтрансфераза может быть получена с использованием известных в практике методов иммобилизации. Таковыми являются различные способы получения иммобилизованных ферментов, которые должны быть ясны специалисту (например, методы, указанные в ЕР 0746608 или в Balcao V.M., Paiva A.L., Malcata F.X., Enzyme Microb. Technol. 1996 May 1: 18 (6): 392-416, или в Reetz M.T., Jaeger K.E., Chem. Phys. Lipids 1998 Jun: 93(1-2): 3-14, или в Bornscheuer U.T., Bessler C., Srinivas R., Krishna S.H. Trends Biotechnol. 2002 Oct; 20(10): 433-7, каждая из которых введена сюда ссылкой).
В одном варианте осуществления пищевой продукт по изобретению содержит пищевые ингредиенты, которые были получены с использованием иммобилизованной липид-ацилтрансферазы, но не содержат липид-ацилтрансферазу в пищевом ингредиенте или пищевом продукте. Например, пищевой продукт может содержать один или несколько из следующего: эмульгатор, более чем один эмульгатор, один или несколько вкусовых агентов, один или несколько улучшающих текстуру агентов и/или один или несколько эфиров стерола, таких как эфиры фитостерола или эфиры фитостанола.
Фермент согласно настоящему изобретению может быть использован с одним или несколькими обычными эмульгаторами, включая, например, моноглицериды, эфиры диацетилвинной кислоты, моно- и диглицериды жирных кислот и лецитины, например, полученные из сои.
Фермент согласно настоящему изобретению может быть использован с одним или несколькими из других подходящих ферментов пищевого качества. Так, в рамках настоящего изобретения в дополнение к ферменту по изобретению к пищевому продукту добавляют по меньшей мере один дополнительный фермент. Такие дополнительные ферменты включают разлагающие крахмал ферменты, такие как эндо- или экзомилазы, пуллуназазы, отщепляющие боковые ветви ферменты, гемицеллюлазы, включая ксиланазы, целлюлазы, липазы, фосфолипазы и протеазы.
Фермент согласно настоящему изобретению может быть использован с одним или несколькими из других подходящих ферментов пищевого качества. Так, в рамках настоящего изобретения в дополнение к ферменту по изобретению к пищевому продукту добавляют по меньшей мере один дополнительный фермент. Такие дополнительные ферменты включают разлагающие крахмал ферменты, такие как эндо- или экзомилазы, пуллуназазы, отщепляющие боковые ветви ферменты, гемицеллюлазы, включая ксиланазы, целлюлазы, оксидоредуктазы, например оксидазу глюкозы, оксидазу пиранозы, сульфгидрилоксидазу или карбогидратоксидазу, такую как окисляющая мальтозу, например оксидаза гексозы (НОХ), липазы, фосфолипазы и гексозоксидазы и протеазы.
В одном предпочтительном варианте осуществления липид-ацилтрансферазу используют в сочетании с липазами, имеющими одну или несколько из следующих липазных активностей: гликолипазную активность (Е.С. 3.1.1.26), триацилглицеринлипазную активность (Е.С. 3.1.1.3), фосфолипазную А2 активность (Е.С. 3.1.1.4) или фосфолипазную А1 активность (Е.С. 3.1.1.32). Подходящие липазные ферменты хорошо известны в практике и включают в качестве примера следующие липазы: LIPOPAN® F и/или LECITASE® ULTRA (Novozymes A/S, Denmark), фосфолипазу А2 (например, фосфолипазу А2 от LIPOMOD 22L от Biocatalysts, LIPOMAX 22L от Biocatalysts, LIPOMAX от Genecor), LIPOLASE® (Novozymes A/S, Denmark), липазу, описанную в WO 03/97835, EP 0977869 или EР 1193314. Эта комбинация липид-ацилтрансферазы, как она определена здесь, и липазы может быть особенно предпочтительной в продуктах из теста или выпечке или в тонких пищевых продуктах, таких как пирожные и конфеты. от Genecor), LIPOLASE® (Novozymes A/S, Denmark), липазу, описанную в WO 03/97835, EP 0977869 или EР 1193314. Эта комбинация липид-ацилтрансферазы, как она определена здесь, и липазы может быть особенно предпочтительной в продуктах из теста или выпечке или в тонких пищевых продуктах, таких как пирожные и конфеты.
Применение липаз в сочетании с ферментом по изобретению может быть особенно выигрышным в случаях, когда может быть желательно некоторое накопление жирных кислот, например в сыре, где свободные жирные кислоты могут придать желаемый вкус, или при приготовлении тонких пищевых продуктов. Специалист должен быть способен комбинировать пропорции липолитических ферментов, например LIPOPAN® F, LECITASE® ULTRA (Novozymes A/S, Denmark), фосфолипазы А2 (например, фосфолипазы А2 от LIPOMOD 22L от Biocatalysts, LIPOMAX 22L от Biocatalysts, LIPOMAX от Genecor), LIPOLASE® (Novozymes A/S, Denmark), липазы, описанной в WO 03/97835, EP 0977869 или EР 1193314, и липид-ацилтрансферазы по настоящему изобретению, чтобы обеспечить желаемые соотношение гидролитической и трансферазной активности, которое даст в результате предпочтительный технический эффект или сочетание технических эффектов в пищевом продукте (такие, как перечисленные здесь в разделе “Технические эффекты”). от Genecor), LIPOLASE® (Novozymes A/S, Denmark), липазы, описанной в WO 03/97835, EP 0977869 или EР 1193314, и липид-ацилтрансферазы по настоящему изобретению, чтобы обеспечить желаемые соотношение гидролитической и трансферазной активности, которое даст в результате предпочтительный технический эффект или сочетание технических эффектов в пищевом продукте (такие, как перечисленные здесь в разделе “Технические эффекты”).
Обычно изготовители тортов используют улучшители тортов для изготовления тортов и обеспечения высокого качества тортов в отношении вкуса, структуры, потребительского качества и внешнего вида. Такие улучшители тортов обычно основываются на эмульгаторах, нанесенных распылением на носитель типа крахмала и мальтодекстрина. Некоторые улучшители представлены также в гелевой форме, основанной на эмульгаторах, сахарах и воде. Такие улучшители тортов очень важны для производства тортов для приготовления продукции высокого качества. Однако улучшители тортов содержат эмульгаторы и другие “ненатуральные” ингредиенты с Е-номерами. Из-за требований потребителей уменьшить число Е-номеров производство тортов нуждается в альтернативных способах изготовления тортов высокого качества без применения эмульгаторов.
Альтернативным путем изготовления тортов является применение фермента, т.е. липид-ацилтрансферазы, определенной здесь, или ферментной композиции согласно настоящему изобретению.
Липид-ацилтрансфераза, как она определена здесь, и/или пищевая ферментная композиция по настоящему изобретению может быть использована при приготовлении “тонких” пищевых продуктов, таких как торты. В таких случаях в пищевом продукте могут быть образованы следующие составляющие:
i) эфиры сахаров и лизолецитин (из углевода в рецепте торта и лецитина в яйцах, которые также составляют часть рецепта торта) и/или
ii) ацилированные пептиды и лизолецитин (путем переноса жирной кислоты от лецитина к протеину или пептиду во время образования конденсатов протеин-жирная кислота, которые известны как высоко эффективные эмульгаторы (Herstellung und Anvendungmöglichkeiten von Eiweiss-Fettsaürekondensaten. Andreas Sander, Eberhard Eilers, Andrea Heilemann, Edith von Kreis. Fett/lipid 99 (1997) Nr. 4, 115-120).
Считается, что при изготовлении некоторых “тонких” пищевых изделий, в особенности сильно жирных тонких пищевых изделий, таких как торты, может быть желательно иметь некоторое накопление жирных кислот. Поэтому комбинация применения липолитических ферментов и липид-ацилтрансферазы, как она определена здесь, может быть особо благоприятным для изготовления высокожирных тонких пищевых изделий. Альтернативно, дополнительные свободные жирные кислоты или жирнокислотное мыло (Е470а) могут быть выбраны и использованы в сочетании с липид-ацилтрансферазой.
Пищевой продукт согласно настоящему изобретению может подходяще включать одну или несколько из следующих добавок:
соевый протеиновый материал, каротиноиды, флавоноиды, антиоксидант и фитохимикалии (в особенности антоцианид, каротиноид, биофлавоноид, глютанион, катехин, изофлавон, ликопен, гинсенозид, пикногенол, алкалоид, пигеум фитостерол, сульфорафон, резвератол, экстракт виноградных косточек или пищевые содержащие станол эфиры), витамин (особенно витамин С, витамин А, витамин В3, витамин D, витамин Е, тиамин, рибофлавин, ниацин, пиридоксин, цианокабаламин, фолиевая кислота, биотин, пантотеновая кислота или витамин К), минералы (в особенности кальций, йод, магний, цинк, железо, селен, марганец, хром, медь, кобальт, молибден или фосфор), жирная кислота (в особенности гамма-линоленовая кислота, укоспентатеновая кислота или декозагексаеновая кислота), масло (в особенности масло бурачника, масло канолы с высоким содержанием каротиноидов или масло семян льна), аминокислота (в особенности триптофан, лизин, метионин, фенилаланин, треонин, валин, лейцин, изолейцин, аланин, аргинин, аспартамовая кислота, цистин, цистеин, глутаминовая кислота, глютамин, глицин, гистидин, пролин, гидроксипролин, серин, таурин или тирозин), фермент (в особенности бромелаин, папаин, амилаза, целлюлаза или кофермент Q), лигнин, эфир станола или дружественные бактерии (в особенности Lactobacillus acidophilus, Lactobacillus bulgaricus, Lactobacillus bifidus, Lactobacillus plantarum или Streptococcus faecium), фолиевая кислота и растворимое волокно.
ТЕХНИЧЕСКИЙ ЭФФЕКТ
Неожиданно липид-ацилтрансфераза имеет значительную ацилтрансферазную активность в пищевых продуктах. Эта активность имеет неожиданно благоприятное применение в способах приготовления пищевых продуктов.
Настоящее изобретение основано на неожиданном открытии, что липид-ацилтрансфераза согласно настоящему изобретению может осуществить этерификацию углевода путем алкоголиза, т.е. перенос ацила от липида в пищевом продукте со значительным содержанием воды. Ранее предполагалось, что такие ферменты если и будут работать таким образом, то только в среде растворителя (т.е. в среде с низким содержанием или с отсутствием воды).
Настоящее изобретение может обеспечить один или несколько из следующих неожиданных технических эффектов для яичных продуктов, в частности майонеза: улучшенная тепловая стабильность во время пастеризации, улучшенные органолептические свойства и улучшенная консистенция.
Настоящее изобретение может обеспечить один или несколько из следующих неожиданных технических эффектов для продуктов из теста и/или выпечки: улучшенный удельный объем или теста, или выпеченных продуктов (например, хлеба и/или торта), улучшенная стабильность теста, улучшенная балльная оценка корки (например, более тонкая и/или хрустящая корка хлеба), улучшенная балльная оценка мякиша (например, более однородное распределение мякиша, и/или более тонкая структура мякиша, и/или более мягкий мякиш), улучшенный внешний вид (например, гладкая поверхность без вздутий на поверхности или дырок или практически без вздутий на поверхности или дырок), пониженное очерствение, улучшенная мягкость, улучшенный запах, улучшенный вкус.
Настоящее изобретение может обеспечить благоприятный эффект от образования сильно поверхностно-активных веществ в пищевом продукте без образования существенного количества свободных жирных кислот, которые снижают способность пищевого продукта окисляться при хранении, поскольку свободные жирные кислоты более склонны к окислению, чем соответствующие эфиры жирных кислот.
Соответственно, настоящее изобретение может обеспечить один или несколько из следующих неожиданных эффектов в пищевом продукте: улучшенный внешний вид, улучшенное ощущение во рту, улучшенная стабильность, в особенности улучшенная термическая стабильность, улучшенный вкус, улучшенная мягкость, улучшенная упругость, улучшенное эмульгирование.
Соответственно, настоящее изобретение может обеспечить один или несколько из следующих неожиданных эффектов в молочных продуктах, таких как, например, мороженое: улучшенное ощущение во рту (предпочтительно, более выраженное ощущение сливок во рту), улучшенный вкус, улучшенный расплав.
Соответственно, настоящее изобретение может обеспечить один или несколько из следующих неожиданных эффектов в яйцах или в яичных продуктах: улучшенная стабильность эмульсии, термическая стабильность эмульсии, улучшенный вкус, уменьшенный плохой запах, улучшенные загущающие свойства, улучшенная консистенция.
Специфические технические эффекты, связанные с использованием липид-ацилтрансферазы, как она определена здесь, при приготовлении пищевого продукта перечислены в таблице ниже.
 |
Пищевой продукт |
Эффект |
| 1 |
Хлеб, пышки и пончики |
Усиливает тесто повышает механическую прочность и увеличивает способность поглощать воду. Увеличивает объем выпеченных продуктов и поддерживает мягкость мякиша. |
| 2 |
Замороженное тесто |
Предотвращает порчу при замораживании. |
| 3 |
Бисквит |
Дает хороший объем кекса и однородную мягкую текстуру. |
| 4 |
Бисквит, крекеры и печенье |
Дает стабильную эмульсию жира и предотвращает прилипание к машине. Предотвращает жировое поседение сильно жирных продуктов. |
| 5 |
Болтушка и панировка |
Улучшает текстуру жареных продуктов. |
| 6 |
Лапша |
Предотвращает прилипание теста к машине. Увеличивает содержание воды и уменьшает потери при готовке. |
| 7 |
Лапша быстрого приготовления |
Предотвращает прилипание лапши друг к другу. |
| 8 |
Паста |
Кондиционер теста предотвращает адгезию при готовке. |
| 9 |
Крем драчены |
Дает крахмальную пасту с гладкой и кремовой текстурой и предотвращает обезвоживание. |
| 10 |
Забеливатель кофе |
Предотвращает разделение масла и воды. |
| 11 |
Взбитый крем |
Обеспечивает стабильную эмульсию. |
| 12 |
Шоколад |
Предотвращает замедленное поседение. |
| 13 |
Карамель, конфеты и нуга |
Улучшает эмульгирование расплавленного сахара и масла. Предотвращает отделение масла. |
| 14 |
Переработанное мясо, сосиски |
Улучшает способность сосисок и прессованной ветчины удерживать воду и предотвращает отделение масляной фазы из паст и пате. |
Соответственно, настоящее изобретение может обеспечить один или несколько из следующих неожиданных эффектов в сырах: уменьшение эффекта выделения масла из сыра, увеличение выхода сыра, улучшение вкуса, ослабленный плохой запах, ослабленный “мыльный” вкус.
При производстве пищевых продуктов, в частности при производстве сыров, применение липид-ацилтрансферазы в соответствии с настоящим изобретением дает значительное преимущество в способности извлекать растворимые протеины из молочных продуктов. Например, при производстве сыра почти 20% всего молочного протеина удаляются в сыворотку (т.е. водную часть молока, которая остается после образования творогов). Сыворотка содержит растворимые молочные протеины, тогда как гидрофобные протеины удерживаются в твороге. При использовании липид-ацилтрансферазы в соответствии с настоящим изобретением возможно перенести ацильную группу от липида (предпочтительно, от гликолипида или фосфолипида) к протеину (в частности, к протеину сыворотки, такому как лактоглобулин), чтобы образовать конденсат протеина и жирной кислоты. Таким образом, образуется продукт, который является более гидрофобным и который должен остаться в твороге, а не быть вымытым в сыворотку. Таким путем больше молочного протеина может быть удержано в конечном пищевом продукте, т.е. в конечном молочном продукте, таком как сыр.
В одном аспекте настоящее изобретение основывается частично на реализации того, что выход пищевых продуктов, таких как сыр, может быть улучшен путем использования липид-ацилтрансферазы. В дополнение или альтернативно, вкус, текстура, окислительная стабильность и/или срок хранения пищевого продукта могут быть улучшены. В дополнение или альтернативно, пищевой продукт может иметь пониженное содержание холестерина или улучшенное содержание эфиров стерола/станола.
Без желания быть связанными конкретной теорией считается, что увеличение выхода может быть результатом трансэтерификации протеинов сыворотки и пептидов, приводящей к значительному повышению гидрофобности протеинов сыворотки и осаждению ацилированных протеинов сыворотки в сырный творог.
В биологических системах, например, осаждение мембраносвязанных протеинов и ферментов достигается по двум разным механизмам. Мембраносвязанные протеины или обладают рядом стягивающих мембрану или гидрофобных доменов, или они, альтернативно, имеют жирную кислоту, прикрепленную к полипептидной смеси. Жирные кислоты имеют обычно цепь длиной в 14 или 16 атомов углерода. Жирные кислоты являются ковалентно прикрепленными к полипептидной цепи в 3 разных положениях: к N-концу аминокислоты – как амидная связь, к остатку цистеина – как тиоэфирная связь, или к аминокислоте серину или треонину – как эфирная связь. Только одна жирная кислота на молекулу полипептида необходима для ввода протеина в мембрану клетки.
Когда жирная кислота ковалентно прикреплена к немембранному протеину, физические и функциональные свойства будут меняться радикально. WO 97/14713 описывает протеины сои и глютена, трансформированные в ацилпроизводные обработкой липазой из Mucor miehet (Lipozyme , Novozymes) и жирной кислотой в органическом растворителе. Липид-ацилтрансфераза согласно настоящему изобретению может быть использована при получении ацилированных протеинов в низководной или высоководной среде. , Novozymes) и жирной кислотой в органическом растворителе. Липид-ацилтрансфераза согласно настоящему изобретению может быть использована при получении ацилированных протеинов в низководной или высоководной среде.
Авторы отмечают, что ацилированные протеины образуют амфифильные комплексы, которые могут быть использованы для ряда косметических продуктов. Ацилированный протеин может образовывать гели, связывать воду остаточной влагой, иметь эмульгирующие свойства и быть очень активным на разделе фаз между водой и липидом.
Так, настоящее изобретение может в одном аспекте относиться к косметической композиции, включающей липид-ацилтрансферазу, как она определена здесь.
В добавление, настоящее изобретение может относиться к применению ацилтрансферазы, как она определена здесь, для получения косметической композиции.
В следующем аспекте настоящее изобретение относится к способу получения in situ эфира протеина в косметической композиции, где способ включает стадию добавления в косметическую композицию (или в ее компоненты) липид-ацилтрансферазы, как она определена здесь.
Многие пищевые продукты являются растворимыми в водных растворах и потому подходят для модификации in situ липазой ацилтрансферазой. При производстве сыра  -лактоглобулин теряется с фракцией сыворотки. После ацилирования липазой ацилтрансферазой или вариантом липазы ацилтрансферазы начальные результаты показывают, что -лактоглобулин теряется с фракцией сыворотки. После ацилирования липазой ацилтрансферазой или вариантом липазы ацилтрансферазы начальные результаты показывают, что  -лактоглобулин может, однако, быть осажден на поверхность мицеллы казеина во время коагуляции сычугом. -лактоглобулин может, однако, быть осажден на поверхность мицеллы казеина во время коагуляции сычугом.  -лактоглобулин имеет три потенциально ацилируемых сайта (остатки серина) на трех поверхностных петлях. Молоко содержит достаточные количества лецитина, подходящего субстрата для того, чтобы фермент липид-ацилтрансфераза ацилировала -лактоглобулин имеет три потенциально ацилируемых сайта (остатки серина) на трех поверхностных петлях. Молоко содержит достаточные количества лецитина, подходящего субстрата для того, чтобы фермент липид-ацилтрансфераза ацилировала  -лактоглобулин. Образовавшийся лизолецитин может оказать дополнительный эмульгирующий эффект. -лактоглобулин. Образовавшийся лизолецитин может оказать дополнительный эмульгирующий эффект.
Улучшения, наблюдаемые с липид-ацилтрансферазой согласно настоящему изобретению, проявляются в сравнении с тем, когда используются липолитические ферменты без ацилтрансферазной активности, такие как триацилглицеринлипазы и фосфолипазы.
ПРЕИМУЩЕСТВА
Образование эмульгатора и эфира стерола/станола in situ из по меньшей мере одного составляющего пищевого материала означает, что пищевой материал будет содержать по меньшей мере одно дополнительное вещество. Это является преимуществом благодаря улучшению в облегчении производства. Например, может не требоваться дополнительная переработка, или добавление ингредиентов, или добавление эмульгаторов. Более того, пищевой продукт может содержать меньше добавок. Уменьшение или устранение добавок является желательным для покупателей и исключение добавок часто может объявляться покупателю при перечислении ингредиентов пищевого продукта. Таким образом, настоящее изобретение имеет дополнительные преимущества.
Преимуществом настоящего изобретения может быть образование in situ эмульгатора в пищевом продукте без вредного увеличения содержания свободных жирных кислот пищевого продукта.
Образование двух эмульгаторов и/или эфира углевода in situ из по меньшей мере одного составляющего пищевого материала означает, что пищевой материал будет содержать по меньшей мере два дополнительных вещества.
Кроме того, когда липид-ацилтрансфераза воздействует на гликолипид, она может благоприятно продуцировать эмульгатор DGMG in situ без вредного увеличения содержания свободных жирных кислот пищевого продукта. Так, ослабление вредных эффектов, приписываемых увеличению содержания свободных жирных кислот, включает, но не ограничивается этим, ослабление “мыльного” вкуса в сыре, предотвращение передозировки в тесто и улучшение пекарских свойств теста.
Для некоторых аспектов преимуществом настоящего изобретения является снижение уровней холестерина в пищевом продукте.
Для других аспектов увеличение содержания эфиров станола и/или стерола в пищевом продукте. Некоторые эфиры стерола/станола могут быть эффективными вкусовыми агентами и/или агентами, улучшающими текстуру. Известно, что некоторые эфиры стерола/станола снижают содержание холестерина и/или липопротеинов низкой плотности в сыворотке крови, когда потребляются с пищевым продуктом. Таким образом, настоящее изобретение может быть использовано для получения пищевого продукта с повышенными концентрациями эфиров стерола и/или эфиров станола.
Для некоторых аспектов, в особенности когда фермент согласно настоящему изобретению используют в продуктах на основе яиц, преимуществом является удаление нежелательных свободных углеводов.
Выгодным является также то, что улучшены эмульсионные свойства пищевого продукта, приводя к улучшению внешнего вида, и/или перерабатываемости, и/или структуры, и/или консистенции, и/или тепловой стабильности без отрицательного влияния на вкус.
В добавление, для некоторых осуществлений выгодно то, что эффект “передозировки”, наблюдаемый при применении липаз как таковых, успешно преодолевается путем добавления фермента в соответствии с настоящим изобретением. Это обусловлено, по меньшей мере частично, тем фактом, что свободные жирные кислоты не образуются или образуются только в незначительной степени при использовании фермента согласно настоящему изобретению.
ВЫДЕЛЕННЫЙ
В одном аспекте, предпочтительно, полипептид или протеин для применения в настоящем изобретении находится в выделенной форме. Термин “выделенный” означает, что последовательность является по меньшей мере существенно свободной от по меньшей мере одного другого компонента, с которым последовательность естественно связана в природе и находится в природе.
ОЧИЩЕННЫЙ
В одном аспекте, предпочтительно, полипептид или протеин для применения в настоящем изобретении находится в очищенной форме. Термин “очищенный” означает, что последовательность находится в сравнительно чистом состоянии, например, по меньшей мере 51% чистоты, или по меньшей мере около 75%, или по меньшей мере около 80%, или по меньшей мере около 90%, или по меньшей мере около 95%, или по меньшей мере около 98% чистоты.
КЛОНИРОВАНИЕ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ, КОДИРУЮЩЕЙ ПОЛИПЕПТИД СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Нуклеотидная последовательность, кодирующая или полипептид, который имеет специфические свойства, как определено здесь, или полипептид, который является подходящим для модификации, может быть изолирована из любой клетки или организма, производящих указанный полипептид. Различные способы выделения нуклеотидных последовательностей хорошо известны в этой области.
Например, библиотека геномной ДНК и/или кДНК может быть создана с использованием хромосомной ДНК или информационной РНК из организма, продуцирующего полипептид. Если последовательность аминокислот полипептида известна, маркированные олигонуклеотидные зонды могут быть синтезированы и использованы для идентификации кодирующих нуклеотид клонов из библиотеки генов, подготовленной из организма. Альтернативно, маркированный олигонуклеотидный зонд, содержащий последовательности, гомологичные другому известному гену полипептида, могут быть использованы для идентификации кодирующих нуклеотид клонов. В последнем случае используют гибридизацию и условия промывки более низкой строгости.
Альтернативно, кодирующие полипептид клоны могут быть идентифицированы вставкой фрагментов геномной ДНК в вектор экспрессии, такой как плазмида, трансформирующий фермент-негативные бактерии полученной библиотекой геномной ДНК, и последующим посевом трансформированных бактерий на агар, содержащий фермент, ингибированный полипептидом, тем самым давая возможность клонам экспрессировать полипептид, который должен быть идентифицирован.
В следующей альтернативе нуклеотидная последовательность, кодирующая полипептид, может быть получена синтетически принятыми стандартными методами, например фосфорамидитиновым методом, описанным Beucage S.L. et al. (1981) Tetrahedron Letters 22, p. 1859-1869, или способом, описанным Matthes et al. (1984) EMBO J. 3, p. 801-806. В фосфорамидитиновом методе олигонуклеотиды синтезируют, например, в автоматическом синтетизаторе ДНК, очищают, прокаливают, сшивают и клонируют в подходящие векторы.
Нуклеотидная последовательность может быть смешанного геномного и синтетического происхождения, смешанного синтетического и кДНК происхождения или смешанного геномного и кДНК происхождения, полученной сшиванием фрагментов синтетического, геномного или кДНК происхождения (как требуется) в соответствии с стандартными методиками. Каждый сшитый фрагмент соответствует различным частям полной нуклеотидной последовательности. Последовательность ДНК может быть также получена реакцией полимеразы цепи (PRC), используя специфические праймеры, описанные, например, в USP 4683202 или в Saiki R.K. et al. (Science (1988) 239, pp. 487-491).
НУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ
Настоящее изобретение охватывает также нуклеотидные последовательности, кодирующие полипептиды, имеющие специфические свойства, какие определены здесь. Термин “нуклеотидная последовательность”, как он используется здесь, относится к олигонуклеотидной последовательности или к полинуклеотидной последовательности и к их вариантам, гомологам фрагментам и производным (таким как их части). Нуклеотидная последовательность может быть геномного, или синтетического, или рекомбинантного происхождения, которые могут быть двунитевыми или однонитевыми, представляя как смысловую, так и антисмысловую нить.
Термин “нуклеотидная последовательность” относительно настоящего изобретения включает геномную ДНК, кДНК, синтетическую ДНК и РНК. Предпочтительно, он означает ДНК, более предпочтительно, кДНК для кодирующей последовательности.
В предпочтительном варианте осуществления нуклеотидная последовательность как таковая, кодирующая полипептид, имеющий специфические свойства, как определено здесь, не охватывает нативную нуклеотидную последовательность в ее естественном окружении, когда она прикреплена к естественно связанной с ней последовательности (последовательностям), которая (которые) также находится (находятся) в своем естественном окружении. Для удобства упоминания будем называть такое предпочтительное осуществление “ненативная нуклеотидная последовательность”. В этом отношении термин “нативная нуклеотидная последовательность” означает полную нуклеотидную последовательность, которая находится в своем нативном окружении и когда она оперативно прикреплена к полному промотору, с которым естественно связана, каковой промотор также находится в своем нативном окружении. Таким образом, полипептид по настоящему изобретению может быть экспрессирован нуклеотидной последовательностью в свой нативный организм, но где нуклеотидная последовательность не находится под контролем промотора, с которым она естественно связана внутри данного организма.
Предпочтительно, полипептид не является нативным полипептидом. В данном отношении термин “нативный полипептид” означает полный полипептид, который находится в своем естественном окружении и когда он был экспрессирован своей нативной нуклеотидной последовательностью.
Обычно нуклеотидную последовательность, кодирующую полипептиды, имеющие специфические свойства, как определено здесь, получают, используя методы рекомбинантной ДНК (т.е. рекомбинантную ДНК). Однако в альтернативном варианте осуществления изобретения нуклеотидная последовательность может быть синтезирована полностью или частично с использованием химических методов, хорошо известных специалистам (см. Caruthers M.H. et al. (1980) Nuc Acids Res Symp Ser 215-23 и Horn T. et al. (1980) Nuc Acids Res Symp Ser 225-232).
МОЛЕКУЛЯРНАЯ ЭВОЛЮЦИЯ
Когда кодирующая фермент нуклеотидная последовательность выделена или предполагаемая кодирующая фермент нуклеотидная последовательность идентифицирована, может быть желательно модифицировать выбранную нуклеотидную последовательность, например, может быть желательно мутировать последовательность для того, чтобы получить фермент в соответствии с настоящим изобретением.
Мутации могут быть введены, используя синтетические олигонуклеотиды. Такие олгонуклеотиды содержат нуклеотидные последовательности, фланкирующие желаемые сайты мутации.
Подходящий метод описан в Morinaga et al. (Biotechnology (1984) 2, p. 646-649). Другой метод введения мутаций в кодирующую фермент нуклеотидную последовательность описан Nelson and Long (Analytical Biochemistry (1989), 180, p. 147-151).
Вместо направленного на сайт мутагенеза, такого как описанный выше, можно ввести мутации случайным образом, например, используя имеющийся в продаже набор реактивов, такой как набор для мутагенеза GeneMorph PCR от Stratagene, или набор для случайного мутагенеза Diversify PCR от Clontech. EP 0583265 ссылается на способы оптимизации мутагенеза на основе ПЦР, которые могут также сочетаться с применением мутагенных аналогов ДНК, таких как описанные в ЕР 0866796. Подверженные ошибкам технологии PRC являются пригодными для получения вариантов липид-ацилтрансфераз с предпочтительными характеристиками. WO 02/06457 ссылается на молекулярную эволюцию липаз.
Третьим методом получения новых последовательностей является фрагментирование неидентичных нуклеотидных последовательностей с использованием или любого числа рестрикционных ферментов, или такого фермента, как Дназа I, и повторной сборки полных нуклеотидных последовательностей кодирования для функциональных протеинов. Альтернативно, можно использовать одну или кратные неидентичные нуклеотидные последовательности и ввести мутации во время сборки полной нуклеотидной последовательности. Тасование ДНК и технологии тасовки семейств являются подходящими для получения вариантов липид-ацилтрансфераз с предпочтительными характеристиками. Подходящие методы для осуществления тасовки можно найти в ЕР 0752008, ЕР 1138763, ЕР 1103606. Тасовка может также сочетаться с другими формами мутагенеза ДНК, как описано в US 6180406 и WO 01/34835.
Таким образом, можно получить многочисленные направленные на сайт или случайные мутации в нуклеотидной последовательности или in vivo, или in vitro и затем провести поиск улучшенной функциональности кодирующего полипептида различными способами. Используя, например, силико- и экзоопосредованные рекомбинантные методы (см. WO 00/58517, US 6344328, US 6361974), можно осуществить молекулярную эволюцию, где полученный вариант сохранит очень слабую гомологию с известными ферментами или протеинами. Такие варианты, полученные таким образом, могут иметь значительную структурную аналогию с известными трансферазными ферментами, но иметь очень низкую гомологию последовательности аминокислот.
В качестве неограничительного примера дополнительно мутации или природные варианты полинуклеотидной последовательности могут быть рекомбинированы или с диким типом, или с другими мутациями, или с природными вариантами для получения новых вариантов. Такие новые варианты также могут быть скринированы для поиска улучшенной функциональности кодирующего полипептида.
Применение вышеупомянутых и подобных методов молекулярной эволюции делает возможными идентификацию и выбор вариантов ферментов по настоящему изобретению, которые имеют предпочтительные характеристики, без какого-либо предварительного знания структуры или функции протеина и делает возможным получение непредсказуемых, но благоприятных мутаций или вариантов. Имеются многочисленные примеры применения молекулярной эволюции на практике для оптимизации или изменения активности фермента; такие примеры включают, но не ограничиваются этим, одно или несколько из следующего: оптимизированная экспрессия и/или активность в клетке-носителе или in vitro, повышенная ферментная активность, измененная специфичность субстрата и/или продукта, повышенная или пониженная ферментная или структурная стабильность, измененная ферментная активность/специфичность в предпочтительных окружающих условиях, например температуре, рН, субстрате.
Как должно быть ясно опытному специалисту, используя инструмент молекулярной эволюции, можно изменить фермент, чтобы улучшить функциональность фермента.
Соответственно, липид-ацилтрансфераза, используемая в изобретении, может быть вариантом, т.е. может содержать по меньшей мере одно замещение, исключение или добавление аминокислоты по сравнению с родительским ферментом. Вариантные ферменты сохраняют по меньшей мере 1%, 2%, 3%, 5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 99% гомологию с родительским ферментом. Подходящие родительские ферменты могут включать любой фермент с эстеразной или липазной активностью. Предпочтительно, родительский фермент выравнивают к консенсусной последовательности pfam00657.
В предпочтительном варианте осуществления вариантный фермент липид-ацилтрансфераза сохраняет или включает по меньшей мере один или несколько из остатков аминокислот консенсусной последовательности pfam00657, найденных в блоках GDSX, GANDY и HPT.
Ферменты, такие как липазы с низкой или отсутствующей липид-ацилтрансферазной активностью в водной среде, могут быть мутированы с использованием инструментов молекулярной эволюции для того, чтобы ввести или улучшить трансферазную активность, получив тем самым фермент липид-ацилтрансфераза со значительной трансферазной активностью, пригодный для применения в композициях и способах по настоящему изобретению.
Соответственно, липид-ацилтрансфераза для применения в изобретении может быть вариантом с улучшенной ферментной активностью по отношению к полярным липидам, предпочтительно, фосфолипидам и/или гликолипидам по сравнению с родительским ферментом. Предпочтительно, такие варианты имеют также низкую или отсутствующую активность по отношению к полярным лизолипидам. Улучшенная ферментная активность по отношению к полярным липидам, фосфолипидам и/или гликолипидам может быть результатом гидролизной и/или трансферазной активности или комбинацией обеих.
Вариантные липид-ацилтрансферазы для применения в изобретении могут иметь пониженную активность по отношению к триглицеридам, и/или моноглицеридам, и/или диглицеридам по сравнению с родительским ферментом.
Подходящий вариантный фермент может не иметь активности по отношению к триглицеридам, и/или моноглицеридам, и/или диглицеридам.
Альтернативно, вариантный фермент для применения в изобретении может иметь повышенную активность к триглицеридам и может также иметь повышенную активность по отношению к одному или нескольким из следующих полярных липидов: фосфолипидам, лецитину, фосфатидилхолину, гликолипидам, дигалактозилмоно-глицериду, моногалактозилдиглицериду.
Варианты липид-ацилтрансфераз являются известными, и один или несколько из таких вариантов могут быть пригодными для применения в способах и применениях согласно настоящему изобретению. В качестве примера только в соответствии с настоящим изобретением могут быть использованы варианты липид-ацилтрансфераз, описанные в Hilton & Buckley J Biol. Chem. 1991 Jan. 15: 266(2): 997-1000; Robertson et al. J Biol. Chem. 1994 Jan 21: 269(3): 2146-50; Brumlik et al. J Bacreriol 1996 Apr; 178(7): 2064-4; Peelman et al. Protein Sci. 1998 Mar; 7(3): 587-99.
ПОСЛЕДОВАТЕЛЬНОСТИ АМИНОКИСЛОТ
Настоящее изобретение охватывает также последовательности аминокислот полипептидов, имеющих специфические свойства, как определено здесь.
Термин “последовательность аминокислот”, как он использован здесь, является синонимом термина “полипептид” и/или термина “протеин”. В некоторых случаях термин “последовательность аминокислот” является синонимом термина “пептид”.
Последовательность аминокислот может быть получена/выделена из подходящего источника, или может быть изготовлена синтетически, или может быть получена использованием методов рекомбинантной ДНК.
Соответственно, последовательности аминокислот могут быть получены из изолированных полипептидов, изученных здесь стандартными методами.
Одним подходящим способом для определения последовательностей аминокислот из изолированных полипептидов является следующий.
Очищенный полипептид может быть высушен замораживанием и 100 мкг высушенного замораживанием материала может быть растворено в 50 мкл смеси из 8 М мочевины и 0,4 М кислого карбоната аммония, рН 8,4. Растворенный протеин может быть денатурирован и восстановлен в течение 15 минут при 50°С после покрытия азотом и добавления 5 мкл 45 мМ дитиотретиола. После охлаждения до комнатной температуры может быть добавлено 5 мкг 100 мМ йодацетамида для дериватизации остатка цистеина в течение 15 минут при комнатной температуре в темноте под азотом.
135 мкл воды и 5 мкг эндопротеиназы Lys-C в 5 мкл воды могут быть добавлены к вышеуказанной реакционной смеси, и расщепление может быть проведено при 37°С под азотом в течение 24 часов.
Полученные пептиды могут быть разделены ЖХВД с обратной фазой на колонке VYDAC C18 (0,46×15 см; 10 мкм; The Separation Group, Califirnia, USA) с использованием растворителя А: 0,1% TFA в воде и растворителя В: 0,1% TFA в ацетонитриле. Выбранные полипептиды могут быть заново хроматографированы на колонке Devosil C18 с использованием такой же системы растворителей перед N-концевым упорядочением. Упорядочение может быть выполнено с использованием секвенатора Applied Biosystems 476A, с применением быстрых циклов пульсации жидкости согласно инструкции производителя (Applied Biosystems, California, USA).
ИДЕНТИЧНОСТЬ ПОСЛЕДОВАТЕЛЬНОСТИ ИЛИ ГОМОЛОГИЯ ПОСЛЕДОВАТЕЛЬНОСТИ
Настоящее изобретение охватывает также применение последовательностей, имеющих степень идентичности или степень гомологии с последовательностью (последовательностями) полипептида, имеющими специфические свойства, определенные здесь, или любой нуклеотидной последовательностью, кодирующей такой полипептид (называемые здесь далее как “гомологичная последовательность” (“гомологичные последовательности”)). Здесь термин “гомологичный” означает объект, имеющий явную гомологию с рассматриваемыми последовательностями аминокислот и рассматриваемыми нуклеотидными последовательностями. Здесь термин “гомология” может быть приравнен к термину “идентичность”.
Гомологичная последовательность аминокислот и/или нуклеотидная последовательность должна обеспечить и/или кодировать полипептид, который сохраняет функциональную активность и/или улучшает активность фермента.
В данном контексте гомологичная последовательность использована для того, чтобы включить последовательность аминокислот, которая может быть по меньшей мере на 75, 85 или 90% идентичной, предпочтительно, по меньшей мере на 95 или 98% идентичной последовательности, являющейся предметом рассмотрения. Обычно гомологи должны включать такие же активные сайты и т.п., что и рассматриваемая последовательность аминокислот. Хотя гомология может также рассматриваться в отношении сходства (т.е. аминокислотные остатки, имеющие сходные химические свойства/функции), в контексте настоящего изобретения предпочтительно выражать гомологию в отношении идентичности последовательности.
В данном контексте гомологичная последовательность использована для того, чтобы включить нуклеотидную последовательность, которая может быть по меньшей мере на 75, 85 или 90% идентичной, предпочтительно, по меньшей мере на 95 или 98% идентичной нуклеотидной последовательности, кодирующей полипептид по настоящему изобретению (последовательности, являющейся предметом рассмотрения). Обычно гомологи должны включать такие же последовательности, какие кодируют активные сайты и т.п., что и рассматриваемая последовательность. Хотя гомология может также рассматриваться в отношении сходства (т.е. аминокислотные остатки, имеющие сходные химические свойства/функции), в контексте настоящего изобретения предпочтительно выражать гомологию в отношении идентичности последовательности.
Сравнения гомологии могут быть проведены на глаз или, удобнее, с помощью легко доступных программ сравнения последовательностей. Такие имеющиеся в продаже компьютерные программы могут рассчитывать % гомологии между двумя или несколькими последовательностями.
% гомологии может быть рассчитан между смежными последовательностями, т.е. одна последовательность является выровненной по другой последовательности, и каждая аминокислота в одной последовательности напрямую сравнивается с соответствующей аминокислотой в другой последовательности, по одному остатку за раз. Это называют “выравниванием без пробелов”. Обычно такие выравнивания проводят только на относительно малом числе остатков.
Хотя это является очень простым и логичным методом, он не учитывает, что, например, в идентичной в целом паре последовательностей одна вставка или одна делеция будет заставлять следующие остатки аминокислот выпадать из выравнивания, что потенциально приводит к большому снижению % гомологии, когда осуществляют глобальное выравнивание. Следовательно, большинство методов сравнения последовательностей разработаны для получения оптимальных выравниваний, которые принимают во внимание возможные вставки и делеции без чрезмерного штрафа на оценку общей гомологии. Это достигается вставкой “пробелов” в выравниваемую последовательность, чтобы постараться максимизировать локальную гомологию.
Однако такие более сложные методы устанавливают “штрафы за пробел” для каждого пробела, который появляется при выравнивании последовательности, так что для одинакового числа идентичных аминокислот выравнивание последовательности с настолько малым числом пробелов, насколько возможно, что отражает более высокую связанность между двумя сравниваемыми последовательностями, получит более высокую оценку, чем последовательность со многими пробелами. Обычно используют “аффинную цену пробела”, которая начисляет относительно высокую цену за существование каждого пробела и более низкий штраф за каждый последующий остаток в пробеле. Это является наиболее широко используемой системой оценки пробелов. Высокий штраф за пробел должен, конечно, давать оптимизированные выравнивания с меньшими пробелами. Большинство программ выравнивания позволяют модифицировать штрафы за пробел. Однако при использовании такого программного продукта для сравнений последовательностей предпочтительно применять значения по умолчанию. Например, при использовании пакета GCG Wisconsin Bestfit штраф за пробел по умолчанию для последовательностей аминокислот составляет -12 за пробел и -4 за расширение.
Расчет максимального % гомологии поэтому прежде всего требует получения оптимального выравнивания, принимая во внимание штрафы за пробел. Подходящей компьютерной программой для осуществления такого выравнивания является пакет GCG Wisconsin Bestfit (Devereux et al. 1984 Nuc. Acids Research 12 p. 387). Примеры других программ, которые могут проводить сравнение последовательностей, включают, но не ограничиваются этим, пакет BLAST (см. Ausbel et al. 1999 Short Protocols in Molecular Biology, 4th Ed. – Chapter 18), FASTA (Altschut et al. 1990 J.Mol.Biol. 403-410) и набор инструментов для сравнения GENEWORKS. И BLAST, и FASTA доступны для автономного и онлайнового поиска (см. Ausbel et al. 1999, рр. от 7-58 до 7-60). Однако для некоторых приложений предпочтительно использовать программу GCG Bestfit. Новый инструмент, называемый BLAST 2 Sequences, также доступен для сравнения белковых и нуклеотидных последовательностей (см. FEMS Micribiol. Lett 1999 174(2), 247-50; FEMS Micribiol. Lett 1999 177(1), 187-8 и tatiana@ncbi.nml.gov).
Хотя конечный % гомологии может быть определен в отношении идентичности, сам процесс выравнивания обычно не основывается на сравнении пар по принципу “все или ничего”. Вместо этого обычно используют матрицу масштабных оценок подобия, которая устанавливает оценки каждому парному сравнению, основываясь на химическом подобии или эволюционном расстоянии. Широко используемым примером такой матрицы является матрица BLOSUM62 – матрица умолчаний для пакета программ BLAST. Программы GCG Wisconsin обычно используют или общедоступные величины по умолчанию, или сделанную специально таблицу сравнения символов, если доступно (см. руководство пользователя для дальнейших подробностей). Для некоторых применений предпочтительно использовать общедоступные величины по умолчанию для пакета GCG или, в случае использования других программ, матрицу умолчаний, такую как BLOSUM62.
Альтернативно, процент гомологии может быть рассчитан с использованием признака кратного выравнивания в DNASIS (Hitachi Software), основанного на алгоритме, аналогичном CLUSTAL (Higgins DG & Sharp PM (1988), Gene 73(1), 237-244). (Hitachi Software), основанного на алгоритме, аналогичном CLUSTAL (Higgins DG & Sharp PM (1988), Gene 73(1), 237-244).
Как только программа произвела оптимальное выравнивание, становится возможно рассчитать % гомологии, предпочтительно % идентичности последовательностей. Программа обычно делает это как часть сравнения последовательностей и генерирует численный результат.
Последовательности могут также иметь делеции, вставки или замещения остатков аминокислот, которые продуцируют необъявленное изменение и приводят к функционально эквивалентному веществу. Могут быть сделаны преднамеренные замещения аминокислот на основе подобия полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков, поскольку сохраняется вторичная связующая активность вещества. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту, положительно заряженные аминокислоты включают лизин и аргинин, и аминокислоты с незаряженными полярными головными группами, имеющие подобные значения гидрофильности, включают лейцин, изолейцин, валин, глицин, аланин, аспарагин, глютамин, серин, треонин, фенилаланин и тирозин.
Могут быть сделаны консервативные замещения, например, согласно приведенной ниже таблице. Аминокислоты в одном и том же блоке во втором столбце и, предпочтительно, в одной и той же строке в третьем столбце могут замещать друг друга.
| АЛИФАТИЧЕСКИЕ |
Неполярные |
G A P |
| I L V |
| Полярные – незаряженные |
C S T M |
| N Q |
| Полярные – заряженные |
D E |
| K R |
| АРОМАТИЧЕСКИЕ |
 |
H F W V |
Настоящее изобретение охватывает также гомологичное замещение (и замещение и замена использованы здесь для того, чтобы обозначить взаимозаменяемость существующего остатка аминокислоты и альтернативного остатка), которое может происходить, т.е. замещение подобного подобным, такое как основного основным, кислотного кислотным, полярного полярным и т.д. Может происходить также негомологичное замещение, т.е. одного класса остатка другим, или, альтернативно, вовлекающее включение ненатуральных аминокислот, таких как орнитин (называемый здесь далее Z), орнитиндиаминомасляная кислота (называемая здесь далее В), норлейцинорнитин (называемый здесь далее О), пирилаланин, тиенилаланин, нафтилаланин и фенилглицин.
Замещения также могут быть сделаны ненатуральными аминокислотами.
Вариантные последовательности аминокислот могут включать подходящие спейсерные группы, которые могут быть вставлены между любыми двумя аминокислотными остатками последовательности, включающие метильные, этильные или пропильные группы в добавление к аминокислотным спейсерам, таким как остатки глицина или  -аланина. Следующая форма вариации включает присутствие одного или нескольких аминокислотных остатков в пептоидной форме и должна быть хорошо понятна специалистам. Во избежание сомнений выражение “пептоидная форма” использовано для обозначения варианта аминокислотного остатка, в котором группа-заместитель -аланина. Следующая форма вариации включает присутствие одного или нескольких аминокислотных остатков в пептоидной форме и должна быть хорошо понятна специалистам. Во избежание сомнений выражение “пептоидная форма” использовано для обозначения варианта аминокислотного остатка, в котором группа-заместитель  -углерода находится на атоме азота остатка, а не на -углерода находится на атоме азота остатка, а не на  -углероде. Способы получения пептидов в пептоидной форме известны в литературе, например Simon R.J. et al., PNAS (1992) 89(20), 9367-9371 и Horwell D.C., Trends Biotechnol. (1995) 13(4), 132-134. -углероде. Способы получения пептидов в пептоидной форме известны в литературе, например Simon R.J. et al., PNAS (1992) 89(20), 9367-9371 и Horwell D.C., Trends Biotechnol. (1995) 13(4), 132-134.
Нуклеотидные зависимости для использования в настоящем изобретении для кодирования полипептида, имеющего определенные здесь специфические свойства, могут включать в себя синтетические или модифицированные нуклеотиды. Многие различные типы модификаций олигонуклеотидов известны в этой области. Они включают метилфосфонатные и фосфортиоатные скелеты и/или добавление акридиновых или полилизиновых цепей к концам 3′ или 5′ молекулы.
Для целей настоящего изобретения должно быть понятно, что описанные здесь нуклеотидные последовательности могут быть модифицированы любым способом, доступным из практики. Такие модификации могут быть осуществлены для того, чтобы улучшить активность in vivo или продолжительность жизни нуклеотидных последовательностей.
Настоящее изобретение охватывает также применение нуклеотидных последовательностей, которые являются комплементарными к обсуждаемым здесь последовательностям, или любые производные, фрагменты или их производные. Если последовательность является комплементарной к их фрагменту, тогда такая последовательность может быть использована как зонд для идентификации подобных кодирующих последовательностей в других организмах и т.д.
Полинуклеотиды, которые не являются на 100% гомологичными последовательностям по настоящему изобретению, но входят в область изобретения, могут быть получены многими путями. Другие варианты описанных здесь последовательностей могут быть получены, например, зондированием библиотек ДНК, изготовленных из особей, например особей из различных популяций. Кроме того, другие вирусные/бактериальные или клеточные гомологи, в особенности клеточные гомологи, обнаруживаемые в клетках млекопитающих (например, крыс, мышей, бычьих клетках и клетках приматов), могут быть получены, и такие гомологи и их фрагменты в принципе будут способны селективно гибридизировать последовательности, показанные здесь в перечне последовательностей. Такие последовательности могут быть получены зондированием библиотек кДНК, составленных из библиотек геномных ДНК от других видов животных, и зондированием таких библиотек зондами, включающими всю или часть любой одной из последовательностей в списках присоединенных последовательностей в условиях от умеренной до высокой жесткости. Подобные соображения применимы к получению видов гомологов и аллельных вариантов полипептидных или нуклеотидных последовательностей по изобретению.
Варианты и штаммы/виды гомологи могут также быть получены с использованием вырожденной ПЦР, в которой используют праймеры, нацеленные в мишень последовательности среди вариантов и гомологов, кодирующих консервативные последовательности аминокислот среди последовательностей по настоящему изобретению. Консервативные последовательности могут быть предсказаны, например, выравниванием последовательностей аминокислот из нескольких вариантов/гомологов. Выравнивание последовательностей может быть осуществлено с использованием компьютерных программ, известных в этой области. Например, широко используется программа GCG Wisconsin PileUp.
Праймеры, используемые в вырожденной ПЦР, должны содержать одну или несколько вырожденных позиций и должны быть использованы при жесткости условий, более низкой, чем условия, используемые для клонирования последовательностей единым праймером последовательности против известных последовательностей.
Альтернативно, такие полинуклеотиды могут быть получены направленным на сайт мутагенезом характеризованных последовательностей. Это может быть полезным, когда, например, требуются бессимптомные изменения последовательности кодонов, чтобы оптимизировать предпочтение кодонов для конкретной клетки-реципиента, в которую была экспрессирована нуклеотидная последовательность. Другие изменения последовательности могут быть желательны для того, чтобы ввести сайты распознавания рестрикционного полипептида или изменить свойство или функцию полипептидов, кодируемых полинуклеотидами.
Полинуклеотиды (полинуклеотидные последовательности) по изобретению могут быть использованы для получения праймера, например праймера ПЦР, праймера для альтернативной реакции амплификации, зонда, например, меченного отличительной меткой, обычными способами, использующими радиоактивные или нерадиоактивные метки, или полинеулеотиды могут быть клонированы в векторы. Такие праймеры, зонды и другие фрагменты должны быть в по меньшей мере 15, предпочтительно, по меньшей мере 20, например, по меньшей мере 25, 30 или 40 нуклеотидов длиной, и также охватываются термином “нуклеотиды по изобретению”, как он использован здесь.
Полинуклеотиды, такие как полинуклеотиды ДНК и зонды согласно изобретению, могут быть получены рекомбинантно, синтетически или любыми другими методами, доступными специалистам. Они могут также быть клонированы стандартными методиками.
В принципе, праймеры могут быть получены синтетическими способами, включая ступенчатое получение желаемой последовательности нуклеиновых кислот, по одному нуклеотиду за раз. Методики для осуществления этого с использованием автоматизированных технологий легко доступны в практике.
Более длинные полинуклеотиды будут, как правило, получаться при использовании рекомбинантных средств, например при использовании методик клонирования ПЦР (реакция полимеразы цепи). Это должно включать изготовление пары праймеров (например, от примерно 15 до 30 нуклеотидов), фланкирующих область нацеливающей на липид последовательности, которую желательно клонировать, ввод праймеров в контакт с мРНК или кДНК, полученными из животных или растительных клеток, осуществление реакции полимеразы цепи при условиях, которые вызывают амплификацию желаемой области, изолирование амплифицированного фрагмента (например, очисткой реакционной смеси на геле агарозы) и извлечение амплифицированной ДНК. Праймеры могут быть разработаны так, чтобы содержать подходящие сайты распознавания рестрикционного фермента, так чтобы амплифицированная ДНК могла быть клонирована в подходящий клонирующий вектор.
ГИБРИДИЗАЦИЯ
Настоящее изобретение охватывает также последовательности, которые являются комплементарными к последовательностям по настоящему изобретению, или последовательности, которые способны гибридизировать, или последовательности по настоящему изобретению, или комплементарные им последовательности.
Термин “гибридизация”, как он использован здесь, должен включать “процесс, с помощью которого нить нуклеиновой кислоты соединяется с комплементарной нитью путем спаривания оснований нуклеиновых кислот”, а также процесс амплификации, как он осуществляется в технологиях реакции полимеразы цепи (ПЦР).
Настоящее изобретение также охватывает применение нуклеотидных последовательностей, которые способны гибридизироваться с последовательностями, являющимися комплементарными к обсуждаемым здесь аспектным последовательностям или к любым их производным, фрагментам или их производным.
Настоящее изобретение также охватывает последовательности, которые способны гибридизироваться с обсуждаемыми здесь нуклеотидными последовательностями.
Условия гибридизации основываются на температуре плавления (Тпл) связующего комплекса, как указано в Berger and Kimmel (1987, Guide to Molecular Cloning Techniques, Methods in Enzymology, Vol. 152, Academic Press, San Diego CA), и предполагают определенную “жесткость”, как объяснено ниже.
Максимальная жесткость обычно появляется при температуре примерно Тпл-5°С (на 5°С ниже Тпл зонда); высокая жесткость при температуре примерно на 5-10°С ниже Тпл; средняя жесткость при температуре примерно на 10-20°С ниже Тпл и низкая жесткость при температуре примерно на 20-25°С ниже Тпл. Как должно быть понятно специалистам, максимальная жесткость гибридизации может быть использована для идентификации или определения подобных или родственных полинуклеотидных последовательностей.
Предпочтительно, настоящее изобретение охватывает также последовательности, которые являются комплементарными к последовательностям, способным к гибридизации при условиях высокой жесткости или условиях средней жесткости с нуклеотидными последовательностями, кодирующими полипептиды, имеющие специфические свойства, как они определены здесь.
Более предпочтительно, настоящее изобретение охватывает последовательности, которые являются комплементарными к последовательностям, способным гибридизировать при высоко жестких условиях (например, 65°С и 0,1×SSC {1×SSC = 0,15 M Na-цитрат, рН 7,01} с нуклеотидными последовательностями, кодирующими полипептиды, имеющие специфические свойства, как они определены здесь.
Настоящее изобретение относится также к нуклеотидным последовательностям, которые могут гибридизироваться с обсужденными здесь нуклеотидными последовательностями (включая комплементарные последовательности обсужденных здесь последовательностей).
Настоящее изобретение относится также к нуклеотидным последовательностям, которые являются комплементарными к последовательностям, которые могут гибридизироваться с обсужденными здесь нуклеотидными последовательностями (включая комплементарные последовательности обсужденных здесь последовательностей).
В область настоящего изобретения включены также полинуклеотидные последовательности, которые способны гибридизироваться с обсужденными здесь нуклеотидными последовательностями при условиях от средней до максимальной жесткости.
В предпочтительном аспекте настоящее изобретение относится к нуклеотидным последовательностям, которые могут гибридизироваться с обсуждаемыми здесь нуклеотидными последовательностями или их комплементами при условиях высокой жесткости (например, 50°С и 0,2×SSC).
В более предпочтительном аспекте настоящее изобретение защищает нуклеотидные последовательности, которые могут гибридизироваться с обсужденными здесь нуклеотидными последовательностями или их комплементами при условиях высокой жесткости (например, 65°С и 0,1×SSC).
ЭКСПРЕССИЯ ПОЛИПЕПТИДОВ
Нуклеотидная последовательность для применения в настоящем изобретении для кодирования полипептида, имеющего специфические свойства, как они определены здесь, может быть введена в рекомбинантный реплицируемый вектор. Вектор может быть использован для того, чтобы реплицировать и экспрессировать нуклеотидную последовательность в полипептидной форме в совместимую клетку-реципиент и/или из нее. Экспрессия может быть контролируемой при использовании контрольных последовательностей, включающих промоторы/энхансеры и другие сигналы регуляции экспрессии. Могут быть использованы прокариотические промоторы и промоторы, функциональные в эукариотических клетках. Специфические ткани или стимулирующие специфические промоторы могут быть использованы. Могут также быть использованы химерные промоторы, включающие элементы последовательностей из двух или более различных промоторов, описанных выше.
Полипептиды, образованные рекомбинантной клеткой-реципиентом путем экспрессии нуклеотидной последовательности могут быть секретированными или могут быть содержащимися внутриклеточно в зависимости от использованных последовательности и/или вектора. Кодирующие последовательности могут быть изготовлены с сигнальной последовательностью, которая направляет секрецию вещества кодирующих последовательностей через конкретные мембраны прокариотических или эукариотических клеток.
ВЕКТОР ЭКСПРЕССИИ
Термин “вектор экспрессии” означает конструкт, способный к экспрессии in vivo или in vitro.
Предпочтительно, вектор экспрессии является введенным в геном организма. Термин “введенный”, предпочтительно, покрывает стабильный ввод в геном.
Нуклеотидная последовательность по настоящему изобретению или кодирующая полипептид, имеющий специфические свойства, как они определены здесь, может находиться в составе вектора, в котором нуклеотидная последовательность функционально связана с регуляторными последовательностями так, что регуляторные последовательности способны обеспечить экспрессию нуклеотидной последовательности подходящим организмом-хозяином, т.е. вектор является вектором экспрессии.
Векторы по настоящему изобретению могут быть трансформированы в подходящую клетку-хозяин, как описано ниже, для того, чтобы обеспечить экспрессию полипептида, имеющего специфические свойства, как они определены здесь.
Выбор вектора, например плазмиды, космиды, вируса или фага, часто будет зависеть от клетки-хозяина, в которую он должен быть введен.
Векторы могут содержать один или несколько генов селектируемых маркеров, таких как ген, который придает резистентность к антибиотикам, например резистентность к ампициллину, канамицину, хлорамфениколу или тетрациклину. Альтернативно, селекция может быть осуществлена путем совместной трансформации (как описано в WO 91/17243).
Векторы могут быть использованы in vitro, например, для получения РНК или использованы для трансфекции или трансформации клетки-хозяина.
Так, в следующем варианте осуществления изобретение относится к способу получения нуклеотидных последовательностей по настоящему изобретению или нуклеотидных последовательностей, кодирующих полипептиды, имеющие специфические свойства, как они определены здесь, путем ввода нуклеотидной последовательности в реплицируемый вектор, ввода вектора в совместимую клетку-хозяин и культивирования клетки-хозяина в условиях, которые благоприятны для репликации вектора.
Вектор может дополнительно включать нуклеотидную последовательность, обеспечивающую репликацию вектора в рассматриваемой клетке-хозяине. Примерами таких последовательностей являются сайты начала репликации плазмид pUC19, pACYC177, pUB110, pE194, pAMB1 и pIJ702.
РЕГУЛЯТОРНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ
В некоторых областях использования нуклеотидная последовательность для применения в настоящем изобретении или нуклеотидная последовательность, кодирующая полипептид, имеющий специфические свойства, как определено здесь, могут быть функционально связаны с регуляторной последовательностью, которая способна обеспечить экспрессию нуклеотидной последовательности, такую как экспрессия, выбранная клеткой-хозяином. В качестве примера, настоящее изобретение относится к вектору, включающему нуклеотидную последовательность по настоящему изобретению, функционально связанную с такой регуляторной последовательностью, т.е. вектор является вектором экспрессии.
Термин “функционально связан” относится к соседнему положению, при котором описанные компоненты находятся во взаимоотношении, обеспечивающем их функционирование предписанным им образом. Регуляторная последовательность, функционально связанная с кодирующей последовательностью, лигирована таким образом, что экспрессия кодирующей последовательности достигается при условиях, совместимых с контрольными последовательностями.
Термин “регуляторные последовательности” включают промоторы и энхансеры и другие сигналы регулирования экспрессии.
Термин “промотор” использован в обычном смысле для этой области, т.е. как, например, связывающий полимеразу сайт РНК.
Улучшенная экспрессия нуклеотидной последовательности, кодирующей фермент, имеющий специфические свойства, определенные здесь, может быть также достигнута путем использования селекции гетерологичных регуляторных зон, например зон промотора, лидера секреции и терминатора.
Предпочтительно, нуклеотидная последовательность по настоящему изобретению может быть функционально связана по меньшей мере с промотором.
Примеры подходящих промоторов для направления транскрипции нуклеотидной последовательности в бактериальных, грибных или дрожжевых хозяевах хорошо известны из уровня техники.
КОНСТРУКТЫ
Термин “конструкт”, который является синонимом таких терминов, как “конъюгат”, “кассета” и “гибрид”, включает нуклеотидную последовательность, кодирующую полипептид, имеющий специфические свойства, как определено здесь, для применения согласно настоящему изобретению, прямо или косвенно присоединенную к промотору. Примером косвенного присоединения является подходящая спейсерная группа, такая как интронная последовательность, такая как Sh1-интрон или ADH-интрон, между промотором и нуклеотидной последовательностью по настоящему изобретению. То же справедливо и для термина “слитый” в связи с настоящим изобретением, который включает прямое или непрямое присоединение. В некоторых случаях термины не покрывают естественную комбинацию нуклеотидной последовательности, колирующей протеин, обычно связанный с промотором гена дикого типа и где они оба находятся в своем естественном окружении.
Конструкт может даже содержать или экспрессировать маркер, который делает возможной селекцию генетического конструкта.
Для некоторых областей применения, предпочтительно, конструкт включает по меньшей мере нуклеотидную последовательность по настоящему изобретению или нуклеотидную последовательность, кодирующую полипептид, имеющий специфические свойства, как определено здесь, функционально связанную с промотором.
КЛЕТКИ-ХОЗЯЕВА
Термин “клетка-хозяин” по отношению к настоящему изобретению включает любую клетку, содержащую или нуклеотидную последовательность, кодирующую полипептид, имеющий специфические свойства, как определено здесь, или вектор экспрессии, как он описан выше, который используют при рекомбинантном получении полипептида, имеющего специфические свойства, как определено здесь.
Так, следующий вариант осуществления настоящего изобретения относится к клеткам-хозяевам, трансформированным или трансфецированным нуклеотидной последовательностью по настоящему изобретению или нуклеотидной последовательностью, которая экспрессирует полипептид, имеющий специфические свойства, как определено здесь. Клетки должны быть выбраны так, чтобы быть совместимыми с указанным вектором, и могут, например, быть прокариотическими (например, бактериальными), грибковыми, дрожжевыми или растительными клетками. Предпочтительно, клетки-хозяева не являются клетками человека.
Примерами подходящих бактериальных организмов-хозяев являются грамм-отрицательные или грамм-положительные бактерии.
В зависимости от природы нуклеотидной последовательности, кодирующей полипептид, имеющий специфические свойства, как определено здесь, и/или желательности дальнейшей переработки экспрессированного протеина могут быть предпочтительны эукариотические хозяева, такие как дрожжи или другие грибы. В общем случае клетки дрожжей являются предпочтительными перед грибковыми клетками, потому что с ними легче манипулировать. Однако некоторые протеины или плохо секретируются из дрожжевой клетки, или в некоторых случаях не перерабатываются должным образом (например, гипергликозилирование в дрожжах). В таких случаях должны быть выбраны различные грибковые клетки.
Использование подходящих клеток-хозяев, таких как дрожжевые, грибковые и растительные клетки-хозяева, может обеспечить посттрансляционную модификацию (например, миристоилирование, гликозилирование, усечение, окаменение и фосфорилирование серина или треонина), если может потребоваться для обеспечения оптимальной биологической активности рекомбинантных продуктов экспрессии по настоящему изобретению.
Клетка-хозяин может быть протеолитически недостаточным или протеолитическим минус штаммом.
ОРГАНИЗМ
Термин “организм” в связи с настоящим изобретением включает любой организм, который может включать нуклеотидную последовательность согласно настоящему изобретению или нуклеотидную последовательность, кодирующую полипептид, имеющий специфические свойства, как определено здесь, и/или полученные из них продукты.
Подходящие организмы могут включать прокариоты, грибы, дрожжи или растения.
Термин “трансгенный организм” в связи с настоящим изобретением включает любой организм, который включает нуклеотидную последовательность, кодирующую полипептид, имеющий специфические свойства, как определено здесь, и/или полученные из него продукты, и/или в котором промотор может сделать возможной экспрессию нуклеотидной последовательности, кодирующей полипептид, имеющий специфические свойства, как определено здесь, внутри организма.
Термин “трансгенный организм” не охватывает нативные нуклеотидные кодирующие последовательности в их естественном окружении, когда они находятся под контролем их естественного промотора, который также находится в своем естественном окружении.
Поэтому трансгенный организм по настоящему изобретению включает любую одну из или комбинацию из нуклеотидной последовательности, кодирующей полипептид, имеющий специфические свойства, как определено здесь, конструктов, как они определены здесь, векторов, как они определены здесь, плазмид, как они определены здесь, клеток, как они определены здесь, или их продуктов. Например, трансгенный организм может также включать нуклеотидную последовательность, кодирующую полипептид, имеющий специфические свойства, как определено здесь, под контролем гетерологичного промотора.
ТРАНСФОРМАЦИЯ КЛЕТОК/ОРГАНИЗМОВ-ХОЗЯЕВ
Как указано выше, организм-хозяин может быть прокариотическим или эукариотическим организмом. Примеры подходящих прокариотических хозяев включают E. coli и Bacillus subtilis.
Указания по трансформации прокариотических хозяев хорошо изложены в литературе (см., например, Sambrook et al. (Molecular Cloning: A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press). Если используется прокариотический хозяин, то нуклеотидную последовательность может быть необходимо подходящим образом модифицировать перед трансформацией, например, удалением интронов.
В другом осуществлении трансгенным организмом могут быть дрожжи.
Клетки мицелиальных грибов могут быть трансформированы с использованием различных методов, известных из уровня техники, таких как процесс, включающий образование фитопластов и трансформацию фитопластов с последующей регенерацией клеточных стенок известным образом. Использование Aspergillus в качестве микроорганизма-хозяина описано в ЕР 0238023.
Другим организмом-хозяином может быть растение. Обзор общих методик, используемых для трансформации растений, можно найти в статье Potrykus (Ann Rev Plant Physiol Plant Mol Biol [1991] 42: 205-225 и Christou (Agro-Food-Industry Hi-Tech March/April 1994 17-27). Дополнительные указания по трансформации растений можно найти в ЕР-А-0449375.
Общие указания по трансформации грибов, дрожжей и растений представлены в следующих разделах.
ТРАНСФОРМИРОВАННЫЕ ГРИБЫ
Организмом-хозяином могут быть грибы, такие как мицелиальные грибы. Примеры таких подходящих хозяев включают любой член, принадлежащий к родам Thermomyces, Acremonium, Aspergillis, Penicillium, Mucor, Neurospora, Trichoderma и т.п.
Обзор указаний по трансформации мицелиальных грибов дан в US-A-5741665, где указано, что стандартные методики для трансформации мицелиальных грибов и культивирования грибов хорошо известны в практике. Расширенный обзор методик в применении к N. crassa можно найти, например, у Davis and de Serres, Methods Enzymol (1971) 17A: 79-143.
Дополнительные указания по трансформации мицелиальных грибов даны в US-A-5674707.
В одном аспекте организм-хозяин может принадлежать роду Aspergillus, такому как Aspergillus niger.
Трансгенный Aspergillus согласно настоящему изобретению может также быть получен, следуя, например, указаниям Turner G. 1994 (Vectors for genetic manipulation. In Martinelli S.D., Kinghorn J.R. (Editors) Aspergillus: 50 years on. Progress in industrial microbiology, vol. 29. Elsevier Amsterdam 1994, pp. 641-666).
Экспрессия гена в мицелиальные грибы была рассмотрена в обзоре Punti et al. (2002) Trends Biotechnol 2002 May; 20(5): 200-6, Archer & Peberdy Crit Rev Biotechnol (1997) 17(4):273-306.
ТРАНСФОРМИРОВАННЫЕ ДРОЖЖИ
В другом осуществлении трансгенным организмом могут быть дрожжи.
Обзор принципов гетерологичной экспрессии гена в дрожжах представлен, например, в Methods Mol. Biol. (1995), 49: 341-54 и Curr Opin Biotechnol (1997) Oct; 8(5): 554-60.
В этом отношении дрожжи, такие как виды Saccharomyces cerevisiae или Pichia pastoris (см. FEMS Microbiol Rev (2000 24(1): 45-66), могут быть использованы как носитель для гетерологичной экспрессии гена.
Обзор принципов гетерологичной экспрессии в Saccharomyces cerevisiae и секреции генных продуктов дан в E. Hinchcliffe и E. Kenny (1993), “Yeast as a vehicle for the expression of heterologous genes”, Yeasts, Vol. 5, Anthony H. Rose and J. Stuart Harrison, eds.
2nd edition, Academic Press Ltd.).
Для трансформации дрожжей было разработано несколько протоколов трансформации. Например, трансгенный Saccharomyces согласно настоящему изобретению может быть получен в соответствии с указаниями Hinnen et al., (1978), Proceedings of the National Academy of Sciences of the USA75, 1929); Beggs J.D. (1978), Nature, London, 275, 104); и Ito H. et al. (1983, J Bacteriology 153, 163-168).
Трансформированные клетки дрожжей могут быть подвергнуты селекции с использованием различных селекционных маркеров, таких как ауксотрофные маркеры с доминантной устойчивостью к антибиотикам.
Подходящий дрожжевой организм-хозяин может быть выбран из биотехнологически релевантных видов дрожжей, таких как, но не ограниченных этим, виды дрожжей, выбранные из Pichia spp., Hansenula spp., Kluyveromyces spp., Yarrowinia spp., Saccharomyces spp., включая S.cerevisiae, или Schizosaccharomyces spp., включая Schizosaccharomyces pombe.
В качестве организма-хозяина может быть использован штамм метилотрофных дрожжей вида Pichia pastoris.
В одном варианте осуществления организмом-хозяином может быть вид Hansenula, такой как H. polymorpha (как описано в WO 01/39544).
ТРАНСФОРМИРОВАННЫЕ РАСТЕНИЯ/КЛЕТКИ РАСТЕНИЙ
Организмом-хозяином, пригодным для настоящего изобретения, может быть растение. Обзор общих методик можно найти в статьях Potrykus (Ann Rev Plant Mol Biol [1991] 42: 205-225) и Christou (Agro-Food-Industry Hi-Tech March/April 1994 17-27) или в WO 01/16308. Трансгенное растение может продуцировать более высокие уровни, например, эфиров фитостеролов и эфиров фитостанолов.
Поэтому настоящее изобретение относится также к способу получения трансгенного растения с улучшенными уровнями эфиров фитостеролов и эфиров фитостанолов, включающему стадии трансформации растительной клетки липид-ацилтрансферазой, как определено здесь (в частности, вектором экспрессии или конструктом, включающим липид-ацилтрансферазу, как определено здесь), и выращивания растения из трансформированной растительной клетки.
СЕКРЕЦИЯ
Часто желательно, чтобы полипептид был секретирован из осуществляющего экспрессию хозяина в культуральную среду, из которой фермент может быть более легко извлечен. Согласно настоящему изобретению последовательность-лидер секреции может быть выбрана в зависимости от используемого для экспрессии хозяина. Гибридные сигнальные последовательности также могут быть использованы в контексте настоящего изобретения.
Типичными примерами гетерологичных последовательностей-лидеров секреции являются последовательности, которые происходят из грибной амилоглюкозидазы (AG), ген (glaA – обе аминокислотные версии, и 18, и 24, например, из Aspergillus), ген а-фактора (дрожжи Saccharomyces, Kluyveromyces и Hansenula) или ген  -амилазы (Bacillus). -амилазы (Bacillus).
ДЕТЕКЦИЯ
В этой области известны различные протоколы для детекции и измерения экспрессии аминокислотной последовательности. Примеры включают анализ фермент-прикрепленным иммуносорбентом (ELISA), радиоиммунный анализ (RIA) и флюоресцентную сортировку активированных клеток (FACS).
Широкое разнообразие меток и методик конъюгации известно специалистам и может быть использовано в различных анализах нуклеиновых кислот и аминокислот.
Ряд компаний, таких как Pharmacia Biotech (Piscataway, NJ), Promega (Madison, WI) и US Biochemical Corp (Cleveland, OH), поставляет наборы и протоколы для таких процедур.
Подходящие молекулы-репортеры или метки включают радионуклиды, ферменты, флюоресцирующие, хемолюминисцентные или хромогенные агенты, а также субстраты, кофакторы, ингибиторы, магнитные частицы и т.п. Патенты, в которых описано применение таких меток, включают US-A-3817837, US-A-3850752, US-A-3939350, US-A-3996345, US-A-4277437, US-A-4275149 и US-A-4366241.
Кроме того, могут быть получены рекомбинантные иммуноглобулины, как показано в US-A-4816567.
СЛИТЫЕ ПРОТЕИНЫ
Полипептид, имеющий специфические свойства, как они определены здесь, может быть получен как слитый протеин, чтобы, например, облегчить его экстракцию и очистку. Примеры партнеров слитого протеина включают глутатион-S-трансферазу (GST), 6xHis, GAL4 (домены, связывающие ДНК и/или активирующие транскрипцию) и  -галактозидазу. Может быть также удобно включить сайт протеолитического расщепления между партнером слитого протеина и целевой белковой последовательностью, чтобы сделать возможным удаление белковой последовательности. Предпочтительно, слитый протеин не препятствует активности протеиновой последовательности. -галактозидазу. Может быть также удобно включить сайт протеолитического расщепления между партнером слитого протеина и целевой белковой последовательностью, чтобы сделать возможным удаление белковой последовательности. Предпочтительно, слитый протеин не препятствует активности протеиновой последовательности.
Системы экспрессии слитых генов в E. coli были рассмотрены в Curr. Opin. Biotechnol. (1995) 6(5): 501-6.
В другом варианте осуществления изобретения последовательности аминокислот полипептида, имеющего специфические свойства, как определено здесь, могут быть лигированы к гетерологичной последовательности, чтобы кодировать слитый протеин. Например, для скрининга библиотек пептидов на агенты, способные влиять на активность вещества, может быть полезно кодировать химерное вещество, экспрессирующее гетерологичный эпитоп, который распознается доступным в продаже антителом.
Изобретение будет теперь описано только для примера со ссылками на следующие фигуры и примеры.
Фиг.1 показывает консенсусную последовательность pfam00657 из базы данных, версия 6 (SEQ ID No. 1).
Фиг.2 показывает последовательность аминокислот (SEQ ID No. 2), полученную из организма Aeromonas hydrophila (P10480; GI: 121051).
Фиг.3 показывает последовательность аминокислот (SEQ ID No. 3), полученную из организма Aeromonas salmonicida (AAG098404; GI: 964017).
Фиг.4 показывает последовательность аминокислот (SEQ ID No. 4), полученную из организма Streptomyces coelicolor A3(2) (Genbank accession number NP-6321558).
Фиг.5 показывает последовательность аминокислот (SEQ ID No. 5), полученную из организма Streptomyces coelicolor A3(2) (Genbank accession number CAC42140).
Фиг.6 показывает последовательность аминокислот (SEQ ID No. 6), полученную из организма Saccharomyces cerevisiae A3(2) (Genbank accession number P41734).
Фиг.7 показывает выравнивание выбранной последовательности к консенсусной последовательности pfam00657.
Фиг.8 показывает парное выравнивание SEQ ID No. 3 c SEQ ID No. 2, показывающее 93% идентичность последовательности аминокислот. Сигнальная последовательность подчеркнута + обозначены различия. Фрагмент GDSX, содержащий активный сайт серина 16 и активные сайты аспарагиновой кислоты 116 и гистидина 291 выделены яркостью (см. затененные области). Числа после аминокислоты представляют минус сигнальную последовательность.
Фиг.9 показывает нуклеотидную последовательность (SEQ ID No. 7), кодирующую липид-ацилтрансферазу согласно настоящему изобретению, полученную из организма Aeromonas hydrophila.
Фиг.10 показывает нуклеотидную последовательность (SEQ ID No. 8), кодирующую липид-ацилтрансферазу согласно настоящему изобретению, полученную из организма Aeromonas salmonicida.
Фиг.11 показывает нуклеотидную последовательность (SEQ ID No. 9), кодирующую липид-ацилтрансферазу согласно настоящему изобретению, полученную из организма Streptomyces coelicolor A3(2) (Genbank accession number NC-003888.1:8327480..8328367).
Фиг.12 показывает нуклеотидную последовательность (SEQ ID No. 10), кодирующую липид-ацилтрансферазу согласно настоящему изобретению, полученную из организма Streptomyces coelicolor A3(2) (Genbank accession number AL939131.1:265480..266367).
Фиг.13 показывает нуклеотидную последовательность (SEQ ID No. 11), кодирующую липид-ацилтрансферазу согласно настоящему изобретению, полученную из организма Saccharomyces cerevisiae (Genbank accession number Z75034).
Фиг.14 показывает последовательность аминокислот (SEQ ID No. 12), полученную из организма Ralstonia (Genbank accession number: AL646052).
Фиг.15 показывает нуклеотидную последовательность (SEQ ID No. 13), кодирующую липид-ацилтрансферазу согласно настоящему изобретению, полученную из организма Ralstonia.
Фиг.16 показывает SEQ ID No. 20. Scoe1 NCBI протеин, код доступа CAB39707.1 GI:4539178 консервативный гипотетический протеин [Streptomyces coelocolor A3(2)].
Фиг.17 показывает нуклеотидную последовательность, показанную как SEQ ID No. 21, кодирующую NCBI протеин, код доступа CAB39707.1 GI:4539178 консервативный гипотетический протеин [Streptomyces coelocolor A3(2)].
Фиг.18 показывает аминокислоту, показанную как SEQ ID No. 22. Scoe2 NCBI протеин, код доступа CAС01477.1 GI:9716139 консервативный гипотетический протеин [Streptomyces coelocolor A3(2)].
Фиг.19 показывает нуклеотидную последовательность, показанную как SEQ ID No. 23, кодирующую Scoe2 NCBI протеин, код доступа CAС01477.1 GI:9716139 консервативный гипотетический протеин [Streptomyces coelocolor A3(2)].
Фиг.20 показывает последовательность аминокислот (SEQ ID No. 24). Scoe3 NCBI протеин, код доступа CAВ88833.1 GI:7536996 предполагаемый протеин [Streptomyces coelocolor A3(2)].
Фиг.21 показывает нуклеотидную последовательность, показанную как SEQ ID No. 25, кодирующую Scoe3 NCBI протеин, код доступа CAВ88833.1 GI:7536996 предполагаемый секретированный протеин [Streptomyces coelocolor A3(2)].
Фиг.22 показывает последовательность аминокислот (SEQ ID No. 26). Scoe4 NCBI протеин, код доступа CAВ89450.1 GI:7672261 предполагаемый секретированный протеин [Streptomyces coelocolor A3(2)].
Фиг.23 показывает нуклеотидную последовательность, показанную как SEQ ID No. 27, кодирующую Scoe4 NCBI протеин, код доступа CAВ89450.1 GI:7672261 предполагаемый секретированный протеин [Streptomyces coelocolor A3(2)].
Фиг.24 показывает последовательность аминокислот (SEQ ID No. 28). Scoe5 NCBI протеин, код доступа CAВ62724.1 GI:6562793 предполагаемый липопротеин [Streptomyces coelocolor A3(2)].
Фиг.25 показывает нуклеотидную последовательность, показанную как SEQ ID No. 29, кодирующую Scoe5 NCBI протеин, код доступа CAВ62724.1 GI:6562793 предполагаемый липопротеин [Streptomyces coelocolor A3(2)].
Фиг.26 показывает последовательность аминокислот (SEQ ID No. 30). Srim1 NCBI протеин, код доступа AAK84028.1 GI:15082088 GDSL-липаза [Streptomyces rimosus].
Фиг.27 показывает нуклеотидную последовательность, показанную как SEQ ID No. 31, кодирующую Srim1 NCBI протеин, код доступа AAK84028.1 GI:15082088 GDSL-липаза [Streptomyces rimosus].
Фиг.28 показывает последовательность аминокислот (SEQ ID No. 32). липид-ацилтрансферазы из Aeromonas hydrophila (ATCC#7965).
Фиг.29 показывает нуклеотидную последовательность (SEQ ID No. 33), кодирующую липид-ацилтрансферазу из Aeromonas hydrophila (ATCC#7965).
Фиг.30 показывает последовательность аминокислот (SEQ ID No. 34). липид-ацилтрансферазы из Aeromonas salmonicida, подвид Salmonicida (ATCC#14174).
Фиг.31 показывает нуклеотидную последовательность (SEQ ID No. 35), кодирующую липид-ацилтрансферазу из Aeromonas salmonicida, подвид Salmonicida (ATCC#14174).
Фиг.32 показывает, что гомологи генов Aeromonas могут быть идентифицированы с использованием системы поиска базового локального выравнивания в National Center for Biotechnology Information, NTH, MD, USA и пополненные геномные базы данных. Фрагмент GDSX был использован при поиске в базе данных и был идентифицирован ряд последовательностей/генов, потенциально кодирующих ферменты с липолитической активностью. Гены были идентифицированы из генов Streptomyces, Xanthomonas и Ralstonia. В качестве примера ниже Ralstonia solanacearum был выровнен к гену Aeromonas salmonicida (satA). Парное выравнивание показало 23% идентичности. Активный сайт серина присутствует на аминовых концах, и могут быть идентифицированы каталитические остатки гистидина и аспартамовой кислоты.
Фиг.33 показывает консенсусную последовательность Pfam00657.11 [семейство 00657, версия 11 базы данных], называемую здесь далее Pfam консенсус, и выравнивание различных последовательностей к консенсусной последовательности Pfam. Стрелки показывают остатки активных сайтов, подчеркнутые боксы показывают три из гомологичных боксов, указанных Upton C and Buckley J.T. (1995) Trends Biochem. Sci 20; 179-179. Заглавные буквы в Pfam консенсусе показывают консервативные остатки во многих членах семейства. Символ – обозначает положение, где скрытая марковская модель консенсуса Pfam ожидала найти остаток, но не нашла, так что вставлен пробел. Символ . обозначает остаток без соответствующего остатка в Pfam консенсусе. Последовательности являются последовательностями аминокислот, перечисленными на фиг.16, 18, 20, 22, 24, 26, 28 и 30.
Фиг.34 показывает консенсусную последовательность Pfam00657.11 [семейство 00657, версия 11 базы данных], называемую здесь далее Pfam консенсус, и выравнивание различных последовательностей к консенсусной последовательности Pfam. Стрелки показывают остатки активных сайтов, подчеркнутые боксы показывают три из гомологичных боксов, указанных Upton C and Buckley J.T. (1995) Trends Biochem. Sci 20; 179-179. Заглавные буквы в Pfam консенсусе показывают консервативные остатки во многих членах семейства. Символ – обозначает положение, где скрытая марковская модель консенсуса Pfam ожидала найти остаток, но не нашла, так что вставлен пробел. Символ . обозначает остаток без соответствующего остатка в Pfam консенсусе. Последовательности являются последовательностями аминокислот, перечисленными на фиг.2, 16, 18, 20, 26, 28 и 30. Было найдено, что все данные протеины являются активными против липидных субстратов.
Фиг.35 показывает вектор экспрессии pet12-AsalGCAT=pSM, содержащий С-терминальный His-меченный ген липид-ацилтрансферазы Aeromonas salmonicida.
Фиг.36 и фиг.37 показывает результаты испытаний клеточных экстрактов в тесте NEFA A Kit Assay, который описывает активность рекомбинантной липид-ацилтрансферазы A. salmonicida по отношению к лецитину. Клеточные экстракты были испытаны на фосфолипазную активность, используя тест NEFA Kit Assay. Лунки слева направо: положительный, контроль, отрицательный, контроль; 20°С, 30°С.
Фиг.38 показывает сырые клеточные экстракты из BL21(DE3)pLysS экспрессированной активной липид-ацилтрансферазы, инкубированной с субстратом лецитином, и реакционная смесь была проанализирована с использованием тонкослойной хроматографии, показавшей присутствие продуктов разложения. Дорожки: 1 – нет фермента; 2 – + A.sal. – 10 мкл, 37°C; 3. + A.sal – 20 мкл, 37°C; 4. + A.sal. – 10 мкл, 24°C; 5. + A.sal. – 20 мкл, 24°C.
Фиг.39 показывает частичную очистку ацилтрансферазы Aeromonas salmonicida, проявляющей фосфолипазную активность, связанную с очищенным His-меченным протеином. SE = обработанные ультразвуком экстракты, His = очищен Ni-NTA спин-набором от Qiagen.
Фиг.40 показывает вектор экспрессии pet12-A.h. GCAT = hSMa, содержавший С-терминальный His-меченный ген глицеролипид-ацилтрансферазы Aeromonas hydrophila был использован для трансформации E. coli, штамм BL21(DE3)pLysS.
Фиг.41 показывает активность сырых экстрактов (5 & 10 мкл), содержащих рекомбинантный фермент Aeromonas hydrophila GCAT. Фермент был испытан по отношению к лецитину с использованием набора неэтерифицируемой жирной кислоты (NEFA) (Roche, Switzerland), показав присутствие фермента, активного против фосфолипида лецитина.
Фиг.42 показывает оптимизацию роста BL21(DE30pLysS прибежища вектора экспрессии pet12-AsalGCAT = pSM, показывающий культивацию при 30°С, приводящую к продукции фермента с высокой активностью по отношению к лецитину. Клеточные экстракты испытывали на фосфолипазную активность, используя набор анализа NEFA.
Фиг.43 показывает частичную очистку ацилтрансферазы Aeromonas hydrophila & A. salmonicida, проявляющей фосфолипазную активность, связанную с очищенным His-меченным протеином. SE = обработанные ультразвуком экстракты, His = очищен Ni-NTA спин-набором от Qiagen.
Фиг.44 показывает экспрессию генов Aeromones в Bacillus subtilis 163, показывая продуцирование секретированного фермента с активностью по отношению и к лецитину, и к DGDG. Конструкт pUB-AH=, содержащий ген A.hydrophila, и конструкт pUB-AS, содержащий ген A. salmonicida. Культуральный фильтрат инкубировали с субстратом в течение 60 минут.
Фиг.45 и фиг.46 показывают планшет ТСХ в проявляющем растворителе IV (хлороформ:метанол:вода (65:24:4)); дорожка 1: 40 мг ситостерола, 30 мин; дорожка 2: трансфераза + 40 мг ситостерола, 30 мин; дорожка 3: трансфераза + 80 мг ситостерола, 30 мин; дорожка 4: трансфераза + 40 мг ситостерола, 120 мин; дорожка 5: трансфераза + 80 мг ситостерола, 120 мин; дорожка 6: трансфераза + 40 мг ситостерола, 300 мин; дорожка 7: 40 мг ситостерола, 300 мин; дорожка 8: холестерин; дорожка 9: ситостерол.
Фиг.47 изображает реакцию между фосфатидилхолином и холестерином, которая катализирована ацилтрансферазой.
Фиг.48 показывает анализ ТСХ липидов, экстрагированных из обработанного ферментом или необработанного яичного желтка: 6) 0,31 PLU/г трансфераза #179, 7) 1,25 PLU/г трансфераза #178-9, 8) 23,25 PLU/г фосфолипаза #3108, 9) контроль.
Фиг.49 показывает испытуемые образцы майонеза, полученные из обработанного ферментом или необработанного яичного желтка: 5) трансфераза #179, 0,31 PLU/г, 6) трансфераза #178-9, 1,25 PLU/г, 7) фосфолипаза #3108, 23,3 PLU/г, 8) контроль, вода.
Фиг.50 показывает ТХС (в растворителе I) липида яичного желтка, обработанного липид-ацилтрансферазой из A. hydrophila.
Фиг.51 показывает ТХС (в растворителе IV) липида яичного желтка, обработанного липид-ацилтрансферазой из A. hydrophila.
Фиг.52 показывает анализ ТСХ обработанного трансферазой липида из яичного желтка в течение времени.
Фиг.53 показывает количество образовавшихся жирной кислоты и эфира холестерина как функцию времени при использовании липид-ацилтрансферазы (Tranf # 178-9) в сравнении с использованием контрольного липолитического фермента Thermomyces lanuginosus.
Фиг.54 показывает относительную трансферазную активность как % от трансферазной и липолитической активности при ферментативной реакции в яичном желтке с высоким содержанием воды, контрольными фосфолипазами являются #1991 (фосфолипаза А2) и #2427 (фосфолипаза А1), липид-ацилтрансферазой является #178.
Фиг.55 показывает влияние содержания воды при анализе трансферазной активности трансферазы #178 при реакции в яичном желтке с высоким содержанием воды.
Фиг.56 показывает трансферазную активность для липид-ацилтрансферазы (#178) как функцию времени реакции при трансферазных реакциях в яичном желтке с высоким содержанием воды.
Фиг.57 и фиг.58 показывают графики, отражающие количество жирной кислоты и холестерина как функцию времени. Графики отражают результаты, полученные анализом ГЖХ в опыте для измерения ацилтрансферазной активности при использовании лецитина и холестерина в буфере в качестве субстрата.
Фиг.59 показывает ТСХ в растворителе I. Яичный желток, обработанный липид-ацилтрансферазой #138 из Aeromonas salmonicida (дорожка 1 и 2) или фосфолипазой #2938 (LIPOPAN F) (дорожка 3); необработанный яичный желток (дорожка 4). F) (дорожка 3); необработанный яичный желток (дорожка 4).
Фиг.60 показывает ТСХ в растворителе IV. Яичный желток, обработанный липид-ацилтрансферазой #138 (дорожка 1 и 2) или фосфолипазой #2938 (дорожка 3); необработанный яичный желток (дорожка 4).
Фиг.61 показывает яичный желток, обработанный липид-ацилтрансферазой #138 (образцы 1 и 2) или фосфолипазой #2938 (образец 3); необработанный яичный желток (образец 4).
Фиг.62 показывает пищевую эмульсию после 2 часов при 100°С. 0) необработанный яичный желток, 1) яичный желток, обработанный липид-ацилтрансферазой #138 в течение 210 минут, 3) яичный желток, обработанный контрольной фосфолипазой #2938 в течение 210 минут.
Фиг.63 показывает планшеты ТСХ, показывающие скрининг трансферазной активности на растительный стерол и глицерин. PC = фосфатидилхолин, LPC = лизофосфатидилхолин, PE = фосфатидилэтаноламин, monogl = моноглицерид.
Фиг.64 показывает планшет ТСХ в растворителе I, образцы 1-6 после 24 часов и образцы 1-4 после 4 часов времени реакции. Анализ ТСХ подтверждает образование эфира стерола в образцах 1, 2, 5 и 6.
Фиг.65 показывает планшет ТСХ в растворителе IV, где трансферазную активность иммобилизованной ацилтрансферазы из Aeromonas salmonicida испытывали в масляной смеси с отбором проб в 0,5, 1, 3, 6 и 24 ч.
Фиг.66 и 67 показывают планшеты ТСХ в растворителе I и IV. Дорожка 1 = лецитин; дорожка 2 = контроль – 10 мин; дорожка 3 = 0,75 PLU, 10 мин; дорожка 4 = 0,75 PLU, 60 мин; дорожка 5 = 0,75 PLU, 220 мин; дорожка 6 = контроль, 20 ч; дорожка 7 = 0,75 PLU, 20 ч; и дорожка 8) эфир холестерина.
Фиг.68 и 69 показывают планшеты ТСХ в растворителе IV. Дорожка 1 = лецитин; дорожка 2 = контроль – 10 мин; дорожка 3 = 1 PLU, 10 мин; дорожка 4 = 1 PLU, 60 мин; дорожка 5 = 1 PLU, 180 мин; дорожка 6 = 1 PLU, 220 мин, дорожка 7 = 1 PLU, 1200 мин; дорожка 8) = контроль, 1200 мин; дорожка 9) = эфир глюкозы; дорожка 19) = холестерин и дорожка 11) = глюкоза.
Фиг.70 показывает реакцию между DGDG и глюкозой, катализируемую липид-ацилтрансферазой.
Фиг.71 показывает последовательность аминокислот (SEQ ID No. 36) конструкта слияния, использованного для мутагенеза гена липид-ацилтрансферазы Aeromonas hydrophila в примере 17. Подчеркнутые аминокислоты представляют сигнальный пептид ксиланазы.
Фиг.72 показывает нуклеотидную последовательность (SEQ ID No. 45), кодирующую фермент из Aeromonas hydrophila, включая сигнальный пептид ксиланазы; и
фиг.73 показывает планшет ТСХ, ясно показывающий образование эфира растительного стерола и моноглицерида. Дорожка 1 – после 1 часа времени реакции, дорожка 2 – после 2 часов времени реакции, дорожка 3 – после 24 часов времени реакции, и дорожка 4 представляет растительный стерол.
ПРИМЕРЫ
За исключением того, где заявлено, анализ ТСХ проводили, как описано в примере 6, и анализ ГЖХ проводили, как описано в примере 1.
Пример 1. Клонирование, секвенирование и гетерологическая экспрессия трансферазы из Aeromonas salmonicida subsp. Salmonicida
Используемые штаммы
Aeromonas salmonicida subsp. Salmonicida (ATCC 14174) получили от АТСС и культивировали в течение ночи при 30°С в среде Luria-Bertani (LB). Клетки центрифугировали и выделяли геномную ДНК, используя методику изоляции геномной кислоты из Qiagen Ltd. Genomic DNA buffer set (кaт. 19060), протеазу К (кaт. 19131) и РНКазу А (кат. 19101), все от Qiagen Ltd. (Boundary court, Gatwick Court, West Sussex, RH10 2AX).
Для получения рекомбинантных ферментов Aeromonas использовали бактериальный штамм-хозяин BL21(DE3)pLysS (Novagen). Компетентные клетки BL21(DE3)pLysS использовали в качестве хозяев для трансформации вектором экспрессии pet12-AsalGCAT=pSM. Трансформанты, содержащие соответствующую плазмиду, культивировали при 37°С в агаровой LB среде, содержавшей 100 мкг/мл ампициллина.
Конструирование вектора экспрессии pet12-AsalGCAT=pSM
Для всех амплификаций ДНК генов трансферазы из Aeromonas использовали геномную ДНК (0,2-1 мкл) в качестве матрицы и pfu ДНК полимеразу (2,5 единиц) использовали с 10 мкл 10×pfu буфера, 1 мкл каждого праймера (50 пмоль/мкл), 200 uMdNTP в общем реакционном объеме 100 мкл. Реакции ПЦР проводили в программируемом термическом циклере, используя следующие условия: 95°С в течение 30 секунд, 30 циклов при 95°С в течение 30 секунд, 60°С в течение 1 минуты и 68°С в течение 2 минут. Использовали дополнительное продление в 5 минут при 72°С.
ПЦР амплификацию гена трансферазы из A. salmonicida проводили за 2 отдельные ПЦР реакции. ПЦР реакцию 1 проводили, используя пару праймеров, as1USNEW (5’AGCATATGAAAA AATGGTTTGT TTGTTTATTG GGG 3′ [SEQ ID No. 36]) и as1s950new (5′ GTG ATG GTG GGC GAG GAA CTC GTA CTG3′ [SEQ ID No. 37]). Вторую ПЦР реакцию проводили для того, чтобы ввести С-терминальную метку гистидина, используя ПЦР продукт первой реакции и праймеры: as1USNEW (5’AGCATATGAAAA AATGGTTTGT TTGTTTATTG GGG 3′ [SEQ ID No. 38]) и AHLS1001 (5’TTGGATCC GAATTCAT CAATG GTG ATG GTG ATG GTG GGC3′ [SEQ ID No. 39]). Продукт ПЦР второй реакции очищали и расщепляли рестрикционными ферментами Ndel и BamHL. 2 мкг вектора ДНК pET 12a также расщепляли рестрикционными ферментами Ndel и BamHL и обрабатывали фосфатазой. Обработанные рестрикционными ферментами pET 12a и продукт ПЦР реакции 2 очищали и лигировали, используя Rapid Ligation Kit (Roche, Switzerland). Смесь лигирования использовали для трансформации клеток E. coli TOP 10. Трансформанты высеивали на агаровую LB среду, содержавшую 100 мкг/мл ампициллина.
Промотор-праймер Т7 (5’TAATACGACTCACTATAG3′ [SEQ ID No.40]) и терминатор-праймер Т7 (5’CTAGTTATTGCTCAGCGG3′ [SEQ ID No.41]) использовали для верификации последовательностей и ориентации клонированных генов трансферазы в векторе рЕТ12а. Секвенирование ДНК проводили, используя набор для секвенирования ABI Prism® BigDye Terminators Cycle с 500 нг плазмиды ДНК в качестве матрицы и 3 пмоль промотор- и терминатор-праймеров. Terminators Cycle с 500 нг плазмиды ДНК в качестве матрицы и 3 пмоль промотор- и терминатор-праймеров.
Конструкт, показанный на фиг.35, был использован для трансформации компетентного бактериального штамма-хозяина BL21(DE3)pLysS (Novagen), и устойчивые к ампициллину трансформанты собирали и использовали для анализа экспрессии.
Экспрессия рекомбинантной липид-ацилтрансферазы Aeromonas salmonicida
Количественное определение ферментной активности по отношению к лецитину проводили, используя набор Non-Esterified Fatty Acid (NEFA) (Roche, Switzerland).
На фиг.36 BL21(DE3)pLysS, содержащий вектор экспрессии pet12-AsalGCAT=pSM, культивировали в среде LB + 100 нг/мл ампициллина и инкубировали при встряхивании при 37°С до достижения OD600 = 0,6-1,0. Культуры затем индуцировали, используя IPTG (0,4 мМ), и инкубацию продолжали в течение следующих 3 часов. Пробы отбирали через 0, 1, 2 и 3 ч после ввода IPTG. Ферментативную активность определяли, используя набор NEFA и лецитин в качестве субстрата.
Оптимизация культивирования для получения более активных ферментов
BL21(DE3)pLysS, содержащий вектор экспрессии pet12-Asal GCAT=pSM, культивировали в среде LB + 100 мкг/мл ампициллина и инкубировали со встряхиванием при различных температурах (37°С, 30°С и 20°С). Оптимальным условием для образования активного фермента липид-ацилтрансферазы являлось культивирование культуры при 30°С, как показано на фиг.37.
Частичная очистка рекомбинантной трансферазы Aeromonas salmonicida
Штамм BL21(DE3)pLysS, содержащий вектор экспрессии pet12-AsalGCAT=pSM, культивировали при 37°С, и сырые клеточные экстракты готовили обработкой ультразвуком. Рекомбинантный фермент далее очищали из обработанных ультразвуком сырых клеточных экстрактов, используя Ni-NTA спин-набор от Qiagen. Для фосфолипазной активности использовали набор NEFA и лецитин в качестве субстрата. Сырые клеточные экстракты из BL21(DE3)pLysS, экспрессированной активной трансферазы инкубировали с субстратом лецитина и реакционную смесь анализировали, используя тонкослойную хроматографию, показавшую присутствие продуктов разложения (см. фиг.38).
Частичная очистка рекомбинантной трансферазы Aeromonas salmonicidae
Штамм BL21(DE3)pLysS, содержащий вектор экспрессии pet12-AsalGCAT=pSM, культивировали при 37°С и сырые клеточные экстракты готовили обработкой ультразвуком. Рекомбинантный фермент далее очищали из обработанных ультразвуком сырых клеточных экстрактов, используя Ni-NTA спин-набор от Qiagen. Фосфолипазную активность определяли, используя набор NEFA и лецитин в качестве субстрата.
Пример 2. Клонирование и экспрессия трансферазы Aeromonas hydrophila в E. coli
Aeromonas hydrophila (ATCC # 7965) получили от АТСС и культивировали в течение ночи при 30°С в среде Luria-Bertani (LB). Клетки центрифугировали и выделяли геномную ДНК, используя методику изоляции геномной кислоты из Qiagen Ltd. Genomic DNA buffer set (кaт. 19060), протеазу К (кaт. 19131) и РНКазу А (кат. 19101), все от Qiagen Ltd. (Boundary court, Gatwick Court, West Sussex, RH10 2AX).
Для получения рекомбинантных ферментов Aeromonas использовали бактериальный штамм-хозяин BL21(DE3)pLysS (Novagen). Компетентные клетки BL21(DE3)pLysS использовали в качестве хозяев для трансформации вектором экспрессии pet12-A.h.GCAT=pSMa. Трансформанты, содержащие соответствующую плазмиду, культивировали при 37°С в агаровой LB среде, содержавшей 100 мкг/мл ампициллина.
Конструирование вектора экспрессии pet12-A.h.GCAT=pSMa
Для всех амплификаций ДНК генов трансферазы из Aeromonas использовали геномную ДНК (0,2-1 мкл) в качестве матрицы и pfu ДНК полимеразу (2,5 единиц) использовали с 10 мкл 10×pfu буфера, 1 мкл каждого праймера (50 пмоль/мкл), 200 uMdNTP в общем реакционном объеме 100 мкл. Реакции ПЦР проводили в программируемом термическом циклере, используя следующие условия: 95°С в течение 30 секунд, 30 циклов при 95°С в течение 30 секунд, 60°С в течение 1 минуты и 68°С в течение 2 минут. Применяли дополнительное продление в 5 минут при 72°С.
ПЦР-амплификацию гена трансферазы из A. hydrophila проводили за 2 отдельные ПЦР-реакции.
ПЦР-реакцию 1 проводили, используя пару праймеров, AHUS1 (5′ GTCATATGAAAAAATGGTTTGTGTGTTTATTGGGATTGGTC3′, SEQ ID No. 42) и as1s950 (5′ ATGGTGATGGTGATGGTGGGCGAGGAACTCGTACTG3′, SEQ ID No. 43).
Вторую ПЦР-реакцию проводили для того, чтобы ввести С-терминальную метку гистидина, используя ПЦР-продукт первой реакции и пару праймеров: AHUS1 (5’GTCATATGAAAAAATGGTTTGTGTGTTTATTGGGATTGGTC3′, SEQ ID No. 44) и AHLS1001 (5’TTGGATCCGAATTCATCAATGGTGATGGTGATGGTGGGC3′, SEQ ID No. 45).
Продукт ПЦР второй реакции очищали и расщепляли рестрикционными ферментами Ndel и BamHL. 2 мкг вектора ДНК pET 12a также расщепляли рестрикционными ферментами Ndel и BamHL и обрабатывали фосфатазой. Обработанные рестрикционными ферментами pET 12a и продукт ПЦР реакции 2 очищали и лигировали, используя Rapid Ligation Kit (Roche, Switzerland). Смесь лигирования использовали для трансформации клеток E. coli TOP10. Трансформанты высеивали на агаровую LB среду, содержавшую 100 мкг/мл ампициллина.
Промотор-праймер Т7 (5’TAATACGACTCACTATAG3′) и терминатор-праймер Т7 (5’CTAGTTATTGCTCAGCGG3′) использовали для верификации последовательностей и ориентации клонированных генов GCAT в векторе рЕТ12а. Секвенирование ДНК проводили, используя набор для секвенирования ABI Prism® BigDye Terminators Cycle с 500 нг плазмиды ДНК в качестве матрицы и 3 пмоль промотор- и терминатор-праймеров. Terminators Cycle с 500 нг плазмиды ДНК в качестве матрицы и 3 пмоль промотор- и терминатор-праймеров.
Конструкт, показанный на фиг.40, был использован для трансформации компетентного бактериального штамма-хозяина BL21(DE3)pLysS (Novagen), и устойчивые к ампициллину трансформанты собирали и использовали для анализа экспрессии.
Экспрессия трансферазы Aeromonas hydrophila в BL21(DE3)pLysS
Штамм E. coli BL21(DE3)pLysS, содержащий вектор экспрессии pet12a-A.h.GCAT=pSMa, культивировали в среде LB + 100 нг/мл ампициллина и инкубировали при встряхивании при 37°С до достижения OD600 = 0,6-1,0. Культуры затем индуцировали, используя IPTG (0,4 мМ), и инкубацию продолжали в течение следующих 3 часов. Пробы отбирали через 0, 1, 2 и 3 ч после ввода IPTG. Ферментативную активность определяли, используя набор NEFA и лецитин в качестве субстрата (фиг.41).
Оптимизация выращивания для получения более активных ферментов
BL21(DE3)pLysS, содержащий вектор экспрессии pet12a-A.h.GCAT=pSMa, культивировали в среде LB + 100 мкг/мл ампициллина и инкубировали со встряхиванием при различных температурах (37°С, 30°С и 20°С). Оптимальным условием для образования активного фермента GCAT являлось культивирование культуры при 30°С, как показано на фиг.42.
Частичная очистка рекомбинантной трансферазы Aeromonas hydrophila (GCAT)
Штамм BL21(DE3)pLysS, содержащий вектор экспрессии pet12a-A.h.GCAT=pSMa, культивировали при 37°С и сырые клеточные экстракты готовили обработкой ультразвуком. Рекомбинантный фермент дополнительно очищали из обработанных ультразвуком сырых клеточных экстрактов, используя Ni-NTA спин-набор от Qiagen. Фосфолипазную активность определяли, используя набор NEFA и лецитин в качестве субстрата (фиг.43).
Пример 3. Экспрессия трансфераз Aeromonas в Bacillus subtilis 163
Конструирование плазмиды
Два различных вектора экспрессии Bacillus subtilis (pUB110 & pBE5) использовали для гетерологической экспрессии генов Aeromonas в Bacillus subtilis. Вектор pUB110 содержит промотор альфаамилазы, тогда как вектор рВЕ содержит промотор P32 как регуляторную область для экспрессии гибридных генов Aeromonas. В векторе pUB110 первая аминокислота зрелых генов GCAT Bacillus subtilis была слита в рамке с последней аминокислотой сигнальной пептидной последовательности ксиланазы от Bacillus subtilis путем рестрикции сайта Nhe 1, что создает 2 дополнительные аминокислоты впереди зрелых протеинов. Вектор pBE5 содержит слияние сигнальной последовательности cg-тазы на сайте Nco1 для выделения рекомбинантных протеинов в культуральный фильтрат.
Реакции ПЦР проводили для того, чтобы получить гены Aeromonas, слитые в рамке с сигнальными последовательностями векторов pUB 110 и pBE5. Реакции ПЦР осуществляли, используя следующие пары праймеров для гена A.hydrophila:
Реакция ПЦР 1: usAHncol (5’ATGCCATGGCCGACAGCCGTCCCGCC3′, SEQ. ID No. 46) и 1sAH (5’TTGGATCCGAATTCATCAATGGTGATC3′, SEQ. ID No. 47).
Реакция ПЦР 2: US-AhnheI (5’TTGCTAGCGCCGACAGCCGTCCCGCC3′, SEQ ID No. 48) и 1sAH (5’TTGGATCCGAATTCATCAATGGTGATG3, SEQ ID No. 49).
Реакции ПЦР осуществляли, используя следующие пары праймеров для гена A. salmonicida:
Реакция ПЦР 3: US-Asncol (5’TTGCCATGGCCGACACTCGCCCCGCC3′, SEQ ID No. 50) и 1sAH (5’TTGGATCCGAATTCATCAATGGTCATG3′, SEQ ID No. 51).
Реакция ПЦР 4: US-ASnhe1 (5’TTGCTAGCGCCGACACTCGCCCCGCC3′, SEQ ID No. 52) и 1sAH (5’TTGGATCCGAATTCATCAATGGTGATG#’, SEQ ID No. 53).
Все продукты ПЦР клонировали в реакции ПЦР II “затупления концов” (вектор TOPO) и секвенировали обратным и прямым секвенирующими праймерами.
Клоны реакций ПЦР 1 и 3 обрезали с помощью Nco1 и Bam HI и использовали в качестве вставок для лигации в вектор рВЕ5, обрезанный с помощью Nco1/Bam HI/фосфатазы. Клоны реакций ПЦР 2 и 4 обрезали с помощью Nco1 и Bam HI и использовали в качестве вставок для лигации в вектор рUB, обрезанный с помощью Nco1/Bam HI/фосфатазы.
Экспрессия генов трансферазы Aeromonas в Bacillus subtilis и характеристика ферментной активности
Ацилтрансферазы из двух видов Aeromonas были успешно экспрессированы в E. coli (результаты приведены выше). Конструкты слияния генов Bacillus pUB110 & pBE5 были использованы для трансформации Bacillus subtilis, и трансформанты были подвергнуты селекции посевом на чашки с канамицином. Выделенные и выращенные в 2×YT устойчивые к канамицину трансформанты были способны к гетерологической экспрессии генов Aeromonas в Bacillus. Культуральные фильтраты имели дигалактолизилдиацилглицерин (DGDG) галактолипазную активность в дополнение к ацилтрансферазной и фосфолипазной активностям. Активность по отношению к дигалактолизилдиацилглицерину (DGDG) измеряли после 60 минут инкубации культурального супернатанта с субстратом, DGDG из пшеничной муки (получаемым от Sigma) так же, как и активность по отношению к лецитину, что показано на фиг.44. Bacillus продуцирует фермент в виде секретированного протеина после культивации в культуральной среде от оставления на ночь (20-24 часа) до 48 часов. В некоторых случаях было показано, что экспрессия генов Aeromonas мешает жизнеспособности клеток и росту в Bacillus & E. coli, поэтому необходимо тщательно выбирать штаммы экспрессии и оптимизировать условия культивирования, чтобы гарантировать экспрессию. Например, некоторые штаммы-хозяева Bacillus (B.s 163, DB104 и OS 21) трансформировали векторами экспрессии для сравнения условий культивирования. B.s 163 оказался трансформируемым 2 генами Aeromonas и был способен экспрессировать активный протеин. DB104 оказался способен к трансформации всеми конструктами, но способным экспрессировать только трансферазу A.salmonicida.
Пример 4: Ферментация и очистка липид-ацилтрансферазы Aeromonas, продуцированной в E. coli
Ферментации E. coli
Микроорганизмы
В этом исследовании использовали два штамма Eschericia coli, один, содержащий липид-ацилтрансферазу Aeromonas hydrophila (пример 2), и два, содержавшие липид-ацилтрансферазы Aeromonas salmonicida (пример 1).
Штамм E. coli, содержащий ген A. hydrophila, был назван DIDK0124, и штамм E. coli, содержащий A. salmonicida, был назван DIDK0125. Ферментация DIDK0124 была названа HYDRO0303, и ферментация DIDK0125 была названа SAL0302. Очищенный протеин от HYDRO025 был назван REF#138, и очищенный протеин от HYDRO0303 был назван REF#135.
Культуральная среда и условия культивирования
Агар LB
Чашки с LB-агаром, использованные для поддержания штаммов, содержали 10 г/л триптона, 5 г/л экстракта дрожжей, 5 г/л NaCl, 15 г/л агара, 100 мг/л ампициллина и 35 мг/л хлорамфеникола. Чашки с агаром инкубировали при 30°С.
Встряхиваемая колба с LB
Среда LB (50 мл на встряхиваемую колбу), использованная для продуцирования высевного материала для культиваций в биореакторе, содержала 10 г/л триптона, 5 г/л экстракта дрожжей, 5 г/л NaCl, 100 мг/л ампициллина и 35 мг/л хлорамфеникола. Встряхиваемые колбы засеивали из чашек с агаром LB и инкубировали при 30°С и 200 об/мин.
Культивация в биореакторе
Культивации в биореакторе проводили в 6 л самодельных биореакторах, заполненных 4 л среды, содержащей 10 г/л триптона, 5 г/л экстракта дрожжей, 5 г/л NaCl, 8 г/л KH2PO4, 0,9 г/л MgSO4·7H2O, 40 г/л моногидрата глюкозы, 0,4 мл/л ADD APT® Foamstop Sin 260 (ADD APT Chemicals AG, Helmond, The Netherlands), 10 мг/л (NH4)2Fe(SO4)2·6H2O, 0,7 мг/л CuSO4·5H2O, 3 мг/л ZnSO4·7H2O, 3 мг/л MnSO4·H2O, 10 мг/л EDTA, 0,1 мг/л NiSO4·6H2O, 0,1 мг/л CoCl2, 0,1 мг/л H3BO4, 0,1 мг/л KI, 0,1 мг/л Na2MoO4·2H2O, 1 г/л ампициллина и 35 мг/л хлорамфеникола.
Биореакторы осеменяли количеством LB-культуры, гарантирующим окончание выращивания после приблизительно 20 часов культивирования (рассчитанным из максимальной удельной скорости роста 0,6 ч-1, ОD600 в встряхиваемой колбе с LB и конечной OD600 в биореакторе приблизительно 20).
SAL0302 инокулировали 10 мл LB-культуры и HYDRO0303 инокулировали 4 мл LB-культуры.
Биореакторы работали при следующих условиях: температура 30°С, перемешивание 800-1000 об/мин (в зависимости от опыта), аэрация 5 л/мин, рН 6,9, регулирование рН 8,75% (мас./об.) NH3-вода и 2 М H2SO4. Индуцирование достигалось добавлением изопропил- -D-тиогалактозида до конечной концентрации 0,6 мМ, когда, соответственно, продуцировалось 0,4 моля (HYDRO0303) и 0,7 молей СО2. -D-тиогалактозида до конечной концентрации 0,6 мМ, когда, соответственно, продуцировалось 0,4 моля (HYDRO0303) и 0,7 молей СО2.
Сбор клеток с культуры
Для сбора клеток и гомогенизации биомассы использовали следующую процедуру:
1) Ферментационный бульон после ферментаций центрифугировали при 5000 g и 4°С в течение 10 минут и супернатант выгружали. Биомассу хранили при -20°С до использования. Биомассу размораживали и повторно суспендировали в 500 мл 20 мМ NaH2PO4, pH 7,4, 500 мМ NaCl, 10 мМ имидазола и ингибиторе протеазы (не содержащем EDTA) Complete (Roche, Germany).
2) Суспендированную биомассу гомогенизировали при 2 кбар и 4°С в разрушителе клеток от Constant Systems Ltd (Warwick, UK).
3) Остатки клеток удаляли центрифугированием при 10000 g и 4°С в течение 30 минут с последующим сбором супернатанта.
4) Супернатант осветляли центрифугированием при 13700 g и 4°С в течение 60 минут с последующим сбором супернатанта.
5) Супернатант фильтровали через фильтры 0,2 мкм Vacu Cap (Pall Life Sciences, UK) и фильтрат собирали для немедленной хроматографической очистки.
Хроматографическая очистка трансфераз
Колонка (2,5×10 см) была заполнена 50 мл геля Chelating Sepharose ff. и загружена сульфатом Ni (согласно методике, описанной производителем, Amersham Biosciences). Колонку доводили до равновесия 200 мл 20 мМ Na2HPO4, pH 7,4, 500 мМ NaCl, 10 мМ имидазола. 400 мл сырого продукта наносили на колонку со скоростью потока 5 мл/мин. Затем колонку промывали 20 мМ Na2HPO4, pH 7,4, 500 мМ NaCl, 10 мМ имидазола до тех пор, пока UV280 не достигало базовой линии. Затем GCAT элюировали 40 мл 20 мМ Na2HPO4, pH 7,4, 500 мМ NaCl и 500 мМ имидазола.
Пример 5: Ферментация и очистка липид-ацилтрансфераз Aeromonas, продуцированных в Bacillus subtilis
Ферментации
ВАС0318-19, ВАС0323-24
Микроорганизм
Микроорганизмы, использованные в этом исследовании, получают путем трансформации штамма-реципиента Bacillus subtilis #163 плазмидой, содержащей ген, кодирующий трансферазу Aeromonas salmonicida, встроенный в вектор pUB110OIS. Экспрессию гена контролировали промотором альфа-амилазы и секрецию трансферазы медиировали сигнальной последовательностью ксиланазы B. subtilis (пример 3). Штаммы были названы DIDK0138 (ферментация BAC0318-19) и DIDK0153 (ферментация BAC0323-24).
Культуральная среда и условия культивирования
Среда для предкультуры
Встряхиваемую колбу (общий объем 500 мл, с разделительными перегородками) заполняли 100 мл среды, содержавшей:
| NaCl |
5 г/л |
| K2HPO4 |
10 г/л |
| Соевая мука |
20 г/л |
| Экстракт дрожжей, BioSpringer 106 |
20 г/л |
| Антивспениватель SIN260 |
5 мл/л |
Величину рН доводили до 7,0 перед обработкой в автоклаве.
После обработки в автоклаве добавляли 6 мл 50% (мас.) Nutriose на колбу. Добавляли канамицин при концентрации 50 мг/л после обработки в автоклаве.
Инокуляция
Встряхиваемую колбу для предкультуры инокулировали замороженной культурой непосредственно из 25% (мас./об.) глицеринового исходного раствора. Встряхиваемую колбу инкубировали при 33°С и 175 об/мин в течение примерно 16 часов, после чего 50 мл использовали для инокуляции ферментера.
Ферментации
Ферментации проводили в 6 л самодельных ферментерах. Разовая загрузка среды (3 л) содержала:
| Кукурузный экстракт (50% dw) |
40 г/л |
| Экстракт дрожжей, BioSpringer 153 (50% dw) |
10 г/л |
| NaCl |
5 г/л |
| CaCl2·2H2O |
0,25 г/л |
| Mn(NO3)2·H2O |
0,2 г/л |
| Антивспениватель SIN260 |
1 мл/л |
| Канамицин (стерилизован фильтрацией в ферментер после автоклавирования) |
50 мг/л |
Сырье содержало:
| Моногидрат глюкозы |
540 г/кг |
| MnSO4·7H2O |
4,8 г/кг |
| Антивспениватель SIN260 |
4 мл/кг |
| Экстракт дрожжей, BioSpringer 153 (50% dw) (автоклавирован отдельно) |
150 г/кг |
Подачу питания при ферментации ВАС0318 и ВАС0323 начинали, основываясь на накоплении СО2 согласно приведенным ниже уравнениям:
Питание-поток [г/час] = 0, Ак.СО2 < 0,15
Питание-поток [г/час] = 2,85+t×1,54, Ак.СО2  0,15 и t < 12 0,15 и t < 12
Питание-поток [г/час] = 21,3, t > 12
t – время (часы) с того момента, когда накопление СО2 (Ак.СО2) достигло 0,15 молей
Подачу питания при ферментации ВАС0319 и ВАС0324 начинали, основываясь на накоплении СО2 согласно приведенным ниже уравнениям:
Питание-поток [г/час] = 0, Ак.СО2 < 0,15
Питание-поток [г/час] = 2,0+t×1,08, Ак.СО2  0,15 и t < 12 0,15 и t < 12
Питание-поток [г/час] = 15, t > 12
t – время (часы) с того момента, когда накопление СО2 (Ак.СО2) достигло 0,15 молей
Величину рН поддерживали при 7,0 добавлением 12,5% (мас./об.) NH3-вода или 2 М фосфорной кислоты.
Аэрация составляла 3 л/мин, соответствуя 1 vvm.
Температура была 33°С.
Ферментер был оборудован двумя 8 см  крыльчатками Раштона, размещенными на расстоянии 10 см. крыльчатками Раштона, размещенными на расстоянии 10 см.
Сбор клеток с культуры
Биомассу удаляли центрифугированием при 16000 g в течение 10 минут при комнатной температуре. Супернатант стерилизовали фильтрацией и фильтрат использовали для очистки и опытов по применению.
Пример 6: Тесты по применению для яичного желтка
В следующих опытах выделенную трансферазу из Aeromonas salmonicida, экспрессированной в E. coli, испытывали на одном яичном желтке и на яичном желтке, куда был добавлен растительный стерол.
Материал
Трансфераза из Aeromonas salmonicida REF#138
Яичный желток из свежих яиц (куриные яйца)
Растительный стерол:  -ситостерол, Sigma S 5753 -ситостерол, Sigma S 5753
Пластины ТСХ: пластины из диоксида кремния, Merck  1.05715.0001 1.05715.0001
Анализ ТСХ
Пластины ТСХ активировали в нагретом шкафу (110°С) в течение 1/2 часа.
100 мл проявляющего растворителя выливали в хроматографическую камеру с крышкой. Стенки камеры были покрыты фильтровальной бумагой (Whatman 2) для того, чтобы насытить камеру парами растворителя.
Пластины ТСХ помещали в рамку и пробу наносили на 2 см пластину ТСХ со дна. Затем пластину ТСХ помещали в камеру ТСХ с проявляющим растворителем. Когда проявляющий растворитель достигал отметки 14 см от дна пластины, пластину вынимали и сушили в вытяжном шкафу и затем помещали в сушильный шкаф при 110°С на 10 минут.
Затем пластину ТСХ погружали в проявляющий реагент и сушили в сушильном шкафу при 110°С в течение 15 минут.
Проявляющий растворитель
 IV: хлороформ:метанол:Н2О (65:25:4) IV: хлороформ:метанол:Н2О (65:25:4)
 I: Ph-эфир:МТБЭ:уксусная кислота (60:40:1) I: Ph-эфир:МТБЭ:уксусная кислота (60:40:1)
Проявляющий буфер (ванадатный буфер)
32 г Na2CO3 и 300 мл Н2О (1 М)
Добавляли 18,2 г пентоксида ванадия (V2O5) и растворяли при мягком нагреве.
Раствор охлаждали до комнатной температуры.
Осторожно добавляли 460 мл 2,5М H2SO4 (460 мл Н2О + 61 мл H2SO4).
Добавляли воду до 1000 мл.
Фосфолипазная активность
Субстрат
0,6% 95% растительного L- -фосфатидилхолина (Avanti # 441601) + 0,4% Triton-X 100 (Sigma X-100) + 5 мМ CaCl2 растворяли в 0,05 М буфере HEPES pH 7,0. -фосфатидилхолина (Avanti # 441601) + 0,4% Triton-X 100 (Sigma X-100) + 5 мМ CaCl2 растворяли в 0,05 М буфере HEPES pH 7,0.
Процедура
400 мкл субстрата добавляли в пробирку Эппендорфа и помещали в термомиксер Эппендорфа при 30°С на 5 минут.
В момент Т=0 добавляли 50 мкл раствора фермента. Анализировали также контроль с водой вместо фермента.
Пробу смешивали при 1000 об/мин в термомиксере Эппендорфа при 30°С в течение 10 минут. В момент Т=10 мин пробирку Эппендорфа помещали в другой термомиксер при 99°С на 10 минут для того, чтобы остановить реакцию.
Свободную жирную кислоту в пробе анализировали, используя набор NEFA от Wako Gmbh.
Ферментную активность PLU-7 рассчитывали как количество микромолей жирной кислоты, продуцированное в минуту при условиях анализа.
Экстракция липида
1 г яичного желтка и 7,5 мл смеси хлороформ:метанол 2:1 смешивали в смесителе Whirley и центрифугировали при 7,5 g в течение 10 минут.
Выделяли 3 мл хлороформовой фазы и использовали для последующего анализа липида.
Результаты
Трансферазу (REF#138) из Aeromonas salmonicida, экспрессированную в E. coli, анализировали на фосфолипазную активность, как описано выше, и анализировали также в яичном желтке с  -ситостеролом и без него. Пробу перемешивали магнитной мешалкой во время реакции. Картина эксперимента показана в таблице 1. -ситостеролом и без него. Пробу перемешивали магнитной мешалкой во время реакции. Картина эксперимента показана в таблице 1.
Реакцию останавливали, добавляя 7,5 мл смеси хлороформ:метанол (2:1), и перемешивали в смесителе Whirley в течение 30 секунд. Хлороформовую фазу выделяли центрифугированием и 2 мкл хлороформовой фазы переносили на предварительно активированную кремнеземную пластину ТСХ и элюировали проявляющим растворителем  I, а другую пластину ТСХ – проявляющим растворителем I, а другую пластину ТСХ – проявляющим растворителем  IV. IV.
Результаты анализа ТСХ показаны на фиг.45 и 46.
Реакция трансферазы для трансферазы из Aeromonas salmonicida в яичном желтке, куда был добавлен растительный стерол, показала, что фермент переносит жирную кислоту от лецитина в яичном желтке к холестерину во время образования эфира холестерина. Хроматограмма ТСХ также показывает, что часть добавленного к яичному желтку стерола была переведена в эфир холестерина.
Количество эфира стерола относительно количества эфира холестерина, образовавшегося во время реакции, может быть проанализировано ЖХВР или ГЖХ.
Известно, что эфиры растительных стеролов уменьшают поглощение холестерина в кишечнике. Когда к яичному желтку добавляют трансферазу и растительный стерол, получают продукт, вызывающий уменьшенное поглощение холестерина, и в то же время получают лизолецитин, который улучшает эмульгационные свойства яичного желтка. Дополнительным преимуществом добавления трансферазы и растительного стерола к яичному желтку является то, что эфир растительного стерола поглощается вместе с естественно доступным холестерином, что, как ожидается, должно оказать более сильный эффект в снижении абсорбции холестерина.
Пример 7: Модификация яичного желтка липид-ацилтрансферазой из Aeromonas salmonicida
В соответствии с настоящим изобретением теперь было показано, что возможно получить лизолецитин из яичного желтка без существенного образования свободной жирной кислоты при применении трансферазы.
Лецитин, содержащийся в яичном желтке, является важным эмульгатором при приготовлении майонеза с тем ограничением, что майонез не является стабильным при нагревании. Поэтому в течение нескольких лет было известно применение фосфолипазы из поджелудочной железы для модификации лецитина яичного желтка в лизолецитин, который является более эффективным эмульгатором. Применение ферментативно модифицированного яичного желтка при приготовлении майонеза приводит к лучшей термической стабильности майонеза во время пастеризации. Ограничением применения поджелудочной фосфолипазы для яичного желтка является то, что количество свободной жирной кислоты также увеличивается, что приводит к пониженной окислительной стабильности, так как свободные жирные кислоты являются более подверженными окислению, чем соответствующие эфиры. Свободная жирная кислота может также вызывать мыльный привкус.
Трансфераза из Aeromonas salmonicida была успешно экспрессирована в B. subtilis и ферментирована в лабораторном масштабе, как описано в примере 5, очищена жидкостной хроматографией и использована для модификации липидов яичного желтка. Ферментативно модифицированный яичный желток был использован для приготовления термически стабильного майонеза.
Трансфераза из A. salmonicida может быть использована для получения лизолецитина и эфира холестерина в яичном желтке без образования значительных количеств свободных жирных кислот, иначе говоря, без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте.
Ферментативно модифицированный яичный желток, полученный с трансферазой, показал улучшенные эмульгационные свойства и может быть применен для термически стабильного майонеза.
Этот фермент является высоко функциональным при модификации яичного желтка, катализируя реакцию переноса липида между лецитином и холестерином (фиг.47).
В этом исследовании дополнительно изучали применение трансферазы для модификации яичного желтка и применение модифицированного яичного желтка при приготовлении термически стабильного майонеза.
Этот пример описывает ферментацию, выделение и ввод трансферазы в яичные желтки, а также ввод ферментативно модифицированного яичного желтка в майонез. Пример подразделяется на две части:
А. Ввод трансферазы в яичный желток
В. Испытание ферментативно модифицированного яичного желтка в майонезе
Экспериментальная часть
А. Ввод
Фермент и субстрат
Трансфераза # 178-9 из A. salmonicida, очистка 2554-100 С73, 15 PLU-7/мл.
Трансфераза # 179 из A. salmonicida, 18,5 PLU-7/мл.
Фосфолипаза А1 LECITASE Ultra (Novozymes A/S, Denmark). Ultra (Novozymes A/S, Denmark).
Яичный желток: жидкий яичный желток с 8% соли, SANOVA FOODS, DK.
Анализ ТСХ проводили, как описано ранее (см. выше пример 6).
Фосфолипазная активность: см. предыдущие примеры.
Экстракция липидов
1 г яичного желтка и 7,5 мл смеси хлороформ:метанол 2:1 смешивали в смесителе Whirley и центрифугировали при 7,5 g в течение 10 минут.
4 мл хлороформовой фазы выделяли и использовали для последующего анализа липида.
Испытание окислительной стабильности
Окислительную стабильность майонеза определяли в установке ML OXYPRESS, где образец подвергали окислительному стрессу посредством нагревания под давлением в атмосфере кислорода.
Спустя некоторое время, называемое периодом индукции (ПИ), окисление образца вызывает определенное расходование кислорода, что регистрируется как изменение давления по датчику давления. Более длительный период индукции указывает на лучшую окислительную стабильность.
Процедура
5 г майонеза помещали в стеклянный сосуд и стеклянный сосуд закрывали датчиком давления. Сосуд заполняли кислородом под давлением 5 бар. Вентиль открывали, чтобы опорожнить сосуд. Данную процедуру повторяли дважды и образец с 5 бар атмосферы кислорода помещали в температуру 80°С. Измеряли давление кислорода как функцию времени и рассчитывали период индукции в часах.
Результаты
Образцы очищенной трансферазы от Aeromonas salmonicide # 179 и 178-9 использовали для обработки яичного желтка, как представлено в таблице 2. Начальное испытание показало, что трансфераза GCAT должна быть введена с намного более низкой фосфолипазной (PLU) активностью, чем у продажной фосфолипазы. Это объясняется тем фактом, что GCAT является трансферазой и потому имеет намного более низкую гидролитическую активность, чем обычная фосфолипаза.
| Таблица 2 |
 |
Яичный желток Sanofo, 8% соли |
2344-44 С89 18,5 PLU-7/мл |
Трансфераза #178-9 |
#3108 Lecitase Ultra |
Вода |
 |
 |
Яичный желток |
Трансфераза #179 |
18,5PLU-7/мл |
1500 PLU-7/мл |
 |
 |
 |
г |
г |
г |
мл |
г |
PLU-7/мл |
| 6 |
120 |
2,00 |
 |
 |
8,00 |
0,31 |
| 7 |
120 |
 |
10 |
 |
0 |
1,25 |
| 8 |
120 |
 |
 |
1,86 |
8,14 |
23,25 |
| 9 |
120 |
 |
 |
 |
10 |
0 |
Ферментативные реакции проводили отвешиванием яичного желтка и фермента в мензурку. Образцы помещали в нагревательную камеру при 37°С во время медленного перемешивания. После 1, 2 и 4 часов времени реакции пробы отбирали для анализа ТСХ. После 4 часов времени реакции продукт хранили при 5°С и использовали для опытов с майонезом.
Анализ ТСХ липидов, экстрагированных из обработанного ферментом яичного желтка, показан на фиг.48.
Анализ ТСХ на фиг.48 показывает явное гидролитическое действие фосфолипазы #3108 на триглицерид во время образования свободных жирных кислот, а также некоторое количество моно- и диглицерида. Как кажется, фосфолипаза #3108 не оказывает влияния на холестерин. Оба образца трансферазы явно участвуют в образовании эфира холестерина одновременно со снижением содержания холестерина.
D. Ферментативно модифицированный яичный желток в майонезе
Для того чтобы исследовать эффект модификации образцов яичного желтка, упомянутых в таблице 2, были проведены испытания по их применению в майонезе с содержанием жира 50%. Был приготовлен также майонез, содержащий необработанный яичный желток.
Целью исследования было определить влияние ферментативно модифицированных яичных желтков на эмульсионные свойства и влияние на термическую стабильность. Все образцы майонеза содержали одинаковое количество масла и эмульгировались только яичным желтком. Все образцы майонеза готовили с применением миксера Koruna (Disho V60/10) и нагревались во время приготовления до 95°С в течение 5 минут.
Образцы майонеза (фиг.49), приготовленные с обработанным ферментом яичным желтком, были удачными и гомогенными без отделения масла. Контрольный образец разделялся на масляную и водную фазу.
Размер частиц капелек масла в образцах майонеза с обработанным ферментом яичным желтком измеряли на Malvern Mastersizer. Образец смешивали с 0,1% SDS в 0,1 М фосфатном буфере, рН 7, перед измерением. Показанием являлся средний размер частиц всех частиц, как показано в таблице 3.
| Таблица 3 |
| Опыт |
Фермент |
Средний размер частиц, мкм |
| 6 |
Трансфераза #179, 0,31 PLU-7/г |
12,9 |
| 7 |
Трансфераза #178-9, 1,25 PLU-7/г |
7,2 |
| 8 |
#3108, Lecitase Ultra, 23 PLU-7/г |
5,2 |
Результаты измерения размеров частиц ясно показывают эффект повышения дозировки трансферазы от A. salmonicida. При высокой дозе трансферазы размер частиц близок к майонезу, приготовленному с Lecitase Ultra. Надо, однако, учитывать, что Lecitase Ultra продуцирует много жирных кислот, что может привести к более тонкому распределению частиц.
Размер капелек масла в майонезе, приготовленном с ферментом, значительно мельче, чем размер капелек масла майонеза, приготовленного без фермента (т.е. контрольного майонеза).
Окислительная стабильность
Окислительную стабильность образцов майонеза 7 и 8 определяли на ML OXYPRESS с результатами, приведенными в таблице 4.
| Таблица 4 |
| Образец |
Индукционный период |
Индукционный период |
 |
Определение 1, часы |
Определение 2, часы |
| 7 |
37,44 |
38,08 |
| 8 |
35,68 |
35,52 |
Измерение окислительной стабильности дало явную значительную разницу окислительной стабильности. Майонез с яичным желтком, обработанным трансферазой 178-9, имеет значительно лучшую окислительную стабильность, чем майонез с яичным желтком, обработанным Lecitase Ultra. Это может быть объяснено тем фактом, что Lecitase Ultra продуцирует больше свободных жирных кислот, которые более подвержены окислению, чем соответствующие эфиры жирных кислот.
Образцы яичных желтков, использованных для приготовления майонеза, экстрагировали хлороформом, и липиды из яичных желтков анализировали методом ГЖХ с результатами, показанными в таблице 5.
| Таблица 5 |
| Опыт |
Фермент |
Жирная кислота |
Холестерин |
Эфир холестерина |
Триглицерид |
| 6 |
Трансфераза #179 |
0,96 |
0,94 |
0,49 |
23,95 |
| 7 |
Трансфераза #178-9 |
1,84 |
0,60 |
1,06 |
24,54 |
| 8 |
#3108, Lecitase Ultra |
14,05 |
1,16 |
0,12 |
2,45 |
| 9 |
Контроль |
0,48 |
1,16 |
0,13 |
22,87 |
Результаты ГЖХ в таблице 5 подтверждают результаты анализа ТСХ, что Lecitase Ultra продуцирует очень большое количество свободных жирных кислот, и большая часть триглицерида гидролизуется. С другой стороны, трансфераза продуцирует лишь умеренное количество свободных жирных кислот, и триглицериды не гидролизуются. Это также ясно показывает, что трансфераза продуцирует эфир холестерина из холестерина.
Результаты показывают, что количество РС в “обработанном ферментом” майонезе понижено по сравнению с контрольным майонезом, тогда как количество LPC повышено в обработанном ферментом майонезе по сравнению с контрольным майонезом. Увеличение LPC может хорошо объяснить улучшенные эмульгационные свойства обработанного ферментом майонеза по сравнению с контрольным майонезом возможно благодаря тому, что холестерин был использован как молекула-акцептор в трансферазной реакции, приводящей в результате к увеличению количества эфиров холестерина в обработанном ферментом майонезе по сравнению с контрольным майонезом. Вдобавок, результаты показывают, что количество свободных жирных кислот не увеличивается значительно, когда яичный желток обрабатывают трансферазой. Результаты далее показывают, что количество свободных жирных кислот, образовавшихся в пищевом продукте, обработанном липид-ацилтрансферазой, значительно ниже, чем в пищевом продукте, обработанном контрольной фосфолипазой, и это справедливо, даже когда количество лизолецитина, образовавшегося в пищевых продуктах, одинаково.
Пример 8: Действие трансферазы Aeromonas salmonicida в кексах
Действие ацилтрансферазы GCAT из Aeromonas salmonicida испытывали на рецепте кекса. Фермент испытывали индивидуально и в сочетании с другими липолитическими ферментами. Ферменты добавляли к некоторым из ингредиентов кекса или добавляли вместе с другими ингредиентами перед замешиванием кекса.
Предварительные результаты показали, что ацилтрансфераза, соединенная с гидролизующим триглицерид ферментом, улучшает объем кекса и структуру мякиша по сравнению с контролем.
В последующих экспериментах испытывали трансферазу из A. salmonicida и варианты поодиночке и в комбинации с гидролизующими триглицерид ферментами. Такие ферменты являются активными по отношению к липидным компонентам яйца и шортенинга, а также к углеводам, протеину, глицерину и холестерину (в яйце), которые образуют часть рецептуры кекса.
Материалы и метод
Фермент
Ацилтрансфераза #179 из Aeromonas salmonicida
Grindamyl EXEL 16, липаза из Thermomyces lanuginosus
Рецепт кекса
| Ингредиент |
% |
г |
| Сахар 35/20 |
20,37 |
204 |
| Мука для кондитерских изделий, Albatros |
18,11 |
181 |
| Пшеничный крахмал |
5,21 |
52 |
| Пекарский порошок |
0,36 |
4 |
| Пастеризованное жидкое целое яйцо |
22,63 |
226 |
| Шортенинг Vegao (Aarhus United) |
18,11 |
181 |
| Сухая молочная сыворотка |
0,68 |
7 |
| Глюкозный сироп, 75% 42 DE |
4,53 |
45 |
| Глицерин |
1,36 |
14 |
| Соль |
0,32 |
3 |
| Масло семян рапса |
6,34 |
63 |
| Сорбат калия |
0,18 |
1,8 |
Оборудование
Миксер: Hobart N50 со шпателем
Печь: хлебопечка Simon
Процедура
Все ингредиенты должны быть доведены до комнатной температуры.
1. Взбить сахар и шортенинг в течение 3 минут – начало на 2-й скорости и переход на 3-ю скорость в течение 30 секунд.
2. Добавить оставшиеся ингредиенты – начало на 1-й скорости и переход на 2-ю скорость в течение 30 секунд – смешивать суммарно 5 минут.
3. Отмерить объем болтушки в 1 дл чашку.
4. Фунтовые формы для кекса обмазать масляной пастой “Babette” и покрыть бумагой.
5. Отвесить 2×350 г в фунтовые формы для кекса.
6. Равномерно размазать массу шпателем.
7. Перед тем как поставить в печь, добавить струйку масла на верх кекса (по длине в середине для того, чтобы заставить кекс разломаться в середине).
8. Печь в течение 50 мин при 180°С.
8. После выпекания вынуть формы из печи и “уронить” их на стол перед тем, как вынуть кекс из форм.
10. Убрать бумагу с кексов и повернуть правильной стороной вверх.
11. Охладить кексы на решетке в течение 60 мин перед взвешиванием и измерением объема.
Примечания
Используемый фермент (используемые ферменты) добавляют в начале смешения или добавляют к некоторым из ингредиентов кекса перед их добавлением к другим ингредиентам кекса.
Ферменты являются активными только во время смешения или реакции компонентов кекса, и ферменты инактивируются во время выпекания кекса.
Результаты
Следующие эксперименты были проведены так, как показано в следующей таблице
Яйца, глюкозный сироп и фермент взаимодействовали в течение 30 минут при 37°С, и вскоре после этого яйца использовали для приготовления кекса согласно указанному выше рецепту.
Предварительные результаты показали, что комбинация ацилтрансферазы и гидролизующей триглицериды липазы из Thermomyces lanuginosus улучшает объем кекса, а также структура мякиша, пищевые качества и внешний вид улучшаются по сравнению с водным контролем. Предварительные результаты показывают, что для кекса может быть предпочтительно использовать комбинацию липид-ацилтрансферазы и липазы.
Пример 9: Целью этих опытов являлось испытание трансферазы из A. hydrophila, экспрессированной в E. coli
Трансферазную реакцию A. hydrophila #135 (0,5 NEFA-PLU/мл) испытывали на яичном желтке. Параметры эксперимента представлены в таблице 6.
| Таблица 6 |
 |
Время реакции |
Яичный желток |
Концентрация #135 |
 |
минуты |
г |
единицы PLU-NEFA |
| 1 |
30 |
1 |
0,000 |
| 2 |
30 |
2 |
0,100 |
| 3 |
60 |
2 |
0,100 |
| 4 |
150 |
2 |
0,100 |
| 5 |
240 |
2 |
0,100 |
| 6 |
1560 |
2 |
0,100 |
| 7 |
1560 |
1 |
0,000 |
Яичный желток нагревали до 37°С и добавляли фермент. По истечении времени реакции добавляли 7 мл смеси CHCl3:метанол 2:1 и перемешивали в миксере Whirley в течение 30 сек.
Образец центрифугировали при 800 g в течение 10 минут и отделяли нижнюю фазу растворителя. 2 мкл этой пробы наносили на кремнеземную пластину ТСХ и элюировали элюирующим растворителем IV. Результаты анализа ТСХ показаны на фиг.50 и 51.
Методики и материалы, упомянутые в этом примере, являются теми, которые подробно описаны в приведенных выше примерах.
Пробы от этого эксперимента анализировали также методом ГЖХ в виде TMS-производных. Результаты анализа ГЖХ показаны в таблице 7.
Таблица 7
ГЖХ анализ липидов из яичного желтка |
 |
Время реакции |
Концентрация трансферазы #135 |
 |
 |
 |
 |
 |
единиц/г яичного желтка |
Свободная жирная кислота |
Холестерин |
Эфир холестерина |
 |
мин |
 |
% |
% |
% |
| 7 |
контроль |
0 |
0,25 |
2,88 |
0,34 |
| 3 |
60 |
0,025 |
0,25 |
2,68 |
0,56 |
| 4 |
150 |
0,025 |
0,29 |
1,85 |
1,72 |
| 5 |
240 |
0,025 |
0,53 |
1,42 |
3,54 |
| 6 |
1560 |
0,025 |
0,95 |
0,3 |
4,43 |
Из ГЖХ анализа свободной жирной кислоты, холестерина и эфира холестерина можно рассчитать молярную концентрацию каждого компонента и рассчитать % трансферазной активности, который показан в таблице 7.
Расчет % трансферазной активности
Из результатов увеличения содержания свободной жирной кислоты, эфира стерола рассчитывают:
 % жирной кислоты = % жирной кислоты (фермент) – % жирной кислоты (контроль), % жирной кислоты = % жирной кислоты (фермент) – % жирной кислоты (контроль),
 % эфира стерола = % эфира стерола (фермент) – % эфира стерола (контроль). % эфира стерола = % эфира стерола (фермент) – % эфира стерола (контроль).
Трансферазную активность рассчитывают как % от общей ферментативной активности:
% трансферазной активности =
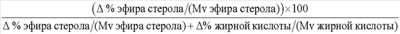
где:
Mv эфира стерола = средний молекулярный вес эфиров стерола;
Mv жирной кислоты = средний молекулярный вес жирных кислот.
Таблица 8
Трансферазная активность A. hydrophila #135 в яичном желтке |
 |
Время реакции |
Концентрация трансферазы #135 |
 |
 |
 |
 |
| единиц/г яичного желтка |
Свободная жирная кислота |
Холестерин |
Эфир холестерина |
Транс феразная активность |
 |
мин |
мМ |
мМ |
мМ |
% |
| 7 |
контроль |
0 |
8,9 |
74,5 |
5,3 |
– |
| 3 |
60 |
0,05 |
8,9 |
69,3 |
8,7 |
100 |
| 4 |
150 |
0,05 |
10,4 |
47,8 |
26,5 |
93 |
| 5 |
240 |
0/05 |
18,9 |
36,7 |
54,6 |
77 |
| 6 |
1560 |
0,05 |
33,9 |
7,8 |
68,4 |
48 |
И анализ ТСХ, и анализ ГЖХ подтверждают, что первоначально трансферазная реакция A. hydrophila #135 является доминирующей реакцией. Спустя 150 минут времени реакции появляется некоторая гидролитическая активность. Спустя 1560 минут трансферазная реакция и гидролитическая реакция почти достигают одинакового уровня. Результаты также показывают, что до тех пор, пока молекула-акцептор холестерин является доступной, трансферазная реакция является доминирующей реакцией. Когда концентрация холестерина понижается, гидролитическая активность становится более доминирующей.
Пример 10: Анализ для измерения трансферазной активности с использованием яичного желтка в качестве субстрата (называемый здесь далее “проба яичного желтка”)
Липид-ацилтрансферазу выделяли из Aeromonas salmonicida и экспрессировали в Bacillus subtilis. Целью этого исследования является разработка аналитического метода, с помощью которого можно было бы измерить и трансферазную, и гидролитическую активность ферментов, и из таких анализов было бы возможно определить и трансферазную, и гидролитическую активность ферментов, используя субстрат, который содержит лецитин и холестерин.
В этой работе в качестве субстрата для анализа фермента использовали яичный желток, поскольку яичный желток содержит и лецитин, и холестерин, и известно, что трансферазы и фосфолипазы очень хорошо работают в этом субстрате.
Препятствием для использования яичного желтка является то, что этот субстрат является сложной смесью воды, липидов и протеинов. Липидные компоненты включают глицериды 66,2%, фосфолипиды 29,6% и холестерин 4,2%. Фосфолипиды состоят из 73% лецитина, 15% цефалина и 12% других фосфолипидов. Из жирных кислот 33% являются насыщенными и 67% являются ненасыщенными, включая 42% олеиновой кислоты и 7% линолевой кислоты (см. Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc.).
Можно ожидать некоторых вариаций в составе яичного желтка. Однако в литературе (Biochimica et Biophysica Acta, 1124 (1992) 205-222) упоминается, что: “зрелый яичный желток домашних кур обладает замечательно постоянным составом липидов и липопротеинов несмотря на многочисленные вариации в условиях кормления и окружающей среды”, и далее указывается: “В результате яичный желток является пищевым продуктом почти постоянного состава, который служит поддержанию его химических и физико-химических свойств для надежного применения в хлебопекарной, косметической и фармацевтической промышленности”.
Эта ссылка указывает, что состав яичного желтка очень постоянен, и поэтому было решено использовать желток куриного яйца в качестве субстрата для пробы яичного желтка.
Количественное определение продуктов реакции липидов от ферментативной обработки яичного желтка проводили путем экстракции липидов из субстрата с последующим анализом ГЖХ липидных компонентов.
Процедура
Материалы
Яичный желток: пастеризованный жидкий яичный желток от Danæg Products A/S, DK-4000 Roskilde.
Буфер HEPES Sigma, кат. номер Н 3375.
Хлороформ, чда.
Ферменты
Очищенная липид-ацилтрансфераза из A. salmonicida #178-9
Липаза Thermomyces languginosus. Grindamyl EXEL 16, там же, номер 147060 (контроль)
Анализ фермента с субстратом яичного желтка
5 г жидкого яичного желтка отвешивали в 20 мл стакан Витона и нагревали до 35°С. Добавляли 0,25 мл раствора фермента и запускали секундомер.
Через регулярные промежутки времени пробы по 0,5 г переносили в 10 мл стакан Драма. Добавляли 20 мкл 4 М HCl, чтобы остановить ферментативную реакцию и подкислить мыло жирной кислоты.
Добавляли 3 мл хлороформа и пробу перемешивали в миксере Whirley в течение 30 сек.
Пробу центрифугировали при 3000g в течение 10 мин и 0,8 мл хлороформовой фазы переносили в тарированный стакан Драма. Хлороформ выпаривали при 60°С под парами азота. Стакан Драма вновь взвешивали.
Выделенные липиды анализировали методами ГЖХ и ТСХ.
Анализ ТСХ – как описано здесь.
Анализ ГЖХ – как описано здесь.
Результаты
Для пробы яичного желтка и использованием яичного желтка в качестве субстрата были проведены опыты, представленные в таблице 9.
0,5 г пробы отбирали спустя 15, 30, 60, 120 и 1080 минут и липиды выделяли экстракцией растворителем. Липиды анализировали методом ТСХ, используя соответственно растворители I и IV. Картина пластины ТСХ показана на фиг.52.
Анализ ТСХ ясно показывает активность трансферазы #178-9 из A. salmonicida (проба 3). Это можно видеть по уменьшению количества фосфолипидов РС и РЕ. Результаты также показывают, что количество лизолецитина LPC не так высоко, как ожидалось. Это может указывать на гидролитическую активность по отношению к лизолецитину или может быть также обусловлено недостаточной экстракцией, так как лизолецитин сильно полярен и поэтому может частично распределяться в водную фазу.
Липиды, выделенные экстракцией растворителем, анализировали также методом ГЖХ для того, чтобы определить количество свободной жирной кислоты, холестерина и эфира холестерина. Результаты ГЖХ показаны в таблице 10.
Таблица 10
Анализ ГЖХ липидов из обработанного ферментом яичного желтка.
Результаты даны в % в расчете на содержание липидов. |
 |
 |
 |
15 |
30 |
60 |
120 |
1080 |
 |
 |
 |
мин |
мин |
мин |
мин |
мин |
| Свободные жирные кислоты |
Контроль |
1 |
0,328 |
0,304 |
0,322 |
0,333 |
0,369 |
 |
T. lanuginosus |
2 |
0,391 |
0,376 |
0,459 |
0,627 |
22,909 |
 |
A. salmonicida #178-9 |
3 |
1,007 |
1,668 |
4,013 |
6,761 |
15,098 |
 |
 |
 |
 |
 |
 |
 |
 |
| Холестерин |
Контроль |
1 |
3,075 |
2,968 |
3,103 |
3,056 |
3,099 |
 |
T. lanuginosus |
2 |
3,130 |
3,032 |
3,045 |
3,026 |
3,225 |
 |
A. salmonicida #178-9 |
3 |
2,835 |
1,912 |
0,356 |
0,220 |
0,206 |
 |
 |
 |
 |
 |
 |
 |
 |
| Эфир холестерина |
Контроль |
1 |
0,416 |
0,397 |
0,422 |
0,408 |
0,437 |
 |
T. lanuginosus |
2 |
0,436 |
0,400 |
0,425 |
0,419 |
0,416 |
 |
A. salmonicida #178-9 |
3 |
1,414 |
2,988 |
6,107 |
6,694 |
5,760 |
 |
 |
 |
 |
 |
 |
 |
 |
| Триглицерид |
Контроль |
1 |
76,153 |
73,505 |
75,565 |
79,344 |
77,382 |
 |
T. lanuginosus |
2 |
74,099 |
74,413 |
77,079 |
74,284 |
21,781 |
 |
A. salmonicida #178-9 |
3 |
73,781 |
73,342 |
77,857 |
82,040 |
72,117 |
Из результатов можно видеть, что почти весь холестерин был этерифицирован спустя 60 минут в пробе 3. Было сделано заключение, что в первые 30 минут имелся избыток субстрата для реакции. Результаты от проб, отобранных спустя 15 и 30 минут, были поэтому использованы для расчета активностей ферментов.
Основываясь на информации таблицы 10 и том факте, что яичный желток содержит 27% липида, было рассчитано количество микромолей жирной кислоты и эфира холестерина, продуцируемое на 1 мл фермента, и результаты приведены в таблице 11.
Результаты в таблице 11 были получены следующими расчетами из результатов по жирным кислотам в пробе 3 (A. salmonicida, 15 мин):
Липид в 5 г яичного желтка = 5×0,27 = 1,35 г.
1,35 г липида содержат 1,007% жирных кислот = 1,35×1,007/100 = 0,01359 г.
Средний молекулярный вес жирных кислот составляет 272.
0,01359 г = 0,01359×1000000/272 = 49,9798 мкмоль.
Добавляли 0,25 мл фермента.
мкмоль жирной кислоты/мл фермента = 49,9798/0,25 = 199,9.
| Таблица 11 |
| Фермент, мкмоль/мл |
 |
 |
 |
 |
 |
 |
0 мин |
15 мин |
30 мин |
| Свободные жирные кислоты |
Контроль |
 |
65,01 |
60,37 |
 |
T. lanuginosus |
 |
77,61 |
74,71 |
 |
Трансфераза #178-9 |
 |
199,86 |
331,06 |
 |
 |
 |
 |
 |
| Эфир холестерина |
Контроль |
 |
35,09 |
33,50 |
 |
T. lanuginosus |
 |
36,77 |
33,73 |
 |
Трансфераза #178-9 |
 |
119,29 |
252,15 |
Из результатов таблицы 11 можно рассчитать изменение количеств жирной кислоты и эфира холестерина, вызванное ферментом, относительно контроля, что показано в таблице 12
Количество продуцированных жирной кислоты или эфира холестерина как функция времени показано на фиг.53.
Из наклона кривой были рассчитаны гидролитическая активность (образование СЖК) и липид-ацилтрансферазная активность (образование эфира холестерина) как функции времени. Затем были рассчитаны относительная трансферазная активность (% ацилтрансферазной активности) и относительная гидролитическая активность, которые приведены в таблице 13. Относительную трансферазную активность определяли, используя протокол для определения % ацилтрансферазной активности, описанный здесь ранее. Например, расчет относительной активности для #178-9:
Общая активность есть активность СЖК + трансферазная активность = 9,023+7,2884 = 16,311 мкмоль/мин/мл.
Относительная трансферазная активность = 7,2884×100/16,311 = 44,7.
Относительная гидролитическая активность = 9,023×100/16,311 = 55,3.
Результаты в таблице 13 подтверждают, что фермент трансферазы из A. salmonicida имеет значительную трансферазную активность, но результаты также подтверждают, что этот фермент имеет значительную гидролитическую активность.
Липаза из T. lanuginosus имеет гидролитическую активность, и относительная трансферазная активность 1,6 не является доказательством какой-либо трансферазной активности, а объясняется неточностью анализа.
Заключение
Яичный желток был использован в качестве субстрата для определения трансферазной и гидролазной активности липид-ацилтрансферазы из Aeromonas salmonicida и липазы из Thermomyces lanuginosus.
При условиях анализа первоначально имелась линейная взаимосвязь между образованием эфира холестерина и свободной жирной кислоты и временем для фермента липид-ацилтрансферазы. Исходя из этой линейной зависимости можно рассчитать гидролитическую активность (образование СЖК) и трансферазную активность (образование эфира холестерина). Была рассчитана также относительная гидролитическая и трансферазная активность. Липид-ацилтрансфераза (в данном случае GCAT) из Aeromonas salmonicida показала почти равные гидролитическую активность и трансферазную активность при данных условиях испытания. Липаза из Thermomyces lanuginosus показала очень низкую гидролитическую активность, и трансферазная активность не была значительной.
Пример 11: Анализ трансферазы в яичном желтке с высоким содержанием воды
Введение
Липид-ацилтрансфераза согласно настоящему изобретению была выделена из Aeromonas salmonicida и экспрессирована в Bacillus subtilis. Начальные эксперименты показали, что этот фермент является весьма эффективным при переносе жирной кислоты от лецитина к холестерину при использовании яичного желтка в качестве субстрата.
В последующих экспериментах трансферазную реакцию изучали более детально, используя в качестве субстрата яичный желток и концентрируя особое внимание на концентрации воды в субстрате.
Процедура
Материалы
Яичный желток: пастеризованный жидкий яичный желток от Danæg Products A/S, DK-4000 Roskilde.
Буфер HEPES Sigma, кат. номер Н 3375.
Хлороформ, чда
Сквалан, чда
Ферменты
#178-9 липид-ацилтрансфераза согласно настоящему изобретению из A. salmonicida.
#2427 фосфолипаза А1 из Fusarium oxysporum, LIPOPAN® F от Novozymes, DK (сравнительный липолитический фермент).
#1991 Фосфолипаза А2 из поджелудочной железы, LIPOMOD 221 от Biocatalysts, UK (сравнительный липолитический фермент).
Анализ фермента с субстратом яичного желтка
5 г жидкого яичного желтка отвешивали в 20 мл стакан Витона и нагревали до 35°С. Добавляли воду и фермент и запускали секундомер.
Через регулярные промежутки времени пробы по 0,5 г переносили в 10 мл стакан Драма. Добавляли 20 мкл 4 М HCl, чтобы остановить ферментативную реакцию и подкислить мыло жирной кислоты.
Добавляли 3 мл хлороформа и пробу перемешивали в миксере Whirley в течение 30 сек.
Пробу центрифугировали при 3000g в течение 10 мин и 0,8 мл хлороформовой фазы переносили в тарированный стакан Драма. Хлороформ выпаривали при 60°С под парами азота. Стакан Драма вновь взвешивали.
Выделенные липиды анализировали методом ГЖХ.
Анализ ГЖХ
Капиллярный газовый хроматограф Perkin Elmer Autosystem 900, снабженный колонкой из плавленой двуокиси кремния WCOT 12,5 м × 0,25 мм внутр.диаметр × 0,1 мкм толщина пленки 5% фенилметилсиликона (CR Sil 8 GB от Chromopack).
Газ-носитель: гелий
Ввод: холодный щелевой инжектор PSSI (начальная температура 50°С, нагрев до 385°С), объем 1,0 мкл
Детектор ПИД: 395°С
Программа термостата:
| Температура термостата, °С |
90 |
280 |
350 |
| Изотермическое время, мин |
1 |
0 |
10 |
| Скорость подъема температуры, °С/мин |
15 |
4 |
 |
Приготовление пробы: 30 мг образца растворяли в 9 мл смеси гептан:пиридин 2:1, содержащей внутренний стандарт гептадекан, 0,5 мг/мл. 300 мкл раствора образца переносили в изогнутую пробирку, добавляли 300 мкл MSTFA (N-метил-N-триметилсилилтрифторацетамид) и давали прореагировать в течение 20 мин при 60°С.
Расчет: коэффициенты отклика для моно-, ди- и триглицеридов и свободной жирной кислоты определяли по стандарту 2 (моно-ди-триглицерид), для холестерина, холестерилпальмитата и холестерилстеарата. Коэффициенты отклика определяли по чистому контрольному веществу (навеска чистого вещества 10 мкг).
Результаты
Яичный желток, содержащий 2% сквалана, использовали в качестве субстрата для реакций. Сквалан добавляли как внутренний стандарт для анализа ГЖХ, чтобы количественно определить липидные компоненты в яичном желтке.
Эксперименты проводили так, как показано в таблице 14.
| Таблица 14 |
 |
 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| Субстрат, яичный желток с 2% сквалана |
г |
5 |
5 |
5 |
5 |
5 |
5 |
2,5 |
2,5 |
| Трансфераза #178-9, 14 PLU-7/мл |
мл |
 |
0,25 |
 |
 |
0,25 |
 |
0,13 |
 |
| LIPOPAN® F, раствор, 200 PLU-7/мл |
мл |
 |
 |
0,25 |
 |
0,25 |
 |
 |
0,13 |
| #1991 фосфолипаза А2, 6300 PLU/мл |
мл |
 |
 |
 |
0,25 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| Вода |
мл |
0,25 |
 |
 |
 |
3,8 |
3,8 |
8,75 |
8,75 |
Пробы отбирали после 30, 60 и 120 минут и анализировали согласно методике, описанной выше. Отбирали пробы 0,5 мл (опыты 1-4), 0,86 мл (опыты 5-6) и 2,2 мл (опыты 7-8).
Результаты анализа ГЖХ показаны в таблице 15. Результаты ГЖХ выражены в процентах от субстрата (яичный желток). Таблица показывает также время реакции и общее количество воды в реакционной смеси.
| Таблица 15 |
| Фермент |
Время реакции |
% воды |
ГЖХ |
ГЖХ |
ГЖХ |
 |
минуты |
в реакции |
% жирной кислоты |
% холестерина |
% эфира холестерина |
| Контроль |
120 |
54 |
0,247 |
0,863 |
0,083 |
| #178 |
30 |
54 |
0,422 |
0,669 |
0,445 |
| #178 |
60 |
54 |
0,515 |
0,549 |
0,672 |
| #178 |
120 |
54 |
0,711 |
0,364 |
1,029 |
| #2427 |
30 |
54 |
2,366 |
0,848 |
0,090 |
| #2427 |
60 |
54 |
3,175 |
0,837 |
0,088 |
| #2427 |
120 |
54 |
3,926 |
0,833 |
0,082 |
| #1991 |
30 |
54 |
1,606 |
0,911 |
0,083 |
| #1991 |
60 |
54 |
1,701 |
0,838 |
0,080 |
| #1991 |
120 |
54 |
1,781 |
0,873 |
0,053 |
| #178 |
30 |
73 |
0,377 |
0,874 |
0,495 |
| #178 |
60 |
73 |
0,488 |
0,665 |
0,719 |
| #178 |
120 |
73 |
0,626 |
0,426 |
0,931 |
| #2427 |
30 |
73 |
2,471 |
0,853 |
0,092 |
| #2427 |
60 |
73 |
3,284 |
0,858 |
0,087 |
| #2427 |
120 |
73 |
4,176 |
0,837 |
0,081 |
| #178 |
30 |
89 |
0,344 |
0,720 |
0,308 |
| #178 |
60 |
89 |
0,443 |
0,725 |
0,446 |
| #178 |
120 |
89 |
0,610 |
0,597 |
0,607 |
| #2427 |
30 |
89 |
0,510 |
0,167 |
0,010 |
| #2427 |
60 |
89 |
0,602 |
0,133 |
0,010 |
| #2427 |
120 |
89 |
0,867 |
0,147 |
0,009 |
Основываясь на анализах жирной кислоты, холестерина и эфира холестерина, можно рассчитать количество образовавшихся свободной жирной кислоты и эфира холестерина как функцию времени реакции и содержания воды. Основываясь на этих результатах, можно затем рассчитать суммарную ферментативную активность как сумму образования жирной кислоты и образования эфира холестерина. Относительная гидролитическая активность и относительная трансферазная активность (т.е. % ацилтрансферазной активности) были затем рассчитаны, и результаты показаны в таблице 16.
Результаты в таблице 16 были также проанализированы статистически, с использованием Statigraphic Multifactor ANOVA. Статистические результаты на фиг.54 подтверждают, что фосфолипаза А1, #2427 и фосфолипаза А2 #1991 не имеют трансферазной активности, тогда как трансфераза #178-9 показывает почти 50% трансферазной активности при данных условиях испытаний.
Эффект содержания воды в испытании на трансферазную активность трансферазы #178-9 также анализировали статистически, что показано на фиг.55. Эти результаты показывают, что в интервале от 54 до 89% воды при испытаниях не было сильного влияния содержания воды на относительную трансферазную активность.
Влияние времени реакции на трансферазную активность для трансферазы #178-9 оценивали с результатами, показанными в таблице 16 и на фиг.56. Результаты на фиг.56 показывают, что относительная трансферазная активность снижается как функция времени реакции. Это может быть объяснено тем фактом, что расходуется большинство молекул акцептора холестерина и поэтому относительная гидролитическая активность возрастает. Отрицательные величины трансферазной реакции для #2427 показывают только, что в рамках погрешности аналитического метода трансферазная активность отсутствует.
| Таблица 16 |
| Фермент |
Время реакции, минуты |
% воды в реакционной смеси |
Образование жирной кислоты |
Потребление холестерина |
Образование эфира холестерина |
Гидролитическая актив ность, % |
Трансферазная активность, % |
| #178 |
30 |
54 |
0,175 |
0,194 |
0,362 |
53 |
47 |
| #178 |
60 |
54 |
0,268 |
0,314 |
0,589 |
52 |
48 |
| #178 |
120 |
54 |
0,464 |
0,499 |
0,946 |
53 |
47 |
| #2427 |
30 |
54 |
2,119 |
0,015 |
0,007 |
100 |
0 |
| #2427 |
120 |
54 |
2,928 |
0,026 |
0,005 |
100 |
0 |
| #2427 |
60 |
54 |
3,679 |
0,030 |
-0,001 |
100 |
0 |
| #1991 |
30 |
54 |
1,359 |
-0,048 |
0,000 |
100 |
0 |
| #1991 |
60 |
54 |
1,454 |
0,025 |
-0,003 |
100 |
0 |
| #1991 |
120 |
54 |
1,534 |
0,100 |
-0,030 |
101 |
-1 |
| #178 |
30 |
73 |
0,130 |
0,099 |
0,412 |
42 |
58 |
| #178 |
60 |
73 |
0,241 |
0,198 |
0,636 |
47 |
53 |
| #178 |
120 |
73 |
0,379 |
0,437 |
0,848 |
51 |
49 |
| #2427 |
30 |
73 |
2,224 |
0,010 |
0,009 |
100 |
0 |
| #2427 |
60 |
73 |
3,037 |
0,005 |
0,004 |
100 |
0 |
| #2427 |
120 |
73 |
3,929 |
0,026 |
-0,002 |
100 |
0 |
| #178 |
30 |
89 |
0,097 |
0,143 |
0,225 |
50 |
50 |
| #178 |
60 |
89 |
0,196 |
0,138 |
0,363 |
56 |
44 |
| #178 |
120 |
89 |
0,363 |
0,266 |
0,524 |
62 |
38 |
| #2427 |
30 |
89 |
0,263 |
0,606 |
-0,073 |
113 |
-13 |
| #2427 |
60 |
89 |
0,355 |
0,730 |
-0,073 |
110 |
-10 |
| #2427 |
120 |
89 |
0,620 |
0,716 |
-0,074 |
105 |
-5 |
Заключение
Липид-ацилтрансферазу из Aeromonas salmonicida испытывали в яичном желтке в качестве субстрата и с различными уровнями содержания воды. Этот фермент сравнивали с контрольными липолитическими ферментами, а именно с фосфолипазой А1 из Fusarium oxysporum и фосфолипазой А2 из поджелудочной железы.
Результаты доказывают, что только трансфераза катализировала трансферазную реакцию между лецитином и холестерином во время образования эфира холестерина. Результаты показали, что в интервале от 54% до 89% воды в субстрате относительная трансферазная активность была почти одинаковой для трансферазы из Aeromonas salmonicida.
Пример 12: Анализ трансферазы в забуференном субстрате для измерения ацилтрансферазной активности (например, для применения в пищевом продукте, использующем лецитин и холестерин)
Липид-ацилтрансфераза была выделена из Aeromonas salmonicida и экспрессирована в Bacillus subtilis. Этот фермент является весьма эффективным в переносе жирной кислоты от лецитина к холестерину во время образования эфиров холестерина. Было также показано, что фермент имеет некоторую гидролитическую активность, которая наблюдается по образованию свободной жирной кислоты. Традиционные фосфолипазы (АС3.1.1.4 и ЕС3.1.1.32) имеют способность гидролизовать лецитин во время образования свободных жирных кислот и лизолецитина, и не сообщалось о трансферазной активности для этих ферментов.
Здесь детализируется тест, который способен оценить и трансферазную, и гидролитическую активность ферментов и таким образом идентифицировать липид-ацилтрансферазы согласно настоящему изобретению; тест использует субстрат, который содержит лецитин и холестерин. В этой работе использовали субстрат на основе фосфатидилхолина и холестерина, диспергированный в буфере. Количественное определение продуктов реакции проводили путем экстракции липидов из субстрата с последующим ГЖХ анализом липидных компонентов.
Процедура
Материалы
L-альфа-фосфатидилхолин 95% (растительный) Avanti No. 441601
Холестерин: Sigma кат. C 8503
Холестеринпальмитат: Sigma С 6072
Холестеринстеарат: Sigma C 3459
Буфер HEPES Sigma cat. No. H 3375
Хлороформ, чда
Ферменты
Очищенная GCAT из A. salmonicida # 178-9
Анализ ТСХ проводили, как описано в примере 6.
Анализ ГЖХ проводили, как описано в примере 11.
Результаты: Анализ трансферазы на основе фосфатидилхолина и холестерина в качестве субстрата.
В нижеследующем трансферазную активность трансферазы испытывали в субстрате на основе фосфатидилхолина и холестерина в соответствии со следующей процедурой.
450 мг фосфатидилхолина (>95% PC Avanti, п.  441601) и 50 мг холестерина растворяли в хлороформе и выпаривали до сухого остатка под вакуумом. 300 мг смеси холестерин/ фосфатидилхолин переносили в стакан Витона и добавляли 15 мл буфера HEPES, pH 7,0. Липид диспергировали в буфере во время перемешивания. 441601) и 50 мг холестерина растворяли в хлороформе и выпаривали до сухого остатка под вакуумом. 300 мг смеси холестерин/ фосфатидилхолин переносили в стакан Витона и добавляли 15 мл буфера HEPES, pH 7,0. Липид диспергировали в буфере во время перемешивания.
Субстрат нагревали до 35°С при перемешивании магнитной мешалкой и добавляли 0,25 мл раствора фермента. Это является сильно обводненной средой с содержанием воды примерно 95%.
Пробы в 2 мл отбирали спустя 0, 5, 10, 15, 25, 40 и 60 минут реакционного времени. Немедленно добавляли 25 мкл 4 М HCl, чтобы подкислить свободную жирную кислоту и остановить ферментативную реакцию. Добавляли 3,00 мл хлороформа и пробу интенсивно встряхивали на Whirley в течение 30 сек. Пробу центрифугировали и 2 мл хлороформовой фазы выделяли и фильтровали через 0,45 мкм фильтры в 10 мл тарированный стакан Драма. Хлороформ выпаривали потоком азота при 60°С и пробы вновь взвешивали. Экстрагированный липид анализировали методом ГЖХ.
Результаты анализов ГЖХ показаны в таблице 17. Результаты выражены в %, рассчитанных на экстрагированный липид. Количество образовавшихся свободной жирной кислоты и эфира холестерина как функция времени показано на фиг.57. Из фиг.57 можно придти к заключению, что ферментативная реакция не является линейной функцией времени, так как вначале наблюдается сильная и гидролитическая, и трансферазная активность. Спустя приблизительно 10 минут и до примерно 60 минут реакция показывает почти линейный характер образования жирной кислоты и эфира холестерина как функции времени. Поэтому было решено рассматривать ферментативную реакцию в данном интервале времени.
| Таблица 17 |
| Минуты |
0 |
5 |
10 |
15 |
25 |
40 |
60 |
| Холестерин, % |
10,064 |
8,948 |
8,577 |
8,656 |
8,102 |
7,856 |
7,809 |
| Эфир холестерина, % |
0,000 |
1,571 |
2,030 |
2,058 |
2,282 |
2,659 |
3,081 |
| СЖК суммарно, % |
0,260 |
1,197 |
1,239 |
1,466 |
2,445 |
2,943 |
3,940 |
Зная количество липида в реакционной смеси и количество добавленного фермента, можно рассчитать образование жирной кислоты и эфира холестерина, выраженное в мкмоль/мл фермента (таблица 18 и фиг.58).
| Таблица 18 |
| Минуты |
10 |
15 |
25 |
40 |
60 |
 |
мкм/мл |
мкм/мл |
мкм/мл |
мкм/мл |
мкм/мл |
| СЖК суммарно |
58,1 |
68,7 |
114,6 |
138,0 |
184,7 |
| Эфир холестерина |
88,9 |
90,0 |
99,3 |
115,6 |
133,8 |
Из результатов в таблице 18 и наклона кривых на фиг.58 можно рассчитать количество жирной кислоты и эфира холестерина как функцию времени, выраженное в мкмоль/мин на мл фермента.
Расчет гидролитической активности и трансферазной активности показан в таблице 19. Относительную трансферазную активность определяли, используя протокол для определения % ацилтрансферазной активности, описанный здесь ранее.
| Таблица 19 |
| Гидролитическая активность (жирная кислота) |
2,52 |
мкмоль/мин на мл фермента |
| Трансферазная активность (эфир холестерина) |
0,94 |
мкмоль/мин на мл фермента |
| Общая активность |
3,45 |
мкмоль/мин на мл фермента |
| Относительная трансферазная активность |
27,1 |
% |
| Относительная гидролитическая активность |
72,9 |
% |
Поиск других ферментов с трансферазной активностью
Описанный выше метод был использован для оценки различных липолитических ферментов на трансферазную и гидролитическую активность. Ферменты испытывали, как показано в таблице 20.
| Таблица 20 |
 |
 |
1 |
2 |
3 |
4 |
5 |
| Субстрат |
мл |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
| #178-9 Трансфераза A. salmonicida 32 PLU-7/мл |
мл |
0,25 |
 |
 |
 |
 |
| 5% #3016 LIPOPAN® F (F. oxysporum) |
мл |
 |
0,25 |
 |
 |
 |
| 5% Thermomyces lanuginosus |
мл |
 |
 |
0,25 |
 |
 |
| 5% Candida rugosa #2983 |
мл |
 |
 |
 |
0,25 |
 |
| 5% Candida cylindracea #3076 |
мл |
 |
 |
 |
 |
0,25 |
Субстрат, содержащий 300 мг фосфатидилхолина/холестерина, диспергированные в 50 мМ буфере HEPES, рН 7,0, нагревали до 35°С при перемешивании. Добавляли раствор фермента и образец выдерживали при 35°С при перемешивании. Пробы отбирали с регулярным промежутком времени и экстрагировали хлороформом. Выделенные липиды анализировали методом ГЖХ, результаты показаны в таблице 21.
| Таблица 21 |
| Проба |
 |
 |
 |
 |
 |
 |
 |
 |
| 1 |
Трансфераза 178-9 |
 |
 |
 |
 |
 |
 |
 |
 |
Минуты |
0 |
5 |
10 |
15 |
25 |
40 |
60 |
 |
СЖК |
1,216 |
2,516 |
2,983 |
2,62 |
2,894 |
3,448 |
3,911 |
 |
Холестерин |
7,547 |
6,438 |
6,365 |
6,15 |
6,136 |
5,936 |
5,662 |
 |
Эфир холестерина |
0 |
1,835 |
2,177 |
2,44 |
2,58 |
2,851 |
3,331 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| 2 |
Fusarium oxysporum (LIPOPAN® F) |
 |
 |
 |
 |
 |
 |
 |
 |
Минуты |
0 |
5 |
10 |
15 |
25 |
40 |
60 |
 |
СЖК |
1,216 |
1,345 |
1,796 |
1,95 |
2,487 |
2,424 |
2,977 |
 |
Холестерин |
7,547 |
7,309 |
7,366 |
7,33 |
7,429 |
7,341 |
7,326 |
 |
Эфир холестерина |
0 |
0,26 |
0,386 |
0,35 |
0,267 |
0,36 |
0,394 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| 3 |
Thermomyces lanuginosus |
 |
 |
 |
 |
 |
 |
 |
 |
Минуты |
0 |
5 |
10 |
15 |
25 |
40 |
60 |
 |
СЖК |
1,216 |
0,853 |
0,875 |
1 |
0,896 |
1,105 |
1,009 |
 |
Холестерин |
7,547 |
7,384 |
7,639 |
7,63 |
7,675 |
7,603 |
7,529 |
 |
Эфир холестерина |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| 4 |
Candida rugosa (#2938) |
 |
 |
 |
 |
 |
 |
 |
 |
Минуты |
0 |
5 |
10 |
15 |
25 |
40 |
60 |
 |
СЖК |
1,216 |
0,982 |
0,987 |
1,02 |
1.135 |
1,131 |
1,15 |
 |
Холестерин |
7,547 |
7,438 |
7,656 |
7,66 |
7,638 |
7,575 |
7,585 |
 |
Эфир холестерина |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| 5 |
Candida cylindricea (#3076) |
 |
 |
 |
 |
 |
 |
 |
 |
Минуты |
0 |
5 |
10 |
15 |
25 |
40 |
60 |
 |
СЖК |
1,216 |
1,032 |
1,097 |
1,07 |
1,203 |
1,131 |
1,43 |
 |
Холестерин |
7,547 |
7,502 |
7,425 |
7,65 |
7,619 |
7,502 |
7,411 |
 |
Эфир холестерина |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
Из анализов ГЖХ видно, что только липид-ацилтрансфераза (178-9) продуцирует значительное количество эфира холестерина и жирных кислот. Фосфолипаза из Fusarium oxysporum также дает стабильное увеличение свободной жирной кислоты, но происходило только начальное образование небольшого количества эфира холестерина, и увеличение количества эфира холестерина в зависимости от времени не наблюдалось.
Зная количество липидного субстрата и анализы ГЖХ, можно рассчитать относительную трансферазную активность и относительную гидролитическую активность, основываясь на результатах за время реакции от 10 до 60 минут. Результаты для трансферазы 178-9 и липазы Fusarium oxysporum показаны в таблице 21. Другие испытанные ферменты не проявили активности.
| Таблица 21А |
 |
Транс фераза 178-9 |
Fusarium oxysporum |
| Гидролитическая активность, микромоль/мин на мл фермента |
1,03 |
0,96 |
| Трансферазная активность, микромоль/мин на мл фермента |
0,40 |
0,01 |
| Общая ферментная активность, микромоль/мин на мл фермента |
1,43 |
0,98 |
 |
 |
 |
| Относительная гидролитическая вктивность |
71,8 |
98,7 |
| Относительная трансферазная активность |
28,2 |
1,3 |
Результат, показанный в таблице 21А, подтверждает значительную трансферазную активность липид-ацилтрансферазы (образец 178-9). Наблюдалось также, что относительная трансферазная активность хорошо согласуется с экспериментом, упомянутым в таблице 19.
Наблюдается, однако, очень низкая трансферазная активность фосфолипазы Fusarium oxysporum. Этот трансферазный уровень настолько низок, что он попадает в погрешность анализа. Как и ожидалось, фосфолипаза Fusarium oxysporum имеет значительную гидролитическую активность.
Заключение
Вместо яичного желтка (показанного в примере 11) в качестве субстрата был использован искусственный субстрат на основе очищенного фосфатидилхолина и холестерина для того, чтобы измерить активность трансферазы из Aeromonas salmonicida. Между 10 мин и 60 мин времени реакции анализ дал почти линейное образование свободных жирных кислот и эфира холестерина как функцию времени. Исходя из активности между 10 мин и 60 мин времени реакции были рассчитаны гидролитическая активность и трансферазная активность.
Концентрация субстрата в этом тесте была относительно более низкой, чем в яичном желтке, а количество воды было относительно более высоким.
Исходя из результатов анализа липид-ацилтрансферазы (в данном случае GCAT) из Aeromonas salmonicida в искусственном субстрате их фосфатидилхолина/холестерина в буфере можно придти к заключению, что этот фермент имеет очень хорошую трансферазную активность также и в системе с очень высоким содержанием воды.
И анализ на основе яичного желтка (см. пример 11), и анализ на фосфатидилхолине/холестерине в буфере (пример 12) могут быть использованы для измерения трансферазной и гидролитической активности ферментов. Яичный желток является предпочтительным с той точки зрения, что гидролитическая и трансферазная активность является линейной зависимостью от времени, а фосфатидилхолин/холестерин в буфере является линейным только в определенном интервале времени.
Пример 13: Пищевые эмульсии
Эффект модифицированного ферментом яичного желтка испытывали на стандартной рецептуре пищевой эмульсии с 60% масла.
Стандартные методы и материалы являются такими, которые были подробно рассмотрены в предшествующих примерах.
Яичный желток был обработан липид-ацилтрансферазой из Aeromonas salmonicida (#138) или фосфолипазой, а именно имеющимся в продаже ферментом Lipopan F® (Novozymes A/S, Denmark) (#2938), как показано в таблице 22.
Анализ ТСХ липидов яичного желтка из обработанного ферментом яичного желтка (таблица 9) показан на фиг.59 и 60.
В этом опыте доза #2938 была увеличена в 10 раз, и это оказало весьма явное воздействие на яичный желток. Количество свободной жирной кислоты значительно возросло, и лецитин (РС) был гидролизован до лизолецитина (LPC). Трансфераза #138 дала явную трансферазную реакцию, так как свободный холестерин был превращен в эфир холестерина и часть лецитина была превращена в лизолецитин.
Другим интересным аспектом ферментативной модификации была консистенция продукта. Образец, обработанный фосфолипазой #2938, стал очень твердым, тогда как образцы, обработанные липид-ацилтрансферазой #138, сохраняли такую же жидкую консистенцию, как контрольный образец (см. фиг.61).
Эти модифицированные яичные желтки испытывали в рецептуре пищевой эмульсии, показанной в таблице 23.
Таблица 23
Майонез с ферментативно модифицированным яичным желтком |
 |
0 |
1а |
2а |
3а |
4а |
 |
% |
% |
% |
% |
% |
| Рапсовое масло |
60 |
60 |
60 |
60 |
60 |
Яичный желток, продукт Sanofo  1123Р2 1123Р2 |
2,8 |
 |
 |
 |
 |
Ферм. модифицированный яичный желток  1 1 |
 |
2,8 |
 |
 |
 |
Ферм. модифицированный яичный желток  2 2 |
 |
 |
2,8 |
 |
 |
Ферм. модифицированный яичный желток  3 3 |
 |
 |
 |
2,8 |
 |
Контроль (необработанный яичный желток)  4 4 |
 |
 |
 |
 |
2,8 |
| Вода |
39 |
36,2 |
36,2 |
36,2 |
36,2 |
| Уксус, 10% уксусной кислоты |
1 |
1 |
1 |
1 |
1 |
Модифицированные яичные желтки 1 и 2 были обработаны липид-ацилтрансферазой, а модифицированный яичный желток 3 был обработан имеющейся в продаже фосфолипазой.
Пищевую эмульсию готовили как эмульсию масло в воде согласно следующей методике: яичный желток и воду отвешивали в стакан. Масло отвешивали отдельно.
В водную фазу погружали миксер Turrax (20000 об/мин). Масло закачивали в водную фазу с постоянной скоростью в течение 2 минут. Перемешивание продолжали дополнительно в течение 1 минуты. Затем добавляли уксус и перемешивали в течение 5 секунд.
Стабильность эмульсии испытывали в нагревательной камере при 100°С. После 2 часов при 100°С оценивали эмульсию (см. фиг.62).
Стабильность эмульсии необработанного яичного желтка в этом опыте была вполне удовлетворительной. Однако обработка яичного желтка липид-ацилтрансферазой #138 улучшила стабильность, так как количество отделяющейся воды снизилось. Яичный желток, обработанный фосфолипазой #2938, дал очень нестабильную эмульсию с почти полным разделением масляной и водной фазы при 100°С.
Авторы считают, что в некоторых областях использование композиций и способов по изобретению может обеспечить улучшенную термическую стабильность эмульсий, таких как заправки для салатов масло в воде и т.п. Это является особенно важным для пищевых эмульсий, которые пастеризуют, чтобы обеспечить длительную сохраняемость, и/или нагревают перед подачей, например, в предварительно приготовленных блюдах, которые повторно разогревают перед подачей (например, в блюдах для микроволновой печи). Хотя и не желая быть связанными какой-либо определенной теорией, предполагается, что при некоторых применениях накопление свободных жирных кислот может быть вредным для термической стабильности таких эмульсий. Следует признать, что улучшенная термическая стабильность пищевых эмульсий, полученных с использованием способов по изобретению, может не проявляться или даже может оказаться нежелательной в некоторых пищевых применениях. Специалистам должно быть ясно, в каких применениях такие характеристики являются желательными, и стабильность эмульсий может быть легко определена при использовании простых тепловых тестов, эквивалентных, например, пастеризации и/или повторному нагреву в микроволновой печи. Авторы изобретения установили, что в предпочтительном варианте осуществления пищевая эмульсия, полученная с применением ферментов по изобретению, имеет улучшенную термическую стабильность.
Пример 14: Трансферазная реакция в яичном желтке, обогащенном растительным стеролом
Трансфераза из Aeromonas salmonicida была способна катализировать образование лизолецитина, моноглицерида и эфиров стерола в яичном желтке, обогащенном растительным стеролом и глицерином. Тот же фермент был испытан в низководной системе, содержащей пальмовое масло, лецитин, растительный стерол и глицерин. Анализами ТСХ и ГЖХ было показано, что моноглицерид и эфиры растительного стерола продуцируются при данных условиях реакции.
Введение
Трансфераза из Aeromonas salmonicida была испытана на трансферазную активность в почти не содержащей воду системе из лецитина, жира, растительного стерола и глицерина.
Материалы
Яичный желток: пастеризованный жидкий яичный желток от Danæg Products A/S, DK-4000 Roskilde.
GCAT трансфераза очищенная #178-9, 32 PLU-7/мл (журнал 2254-100).
Соевый лецитин Yolkin от Aarhus United, Denmark.
Пальмовое масло 43, от Aarhus United, Denmark.
L- -фосфатидилхолин 95% растительный (Avanti #441601). -фосфатидилхолин 95% растительный (Avanti #441601).
Ситостерол, Sigma nr. S5753.
Растительный стерол: Generol N122 от Cognis, Germany.
Глицерин, п. 085915.
Результаты
Первоначальный скрининг трансферазной активности по отношению к растительному стеролу и глицерину был проведен в яичном желтке, как показано в таблице 24.
* Вода, соответствующая количеству воды в растворе фермента = 83 мкл
Ингредиенты смешивали и нагревали до 37°С и выдерживали при этой температуре при перемешивании магнитной мешалкой.
Пробы по 0,1 г отбирали спустя 3 и 23 часа и анализировали методом ТСХ. Результаты анализов ТСХ показаны на фиг.63.
Результат на фиг.63 показывает, что и холестерин, и растительные стеролы этерифицируются в результате трансферазной реакции одновременно с образованием лизолецитина (образцы 3 и 4), так как почти весь свободный стерол и холестерин были превращены в соответствующий эфир в образце 3.
Результаты также показывают, что образец, содержащий только глицерин и яичный желток, продуцировал моноглицерид. Количество моноглицерида должно быть подтверждено анализом ГЖХ. Когда вместе с глицерином добавляли стерол (образец 2), количество моноглицерида было очень низким и не обнаруживаемым методом ТСХ. Это показывает, что до тех пор, пока имеется избыток стерола или холестерина, трансферазная реакция, использующая глицерин, является умеренной.
В другом эксперименте трансферазный фермент 178-9 добавляли к смеси соевого лецитина, глицерина и растительного стерола для того, чтобы изучить каталитическую активность фермента в этой реакционной смеси.
Состав реакционных смесей в данных опытах показан в таблице 25.
| Таблица 25 |
 |
 |
1 |
2 |
3 |
4 |
5 |
6 |
| Соевый лецитин |
г |
1,875 |
2,25 |
1,875 |
2,5 |
3,5 |
3,5 |
| Растительный стерол Generol N 122 |
г |
0,225 |
0,225 |
0 |
0 |
0,225 |
0,5 |
| Пальмовое масло 43 |
г |
2,675 |
2,25 |
2,8 |
2,125 |
1,062 |
0,831 |
| Глицерин |
г |
0,225 |
0,275 |
0,325 |
0,375 |
0,248 |
0,238 |
| Трансфераза #178-9, 32 PLU/мл |
мл |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
Опыт проводили смешением липидных компонентов при перемешивании при 46°С. Добавляли фермент и пробы отбирали спустя 4 и 24 часа.
Пробы анализировали методом ТСХ, как показано на фиг.64.
Пробы от опытов 2, 4 и 5 спустя 24 часа времени реакции анализировали также методом ГЖХ, и результаты показаны в таблице 26.
| Таблица 26 |
 |
 |
2 |
4 |
5 |
| Глицерин |
% |
3,16 |
5,71 |
4,17 |
| Жирные кислоты |
% |
4,23 |
5,36 |
6,67 |
| Моно |
% |
2,24 |
3,87 |
3,92 |
| Стерол |
% |
2,13 |
 |
2,62 |
| Эфир стерола |
% |
2,89 |
 |
2,14 |
Результаты подтвердили, что трансфераза 178-9 способна катализировать образование эфиров растительных стеролов и моноглицерида из реакционной смеси, содержащей соевый лецитин, глицерин и растительный стерол. Такая реакционная смесь могла бы представлять интерес для применения в производстве маргарина, где моноглицериды являются желательными из-за их эмульгирующих свойств, а эфиры растительных стеролов желательны из-за их эффекта снижения холестерина.
Заключение
Трансфераза GCAT из Aeromonas salmonicida способна катализировать образование эфиров растительных стеролов и моноглицерида в яичном желтке, когда добавлены растительный стерол и глицерин. Тот же фермент катализирует образование эфиров растительных стеролов и моноглицерида в смеси пальмового масла, лецитина, растительного стерола и глицерина. Поэтому фермент представляет интерес для применения в маргарине и других маслосодержащих пищевых продуктах, где моноглицерид и лизолецитин необходимы для улучшения эмульгирования, а эфиры растительных стеролов желательны из-за их эффекта снижения холестерина.
Пример 15: Иммобилизация липид-ацилтрансферазы из Aeromonas salmonicida и применение в синтезе эфиров стерола
Липид-ацилтрансферазу (в данном случае GCAT) из A. salmonicida иммобилизовали на целит осаждением ацетоном. 10 мл раствора фермента в 20 мМ буфера ТЕА, рН 7, медленно перемешивали с 0,1 г целита 535 535 (от Fluka) в течение 2 часов при комнатной температуре.
50 мл холодного ацетона добавляли при продолжающемся перемешивании. Осадок выделяли центрифугированием при 5000 g в течение 1 минуты. Осадок промывали 2 раза 20 мл холодного ацетона. Целит сушили при комнатной температуре в течение примерно 1 часа.
Иммобилизованную трансферазу испытывали в масляной смеси, содержащей 13% фосфатидилхолина и 7% растительного стерола (таблица 27).
| Таблица 27 |
 |
% |
| Лецитин Avanti |
12,0 |
| Растительный стерол Generol 122N |
6,6 |
| Пальмовое масло 43 |
71,4 |
| Глицерин |
5,0 |
| Иммобилизованная трансфераза #178, 45 U/г |
2,0 |
| Вода |
3,0 |
Лецитин, растительный стерол и соевое масло нагревали до 46°С и растительный стерол растворяли. Добавляли иммобилизованную трансферазу.
Трансферазная реакция продолжалась при 46°С при мягком перемешивании магнитной мешалкой. Пробы для анализа отбирали спустя 1/2, 1, 3, 6 и 24 ч и анализировали методом ТСХ. Реакцию останавливали спустя 24 часа реакционного времени и иммобилизованную трансферазу отфильтровывали.
Пробы анализировали методом ТСХ, и результаты показаны на фиг.65.
Анализ ТСХ ясно показал эффект иммобилизованной трансферазы из A. salmonicida в превращении холестерина в эфир холестерина. Наблюдалось также, что образовалось небольшое количество моноглицерида. Было также показано, что фермент имеет высокую активность в средах с высоким содержанием воды (6-89% воды), поэтому трансфераза и другие трансферазы для использования по изобретению могут быть также использованы в приложениях с иммобилизованным ферментом со значительным содержанием воды. Это делает возможным замещение растворителей, используемых в современных иммобилизованных липазах при биоконверсии липидов с использованием трансфераз.
Пример 16: Трансфераза Aeromonas salmonicida может осуществлять перенос от фосфолипида к стеролу, образуя эфир стерола, и/или к молекуле сахара, образуя эфир сахара
Липид-ацилтрансфераза из Aeromonas salmonicida экспрессированная в E. coli (Hydro 0303), обозначенная как #139, была очищена на колонке HR 2,5/10 c Chelating Sepharose FF и проанализирована на фосфолипазную активность. Трансферазную активность оценивали в яичном желтке на ферментативную активность и функциональность в яичном желтке. Фермент был также испытан в яичном желтке, содержащем глюкозу.
Фосфолипазная активность
Трансферазу #139, выделенную из колонки HR 2,5/10 c Chelating Sepharose FF, анализировали с NEFA-PLU (pH 7). Активность составила 1,15 единиц NEFA-PLU/мл.
Яичный желток
В начальном тесте на применимость трансферазу #139 испытывали в яичном желтке согласно следующей процедуре.
1 г свежего яичного желтка отвешивали в 10 мл колбу с завинчивающейся крышкой. Добавляли препарат фермента и перемешивали на мешалке Vortex. Образец помешали при температуре 37°С и перемешивали магнитной мешалкой.
Реакцию останавливали добавлением 7,5 мл смеси хлороформ:метанол (2:1) и перемешивали на мешалке Whirley в течение 30 секунд. Хлороформовую фазу отделяли центрифугированием и 2 мкл хлороформовой фазы переносили на предварительно активированную пластину ТСХ из диоксида кремния и элюировали текущим буфером I, а другую пластину – текущим буфером IV.
Параметры опыта показаны в таблице 28.
Анализы ТСХ показаны на фиг.66 и 67. Анализ ТСХ ясно демонстрирует трансферазную реакцию трансферазы #139. Холестерин превращается в эфир холестерина, и количество лецитина уменьшается. Результат, однако, показывает также, что лизолецитин накапливается только в очень небольшом количестве из-за того, что трансфераза #139 является также активной по отношению к лизолецитину. Это наблюдение подтверждается образованием свободных жирных кислот (СЖК).
Яичный желток и глюкоза
Ранее было показано, что трансфераза из Aeromonas salmonicida (#138) способна использовать глюкозу в качестве молекулы-акцептора в трансферазной реакции. Было проверено также, может ли трансфераза #139 использовать глюкозу в качестве молекулы-акцептора. Параметры эксперимента представлены в таблице 29.
Продукты реакции анализировали методами ТСХ и ГЖХ.
Анализ ТСХ показывает образование эфира глюкозы после 220 мин времени реакции (фиг.69, дорожка 6), но после 1200 мин времени реакции никакого эфира глюкозы не видно. Поэтому следует прийти к заключению, что трансфераза #139 обладает и трансферазной, и гидролитической активностью. Это подтверждается также тем фактом, что количество свободных жирных кислот постоянно возрастает по ходу времени реакции.
Трансфераза из Aeromonas hydrophila была испытана в яичном желтке. Результат подтверждает, что этот фермент катализирует образование эфира холестерина одновременно с образованием лизолецитина. После длительного времени реакции, когда большая часть холестерина израсходована, образовывалась также свободная жирная кислота. Можно поэтому придти к заключению, что фермент имеет преимущественно трансферазную активность, но наблюдалась также и гидролитическая активность, когда только вода была доступна как молекула-донор.
В опыте с яичным желтком и глюкозой было обнаружено, что трансфераза из Aeromonas hydrophila способна катализировать образование эфира глюкозы in situ в пищевой среде с высоким содержанием воды (фиг.70).
Пример 17: Варианты липид-ацилтрансферазы из Aeromonas hydrophila (Ahyd2) (SEQ ID No.36, см. фиг.71)
Были введены мутации с использованием набора реактивов QuikChange® Multi-Site Directed Mutagenesis kit Stratagene, La Jolla, CA 92037, USA, следуя инструкции, предоставленной Stratagene.
Варианты с Tyr256 показали повышенную активность по отношению к фосфолипидам.
Варианты с Tyr256 и Tyr260 показали повышенную активность по отношению к галактолипидам.
Вариант с Tyr265 показал повышенную трансферазную активность с галактолипидами в качестве донора ацила.
Числа показывают положения на следующей последовательности: Фермент из Aeromonas hydrophila, аминокислотная последовательность которого показана как SEQ ID No.36 на фиг.71 (подчеркнутые аминокислоты показывают сигнальный пептид ксиланазы). Нуклеотидной последовательностью является последовательность, которая показана как SEQ ID No.54 на фиг.72.
Пример 18: Применение ацилтрансферазной реакции для продуцирования эфира растительного стерола и моноглицерида для приготовления маргарина
Ацилтрансфераза из Aeromonas salmonicida, экспрессированная в Bacillus subtilis, была испытана в смеси пальмового масла, содержащей растительный лецитин, растительный стерол и глицерин. Ацилтрансфераза показала способность утилизировать и растительный стерол, и глицерин в качестве молекул-акцепторов во время продуцирования эфира растительного стерола и моноглицерида. Реакционную смесь использовали для приготовления столового маргарина хорошего качества, основанного на моноглицериде в реакционной смеси, и в то же время маргарин был обогащен эфиром растительного стерола, который, как было показано, обладает эффектом снижения холестерина.
Целью этой работы было изучение возможности продуцировать моноглицерид и эфир растительного стерола путем ферментативной реакции лецитина, растительного стерола и глицерина, растворенных в растительном жире.
Начальные эксперименты показали, что возможно использовать ацилтрансферазу из Aeronmonas salmonicida для того, чтобы продуцировать моноглицерид и эфир растительного стерола из лецитина, глицерина и растительного стерола.
В этом эксперименте такую реакционную смесь использовали для приготовления столового маргарина.
Материалы
Липид-ацилтрансфераза из Aeromonas salmonicida, #196 C101, 18,6 PLU/г (журнал 2254-104).
Пальмовое масло 43 от Aarhus United, DK.
L- -фосфатидилхолин 95% растительный (Avanti, #441601). -фосфатидилхолин 95% растительный (Avanti, #441601).
Растительный стерол: Generol N122 от Cognis, Germany.
Глицерин, п. 085915.
Дистиллированный моноглицерид, Dimodan HP от Danisco.
Приготовление маргарина
1. Смешать ингредиенты водной фазы (если требуется, пастеризовать водную фазу нагреванием до примерно 80°С). Довести рН до 5,5.
2. Расплавить жировую фазу и довести температуру до примерно 40-45°С.
3. Нагреть эмульгатор с некоторым количеством масла в соотношении 1 часть эмульгатора на 5 частей масла до температуры (75-80°С), которая на 5-10°С выше температуры плавления эмульгатора. Когда смесь полностью расплавится и хорошо перемешается, добавить оставшееся нагретое масло, непрерывно перемешивая.
4. Добавить вкусовую добавку.
5. Добавить водную фазу к жировой фазе, непрерывно перемешивая.
6. Охладить в трубчатом холодильнике (обычная производительность, обычное охлаждение) до температуры на выходе 8-10°С.
Результаты
Ацилтрансфераза из A. salmonicida была испытана в смеси пальмового масла, как показано в таблице 30. Лецитин, растительный стерол, глицерин и пальмовое масло нагревали до 60°С при перемешивании для солюбилизации растительного стерола и лецитина.
| Таблица 30 |
| Субстрат |
% |
| Лецитин Avanti |
12,0 |
| Растительный стерол Generol 122N |
6,6 |
| Пальмовое масло, температура плавления 43 |
76,4 |
| Глицерин |
5,0 |
Субстрат охлаждали до 48°С и добавляли ацилтрансферазу #196 в количестве, указанном в таблице 31. Реакционную смесь выдерживали при 48°С в течение 24 часов при медленном перемешивании.
| Таблица 31 |
 |
г |
| Субстрат |
220 |
| Трансфераза #196 C101, 18,6 PLU/г |
15 |
Пробы реакционной смеси отбирали спустя 1, 4 и 24 часа времени реакции и анализировали методом ТСХ в растворителе I (фиг.73). Результаты анализа ТСХ ясно показывают образование эфира растительного стерола и моноглицерида. На фиг.73 первая дорожка представляет пробу после 1 часа времени реакции, дорожка 2 представляет 4 часа времени реакции, дорожка 3 представляет 24 часа времени реакции, и дорожка 4 представляет растительный стерол.
Реакцию останавливали после 24 часов времени реакции и остатки нерастворенного растительного стерола удаляли, а прозрачный раствор использовали для получения маргарина.
Маргарин
Реакционную смесь, содержащую моноглицерид и эфир растительного стерола, использовали для получения столового маргарина согласно рецептуре, показанной в таблице 32.
| Таблица 32 |
Протокол  3734 3734 |
1 |
2 |
| Водная фаза |
 |
 |
| Вода |
16 |
16 |
| Соль |
0,5 |
0,5 |
| Сухое обезжиренное молоко |
1 |
1 |
| Сорбат калия |
0,1 |
0,1 |
| EDTA |
0,015 |
0,015 |
| pH |
5,5 |
5,5 |
 |
 |
 |
| Водная фаза, всего |
16,6 |
16,6 |
 |
 |
 |
| Жировая фаза |
 |
 |
| Пальмовое масло 43 |
25 |
25 |
| Рапсовое масло |
75 |
75 |
 |
 |
 |
 |
 |
 |
| Жировая фаза, всего |
83,2 |
78,4 |
| Dimodan HP |
0,2 |
 |
| Реакционная смесь |
 |
5 |
Маргарин, полученный из реакционной смеси, оценили как имеющий хорошее качество с хорошей способностью к намазыванию и хорошим ощущением во рту без какого-либо постороннего привкуса. Маргарин был сравним по уровню качества со стандартным маргарином, приготовленным с использованием дистиллированного моноглицерида Dimodan HP.
Единственным наблюдавшимся различием было то, что маргарин, протокол 3734  2 с реакционной смесью был немного более твердым, что объясняется тем фактом, что данная рецептура содержала больше пальмового масла, чем контрольный маргарин. 2 с реакционной смесью был немного более твердым, что объясняется тем фактом, что данная рецептура содержала больше пальмового масла, чем контрольный маргарин.
Пример 19: Применение липид-ацилтрансферазы при приготовлении хлеба
Одним из ограничений применения липаз в хлебопечении является то, что во время липазной реакции образуется свободная жирная кислота. Хорошо известно, что образование слишком большого количества свободной жирной кислоты будет иметь негативное влияние на поведение муки при изготовлении хлеба, так как клейковина становится слишком жесткой и образуется упругое (т.е. менее эластичное) тесто, которое не может расширяться во время ферментации и выпечки.
Образования свободной жирной кислоты следует также избегать с точки зрения окислительной стабильности, поскольку свободные жирные кислоты более склонны к окислению липидов, чем соответствующие триглицериды.
В настоящем изобретении проблемы образования свободной жирной кислоты при добавлении в тесто липолитического фермента были преодолены за счет использования липид-ацилтрансферазы, которая вместо продуцирования свободных жирных кислот переносит одну или несколько жирных кислот от липидного донора ацила к неводной молекуле-акцептору, присутствующей в тесте, такой как углевод, протеин, или пептид, или, если используется в хлебе с молочным жиром, стерол. Альтернативно или в комбинации в тесто могут быть добавлены другие акцепторы, перечисленные выше, например, фитостеролы или фитостанолы. Предпочтительно, молекула-акцептор в тесте может быть одной или несколькими из глюкозы, сахарозы или мальтозы и/или других углеводов, обычно доступных в тесте.
В следующих экспериментах ацилтрансферазу испытывали в маломасштабных опытах по хлебопечению. Образовавшиеся продукты реакции и липидные компоненты в полностью расстоенном тесте экстрагировали водой, насыщенной бутанолом, и анализировали методами ЖХВД и ГЖХ
Материалы и методы
Ферменты
Ацилтрансфераза 550 PLU-7/мл.
Lipopan F BG, промышленная липаза от Novozymes. 12000 LIPU/г или Grindamyl Exel 16, 12000 LIPU/г. F BG, промышленная липаза от Novozymes. 12000 LIPU/г или Grindamyl Exel 16, 12000 LIPU/г.
Лецитин порошок, 95% фосфолипид (доступен от Danisco A/S, Denmark).
Дигалакозилдиглицерид из цельной пшеничной муки (от Sigma D4651).
Мука: Sølvmel nr. 2001084 (датская пшеничная мука, полученная от Havnemøllerne, Odense, Denmark).
Минипекарный тест
Мука, 50 г, сухие дрожжи 10 г, глюкоза 0,8 г, соль 0,8 г, 70 ч/млн аскорбиновой кислоты и 400 единиц Брабендера воды замешивали в 50 г тестомесильной чаше Брабендера в течение 5 мин при 30°С.
Время расстойки составляло 10 мин при 34°С. Тесто отвешивали по 15 г каждого теста, затем формовали на специальном устройстве, где тесто раскатывали между деревянной пластиной и плексигласовой рамкой. Образцы теста расстаивали в формах в течение 45 мин при 34°С и выпекали в домашней печи Voss 8 мин при 225°С.
После выпекания хлебцы охлаждали до комнатной температуры и спустя 20 мин хлебцы взвешивали и определяли объем методом смещения рапсового семени. Хлебцы также разрезали и оценивали мякиш и корку.
Результаты и заключение
Предварительные результаты показывают, что липид-ацилтрансфераза явно демонстрирует положительный эффект и на объем хлеба, и на внешний вид хлеба. В частности, предварительные результаты показывают, что использование липид-ацилтрансферазы приводит к увеличение удельного объема хлеба по сравнению с хлебом, полученным с контролем (без фермента) и полученным с применением доступного в продаже протолитичнского фермента, а именно Grindamyl Exel или Lipopan F . .
Пример 20: Стандартное мороженое с молочным жиром
Функцией эмульгаторов, используемых в мороженом, является осуществление контролируемой кристаллизации жира и мягкой дестабилизации в результате десорбции протеина во время старения мороженого. Это изменение улучшает качество мороженого. Для приготовления мороженого обычно используют моноглицериды, но известно также использование в производстве мороженого полярных эмульгаторов, подобных полисорбатам и эфирам сахаров в сочетании с моно- и диглицеридами, чтобы содействовать контролируемой дестабилизации жира и получить мороженое с очень хорошей кремовой и однородной при еде консистенцией.
Эмульгаторы, используемые в мороженом, обычно добавляют в смесь для мороженого в виде порошка. Недавно было, однако, показано, что моно-диглицериды могут быть продуцированы ферментативной реакцией жира в рецептуре мороженого с использованием липаз. Проблемой для использования липаз, однако, является то, что липазы катализируют также образование свободных жирных кислот, когда вода является доступной в реакционной смеси.
Было, однако, неожиданно показано, что липид-ацилтрансфераза преодолевает ограничения для липазы, так как ацилтрансфераза способна переносить жирную кислоту от лецитина и других липидов к молекулам-акцепторам, подобным стеролу, холестерину, глюкозе, глицерину и протеинам/пептидам без образования значительного количества свободных жирных кислот.
Одним из главных ингредиентов мороженого являются молочные сливки, содержащие 38% молочного жира. Молочные сливки содержат также меньшее количество лецитина, который является молекулой-донором для ацилтрансферазы (“Комплекс молочных липидов составляет примерно 1% от общего молочного жира и состоит главным образом из фосфолипидов”, Ref. Ullman’s Encyclopedia of Industrial Chemistry Copyright © 2003 by Wiley-VCH Verlag GmbH & Co. KGaA). Молочные сливки содержат также небольшое количество холестерина, который является молекулой-акцептором для ацилтрансферазы.
Таким образом, из составляющих мороженого можно продуцировать и моноглицерид, и полярные эмульгаторы, подобные лизолецитину и эфиру сахара, которые известны как оказывающие благоприятный эффект при изготовлении мороженого.
Дополнительным благоприятным эффектом реакции ацилтрансферазы в молочных сливках является образование эфира холестерина, который может замедлить поглощение холестерина в кишечнике.
| Рецепт мороженого |
 |
с эмульгатором |
с ферментом |
| Молочные сливки, 38% |
23,65 |
23,65 |
| Обезжиренное молоко |
53,30 |
53,30 |
| Порошковое обезжиренное молоко |
4,90 |
11,30 |
| Сахар |
12,00 |
12,00 |
| Глюкозный сироп, DE 42, 75% TS |
4,25 |
4,25 |
| Глицерин |
1,0 |
1,0 |
| Смесь стабилизаторов |
0,2 |
0,2 |
| Cremodan SE 30 |
0,6 |
 |
| Липид-ацилтрансфераза, 500 PLU/г |
 |
0,1 |
| Grinsted Flavouring 2976 |
0,1 |
0,1 |
| Краситель |
+ |
+ |
Процесс приготовления мороженого
1. Нагреть молочные сливки, глюкозный сироп и глицерин до примерно 40°С. Добавить ацилтрансферазу и дать смеси реагировать в течение 30 минут. Пробу отбирали для анализа.
2. Нагреть все другие жидкие ингредиенты до примерно 40°С.
3. Добавить другие сухие ингредиенты (смесь стабилизаторов смешивают с сахаром перед добавлением).
4. Когда сухие ингредиенты растворятся, добавить смесь молочных сливок и глюкозного сиропа.
5. Пастеризовать при 80-85°С/20-40 секунд.
6. Гомогенизировать при 80°С (190 бар для рецепта 1 и 175 бар для рецепта 2).
7. Охладить до температуры состаривания 4°С.
8. Заморозить в замораживателе непрерывного действия до желаемой взбитости (рекомендуется 100%).
9. Закалить мороженое в туннельном закалочном аппарате при -40°С.
10. Хранить при температуре ниже -25°С.
Результаты
Применение ацилтрансферазы при изготовлении мороженого содействует получению мороженого с очень хорошим вкусом и превосходным нежным ощущением во рту, сопоставимого с мороженым, изготовленным с использованием промышленного эмульгатора Cremodan SE 30. Расплав мороженого, изготовленного с липид-ацилтрансферазой, также оказался улучшенным.
Пример 21: Ацилтрансфераза в сыре
Сыр является свежим или зрелым твердым или полутвердым продуктом, полученным путем коагуляции молока, обезжиренного молока, частично обезжиренного молока, сливок, подсырных сливок, или пахты, или любой комбинации этих материалов через воздействие сычуга или других подходящих коагулирующих агентов и частичного дренирования сыворотки, которая является результатом такой коагуляции.
Выход сыра зависит в первую очередь от содержания жира и протеина в молоке. Концентрации соли (в особенности солей кальция) и протеина, а также кислотность являются очень важными для коагуляции (Ref. Ullman’s Encyclopedia of Industrial Chemistry Copyright © 2003 by Wiley-VCH Verlag GmbH & Co. KGaA).
Такая попытка была сделана для того, чтобы оптимизировать и повысить выход сыра путем оптимизации процедуры изготовления сыра (USP 4959229) или путем использования улучшенного способа створаживания (USP 2581240), которые повышали количество протеинов сыворотки в твороге.
В настоящем изобретении количество протеинов сыворотки в твороге повышено путем ферментативной модификации протеина сыворотки обработкой молока во время приготовления сыра липид-ацилтрансферазой.
Когда жирная кислота ковалентно присоединяется к немембранному протеину, подобному  -лактоглобулину, физические и функциональные свойства радикально изменяются. -лактоглобулину, физические и функциональные свойства радикально изменяются.
Для приготовления сыра по настоящему изобретению ацилтрансферазу добавляют к молоку до того или в то же время, когда к молоку добавляют сычуг.
Во время осаждения казеина ацилтрансфераза способна использовать лецитин и другие липиды молока в качестве донора, а пептиды или протеин – в качестве молекул-акцепторов во время образования ацилированного протеина или ацилированных пептидов.
Изменение гидрофобных свойств протеина молока приводит к увеличенному осаждению протеина в творог во время образования сыра.
Поскольку повышение выхода сыра, полученного по настоящему изобретению, берет начало от увеличенного удерживания в сырном коагулюме протеина, который обычно теряется с сывороткой, подходящий способ, непосредственно связанный с механизмом по изобретению, базируется на определении количества протеина, который остается в сыворотке. Меньше протеина в сыворотке неизбежно означает больше протеина в твороге и более высокий выход сыра.
Тест на количество протеина в сыворотке может быть осуществлен следующим путем. Снятое или цельное молоко нагревают до температуры, подходящей для сычужной коагуляции, обычно 30-35°С в 100 мл стакане. Необязательно добавляют 1% сыпучей молочнокислой бактериальной закваски и добавляют стандартный сычуг в количестве, соответствующем, например, 0,03-0,05%. Когда молоко свертывалось в коагулюм, достаточно твердый для того, чтобы его можно было разрезать на кубики в боковой длиной около 0,5 см, такую нарезку проводили острым ножом. Тем самым инициировали синерезис и после 30 минут периода выдержки, что позволяло творогу осесть, выводили пробу сыворотки и центрифугировали ее в лабораторной центрифуге в течение 10 мин. Эту пробу анализировали на содержание протеина, используя, например, метод Кьельдаля. Альтернативно и/или как дополнение, пробу можно было анализировать методами, которые позволяют установить тип и количество индивидуальных протеиновых компонентов.
Пример 22: Анализ в низководной среде
Трансферазные реакции липолитических ферментов в низководной среде.
Процедура
Материалы
Холестерин Sigma cat. C 8503.
L-альфа-фосфатидилхолин 95% (растительный) Avanti #441601.
Соевое масло, Aarhus United, DK.
Хлороформ, чда.
Ферменты
#179, GCAT из A. salmonicida.
#2427, фосфолипаза А1 из Fusarium oxysporum, LIPOPAN® F от Novozymes, Denmark.
#1991, фосфолипаза А2 из поджелудочной железы, LIPOMOD 22L от Biocatalysts, UK.
#2373, липаза Candida antarctica, Novozyme 525 L от Novozymes, Denmark.
Испытания фермента
13,1% лецитина и 6,6% холестерина растворяли в соевом масле, нагретом до 60°С при перемешивании.
Субстрат отвешивали в 20 мл стакан Витона и нагревали до 46°С. Добавляли воду и раствор фермента и запускали секундомер.
Через регулярные интервалы времени 50 мг пробы переносили в 10 мл стакан Драма и замораживали. Выделенный липид анализировали методом ГЖХ.
Анализ ГЖХ
Анализ ГЖХ проводили, как описано в примере 11.
Результаты
Эксперимент проводили, как показано в таблице 33.
Субстрат на основе соевого масла, содержащий 13,1% лецитина и 6,6% холестерина, нагревали до 46°С. Добавляли раствор фермента и запускали секундомер. Спустя 30, 60 и 120 минут времени реакции отбирали пробы для ГЖХ анализа.
Результаты анализа ГЖХ показаны в таблице 34. Результаты выражены в процентах от общего состава пробы. Основываясь на результатах ГЖХ, можно рассчитать количество жирной кислоты и эфира холестерина, продуцированное ферментативной реакцией, относительно контрольного образца без добавления фермента. При данных условиях эксперимента была определена общая ферментативная активность как гидролитическая активность по образованию жирной кислоты и трансферазная активность, определенная по образованию эфира холестерина. Из этих результатов и информации о молекулярном весе жирной кислоты и эфира холестерина можно рассчитать относительную мольную гидролитическую активность и относительную мольную трансферазную активность, которые показаны в таблице 35.
| Таблица 34 |
| Фермент |
Время реакции, |
Жирная кислота, |
Холестерин, |
Эфир холестерина, |
 |
минуты |
% |
% |
% |
| Контроль |
120 |
0,533 |
7,094 |
0,000 |
| #179 |
30 |
0,770 |
5,761 |
2,229 |
| #179 |
60 |
0,852 |
5,369 |
2,883 |
| #179 |
120 |
0,876 |
4,900 |
3,667 |
| #2427 |
30 |
3,269 |
7,094 |
0,000 |
| #2427 |
60 |
3,420 |
7,094 |
0,000 |
| #2427 |
120 |
3,710 |
7,094 |
0,000 |
| #1991 |
30 |
2,871 |
7,094 |
0,000 |
| #1991 |
60 |
3,578 |
7,094 |
0,000 |
| #1991 |
120 |
3,928 |
7,094 |
0,000 |
| #2373 |
30 |
1,418 |
7,094 |
0,000 |
| #2373 |
60 |
1,421 |
7,094 |
0,000 |
| #2373 |
120 |
1,915 |
7,094 |
0,000 |
| Таблица 35 |
| Фермент |
Время реакции, |
Образование жирной кислоты |
Расход холестерина |
Образование эфира холестерина |
Гидролитическая активность, |
Трансферазная активность, |
 |
мин |
 |
 |
 |
% |
% |
| #179 |
30 |
0,238 |
1,334 |
2,229 |
20 |
80 |
| #179 |
60 |
0,319 |
1,725 |
2,883 |
21 |
79 |
| #179 |
120 |
0,343 |
2,195 |
3,667 |
18 |
82 |
| #2427 |
30 |
2,737 |
0,000 |
0,000 |
100 |
0 |
| #2427 |
60 |
2,887 |
0,000 |
0,000 |
100 |
0 |
| #2427 |
120 |
3,177 |
0,000 |
0,000 |
100 |
0 |
| #1991 |
30 |
2,338 |
0,000 |
0,000 |
100 |
0 |
| #1991 |
60 |
3,046 |
0,000 |
0,000 |
100 |
0 |
| #1991 |
120 |
3,395 |
0,000 |
0,000 |
100 |
0 |
| #2373 |
30 |
0,885 |
0,000 |
0,000 |
100 |
0 |
| #2373 |
60 |
0,888 |
0,000 |
0,000 |
100 |
0 |
| #2373 |
120 |
1,383 |
0,000 |
0,000 |
100 |
0 |
Заключение
В этих экспериментах наблюдалось, что все испытанные ферменты показали гидролитическую активность, поскольку количество жирной кислоты возрастало. Однако единственным ферментом, который показал трансферазную активность, был GCAT из A. salmonicida. Поэтому пришли к заключению, что в масляной системе с лецитином и холестерином, содержащей 6% воды, фосфолипаза А1 из Fusarium oxysporum, фосфолипаза А2 из поджелудочной железы и липаза из Candida antarctica проявляют только гидролитическую активность.
Все публикации, упомянутые в вышеприведенном описании настоящим включены в качестве ссылки. Различные модификации и вариации описанных способов и систем по настоящему изобретению должны быть ясны для специалистов без отклонения от объема и духа настоящего изобретения. Хотя настоящее изобретение было описано в связи с конкретными предпочтительными осуществлениями, должно быть понятно, что изобретение, как оно заявлено в формуле изобретения, не должно чрезмерно ограничиваться такими конкретными осуществлениями. Действительно, различные модификации описанных способов осуществления изобретения, которые очевидны для специалистов в биохимии и биотехнологии или в смежных областях, рассматриваются как находящиеся в рамках нижеследующей формулы изобретения.






Формула изобретения
1. Способ получения in situ эмульгатора в пищевом продукте, где способ включает стадию добавления к пищевому продукту липид-ацилтрансферазы, где липид-ацилтрансфераза характеризуется как фермент, способный переносить ацильную группу от липида к одному или к нескольким из акцепторов ацильной группы, и который включает фрагмент последовательности аминокислот GDSX, где Х представляет собой один или несколько из аминокислотных остатков L, А, V, I, F, Y, Н, Q, Т, N, М или S.
2. Способ по п.1, где образуются по меньшей мере 2 эмульгатора.
3. Способ по п.1, где эмульгатор образуется без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте.
4. Способ по п.1, где акцептором ацильной группы является стерол, станол, углевод, протеин или его субъединица, глицерин.
5. Способ по п.2, где по меньшей мере одним из эмульгаторов является эфир углевода.
6. Способ по п.2, где по меньшей мере одним из эмульгаторов является эфир протеина.
7. Способ по п.1, где одно или несколько соединений из числа эфира стерола, или эфира станола, или эфира протеина, или эфира углевода, или диглицерида, или моноглицерида получают in situ в пищевом продукте.
8. Способ по п.7, где эфир стерола является одним или несколькими соединениями из числа эфира альфа-ситостерола, эфира бета-ситостерола, эфира стигмастерола, эфира эргостерола, эфира кампестерола или эфира холестерина.
9. Способ по п.7, где эфир станола является одним или несколькими соединениями из числа эфира бета-ситостанола или ss-ситостанола.
10. Способ по п.1, где фермент липид-ацилтрансфераза включает Н-309 или включает гистидиновый остаток в положении, соответствующем His-309 в последовательности аминокислот липолитического фермента Aeromonas hydrophila, показанную как SEQ ID No. 2 или SEQ ID No. 32.
11. Способ по п.1, где липид-ацилтрансфераза может быть получена из организма, относящегося к одному или нескольким из следующих родов: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobacterium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mezorhizobium, Ralstonia, Xanthomonas и Candida.
12. Способ по п.1, где липид-ацилтрансфераза включает одну или несколько из следующих последовательностей аминокислот:
(i) последовательность аминокислот SEQ ID No. 2;
(ii) последовательность аминокислот SEQ ID No. 3;
(iii) последовательность аминокислот SEQ ID No. 4;
(iv) последовательность аминокислот SEQ ID No. 5;
(v) последовательность аминокислот SEQ ID No. 6;
(vi) последовательность аминокислот SEQ ID No. 12;
(vii) последовательность аминокислот SEQ ID No. 20;
(viii) последовательность аминокислот SEQ ID No. 22;
(ix) последовательность аминокислот SEQ ID No. 24;
(x) последовательность аминокислот SEQ ID No. 26;
(xi) последовательность аминокислот SEQ ID No. 28;
(xii) последовательность аминокислот SEQ ID No. 30;
(xiii) последовательность аминокислот SEQ ID No. 32;
(xiv) последовательность аминокислот SEQ ID No. 34;
или последовательность аминокислот, которая имеет 75% или более идентичности с любой из последовательностей, показанных как SEQ ID No. 2; SEQ ID No. 3; SEQ ID No. 4; SEQ ID No. 5; SEQ ID No. 6; SEQ ID No. 12; SEQ ID No. 20; SEQ ID No. 22; SEQ ID No. 24; SEQ ID No. 26; SEQ ID No. 28; SEQ ID No. 30; SEQ ID No. 32; или SEQ ID No. 34.
13. Способ по п.1, где эмульгатор представляет одно или несколько из следующих соединений: моноглицерид, лизофосфатидилхолин, DGMG.
14. Применение липид-ацилтрансферазы для получения из пищевого материала пищевого продукта, включающего эмульгатор, где эмульгатор получен без увеличения или без существенного увеличения содержания свободных жирных кислот в пищевом продукте, и где эмульгатор образован из составляющих пищевого материала посредством липид-ацилтрансферазы, где липид-ацилтрансфераза характеризуется как фермент, способный переносить ацильную группу от липида к одному или к нескольким из следующих акцепторов ацильной группы и включающий фрагмент последовательности аминокислот GDSX, где Х представляет собой один или несколько из аминокислотных остатков L, А, V, I, F, Y, Н, Q, Т, N, М или S.
15. Применение по п.14, где образуется по меньшей мере два эмульгатора.
16. Применение по п.15, где по меньшей мере одним из эмульгаторов является эфир углевода.
17. Применение по п.15, где по меньшей мере одним из эмульгаторов является эфир протеина.
18. Применение по п.14, где одно или несколько соединений из числа эфира стерола или эфира станола, или эфира протеина, или эфира углевода, или диглицерида, или моноглицерида также получено in situ в пищевом продукте.
19. Применение по п.18, где эфир стерола является одним или несколькими соединениями из числа эфира альфа-ситостерола, эфира бета-ситостерола, эфира стигмастерола, эфира эргостерола, эфира кампестерола или эфира холестерина.
20. Применение по п.18, где эфир станола является одним или несколькими соединениями из числа эфира бета-ситостанола или ss-ситостанола.
21. Применение по п.14, где фермент липид-ацилтрансфераза включает Н-309 или включает гистидиновый остаток в положении, соответствующем His-309 в последовательности аминокислот липолитического фермента Aeromonas hydrophila, показанную как SEQ ID No. 2 или SEQ ID No. 32.
22. Применение по п.14, где липид-ацилтрансфераза может быть получена из организма, относящегося к одному или нескольким из следующих родов: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobactrium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mezorhizobium, Ralstonia, Xanthomonas и Candida.
23. Применение по п.15, где липид-ацилтрансфераза включает одну или несколько из следующих последовательностей аминокислот:
(i) последовательность аминокислот SEQ ID No. 2;
(ii) последовательность аминокислот SEQ ID No. 3;
(iii) последовательность аминокислот SEQ ID No. 4;
(iv) последовательность аминокислот SEQ ID No. 5;
(v) последовательность аминокислот SEQ ID No. 6;
(vi) последовательность аминокислот SEQ ID No. 12;
(vii) последовательность аминокислот SEQ ID No. 20;
(viii) последовательность аминокислот SEQ ID No. 22;
(ix) последовательность аминокислот SEQ ID No. 24;
(x) последовательность аминокислот SEQ ID No. 26;
(xi) последовательность аминокислот SEQ ID No. 28;
(xii) последовательность аминокислот SEQ ID No. 30;
(xiii) последовательность аминокислот SEQ ID No. 32;
(xiv) последовательность аминокислот SEQ ID No. 34;
или последовательность аминокислот, которая имеет 75% или более идентичности с любой из последовательностей, показанных как SEQ ID No. 2; SEQ ID No. 3; SEQ ID No. 4; SEQ ID No. 5; SEQ ID No. 6; SEQ ID No. 12; SEQ ID No. 20; SEQ ID No. 22; SEQ ID No. 24; SEQ ID No. 26; SEQ ID No. 28; SEQ ID No. 30; SEQ ID No. 32; или SEQ ID No. 34.
24. Применение по п.14, где эмульгатор представляет собой одно или несколько из следующих соединений: моноглицерид, лизофосфатидилхолин, DGMG.
РИСУНКИ
|
|