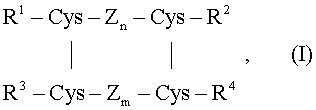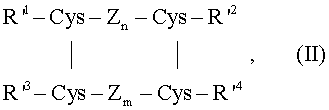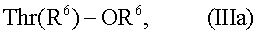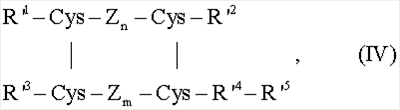Патент на изобретение №2376379
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ИНСУЛИНОВЫХ СОЕДИНЕНИЙ
(57) Реферат:
Изобретение относится к области биотехнологии и может быть использовано для получения инсулиновых соединений. В растворителе, содержащем от 55% до 70% воды (мас./мас.), предшественник инсулина или предшественник производного инсулина подвергают ферментативному расщеплению при щелочных значениях рН. При ферментативном расщеплении используют трипсин или лизилспецифичную протеазу, предпочтительно Achromobacter lyticus протеазу I. Затем без выделения промежуточного продукта из реакционной смеси к указанному промежуточному продукту ферментативно присоединяют нуклеофильное соединение, представляющее собой эфир аминокислоты, амид аминокислоты, пептид, эфир пептида или амид пептида в реакционной смеси, имеющей содержание воды в интервале от 10% до 50% воды (мас./мас.), при кислых значениях рН, близких к нейтральному значению рН. При необходимости производят удаление защитных(ой) групп(ы). Изобретение позволяет получить инсулиновое соединение из его предшественника эффективным усовершенствованным способом. 2 н. и 22 з.п. ф-лы.
Настоящее изобретение относится к усовершенствованному способу превращения предшественника инсулина в инсулин, необязательно через эфир инсулина. ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ Инсулин представляет собой гормон поджелудочной железы, принимающий участие в регуляции концентрации глюкозы в крови. Например, больным инсулинзависимым сахарным диабетом для контроля за концентрацией глюкозы в крови назначают инсулин человека, свиньи, быка, аналоги инсулина и смешанные инсулины. Инсулин свиньи или быка обычно получают из поджелудочной железы. Инсулин человека может быть получен полусинтетически из инсулина свиньи. Альтернативно, инсулин человека, так же как и многие аналоги инсулина, может быть получен с помощью генной инженерии. Методом генной инженерии, который может быть, например, осуществлен на бактериях или дрожжах, получаемый предшественник инсулина впоследствии превращается в желаемый продукт. Это превращение может быть выполнено различными способами. Один вариант представляет собой так называемое транспептидирование, при котором расщепление пептида и соединение пептида происходит последовательно в одной и той же реакционной смеси, при тех же условиях реакции, см., например, патент США Другой вариант представляет собой на первой стадии расщепление предшественника инсулина, см., например, Hoppe-Seyler’s Z. Physiol. Chem. 359 (1978), 799, затем выделение промежуточного продукта, а затем проведение желаемого взаимодействия с реакционной смесью, отличной от используемой на первой стадии, см., например, Nature 280 (1979), 412. В соответствии с EP 87238, реакцию транспептидирования проводят в системе растворителей, содержащей примерно от 75% до 97% (об/об, по меньшей мере, один неводный смешивающийся с реакционной смесью растворитель, включающий в себя, по меньшей мере, около 50% (об/об) бутан-1,4-диола. В соответствии с US 4579820, процесс транспептидирования проводят с использованием фермента L-специфичной сериновой карбоксипептидазы, например карбоксипептидазы Y. В соответствии с US 4601979 (Nordisk Insulinlaboratorium), транспептидирование или только пептидное взаимодействие проводят в водной реакционной среде, по существу свободной от органического растворителя. В соответствии с WO 83/00504 (Nordisk Insulinlaboratorium), свиной продукт обрабатывали карбоксипептидазой А, полученный в результате дез-аланин-В30 инсулиновый продукт суспендировали в низшем спирте и эту суспензию смешивали с раствором эфира L-треонина и трипсина. Во всех отдельных примерах выделяли дез-аланин-В30 инсулиновый продукт либо с помощью сушки вымораживанием, либо осаждением. Целью данного изобретения является устранение или уменьшение, по меньшей мере, некоторых недостатков предшествующего уровня техники. Следовательно, не все более подробно описанные недостатки, указанные ниже, могут быть полностью устранены или уменьшены. ОПРЕДЕЛЕНИЯ Используемый здесь термин “аминокислота” относится к аминокислотам, которые могут быть закодированы нуклеотидными последовательностями. Аналогично, это применяется к выражению аминокислотный остаток, представляющий собой аминокислоту, у которой из карбоксильной группы была удалена гидроксигруппа и/или из аминогруппы был удален водород. Сходным образом, выражения пептид и пептидный остаток состоят из остатков аминокислот. Предпочтительно, пептид содержит не более 10 аминокислотных остатков. Используемое здесь выражение амид аминокислоты относится к аминокислоте, имеющей необязательно замещенную С-концевую карбоксамидную группу. Используемое здесь выражение амид пептида относится к пептиду, имеющему необязательно замещенную С-концевую карбоксамидную группу. Используемое здесь выражение “предшественник инсулина” относится к полипептиду, состоящему из двух пептидных цепей (соответствующих А и В цепям инсулина, и в дальнейшем обозначенные А и В цепями) которые, подобно инсулину, соединены друг с другом двумя дисульфидными мостиками (от одного остатка цистеина (Cys) к другому остатку цистеина) между двумя пептидными цепями, и где, как в инсулине, существует дисульфидный мостик от одного остатка цистеина в цепи А до другого остатка цистеина в цепи А. У этого предшественника инсулина имеется, по меньшей мере, один остаток лизина или аргинина в В цепи. Необязательно, в этом предшественнике инсулина цепи А и В соединены друг с другом через третью пептидную цепь (соответствующую соединительному пептиду в инсулине) между С-концом В цепи и N-концом А цепи. В том случае, когда А и В цепи соединены друг с другом через эту третью пептидную цепь, на С-конце третьего пептида присутствует лизин. Необязательно, в этом предшественнике инсулина с N-концом В цепи может быть соединена четвертая пептидная цепь. В том случае, когда эта четвертая пептидная цепь соединена с N-концом В цепи, на С-конце четвертой пептидной цепи присутствует лизин. Более того, в этом предшественнике инсулина идентичность аминокислотных остатков инсулину человека составляет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 90% и еще более предпочтительно, по меньшей мере, 95%, при условии, что третья и четвертая пептидные цепи не принимаются во внимание для этих подсчетов. В инсулине человека имеются дисульфидные мостики между CysA6 и CysA11, между CysA7 и CysB7 и между CysA20 и CysB19 и лизин в положении B29. Используемое здесь выражение “эфир аминокислоты” относится к аминокислоте, несущей С-концевую защищенную карбоксильную группу и, необязательно, защищенную гидроксильную группу. Используемое здесь выражение “эфир пептида” относится к пептиду, в котором, по меньшей мере, С-концевая карбоксильная группа несет защищенную карбоксильную группу. Необязательно, любая гидроксильная группа защищена и, необязательно, Используемый здесь термин “нуклеофильное соединение” относится к эфиру аминокислоты, амиду аминокислоты, пептиду, эфиру пептида и амиду пептида. В любом из этих эфиров аминокислот, амидов аминокислот, пептидов, эфиров пептидов и амидов пептидов, аминогруппа в любой группе лизина необязательно модифицирована, предпочтительно гидрофобной группой, например ацильной группой, имеющей, по меньшей мере, 10 атомов углерода. Используемое здесь выражение “инсулиновое соединение” относится к инсулину любых видов, таких как свиной инсулин, бычий инсулин, инсулин человека и их соли, такие как цинковые соли и протаминовые соли. Более того, используемое здесь выражение “инсулиновое соединение” относится к тому, что кратко могло быть названо “аналоги инсулина”. Аналоги инсулина, используемые здесь, относятся к инсулиновым соединениям, в которых один или более аминокислотных остатков были заменены другими аминокислотными остатками и/или из которых один или более аминокислотных остатков был удален, и/или к которым один или более аминокислотных остатков был добавлен, при условии, что указанный аналог инсулина имеет достаточную инсулиновую активность. Примеры аналогов инсулина описаны в следующих патентах и эквивалентах к ним: US 5618913; EP 254516; EP 280534; US 5750497; и US 6011007. Примерами отдельных аналогов инсулина являются инсулин-аспарт (т.е. [AspB28] инсулин человека), инсулин-лизпро (т.е. [LysB28ProB29] инсулин человека) и инсулин-гларгин (т.е. [GlyA21,ArgB31,ArgB32] инсулин человека). Используемое здесь выражение “аналог инсулина” также охватывает то, что могло быть названо производными инсулина, т.е. соединения, которые специалист в данной области в целом может рассматривать как производные инсулина, см. основные руководства, например инсулин, содержащий заместитель, отсутствующий в исходной молекуле инсулина. Примерами производных инсулина являются инсулины или аналоги инсулина, имеющие необязательно замещенную карбоксамидную группу. Также соединения, которые могут рассматриваться и как производные инсулина, и как аналоги инсулина, здесь охвачены выражением «аналог инсулина». Примеры таких соединений описаны в следующих патентах и эквивалентах к ним: US 5750497 и US 6011007. Следовательно, дополнительным примером аналога инсулина является инсулин-детемир (т.е. дез-ThrB30 инсулин человека Используемый здесь термин «значение рН» относится к значению, измеренному с помощью рН-метра путем погружения каломельного комбинированного стеклянного электрода, соединенного с рН-метром, непосредственно в раствор, в котором измеряют значение рН. рН-Метр калибруют водным стандартным буфером. ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ SEQ ID NO.: 1 представляет собой часть пептидной молекулы Glu-{Glu-Ala)3-Pro-Lys-; SEQ ID NO.: 2 представляет собой часть пептидной молекулы Glu-Glu-Gly-Glu-Pro-Lys-; и SEQ ID NO.: 3 представляет собой часть пептидной молекулы Gly-Phe-Phe-Tyr-Thr-Lys-Pro-Thr. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Настоящее изобретение относится к способу получения инсулиновых соединений. Эти инсулиновые соединения могут быть использованы в качестве лекарственных средств. В предпочтительном варианте осуществления данного изобретения получают соединения инсулина, имеющие треонин (Thr) на С-конце В цепи. Любой специалист в данной области, например врач, способен определить, какие дозы инсулиновых соединений назначить больному диабетом и когда. Исходным веществом для способа по данному изобретению является предшественник инсулина, который подвергают как пептидному расщеплению, так и пептидному сшиванию в условиях, благоприятных для обеих реакций, но где не имеет места выделение промежуточного продукта. Другими словами, предшественник инсулина подвергается пептидному расщеплению, и полученный в результате продукт, т.е. промежуточный продукт, подвергают пептидному сшиванию. Условия, благоприятные для расщепления пептидных связей, неидентичны условиям, благоприятным для пептидного сшивания. Следовательно, на первой стадии данного изобретения, т.е. стадии расщепления, или реакции расщепления, условия для проведения реакции в реакционной смеси выбирают таким образом, чтобы они были благоприятными для расщепления пептидных связей, и на второй стадии данного изобретения, т.е. стадии присоединения, или реакции присоединения, условия для проведения реакции в реакционной смеси изменены таким образом, чтобы они были благоприятны для образования связи. В одном предпочтительном варианте осуществления данного изобретения предшественник инсулина на первой стадии растворяют в преимущественно водной среде и добавляют фермент, используемый для расщепления. Эта реакционная смесь может не содержать или по существу не содержать органический растворитель. Альтернативно, реакционная смесь может содержать определенное количество органического растворителя, который может обеспечить соответствующую растворимость предшественника инсулина. Однако нежелательно использовать органический растворитель в количестве, которое может нежелательным образом повлиять на ферментативное расщепление. На первой стадии способа по данному изобретению параметры реакции, такие как значение рН, температура и время, выбирают таким образом, чтобы они были благоприятны для расщепления по остатку(ам) лизина или остатку(ам) аргинина. Когда реакция расщепления прошла до определенной, желаемой степени, с реакционной смесью смешивают нуклеофильное соединение и органический растворитель (без предварительного выделения промежуточного продукта), таким образом, чтобы происходило взаимодействие нуклеофильного вещества с остатком лизина или аргинина желаемого промежуточного продукта. На этой стадии параметры реакции устанавливают таким образом, чтобы они подходили для реакции присоединения. В предпочтительном варианте осуществления изобретения нуклеофильное вещество представляет собой эфир аминокислоты, например эфир треонина или эфир пептида. Впоследствии защитная группа(ы), если требуется, могут быть удалены из полученного в результате вещества. По сравнению с известной реакцией транспептидирования преимущества, полученные при использовании способа по данному изобретению, состоят в более коротком суммарном времени протекания реакции с тем же количеством фермента и сходным или более высоким выходом. По сравнению с реакцией, проводимой в двух реакторах с расщеплением в водной среде, выделением промежуточного продукта и проведения присоединения в смеси органического растворителя и воды, преимущества, полученные способом по данному изобретению, состоят в более коротком суммарном времени протекания реакции, использовании меньшего количества фермента и более легком протекании процесса. Более точно, данное изобретение относится к следующим вариантам осуществления. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Как видно из пункта 1, сначала происходит расщепление пептидных связей, а затем происходит реакция присоединения. Вкратце, реакцию расщепления (т.е. ферментативное расщепление) проводят следующим образом. Ферментативное расщепление предшественника инсулина (т.е. пептидное расщепление) происходит в реакционной смеси, содержащей, по меньшей мере, около 55%, предпочтительно, по меньшей мере, около 60%, более предпочтительно, по меньшей мере, 70% воды (мас./мас.). В предпочтительном варианте осуществления данного изобретения концентрация предшественника инсулина в реакционной смеси, где происходит ферментативное расщепление, составляет, по меньшей мере, 2%, предпочтительно в интервале примерно от 5 до 10% (масса/объем). Реакцию расщепления проводят в нейтральной или щелочной среде, предпочтительно имеющей значение рН в интервале примерно от 6 до 11, более предпочтительно в интервале примерно от 8 до 10. В предпочтительном варианте осуществления данного изобретения количество фермента по сравнению с количеством предшественника инсулина находится в интервале приблизительно от 0,05 до, приблизительно, 5% (мас./мас.), предпочтительно приблизительно от 0,1 до, приблизительно, 2%. Неважно, какой тип трипсинового фермента используют в данном изобретении. Трипсин представляет собой хорошо охарактеризованный фермент, доступный в высокой степени очистки, особенно бычьего или свиного происхождения. Из микробного источника может быть получена протеаза I Acromobacter lyticus (здесь и далее обозначенная ALP). Более того, ферментная форма, нативный ли это фермент или активный иммобилизованный фермент или производное фермента, не является веществом для осуществления данного изобретения. Если необходимо расщепление по карбоксильной группе аргинина, может быть использован трипсин, если необходимо расщепление по карбоксильной группе лизина, может быть использован либо трипсин, либо ALP. Для расщепления по карбоксильной группе лизина предпочтительным является ALP. В качестве примеров активных производных фермента могут быть упомянуты ацетилированный трипсин, сукцинилированный трипсин, трипсин, обработанный глутаровым альдегидом, и иммобилизованный трипсин или производные ALP. При использовании иммобилизованного трипсина или ALP он может быть суспендирован в реакционной смеси или им может быть заполнена колонка. В большой степени действие фермента контролируется соотношением содержания воды и растворителя, значением рН и температурой реакции. Повышение концентрации органического растворителя в реакционной смеси и снижение значения рН приблизительно до нейтрального сдвигает обычную ферментативную реакцию от расщепления в сторону взаимодействия. Понижение температуры снижает скорость реакции, но также может уменьшить образование побочного продукта и денатурацию фермента. В предпочтительном варианте осуществления данного изобретения предшественник инсулина растворяют в водной среде, имеющей концентрацию ацетатных ионов в интервале примерно от 5 мМ до 500 мМ, предпочтительно в интервале примерно от 20 мМ до 200 мМ. Например, могут быть использованы ацетат натрия, калия, аммония или ацетат триэтиламмония. В соответствии с одним вариантом осуществления данного изобретения предшественник инсулина (являющийся пептидом) может быть представлен следующей общей формулой I:
где Zn и Zm независимо друг от друга представляют две пептидные части молекулы, каждая содержащая n и m аминокислотных остатков соответственно, R1 представляет пептидный остаток, который необязательно содержит остаток лизина или аргинина, R2 представляет аминокислотный остаток или пептидный остаток, R3 представляет пептидный остаток, который необязательно содержит остаток лизина или аргинина, R4 представляет остаток лизина или аргинина или остаток пептида, который содержит остаток лизина или аргинина, или R1 и R4 вместе представляют собой пептидный остаток, содержащий остаток лизина или аргинина, две вертикальные линии показывают дисульфидные связи между двумя остатками цистеина и, кроме того, существует дисульфидная связь между двумя остатками цистеина, находящимися в R1 и в Zn. Предпочтительно, аминокислотные остатки, находящиеся в предшественнике инсулина формулы I, представляют собой те, которые могут быть закодированы нуклеотидными последовательностями. В соответствии с предпочтительным вариантом осуществления изобретения используют предшественник инсулина, у которого число аминокислотных остатков в R1 и R4 вместе находится в диапазоне примерно от 8 до 50. В другом предпочтительном варианте осуществления данного изобретения Zn содержит 12 аминокислотных остатков. В другом предпочтительном варианте осуществления данного изобретения Zm содержит 11 аминокислотных остатков. В другом предпочтительном варианте осуществления данного изобретения R2 содержит 1 аминокислотный остаток. Например, Asn или Gly. В другом предпочтительном варианте осуществления данного изобретения R3 содержит 6 аминокислотных остатков. В предпочтительном варианте осуществления данного изобретения предшественник инсулина представляет собой предшественник с одной цепью, т.е. соединение формулы (I), где R1 и R4 вместе представляют собой пептидный остаток, содержащий остаток лизина или аргинина. Следовательно, предпочтительно, предшественник инсулина представляет собой инсулин, отличный от инсулина млекопитающих, такого как свиной инсулин, кроличий инсулин, инсулин собаки или инсулин кита. В соответствии с другим вариантом осуществления данного изобретения предшественник инсулина формулы I содержит те же аминокислотные остатки в положениях с A1 по A21 и в положениях с B1 по B29, которые присутствуют в инсулине человека в тех же положениях. В соответствии с другим вариантом осуществления изобретения предшественник инсулина формулы I содержит те же аминокислотные остатки в положениях с А1 по А21 и в положениях с В1 по В29 при условии, что аминокислотный остаток в положении В28 представляет собой Asp. В соответствии с другим вариантом осуществления изобретения предшественник инсулина формулы I содержит те же самые аминокислотные остатки в положениях с A1 по A21 и в положениях с B1 по B29, которые присутствуют в инсулине человека в тех же положениях, при условии, что аминокислотный остаток в положении B28 представляет собой Lys, а аминокислотный остаток в положении B29 представляет собой Pro. В соответствии с другим вариантом осуществления изобретения предшественник инсулина формулы I содержит те же самые аминокислотные остатки в положениях с A1 по A21 и в положениях с B1 по B29, которые присутствуют в инсулине человека в тех же положениях, при условии, что аминокислотный остаток в положении A21 представляет собой Gly, а аминокислотные остатки в положениях B31 и B32 оба представляют собой Arg. Примерами отдельных предшественников инсулина, которые могут быть использованы в способе по настоящему изобретению, являются проинсулин человека; проинсулин обезьяны; [Ala31,Lys32]-дез{33-63) проинсулин свиньи; проинсулин свиньи; [Asp28]-дез(30-65) проинсулин человека, удлиненный на N-конце Glu-(Gtu-Ala)3-Pro-Lys- (SEQ ID NO.:1); и [Asp28,Met30,Trp31,Lys32]-дез(33-65) проинсулин человека, удлиненный на N-конце Glu-Glu-Gly-Glu-Pro-Lys- (SEQ ID N 2). Предшественники инсулина формулы I могут быть получены, как описано или аналогично тому, как описано в международных заявках, опубликованных под номерами WO 01/49742, WO 01/49870, WO 01/079250, и WO 02/079254, содержание которых включено здесь в качестве ссылки. Желаемый промежуточный продукт (т.е. целевой продукт расщепления) соответствует предшественнику инсулина, где, по меньшей мере, один остаток лизина или аргинина был отщеплен с образованием лизильного или аргинильного радикала, соответственно. Кроме того, в желаемом промежуточном продукте цепи А и В, соединенные друг с другом через два дисульфидных мостика, не соединены друг с другом через пептидную цепь между С-концом В цепи и N-концом А цепи. В предпочтительном варианте осуществления данного изобретения, число аминокислотных остатков, присутствующих в желаемом промежуточном продукте, находится в интервале примерно от 48 до 52, предпочтительно в интервале примерно от 49 до 51, еще более предпочтительно 50. В другом предпочтительном варианте осуществления данного изобретения в желаемом промежуточном продукте присутствует не более 4, предпочтительно не более 3, более предпочтительно не более 2 и еще более предпочтительно не более 1 аминокислотных остатков, которые отсутствуют в соответствующих положениях инсулина человека. В соответствии с одним вариантом осуществления данного изобретения желаемый промежуточный продукт (желаемый продукт расщепления) может быть представлен общей формулой II
где Zn и Zm независимо друг от друга представляют две пептидные части молекулы, каждая содержащая n и m аминокислотных остатков соответственно, R’1 представляет пептидный остаток, R’2 представляет аминокислотный остаток или пептидный остаток, R’3 представляет пептидный остаток, R’4 представляет остаток лизина или аргинина, или пептида, содержащий остаток лизина или аргинина на С-конце, две вертикальные линии указывают на дисульфидную связь между двумя остатками цистеина и, кроме того, существует дисульфидная связь между двумя остатками цистеина, присутствующими в R’1 и в Zn. В предпочтительном варианте осуществления настоящего изобретения R’1 представляет собой аминокислотные остатки с A1 по A6 в инсулине человека в таком порядке, где необязательно один или два аминокислотных остатка могут быть заменены другим аминокислотным остатком или где один или два аминокислотных остатка отсутствуют. В другом предпочтительном варианте осуществления данного изобретения R’2 представляет собой -Asn или -Gly. В другом предпочтительном варианте осуществления данного изобретения R’3 представляет собой аминокислотные остатки с B1 по B6 в инсулине человека в таком порядке, где необязательно один или два аминокислотных остатка могут быть заменены другим аминокислотным остатком или где один или два аминокислотных остатка отсутствуют. В другом предпочтительном варианте осуществления данного изобретения R’4 аминокислотные остатки с B20 по B29 в инсулине человека по порядку, при условии, что в положении В28 находится Asp, а в положении В29 находится Lys, и аминокислотные остатки с В20 по В28 в инсулине человека по порядку при условии, что в положении В28 находится Lys, в каждом из которых, необязательно, один или два аминокислотных остатка могут быть заменены другим аминокислотным остатком или где один или два аминокислотных остатка отсутствуют, или где часть любого из этих пептидных остатков не содержит один или несколько смежных С-концевых аминокислотных остатков. В другом предпочтительном варианте осуществления данного изобретения Zn представляет собой аминокислотные остатки с А8 по А19 в инсулине человека в таком порядке, где необязательно один или два аминокислотных остатка заменяются другим аминокислотным остатком или где один или два аминокислотных остатков не присутствуют. В другом предпочтительном варианте осуществления изобретения Zm представляет собой аминокислотные остатки с B8 по B18 инсулина человека в таком порядке, где необязательно один или два аминокислотных остатков заменяются другим аминокислотным остатком или где один или два аминокислотных остатка не присутствуют. В течение как реакции расщепления, так и реакции присоединения температура реакции находится в интервале от точки замерзания реакционной смеси примерно до 50°C. Предпочтительная температура находится в интервале примерно от 0°С примерно до 25°C. Вкратце, реакция взаимодействия проводится следующим образом. При расщеплении, по меньшей мере, примерно 25%, предпочтительно, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 75%, предпочтительно, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 95%, предшественника инсулина до желаемого промежуточного продукта нуклеофильное вещество, с одной стороны, и органический растворитель, с другой стороны, смешивают с реакционной смесью, в которой происходило расщепление, таким образом, чтобы получить условия реакции, которые подходят или благоприятствуют стадии взаимодействия. Процент расщепления (конверсии) основан на равновесии, возможном в реакционной смеси, используемой для расщепления. Обычно, с начала реакции ферментативного расщепления и до истечения определенного периода времени, выход желаемого промежуточного продукта, т.е. желаемый продукт расщепления, увеличивается и достигает максимальной концентрации. В последствии, концентрация желаемого продукта расщепления может снижаться. В предпочтительном варианте осуществления данного изобретения из реакционной смеси не удаляют компоненты, образовавшиеся в результате реакции расщепления до того, как произойдет реакция присоединения. Простой способ осуществления этого заключается в добавлении после реакции расщепления нуклеофильного вещества и достаточного количества органического растворителя. В этом способе, например, фермент, используемый на стадии расщепления, также используется на стадии присоединения. Способ по данному изобретению также охватывает реакции присоединения в реакционной смеси, которая кроме желаемого промежуточного продукта содержит небольшое количество частично расщепленного предшественника инсулина и/или непрореагировавшего предшественника инсулина. В другом предпочтительном варианте осуществления данного изобретения нуклеофильное вещество представляет собой амид аминокислоты или амид пептида, где карбоксамидная группа является незамещенной или моно- или дизамещенной алкильной группой с не более 16 атомами углерода, эта алкильная группа(ы), вместе со смежным атомом азота, может образовать кольцо или карбоксамидная группа является моно- или дизамещенной арильной группой. Предпочтительными являются алифатические заместители. Примерами замещенных карбоксамидных групп являются N,N-диметилкарбоксамид, N,N-диэтилкарбоксамид и N-гексилкарбоксамид. В предпочтительном варианте осуществления данного изобретения нуклеофильное соединение представляет собой эфир аминокислоты, где карбоксильная группа защищена и любая гидроксигруппа необязательно защищена. Еще в одном предпочтительном варианте осуществления изобретения нуклеофильное соединение представляет собой эфир треонина, где карбоксильная группа защищена и необязательно защищена гидроксильная группа. Следовательно, эфир L-треонина может быть представлен следующей общей формулой IIIa:
где R6 представляет защитную группу карбоксила и R5 представляет водород или защитную группу гидроксила. Для большей ясности, эфир треонина может быть проиллюстрирован общей формулой CH3-C(OR5)-CH(NH2)COOR6, где R5 и R6 определены выше. Известно несколько нуклеофильных соединений и остальные нуклеофильные соединения могут быть получены по аналогии с получением известных соединений или по аналогии с известными способами. Нуклеофильные соединения могут быть использованы в виде свободного основания или их растворимых солей, таких как гидрохлориды, ацетаты, пропионаты и бутираты. Когда начинается реакция присоединения, желательно, чтобы в растворе взаимодействующей реакционной смеси присутствовал значительный избыток нуклеофильного соединения, с молярным соотношением между нуклеофильным соединением и желаемым промежуточным продуктом, предпочтительно превышающим 5:1. В начале реакции присоединения концентрация нуклеофильного соединения в реакционной смеси предпочтительно должно превышать 0,1 М, наивысшую концентрацию, допускающую растворимость. Для получения 60% выхода, предполагаемого здесь как важный аспект для практического применения данного изобретения, температура реакции, содержание воды и значение рН взаимосвязаны в описанных интервалах. Органические растворители, подходящие для применения в данном изобретении, представляют собой полярные растворители, которые смешиваются с водой и предпочтительно такие, которые способны содержать высокие концентрации желаемого промежуточного продукта (например формулы II) и нуклеофильного соединения. Примерами подходящих органических растворителей являются апротонные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон-2 и диметилсульфоксид, и протонные растворители, такие как уксусная кислота, этиловый спирт, метиловый спирт, 2-пропанол, 1-пропанол, бутанол и 1,4-бутандиол. Также могут быть использованы диоксан, ацетон, тетрагидрофуран, формамид и ацетонитрил, и даже эфир аминокислоты, используемый в качестве нуклеофильного соединения, может полностью или частично быть использован в качестве органического растворителя. Природа растворителя влияет на систему в целом, и взаимосвязи, подходящие для одного растворителя, производящие высокие выходы, могут не использоваться с другими растворителями. Наилучшие выходы были получены с апротонными растворителями, и апротонные растворители являются наиболее предпочтительными для практической реализации данного изобретения. Очевидно, при подсчете или определении содержания воды в реакционной смеси нуклеофильное соединение рассматривают как органический растворитель. Добавление кислоты, такой как соляная кислота, муравьиная кислота, уксусная кислота, пропионовая кислота или масляная кислота, или основания, такого как пиридин, ТРИС, N-метилморфолин, триэтиламин или N-этилморфолин, является необязательным. Их включают в реакционную смесь для достижения подходящего значения рН. Хотя в практическом применении настоящего изобретения могут быть использованы минеральные кислоты или основания, предпочтительными являются органические кислоты и основания, в частности обозначенные выше. Наиболее предпочтительны органические кислоты. В начале реакции присоединения массовое соотношение между трипсином или ALP (в расчете на кристаллический трипсин или ALP или соответствующее этому количество производного трипсина или ALP) и желаемым промежуточным продуктом в реакционной смеси предпочтительно находится в ряду примерно от 1:1000 примерно до 1:10, более предпочтительно в ряду примерно от 1:200 примерно до 1:50. В некоторых случаях, фермента, добавленного на стадии расщепления, достаточно для проведения реакции присоединения, и в этом случае нет необходимости добавлять дополнительное количество фермента на протяжении стадии присоединения. В других случаях на стадии присоединения может потребоваться добавление дополнительного количества фермента. Поскольку высокие концентрации желаемого промежуточного продукта и нуклеофильного соединения в растворе способствуют высокой скорости превращения, выбор растворителя необъективно направлен на те растворители, в которых реагенты растворимы в высокой степени. Особенно важна растворимость нуклеофильного соединения, поскольку этот реагент должен присутствовать в высокой концентрации. В начале реакции присоединения молярное отношение нуклеофильного соединения к желаемому промежуточному продукту предпочтительно должно превышать 5:1, предпочтительно превышать 50:1. В начале реакции присоединения концентрация нуклеофильного соединения в реакционной смеси предпочтительно составляет, по меньшей мере, 0,1 М. В предпочтительном варианте осуществления данного изобретения используют нуклеофильное соединение, имеющее защитную группу(ы) по карбоксильной группе, которые могут быть удалены из полученного в результате инсулинового соединения в условиях, не вызывающих существенных необратимых изменений в молекуле инсулина. В качестве примера таких защитных групп карбоксила могут быть упомянуты низший алкил, например метил, этил и трет-бутил, замещенные бензильные группы, такие как п-метоксибензил, дифенилметил и 2,4,6-триметилбензил, и группы общей формулы -СН2-СН2-SO2R7, где R7 представляет низший алкил, такой как метил, этил, пропил и н-бутил. Подходящими защитными группами гидроксила являются те, которые могут быть удалены в условиях, не вызывающих значительных необратимых изменений в молекуле инсулина. В качестве примера такой группы может быть упомянут трет-бутил. Кроме того, обычно используемые защитные группы описаны Wunch: Metoden der Organischen Chemie (Houben-Weyl), Vol. XV/1, editor: Eugen Muller, Georg Thieme Verlag, Stuttgart 1974. В соответствии с одним вариантом осуществления данного изобретения, в результате осуществления способа по данному изобретению образуется соединение общей формулы IV: где Zn и Zm независимо друг от друга представляют две пептидные части молекулы, каждая содержащая n и m аминокислотных остатков, соответственно, R’1 представляет пептидный остаток, R’2 представляет аминокислотный остаток или пептидный остаток, R’3 представляет пептидный остаток, R’4 упомянут выше и R’6 представляет собой аминокислоту, несущую по карбоксилу защитную группу или пептидный остаток, необязательно несущий защитную группу карбоксила. Любая защитная группа карбоксила (например R6) и любая защитная группа гидроксила (например R5), присутствующая в инсулиновых соединениях, может быть удалена известными способами или способами, известными по существу. В том случае, когда защитная группа представляет собой метил, этил или группу общей формулы -CH2-CH2-SO2R7, где R7 определен выше, указанная защитная группа может быть удалена в слабощелочных условиях в водной среде, предпочтительно при значении рН в интервале примерно от 8 примерно до 12, например примерно при 9,5. В качестве основания могут быть использованы сильные основания, например третичный амин, например триэтиламин, гидроксиды щелочноземельных металлов, такие как гидроксид кальция или магния. В случае, когда карбоксильная защитная группа представляет собой трет-бутил, замещенный бензил, как например п-метоксибензил или 2,4,6-триметилбензил или дифенилметил, указанная группа может быть удалена ацидолизом, предпочтительно с помощью трифторуксусной кислоты. Трифторуксусная кислота может быть безводной или может содержать некоторое количество воды, или она может быть разбавлена органическим растворителем, таким как дихлорметан. В случае, когда гидроксильная защитная группа (например R5) представляет собой трет-бутил, указанная группа может быть удалена с помощью ацидолиза, см. выше. Предпочтительно, полученные инсулиновые соединения не имеют защитную группу гидроксила. В предпочтительном варианте осуществления изобретения способом по настоящему изобретению предшественник инсулина (например, формулы I) превращается в инсулиновое соединение (например, формулы IV), имеющее защитную группу карбоксила на С-конце аминокислотного остатка в В цепи, которая затем может быть удалена с образованием инсулинового соединения, не имеющего защитной группы карбоксила. При выборе условий реакции в соответствии с вышеуказанными объяснениями и, принимая во внимание результаты, полученные в следующих примерах, возможно получить выход инсулинового соединения выше 60%, и даже выше 80% и при определенных предпочтительных условиях выше 90%. Способом по настоящему изобретению могут быть получены инсулиновые соединения приемлемой чистоты и, если требуется, дополнительно очищены для терапевтического назначения. Более конкретно, инсулин-аспарт может, например, быть получен ферментативным расщеплением с помощью ALP предшественника инсулина, такого как [Asp28]-дез(30-65) проинсулин человека, удлиненного на N-конце Glu-(Giu-Ala)3-Pro-Lys- (SEQ ID NO.: 1), и взаимодействием с нуклеофильным соединением, таким как метиловый эфир L-треонина с последующим гидролизом. Инсулин-лизпро может быть, например, получен ферментативным расщеплением предшественника, такого как свиной инсулин, с помощью трипсина и взаимодействием с нуклеофильным соединением, таким как Gly-Phe-Phe-Tyr-Thr-Lys-Pro-Thr (SEQ ID NO.: 3). Инсулин-гларгин, например, может быть получен ферментативным расщеплением предшественника инсулина, такого как [Gly86]-дез(30-65) проинсулина человека, с помощью ALP и взаимодействием с нуклеофильным соединением, таким как Thr-Arg-Arg-OMe, с последующим гидролизом. Используемые здесь аббревиатуры соответствуют правилам, принятым (1974) ИЮПАК-ИЮБ Комиссией по биохимической номенклатуре, см. Collected Tentative Rules & Recommendations of the Commission on Biochemical Nomenclature IUPAC-IUB, 2nd edition, Maryland 1975. Упоминание здесь ссылок не признается составляющим предшествующий уровень техники. Здесь слово “содержать” имеет широкое значение “включать в себя”, “заключать в себе” или “содержать в себе” (см. руководство ЕРО С 4.13). Следующие примеры предложены с целью иллюстрации, не ограничения. Пример 1 200 мг [Ala31, Lys32]-дез(33-63) проинсулина свиньи суспендировали в 1,35 мл воды и значение рН доводили до 9 с помощью 10 мкл триэтиламина. При слабом перемешивании добавляли смесь 375 мкл N,N-диметилацетамида и 460 мкл воды и к полученному в результате раствору добавляли 315 мкл 5,4 мг/мл водного раствора Achromobacter lyticus лизил специфичной протеазы (ЕС 3.4.21.50) (обозначенная здесь ALP). Значение рН доводили до 9,8 с помощью 20 мкл триэтиламина и реакционный раствор, содержащий 78% воды, оставляли на 1 час при 23°С. Реакционный раствор подкисляли добавлением 70 мкл 4 н соляной кислоты и охлаждали в ледяной бане. Добавляли раствор 300 мг метилового эфира L-треонина в 4,85 мл N,N-диметилацетамида и значение рН доводили до 6,5 добавлением 450 мкл 4 н соляной кислоты. Реакционный раствор, содержащий 32% воды, оставляли на 4 часа при 23°С, после чего реакцию останавливали добавлением соляной кислоты до значения рН<3. С помощью ВЭЖХ анализа с обращенной фазой на колонке 4 мм × 250 мм 5 мкм С18 с диоксидом кремния с элюентом этанол-вода, содержащим 0,125 М сульфата аммония, доведенным до значения рН 4, после общего времени реакции 5 часов был установлен 86% выход превращения в метиловый эфир инсулина человека. Для сравнения провели одноэтапное превращение: 100 мг [Ala31, Lys32]-дез(33-63) проинсулина свиньи суспендировали в смеси 887 мкл воды и 175 мкл N,N-диметилацетамида. 150 мг метилового эфира L-треонина растворяли в 2,265 мл N,N-диметилацетамида и медленно добавляли к охлажденной льдом смеси. Значение рН доводили до 6,5 с помощью 340 мкл уксусной кислоты и добавляли 158 мкл 5,4 мг/мл водного раствора ALP. Реакцию превращения контролировали с помощью ВЭЖХ-ОФ анализа подкисленных образцов. Через 5 часов было установлено 53% превращение в метиловый эфир инсулина человека, и через 24 часа превращение достигло максимума – 87%. Выделенный метиловый эфир инсулина человека превращали в инсулин человека путем растворения в воде при значении рН 10 с концентрацией 10 мг/мл. Реакцию прекращали через 24 часа доведением значения рН до 5,2 1н соляной кислотой, и осажденный инсулин человека выделяли центрифугированием и очищали высокоэффективной жидкостной хроматографией с обращенной фазой. За тот же промежуток времени, т.е. 5 часов, выход по способу по данному изобретению по сравнению с известным по существу способом, увеличивался на 62%. По двум способам получались почти одиноковые выходы, если время реакции по существу известного способа одностадийного превращения было увеличено почти в 5 раз, по сравнению с временем реакции для способа по данному изобретению. Пример 2 200 мг инсулина свиньи суспендировали в 1,37 мл воды и прислабом перемешивании добавляли смесь 294 мкл N-метил-2-пирролидона и 326 мкл воды. Значение рН доводили до 9,0 с помощью 10 мкл 2н гидроксида натрия и к полученному в результате раствору добавляли 315 мкл 5,4 мг/мл водного раствора ALP. Значение рН доводили до 9,8 с помощью 12 мкл 2н гидроксида натрия и реакционный раствор, содержащий 80% воды, оставляли на 4 часа при 23°С. Реакционный раствор подкисляли добавлением 70 мкл 4 н соляной кислоты и охлаждали в ледяной бане. Раствор 300 мг метилового эфира L-треонина в 4,4 мл N-метил-2-пирролидона подкисляли 500 мкл 4 н соляной кислоты. Медленно добавляли раствор инсулина и значение рН доводили до 6,5 50 мкл 2н соляной кислотой. Реакционный раствор, содержащий 34% воды, оставляли на 4 часа при 23°С, после чего реакцию останавливали добавлением соляной кислоты до значения рН<3. С помощью ВЭЖХ анализа с обращенной фазой на колонке 4 мм × 250 мм 5 мкм С18 с диоксидом кремния с элюентом этанол-вода, содержащим 0,125 М сульфата аммония, доведенным до значения рН 4, после общего времени реакции 8 часов была установлена степень превращения в метиловый эфир инсулина человека 86%. Для сравнения проводили одностадийной превращение: 100 мг инсулина свиньи суспендировали в смеси 848 мкл воды и 147 мкл N-метил-2-пирролидона. 150 мг метилового эфира L-треонина растворяли в 2,2 мл N-метил-2-пирролидона и медленно добавляли к охлажденной льдом смеси. Значение рН доводили до 6,5 300 мкл уксусной кислоты и добавляли 158 мкл 5,4 мг/мл водного раствора ALP. Реакционный раствор оставляли при 23°С. Реакцию превращения контролировали ВЭЖХ-ОФ анализом подкисленных образцов. Через 8 часов установили превращение до 54% и через 48 часов достигался максимум 86% превращения в метиловый эфир инсулина человека. Выделенный метиловый эфир инсулина человека может быть превращен в инсулин человека с помощью щелочного гидролиза. За тот же промежуток времени, т.е. 8 часов, выход по способу данного изобретения увеличивался на 59%, по сравнению с известным по существу способом. По двум способам получались одинаковые выходы, если время реакции известного по существу способа одностадийного превращения увеличивали в 6 раз по сравнению со временем реакции для способа по данному изобретению. Пример 3 200 мг [Asp28]-дез(30-65) проинсулина человека, удлиненного на N-конце пептидом Gin-(Glu-Ala)3-Pro-Lys- (SEQ ID NO.: 1), суспендировали в 1,35 мл воды. При легком перемешивании добавляли смесь 350 мкл N,N-диметилформамида и 425 мкл воды и значение рН доводили до 9 с помощью 45 мкл триэтиламина. К полученному в результате раствору добавляли 200 мкл 8,5 мг/мл водного раствора ALP и значение рН доводили до 9,8 20 мкл триэтиламина. Реакционный раствор, содержащий 76% воды, оставляли на 1 час при 23°С. Реакционный раствор подкисляли добавлением 70 мкл 4 н соляной кислоты и охлаждали в ледяной бане. Добавляли раствор 300 мг метилового эфира L-треонина в 4,95 мл N,N-диметилформамида и значение рН доводили до 6,5 добавлением 470 мкл 4 н соляной кислоты. Реакционный раствор, содержащий 30% воды, оставляли на 4 часа при 23°С, после чего реакцию останавливали добавлением соляной кислоты до значения рН<3. С помощью ВЭЖХ анализа с обращенной фазой на колонке 4 мм × 250 мм 5 мкм С18 с диоксидом кремния с элюентом этанол-вода, содержащим 0,125 М сульфата аммония, доведенным до значения рН 4, после общего времени реакции 5 часов была установлена степень превращения 87% в [AspB28]-метиловый эфир инсулина человека. Для сравнения проводили одностадийное превращение: 90 мг [Asp28]-дез(30-65) проинсулина человека, удлиненного на N-конце пептидом Glu-(Glu-Ala)3-Pro-Lys- (SEQ ID NO.: 1), суспендировали в смеси 887 мкл воды и 175 мкл N,N-диметилформамида. 150 мг метилового эфира L-треонина растворяли в 2,13 мл N,N-диметилформамида и медленно добавляли к охлажденной льдом смеси. Значение рН доводили до 6,5 250 мкл уксусной кислоты и добавляли 118 мкл 8,5 мг/мл водного раствора ALP. Реакцию превращения контролировали ВЭЖХ-ОФ анализом подкисленных образцов. Через 5 часов было установлено превращение до 47% и через 24 часа превращение в [AspB28]-метиловый эфир инсулина человека достигло максимума – 81%. Выделенный метиловый эфир инсулина человека может быть превращен в [AspB28]-инсулин человека с помощью щелочного гидролиза. За тоже самое время реакции, т.е. 5 часов, выход по способу данного изобретения был почти удвоен по сравнению со способом, известным по существу. Сравнимые выходы были получены двумя способами, если время реакции известного по существу одностадийного превращения было увеличено примерно в 5 раз по сравнению с временем реакции для способа по данному изобретению. Пример 4 1,5 г предшественника инсулин-аспарта [Asp28, Met30, Trp31, Lys32]-дез(33-65)проинсулин человека, удлиненный на N-конце пептидом Glu-Glu-Gly-Glu-Pro-Lys- (SEQ ID NO.: 2) суспендировали в 3,5 г воды. Легким помешиванием и при температуре окружающей среды растворяли данный предшественник постепенным добавлением 4 М гидроксида натрия до значения рН 10,67. Добавляли 3,7 г 45% (масс/масс) раствора этанола в воде. Добавляли 1,5 мл 5,8 мг/мл водного раствора ALP и смесь, содержащую 69% воды, оставляли для взаимодействия на 2 часа. Значение рН доводили до 4,7 добавлением 4 н соляной кислоты. 2,025 г этилового эфира L-треонина растворяли в 16,2 мл этанола и этот раствор добавляли при максимальной температуре 15°С. Значение рН доводили до 6,5 4 н соляной кислотой. Температуру доводили до температуры окружающей среды и реакционную смесь, содержащую 33% воды, оставляли на 20 часов при этой температуре. С помощью анализа ВЭЖХ с обращенной фазой на колонке 4 мм × 250 мм 5 мкм С18 с диоксидом кремния с элюентом ацетонитрил-вода, содержащим 200 мМ сульфата натрия, со значением рН, доведенным до 3,6, через 1 час времени реакции была установлена степень превращения 89,1% в этиловый эфир инсулин-аспарта и через 20 часов времени реакции была установлена степень превращения 90,5%. Выделенный этиловый эфир инсулин-аспарта может быть превращен в инсулин-аспарт с помощью щелочного гидролиза. Пример 5 10,9 г предшественника инсулин-аспарта [Asp28, Met30, Trp31, Lys32]-дез(33-65)проинсулин человека, удлиненный на N-конце пептидом Glu-Glu-Gly-Glu-Pro-Lys- (SEQ ID NO.: 2) суспендировали в 49,3 г воды. При легком помешивании и при температуре окружающей среды растворяли данный предшественник постепенным добавлением 37,6 г смеси, содержащей 0,36 М гидроксида натрия, 0,27 М ацетата натрия и 36% N-метил-2-пирролидона. Значение рН доводили до 9,7 с помощью 9,2 мл 0,5 М гидроксида натрия. Добавляли 7,1 мл 7,1 мг/мл водного раствора ALP и смесь, содержащую 79% воды, оставляли для взаимодействия на 5 часов. На протяжении реакции значение рН удерживали постоянным при 9,7 путем добавления дополнительно 0,5 М гидроксида натрия. Реакционную смесь охлаждали до 5°С и значение рН доводили до 5,7 путем добавления 2,73 г 4 н соляной кислоты. Добавляли 14,02 г этилового эфира L-треонина и значение рН доводили до 6,0 4 н соляной кислотой. Добавляли 344 г охлажденного (4°С) N-метил-2-пирролидона. Температуру доводили до 22°С и значение рН доводили до 6,5 соляной кислотой. Реакционную смесь, содержащую 25% воды, оставляли на 9 часов при этой температуре. С помощью анализа ВЭЖХ с обращенной фазой на колонке 4 мм × 250 мм 5 мкм С18 с диоксидом кремния с элюентом ацетонитрил-вода, содержащим 200 мМ сульфата натрия, со значением рН, доведенным до 3,6, была установлена степень превращения 87,5% в этиловый эфир инсулин-аспарта после общего времени реакции 14 часов. Выделенный этиловый эфир инсулин-аспарта может быть превращен в инсулин-аспарт с помощью щелочного гидролиза.
Формула изобретения
1. Способ получения инсулина из различных видов и его производных, где а) в растворителе, содержащем от 55 до 70% воды (мас./мас.), предшественник инсулина или предшественник производного инсулина подвергают ферментативному расщеплению при щелочных значениях рН, где фермент, используемый для ферментативного расщепления, представляет собой трипсин или лизилспецифичную протеазу, предпочтительно Achromobacter lyticus протеазу I, после чего, без выделения промежуточного продукта из реакционной смеси b) к указанному промежуточному продукту ферментативно присоединяют нуклеофильное соединение, представляющее собой эфир аминокислоты, амид аминокислоты, пептид, эфир пептида или амид пептида в реакционной смеси, имеющей содержание воды в интервале от 10 до 50% воды (мас./мас.), при кислых значениях рН, близких к нейтральному значению рН, и с), по желанию, удаление защитных(ой) групп(ы). 2. Способ по п.1, где перед началом реакции присоединения 25%, 50%, 75%, 85% или 95% предшественника инсулина расщеплено до промежуточного продукта. 3. Способ по п.1, где нуклеофильное соединение представляет собой эфир аминокислоты. 4. Способ по п.3, где эфир аминокислоты представляет собой эфир треонина. 5. Способ по п.1, где нуклеофильное соединение представляет собой амид аминокислоты. 6. Способ по п.1, где нуклеофильное соединение представляет собой пептид. 7. Способ по п.1, где нуклеофильное соединение представляет собой эфир пептида. 8. Способ по п.1, где нуклеофильное соединение представляет собой амид пептида. 9. Способ по п.1, предусматривающий стадию удаления защитных(ой) групп(ы) из инсулина из различных видов и его производных. 10. Способ по п.1, где полученный инсулин из различных видов и его производные имеют треонин в положении В30. 11. Способ по п.1, где производное инсулина представляет собой инсулин-аспарт, инсулин-лизпро, инсулин-гларгин или инсулин-детемир. 12. Способ получения инсулина из различных видов и его производных, где а) в растворителе, содержащем от 55 до 70% воды (мас./мас.), предшественник инсулина или предшественник производного инсулина подвергают ферментативному расщеплению при щелочных значениях рН, где фермент, используемый для ферментативного расщепления, представляет собой трипсин или лизилспецифичную протеазу, предпочтительно Achromobacter lyticus протеазу I, после чего, b) к промежуточному продукту ферментативно присоединяют нуклеофильное соединение, представляющее собой эфир аминокислоты, амид аминокислоты, пептид, эфир пептида или амид пептида, в реакционной смеси, используемой для реакции ферментативного расщепления, при условии, что состав реакционной смеси изменяют таким образом, что содержание воды в реакционной смеси находится в интервале от 10 до 50% воды (мас./мас.), при кислых значениях рН, близких к нейтральному значению рН, и с), по желанию, удаление защитных(ой) групп(ы). 13. Способ по п.12, где между стадиями расщепления и присоединения не проводят выделение промежуточного продукта. 14. Способ по п.12, где фермент, используемый на стадии расщепления, также присутствует на стадии присоединения. 15. Способ по п.12, где перед началом реакции присоединения 25%, 50%, 75%, 85% или 95% предшественника инсулина расщеплено до промежуточного продукта. 16. Способ по п.12, где нуклеофильное соединение представляет собой эфир аминокислоты. 17. Способ по п.16, где эфир аминокислоты представляет собой эфир треонина. 18. Способ по п.12, где нуклеофильное соединение представляет собой амид аминокислоты. 19. Способ по п.12, где нуклеофильное соединение представляет собой пептид. 20. Способ по п.12, где нуклеофильное соединение представляет собой эфир пептида. 21. Способ по п.12, где нуклеофильное соединение представляет собой амид пептида. 22. Способ по п.12, предусматривающий стадию удаления защитных(ой) групп(ы) из инсулина из различных видов и его производных. 23. Способ по п.12, где полученный инсулин из различных видов и его производные имеют треонин в положении В30. 24. Способ по п.12, где производное инсулина представляет собой инсулин-аспарт, инсулин-лизпро, инсулин-гларгин или инсулин-детемир.
|
||||||||||||||||||||||||||

 517
517 -аминогруппа любого остатка лизина модифицирована, предпочтительно гидрофобной группой, например ацильной группой, имеющей, по меньшей мере, 10 атомов углерода. Предпочтительно, эфир пептида содержит не более 10 аминокислотных остатков.
-аминогруппа любого остатка лизина модифицирована, предпочтительно гидрофобной группой, например ацильной группой, имеющей, по меньшей мере, 10 атомов углерода. Предпочтительно, эфир пептида содержит не более 10 аминокислотных остатков. LysB29тетрадеканоил). Инсулиновые соединения, полученные с помощью данного изобретения, обладают противодиабетической активностью, достаточно высокой для использования при лечении больных диабетом. Противодиабетическая активность может быть определена с использованием так называемого анализа свободных жировых клеток.
LysB29тетрадеканоил). Инсулиновые соединения, полученные с помощью данного изобретения, обладают противодиабетической активностью, достаточно высокой для использования при лечении больных диабетом. Противодиабетическая активность может быть определена с использованием так называемого анализа свободных жировых клеток.