|
|
(21), (22) Заявка: 2007107918/13, 29.07.2005
(24) Дата начала отсчета срока действия патента:
29.07.2005
(30) Конвенционный приоритет:
03.08.2004 AU 2004904326
(43) Дата публикации заявки: 10.09.2008
(46) Опубликовано: 20.12.2009
(56) Список документов, цитированных в отчете о
поиске:
RU 2152997 С2, 20.07.2000. KR 20030097366 A, 31.12.2003. JP 2003174891 A, 24.06.2003.
(85) Дата перевода заявки PCT на национальную фазу:
05.03.2007
(86) Заявка PCT:
AU 2005/001116 20050729
(87) Публикация PCT:
WO 2006/012675 20060209
Адрес для переписки:
129090, Москва, ул.Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. А.В.Мицу, рег. 364 364
|
(72) Автор(ы):
МАКНЕЙЛ Скотт Дэвид (AU),
ЧЭМБЕРЛЕЙН Дуглас Алан (AU),
БАУЭР Роберт Синдеком (NZ)
(73) Патентообладатель(и):
ГРЕЙН БАЙОТЕК ОСТРЕЙЛИА ПТИ ЛТД (AU)
|
(54) ТОЛЕРАНТНОЕ К СТРЕССУ ТРАНСГЕННОЕ РАСТЕНИЕ ПШЕНИЦЫ
(57) Реферат:
Настоящее изобретение относится к биотехнологии. Описано толерантное к стрессу растение пшеницы, где указанное растение пшеницы трансформировано молекулой нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ). Раскрыт способ защиты растения пшеницы от стресса, включающий стадию введения молекулы нуклеиновой кислоты в растение пшеницы, где молекула нуклеиновой кислоты кодирует орнитинаминотрансферазу (ОАТ). Представлена конструкция нуклеиновой кислоты, включающая промотор, выделенный из растения, и ген орнитинаминотрансферазы (ОАТ), где указанная конструкция способна трансформировать растение пшеницы таким образом, что указанное растение пшеницы становится толерантным к стрессу. Раскрыт способ получения трансгенного растения пшеницы с индуцируемой или повышенной толерантностью к соли, включающий трансформацию растительной ткани или клетки растения пшеницы молекулой нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ), регенерацию ткани или клетки в целое растение и экспрессию ОАТ в регенерированном растении в течение времени и в условиях, достаточных для индукции или повышения толерантности растения к концентрации соли более чем 100 мМ. Изобретение позволяет получать устойчивое к стрессу растение. 5 н. и 8 з.п. ф-лы, 5 ил., 1 табл.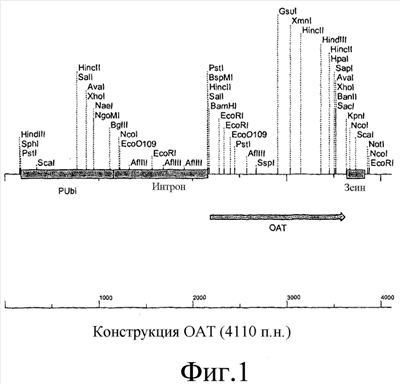
Данная заявка основана и притязает на приоритет предварительной заявки на патент Австралии 2004904326, поданной 3 августа 2004.
Область техники, к которой относится изобретение
Настоящее изобретение относится к трансгенным растениям пшеницы. В частности, настоящее изобретение относится к трансгенному растению пшеницы с повышенной толерантностью к стрессу окружающей среды, такому как солевой стресс.
Уровень техники
Угроза повышенной засоленности для сельского хозяйства возрастает во всем мире тревожащими темпами. В связи с увеличением численности населения в мире и снижением площадей пахотных земель важно в полной мере использовать биотехнологию растений для повышения урожайности сельскохозяйственных культур. Для снижения вредного влияния солевого стресса на урожайность культур существует потребность в солетолерантных сортах растений, таких как злаковые растения.
Предпринимались многочисленные попытки вывести растения с повышенной толерантностью к солевому стрессу. Например, в результате обычного скрещивания диких видов были получены новые сорта пшеницы с некоторой толерантностью к солевому стрессу. Однако обычное скрещивание представляет собой медленный процесс для получения новых сортов культур, и ограниченные ресурсы зародышей для получения толерантности к стрессу и несовместимость гибридов между отдаленно родственными видами растений создают дополнительные проблемы для способов обычного скрещивания. Кроме того, эффективность воспроизведения у растений толерантности к соли при использовании обычного скрещивания по-прежнему относительно низка для промышленно доступных сортов с устойчивостью к концентрации соли не более чем к 100 мМ.
Причинами солевого стресса является снижение водного потенциала в клетках пораженных растений и также избыток ионов натрия, что оказывает отрицательное влияние на ключевые биохимические пути в растительных клетках. Недавно проведенные исследования были посвящены молекулярным подходам для получения культур с повышенной толерантностью к солевому стрессу. На основании собранных данных экспериментальных наблюдений и теоретических соображений было высказано предположение, что механизм, который может лежать в основе толерантности растений к солевому стрессу, заключается в том, что происходит накопление совместимых, низкомолекулярных осмолитов, таких как полиолы/сахара, определенные аминокислоты и ониевые соединения.
Многочисленные исследования связаны с накоплением пролина в растениях в целях повышения солетолерантности, а также повышения толерантности к отсутствию воды, высокой и низкой температуре, токсичным тяжелым металлам, инфекционным патогенам, анаэробным условиям, недостатку питательных веществ, загрязнению атмосферы и УФ-облучению (например, смотри Stewart & Lee, 1974, Planta, 120: 279-289; Briens & Larher, 1982, Plant, Cell & Environ., 5: 287-292; Barnett & Naylor, 1966, Plant Physiol., 41: 1222-1230; Boggess et al., 1976, Aust. J. Plant Physiol., 3: 513-525; Jones et al., 1980, Aust. J. Plant Physiol., 7: 193-205; Katz & Tal, Z. Pflanzenphysiol. Bd., 98: 283-288; Treichel, 1986, Plant Physiol., 67: 173-181; Thomas et al., 1992, Plant Physiol., 98: 626-631). Результаты исследований, обобщенные в обзоре Hare и Cress (1997), указывают, что во время воздействия стресса на растение повышение уровня пролина в растении связано с ослаблением отрицательных физиологических эффектов. Например, на основе анализа экспериментальных данных многих исследований можно предположить, что накопление пролина может служить для защиты мембран растительных клеток и полипептидов от отрицательных эффектов неорганических ионов и экстремальных температур.
Концентрацию пролина в растительной клетке можно повысить увеличением продукции пролина и/или снижением разрушения пролина. Существуют два пути, согласно которым образуется пролин в растительной клетке. Имеются глутаминовый путь и орнитиновый путь. Было высказано предположение, что пролин образуется в молодых растениях Arabidopsis thaliana из глутамата или орнитина, в то время как в зрелых растениях, или при воздействии стресса, глутаматный путь, как правило, доминирует (например, смотри Roosens et al., 1998, Plant Physiol., 117: 263-271).
Несколько генов, кодирующих ферменты, участвующие в биосинтезе определенных осмолитов, таких как пролин, вводили в двудольное растение табака. Однако, несмотря на то, что регенерированные растения табака проявляли частичную толерантность к солевому стрессу (например, смотри Tarczynski et al., 1993; Science, 259: 508-510; Kishor et al., 1995, Plant Physiol., 108: 1387-1394; Lilius et al., 1966, Biotech., 14: 177-180), данные исследования не получили своего продолжения.
Важнее, что несмотря на проведение некоторых исследований с табаком, двудольным растением, гены, принимающие участие в биосинтезе осмолитов, таких как пролин, к настоящему времени не вводили в растение пшеницы. Следовательно, по-прежнему остается потребность в промышленно доступном растении пшеницы, которое было бы способно выдерживать стресс.
Сущность изобретения
Заявители с удивлением установили, что введение в растение пшеницы молекулы нуклеиновой кислоты, кодирующей орнитинаминотрансферазу (ОАТ), обеспечивает трансгенное растение пшеницы индуцируемой или повышенной толерантностью к стрессу. Соответственно, в его самой общей форме изобретение, раскрытое здесь, обеспечивает толерантное к стрессу растение пшеницы и способ защиты указанных растений. В способе используется молекула нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ).
В первом аспекте настоящее изобретение относится к толерантному к стрессу растению пшеницы, где указанное растение пшеницы трасформировано молекулой нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ).
Во втором аспекте настоящее изобретение относится к способу защиты растения пшеницы от стресса, включающему стадию введения молекулы нуклеиновой кислоты в растение пшеницы, где данная молекула нуклеиновой кислоты кодирует орнитинаминотрансферазу (ОАТ).
В одном варианте осуществления стресс выбран из группы, состоящей из засухи, соли, обезвоживания, жары, холода, заморозков, избытка воды, повреждения, механического стресса, окислительного стресса, озона, высокой освещенности, тяжелых металлов, отсутствия питательных веществ и токсических химических веществ. Более предпочтительно стрессом является соль, заморозки или засуха. Наиболее предпочтительно стресс представляет наличие концентрации соли более чем 100 мМ или температуру ниже 0°С.
Молекула нуклеиновой кислоты может представлять собой кДНК, РНК или их гибридную молекулу. Предпочтительно молекулой нуклеиновой кислоты является молекула кДНК, кодирующая орнитинаминотрансферазу (ОАТ). Наиболее предпочтительно молекула кДНК имеет нуклеотидную последовательность, которая по существу представляет таковую, представленную на фиг.2 (SEQ ID NO: 1), или ее биологически активный фрагмент.
Молекулу нуклеиновой кислоты можно интегрировать в геном клетки-хозяина, или она может находиться в виде внехромосомного элемента.
Молекулу нуклеиновой кислоты орнитинаминотрансферазы (ОАТ) можно выделить из любого вида растений. Предпочтительно растение представляет собой Arabidopsis thaliana.
Растение пшеницы, трансформированное молекулой нуклеиновой кислоты орнитинаминотрансферазы (ОАТ), может представлять любой сорт растения пшеницы. Предпочтительно растение пшеницы выбрано из группы, состоящей из Triticum aestivum и Triticum durum.
В третьем аспекте настоящее изобретение также относится к трансгенному растению пшеницы, растительному материалу, семенам или потомству, содержащим молекулу нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ), где экспрессия данной молекулы нуклеиновой кислоты приводит к получению трансгенного растения, растительного материала, семян или потомства, которые способны расти в присутствии концентрации соли более чем 100 мМ.
В четвертом аспекте настоящее изобретение относится к конструкции нуклеиновой кислоты, включающей промотор, выделенный из растения, и ген орнитинаминотрансферазы (ОАТ), имеющий определенные здесь значения.
Промотор может быть конститутивным, убиквитиновым, индуцируемым стрессом, тканеспецифическим или функционирующим на определенных стадиях развития. Предпочтительно промотор является промотором убиквитина.
В одном варианте осуществления конструкция по существу представляет таковую, представленную на фиг.1. Однако, очевидно, понятно, что в условиях in vitro можно получить модифицированные и вариантные формы конструкций способами химической и ферментной обработки или в условиях in vivo способами технологии рекомбинантной ДНК. Такие конструкции могут отличаться от раскрытых, например, в результате одной или нескольких нуклеотидных замен, делеций или вставок, но по существу они сохраняют биологическую активность конструкции или молекулы нуклеиновой кислоты по данному изобретению.
В другом варианте осуществления трансгенное растение пшеницы дополнительно включает эндогенную систему деградации пролина, активность которой подавлена.
Трансгенное растение может дополнительно включать полинуклеотид, который кодирует селектируемый маркер и который функционально связан с полинуклеотидом, который кодирует ОАТ, посредством чего облегчается отбор трансгенного растения пшеницы.
В еще одном варианте осуществления настоящее изобретение относится к продукту питания, полученному из трансгенного растения пшеницы по изобретению.
В пятом аспекте настоящее изобретение относится к способу получения трансгенного растения пшеницы с индуцируемой или повышенной толерантностью к соли, где способ включает стадии:
а) трансформации растительной ткани или клетки растения пшеницы молекулой нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ);
b) регенерации ткани или клетки в целое растение и
с) экспрессии ОАТ в регенерированном растении в течение периода времени и в условиях, достаточных для индукции или повышения толерантности растения к концентрации соли более чем 100 мМ.
В еще одном варианте осуществления способ дополнительно включает стадию трансформации растения пшеницы полинуклеотидом, кодирующим селектируемый маркер, который функционально связан с молекулой нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ), посредством чего облегчается отбор трансгенного растения пшеницы.
В еще одном варианте осуществления способ дополнительно включает стадию снижения активности эндогенной системы деградации пролина в трансгенном растении пшеницы.
Краткое описание фигур
На фиг.1 представлена конструкция нуклеиновой кислоты, включающая промотор убиквитина, функционально связанный с ОАТ.
На фиг.2 представлена нуклеотидная последовательность ОАТ.
На фиг.3 представлена аминокислотная последовательность ОАТ.
На фиг.4 приведена солетолерантность высокой, средней и низкой степени для линии 2590.1. Трансгенная линия расщепляется на 3 отдельные группы.
На фиг.5 показано влияние на развитие семян трансгенных растений (2490.1 и 2721.1) и их соответствующих контрольных сортов (Westonia и Carnamah) через 13 суток после единичного эпизода замораживания.
Определения
В последующем описании приводится ряд терминов, используемых в технологии рекомбинантной ДНК. Если не указано иначе, то все использованные здесь технические и научные термины имеют значения, обычно вкладываемые специалистами в области, к которой относится данное изобретение. Последующие ссылки обеспечивают специалиста в данной области общим определением многих терминов, использованных в данном изобретении: Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed., 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., Rieger R., et al. (eds.), Springer Verlag (1991); и Hale & Marham, The Harper Collins Dictionary of Biology (1991). Однако для обеспечения ясного и последовательного понимания описания и формулы изобретения, включая объем, обеспечиваемый такими терминами, приводятся следующие определения.
Термин «клетка» можно отнести к любой клетке из растения, включая, но без ограничения соматические клетки, гаметы или зародыши.
«Зародыш» относится к растению-спорофиту перед началом роста. Зародыши можно получить оплодотворением гамет при половом скрещивании или самоопылении. «Половое скрещивание» означает опыление одного растения другим. «Самоопыление» представляет получение семени самоопылением, т.е. пыльца и семяпочка происходят от одного и того же растения. Термин «возвратное скрещивание» относится к скрещиванию гибридного растения F1 с одной из его родительских форм. Как правило, возвратное скрещивание применяют для переноса генов, которые придают легко наследуемый, высоко передающийся признак в инбредную линию. Инбредной линией называют возвратную родительскую форму. Источником желаемого признака является родитель-донор. После полового скрещивания донора и родительской формы, F, отбирают гибридные растения, которые обладают желаемым признаком родителя-донора, и скрещивают повторно (т.е. подвергают возвратному скрещиванию) с возвратной родительской формой, с которой вновь скрещивается гибрид, или инбредной линией.
Зародыши также можно получить «соматогенезом зародышей» и «клонированием». Соматический эмбриогенез представляет собой прямое или опосредованное получение зародышей из клеток, тканей или органов растений.
Опосредованный соматический эмбриогенез характеризуется ростом каллуса и образованием зародышей на поверхности каллуса.
Прямой соматический эмбриогенез представляет образование вегетативного зародыша из одной клетки или группы клеток в эксплантате ткани без фазы образования каллуса. Поскольку имеется тенденция образования аномальных растений из каллуса, то прямой соматический эмбриогенез является предпочтительным.
Общий термин «зерно» представляет эндосперм, присутствующий в семяпочке растения.
Фраза «введение последовательности нуклеиновой кислоты» относится к введению последовательностей нуклеиновых кислот рекомбинантными средствами, включая, но не ограничиваясь этим, опосредованную Agrobacterium трансформацию, биолистические методы, электропорацию, методы in planta и тому подобное. Термин «нуклеиновые кислоты» является синонимом ДНК, РНК и полинуклеотидов. Растение, включающее введенную последовательность нуклеиновой кислоты, относится здесь к растению поколения R. Можно также получить растения R1 в результате клонирования, полового скрещивания или самоопыления растений, в которые введены последовательности нуклеиновых кислот.
«Молекула нуклеиновой кислоты» или «молекула полинуклеиновой кислоты» относится к дезоксирибонуклеиновой кислоте и рибонуклеиновой кислоте во всех их формах, т.е. одноцепочечной и двухцепочечной ДНК, кДНК, мРНК и тому подобное.
«Молекула двухцепочечной ДНК» относится к полимерной форме дезоксирибонуклеотидов (аденина, гуанина, тимина или цитозина) в ее нормальной двухцепочечной спиральной форме. Данный термин относится только к первичной и вторичной структуре молекулы и не ограничивается какими-либо конкретными третичными формами. Таким образом, данный термин включает двухцепочечную ДНК, найденную inter alia, в линейных молекулах ДНК (например, рестрикционные фрагменты), вирусах, плазмидах и хромосомах. При обсуждении структуры конкретных молекул двухцепочечной ДНК последовательности здесь могут быть описаны согласно общепринятому способу с предоставлением последовательности только в направлении 5′ к 3′ вдоль нетранскрибируемой цепи ДНК (т.е. цепи, имеющей последовательность, гомологичную мРНК).
Последовательность ДНК «соответствует» аминокислотной последовательности, если согласно генетическому коду трансляция последовательности ДНК дает аминокислотную последовательность (т.е. последовательность ДНК «кодирует» аминокислотную последовательность).
Одна последовательность ДНК «соответствует» другой последовательности ДНК, если две последовательности кодируют одну и ту же аминокислотную последовательность.
Две последовательности ДНК являются «по существу одинаковыми», когда, по меньшей мере, примерно 85%, предпочтительно, по меньшей мере, примерно 90% и наиболее предпочтительно, по меньшей мере, примерно 95% нуклеотидов совпадают по определенной длине последовательностей ДНК.
«Гетерологичная» область или домен ДНК-конструкции представляет определяемый сегмент ДНК внутри более крупной молекулы ДНК, который не обнаруживают в более крупной молекуле в природе. Таким образом, когда гетерологичная область кодирует ген растения, то, как правило, ген будет фланкирован ДНК, которая не фланкирует геномную ДНК растения в геноме организма-источника. Другим примером гетерологичной области является конструкция, в которой саму кодирующую последовательность не обнаруживают в природе (например, кДНК, в которой геномная кодирующая последовательность содержит интроны или синтетические последовательности, имеющие кодоны иные, чем природный ген). Аллельные вариации или природные мутационные события не приводят к образованию гетерологичной области ДНК, имеющей определенное здесь значение.
«Кодирующая последовательность» представляет последовательность в рамке считывания кодонов, которые соответствуют или кодируют белковую или пептидную последовательность. Две кодирующие последовательности соответствуют друг другу, если последовательности или их комплементарные последовательности кодируют одни и те же аминокислотные последовательности. Кодирующая последовательность в комбинации с соответствующими регуляторными последовательностями может транскрибироваться и транслироваться в полипептид в условиях in vivo. Как правило, на 3′-конце кодирующей последовательности располагается сигнал полиаденилирования и терминатор транскрипции.
Полинуклеотидные «гомологи» относятся к ДНК или РНК и их полимерам в любой одноцепочечной или двухцепочечной форме, содержащие известные аналоги природных нуклеотидов, которые обладают одинаковыми связывающими свойствами, как и стандартная нуклеиновая кислота, и метаболизируются аналогично природным нуклеотидам.
«Трансгенные растения» являются растениями, в которые вставлена нуклеиновая кислота с помощью рекомбинантных методов, например, с помощью содержащих нуклеиновую кислоту векторов. «Вектор» представляет собой композицию нуклеиновой кислоты, которая может трансдуцировать, трансформировать или инфицировать клетку, обеспечивая тем самым экспрессию кодируемых вектором нуклеиновых кислот в клетке, и необязательно белков иных, чем естественные для клетки, или способом, не являющимся естественным для клетки. Вектор включает нуклеиновую кислоту (как правило, РНК или ДНК) для экспрессии в клетке. Вектор необязательно включает вещества, которые способствуют проникновению нуклеиновой кислоты в клетку, такие как ретровирусная частица, липосома, белковая оболочка или тому подобное. Векторы содержат последовательности нуклеиновых кислот, которые позволяют им размножаться и подвергаться отбору в бактериях или организмах, не относящихся к растениям. Описание векторов и методов молекулярной биологии смотри в Current Protocols in Molecular Biology, Ausubel, et al., (eds.), Current Protocols, общее издание Greene Publishing Associates, Inc. и John Wiley & Sons, Inc. (включая дополнение 1998) (Ausubel).
«Плазмиды» представляют собой один тип вектора, который включает ДНК, способную реплицироваться внутри растительной клетки, либо вне хромосом, либо в виде части хромосомы(м) растительной клетки, и они обозначаются предшествующей прописной буквой «р», и/или затем заглавными буквами, и/или цифрами. Исходные плазмиды здесь представляют промышленно доступные, широкодоступные в неограниченном смысле, или которые можно сконструировать из таких промышленно доступных плазмид способами, раскрытыми здесь, и/или с использованием опубликованных методов. В некоторых случаях, как станет очевидным специалистам в данной области, можно использовать другие плазмиды, известные в данной области, взаимозаменяемо с плазмидами, описанными здесь.
Фраза «экспрессирующая кассета» или «кассета экспрессии» относится к последовательности нуклеиновой кислоты внутри вектора, которая предназначена для транскрипции, и регуляторной последовательности для регуляции экспрессии. Термин «регуляторные последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной нуклеотидной кодирующей последовательности в определенной клетке-хозяине. Регуляторные последовательности, подходящие для экспрессии в прокариотах, например, включают точки начала репликации, промоторы, сайты связывания рибосомы и сайты терминации транскрипции. Регуляторные последовательности, подходящие для экспрессии в эукариотах, например, включают точки начала репликации, промоторы, сайты связывания рибосомы, сигналы полиаденилирования и энхансеры. Одной из наиболее важных регуляторных последовательностей является промотор.
«Промотор» представляет спектр регуляторных последовательностей нуклеиновых кислот, которые регулируют транскрипцию нуклеиновой кислоты. В том смысле, в котором здесь используется данный термин, промотор включает необходимые последовательности нуклеиновых кислот вблизи сайта начала транскрипции, такие как в случае промотора полимеразы типа II, элемент ТАТА.
Промотор также необязательно включает дистальные энхансерные или репрессорные элементы, которые могут быть расположены на расстоянии в нескольких тысяч пар оснований от сайта (участка) начала транскрипции. Промотор может быть либо гомологичным, т.е. представлять собой природный для регуляции экспрессии желаемой нуклеиновой кислоты, либо гетерологичным, т.е. представлять собой природный для регуляции экспрессии нуклеиновой кислоты, полученной из гена иного, чем желаемая нуклеиновая кислота. Желательными являются гибридные гены с гетерологичными промоторными последовательностями, например, для регуляции экспрессии кодируемых белков. «Конститутивный» промотор представляет собой промотор, который является активным в отобранном организме в большей части возможных условий окружающей среды и стадий развития. «Индуцируемым» промотором является промотор, который функционирует при определенных условиях окружающей среды и на определенных стадиях развития в отобранном организме.
Примеры включают промоторы из вирусов растений, такие как промотор 35S из вируса мозаики цветной капусты (CaMV), описанный Odell et al., (1985), Nature, 313: 810-812, и промоторы из генов, таких как ген актина риса (McElroy et al., (1990), Plant Cell, 163-171); убиквитина (Christensen et al., (1992), Plant Mol. Biol. 12: 619-632; и Christensen et al., (1992), Plant Mol. Biol. 18: 675-689); pEMU (Last et al., (1991), Theor. Appl. Genet., 81: 581-588); MAS (Velten et al., (1984), EMBO J. 3: 2723-2730); и гистона Н3 кукурузы (Lepetit et al., (1992), Mol. Gen. Genet. 231: 276-285; и Atanassvoa et al., (1992), Plant Journal 2(3): 291-300).
Дополнительные регуляторные элементы, которые могут быть связаны с полинуклеотидами ОАТ для экспрессии в растительных клетках, включают терминаторы, последовательности полиаденилирования и последовательности нуклеиновых кислот, кодирующие сигнальные пептиды, которые позволяют локализоваться внутри растительной клетки или секретировать белок из клетки. Такие регуляторные элементы и способы добавления или обмена данных элементов с регуляторными элементами гена репликазы известны, и они включают, но ограничиваются этим, 3′-концевые области терминации и/или полиаденилирования, такие как для гена нопалинсинтазы Agrobacterium tumefaciens (nos) (Bevan et al., (1983), Nucl. Acids Res. 12: 369-385); гена ингибитора протеиназы II картофеля (PINII) (Keil et al., (1986), Nucl. Acids Res. 14: 5641-5650); и An et al., (1989), Plant Cell, 1: 115-122); и гена CaMV 19S (Mogen et al., (1990), Plant Cell, 2: 1261-1272).
Сигнальные последовательности растений включают, но не ограничиваются этим, последовательности ДНК/РНК, кодирующие сигнальные пептиды, которые направляют белки во внеклеточный матрикс растительной клетки (Dratewka-Kos et al., (1989), J. Biol. Chem., 264: 4896-4900), удлиняющий ген Nicotiana plumbaginifolia (DeLoose et al., (1991), Gene, 99: 95-100), сигнальные пептиды, которые направляют белки в вакуоли, такие как ген спорамина сладкого картофеля (Matsuka et al., (1991), PNAS, 88: 834) и ген лектина ячменя (Wilkins et al., (1990), Plant Cell, 2: 301-313), сигнальные пептиды, которые направляют белки на секрецию, такие как PRIb (Lind et al., (1992), Plant Mol. Biol. 18: 47-53) или альфа-амилаза ячменя (BAA) (Rahmatullah et al., (1989), Plant Mol. Biol., 12: 119, и эти источники включены здесь для сведения).
Для целей настоящего изобретения промоторную последовательность связывают по ее 3′-концу со стартовым кодоном трансляции кодирующей последовательности и наращивают слева для включения минимального количества оснований или элементов, необходимых для инициации транскрипции на уровнях, детектируемых по сравнению с фоном. Внутри промоторной последовательности находится сайт инициации транскрипции (соответственно определяемый картированием с помощью нуклеазы S1), а также домены связывания белка (консенсусные последовательности), ответственные за связывание с РНК-полимеразой.
«Экзогенный» элемент представляет собой таковой, который является чужеродным для клетки-хозяина или гомологичным для клетки-хозяина, но в положении внутри клетки-хозяина, в котором обычно элемент не обнаруживают.
«Расщепление» ДНК относится к каталитическому расщеплению ДНК ферментом, который функционирует только в определенных положениях в ДНК. Такие ферменты называются рестриктазами (ферментами рестрикции) или рестрикционными эндонуклеазами, и сайты внутри ДНК, по которым такие ферменты расщепляют, называются сайтами рестрикции. Если имеются множественные сайты рестрикции внутри ДНК, то в результате расщепления будут образовываться два или более линеаризованных фрагментов ДНК (рестрикционные фрагменты). Использованные здесь различные рестриктазы являются промышленно доступными и для них применяют условия реакции, кофакторы и другие требования, установленные производителями ферментов. Обычно рестриктазы обозначаются сокращениями, состоящими из заглавной буквы, за которой следуют другие буквы, указывающие микроорганизм, из которого первоначально получена каждая рестриктаза и затем следует число, обозначающее конкретный фермент. Как правило, 1 мкг ДНК расщепляется примерно 1-2 единицами фермента примерно в 20 мкл буферного раствора. Производителем указываются соответствующие буферы и количества субстрата для конкретных рестриктаз, и/или они хорошо известны в данной области.
«Извлечение» или «выделение» данного фрагмента ДНК из рестрикционного гидролизата, как правило, проводят разделением продуктов расщепления, которые называют «рестрикционными фрагментами» в полиакриламидном или агарозном геле электрофорезом, идентификацией интересующего фрагмента по его подвижности по отношению к маркерным фрагментам ДНК с известной молекулярной массой, вырезанием участка геля, который содержит желаемый фрагмент, и выделением ДНК из геля, например, электроэлюцией.
«Лигирование» относится к способу образования фосфодиэфирных связей между двумя двухцепочечными фрагментами ДНК. Если не указано иначе, то лигирование проводят с использованием известных буферов и условий с 10 единицами ДНК-лигазы Т4 в расчете на 0,5 мкг примерно эквимолярных количеств фрагментов ДНК, которые подвергаются лигированию.
«Олигонуклеотиды» представляют собой короткие по длине, одно- или двухцепочечные полидезоксинуклеотиды, которые синтезируют химическим путем известными методами (включая, например, триэфирную, фосфорамидитную или фосфонатную химию), такими, как описаны Engels et al., (1989), Agnew. Chem. Int. Ed. Engl. 28: 716-734. Затем их очищают, например, электрофорезом в полиакриламидном геле.
«Полимеразная цепная реакция» или «ПЦР», в том смысле, в котором здесь используется данный термин, как правило, относится к методу амплификации желаемой нуклеотидной последовательности в условиях in vitro, как описано в патенте США  4683195. В основном метод ПЦР включает повторяющиеся циклы синтетического удлинения праймера с использованием двух олигонуклеотидных праймеров, способных к гибридизации в основном с матричной нуклеиновой кислотой. Как правило, праймеры, используемые в ПЦР, будут комплементарны нуклеотидным последовательностям внутри матрицы на обоих концах или будут фланкировать нуклеотидную последовательность, предназначенную для амплификации, хотя также можно использовать праймеры, комплементарные нуклеотидной последовательности, предназначенной для амплификации. Wang et al., в PCR Protocols, pp. 70-75 (Academic Press, 1990); Ochman et al., в PCR Protocols, pp. 219-227; Triglia et al., (1988), Nucl. Acids Res. 16: 8186. 4683195. В основном метод ПЦР включает повторяющиеся циклы синтетического удлинения праймера с использованием двух олигонуклеотидных праймеров, способных к гибридизации в основном с матричной нуклеиновой кислотой. Как правило, праймеры, используемые в ПЦР, будут комплементарны нуклеотидным последовательностям внутри матрицы на обоих концах или будут фланкировать нуклеотидную последовательность, предназначенную для амплификации, хотя также можно использовать праймеры, комплементарные нуклеотидной последовательности, предназначенной для амплификации. Wang et al., в PCR Protocols, pp. 70-75 (Academic Press, 1990); Ochman et al., в PCR Protocols, pp. 219-227; Triglia et al., (1988), Nucl. Acids Res. 16: 8186.
«Клонирование ПЦР» относится к применению метода ПЦР для амплификации конкретной желаемой нуклеотидной последовательности, которая имеется среди нуклеиновых кислот из подходящего источника клетки или ткани, включая полную геномную ДНК и кДНК, транскрибированную из общей клеточной РНК. Frohman et al., (1998), Proc. Nat. Aсad. Sci. USA, 85:8998-9002; Saiki et al., (1998), Science, 239: 487-492; Mullis et al., (1987), Meth. Enzymol., 155: 335-350.
Фраза «функционально кодирует» относится к функциональной связи между промотором и второй последовательностью нуклеиновой кислоты, где промоторная последовательность инициирует транскрипцию РНК, соответствующую второй последовательности.
Термин «потомство» относится к потомкам конкретного растения (полученным самоопылением) или пары растений (полученным скрещиванием или возвратным скрещиванием). Потомки могут представлять F1, Fez или любое последующее поколение.
Как правило, родительские формы представляют собой донор пыльцы и донор семядоли, которые скрещивают между собой для получения растения-потомка по данному изобретению.
Родители также относятся к родителям F1 гибридного растения по данному изобретению (растения F2). Наконец, родители относятся к возвратным родительским формам, с которыми вновь скрещивают гибридные растения по данному изобретению, с получением другого гибридного растения по данному изобретению.
Фраза «получение трансгенного растения» относится к получению растения по данному изобретению. Растение получают с помощью рекомбинантных методов, т.е. клонирования, соматического эмбриогенеза или любого другого метода, используемого специалистами в данной области.
«Интеграцию» ДНК можно проводить с использованием негомологичной рекомбинации с последующим массовым переносом ДНК в клетки с использованием микроинъекции, биолистики, электропорации или липофекции. Также включаются альтернативные способы, такие как гомологичная рекомбинация и/или опосредованная рестриктазами интеграция (REMI) или транспозоны, и их можно рассматривать в качестве усовершенствованных методов интеграции.
«Клон» представляет популяцию клеток, полученных от одной клетки или общего предка митозом.
«Гомологи последовательности нуклеиновой кислоты» относятся к дезоксирибонуклеотидам или рибонуклеотидам и их полимерам в одно- или двухцепочечной форме, содержащим известные аналоги природных нуклеотидов, которые обладают аналогичными связывающими свойствами, как и стандартная нуклеиновая кислота, и метаболизируются путем, аналогичным природным нуклеотидам.
Если не указано иначе, то конкретная последовательность нуклеиновой кислоты также косвенным образом включает ее консервативно модифицированные варианты (например, в результате замен вырожденного кодона) и комплементарные последовательности, а также точно указанную последовательность. В частности, замены вырожденного кодона можно провести получением последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов замещается на остатки из смешанных оснований и/или дезоксиинозина (Batzer et al., (1991), Nucleic Acid Res. 19: 5081; Ohtsuka et al., (1985), J. Biol. Chem. 260: 2605-2608; и Rossolini et al., (1994), Mol. Cell. Probes 8: 91-98). Термин «нуклеиновая кислота» используется взаимозаменяемо с геном, кДНК и мРНК, кодируемыми геном.
Термин «гомолог аминокислотной последовательности» относится к белку с аналогичной аминокислотной последовательностью. Очевидно, специалисты в данной области понимают, что ключевая аминокислотная последовательность находится внутри функционального домена белка. Таким образом, возможно для гомологичного белка иметь менее чем 40% гомологию по длине аминокислотной последовательности, но более чем 90% гомологию в одном функциональном домене. В дополнение к природным аминокислотам гомологи также включают белки, в которых один или несколько аминокислотных остатков представляет искусственный химический аналог соответствующей природной аминокислоты, а также природных белков.
Аминокислоты могут обозначаться здесь хорошо известными для них символами из трех букв или символами из одной буквы, рекомендованными Комиссией по биохимической номенклатуре IUPAC-IUB.
Аналогично нуклеотиды можно обозначать с использованием обычно принятых для них кодов из одной буквы.
Термин «консервативно модифицированные варианты» применяется по отношению к аминокислотным последовательностям и последовательностям нуклеиновых кислот. По отношению к конкретной последовательности нуклеиновой кислоты консервативно модифицированные варианты относятся к таким нуклеиновым кислотам, которые кодируют идентичные или в основном идентичные аминокислотные последовательности или когда нуклеиновая кислота не кодирует аминокислотную последовательность, до в основном идентичных последовательностей.
В результате вырожденности генетического кода большое количество функционально идентичных нуклеиновых кислот кодируют любой данный белок. Например, кодоны GCA, GCC, GCG и GCU все кодируют аминокислоту аланин. Таким образом, в каждом положении, где аланин обозначен кодоном, кодон может быть изменен на любой из представленных соответствующих кодонов без изменения кодируемого полипептида. Такие варианты нуклеиновых кислот являются «молчащими вариантами», которые представляют один вид консервативно модифицированных вариантов. Каждая последовательность нуклеиновой кислоты здесь, которая кодирует полипептид, также описывает каждый возможный молчащий вариант нуклеиновой кислоты. Очевидно, специалисты в данной области понимают, что конкретные нуклеиновые кислоты в кодоне (за исключением AUG, который, как правило, является единственным кодоном для метионина) можно модифицировать с получением функционально идентичной молекулы. Следовательно, каждый молчащий вариант нуклеиновой кислоты, который кодирует полипептид, подразумевается в каждой описанной последовательности.
В отношении аминокислотных последовательностей, очевидно, специалисты в данной области понимают, что отдельные замены, делеции и добавления в нуклеотидную, пептидную, полипептидную или белковую последовательность, которые изменяют, добавляют или подвергают делеции одну аминокислоту или небольшой процент аминокислот в кодируемой последовательности, представляют «консервативно модифицированный вариант», в котором изменение приводит к замене аминокислоты на химически аналогичную аминокислоту. В данной области хорошо известны таблицы консервативных замен, которые обеспечивают функционально аналогичные аминокислоты.
Каждая из следующих шести групп включает аминокислоты, которые представляют консервативные замены друг для друга:
1) аланин (А), серин (S), треонин (T);
2) аспарагиновая кислота (D), глутаминовая кислота (Е);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (K);
5) изолейцин (I), лейцин (L), метионин (M), валин (V); и
6) фенилаланин (F), тирозин (Y), триптофан (W).
(Смотри, например, Creighton, Proteins (1984).)
В том смысле, в котором они здесь используются, термины «трансформация» и «трансфекция» относятся к способу введения желаемой нуклеиновой кислоты, такой как плазмида или экспрессирующий вектор, в растительные клетки, в культуре или в органах растения, различными методами, используемыми специалистами в области молекулярной биологии. Следовательно, клетка «трансформирована» экзогенной ДНК, когда такая экзогенная ДНК введена внутрь клеточной оболочки. Экзогенную ДНК можно интегрировать или можно не интегрировать (ковалентно связывать) в хромосомную ДНК, составляющую геном клетки. В прокариотах и дрожжах, например, экзогенную ДНК можно сохранять в виде эписомального элемента, такого как плазмида. В отношении эукариотических клеток, то стабильно трансформированная клетка представляет таковую, в которой экзогенная ДНК наследуется дочерними клетками посредством репликации хромосом. Данная стабильность демонстрируется способностью эукариотической клетки образовывать клеточные линии или клоны, состоящие из популяции дочерних клеток, включающих экзогенную ДНК.
Известны многочисленные способы введения чужеродных генов в растения, и их можно использовать для вставки модифицированной нуклеиновой кислоты в растение-хозяин, включая протоколы биологической и физической трансформации растений. Например, смотри Miki et al., (1993), «Procedure for Introducing Foreign DNA into Plants», в: Methods in Plant Molecular Biology and Biotechnology, Glick and Thompson, eds., CRC Press, Inc., Boca Raton, pages 67-88. Выбранные способы варьируют в зависимости от растения-хозяина и включают способы химической трансфекции, такие как кальций фосфатный, опосредованный микроорганизмами перенос гена, такими как Agrobacteruim (Horsch et al., (1985), Science, 227: 1229-31), электропорация, микроинъекция и биолистическая бомбардировка.
Известны и являются промышленно доступными экспрессирующие кассеты и векторы и культуральные методы в условиях in vitro для трансформации растительной клетки и ткани. Например, смотри Gruber et al., (1993), «Vectors for Plant Transformation» в: Methods in Plant Molecular Biology and Biotechnology, Glick and Thompson, eds., CRC Press, Inc., Boca Raton, pages 89-119.
Наиболее широко применяемый способ для введения экспрессирующего вектора в растения основан на природной системе трансформации с Agrobacteruim. A. tumefaciens и A. rhizogenes являются патогенными почвенными бактериями для растений, которые генетически трансформируют растительные клетки. Ti- и Ri-плазмиды соответственно на основе A. tumefaciens и A. rhizogenes несут гены, ответственные за генетическую трансформацию растений. Например, смотри Kado (1991), Crit. Rev. Plant Sci. 10: 1. Описания векторных систем на основе Agrobacteruim и способов опосредованного Agrobacteruim переноса генов приведены Gruber et al., выше; Miki et al., выше; и Moloney et al., (1989), Plant Cell Reports, 8: 238.
Аналогично ген можно вставить в область Т-ДНК плазмид Ti и Ri, полученных соответственно из A. tumefaciens и A. rhizogenes. Таким образом, экспрессирующие кассеты можно конструировать с использованием указанных выше данных плазмид. Известны многие регуляторные последовательности, которые при связывании с гетерологичной кодирующей последовательностью и трансформированные в микроорганизмы-хозяева проявляют точность воспроизведения при экспрессии гена в отношении ткане-/органоспецифичности исходной кодирующей последовательности. Например, смотри Benfey and Chua (1989), Science, 244: 174-181. Особенно подходящими регуляторными последовательностями для применения в данных плазмидах являются промоторы для конститутивной, специфической для листьев экспрессии гена в различных растениях-мишенях. Другие подходящие регуляторные последовательности включают промотор и терминатор из гена нопалинсинтазы (NOS). Промотор и терминатор NOS находятся в плазмиде pARC2, доступной из Американской коллекции типовых культур и обозначенной АТСС 67238. Если используется данная система, то также должен присутствовать ген вирулентности (vir) либо из Ti-плазмиды, либо из Ri-плазмиды, наряду с участком Т-ДНК, или при использовании бинарной системы, в которой vir-ген находится в отдельном векторе. Такие системы, векторы для применения здесь и способы трансформации растительных клеток описаны в патенте США  4658082; заявке на патент США 4658082; заявке на патент США  913914, поданной 1 октября 1986, цитированной в патенте США 913914, поданной 1 октября 1986, цитированной в патенте США  5262306 от 16 ноября 1993, Robeson et al.; и Simpson et al., (1986), Plant Mol. Biol. 6: 403-415 (также упомянут в патенте ‘306); все эти источники включены здесь полностью для сведения. 5262306 от 16 ноября 1993, Robeson et al.; и Simpson et al., (1986), Plant Mol. Biol. 6: 403-415 (также упомянут в патенте ‘306); все эти источники включены здесь полностью для сведения.
После конструирования данные плазмиды можно поместить в A. rhizogenes или A. tumefaciens и данные векторы использовать для трансформации клеток растительных видов, которые обычно чувствительны к засоленности. В настоящем изобретении также предусматривается несколько других трансгенных растений, включая, но не ограничиваясь соевыми бобами, кукурузой, сорго, люцерной, рисом, клевером, капустой, бананами, кофе, сельдереем, табаком, вигной китайской, хлопком, дыней и перцем. Выбор A. tumefaciens или A. rhizogenes будет зависеть от растения, подвергающегося трансформации. Как правило, A. tumefaciens является предпочтительным микроорганизмом для трансформации. Большая часть двудольных растений, некоторые голосемянные растения и немногие однодольные растения (например, некоторые члены семейств Liliales и Arales) являются чувствительными к инфицированию A. tumefaciens. A. rhizogenes также имеет широкий ряд хозяев, включающий большинство двудольных растений и некоторые голосемянные растения, в число которых входят члены семейств Leguminosae, Compositae и Chenopodiaceae. Альтернативные методы, которые, как было доказано, являются эффективными в генетической трансформации растений, включают бомбардировку частицами и электропорацию. Например, смотри Rhodes et al., (1988), Science, 240: 204-207; Shigekawa and Dower, (1988), Bio/Techniques, 6: 742-751; Sanford et al., (1987), Particulate Science & Technology, 5: 27-37; и McCabe, (1998), Bio/Technology, 6: 923-926.
После трансформации данные клетки можно использовать для регенерации трансгенных растений, способных выдерживать стрессы окружающей среды. Например, цельные растения можно инфицировать данными векторами, повредив растение и затем введя вектор в место повреждения. Повреждению можно подвергнуть любую часть растения, включая листья, стебли и корни. Альтернативно растительную ткань, в виде эксплантата, такую как ткань семядоли или листовые диски, можно инфицировать данными векторами и культивировать в условиях, способствующих регенерации растения. Можно использовать корни или побеги, трансформированные инфицированием растительной ткани A. rhizogenes или A. tumefaciens, включающими ген, кодирующий интересующий ген, в качестве источника растительной ткани для регенерации трансгенных растений либо соматическим эмбриогенезом, либо органогенезом. Примеры таких методов регенерации растительной ткани описаны Shanin (1985), Theor. Appl. Genet., 69: 235-240; патент США  4658082; Simpson et al., (1986), Plant Mol. Biol., 6: 403-415; и заявки на патент США 4658082; Simpson et al., (1986), Plant Mol. Biol., 6: 403-415; и заявки на патент США  913913 и 913914, обе поданные 1 октября 1986, цитированные в патенте США 913913 и 913914, обе поданные 1 октября 1986, цитированные в патенте США  5262306 от 16 ноября 1993, Robeson et al.; данные источники полностью включены здесь для сведения. 5262306 от 16 ноября 1993, Robeson et al.; данные источники полностью включены здесь для сведения.
Несмотря на факт наличия широкого ряда хозяев для опосредуемой Agrobacteruim трансформации, некоторые экономически важные виды злаковых культур и голосемянные растения, как правило, не поддаются данному способу переноса генов, несмотря на то, что недавно некоторый успех был достигнут на рисе (Hiei et al., (1994), The Plant Journal, 6: 271-282). Было разработано несколько способов трансформации растений в качестве альтернативы для опосредуемой Agrobacteruim трансформации, и, в целом, они относятся к методам прямого переноса генов.
В основном применяемым методом трансформации растений является опосредуемая микрочастицами трансформация, в котором ДНК доставляют на поверхности микрочастиц размером примерно от 1 до 4 мкм. Экспрессирующий вектор вводят в растительные ткани с помощью биолистического устройства, которое увеличивает скорость микрочастиц до 300-600 м/сек, что является достаточным для проникновения через стенки и мембраны растительной клетки (Sanford et al., (1987), Part. Sci. Technol. 5: 27; Sanford, 1988, Trends Biotech., 6: 299; Sanford, (1990), Physiol. Plant 79: 206; Klein et al., (1992), Biotechnology 10: 268).
Еще одним способом физической доставки ДНК в растения является ультразвуковая обработка клеток-мишеней, описанная Zang et al., (1991), Bio/Tеchnology, 9: 996. Альтернативно использовали слияние с липосомой или сферопластом для введения экспрессирующих векторов в растения. Например, смотри Deshayes et al., (1985), EMBO J. 4: 2731; и Christou et al., (1987), PNAS USA, 84: 3962. Сообщалось о прямом поглощении ДНК протопластами с использованием осаждения СаCl2, поливинилового спирта или поли-L-орнитина. Например, смотри Hain et al., (1985), Mol. Gen. Genet. 199: 161; и Draper et al., (1982), Plant Cell Physiol. 23: 451.
Также описана электропорация протопластов и цельных клеток и тканей. Например, смотри Donn et al., (1990), In: Abstracts of the VIIth Int’l Congress on Plant Cell and Tissue Culture IAPTC, A2-38, page 53; D’Halluin et al., (1992), Plant Cell 4: 1495-1505; и Spencer et al., (1994), Plant Mol. Biol. 24: 51-61.
Альтернативно ДНК-конструкции объединяют с подходящими фланкирующими Т-ДНК областями и вводят в соответствующий вектор-хозяин Agrobacteruim tumefaciens. Вирулентная функция Agrobacteruim tumefaciens для хозяина направляет вставку конструкции и смежного маркера в ДНК растительной клетки при инфицировании клетки бактериями.
В данной области известны и хорошо описаны в научной и патентной литературе методы на основе микроинъекции. Paszkowski et al., 1984, EMBO J., 3: 2717 описано введение ДНК-конструкций с использованием осаждения полиэтиленгликолем. Fromm et al., 1985, Proc. Nat’l. Acad. Sci. USA, 82: 5824 описаны способы на основе электропорации. Klein et al., 1987, Nature 327: 70-73 описали методы баллистической трансформации.
В научной литературе также хорошо описаны способы опосредованной Agrobacteruim tumefaciens трансформации, включая бомбардировку микрочастицами и применение бинарных векторов. Например, смотри Horsch et al., 1984, Science, 233: 496-498 и Fraley et al., 1983, Proc. Nat’l. Acad. Sci. USA, 80: 4803.
Одним предпочтительным способом трансформации растений по изобретению является бомбардировка микрочастицами. В данном методе ткани-мишени обрабатывают осмотическим соединением. Затем модифицированную ДНК гена ОАТ осаждают и наносят на микрочастицы из вольфрама или золота. Затем микрочастицы нагружают в «ружье» для микрочастиц или биолистическое устройство и обработанные клетки бомбардируют (Bower et al., 1996).
Подробное описание изобретения
Все упомянутые публикации цитируются для целей описания и раскрытия протоколов и реагентов, о которых сообщалось в публикациях и которые могут быть использованы для изобретения. Ничего здесь не истолковывается для признания того, что изобретение не получило название для предшествования такому раскрытию изобретением предшествующего уровня.
В практике настоящего изобретения используются, если не указано иначе, обычные способы молекулярной биологии, биологии растений и рекомбинантной ДНК, которые находятся в пределах возможностей специалистов в данной области. Такие способы являются хорошо известными специалистам в данной области, и они полностью поясняются в литературе. Например, смотри Maniatis, Fritsch & Sambrook, «Molecular Cloning: A Laboratory Manual» (1982); «DNA Cloning: A Practical Approach», Volumes I and II (D.N.Glover, Ed., 1985); «Oligonucleotide Synthesis» (M.J.Gait, Ed., 1984); «Nucleic Acid Hybridization» (B.D.Hames & S.J.Higgins, eds., 1985); «Transcription and Translation» (B.D.Hames & S.J.Higgins, eds., 1984); B.Perbal, «A Practical Guide to Molecular Cloning»(1984) и Sambrook et al., «Molecular Cloning: A Laboratory Manual» 12th edition (1989).
Очевидно, понятно, что изобретение не ограничивается описанными конкретными веществами и способами, поскольку они могут варьироваться. Также понятно, что использованная здесь терминология предназначается только для цели описания конкретных вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который будет ограничиваться только прилагаемой формулой изобретения. Необходимо отметить, что, как использовано здесь и в прилагаемой формуле изобретения, формы единственного числа включают множественные формы, если только контекст четко не указывает на иное. Так, например, в отношении «полинуклеотида» он включает множество таких полинуклеотидов, и в отношении «энхансерного элемента» он относится к одному или нескольким энхансерным элементам. Несмотря на то, что для практики или тестирования настоящего изобретения можно использовать любые вещества и способы, аналогичные или эквивалентные описанным здесь, далее будут описаны предпочтительные вещества и способы.
В одном из наиболее широких аспектов настоящего изобретения предусматривается применение трансгена, сконструированного для получения трансгенного растения пшеницы, которое экспрессирует ген орнитинаминотрансферазы (ОАТ). Орнитинаминотрансфераза (ОАТ) представляет собой фермент пути метаболизма орнитина, при участии которого продуцируется пролин в растительной клетке. ОАТ катализирует перенос аминогруппы с орнитина на альфа-кетоглутарат с образованием глутамат-5-полуальдегида и глутаминовой кислоты. Следовательно, в том смысле, в котором он здесь используется, термин «трансгенное растение» относится к растению, которое содержит полинуклеотидную последовательность ОАТ, включая, но не ограничиваясь полинуклеотидами, которые, возможно, в норме отсутствуют, последовательности ДНК, которые в норме не транскрибируются в РНК или транслируются в белок («экспрессируются»).
Термин «растение пшеницы», в том смысле, в котором он здесь используется, включает, например, любое растение, обнаруженное в семействе пшеницы, выбранное из группы, состоящей из Triticum aestivum, Triticum durum, Triticum aestivum var. westonia, Triticum monococcum, Triticum aegilopoides, Triticum turgidum, Triticum polonicum, Triticum carthlicum, Triticum dicoccum, Triticum paleocolchicum, Triticum aestivum var. carnamah и Triticum turanicum.
Термин «трансген», в том смысле, в котором он здесь используется, относится к любой полинуклеотидной последовательности, которая кодирует полипептид ОАТ, который вставлен в геном клетки растения пшеницы в результате экспериментальных манипуляций. Трансген может представлять собой «эндогенную последовательность ДНК» или «гетерологичную последовательность ДНК» (т.е. «чужеродную ДНК»). Термин «эндогенная последовательность ДНК» относится к нуклеотидной последовательности, которая обнаружена в клетке в природе, в которую она введена, при условии, что она не содержит некоторую модификацию (например, точечную мутацию, присутствие селективного гена-маркера и т.д.) по сравнению с природной последовательностью. Термин «гетерологичная последовательность ДНК» относится к нуклеотидной последовательности, которая лигирована с или подвергнута манипуляции для того, чтобы быть лигированной с последовательностью нуклеиновой кислоты, с которой она не лигирована в природе или с которой она лигирована в природе в другом положении. Гетерологичная ДНК не является эндогенной для клетки, в которую она вставлена, а получена из другой клетки. Также гетерологичная ДНК содержит эндогенную последовательность ДНК, которая включает некоторую модификацию. Как правило, но необязательно, гетерологичная ДНК кодирует РНК и белки, которые в норме не продуцируются клеткой, в которой она экспрессируется. Примеры гетерологичной ДНК включают мутантные гены дикого типа (т.е. гены дикого типа, которые модифицированы таким образом, что более они не являются генами дикого типа), репортерные гены, последовательности, регулирующие транскрипцию и трансляцию, селектируемые белки-маркеры (например, белки, придающие устойчивость к лекарственным препаратам) и т.д.
Таким образом, после идентификации подходящего растения-хозяина пшеницы, что уже обсуждалось выше, конструируют трансген, который содержит один или несколько полинуклеотидов ОАТ или их функционально активные фрагменты. Термин «функционально активный» при использовании по отношению к полинуклеотидам ОАТ по настоящему изобретению относится к примерной конструкции, в которой изменение нуклеотидной последовательности необязательно оказывает влияние на способность последовательности кодировать полипептид, способный осуществлять по существу такую же функцию, как неизмененный «родительский» полипептид. Например, нуклеотидную последовательность можно усечь, удлинить или подвергнуть мутации таким образом, чтобы полипептид, кодируемый нуклеотидной последовательностью, отличался от «родительской» последовательности, но по-прежнему кодировал полипептид, который способен функционировать по существу таким же образом, как и «родительская» молекула. Следовательно, функционально активное производное, аналог, гомолог или вариант полинуклеотида ОАТ по настоящему изобретению будет иметь нуклеотидную последовательность, которая отличается от нуклеотидной последовательности, представленной на фиг.2 (SEQ ID NO: 1), но полипептид, кодируемый функционально активным производным, аналогом, гомологом или вариантом, способен проявлять одну или несколько известных функциональных активностей, характерных для полипептидов ОАТ. Такие модификации можно осуществить сайт-направленным мутагенезом, или они могут быть спонтанными.
Синонимы ОАТ (номер-ЕС 2.6.1.13) включают L-орнитин: 2-оксокислота-аминотрансферазу, орнитинаминотрансферазу, орнитин-оксокислота-трансаминазу, орнитинкетокислота-аминотрансферазу, L-орнитин 5-аминотрансферазу, L-орнитинаминотрансферазу, L-орнитин: альфа-кетоглутарат-дельта-аминотрансферазу, орнитин-5-аминотрансферазу, орнитин-дельта-трансаминазу, орнитинтрансаминазу, орнитин-2-оксокислота-аминотрансферазу, орнитин-альфа-кетоглутарат-аминотрансферазу, орнитин-кетокислота-аминотрансферазу, орнитин-кетокислота-трансаминазу, орнитин-кетоглутарат-аминотрансферазу, орнитин-оксокислота-аминотрансферазу и орнитин-альфа-оксоглутарат-трансаминазу.
Специалистам в данной области, очевидно, понятно, что функционально активное производное, аналог, гомолог или вариант полинуклеотида ОАТ по настоящему изобретению могут существенно варьировать, за исключением областей, относящихся к важным, например, сайтам связывания рецептора; однако области высококонсервативных последовательностей между полинуклеотидами ОАТ, выделенные из различных вирусов, вероятно, кодируют важные области, такие как сайты связывания рецептора и тому подобное. Следовательно, вероятно, что мутации в данных высококонсервативных областях не будут приводить к образованию функционально активных производных, аналогов, гомологов или вариантов. Например, консервативные нуклеотидные последовательности, представленные в таблице 1, вероятно, остаются без изменений, если замены являются очень консервативными.
Последовательности, которые являются по существу аналогичными, можно идентифицировать саузерн-блоттингом, например, в условиях высокой, средней или низкой силы, как определено для такой конкретной системы. Определить подходящие условия гибридизации может специалист в данной области. Например, смотри Sambrook et al., DNA Cloning, vols. I, II and III. Nucleic Acid Hybridization. Однако, как правило, «сильные условия» для гибридизации или отжига молекул нуклеиновой кислоты представляют таковые, при которых:
1) используется низкая ионная сила и высокая температура для отмывки, например, 0,015 М NaCl/0,0015 М цитрат натрия/0,1% додецилсульфат натрия (SDS) при 50°С или
2) используется во время гибридизации денатурирующий реагент, такой как формамид, например, 50% (об./об.) формамид с 0,1% бычьего сывороточного альбумина/0,1% Фиколла/0,1% поливинилпирролидона/50 мМ натриевым фосфатным буфером при рН 6,5 с 750 мМ NaCl, 75 мМ цитрата натрия при 42°С.
Примером условий средней силы для гибридизации является применение 50% формамида, 5 × SSC (0,75 М NaCl, 0,075 мМ цитрата натрия), 50 мМ фосфата натрия (рН 6,8), 0,1% пирофосфата натрия, 5 × раствор Денхардта, обработанная ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% декстрана сульфата при 42°С, при отмывке при 42°С в 0,2 × SSC и 0,1% SDS.
В качестве дополнительного примера, и без ограничения, условия низкой силы включают описанные Shilo and Weinberg в 1981 (Proc. Natl. Acad. Sci. USA, 78: 6789-6792). Когда фильтры с ДНК обрабатывают с использованием данных условий, то обычно их предварительно обрабатывают в течение 6 ч при 40°С в растворе, содержащем 35% формамида, 5 × SSC, 50 мМ Трис-HCl (рН 7,5), 5 мМ ЭДТА, 0,1% PVP, 0,1% Фиколла, 1% ВSA и 500 мкг/мл денатурированной ДНК спермы лосося. Гибридизацию проводят в том же растворе со следующими модификациями: 0,02% PVP, 0,02% Фиколла, 0,2% ВSA, 100 мкг/мл ДНК спермы лосося, 10% (мас./об.) декстрана сульфата и используют 5-20 × 106 имп/мин меченный 32Р зонд. Фильтры инкубируют в смеси для гибридизации в течение 18-20 ч при 40°С и затем промывают в течение 1,5 ч при 55°С в растворе, содержащем 2 × SSC, 25 мМ Трис-HCl (рН 7,4), 5 мМ ЭДТА и 0,1% SDS. Раствор для отмывки заменяют на свежий раствор и инкубируют еще в течение 1,5 ч при 60°С. Фильтры гибридизуют сухими и подвергают авторадиографии. Если необходимо, то фильтры промывают третий раз при 65-68°С и вновь подвергают авторадиографии на пленке. В данной области хорошо известны другие условия низкой силы, которые можно использовать (например, которые применяют для перекрестновидовой гибридизации).
Полинуклеотиды, функционально активные производные, аналоги или варианты ОАТ по изобретению можно получить различными способами, известными в данной области. Например, клонированные полинуклеотиды ОАТ можно модифицировать с использованием любой из многочисленных стратегий, известных в данной области (например, смотри Maniatis, T., 1990, Molecular Cloning, A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.). Последовательность можно расщепить по соответствующим сайтам с помощью рестриктазы(з) с последующей дополнительной ферментативной модификацией, если желательно, выделить и лигировать в условиях in vitro.
Кроме того, кодирующие ОАТ полинуклеотидные последовательности можно подвергнуть мутации в условиях in vitro и in vivo для получения или разрушения функциональных областей или получения вариаций в функциональных областях и/или получения новых сайтов для рестрикционных эндонуклеаз или разрушения уже имеющихся в целях облегчения проведения дополнительной модификации в условиях in vitro. Можно использовать любую методику для проведения мутагенеза, известную в данной области, включая, но не ограничиваясь химическим мутагенезом, сайт-направленным мутагенезом in vitro (Hutchinson et al., 1978, J. Biol. Chem., 253: 6551).
Альтернативно полинуклеотидные варианты полинуклеотидов ОАТ можно получить в результате замен вырожденных кодонов или комплементарных последовательностей. В частности, замены вырожденных кодонов можно провести образованием последовательностей, в которых третье положение одного или более (или всех) кодонов заменяют на остатки смешанных оснований и/или дезоксиинозина (Batzer et al., 1991, Nucleic Acid Res. 19: 5081; Ohtsuka et al., 1985, J. Biol. Chem., 260: 2605-2608; и Rossolini et al., 1994, Mol. Cell. Probes, 8: 91-98). Альтернативно вариант может представлять собой полинуклеотид, который по существу аналогичен SEQ ID NO: 1 (фиг.2) или в который добавляют, который подвергают делеции или заменяют на один или несколько нуклеотидов в 3′- и/или 5′-конце(х) полинуклеотида или внутри полинуклеотида.
В одном варианте осуществления полинуклеотиды ОАТ представляют собой молекулы двухцепочечной ДНК, имеющие, по меньшей мере, 85% идентичность по нуклеотидной последовательности с SEQ ID NO: 1. После идентификации и выделения или конструирования соответствующего трансгена его вставляют в экспрессирующий вектор с помощью стандартных методов. Следовательно, настоящее изобретение также включает экспрессирующий вектор, содержащий трансген по настоящему изобретению. Таким образом, в одном варианте осуществления конструируют экспрессирующий вектор, который содержит выделенную и очищенную молекулу ДНК, включающую промотор, функционально связанный с кодирующей областью для ОАТ, где кодирующая область функционально связана с областью терминации транскрипции, посредством чего промотор регулирует транскрипцию кодирующей области. Кодирующая область может включать сегмент или последовательность, кодирующую ген ОАТ. Молекула ДНК, содержащая экспрессирующий вектор, также может включать интрон растительного происхождения и может также содержать другие элементы растительного происхождения, такие как последовательности, кодирующие нетранслируемые последовательности (UTL), и последовательности, которые функционируют в качестве энхансеров транскрипции или трансляции.
Предпочтительные векторы для трансформации растений включают, но не ограничиваются этим, таковые, полученные из плазмиды Ti Agrobacterium tumefaciens, а также раскрытые, например, Herrera-Estrella (1983), Bevan (1983), Klee (1985) и в заявке на европейский патент 0120516 (каждый из этих источников включен здесь для сведения).
Поскольку для трансформации растения пшеницы предпочтительно используют экспрессирующие векторы по настоящему изобретению, то выбирают промотор, который обладает способностью регулировать экспрессию в данном конкретном виде растений. В данной области также хорошо известны промоторы, которые функционируют в различных видах растений. Промоторы, которые пригодны для экспрессии полипептида в растениях, представляют таковые, которые являются индуцируемыми, вирусными, синтетическими или конститутивными, как уже были описаны (Odell et al., 1985, выше), и/или временно регулируемыми, пространственно регулируемыми и пространственно-временно регулируемыми. Предпочтительные промоторы включают сильные промоторы CaMV35S и промотор FMV35S.
Экспрессия гена, который находится в двухцепочечной ДНК, локализованной в ядерном геноме растения, включает транскрипцию матричной РНК (мРНК) из кодирующей цепи ДНК под действием фермента РНК-полимеразы и последующий процессинг первичного транскрипта мРНК внутри ядра. Область ДНК, называемая «промотором», регулирует транскрипцию ДНК в мРНК. ДНК, содержащая промотор, представляет последовательность оснований, которая дает сигналы для РНК-полимеразы для связывания с ДНК и инициации транскрипции мРНК с использованием одной из цепей ДНК в качестве матрицы для образования соответствующей цепи РНК. Выбранный конкретный промотор должен быть способен обеспечивать достаточную транскрипцию кодирующей последовательности ОАТ с воспроизведением существенной защиты от стресса окружающей среды в полученном растении.
Полинуклеотиды ОАТ по настоящему изобретению могут регулироваться под действием разнообразных промоторов в растительных тканях. Промоторы могут быть почти конститутивными (т.е. они регулируют транскрипцию трансгена во всех тканях), такие как промотор CaMV35S, 1′- или 2′-промотор, полученный из Т-ДНК Agrobacterium tumefaciens, или тканеспецифический или специфический для определенных стадий развития промотор. Сильные или двойные варианты промоторов CaMV35S и FMV35S являются особенно пригодными в практике настоящего изобретения (Kay et al., 1987; Rogers, патент США  5378619). 5378619).
Альтернативно промотор растения может находиться под контролем окружающей среды. Такие промоторы называются здесь «индуцируемыми» промоторами. Примеры условий окружающей среды, которые могут оказывать влияние на транскрипцию под действием индуцируемых промоторов, включают воздействие патогена, анаэробные условия или наличие света.
Предпочтительно использовать промотор, который был бы способен обеспечить высокую экспрессию. Такие промоторы включают, но не ограничиваются промотором убиквитина кукурузы, описанным Christensen and Quail (1996), промотором актина риса, описанным McElroy D., Blowers A.D., Jenes B. и Wu R. (1990), промотором вируса мозаики коммелины, описанный Medberry SL, Lockhart BEL. and Olszewskine (1992).
Очевидно, специалисты в данной области понимают, что имеется ряд промоторов, которые активны в растительных клетках, и они описаны в литературе. Такие промоторы можно получить из растений или вирусов растений, и они включают, но не ограничиваются промоторами нопалинсинтазы (NOS) и октопинсинтазы (OСS) (которые переносят в онкогенных плазмидах A. tumefaciens), 19S- и 35S-промоторами вируса мозаики цветной капусты (CaMV), светоиндуцируемыми промотором из малой субъединицы рибулозо-1,5-бифосфат-карбоксилазы (ssRUBISCO, очень распространенного растительного полипептида), промотором Act1 риса и 35S-промотором вируса мозаики норичника шишковатого (FMV). Все данные промоторы использовали для создания различных типов ДНК-конструкций, которые экспрессировались в растениях (например, смотри McElroy et al., 1990, патент США  5463175). 5463175).
Кроме того, также может быть предпочтительным обеспечить экспрессию полинуклеотида ОАТ при использовании интегрирующих в растения векторов, содержащих тканеспецифический промотор. Конкретные ткани-мишени могут включать лист, стебель, корень, клубень, семя, фрукт и т.д., и выбранный промотор должен обладать желаемой тканеспецифичностью и специфичностью для отдельных стадий развития. Следовательно, функция промотора должна быть оптимизирована выбором промотора со способностью к экспрессии в желаемой ткани и соответствующей силой промотора и выбором трансформанта, в котором создается желаемый уровень устойчивости к стрессу в тканях-мишенях. Обычно применяется данный подход отбора из пула трансформантов по экспрессии гетерологичных структурных генов в растениях, поскольку имеется различие между трансформантами, включающими один и тот же гетерологичный ген, за счет сайта вставки гена в геном растения (обычно называемый «эффектом положения»). В дополнение к промоторам, о которых известно, что они вызывают транскрипцию (конститутивную или тканеспецифическую) ДНК в растительных клетках, можно идентифицировать другие промоторы для применения в настоящем изобретении скринингом библиотеки кДНК растений для генов, которые избирательно или предпочтительно экспрессируются в тканях-мишенях, затем определением промоторных областей.
Другими примерами тканеспецифических промоторов являются промоторы сахарозосинтетазы 1 (Yang et al., 1990), алкогольдегидрогеназы кукурузы (Vogel et al., 1989), светлого урожайного комплекса кукурузы (Simpson, 1986), белка теплового шока кукурузы (Odell et al., 1985, выше), малой субъединицы карбоксилазы RuBP гороха (Poulsen et al., 1986; Cushmore et al., 1983), маннопинсинтазы Ti-плазмиды (McBride and Summerfelt, 1989), нопалинсинтазы Ti-плазмиды (Langridge et al., 1989), калконизомеразы петуньи (Van Tunen et al., 1988), богатого глицином белка 1 бобов (Keller et al., 1989), транскрипта CaMV35S (Odell et al., 1985, выше) и пататина картофеля (Wenzler et al., 1989). Предпочтительными промоторами являются промоторы вируса мозаики цветной капусты (CaMV35S) и малой субъединицы S-E9 карбоксилазы RuBP.
Промоторы, использованные в конструкциях ДНК по настоящему изобретению, если желательно, можно модифицировать для воздействия на их регуляторные характеристики. Например, промотор CaMV35S можно лигировать с участком гена ssRUBISCO, который репрессирует экспрессию ssRUBISCO при отсутствии света, в целях создания промотора, который активен в листьях, но не активен в корнях. Для целей данного описания фраза промотор «CaMV35S» включает вариации промотора CaMV35S, например, промоторы, полученные лигированием с областями оператора, неспецифическим или регулируемым мутагенезом и т.д. Кроме того, промоторы можно изменить таким образом, чтобы они включали множественные «энхансерные последовательности» для способствования высокой экспрессии гена. Kay et al., (1987) сообщили о примерах таких энхансерных последовательностей.
Трансгенное растение по настоящему изобретению, полученное из трансформированной растительной клетки с тканеспецифическим промотором, можно подвергнуть скрещиванию со вторым трансгенным растением, полученным из трансформированной растительной клетки с другим тканеспецифическим промотором, с получением гибридного трансгенного растения, которое проявляет эффекты трансформации в более чем одной определенной ткани.
РНК, полученная из ДНК-конструкции по настоящему изобретению, может также содержать 5′-концевую нетранслируемую лидерную последовательность (5’UTL). Данную последовательность можно получить из промотора, выбранного для экспрессии гена, и можно специфически модифицировать таким образом, чтобы усилить трансляцию мРНК. 5′-концевые нетранслируемые области можно также получить из вирусных РНК, из подходящих эукариотических генов или из последовательности синтетического гена. Настоящее изобретение не ограничивается конструкциями, в которых нетранслируемая область происходит из 5′-концевой нетранслируемой последовательности, которая сопровождает промоторную последовательность. Одной лидерной последовательностью растительного гена для применения в настоящем изобретении является лидер белка теплового шока 70 (hsp70) петуньи (Winter et al., 1988).
5′-концевые UTL способны регулировать экспрессию гена, когда они находятся в последовательности ДНК между сайтом инициации транскрипции и стартом кодирующей последовательности. Собраны данные по лидерным последовательностям для прогноза оптимальных и субоптимальных последовательностей и получения «консенсусных» и предпочтительных лидерных последовательностей (Joshi, 1987). Предусматривается, что предпочтительные лидерные последовательности включают таковые, содержащие последовательности с прогнозом наличия прямой оптимальной экспрессии связанного структурного гена, т.е. включают предпочтительную консенсусную лидерную последовательность, которая может повысить или поддержать стабильность мРНК и предупредить несоответствующую инициацию трансляции. Выбор таких последовательностей будет понятен специалистам в данной области в свете настоящего раскрытия. Наиболее предпочтительными являются последовательности, полученные из генов с высокой экспрессией в растениях и, в частности, в кукурузе. Одним особенно пригодным лидером может быть лидер HSP70 петуньи.
Для оптимизированной экспрессии в экспрессирующую ДНК-конструкцию можно также вставить интрон. Как правило, такой интрон помещают около 5′-конца мРНК в нетранслируемой последовательности. Данный интрон можно получить, но не ограничиваясь этим, из ряда интронов, состоящего из интрона белка теплового шока кукурузы (HSP) 70 (патент США  5424412, 1995), интрона Act1 риса (McElroy et al., 1990), интрона 1 Adh (Callis et al., 1987) или интрона сахарозосинтазы (Vasil et al., 1989). 5424412, 1995), интрона Act1 риса (McElroy et al., 1990), интрона 1 Adh (Callis et al., 1987) или интрона сахарозосинтазы (Vasil et al., 1989).
3′-концевая нетранслируемая область генов по настоящему изобретению, которая находится в ядерном геноме растения, также содержит сигнал полиаденилирования, который функционирует в растениях для добавления аденилатнуклеотидов к 3′-концу мРНК. РНК-полимераза транскрибирует кодирующую последовательность ДНК ядерного генома через сайт, в котором имеет место полиаденилирование. Как правило, последовательности ДНК, расположенные на расстоянии несколько сотен оснований справа от сайта полиаденилирования, служат для терминации транскрипции. Данные последовательности ДНК называются здесь областями терминации транскрипции. Данные области необходимы для эффективного полиаденилирования транскрибированной матричной РНК (мРНК). Примерами предпочтительных 3′-концевых областей являются 1) 3′-концевые транскрибируемые, нетранслируемые области, содержащие сигнал подиаденилирования генов онкогенной (Ti) плазмиды Agrobacterium, таких как ген нопалинсинтазы (NOS) и 2) 3′-концы генов растений, таких как ген малой субъединицы рибулозо-1,5-бифосфаткарбоксилазы гороха, обозначенной здесь как Е9 (Fischhoff et al., 1987). Как правило, конструкции будут включать полинуклеотиды ОАТ наряду с 3′-концевой последовательностью ДНК, которая функционирует в качестве сигнала для терминации транскрипции и в конструкциях, предназначенных для экспрессии ядерного генома, для полиаденилирования полученной мРНК. Наиболее предпочтительными 3′-концевыми элементами рассматриваются таковые, происходящие из гена нопалинсинтазы A. tumefaciens (nos 3′-конец) (Bevan et al., 1983), терминатор транскрипта Т7 из гена октопинсинтазы A. tumefaciens и 3′-конец генов ингибитора I или II протеазы из картофеля или томата. Когда желательно, можно дополнительно включить регуляторные элементы, такие как элемент OMEGA TMV (Gallie et al., 1989).
Для повышения экспрессии можно использовать энхансеры транскрипции или дупликаторы энхансеров. Часто данные энхансеры обнаруживают в 5′-конце от старта транскрипции в промоторе, который функционирует в эукариотических клетках, но часто его можно вставить в прямом и обратном направлении от 5′ к 3′ по отношению к кодирующей последовательности. Примеры энхансеров включают элементы из промотора CaMV35S, генов октопинсинтазы (Ellis et al., 1987), гена актина риса и промотора из эукариотов, не относящихся к растениям (например, дрожжей; Ma et al., 1988).
В некоторых вариантах осуществления изобретения применяют элементы внутренних сайтов связывания рибосомы (IRES) для создания мультигена, или полицистронных мРНК. Элементы IRES способны обходить модель сканирования рибосомы 5′-метилированнной кэп-зависимой трансляции и начинать трансляцию на внутренних сайтах (Pelletier and Sonenberg, 1985). Описаны элементы IRES двух членов семейства пикорнавирусов (вируса полиомиелита и энцефаломиокардита) (Pelletier and Sonenberg, 1988), а также IRES из мРНК млекопитающих (Macejak and Sarnow, 1991). Элементы IRES можно связать с гетерологичными открытыми рамками считывания. Много открытых рамок считывания можно транскрибировать вместе; каждая разделенная IRES, приводя к образованию полицистронных мРНК. С помощью элемента IRES каждая открытая рамка считывания является доступной для рибосом для эффективной трансляции. Можно эффективно экспрессировать много генов с использованием одного промотора/энхансера для транскрибирования одной мРНК.
Любую гетерологичную открытую рамку считывания можно связать с элементами IRES. Это включает гены секретируемых белков, мультисубъединичных белков, кодируемые независимыми генами, гены внеклеточных или связанных с мембраной белков и селектируемых маркеров. Таким образом, можно обеспечить одновременную экспрессию нескольких белков в клетке с использованием одной конструкции и одного селектируемого маркера.
Выбор такого экспрессирующего вектора и, в конечном итоге, с каким промотором будет функционально связан полинуклеотид ОАТ непосредственно зависит от клетки-хозяина, предназначенной для трансформации. Это хорошо известные ограничения, имеющиеся в области конструирования молекул рекомбинантной ДНК. Однако вектор, пригодный для практики настоящего изобретения, способен регулировать экспрессию кодирующей ОАТ области, с которой он функционально связан.
Как правило, вектор, включающий последовательность ОАТ, также будет содержать ген-маркер, который придает растительным клеткам селектируемый фенотип. Например, маркер может кодировать устойчивость к биоциду, в частности, устойчивость к антибиотику, такую как устойчивость к канамицину, G418, блеомицину, гигромицину, или устойчивость к гербициду, такую как устойчивость к хлорслуфорону или фосфинотрицину (активное вещество биалафоса и Баста).
Типичные векторы, пригодные для экспрессии генов в высших растениях, хорошо известны в данной области, и они включают векторы, полученные из онкогенной плазмиды (Ti) A. tumefaciens, описанные (Rogers et al., 1987). Однако известно несколько других интегрирующих векторных систем для функционирования в растениях, включая регуляторный вектор переноса рCaMVCN, описанный (Fromm et al., 1985). рCaMVCN (производства Pharmacia, Piscataway, N.J.) содержит промотор CaMV35S.
В одном варианте осуществления вектор, используемый для экспрессии полинуклеотида ОАТ, включает селективный маркер, который эффективен в растительной клетке. В другом варианте осуществления гены, кодирующие полинуклеотид ОАТ и/или селективный маркер, находятся в двух или более отдельных векторах. Селективные маркеры могут представлять собой селективные маркеры устойчивости к лекарственным препаратам или метаболические селективные маркеры. Одним предпочтительным маркером устойчивости к лекарственным препаратам является ген, экспрессия которого приводит к развитию устойчивости к канамицину; т.е. описан химерный ген, включающий промотор нопалинсинтазы, неомицинфосфотрансферазы II Tn5 (nptII) и 3′-концевую нетранслируемую область нопалинсинтазы (Rogers et al., 1988).
В данной области хорошо известны способы получения экспрессирующих векторов. Экспрессирующие (трансформирующие) векторы, используемые для трансформации растений, и способы получения таких векторов описаны в патентах США  4971908, 4940835, 4769061 и 4757011 (каждый из этих источников включен здесь для сведения). Такие векторы можно модифицировать для включения кодирующей последовательности по настоящему изобретению. 4971908, 4940835, 4769061 и 4757011 (каждый из этих источников включен здесь для сведения). Такие векторы можно модифицировать для включения кодирующей последовательности по настоящему изобретению.
Разнообразные способы были разработаны для функционального связывания ДНК с векторами посредством комплементарных связывающих концов или «затупленных» концов. Например, комплементарные гомополимерные хвосты можно добавить к сегменту ДНК, предназначенному для вставки, и к ДНК-вектору. Затем вектор и сегмент ДНК соединяют образованием водородных связей между комплементарными гомополимерными хвостами с образованием молекул рекомбинантной ДНК.
В одном варианте осуществления двухцепочечную ДНК, кодирующую ОАТ, представленную на фиг.2 (SEQ ID NO 1), лигируют с промотором убиквитина и терминатором зеина с образованием экспрессирующего вектора, названного «pGBA2», который представлен на фиг.1.
Предусматривается также растение пшеницы, трансформированное экспрессирующим вектором по настоящему изобретению. Также предусматривается трансгенное растение, полученное из такой трансформированной или трансгенной клетки. Очевидно, специалисты в данной области понимают, что химерный растительный ген растения, включающий структурную кодирующую последовательность по настоящему изобретению, можно вставить в геном растения способами, хорошо известными в данной области. Такие способы трансформации ДНК растительных клеток включают опосредованную Agrobacterium трансформацию, применение липосом, трансформацию с использованием вирусов или пыльцы, электропорацию, трансформацию протопластов, перенос гена в пыльцу, инъекцию в репродуктивные органы, инъекцию в незрелые зародыши и бомбардировку частицами. Каждый из данных способов имеет отдельные преимущества и недостатки. Таким образом, один конкретный способ введения генов в конкретную линию растений необязательно может быть наиболее эффективным для другой линии растений, но хорошо известны способы, пригодные для каждой линии растений.
Имеется много способов введения трансформирующих сегментов ДНК в клетки, но не все являются подходящими для доставки ДНК в растительные клетки. Полагают, что подходящие способы практически включают любой способ, с помощью которого ДНК можно вставить в клетку, такой как инфицирование A. tumefaciens и близкими штаммами Agrobacterium, прямая доставка ДНК, такая как, например, опосредованная ПЭГом трансформация протопластов (Omirulleh et al., 1993), с помощью опосредованного высушиванием/подавления захвата ДНК, электропорации, перемешивания с волокнами из карбида кремния, ускорения покрытых ДНК частиц и т.д. В некоторых вариантах осуществления способы ускорения являются предпочтительными, например, бомбардировка микрочастицами и тому подобное.
Специалистам в данной области хорошо известна технология введения ДНК в клетки. Описано четыре основных способа доставки гена в клетки: 1) химические методы (Graham and van der Eb, 1973); 2) физические методы, такие как микроинъекция (Capecchi, 1980), электропорация (Wong and Neumann, 1982; Fromm et al., 1985) и генное «ружье» (Johnston and Tang, 1994; Fynan et al., 1993); 3) вирусные векторы (Clapp, 1993; Lu et al., 1993; Eglitis and Anderson, 1988a, 1988b); и 4) опосредуемые рецепторами механизмы (Curiel et al., 1991; 1992; Wagner et al., 1992).
Обработка различных животных и растительных клеток короткими электрическими импульсами высокого напряжения приводит к образованию нанометровых отверстий в плазматической мембране. ДНК непосредственно проходит в клеточную цитоплазму через данные отверстия или в результате перераспределения мембранных компонентов, которое происходит при закрытии отверстий. Электропорация может быть очень эффективной, и ее можно использовать для временной экспрессии клонированных генов и для получения клеточных линий, которые несут интегрированные копии интересующего гена. В противоположность опосредованной кальцием фосфатом трансфекции и слиянию протопластов электропорация часто приводит к образованию клеточных линий, которые несут одну или большей частью несколько интегрированных копий чужеродной ДНК.
Введение ДНК с помощью элекропорации является хорошо известным специалистам в данной области. Для проведения трансформации электропорацией можно использовать рыхлые ткани, такие как суспензионная культура клеток или зародышевый каллус, или альтернативно можно непосредственно трансформировать незрелые зародыши или другие организованные ткани. Следует частично разрушить клеточные стенки выбранных клеток, подвергнув их воздействию разрушающих пектин ферментов (пектолиаз) или механическому разрушению в контролируемых условиях, делая клетки более восприимчивыми к трансформации. Затем такие клетки становятся реципиентами для переноса ДНК электропорацией, которую можно провести на данной стадии, и затем идентифицировать трансформированные клетки подходящим отбором или скринингом в зависимости от природы вновь включенной ДНК.
Дополнительным преимущественным способом доставки трансформирующих сегментов ДНК в растительные клетки является бомбардировка микрочастицами. В данном способе частицы можно покрыть нуклеиновыми кислотами и доставить в клетки с помощью движущей силы. Примеры частиц включают таковые из вольфрама, золота, платины и тому подобное. С использованием данных частиц ДНК переносятся через клеточную стенку и в цитоплазму на поверхности небольших металлических частиц, как это описано (Klein et al., 1987; Klein et al., 1988; Kawata et al., 1988). Металлические частицы проникают через несколько слоев клеток и таким образом обеспечивают трансформацию клеток внутри эксплантатов ткани.
Преимущество бомбардировки микрочастицами, в дополнение к тому, что она является эффективным средством для воспроизводимо стабильной трансформации растительных клеток, заключается в том, что для нее не требуется ни выделения протопластов (Cristou et al., 1988), ни наличия чувствительности к инфицированию Agrobacterium. Показательным вариантом осуществления способа доставки ДНК в растительные клетки ускорением является биолистическая система для доставки частиц, которую можно использовать для доставки частиц, покрытых ДНК или клетками через сито, такое как сито из нержавеющей стали или Nytex, на поверхность фильтра, покрытого культивированными растительными клетками в суспензии. Сито распределяет частицы таким образом, что они не доставляются в клетки-реципиенты в виде крупных агрегатов. Полагают, что сито, расположенное между устройством для частиц и клетками, предназначенными для бомбардировки, приводит к уменьшению размера агрегатов частиц и может вносить свой вклад в обеспечение более высокой частоты трансформации снижением числа повреждений, возникающих в клетках-реципиентах под действием частиц, которые являются слишком крупными.
Для бомбардировки клетки в суспензии предпочтительно концентрируют на фильтрах или на твердой культуральной среде. Альтернативно незрелые зародыши или другие клетки-мишени можно расположить на твердой культуральной среде. Клетки, предназначенные для бомбардировки, располагают на соответствующем расстоянии ниже тормозной платы для микрочастиц. Если желательно, то одно или более сит также можно поместить между ускорительным устройством и клетками для бомбардировки. При использовании приведенной ниже методики можно получить до 1000 или более фокусов клеток, временно экспрессирующих ген-маркер. Количество клеток в фокусе, которые экспрессируют продукт экзогенного гена в течение 48 ч после бомбардировки, часто может находиться в пределах от 1 до 10 и в среднем составлять 1-3.
При трансформации бомбардировкой можно оптимизировать условия культивирования перед бомбардировкой и параметры бомбардировки для получения максимального числа стабильных трансформантов. В данной технологии важными являются физические и химические параметры бомбардировки. Физическими факторами являются таковые, которые включают манипулирование с преципитатом ДНК/микрочастиц, или таковые, которые оказывают влияние на полет и скорость макро- и микрочастиц. Биологические факторы включают все стадии манипуляций с клетками перед и сразу же после бомбардировки, корректировку осмоса клеток-мишеней для избежания повреждения, связанного с бомбардировкой, и также природу трансформирующей ДНК, такую как линеаризованная ДНК или интактные суперспиральные плазмиды. Полагают, что манипуляции перед бомбардировкой имеют особое значение для успешной трансформации незрелых растительных зародышей.
Следовательно, предусматривается, что может быть желательным предварительно скорректировать несколько параметров бомбардировки в маломасштабных исследованиях для полной оптимизации условий. В частности, может быть желательным подвергнуть корректировке физические параметры, такие как длина щели, длина полета, длина ткани и давление гелия. Также можно свести до минимума факторы снижения повреждения (TRF) модификацией условий, влияющих на физиологическое состояние клеток-реципиентов, и которые, следовательно, могут оказать влияние на эффективность трансформации и интеграции. Например, можно подвергнуть корректировке осмотическое состояние, гидратацию ткани и стадию субкультивирования или клеточный цикл клеток-реципиентов для оптимальной трансформации. Специалистам в данной области известно осуществление других обычных корректировок в свете настоящего раскрытия.
Специалистам в данной области хорошо известны способы опосредованной частицами трансформации. В патенте США  5015580 (специально включенном здесь для сведения) описывается трансформация соевых бобов с использованием такой методики. 5015580 (специально включенном здесь для сведения) описывается трансформация соевых бобов с использованием такой методики.
Опосредуемый Аgrobacterium перенос представляет собой широко применяемую систему для введения генов в растительные клетки, поскольку ДНК можно ввести в ткани целого растения, элиминируя тем самым необходимость в регенерации интактного растения из протопласта. В данной области хорошо известно применение опосредованных Аgrobacterium растительных интегрирующих векторов для введения ДНК в растительные клетки. Например, смотри описанные способы (Fraley et al., 1985; Rogers et al., 1987). Генная инженерия растений хлопчатника с использованием опосредованного Аgrobacterium переноса описана в патенте США  5004863 (специально включенном здесь для сведения); как и описана в патенте США 5004863 (специально включенном здесь для сведения); как и описана в патенте США  5349124 трансформация растений латука (специально включенном здесь для сведения); и опосредованная Аgrobacterium трансформация соевых бобов в патенте США 5349124 трансформация растений латука (специально включенном здесь для сведения); и опосредованная Аgrobacterium трансформация соевых бобов в патенте США  5416011 (специально включенном здесь для сведения). Кроме того, интеграция Ti-ДНК представляет собой относительно точный способ, приводящий к незначительным перерасположениям. Область ДНК, предназначенную для переноса, определяют по граничащим последовательностям, и, как правило, вставку ДНК в геном растений проводят, как описано (Spielmann et al., 1988; Jorgensen et al., 1987). 5416011 (специально включенном здесь для сведения). Кроме того, интеграция Ti-ДНК представляет собой относительно точный способ, приводящий к незначительным перерасположениям. Область ДНК, предназначенную для переноса, определяют по граничащим последовательностям, и, как правило, вставку ДНК в геном растений проводят, как описано (Spielmann et al., 1988; Jorgensen et al., 1987).
Современные векторы для трансформации с участием Аgrobacterium способны реплицироваться в E. coli, а также Аgrobacterium, что позволяет проводить соответствующие манипуляции, как описано (Klee et al., 1985). Кроме того, недавние технологические достижения в области векторов для опосредованного Аgrobacterium переноса генов привели к усовершенствованию расположения генов и сайтов рестрикции в векторах для облегчения конструирования векторов, способных экспрессировать различные кодирующие полипептиды гены. Векторы, описанные (Rogers et al., 1987), содержат удобные мультилинкерные области, фланкированные промотором и сайтом полиаденилирования, для непосредственной экспрессии вставленных кодирующих полипептид генов и являются подходящими для настоящих целей. Кроме того, для трансформаций можно использовать Аgrobacterium, содержащие «вооруженные» и «разоруженные» Ti-гены. В сортах растений, для которых является эффективной опосредованная Аgrobacterium трансформация, этот способ является способом выбора за счет простоты его постановки и определенной природы переноса гена.
Оказалось, что опосредованная Аgrobacterium трансформация листовых дисков и других тканей, таких как семядоли и гипокотили, ограничивается растениями, которые инфицируются Аgrobacterium в природе. Опосредованная Аgrobacterium трансформация является наиболее эффективной для двудольных растений. Оказалось, что только некоторые однодольные растения являются естественными хозяевами для Аgrobacterium, хотя описано получение трансгенных растений спаржи с использованием векторов на основе Аgrobacterium (Bytebier et al., 1987). Недавно другие однодольные растения также были трансформированы Аgrobacterium. В эту группу входит кукуруза (Ishida et al., 1996) и рис (Cheng et al., 1998).
Трансгенное растение, полученное с использованием способов трансформации с участием Аgrobacterium, как правило, содержит один ген на одну хромосому. Такие трансгенные растения можно отнести к гетерозиготным в отношении добавленного гена. Однако поскольку использование слова «гетерозиготный», как правило, указывает на присутствие комплементарного гена в том же локусе второй хромосомы из пары хромосом, и такой ген отсутствует в растении, включающем один добавленный ген, как это здесь имеет место, то полагается, что более точным названием такого растения является независимый сегрегант, поскольку добавленный, экзогенный ген независимо расщепляется во время митоза и мейоза.
Независимый сегрегант может быть предпочтительным, когда растение является промышленно доступным в качестве гибрида, такое как кукуруза. В данном случае независимый сегрегант, содержащий ген, подвергают скрещиванию с другим растением с получением растения-гибрида, которое является гетерозиготным в отношении интересующего гена.
Альтернативное преимущество трансгенного растения заключается в том, что оно является гомозиготным для добавленного полинуклеотида ОАТ; т.е. трансгенное растение содержит два добавленных гена, один ген в том же локусе в каждой хромосоме из пары хромосом. Гомозиготное трансгенное растение можно получить половым скрещиванием (самоопылением) независимого сегрегантного трансгенного растения, которое содержит один добавленный ген, развитием некоторых из полученных семян и анализом полученных растений, продуцированных на активность интересующего гена и менделевского наследования, указывая на гомозиготность по сравнению с контрольным (природным, нетрансгенным) или независимым сегрегантным трансгенным растением.
Два различных трансгенных растения можно подвергнуть скрещиванию с получением потомства, которое содержит два независимо расходящихся, добавленных экзогенных гена. Самоопыление соответствующего потомства может дать растения, которые являются гомозиготными для обоих добавленных экзогенных генов, которые кодируют интересующий полипептид. Также предусматривается возвратное скрещивание с родительским растением и трансскрещивание с нетрансгенным растением.
Трансформацию растительных протопластов можно проводить с использованием способов на основе осаждения кальцием фосфатом, обработки полиэтиленгликолем, электропорации и комбинаций данных методов (например, смотри Potrykus et al., 1985; Lorz et al., 1985; Fromm et al., 1985; Uchimiya et al., 1986; Callis et al., 1987; Marcotte et al., 1988).
Применение данных систем для зародышей различных растений зависит от их способности регенерировать такой конкретный сорт растения из протопластов. Описаны показательные методы регенерации злаковых из протопластов (например, смотри Fujimura et al., 1985; Toriyama et al., 1987; Yamada et al., 1986; Abdullah et al., 1986).
Для трансформации зародышей растений, которые невозможно успешно регенерировать из протопластов, можно использовать другие пути для введения ДНК в интактные клетки и ткани. Например, можно проводить регенерацию злаковых из незрелых зародышей или эксплантатов, как это описано (Vasil, 1988).
Также ДНК можно вводить в растения прямым переносом ДНК в пыльцу, как это описано (Zhou et al., 1983; Hess, 1987). Экспрессию генов, кодирующих полипептид, можно обеспечить инъекцией ДНК в репродуктивные органы растения, как это описано (De La Pena et al., 1987). ДНК можно также инъецировать непосредственно в клетки незрелых зародышей и ввести в клетки регидратацией высушенных зародышей, как это описано (Neuhaus et al., 1987; Benbrook et al., 1986).
После проведения доставки экзогенных полинуклеотидов ОАТ в клетки-реципиенты пшеницы следующая стадия получения трансгенных растений пшеницы по настоящему изобретению, как правило, заключается в идентификации трансформированных клеток для дальнейшего культивирования и регенерации растения. Как уже упоминалось выше, для повышения возможности идентифицировать трансформанты может быть желательным использовать селектируемый или выявляемый в скрининге ген-маркер или в дополнении к этому полинуклеотид ОАТ. В данном случае затем, как правило, следует анализировать популяцию потенциально трансформированных клеток, подвергнув клетки воздействию селективного реагента или реагентов, или провести скрининг на наличие признака желаемого гена-маркера.
Примерный вариант осуществления способов идентификации трансформированных клеток включает воздействие на трансформированные культуры селективным реагентом, таким как ингибитор метаболизма, антибиотик, гербицид и тому подобное. Клетки, которые были трансформированы и содержат стабильно интегрированный вставленный ген-маркер, придающий устойчивость к использованному селективному реагенту, будут расти и делиться в культуре. Чувствительные клетки будут не способны к дальнейшему культивированию. Один пример предпочтительного гена-маркера придает устойчивость к глифосату. Когда в качестве селективного маркера используется данный ген, то культуру предполагаемо трансформированных клеток обрабатывают глифосатом. При обработке трансгенные клетки будут доступны для последующего культивирования, в то время как чувствительные или нетрансформированные клетки – нет. Данный способ подробно описан в патенте США  5569834, который специально включен здесь для сведения. Другим примером предпочтительной системы селективного маркера является система резистентности неомицинфосфотрансферазы (nptII), с помощью которой придается резистентность к антибиотику канамицину, как это описано в патенте США 5569834, который специально включен здесь для сведения. Другим примером предпочтительной системы селективного маркера является система резистентности неомицинфосфотрансферазы (nptII), с помощью которой придается резистентность к антибиотику канамицину, как это описано в патенте США  5569834 (который специально включен здесь для сведения). Вновь после трансформации данной системой трансформированные клетки будут подвергаться дальнейшему культивированию при обработке канамицином, в то время как нетрансформированные клетки – нет. Еще одна предпочтительная селективная маркерная система включает применение генной конструкции, придающей устойчивость к паромомицину. Применение данного типа селективной маркерной системы описано в патенте США 5569834 (который специально включен здесь для сведения). Вновь после трансформации данной системой трансформированные клетки будут подвергаться дальнейшему культивированию при обработке канамицином, в то время как нетрансформированные клетки – нет. Еще одна предпочтительная селективная маркерная система включает применение генной конструкции, придающей устойчивость к паромомицину. Применение данного типа селективной маркерной системы описано в патенте США  5424412 (который специально включен здесь для сведения). 5424412 (который специально включен здесь для сведения).
Другая предпочтительная селективная маркерная система включает применение генов, предусмотренных данным изобретением. В частности, у клеток, трансформированных полинуклеотидом ОАТ или его функциональными эквивалентными вариантами, будет развиваться толерантность к соли. Таким образом, растительные клетки, которые содержат молекулу рекомбинантной ДНК, вставленную в их геном, можно отобрать из популяции клеток, в которые не удалось вставить рекомбинантную молекулу, при культивировании клеток и выделении клеток, которые являются устойчивыми к высоким концентрациям соли.
Дополнительно предусматривается, что для идентификации трансформированных клеток будут пригодными комбинации выявляемых в скрининге и селектируемых маркеров. В некоторых типах клеток или тканей селективный реагент, такой как глифосат или канамицин, может не обеспечить в достаточной мере гибели клеток для четкого распознавания трансформированных клеток или может вызвать одинаковое существенное неселективное подавление трансформантов и нетрансформантов, приводя к отсутствию эффективности метода отбора. Предполагается, что селекция с использованием подавляющего рост соединения, такого как глифосат, в концентрациях ниже вызывающих 100% подавление с последующим скринингом культивируемой ткани на экспрессию выявляемого в скрининге гена-маркера, такого как ген, кодирующий резистентность к канамицину, позволит выделять трансформанты от типов клеток или тканей, которые не подвергаются одному отбору. Было предположено, что комбинации отбора и скрининга могут способствовать идентификации трансформантов в более широком ряду типов клеток и тканей.
В данной области хорошо известно развитие или регенерация растений из единичных протопластов растений или различных эксплантатов (Weissbach and Weissbach, 1988). Как правило, данный способ регенерации и роста включает стадии отбора трансформированных клеток, культивирование данных отдельных клеток через обычные стадии эмбрионального развития от стадии приростка с корешком. Трансгенные зародыши и семена регенерируют аналогичным образом. Затем полученные трансгенные корневые побеги высаживают в соответствующую среду для роста растений, такую как почва.
Развитие и регенерацию растений, содержащих чужеродный экзогенный ген, который кодирует интересующий полипептид, введенный с помощью Аgrobacterium из эксплантатов листа, можно обеспечить способами, хорошо известными в данной области, такими как описаны (Horsch et al., 1985). В данном способе трансформанты культивируют в присутствии селективного реагента и в среде, которая индуцирует регенерацию побегов в линии растений, трансформированных, как описано (Fraley et al., 1983). В частности, в патенте США  5349124 (который специально включен здесь для сведения) подробно описывается получение генетически трансформированных клеток и растений латука, экспрессирующих гибридные кристаллические белки, придающие таким растениям инсектицидную активность против личинок Lepidopteran. 5349124 (который специально включен здесь для сведения) подробно описывается получение генетически трансформированных клеток и растений латука, экспрессирующих гибридные кристаллические белки, придающие таким растениям инсектицидную активность против личинок Lepidopteran.
Как правило, с помощью такой методики получают побеги в течение 2-4 месяцев и затем эти побеги переносят в соответствующую индуцирующую рост корней среду, содержащую селективный реагент и антибиотик для профилактики бактериального роста. Проростки, у которых появляются корешки в присутствии селективного реагента для получения всходов, затем переносят в почву или другую среду для получения корней. Данные методы варьируют в зависимости от используемой конкретной линии растения, такие вариации хорошо известны в данной области.
Предпочтительно, чтобы регенерированные растения самоопылялись с получением гомозиготных трансгенных растений, или пыльцу, полученную из регенерированных растений скрещивают с выращенными из семян растениями агрономически важных линий. Данные линии могут быть инбредными или аутбредными линиями. В противоположность пыльцу от растений данных важных линий используют для опыления регенерированных растений. Трансгенное растение по настоящему изобретению, включающее желаемый полипептид, культивируют с использованием способов, хорошо известных специалистам в данной области.
В одном варианте осуществления трансгенное растение по настоящему изобретению содержит повышенное количество генов для мРНК ОАТ. Предпочтительное трансгенное растение является независимым сегрегантом и может передавать данные гены и их активности своему потомству. Более предпочтительное трансгенное растение является гомозиготным для полинуклеотида ОАТ и передает его всему своему потомству при половом скрещивании. Семя от трансгенного растения можно выращивать в открытом грунте или теплице и полученные с половой зрелостью трансгенные растения самоопыляются с получением действительно выведенных растений. Потомство от данных растений становится действительно выведенными линиями, которые оценивают на экспрессию трансгена ОАТ.
Предусматривается, что в некоторых случаях геном трансгенного растения будет увеличиваться за счет стабильного введения одного или более трансгенов ОАТ, природного, синтетически модифицированного или мутантного. В некоторых случаях более чем один трансген будет вставлен в геном клетки трансформированного растения-хозяина. Как это имеет место в случае, когда более чем один кодирующий ОАТ сегмент ДНК включается в геном такого растения. В некоторых ситуациях может быть желательным иметь один, два, три, четыре или даже более генов ОАТ (природных или генно-инженерных), включенных и стабильно экспрессированных в трансформированном трансгенном растении.
В одном варианте осуществления настоящего изобретения у трансгенных растений пшеницы, содержащих повышенное количество полипептидов ОАТ, будет индуцирована или повышена толерантность к стрессу. Термин «толерантность» включает спектр защиты от уменьшения до полного подавления изменения в клеточном метаболизме, которое приводит к уменьшению роста клетки и/или гибели клетки, вызванных стрессовым условием. Предпочтительно, чтобы трансгенные растения пшеницы по настоящему изобретению были толерантными к стрессовым условиям в том смысле, что растения пшеницы были бы способны расти по существу нормально в условиях, при которых соответствующее растение пшеницы дикого типа проявляет замедленный рост, метаболизм, жизнеспособность, продуктивность и/или мужскую или женскую стерильность.
В том смысле, в котором здесь используется данный термин, «толерантность к стрессу» относится к способности расти и продуцировать биомассу по время стресса, способности возобновлять рост и продукцию биомассы после стресса и способности выдерживать стресс. Термин «толерантность к стрессу» также включает способность растения проходить его программу развития во время стресса аналогично растению, которое не находится в стрессовых условиях, например, проходить от покоя до развития и от стадии вегетации до репродукции в стрессовых условиях аналогично растению, которое не находится в стрессовых условиях. Методологии для определения роста и ответной реакции растения на стресс включают, но не ограничиваются определением его высоты, площади листа, связи растения с водой, способности к цветению и способности давать потомство и урожай, или любые другие методологии, известные специалистам в данной области.
Термин «стресс» включает биотический стресс, такой стресс как вызванный патогеном (включая вирусы, бактерии, грибы, насекомые и нематоды) и их комбинации, а также стресс окружающей среды, особенно поскольку отрицательные условия окружающей среды способствуют патогену преодолевать природную толерантность растения к стрессу.
Термин «патоген» означает такие организмы, которые оказывают отрицательное влияние на физиологическое состояние растения. Примеры патогенов включают вирусы, бактерии, грибы, паразиты и вредители, такие как нематоды и насекомые, которые способны оказывать отрицательное влияние на физиологическое состояние растения.
Термин «стресс окружающей среды» получил различные толкования в данной области предшествующего уровня и во многом совпадал с термином «осмотический стресс». Например, Holmberg & Bulow, 1998 (Trends Plant Sci. 3, 61-66) определяют различные стрессовые факторы окружающей среды как таковые, которые приводят к абиотическому стрессу. Соль, засуха, жара, охлаждение и заморозки все описаны в качестве примеров условий, которые вызывают осмотический стресс. Термин «стресс окружающей среды», в том смысле, в котором он используется в настоящем описании, относится к любым отрицательным эффектам на метаболизм, рост или жизнеспособность клетки, ткани, семени, органа и целого растения, которые возникают в результате неживого или небиологического стресса окружающей среды. Конкретнее, он также включает факторы окружающей среды, такие как солевой стресс, водный стресс (затопление, избыток воды, засуха, обезвоживание), анаэробный стресс (низкая концентрация кислорода, СО2 и т.д.), аэробный стресс, осмотический стресс, температурный стресс (жара/тепло, холод, заморозки, мороз) или отсутствие питательных веществ, стресс в результате воздействия загрязнителей (тяжелые металлы, токсические химикаты), озон, высокое освещение и комбинации данных факторов.
В одном предпочтительном варианте осуществления трансгенные растения пшеницы по настоящему изобретению обладают повышенной способностью выдерживать солевой стресс. Термин «солевой стресс», «индуцированный соленостью стресс» или аналогичные термины относятся к любому стрессу, который связан с или возник в результате повышенных концентраций соли и который приводит к изменению в осмотическом потенциале внутриклеточной или внеклеточной среды клетки. В частности, солетолерантные растения пшеницы по настоящему изобретению способны обеспечить повышение урожайности семян, по меньшей мере, на 350% по сравнению с нетрансформированными растениями пшеницы дикого типа в присутствии, по меньшей мере, 150 мМ NaCl.
С использованием, например, методики, описанной в примере 6 ниже, трансгенные растения можно тестировать в гидропонной системе при концентрации соли 150 мМ против промышленно доступного сорта пшеницы, такого как Westonia. Например, 10 трансгенных растений толерантной к соли линии 2490.1 расщеплялись на три степени толерантности к соли (смотри фиг.4). Самая высокая группа 2490.1 имела в 3,5 раза больше семян, с большей массой, числом ростков и числом метелок на растение по сравнению с Westonia и трансгенной группой с низкой толерантностью к соли.
В одном варианте осуществления настоящее изобретение обеспечивает продукт питания, полученный из растения по изобретению. В том смысле, в котором здесь используется данный термин, «продукт питания» означает любое вещество, которое может метаболизироваться в организме с образованием энергии и строительного материала для построения тканей, и он включает жидкий и твердый продукт питания.
В описании слово «содержат» и вариации слова, такие как «содержащий» и «содержит», означает «включая, но не ограничиваясь» и не предназначено для исключения других добавок, компонентов, целых чисел или стадий.
В дальнейшем изобретение будет дополнительно описано при обращении только к следующим, не ограничивающим примерам. Однако следует понимать, что последующие примеры являются только иллюстративными и никоим образом не ограничивают общую применимость изобретения, описанного выше. В частности, несмотря на то, что изобретение описано подробно в отношении применения конкретного гена ОАТ в двух сортах пшеницы, очевидно, понятно, что установленные здесь факты не ограничиваются данным источником генов ОАТ или данными сортами пшеницы.
Пример 1 Ген орнитинаминотрансферазы (ОАТ)
Ген ОАТ выделяли из Arabidopsis thaliana в бинарный вектор. Для трансформации пшеницы ген амплифицировали амплификацией ПЦР и переносили в вектор pGBA2 с использованием сайтов рестрикции BamH1 и Kpn1.
Праймеры для амплификации гена ОАТ с сайтами рестрикции BamH1 (5′-конец) и Kpn1 (3′-конец) были следующими:
Прямой праймер – 5′ GCATGGATCCGCTTCACAATGGCAGCCACCACG
Сайт BamH1 подчеркнут и стартовый кодон выделен жирным шрифтом.
Обратный праймер – 5′ GCATGGTACCGAAAGCTGGGTTCAAGCATAGAGG
Сайт Kpn1 подчеркнут и стартовый кодон выделен жирным шрифтом.
Праймеры, использованные для идентификации гена ОАТ Arabidopsis в трансформированной пшенице, были следующими:
Прямой праймер – 5′ GAGTTGTGACAATGATGCTACTCGTGG
Обратный праймер – 5′ CGAGTACATCGTGAAGAGCCTCAGATCC
Длина предполагаемого продукта ПЦР составляла фрагмент из 770 п.н.
Амплификацию гена ОАТ с сайтами рестрикции BamH1 и Kpn1 проводили с ДНК-полимеразой Pfu (Promega). Использованные реагенты и методика описаны в инструкции к Pfu. Продукт ПЦР подвергли электрофорезу в 1% агарозовом геле и сравнивали с маркерной ДНК размером 1 т.п.н. Амплифицированный продукт выделяли из агарозового геля с использованием набора для очистки ДНК UltracleanTM (Geneworks) согласно инструкциям изготовителя. Вкратце, интересующую полосу вырезали из геля, добавляли 3 объема реагента Ultra-salt и смесь инкубировали при 65°С в течение 5 мин для растворения агарозы. Добавляли 5-7 мкл силикагеля Ultra-Bind и раствор тщательно перемешивали и пробирку инкубировали при комнатной температуре в течение 5 мин для связывания ДНК. Вещество Bresa-Bind/ДНК центрифугировали при 20800 g в течение 5 сек, супернатант отбрасывали и осадок после центрифугирования ресуспендировали в 1 мл раствора Ultra-Wash перемешиванием на вортексе в течение 10 сек. Затем пробирку центрифугировали в течение 5 сек и все следовые количества супернатанта удаляли аспирацией. ДНК элюировали из Ultra-Bind ресуспедированием осадка после центрицугирования в 2 объемах дистиллированной воды, инкубированием при комнатной температуре в течение 5 мин, цетрифугированием в течение 1 мин при 20800 g и удалением супернатанта, содержащего ДНК, в новую пробирку.
Амплификацию фрагмента гена ОАТ для скрининга растений пшеницы, включающих ген, проводили следующим образом: составляющими компонентами для ПЦР были 4 мМ MgCl2, 10 мМ Трис-HCl, 50 мМ KCl, 0,75 мМ dNTP и 0,2 пмоль каждого праймера. Условия реакции были 94°С в течение 3 мин, затем 35 циклов при 94°С в течение 30 сек, 60°С в течение 30 сек и 72°С в течение 2 мин. Реакцию проводили при 72°С в течение 7 мин перед выдерживанием при температуре 15°С. Затем реакционную смесь ПЦР разделяли в 1% агарозовом геле и сравнивали с маркерной ДНК размером 1 т.п.н.
Пример 2 Клонирование гена ОАТ в вектор pGBA2
Продукт ген ОАТ с сайтами рестрикции BamH1 и Kpn1 из примера 1 расщепляли рестриктазами BamH1 и Kpn1 и лигировали в вектор pGBA2, также расщепленный BamH1 и Kpn1 между промотором убиквитина и терминатором зеина. Промотор убиквитина, ген ОАТ и терминатор зеина составляли конструкцию ОАТ (фиг. 1). Компетентные клетки штамма DH10b E. coli трансформировали смесью для лигирования и высевали на агар LB, содержащий ампициллин для отбора клеток E. coli, трансформированных pGBA2. Затем трансформированные колонии E. coli тестировали на присутствие гена ОАТ в плазмиде pGBA2 амплификацией ПЦР фрагмента гена ОАТ размером 770 п.н. Присутствие гена ОАТ подтверждали расщеплением рестриктазами и электрофореграмму сравнивали с предполагаемой электрофореграммой по размерам фрагмента.
Пример 3 Секвенирование гена ОАТ
Секвенирование проводили на одном клоне, идентифицированном в примере 2, с использованием автоматического секвенатора ABI377 (Applied Biosystems Industries) согласно инструкциям изготовителя. Секвенирование проводили с использованием прямого и обратного праймеров из примера 1, с помощью которых получали фрагмент размером 770 п.н., плюс другой внутренний праймер (5′ ACAATTGCTAATGTACGTCC). Программное обеспечение SeqEdTM версию 1.0.3 (Applied Biosystems Industries) использовали для анализа первичных данных по секвенированию и web-программу MultAlin (Corpet, 1988) для сравнения последовательности с предполагаемой последовательностью гена ОАТ Arabidopsis от Genbank (NM 123987). На фиг.2 представлена полученная нуклеотидная последовательность, в то время как на фиг.3 показана аминокислотная последовательность ОАТ.
Пример 4 Получение трансгенных растений пшеницы с конструкцией ОАТ
Получали популяцию трансгенных растений пшеницы, содержащих конструкцию ОАТ, как описано в примере 2, с использованием следующих методик.
Получение конструкции ОАТ
pGBA2, содержащую конструкцию ОАТ, расщепляли НаеII с получением фрагмента, содержащего конструкцию ОАТ, и фрагмент из 177 п.н. из pGBA2 на 5′-конце конструкции и фрагмент из 283 п.н. из pGBA2 на 3′-конце конструкции (фиг.1). Конструкцию ОАТ подвергали электрофорезу на 1% агарозовом геле и ДНК экстрагировали из геля, как описано в примере 1. ДНК ресуспендировали в воде до концентрации 500 нг/мкл.
Ткань-мишень
Растения пшеницы (культуры Westonia и Carnamah) культивировали при 22-24°С в теплице. Собирали семена с незрелыми зародышами через 11-15 суток после цветения и поверхность стерилизовали. Незрелые зародыши извлекали и помещали в среду MS (Murashige and Skoog, 1962), содержащую 2,5 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-D) перед бомбардировкой.
Бомбардировка микрочастицами
Осмотическую обработку тканей-мишеней, осаждение ДНК и бомбардировку микрочастицами проводили, как описано для сахарного тростника (Bower et al., 1996) за исключением использования частиц из вольфрама. Ткани пшеницы подвергали бомбардировке 50 мкг частиц золота на одну бомбардировку. Использованным для бомбардировки линейным фрагментом была линейная конструкция САН (Weeks et al., 2000), кодируемая геном цианамидгидратазы для разрушения цианамида, в эквимолярных концентрациях с линейной конструкцией ОАТ.
Отбор
После бомбардировки зародыши помещали в среду MS, содержащую 2,5 мг/л 2,4-D, на две недели при 24°С в темноте, переносили на ту же среду с добавлением 40 мг/л цианамида (Sigma) еще на шесть недель в тех же условиях культивирования со сменой среды каждые две недели. Затем ткань переносили в среду MS, содержащую 0,1 мг/л 2,4-D и 40 мг/л цианамида, и переносили на свет для регенерации. Через 2 недели ткань переносили в среду MS, не содержащую аспарагин и глутамин, и с 0,1 мг/л 2,4-D и 55 мг/л цианамида (среда С2). Через 2 недели ткань переносили в среду С2 без 2,4-D и с 65 мг/л цианамида (среда С3). Из тканей развивались здоровые проростки, и их переносили на среду 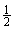 MS, содержащую 65 мг/л цианамида. После появления корней их переносили в смесь для горшочков в теплице. MS, содержащую 65 мг/л цианамида. После появления корней их переносили в смесь для горшочков в теплице.
Пример 5 Трансгенный анализ на основе ПЦР
Для оценки того, содержат или нет растения, полученные в примере 4, трансген для гена ОАТ Arabidopsis фрагмент гена амплифицировали ПЦР.
Метод экстракции ДНК из листа пшеницы подробно описан в инструкциях для набора Nucleon PhytoPureTM (Amersham Biosciences) для экстракции ДНК из растений.
Праймеры для ПЦР и условия амплификации фрагмента размером 770 п.н. описаны в примерах 1 и 2.
Примерно 50% трансгенных растений, полученных в результате отбора, содержали ген ОАТ.
Пример 6 Скрининг на солетолерантность с использованием солевой гидропонной системы
Идентифицировав растения пшеницы с геном ОАТ, трансгенным растениям Т0 давали дать семена и затем собирали семена для скрининга в солевой гидропонной системе.
В предыдущих опытах было установлено, что концентрация соли 150 мМ значительно ухудшает рост растений и приводит к ранней продукции семян.
Семена высевали в кубы из минеральной шерсти (одно семя на куб) и давали возможность взойти и расти в воде до высоты примерно 10 см. Затем растения переносили в 41 горшочек с отверстиями, содержащими базальт (2 см голубого металла). Горшочки помещали в гидропонную непрерывную проточную систему с 1/2 раствора Hoaglands, заполненного на высоту 2 см ниже верхней части базальтового основания. В каждом горшочке находилось 5 растений, и 2 горшочка приходилось на трансгенную линию. Растениям давали адаптироваться к гидропонной системе в течение 3 суток перед доведением концентрации соли в растворе до 50 мМ с использованием смеси NaCl:CaCl2 соответственно в соотношении 9:1. Каждые 3 суток раствор доводили 50 мМ до достижения концентрации соли 150 мМ. Затем концентрацию соли в растворе поддерживали на 150 мМ. Резервуарный бак регулярно пополняли  раствора Hoaglands с учетом испарения и поглощения питательных веществ растениями. раствора Hoaglands с учетом испарения и поглощения питательных веществ растениями.
После завершения цикла развития растений их собирали для исследования фенотипа. Данные исследования включали определения количества ростков на растение, количества метелок на растение, массы семян на растение и количества семян на растение.
Трансгенная линия 2490.1 проявляла толерантность к соли при концентрации соли 150 мМ в гидропонной системе. 10 тестированных растений линии 2490.1 показывали расщепление в отношении солетолерантности при наличии трех достоверно различающихся групп (фиг. 4). Группа с высокой солетолерантностью, и группа со средней солетолерантностью, и группа с отсутствием солетолерантности находились соответственно в соотношении 1:2,5:1,5. Растения трансгенной линии 2490.1 в таблице 1 представляют группу с высокой толерантностью к соли, в то время как нулевые сегреганты представляют растения в группе с отсутствием солетолерантности.
В таблице 1 показано более чем в 3,5 раза повышенное количество ростков, количество метелок и масса семян у сегрегантов 2490.1 с высокой толерантностью к соли по сравнению с Westonia и сегрегантами с низкой толерантностью к соли (отсутствие солетолерантности). У сегрегантов с высокой толерантностью к соли было в 4 раза больше семян по сравнению с двумя типами контролей.
| Таблица 1 |
| Количество ростков, количество метелок, количество семян и масса семян для трансгенных растений с наличием толерантности к соли, промышленно доступного сорта (Westonia) и нулевых сегрегантов. S.D. представляет стандартное отклонение. Трансгенная линия 2490.1 была на основе Westonia. |
| Проба |
Трансгенная линия 2490.1 |
 |
Нулевые сегрегаты |
| Среднее значение |
Стандартное отклонение |
Среднее значение |
Стандартное отклонение |
Среднее значение |
Стандартное отклонение |
| Количество ростков |
13,5 |
3,5 |
2,8 |
1,32 |
3,7 |
1,15 |
| Количество метелок |
11 |
1,4 |
2,6 |
1,17 |
3 |
0 |
| Количество семян |
218 |
57,3 |
49,9 |
24,2 |
52,7 |
13,5 |
| Масса семян |
7,65 |
0,58 |
1,54 |
0,95 |
2,09 |
0,82 |
Пример 7 Оценка толерантности к замораживанию
Семена из поколения Т2 растений, содержащих трансген ОАТ (линии 2490.1 и 2721.1), высевали из расчета 4 семени на горшочек емкостью 4 л (содержащий стерильную смесь для горшочков и удобрение) и культивировали в контролируемых комнатных условиях. Условия в комнате представляли собой 20°С днем (12 ч, начало 3:00 после полудня) и 14°С ночью (12 ч). Примерно за 20 суток до цветения температуру днем снижали на 2°С через каждые 2 суток и температуру ночью на 2°С через каждые 3 суток до конечной температуры днем 8°С и ночью 4°С.
После начала цветения растения переносили в морозильную камеру (излучающая охлаждающая установка и контролируемая температура пола/корней), где температуру опускали с 4°С до -4°С, когда температуру поддерживали в течение 3 ч перед обратным повышением до 4°С. Данную методику проводили в течение 12 ч и после этого растения возвращали в контролируемые комнатные условия. Затем температуру контролируемых комнатных условий повышали для дневной температуры со скоростью 2°С каждые 2 суток и ночную температуру на 4°С каждые 3 суток, начиная с 7 суток после замораживания, до конечной дневной температуры 24°С и ночной температуры 18°С.
Через 13 суток после замораживания оценивали в баллах развитие семян у трансгенных растений и соответствующих контролей по развитию метелок у пшеницы. Оценку в баллах проводили в сравнении с нетрансгенными растениями Westonia, которые не подвергали замораживанию, в качестве фона (0 значения), для замороженных растений Westonia и трансгенной линии 2490.1 и не подвергшимися замораживанию растениями Carnamah в качестве фоновой линии для замороженных растений Carnamah и линии 2721.1. Ряд баллов составлял от 0 до 5, притом что 5 баллов соответствовало незначительному развитию или отсутствию развития семян по сравнению с контролем (базовая линия).
У обеих подвергшихся замораживанию трансгенных линий имело место достоверное ослабление отрицательного влияния замораживания на развитие семян (фиг.5) по сравнению с замороженными контролями (сорта пшеницы Westonia и Carnamah). В среднем отрицательное действие проявлялось в три раза слабее. Следовательно, на основе данных первоначальных установленных фактов можно предположить, что трансгенные растения также являются толерантными к замораживанию.
Список источников литературы




  
Формула изобретения
1. Толерантное к стрессу растение пшеницы, где указанное растение пшеницы трансформировано молекулой нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ).
2. Толерантное к стрессу растение пшеницы по п.1, где молекула нуклеиновой кислоты представляет собой молекулу кДНК, имеющей нуклеотидную последовательность, которая, по существу, представляет таковую, представленную в SEQ ID N0:1 или ее биологически активный фрагмент.
3. Способ защиты растения пшеницы от стресса, включающий стадию введения молекулы нуклеиновой кислоты в растение пшеницы, где молекула нуклеиновой кислоты кодирует орнитинаминотрансферазу (ОАТ).
4. Способ по п.3, в котором стресс представляет соль или засуху.
5. Способ по п.3, в котором стресс представляет присутствие более чем 100 мМ соли.
6. Способ по любому из пп.3-5, в котором молекула нуклеиновой кислоты орнитинаминотрансферазы (ОАТ) выделена из Arabidopsis thaliana.
7. Способ по любому из пп.3-6, в котором растение пшеницы выбрано из группы, состоящей из Triticum aestivum и Tciticum durum.
8. Трансгенное растение пшеницы, растительный материал или его семена, содержащие молекулу нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ), где экспрессия указанной молекулы нуклеиновой кислоты дает трансгенное растение, растительный материал или его семена, которые способны расти в присутствии более чем 100 мМ соли.
9. Конструкция нуклеиновой кислоты, включающая промотор, выделенный из растения и ген орнитинаминотрансферазы (ОАТ), где указанная конструкция способна трансформировать растение пшеницы таким образом, что указанное растение пшеницы становится толерантным к стрессу.
10. Конструкция нуклеиновой кислоты по п.9, где указанный промотор представляет конститутивный промотор, промотор убиквитина, индуцируемый стрессом промотор, тканеспецифический промотор или функционирующий на определенных стадиях развития промотор.
11. Конструкция нуклеиновой кислоты по п.9, где указанный промотор представляет промотор убиквитина.
12. Конструкция нуклеиновой кислоты по п.9, где молекула нуклеиновой кислоты представляет собой молекулу кДНК, имеющую нуклеотидную последовательность, которая, по существу, представляет таковую, представленную в SEQ ID NO:1 или ее биологически активный фрагмент.
13. Способ получения трансгенного растения пшеницы с индуцируемой или повышенной толерантностью к соли, где способ включает стадии:
a) трансформации растительной ткани или клетки растения пшеницы молекулой нуклеиновой кислоты, которая кодирует орнитинаминотрансферазу (ОАТ);
b) регенерации ткани или клетки в целое растение, и
c) экспрессии ОАТ в регенерированном растении в течение времени и в условиях, достаточных для индукции или повышения толерантности растения к концентрации соли более чем 100 мМ.
РИСУНКИ
|
|