|
|
(21), (22) Заявка: 2006140528/13, 16.11.2006
(24) Дата начала отсчета срока действия патента:
16.11.2006
(43) Дата публикации заявки: 27.05.2008
(46) Опубликовано: 20.12.2009
(56) Список документов, цитированных в отчете о
поиске:
US 6582951 B1, 24.06.2003. US 6004776 A, 21.12.1999.
Адрес для переписки:
117545, Москва, 1-й Дорожный пр-д, 1, ФГУП ГосНИИгенетика
|
(72) Автор(ы):
Юзбашев Тигран Владимирович (RU),
Соболевская Татьяна Ивановна (RU),
Тихонова Евгения Юрьевна (RU),
Выборная Татьяна Владимировна (RU),
Лаптев Иван Александрович (RU),
Синеокий Сергей Павлович (RU)
(73) Патентообладатель(и):
Федеральное государственное унитарное предприятие “Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов” (ФГУП ГосНИИгенетика) (RU)
|
(54) ИНТЕГРАТИВНЫЙ ВЕКТОР Random-URA3-RPT ДЛЯ ПОСЛЕДОВАТЕЛЬНОГО ВВЕДЕНИЯ МНОЖЕСТВЕННЫХ КОПИЙ ГЕНЕТИЧЕСКИХ ЭЛЕМЕНТОВ В ДРОЖЖИ Yarrowia lipolytica
(57) Реферат:
Изобретение относится к области биотехнологии и генной инженерии. Получен новый интегративный вектор Random-URA3-RPT для последовательного повышения копий в штаммах дрожжей Yarrowia lipolytica. Вектор может быть использован для оптимизации продукции различных ферментов и карбоновых кислот путем повышения количества копий в геноме любых необходимых генетических элементов, влияющих на их биосинтез. 4 ил., 1 табл.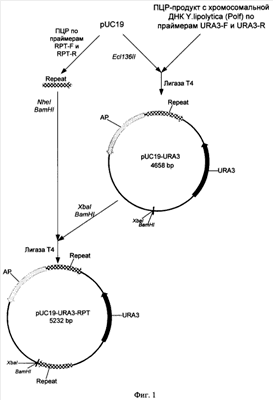
Изобретение относится к микробиологической промышленности и может быть использовано для увеличения продуктивности дрожжей Yarrowia lipolytica по целевому продукту.
Дрожжи рода Yarrowia являются важным биотехнологическим продуцентом ряда карбоновых кислот и ферментов. При этом одним из важных и эффективных методов увеличения продукции белков, наряду с использованием сильных промоторов, является повышение числа копий структурного гена в штаммах продуцентах белков.
Наиболее распространенный способ повышения количества копий генов в штаммах дрожжей заключается в использовании вектора, содержащего участок, имеющий множественную гомологию в геноме штамма реципиента, и дефектный селективный маркер, т.е. селективный маркер, имеющий сниженный уровень экспрессии. В качестве участка, имеющего множественную гомологию в геноме, используют как рибосомальные гены rDNA (US 5786212), так и фрагменты транспозонов (US 5629203, US 6582951). В качестве дефектных маркеров, как правило, используют гены комплементирующие ауксотрофность по азотистым основаниям и аминокислотам LEU2, TRP1 или URA3 и имеющие делетированную промоторную часть, что приводит к снижению их активности (US 6090574, US 6004776, US 5786212, US 6582951).
Один из недостатков метода, основанного на использовании повторяющихся в геноме последовательностей, состоит в образовании при интеграции тандемных повторов. При эффективной экспрессии структурного гена тандемные повторы по механизму гомологичной рекомбинации могут выщепляться, что приводит к нестабильности штамма.
Для культуры Y.lipolytica решение этой проблемы предложено в патенте US 6582951, где для трансформации использовались штаммы, не содержащие транспозонных повторов Zeta, что снизило эффективность трансформации, но позволило получить стабильные многокопийные трансформанты.
К недостаткам ближайшего аналога можно отнести ограничение максимального количества копий и невозможность повторного использования маркера. Кроме того, при единовременном встраивании большого числа копий, учитывая влияние у эукариот так называемого «эффекта положения», достаточно вероятно встраивание части копий в неудачный, «молчащий» участок генома, что подтверждается несогласованностью между количеством копий и уровнем экспрессии у трансформантов, полученных этим методом.
Задача изобретения состоит в конструировании интегративного вектора для многокопийной трансформации штаммов Y.lipolytica, позволяющего трансформировать штамм любым необходимым количеством копий с повторным использованием селективного маркера, осуществлять контроль над повышением продукции при добавлении каждой копии и не образующий тандемных повторов.
Задача решена путем конструкции вектора, представляющего собой ПЦР продукт, в котором в качестве селективного маркера используется ген URA3 Y.lipolytica, ограниченный прямыми повторами длиной не менее 100 п.о., а по краям молекулы в качестве участков интеграции используются случайные последовательности длиной не менее 18 п.о., при этом по крайней мере с одной из сторон между прямым повтором и участком интеграции содержится полилинкер.
Использование при трансформации в качестве вектора ПЦР-амплификата с матричной плазмиды, ограниченного по обоим фланкам участками случайной последовательности, позволяет увеличить число участков потенциального встраивания. Случайные последовательности на концах молекулы вектора также позволяют предотвратить повторное встраивание конструкции в предыдущую копию. Использование URA3 маркера обусловлено возможностью проведения контрселекции на токсичном аналоге 5-FOA, что позволяет проводить вырезание маркера по прямым повторам и использовать его многократно для введения каждой последующей копии вектора.
Именно такое сочетание элементов вектора дает возможность последовательно трансформировать штамм по одной копии вектора неограниченное число раз, что в свою очередь позволяет вести контроль удачного встраивания каждой копии по повышению продукции целевого гена и последовательно доводить количество копий до того момента, пока наблюдается эффект от повышения их количества.
Для оценки эффективности предложенного вектора многокопийной трансформации была сконструирована производная матричная плазмида pR-hp4d-lip2 на основе вектора pUC19. Плазмида содержит экспрессионную кассету с геном LIP2, кодирующим липазу Y.lipolytica, под регуляцией синтетического промотора hp4d и с собственным терминатором. На базе этой плазмиды в примере описано конструирование трансформанта, содержащего в геноме две копии гена LIP2 Y.lipolytica под регуляцией промотора hp4d и продуцирующего липазу до 1150 ед/мл за 10 дней ферментации в жидкой среде в качалочных колбах.
Изобретение проиллюстрировано следующими чертежами:
Фиг.1. Схема получения базовой матричной плазмиды pUC19-URA3-RPT.
Фиг.2. Схема получения матричной плазмиды pR-hp4d-lip2.
Фиг.3. Схема матричной плазмиды pR-hp4d-lip2 для последовательного введения копий и механизм вырезания маркера URA3.
Фиг.4. Чашечный тест на липазную активность трансформантов, несущих одну копию pR-hp4d-lip2. Polf – негативный контроль.
Пример 1: Получение базовой матричной плазмиды pUC19-URA3-RPT
Для селекции и дальнейшего вырезания селективного маркера URA3 получают конструкцию, содержащую ген URA3, ограниченный с обеих сторон прямыми повторами (Фиг.1). Фрагмент ДНК размером 1972 п.н., кодирующий аминокислотную последовательность, промоторную и терминаторную области гена URA3 Y.lipolytica, получают при помощи ПЦР с использованием Pfu-полимеразы (Fermentas Inc.) и праймеров: ATCGATCGACAAAGGCCTG (URA3-F) и GAGTATACCTGTACAGAC (URA3-R). В качестве матрицы для ПЦР используют тотальную геномную ДНК штамма Polf Y.lipolytica (ATCC MYA-2613), полученную по методу, описанному в Kaiser et., al. (1994) Methods in Yeast Genetics. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory. Фрагмент ДНК размером 593 п.н., кодирующий последовательность повтора (Repeat) получают при помощи ПЦР с использованием Pfu-полимеразы (Fermentas Inc.) и праймеров: AAGGATCCCATTTATCAGGGTTATTGTCTC (RPT-F) и TATATTCTAGAGCTAGCACTGGCCGTCGTTTTACAAC (RPT-R). Матрицей для ПЦР служит плазмида pUC19.
Два полученных фрагмента амплифицированной ДНК очищают после электрофореза в 1% агарозном геле методом экстракции ДНК (Kit #K0513, Fermentas Inc.).
0,5 мкг полученного после амплификации фрагмента ДНК URA3 лигируют с 0,2 мкг ДНК вектора pUC19, обработанного эндонуклеазой рестрикции Ес1136II и трансформируют в Е. coli XL1 (Blue). Клоны, содержащие необходимую вставку амплифицированной ДНК размером 1972 п.н., отбирают на чашках по устойчивости к ампициллину и стандартному тесту на отсутствие активности  -галактозидазы. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом и секвенируют (стандартные праймеры M13/pUC 17-mer, M13/pUC reverse 17-mer). Полученная плазмида размером 4658 н.п. названа pUC19-URA3. -галактозидазы. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом и секвенируют (стандартные праймеры M13/pUC 17-mer, M13/pUC reverse 17-mer). Полученная плазмида размером 4658 н.п. названа pUC19-URA3.
0,5 мкг полученного после амплификации фрагмента ДНК Repeat обрабатывают эндонуклеазами рестрикции NheI и BamHI, далее лигируют с 0,2 мкг ДНК вектора pUC19-URA3, обработанной рестриктазами XbaI и BamHI Ес1136II и трансформируют в Е. coli XL1 (Blue). Полученная плазмида размером 5232 н.п.названа pUC19-URA3-RPT.
Пример 2: Получение матричной плазмиды для экспрессии гена LIP2 Y.lipolytica pR-hp4d-lip2
0,4 мкг фрагмента, полученного после обработки вектора pMH-LIP2 эндонуклеазами рестрикции XmaJI и NheI, лигируют с 0,2 мкг ДНК вектора pUC19-URA3-RPT, обработанного эндонуклеазами рестрикции NheI и XbaI, и далее трансформируют в Е. coli XL1 (Blue). Полученная плазмида размером 6906 н.п.содержит ген LIP2 Y.lipolytica, кодирующий липазу, под регуляцией промотора hp4d и названа pR-hp4d-lip2 (Фиг.2).
Пример 3: Получение вектора R-hp4d-lip2, его введение в штамм Polf Y.lipolytica и анализ продукции
Вектор R-hp4d-lip2 получают путем амплификации методом ПЦР с матричной плазмиды pR-hp4d-lip2, используя праймеры: 5′-N20GTTGAATACTCATACTCTTCC (Random-F) и 5′-N20AGCACTACTAGACGCGTGCCATTCGATCGCATGCTG (Random-R), которые на 5′ -конце содержат случайную последовательность длиной в 20 нуклеотидов (Фиг.3)
Трансформацию штамма Polf Y.lipolytica осуществляют литиевым методом (Current Genetic, 1989, vol 16, pp.253-260) с использованием 300 нг очищенного ПЦР-продукта.
Селекцию трансформантов ведут по комплементации ауксотрофности по урацилу на минимальной среде YNB (Himedia) с добавлением глюкозы (2 мас.%) и лейцина (0,01 мас.%).
Липазную активность 32 трансформантов первоначально оценивают в чашечном тесте с трибутиратом по зонам прояснения. В тесте используют минимальную среду YNB с добавлением глюкозы (5 мас.%), трибутирата (2 мас.%) и лейцина (0,02 мас.%). В качестве контрольного взят штамм Polf Y.lipolytica с комплементированной ауксотрофностью по урацилу. Из результатов теста видно, что часть трансформантов имеет уровень продукции секретируемой липазы, сравнимый с контролем (Фиг.4), что можно объяснить гомологичным встраиванием вектора.
Трансформантов, показавших наибольшее соотношение диаметра зоны к диаметру колонии на чашках с трибутиратом, проверяют на наличие интегрированного в геном вектора методом ПЦР с хромосом трансформантов по праймерам AAGGATCCCATTTATCAGGGTTATTGTCTC и CCTAGGCCATTCGATCGCATGCTG. Полученный фрагмент длиной 4800 н.п. соответствует длине полного вектора, что указывает на прохождение негомологичной интеграции вектора по случайной последовательности в 20 н.п.
Ферментацию клонов, показавших наибольшее соотношение диаметра зоны к диаметру колонии на чашках с трибутиратом, проводят в минимальной среде YNB с добавлением оливкового масла (5 мас.%), глюкозы (5 мас.%) и лейцина (0,02 мас.%) в колбах (750 мл) с рабочим объемом 50 мл. В качестве контроля используют штамм Polf Y.lipolytica с комплементированной ауксотрофностью по урацилу и лейцину, а также дикий штамм W29 (CLIB 89), предшественник штамма Polf. Ферментацию продолжают 10 дней, пробы отбирают каждые 24 часа. Липазную активность измеряют методом, основанным на гидролизе п-нитрофенилбутирата с образованием бутирата и п-нитрофенола (Appl. Microbiol. Biotechnol., 2003, vol. 63, pp.136-142). Единица липазной активности соответствует такому количеству фермента, которое высвобождает 1 мкмоль п-нитрофенола за минуту в 1 мл рабочего раствора.
Результаты, представленные в таблице, свидетельствуют об успешной экспрессии введенного гена липазы.
| Липазная активность клонов с одиночной копией гена липазы LIP2 под гибридным промотором hp4d |
 клона клона |
ЛА, ед/мл |
| 3 день ферментации |
5 день ферментации |
10 день ферментации |
| 1 |
163,6 |
497 |
144,7 |
| 2 |
97,4 |
144 |
177,3 |
| 3 |
183,8 |
353,5 |
607,8 |
| 4 |
144,2 |
382,3 |
422,2 |
| 5 |
67,4 |
135,2 |
233,2 |
| Polf×leu+×ura+ |
13,4 |
0 |
0 |
| W29 |
61,5 |
8,95 |
0 |
Пример 4: Получение и анализ трансформантов, содержащих две копии гена LIP2 под контролем гибридного промотора hp4d
Для получения клона с вырезанным по прямым повторам маркером URA3 применяют метод селекции на минимальной среде с 5-FOA (Mol. Gen. Genet., 1984, vol.197, pp.345-346). Частота рекомбинации по прямым повторам – около 10-4. Введение второй копии гена липазы осуществляют путем повторной трансформации полученного штамма ПЦР-продуктом R-hp4d-lip2. Трансформацию, отбор лучших трансформантов в чашечном тесте и их ферментацию в жидкой среде проводят, как в примере 3.
Максимальная липазная активность штамма Y. lipolityca, содержащего две копии гена липазы lip2 под контролем гибридного промотора hp4d, достигает 1150 ед./мл за 10 дней ферментации, что в два раза больше максимальной активности трансформанта с одной копией гена. Это свидетельствует о том, что липазная активность Y. lipolityca возрастает пропорционально увеличению числа копий гена липазы.
Таким образом, к существенным преимуществам заявленного вектора можно отнести отсутствие ограничения на повышение его копий в геноме, возможность дальнейшего использования маркера и возможность отслеживания повышения продукции при встраивании каждой последующей копии структурного гена, что позволяет избежать негативного влияния «эффекта положения».
Формула изобретения
Интегративный вектор Random-URA3-RPT для последовательного введения множественных копий генетических элементов в дрожжи Yarrowia lipolytica, представляющий собой ПЦР продукт, в котором в качестве селективного маркера использован ген URA3 Y. lipolytica, ограниченный прямыми повторами длиной не менее 100 п.о., а по краям молекулы в качестве участков интеграции использованы случайные последовательности длиной не менее 18 п.о., при этом по крайней мере с одной из сторон, между прямым повтором и участком интеграции содержится полилинкер.
РИСУНКИ
|
|