|
|
(21), (22) Заявка: 2005118419/13, 13.11.2003
(24) Дата начала отсчета срока действия патента:
13.11.2003
(30) Конвенционный приоритет:
15.11.2002 US 60/426,592
(43) Дата публикации заявки: 20.01.2006
(46) Опубликовано: 20.12.2009
(56) Список документов, цитированных в отчете о
поиске:
RU 2209082 С2, 27.07.2003. WO 0228165, 11.04.2002. MONATH TP, ARROYO J, MILLER С, GUIRAKHOO F. West Nile virus vaccine. Curr Drug Targets Infect Disord. 2001 May; 1(1): 37-50. Review.
(85) Дата перевода заявки PCT на национальную фазу:
15.06.2005
(86) Заявка PCT:
US 03/36623 20031113
(87) Публикация PCT:
WO 2004/045529 20040603
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
АРРОЙО Хуан (US),
МИЛЛЕР Чарльз М. (US),
КАТАЛАН Джон Аврам (US),
МОНАТ Томас П. (US)
(73) Патентообладатель(и):
ЭКЭМБИС, ИНК. (US)
|
(54) ВАКЦИНА ПРОТИВ ВИРУСА ЛИХОРАДКИ ЗАПАДНОГО НИЛА
(57) Реферат:
Изобретение относится к области вирусологии и молекулярной биологии. Предложены генетическая конструкция для стимуляции иммунного ответа против вируса Западного Нила, а также химерный флавивирус, способ индукции иммунного ответа, способ получения химерной флавивирусной вакцины и применение химерного флавивируса для вакцинации. Изобретение может быть использовано для профилактики или лечения инфекции, вызванной вирусом Западного Нила. 5 н. и 15 з.п. ф-лы, 8 табл., 1 ил.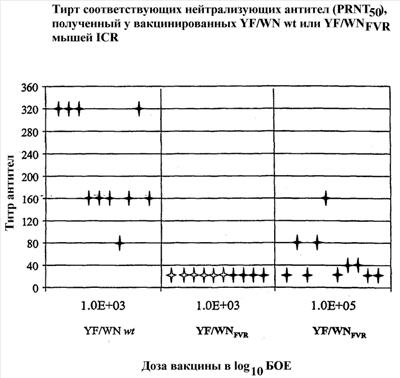
Описание
Настоящее изобретение относится к вакцинам против вируса лихорадки Западного Нила.
Предпосылки создания изобретения
Вирус Западного Нила (WN) начиная с самого раннего его обнаружения в северном полушарии продолжал быстро распространяться по Северной Америке. Первые случаи в районе Нью-Йорка были диагностированы в 1999 г., и до 2002 г. человеческая смертность возросла до более 150 случаев, и вирус продолжал распространяться, достигнув Калифорнии. Появление инфицированных/мертвых птиц показывает, что существует большой резервуар инфицированных москитов в географических областях, где встречается данная инфекция. К настоящему времени не существует эффективного лекарственного лечения от вируса Западного Нила, и методы сдерживания заболеваемости и профилактики не оказывают значительного влияния на число случаев инфекции у людей. Таким образом, риск миграции вируса на Южно-Американский континент, а также эпидемий в слаборазвитых странах чрезвычайно велик.
Вирус Западного Нила является представителем семейства флавивирусов. Эти вирусы являются мелкими, оболочечными РНК-вирусами с положительной цепью, которые являются причиной многих случаев заболеваний у человека и животных по всему миру. Примеры флавивирусов, кроме вируса Западного Нила, включают вирус желтой лихорадки, вирус японского энцефалита и вирусы Денге.
Белки флавивирусов продуцируются трансляцией единственной длинной открытой рамкой считывания с образованием полипротеина, который подвергается сложной серии посттрансляционных протеолитических расщеплений комплексом протеаз хозяина и вирусных протеаз с образованием зрелых вирусных белков (Amberg et al., J. Virol. 73: 8083-8094, 1999; Rice,  Flaviviridae Flaviviridae , In Virology, Fields (ed.), Raven-Lippincott, New York, 1995, Volume I, p.937). Структурные белки вирусов собираются в полипротеин по порядку С-рrМ-Е, где «С» является капсидом, «рrМ» (или предмембранный) является предшественником вирусного, связанного с оболочкой М (мембранного) белка, и «Е» является оболочечным белком. Эти белки присутствуют в N-концевой области полипротеина, тогда как неструктурные белки (NS1, NS2А, NS2 В, NS3, NS4А, NS4 В и NS5) расположены в С-концевой области полипротеина. , In Virology, Fields (ed.), Raven-Lippincott, New York, 1995, Volume I, p.937). Структурные белки вирусов собираются в полипротеин по порядку С-рrМ-Е, где «С» является капсидом, «рrМ» (или предмембранный) является предшественником вирусного, связанного с оболочкой М (мембранного) белка, и «Е» является оболочечным белком. Эти белки присутствуют в N-концевой области полипротеина, тогда как неструктурные белки (NS1, NS2А, NS2 В, NS3, NS4А, NS4 В и NS5) расположены в С-концевой области полипротеина.
Краткое изложение изобретения
Данное изобретение относится к молекулам нуклеиновой кислоты, которые включают последовательности, кодирующие предмембранные и оболочечные белки вируса Западного Нила и капсидные и неструктурные белки вируса желтой лихорадки. Предмембранные и оболочечные белки вируса Западного Нила этих химер включают одну аттенуирующую мутацию или несколько, которые могут быть, например, заменой аминокислоты в положениях 107, 316 и/или 440 оболочечного белка. В качестве конкретных примеров заменой аминокислоты в положении 107 может быть замена лейцина на фенилаланин (или его консервативную аминокислоту); заменой аминокислоты в положении 316 может быть замена аланина на валин (или его консервативную аминокислоту); и заменой аминокислоты в положении 440 может быть замена лизина на аргинин (или его консервативную аминокислоту).
Данное изобретение также относится к химерным флавивирусам, кодируемым молекулами нуклеиновых кислот, описанных здесь, а также способам индукции иммунного ответа против вируса Западного Нила у субъекта путем введения таких химерных флавивирусов. Кроме того, данное изобретение относится к использованию таких химерных флавивирусов в способах вакцинации и их применению в способах изготовления лекарственных препаратов для использования для таких способов. Способы, описанные здесь, могут применяться для субъектов, которые подвергаются риску развития, но у них нет инфекции, вызываемой вирусом Западного Нила, а также для субъектов, которые инфицированы вирусом Западного Нила. Данное изобретение также относится к способам получения химерных флавивирусов, описанных здесь.
Данное изобретение имеет несколько преимуществ. Например, как описано более детально ниже, аттенуирующие мутации вирусов данного изобретения дают в результате сниженную нейровирулентность, и, кроме того, не оказывают значительного побочного действия на способность вирусов вызывать эффективный иммунный ответ. Таким образом, вирусы по настоящему изобретению обеспечивают эффективный и безопасный подход к профилактике и лечению инфекции, вызываемой вирусом Западного Нила.
Другие признаки и преимущества данного изобретения будут очевидны из следующего далее подробного описания и формулы изобретения.
Краткое описание чертежа
На фиг.1 представлен график, показывающий титр соответствующих нейтрализующих антител (PRNT50), получаемый у мышей IСR, вакцинированных вирусом YF/WN wt или YF/WNFVR. Показаны индивидуальные титры нейтрализующих антител против вируса YF/WN wt. Белые символы обозначают мышей, которые не выжили после внутрибрюшинного заражения штаммом WNV NY-99. 100%-ное выживание было получено в группах, вакцинированных дозой 103 БОЕ (бляшкообразующая единица) YF/WN wt и дозой 105 БОЕ YF/WNFVR. В группе, вакцинированной 103 БОЕ YF/WNFVR, после заражения выжили только 40% мышей.
Подробное описание
Данное изобретение относится к вакцинам и способам их применения для профилактики и лечения инфекции, вызываемой вирусом Западного Нила (WN). Способы данного изобретения включают вакцинацию субъектов живым аттенуированным химерным флавивирусом, который состоит из вируса желтой лихорадки, у которого предмембранный и оболочечный белки были заменены белками вируса Западного Нила. Белки вируса Западного Нила у химер данного изобретения включают одну или более аттенуирующих мутаций, которые дополнительно описаны ниже.
Основные способы конструирования и применения химерных флавивирусов, которые можно использовать в данном изобретении, подробно описаны, например, в патентных заявках США с серийными номерами 09/007664, 09/121587 и 09/452638; в международных заявках РСТ/US 98/03894 (WО 98/37911) и РСТ/US00/32821 (WО 01/39802) и в Chambers et al., J. Virol. 73: 3095-3101, 1999, каждая из которых включена здесь в качестве ссылки в полном объеме. Как описано дополнительно ниже, эти способы модифицированы для использования по данному изобретению путем включения стадии введения одной или нескольких аттенуирующих мутаций во вставочные последовательности вируса Западного Нила. Методы, которые можно использовать для получения вирусов по данному изобретению, также описаны в РСТ/US03/01319 (WО 03/060088 А2), который приведен здесь в качестве ссылки.
В одном из примеров химерного вируса по данному изобретению аттенуирующая мутация расположена в положениях 107, 316 или 440 (или их сочетания) оболочечного белка вируса Западного Нила. Мутации, таким образом, могут быть, например, в одной или нескольких аминокислотах 102-112, 311-321 и/или 435-445 оболочечного белка вируса Западного Нила. В качестве конкретного примера, используя в качестве исходной последовательность штамма вируса Западного Нила NY99-flamingo-382-99 (инвентарный номер в GenBank АF196835), лизин в положении 107 можно заменить фенилаланином, аланин в положении 316 можно заменить валином и/или лизин в положении 440 можно заменить аргинином. Кроме указанных выше аминокислот можно производить замены другими аминокислотами, такими как аминокислоты, которые давали бы в результате консервативное изменение аминокислот, указанных выше.
Консервативные замены обычно включают замены в следующих группах: глицин, аланин, валин, изолейцин и лейцин; аспарагиновая кислота, глютаминовая кислота, аспарагин и глютамин; серин и треонин; лизин и аргинин и фенилаланин и тирозин. В конкретном примере химера данного изобретения включает каждую из специфических замен, указанных выше. Кроме того, как обсуждается дополнительно ниже, в химерных вирусах по данному изобретению могут быть также изменены другие остатки (например, в положениях 138, 176 и/или 280).
Вакцины по данному изобретению можно вводить в количестве и с использованием методов, которые легко могут быть определены специалистами в данной области. Вакцины могут применяться и быть получены, например, в виде жидкости, собираемой из клеточных культур, инфицированных химерным вирусом. Живой аттенуированный химерный вирус может быть получен в виде стерильного водного раствора, содержащего от 102 до 108, например от 106 до 107, инфицирующих единиц (например, бляшкообразующих единиц ( БОЕ ) или инфекционных доз тканевой культуры) в объеме дозы от 0,1 до 1,0 мл для введения, например, подкожным, внутримышечным или внутрикожным путем. Кроме того, может быть выбран путь введения через слизистые оболочки, такой как пероральный путь введения. Выбор соответствующего количества химеры для введения может быть осуществлен специалистами в данной области, и это количество может изменяться в зависимости от многих факторов, например массы и общего состояния здоровья субъекта, которому вводят эту химеру. Субъект может быть вакцинирован один раз, или, если необходимо, может иметь место дополнительная иммунизация.
Как отмечено выше, вакцины можно вводить в качестве первичных профилактических средств субъекту, который подвергается риску инфицирования вирусом Западного Нила. Вакцины можно также использовать как вторичные средства для лечения инфицированных вирусом Западного Нила субъектов путем стимуляции иммунного ответа к инфицирующему вирусу. Также, хотя и не требуется, для усиления иммуногенности химерных вакцин против вируса Западного Нила можно использовать адъюванты. Выбор соответствующих адъювантов может быть легко осуществлен специалистом в данной области.
Изобретение частично основано на следующих экспериментальных результатах.
Экспериментальные результаты
Чтобы улучшить характеристики безопасности химерной вакцины из вирусов Западного Нила/ желтой лихорадки заявители изобретения исследовали, снизят ли нейровирулентность аттенуирующие точечные мутации в оболочечном белке. Как подробно описано ниже, авторами была сконструирована химера YF/WN, у которой отсутствует нейроинвазивность вируса Западного Нила, на мышах, и которая менее нейровирулентна, чем вакцинный штамм желтой лихорадки 17D YF, на моделях с мышами и обезьянами. Ниже приведено описание мутагенеза оболочечного белка и оценка безопасности, иммуногенности и эффективности этого и родственных вирусов на моделях с мышами и макаками-резусами.
Материалы и методы
Химерные конструкции YF/WN и молекулярные методики
Химерные флавивирусы были сконструированы с использованием технологии ChimeriVax , которая включает использование двухплазмидной системы, которая была описана ранее (смотри, например, патентные заявки США , которая включает использование двухплазмидной системы, которая была описана ранее (смотри, например, патентные заявки США   09/007664, 09/121587 и 09/452638; международные заявки РСТ/US98/03894 (WО 98/37911) и РСТ/US00/32821 (WО 01/39802); и Chambers et al., J. Virol. 73: 3095-3101, 1999). Двухплазмидная система обеспечивает стабильность плазмиды в E.coli и удобный способ манипулирования клонированной основной цепью вируса желтой лихорадки (YF), облегчающий замену генов желтой лихорадки (YF) рrМ и Е генами целевого флавивируса. Используемые гены рrМ и Е вируса Западного Нила (WN) клонировали из изолята 383-99 flamingo WNV, последовательность с инвентарным номером GenBank АF196835. Вирусную кДНК рrМЕ получали с помощью ОТ-ПЦР (RT-PCR) (набор XL-PCR, Perkin Elmer). 5′-конец гена рrМ WN клонировали точно на 3′-конце капсидного гена 17D YF методом удлинения перекрывающихся участков с применением ПЦР с использованием полимеразы Рwо (Roche). Эта стадия клонирования сохраняет целостность сигнала расщепления/процессинга, кодируемого на 3′-конце капсидного гена вируса YF. 3′-конец Е гена также клонировали точно на 5′-конце кодирующей последовательности NS1 YF методом удлинения перекрывающихся участков с применением ПЦР. Использование этой двухплазмидной системы для клонировании области рrМЕ вируса Западного Нила в основную цепь 17D YF описано ранее (Arroyo et al., Trends in Molecular Medicine 7(8): 350-354, 2001). Молчащие мутации вводили в последовательность рrМ и Е, чтобы создать уникальные сайты рестрикции Вsр ЕI и Еаg I. Расщепление двух плазмид этими ферментами давало фрагменты ДНК, которые очищали на геле и лигировали in vitro с получением химерной кДНК полной длины. Эту кДНК линеаризировали с помощью Хhо I, чтобы облегчить транскрипцию in vitro полимеразой SР6 (Epicentre). Продукт РНК вводили в линии клеток эукариот, что делало возможным осуществление трансляции вирусной РНК и репликации вируса. 09/007664, 09/121587 и 09/452638; международные заявки РСТ/US98/03894 (WО 98/37911) и РСТ/US00/32821 (WО 01/39802); и Chambers et al., J. Virol. 73: 3095-3101, 1999). Двухплазмидная система обеспечивает стабильность плазмиды в E.coli и удобный способ манипулирования клонированной основной цепью вируса желтой лихорадки (YF), облегчающий замену генов желтой лихорадки (YF) рrМ и Е генами целевого флавивируса. Используемые гены рrМ и Е вируса Западного Нила (WN) клонировали из изолята 383-99 flamingo WNV, последовательность с инвентарным номером GenBank АF196835. Вирусную кДНК рrМЕ получали с помощью ОТ-ПЦР (RT-PCR) (набор XL-PCR, Perkin Elmer). 5′-конец гена рrМ WN клонировали точно на 3′-конце капсидного гена 17D YF методом удлинения перекрывающихся участков с применением ПЦР с использованием полимеразы Рwо (Roche). Эта стадия клонирования сохраняет целостность сигнала расщепления/процессинга, кодируемого на 3′-конце капсидного гена вируса YF. 3′-конец Е гена также клонировали точно на 5′-конце кодирующей последовательности NS1 YF методом удлинения перекрывающихся участков с применением ПЦР. Использование этой двухплазмидной системы для клонировании области рrМЕ вируса Западного Нила в основную цепь 17D YF описано ранее (Arroyo et al., Trends in Molecular Medicine 7(8): 350-354, 2001). Молчащие мутации вводили в последовательность рrМ и Е, чтобы создать уникальные сайты рестрикции Вsр ЕI и Еаg I. Расщепление двух плазмид этими ферментами давало фрагменты ДНК, которые очищали на геле и лигировали in vitro с получением химерной кДНК полной длины. Эту кДНК линеаризировали с помощью Хhо I, чтобы облегчить транскрипцию in vitro полимеразой SР6 (Epicentre). Продукт РНК вводили в линии клеток эукариот, что делало возможным осуществление трансляции вирусной РНК и репликации вируса.
Точечные мутации вводили в разные кодоны гена Е для получения вариантов первоначальной химеры, кодирующей рrМЕ WN дикого типа. В таблице I показаны целевые сайты мутаций и олигонуклеотидные последовательности, использованные для создания химер YF/WN, описанных ниже. Сайты мутаций подтверждали секвенированием оболочечных белков (область рrМЕ), полученных вирусов. Образцы вирусной кДНК для секвенирования получали из РНК, экстрагированной из супернатантов вирусов (Trizol LS, Invitrogen) c последующими ОТ-ПЦР (набор XL-PCR, Perkin Elmer) и секвенированием с использованием синтетических праймеров (Invitrogen) и секвенатора CEQ 2000 (Beckman).
Вирусы и клеточные линии
Химерные вирусы YF/WN (т.е. ChimeriVax -West Nile) получали трансфекцией РНК (вирус пассажа I, РI) в клетки линии Vero E6 (ATCC, CIDVR UMASS Medical Center Worcester, MA). Основной исследуемый посевной материал (RMS) получали путем дополнительного амплифицирования (пассаж либо 2, либо 3 при 0,001 МОI (множественность заражения) в клетках Vero E6. Клетки Vero E6 поддерживали в МЕМ (Invitrogen), 10% FВS (Hyclone). Получение предварительного основного посевного материала (РМS) для производства вакцины начнали трансфекцией в бессывороточные клетки линии Vero (SF-Vero) (ATCC, Baxter/Immuno Orth, Austria) c последующим амплификационным пассажем в той же самой линии клеток SF-Vero для получения PMS Р2 или предварительного основного посевного материала. Клетки клеточной линии SF-Vero делились и их сохраняли в препарате бессывороточной, безбелковой среды VT-Media (Baxter/Immuno, Austria). Используемый вирус WN дикого типа был штаммом NY-99 (изолят NY99-35262-11 flamingo), полученным из CDC, Fort Collins, CO (инвентарное обозначение СDС В82332W) с помощью двух дополнительных пассажей в клетках Vero E6 c получением основного банка вируса. 17D YF является коммерческой вакциной (YF-VAX®, Aventis Pasteur, Swiftwater, PA), используемой здесь после восстановления лиофилизированного продукта и после одного пассажа в клетках Vero E6 (АТСС, Acambis Inc., Cambridge, MA). -West Nile) получали трансфекцией РНК (вирус пассажа I, РI) в клетки линии Vero E6 (ATCC, CIDVR UMASS Medical Center Worcester, MA). Основной исследуемый посевной материал (RMS) получали путем дополнительного амплифицирования (пассаж либо 2, либо 3 при 0,001 МОI (множественность заражения) в клетках Vero E6. Клетки Vero E6 поддерживали в МЕМ (Invitrogen), 10% FВS (Hyclone). Получение предварительного основного посевного материала (РМS) для производства вакцины начнали трансфекцией в бессывороточные клетки линии Vero (SF-Vero) (ATCC, Baxter/Immuno Orth, Austria) c последующим амплификационным пассажем в той же самой линии клеток SF-Vero для получения PMS Р2 или предварительного основного посевного материала. Клетки клеточной линии SF-Vero делились и их сохраняли в препарате бессывороточной, безбелковой среды VT-Media (Baxter/Immuno, Austria). Используемый вирус WN дикого типа был штаммом NY-99 (изолят NY99-35262-11 flamingo), полученным из CDC, Fort Collins, CO (инвентарное обозначение СDС В82332W) с помощью двух дополнительных пассажей в клетках Vero E6 c получением основного банка вируса. 17D YF является коммерческой вакциной (YF-VAX®, Aventis Pasteur, Swiftwater, PA), используемой здесь после восстановления лиофилизированного продукта и после одного пассажа в клетках Vero E6 (АТСС, Acambis Inc., Cambridge, MA).
Нейроинвазивность и нейровирулентность у взрослых мышей и мышат на грудном вскармливании; методы определения иммуногенности и титров заражения (методика иммунизации, анализа бляшек, PRNT)
Мышам делали внутрибрюшинную прививку (в/б) для испытания на нейроинвазию или при заражении вирусом WN дикого типа. Объемы для внутрибрюшинной прививки составляли 100-200 мкл, вводимых шприцом 25G. Взрослым мышам и мышатам на грудном вскармливании вакцину вводили внутрицеребрально для испытания на нейровирулентность. Для внутрицеребрального введения использовали объем прививки, равный 20 мкл, вводимый в правую сторону фронтальной доли мозга. Вирусы разводили в М199 буфером HEPES (Invitrogen) и 20%-ным FBS (Hyclone), если не указано иначе. Исследование бляшек в клетках Vero осуществляли для подтверждения титра иммунизиующей дозы вируса (Monath et al., J. Virol. 74(4): 1742-1751, 2000).
За мышами наблюдали в течение срока, равного 21 дню, чтобы определить нейроинвазию, нейровирулентность или выживание после заражения вирусом Западного Нила. Наблюдали/оценивали заболеваемость и смертность, и выживших подвергали эвтаназии.
Чтобы определить титры нейтрализующих антител мышей обескровливали ретроорбитальным путем, и сыворотку отделяли центрифугированием. Исследование нейтрализации по снижению числа бляшек (РRNТ) использовали для определения титров нейтрализующих антител в сыворотке.
Исследование нейровирулентности у резусов
Испытание на обезьянах-резусах для определения нейровирулентности вакцин от желтой лихорадки (YF), как описано в руководстве ВОЗ, использовали для определения безопасности химер YF/WN (Monath et al., J. Virol. 74(4): 1742-1751, 2000). Животным внуртрицеребрально вводили вакцину, и ежедневно получали образцы крови для определения уровней вирусемии, используя бляшечную методику исследования. Животных осматривали ежедневно на признаки связанных с заболеванием симптомов, таких как лихорадка или тремор. Животных подвергали эвтаназии через 30 дней после инфицирования, и ткани головного и спинного мозга затем забирали на гистопатологию. Нейропатологию оценивали по предписанной ВОЗ системе, и значения анализировали на патологию, сравнимую с патологией, связанной со стандартной вакциной 17D YF.
Иммуногенность у макак-резусов и заражение
Макак-резусов вакцинировали подкожным введением единственной 0,5-мл дозы вакцины, номинально содержащей 4 log10 БОЕ. Вирусемию определяли исследованием на бляшкообразование разбавленной сыворотки на клетках Vero с использованием образцов сыворотки, которые ежедневно собирали с 0 по 10 день (Monath et al., J. Virol. 74(4): 1742-1751, 2000). Уровни нейтрализующих антител определяли исследованием титров нейтрализации по снижению бляшек (РRNТ) (Monath et al., J. Virol. 74(4): 1742-1751, 2000). Животных заражали через 64 дня после вакцинации вирусом NY99 WN дикого типа.
Генетическая стабильность (in vivo и in vitro пассажи) и секвенирование
Конструкцию YF/WN wt (например, ChimeriVax -WN01) без аттенуирующих мутаций в белке Е пассировали шесть раз в клетках Vero E6 с последующими шестью пассажами на мышатах на грудном вскармливании при введении внутрицеребральным путем. Конструкции предосновного посевного материала и основного исследуемого посевного материала YF/WNFVR (например, ChimeriVax -WN01) без аттенуирующих мутаций в белке Е пассировали шесть раз в клетках Vero E6 с последующими шестью пассажами на мышатах на грудном вскармливании при введении внутрицеребральным путем. Конструкции предосновного посевного материала и основного исследуемого посевного материала YF/WNFVR (например, ChimeriVax -WN02) с тремя аттенуирующими мутациями, введенными в белок Е, пассировали 12 и 10 раз, соответственно в бессывороточном, безбелковом субстрате клеток SF-Vеrо. Все пассажи выполняли первоначальными 0,01 МОI с последующим сбором на третий день, и продолжая без титрования для определения активности вируса. Титры вируса, использованные при каждом пассаже, позднее подсчитывали бляшечным исследованием. Нейровирулентность пассированных вирусов определяли внутрицеребральным введением взрослым мышам и мышатам на грудном вскармливании. Вирусную ДНК затем секвенировали. -WN02) с тремя аттенуирующими мутациями, введенными в белок Е, пассировали 12 и 10 раз, соответственно в бессывороточном, безбелковом субстрате клеток SF-Vеrо. Все пассажи выполняли первоначальными 0,01 МОI с последующим сбором на третий день, и продолжая без титрования для определения активности вируса. Титры вируса, использованные при каждом пассаже, позднее подсчитывали бляшечным исследованием. Нейровирулентность пассированных вирусов определяли внутрицеребральным введением взрослым мышам и мышатам на грудном вскармливании. Вирусную ДНК затем секвенировали.
Результаты
Фенотип вирулентности YF/WN wt по сравнению с 17D YF (YF-VАХ®)
Первоначальная химера вируса Западного Нила кодировала гены оболочечного и предмембранного белков штамма NY99 WN дикого типа (т.е. YF/WN wt или ChimeriVax -WN01). У этого химерного вируса отсутствовала способность вызывать энцефалит после внутрицеребрального заражения при дозах 106 БОЕ на мышь IСR (таблица 2). Энцефалит оценивали ежедневным наблюдением изменений двигательного поведения, ведущего к параличу и смерти. Отсутствие нейроинвазии YF/WN wt у взрослых мышей наблюдалось также другими исследователями у мышей, которым вводили вакцину 17D YD (Ryman et al., Virology 230(2):376-380, 1997). Напротив, вирус NY99 WN дикого типа был летальным для мышей при введении внутрибрюшинным путем в таком небольшом количестве, как 1-4 БОЕ (Beaslеy et al., Virology 296:17-23, 2002). Как установлено здесь, внутрицеребральный LD50 YF/WN wt находится между 103 и 105 БОЕ. Фенотип по нейровирулентности YF/WN wt ниже фенотипа вируса 17D YF, когда внутрицеребральный LD50 для мышей IСR находится между 101 и 102 БОЕ. Однако с вирусом YF/WN wt не выявлено четкого пограничного момента у 21-дневных мышей (таблица 3). -WN01). У этого химерного вируса отсутствовала способность вызывать энцефалит после внутрицеребрального заражения при дозах 106 БОЕ на мышь IСR (таблица 2). Энцефалит оценивали ежедневным наблюдением изменений двигательного поведения, ведущего к параличу и смерти. Отсутствие нейроинвазии YF/WN wt у взрослых мышей наблюдалось также другими исследователями у мышей, которым вводили вакцину 17D YD (Ryman et al., Virology 230(2):376-380, 1997). Напротив, вирус NY99 WN дикого типа был летальным для мышей при введении внутрибрюшинным путем в таком небольшом количестве, как 1-4 БОЕ (Beaslеy et al., Virology 296:17-23, 2002). Как установлено здесь, внутрицеребральный LD50 YF/WN wt находится между 103 и 105 БОЕ. Фенотип по нейровирулентности YF/WN wt ниже фенотипа вируса 17D YF, когда внутрицеребральный LD50 для мышей IСR находится между 101 и 102 БОЕ. Однако с вирусом YF/WN wt не выявлено четкого пограничного момента у 21-дневных мышей (таблица 3).
Подходы с многосайтовым мутагенезом
Аминокислоты в оболочечном белке заменяли, чтобы определить, будут ли эти замены снижать вирулентность химер YF/WN. Изменения вирулентности оценивали на модели на мышах и сравнивали с нейровирулентностью исходной химеры YF/WN wt. Аминокислотные остатки, картируемые в положениях оболочечного гена (Е) YF/WN wt 107, 138, 176 и 280, все были изменены в единственной конструкции с шифровкой аминокислотных остатков как F, К, V и М соответственно. Новый химерный вирус определяли как YF/WNFКVМ. Затем конструировали химеры, в которых каждый аминокислотный остаток в группе FКVМ, один, изменяли, чтобы оценить его особую роль в нейровирулентности (таблица 4). Кроме того, мутации аминокислотных остатков 316 и 440 изменяли на V и R соответственно на основе предшествующих данных, показывающих, что мутации в Е-белке, которые картировали в этих областях, могут воздействовать на биологию третьего домена белка Е (Rey et al., Nature 375(6529): 291-298, 1995; Allison et al., J. Virol. 75(9):4268-4275, 2001). Наблюдения за нейровирулентностью химер, имеющих модифицированные аминокислоты в белке Е, показали, что остатки 107, 316 и 440 являются наиболее важными аминокислотами, отвечающими за нейровирулентность вируса WN. На основе этой информации была создана многосайтная конструкция YF/WNFVR и выбрана в качестве кандидата на вакцину. Все многосайтные химеры растили до титров 107 БОЕ /мл на бессывороточных клетках SF Vеrо.
Исследования нейровирулентности на мышах и макаках-резусах
Нейровирулентность вирусов с единственной или многосайтными мутациями в гене оболочечного белка YF/WN wt у мышей определяли на 21-дневных мышах, которым вводили внутрицеребрально путем дозы вируса между 104 и 105 БОЕ. Эта оценка определила остатки 107 и 280 (таблица 4) и сочетание 316/440 (таблица 5) как более доминантные аттенуирующие мутации, что определено по гибели мышей и относительному среднему времени выживания (АSТ). Химера, выбранная в качестве кандидата на данную вакцину, которая имеет комбинацию мутаций F, V и R остатков 107, 316 и 440 соответственно, была авирулентной у взрослых мышей (таблица 6). Однако некоторая нейровирулентность наблюдалась у двухдневных мышат на грудном вскармливании, подобно вакцине ChimeriVax -JЕ, которая является безопасной для людей (Monath et al., Vaccine 20:1004-1018, 2002). -JЕ, которая является безопасной для людей (Monath et al., Vaccine 20:1004-1018, 2002).
Фенотип нейровирулентности химер вируса Западного Нила для макак-резусов оценивали с конструкцией YF/WN wt и сравнивали с нейровирулентностью вакцины 17D YF. Макакам-резусам вводили внутрицеребрально YF/WN wt и сравнивали с введением доз вакцины 17D YF. Химера давала титры вирусемии и продолжительность, сходные с показателями для вакцины 17D YF. Этот вирус был не более нейровирулентен, чем вакцина YF, указывая на то, что химеры YF/WN являются такими же безопасными, как и вакцина 17D YF.
Исследование иммуногенности на мышах и макаках-резусах
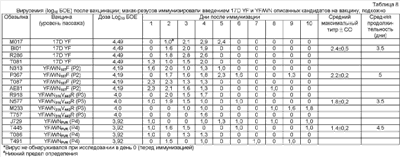
Сравнивали иммуногенность химеры YF/WN wt и конструкции YF/WNFVR, которая имеет мутации остатков оболочечного белка 107, 316 и 440. Мышам подкожно вводили дозы вакцины в интервале между 2 и 5 log10 БОЕ. Сыворотку собирали четыре недели после иммунизации и титровали на нейтрализующие антитела. Данные на чертеже показывают, что сайт-нацеленное аттенуирование конструкции YF/WN wt в результате дает менее иммуногенный вирус. Внутрибрюшинное заражение иммунизированных мышей вирусом NY99 WN дикого типа выявило у конструкций корреляцию активности вакцины с эффективностью. Все мыши, иммунизированные дозой 105 БОЕ/мл любой из химер YF/WN, были защищены от заражения вирулентным вирусом.
У макак-резусов иммуногенность кандидатов в вакцины с одной, двумя или тремя аттенуирующими мутациями, YF/WN107F, YF/WN316V440R или YF/WNFVR, была одинаковой. Не было значительных различий в титрах соответствующих антител, когда животные получали дозу вакцины 104 БОЕ. Исследования эффективности, определяемой путем заражения вирусом WN NY99 дикого типа после иммунизации, ясно показали, что вероятные вакцины WN, испытанные на модели макак-резусов обладали 100%-ной эффективностью по сравнению с контрольными животными (таблица 7).
Вирусемия после вакцинации у макак-резусов была одинаковой продолжительности по сравнению с продолжительностью, вызываемой вакциной 17D YF, но более низкой по значению, с линейной корреляцией с числом аттенуирующих одиночных мутаций в химерах (таблица 8). Тем не менее оценка безопасности на основе висцеротропизма (или вирусемии после вакцинации) показывает, что любой из кандидатов в вакцины, испытанных на модели макак, является более безопасным, чем 17D YF.
Последующее внутрицеребральное заражение иммунизированных макак-резусов 5,8 log10 БОЕ WN NY99 не вызывало обнаруживаемой вирусемии, и не наблюдалось клинических признаков заболевания или гибели животных, вакцинированных конструкциями YF/WN. Значительная вирусемия в результате репликации WNV была обнаружена при вакцинации 17D YF. Уровни вирусемии, обнаруживаемые у животных в этой группе, имели средний титр log10 БОЕ, равный 2,25±0,62 со средней продолжительностью, равной 3,5 дням. Эти уровни вирусемии сходны с уровнями, наблюдаемыми в вакцинированной контрольной группе (n=2) со средним титром log10 БОЕ, равным 2,33±0,47, и средней продолжительностью 4,5 дня. Две из четырех макак-резусов, вакцинированных 17D YF, выжили после внутрицеребрального заражения штаммом WN NY99. Выжившие теряли аппетит, и у них проявлялись симптомы оцепенения с повышенной температурой после заражения. У животных, которых подвергали эвтаназии после заражения штаммом WNV NY99, были представлены симптомы, включающие лихорадку и тремор.
Генетическая стабильность
Для определения генетической стабильности конструкций при выращивании на стационарных культурах осуществляли субстрат-пассажные исследования in vitro и in vivo с химерами YF/WN wt или YF/WNFVR. После шести пассажей YF/WN wt in vitro в клетках Vero E6 с последующими шестью пассажами in vivo в головном мозге взрослых мышей IСR не обнаружено нежелательных мутаций в области гена оболочечного белка (рrМ, Е) этой химеры. Гетерозиготная мутация в белке Е в положении Е336, приводящая к замене цистеина на серин, была установлена после десяти пассажей in vitro вируса YF/WNFVR в клетках Vero E6. В отдельном исследовании пассаж YF/WNFVR в клетках SF-Vero приводил к селекции мутации в положении Е 313, которая изменяла аминокислоту в этом положении с глицина на аргинин. Во время всех серийных пассажей вируса в клетках Vero не обнаружено реверсий/мутаций целевых остатков 107F, 316V или 440R, которые участвуют в нейровирулентности вируса.

Праймеры для сайт-направленного мутагенеза для создания мутантного аттенуированного вируса желтой лихорадки/ Западного Нила. Изменения нуклеотидов, которые вводят новую аминокислоту, указаны жирным шрифтом. Введенные молчащие сайты рестрикции подчеркнуты. Праймеры, указанные *(звездочкой), являются клонирующими праймерами, использованными для субклонирования фрагмента. Один включает изменение нуклеотида, тогда как другие – нет.
Таблица 3
Нейровирулентность YF/WN wt (ChimeriVax -West Nile 01) по отношению к 17D YF, реакция на дозу (3-4-недельные самки мышей линии Harlan-Sprague ICR) -West Nile 01) по отношению к 17D YF, реакция на дозу (3-4-недельные самки мышей линии Harlan-Sprague ICR) |
| Вирус в/ц |
Доза1 (log10 БОЕ) |
% гибели (число погибших/число испытуемых) |
СВВ |
| YF/WN wt |
-2 |
0(0/5) |
– |
| (Р2) |
-0,30 |
0(0/5) |
– |
 |
0,89 |
20(1/5) |
11 |
 |
2,23 |
0(0/5) |
– |
 |
3,24 |
20(1/5) |
10 |
 |
4,06 |
60(3/5) |
9 |
 |
5,45 |
20(1/5) |
9 |
| YF17D |
0 |
20(1/5) |
9 |
| (ATCC) |
0 |
60(3/5) |
10,3 |
 |
0,9 |
100(5/5) |
9,2 |
 |
0,98 |
100(5/5) |
8,2 |
 |
2,78 |
100(5/5) |
8 |
| Имитация |
N/A |
0(0/3) |
– |
| 1Действительную дозу, доставляемую внутрицеребрально, принимали за равную 20 мкл для показанных расчетов обратного титрования. |
Таблица 4
Нейровирулентность вариантов ChimeriVax -WN 01 после сайт-направленного мутагенеза в протеиновых остатках 107, 138, 176 и 280, испытанных на взрослых мышах1 -WN 01 после сайт-направленного мутагенеза в протеиновых остатках 107, 138, 176 и 280, испытанных на взрослых мышах1 |
| Вирус (пассаж в Vero) |
Намеченная доза (log10 БОЕ) |
Доза по обратному титрованию (log10 БОЕ) |
% гибели (число погибших/ число испытуемых) |
СВВ |
| YF/WN wt |
4 |
4,87 |
100(5/5) |
8,6 |
| (P3) |
5 |
6,09 |
60(3/5) |
9 |
| YF/WN107F |
4 |
4,22 |
0(0/5) |
– |
| (P2) |
4 |
4,42 |
0(0/8) |
– |
 |
5 |
4,99 |
0(0/5) |
– |
| YF/WN138K |
4 |
4,26 |
60(3/5) |
10,33 |
| (P3) |
4 |
4,41 |
63(5/8) |
11,4 |
 |
5 |
5,48 |
60(3/5) |
9,33 |
| YF/WN176V |
4 |
4,42 |
80(4/5) |
12,5 |
| (P3) |
5 |
5,54 |
80(4/5) |
11 |
| YF/WN280M |
4 |
4,14 |
40(2/5) |
9 |
| (P3) |
4 |
4,55 |
89(7/8) |
11,86 |
 |
5 |
5,14 |
0(0/5) |
– |
| YF/107F138K280M |
4 |
3,70 |
0(0/5) |
– |
| (P2) |
5 |
4,81 |
0(0/5) |
– |
| YF/107F138K176V280M |
4 |
4,13 |
0(0/5) |
– |
| (P3) |
5 |
5,10 |
20(1/5) |
7 |
| YF-VAX |
3 |
2,77 |
100(5/5) |
9 |
| WN NY99 |
4 |
3,90 |
100(5/5) |
5 |
| 1Мыши, заражаемые внутрицеребрально, были 3-4-недельными самками Taconic ICR. P2 и P3 указывают второе и третье поколение вируса при пассажах на клетках Vero соответственно. |
Таблица 5
Нейровирулентность вариантов ChimeriVax -WN 01 после сайт-направленного мутагенеза в протеиновых остатках 316 и 440, испытанных на взрослых мышах1 -WN 01 после сайт-направленного мутагенеза в протеиновых остатках 316 и 440, испытанных на взрослых мышах1 |
| Вирус (пассаж в Vero) |
Доза по обратному титрованию (log10 БОЕ) |
% гибели (число погибших/ число испытуемых) |
СВВ |
| YF/WN wt |
4,11 |
83(10/12) |
 |
| (P3) |
4,74 |
60(3/5) |
 |
 |
4,83 |
100(8/8) |
 |
| YF/WN316V |
4,09 |
25(3/12) |
 |
| (P3) |
4,67 |
38(3/8) |
 |
 |
4,57 |
38(9/24) |
 |
| YF/WN440R |
4,17 |
83(10/12) |
 |
| (P3) |
4,60 |
38(3/8) |
 |
 |
4,35 |
56(14/25) |
 |
| YF/WN316V440R |
3,9 |
17(2/12) |
 |
| (P3) |
4,12 |
40(2/5) |
 |
 |
3,71 |
36(9/25) |
 |
| 1Мыши, заражаемые внутрицеребрально, были 3-4-недельными самками Taconic ICR. Представлены результаты трех независимых экспериментов. |
| Таблица 7 |
| Титры соответствующих нейтрализующих антител (TCHA50; PRNT50) против вируса YF/WN wt. Макакам-резусам вводили 17D YF или описанных кандидатов на вакцину, подкожно |
| Обезьяна |
Вакцина |
Доза Log10 БОЕ |
День после иммунизации (дпи) |
День после заражения (дпз) |
| 14 дпи |
30 дпи |
63 дпи |
15 дпз |
31-34 дпз |
| М017 |
YF17D |
4,49 |
NT |
NT |
<40 |
с |
– |
| BI01 |
YF17D |
4,49 |
NT |
NT |
<40 |
>640 |
NT |
| R286 |
YF17D |
4,49 |
NT |
NT |
<40 |
– |
– |
| Т081 |
YF17D |
4,49 |
NT |
NT |
<40 |
>640 |
NT |
| N313 |
YF/WN107F (P2) |
4,19 |
160 |
>640 |
>640 |
2560 |
5120 |
| Р367 |
YF/WN107F (P2) |
4,19 |
<40 |
640 |
640 |
5120 |
2560 |
| Т087 |
YF/WN107F (P2) |
4,19 |
<40 |
640 |
>б40 |
2560 |
1280 |
| АЕ81 |
YFAVN107F (P2) |
4,19 |
<40 |
>640 |
160 |
>10240 |
>20480 |
| GMTa |
 |
 |
57 |
640 |
453 |
4305 |
4305 |
| R918 |
YF/WN316V440R (P3) |
4,0 |
<40 |
320 |
>640 |
>1280 |
2560 |
| N577 |
YF/WN316V440R (P3) |
4,0 |
<40 |
>160 |
320 |
>1280 |
2560 |
| М233 |
YF/WN316V400R (P3) |
4,0 |
<40 |
>160 |
320 |
640 |
1280 |
| Т757 |
YF/WN316V440R (P3) |
4,0 |
<40 |
40 |
>640 |
>1280 |
>5120 |
| GMT |
 |
 |
40 |
135 |
453 |
1076 |
2560 |
| J729 |
YF/WNFVR (P4) |
3,92 |
<40 |
320 |
80 |
>5120 |
>5120 |
| T445 |
YF/WNFVR (P4) |
3,92 |
80 |
640 |
160 |
640 |
>5120 |
| T086 |
YF/WNFVR (P4) |
3,92 |
160 |
>320 |
>640 |
1280 |
>5120 |
| T491 |
YF/WNFVR (P4) |
3,92 |
80 |
320 |
160 |
2560 |
>5120 |
| GMT |
 |
 |
80 |
381 |
190 |
1280 |
5120 |
| aСГЗТ (GMT), среднее геометрическое значение титра; когда конечное значение не определено, при расчете использовали ограничивающий исследование титр (например, >640 принято как 640, и <40 принимали как 40); bНО (NT) = не испытан; с – животное подвергали эвтаназии после развития симптомов, связанных с инфекцией, вызванной вирусом Западного Нила. |
Формула изобретения
1. Генетическая конструкция для стимуляции иммунного ответа против вируса Западного Нила, содержащая последовательности, кодирующие предмембранные и оболочечные белки вируса Западного Нила и капсидные и неструктурные белки вируса желтой лихорадки, где указанные предмембранные или оболочечные белки содержат аттенуирующую мутацию, и где указанная аттенуирующая мутация содержит аминокислотную замену в одном или нескольких положениях, выбранных из группы, состоящей из положений 107, 316 и 440 оболочечного белка вируса Западного Нила.
2. Генетическая конструкция по п.1, где указанная аминокислотная замена находится в положении 107.
3. Генетическая конструкция по п.1, где указанная аминокислотная замена находится в положении 316 и положении 440.
4. Генетическая конструкция по п.1, где указанная аминокислотная замена находится в положениях аминокислот 107, 316 и 440.
5. Генетическая конструкция по п.1, где указанная аминокислотная замена в положении 107 представляет собой замену лейцина на фенилаланин или консервативную аминокислоту.
6. Генетическая конструкция по п.1, где указанная аминокислотная замена в положении 316 представляет собой замену аланина на валин или консервативную аминокислоту.
7. Генетическая конструкция по п.1, где указанная аминокислотная замена в положении 440 представляет собой замену лизина на аргинин или консервативную аминокислоту.
8. Химерный флавивирус, содержащий генетическую конструкцию по п.1, для применения в вакцинации и получения лекарственных средств для вакцинации.
9. Химерный флавивирус по п.8, где указанная аттенуирующая мутация включает аминокислотную замену в одном или нескольких положениях, выбранных из группы, состоящей из положений 107, 316 и 440 оболочечного белка вируса Западного Нила.
10. Химерный флавивирус по п.9, где указанная аминокислотная замена находится в положении 107.
11. Химерный флавивирус по п.9, где указанная аминокислотная замена находится в положении 316 и положении 440.
12. Химерный флавивирус по п.9, где указанная аминокислотная замена находится в положениях аминокислот 107, 316 и 440.
13. Химерный флавивирус по п.9, где указанная аминокислотная замена в положении 107 представляет собой замену лейцина на фенилаланин или консервативную аминокислоту.
14. Химерный флавивирус по п.9, где указанная аминокислотная замена в положении 316 представляет собой замену аланина на валин или консервативную аминокислоту.
15. Химерный флавивирус по п.9, где указанная аминокислотная замена в положении 440 представляет собой замену лизина на аргинин или консервативную аминокислоту.
16. Способ индукции иммунного ответа на вирус Западного Нила у пациента, где указанный способ включает введение пациенту химерного флавивируса по п.8.
17. Способ по п.16, где указанный пациент не инфицирован, но подвергается риску инфицирования вирусом Западного Нила.
18. Способ по п.16, где указанный пациент инфицирован вирусом Западного Нила.
19. Способ получения химерной флавивирусной вакцины, который включает:
(i) введение генетической конструкции по п.1 в клетки;
(ii)сбор вируса из клеток; и
(iii) получение композиции вместе с собранным вирусом для введения в виде вакцины.
20. Применение химерного флавивируса по п.8 для вакцинации против вируса Западного Нила.
РИСУНКИ
|
|