Патент на изобретение №2376372
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ ПОДВЕРЖЕННОСТИ К СЕРДЕЧНО-СОСУДИСТЫМ ЗАБОЛЕВАНИЯМ
(57) Реферат:
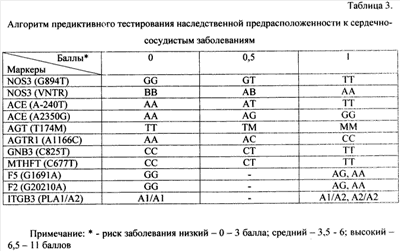
Изобретение относится к биотехнологии и может быть использовано для диагностики наследственной предрасположенности к сердечно-сосудистым заболеваниям у человека. Способ основан на определении генотипов по полиморфным вариантам Al166C гена AGTR1, А-240Т и A2350G гена АСЕ, С677Т гена MTHFR, T174M гена AGT, C825T гена GNB3, VNTR4a/b и G894T гена NOS3, G1691А гена F5, PLA1/A2 гена ITGB3, G20210A гена F2 и оценке риска путем суммирования количества баллов, присвоенных каждому генотипу. При этом генотипам «низкого» риска сердечно-сосудистой патологии присваивается 0 баллов, к ним относятся генотипы 1166АА гена AGTR1, -240АА, 2350АА гена АСЕ, 677СС гена MTHFR, 174TT гена AGT, 825CC гена GNB3, VNTR4bb и 894GG гена NOS3, 1691GG гена F5, PLA1/A1 гена ITGB3, 20210GG гена F2. Генотипам «среднего» риска присваивается 0,5 баллов, к ним относятся генотипы 1166АС гена AGTR1, -240АТ и 2350AG гена АСЕ, 677СТ гена MTHFR, 174TM гена AGT, 825CT гена GNB3, VNTR4ab и 894GT гена NOS3. Генотипам «высокого» риска присваивается 1 балл, к ним относятся генотипы 1166СС гена AGTR1, -240ТТ и 2350GG гена АСЕ, 677ТТ гена MTHFR, 174MM гена AGT, 825TT гена GNB3, VNTR4aa и 894GT гена NOS3, 1691GA и 1691АА гена F5, PLA1/A2 и PLA2/A2 гена ITGB3, 20210GA и 20210АА гена F2. Риск сердечно-сосудистых болезней считается «низким» при сумме баллов от 0 до 3, средним – от 3,5 до 6, высоким – от 6,5 до 11 баллов. Изобретение позволяет увеличить точность генетической диагностики и учитывает взаимосвязь патогенеза большинства сердечно-сосудистых заболеваний. 8 табл.
Изобретение относится к молекулярной биологии и медицине и может быть использовано для диагностики (в том числе предиктивной) наследственной предрасположенности к сердечно-сосудистым заболеваниям (ССЗ) у человека. Сердечно-сосудистые болезни занимают одно из первых мест в структуре смертности в большинстве стран, в том числе в России – 55% от общего числа умерших (Статистические материалы Минздрава России, 2003). Ранняя диагностика позволяет осуществлять эффективные профилактические мероприятия, а своевременное начало лечения способствует сохранению трудоспособности и профилактике осложнений – необратимого повреждения органов-мишеней (сердца, почек, сосудов). Хорошо изучены факторы риска сердечно-сосудистых заболеваний, к которым относятся высокий уровень артериального давления крови, пожилой возраст, избыток массы тела, фактор курения, сахарный диабет, принадлежность к мужскому полу и др. Разработаны клинические и биохимические маркеры повышенного риска сердечно-сосудистых заболеваний: высокий уровень общего холестерина и холестерина липопротеидов низкой плотности, низкий уровень холестерина липопротеидов высокой плотности, высокий уровень глюкозы сыворотки крови и др. В настоящее время риск ССЗ оценивается по данным клинико-инструментальных методов (измерение уровня артериального давления крови, эхо- и электрокардиография, ангиография и т.д.), биохимических показателей (липидный спектр крови, уровень глюкозы крови), с учетом воздействия вредных внешне-средовых факторов (курение, диета, богатая жирами и солью). В то же время вклад наследственности в формирование ССЗ составляет 50-70%. Однако пока не разработаны надежные методы индивидуальной оценки «генетического» риска ССЗ, хотя описано и подробно изучено несколько десятков генов-кандидатов различных ССЗ. Существующие на сегодня аналоги включают, как правило, небольшое количество генетических маркеров или предназначены для расчета риска отдельных сердечно-сосудистых заболеваний. В частности, известная международная коммерческая сеть, объединяющая европейские генетические лаборатории – GENDIA (wwvv.gendia.net), предлагает тестирование генетических полиморфизмов для определения риска развития различных заболеваний, в том числе сердечно-сосудистых. Острый инфаркт миокарда -один ген LTA (полиморфные варианты A252G и С804А); коронарный спазм – ген NOS3 (полиморфный вариант G894T); ишемическая болезнь сердца – ген АРОЕ (полиморфные варианты Е2, Е3, Е4); венозные тромбозы – 4 мутации в трех генах; артериальная гипертония – гены АСЕ и NOS3 (по одному полиморфному варианту). В общей сложности предлагается анализ только 10 генов (LTA, AGT, АРОЕ, NOS3, F5, F2, MTHFR, РАIl, Fl3, АСЕ). Предлагаемые панели включают малое число полиморфизмов (только антитромботическая панель включает анализ четырех полиморфных вариантов; G1691A в гене F5, G20210A в гене F2, С677Т и А1298С в гене MTHFR), во всех остальных случаях предлагается тестирование одного-двух полиморфизмов, чего явно недостаточно для надежной оценки риска развития заболеваний. Кроме того, почти все существующие аналоги построены на данных, опубликованных в научной литературе, а не на результатах собственных научных исследований, отсутствует информация о возможности применения тест-систем в различных популяциях, в том числе у русских. Наиболее близким к предлагаемому способу генетической диагностики является метод, предложенный Глотовым, Иващенко, Образцовой и др. (Глотов А.С., Иващенко Т.Э., Образцова Г.И., Наседкина Т.В., Баранов B.C. Зависимость между возникновением стабильной артериальной гипертензии у детей и полиморфизмом генов ренин-ангиотензиновой и кинин-брадикининовой систем. Молекулярная биология, 2007, т.41, Технической задачей изобретения является разработка панели генетических маркеров и способа расчета риска для улучшения точности диагностики наследственной предрасположенности к сердечно-сосудистым заболеваниям с учетом взаимосвязи патогенеза большинства из них.
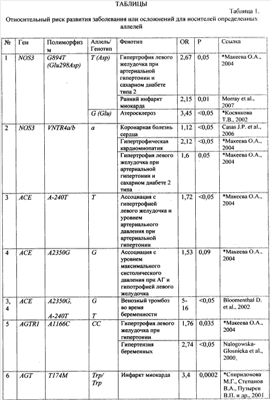
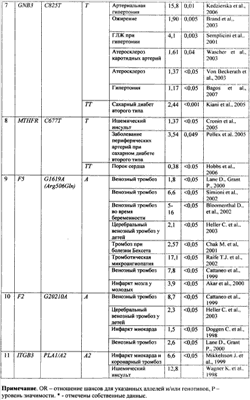
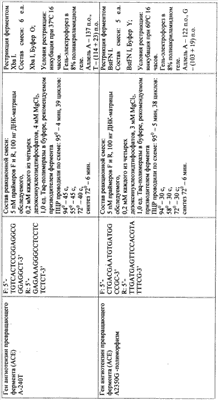
Диагностическая ценность генетических вариантов, используемых в предлагаемом способе генетической диагностики, подтверждена рядом исследований: сведения об ассоциации генетических маркеров с различными сердечно-сосудистыми заболеваниями по данным научной литературы и результатам собственных исследований, а также показатели отношения шансов (OR) для сердечно-сосудистых заболеваний приведены в табл.1. В дальнейшем сущность изобретения поясняется описанием и таблицами. Сущность предлагаемого изобретения состоит в анализе любым из известных молекулярно-генетических методов 11 полиморфных вариантов в 9 генах (см. табл.2), имеющих отношение к регуляции сосудистого тонуса и ремоделированию сердца (полиморфные варианты VNTR4a/b и G894T гена NOS3, А-240Т и A2350G гена АСЕ, А1166С гена AGTR1, Т174М гена AGT, C825T гена GNB3), обмену гомоцистеина (полиморфный вариант С677Т гена MTHFT), свертывающей системе крови (тромботическая панель) вариант G1691A гена F5, G20210A гена F2, PLA1/A2 гена ITGB3 для диагностики подверженности к сердечно-сосудистым заболеваниям и оценке риска развития сердечно-сосудистой патологии. Для оценки генетического риска ССЗ был разработан следующий алгоритм. Каждому возможному генотипу в зависимости от того, являются ли он протективным или предрасполагающим к развитию патологии, присваивается балл в соответствии с данными, приведенными в табл.3. Эти данные были получены при анализе групп больных с сердечно-сосудистыми заболеваниями и здоровыми жителями г.Томска (проанализировано более 300 случаев), а также анализа опубликованных исследований. Для расчета риска ССЗ суммируются баллы, полученные при молекулярно-генетическом анализе, и риск развития заболевания оценивается как «низкий», «средний» или «высокий». Апробацию предлагаемого способа проводили несколькими методами: (1) на группе добровольцев (50 человек) г.Томска в возрасте от 27 до 57 лет. Группа обследуемых представляла собой случайную выборку работающего населения, добровольцы не имели тяжелых инвалидизирующих заболеваний. Тестирование наследственной предрасположенности к сердечно-сосудистой патологии проводили без учета данных о состоянии здоровья пациентов. Исследуемые были разделены по возрасту на две группы: 27-35 лет и 36-57 лет. В первой группе было 53% обследованных, во второй – 47%. Анализ генотипов по 11 полиморфным вариантам предлагаемой генетической панели для диагностики подверженности к сердечно-сосудистым заболеваниям проводили, как описано в табл.4. Риск развития заболевания оценивали в зависимости от генотипа, выявленного у пациента, по методу, приведенному в табл.3. Для определения надежности оценки риска путем анализа генетических маркеров результаты оценки риска были сопоставлены с данными обследования состояния сердечно-сосудистой системы у изученных добровольцев. Было установлено, что в первой группе пациентов низкий риск развития сердечно-сосудистой патологии был у 26%, средний – у 32%, высокий – у 42%. Все пациенты с низким и средним риском развития заболевания были здоровы, в группе с высоким риском – половина пациентов имела заболевания сердечно-сосудистой системы с осложнениями. В возрастной группе от 36 лет и старше у 30% пациентов риск был оценен как низкий, у 52% – как средний, у 11% – как высокий. Небольшая доля пациентов, имеющих высокий риск в старшей возрастной группе, была связана с условиями формирования выборки – работающее население (следовательно, пациенты с высоким риском ССЗ, у которых в данном возрасте наследственная предрасположенность уже привела к развитию тяжелой патологии и инвалидизации). Процент страдающих сердечно-сосудистыми заболеваниями был выше в группе среднего и высокого риска, чем в группе низкого риска. Оценку диагностической ценности разработанного способа генетической диагностики подверженности к сердечно-сосудистым заболеваниям проводили также на группе из случайным образом набранных индивидуумов (124 мужчины, средний возраст 44 года), проводили оценку риска ССЗ разными методами. Пациенты были набраны в ходе эпидемиологического исследования и были повторно обследованы спустя 10 лет. Такое изменение соотношения долей групп риска спустя 10 лет может свидетельствовать об элиминации из популяции индивидов с высоким генетическим риском ССЗ. Данный факт подтверждает целесообразность тестирования по разработанной панели генетических маркеров и эффективность оценки риска по предложенному алгоритму. Изобретение иллюстрируется следующим примером конкретного выполнения. Молекулярно-генетическое исследование пациента Проанализированы следующие полиморфные варианты генов по способу, описанному в табл.3: – ангиотензин-превращающего фермента – АСЕ (A2350G, А-240Т) – рецептора ангиотензина II 1-го типа – AGTRJ (A1166C) – ангиотензиногена – AGT (T174M) – – метилентетрагидрофолатредуктазы – MTHFR (C677T) – эндотелиальной синтазы окиси азота – NOS3 (VNTR4a/b, G894T) – пятого фактора свертывающей системы – F5 (G1691А) – Iia/IIIb рецептора тромбоцитов – ITGB3 (PLA1/A2) – протромбина – F2 (G20210A) Результаты генетического тестирования пациента Ген AGTR1, полиморфизм А1166C – генотип пациента – АА – 0 баллов; Ген АСЕ, полиморфизм А-240Т – генотип пациента – АА – 0 баллов; Ген АСЕ, полиморфизм A2350G – генотип пациента – GG – 1 балл; Ген MTHFR, полиморфизм C677T – генотип пациента – СТ – 0,5 балла; Ген AGT, полиморфизм T174M – генотип пациента – ТМ – 0,5 балла; Ген GNB3, полиморфизм С825Т – генотип пациента – СТ – 0,5 балла; Ген NOS3, полиморфизм VNTR4a/b – генотип пациента – bb – 0 баллов; Ген NOS3, полиморфизм G894T – генотип пациента – GG – 0 баллов; Ген F5, полиморфизм G 1691 А – генотип пациента – GG – 0 баллов; Ген ITGB3, полиморфизм PLA1/A2 – генотип пациента – А1/А2– 1 балл; Ген F2, полиморфизм G20210A – генотип пациента – GA – 1 балл. Заключение по результатам генетического тестирования пациента Образец ДНК пациента исследован по 11 локусам подверженности к сердечно-сосудистой патологии. Установлено гомозиготное носительство неблагоприятного аллеля в отношении развития сердечно-сосудистых заболеваний (артериальная гипертония, гипертрофия левого желудочка) по гену АСЕ (2350G) и гетерозиготное состояние – генов AGT (T174M) и GNB3 (825Т). У пациентов-носителей аллеля Т гена GNB3 (825Т) повышен риск метаболических нарушений (ожирение), при терапии артериальной гипертонии могут быть особенно эффективны тиазидные диуретики. В гетерозиготном состоянии выявлен аллель 677Т гена MTHFR (определяет подверженность к гипергомоцистинемии и сосудистым нарушениям), который в сочетании с низким фолатным статусом приводит к повреждению эндотелия, микротромбообразованию, нарушению микроциркуляцин. Пациентке показано исследование в динамике уровня гомоцистеина. Установлено гетерозиготное состояние аллеля PLA1/A2 гена ITGB3, наличие которого определяет усиление агрегации тромбоцитов, что может усиливать риск тромбообразования. Кроме того, наличие аллеля PLA2 увеличивает вероятность невынашивания беременности, предрасполагает к фетоплацентарной недостаточности и развитию перинатальной патологии плода (гипоксия). Вероятность развития указанной патологии существенно повышается при сочетанном гестозе (на фоне имеющейся экстрагенитальной патологии). У пациентки выявлена наследственная предрасположенность к венозным тромбозам (GA-генотип гена протромбина). В связи с этим противопоказано применение оральных контрацептивов, необходим выбор альтернативных методов предохранения от нежелательной беременности. Профилактику и лечение тромбоэмболических осложнений рекомендуется проводить препаратами низкомолекулярного гепарина. Риск развития сердечно-сосудистой патологии – высокий (сумма балов риска – 4,5), необходимо исключить другие факторы риска (избыточная масса тела, повышение уровня холестерина, артериальная гипертензия). Рекомендации для пациента 1. Диагностические мероприятия: – контроль показателей свертывания крови (агрегация тромбоцитов, контроль уровня протромбина); – исследование в динамике уровня гомоцистеина в сыворотке крови; – контроль уровня артериального давления. 2. Лечебно-профилактические мероприятия: – отказ от кофе и курения; употребление продуктов питания с высоким содержанием фолиевой кислоты и витаминов группы В; назначение витаминных препаратов (В6, В12) и фолиевой кислоты – в зависимости от уровня гомоцистеина в сыворотке крови; – диетотерапия с учетом результатов исследования липидного обмена; – выбор оптимального метода предохранения от беременности с учетом результатов генетического тестирования; – при планировании и наступлении беременности необходимо проведение периконцепционной профилактики; – при наступлении беременности рекомендуется наблюдение акушера-гинеколога и включение пациентки в группу риска по развитию фетоплацентарной недостаточности и гипоксии плода; – при планировании (наступлении) беременности необходимо включение пациентки в группу риска по развитию тромбоэмболических осложнений на фоне беременности и послеродовом периоде; – включение пациентки в группу риска по развитию тромбоэмболических осложнений при хирургических вмешательствах и травмах, длительной иммобилизации; – профилактику и лечение тромбоэмболических осложнений рекомендуется проводить препаратами низкомолекулярного гепарина; – при терапии артериальной гипертонии более эффективными могут быть тиазидные диуретики. 3. Информация для пациента В целях создания условий, препятствующих реализации генетически детерминированной патологии, необходимо: – наблюдение врача-кардиолога; – придерживаться плана рекомендованного диагностического обследования. Таким образом, разработана панель генетических маркеров, позволяющая улучшить точность диагностики наследственной предрасположенности к сердечнососудистым заболеваниям. ТАБЛИЦЫ
Формула изобретения
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 1, с.18-25) – «кардиочип», включающий семь вариантов генов ренин-ангиотензиновой и кинин-брадикининовой систем, использованный авторами для диагностики стабильной артериальной гипертензии у детей. Недостатком данного набора молекулярно-генетических маркеров является небольшое число вариантов, включенных в анализ: анализируются только полиморфные варианты генов ренин-ангиотензиновой и кинин-брадикининовой систем, тогда как известно множество метаболических цепей, компоненты которы также играющих важную роль в формировании сердечно-сосудистых заболеваний.
1, с.18-25) – «кардиочип», включающий семь вариантов генов ренин-ангиотензиновой и кинин-брадикининовой систем, использованный авторами для диагностики стабильной артериальной гипертензии у детей. Недостатком данного набора молекулярно-генетических маркеров является небольшое число вариантов, включенных в анализ: анализируются только полиморфные варианты генов ренин-ангиотензиновой и кинин-брадикининовой систем, тогда как известно множество метаболических цепей, компоненты которы также играющих важную роль в формировании сердечно-сосудистых заболеваний.