|
|
(21), (22) Заявка: 2006100679/13, 18.06.2004
(24) Дата начала отсчета срока действия патента:
18.06.2004
(30) Конвенционный приоритет:
18.06.2003 EP 03013826.7
14.08.2003 EP 03018478.2
22.10.2003 EP 03024283.8
(43) Дата публикации заявки: 27.07.2007
(46) Опубликовано: 20.12.2009
(56) Список документов, цитированных в отчете о
поиске:
WO 9222327, 23.12.1992. PUHLMANN M. et al., “Vaccinia as a vector for tumor-directed gene therapy: biodistribution of a thymidine kinase-deleted mutant”, Cancer Gene Ther. 2000 Jan; 7(1): 66-73. TARTAGLIA et al., “NYVAC: a highly attenuated strain of vaccinia vims”, Virology. 1992 May; 188(1): 217-32.
(85) Дата перевода заявки PCT на национальную фазу:
18.01.2006
(86) Заявка PCT:
US 2004/019866 20040618
(87) Публикация PCT:
WO 2005/047458 20050526
Адрес для переписки:
117342, Москва, ул. Миклухо-Маклая, 65, корп.4, кв.34, пат.пов. И.Л.Стояченко, рег.  23 23
|
(72) Автор(ы):
СЗАЛЭЙ Аладар А. (US),
ТИМИРЯСОВА Татьяна (US),
Ю. Йонг А. (US),
ЖАНГ Кьян (US)
(73) Патентообладатель(и):
ДЖЕНЕЛЮКС КОРПОРЕЙШН (US)
|
(54) МОДИФИЦИРОВАННЫЕ РЕКОМБИНАНТНЫЕ ВАКЦИНИРУЮЩИЕ ВИРУСЫ И ДРУГИЕ МИКРООРГАНИЗМЫ И ИХ ПРИМЕНЕНИЕ
(57) Реферат:
Изобретение относится к области биотехнологии и вирусологии. Рекомбинантный вирус коровьей оспы содержит вирус коровьей оспы, включающий модифицированный ген тимидин-киназы (ТК), модифицированный ген НА и модифицированный ген F3 или нарушенный локус F3. При этом каждый из ТК, НА и F3 гена или локуса вируса коровьей оспы инактивирован и F3 ген или локус находится во фрагменте HindIII-F вируса коровьей оспы между открытыми рамками считывания F14L и F15L. Раскрыты также композиции и способы для лечения рака и ингибирования иммунопривилегированных клеток или тканей у животных. Изобретение может быть использовано в ветеринарии и медицине. 12 н.и 22 з.п. ф-лы, 3 ил., 2 табл.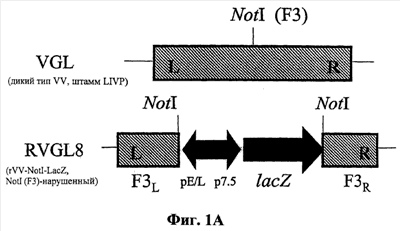
Текст описания приведен в факсимильном виде.                                                                                                                                                                                                                                                                   
Формула изобретения
1. Рекомбинантный вирус коровьей оспы для лечения рака, содержащий вирус коровьей оспы, включающий модифицированный ген тимидин-киназы (ТК), модифицированный ген НА и модифицированный ген F3 или нарушенный локус F3, где
каждый из ТК,НА и F3 гена или локуса вируса коровьей оспы инактивирован; и
F3 ген или локус находится во фрагменте HindIII-F вируса коровьей оспы между открытыми рамками считывания F14L и F15L.
2. Рекомбинантный вирус коровьей оспы по п.1, отличающийся тем, что ТК ген и НА ген инактивированы и F3 ген или локус инактивирован вставкой в него гетерологичной нуклеиновой кислоты.
3. Рекомбинантный вирус коровьей оспы по п.1, отличающийся тем, что вирус коровьей оспы содержит гетерологичную нуклеиновую кислоту, которая кодирует антитело или другой терапевтический продукт.
4. Рекомбинантный вирус коровьей оспы по любому из пп.1-3, отличающийся тем, что вирус коровьей оспы относится к штамму Lister.
5. Рекомбинантный вирус по п.4, отличающийся тем, что штамм представляет собой штамм LIVP.
6. Рекомбинантный вирус коровьей оспы по п.1 или 4, отличающийся тем, что модификация гена F3 осуществлена по сайту NotI гена F3 или в соответствующем локусе.
7. Рекомбинантный вирус коровьей оспы по п.6, отличающийся тем, что модификация осуществлена по положению 35 гена F3 или по положению 1475 внутри фрагмента HindIII F ДНК вируса коровьей оспы штамма LIVP.
8. Рекомбинантный вирус коровьей оспы по п.1 или 4, отличающийся тем, что ген ТК, НА и/или F3 содержит вставку гетерологичной нуклеиновой кислоты, которая кодирует белок.
9. Рекомбинантный вирус коровьей оспы по п.8, отличающийся тем, что гетерологичная нуклеиновая кислота включает регуляторную последовательность, оперативно связанную с нуклеиновой кислотой, кодирующей белок.
10. Рекомбинантный вирус коровьей оспы по п.9, отличающийся тем, что регуляторная последовательность содержит ранний/поздний промотор р7.5 вируса коровьей оспы.
11. Рекомбинантный вирус коровьей оспы по п.9, отличающийся тем, что регуляторная последовательность содержит ранний/поздний промотор pE/L вируса коровьей оспы.
12. Рекомбинантный вирус коровьей оспы по п.8, отличающийся тем, что гетерологичная нуклеиновая кислота кодирует определяемый белок или белок, способный индуцировать определяемый сигнал.
13. Клетка-хозяин, содержащая рекомбинантный вирус коровьей оспы по п.1 или 4.
14. Клетка-хозяин по п.13, являющаяся опухолевой клеткой.
15. Фармацевтическая композиция для лечения рака, содержащая рекомбинантный вирус коровьей оспы по п.1 или 4 и фармацевтически приемлемый носитель, составленная для системного введения.
16. Фармацевтическая композиция по п.15, отличающаяся тем, что она составлена для внутривенного введения или составлена в носителе для доставки.
17. Комбинация для лечения рака, содержащая, по крайней мере, два компонента, где первый компонент является фармацевтической композицией по п.15, а второй компонент является противораковым агентом, причем противораковый агент является химиотерапевтическим соединением.
18. Комбинация по п.17, отличающаяся тем, что противораковый агент выбран из числа алкилирующих агентов, антиметаболитов, платиновых координационных комплексов, антрацендионов, замещенных производных мочевины, производных метилгидразина, адренокортикальных супрессантов и противораковых полисахаридов.
19. Комбинация по п.18, отличающаяся тем, что противораковый агент выбран из числа следующих: ганцикловир, 5-фторурацил, 6-метилпурин-дезоксирибозид, цефалоспорин-доксорубицин, 4-[(2-хлорэтил)(2-мезилоксиэтил)амино] бензоил-L-глутаминовая кислота, ацетоминофен, индол-3-уксусная кислота, СВ1954, 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикампототецин, бис-(2-хлорэтил)амино-4-гидроксифениламинометанон 28, 1-хлорметил-5-гидрокси-1,2-дигидро-3Н-бенз[е]индол, эпирубицин-глюкуронид, 5′-дезокси-5-фторуридин, цитозин-арабинозид и линамарин.
20. Комбинация по п.17, отличающаяся тем, что соединение и вирус содержатся отдельно в двух компонентах.
21. Комбинация по п.17, отличающаяся тем, что соединение и вирус содержатся в одном компоненте.
22. Способ подавления иммунопривилегированных клеток у животного, включающий введение животному фармацевтической композиции по п.15 в количестве, эффективном для подавления иммунопривилегированных клеток, при этом вирус накапливается в иммунопривилегированных клетках, опосредуя, таким образом, аутоиммунизацию, что приводит к уничтожению клеток или уменьшению их количества.
23. Способ по п.22, отличающийся тем, что иммунопривилегированные клетки включают опухолевые клетки.
24. Способ подавления иммунопривилегированных клеток или тканей у животного по п.22, в котором вместе с вирусом вводят второй микроорганизм, микроорганизмы вводят одновременно, последовательно или поочередно, микроорганизмы накапливаются в иммунопривилегированных клетках, в результате чего животное подвергается аутоиммунизации против иммунопривилегированных клеток или тканей.
25. Способ по п.24, в котором иммунопривилегированные клетки или ткани включают опухолевые клетки.
26. Применение фармацевтической композиции по п.15 для уничтожения иммунопривилегированных клеток или тканей.
27. Применение рекомбинантного вируса по п.1 или 4 для составления фармацевтической композиции для генной терапии или вакцинной терапии.
28. Применение по п.27, отличающееся тем, что генная терапия представляет собой генную терапию рака.
29. Применение рекомбинантного вируса по п.1 или 4 для составления лекарства, предназначенного для подавления иммунопривилегированных клеток или тканей у животного, при этом вирус накапливается в иммунопривилегированных клетках, вирус не накапливается до токсических уровней в органах и тканях, которые не содержат иммунопривилегированные клетки или ткани.
30. Применение комбинации по п.17 для лечения рака.
31. Применение комбинации по п.17 для составления лекарства, предназначенного для лечения рака.
32. Способ ингибирования роста иммунопривилегированных клеток или тканей в организме субъекта, включающий следующие стадии: (а) введение субъекту модифицированного микроорганизма, кодирующего определяемый генный продукт, в количестве, эффективном для ингибирования роста иммунопривилегированных клеток или тканей, при этом модифицированный микроорганизм накапливается в иммунопривилегированных тканях или клетках, причем модифицированный организм является рекомбинантным вирусом по п.1 или 4; (b) по желанию субъекта вводят терапевтическое вещество, которое понижает патогенность микроорганизма; (с) осуществляют мониторинг присутствия определяемого генного продукта в организме субъекта до тех пор, пока определяемый генный продукт не станет присутствовать в основном только в иммунопривилегированных тканях или клетках субъекта, и (d) прекращают или временно приостанавливают введение терапевтического соединения, в результате чего увеличивается патогенность микроорганизма, и рост иммунопривилегированных клеток или тканей ингибируется.
33. Способ по п.32, отличающийся тем, что терапевтическое соединение понижает экспрессию одного или более генов, кодируемых микроорганизмом, что вызывает клеточный лизис или апоптоз.
34. Вакцина для лечения рака, содержащая рекомбинантный вирус коровьей оспы по п.1 или 4.
РИСУНКИ
|
|