|
|
(21), (22) Заявка: 2006122804/13, 20.05.2004
(24) Дата начала отсчета срока действия патента:
20.05.2004
(30) Конвенционный приоритет:
27.11.2003 KR 10-2003-0084934
23.04.2004 KR 10-2004-0028105
(43) Дата публикации заявки: 10.01.2008
(46) Опубликовано: 20.12.2009
(56) Список документов, цитированных в отчете о
поиске:
US 5521075, 28.05.1996. KR 1999-0014331, 25.02.1999. KR 2002-0003712, 15.01.2002. RU 2119536 C1, 27.09.1998.
(85) Дата перевода заявки PCT на национальную фазу:
27.06.2006
(86) Заявка PCT:
KR 2004/001210 20040520
(87) Публикация PCT:
WO 2005/052135 20050609
Адрес для переписки:
103735, Москва, ул. Ильинка, 5/2, ООО “Союзпатент”, пат.пов. А.П.Агурееву
|
(72) Автор(ы):
ЛИ Санг Уп (KR),
Ли Санг Цзун (KR)
(73) Патентообладатель(и):
КОРЕЯ ЭДВАНСТ ИНСТИТЬЮТ ОФ САЙЕНС ЭНД ТЕКНОЛОДЖИ (KR)
|
(54) МУТАНТ БАКТЕРИИ РУБЦА РОДА Mannheimia (ВАРИАНТЫ) – ПРОДУЦЕНТ ЯНТАРНОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ
(57) Реферат:
Настоящее изобретение относится к биотехнологии, в частности к мутанту бактерий рубца рода MANNHEIMIA, полученному путем инактивации гена лактатдегидрогеназы (IdhA) и гена пируват-формиат лиазы (pfl), мутанту бактерий рубца рода MANNHEIMIA, полученному путем инактивации гена лактатдегидрогеназы (IdhA), гена пируват-формиат лиазы (pfl), гена фосфотрансацетилазы (pta) и гена ацетаткиназы (ackA), мутанту бактерий рубца рода MANNHEIMIA, полученному путем инактивации гена лактатдегидрогеназы (IdhA), гена пируват-формиат лиазы (pfl) и гена фосфоенолпируваткарбоксилазы (ppc), к способам получения янтарной кислоты путем культивирования указанных выше мутантов в анаэробных условиях. По сравнению с прежними штаммами дикого типа, продуцировавшими различные органические кислоты, бактериальные мутанты настоящего изобретения обладают способностью продуцировать янтарную кислоту в высокой концентрации, в то время как продукция других органических кислот снижена или отсутствует. 7 н. и 21 з.п. ф-лы, 13 ил., 1 табл.
Область техники, к которой относится изобретение
Настоящее изобретение имеет отношение к мутанту бактерий рубца, который продуцирует янтарную кислоту в высоких концентрациях, в то время как продукция других органических кислот снижена или отсутствует; а также к способу продукции янтарной кислоты, который характеризуется культивированием таких мутантов в анаэробных условиях.
Уровень техники
Различные анаэробные микроорганизмы, включая Succinivibrio dextrinosolvens, Fibrobacter succinogenes, Ruminococcus flavefaciens и т.п., продуцируют янтарную кислоту как конечный продукт метаболизма глюкозы (Zeikus, Annu. Rev. Microbiol., 34:423, 1980). О штаммах, продуцирующих янтарную кислоту с выходом, полезным с точки зрения промышленного производства, до сих пор не сообщалось за исключением Anaerobiospirillum succiniciproducen, для которого известно, что он продуцирует янтарную кислоту из глюкозы в высоких концентрациях и с высоким выходом в присутствии избыточных количеств CO2 (David et al., Int. J. Syst. Bacterial., 26:498, 1976). Тем не менее, так как Anaerobiospirillum succiniciproducens является облигатным анаэробным микроорганизмом, ферментационный способ продукции янтарной кислоты с применением этого микроорганизма имеет недостаток, который заключается в том, что сам способ становится нестабильным при контакте микроорганизма даже с небольшим количеством кислорода.
Чтобы преодолеть этот недостаток, был сконструирован штамм Mannheimia succiniciproducens 55E, который обладает не только устойчивостью к кислороду, но также высокой продуктивностью синтеза органической кислоты. Однако, так как этот штамм, кроме янтарной кислоты, продуцирует также муравьиную кислоту, уксусную кислоту и молочную кислоту, он обладает недостатками, среди которых низкий выход и большие затраты в процессе очистки при удалении других органических кислот, не являющихся янтарной кислотой. В различных источниках литературы сообщалось о рекомбинантных штаммах Е. coli, используемых для продукции янтарной кислоты. Если у штаммов Е. coli происходит инактивация гена, кодирующего лактатдегидрогеназу, и гена, кодирующего пируват-формиат лиазу, то им затруднительно расти в анаэробных условиях. Кроме того, у этих штаммов слишком низкий выход, чтобы применять их в промышленном масштабе, так как хотя молочная кислота и не продуцируется в качестве продукта ферментации, считают, что другие метаболиты (уксусная кислота и этанол) составляют примерно половину от продукции янтарной кислоты. Чтобы преодолеть такие недостатки, клетки Е. coli выращивали в аэробных условиях и затем для индукции ферментации янтарной кислоты создавали анаэробные условия роста. Однако в результате этой попытки низкая продуктивность все еще сохранялась (Vemuri et al., J. Ind. Microbiol. Biotechnol., 28:325, 2002). Также было сообщено о других примерах, в которых в Е. coli вводят гены таких ферментов, как пируваткарбоксилаза, фосфоенолпируваткарбоксилаза, фосфоенолпируваткарбоксикиназа и малик-фермент, которые фиксируют CO2 в метаболическом пути ферментации янтарной кислоты, усиливая таким способом продукцию янтарной кислоты (Vemuri et al., Appl. Environ. Microbiol., 68:1715, 2002; Millard et al., Appl. Environ. Microbiol., 62:1808, 1996; Chao и Liao, Appl. Environ. Microbiol., 59:4261, 1993; Stols и Donnelly, Appl. Environ. Microbiol., 63:2695, 1997).
Между тем, известно, что инакгивация гена ptsG в Е. coli вносит вклад в улучшение продукции бактерий и продукции янтарной кислоты (Chatterjee et al., Appl. Environ. Microbiol., 67:148, 2001), но у большинства бактерий рубца ген ptsG отсутствует и, таким образом, у них есть преимущество, состоящее в том, что им не требуется процесс инактивации гена ptsG, как в случае с Е. coli. Недавно был успешно проведен опыт, в котором гены ферментов, фиксирующих СО2 в метаболическом пути янтарнокислого брожения, вводили в бактерии рубца, включая род Actinobacillus и род Anaerobiospirillum. Однако в этом опыте в больших количествах продуцировались другие органические кислоты или выход янтарной кислоты был слишком низким и в результате этого не был достигнут необходимый уровень для применения в промышленном производстве.
Раскрытие изобретения
Таким образом, в процессе интенсивных исследований, чтобы усовершенствовать штаммы бактерий, которые продуцируют с высоким выходом янтарную кислоту, разработчики настоящего изобретения сконструировали бактериальные мутанты Mannheimia sp.LPK (KCTC 10558 ВР) с помощью инактивации гена лактатдегидрогеназы (ldhA) и гена пируват-формиат лиазы (pfl) бактерии Mannheimia succiniciproducens 55E, которая относится к бактериям рубца, и из штамма LPK сконструировали бактериальные мутанты Mannheimia sp.LPK7 и LPK4 с помощью инактивации гена фосфотрансацетилазы (ptd), и гена ацетаткиназы (ackA), и гена фосфоенолпируваткарбоксилазы (ррс) соответственно, затем подтвердили, что культура таких бактериальных мутантов в анаэробных условиях запасает с высоким выходом янтарную кислоту, осуществляя таким образом настоящее изобретение.
Таким образом, главной целью настоящего изобретения является предоставление мутанта бактерий рубца, который продуцирует с высоким выходом янтарную кислоту, в то время как другие органические кислоты не продуцируются, а также способ производства этого мутанта.
Другой целью настоящего изобретения является предоставление способа продукции янтарной кислоты, который характеризуется культивированием указанных бактериальных мутантов в анаэробных условиях.
Чтобы достичь указанных целей, в одном аспекте настоящее изобретение обеспечивает мутанта бактерий рубца, в котором ген, кодирующий лактатдегидрогеназу (ldhA), и ген, кодирующий пируват-формиат лиазу (pfl), были инактивированы и который обладает способностью продуцировать янтарную кислоту в высоких концентрациях, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует.
В другом аспекте настоящее изобретение обеспечивает мутанта бактерий рубца, в котором были инактивированы ген, кодирующий лактатдегидрогеназу (ldhA), ген, кодирующий пируват-формиат лиазу (pfl), ген, кодирующий фосфотрансацетилазу (pta), и ген, кодирующий ацетаткиназу (ackA), и который обладает способностью продуцировать янтарную кислоту в высоких концентрациях, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует.
Еще в одном аспекте настоящее изобретение обеспечивает мутанта бактерий рубца, в котором были инактивированы ген, кодирующий лактатдегидрогеназу (ldhA), ген, кодирующий пируват-формиат лиазу (pfl), и ген, кодирующий фосфоенолпируваткарбоксилазу (ррс), и который обладает способностью продуцировать янтарную кислоту в высоких концентрациях, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует.
В настоящем изобретении бактерии рубца предпочтительно являются гомоферментативными бактериями, которые могут быть выбраны из группы, включающей род Mannheimia, род Actinobacillus и род Anaerobiospirillum, и которые продуцируют только янтарную кислоту, в то время как продукция других органических кислот снижена или отсутствует. В предпочтительном воплощении настоящего изобретения мутант бактерий рубца представляет собой Mannheimia sp. LPK, LPK7 или LPK4.
Еще в одном аспекте настоящее изобретение предоставляет способ создания мутанта бактерий рубца, который обладает способностью продуцировать янтарную кислоту в высоких концентрациях, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует, способ, включающий инактивацию гена, кодирующего лактатдегидрогеназу (ldhA), и гена, кодирующего пируват-формиат лиазу (pfl), в бактериях рубца, которые выбирают из группы, включающей род Mannheimia, род Actinobacillus и род Anaerobiospirillum.
В способе производства мутанта бактерий рубца предпочтительно проводят инактивацию генов ldhA и pfl с помощью гомологичной рекомбинации. Гомологичную рекомбинацию предпочтительно проводят, применяя вектор для генетического обмена, содержащий инактивированный ген ldhA, и вектор для генетического обмена, содержащий инактивированный ген pfl. Предпочтительно вектор, содержащий инактивированный ген ldhA, является pMLKO-sacB, вектор, содержащий инактивированный ген pfl, является pMPKO-sacB.
Еще в одном аспекте настоящее изобретение предоставляет способ производства мутанта бактерий рубца, который обладает способностью продуцировать янтарную кислоту в высоких концентрациях, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует, способ, включающий дополнительную инактивацию гена, кодирующего фосфотрансацетилазу (pta), и гена, кодирующего ацетаткиназу (ackA) в бактериях рубца, которые выбирают из группы, включающей род Mannheimia, род Actinobacillus и род Anaerobiospirillum; и где ген, кодирующй лактатдегидрогеназу (ldhA), и ген, кодирующй пируват-формиат лиазу (pfl), были инактивированы.
Инактивацию генов pta и ackA предпочтительно проводили с помощью гомологичной рекомбинации. Гомологичную рекомбинацию предпочтительно проводили, применяя вектор для генетического обмена, содержащий инактивированные гены pta или ackA. Вектор для генетического обмена, содержащий инактивированные гены pta или ackA, предпочтительно является pPTA-sacB.
Еще в одном аспекте настоящее изобретение предоставляет способ производства мутанта бактерии рубца, который обладает способностью продуцировать янтарную кислоту в высоких концентрациях, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует, способ, включающий дополнительную инактивацию гена, кодирующего фосфоенолпируваткарбоксилазу (ррс) в бактериях рубца, которые выбирают из группы, включающей род Mannheimia, род Actinobacillus и род Anaerobiospirillum, и где ген, кодирующий лактатдегидрогеназу (ldhA), и ген, кодирующий пируват-формиат лиазу (pfl), были инактивированы.
Инактивацию гена ррс предпочтительно проводили с помощью гомологичной рекомбинации. Гомологичную рекомбинацию предпочтительно проводили, применяя вектор для генетического обмена, содержащий инактивированный ген ррс. Вектор для генетического обмена, содержащий инактивированный ген ррс, предпочтительно является pPPC-sacB.
В настоящем изобретении мутант бактерий рубца, обладающий инактивированным геном, кодирующим лактатдегидрогеназу (ldhA), и инактивированным геном, кодирующим пируват-формиат лиазу (pfl), предпочтительно является Mannheimia sp.LPK (KCTC 10558 ВР).
Еще в одном аспекте настоящее изобретение предоставляет вектор для генетического обмена pMLKO-sacB, содержащий инактивированный ген ldhA; вектор для генетического обмена pMPKO-sacB, содержащий инактивированный ген pfl; вектор для генетического обмена pPTA-sacB, содержащий инактивированные гены pta и ackA; и вектор для генетического обмена pPPC-sacB, содержащий инактивированный ген ppc.
Еще в одном аспекте настоящее изобретение предоставляет способ продукции янтарной кислоты, способ, включающий стадии культивирования мутантов бактерий рубца в анаэробных условиях и извлечение янтарной кислоты из культуральной среды.
Термин «инактивация», употребляемый в тексте, означает, что гены, кодирующие ферменты, модифицируются таким образом, что ферменты не могут вырабатываться. В настоящем изобретении оба гена: лактатдегидрогеназы (ldhA) и пируват-формиат лиазы (pfl) были идентифицированы с помощью общедоступной генетической информации о штамме Mannheimia succiniciproducens 55E, который относится к бактериям рубца, и затем оба гена удаляли из Mannheimia succiniciproducens 55E с применением векторов, содержавших инактивированные гены, и таким образом конструировали бактериальный мутант Mannheimia sp.LPK (KCTC 10558 ВР). Затем инактивировали каждый из генов pta-ackA и ррс бактериального мутанта Mannheimia sp. LPK, создавая таким способом различные бактериальные мутанты. Затем было подтверждено, что такие бактериальные мутанты продуцируют янтарную кислоту в высоких концентрациях, в то время как продукция других органических кислот снижена или отсутствует.
Бактериальные мутанты настоящего изобретения {Mannheimia sp. LPK, LPK4 и LPK7) являются грамотрицательными факультативными анаэробами, они относятся к неподвижным палочкам или коккобациллам, они не производят эндоспоры и могут продуцировать в анаэробных условиях янтарную кислоту.
Краткое описание фигур
Фигура 1 демонстрирует способ конструирования вектора, содержащего инактивированный ген ldhA (pMLKO-sacB).
Фигура 2 демонстрирует способ конструирования вектора, содержащего инактивированный ген pfl (pMPKO-sacB).
Фигура 3 демонстрирует способ конструирования бактериального мутанта (LPK) с помощью инактивации генов ldhA и pfl в Mannheimia succiniciproducens 55E.
Фигура 4 – фотография электрофореза, демонстрирующего инактивацию генов ldhA и pfl в Mannheimia sp.LPK [M: маркер молекулярной массы лямбда HindIII; дорожки 1-3: ПЦР-продукт LU1 & КМ1 (1,5 т.п.н.); дорожки 4-6: ПЦР-продукт LD2 & КМ2 (1,7 т.п.н.); дорожки 7-9: ПЦР-продукт PU1 & СМ1 (2,2 т.п.н.) и дорожки 10-12: ПЦР-продукт PD2 & СМ2 (1,6 т.п.н)].
Фигура 5 демонстрирует характеристики культивирования Mannheimia sp.LPK в анаэробных условиях при насыщении СО2.
Фигура 6 демонстрирует способ конструирования вектора, содержащего инактивированные гены pta и ackA (pPTA-sacB).
Фигура 7 представляет собой способ конструирования вектора, содержащего инактивированный ген ppc (pPPC-sacB).
Фигура 8 демонстрирует способ конструирования бактериального мутанта LPK7 с помощью инактивации генов pta и ackA в Mannheimia sp. LPK.
Фигура 9 демонстрирует способ конструирования бактериального мутанта LPK4 с помощью инактивации гена ррс в Mannheimia sp. LPK.
Фигура 10 – фотография электрофореза, демонстрирующего инактивацию генов pta и ackA в Mannheimia sp.LPK7 [M: маркер «лестница» молекулярной массы (1 т.п.н.); дорожка 1: ПЦР-продукт Р13 & Р14 (1,1 т.п.н.) и дорожка 2: ПЦР-продукт Р15 & Р16 (1,5 т.п.н.)].
Фигура 11 – фотография электрофореза, демонстрирующего инактивацию гена ppc в Mannheimia sp.LPK4 [M: маркер «лестница» молекулярной массы (1 т.п.н.); дорожка 1: ПЦР-продукт Р13 & Р17 (1,1 т.п.н.) и дорожка 2: ПЦР-продукт Р15 & Р18 (1,5 т.п.н.)].
Фигура 12 демонстрирует характеристики культивирования Mannheimia sp. LPK7 в анаэробных условиях при насыщении СO2.
Фигура 13 демонстрирует характеристики культивирования Mannheimia sp. LPK4 в анаэробных условиях при насыщении CO2.
Осуществление изобретения
Далее настоящее изобретение будет детально раскрыто с помощью примеров. Однако для специалистов в этой области техники очевидно, что эти примеры даны исключительно в иллюстративных целях и не ограничивают объем настоящего изобретения.
Более детально, следующие примеры иллюстрируют только способ, включающий инактивацию генов в штамме рода Mannheimia для получения бактериальных мутантов и последующей продукции янтарной кислоты в высокой концентрации с помощью этих бактериальных мутантов. Однако специалистам в этой области техники также будут очевидны способы, с помощью которых мутанты бактерий рубца с инактивацией в этих генах получают из других штаммов бактерий рубца, таких как род Actinobacillus и род Anaerobiospirillum, и янтарную кислоту продуцируют, применяя штаммы бактерий.
Кроме того, следующие примеры иллюстрируют только определенные виды сред выращивания и способов культивирования. Однако для специалистов в этой области техники будет очевидным применение других сред, отличающихся от сыворотки, раствора кукурузного экстракта (CSL), как описано в литературе (Lee et al., Bioprocess Biosyst. Eng., 26:63, 2003; Lee et al., Appl. Microbiol. Biotechnol., 58:663, 2002; Lee et al., Biotechnol. Lett., 25:111, 2003; Lee et al., Appl. Microbiol. Biotechnol., 54:23, 2000; Lee et al., Biotechnol. Bioeng., 72:41, 2001), и применение различных методов, таких как метод подпитываемой культуры или метод непрерывной культуры.
Пример 1: Конструирование pMLKO-sacB
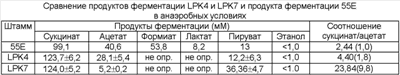
Чтобы инактивировать ген лактатдегидрогеназы (ldhA) с помощью гомологичной рекомбинации, следующим образом был сконструирован вектор для генного обмена. Вначале, используя геномную ДНК Mannheimia succiniciproducens 55E (КСТС 0769 ВР) в качестве матрицы, проводили ПЦР, применяя праймеры, указанные ниже в виде последовательностей SEQ ID NO: 1 и SEQ ID NO: 2, и затем полученный ПЦР-фрагмент разрезали с помощью SaсI и PstI и вводили в вектор pUC18 (New England Biolabs, Inc., Beverly, Mass.), конструируя таким образом вектор pUC18-Ll.
SEQ ID NO: 1: 5′-CAGTGAAGGAGCTCCGTAACGCATCCGCCG (LS1)
SEQ ID NO: 2: 5′-CTTTATCGAATCTGCAGGCGGTTTCCAAAA (LP1)
После этого, используя геномную ДНК Mannheimia succiniciproducens 55E в качестве матрицы, проводили ПЦР, применяя праймеры, указанные ниже в виде последовательностей SEQ ID NO: 3 и SEQ ID NO: 4, и полученный ПЦР-фрагмент разрезали с помощью PstI и HindIII и вводили в вектор pUC18-Ll, конструируя таким образом вектор pUC18-Ll-L2.
SEQ ID NO: 3: 5′-GTACTGTAAACTGCAGCTTTCATAGTTAGC (LP2)
SEQ ID NO: 4: 5′-GCCGAAAGTCAAGCTTGCCGTCGTTTAGTG (LH2)
Вектор pUC4K (Pharmacia, Freiburg, Germany) разрезали с помощью PstI, и полученный ген, устойчивый к канамицину, сливали с вектором pUC18-Ll-L2, разрезанным с помощью PstI, конструируя таким образом вектор pUC18-Ll-KmR-L2. Линкер, указанный ниже в виде последовательности SEQ ID NO: 5, вставляли в вектор pUC18-L1-KmR L2, разрезанный с помощью SacI, конструируя таким образом новый сайт рестрикции XbaI.
SEQ ID NO: 5: 5′-TCTAGAAGCT
ПЦР с использованием в качестве матрицы вектора pKmobsacB (Schafer et al., Gene, 145:69, 1994) проводили, применяя праймеры, указанные ниже в виде последовательностей SEQ ID NO: 6 и 7, и полученный ПЦР-продукт разрезали с помощью XbaI и вставляли в указанный выше ферментативный сайт рестрикции XbaI, конструируя таким образом вектор pMLKO-sacB (Фигура 1).
SEQ ID NO: 6: 5′-GCTCTAGACCTTCTATCGCCTTCTTGACG (SXF)
SEQ ID NO: 7: 5′-GCTCTAGAGGCTACAAAATCACGGGCGTC (SXR)
Пример 2: Конструирование вектора рМРКО-sacB
Чтобы инактивировать ген пируват-формиат лиазы (pfl) с помощью гомологичной рекомбинации, следующим образом был сконструирован вектор для генного обмена. Матрицу вектора pKmobsacB, содержащего ген sacB (Genbank 02730) амплифицировали с помощью ПЦР, применяя праймеры, указанные ниже в виде последовательностей SEQ ID NО: 8 и SEQ ID NO: 9. Полученный ПЦР-продукт sacB разрезали с помощью PstI и BamHI и вводили в вектор pUC19 (Stratagene Cloning Systems. La Jolla, Calif.), конструируя таким образом вектор pUC19-sacB.
SEQ ID NO: 8: 5′-AGCGGATCCCCTTCTATCGCCTTCTTGACG (SBG)
SEQ ID NO: 9: 5′-GTCCTGCAGGGCTACAAAATCACGGGCGTC (SPR)
Используя геномную ДНК Mannheimia succiniciproducens 55E в качестве матрицы, проводили ПЦР, применяя праймеры, указанные ниже в виде последовательностей SEQ ID NO: 10 и SEQ ID NO: 11. Полученный ПЦР-фрагмент разрезали с помощью BamHI и вставляли в вектор pUC19-sacB, разрезанный с помощью BamHI, конструируя таким образом вектор pUC19-sacB-pfl.
SEQ ID NO: 10: 5′-CATGGCGGATCCAGGTACGCTGATTTCGAT (PB1)
SEQ ID NO: 11: 5′-CAAGGATCCAACGGATAAAGCTTTTATTAT (PB2)
Чтобы получить ген, устойчивый к хлорамфениколу, проводили ПЦР, используя вектор pACYC184 (New England Biolabs, Inc., Beverly, Mass.) в качестве матрицы, с применением праймеров, указанных ниже в виде последовательностей SEQ ID NO: 12 и SEQ ID NO: 13. Полученный ПЦР-продукт разрезали с помощью SmaI и вставляли в вектор pUC19-sacB-pfl, разрезанный с помощью BstI1071, конструируя таким образом вектор pMPKO-sacB (Фигура 2).
SEQ ID NO: 12: 5′-CTCGAGCCCGGGGTTTAAGGGCACCAATAA (CTR)
SEQ ID NO: 13: 5′-CTCGAGCCCCGGGCTTTGCGCCGAATAAAT (CTF)
Пример 3: Конструирование штамма Mannheimia sp.LPK
Фигура 3 демонстрирует способ конструирования мутантного штамма (LPK) с помощью инактивации генов ldhA и pfl в Mannheimia succiniciproducens 55E. Mannheimia succiniciproducens 55E выращивали на чашке в среде LB, содержащей 10 г/л глюкозы, и культивировали при 37°С в течение 36 часов. Образовавшиеся колонии инокулировали в 10 мл жидкой среды LB с глюкозой и культивировали в течение 12 часов. Культуральную питательную среду с хорошо выросшими бактериями инокулировали в пропорции 1% на 100 мл жидкой среды LB с глюкозой и культивировали на термостатированном шейкере при 200 об/мин при 37°С.
Когда культуральная питательная среда достигала приблизительно 0,2-0,3 единиц OD (оптической плотности) после 4-5 часов инкубации, ее центрифугировали при 4°С и 4000 об/мин в течение 10 мин, чтобы собрать клетки. Затем клетки вновь суспендировали в 200 мл 10%-ного раствора глицерина при 4°С. Суспензию центрифугировали при 4°С и 4000 об/мин в течение 10 мин и клетки собирали и вновь суспендировали в 200 мл 10%-ного раствора глицерина при 4°С и центрифугировали при 4°С и 4000 об/мин в течение 10 мин, чтобы собрать клетки. Клетки суспендировали в глицерине при соотношении объемов 1:1 для получения концентрата клеток.
Полученный таким образом концентрат клеток смешивали с векторами для генетического обмена pMLKO-sacB и pMPKO-sacB, сконструированными в Примерах 1 и 2, и затем подвергали электропорации в условиях 1,8 кВ, 25 мкФ и 200 Ом. В смесь для электропорации добавляли 1 мл жидкой среды LB с глюкозой и растили смесь в термостатированном шейкере при 37°С и 200 об/мин в течение одного часа. Культуральную питательную среду помещали в чашки с твердой средой LB с глюкозой, содержащей подходящий антибиотик [Km (конечная концентрация 25 мкг/мл) или Cm (6,8 мкг/мл)] и растили при 37°С в течение 48 час и более. Чтобы отобрать колонии, где произошел только один двойной кроссовер, образовавшиеся колонии наносили в виде штрихов на среду LB с сахарозой (среда LB с 100 г/л сахарозы), содержащей 25 мкг/мл Km или Cm (6,8 мкг/мл). Через 24 часа образовавшиеся колонии вновь наносили в виде штрихов на идентичную чашку.
Колонию (мутант), образовавшуюся на чашке, растили в жидкой среде LB с глюкозой, содержащей антибиотик, и из выращенного штамма выделяли геномную ДНК с помощью метода, описанного Rochelle et al. (FEMS Microbiol. Lett., 100:59, 1992). ПЦР проводили, используя в качестве матрицы геномную ДНК мутанта, и ПЦР-продукт разделяли электрофоретически, чтобы подтвердить инактивацию генов ldhA и pfl в ПЦР-продукте.
Для подтверждения инактивации гена ldhA ПЦР проводили дважды следующим образом. Сначала геномную ДНК мутанта в качестве матрицы амплифицировали с помощью ПЦР с применением праймеров, указанных ниже в виде последовательностей SEQ ID NO: 14 и SEQ ID NO: 15.
SEQ ID NO: 14: 5′-GACGTTTCCCGTTGAATATGGC (KM1)
SEQ ID NO: 15: 5′-CATTGAGGCGTATTATCAGGAAAC (LUI)
Затем геномную ДНК мутанта в качестве матрицы амплифицировали с помощью ПЦР с применением праймеров, указанных ниже в виде последовательностей SEQ ID NO: 16 и SEQ ID NO: 17. Продукты, полученные в двух ПЦР, разделяли электрофоретически для подтверждения инактивации гена ldhA по их размерам (1,5 т.п.н.) (Фигура 4).
SEQ ID NO: 16: 5′-GCAGTTTCATTTGATGCTCGATG (KM2)
SEQ ID NO: 17: 5′-CCTCTTACGATGACGCATCTTTCC (LD2)
Чтобы подтвердить инактивацию гена pfl, дважды проводили ПЦР следующим образом. Сначала геномную ДНК мутанта в качестве матрицы амплифицировали с помощью ПЦР с применением праймеров, указанных ниже в виде последовательностей SEQ ID NO: 18 и SEQ ID NO: 19.
SEQ ID NO: 18: 5′-GGTGGTATATCCAGTGATTTTTTTCTCCAT (CM1)
SEQ ID NO: 19: 5′-CTTTGCAACATTATGGTATGTATTGCCG (PU1)
Затем геномную ДНК мутанта в качестве матрицы амплифицировали с помощью ПЦР с применением праймеров, указанных ниже в виде последовательностей SEQ ED NO: 20 и SEQ ID NO: 21. Продукты, полученные в двух ПЦР, разделяли электрофоретически для подтверждения инактивации гена pfl по их размерам (1,5 т.п.н.) (Фигура 4). На Фигуре 4 представлен маркер молекулярной массы (ДНК фага лямбда, гидролизованная HindIII), дорожки 1-3 представляют ПЦР-продукт LUI & KM1 (1,5 т.п.н.), дорожки 4-6 представляют ПЦР-продукт LD2 & КМ2 (1,7 т.п.н.), дорожки 7-9 представляют ПЦР-продукт PU1 & СМ1 (2,2 т.п.н.) и дорожки 10-12 представляют ПЦР-продукт PD2 & СМ2 (1,6 т.п.н.).
SEQ ID NO: 20: 5′-TACTGCGATGAGTGGCAGGGCGGGGCGTAA (СМ2)
SEQ ID NO: 21: 5′-CCCCAGCATGTGCAAATCTTCGTCAC (PD2)
Инактивация гена ldhA была подтверждена тем, что продукт, полученный в ПЦР с применением праймеров (LU1 и КМ1) последовательностей SEQ ID NO: 14 и SEQ ID NO: 15 имел размер 1,5 т.п.н. и в то же время продукт, полученный в ПЦР с применением праймеров (LD2 и КМ2) последовательностей SEQ ID NO: 16 и SEQ ID NO: 17 имел размер 1,7 т.п.н. Инактивация гена pfl была подтверждена тем, что продукт, полученный в ПЦР с применением праймеров (PU1 и СМ1) последовательностей SEQ ID NO: 18 и SEQ ID NO: 19, имел размер 2,2 т.п.н. и в то же время продукт, полученный в ПЦР с применением праймеров (PD2 и СМ2) последовательностей SEQ ID NO: 20 и SEQ ID NO: 21 имел размер 1,6 т.п.н. Расположение каждого праймера показано на Фигуре 3. Мутант, сконструированный указанным выше способом, то есть мутант с инактивацией генов ldhA и pfl, был назван «Mannheimia sp. LPK» и был депонирован под каталожным номером КСТС 10881ВР 26 ноября 2003 г.в Корейскую коллекцию типовых культур (КСТС) Корейского исследовательского института биологической науки и биотехнологии (KRIBB).
Пример 4: Характеристики ферментации Mannheimia sp. LPK
Для того чтобы исследовать характеристики ферментации мутанта Mannheimia sp.LPK, сконструированного как указано выше в Примере 3, его растили в анаэробных условиях с насыщением СО2 и полученный продукт анализировали. Сначала 100 мл среды прекультивирования, включающей 20 г/л глюкозы, 5 г/л полипептона, 5 г/л дрожжевого экстракта, 3 г/л К2НРO4, 1 г/л NaCl, 1 г/л (NH4)2SO4, 0,2 г/л CaCl2·2H2O, 0,2 г/л MgCl2·6H2O и 10 г/л MgCO3, насыщали СО2, а затем в среду прекультивирования инокулировали Mannheimia sp. LPK и прокультивировали при 39°С в течение 14 час. Затем 0,9 л культуральной среды, содержащей 20 г/л глюкозы, 5 г/л полипептона, 5 г/л дрожжевого экстракта, 3 г/л К2НРO4, 1 г/л NaCl, 5 г/л (NH4)2SO4, 0,2 г/л CaCl2·2H2O, 0,2 г/л MgCl2·6H2O и 5 г/л Na2CO3 помещали в культуральный резервуар на 2,5 л, и 100 мл прокультивированных микроорганизмов инокулировали в культуральную среду и культивировали в закрытом виде (batch cultured) при 39°С и рН 6,5, поддерживая поступление диоксида углерода со скоростью потока 0,25 vvm.
Концентрацию клеток в культуральной среде измеряли с помощью спектрофотометра (Ultraspec 3000, Pharmacia Biotech., Sweden) и количество сукцината, глюкозы, лактата, ацетата и формиата измеряли с помощью ВЭЖХ (колонка Aminex HPX-87Н, Bio-Rad, USA) (Фигура 5). Символы на Фигуре 5 относятся к изменениям концентрации клеток (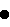 ), сукцината (о), глюкозы ( ), сукцината (о), глюкозы ( ), формиата ( ), формиата ( ) и ацетата ( ) и ацетата (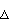 ) от времени пассажа культуры. Как показано на Фигуре 5, после 14 час культивирования концентрация поглощенной глюкозы составила 20 г/л и концентрация продуцированного сукцината была 17,2 г/л, что указывает на то, что выход сукцината (количество продуцированного сукцината/количество поглощенной глюкозы) составляет 81% и объем продуктивности сукцината (концентрация продуцированного сукцината/затраченное время) составляет 1,23 г/л/час. Способ продукции янтарной кислоты настоящего изобретения с применением выращивания Mannheimia sp.LPK в анаэробных условиях при насыщении СO2 продемонстрировал значительное увеличение выхода по сравнению с продукцией янтарной кислоты при выращивании родительского штамма Mannheimia succiniciproducens 55E в анаэробных условиях при насыщении СО2 и продемонстрировал соотношение янтарная кислота/уксусная кислота 40,7:1, указывающее на то, что он может продуцировать янтарную кислоту с небольшой продукцией или отсутствием продукции побочных продуктов. ) от времени пассажа культуры. Как показано на Фигуре 5, после 14 час культивирования концентрация поглощенной глюкозы составила 20 г/л и концентрация продуцированного сукцината была 17,2 г/л, что указывает на то, что выход сукцината (количество продуцированного сукцината/количество поглощенной глюкозы) составляет 81% и объем продуктивности сукцината (концентрация продуцированного сукцината/затраченное время) составляет 1,23 г/л/час. Способ продукции янтарной кислоты настоящего изобретения с применением выращивания Mannheimia sp.LPK в анаэробных условиях при насыщении СO2 продемонстрировал значительное увеличение выхода по сравнению с продукцией янтарной кислоты при выращивании родительского штамма Mannheimia succiniciproducens 55E в анаэробных условиях при насыщении СО2 и продемонстрировал соотношение янтарная кислота/уксусная кислота 40,7:1, указывающее на то, что он может продуцировать янтарную кислоту с небольшой продукцией или отсутствием продукции побочных продуктов.
Пример 5: Конструирование вектора pPTA-sacB
Чтобы инактивировать ген фосфотрансацетилазы (pta) и ген ацетаткиназы (ackA) с помощью гомологичной рекомбинации, следующим образом был сконструирован вектор для генного обмена. Сначала геномную ДНК Mannheimia sp.LPK (KCTC 10558BP) в качестве матрицы амплифицировали с помощью ПЦР, применяя праймеры, указанные ниже в виде последовательностей SEQ ID NO: 22 и SEQ ID NO: 23, и полученный ПЦР-фрагмент разрезали с помощью XbaI и BamHI и вводили в вектор pUC19, конструируя таким образом вектор pUC19-PTAl.
SEO ID NO: 22: 5′-GCTCTAGATATCCGCAGTATCACTTTCTGCGC
SEQ ID NO: 23: 5′-TCCGCAGTCGGATCCGGGTTAACCGCACAG
После этого геномную ДНК Mannheimia sp.LPK в качестве матрицы амплифицировали с помощью ПЦР, используя праймеры, указанные ниже в виде последовательностей SEQ ID NO: 24 и SEQ ID NO: 25, и полученный ПЦР-фрагмент разрезали с помощью XbaI и SacI и вставляли в вектор pUC19-PTAl, конструируя таким образом вектор pUC19-PTA12.
SEQ ID NO: 24: 5′-GGGGAGCTCGCTAACTTAGCTTCTAAAGGCCATGTTTCC
SEQ ID NO: 25: 5′-GCTCTAGATATCCGGGTCAATATCGCCGCAAC
Плазмиду рIС156 (Steinmetz et al., Gene, 142:79, 1994), содержащую ген устойчивости к стрептомицину (GenBank X02588), амплифицировали в качестве матрицы с помощью ПЦР, используя праймеры, указанные ниже в виде последовательностей SEQ ID NO: 26 и SEQ ID NO: 27, и полученный ПЦР-фрагмент (ген устойчивости к стрептомицину) вырезали с помощью EcoRV и вводили в вектор pUC19-PTA12, конструируя таким образом вектор pUC19-PTA1S2, имеющий ген устойчивости к стрептомицину. Сконструированный вектор pUC19-PTA1S2 разрезали с помощью SacI и BamHI и вводили в вектор pUC19-SacB (см. Пример 2), конструируя таким образом вектор a pPTA-sacB (Фигура 6).
SEQ ID NO: 26: 5′-GAATTCGAGCTCGCCCGGGGATCGATCCTC
SEQ ID NO: 27: 5′-CCCGGGCCGACAGGCTTTGAAGCATGCAAATGTCAC
Пример 6: Конструирование вектора рРРС-sacB
Чтобы инактивировать ген фосфоенолпируваткарбоксилазы (ррс) с помощью гомологичной рекомбинации, следующим образом был сконструирован вектор для генного обмена. Сначала геномную ДНК Mannheimia sp.LPK в качестве матрицы амплифицировали с помощью ПЦР, применяя праймеры, указанные ниже в виде последовательностей SEQ ID NO: 28 и SEQ ID NO: 29, и полученный ПЦР-фрагмент разрезали с помощью XbaI и BamHI и вводили в вектор pUC19, конструируя таким образом вектор pUC 19-PPC1.
SEQ ID NO: 28: 5′-TACGGATCCCCAGAAAATCGCCCCCATGCCGA
SEQ ID NO: 29: 5′-GCTCTAGATATCGTTTGATATTGTTCCGCCACATTTG
После этого геномную ДНК Mannheimia sp.LPK в качестве матрицы амплифицировали с помощью ПЦР, применяя праймеры, указанные ниже в виде последовательностей SEQ ID NO: 30 и SEQ ID NO: 31, и полученный ПЦР-фрагмент разрезали с помощью XbaI и SacI и вставляли в вектор pUC19-PPC1, конструируя таким образом вектор pUC19-PPC12.
SEQ ID NO: 30: 5′-GCTCTAGATATCCGTCAGGAAAGCACCCGCCATAGC
SEQ ID NO: 31: 5′-GGGGAGCTCGTGTGGCGCTGCGGAAGTAAGGCAAAAATC
Ген устойчивости к стрептомицину, вырезанный с помощью EcoRV (см. Пример 5), вводили в вектор pUC19-PPC12, чтобы сконструировать вектор pUC19-PPC1S2. Вектор pUC19-PPClS2 разрезали с помощью SacI и BamHI и вводили в вектор pUC19-SacB, конструируя таким образом вектор pPPC-sacB (Фигура 7).
Пример 7: Конструирование штаммов Mannheimia sp.LPK7 и LPK4
Фигуры 8 и 9 демонстрируют способы конструирования мутантных штаммов LPK7 и LPK4 с помощью инактивации генов pta-ackA и ррс в Mannheimia sp.LPK соответственно.
Mannheimia sp.LPK помещали на чашку со средой LB, содержащей 10 г/л глюкозы, и культивировали при 37°С в течение 36 час. Образовавшиеся колонии инокулировали в 10 мл жидкой среды LB с глюкозой и культивировали в течение 12 час. Культуральную питательную жидкость с достаточно хорошо выросшими бактериями инокулировали в пропорции 1% на 100 мл жидкой среды LB с глюкозой и культивировали в термостатированном шейкере при 37°С.
Концентрат клеток собирали из полученной культуральной питательной среды так, как описано в Примере 3. Собранный концентрат клеток смешивали с векторами для генетического обмена pPTA-sacB и pPPC-sacB, сконструированными, как описано в Примерах 5 и 6, и затем подвергали электропорации в условиях 1,8 кВ, 25°F и 200 Ом. Смесь для электропорации добавляли в 1 мл жидкой среды LB с глюкозой и культивировали в термостатированном шейкере при 200 об/мин и 37°С в течение одного часа.
Культуральную питательную среду помещали в чашку с твердой средой LB с глюкозой, содержащей антибиотик стрептомицин (конечная концентрация 50 мкг/мл), и культивировали при 37°С, по меньшей мере, в течение 48 час. Чтобы выбрать колонию, в которой произошел двойной кроссовер, образовавшиеся колонии наносили в виде штрихов на среду LB с сахарозой (среда LB, содержащая 100 г/л сахарозы), содержащую 50 мкг/мл стрептомицина. Через 24 часа образовавшиеся колонии наносили в виде штрихов на такую же чашку. Колонию (мутант), образовавшуюся на чашке, культивировали в жидкой среде LB с глюкозой, содержащей антибиотик, и из культивированного штамма выделяли геномную ДНК с помощью метода Rochelle et al. Выделенную геномную ДНК мутанта в качестве матрицы амплифицировали с помощью ПЦР и ПЦР-продукт разделяли электрофоретически для подтверждения инактивации обоих генов pta-ackA и ррс.
Чтобы подтвердить инактивацию гена pta-ackA, дважды проводили ПЦР следующим образом. Сначала геномную ДНК мутанта в качестве матрицы амплифицировали с помощью ПЦР с применением праймеров, указанных ниже в виде последовательностей SEQ ID NO: 32 и SEQ ID NO: 33. Затем геномную ДНК мутанта в качестве матрицы амплифицировали с помощью ПЦР с применением праймеров, указанных ниже в виде последовательностей SEQ ID NO: 34 и SEQ ID NO: 35.
SEQ ID NO: 32: 5′-CCTGCAGGCATGCAAGCTTGGGCTGCAGGTCGACTC
SEQ ID NO: 33: 5′-GCTGCCAAACAACCGAAAATACCGCAATAAACGGC
SEQ ID NO: 34: 5′-GCATGTAACTTTACTGGATATAGCTAGAAAAGGCATCGGGGAG
SEQ ID NO: 35: 5′-GCAACGCGAGGGTCAATACCGAAGGATTTCGCCG
Продукты, полученные в двух ПЦР, разделяли электрофоретически для подтверждения инактивации гена pta-ackA по их размерам (Фигура 10). На Фигуре 10 М представляет собой маркер «лестницу» молекулярной массы (1 т.п.н.), дорожка 1 представляет собой ПЦР-продукт Р13&Р14(1,1 т.п.н.) и дорожка 2 представляет собой ПЦР-продукт Р15 & Р16 (1,5 т.п.н.). Инактивация гена pta-ackA была подтверждена тем, что продукт, полученный в ПЦР с применением праймеров последовательностей SEQ ID NO: 32 и SEQ ID NO: 33 (Р13 & Р14), имел размер 1,1 т.п.н. и в то же время продукт, полученный в ПЦР с применением праймеров последовательностей SEQ ID NO: 34 и SEQ ID NO: 35 (Р15 & Р16), имел размер 1,5 т.п.н. Расположение праймеров показано на Фигуре 8. Мутант, сконструированный указанным выше способом, то есть штамм, полученный путем инактивации гена pta-ackA в Mannheimia sp. LPK, был назван «Mannheimia sp. LPK7» и был депонирован под каталожным номером КСТС 10626 ВР в КСТС, международный депозитарный отдел.
Кроме того, чтобы подтвердить инактивацию гена ррс, дважды проводили ПЦР следующим образом. Сначала геномную ДНК мутанта в качестве матрицы амплифицировали с помощью ПЦР с применением праймеров, указанных ниже в виде последовательностей SEQ ID NO: 32 и SEQ ID NPO: 36. Затем геномную ДНК мутанта в качестве матрицы амплифицировали с помощью ПЦР с применением праймеров, указанных ниже в виде последовательностей SEQ ID NO: 34 и SEQ ID NO: 37.
SEQ ID NO: 36: 5′-GATCCAGGGAATGGCACGCAGGCTTTCAACGCCGCC
SEQ ID NO: 37: 5′-GCAAAGCCAGAGGAATGGATGCCATTAACCAATAGCG
Продукты, полученные в двух ПЦР, разделяли электрофоретически для подтверждения инактивации гена ррс по их размерам (Фигура 11). На Фигуре 11 М представляет собой маркер «лестницу» молекулярной массы (1 т.п.н.), дорожка 1 представляет собой ПЦР-продукт Р13 & Р17 (1,1 т.п.н.) и дорожка 2 представляет собой ПЦР-продукт Р15 & Р18 (1,5 т.п.н.). Инактивация гена ppc была подтверждена тем, что продукт, полученный в ПЦР с применением праймеров последовательностей SEQ ID NO: 32 и SEQ ID NO: 36 (P13 & P17), имел размер 1,1 т.п.н., в то же время продукт, полученный в ПЦР с применением праймеров последовательностей SEQ ID NO: 34 и SEQ ID NO: 37 (P 15 & P 18), имел размер 1,5 т.п.н. Расположение праймеров показано на Фигуре 9. Мутантный штамм, сконструированный указанным выше способом, то есть штамм, полученный инактивацией гена ррс, в Mannheimia sp.LPK был назван «Mannheimia sp.LPK4».
Пример 8: Характеристики ферментации LPK7 и LPK4
Для того чтобы исследовать характеристики ферментации Mannheimia sp.LPK7 и LPK4, сконструированных, как указано выше в Примере 7, мутантов растили в анаэробных условиях с насыщением CO2 и полученные продукты анализировали. Сначала в 200 мл среды прекультивирования, описанной в Примере 4, инокулировали Mannheimia sp.LPK7 и LPK4 и прокультивировали при 39°С в течение 24 час. Затем 1,8 л культуральной среды, такой же как в Примере 4, за исключением того, что концентрация глюкозы составляла 18 г/л (конечная концентрация 100 мМ), помещали в культуральный резервуар на 6,6 л, 100 мл прокультивированных микроорганизмов инокулировали в культуральную среду и затем культивировали в одном цикле при 39°С и рН 6,5, поддерживая поступление диоксида углерода со скоростью потока 0,25 vvm.
Концентрацию клеток, сукцината, глюкозы, лактата, ацетата и формиата измеряли так же, как в Примере 4 (Фигуры 12 и 13). Символы на Фигурах 12 и 13 относятся к изменениям концентрации клеток (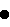 в верхней части фигуры), сукцината ( в верхней части фигуры), сукцината (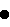 в нижней части фигуры), глюкозы ( в нижней части фигуры), глюкозы ( ), формиата ( ), формиата ( ) и ацетата ( ) и ацетата (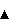 ) от времени культивирования. Как показано на Фигуре 12, после 22 час культивирования Mannheimia sp.LPK7 концентрация поглощенной глюкозы составила 100 мМ и концентрация продуцированного сукцината была 124 мМ, что указывает на то, что выход сукцината (количество продуцированного сукцината/количество поглощенной глюкозы) составляет 124 мол.%. И продукция ацетата значительно снизилась (Таблица). Так же как показано на Фигуре 13, после 22 час культивирования Mannheimia sp.LPK4 концентрация поглощенной глюкозы составила 100 мМ и концентрация продуцированного сукцината была 123,7 мМ, что указывает на то, что выход сукцината (количество продуцированного сукцината/количество поглощенной глюкозы) составляет 123,7 мол.%. И продукция ацетата значительно снизилась (Таблица). Способ продукции янтарной кислоты настоящего изобретения с помощью культивирования Mannheimia sp.LPK7 в анаэробных условиях при насыщении СО2 продемонстрировал значительное увеличение выхода янтарной кислоты и также 9,8-кратное увеличение соотношения янтарная кислота:уксусная кислота по сравнению с продукцией янтарной кислоты при культивировании родительского штамма Mannheimia succiniciproducens 55E в анаэробных условиях при насыщении СО2, указывающее на то, что с помощью способа настоящего изобретения можно продуцировать янтарную кислоту с незначительной продукцией или отсутствием продукции побочных продуктов. ) от времени культивирования. Как показано на Фигуре 12, после 22 час культивирования Mannheimia sp.LPK7 концентрация поглощенной глюкозы составила 100 мМ и концентрация продуцированного сукцината была 124 мМ, что указывает на то, что выход сукцината (количество продуцированного сукцината/количество поглощенной глюкозы) составляет 124 мол.%. И продукция ацетата значительно снизилась (Таблица). Так же как показано на Фигуре 13, после 22 час культивирования Mannheimia sp.LPK4 концентрация поглощенной глюкозы составила 100 мМ и концентрация продуцированного сукцината была 123,7 мМ, что указывает на то, что выход сукцината (количество продуцированного сукцината/количество поглощенной глюкозы) составляет 123,7 мол.%. И продукция ацетата значительно снизилась (Таблица). Способ продукции янтарной кислоты настоящего изобретения с помощью культивирования Mannheimia sp.LPK7 в анаэробных условиях при насыщении СО2 продемонстрировал значительное увеличение выхода янтарной кислоты и также 9,8-кратное увеличение соотношения янтарная кислота:уксусная кислота по сравнению с продукцией янтарной кислоты при культивировании родительского штамма Mannheimia succiniciproducens 55E в анаэробных условиях при насыщении СО2, указывающее на то, что с помощью способа настоящего изобретения можно продуцировать янтарную кислоту с незначительной продукцией или отсутствием продукции побочных продуктов.
Как было сообщено Bulter et al., даже если все известные до настоящего времени гены микроорганизмов, ответственные за продукцию ацетата, инактивированы, значительное количество ацетата продуцируется при метаболизме аминокислот и жирных кислот, механизм которого до сих пор не известен (Bulter et al. PNAS, 101:2299, 2004). Таким образом, в настоящем изобретении все пути продукции ацетата, известные в настоящее время, были отключены и были достигнуты высокий выход ферментации сукцината и высокая концентрация сукцината при ферментации.
Несмотря на то, что настоящее изобретение было детально описано с отсылками к специфическим деталям, специалистам в этой области техники будет очевидно, что это описание имеет отношение только к предпочтительным воплощениям и не ограничивает объем настоящего изобретения. Таким образом, действительный объем настоящего изобретения будет определен в прилагаемой Формуле изобретения и ее эквивалентах.
Применимость в промышленном производстве
Как описано и детально предоставлено выше по сравнению с прежним способом продукции янтарной кислоты с применением облигатных анаэробных штаммов, мутантные штаммы Mannheimia sp. (LPK, LPK7 и LPK4) продуцируют янтарную кислоту в анаэробных условиях при насыщении СO2 и являются факультативными анаэробами, обладающими высокой резистентностью по отношению к кислороду. Таким образом, продукция янтарной кислоты с применением таких мутантов может не только устранить нестабильность способа ферментации, вызываемую воздействием кислорода и т.п., но также устранить продукцию других органических кислот, таким образом делая возможным оптимизировать и максимизировать способ очистки и выход продукции.
Формула изобретения
1. Мутант бактерий рубца рода Mannheimia, модифицированный таким образом, что в указанном мутанте инактивированы ген, кодирующий лактатдегидрогеназу (IdhA), и ген, кодирующий пируват-формиат лиазу (pfl), и который обладает способностью продуцировать янтарную кислоту в высокой концентрации, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует.
2. Мутант бактерий рубца по п.1, отличающийся тем, что бактерии рубца являются гомоферментативными бактериями, продуцирующими только янтарную кислоту, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует.
3. Мутант бактерий рубца по п.1, отличающийся тем, что мутант бактерий рубца является Mannheimia sp.LPK.
4. Мутант бактерий рубца по п.3, отличающийся тем, что указанный Mannheimia sp.LPK представляет собой КСТС 10558 ВР.
5. Мутант бактерий рубца рода Mannheimia, модифицированный таким образом, что в указанном мутанте инактивированы ген, кодирующий лактатдегидрогеназу (IdhA), ген, кодирующий пируват-формиат лиазу (pfl), ген, кодирующий фосфотрансацетилазу (pta), и ген, кодирующий ацетаткиназу (ackA), и который обладает способностью продуцировать янтарную кислоту в высокой концентрации, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует.
6. Мутант бактерий рубца по п.5, отличающийся тем, что бактерии рубца являются гомоферментатавными бактериями, продуцирующими только янтарную кислоту, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует.
7. Мутант бактерий рубца по п.5, отличающийся тем, что мутант бактерий рубца является Mannheimia sp.LPK7.
8. Мутант бактерий рубца по п.7, в котором указанный Mannheimia sp.LPK7 представляет собой КСТС 10626 ВР.
9. Мутант бактерий рубца рода Mannheimia, модифицированный таким образом, что в указанном мутанте инактивированы ген, кодирующий лактатдегидрогеназу (IdhA), ген, кодирующий пируват-формиат лиазу (pfl), и ген, кодирующий фосфоенолпируваткарбоксилазу (ppc), и который обладает способностью продуцировать янтарную кислоту в высокой концентрации, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует.
10. Мутант бактерий рубца по п.9, отличающийся тем, что бактерии рубца являются гомоферментативными бактериями, продуцирующими только янтарную кислоту, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует.
11. Мутант бактерий рубца по п.9, отличающийся тем, что мутант бактерий рубца является Mannheimia sp.LPK.4.
12. Способ получения мутанта бактерий рубца рода Mannheimia, обладающего способностью продуцировать янтарную кислоту в высокой концентрации, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует, способ, включающий инактивацию гена, кодирующего лактатдегидрогеназу (IdhA), и гена, кодирующего пируват-формиат лиазу (pfl).
13. Способ по п.12, отличающийся тем, что инактивацию генов IdhA и pfl проводят с помощью гомологичной рекомбинации.
14. Способ по п.13, отличающийся тем, что гомологичную рекомбинацию проводят, применяя вектор для генетического обмена, содержащий инактивированный ген IdhA, и вектор для генетического обмена, содержащий инактивированный ген pfl.
15. Способ по п.14, отличающийся тем, что вектор для генетического обмена, содержащий инактивированный ген IdhA, является вектором pMLKO-sacB, и вектор для генетического обмена, содержащий инактивированный ген pfl, является вектором pMPKO-sacB.
16. Способ получения мутанта бактерий рубца рода Mannheimia, обладающего способностью продуцировать янтарную кислоту в высокой концентрации, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует, включающий инактивацию гена, кодирующего фосфотрансацетилазу (pta), и гена, кодирующего ацетаткиназу (ackA) в бактерии рубца рода Mannheimia, имеющей инактивированый ген, кодирующий лактатдегидрогеназу (IdhA), и ген, кодирующий пируват-формиат лиазу (pfl).
17. Способ по п.16, отличающийся тем, что мутант бактерий рубца рода Mannheimia, имеющий инактивированные гены, кодирующие лактатдегидрогеназу (IdhA) и пируват-формиат лиазу (pfl), является Mannheimia sp.LPK (KLCTC 10558BP).
18. Способ по п.16, отличающийся тем, что инактивацию гена pta и ackA проводят с помощью гомологичной рекомбинации.
19. Способ по п.18, отличающийся те, что гомологичную рекомбинацию проводят с применением вектора для генетического обмена, содержащего инактивированные гены pta и ackA.
20. Способ по п.19, отличающийся тем, что вектор для генетического обмена, содержащий инактивированные гены pta и ackA, является вектором pPTA-sacB.
21. Способ получения мутанта бактерий рубца рода Mannheimia, обладающего способностью продуцировать янтарную кислоту в высокой концентрации, в то время как продукция других органических кислот в анаэробных условиях снижена или отсутствует, способ, включающий инактивацию гена, кодирующего фосфоенолпируваткарбоксилазу (ррс), в бактерии рубца рода Mannheimia, имеющий инактивированый ген, кодирующий лакгатдегидрогеназу (IdhA), и ген, кодирующий пируват-формиат лиазу (pfl).
22. Способ по п.21, отличающийся тем, что мутант бактерий рубца, имеющий инактивированные гены, кодирующие лактатдегидрогеназу (IdhA) и пируват-формиат лиазу (pfl), является Mannheimia sp.LPK (KCTC 10558 ВР).
23. Способ по п.21, отличающийся тем, что инактивацию гена ррс проводят с помощью гомологичной рекомбинации.
24. Способ по п.23, отличающийся тем, что гомологичную рекомбинацию проводят с применением вектора для генетического обмена, содержащего инактивированный ген ррс.
25. Способ по п.24, отличающийся тем, что вектор для генетического обмена, содержащий инактивированный ген ррс, является вектором рРРС-sacB.
26. Способ получения янтарной кислоты, включающий культивирование мутанта бактерий рубца по любому из пп.1, 5 или 9 в анаэробных условиях и выделение янтарной кислоты из культуральной среды.
27. Способ по п.26, отличающийся тем, что культивирование является гомоферментацией, в которой продуцируется янтарная кислота в высокой концентрации, тогда как продукция других органических кислот снижена или отсутствует.
28. Способ по п.26, отличающийся тем, что мутант бактерий рубца является Mannheimia sp.LPK, LPK7 или LPK4.
Приоритет:
27.11.2003 по пп.1-4, 12-15, 26-28;
23.04.2004 по пп.5-11, 16-28.
РИСУНКИ
|
|