|
(21), (22) Заявка: 2008124773/13, 20.06.2008
(24) Дата начала отсчета срока действия патента:
20.06.2008
(46) Опубликовано: 20.12.2009
(56) Список документов, цитированных в отчете о
поиске:
NELSON K.E. et al, Evidence for lateral gene transfer between Archaea and bacteria from genome sequence of Thermotoga maritime, Nature, 1999, v.399, n.6734, p.323-329. PELCZAR P. et al., Agrobacterium proteins VirD2 and VirE2 mediate precise integration of synthetic T-DNA complexes in mammalian cells, EMBO Rep., 2004, v.5, n.6, p.632-637. RU 2248983 C1, 27.03.2005. WO 9505471 A2, 23.02.1995. US 6897053, 24.05.2005.
Адрес для переписки:
107150, Москва, ул. б-р Маршала Рокоссовского, 18, кв.32, Д.В. Гришину
|
(72) Автор(ы):
Гришин Дмитрий Викторович (RU)
(73) Патентообладатель(и):
Гришин Дмитрий Викторович (RU)
|
(54) ХИМЕРНЫЙ БЕЛОК ДЛЯ НЕВИРУСНОГО ТРАНСГЕНЕЗА, ВКЛЮЧАЮЩИЙ ДНК-СВЯЗЫВАЮЩИЙ ДОМЕН SSBTne И СИГНАЛ ЯДЕРНОЙ ЛОКАЛИЗАЦИИ VirD2
(57) Реферат:
Изобретение относится к области генной инженерии, конкретно к невирусному трансгенезу клеток, и может быть использовано в медицинской и сельскохозяйственной биотехнологии для доставки экзогенов. Конструируют белок, включающий ДНК связывающий домен SSBTne из термофильного микроорганизма Termatoga neapolitana, присоединенный к С-концу домена VirD2 из Agrobacterium tumefaciens, являющегося сигналом ядерной локализации. Изобретение обеспечивает эффективный транспорт трансгена в клеточное ядро. 6 ил., 1 табл.
I. Описание изобретения
Одной из важнейших задач биотехнологии является повышение адресности доставки и эффективности интеграции чужеродных генов при трансфекции эукариотических клеток.
Понятно, что векторы для транспорта генов должны преодолевать многочисленные физиологические барьеры, например внутриклеточные барьеры:
– невозможность самостоятельного выхода нуклеиновой кислоты из эндосомы,
– деградация нуклеиновой кислоты в лизосомах вследствии длительного их пребывания в эндосоме,
– неспособность нуклеиновой кислоты к самостоятельному направленному транспорту в ядро клетки.
Именно наличие этих барьеров приводит к низкой эффективности микроинъекции и к малой эффективности трансфекции клеточных культур. До недавнего времени большинство протоколов транспорта генов включало доставку экзогенов посредством вирусных векторов.
Однако ряд очевидных недостатков вирусных векторов побуждал искать альтернативные невирусные системы, в качестве которых в настоящее время чаще всего используются различные липосомные агенты. Но липосомная доставка также имеет ряд недостатков – липосомы не решают проблему вышеперечисленных барьеров.
Предполагается, что будущие невирусные векторные системы для транспорта генов должны сочетать в себе как элементы вирусных векторов, так и невирусных систем, при этом речь будет идти уже не о вирусном или липосомном транспорте генов, а, скорее, о виросомной доставке.
Новые возможности в решении данных вопросов были получены благодаря активному изучению механизмов агробактериальной трансформации и вирусной инфекции клеток. Наиболее интересными с этой точки зрения являются два механизма, облигатно присутствующих практически у всех вирусных и бактериальных внутриклеточных паразитов, а именно наличие ДНК связывающих белков, способных противодействовать нуклеазам хозяйской клетки, и наличие сигналов ядерной локализации (NLS), обладающих кариофильными свойствами, т.е. способностью адресно протаскивать паразитическую ДНК в ядро хозяйской клетки.
Т.е. одним из вариантов преодоления вышеперечисленных барьеров для доставки может стать использование в целях трансфекции, в дополнение к таким системам как липосомы, вирусных и бактериальных белковых агентов, которые позволили бы, с одной стороны, защитить экзоген, а, с другой стороны, адресовать встройку трансгена в целевой геном. Таким образом, нашей целью стало создание новых невирусных векторных систем для доставки экзогенов на базе вышеперечисленных механизмов ДНК-связывания и сигналов ядерного тпранспорта.
Изобретением является химерный рекомбинантный белок, включающий ДНК связывающий домен SSBTne из Termatoga neapolitana, присоединенный к С-концу домена VirD2 из Agrobacterium tumefaciens, являющегося сигналом ядерной локализации, который как изобретение относится к области «генной инженерии» и «биотехнологии».
Прототипом предлагаемому изобретению являются ДНК связывающий домен SSBTne и сигнал ядерной локализации VirD2 как автономные белковые конструкции [1; 2].
Отличительная сущность изобретения заключается в том, что сконструированный белок VirD2-SSBTne (фиг.1) обладает трансфецирующей способностью и способностью повышать эффективность липосомальной трансфекции.
Технический результат, достигаемый настоящим изобретением, заключается в том, что полученная белковая конструкция, включающая ДНК связывающий домен SSBTne и сигнал ядерной локализации VirD2, способна как самостоятельно выступать в роли вектора при трансфекции клеток эукариот, так и повышать эффективность липосомальной трансфекции. Основная цель: получение высокоочищенного нативного белка VirD2 -SSBTne и изучение его базовых свойств.
Для достижения цели поставлены следующие задачи:
– получение генной конструкции, кодирующей целевой белок,
– оптимизация плазмидных векторов, в которые встраивались генные конструкции,
– наработка генов в препаративных количествах в клонирующих векторах,
– получение высокоочищенного целевого белка.
Источники клонируемого материала:
1) Ген ДНК-связывающего белка SSBTne из археобактерии Termatoga neapolitana [1].
2) Ген сигнала ядерной локализации или ядерного транспорта VirD2 из агробактерии Agrobacterium tumefaciens [2].
Схема клонирования по этапам.
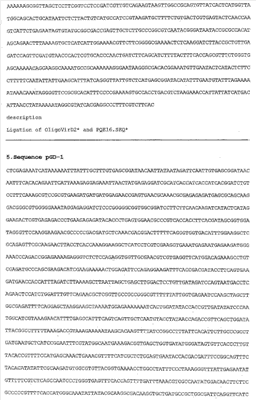
Ген SSBTne был получен на основе известной последовательности ДНК-связывающего белка SSBTne из археобактерии Termatoga neapolitana посредством ПЦР [(94°С – 2 мин; 60°С – 30 с; 72°С – 1 мин) X 30; 72°С – 5 мин] с корректирующими праймерами (см. табл.  1). Ген VirD2 был собран на основе известной последовательности сигнала ядерной локализации из корректирующих олигонуклеотидов (см. табл. 1). Ген VirD2 был собран на основе известной последовательности сигнала ядерной локализации из корректирующих олигонуклеотидов (см. табл.  1 перечень последовательностей). Далее посредством лигатирования ген SSBTne был встроен в плазмидный вектор pQE6, а ген VirD2 был встроен в цлазмидный вектор pQE16 фирмы Quageen (см. перечень последовательностей 1 перечень последовательностей). Далее посредством лигатирования ген SSBTne был встроен в плазмидный вектор pQE6, а ген VirD2 был встроен в цлазмидный вектор pQE16 фирмы Quageen (см. перечень последовательностей  1; 1;  2). 2).
Лигатирование конструкций, гидролизованных по соответствующим рестрикционным сайтам, проводилось по 4-компонентной схеме: 10×буфер для лигатирования, 250 мМ KCl, 10×Нех, 10×АТФ. Продолжительность лигатирования лигазой фага Т4 составляла 24 часа при температуре +4°С. Далее компетентные клетки E.coli М15 (nals, strs, rifs, lac–, ara–, gal–, mtl–, F’–, recA+, uvr+, lon+, pREP4 – kanamycin resistance 25 мг/мл) трансформировались лигазными смесями методом электропорации при следующем режиме: 2,5 kV, 25 mF в течение 4 с, после чего они высевались на агаризованную питательную среду LB с соответствующими антибиотиками (ампициллин; канамицин) для селекции. На следующие сутки проводился пересев отобранных клонов как на сектора агаризованной питательной среды, так и в жидкую питательную среду LB с соответствующими антибиотиками для последующего скрининга плазмидной ДНК, которая выделялась методом щелочного лизиса. Правильность сборки генов, кодирующих химерные белковые конструкции, подтверждалась рестрикционным анализом и секвенированием на автоматическом секвенаторе ALF express II (Amersham Biosciences corp., США) (последовательности соответствовали теоретическим). Были получены плазмидные конструкции: pQeSSBTne, pQeVirD2, pGD-1 (см. перечень последовательностей  3; 3;  4; 4;  5). 5).
Для экспрессии белков был использован экспрессионный штамм Е.coll M15. Индукция экспрессии осуществлялась путем добавления к клеточной культуре с оптической плотностью 0,9-1,2 (550 нм) индуктора ИПТГ (изопропил- -D-тиогалактопиранозид) в концентрации 0,1 мМ. Время индукции составляло 3,0 часа. -D-тиогалактопиранозид) в концентрации 0,1 мМ. Время индукции составляло 3,0 часа.
В препаративных количествах белок выделялся посредством фракционирования методом гельфильтрации. 1,5 л индуцированной культуры осаждались при 4000 об/мин 30 мин, осадок выдерживался при -70°С сутки, затем осадок промывался 100 мл Н2O MQ и ресуспендировался в 40 мл рабочего буфера Buf.B (Tris Cl, рН 7,4; KCl 50 mM.; EDTA 1 mM; Tween 20, 0,5%; Triton X100, 0,5%).
Затем добавлялся лизоцим до ослизнения, осадок выдерживался 15 мин при 0°С. Затем раствор обрабатывался УЗ в мягком режиме во льду, после чего добавлялись ДНКаза и РНКаза (1 мл/40 мл лизата), и осуществлялся прогрев на водяной бане при 75°С в течение 45 мин, при этом благодаря наличию термостабильного домена целевой белок полностью сохранял свои свойства и концентрировался в супернатанте в растворимом виде, в то время как большинство штаммовых белков коагулировали, что значительно упрощало последующую его очистку методом гельфильтрации. Далее производилось центрифугирование (4000 об/мин 40 мин 3°С) и супернатант переносили в чистую пробирку через фильтр (0.45 µm) (перед этим отбирались 1,5 мл в качестве контроля после ЦФ). Т.к. оптимальным отношением объема колонки к объему наносимого образца является Vк/Vо=40 [3], то препарат был сконцентрирован посредством диализа в Sefadex G-50 (Sigma, USA) до 7 см3. Колонка V=300 см3 заполнялась сорбентом Sefadex G-75 (Sigma, USA), промывалась 3-мя объемами рабочего буфера при скорости потока в 9 см3/мин (Р=0,15 МПа или 1,5 бара), после чего ее уравновешивали 5-ю объемами рабочего буфера. 7 см3 образца наносили на колонку. При скорости элюирования 19 см3/ч проводили сбор фракций, ориентируясь на данные самописца и спектрофотометра 50 (nm). Посредством электрофореза в 17% полиакриламидном геле (фиг.2) было доказано, что целевой белок вышел во фракциях  X-XI. X-XI.
Таким образом, был получен высокоочищенный химерный двудоменный белок VirD2-SSBTne (а.к. последовательность см. в перечне последовательностей  6) с молекулярным весом 23 кДа и концентрацией 2 мг/мл, который будет использован для дальнейших исследований в области усовершенствования методов невирусной трансфекции клеток эукариот. 6) с молекулярным весом 23 кДа и концентрацией 2 мг/мл, который будет использован для дальнейших исследований в области усовершенствования методов невирусной трансфекции клеток эукариот.
На следующем этапе были изучены базовые свойства белка VirD2-SSBTne, именно эти свойства и определяли способен ли он войти в состав трансфецирующего реагента.
Сначала изучались ДНК – связывающие свойства исследуемых белков ViRD2-SSBTne по методу ретардации в агарозном геле, т.к., связываясь с ДНК, белки утяжеляют ее.
Предварительно белки связывались с фрагментами ДНК при температуре 94°С с целью образования одноцепочечных форм ДНК.
На форезе (фиг.3) виден четкий сдвиг ДНК-белковых комплексов относительно голой ДНК, при этом наиболее четкая ретардация наблюдается на 2-ом треке, при этом оптимальные молярные соотношения нуклеиновой кислоты и белка составляют 1:50, соответственно.
Затем была изучена способность полученных белков защищать ДНК от воздействия ДНКазы. ДНК смешивалась при температурном оптимуме с нашим белком, затем добавлялась ДНКаза в кол-ве 3 мкл и результат оценивался относительно положительного и отрицательного контролей в агарозном геле (фиг.4). Было видно (на 1-м) треках, что ДНК в присутствии наших белков не подвергалась разрушающему воздействию ДНКазы, т.е. наши белки обладали выраженными нуклеазпротективными свойствами. В качестве репортерного функционального гена был выбран ген белка GFP под контролем CMV промотера в составе коммерческого челночного вектора pCECMVGFP (перечень последовательностей приложения  7). 7).
Были разработаны и оптимизированы реагенты для трансфекции на базе катионных липосом (липофектин) и полученных белковых конструкций. Т.е. был подобран наиболее физиологичный буфер, которым оказался фосфатный буфер PBS, был подобран фоновый ионный состав, в качестве которого выступали ионы Mg2+ и Zn2+, благодаря своему стабилизирующему воздействию на наши белки, а также было определено оптимальное объемное соотношение ДНК-белкового комплекса и липофектина (1:1).
На завершающем этапе была проведена трансфекция клеточных линий Cos-1 и Нер-2 нашими трансфецирующими реагентами, далее был проведен статистический учет результатов трансфекции посредством флюоресцентной микроскопии с последующим фотодетектированием, в результате чего было доказано, что конструкция VirD2-SSBTne сама по себе обладает векторными свойствами, определяя достоверный выход трансфекции на уровне 5%, а так же детерминирует достоверное (Р>0,999) увеличение эффективности липосомальной трансфекции клеток Cos-1 и Нер-2 в 2 раза (с 15-25% до 30-50%) (фиг.5).
Подписи к фиг.2
Результаты электрофореза в 17% ПААГ в присутствии SDS
1. Штамм E.coli М15 (VirD2-SSBTne) до индукции IPTG (без прогрева)
2. Штамм E.coli М15 {VirD2-SSBTne) индукция IPTG (без прогрева)
3. Штамм E.coli Ml5 (VirD2-SSBTne) до инд. IPTG термолизис (75°С 45 мин)
4. Штамм E.coli М15 (VirD2-SSBTne) инд. IPTG термолизис (75°С 45 мин), (проба до гельфильтрации)
5. Фракция белка  X (после гельфильтрации) X (после гельфильтрации)
6. Фракция белка  XI (после гельфильтрации) XI (после гельфильтрации)
7. Маркер молекулярного веса (30 кДа).
Подписи к фиг.3
Ретардация ДНК-белкового комплекса в 1,5% агарозном геле
1. ДНК, свободная
2. ДНК: Белок 1:50
3. ДНК: Белок 1:25
4. ДНК: Белок 1:12,5
Подписи к фиг.4
Электрофорез в 1,5% агарозном геле (изучение нуклеазпротективных свойств VirD2-SSBTne).
1. ДНК+ДНКаза+VirD2-SSBTne
2. маркер мол. веса лямбда
3. ДНК без ДНКазы
4. ДНК+ДНКаза
5. ДНК+ДНКаза (дубль)
Подписи к фиг.5
Учет результатов трансфекции клеток линии Нер-2 комплексом pCECMVGFP и [VirD2-SSB]-LP. а) pCECMVGFP+буф.PBS, б) pCECMVGFP+LP+буф.PBS, в) pCECMVGFP+[VirD2-SSB], г) pCECMVGFP+[VirD2-SSB]+LP.
Подписи к фиг.6
Учет результатов трансфекции клеток линии Cos-1 комплексом pCECMVGFP и [VirD2-SSB]-LP. а) pCECMVGFP+буф.PBS, б) pCECMVGFP+LP+буф.PBS, в) pCECMVGFP+[VirD2-SSB], г) pCECMVGFP+[VirD2~SSB]+LP.
Перечень последовательностей













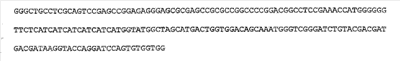
Литература
3. Остерман Л.А. Методы исследования белков и нуклеиновых кислот. – издат. «Наука», 1981.
Формула изобретения
Химерный рекомбинантный белок для доставки экзогенов при трансфекции клеток эукариот, включающий ДНК-связывающий домен SSBTne из термофильного микроорганизма Termatoga neapolitana, присоединенный к С-концу домена VirD2 из Agrobacterium tumefaciens, являющегося сигналом ядерной локализации, где позиционируемый белок обладает аминокислотной последовательностью, приведенной в перечне последовательностей  6 описания. 6 описания.
РИСУНКИ
|