|
(21), (22) Заявка: 2007103815/04, 01.07.2005
(24) Дата начала отсчета срока действия патента:
01.07.2005
(30) Конвенционный приоритет:
01.07.2004 JP 2004-195836
(43) Дата публикации заявки: 10.08.2008
(46) Опубликовано: 20.12.2009
(56) Список документов, цитированных в отчете о
поиске:
WO 2003/101968 А1, 11.12.2003. WO 2002/030907 А1, 18.04.2002. WO 2003/024962 A1, 27.03.2003.
(85) Дата перевода заявки PCT на национальную фазу:
01.02.2007
(86) Заявка PCT:
JP 2005/012208 20050701
(87) Публикация PCT:
WO 2006/004040 20060112
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ИНОУЕ Хидеказу (JP),
МУРАФУДЗИ Хиденобу (JP),
ХАЯСИ Ясухиро (JP)
(73) Патентообладатель(и):
АСУБИО ФАРМА КО., ЛТД. (JP)
|
(54) ПРОИЗВОДНОЕ ТИЕНОПИРАЗОЛА, ИМЕЮЩЕЕ ИНГИБИРУЮЩУЮ ФОСФОДИЭСТЕРАЗУ 7 (PDE 7) АКТИВНОСТЬ
(57) Реферат:
Описываются новые соединения тиенопиразола формулы (I), где R1 обозначает незамещенную С3-С8-циклоалкильную группу или тетрагидропиранил, R2 обозначает незамещенную C1-С3алкильную группу, R3 обозначает атом водорода, R4 обозначает разные группы, указанные в формуле изобретения. Соединения ингибируют PDE 7 и, следовательно, повышают клеточный уровень цАМФ. Вследствие этого такое соединение применимо для лечения различных типов таких заболеваний, как аллергические заболевания, воспалительные заболевания или иммунологические заболевания. Описываются также фармацевтическая композиция, способ ингибирования PDE, способы получения соединения формулы (I), где R4 обозначает
CO2R7, и промежуточные соединения. 8 н. и 12 з.п. ф-лы, 138 табл.
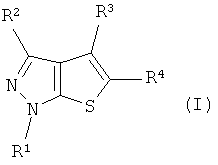
Область техники
Данное изобретение относится к производным тиенопиразола, их фармацевтически приемлемым солям и сольватам, имеющим селективное ингибирующее PDE 7 (фосфодиэстеразу VII) действие. Кроме того, данное изобретение относится к промежуточным соединениям для получения указанных производных тиенопиразола и способу их получения. Эти соединения являются эффективными соединениями для лечения различных типов таких заболеваний, как аллергические заболевания, воспалительные заболевания и иммунологические заболевания.
Уровень техники
Циклический АМФ (цАМФ) или циклический ГМФ (цГМФ), который является внутриклеточным вторичным мессенджером, разрушается и инактивируется фосфодиэстеразами (PDE 1 – PDE 11). PDE 7 селективно разрушает цАМФ и характеризуется как фермент, который не ингибируется ролипрамом. Ролипрам является селективным ингибитором PDE 4, который подобным образом разрушает цАМФ.
Предполагается, что PDE 7 играет важную роль для активации Т-клеток (Beavo et al., Science, 283, 848 (1999)), и хорошо известно, что активация Т-клеток имеет отношение к обострению аллергических заболеваний, воспалительных заболеваний или иммунологических заболеваний. Этими заболеваниями являются, например, бронхиальная астма, хронический бронхит, хроническая обструктивная болезнь легких, аллергический ринит, псориаз, атопический дерматит, конъюнктивит, остеоартрит, ревматоидный артрит, рассеянный склероз, системная красная волчанка, воспалительное заболевание кишечника, гепатит, панкреатит, энцефаломиелит, сепсис, болезнь Крона, реакция отторжения в трансплантации, реакция трансплантат против хозяина (GVH-заболевание) и рестеноз после ангиоплаcтики [J. Allergy Clin. Immunol., 2000 Nov; 106(5 Suppl.): S221-6; Am. J. Respir. Crit. Care Med., 1996 Feb; 153(2): 629-32; Am. J. Respir. Crit. Care Med., 1999 Nov; 160(5 Pt 2): S33-7; Clin. Exp. Allergy, 2000 Feb; 30(2): 242-54; Hosp. Med., 1998 Jul; 59(7): 530-3; Int. Arch. Allergy Immunol., 1998 Mar; 115(3): 179-90; J. Immunol., 1991 Feb 15; 146(4): 1169-74; Osteoarthritis Cartilage, 1999 Jul; 7(4): 401-2; Rheum. Dis. Clin. North Am., 2001 May; 27(2): 317-34; J. Autoimmun., 2001 May; 16(3): 187-92; Curr. Rheumatol. Rep., 2000 Feb; 2(1): 24-31; Trends Immunol., 2001 Jan; 22(1): 21-6; Curr. Opin. Immunol., 2000 Aug; 12(4): 403-8; Diabetes Care, 2001 Sep; 24(9): 1661-7; J. Neuroimmunol., 2000 Nov 1; 111(1-2): 224-8; Curr. Opin. Immunol., 1997 Dec; 9(6): 793-9; JAMA, 1999 Sep 15; 282(11):1076-82; Semin. Cancer Biol., 1996 Apr; 7(2): 57-64; J. Interferon Cytokine Res., 2001 Apr; 21(4): 219-21].
Таким образом, считается, что соединение, имеющее ингибирующее PDE 7 действие, является полезным для лечения различных типов таких заболеваний, как аллергические заболевания, воспалительные заболевания или иммунологические заболевания, имеющие отношение к Т-клеткам.
Было сделано предположение, что многие соединения селективно ингибируют PDE 7. Могут быть упомянуты такие примеры, как производные имидазопиридина (Патентный Документ 1), производные дигидропурина (Патентный Документ 2), производные пиррола (Патентный Документ 3), производные бензотиопираноимидазолона (Патентный Документ 4), гетероциклические соединения (Патентный Документ 5; Патентный Документ 6), производные хиназолина и пиридопиримидина (Патентный Документ 7), спиротрициклические соединения (Патентный Документ 8), производные тиазола и оксатиазола (Патентный Документ 9), производные сульфонамида (Патентный Документ 10), производные гетеробиарилсульфонамида (Патентный Документ 11), производные дигидроизохинолина (Патентный Документ 12), производные гуанина (Непатентный Документ 1), производные бензотиадиазина и производные бензотиенотиадиазина (Непатентный Документ 2 и Непатентный Документ 3). Однако до настоящего времени не разработаны лечебные лекарственные средства, имеющие ингибирующее PDE 7 действие, в качестве основного фармакологического механизма.
Хотя некоторые соединения, имеющие скелет (структуру) тиенопиразола, были известны (Патентные Документы 13 – 24; Непатентные Документы 4-8), не было предположений, что эти соединения имеют ингибирующее PDE 7 действие. Кроме того, сообщался способ получения производных тиенопиразола данного изобретения (Непатентные Документы 9-11); однако заместители на скелете тиенопиразола являются другими, чем заместители данного изобретения.
Патентный Документ 1: International Patent Publication WO 01/34,601
Патентный Документ 2: International Patent Publication WO 00/68,203
Патентный Документ 3: International Patent Publication WO 01/32,618
Патентный Документ 4: DE Patent 19,950,647
Патентный Документ 5: International Patent Publications WO 02/88,080
Патентный Документ 6: International Patent Publications WO 02/87,513
Патентный Документ 7: International Patent Publication WO 02/102,315
Патентный Документ 8: International Patent Publication WO 02/74,754
Патентный Документ 9: International Patent Publication WO 02/28,847
Патентный Документ 10: International Patent Publication WO 01/98,274
Патентный Документ 11: International Patent Publication WO 01/74,786
Патентный Документ 12: International Patent Publication WO 02/40,450
Патентный Документ 13: International Patent Publication WO 02/100,403
Патентный Документ 14: International Patent Publication WO 02/79,146
Патентный Документ 15: International Patent Publication WO 02/66,469
Патентный Документ 16: International Patent Publication WO 01/90,101
Патентный Документ 17: U.S. Patent No. 6022307
Патентный Документ 18: International Patent Publication WO 03/024,962
Патентный Документ 19: International Patent Publication WO 03/029,245
Патентный Документ 20: International Patent Publication WO 03/040,096
Патентный Документ 21: International Patent Publication WO 03/097,617
Патентный Документ 22: International Patent Publication WO 03/099,821
Патентный Документ 23: International Patent Publication WO 97/27,200
Патентный Документ 24: U.S. Patent No. 3649641
Непатентный Документ 1: Bioorg. Med. Chem. Lett., 11(2001), 1081
Непатентный Документ 2: J. Med. Chem., 43(2000), 683
Непатентный Документ 3: Eur. J. Med. Chem., 36(2001), 333
Непатентный Документ 4: Russ. J. Org. Chem., 39(2003), 893
Непатентный Документ 5: Aknos Consulting and Solutions GmbH Co., Catalog: Akos samples
Непатентный Документ 6: Phosphorus, sulfur and silicon and related Elements, 157(2000), 107
Непатентный Документ 7: Zhurnal Organisheskoi Khimii., 9(1973), 2416
Непатентный Документ 8: Zhurnal Organisheskoi Khimii., 5(1969), 1498
Непатентный Документ 9: Phosphorus, sulfur and silicon and related Elements, 157(2000), 107
Непатентный Документ 10: Chinese Chemical Letters, 10(3), (1999), 189
Непатентный Документ 11: Indian Journal of Chemistry, Section B: Organic Chemistry Including Medicinal Chemistry, 35B(7), (1996), 715
Описание изобретения
Проблема, подлежащая решению в данном изобретении
Целью данного изобретения является обеспечение новых соединений, имеющих ингибирующую PDE 7 активность, и ингибиторов PDE 7, содержащих указанные ингибиторы в качестве активного ингредиента. Кроме того, данное изобретение обеспечивает применимые промежуточные соединения для получения вышеупомянутых новых соединений.
Соединения данного изобретения ингибируют PDE 7 селективно и, следовательно, повышают уровень клеточного цАМФ. Поэтому соединения данного изобретения применимы для лечения различных типов таких заболеваний, как аллергические заболевания, воспалительные заболевания или иммунологические заболевания, ингибированием активации Т-клеток.
Например, соединения данного изобретения применимы для лечения или предупреждения таких заболеваний, как бронхиальная астма, хронический бронхит, хроническая обструктивная болезнь легких, аллергический ринит, псориаз, атопический дерматит, конъюнктивит, остеоартрит, ревматоидный артрит, рассеянный склероз, системная красная волчанка, воспалительное заболевание кишечника, гепатит, панкреатит, энцефаломиелит, сепсис, болезнь Крона, реакция отторжения в трансплантации, реакция трансплантат против хозяина (GVH-заболевание) и рестеноз после ангиоплаcтики.
Средства для решения этой проблемы
Посредством интенсивных исследований исследуемых соединений, способных ингибировать PDE 7, авторы данного изобретения обнаружили, что соединения, имеющие скелет тиенопиразола в молекуле, представленной формулой (I), указанной ниже, имеют сильное и селективное ингибирующее PDE 7 действие, и, следовательно, завершили данное изобретение.
Таким образом, в качестве одного аспекта данного изобретения обеспечены соединения тиенопиразола, представленные следующей формулой (I):
Формула 1
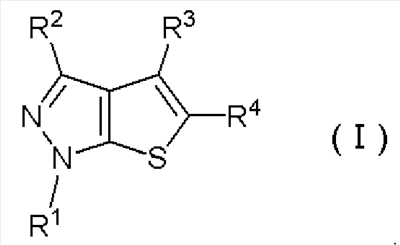
где R1 обозначает замещенную или незамещенную С3-С8алкильную группу, замещенную или незамещенную циклоалкильную группу или замещенную или незамещенную гетероциклоалкильную группу;
R2 обозначает атом водорода или замещенную или незамещенную С1-С3алкильную группу;
R3 обозначает атом водорода, замещенную или незамещенную С1-С3алкильную группу или атом галогена;
R4 обозначает замещенную или незамещенную арильную группу, замещенную или незамещенную гетероарильную группу или группу -СОNR5R6 или -СО2R7;
R5 и R6, одинаковые или разные, обозначают атом водорода; С1-С6алкильную группу, которая может быть замещена атомом галогена, замещенной или незамещенной арильной группой, замещенной или незамещенной гетероарильной группой, замещенной или незамещенной гетероциклоалкильной группой, замещенной или незамещенной циклоалкильной группой, группой -NR7COR8, -СОR8, -NR9R10; замещенную или незамещенную циклоалкильную группу; замещенную или незамещенную гетероциклоалкильную группу; замещенную или незамещенную арильную группу; замещенную или незамещенную гетероарильную группу; или замещенную или незамещенную гетероциклоалкильную группу, в которой кольцо образовано вместе с атомом азота, связывающим R5 и R6;
R7 обозначает атом водорода или замещенную или незамещенную С1-С3алкильную группу;
R8 обозначает замещенную или незамещенную гетероциклоалкильную группу или группу -ОН, -ОR7 или NR9R10;
R9 и R10, одинаковые или разные, обозначают атом водорода, замещенную или незамещенную С1-С3алкильную группу, замещенную или незамещенную гетероциклоалкильную группу; замещенную или незамещенную ацильную группу; группу -SO2R7 или замещенную или незамещенную гетероциклоалкильную группу, в которой кольцо образовано вместе с атомом азота, связывающим R5 и R6,
или их фармацевтически приемлемые соли или сольваты.
В другом аспекте данного изобретения обеспечена ингибирующая PDE 7 композиция, содержащая вышеупомянутые соединения тиенопиразола или их фармацевтически приемлемые соли или сольваты в качестве активного ингредиента.
Еще в одном аспекте данного изобретения обеспечен способ получения соединений тиенопиразола, представленных формулой (I).
В частности, этот способ предусматривает хлорирование производного пиразол-5-она, представленного формулой (VI):
Формула 2
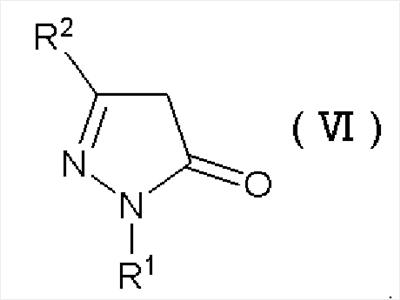
где R1 и R2 имеют определенные выше значения, и затем реакцию электрофильного замещения полученного соединения без отделения с получением производного пиразола формулы (IV):
Формула 3
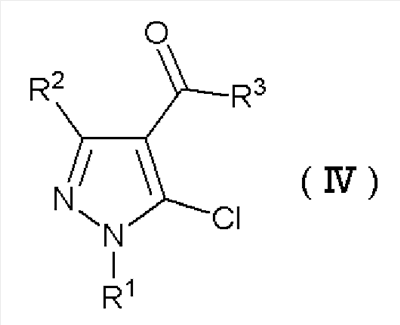
где R1, R2 и R3 имеют определенные выше значения, и затем реакцию полученного производного пиразола формулы (IV) с соединением формулы (III) в присутствии основания:
Формула 4
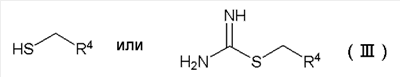
где R4 имеют определенные выше значения, с получением соединения формулы (II):
Формула 5
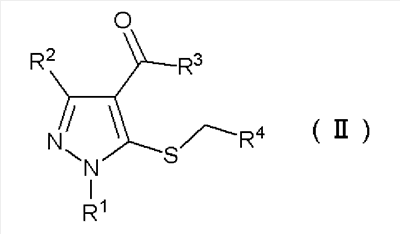
где R1, R2, R3 и R4 имеют определенные выше значения, и затем обработку полученного соединения формулы (II) основанием с получением соединения тиенопиразола формулы (I):
Формула 6
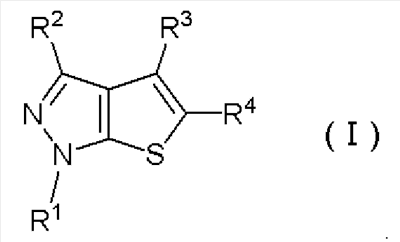
где R1, R2, R3 и R4 имеют определенные выше значения.
Кроме того, промежуточное соединение формулы (IV) может быть получено реакцией электрофильного замещения соединения хлорпиразола формулы (V):
Формула 7
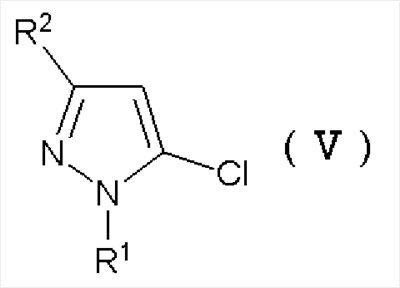
где R1 и R2 имеют определенные выше значения.
Кроме того, соединение формулы (I) может быть получено синтезом в одном реакторе из соединения формулы (IV) без выделения промежуточного соединения формулы (II). В частности, обеспечен способ получения соединения формулы (I), в котором R3 обозначает атом водорода.
Результаты изобретения
Соединения данного изобретения ингибируют селективно PDE 7 и, следовательно, соединения данного изобретения применимы для лечения или предупреждения таких заболеваний, как бронхиальная астма, хронический бронхит, хроническая обструктивная болезнь легких, аллергический ринит, псориаз, атопический дерматит, конъюнктивит, остеоартрит, ревматоидный артрит, рассеянный склероз, системная красная волчанка, воспалительное заболевание кишечника, гепатит, панкреатит, энцефаломиелит, сепсис, болезнь Крона, реакция отторжения в трансплантации, реакция трансплантат против хозяина (GVH-заболевание) и рестеноз после ангиоплаcтики.
Кроме того, соединения формулы (II) и формулы (IV) являются важными промежуточными соединениями для синтеза соединения формулы (I), и, следовательно, с использованием этих промежуточных соединений, соединения данного изобретения, представленные формулой (I), могут быть получены простым и легким способом.
Теперь данное изобретение будет объяснено конкретно следующим образом.
Термин  Сn-Сmалкильная группа Сn-Сmалкильная группа данного изобретения включает в себя алкильную группу с прямой или разветвленной цепью, имеющую n-m атомов углерода. Термин данного изобретения включает в себя алкильную группу с прямой или разветвленной цепью, имеющую n-m атомов углерода. Термин  циклоалкильная группа циклоалкильная группа обозначает циклоалкильную группу, имеющую 3-8 атомов углерода, такую как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п. Термин «гетероциклоалкильная группа» может быть 3-7-членной моноциклической или полициклической гетероциклической группой, содержащей 1-4 одинаковых или таких различных гетероатома, как атом (атомы) кислорода, азота или серы, и примеры могут включать в себя пиперидинил, пирролидинил, пиперазинил, тетрагидрофурил, тетрагидропиранил, морфолинил, азетидинил, имидазолидинил, оксазолидинил, гексагидропирролидинил, октагидроиндолидинил, октагидрохинолидинил, октагидроиндолил и их оксопроизводные. обозначает циклоалкильную группу, имеющую 3-8 атомов углерода, такую как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п. Термин «гетероциклоалкильная группа» может быть 3-7-членной моноциклической или полициклической гетероциклической группой, содержащей 1-4 одинаковых или таких различных гетероатома, как атом (атомы) кислорода, азота или серы, и примеры могут включать в себя пиперидинил, пирролидинил, пиперазинил, тетрагидрофурил, тетрагидропиранил, морфолинил, азетидинил, имидазолидинил, оксазолидинил, гексагидропирролидинил, октагидроиндолидинил, октагидрохинолидинил, октагидроиндолил и их оксопроизводные.
Термин «атом галогена» включает в себя хлор, фтор, бром и иод. Термин «арильная группа» может обозначать ароматическую углеводородную группу, которая состоит из монобензольного кольца или связанного или конденсированного бензольного кольца, такую как фенил, нафтил, бифенил и т.п.; и дициклическую или трициклическую группу, которая состоит из бензольного кольца, конденсированного с циклоалкильным или гетероциклическим кольцом, такую как 1,2,3,4-тетрагидронафталин, 2,3-дигидроинден, индолин, кумарон и т.п.
Термин «гетероарильная группа» может обозначать 5-7-членную моноциклическую гетероарильную группу или полициклическую гетероарильную группу, имеющую 2-8 атомов углерода с 1-4 гетероатомами, такими как атом (атомы) кислорода, азота, серы, где эта полициклическая гетероарильная группа имеет конденсированную кольцевую систему с одним и тем же или отличающимся моноциклическим гетероарильным или бензольным кольцом; или полициклическую группу, которая состоит из гетероарильной группы, конденсированной с циклоалкильным или гетероциклоалкильным кольцом.
Примеры включают в себя пиррол, фурил, тиенил, имидазолил, тиазолил, пиразинил, индолил, индолинил, хинолинил, изохинолинил, тетразолил, пиридинил, пиразолил, пиридазинил, пиримидинил, бензотиофенил, изоксазолил, индазолил, бензоимидазолил, фталазинил, триазолил, бензооксазолил, бензотиазолил, дигидроциклопентапиридинил, дигидропирропиридинил и т.п.
Примеры подходящего заместителя данного изобретения могут включать в себя имеющую прямую или разветвленную цепь или циклическую С1-С8алкильную группу, которая может быть замещена одним или такими несколькими группами, как метил, этил, пропил, изопропил, н-бутил, трет-бутил, циклогексил, циклогептил, метоксиметил, гидроксиметил, трифторметил, С1-С3алкоксигруппа, атом галогена и гидроксильная группа; цианогруппу; замещенную или незамещенную алкоксигруппу, такую как метоксигруппа, этоксигруппа; аминогруппу, которая может быть замещена С1-С6алкильной группой или ацильной группой, такую как амино, метиламино, этиламино, диметиламино, ациламино и т.п.; карбоксильную группу; замещенную или незамещенную сложноэфирную группу; фосфатную группу; сульфогруппу; замещенную или незамещенную арильную группу; замещенную или незамещенную гетероарильную группу; насыщенную или ненасыщенную гетероциклоалкильную группу, которая может быть замещенной; замещенную или незамещенную карбамоильную группу; замещенную или незамещенную амидную группу; замещенную или незамещенную тиоамидную группу; атом галогена; нитрогруппу; замещенную или незамещенную сульфоновую группу; замещенную или незамещенную сульфониламидную группу; оксогруппу; замещенную или незамещенную группу мочевины; имеющую прямую или разветвленную цепь или циклическую алкенильную группу, такую как этенил, пропенил, циклогексенил и т.п.
Примеры подходящего заместителя  С3-С8алкильной группы, которая может быть замещенной С3-С8алкильной группы, которая может быть замещенной , в группе R1 могут включать в себя гидроксильную группу, атом галогена, алкоксигруппу и т.п., а примеры подходящего заместителя «циклоалкильной группы, которая может быть замещенной», в группе R1 включают в себя гидроксильную группу, алкоксигруппу, оксогруппу, С1-С3алкильную группу, такую как метильная группа. Примеры подходящего заместителя «гетероциклоалкильной группы, которая может быть замещенной , в группе R1 могут включать в себя гидроксильную группу, атом галогена, алкоксигруппу и т.п., а примеры подходящего заместителя «циклоалкильной группы, которая может быть замещенной», в группе R1 включают в себя гидроксильную группу, алкоксигруппу, оксогруппу, С1-С3алкильную группу, такую как метильная группа. Примеры подходящего заместителя «гетероциклоалкильной группы, которая может быть замещенной , в группе R1 могут включать в себя С1-С3алкильную группу, такую как метильная группа. , в группе R1 могут включать в себя С1-С3алкильную группу, такую как метильная группа.
Примеры подходящего заместителя «С1-С3алкильной группы, которая может быть замещенной», в группе R2 могут включать в себя гидроксильную группу, алкоксигруппу, атом галогена, такой как атом фтора. Кроме того, примеры подходящего заместителя  С1-С3алкильной группы, которая может быть замещенной С1-С3алкильной группы, которая может быть замещенной , в группе R3 включают в себя гидроксильную группу, алкоксигруппу, атом галогена, такой как атом фтора. , в группе R3 включают в себя гидроксильную группу, алкоксигруппу, атом галогена, такой как атом фтора.
Примеры подходящего заместителя  арильной группы, которая может быть замещенной арильной группы, которая может быть замещенной и и  гетероарильной группы, которая может быть замещенной гетероарильной группы, которая может быть замещенной , в группе , в группе
R4 могут включать в себя гидроксильную группу, атом галогена, гетероциклоалкильную группу, которая может быть замещена С1-С6алкильной группой.
Примеры подходящего заместителя  циклоалкильной группы, которая может быть замещенной циклоалкильной группы, которая может быть замещенной , в группах R5 и R6 могут включать в себя гидроксильную группу; оксогруппу; карбоксильную группу; группу эфира карбоновой кислоты; цианогруппу; С1-С6алкильную группу {где указанная С1-С6алкильная группа может быть замещена С1-С3алкоксигруппой, гидроксильной группой, аминогруппой, которая может быть замещена С1-С6алкильной группой, арилсульфонилоксигруппой, гетероциклоалкильной группой (где указанная гетероциклоалкильная группа может быть замещена гидроксильной группой, С1-С6алкильной группой, оксогруппой или ацетильной группой)}; амидную группу (где указанная амидная группа может быть замещена циклоалкильной группой или С1-С6алкильной группой, которая может быть замещена гидроксильной группой); гетероциклоалкиламидную группу, которая может быть замещена С1-С6алкильной группой; гетероциклоалкиламидную группу, которая может быть замещена гидроксильной группой; аминогруппу (где указанная аминогруппа может быть замещена С1-С6алкильной группой, которая может быть замещена С1-С3алкоксигруппой и ацильной группой); гетероциклоалкильную группу {где указанная гетероциклоалкильная группа может быть замещена С1-С6алкильной группой (где указанная алкильная группа может быть замещена гидроксильной группой), оксогруппой, ацильной группой, гидроксильной группой, аминогруппой, которая может быть замещена С1-С6алкильной группой, аминогруппой, которая может быть замещена ацильной группой, С1-С3алкоксигруппой, алкоксикарбонильной группой, карбоксильной группой, аминокарбонильной группой, которая может быть замещена С1-С6алкильной группой, или сульфонильной группой, которая может быть замещена С1-С6алкильной группой}. , в группах R5 и R6 могут включать в себя гидроксильную группу; оксогруппу; карбоксильную группу; группу эфира карбоновой кислоты; цианогруппу; С1-С6алкильную группу {где указанная С1-С6алкильная группа может быть замещена С1-С3алкоксигруппой, гидроксильной группой, аминогруппой, которая может быть замещена С1-С6алкильной группой, арилсульфонилоксигруппой, гетероциклоалкильной группой (где указанная гетероциклоалкильная группа может быть замещена гидроксильной группой, С1-С6алкильной группой, оксогруппой или ацетильной группой)}; амидную группу (где указанная амидная группа может быть замещена циклоалкильной группой или С1-С6алкильной группой, которая может быть замещена гидроксильной группой); гетероциклоалкиламидную группу, которая может быть замещена С1-С6алкильной группой; гетероциклоалкиламидную группу, которая может быть замещена гидроксильной группой; аминогруппу (где указанная аминогруппа может быть замещена С1-С6алкильной группой, которая может быть замещена С1-С3алкоксигруппой и ацильной группой); гетероциклоалкильную группу {где указанная гетероциклоалкильная группа может быть замещена С1-С6алкильной группой (где указанная алкильная группа может быть замещена гидроксильной группой), оксогруппой, ацильной группой, гидроксильной группой, аминогруппой, которая может быть замещена С1-С6алкильной группой, аминогруппой, которая может быть замещена ацильной группой, С1-С3алкоксигруппой, алкоксикарбонильной группой, карбоксильной группой, аминокарбонильной группой, которая может быть замещена С1-С6алкильной группой, или сульфонильной группой, которая может быть замещена С1-С6алкильной группой}.
Примеры подходящего заместителя  гетероциклоалкильной группы, которая может быть замещенной гетероциклоалкильной группы, которая может быть замещенной , могут включать в себя бензильную группу; ацильную группу; оксогруппу; гетероциклоалкильную группу (где указанная гетероциклоалкильная группа может быть замещена С1-С6алкильной группой, ацильной группой, сульфогруппой, которая может быть замещена С1-С6алкильной группой или алкоксикарбонильной группой); С1-С6алкильную группу, которая может быть замещена карбоксильной группой или группой эфира карбоновой кислоты; амидогруппу, которая может быть замещена С1-С6алкильной группой; гетероциклоалкиламидную группу, которая может быть замещена С1-С6алкильной группой; сульфогруппу, которая может быть замещена С1-С6алкильной группой; сульфонамидную группу, которая может быть замещена С1-С6алкильной группой; циклоалкильную группу, которая может быть замещена оксогруппой или гидроксильной группой; алкоксикарбонильную группу и т.п. , могут включать в себя бензильную группу; ацильную группу; оксогруппу; гетероциклоалкильную группу (где указанная гетероциклоалкильная группа может быть замещена С1-С6алкильной группой, ацильной группой, сульфогруппой, которая может быть замещена С1-С6алкильной группой или алкоксикарбонильной группой); С1-С6алкильную группу, которая может быть замещена карбоксильной группой или группой эфира карбоновой кислоты; амидогруппу, которая может быть замещена С1-С6алкильной группой; гетероциклоалкиламидную группу, которая может быть замещена С1-С6алкильной группой; сульфогруппу, которая может быть замещена С1-С6алкильной группой; сульфонамидную группу, которая может быть замещена С1-С6алкильной группой; циклоалкильную группу, которая может быть замещена оксогруппой или гидроксильной группой; алкоксикарбонильную группу и т.п.
Кроме того, примеры подходящего заместителя  арильной группы, которая может быть замещенной арильной группы, которая может быть замещенной , в группе R5 и R6 могут включать в себя атом галогена; нитрогруппу; цианогруппу; ацильную группу; аминогруппу, которая может быть замещена ацильной группой; амидную группу (где указанная амидная группа может быть замещена С1-С6алкильной группой, которая может быть замещена С1-С3алкоксигруппой или С1-С6алкильной группой, которая может быть замещена гидроксильной группой); алкоксикарбониламиногруппу; алкоксикарбонильную группу; алкоксигруппу (где указанная алкоксигруппа может быть замещена карбоксильной группой, группой эфира карбоновой кислоты или амидной группой); карбонильную группу; карбоксильную группу; группу эфира карбоновой кислоты; карбамоильную группу; сульфогруппу; сульфонамидную группу; аминосульфонильную группу; С1-С6алкильную группу (где указанная алкильная группа может быть замещена С1-С3алкоксигруппой, гидроксильной группой или гетероциклоалкильной группой, которая может быть замещена С1-С6алкильной группой); гетероциклоалкиламидную группу, которая может быть замещена С1-С6алкильной группой; гетероциклоалкильную группу, которая может быть замещена гидроксильной группой; группу уксусной кислоты; группу амида уксусной кислоты; или гетероциклоалкильную группу (где указанная гетероциклоалкильная группа может быть замещена гидроксильной группой, оксогруппой, ацильной группой, С1-С6алкильной группой, аминогруппой, которая может быть замещена , в группе R5 и R6 могут включать в себя атом галогена; нитрогруппу; цианогруппу; ацильную группу; аминогруппу, которая может быть замещена ацильной группой; амидную группу (где указанная амидная группа может быть замещена С1-С6алкильной группой, которая может быть замещена С1-С3алкоксигруппой или С1-С6алкильной группой, которая может быть замещена гидроксильной группой); алкоксикарбониламиногруппу; алкоксикарбонильную группу; алкоксигруппу (где указанная алкоксигруппа может быть замещена карбоксильной группой, группой эфира карбоновой кислоты или амидной группой); карбонильную группу; карбоксильную группу; группу эфира карбоновой кислоты; карбамоильную группу; сульфогруппу; сульфонамидную группу; аминосульфонильную группу; С1-С6алкильную группу (где указанная алкильная группа может быть замещена С1-С3алкоксигруппой, гидроксильной группой или гетероциклоалкильной группой, которая может быть замещена С1-С6алкильной группой); гетероциклоалкиламидную группу, которая может быть замещена С1-С6алкильной группой; гетероциклоалкильную группу, которая может быть замещена гидроксильной группой; группу уксусной кислоты; группу амида уксусной кислоты; или гетероциклоалкильную группу (где указанная гетероциклоалкильная группа может быть замещена гидроксильной группой, оксогруппой, ацильной группой, С1-С6алкильной группой, аминогруппой, которая может быть замещена
С1-С6алкильной группой, аминогруппой, которая может быть замещена ацильной группой, С1-С3алкоксигруппой, алкоксикарбонильной группой и т.п.).
Примеры подходящего заместителя  гетероарильной группы, которая может быть замещенной гетероарильной группы, которая может быть замещенной , в группе R5 и R6 могут включать в себя атом галогена; ацильную группу; амидную группу {где указанная амидная группа может быть замещена С1-С6алкильной группой (где указанная алкильная группа может быть дополнительно замещена аминогруппой, которая может быть замещена С1-С6алкильной группой или гидроксильной группой)}; циклоалкильную группу, которая может быть замещена гидроксильной группой; циклогетероалкильную группу, которая может быть замещена С1-С6алкильной группой или ацильной группой; гетероциклоалкиламидную группу, которая может быть замещена С1-С6алкильной группой; гетероциклоалкиламидную группу, которая может быть замещена гидроксильной группой; оксогруппу; ациламиногруппу; С1-С6алкильную группу (где указанная алкильная группа может быть замещена циклогетероалкильной группой, которая может быть замещена гидроксильной группой, ацильной группой или циклогетероалкильной группой, которая может быть замещена гидроксильной группой); карбоксильную группу; группу эфира карбоновой кислоты; сульфонильную группу; гетероциклоалкильную группу (где указанная гетероциклоалкильная группа может быть замещена гидроксильной группой, оксогруппой, ацильной группой, С1-С6алкильной группой, аминогруппой, которая может быть замещена С1-С6алкильной группой, аминогруппой, которая может быть замещена ацильной группой, С1-С3алкоксигруппой, алкоксикарбонильной группой и т.п.). , в группе R5 и R6 могут включать в себя атом галогена; ацильную группу; амидную группу {где указанная амидная группа может быть замещена С1-С6алкильной группой (где указанная алкильная группа может быть дополнительно замещена аминогруппой, которая может быть замещена С1-С6алкильной группой или гидроксильной группой)}; циклоалкильную группу, которая может быть замещена гидроксильной группой; циклогетероалкильную группу, которая может быть замещена С1-С6алкильной группой или ацильной группой; гетероциклоалкиламидную группу, которая может быть замещена С1-С6алкильной группой; гетероциклоалкиламидную группу, которая может быть замещена гидроксильной группой; оксогруппу; ациламиногруппу; С1-С6алкильную группу (где указанная алкильная группа может быть замещена циклогетероалкильной группой, которая может быть замещена гидроксильной группой, ацильной группой или циклогетероалкильной группой, которая может быть замещена гидроксильной группой); карбоксильную группу; группу эфира карбоновой кислоты; сульфонильную группу; гетероциклоалкильную группу (где указанная гетероциклоалкильная группа может быть замещена гидроксильной группой, оксогруппой, ацильной группой, С1-С6алкильной группой, аминогруппой, которая может быть замещена С1-С6алкильной группой, аминогруппой, которая может быть замещена ацильной группой, С1-С3алкоксигруппой, алкоксикарбонильной группой и т.п.).
Примеры подходящего заместителя  замещенной или незамещенной гетероциклоалкильной группы, которая образована указанной кольцевой системой вместе с атомом азота, который участвует в связывании замещенной или незамещенной гетероциклоалкильной группы, которая образована указанной кольцевой системой вместе с атомом азота, который участвует в связывании , могут включать в себя ацильную группу; амидную группу; С1-С6алкильную группу или С1-С3алкоксигруппу; карбонильную группу; карбоксильную группу; группу эфира карбоновой кислоты; гидроксильную группу; карбамоильную группу; сульфонамидную группу; аминосульфогруппу; оксогруппу и т.п. , могут включать в себя ацильную группу; амидную группу; С1-С6алкильную группу или С1-С3алкоксигруппу; карбонильную группу; карбоксильную группу; группу эфира карбоновой кислоты; гидроксильную группу; карбамоильную группу; сульфонамидную группу; аминосульфогруппу; оксогруппу и т.п.
Примеры подходящего заместителя  С1-С3алкильной группы, которая может быть замещенной С1-С3алкильной группы, которая может быть замещенной , в группе R7 могут включать в себя гидроксильную группу, алкоксигруппу, атом галогена, такой как атом фтора, и т.п. , в группе R7 могут включать в себя гидроксильную группу, алкоксигруппу, атом галогена, такой как атом фтора, и т.п.
Примеры подходящего заместителя  гетероциклоалкильной группы, которая может быть замещенной гетероциклоалкильной группы, которая может быть замещенной , в группе R8 могут включать в себя гидроксильную группу, алкоксигруппу, оксогруппу, ацильную группу, С1-С6алкильную группу, С1-С3алкоксигруппу, карбоксильную группу, амидную группу и т.п. , в группе R8 могут включать в себя гидроксильную группу, алкоксигруппу, оксогруппу, ацильную группу, С1-С6алкильную группу, С1-С3алкоксигруппу, карбоксильную группу, амидную группу и т.п.
В группах R9 и R10 примеры подходящего заместителя  С1-С3алкильной группы, которая может быть замещенной С1-С3алкильной группы, которая может быть замещенной , могут включать в себя гидроксильную группу, алкоксигруппу и т.п. Кроме того, примеры подходящего заместителя , могут включать в себя гидроксильную группу, алкоксигруппу и т.п. Кроме того, примеры подходящего заместителя  гетероциклоалкильной группы, которая может быть замещенной гетероциклоалкильной группы, которая может быть замещенной , могут включать в себя С1-С6алкильную группу, гидроксильную группу, алкоксигруппу, оксогруппу, ацильную группу и т.п., а примеры подходящего заместителя , могут включать в себя С1-С6алкильную группу, гидроксильную группу, алкоксигруппу, оксогруппу, ацильную группу и т.п., а примеры подходящего заместителя  ацильной группы, которая может быть замещенной ацильной группы, которая может быть замещенной , могут включать в себя С1-С6алкильную группу, гидроксильную группу, алкоксигруппу и т.п. , могут включать в себя С1-С6алкильную группу, гидроксильную группу, алкоксигруппу и т.п.
Примеры подходящего заместителя  замещенной или незамещенной гетероциклоалкильной группы, которая образована указанной кольцевой системой вместе с атомом азота, который участвует в связывании замещенной или незамещенной гетероциклоалкильной группы, которая образована указанной кольцевой системой вместе с атомом азота, который участвует в связывании , могут включать в себя ацильную группу; амидную группу; С1-С6алкильную группу, С1-С3алкоксигруппу; карбонильную группу; карбоксильную группу; группу эфира карбоновой кислоты; гидроксильную группу; карбамоильную группу; сульфонамидную группу; аминосульфогруппу и т.п. , могут включать в себя ацильную группу; амидную группу; С1-С6алкильную группу, С1-С3алкоксигруппу; карбонильную группу; карбоксильную группу; группу эфира карбоновой кислоты; гидроксильную группу; карбамоильную группу; сульфонамидную группу; аминосульфогруппу и т.п.
Предпочтительные соединения формулы (I) данного изобретения могут включать в себя соединения, где R1 обозначает циклогексильную группу, циклогептильную группу или тетрагидропиранильную группу; R2 обозначает метильную группу; R3 обозначает атом водорода и R4 обозначает группу -NR5R6 (где один из этих R5 и R6 обозначает атом водорода).
Понятно, что когда соединения формулы (I) данного изобретения существуют в таутомерных смесях, каждый таутомерный изомер сам по себе, а также их смесь включены в объем соединений данного изобретения. Кроме того, радиоактивно меченое соединение формулы (I) будет включено в объем соединений данного изобретения.
Соединения данного изобретения могут содержать один или более асимметричных атомов углерода и могут находиться в виде оптического изомера (R)-формы или (S)-формы, рацемических форм, а также диастереомеров. Кроме того, соединения данного изобретения могут находиться в виде геометрического изомера, такого как (Z)-форма или (Е)-форма вследствие двойной связи в заместителе. Таким образом, соединения данного изобретения должны включать в себя эти соединения сами по себе, а также их смеси изомеров.
Соединения данного изобретения могут образовывать их кислотно-аддитивную соль с различными кислотами. Примеры кислотно-аддитивной соли включают в себя соли с неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; соли с органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, бензойная кислота, пикриновая кислота, метансульфоновая кислота, толуолсульфоновая кислота, бензолсульфоновая кислота, трихлоруксусная кислота, трофторуксусная кислота, аспарагиновая кислота, глутаминовая кислота и т.п.
Соединения данного изобретения могут образовывать фармацевтически приемлемые соли при обработке различными типами металла, в частности щелочным металлом или щелочно-земельным металлом. Эти соли могут включать в себя соль натрия, соль калия, соль кальция и т.п. Кроме того, соединения данного изобретения могут включать в себя их гидрат или сольват с этанолом или изопропанолом и их полиморфизмы.
Следующие соединения являются предпочтительными соединениями тиенопиразола формулы (I) данного изобретения:
этил-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксилат;
N-бензил-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-фенил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{4-[ацетил(метил)амино]фенил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[4-(ацетиламино)-3-метоксифенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(1-ацетил-2,3-дигидро-1Н-индол-5-ил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенилкарбамат;
трет-бутил-5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-индолинкарбоксилат;
1-циклогексил-N-(2,3-дигидро-1Н-индол-5-ил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(1Н-индол-5-ил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(4-морфолинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(3-нитрофенил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(3-аминофенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[3-(ацетиламино)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{4-[(метиламино)карбонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(1-пропионил-2,3-дигидро-1Н-индол-5-ил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-индолинкарбоксилат;
1-циклогексил-N-(1-изобутирил-2,3-дигидро-1Н-индол-5-ил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(1-бутирил-2,3-дигидро-1Н-индол-5-ил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[1-(2,2-диметилпропаноил)-2,3-дигидро-1Н-индол-5-ил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(2-оксо-2,3-дигидро-1Н-индол-5-ил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[4-(ацетиламино)-3-хлорфенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(этиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(метоксиметил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(гидроксиметил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(4-морфолинилкарбонил)фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{4-[(4-метил-1-пиперазинил)карбонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{4-[(метилсульфонил)амино]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{4-[(метиламино)сульфонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{1-[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-2,3-дигидро-1Н-индол-5-ил}ацетамид;
1-циклогексил-3-метил-N-{4-[(4-метил-1-пиперазинил)сульфонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(4-{[(2-метоксиэтил)амино]карбонил}фенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(4-ацетилфенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(диметиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бензоат;
4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бензойная кислота;
1-циклогексил-N-(2-метокси-4-нитрофенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(4-амино-2-метоксифенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[4-(ацетиламино)-2-метоксифенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(изопропиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(4-{[(2-гидроксиэтил)амино]карбонил}фенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[6-(ацетиламино)-3-пиридинил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(4-метоксифенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-циклопентил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N,1-дициклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{4-[(трет-бутиламино)карбонил]фенил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{5-[(изопропиламино)карбонил]-2-пиридинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(формиламино)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-4-[(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)сульфонил]-1-пиперазинкарбоксилат;
1-циклогексил-3-метил-N-[4-(1-пиперазинилсульфонил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(4-морфолинилсульфонил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(метилсульфонил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[1-(циклопропилкарбонил)-2,3-дигидро-1Н-индол-5-ил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[1-(метилсульфонил)-2,3-дигидро-1Н-индол-5-ил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(1-ацетил-1Н-индол-5-ил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-циклопропил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(1-бензил-4-пиперидинил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(4-пиперидинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(1-ацетил-4-пиперидинил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенокси)ацетат;
(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенокси)уксусная кислота;
1-циклогексил-3-метил-N-{4-[2-(метиламино)-2-оксоэтокси]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)ацетат;
(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)уксусная кислота;
1-циклогексил-3-метил-N-{4-[2-(метиламино)-2-оксоэтил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-4-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)-1-пиперазинкарбоксилат;
1-циклогексил-3-метил-N-[4-(1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[4-(4-ацетил-1-пиперазинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(транс-4-гидроксициклогексил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(4-оксоциклогексил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{4-[2-(4-метил-1-пиперазинил)-2-оксоэтокси]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[2-(диметиламино)-2-оксоэтокси]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
2-{4-[4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил]сульфонил}-1-пиперазинил}этилацетат;
1-циклогексил-(4-{[4-(2-гидроксиэтил)-1-пиперазинил]сульфонил}фенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[транс-4-(ацетиламино)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N,3-диметил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-1-циклопентил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксилат;
N-[4-(ацетиламино)фенил]-1-циклопентил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-1-циклогептил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксилат;
N-[4-(ацетиламино)фенил]-1-циклогептил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N,3-диметил-N-фенил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(4-пиридинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(3-пиридинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(4-нитрофенил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(4-аминофенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[4-(ацетиламино)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(метоксиацетил)амино]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-пиридинкарбоксилат;
5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-пиридинкарбоновая кислота;
1-циклогексил-3-метил-N-{6-[(метиламино)карбонил]-3-пиридинил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{6-[(диметиламино)карбонил]-3-пиридинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(4-метил-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метансульфонат 1-циклогексил-3-метил-N-[4-(4-метил-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида;
N-(4-цианофенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[6-(4-метил-1-пиперазинил)-3-пиридинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{3-[(4-метил-1-пиперазинил)сульфонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{3-[(метиламино)сульфонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогептил-3-метил-N-[4-(4-метил-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[3-(4-метил-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[4-(ацетиламино)-3-метоксифенил]-1-циклогептил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(3,5-дихлор-4-пиридинил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
5-(4-бромфенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол;
1-циклогексил-3-метил-5-[4-(4-метил-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол;
1-циклогексил-3-метил-5-[4-(4-метил-1,4-диазепам-1-ил)фенил]-1Н-тиено[2,3-c]пиразол;
1-циклогексил-N-{3-фтор-4-[(2-гидроксиэтил)(метил)амино]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
HCl-соль 1-циклогексил-N-{3-фтор-4-[(2-гидроксиэтил)(метил)амино]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида;
этил-цис-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоксилат;
цис-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоновая кислота;
1-циклогексил-N-{цис-4-(гидроксиметил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоксилат;
1-циклогексил-N-{[транс-4-(гидроксиметил)циклогексил]метил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексилкарбамат;
N-(транс-4-аминоциклогексил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[транс-4-(4-морфолинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(4-пиперидинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-(1-тетрагидро-2Н-пиран-4-ил-4-пиперидинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[1-(1,4-диазаспиро[4.5]декан-8-ил)-4-пиперидинил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[1-(4-оксоциклогексил)-4-пиперидинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[1-(транс-4-гидроксициклогексил)-4-пиперидинил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-4-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)-1-пиперидинкарбоксилат;
1-циклогексил-3-метил-N-[4-(4-пиперидинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(1-метил-4-пиперидинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(4-этил-1-пиперазинил)-3-фторфенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[3-фтор-4-(4-метил-1,4-диазепам-1-ил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-метоксибензоат;
4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-метоксибензойная кислота;
1-циклогексил-N-{3-метокси-4-[(4-метил-1-пиперазинил)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[3-метокси-4-(4-морфолинилкарбонил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(4-гидрокси-1-пиперидинил)карбонил]-3-метоксифенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(4-{[(2-гидроксиэтил)амино]карбонил}-3-метоксифенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(3-метокси-4-{[(2-метоксиэтил)амино]карбонил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{3-метокси-4-[(метиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(диметиламино)карбонил]-3-метоксифенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[3-фтор-4-(4-метил-1-пиперазинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[3-хлор-4-(4-метил-1-пиперазинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(1,4-диокса-8-азаспиро[4.5]дека-8-ил)-3-фторфенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[3-фтор-4-(4-оксо-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[3-фтор-4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[3-хлор-4-(1,4-диокса-8-азаспиро[4.5]дека-8-ил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[3-хлор-4-(4-оксо-1-пиперидинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[3-хлор-4-(4-гидрокси-1-пиперидинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{3-фтор-4-[4-(метиламино)-1-пиперидинил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-1-(2-хлор-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)-4-пиперидинил(метил)карбамат;
N-{3-хлор-4-[4-(метиламино)-1-пиперидинил]фенил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[транс-4-(4-метил-1-пиперазинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[транс-4-(4-метил-1,4-диазепам-1-ил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[транс-4-(4-метокси-1-пиперидинил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
бензил-4-(транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1,4-диазепам-1-карбоксилат;
1-циклогексил-N-[транс-4-(1,4-диазепам-1-ил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[транс-4-(4-ацетил-1,4-диазепам-1-ил)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{транс-4-[(2-метоксиэтил)(метил)амино]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{цис-4-[(2-метоксиэтил)(метил)амино]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[транс-4-(1,4-диокса-8-азаспиро[4.5]дека-8-ил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[транс-4-(4-оксо-1-пиперидинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[транс-4-(4-гидрокси-1-пиперидинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{транс-4-[(2R,6S)-2,6-диметилморфолинил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{цис-4-[(2R,6S)-2,6-диметилморфолинил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{транс-4-[4-(метиламино)-1-пиперидинил]циклогексил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(транс-4-{4-[ацетил(метил)амино]-1-пиперидинил}циклогексил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{транс-4-[4-(диметиламино)-1-пиперидинил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-1-(транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиперидинилкарбамат;
трет-бутил-1-(цис-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиперидинилкарбамат;
N-[транс-4-(4-амино-1-пиперидинил)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[цис-4-(4-амино-1-пиперидинил)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-4-(транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1-пиперазинкарбоксилат;
трет-бутил-4-(цис-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1-пиперазинкарбоксилат;
1-циклогексил-3-метил-N-[транс-4-(1-пиперазинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[цис-4-(1-пиперазинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[транс-4-(4-ацетил-1-пиперазинил)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[3-фтор-4-(4-метил-1,4-диазепам-1-ил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоновая кислота;
3-метил-N-[4-(4-метил-1-пиперазинил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[3-фтор-4-(4-метил-1-пиперазинил)фенил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(4-морфолинилметил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[2-(диметиламино)этил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{4-[2-(4-морфолинил)этил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{4-[(3-метил-2,5-диоксо-1-имидазолидинил)метил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(3-метил-2,5-диоксо-1-имидазолидинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоксилат;
4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоновая кислота;
1-циклогексил-N-[4-(гидроксиметил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{4-[(4-метил-1-пиперазинил)карбонил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(диметиламино)карбонил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(4-цианоциклогексил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этил(метил)карбамат;
1-циклогексил-3-метил-N-[2-(метиламино)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{2-[ацетил(метил)амино]этил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{2-[метил(метилсульфонил)амино]этил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинил)ацетат;
(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинил)уксусная кислота;
этил-2-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинил)-2-метилпропаноат;
2-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинил)-2-метилпропановая кислота;
1-циклогексил-N-[2-(5,5-диметил-2,4-диоксо-1,3-оксазолидин-3-ил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{2-[метил(4-морфолинилкарбонил)амино]этил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{2-[[(диметиламино)карбонил](метил)амино]этил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этил(метил)карбамат;
1-циклогексил-N-{2-[(метоксиацетил)(метил)амино]этил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{2-[(гликолоил)(метил)амино]этил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(4-{[(2-гидроксиэтил)(метил)амино]карбонил}циклогексил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-(1S,3S)-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклопентанкарбоксилат;
(1S,3S)-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклопентанкарбоновая кислота;
1-циклогексил-3-метил-N-[2-(4-метил-2,3-диоксо-1-пиперазинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{(1S,3S)-3-[(диметиламино)карбонил]циклопентил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-(1R,3R)-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклопентанкарбоксилат;
(1R,3R)-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклопентанкарбоновая кислота;
1-циклогексил-N-{(1R,3R)-3-[(диметиламино)карбонил]циклопентил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{1-[(диметиламино)карбонил]-4-пиперидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(4-морфолинилкарбонил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{4-[(метиламино)карбонил]циклогексил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(циклопропиламино)карбонил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(4-гидрокси-1-пиперидинил)карбонил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{1-[(диметиламино)сульфонил]-4-пиперидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинкарбоксилат;
1-циклогексил-3-метил-N-(4-пиперидинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[(3S)-1-бензилпирролидинил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[(3S)-пирролидинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{(3S)-1-[(диметиламино)карбонил]пирролидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(2,5-диоксо-1-имидазолидинил)метил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-1-[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-4-пиперидинкарбоксилат;
1-[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-4-пиперидинкарбоновая кислота;
1-[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-N-метил-4-пиперидинкарбоксамид;
этил-(3S)-[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-3-пиперидинкарбоксилат;
N-[(6S,7aS)-1,3-диоксогексагидро-1Н-пирроло[1,2-c]имидазол-6-ил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[(6S,7aS)-2-метил-1,3-диоксогексагидро-1Н-пирроло[1,2-c]имидазол-6-ил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
{1-[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-3-пиперидинил}метанол;
N-{4-[(диметиламино)карбонил]фенил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[6-(2-оксо-1-имидазолидинил)-3-пиридинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(1S,3S)-3-(гидроксиметил)циклопентил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{(1S,3S)-3-[(2,5-диоксо-1-имидазолидинил)метил]циклопентил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(2,5-диоксо-1-имидазолидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[4-(3-метил-2,5-диоксо-1-имидазолидинил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[6-(2-оксо-1-имидазолидинил)-3-пиридинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(3R)-3-гидроксипирролидинил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{3-фтор-4-[(3R)-3-гидроксипирролидинил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{3-[(4-гидрокси-1-пиперидинил)сульфонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{4-[4-{[трет-бутил(диметил)силил]окси}-1-пиперидинил]сульфонил}фенил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{4-[(4-гидрокси-1-пиперидинил)сульфонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(2-гидроксиэтил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[3-фтор-4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(4-метил-1-пиперазинил)-3-(трифторметил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(2-оксо-1,3-оксазолидин-3-ил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(2-оксо-1-имидазолидинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
4-[(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)амино]-4-оксобутановая кислота;
1-циклогексил-N-[4-(2,5-диоксо-1-пирролидинил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(1,1-диоксид-2-изотиазолидинил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
бензил-[{[(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)амино]карбонил}(метил)амино]ацетат;
1-циклогексил-3-метил-N-[4-(3-метил-2,5-диоксо-1-имидазолидинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(3-метил-2,5-диоксо-1-имидазолидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[3-(3-метил-2,5-диоксо-1-имидазолидинил)пропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-({[(2-гидроксиэтил)(метил)амино]карбонил}амино)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(3-метил-2-оксо-1-имидазолидинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}пропаноат;
N-[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]- -аланин; -аланин;
трет-бутил-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}ацетат;
{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}уксусная кислота;
1-циклогексил-3-метил-N-[3-(4-морфолинил)-3-оксопропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этилкарбамат;
N-(2-аминоэтил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[3-(диметиламино)-3-оксопропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{3-[метил(1-метил-4-пиперидинил)амино]-3-оксопропил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[3-(4-гидрокси-1-пиперидинил)-3-оксопропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(4-морфолинил)-2-оксоэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[2-(диметиламино)-2-оксоэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(4-метил-1-пиперазинил)-2-оксоэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[2-(4-гидрокси-1-пиперидинил)-2-оксоэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[3-(4-метил-1-пиперазинил)-3-оксопропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{2-[метил(1-метил)-4-пиперидинил)амино]-2-оксоэтил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(2-оксо-1,3-оксазолидинил-3-ил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[2-(1,1-диоксид-2-изотиазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[2-({[(2-гидроксиэтил)(метил)амино]карбонил}амино)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(3-метил-2-оксо-1-имидазолидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бутаноат;
4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бутановая кислота;
1-циклогексил-N-[2-(2,5-диоксо-1-имидазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(диметиламино)-4-оксобутил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(3,4,4-триметил-2,5-диоксо-1-имидазолидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[2-(2,4-диоксо-1,3-тиазолидин-3-ил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[1-(гидроксиметил)циклопропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{1-[(3-метил-2,5-диоксо-1-имидазолидинил)метил]циклопропил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил[(2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этил)амино]ацетат;
метил[(аминокарбонил)(2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этил)амино]ацетат;
1-циклогексил-N-[2-(2,4-диоксо-1-имидазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[2-(4,4-диметил-2,5-диоксо-1-имидазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(5-метил-1,1-диоксид-1,2,5-тиадиазолидин-2-ил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[2-(3-этил-2,4-диоксо-1-имидазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(3-метил-2,4-диоксо-1-имидазолидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(1S)-2-гидрокси-1-метилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(1S)-2-(2,5-диоксо-1-имидазолидинил)-1-метилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[(3R)-1-бензилпирролидинил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[(3R)-пирролидинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{(3R)-1-[(диметиламино)карбонил]пирролидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(1R)-2-гидрокси-1-метилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(1R)-2-(2,5-диоксо-1-имидазолидинил)-1-метилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(2S)-2-гидроксипропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(2R)-2-(2,5-диоксо-1-имидазолидинил)пропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(2R)-2-гидроксипропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(2S)-2-(2,5-диоксо-1-имидазолидинил)пропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(1R)-1-(гидроксиметил)пропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{(1R)-1-(2,5-диоксо-1-имидазолидинил)метил]пропил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[(1R)-1-(гидроксиметил)-2-метилпропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{(1R)-1-(2,5-диоксо-1-имидазолидинил)метил]-2-метилпропил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-метилпропилкарбамат;
N-(2-амино-1,1-диметилэтил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[2-(2,5-диоксо-1-имидазолидинил)-1,1-диметилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(3-амино-2,2-диметилпропил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[3-(2,5-диоксо-1-имидазолидинил)-2,2-диметилпропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
(±)-1-циклогексил-N-[транс-2-(гидроксиметил)циклопропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[4-(3-оксо-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[4-(3-оксо-1-пиперазинил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бензоат;
3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бензойная кислота;
1-циклогексил-N-{3-[(диметиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[3-(4-морфолинилкарбонил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-транс-4-{[(1-тетрагидро-2Н-пиран-4-ил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоксилат;
транс-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоновая кислота;
N-{транс-4-[(диметиламино)карбонил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[транс-4-(4-морфолинилкарбонил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{транс-4-[(4-гидрокси-1-пиперидинил)карбонил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-{транс-4-[(4-метил-1-пиперазинил)карбонил]циклогексил}-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[3-(4-морфолинил)пропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(4-морфолинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[2-(1-пиперидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[транс-4-(гидроксиметил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
(транс-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)метил-п-толуолсульфонат;
3-метил-N-[транс-4-(4-морфолинилметил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{транс-4-[(диметиламино)метил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{транс-4-[(4-ацетил-1-пиперазинил)метил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{3-[(диметиламино)сульфонил]фенил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[3-(метилсульфонил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{3-[(2-{[трет-бутил(диметил)силил]окси}этил)сульфонил]фенил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[3-[(2-гидроксиэтил)сульфонил]фенил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[транс-4-(4-морфолинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[6-(4-гидрокси-1-пиперидинил)-3-пиридинил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[2,3-дифтор-4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[4-(4-гидрокси-1-пиперидинил)-3-метилфенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[3-циано-4-(4-гидрокси-1-пиперидинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-(4-гидрокси-1-пиперидинил)бензоат;
5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-(4-гидрокси-1-пиперидинил)бензойная кислота;
N-[6-(4-гидрокси-1-пиперидинил)-3-пиридинил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-1-тетрагидро-2Н-пиран-4-ил-N-(1-тетрагидро-2Н-пиран-4-ил-4-пиперидинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[6-(4-гидрокси-1-пиперидинил)карбонил]-3-пиридинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(6-{[(2-гидроксиэтил)амино]карбонил}-3-пиридинил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{6-[(4-метил-1-пиперазинил)карбонил]-3-пиридинил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[6-({[2-(диметиламино)этил]амино}карбонил]-3-пиридинил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-(6-{[(транс-4-гидроксициклогексил)амино]карбонил}-3-пиридинил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-{6-[(4-метил-1,4-диазепам-1-ил)карбонил]-3-пиридинил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинкарбоксилат;
3-метил-N-(4-пиперидинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{1-[(диметиламино)карбонил]-4-пиперидинил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-4-{4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}пиперидин-1-ил}-1-пиперидинкарбоксилат;
3-метил-N-(пиперидин-4-ил-4-пиперидинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-(1-ацетилпиперидин-4-ил-4-пиперидинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-(1-метансульфонилпиперидин-4-ил-4-пиперидинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
трет-бутил-4-(транс-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1-пиперазинкарбоксилат;
трет-бутил-4-(цис-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1-пиперазинкарбоксилат;
3-метил-N-[транс-4-(1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[цис-4-(1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[транс-4-(4-ацетил-1-пиперазинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-{транс-4-[4-(метилсульфонил)-1-пиперазинил]циклогексил}-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[цис-4-(4-ацетил-1-пиперазинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[1-(4-морфолинилкарбонил)-4-пиперидинил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-{1-[(4-метил-1-пиперазинил)карбонил]-4-пиперидинил}-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(транс-4-гидроксициклогексил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-(4-оксоциклогексил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[транс-4-(цис-2,6-диметилморфолинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[цис-4-(цис-2,6-диметилморфолинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-[6-(гидроксиметил)-3-пиридинил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
метил-5-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-пиридинкарбоксилат;
5-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-пиридинкарбоновая кислота;
N-(6-{[(транс-4-гидроксициклогексил)амино]карбонил}-3-пиридинил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[6-({[2-(диметиламино)этил]амино}карбонил)-3-пиридинил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-(6-{[(1-метил-4-пиперидинил)амино]карбонил}-3-пиридинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(6-{[(1-ацетил-4-пиперидинил)амино]карбонил}-3-пиридинил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[6-(4-морфолинилметил)-3-пиридинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-N-{6-[(4-гидрокси-1-пиперидинил)метил]-3-пиридинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{6-[(4-ацетил-1-пиперазинил)метил]-3-пиридинил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[транс-4-(4-метил-2-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-циклогексил-3-метил-N-[транс-4-(4-метил-2-оксо-1-пиперазинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[транс-4-(3-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[цис-4-(3-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[транс-4-(4-метил-3-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[цис-4-(4-метил-3-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-1-(транс-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиперидинкарбоксилат;
этил-1-(цис-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиперидинкарбоксилат;
N-{транс-4-[4-(гидроксиметил)-1-пиперидинил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{цис-4-[4-(гидроксиметил)-1-пиперидинил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[транс-4-(4-гидрокси-1-пиперидинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-(цис-4-{4-[(диметиламино)карбонил]-1-пиперидинил}циклогексил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
1-(транс-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиперидинкарбоновая кислота;
N-(транс-4-{4-[(диметиламино)карбонил]-1-пиперидинил}циклогексил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
этил-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксилат;
3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоновая кислота;
3-метил-N-[транс-4-(4-морфолинил)циклогексил]-1-тетрагидро-2Н-пиран-3-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[транс-4-(4-этил-3-оксо-1-пиперазинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-[цис-4-(4-этил-3-оксо-1-пиперазинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
N-{транс-4-[(4-этил-3-оксо-1-пиперазинил)метил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-{транс-4-[(4-метил-3-оксо-1-пиперазинил)метил]циклогексил}-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
3-метил-N-[4-(4-метил-2-оксо-1-пиперазинил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид.
Соединения, представленные формулой (I) данного изобретения, могут быть получены следующими способами.
Формула 8
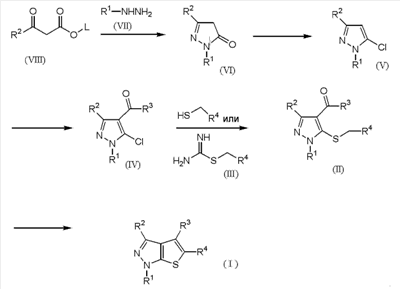
где R1, R2, R3 и R4 имеют определенные выше значения; L обозначает низшую
С1-С3алкильную группу.
Сначала соединение (VI) получали из соединения (VIII) реакцией с R1NHNH2 (VII) в соответствии с известным способом (например, см. Международную публикацию патента WO 03/053975). Конкретно, соединение (VIII) взаимодействует с 1-2-эквивалентами, предпочтительно приблизительно 1 эквивалентом, соединения (VII) в растворителе или без него при температуре от комнатной температуры до 120ºС. Растворителем, который может быть использован в этой реакции, является водный раствор неорганической кислоты, такой как соляная кислота или серная кислота; такой ароматический углеводород, как бензол или толуол; такая органическая кислота, как уксусная кислота; такие простые эфиры, как 1,4-диоксан или тетрагидрофуран; такие галогенированные углеводороды, как дихлорметан; такие спирты, как метанол или этанол, или смешанный растворитель из этих растворителей.
После завершения реакции реакционную смесь нейтрализуют и эту смесь экстрагируют органическим растворителем, который является не смешивающимся с водой растворителем, и органический слой промывают последовательно водой и насыщенным солевым раствором. Затем соединение (VI) может быть получено удалением растворителя. Это соединение (VI) может быть очищено перекристаллизацией, если это необходимо.
Исходные соединения (VII) и (VIII), используемые в этой реакции, могут быть коммерчески доступными или могут быть известными соединениями (например, J. Org. Chem., 1981, 46, 5414-5415). Кроме того, соединения (VII) могут быть использованы в виде соли с кислотными соединениями, такой как соль соляной кислоты или соль уксусной кислоты.
Затем полученное соединение (VI) превращают в соединение (V) в соответствии с общепринятым способом. А именно, эту реакцию можно проводить взаимодействием соединения (VI) с 1-6 эквивалентами галогенирующего реагента, такого как оксихлорид фосфора или тионилхлорид, в таком ароматическом углеводородном растворителе, как бензол или толуол, или в отсутствие растворителя, при температуре от комнатной температуры до температуры кипения растворителя в течение 1-12 часов. После завершения реакции соединение (V) может быть получено удалением растворителя.
Полученное соединение (V) превращают без дополнительной очистки в соединение (IV) реакцией электрофильного замещения. Например, соединение (V), в котором R3 обозначает атом водорода, может быть получено реакцией Вильсмайера с реагентом реакции, приготовленным из 1-5 эквивалентов оксихлорида фосфора, в амидном растворителе, таком как N,N-диметилформамид. Реакцию проводят при температуре от комнатной температуры до 120ºС в течение 1-12 часов.
После завершения реакции к реакционной смеси добавляют водный раствор неорганического основания, такой как водный раствор гидроксида натрия, и эту смесь экстрагируют органическим растворителем, который является не смешивающимся с водой растворителем, и органический слой промывают последовательно водой и насыщенным солевым раствором. Затем соединение (IV) может быть получено удалением растворителя. Это соединение (IV) может быть очищено колоночной хроматографией или перекристаллизацией, если это необходимо.
Далее, соединение (IV) может быть превращено непосредственно из соединения (IV) реакцией Вильсмайера в едином процессе или в реакции синтеза в одном реакторе без выделения промежуточного соединения (V). Конкретно, соединение (VI) обрабатывают 2-5 эквивалентами оксихлорида фосфора без использования растворителя реакции при температуре от комнатной температуры до 120ºС с получением соединения (V) в реакционной смеси. Затем к этой реакционной смеси, содержащей полученное соединение (V), добавляют формамидные растворители, такие как N,N-диметилформамид, при 0ºС-120ºС, и реакцию Вильсмайера проводят при температуре от комнатной температуры до 120ºС в течение 1-24 часов.
После завершения реакции к реакционной смеси добавляют водный раствор неорганического основания, такой как водный раствор гидроксида натрия, и эту смесь экстрагируют органическим растворителем, который является растворителем не смешивающимся с водой, и органический слой промывают последовательно водой и насыщенным солевым раствором. Затем соединение (IV) может быть получено удалением растворителя. Это соединение (IV) может быть очищено колоночной хроматографией или перекристаллизацией, если это необходимо.
Затем полученное соединение (IV) превращают в соединение (II). Реакцию проводят обработкой соединения (IV) 1-1,5 эквивалентами соединения (III), в растворителе при температуре от комнатной температуры до 80ºС в течение 0,5-8 часов. Растворитель, используемый в этой реакции, является таким полярным растворителем, как ацетонитрил или N,N-диметилформамид; такими простыми эфирами, как 1,4-диоксан или тетрагидрофуран; такими галогенированными углеводородами, как дихлорметан, такими спиртами, как метанол или этанол, или смесью этих растворителей. В этой реакции, соединение (III) предварительно обрабатывают основанием, таким как карбонат калия, гидрид натрия, трет-бутоксид калия, метилат натрия или гидроксид натрия.
После завершения этой реакции к реакционной смеси добавляют воду и эту смесь экстрагируют органическим растворителем, который является не смешивающимся с водой растворителем, и органический слой промывают последовательно водой и насыщенным солевым раствором. Затем соединение (II) может быть получено удалением растворителя. Это соединение (II) может быть очищено колоночной хроматографией или перекристаллизацией, если это необходимо.
Затем полученное соединение (II) превращают в соединение (I) данного изобретения реакцией циклизации (замыкания цикла).
Условия реакции циклизации могут варьироваться в зависимости от разновидности группы R4. Когда группа R4 является группой -СО2R7, соединение (I) может быть получено из соединения (II) обработкой 1-1,5 эквивалентами такого основания, как карбонат калия, гидрид натрия, метилат натрия или гидроксид натрия, в растворителе при 0ºС-80ºС в течение 0,5-24 часов. Растворитель, который должен быть использован в этой реакции, является таким полярным растворителем, как ацетонитрил или N,N-диметилформамид; такими простыми эфирами, как 1,4-диоксан или тетрагидрофуран; такими галогенированными углеводородами, как дихлорметан, такими спиртами, как метанол или этанол, или смесью этих растворителей.
После завершения этой реакции к реакционной смеси добавляют воду и эту смесь экстрагируют органическим растворителем, который является не смешивающимся с водой растворителем, и органический слой промывают последовательно водой и насыщенным солевым раствором. Затем соединение (I) может быть получено удалением растворителя. Это соединение (I) может быть очищено колоночной хроматографией или перекристаллизацией, если это необходимо.
Далее, когда группа R4 является группой -СО2R7, соединение (I) может быть получено из соединения (IV) без отделения соединения (II) в соответствующей ступенчатой реакции.
Когда группа R4 является арильной группой, которая может быть замещенной, или гетероарильной группой, которая может быть замещенной, соединение (I) может быть получено из соединения (II) обработкой 1-3 эквивалентами такого сильного основания, как диизопропиламид лития или бис(триметилсилил)амид лития, в простых эфирах, таких как диэтиловый эфир или тетрагидрофуран.
После завершения этой реакции к реакционной смеси добавляют воду и эту смесь экстрагируют органическим растворителем, который является не смешивающимся с водой растворителем, и органический слой промывают последовательно водой и насыщенным солевым раствором, затем органический растворитель удаляют. Полученный остаток растворяют в таких спиртах, как метанол или этанол, и к этой смеси добавляют кислоту, такую как соляная кислота, и затем эту смесь перемешивают при температуре от комнатной температуры до 60ºС с получением соединения (I).
После завершения этой реакции к реакционной смеси добавляют воду и эту смесь экстрагируют органическим растворителем, который является не смешивающимся с водой растворителем, и органический слой промывают последовательно водой и насыщенным солевым раствором. Затем соединение (I) может быть получено удалением растворителя. Это соединение (I) может быть очищено колоночной хроматографией или перекристаллизацией, если это необходимо.
В случае, когда группа R4 является группой -CONR5R6, сначала соединение (I), в котором группа R4 является группой -СО2R7, полученное описанным выше способом, превращают в соединение (I), в котором группа R4 является -СО2Н. Этой реакцией превращения является реакция гидролиза соединения сложного эфира, и она может проводиться различными способами. Например, реакцию гидролиза можно проводить в присутствии такого основания, как гидроксид натрия, в растворителе при температуре от комнатной температуры до температуры кипения растворителя. Растворителем, который должен использоваться в этой реакции, могут быть такие спирты, как метанол или этанол, вода или смесь этих растворителей. После завершения реакции реакционную смесь концентрируют и эту смесь нейтрализуют добавлением соляной кислоты с получением соединения (I), в котором группа R4 является -СО2Н.
Затем, полученное соединение (I), в котором группа R4 является -СО2Н, превращают в соединение, в котором группа R4 является -CONR5R6, реакцией амидирования в соответствии с несколькими известными способами. Например, соединение (I), в котором группа R4 является -СО2Н, превращают в соответствующий хлорангидрид кислоты обработкой таким галогенирующим реагентом, как оксихлорид фосфора или тионилхлорид. Затем полученный хлорангидрид кислоты обрабатывают аминным соединением HNR5R6 в присутствии такого основного катализатора, как триэтиламин, в растворителе при температуре от 0ºС до комнатной температуры. Растворителем, который должен использоваться в этой реакции, могут быть такие галогенированные углеводороды, как дихлорметан; такие ароматические углеводороды, как толуол или бензол; простые такие эфиры, как диэтиловый эфир или тетрагидрофуран, или смесь этих растворителей.
После завершения этой реакции реакционную смесь разбавляют органическим растворителем, который является не смешивающимся с водой растворителем, и органический слой промывают последовательно водой и насыщенным солевым раствором. Затем соединение (I), в котором группа R4 является -CONR5R6, может быть получено удалением растворителя. Это соединение может быть очищено колоночной хроматографией или перекристаллизацией, если это необходимо.
Все вышеупомянутые реакции хорошо известны, и реагенты, которые должны использоваться, или условия реакций, которые должны использоваться, могут быть легко установлены в соответствии со стандартными руководствами и описанными ниже примерами. Кроме того, специалистом в данной области могут быть легко выбраны другие способы или модифицированные способы для получения соединения (I) данного изобретения.
Примеры
Данное изобретение иллюстрируется более подробно биологическими тестами, примерами и примерами получения.
Синтез соединений данного изобретения и промежуточные соединения, которые должны использоваться в этом синтезе, иллюстрированы в примерах и примерах получения, описанных позднее. Кроме того, физико-химические данные и химическая структура этих соединений и промежуточных соединений суммированы в представленных таблицах.
Номера соединений в примерах являются идентичными номерам в таблицах.
Следует отметить, что данное изобретение никоим образом не ограничивается этими примерами.
Биологический тест 1
Способы оценки ингибирующего PDE 7 действия
Ингибирующее PDE 7 (фосфодиэстеразу VII) действие соединений данного изобретения получали с использованием следующего способа, который был модифицированным способом анализа, описанного в Biochemical. Pharmacol. 48(6), 1219-1223 (1994).
(1) Получали активную фракцию PDE 7 (фосфодиэстеразы VII). То есть клетки MOLT-4 (получаемые из АТСС в виде АТСС No. CRL-1582), которые были клеточной линией Т-клеток острой лимфобластной лимфомы человека, инкубировали в культуральной среде RPMI 1640, содержащей 10% фетальную телячью сыворотку, для получения 5×108 клеток MOLT-4. Эти клетки собирали центрифугированием и суспендировали с 10 мл буферного раствора А [25 мМ Трис-HCl, 5 мМ 2-меркаптоэтанол, 2 мМ бензамидин, 2 мМ ЭДТА, 0,1 мМ 4-(2-аминоэтил)бензолсульфонилгидрохлорид; рН 7,5], затем гомогенизировали с помощью Polytron®. Гомогенизат центрифугировали при 25000×g в течение 10 минут при 4ºС. Супернатант отделяли и полученный таким образом супернатант дополнительно центрифугировали при 100000×g в течение 60 минут при 4ºС и затем фильтровали с использованием фильтра 0,2 мкм с получением растворимой фракции.
(2) Полученную растворимую фракцию наносили в уравновешенную колонку HiTrap Q (5 мл×2) с буферным раствором А и фракции фосфодиэстеразы элюировали 300 мл буфера А с линейным градиентом концентраций 0-0,8М NaCl. 5 мл каждого из 60 элюентов собирали и каждый из элюентов испытывали на метаболические активности фосфодиэстеразы в отношении циклического АМФ. Фракции, элюирующиеся концентрацией 350 мМ NaCl, где метаболические активности не инактивировались 10 мкМ ролипрамом (селективным ингибитором фосфодиэстеразы IV) и 10 мкМ милриноном (селективным ингибитором фосфодиэстеразы III), собирали в виде раствора для хранения для использования в тестировании ингибирующего PDE 7 действия.
(3) Тестируемое соединение, имеющее требуемую концентрацию, взаимодействовало в растворе 20 мМ Трис-HCl (рН 7,5), 1 мМ MgCl2, 100 мкМ ЭДТА, 330 мкг/мл бычьего сывороточного альбумина, 4 мкг/мл 5′-нуклеотидазы, 0,1 мкКи 3Н-цАМФ (0,064 мкМ цАМФ), 10 мкМ ролипрама в растворе для хранения PDE 7 в течение 2 часов при 25ºС. После этой реакции к реакционной смеси добавляли суспензию Sephadex®-QAE в 10 мМ HEPES-Na (рН 7,0) и этой смеси давали стоять в течение 5 минут. Затем Sephadex®-QAE добавляли к полученному супернатанту, эту смесь оставляли стоять на 5 минут и затем измеряли радиоактивность раствора.
(4) IC50 рассчитывали как 50% ингибирующую концентрацию метаболических активностей фосфодиэстеразы VII тестируемого соединения.
Соединения данного изобретения селективно ингибируют PDE 7, и их селективности более чем в 10 раз превышают селективности другой фосфодиэстеразы. Таким образом, ожидается, что побочное действие соединений данного изобретения, вызываемое другим изозимом, является более низким.
Например, селективность против PDE 4 (фосфодиэстеразы IV) соединений данного изобретения была подтверждена с использованием следующего биологического теста.
Биологический тест 2
Способы оценки ингибирующего PDE 4 действия
Ингибирующее PDE 4 (фосфодиэстеразу IV) действие соединений данного изобретения определяли следующим способом, который был модифицированным способом анализа, описанного в Biochemical. Pharmacol. 48(6), 1219-1223 (1994).
(1) Получали активную фракцию PDE 4 (фосфодиэстеразы IV). То есть печени, полученные из трех мышей Balb/c (самцов, 12 недель, получаемых из CLEA Japan, Inc.), суспендировали с 30 мл буферного раствора В [20 мМ бис-трис, 5 мМ 2-меркаптоэтанол, 2 мМ бензамидин, 2 мМ ЭДТА, 0,1 мМ 4-(2-аминоэтил)бензолсульфонилгидрохлорид, 50 мМ ацетат натрия; рН 6,5], затем гомогенизировали гомогенизатором Polytron®. Гомогенизат центрифугировали при 25000×g в течение 10 минут при 4ºС. Супернатант отделяли и полученный таким образом супернатант дополнительно центрифугировали при 100000 х g в течение 60 минут при 4ºС и затем фильтровали с использованием фильтра 0,2 мкм с получением растворимой фракции.
(2) Полученную растворимую фракцию наносили в уравновешенную колонку ДЭАЭ-сефарозы (1×10 см) с буферным раствором В и фракции фосфодиэстеразы элюировали 120 мл буфера В с линейным градиентом концентраций 0,05-1 М ацетата натрия. 5 мл каждого из 24 элюентов собирали и каждый из элюентов испытывали на метаболические активности фосфодиэстеразы в отношении циклического АМФ. Фракции, элюирующиеся концентрацией 650 мМ ацетата натрия, где метаболические активности инактивировались 30 мкМ ролипрамом (селективным ингибитором фосфодиэстеразы IV), собирали в виде раствора для хранения для тестирования ингибирующего PDE 4 действия.
(3) Тестируемое соединение, имеющее требуемую концентрацию, взаимодействовало в растворе 20 мМ Трис-HCl (рН 7,5), 1 мМ MgCl2, 100 мкМ ЭДТА, 330 мкг/мл бычьего сывороточного альбумина, 4 мкг/мл 5′-нуклеотидазы, 0,1 мкКи 3Н-цАМФ (0,064 мкМ цАМФ) и растворе для хранения PDE 4 в течение 2 часов при 25ºС. После этой реакции к реакционной смеси добавляли суспензию Sephadex®-QAE в 10 мМ HEPES-Na (рН 7,0) и этой смеси давали стоять в течение 5 минут. Затем к полученному супернатанту добавляли Sephadex®-QAE, эту смесь оставляли стоять на 5 минут и затем измеряли радиоактивность раствора.
(4) IC50 рассчитывали как 50% ингибирующую концентрацию метаболических активностей фосфодиэстеразы IV тестируемого соединения.
В качестве результата вышеописанного биологического теста 2 IC50 ингибирующего PDE 4 действия соединений данного изобретения была более чем в 10 раз, более низкой, чем IC50 ингибирующего PDE 7 действия.
В следующих таблицах 1-4 суммированы величины IC50 ингибирующих PDE 7 активностей и ингибирующих PDE 4 активностей.
| Таблица 1 |
| Номер соединения |
IC50/мкМ PDE7 |
IC50/мкМ PDE4 |
Номер соединения |
IC50/мкМ PDE7 |
IC50/мкМ PDE4 |
| 10 |
0,027 |
1,8 |
46 |
0,03 |
2 |
| 11 |
0,019 |
2 |
47 |
0,032 |
3,5 |
| 12 |
0,053 |
5 |
51 |
0,075 |
9,5 |
| 14 |
0,088 |
3,7 |
53 |
0,055 |
3,5 |
| 16 |
0,034 |
2,2 |
58 |
0,036 |
3,6 |
| 20 |
0,033 |
>30 |
59 |
0,08 |
7 |
| 21 |
0,084 |
2,5 |
60 |
0,065 |
6,5 |
| 23 |
0,083 |
4,8 |
67 |
0,023 |
3,5 |
| 25 |
0,098 |
6,5 |
70 |
0,025 |
4,7 |
| 26 |
0,044 |
3 |
72 |
0,01 |
1,2 |
| 28 |
0,05 |
30 |
73 |
0,012 |
1 |
| 32 |
0,095 |
2,5 |
74 |
0,05 |
7 |
| 36 |
0,04 |
25 |
76 |
0,02 |
2 |
| 37 |
0,028 |
2 |
77 |
0,02 |
2 |
| 38 |
0,033 |
5 |
79 |
0,06 |
– |
| 39 |
0,014 |
3,5 |
80 |
0,06 |
2,5 |
| 40 |
0,075 |
15 |
94 |
0,058 |
>30 |
| 41 |
0,05 |
12 |
99 |
0,099 |
5 |
| 45 |
0,05 |
12 |
100 |
0,037 |
>30 |
| Таблица 2 |
| Номер соединения |
IC50/мкМ PDE7 |
IC50/мкМ PDE4 |
Номер соединения |
IC50/мкМ PDE7 |
IC50/мкМ PDE4 |
| 101 |
0,03 |
1,3 |
156 |
0,055 |
2 |
| 102 |
0,085 |
5,5 |
159 |
0,035 |
1,6 |
| 104 |
0,058 |
1,5 |
162 |
0,07 |
2 |
| 106 |
0,009 |
1,2 |
163 |
0,014 |
0,9 |
| 107 |
0,017 |
2 |
165 |
0,02 |
0,65 |
| 109 |
0,015 |
1 |
166 |
0,016 |
1,5 |
| 110 |
0,075 |
5,5 |
167 |
0,015 |
1 |
| 111 |
0,01 |
>30 |
168 |
0,022 |
1,5 |
| 112 |
0,008 |
1,2 |
170 |
0,022 |
1,3 |
| 114 |
0,021 |
1,5 |
171 |
0,037 |
1,7 |
| 115 |
0,04 |
1,5 |
172 |
0,048 |
9,4 |
| 125 |
0,075 |
4 |
176 |
0,02 |
1,7 |
| 132 |
0,088 |
10 |
177 |
0,013 |
1,6 |
| 133 |
0,009 |
1,8 |
179 |
0,0031 |
0,75 |
| 135 |
0,053 |
7,4 |
180 |
0,01 |
1,4 |
| 141 |
0,022 |
1,6 |
181 |
0,0086 |
0,86 |
| 142 |
0,014 |
2 |
184 |
0,0068 |
1,1 |
| 147 |
0,085 |
3 |
188 |
0,0065 |
0,7 |
| 149 |
0,065 |
2 |
190 |
0,0035 |
1,7 |
| 150 |
0,045 |
0,7 |
191 |
0,0089 |
0,98 |
| 152 |
0,085 |
3 |
196 |
0,09 |
7,5 |
| 155 |
0,01 |
1,5 |
197 |
0,079 |
4,4 |
| Таблица 3 |
| Номер соединения |
IC50/мкМ PDE7 |
IC50/мкМ PDE4 |
Номер соединения |
IC50/мкМ PDE7 |
IC50/мкМ PDE4 |
| 199 |
0,056 |
5,8 |
255 |
0,089 |
12 |
| 200 |
0,016 |
1,9 |
256 |
0,002 |
0,81 |
| 201 |
0,018 |
2,2 |
257 |
0,068 |
8,3 |
| 202 |
0,033 |
2,4 |
258 |
0,015 |
4,7 |
| 203 |
0,0061 |
1,4 |
260 |
0,037 |
4,5 |
| 205 |
0,091 |
14 |
261 |
0,028 |
1,9 |
| 206 |
0,05 |
3,8 |
262 |
0,028 |
3,8 |
| 207 |
0,024 |
2,4 |
263 |
0,054 |
3,5 |
| 208 |
0,025 |
3,8 |
264 |
0,081 |
6,3 |
| 209 |
0,077 |
7,4 |
266 |
0,07 |
11 |
| 225 |
0,018 |
2 |
268 |
0,088 |
4,8 |
| 227 |
0,056 |
10 |
270 |
0,015 |
1,8 |
| 228 |
0,051 |
5,8 |
271 |
0,0089 |
2,1 |
| 230 |
0,023 |
7 |
273 |
0,014 |
1,6 |
| 234 |
0,013 |
2,1 |
274 |
0,0099 |
1,7 |
| 235 |
0,017 |
2,8 |
276 |
0,004 |
1,2 |
| 236 |
0,02 |
2,7 |
277 |
0,032 |
7,8 |
| 237 |
0,0078 |
– |
280 |
0,017 |
1,9 |
| 238 |
0,0078 |
2,7 |
302 |
0,06 |
6,1 |
| 239 |
0,015 |
2,6 |
305 |
0,066 |
6,8 |
| 240 |
0,041 |
– |
313 |
0,09 |
12 |
| 246 |
0,051 |
6,6 |
316 |
0,097 |
15 |
| 247 |
0,0065 |
1,4 |
317 |
0,067 |
12 |
| Таблица 4 |
| Номер соединения |
IC50/мкМ PDE7 |
IC50/мкМ PDE4 |
Номер соединения |
IC50/мкМ PDE7 |
IC50/мкМ PDE4 |
| 323 |
0,071 |
6,3 |
379 |
0,013 |
1,2 |
| 325 |
0,034 |
4 |
380 |
0,056 |
1,5 |
| 331 |
0,029 |
4,9 |
381 |
0,022 |
0,67 |
| 339 |
0,02 |
5,1 |
382 |
0,025 |
0,62 |
| 340 |
0,054 |
28 |
383 |
0,074 |
2,4 |
| 341 |
0,005 |
1,8 |
395 |
0,019 |
1,4 |
| 342 |
0,028 |
4,6 |
396 |
0,022 |
0,9 |
| 349 |
0,078 |
2,8 |
402 |
0,019 |
7,3 |
| 358 |
0,071 |
11 |
404 |
0,032 |
3,5 |
| 360 |
0,057 |
7,9 |
412 |
0,043 |
4,9 |
| 365 |
0,041 |
3,9 |
413 |
0,05 |
2,5 |
| 366 |
0,049 |
3,6 |
414 |
0,035 |
2,8 |
| 367 |
0,02 |
2,3 |
415 |
0,093 |
5,1 |
| 368 |
0,026 |
2,9 |
416 |
0,017 |
1,3 |
| 369 |
0,024 |
7,6 |
417 |
0,063 |
7 |
| 370 |
0,0087 |
4,1 |
419 |
0,029 |
5,7 |
| 371 |
0,017 |
3,6 |
423 |
0,072 |
8,1 |
| 372 |
0,011 |
4 |
425 |
0,09 |
13 |
| 373 |
0,0045 |
3,4 |
428 |
0,05 |
9,7 |
| 375 |
0,0072 |
0,93 |
436 |
0,03 |
7,2 |
| 378 |
0,044 |
2,5 |
440 |
0,097 |
28 |
Соединения данного изобретения ингибируют PDE 7 селективно и, следовательно, повышают уровень клеточного цАМФ. Поэтому соединения данного изобретения применимы для лечения различных типов таких заболеваний, как аллергические заболевания, воспалительные заболевания или иммунологические заболевания. Например, соединения данного изобретения применимы для лечения или предупреждения таких заболеваний, как бронхиальная астма, хронический бронхит, хроническая обструктивная болезнь легких, аллергический ринит, псориаз, атопический дерматит, конъюнктивит, остеоартрит, ревматоидный артрит, рассеянный склероз, системная красная волчанка, воспалительное заболевание кишечника, гепатит, панкреатит, энцефаломиелит, сепсис, болезнь Крона, реакция отторжения в трансплантации, реакция трансплантат против хозяина (GVH-заболевание) и рестеноз после ангиоплаcтики.
Соединения данного изобретения могут быть использованы для приготовления фармацевтической композиции или ингибитора PDE 7. В качестве активного ингредиента одно или несколько соединений могут вводиться в подходящей готовой форме. Готовая форма для перорального введения может включать в себя, например, капсулы, гранулы, мелкие гранулы, сиропы, сухие сиропы или т.п.; готовая форма для парентерального введения может включать в себя, например, инъекционный раствор, форму суппозитория, например ректального суппозитория или вагинального суппозитория, форму для назального введения, такую как спреи, или форму для чрескожной абсорбции, такую как мазь и пластыри, и т.п.
Доза введения может варьироваться в зависимости от различных типов факторов. Этими факторами могут быть состояние пациентов, тяжесть заболеваний, возраст, присутствие осложнения, а также форма введения. Обычная рекомендуемая суточная доза для перорального введения находится в диапазоне 0,1-1000 мг/день для взрослого, предпочтительно 0,1-500 мг/день для взрослого и более предпочтительно 1-100 мг/день для взрослого. В случае парентерального введения обычная рекомендуемая суточная доза находится в диапазоне 1/10-1/2 на основе дозы для перорального введения. Эти дозы могут корректироваться в зависимости от возраста, а также от состояния пациента.
Токсикологические свойства соединений данного изобретения являются низкими, и, следовательно, ожидается, что соединения данного изобретения имеют высокий предел безопасности.
Примеры и примеры получения
Соединения данного изобретения и промежуточные соединения, используемые для синтеза соединений данного изобретения, иллюстрируются в следующих примерах получения и примерах.
Физико-химические данные и химическая структура этих соединений суммированы в таблицах. Номера соединений в примерах и примерах получения идентичны номерам соединений в этих таблицах.
Пример получения 1
трет-Бутил-5-нитро-1-индолинкарбоксилат
К раствору 500 мг (3,05 ммоль) 5-нитроиндолина в 10 мл безводного дихлорметана добавляли 798 мг (3,65 ммоль) ди-трет-бутилдикарбоната при охлаждении льдом и эту смесь перемешивали в течение 1,5 часа. Затем к этой смеси добавляли каталитическое количество 4-диметиламинопиридина и смесь перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли воду и эту смесь экстрагировали дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 6/1) с получением 800 мг (99%) указанного в заголовке соединения.
Пример получения 2
трет-Бутил-5-амино-1-индолинкарбоксилат
80 мг 10% палладия на угле добавляли к раствору 760 мг (2,88 ммоль) соединения, полученного в примере получения 1, в 60 мл метанола и атмосферу реакции заменяли на атмосферу газообразного водорода. Затем эту смесь перемешивали в течение 30 минут при комнатной температуре и фильтровали через Celite®. Фильтрат удаляли при пониженном давлении с получением 670 мг указанного в заголовке соединения.
Пример получения 3
трет-Бутил-5-(ацетиламино)-1-индолинкарбоксилат
К раствору 300 мг (1,28 ммоль) соединения, полученного в примере получения 2, в 10 мл безводного дихлорметана добавляли 191 мкл (2,69 ммоль) ацетилхлорида и 375 мкл (2,69 ммоль) триэтиламина и эту смесь перемешивали в течение 1 часа при комнатной температуре. Затем к реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/1-1/2) с получением 370 мг (выход количественный) указанного в заголовке соединения.
Пример получения 4
HCl-соль N-(2,3-дигидро-1Н-индол-5-ил)ацетамида
Раствор смеси 330 мг (1,19 ммоль) соединения, полученного в примере получения 3, в 15 мл смеси 4 М HCl/диоксан перемешивали в течение 1,5 часов при комнатной температуре. Затем к реакционной смеси добавляли диэтиловый эфир и полученные осадки собирали с получением 173 мг (68%) указанного в заголовке соединения.
Пример получения 5
6-Амино-N-изопропилникотинамид
К раствору 300 мг (2,17 ммоль) 6-аминоникотиновой кислоты в 50 мл хлороформа добавляли 370 мкл (4,34 ммоль) изопропиламина, 4 мл безводной пропанфосфоновой кислоты (25 мас.% раствора в этилацетате) и 1,4 мл (10 ммоль) триэтиламина и эту смесь перемешивали в течение 6 часов при комнатной температуре. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и эту смесь экстрагировали дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1-5/1) с получением 30 мг (8%) указанного в заголовке соединения.
Пример получения 6
1-(Метилсульфонил)-5-нитроиндолин
К раствору 300 мг (1,83 ммоль) 5-нитроиндолина в 20 мл дихлорметана добавляли 141 мкл (2,74 ммоль) метансульфонилхлорида и 382 мкл (2,74 ммоль) триэтиламина и эту смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли дополнительно 141 мкл (2,74 ммоль) метансульфонилхлорида и 255 мкл (1,83 ммоль) триэтиламина и эту смесь перемешивали в течение 2 часов при комнатной температуре. Затем к реакционной смеси добавляли воду и эту смесь экстрагировали дихлорметаном. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, остаток обрабатывали диэтиловым эфиром и затем осадки собирали фильтрованием с получением 410 мг (92%) указанного в заголовке соединения.
Пример получения 7
1-(Метилсульфонил)-5-индолинамин
Указанное в заголовке соединение 150 мг (58%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 6, вместо соединения, полученного в примере получения 1.
Пример получения 8
2-{4-[(4-Нитрофенил)сульфонил]-1-пиперазинил}этанол
К раствору 415 мкл (3,38 ммоль) 1-пиперазинэтанола в 20 мл дихлорметана добавляли 500 мг (2,26 ммоль) 4-нитробензолсульфонилхлорида и 472 мкл (3,38 ммоль) триэтиламина при охлаждении льдом и эту смесь перемешивали в течение 30 минут при той же самой температуре. Реакционную смесь разбавляли дихлорметаном и органический слой промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 30/1) с получением 670 мг (94%) указанного в заголовке соединения.
Пример получения 9
2-{4-[(4-Нитрофенил)сульфонил]-1-пиперазинил}этилацетат
Указанное в заголовке соединение 175 мг (77%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере получения 8, вместо соединения, полученного в примере получения 2.
Пример получения 10
2-{4-(4-Аминофенил)сульфонил}-1-пиперазинил}этилацетат
Указанное в заголовке соединение 130 мг (95%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 9, вместо соединения, полученного в примере получения 1.
Пример получения 11
трет-Бутил-транс-4-(ацетиламино)циклогексилкарбамат
Указанное в заголовке соединение 130 мг (68%) получали аналогично примеру получения 3 с использованием трет-бутил-транс-4-аминоциклогексилкарбамата вместо соединения, полученного в примере получения 2.
Пример получения 12
Соль трифторуксусной кислоты N-(транс-4-аминоциклогексил)ацетамида
К раствору 220 мг (0,86 ммоль) соединения, полученного в примере получения 11, в 8 мл дихлорметана добавляли 8 мл трифторуксусной кислоты при комнатной температуре и эту смесь перемешивали в течение 30 минут при той же самой температуре. Реакционную смесь концентрировали и остаток обрабатывали диэтиловым эфиром. Полученные осадки собирали фильтрованием с получением 194 мг (84%) указанного в заголовке соединения.
Пример получения 13
2-Метокси-N-(4-нитрофенил)ацетамид
К смешанному раствору 384 мкл (5,0 ммоль) метоксиуксусной кислоты и 691 мг (5,0 ммоль) п-нитроанилина в 10 мл дихлорметана добавляли 1,53 мг (5,5 ммоль) 2-хлор-1,3-диметилимидазолийгексафторфосфата и 1,53 мл (11,0 ммоль) триэтиламина и эту смесь нагревали с обратным холодильником при кипении в течение 7 часов. Затем эту реакционную смесь экстрагировали этилацетатом, экстракт промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1) с получением 750 мг (71%) указанного в заголовке соединения.
Пример получения 14
N-(4-Аминофенил)-2-метоксиацетамид
Указанное в заголовке соединение 604 мг (86%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 13, вместо соединения, полученного в примере получения 1.
Пример получения 15
6-(4-Метил-1-пиперазинил)-3-пиридиниламин
Указанное в заголовке соединение 536 мг (выход количественный) получали аналогично примеру получения 2 с использованием 1-метил-4-(5-нитро-2-пиридинил)пиперазина вместо соединения, полученного в примере получения 1.
Пример получения 16
1-Метил-4-[(3-нитрофенил)сульфонил]пиперазин
К раствору 500 мг (2,26 ммоль) 3-нитробензолсульфонилхлорида в 30 мл дихлорметана добавляли 275 мкл (2,48 ммоль) N-метилпиперазина и 786 мкл (5,64 ммоль) триэтиламина и эту смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь экстрагировали дихлорметаном и органический слой промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток обрабатывали диэтиловым эфиром с получением 510 мг (79%) указанного в заголовке соединения.
Пример получения 17
4-[(4-Метил-1-пиперазинил)сульфонил]анилин
Указанное в заголовке соединение 350 мг (98%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 16, вместо соединения, полученного в примере получения 1.
Пример получения 18
2-[2-Фтор(метил)-4-нитроанилино]этанол
К раствору 554 мкл (5,0 ммоль) 3,4-дифторнитробензола в 10 мл диметилсульфоксида добавляли 1,38 мг (10,0 ммоль) карбоната калия и 803 мкл (10,0 ммоль) 2-метиламиноэтанола и эту смесь перемешивали в течение 1,5 часов при 100ºС. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом, затем этот экстракт промывали водой и насыщенным солевым раствором. После сушки над безводным сульфатом натрия растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/1) с получением 1,06 г (99%) указанного в заголовке соединения.
Пример получения 19
2-(4-Амино-2-фторметиланилино)этанол
Указанное в заголовке соединение 900 мг (выход количественный) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 18, вместо соединения, полученного в примере получения 1.
Пример получения 20
трет-Бутил-4-(4-нитрофенил)-1-пиперидинкарбоксилат
К раствору 4,84 г (30 ммоль) 4-фенилпиперидина в 30 мл концентрированной серной кислоты добавляли постепенно раствор 1,26 мл дымящей азотной кислоты в 5 мл концентрированной серной кислоты при охлаждении льдом и после добавления эту реакционную смесь нагревали до комнатной температуры. Затем реакционную смесь выливали в 200 г льда и медленно добавляли водный раствор гидроксида натрия до подщелачивания этой смеси. Смесь экстрагировали хлороформом и органический слой сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Затем к раствору полученного остатка в 20 мл дихлорметана добавляли 2,18 г (10 ммоль) ди-трет-бутилдикарбоната и эту смесь перемешивали в течение 1 часа при комнатной температуре. Смесь концентрировали и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 0,78 г (8%) указанного в заголовке соединения.
Пример получения 21
трет-Бутил-4-(4-аминофенил)-1-пиперидинкарбоксилат
Указанное в заголовке соединение 392 мг (57%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 20, вместо соединения, полученного в примере получения 1.
Пример получения 22
1-Этил-4-(2-фтор-4-нитрофенил)пиперазин
Указанное в заголовке соединение 2,33 г (92%) получали аналогично примеру получения 18 с использованием N-этилпиперазина вместо 2-метиламиноэтанола.
Пример получения 23
1-(2-Фтор-4-нитрофенил)-4-метил-1,4-диазепам
Указанное в заголовке соединение 2,21 г (87%) получали аналогично примеру получения 18 с использованием N-метилгомопиперазина вместо 2-метиламиноэтанола.
Пример получения 24
4-(4-Этил-1-пиперазинил)-3-фторанилин
Указанное в заголовке соединение 1,85 г (94%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 22, вместо соединения, полученного в примере получения 1.
Пример получения 25
1-(2-Фтор-4-нитрофенил)-4-метилпиперазин
К раствору 3,9 мл (35 ммоль) 3,4-дифторнитробензола в 60 мл диметилсульфоксида добавляли 9,7 мл (87,5 ммоль) N-метилпиперазина и 12,1 г (87,5 ммоль) карбоната калия и эту смесь нагревали с обратным холодильником при кипении в течение 5 часов при 100ºС. Реакционную смесь охлаждали до комнатной температуры и выливали в 500 мл ледяной воды, полученные осадки собирали. Собранные осадки растворяли в 2 М водном растворе HCl и промывали эфиром. Водный слой нейтрализовали 4 М водным раствором NaOH с получением осадков. Осадки собирали с получением 5,71 г (68%) указанного в заголовке соединения.
Пример получения 26
3-Фтор-4-(4-метил-1-пиперазинил)анилин
Указанное в заголовке соединение 2,76 г (выход количественный) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 25, вместо соединения, полученного в примере получения 1.
Пример получения 27
8-(2-Фтор-4-нитрофенил)-1,4-диокса-8-азаспиро[4.5]декан
Указанное в заголовке соединение 2,82 г (выход количественный) получали аналогично примеру получения 25 с использованием 1,4-диокса-8-азаспиро[4.5]декана вместо N-метилпиперазина.
Пример получения 28
4-(1,4-Диокса-8-азаспиро[4.5]дека-8-ил)-3-фторанилин
К раствору 2,0 г (7,09 ммоль) соединения, полученного в примере получения 27, в 30 мл метанола добавляли 200 мг платины на сероуглероде (осерненной платины) и атмосферу реакции заменяли атмосферой газообразного водорода. Затем эту смесь перемешивали в течение 5 часов при нормальных давлениях и температуре. Реакционную смесь фильтровали через целит (Celite®) и фильтрат удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1-1/1) с получением 1,71 г (96%) указанного в заголовке соединения.
Пример получения 29
8-(2-Хлор-4-нитрофенил)-1,4-диокса-8-азаспиро[4.5]декан
Указанное в заголовке соединение 3,05 г (выход количественный) получали аналогично примеру получения 25 с использованием 3,4-дихлорнитробензола и (1,4-диокса-8-азаспиро[4.5]декана вместо 3,4-дифторнитробензола и N-метилпиперазина соответственно.
Пример получения 30
3-Хлор-4-(1,4-диокса-8-азаспиро[4.5]декан-8-ил)анилин
Указанное в заголовке соединение 1,84 г (85%) получали аналогично примеру получения 28 с использованием соединения, полученного в примере получения 29, вместо соединения, полученного в примере получения 27.
Пример получения 31
3-Фтор-4-(4-метил-1,4-диазепам-1-ил)анилин
Указанное в заголовке соединение 1,85 г (94%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 23, вместо соединения, полученного в примере получения 1.
Пример получения 32
4-[2-(4-Морфолинил)этил]анилин
Указанное в заголовке соединение 2,17 г (выход количественный) получали аналогично примеру получения 2 с использованием 4-[2-(4-морфолинил)этил]нитробензола вместо соединения, полученного в примере получения 1.
Пример получения 33
1-Метил-3-(4-нитробензил)-2,4-имидазолидиндион
К раствору смеси 685 мг (6,0 ммоль) 1-метилгидантоина в 10 мл N,N-диметилформамида и 10 мл тетрагидрофурана добавляли 240 мг (6,9 ммоль) гидрида натрия (60% в масле) при комнатной температуре и эту смесь перемешивали в течение 30 минут при той же самой температуре. Затем к реакционной смеси добавляли 1,08 г (5,0 ммоль) п-нитробензилбромида и эту смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением 1,38 г (количественный выход) указанного в заголовке соединения.
Пример получения 34
3-(4-Аминобензил)-1-метил-2,4-имидазолидиндион
К смешанному раствору 1,33 г (5,34 ммоль) соединения, полученного в примере получения 33, в 12 мл этанола и 6 мл концентрированной соляной кислоты добавляли 5,41 г (24,01 ммоль) дегидрата хлорида олова (II) при комнатной температуре и эту смесь перемешивали в течение 2 часов при 75ºС. Реакционную смесь охлаждали до комнатной температуры, подщелачивали добавлением 4 н. водного раствора гидроксида натрия и обрабатывали хлороформом. Эту смесь фильтровали через целит и хлороформный слой отделяли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 1,148 г (98%) указанного в заголовке соединения.
Пример получения 35
трет-Бутил-транс-4-цианоциклогексилкарбамат
К раствору 765 мг (4,99 ммоль) транс-4-цианоциклогексанкарбоновой кислоты в 10 мл трет-бутанола добавляли 766 мкл (5,49 ммоль) триэтиламина и 1,13 мл (5,24 ммоль) дифенилфосфорилазида при комнатной температуре и эту смесь нагревали с обратным холодильником при кипении в течение 6 часов. После охлаждения реакционной смеси до комнатной температуры к этой смеси добавляли этилацетат и органический слой промывали насыщенным водным раствором бикарбоната натрия, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1) с получением 608 мг (54%) указанного в заголовке соединения.
Пример получения 36
HCl-соль транс-4-аминоциклогексанкарбонитрила
Указанное в заголовке соединение 361 мг (90%) получали аналогично примеру получения 4 с использованием соединения, полученного в примере получения 35, вместо соединения, полученного в примере получения 3.
Пример получения 37
HCl-соль 1-(2-аминоэтил)-4-метил-2,3-пиперазиндиона
К раствору 3,60 г (11,95 ммоль) 2-[2-(4-метил-2,3-диоксо-1-пиперазинил)этил]фталимида в 30 мл этанола добавляли 695 мкл (14,34 ммоль) моногидрата гидразина и эту смесь перемешивали при 40ºС в течение ночи. Реакционную смесь охлаждали до комнатной температуры, затем к этой смеси добавляли 25 мл воды и 6 мл 6 н. HCl и смесь перемешивали в течение 5 часов при комнатной температуре. После удаления нерастворимых веществ фильтрованием фильтрат концентрировали и остаток перекристаллизовывали с использованием 2% водно-этанольного раствора с получением 2,12 г (85%) указанного в заголовке соединения.
Пример получения 38
трет-Бутил-1-[(диметиламино)карбонил]-4-пиперидинилкарбамат
К раствору 500 мг (2,50 ммоль) трет-бутил-4-пиперидинилкарбамата в 20 мл дихлорметана добавляли 552 мкл (3,74 ммоль) триэтиламина и 276 мкл (3,00 ммоль) диметиламинокарбонилхлорида и эту смесь перемешивали в течение 2 часов при комнатной температуре. Затем эту смесь обрабатывали этилацетатом, органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 636 мг (94%) указанного в заголовке соединения.
Пример получения 39
HCl-соль 4-амино-N,N-диметил-1-пиперидинкарбоксамида
Указанное в заголовке соединение 571 мг (выход количественный) получали аналогично примеру получения 4 с использованием соединения, полученного в примере получения 38, вместо соединения, полученного в примере получения 3.
Пример получения 40
трет-Бутил-1-[(диметиламино)сульфонил]-4-пиперидинкарбамат
К раствору 412 мг (2,06 ммоль) трет-бутил-4-пиперидинилкарбамата в 20 мл дихлорметана добавляли 430 мкл (3,09 ммоль) триэтиламина и 265 мкл (2,47 ммоль) диметилсульфамоилхлорида и эту смесь перемешивали в течение 2 часов при комнатной температуре. Затем эту смесь обрабатывали этилацетатом и органический слой промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 536 мг (85%) указанного в заголовке соединения.
Пример получения 41
HCl-соль 4-амино-N,N-диметил-1-пиперидинсульфонамида
Указанное в заголовке соединение 0,42 г (выход количественный) получали аналогично примеру получения 4 с использованием соединения, полученного в примере получения 40, вместо соединения, полученного в примере получения 3.
Пример получения 42
Метил-(2S,4S)-4-[трет-бутоксикарбонил]амино]-2-пирролидинкарбоксилат
Указанное в заголовке соединение 4,70 г (96%) получали аналогично примеру получения 2 с использованием метил-(2S,4S)-1-бензилоксикарбонил-4-трет-бутоксикарбониламинопирролидин-2-карбоксилата вместо соединения, полученного в примере получения 1.
Пример получения 43
Метил-(2S,4S)-1-(аминокарбонил)-4-[(трет-бутоксикарбонил)амино]-2-пирролидинкарбоксилат
К раствору 4,60 г (18,83 ммоль) соединения, полученного в примере получения 42, в 80 мл диоксана и 80 мл воды добавляли 2,29 г (28,55 ммоль) изоцианата калия и 3,23 мл (56,49 ммоль) уксусной кислоты и эту смесь перемешивали в течение 17 часов при комнатной температуре. Затем смесь обрабатывали этилацетатом, органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1) с получением 2,32 г (43%) указанного в заголовке соединения.
Пример получения 44
трет-Бутил-(6S,7aS)-1,3-диоксогексагидро-1Н-пирроло[1,2-c]имидазол-6-илкарбамат
К раствору 2,21 г (7,69 ммоль) соединения, полученного в примере получения 43, в 150 мл метанола постепенно добавляли 615 мг (15,38 ммоль) гидрида натрия (60% в масле) и смесь перемешивали в течение 30 минут при комнатной температуре. После концентрирования реакционной смеси к этой смеси добавляли этилацетат и разбавленную соляную кислоту. Органический слой отделяли, сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением 1,8 г (92%) указанного в заголовке соединения.
Пример получения 45
HCl-соль (6S,7aS)-аминотетрагидро-1Н-пирроло[1,2-c]имидазол-1,3(2Н)-диона
Указанное в заголовке соединение 1,18 г (91%) получали аналогично примеру получения 4 с использованием соединения, полученного в примере получения 44, вместо соединения, полученного в примере получения 3.
Пример получения 46
1-(5-Амино-2-пиридинил)-2-имидазолидинон
Указанное в заголовке соединение 730 мг (выход количественный) получали аналогично примеру получения 2 с использованием 1-(5-нитро-2-пиридинил)-2-имидазолидинона вместо соединения, полученного в примере получения 1.
Пример получения 47
3-(4-Аминофенил)-2,4-имидазолидиндион
Указанное в заголовке соединение 179 мг (69%) получали аналогично примеру получения 2 с использованием 3-(4-нитрофенил)-2,4-имидазолидиндиона вместо соединения, полученного в примере получения 1.
Пример получения 48
3-(4-Аминофенил)-1-метил-2,4-имидазолидиндион
Указанное в заголовке соединение 413 мг (95%) получали аналогично примеру получения 2 с использованием 3-(4-нитрофенил)-1-метил-2,4-имидазолидиндиона вместо соединения, полученного в примере получения 1.
Пример получения 49
(3R)-1-(4-Аминофенил)-3-пирролидинол
Указанное в заголовке соединение 1,98 г (выход количественный) получали аналогично примеру получения 2 с использованием (3R)-1-(4-нитрофенил)-3-пирролидинола вместо соединения, полученного в примере получения 1.
Пример получения 50
(3R)-1-(2-Фтор-4-нитрофенил)-3-пирролидинол
Указанное в заголовке соединение 2,19 г (65%) получали аналогично примеру получения 18 с использованием (R)-3-пирролидинола вместо 2-метиламиноэтанола.
Пример получения 51
(3R)-1-(4-Амино-2-фторфенил)-3-пирролидинол
Указанное в заголовке соединение 1,81 г (99%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 50, вместо соединения, полученного в примере получения 1.
Пример получения 52
1-[(3-Нитрофенил)сульфонил]-4-пиперидинол
Указанное в заголовке соединение 1,91 г (49%) получали аналогично примеру получения 16 с использованием 4-гидроксипиперидина вместо N-метилпиперазина.
Пример получения 53
1-[(3-Аминофенил)сульфонил]-4-пиперидинол
Указанное в заголовке соединение 1,56 г (52%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 52, вместо соединения, полученного в примере получения 1.
Пример получения 54
1-[(4-Нитрофенил)сульфонил]-4-пиперидинол
Указанное в заголовке соединение 1,91 г (49%) получали аналогично примеру получения 8 с использованием 4-гидроксипиперидина вместо 1-пиперазинэтанола.
Пример получения 55
4-{[трет-Бутил(диметил)силил]окси}-1-[(4-нитрофенил)сульфонил]пиперидин
К раствору 1,5 г (5,24 ммоль) соединения, полученного в примере получения 54, в 60 мл дихлорметана добавляли 1,32 мл (5,76 ммоль) трет-бутилдиметилсилилтрифтората при 0ºС и эту смесь перемешивали в течение ночи при комнатной температуре. После реакции реакционную смесь промывали водой и органический слой сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 5/1) с получением 2,04 г (97%) указанного в заголовке соединения.
Пример получения 56
4-[(4-{[трет-Бутил(диметил)силил]окси}-1-пиперидинил)сульфонил]анилин
Указанное в заголовке соединение 1,67 г (98%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 55, вместо соединения, полученного в примере получения 1.
Пример получения 57
1-Метил-4-[4-нитро-2-(трифторметил)фенил]пиперазин
Указанное в заголовке соединение 2,28 г (82%) получали аналогично примеру получения 25 с использованием 2-фтор-5-нитробензотрифторида вместо 3,4-дифторнитробензола.
Пример получения 58
4-(4-Метил-1-пиперидинил)-3-(трифторметил)фениламин
Указанное в заголовке соединение 1,96 г (99%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 57, вместо соединения, полученного в примере получения 1.
Пример получения 59
2-[2-(5-Метил-1,1-диоксид-1,2,5-тиадиазолидин-2-ил)этил]-1Н-изоиндол-1,3(2Н)-дион
К раствору 686 мг (5,04 ммоль) 2-метил-1,2,5-тиадиазолидин-1,1-диоксида в 10 мл N,N-диметилформамида добавляли 212 мг (5,30 ммоль) гидрида натрия (60% в масле) при комнатной температуре и эту смесь перемешивали в течение 1 часа при той же самой температуре. Затем к реакционной смеси добавляли 1,41 г (5,54 ммоль) N-(2-бромэтил)фталимида и смесь перемешивали в течение 1,5 часов при 75ºС. После реакции к реакционной смеси добавляли воду и растворитель удаляли при пониженном давлении. Полученный остаток обрабатывали водой, экстрагировали дихлорметаном и органический слой промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/5) и отверждали обработкой смесью этилацетат/эфир с получением 526 мг (34%) указанного в заголовке соединения.
Пример получения 60
HCl-соль 2-(5-метил-1,1-диоксид-1,2,5-тиадиазолидин-2-ил)этанамина
К суспензии 500 мг (1,62 ммоль) соединения, полученного в примере получения 59, в 5 мл этанола добавляли 94 мкл (1,94 ммоль) моногидрата гидразина и эту смесь перемешивали в течение 6 часов при 70ºС. Затем нерастворимые вещества удаляли фильтрованием, фильтрат удаляли при пониженном давлении и к остатку добавляли 5 мл воды и 1,5 мл 6М водного раствора HCl. Затем эту смесь перемешивали в течение 6 часов при комнатной температуре, нерастворимые вещества удаляли фильтрованием и фильтрат удаляли при пониженном давлении. Полученный остаток перекристаллизовывали из этанола с получением 287 мг (82%) указанного в заголовке соединения.
Пример получения 61
1-(2-Фтор-4-нитрофенил)-4-пиперидинол
К раствору 4,77 г (30,0 ммоль) 3,4-дифторнитробензола в 100 мл N,N-диметилформамида добавляли 5,33 г (40,0 ммоль) карбоната калия и 3,03 г (30,0 ммоль) 4-гидроксипиперидина и эту смесь перемешивали в течение 1 часа при 120ºС. После охлаждения реакционной смеси до комнатной температуры реакционную смесь разбавляли хлороформом и нерастворимые вещества удаляли фильтрованием. Фильтрат концентрировали и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1,5/1) с получением 3,1 г (43%) указанного в заголовке соединения.
Пример получения 62
1-(4-Амино-2-фторфенил)-4-пиперидинол
К раствору 2,95 г (12,28 ммоль) соединения, полученного в примере получения 61, в 100 мл этанола добавляли 600 мг 5% палладия на угле и атмосферу заменяли на атмосферу водорода. Смесь перемешивали в течение 2 часов при комнатной температуре и фильтровали. Фильтрат удаляли при пониженном давлении с получением 2,48 г (96%) указанного в заголовке соединения.
Пример получения 63
трет-Бутил-транс-4-(4-морфолинил)циклогексилкарбамат
К раствору 21,43 г (0,1 моль) трет-бутил-N-(транс-4-аминоциклогексил)карбамата в 250 мл N,N-диметилформамида добавляли 16,7 мл (0,12 моль) бис(2-бромэтилового) эфира и 34,85 мл (0,25 моль) триэтиламина и эту смесь перемешивали в течение 6 часов при 70ºС. Затем растворитель удаляли при пониженном давлении и остаток обрабатывали этилацетатом. Органический слой промывали водным раствором карбоната натрия и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: только хлороформ – хлороформ/метанол = 30/1) с получением 19,92 г (70%) указанного в заголовке соединения.
Пример получения 64
Ди-HCl-соль транс-4-(4-морфолинил)циклогексиламина
К раствору 18,53 г (65,16 ммоль) соединения, полученного в примере получения 63, в 65 мл хлороформа добавляли 130 мл раствора 4 н. HCl/этилацетат и эту смесь перемешивали в течение 3 часов при комнатной температуре. Реакционную смесь обрабатывали 200 мл диэтилового эфира и отделенные осадки собирали с получением 16,22 г (97%) указанного в заголовке соединения.
Пример получения 65
4-(4-Нитрофенил)-2-пиперазинон
К раствору 1,275 г (9,04 ммоль) 4-фторнитробензола в 30 мл N,N-диметилформамида добавляли 1,87 г (13,56 ммоль) карбоната натрия и 905 мг (9,04 ммоль) пиперазин-2-она и эту смесь перемешивали в течение 1 часа при 130ºС и в течение 1 часа при 140ºС. Реакционную смесь охлаждали до комнатной температуры и разбавляли хлороформом, затем нерастворимые вещества удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении и полученное твердое вещество промывали этанолом с получением 859 мг (43%) указанного в заголовке соединения.
Пример получения 66
4-(4-Аминофенил)-2-пиперадинон
Указанное в заголовке соединение 640 мг (89%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 65, вместо соединения, полученного в примере получения 1.
Пример получения 67
3-Амино-N,N-диметилбензолсульфонамид
Указанное в заголовке соединение 2,55 г (99%) получали аналогично примеру получения 2 с использованием N,N-диметил-3-нитробензолсульфонамида вместо соединения, полученного в примере получения 1.
Пример получения 68
3-[(2-{[трет-Бутил(диметил)силил]окси}этил)сульфонил]нитробензол
К раствору 955 мг (4,13 ммоль) 3-[(2-гидроксиэтил)сульфонил]нитробензола в 30 мл дихлорметана добавляли 747 мг (4,96 ммоль) трет-бутилдиметилсилилхлорида и 10 мг 4-диметиламинопиридина и эту смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь разбавляли дихлорметаном и органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1-2/1) с получением 1,27 г (89%) указанного в заголовке соединения.
Пример получения 69
3-{[(2-трет-Бутил(диметил)силил)окси]этил)сульфонил}анилин
Указанное в заголовке соединение 856 мг (94%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 68, вместо соединения, полученного в примере получения 1.
Пример получения 70
3-[(2-Гидроксиэтил)(метил)амино]-N-(4-нитрофенил)ацетамид
К суспензии 2,946 г (13,73 ммоль) 2-хлор-N-(4-нитрофенил)ацетамида в 30 мл этанола добавляли 3,31 мл (41,18 ммоль) 2-(метиламино)этанола и эту смесь нагревали с обратным холодильником при кипении в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры и концентрирования остаток обрабатывали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 2,05 г (59%) указанного в заголовке соединения.
Пример получения 71
4-Метил-1-(4-нитрофенил)-2-пиперазинон
К раствору 1,48 г (5,84 ммоль) соединения, полученного в примере получения 70, в 50 мл тетрагидрофурана добавляли 1,75 мл (7,01 ммоль) три-н-бутилфосфина и 1,21 г (7,01 ммоль) 1,1′-азобис(N,N-диметилформамида) и эту смесь перемешивали в течение 4 часов при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле с получением 738 мг (54%) указанного в заголовке соединения.
Пример получения 72
1-(4-Аминофенил)-4-метил-2-пиперазинон
Указанное в заголовке соединение 545 мг (выход количественный) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 71, вместо соединения, полученного в примере получения 1.
Пример получения 73
1-(5-Нитро-2-пиридинил)-4-пиперидинол
К суспензии 1,0 г (6,3 ммоль) 2-хлор-5-нитропиридина в 20 мл н-пропанола добавляли 1,9 г (18,9 ммоль) 4-гидроксипиперидина и эту смесь перемешивали в течение 1,5 часов при 100ºС. После охлаждения реакционной смеси растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 50/1) с получением 1,37 г (97%) указанного в заголовке соединения.
Пример получения 74
1-(5-Амино-2-пиридинил)-4-пиперидинол
К суспензии 1,35 г (6,04 ммоль) соединения, полученного в примере получения 73, в 18 мл этанола и 3 мл воды добавляли 1,3 г восстановленного железа и 0,25 мл концентрированной соляной кислоты и эту смесь перемешивали в течение 2 часов при 90ºС. После охлаждения реакционной смеси смесь фильтровали через Celite® и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 601 мг (51%) указанного в заголовке соединения.
Пример получения 75
1-(2,3-Дифтор-4-нитрофенил)-4-пиперидинол
К раствору 1,72 мл (15 ммоль) 2,3,4-трифторбензола в N,N-диметилформамиде добавляли 1,01 г (10 ммоль) 4-гидроксипиперидина и 2,3 мл (20 ммоль) 2,6-лутидина и эту смесь перемешивали в течение 24 часов при комнатной температуре. Растворитель удаляли при пониженном давлении и к остатку добавляли насыщенный водный раствор бикарбоната натрия и эту смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1 – только этилацетат) с получением 1,82 г (70%) указанного в заголовке соединения.
Пример получения 76
1-(4-Амино-2,3-дифторфенил)-4-пиперидинол
Указанное в заголовке соединение 1,23 г (78%) получали аналогично примеру получения 74 с использованием соединения, полученного в примере получения 75, вместо соединения, полученного в примере получения 73.
Пример получения 77
1-(2-Метил-4-нитрофенил)-4-пиперидинол
К раствору 1,55 г (10 ммоль) 2-фтор-5-нитротолуола в 35 мл N,N-диметилформамида добавляли 1,01 г (10 ммоль) 4-гидроксипиперидина и 1,81 г (13 ммоль) карбоната калия и эту смесь перемешивали в течение 2 часов при 120ºС. Реакционную смесь выливали в лед и эту смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/1) с получением 1,5 г (63%) указанного в заголовке соединения.
Пример получения 78
1-(4-Амино-2-метилфенил)-4-пиперидинол
Указанное в заголовке соединение 1,2 г (выход количественный) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 77, вместо соединения, полученного в примере получения 1.
Пример получения 79
2-(4-Гидрокси-1-пиперидинил)-5-нитробензонитрил
Указанное в заголовке соединение 2,0 г (81%) получали аналогично примеру получения 77 с использованием 2-фтор-5-нитробензонитрила вместо 2-фтор-5-нитротолуола.
Пример получения 80
5-Амино-2-(4-гидрокси-1-пиперидинил)бензонитрил
К суспензии 1,0 г (4,04 ммоль) соединения, полученного в примере получения 79, в 10 мл воды добавляли 790 мг (14,14 ммоль) железа и 130 мг (2,42 ммоль) хлорида аммония и эту смесь нагревали с обратным холодильником при кипении в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/1-1/4) с получением 327 мг (37%) указанного в заголовке соединения.
Пример получения 81
Метил-2-(4-гидрокси-1-пиперидинил)-5-нитробензоат
Указанное в заголовке соединение 2,30 г (98%) получали аналогично примеру получения 77 с использованием метил-2-фтор-5-нитробензоата вместо 2-фтор-5-нитротолуола.
Пример получения 82
Метил-5-амино-2-(4-гидрокси-1-пиперидинил)бензоат
Указанное в заголовке соединение 1,83 г (91%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 81, вместо соединения, полученного в примере получения 1.
Пример получения 83
трет-Бутил-1-тетрагидро-2Н-пиран-4-ил-4-пиперидинилкарбамат
К суспензии 9,5 г (184 ммоль) трет-бутилпиперидин-4-илкарбамата в 200 мл 1,2-дихлорэтана добавляли 4,4 мл (47,4 ммоль) тетрагидро-4Н-пиран-4-она и 1,0 мл уксусной кислоты и эту смесь перемешивали в течение 30 минут. Реакционную смесь охлаждали до 0ºС и к этой смеси добавляли 15 г (71,1 ммоль) триацетоксиборгидрида натрия и смесь перемешивали в течение 4 часов при комнатной температуре и затем к смеси добавляли дополнительно 5,0 г (23,6 ммоль) триацетоксиборгидрида натрия и смесь перемешивали в течение 64 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1) с получением 11,54 г (86%) указанного в заголовке соединения.
Пример получения 84
Ди-HCl-соль 1-тетрагидро-2Н-пиран-4-ил-4-пиперидинамина
Указанное в заголовке соединение 10,8 г (выход количественный) получали аналогично примеру получения 4 с использованием соединения, полученного в примере получения 83, вместо соединения, полученного в примере получения 3.
Пример получения 85
трет-Бутил-4-(4-{[(бензилокси)карбонил]амино}циклогексил)-1-пиперазинкарбоксилат
Указанное в заголовке соединение 4,0 г (96%) получали аналогично примеру получения 83 с использованием бензил-4-оксоциклогексилкарбамата и трет-бутил-1-пиперазинкарбамата вместо тетрагидро-4Н-пиран-4-она и трет-бутилпиперидин-4-илкарбамата соответственно.
Пример получения 86
трет-Бутил-4-(4-аминоциклогексил)-1-пиперазинкарбоксилат
Указанное в заголовке соединение 2,6 г (выход количественный) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 85, вместо соединения, полученного в примере получения 1.
Пример получения 87
Ди-HCl-соль (5-амино-2-пиридинил)метанола
Указанное в заголовке соединение 686 мг (78%) получали аналогично примеру получения 4 с использованием трет-бутил-6-(гидроксилметил)пиридин-3-илкарбамата вместо соединения, полученного в примере получения 3.
Пример получения 88
трет-Бутил-транс-4-[(хлорацетил)амино]циклогексилкарбамат
Указанное в заголовке соединение 604 мг (89%) получали аналогично примеру получения 3 с использованием трет-бутил-транс-4-аминоциклогексилкарбамата и хлорацетилхлорида вместо соединения, полученного в примере получения 2, и ацетилхлорида соответственно.
Пример получения 89
трет-Бутил-транс-4-({[(2-гидроксиэтил)(метил)амино]ацетил}амино)циклогексилкарбамат
К суспензии 560 мг (1,93 ммоль) соединения, полученного в примере получения 88, в 5 мл этанола добавляли 464 мкл (5,78 ммоль) 2-(метиламино)этанола и эту смесь нагревали с обратным холодильником при кипении в течение 1 часа. После охлаждения растворитель удаляли при пониженном давлении, к остатку добавляли воду и эту смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали перекристаллизацией (из изопропанола) с получением 391 мг (61%) указанного в заголовке соединения.
Пример получения 90
трет-Бутил-транс-4-(4-метил-2-оксо-1-пиперазинил)циклогексилкарбамат
589 мг (5,25 ммоль) трет-бутоксида калия добавляли к суспензионному раствору 560 мг (1,7 ммоль) соединения, полученного в примере получения 89, в 10 мл тетрагидрофурана и к этой смеси добавляли раствор 499 мг (2,62 ммоль) п-толуолсульфонилхлорида в 5 мл тетрагидрофурана и затем эту смесь перемешивали в течение 2 часов при 0ºС. К реакционной смеси добавляли дополнительно 499 мг (2,62 ммоль) п-толуолсульфонилхлоридва и 589 мг (5,25 ммоль) трет-бутоксида калия и эту смесь перемешивали в течение 30 минут при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 398 мг (75%) указанного в заголовке соединения.
Пример получения 91
Ди-HCl-соль 1-(транс-4-аминоциклогексил)-4-метил-2-пиперазинона
Указанное в заголовке соединение 349 мг (выход количественный) получали аналогично примеру получения 4 с использованием соединения, полученного в примере получения 90, вместо соединения, полученного в примере получения 3.
Пример получения 92
Этил-1-(4-{[(бензилокси)карбонил]амино}циклогексил)-4-пиперидинкарбоксилат
Указанное в заголовке соединение 2,6 г (67%) получали аналогично примеру получения 83 с использованием бензил-4-оксоциклогексилкарбамата и этилизонипекотината вместо тетрагидро-4Н-пиран-4-она и трет-бутилпиперидин-4-илкарбамата соответственно.
Пример получения 93
Этил-1-(4-аминоциклогексил)-4-пиперидинкарбоксилат
Указанное в заголовке соединение 1,58 г (выход количественный) получали аналогично примеру получения 2 с использованием соединения, полученного в примере получения 92, вместо соединения, полученного в примере получения 1.
Пример получения 94
Этил-1-(4-нитрофенил)-4-пиперидинол
К раствору 14,1 г (0,10 моль)) 4-фторнитробензола в 200 мл N,N-диметилформамида добавляли 20,73 г (0,15 моль) карбоната калия и 10,1 г (0,10 моль) 4-гидроксипиперидина и эту смесь перемешивали в течение 1 часа при 140ºС. Реакционную смесь охлаждали до комнатной температуры и смесь обрабатывали хлороформом и затем нерастворимые вещества удаляли фильтрованием. Фильтрат концентрировали и остаток перекристаллизовывали из этанола с получением 17,27 г (78%) указанного в заголовке соединения.
Пример получения 95
1-(Аминофенил)-4-пиперидинол
К раствору 17,09 г (76,95 ммоль) соединения, полученного в примере получения 94, в 300 мл метанола добавляли 2,0 г 5% палладия на угле и атмосферу заменяли атмосферой водорода. Смесь перемешивали в течение ночи при комнатной температуре и затем фильтровали. Фильтрат удаляли при пониженном давлении с получением 13,04 г (88%) указанного в заголовке соединения.
Пример 1
2-Циклогексил-5-метил-2,4-дигидро-3Н-пиразол-3-он
Смешанный раствор 39,88 г (0,265 моль) HCl-соли циклогексилгидразина в 28,57 мл (0,265 моль) метилацетоацетата нагревали в течение 1 часа при 120ºС. После охлаждения реакционной смеси до комнатной температуры к этой смеси добавляли дихлорметан и смесь нейтрализовали 2 н. водным раствором NaOH. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток обрабатывали гексаном с получением кристаллического твердого вещества и это кристаллическое твердое вещество собирали фильтрованием с получением 33,84 г (71%) указанного в заголовке соединения.
Пример 2
5-Хлор-1-циклогексил-3-метил-1Н-пиразол
Смесь 13,5 г (74,9 ммоль) соединения, полученного в примере 1, и 13,5 мл оксихлорида фосфора нагревали в течение 2 часов при 110ºС. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток экстрагировали этилацетатом, экстракт промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 9,84 г (66%) указанного в заголовке соединения.
Пример 3-1
5-Хлор-1-циклогексил-3-метил-1Н-пиразол-4-карбоальдегид
К раствору 9,84 г (49,52 ммоль) соединения, полученного в примере 2, в 50 мл N,N-диметилформамида добавляли 11,5 мл (123,8 ммоль) оксихлорида фосфора при охлаждении льдом и эту смесь перемешивали в течение 30 минут при комнатной температуре и в течение 1 часа при 80ºС. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток экстрагировали этилацетатом, экстракт промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 10/1) с получением 8,73 г (76%) указанного в заголовке соединения.
Пример 3-2
5-Хлор-1-циклогексил-3-метил-1Н-пиразол-4-карбоальдегид
Смесь 110 г (0,61 моль) соединения, полученного в примере 1, и 216 мл (2,32 ммоль) оксихлорида фосфора нагревали и перемешивали в течение 2 часов при 110ºС. Затем реакционную смесь охлаждали до комнатной температуры и добавляли постепенно к 630 мл охлажденного N,N-диметилформамида. После добавления эту смесь перемешивали в течение 30 минут при комнатной температуре и в течение 5 часов при 80ºС. Реакционную смесь охлаждали до комнатной температуры и смесь выливали медленно в лед. К этой смеси добавляли хлороформ и рН смеси доводили до приблизительно 4 4 н. водным раствором NaOH (приблизительно 2,3 л). Органический слой отделяли и водный слой экстрагировали хлороформом. Объединенный органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат /гексан = 10/1=1/7) с получением 100,8 г (73%) указанного в заголовке соединения.
Пример 4
Этил-[(1-циклогексил-4-формил-3-метил-1Н-пиразол-5-ил)сульфанил]ацетат
К раствору 8,0 г (35,3 ммоль) соединения, полученного в примере 3, в 100 мл ацетонитрила добавляли 4,84 мл (44,11 ммоль) этилтиогликолата и 7,32 г (52,93 ммоль) карбоната калия и эту смесь нагревали с обратным холодильником при кипении в течение 4 часов. Затем к реакционной смеси дополнительно добавляли 1,93 мл (17,64 ммоль) этилтиогликолата и 2,43 г (17,64 ммоль) карбоната калия и эту смесь нагревали с обратным холодильником при кипении в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры и концентрирования при пониженном давлении остаток экстрагировали этилацетатом, экстракт промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1) с получением 8,09 г (74%) указанного в заголовке соединения.
Пример 5-1
Этил-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксилат
К раствору 7,95 г (25,61 ммоль) соединения, полученного в примере 4, в 100 мл N,N-диметилформамида добавляли 5,31 г (38,42 ммоль) карбоната калия и 677 мг (2,56 ммоль) 18-краун-6 и эту смесь нагревали в течение 2 часов при 120ºС-130ºС. После охлаждения реакционной смеси до комнатной температуры смесь экстрагировали этилацетатом, экстракт промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 15/1) с получением 2,2 г (29%) указанного в заголовке соединения.
Пример 5-2
Этил-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксилат
К раствору 63,4 мл (0,578 ммоль) этилгликолата в 1 л тетрагидрофурана добавляли постепенно 23 г (0,578 моль) гидрида натрия (60% в масле) при охлаждении льдом и эту смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь охлаждали ледяной водой и раствор 100,8 г (0,444 моль) соединения, полученного в примере 3, в 400 мл тетрагидрофурана добавляли постепенно к этой реакционной смеси на протяжении 45 минут и смесь перемешивали в течение 2 часов при комнатной температуре. Затем реакционную смесь охлаждали ледяной водой и к реакционной смеси добавляли постепенно 23 г (0,578 моль) гидрида натрия (60% в масле) и смесь перемешивали в течение 30 минут при 0ºС. После реакции реакционную смесь выливали медленно в раствор лед/этилацетат и органический слой отделяли. Водный слой экстрагировали этилацетатом, объединенный органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/гексан = 1/8-1/5) с получением 104,7 г (81%) указанного в заголовке соединения.
Пример 6
1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоновая кислота
К раствору 11,89 г (40,66 ммоль) соединения, полученного в примере 5, в 100 мл этанола добавляли 44,7 мл (44,7 ммоль) 1 н. раствора гидроксида натрия и эту смесь нагревали в течение 1 часа при 60ºС. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и диэтиловый эфир и водный слой отделяли. К водному слою добавляли 23 мл 2 н. водного раствора HCl и полученные осадки собирали с получением 10,38 г (97%) указанного в заголовке соединения.
Пример 7
N-Бензил-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 60 мг (0,23 ммоль) соединения, полученного в примере 6, в 2 мл дихлорметана добавляли 33 мкл (0,45 ммоль) тионилхлорида и эту смесь перемешивали в течение 8 часов при 80ºС. Затем растворитель удаляли при пониженном давлении с получением соответствующего промежуточного соединения хлорангидрида кислоты.
Затем 27 мкл (0,25 ммоль) бензиламина и 79 мкл триэтиламина добавляли к раствору вышеуказанного промежуточного соединения хлорангидрида кислоты в 2 мл безводного дихлорметана при охлаждении льдом и эту смесь перемешивали в течение 1,5 часов при комнатной температуре. Затем к реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1-3/1) с получением 75 мг (94%) указанного в заголовке соединения.
Пример 8
1-Циклогексил-3-метил-N-фенил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 65 мг (84%) получали аналогично примеру 7 с использованием анилина вместо бензиламина.
Пример 9
N-{4-[Ацетил(метил)амино]фенил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 89 мг (82%) получали аналогично примеру 7 с использованием N-(4-аминофенил)-N-метилацетамида вместо бензиламина.
Пример 10
N-[4-(Ацетиламино)-3-метоксифенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 73 мг (65%) получали аналогично примеру 7 с использованием N-(4-амино-3-метоксифенил)ацетамида вместо бензиламина.
Пример 11
N-(1-Ацетил-2,3-дигидро-1Н-индол-5-ил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 30 мг (27%) получали аналогично примеру 7 с использованием 1-ацетил-2,3-дигидро-1Н-индол-5-иламина вместо бензиламина.
Пример 12
Этил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенилкарбамат
Указанное в заголовке соединение 101 мг (89%) получали аналогично примеру 7 с использованием этил-4-аминофенилкарбамата вместо бензиламина.
Пример 13
трет-Бутил-5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-индолинкарбоксилат
Указанное в заголовке соединение 133 мг (92%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 2, вместо бензиламина.
Пример 14
HCl-соль 1-циклогексил-N-(2,3-дигидро-1Н-индол-5-ил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 68 мг (99%) получали аналогично примеру 4 с использованием соединения, полученного в примере 13, вместо соединения, полученного в примере получения 3.
Пример 15
1-Циклогексил-N-(1Н-индол-5-ил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 95 мг (95%) получали аналогично примеру 7 с использованием 5-аминоиндола вместо бензиламина.
Пример 16
1-Циклогексил-3-метил-N-[4-(4-морфолинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 85 мг (89%) получали аналогично примеру 7 с использованием 4-(4-морфолинил)анилина вместо бензиламина.
Пример 17
1-Циклогексил-3-метил-N-(3-нитрофенил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 175 мг (60%) получали аналогично примеру 7 с использованием 3-нитроанилина вместо бензиламина.
Пример 18
N-(3-Аминофенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 142 мг (выход количественный) получали аналогично примеру получения 2 с использованием соединения, полученного в примере 17, вместо соединения, полученного в примере получения 1.
Пример 19
N-[3-(Ацетиламино)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 60 мг (0,17 ммоль) соединения, полученного в примере 18, в 4 мл безводного тетрагидрофурана добавляли 25 мкл (0,35 ммоль) ацетилхлорида и 50 мкл (0,35 ммоль) триэтиламина при охлаждении льдом и эту смесь перемешивали в течение 2 часов при комнатной температуре. Затем к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1-1/2) с получением 15 мг (22%) указанного в заголовке соединения.
Пример 20
1-Циклогексил-3-метил-N-{4-(метиламино)карбонил}фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 37 мг (41%) получали аналогично примеру 7 с использованием 4-амино-N-метилбензамида вместо бензиламина.
Пример 21
1-Циклогексил-3-метил-N-(1-пропионил-2,3-дигидро-1Н-индол-5-ил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 47 мг (75%) получали аналогично примеру 19 с использованием соединения, полученного в примере 14, и пропионилхлорида вместо использования соединения, полученного в примере 18, и ацетилхлорида соответственно.
Пример 22
Этил-5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-индолинкарбоксилат
Указанное в заголовке соединение 62 мг (82%) получали аналогично примеру 19 с использованием соединения, полученного в примере 14, и этилхлоркарбоната вместо соединения, полученного в примере 18, и ацетилхлорида соответственно.
Пример 23
1-Циклогексил-N-(1-изобутил-2,3-дигидро-1Н-индол-5-ил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 68 мг (89%) получали аналогично примеру 19 с использованием соединения, полученного в примере 14, и изобутирилхлорида вместо соединения, полученного в примере 18, и ацетилхлорида соответственно.
Пример 24
N-(1-Бутирил-2,3-дигидро-1Н-индол-5-ил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 66 мг (87%) получали аналогично примеру 19 с использованием соединения, полученного в примере 14, и н-бутирилхлорида вместо соединения, полученного в примере 18, и ацетилхлорида соответственно.
Пример 25
1-Циклогексил-N-[1-(2,2-диметилпропаноил)-2,3-дигидро-1Н-индол-5-ил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 59 мг (76%) получали аналогично примеру 19 с использованием соединения, полученного в примере 14, и пропаноилхлорида вместо соединения, полученного в примере 18, и ацетилхлорида соответственно.
Пример 26
1-Циклогексил-3-метил-N-(2-оксо-2,3-дигидро-1Н-индол-5-ил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 60 мг (58%) получали аналогично примеру 7 с использованием 5-амино-1,3-дигидро-2Н-индол-2-она вместо бензиламина.
Пример 27
N-[4-(Ацетиламино)-3-хлорфенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 28 мг (43%) получали аналогично примеру 7 с использованием N-(4-амино-2-хлорфенил)ацетамида вместо бензиламина.
Пример 28
1-Циклогексил-N-{4-[(этиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 30 мг (32%) получали аналогично примеру 7 с использованием 4-амино-N-этилбензамида вместо бензиламина.
Пример 29
1-Циклогексил-N-[4-(метоксиметил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 62 мг (70%) получали аналогично примеру 7 с использованием 4-(метоксиметил)анилина вместо бензиламина.
Пример 30
1-Циклогексил-N-[4-(гидроксиметил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 65 мг (76%) получали аналогично примеру 7 с использованием (4-аминофенил)метанола вместо бензиламина.
Пример 31
1-Циклогексил-3-метил-N-[4-(морфолинилкарбонил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 88 мг (90%) получали аналогично примеру 7 с использованием 4-(4-морфолинилкарбонил)анилина вместо бензиламина.
Пример 32
1-Циклогексил-3-метил-N-{4-[(4-метил-1-пиперазинил)карбонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 57 мг (53%) получали аналогично примеру 7 с использованием 4-[(4-метил-1-пиперазинил)карбонил]анилина вместо бензиламина.
Пример 33
1-Циклогексил-3-метил-N-{4-[(метилсульфонил)амино]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 33 мг (33%) получали аналогично примеру 7 с использованием N-(4-аминофенил)метансульфонамида вместо бензиламина.
Пример 34
1-Циклогексил-3-метил-N-{4-[(метиламино)сульфонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 22 мг (22%) получали аналогично примеру 7 с использованием 4-амино-N-метилбензолсульфонамида вместо бензиламина.
Пример 35
N-{1-[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-2,3-дигидро-1Н-индол-5-ил}ацетамид
Указанное в заголовке соединение 76 мг (80%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 4, вместо бензиламина.
Пример 36
1-Циклогексил-3-метил-N-{4-[(4-метил-1-пиперазинил)сульфонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 36 мг (32%) получали аналогично примеру 7 с использованием 4-[(4-метил-1-пиперазинил)сульфонил]анилина вместо бензиламина.
Пример 37
1-Циклогексил-N-(4-{[(2-метоксиэтил)амино]карбонил}фенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 50 мг (50%) получали аналогично примеру 7 с использованием 4-амино-N-(2-метоксиэтил)бензамида вместо бензиламина.
Пример 38
N-(4-Ацетилфенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 54 мг (62%) получали аналогично примеру 7 с использованием п-аминоацетофенона вместо бензиламина.
Пример 39
1-Циклогексил-N-{4-[(диметиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 86 мг (92%) получали аналогично примеру 7 с использованием 4-амино-N,N-диметилбензамида вместо бензиламина.
Пример 40
Этил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бензоат
Указанное в заголовке соединение 80 мг (51%) получали аналогично примеру 7 с использованием этил-4-аминобензоата вместо бензиламина.
Пример 41
4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бензойная кислота
К раствору 55 мг (0,13 ммоль) соединения, полученного в примере 40, в 8 мл этанола добавляли 134 мкл 1 М раствора гидроксида натрия и эту смесь перемешивали в течение 1 часа при комнатной температуре. Затем к реакционной смеси добавляли 20 мл воды и водный слой промывали этилацетатом. Водный слой нейтрализовали добавлением 1 М раствора HCl и полученные осадки собирали с получением 33 мг (65%) указанного в заголовке соединения.
Пример 42
1-Циклогексил-N-(2-метокси-4-нитрофенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 73 мг (31%) получали аналогично примеру 7 с использованием 2-метокси-4-нитроанилина вместо бензиламина.
Пример 43
N-(4-Амино-2-метоксифенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 22 мг (37%) получали аналогично примеру получения 2 с использованием соединения, полученного в примере 42, вместо соединения, полученного в примере получения 1.
Пример 44
N-[4-(Ацетиламино)-2-метоксифенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 27 мг (49%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 43, вместо соединения, полученного в примере получения 2.
Пример 45
1-Циклогексил-N-{4-[(изопропиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 47 мг (49%) получали аналогично примеру 7 с использованием 4-амино-N-изопропилбензамида вместо бензиламина.
Пример 46
1-Циклогексил-N-(4-{[(2-гидроксиэтил)амино]карбонил}фенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 93 мг (72%) получали аналогично примеру 7 с использованием 4-амино-N-(2-гидроксиэтил)бензамида вместо бензиламина.
Пример 47
N-[6-(Ацетиламино)-3-пиридинил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 33 мг (37%) получали аналогично примеру 7 с использованием N-5-(амино-2-пиридинил)ацетамида вместо бензиламина.
Пример 48
1-Циклогексил-N-(4-метоксифенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 81 мг (96%) получали аналогично примеру 7 с использованием п-анизидина вместо бензиламина.
Пример 49
1-Циклогексил-N-циклопентил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 65 мг (85%) получали аналогично примеру 7 с использованием циклопентиламина вместо бензиламина.
Пример 50
N,1-дициклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 82 мг (выход количественный) получали аналогично примеру 7 с использованием циклогексиламина вместо бензиламина.
Пример 51
N-{4-[(трет-Бутиламино)карбонил]фенил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 89 мг (89%) получали аналогично примеру 7 с использованием 4-амино-N-(трет-бутил)бензамида вместо бензиламина.
Пример 52
1-Циклогексил-N-{5-[(изопропиламино)карбонил]-2-пиридинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 13 мг (20%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 5, вместо бензиламина.
Пример 53
1-Циклогексил-N-[4-(формиламино)фенил]-3-метил-1Н-тиено[2,3-с]пиразол-5-карбоксамид
Указанное в заголовке соединение 11 мг (19%) получали аналогично примеру 7 с использованием 4-аминофенилформамида вместо бензиламина.
Пример 54
трет-Бутил-4-[(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-с]пиразол-5-ил)карбонил]амино}фенил)сульфонил]-1-пиперазинкарбоксилат
Указанное в заголовке соединение 71 мг (32%) получали аналогично примеру 7 с использованием трет-бутил-4-[(4- аминофенил)сульфонил]-1-пиперазинкарбоксилата вместо бензиламина.
Пример 55
HCl-соль 1-циклогексил-3-метил-N[4-1-пиперазинилсульфонил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 30 мг (61%) получали аналогично примеру получения 4 с использованием соединения, полученного в примере 54, вместо соединения, полученного в примере получения 3.
Пример 56
1-Циклогексил-3-метил-N-[4-(4-морфолинилсульфонил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 14 мг (12%) получали аналогично примеру 7 с использованием 4-(4-морфолинилсульфонил)анилина вместо бензиламина.
Пример 57
1-Циклогексил-3-метил-N-[4-(метилсульфонил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 41 мг (43%) получали аналогично примеру 7 с использованием 4-(метилсульфонил)анилина вместо бензиламина.
Пример 58
1-Циклогексил-N-[1-(циклопропилкарбонил)-2,3-дигидро-1Н-индол-5-ил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 42 мг (49%) получали аналогично примеру 19 с использованием соединения, полученного в примере 14, и циклопропанкарбонилхлорида вместо соединения, полученного в примере 18, и ацетилхлорида соответственно.
Пример 59
1-Циклогексил-3-метил-N-[1-(метилсульфонил)-2,3-дигидро-1Н-индол-5-ил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 106 мг (выход количественный) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 7, вместо бензиламина.
Пример 60
N-(Ацетил-1Н-индол-5-ил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 94 мг (97%) получали аналогично примеру 7 с использованием 1-ацетил-1Н-индол-5-амина вместо бензиламина.
Пример 61
1-Циклогексил-N-циклопропил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 67 мг (96%) получали аналогично примеру 7 с использованием циклопропиламина вместо бензиламина.
Пример 62
N-(1-Бензил-4-пиперидинил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 200 мг (81%) получали аналогично примеру 7 с использованием 1-бензил-4-пиперидиниламина вместо бензиламина.
Пример 63
HCl-соль 1-циклогексил-3-метил-N-(4-пиперидинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К раствору 180 мг (0,42 моль) соединения, полученного в примере 62, в 4 мл 1,2-дихлорэтана добавляли 50 мкл 1-хлорэтилхлорформиата и эту смесь нагревали с обратным холодильником при кипении в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток растворяли в 6 мл метанола и эту смесь нагревали с обратным холодильником при кипении в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры растворитель удаляли при пониженном давлении. Остаток промывали этилацетатом и полученные осадки собирали с получением 109 мг (69%) указанного в заголовке соединения.
Пример 64
N-(1-Ацетил-4-пиперидинил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 40 мг (78%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 63, вместо соединения, полученного в примере получения 2.
Пример 65
Этил-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенокси)ацетат
Указанное в заголовке соединение 320 мг (96%) получали аналогично примеру 7 с использованием этил-(4-аминофенокси)ацетата вместо бензиламина.
Пример 66
(4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенокси)уксусная кислота
Указанное в заголовке соединение 268 мг (95%) получали аналогично примеру 41 с использованием соединения, полученного в примере 65, вместо соединения, полученного в примере 40.
Пример 67
1-Циклогексил-3-метил-N-{[(4-[2-(метиламино)-2-оксоэтокси]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 24 мг (39%) получали аналогично примеру получения 5 с использованием соединения, полученного в примере 66, и метиламина (30% раствора в метаноле) вместо 6-аминоникотиновой кислоты и изопропиламина соответственно.
Пример 68
Этил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)ацетат
Указанное в заголовке соединение 223 мг (93%) получали аналогично примеру 7 с использованием этил(4-аминофенил)ацетата вместо бензиламина.
Пример 69
(4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)уксусная кислота
Указанное в заголовке соединение 157 мг (84%) получали аналогично примеру получения 41 с использованием соединения, полученного в примере 68, вместо соединения, полученного в примере 40.
Пример 70
1-Циклогексил-3-метил-N-{4-[2-(метиламино)-2-оксоэтил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 31 мг (50%) получали аналогично примеру получения 5 с использованием соединения, полученного в примере 69, и метиламина (30% раствора в метаноле) вместо 6-аминоникотиновой кислоты и изопропиламина соответственно.
Пример 71
трет-Бутил-4-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)-1-пиперазинкарбоксилат
Указанное в заголовке соединение 158 мг (выход количественный) получали аналогично примеру 7 с использованием трет-бутил-4-(4-аминофенил)-1-пиперазинкарбоксилата вместо бензиламина.
Пример 72
HCl-соль 1-циклогексил-3-метил-N-[4-(1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 108 мг (88%) получали аналогично примеру получения 4 с использованием соединения, полученного в примере 71, вместо соединения, полученного в примере получения 3.
Пример 73
N-[4-(4-Ацетил-1-пиперазинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 32 мг (63%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 72, вместо соединения, полученного в примере получения 2.
Пример 74
1-Циклогексил-N-(транс-4-гидроксициклогексил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 82 мг (выход количественный) получали аналогично примеру 7 с использованием транс-4-аминоциклогексанола вместо бензиламина.
Пример 75
1-Циклогексил-3-метил-N-(4-оксоциклогексил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 4,0 г (11,1 ммоль) соединения, полученного в примере 74, в 200 мл дихлорметана добавляли 5,0 г (13,3 ммоль) дихромата пиридиния и эту смесь перемешивали в течение 6 часов при комнатной температуре. Затем к реакционной смеси добавляли дополнительно 5,0 г (13,3 ммоль) дихромата пиридиния и эту смесь перемешивали в течение 18 часов. Реакционную смесь фильтровали через Celite® и фильтрат удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 2,6 г (65%) указанного в заголовке соединения.
Пример 76
1-Циклогексил-3-метил-N-{4-[2-(4-метил-1-пиперазинил)-2-оксоэтокси]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 65 мг (90%) получали аналогично примеру получения 5 с использованием соединения, полученного в примере 66, и N-метилпиперазина вместо 6-аминоникотиновой кислоты и изопропиламина соответственно.
Пример 77
1-Циклогексил-N-{4-[-2-(диметиламино)-2-оксоэтокси]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 43 мг (67%) получали аналогично примеру получения 5 с использованием соединения, полученного в примере 66, и HCl-соли диметиламина вместо 6-аминоникотиновой кислоты и изопропиламина соответственно.
Пример 78
2-{4-[(4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)сульфонил]-1-пиперазинил}этилацетат
Указанное в заголовке соединение 60 мг (28%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 10, вместо бензиламина.
Пример 79
1-Циклогексил-N-(4-{[(4-(2-гидроксиэтил)-1-пиперазинил]сульфонил}фенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 45 мг (0,08 ммоль) соединения, полученного в примере 78, в 4 мл этанола добавляли 86 мкл 1 М водного раствора гидроксида натрия и эту смесь перемешивали в течение 1 часа при комнатной температуре. Затем к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1) с получением 31 мг (74%) указанного в заголовке соединения.
Пример 80
N-[транс-4-(Ацетиламино)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 28 мг (30%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 12, вместо бензиламина.
Пример 81
1-Циклогексил-N,3-диметил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 58 мг (92%) получали аналогично примеру 7 с использованием HCl-соли метиламина вместо бензиламина.
Пример 82
2-Циклопентил-5-метил-2,4-дигидро-3Н-пиразол-3-он
Указанное в заголовке соединение 9,70 г (80%) получали аналогично примеру 1 с использованием HCl-соли циклопентилгидразина вместо HCl-соли циклогексилгидразина.
Пример 83
5-Хлор-1-циклопентил-3-метил-1Н-пиразол
Указанное в заголовке соединение 4,5 г (81%) получали аналогично примеру 2 с использованием соединения, полученного в примере 82, вместо соединения, полученного в примере 1.
Пример 84
5-Хлор-1-циклопентил-3-метил-1Н-пиразол-4-карбоальдегид
Указанное в заголовке соединение 4,0 г (79%) получали аналогично примеру 3-1 с использованием соединения, полученного в примере 83, вместо соединения, полученного в примере 2.
Пример 85
Этил-[(1-циклопентил-4-формил-3-метил-1Н-пиразол-5-ил)сульфанил]ацетат
Указанное в заголовке соединение 1,9 г (36%) получали аналогично примеру 4 с использованием соединения, полученного в примере 84, вместо соединения, полученного в примере 3.
Пример 86
Этил-1-циклопентил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксилат
Указанное в заголовке соединение 1,47 г (87%) получали аналогично примеру 5-1 с использованием соединения, полученного в примере 85, вместо соединения, полученного в примере 4.
Пример 87
1-Циклопентил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоновая кислота
Указанное в заголовке соединение 0,49 г (68%) получали аналогично примеру 6 с использованием соединения, полученного в примере 86, вместо соединения, полученного в примере 5.
Пример 88
N-{4-(Ацетиламино)фенил]-1-циклопентил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 88 мг (72%) получали аналогично примеру 7 с использованием N-(4-аминофенил)ацетамида и соединения, полученного в примере 87, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 89
2-Циклогептил-5-метил-2,4-дигидро-3Н-пиразол-3-он
Указанное в заголовке соединение 16,27 г (52%) получали аналогично примеру 1 с использованием HCl-соли циклогептилгидразина вместо HCl-соли циклогексилгидразина.
Пример 90
5-Хлор-1-циклогептил-3-метил-1Н-пиразол
Указанное в заголовке соединение 6,92 г (79%) получали аналогично примеру 2 с использованием соединения, полученного в примере 89, вместо соединения, полученного в примере 1.
Пример 91
5-Хлор-1-циклогептил-3-метил-1Н-пиразол-4-карбоальдегид
Указанное в заголовке соединение 6,47 г (84%) получали аналогично примеру 3-1 с использованием соединения, полученного в примере 90, вместо соединения, полученного в примере 2.
Пример 92
Этил-1-циклогептил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксилат
К раствору 6,4 г (26,6 ммоль) соединения, полученного в примере 91, в 100 мл ацетонитрила добавляли 3,06 мл (27,9 ммоль) этилтиогликолата и 7,72 г (55,8 ммоль) карбоната калия и эту смесь нагревали с обратным холодильником при кипении в течение 23 часов. Затем добавляли дополнительно 3,06 мл (27,9 ммоль) этилтиогликолата и эту смесь нагревали с обратным холодильником при кипении в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры смесь концентрировали и остаток экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 20/1) с получением 2,46 г (30%) указанного в заголовке соединения.
Пример 93
1-Циклогептил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоновая кислота
Указанное в заголовке соединение 1,40 г (67%) получали аналогично примеру 6 с использованием соединения, полученного в примере 92, вместо соединения, полученного в примере 5.
Пример 94
N-[4-(Ацетиламино)фенил]-1-циклогептил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 71 мг (60%) получали аналогично примеру 7 с использованием N-(4-аминофенил)ацетамида и соединения, полученного в примере 93, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 95
1-Циклогексил-N,3-диметил-N-фенил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 103 мг (96%) получали аналогично примеру 7 с использованием N-метиланилина вместо бензиламина.
Пример 96
1-Циклогексил-3-метил-N-(4-пиридинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 80 мг (96%) получали аналогично примеру 7 с использованием 4-аминопиридина вместо бензиламина.
Пример 97
1-Циклогексил-3-метил-N-(3-пиридинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 48 мг (57%) получали аналогично примеру 7 с использованием 3-аминопиридина вместо бензиламина.
Пример 98
1-Циклогексил-3-метил-N-(4-нитрофенил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 170 мг (0,643 ммоль) соединения, полученного в примере 6, в 3 мл 1,2-дихлорэтана добавляли 94 мкл (1,29 ммоль) тионилхлорида и эту смесь перемешивали в течение 1,5 часов при 90ºС. После охлаждения реакционной смеси до комнатной температуры растворитель удаляли при пониженном давлении с получением соответствующего промежуточного соединения хлорангидрида кислоты.
Затем к раствору 170 мг (0,643 ммоль) 4-нитроанилина в 4 мл тетрагидрофурана добавляли 77 мг (60% в масле; 1,93 ммоль) боргидрида натрия и эту смесь перемешивали в течение 10 минут при комнатной температуре. Затем к этой смеси добавляли вышеупомянутый хлорангидрид кислоты в 3 мл тетрагидрофурана и смесь перемешивали в течение 30 минут при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и полученное твердое вещество промывали метанолом с получением 150 мг (61%) указанного в заголовке соединения.
Пример 99
N-(4-Аминофенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 142 мг (выход количественный) получали аналогично примеру получения 2 с использованием соединения, полученного в примере 98, вместо соединения, полученного в примере получения 1.
Пример 100
N-[4-(Ацетиламино)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 10 мг (24%) получали аналогично примеру 19 с использованием соединения, полученного в примере 99, вместо соединения, полученного в примере 18.
Пример 101
1-Циклогексил-N-{4-[(метоксиацетил)амино]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 92 мг (88%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 14, вместо бензиламина.
Пример 102
Метил-5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-пиридинкарбоксилат
Указанное в заголовке соединение 98 мг (43%) получали аналогично примеру 7 с использованием метил-5-амино-2-пиридинкарбоксилата вместо бензиламина.
Пример 103
5-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-пиридинкарбоновая кислота
Указанное в заголовке соединение 160 мг (87%) получали аналогично примеру 41 с использованием соединения, полученного в примере 102, вместо соединения, полученного в примере 40.
Пример 104
1-Циклогексил-3-метил-N-{6-[(метиламино)карбонил]-3-пиридинил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 44 мг (77%) получали аналогично примеру получения 5 с использованием соединения, полученного в примере 103, и метиламина (30% раствора в метаноле) вместо 6-аминоникотиновой кислоты и изопропиламина соответственно.
Пример 105
1-Циклогексил-N-{6-[(диметиламино)карбонил]-3-пиридинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 50 мг (85%) получали аналогично примеру получения 5 с использованием соединения, полученного в примере 103, и HCl-соли диметиламина вместо 6-аминоникотиновой кислоты и изопропиламина соответственно.
Пример 106
1-Циклогексил-3-метил-N-[4-(4-метил-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 76 мг (77%) получали аналогично примеру 7 с использованием 4-(4-метил-1-пиперазинил)анилина вместо бензиламина.
Пример 107
Метансульфонат 1-циклогексил-3-метил-N-[4-(4-метил-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К суспензии 563 мг (1,287 ммоль) соединения, полученного в примере 106, в 5,6 мл метанола добавляли 85,6 мкл (1,319 ммоль) метансульфоновой кислоты при 50ºС и эту смесь нагревали с обратным холодильником при кипении. Затем реакционную смесь постепенно охлаждали до 0ºС и полученные осадки собирали с получением 452 мг (66%) указанного в заголовке соединения.
Пример 108
N-(4-Цианофенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 300 мг (выход количественный) получали аналогично примеру 7 с использованием 4-цианоанилина вместо бензиламина.
Пример 109
Ди-HCl-соль 1-циклогексил-3-метил-N-[6-(4-метил-1-пиперазинил)-3-пиридинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида
1-Циклогексил-3-метил-N-[6-(4-метил-1-пиперазинил)-3-пиридинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид 235 мг (79%) получали аналогично примеру 7 с использованием 4-цианоанилина вместо бензиламина. Затем к раствору 132 мг (0,301 ммоль) вышеуказанного свободного основания в 2 мл метанола добавляли 166 мкл раствора 4 н. HCl/диоксан и эту смесь разбавляли диэтиловым эфиром. Полученные осадки собирали с получением 140 мг (91%) указанного в заголовке соединения.
Пример 110
HCl-соль 1-циклогексил-3-метил-N-{3-[(4-метил-1-пиперазинил)сульфонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамида
1-Циклогексил-3-метил-N-{3-[(4-метил-1-пиперазинил)сульфонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид 133 мг (87%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 17, вместо бензиламина. Затем к раствору 133 мг (0,265 ммоль) вышеуказанного свободного основания в 3 мл метанола добавляли 80 мкл раствора 4 н. HCl/диоксан и эту смесь разбавляли диэтиловым эфиром. Полученные осадки собирали с получением 138 мг (97%) указанного в заголовке соединения.
Пример 111
1-Циклогексил-3-метил-N-{3-[(метиламино)сульфонил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 45 мг (34%) получали аналогично примеру 7 с использованием 3-амино-N-метилбензолсульфонамида вместо бензиламина.
Пример 112
1-Циклогептил-3-метил-N-[(4-(4-метил-1-пиперазинил)фенил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 89 мг (78%) получали аналогично примеру 106 с использованием соединения, полученного в примере 93, вместо соединения, полученного в примере 6.
Пример 113
1-Циклогексил-3-метил-N-[(3-(4-метил-1-пиперазинил)фенил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 106 мг (80%) получали аналогично примеру 7 с использованием 3-(4-метил-1-пиперазинил)анилина вместо бензиламина.
Пример 114
1-Циклогексил-N-[(4-(4-гидрокси-1-пиперидинил)фенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 4,1 г (15,51 ммоль) соединения, полученного в примере 6, в 50 мл 1,2-дихлорэтана добавляли 2,26 мл (31,02 ммоль) тионилхлорида и эту смесь нагревали с обратным холодильником при кипении в течение 1,5 часов. После охлаждения реакционной смеси растворитель удаляли при пониженном давлении с получением соответствующего промежуточного соединения хлорангидрида кислоты.
Затем 3,04 г (15,82 ммоль) соединения, полученного в примере получения 95, и 4,32 мл (31,02 ммоль) триэтиламина добавляли к раствору вышеуказанного промежуточного соединения хлорангидрида кислоты в 150 мл безводного дихлорметана при охлаждении льдом и эту смесь перемешивали в течение 20 часов при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1-30/1) с получением 7,5 г (83%) указанного в заголовке соединения.
Пример 115
N-[4-(Ацетиламино)-3-метоксифенил]-1-циклогептил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 160 мг (59%) получали аналогично примеру 10 с использованием соединения, полученного в примере 93, вместо соединения, полученного в примере 6.
Пример 116
1-Циклогексил-N-(3,5-дихлор-4-пиридинил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 342 мг (88%) получали аналогично примеру 98 с использованием 4-амино-3,5-дихлорпиридина вместо 4-нитроанилина.
Пример 117
5-[(4-Бромбензил)сульфанил]-1-циклогексил-3-метил-1Н-пиразол-4-карбоальдегид
К раствору 1,2 г (5,29 ммоль) соединения, полученного в примере 3, в 21 мл этанола добавляли 2,07 г (6,35 ммоль) соли бромистоводородной кислоты S-(4-бромбензил)изотиомочевины и 10,6 мл 2 н. раствора гидроксида натрия и эту смесь нагревали с обратным холодильником при кипении в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры эту смесь концентрировали и остаток разбавляли этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 7/1) с получением 1,723 г (82%) указанного в заголовке соединения.
Пример 118
5-(4-Бромфенил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол
К раствору 1,623 г (4,13 ммоль) соединения, полученного в примере 117, в 30 мл тетрагидрофурана добавляли постепенно раствор 10,3 мл (10,3 ммоль) 1 М бис(триметилсилил)амида лития в тетрагидрофуране при -78ºС и эту смесь перемешивали в течение 30 минут при той же самой температуре. Затем реакционную смесь нагревали медленно до 0ºС на протяжении 1 часа и к реакционной смеси добавляли воду. Смесь экстрагировали дихлорметаном и органический слой сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и к остатку добавляли 15 мл этанола и 10 мл раствора 4 н. HCl/диоксан и смесь перемешивали в течение 30 минут при комнатной температуре и в течение 30 минут при 60ºС. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Осадок разбавляли этилацетатом и органический слой промывали насыщенным водным раствором бикарбоната натрия и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 8/1) с получением 717 мг (46%) указанного в заголовке соединения.
Пример 119
1-Циклогексил-3-метил-5-[4-(4-метил-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол
К раствору 175 мг (0,466 ммоль) соединения, полученного в примере 118, в 30 мл толуола добавляли 115 мкл (1,40 ммоль) N-метилпиперазина, 89,6 мг (0,933 ммоль) трет-бутоксида натрия, 5,2 мг (0,023 ммоль) ацетата палладия (II) и 9,4 мг (0,0466 ммоль) три-трет-бутилфосфина и эту смесь нагревали с обратным холодильником при кипении в течение 5 часов. После охлаждения смеси до комнатной температуры к смеси добавляли этилацетат, органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 158 мг (86%) указанного в заголовке соединения.
Пример 120
Метансульфонат 1-циклогексил-3-метил-5-[4-(4-метил-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразола
Указанное в заголовке соединение 143 мг (94%) получали аналогично примеру 107 с использованием соединения, полученного в примере 119, вместо соединения, полученного в примере 106.
Пример 121
1-Циклогексил-3-метил-5-[4-(4-метил-1,4-диазепам-1-ил)фенил]-1Н-тиено[2,3-c]пиразол
Указанное в заголовке соединение 124 мг (65%) получали аналогично примеру 119 с использованием N-метилгомопиперазина вместо N-метилпиперазина.
Пример 122
1-Циклогексил-N-(2-гидроксипропил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 82 мг (78%) получали аналогично примеру 7 с использованием 2-аминоэтанола вместо бензиламина.
Пример 123
1-Циклогексил-N-(3-гидроксипропил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 103 мг (94%) получали аналогично примеру 7 с использованием 3-амино-1-пропанола вместо бензиламина.
Пример 124
1-Циклогексил-N-{3-фтор-4-[(2-гидроксиэтил)(метил)амино]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 99 мг (68%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 19, вместо бензиламина.
Пример 125
HCl-соль 1-циклогексил-N-{3-фтор-4-[(2-гидроксиэтил)(метил)амино]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К раствору 91 мг (0,211 ммоль) соединения, полученного в примере 124, в 2 мл диэтилового эфира и 1 мл этилацетата добавляли 63 мкл (0,25 ммоль) раствора 4 н. HCl/1,4-диоксан и дополнительно добавляли к этой смеси 3 мл диэтилового эфира. Полученные осадки собирали с получением 86 мг (87%) указанного в заголовке соединения.
Пример 126
Этил-цис-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоксилат
Указанное в заголовке соединение 365 мг (92%) получали аналогично примеру 7 с использованием этил-цис-4-аминоциклогексанкарбоксилата вместо бензиламина.
Пример 127
цис-4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоновая кислота
Указанное в заголовке соединение 123 мг (88%) получали аналогично примеру 41 с использованием соединения, полученного в примере 126, вместо соединения, полученного в примере 40.
Пример 128
1-Циклогексил-N-[цис-4-(гидроксиметил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 185 мг (0,433 ммоль) соединения, полученного в примере 126, в 6 мл тетрагидрофурана добавляли 56 мг (1,33 ммоль) хлорида лития и 50 мг (1,33 ммоль) боргидрида натрия и эту смесь перемешивали в течение 14 часов при комнатной температуре. Затем к смеси добавляли этилацетат и органический слой промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/3) с получением 110 мг (66%) указанного в заголовке соединения.
Пример 129
Метил-транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}метил)циклогексанкарбоксилат
Указанное в заголовке соединение 605 мг (96%) получали аналогично примеру 7 с использованием соли соляной кислоты этил-транс-4-аминоциклогексанкарбоксилата вместо бензиламина.
Пример 130
1-Циклогексил-N-метил{[транс-4-(гидроксиметил)циклогексил]метил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 150 мг (80%) получали аналогично примеру 128 с использованием соединения, полученного в примере 129, вместо соединения, полученного в примере 126.
Пример 131
трет-Бутил-транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексилкарбамат
Указанное в заголовке соединение 90 мг (выход количественный) получали аналогично примеру 7 с использованием трет-бутил-транс-4-аминоциклогексилкарбамата вместо бензиламина.
Пример 132
N-(транс-4-Аминоциклогексил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 890 мг (1,93 ммоль) соединения, полученного в примере 131, в 5 мл N,N-диметилформамида добавляли 9,66 мл раствора 4 н. HCl/диоксан и эту смесь перемешивали в течение 3 часов при комнатной температуре. Затем эту смесь разбавляли дихлорметаном и к смеси добавляли 50 мл 1 н. раствора гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на щелочном силикагеле (элюент: хлорофом/метанол = 60/1) с получением 495 мг (71%) указанного в заголовке соединения.
Пример 133
1-Циклогексил-3-метил-N-[транс-4-(4-морфолинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 120 мг (0,333 ммоль) соединения, полученного в примере 132, в 8 мл N,N-диметилформамида добавляли 46,8 мкл (0,333 ммоль) бис(2-хлорэтилового) эфира, 116 мкл (0,832 ммоль) триэтиламина, 50 мг (0,333 ммоль) иодида натрия и 6,5 мкл (0,333 ммоль) 15-краун-5 и эту смесь перемешивали в течение 24 часов при 100ºС. После охлаждения реакционной смеси до комнатной температуры смесь экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 20/1) с получением 22 мг (15%) указанного в заголовке соединения.
Пример 134
1-Циклогексил-3-метил-N-(4-пиперидинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Насыщенный раствор бикарбоната натрия и этилацетат добавляли к соединению, полученному в примере 63, и органический слой сушили над безводным сульфатом натрия. Растворитель удаляли и остаток очищали колоночной хроматографией на щелочном силикагеле (элюент: хлороформ/метанол = 60/1) с получением 411 мг (60%) указанного в заголовке соединения.
Пример 135
1-Циклогексил-3-метил-N-(1-тетрагидро-2Н-пиран-4-ил-4-пиперидинил)-
1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,433 ммоль) соединения, полученного в примере 134, в 8 мл дихлорметана добавляли 44 мкл (0,476 ммоль) тетрагидро-4-пиранона и 128 мг (0,606 ммоль) триацетоксиборгидрида натрия и эту смесь перемешивали в течение 24 часов при комнатной температуре. Затем к реакционной смеси добавляли насыщенный раствор бикарбоната натрия и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=20/1) с получением 70 мг (38%) указанного в заголовке соединения.
Пример 136
1-Циклогексил-N-[1-(1,4-диоксаспиро[4.5]декан-8-ил)-4-пиперазинил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 180 мг (92%) получали аналогично примеру 135 с использованием моноэтиленкеталя 1,4-циклогександиона вместо тетрагидро-4-пиранона.
Пример 137
1-Циклогексил-3-метил-N-[1-(4-оксоциклогексил)-4-пиперидинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 153 мг (0,314 ммоль) соединения, полученного в примере 136, в 3 мл ацетона и 1 мл воды добавляли 71,8 мг (0,377 ммоль) моногидрата п-толуолсульфоновой кислоты и эту смесь нагревали с обратным холодильником при кипении в течение 2 дней. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и эту смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением 120 мг (86%) указанного в заголовке соединения.
Пример 138
1-Циклогексил-N-[1-(транс-4-гидроксициклогексил)-4-пиперидинил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 109 мг (0,246 ммоль) соединения, полученного в примере 137, в 8 мл этанола добавляли 14,0 мг (0,369 ммоль) боргидрида натрия и эту смесь перемешивали в течение 1 часа при 0ºС. Затем к реакционной смеси добавляли дихлорметан и органический слой промывали водой и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1) с получением 67 мг (61%) указанного в заголовке соединения.
Пример 139
трет-Бутил-4-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)-1-пиперидинкарбоксилат
Указанное в заголовке соединение 649 мг (выход количественный) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 21, вместо бензиламина.
Пример 140
1-Циклогексил-3-метил-N-[4-(4-пиперидинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 584 мг (1,12 ммоль) соединения, полученного в примере 139, в 3 мл дихлорметана добавляли 0,86 мл (11,2 ммоль) трифторуксусной кислоты при комнатной температуре и эту смесь перемешивали в течение 1,5 часов при той же самой температуре. Затем смесь экстрагировали дихлорметаном и органический слой промывали 2 н. раствором гидроксида натрия и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 100/1) с получением 437 мг (92%) указанного в заголовке соединения.
Пример 141
HCl-соль 1-циклогексил-3-метил-N-[4-(4-пиперидинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 94 мг (86%) получали аналогично примеру 125 с использованием соединения, полученного в примере 140, вместо соединения, полученного в примере 124.
Пример 142
1-Циклогексил-3-метил-N-[4-(1-метил-4-пиперидинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 174 мг (0,412 ммоль) соединения, полученного в примере 140, в 5 мл хлороформа добавляли 31 мкл (0,494 ммоль) метилиодида и 86 мкл (0,618 ммоль) триэтиламина и эту смесь перемешивали в течение 2 часов при комнатной температуре. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 46 мг (26%) указанного в заголовке соединения.
Пример 143
1-Циклогексил-N-[4-(4-этил-1-пиперазинил)-3-фторфенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 90 мг (42%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 24, вместо бензиламина.
Пример 144
1-Циклогексил-N-[3-фтор-4-(4-метил-1,4-диазепам-1-ил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 161 мг (76%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 31, вместо бензиламина.
Пример 145
Этил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-метоксибензоат
Указанное в заголовке соединение 401 мг (80%) получали аналогично примеру 7 с использованием этил-4-амино-2-метоксибензоата вместо бензиламина.
Пример 146
4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-метоксибензойная кислота
Указанное в заголовке соединение 242 мг (59%) получали аналогично примеру 41 с использованием соединения, полученного в примере 145, вместо соединения, полученного в примере 40.
Пример 147
HCl-соль 1-циклогексил-N-{3-метокси-4-[(4-метил-1-пиперазинил)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К раствору 200 мг (0,48 ммоль) соединения, полученного в примере 146, в 3 мл безводного дихлорметана добавляли 64 мкл (0,58 ммоль) N-метилпиперазина и 111 мг (0,58 ммоль) HCl-соли 1-этил-3-(3-диметиламинопропил)карбодиимида и эту смесь перемешивали в течение 3 часов при комнатной температуре. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1-10/1). Полученное неочищенное кристаллическое твердое вещество растворяли в растворе 4 М HCl/диоксан и растворитель удаляли при пониженном давлении. Полученное твердое вещество собирали с получением 124 мг (49%) указанного в заголовке соединения.
Пример 148
1-Циклогексил-N-[3-метокси-4-(4-морфолинилкарбонил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 76 мг (79%) получали аналогично примеру 147 с использованием морфолина вместо N-метилпиперазина.
Пример 149
1-Циклогексил-N-{4-[(4-гидрокси-1-пиперидинил)карбонил]фенил}-3-метоксифенил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 68 мг (69%) получали аналогично примеру 147 с использованием 4-гидроксипиперидина вместо N-метилпиперазина.
Пример 150
1-Циклогексил-N-(4-{[(2-гидроксиэтил)амино]карбонил}-3-метоксифенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 53 мг (58%) получали аналогично примеру 147 с использованием 2-аминоэтанола вместо N-метилпиперазина.
Пример 151
1-Циклогексил-N-(3-метокси-4-{[(2-метоксиэтил)амино]карбонил}фенил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 73 мг (78%) получали аналогично примеру 147 с использованием 2-метоксиэтиламина вместо N-метилпиперазина.
Пример 152
1-Циклогексил-N-{3-метокси-4-[(4-метиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 31 мг (36%) получали аналогично примеру 147 с использованием HCl-соли метиламина вместо N-метилпиперазина.
Пример 153
1-Циклогексил-N-{4-[(диметиламино)карбонил]-3-метоксифенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 70 мг (80%) получали аналогично примеру 147 с использованием HCl-соли диметиламина вместо N-метилпиперазина.
Пример 154
1-Циклогексил-N-[3-фтор-4-(4-метил-1-пиперазинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 136 мг (79%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 26, вместо бензиламина.
Пример 155
Соль метансульфоновой кислоты 1-циклогексил-N-[3-фтор-4-(4-метил-1-пиперазинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Суспензию 100 мг (0,22 ммоль) соединения, полученного в примере 154, в 2 мл метанола нагревали при 50ºС и к этой суспензии добавляли 14 мл (0,22 ммоль) метансульфоновой кислоты и затем эту смесь нагревали с обратным холодильником при кипении в течение 10 минут. Реакционную смесь постепенно охлаждали и полученные осадки собирали с получением 68 мг (56%) указанного в заголовке соединения.
Пример 156
N-[3-Хлор-4-(4-метил-1-пиперазинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 169 мг (95%) получали аналогично примеру 7 с использованием 3-хлор-4-(4-метил-1-пиперазинил)анилина вместо бензиламина.
Пример 157
1-Циклогексил-N-[4-(1,4-диокса-8-азаспиро[4.5]декан-8-ил)-3-фторфенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 546 мг (96%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 28, вместо бензиламина.
Пример 158
1-Циклогексил-N-[3-фтор-4-(4-оксо-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 500 мг (1,00 ммоль) соединения, полученного в примере 157, в смешанном растворе 20 мл толуола и 2 мл воды добавляли 229 мг (1,20 ммоль) моногидрата п-толуолсульфоновой кислоты и эту смесь нагревали с обратным холодильником при кипении в течение 8 часов. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 460 мг (выход количественный) указанного в заголовке соединения.
Пример 159-1
1-Циклогексил-N-[3-фтор-4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 150 мг (0,33 ммоль) соединения, полученного в примере 158, в безводном метаноле добавляли 15 мг (0,39 ммоль) боргидрида натрия при охлаждении льдом и эту смесь перемешивали в течение 3 часов при той же самой температуре и в течение 2 часов при комнатной температуре. Затем к реакционной смеси добавляли ацетон и растворитель удаляли при пониженном давлении. Остаток разбавляли этилацетатом и органический слой промывали водой и насыщенным солевым раствором. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/2-0/1) с получением 114 мг (76%) указанного в заголовке соединения.
Пример 159-2
К суспензии 900 мг (3,40 ммоль) соединения, полученного в 15 мл 1,2-дихлорэтана, добавляли 497 мкл (6,81 ммоль) тионилхлорида и эту смесь нагревали с обратным холодильником при кипении в течение 1,5 часов. После охлаждения реакционной смеси растворитель удаляли при пониженном давлении с получением промежуточного соединения хлорангидрида кислоты.
Затем 752 мг (3,57 ммоль) соединения, полученного в примере получения 62, и 949 мкл (6,81 ммоль) триэтиламина добавляли к раствору промежуточного соединения хлорангидрида кислоты, полученного, как указано выше, в 40 мл безводного дихлорметана и эту смесь перемешивали в течение 6 часов при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток перекристаллизовывали из этанола с получением 0,86 г (55%) указанного в заголовке соединения.
Пример 160
N-[3-Хлор-4-(1,4-диокса-8-азаспиро[4.5]декан-8-ил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 565 мг (96%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 30, вместо бензиламина.
Пример 161
N-[3-Хлор-4-(4-оксо-1-пиперидинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 282 мг (61%) получали аналогично примеру 158 с использованием соединения, полученного в примере 160, вместо соединения, полученного в примере 157.
Пример 162
N-[3-Хлор-4-(4-гидрокси-1-пиперидинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 90 мг (90%) получали аналогично примеру 159-1 с использованием соединения, полученного в примере 161, вместо соединения, полученного в примере 158.
Пример 163
1-Циклогексил-N-{3-фтор-4-[4-(метиламино)-1-пиперидинил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 150 мг (0,33 ммоль) соединения, полученного в примере 158, в 3 мл 1,2-дихлорэтана добавляли 68 мкл (0,66 ммоль) триэтиламина (30% раствора в этаноле), 20 мкл уксусной кислоты и 105 мг (0,50 ммоль) триацетоксиборгидрида натрия и эту смесь перемешивали в течение 18 часов при комнатной температуре. Затем к реакционной смеси добавляли насыщенный раствор бикарбоната натрия и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1) с получением 148 мг (97%) указанного в заголовке соединения.
Пример 164
трет-Бутил-1-(2-хлор-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}фенил)-4-пиперидинил(метил)карбамат
К суспензии 200 мг (0,43 ммоль) соединения, полученного в примере 161, в 3 мл 1,2-дихлорэтана добавляли 88 мкл (0,85 ммоль) триэтиламина (30% раствора в этаноле), 15 мкл уксусной кислоты и 135 мг (0,64 ммоль) триацетоксиборгидрида натрия и эту смесь перемешивали в течение 4 часов при комнатной температуре. Затем к реакционной смеси добавляли насыщенный раствор бикарбоната натрия и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растворяли в 4 мл дихлорметана. К этой смеси добавляли 186 мг (0,85 ммоль) трет-бутилдикарбоната и 0,14 мл (1,02 ммоль) триэтиламина и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/1) с получением 236 мг (95%) указанного в заголовке соединения.
Пример 165
N-{3-Хлор-4-[4-(метиламино)-1-пиперидинил]фенил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 211 мг (0,36 ммоль) соединения, полученного в примере 164, в 3 мл дихлорметана добавляли 1,5 мл трифторуксусной кислоты и эту смесь перемешивали в течение 1,5 часов при комнатной температуре. После удаления растворителя при пониженном давлении к остатку добавляли воду и смесь экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 116 мг (66%) указанного в заголовке соединения.
Пример 166
1-Циклогексил-3-метил-N-[транс-4-(4-метил-1-пиперазинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,42 ммоль) соединения, полученного в примере 75, в 3 мл дихлорметана добавляли 93 мкл (0,84 ммоль) N-метилпиперазина, 15 мкл уксусной кислоты и 133 мг (0,63 ммоль) триацетоксиборгидрида натрия и эту смесь перемешивали в течение 3 часов при комнатной температуре. Затем к реакционной смеси добавляли насыщенный раствор бикарбоната натрия и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на щелочном силикагеле (элюент: этилацетат) с получением 103 мг (56%) указанного в заголовке соединения.
Пример 167
1-Циклогексил-3-метил-N-[транс-4-(4-метил-1,4-диазепам-1-ил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 101 мг (53%) получали аналогично примеру 166 с использованием N-метилгомопиперазина вместо N-метилпиперазина.
Пример 168
1-Циклогексил-N-[транс-4-(4-метокси-1-пиперидинил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 30 мг (20%) получали аналогично примеру 166 с использованием соли п-толуолсульфоновой кислоты 4-метоксипиперидина вместо N-метилпиперазина.
Пример 169
Бензил-4-(транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1,4-диазепам-1-карбоксилат
Указанное в заголовке соединение 252 мг (78%) получали аналогично примеру 166 с использованием бензил-1-гомопиперазинкарбоксилата вместо N-метилпиперазина.
Пример 170
1-Циклогексил-N-[транс-4-(1,4-диазепам-1-ил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Смешанный раствор 219 мг (0,38 ммоль) соединения, полученного в примере 169, в 3 мл 30% HBr/уксусная кислота перемешивали в течение 3 часов при комнатной температуре. Затем реакционную смесь нейтрализовали 4 М водным раствором гидроксида натрия и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на щелочном силикагеле (элюент: дихлорметан/метанол = 30/1) с получением 126 мг (75%) указанного в заголовке соединения.
Пример 171
N-[транс-4-(4-Ацетил-1,4-диазепам-1-ил)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 96 мг (99%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 170, и уксусного ангидрида вместо соединения, полученного в примере получения 2, и ацетилхлорида соответственно.
Пример 172
1-Циклогексил-N-{транс-4-[(2-метоксиэтил)(метил)амино]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 131 мг (73%) получали аналогично примеру 166 с использованием N-(2-метоксиэтил)метиламина вместо N-метилпиперазина.
Пример 173
1-Циклогексил-N-{цис-4-[(2-метоксиэтил)(метил)амино]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 34 мг (19%) получали в виде побочного продукта в примере 172.
Пример 174
1-Циклогексил-N-[транс-4-(1,4-диокса-8-азаспиро[4.5]декан-8-ил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 664 мг (98%) получали аналогично примеру 166 с использованием 1,4-диокса-8-азаспиро[4.5]декана вместо N-метилпиперазина.
Пример 175
1-Циклогексил-3-метил-N-[транс-4-(4-оксо-1-пиперидинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Смесь 384 мг (0,79 ммоль) соединения, полученного в примере 174, в 6 мл 6 М водного раствора HCl перемешивали в течение 9 дней при комнатной температуре. Затем реакционную смесь нейтрализовали насыщенным водным раствором бикарбоната натрия и эту смесь экстрагировали хлороформом. Органический слой промежуточного соединения промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 317 мг (91%) указанного в заголовке соединения.
Пример 176
1-Циклогексил-N-[транс-4-(4-гидрокси-1-пиперидинил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 102 мг (выход количественный) получали аналогично примеру 159 с использованием соединения, полученного в примере 175, вместо соединения, полученного в примере 158.
Пример 177
1-Циклогексил-N-{транс-4-[(2R,6S)-2,6-диметилморфолинил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 126 мг (66%) получали аналогично примеру 166 с использованием цис-2,6-диметилморфолина вместо N-метилпиперазина.
Пример 178
1-Циклогексил-N-{цис-4-[(2R,6S)-2,6-диметилморфолинил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 50 мг (26%) получали в виде побочного продукта в примере 177.
Пример 179
1-Циклогексил-3-метил-N-{транс-4-[4-(метиламино)-1-пиперидинил]циклогексил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 182 мг (89%) получали аналогично примеру 166 с использованием соединения, полученного в примере 175, и метиламина (30% раствора в этаноле) вместо соединения, полученного в примере 75, и N-метилпиперазина соответственно.
Пример 180
N-(транс-4-{4-[Ацетил(метил)амино]-1-пиперидинил}циклогексил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 35 мг (72%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 179, и уксусного ангидрида вместо соединения, полученного в примере получения 2, и ацетилхлорида соответственно.
Пример 181
1-Циклогексил-N-{транс-4-[4-(диметиламино)-1-пиперидинил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К смешанному раствору 70 мг (0,15 ммоль) соединения, полученного в примере 179, в 2 мл этанола и 2 мл воды добавляли 30 мг параформальдегида и 1 мл муравьиной кислоты и эту смесь нагревали с обратным холодильником при кипении в течение 6 часов. К реакционной смеси добавляли дополнительно 30 мг параформальдегида и 1 мл муравьиной кислоты и смесь нагревали с обратным холодильником при кипении в течение 18 часов. Затем реакционную смесь охлаждали до комнатной температуры и нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток перекристаллизовывали из этилацетата с получением 32 мг (44%) указанного в заголовке соединения.
Пример 182
трет-Бутил-1-(транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиперидинилкарбамат
Указанное в заголовке соединение 176 мг (58%) получали аналогично примеру 166 с использованием трет-бутил-4-пиперидинкарбамата вместо N-метилпиперазина.
Пример 183
трет-Бутил-1-(цис-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиперидинилкарбамат
Указанное в заголовке соединение 94 мг (31%) получали в виде побочного продукта в примере 182.
Пример 184
N-[транс-4-(4-Амино-1-пиперидинил)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 82 мг (60%) получали аналогично примеру 165 с использованием соединения, полученного в примере 182, вместо соединения, полученного в примере 164.
Пример 185
N-[цис-4-(4-Амино-1-пиперидинил)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 63 мг (95%) получали аналогично примеру 165 с использованием соединения, полученного в примере 183, вместо соединения, полученного в примере 164.
Пример 186
трет-Бутил-4-(транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1-пиперазинкарбоксилат
Указанное в заголовке соединение 218 мг (74%) получали аналогично примеру 166 с использованием трет-бутил-1-пиперазинкарбоксилата вместо N-метилпиперазина.
Пример 187
трет-Бутил-4-(цис-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1-пиперазинкарбоксилат
Указанное в заголовке соединение 72 мг (14%) получали в виде побочного продукта в примере 186.
Пример 188
1-Циклогексил-3-метил-N-[транс-4-(1-пиперазинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 146 мг (86%) получали аналогично примеру 165 с использованием соединения, полученного в примере 186, вместо соединения, полученного в примере 164.
Пример 189
1-Циклогексил-3-метил-N-[цис-4-(1-пиперазинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 51 мг (97%) получали аналогично примеру 165 с использованием соединения, полученного в примере 187, вместо соединения, полученного в примере 164.
Пример 190
N-[транс-4-(4-Ацетил-1-пиперазинил)циклогексил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 81 мг (95%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 188, вместо соединения, полученного в примере получения 2.
Пример 191
Гемифумарат 1-циклогексил-N-[3-фтор-4-(4-метил-1,4-диазепам-1-ил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К раствору 143 мг (0,305 ммоль)) соединения, полученного в примере 144, в 2 мл этанола добавляли 38,9 мг (0,335 ммоль) фумаровой кислоты и полученные осадки собирали с получением 139 мг (86%) указанного в заголовке соединения.
Пример 192
5-Метил-2-тетрагидро-2Н-пиран-4-ил-2,4-дигидро-3Н-пиразол-3-он
Указанное в заголовке соединение 6,93 г (58%) получали аналогично примеру 1 с использованием 4-тетрагидропиранилгидразина вместо HCl-соли циклогексилгидразина.
Пример 193
5-Хлор-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-пиразол-4-карбоальдегид
Раствор смеси 6,87 г (3,77 ммоль) соединения, полученного в примере 192, и 14,1 мл (150,8 ммоль) оксихлорида фосфора перемешивали в течение 1 часа при 110ºС. После охлаждения реакционной смеси до комнатной температуры смесь постепенно добавляли к охлажденным льдом 40 мл N,N-диметилформамида и эту смесь перемешивали в течение 1 часа при комнатной температуре и в течение 3 часов при 90ºС. Затем реакционную смесь охлаждали льдом, разбавляли этилацетатом и рН реакционной смеси доводили до 4 добавлением 2 н. водного раствора NaOH. Смесь экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1) с получением 4,64 г (54%) указанного в заголовке соединения.
Пример 194
Этил-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксилат
К раствору 16,54 мл (0,151 моль) этилтиогликолата в 300 мл тетрагидрофурана добавляли 6,03 г (0,151 моль) гидрида натрия (60% в масле) в виде небольших порций и смесь перемешивали в течение 3 минут. Затем 31,36 г (0,137 моль) соединения, полученного в примере 193, добавляли к этой смеси сразу же и эту смесь перемешивали в течение 1 часа. К этой смеси дополнительно добавляли 6,03 г (0,151 моль) гидрида натрия (60% в масле) в виде небольших порций при 0ºС и эту смесь перемешивали в течение 1 часа. Реакционную смесь разбавляли этилацетатом и органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1-2/1) с получением 30,1 г (76%) указанного в заголовке соединения.
Пример 195
3-Метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоновая кислота
Указанное в заголовке соединение 4,26 г (99%) получали аналогично примеру 6 с использованием соединения, полученного в примере 194, вместо соединения, полученного в примере 5.
Пример 196
3-Метил-N-[4-(4-метил-1-пиперазинил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 166 мг (84%) получали аналогично примеру 7 с использованием 4-(4-метил-1-пиперазинил)анилина и соединения, полученного в примере 194, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 197
N-[3-Фтор-4-(4-метил-1-пиперазинил)фенил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 214 мг (83%) получали аналогично примеру 7 с использованием [3-фтор-4-(4-метил-1-пиперазинил)анилина и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 198
1-Циклогексил-3-метил-N-[4-(4-морфолинилметил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 173 мг (87%) получали аналогично примеру 7 с использованием 4-(4-морфолинилметил)анилина вместо бензиламина.
Пример 199
Фумарат 1-циклогексил-3-метил-N-[4-(4-морфолинилметил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида
41,7 мг (0,59 ммоль) фумаровой кислоты добавляли к смеси 150 мг (0,432 ммоль) соединения, полученного в примере 198, в 1 мл этанола и 2 мл диэтилового эфира дополнительно добавляли к этой смеси. Затем эту смесь перемешивали в течение ночи и образующиеся осадки собирали фильтрованием с получением 112 мг (59%) указанного в заголовке соединения.
Пример 200
1-Циклогексил-N-{4-[2-(диметиламино)этил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 83 мг (75%) получали аналогично примеру 7 с использованием 4-[(2-диметиламино)этил]анилина вместо бензиламина.
Пример 201
1-Циклогексил-3-метил-N-{4-[2-(4-морфолинил)этил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 140 мг (68%) получали аналогично примеру 7 с использованием соединения, полученного в примере 32, вместо бензиламина.
Пример 202
1-Циклогексил-3-метил-N-{4-[(3-метил-2,5-диоксо-1-имидазолидинил)метил]фенил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 185 мг (88%) получали аналогично примеру 7 с использованием соединения, полученного в примере 34, вместо бензиламина.
Пример 203
1-Циклогексил-3-метил-N-[4-(3-метил-2,5-диоксо-1-имидазолидинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 116 мг (57%) получали аналогично примеру 7 с использованием 4-(3-метил-2,5-диоксо-1-имидазолидинил)анилина вместо бензиламина.
Пример 204
Метил-транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоксилат
Указанное в заголовке соединение 2,18 г (95%) получали аналогично примеру 7 с использованием метил-транс-4-аминоциклогексанкарбоксилата вместо бензиламина.
Пример 205
4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоновая кислота
Указанное в заголовке соединение 1,48 г (выход количественный) получали аналогично примеру 41 с использованием соединения, полученного в примере 204, вместо соединения, полученного в примере 40.
Пример 206
1-Циклогексил-N-[4-(гидроксиметил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 200 мг (0,496 ммоль) соединения, полученного в примере 204, в 5 мл тетрагидрофурана добавляли 43 мг (1,98 ммоль) боргидрида лития и эту смесь перемешивали в течение 1,5 часов при нагревании при 70ºС. Реакционную смесь охлаждали до комнатной температуры, к смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток перекристаллизовывали из смеси изопропанол/гексан (1/1) с получением 76 мг (41%) указанного в заголовке соединения.
Пример 207
1-Циклогексил-3-метил-N-{4-[(4-метил-1-пиперазинил)карбонил]циклогексил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 200 мг (0,513 ммоль) соединения, полученного в примере 205, в 5 мл дихлорметана и 1 мл N,N-диметилформамида добавляли 51,3 мкл (0,462 ммоль) N-метилпиперазина и 750 мг PS-карбодиимида (Argonaut Co.) и эту смесь перемешивали в течение ночи при комнатной температуре. Этот реагент удаляли фильтрованием и фильтрат концентрировали с получением 36 мг (15%) указанного в заголовке соединения.
Пример 208
1-Циклогексил-N-{4-[(диметиламино)карбонил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 18 мг (8%) получали аналогично примеру 207 с использованием 2 М диметиламина в тетрагидрофуране вместо N-метилпиперазина.
Пример 209
N-(4-Цианоциклогексил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 189 мг (84%) получали аналогично примеру 7 с использованием соединения, полученного в примере 36, вместо бензиламина.
Пример 210
трет-Бутил-2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этил(метил)карбамат
Указанное в заголовке соединение 1,89 г (99%) получали аналогично примеру 7 с использованием [2-(N-Boc-N-метил)амино]этиламина вместо бензиламина.
Пример 211
2HCl-соль 1-циклогексил-3-метил-N-[2-(метиламино)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 1,71 г (выход количественный) получали аналогично примеру получения 4 с использованием соединения, полученного в примере 210, вместо соединения, полученного в примере 3.
Пример 212
N-{2-[Ацетил(метил)амино]этил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,381 ммоль) соединения, полученного в примере 211, в 5 мл дихлорметана добавляли 54 мкл (0,572 ммоль) уксусного ангидрида и 123 мкл (1,53 ммоль) пиридина и эту смесь перемешивали в течение 1 часа при комнатной температуре. Затем к реакционной смеси дополнительно добавляли 54 мкл (0,572 ммоль) уксусного ангидрида и 123 мкл (1,53 ммоль) пиридина и эту смесь перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли воду, смесь экстрагировали дихлорметаном и органический слой сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 30/1) с получением 120 мг (87%) указанного в заголовке соединения.
Пример 213
HCl-соль 1-циклогексил-3-метил-N-{2-[метил(метилсульфонил)амино]этил}-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К раствору 150 мг (0,381 ммоль) соединения, полученного в примере 211, в 5 мл дихлорметана добавляли 44 мкл (0,572 ммоль) метансульфонилхлорида и 212 мкл (1,53 ммоль) триэтиламина и эту смесь перемешивали в течение 1 часа при комнатной температуре. После реакции к реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) и элюат обрабатывали 4N-HCl/диоксан с получением 128 мг (77%) указанного в заголовке соединения.
Пример 214
Этил-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинил)ацетат
К раствору 250 мг (0,722 моль) соединения, полученного в примере 134, в 6 мл дихлорметана добавляли 88 мкл (0,794 ммоль) этилбромацетата и 151 мкл (1,082 ммоль) триэтиламина и эту смесь перемешивали в течение 3 дней при комнатной температуре. Затем к реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 237 мг (76%) указанного в заголовке соединения.
Пример 215
(4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинил)уксусная кислота
Указанное в заголовке соединение 176 мг (86%) получали аналогично примеру 41 с использованием соединения, полученного в примере 214, вместо соединения, полученного в примере 40.
Пример 216
Этил-2-(4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинил)-2-метилпропаноат
К раствору 252 мг (0,727 ммоль) соединения, полученного в примере 134, в 5 мл N,N-диметилформамида добавляли 128 мкл (0,873 ммоль) этил-2-бромизобутирата и 152 мкл (1,09 ммоль) триэтиламина и эту смесь перемешивали в течение ночи при 70ºС. Затем к реакционной смеси добавляли воду и эту смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 115 мг (34%) указанного в заголовке соединения.
Пример 217
2-(4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинил)-2-метилпропановая кислота
Указанное в заголовке соединение 65 мг (69%) получали аналогично примеру 41 с использованием соединения, полученного в примере 216, вместо соединения, полученного в примере 40.
Пример 218
N-[4-(4-Гидрокси-1-пиперидинил)фенил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 198 мг (90%) получали аналогично примеру 7 с использованием 1-(4-аминофенил)-4-пиперидинола и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 219
1-Циклогексил-N-[2-(5,5-диметил-2,4-диоксо-1,3-оксазолидин-3-ил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,488 моль) соединения, полученного в примере 122, в 5 мл тетрагидрофурана добавляли 75,6 мг (0,586 ммоль) 5,5-диметилоксазолидиндиона, 154 мг (0,586 ммоль) трифенилфосфина и 267 мкл (0,586 ммоль) диэтилазодикарбоксилата (40% раствора в толуоле) и эту смесь перемешивали в течение 2 часов при комнатной температуре. После реакции к реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/ацетон = 2/1 для первого испытания и гексан/этилацетат = 2/1 для второго испытания) с получением 133 мг (65%) указанного в заголовке соединения.
Пример 220
1-Циклогексил-3-метил-N-{[метил-(4-морфолинилкарбонил)амино]этил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 164 мг (99%) получали аналогично примеру 214 с использованием соединения, полученного в примере 211, и 4-морфолинилкарбонилхлорида вместо соединения, полученного в примере 134, и этилбромацетата соответственно.
Пример 221
1-Циклогексил-N-{2-[[(диметиламино)карбонил](метил)амино]этил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 119 мг (80%) получали аналогично примеру 214 с использованием соединения, полученного в примере 211, и диметиламинокарбонилхлорида вместо соединения, полученного в примере 134, и этилбромацетата соответственно.
Пример 222
Метил-2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этил(метил)карбамат
К раствору 150 мг (0,381 ммоль) соединения, полученного в примере 211, в 5 мл дихлорметана и 5 мл воды добавляли 158 мг (1,14 ммоль) карбоната калия и 44 мкл (0,572 ммоль) этилхлоркарбоната и эту смесь перемешивали в течение ночи при комнатной температуре. Затем к реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 120 мг (83%) указанного в заголовке соединения.
Пример 223
1-Циклогексил-N-{2-[(метоксиацетил)(метил)амино]этил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 124 мг (83%) получали аналогично примеру 214 с использованием соединения, полученного в примере 211, и метоксиацетилхлорида вместо соединения, полученного в примере 134, и этилбромацетата соответственно.
Пример 224
1-Циклогексил-N-{2-[гликолоил(метил)амино]этил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,381 ммоль) соединения, полученного в примере 211, в 6 мл дихлорметана добавляли 34,8 мг (0,458 ммоль) гидроксиуксусной кислоты, 186 мкл (1,335 ммоль) триэтиламина, 61,8 мг (0,458 ммоль) N-гидроксибензотриазола и 80,4 мг (0,419 ммоль) 1-этил-3-(3′-диметиламинопропил)карбодиимида и эту смесь перемешивали в течение 3 часов при комнатной температуре. Затем к реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 87 мг (60%) указанного в заголовке соединения.
Пример 225
1-Циклогексил-N-(4-{[(2-гидроксиэтил)(метил)амино]карбонил}циклогексил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 128 мг (74%) получали аналогично примеру 224 с использованием соединения, полученного в примере 205, и 2-N-метиламиноэтанола вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 226
Метил-(1S,3S)-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклопентанкарбоксилат
Указанное в заголовке соединение 565 мг (97%) получали аналогично примеру 7 с использованием метил-(1S,3S)-3-аминоциклопентанкарбоксилата вместо бензиламина.
Пример 227
(1S,3S)-3-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклопентанкарбоновая кислота
Указанное в заголовке соединение 542 мг (выход количественный) получали аналогично примеру 41 с использованием соединения, полученного в примере 226, вместо соединения, полученного в примере 40.
Пример 228
1-Циклогексил-3-метил-N-[2-(4-метил-2,3-диоксо-1-пиперазинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 88 мг (35%) получали аналогично примеру 7 с использованием соединения, полученного в примере 37, вместо бензиламина.
Пример 229
1-Циклогексил-N-{(1S,3S)-3-[(диметиламино)карбонил]циклопентил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 176 мг (91%) получали аналогично примеру 224 с использованием соединения, полученного в примере 227, и раствора 2 М диметиламин/тетрагидрофурана вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 230
HCl-соль 1-циклогексил-N-{(1S,3S)-3-[(диметиламино)карбонил]циклопентил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 137 мг (84%) получали аналогично примеру 125 с использованием соединения, полученного в примере 229, вместо соединения, полученного в примере 124.
Пример 231
Метил-(1R,3R)-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклопентанкарбоксилат
Указанное в заголовке соединение 772 мг (99%) получали аналогично примеру 7 с использованием метил-(1R,3R)-3-аминоциклопентанкарбоксилата вместо бензиламина.
Пример 232
(1R,3R)-3-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклопентанкарбоновая кислота
Указанное в заголовке соединение 822 мг (выход количественный) получали аналогично примеру 41 с использованием соединения, полученного в примере 231, вместо соединения, полученного в примере 40.
Пример 233
1-Циклогексил-N-{(1R,3R)-3-[(диметиламино)карбонил]циклопентил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 153 мг (79%) получали аналогично примеру 224 с использованием соединения, полученного в примере 232, и раствора 2 М диметиламин/тетрагидрофуран вместо соединения, полученного в примере 221, и гидроксиуксусной кислоты соответственно.
Пример 234
HCl-соль 1-циклогексил-N-{(1R,3R)-3-[(диметиламино)карбонил]циклопентил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 80 мг (54%) получали аналогично примеру 125 с использованием соединения, полученного в примере 233, вместо соединения, полученного в примере 124.
Пример 235
1-Циклогексил-N-{1-[(диметиламино)карбонил]-4-пиперидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 241 мг (95%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 39, вместо бензиламина.
Пример 236
1-Циклогексил-3-метил-N-[4-(4-морфолинилкарбонил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 236 мг (96%) получали аналогично примеру 224 с использованием соединения, полученного в примере 205, и морфолина вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 237
1-Циклогексил-3-метил-N-{4-[(метиламино)карбонил]циклогексил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 122 мг (79%) получали аналогично примеру 224 с использованием соединения, полученного в примере 205, и метиламина (30% раствора в этаноле) вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 238
1-Циклогексил-N-{4-[(циклопропиламино)карбонил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 115 мг (64%) получали аналогично примеру 224 с использованием соединения, полученного в примере 205, и циклопропиламина вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 239
1-Циклогексил-N-{4-[(4-гидрокси-1-пиперидинил)карбонил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 157 мг (86%) получали аналогично примеру 224 с использованием соединения, полученного в примере 205, и 4-гидроксипиперидина вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 240
1-Циклогексил-N-{1-[(диметиламино)сульфонилкарбонил]-4-пиперидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 257 мг (99%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 41, вместо бензиламина.
Пример 241
трет-Бутил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинкарбоксилат
Указанное в заголовке соединение 2,57 г (98%) получали аналогично примеру 7 с использованием 4-амино-1-Вос-пиперидина вместо бензиламина.
Пример 242
Ди-HCl-соль 1-циклогексил-3-метил-N-(4-пиперидинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 2,29 г (97%) получали аналогично примеру получения 4 с использованием соединения, полученного в примере 241, вместо соединения, полученного в примере получения 3.
Пример 243
N-[(3S)-1-Бензилпирролидинил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 2,32 г (97%) получали аналогично примеру 7 с использованием (3S)-1-бензил-3-аминопирролидина вместо бензиламина.
Пример 244
1-Циклогексил-3-метил-N-[(3S)-пирролидинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 2,26 г (5,36 ммоль) соединения, полученного в примере 243, в 50 мл 1,2-дихлорэтана добавляли 721 мкл (6,68 ммоль) 1-хлорэтилхлорформиата и эту смесь нагревали с обратным холодильником при кипении в течение 2 часов. Затем к этой смеси дополнительно добавляли 289 мкл (2,67 ммоль) 1-хлорэтилхлорформиата и эту смесь нагревали с обратным холодильником при кипении в течение 1 часа при перемешивании. Растворитель удаляли при пониженном давлении, к остатку добавляли 50 мл метанола и эту смесь нагревали с обратным холодильником при кипении в течение 30 минут. Растворитель удаляли при пониженном давлении, остаток обрабатывали насыщенным водным раствором бикарбоната натрия и смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1) с получением 0,83 г (47%) указанного в заголовке соединения.
Пример 245
1-Циклогексил-N-{(3S)-1-[(диметиламино)карбонил]пирролидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 155 мг (85%) получали аналогично примеру 214 с использованием соединения, полученного в примере 244, и диметиламинокарбонилхлорида вместо соединения, полученного в примере 134, и этилбромацетата соответственно.
Пример 246
HCl-соль 1-циклогексил-N-{(3S)-1-[(диметиламино)карбонил]пирролидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 155 мг (85%) получали аналогично примеру 125 с использованием соединения, полученного в примере 245, вместо соединения, полученного в примере 124.
Пример 247
1-Циклогексил-N-{4-[(2,5-диоксо-1-имидазолидинил)метил]циклогексил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 136 мг (0,362 ммоль) соединения, полученного в примере 206, в 10 мл тетрагидрофурана добавляли 72 мг (0,724 ммоль) гидантоина, 135 мкл (0,543 ммоль) три-н-бутилфосфина и 1,1′-азобис(N,N-диметилформамида) и эту смесь перемешивали в течение 3 часов при 60ºС. Реакционную смесь охлаждали до комнатной температуры, обрабатывали водой и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат) с получением 96 мг (58%) указанного в заголовке соединения.
Пример 248
Этил-1-[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-4-пиперидинкарбоксилат
Указанное в заголовке соединение 2,73 г (98%) получали аналогично примеру 7 с использованием изонипекотиновой кислоты вместо бензиламина.
Пример 249
1-[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-4-пиперидинкарбоновая кислота
Указанное в заголовке соединение 1,1 г (99%) получали аналогично примеру 41 с использованием соединения, полученного в примере 248, вместо соединения, полученного в примере 40.
Пример 250
1-[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбонил]-N-метил-4-пиперидинкарбоксамид
Указанное в заголовке соединение 195 мг (94%) получали аналогично примеру 224 с использованием метиламина (30% раствора в этаноле) и соединения, полученного в примере 249, вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 251
Этил-(3S)-1-[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-3-пиперидинкарбоксилат
Указанное в заголовке соединение 2,29 г (выход количественный) получали аналогично примеру 7 с использованием этил-(R)-нипекотиновой кислоты вместо бензиламина.
Пример 252
N-[(6S,7aS)-1,3-Диоксогексагидро-1Н-пирроло[1,2-c]имидазол-6-ил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 595 мг (74%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 45, вместо бензиламина.
Пример 253
HCl-соль N-[(6S,7aS)-1,3-диоксогексагидро-1Н-пирроло[1,2-c]имидазол-6-ил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К раствору 150 мг (0,374 ммоль) соединения, полученного в примере 252, в 10 мл тетрагидрофурана добавляли 30 мкл (0,747 ммоль) метанола, 122 мг (0,476 ммоль) трифенилфосфина и 213 мкл (0,467 ммоль) диэтилазодикарбоксилата (40% раствора в толуоле) и эту смесь перемешивали в течение 1 часа при комнатной температуре. Затем растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1 для первого испытания; дихлорметан/этилацетат = 1/1 для второго испытания) и полученный продукт превращали в HCl-соль обработкой 100 мкл раствора 4 н. HCl/диоксан и перекристаллизовывали из смеси метанол-этанол (1/1) с получением 23 мг (15%) указанного в заголовке соединения.
Пример 254
(±)-{1-[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]-3-пиперидинил}метанол
Указанное в заголовке соединение 595 мг (74%) получали аналогично примеру 7 с использованием (±)-3-гидроксиметилпиперидина вместо бензиламина.
Пример 255
N-{4-[(Диметиламино)карбонил]фенил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 123 мг (80%) получали аналогично примеру 7 с использованием 4-(диметиламинокарбонил)анилина вместо бензиламина.
Пример 256
1-Циклогексил-3-метил-N-[6-(2-оксо-1-имидазолидинил)-3-пиридинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 199 мг (83%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 46, вместо бензиламина.
Пример 257
1-Циклогексил-N-[(1S,3S)-3-(гидроксиметил)циклопентил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 462 мг (выход количественный) получали аналогично примеру 206 с использованием соединения, полученного в примере 226, вместо соединения, полученного в примере 204.
Пример 258
1-Циклогексил-N-{(1S,3S)-3-[(2,5-диоксо-1-имидазолидинил)метил]циклопентил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 74 мг (40%) получали аналогично примеру 247 с использованием соединения, полученного в примере 257, вместо соединения, полученного в примере 206.
Пример 259
1-Циклогексил-N-[4-(2,5-диоксо-1-имидазолидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 54 мг (27%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 47, вместо бензиламина.
Пример 260
3-Метил-N-[4-(3-метил-2,5-диоксо-1-имидазолидинил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 104 мг (61%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 48, и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 261
3-Метил-N-[6-(2-оксо-1-имидазолидинил)-3-пиперидинил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 101 мг (63%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 46, и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 262
1-Циклогексил-N-{4-[(3R)-3-гидроксипирролидинил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 308 мг (64%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 49, вместо бензиламина.
Пример 263
1-Циклогексил-N-{3-фтор-4-[(3R)-3-гидроксипирролидинил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 397 мг (79%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 51, вместо бензиламина.
Пример 264
1-Циклогексил-N-{3-[(4-гидрокси-1-пиперидинил)сульфонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 80 мг (35%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 53, вместо бензиламина.
Пример 265
N-{4-[4-{[трет-Бутил(диметил)силил]окси}-1-пиперидинил]сульфонил}фенил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 243 мг (69%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 56, вместо бензиламина.
Пример 266
1-Циклогексил-N-{4-[(4-гидрокси-1-пиперидинил)сульфонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 231 мг (0,374 ммоль) соединения, полученного в примере 265, в 5 мл тетрагидрофурана добавляли 562 мкл (0,562 ммоль) тетрабутиламмонийфторида (1 М раствора в тетрагидрофуране) и эту смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь обрабатывали этилацетатом и органический слой промывали водой, насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/2) с получением 176 мг (94%) указанного в заголовке соединения.
Пример 267
1-Циклогексил-N-[4-(2-гидроксиэтил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 139 мг (64%) получали аналогично примеру 7 с использованием 4-аминофенетилового спирта вместо бензиламина.
Пример 268
N-[3-Фтор-4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 161 мг (96%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 62, и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 269
1-Циклогексил-3-метил-N-[4-(4-метил-1-пиперазинил)-3-(трифторметил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 229 мг (80%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 58, вместо бензиламина.
Пример 270
1-Циклогексил-3-метил-N-[транс-4-(2-оксо-1,3-оксазолидин-3-ил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 150 мг (0,416 ммоль) соединения, полученного в примере 132, в 2,5 мл тетрагидрофурана добавляли 52 мкл (0,050 ммоль) 2-хлорэтилхлорформиата и 87 мкл (0,624 ммоль) триэтиламина и эту смесь перемешивали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением промежуточного соединения уретана.
Затем к раствору смеси промежуточного соединения уретана, полученного, как описано выше, в 2 мл этанола и 4 мл тетрагидрофурана добавляли 2 мл 4М водного раствора NaOH и эту смесь перемешивали в течение 40 часов при комнатной температуре. Растворитель удаляли при пониженном давлении, остаток обрабатывали водой и смесь экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 10/1) с получением 180 мг (выход количественный) указанного в заголовке соединения.
Пример 271
1-Циклогексил-3-метил-N-[транс-4-(2-оксо-1-имидазолидинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 150 мг (0,416 ммоль) соединения, полученного в примере 132, в 4 мл тетрагидрофурана добавляли 71 мкл (0,832 ммоль) 2-хлорэтилизоцианата и эту смесь перемешивали в течение 3,5 часов при комнатной температуре. К реакционной смеси добавляли 2 мл 1 М водного раствора NaOH и смесь перемешивали. Затем к этой смеси дополнительно добавляли 5 мл 4 М водного раствора NaOH и 15 мл тетрагидрофурана и эту смесь перемешивали в течение 2 часов. Затем к этой реакционной смеси добавляли 15-краун-5 и смесь перемешивали в течение 43 часов при комнатной температуре, затем к реакционной смеси добавляли 5 мл этанола и перемешивали в течение 6 часов при 80ºС. Растворитель удаляли при пониженном давлении и остаток обрабатывали водой. Смесь экстрагировали хлороформом и органический слой промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 10/1) с получением 106 мг (55%) указанного в заголовке соединения.
Пример 272
4-[(транс-4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)амино]-4-оксобутановая кислота
К суспензии 150 мг (0,416 ммоль) соединения, полученного в примере 132, в 5 мл ксилола добавляли 62 мг (0,624 ммоль) янтарного ангидрида и эту смесь нагревали с обратным холодильником при кипении в течение 5 часов. Растворитель удаляли при пониженном давлении и остаток обрабатывали эфиром. Полученные осадки собирали с получением 178 мг (93%) указанного в заголовке соединения.
Пример 273
1-Циклогексил-N-[транс-4-(2,5-диоксо-1-пирролидинил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Смесь 141 мг (0,306 ммоль) соединения, полученного в примере 272, 2 мл уксусного ангидрида и 33 мг ацетата натрия перемешивали в течение 3 часов при 60ºС и в течение 14 часов при 80ºС, затем к реакционной смеси дополнительно добавляли 2 мл уксусного ангидрида и эту смесь перемешивали в течение 6 часов при 100ºС. После реакции к реакционной смеси добавляли ледяную воду и смесь нейтрализовали добавлением насыщенного водного раствора бикарбоната натрия и экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток обрабатывали этанолом с получением 59 мг (49%) указанного в заголовке соединения
Пример 274
1-Циклогексил-N-[транс-4-(1,1-диоксид-2-изотиазолидинил)циклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,416 ммоль) соединения, полученного в примере 132, в 10 мл дихлорметана добавляли 87 мкл (0,624 ммоль) триэтиламина и 61 мкл (0,50 ммоль) 3-хлорпропансульфонилхлорида и эту смесь перемешивали в течение 1,5 часов при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением промежуточного соединения сульфонамида.
Затем к смешанному раствору промежуточного соединения сульфонамида, полученного, как описано выше, в 5 мл этанола добавляли 2 мл 4 М водного раствора NaOH и эту смесь перемешивали в течение 1,5 часов при комнатной температуре и в течение 3 часов при 80ºС. Реакционную смесь охлаждали и обрабатывали водой экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток перекристаллизовывали из этанола с получением 112 мг (58%) указанного в заголовке соединения.
Пример 275
Бензил-[{[(транс-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)амино]карбонил}(метил)амино]ацетат
К раствору 200 мг (0,555 ммоль) соединения, полученного в примере 132, в 4 мл тетрагидрофурана добавляли 66 мг (0,22 ммоль) трифосгена и 232 мкл (1,66 ммоль) триэтиламина и эту смесь перемешивали в течение 1 часа при комнатной температуре. Затем к реакционной смеси добавляли 195 мг (0,55 ммоль) саркозина бензилового эфира п-толуолсульфокислоты и 77 мкл (0,55 ммоль) триэтиламина и эту смесь перемешивали в течение 5 часов при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом, органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 15/1) с получением 227 мг (72%) указанного в заголовке соединения.
Пример 276
1-Циклогексил-3-метил-N-[транс-4-(3-метил-2,5-диоксо-1-имидазолидинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 207 мг (0,366 ммоль) соединения, полученного в примере 275, в 5 мл этанола добавляли 0,5 мл 6 М водного раствора HCl и смесь нагревали с обратным холодильником при кипении в течение 4 часов. После реакции эту смесь нейтрализовали добавлением насыщенного водного раствора бикарбоната натрия и экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 15/1) с получением 169 мг (выход количественный) указанного в заголовке соединения.
Пример 277
1-Циклогексил-3-метил-N-[2-(3-метил-2,5-диоксо-1-имидазолидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,487 ммоль) соединения, полученного в примере 122, и 55,6 мг (0,487 ммоль) 1-метилгидантоина, 4 мл тетрагидрофурана добавляли 121 мкл (0,487 ммоль) н-бутилфосфина и 83,8 мг (0,487 ммоль) 1,1′-азо-бис(N,N-диметилформамида) и эту смесь перемешивали в течение 5 часов при комнатной температуре. Реакционную смесь обрабатывали водой и экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат) с получением 113 мг (58%) указанного в заголовке соединения.
Пример 278
1-Циклогексил-3-метил-N-[3-(3-метил-2,5-диоксо-1-имидазолидинил)пропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 147 мг (75%) получали аналогично примеру 277 с использованием соединения, полученного в примере 123, вместо соединения, полученного в примере 122.
Пример 279
1-Циклогексил-N-[транс-[4-({[(2-гидроксиэтил)(метил)амино]карбонил}аминоциклогексил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 200 мг (0,555 ммоль) соединения, полученного в примере 132, в 4 мл тетрагидрофурана добавляли 66 мг (0,22 ммоль) трифосгена и 232 мкл (1,66 ммоль) триэтиламина и эту смесь перемешивали в течение 1 часа при комнатной температуре. Затем к реакционной смеси добавляли 54 мкл (0,66 ммоль) 2-(метиламино)этанола и эту смесь перемешивали в течение 3 часов при комнатной температуре. Реакционную смесь обрабатывали водой и экстрагировали хлороформом, промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 15/1) с получением 190 мг (74%) указанного в заголовке соединения.
Пример 280
1-Циклогексил-3-метил-N-[транс-[4-(3-метил-2-оксо-1-имидазолидинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 187 мг (0,519 ммоль) соединения, полученного в примере 279, в 6 мл тетрагидрофурана добавляли 140 мг (1,25 ммоль) трет-бутоксида калия и эту смесь охлаждали до 0ºС. Затем к реакционной смеси добавляли постепенно раствор 119 мг (0,623 ммоль) п-толуолсульфонилхлорида в 2 мл тетрагидрофурана и эту смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь обрабатывали водой и экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 20/1) с получением 115 мг (64%) указанного в заголовке соединения.
Пример 281
Этил-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}пропаноат
Указанное в заголовке соединение 716 мг (98%) получали аналогично примеру 7 с использованием HCl-соли этилового эфира  -аланина вместо бензиламина. -аланина вместо бензиламина.
Пример 282
N-[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]- -аланин -аланин
Указанное в заголовке соединение 620 мг (99%) получали аналогично примеру 41 с использованием соединения, полученного в примере 281, вместо соединения, полученного в примере 40.
Пример 283
трет-Бутил-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}ацетат
Указанное в заголовке соединение 663 мг (88%) получали аналогично примеру 7 с использованием HCl-соли трет-бутилового эфира глицина вместо бензиламина.
Пример 284
{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}уксусная кислота
Смешанный раствор 637 мг (1,68 ммоль) соединения, полученного в примере 283, и 5 мл смеси 4 М HCl/диоксан перемешивали в течение 5 часов при комнатной температуре и после реакции растворитель удаляли при пониженном давлении. Остаток обрабатывали водой и экстрагировали хлороформом, органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 556 мг (выход количественный) указанного в заголовке соединения.
Пример 285
1-Циклогексил-3-метил-N-[3-(4-морфолинил)-3-оксопропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Суспензию 85 мг (0,253 ммоль) соединения, полученного в примере 282, 246 мг (0,337 ммоль) PS-карбодиимида (Argonaut Co.) и 39 мг (0,287 ммоль) 1-гидроксибензотриазола в 4 мл дихлорметана перемешивали в течение 10 минут при комнатной температуре. К реакционной смеси добавляли 20 мкл (0,228 ммоль) морфолина и эту смесь перемешивали в течение 20 часов при комнатной температуре. Затем к реакционной смеси добавляли 267 мг (0,861 ммоль) МР-карбоната (Argonaut Co.) и смесь перемешивали в течение 3 часов при комнатной температуре. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток перекристаллизовывали из смеси этилацетат/гексан с получением 80 мг (78%) указанного в заголовке соединения.
Пример 286
трет-Бутил-2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этилкарбамат
Указанное в заголовке соединение 2,23 г (97%) получали аналогично примеру 7 с использованием трет-бутилового эфира N-(2-аминометил)карбаминовой кислоты вместо бензиламина.
Пример 287
N-(2-Аминоэтил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 2,18 г (5,36 ммоль) соединения, полученного в примере 286, в 20 мл дихлорметана добавляли 5 мл раствора 4 М HCl/диоксан и эту смесь перемешивали в течение 18 часов при комнатной температуре. После реакции растворитель удаляли при пониженном давлении и остаток нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток обрабатывали этанолом с получением 670 мг (41%) указанного в заголовке соединения.
Пример 288
1-Циклогексил-N-[3-(диметиламино)-3-оксопропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 52 мг (57%) получали аналогично примеру 285 с использованием смеси 2,0 М диметиламин/тетрагидрофуран вместо морфолина.
Пример 289
1-Циклогексил-3-метил-N-{3-[метил-(1-метил-4-пиперидинил)амино]-3-оксопропил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 79 мг (70%) получали аналогично примеру 285 с использованием 1-метил-4-(метиламино)пиперидина вместо морфолина.
Пример 290
1-Циклогексил-N-[3-(4-гидрокси-1-пиперидинил)-3-оксопропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 74 мг (70%) получали аналогично примеру 285 с использованием 4-гидроксипиперидина вместо морфолина.
Пример 291
1-Циклогексил-3-метил-N-[2-(4-морфолинил)-2-оксоэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 62 мг (63%) получали аналогично примеру 285 с использованием соединения, полученного в примере 284, вместо соединения, полученного в примере 282.
Пример 292
1-Циклогексил-N-[2-(диметиламино)-2-оксоэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 63 мг (71%) получали аналогично примеру 285 с использованием соединения, полученного в примере 284, и смеси 2,0 М диметиламин/тетрагидрофуран вместо соединения, полученного в примере 282, и морфолина соответственно.
Пример 293
1-Циклогексил-3-метил-N-[2-(4-метил-1-пиперазинил)-2-оксоэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 68 мг (67%) получали аналогично примеру 285 с использованием соединения, полученного в примере 284, и N-метилпиперазина вместо соединения, полученного в примере 282, и морфолина соответственно.
Пример 294
1-Циклогексил-N-[2-(4-гидрокси-1-пиперидинил)-2-оксоэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 75 мг (73%) получали аналогично примеру 285 с использованием соединения, полученного в примере 284, и 4-гидроксипиперидина вместо соединения, полученного в примере 282, и морфолина соответственно.
Пример 295
1-Циклогексил-3-метил-N-[3-(4-метил-1-пиперазинил)-3-оксопропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 84 мг (80%) получали аналогично примеру 285 с использованием N-метилпиперазина вместо морфолина.
Пример 296
Фумарат 1-циклогексил-3-метил-N-{3-[4-метил-1-пиперидинил]-3-оксопропил}-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 41 мг (41%) получали аналогично примеру 191 с использованием соединения, полученного в примере 295, вместо соединения, полученного в примере 144.
Пример 297
1-Циклогексил-3-метил-N-{2-[метил-(1-метил-4-пиперидинил)амино]-2-оксоэтил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 81 мг (74%) получали аналогично примеру 285 с использованием соединения, полученного в примере 284, и 1-метил-4-(метиламино)пиперидина вместо соединения, полученного в примере 282, и морфолина соответственно.
Пример 298
Фумарат 1-циклогексил-3-метил-N-{2-[метил-(1-метил-4-пиперидинил)амино-2-оксоэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 74 мг (79%) получали аналогично примеру 191 с использованием соединения, полученного в примере 297, вместо соединения, полученного в примере 144.
Пример 299
1-Циклогексил-3-метил-N-[2-(2-оксо-1,3-оксазолидин-3-ил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 150 мг (0,490 ммоль) соединения, полученного в примере 287, в 3 мл тетрагидрофурана добавляли 102 мкл (0,735 ммоль) триэтиламина и 61 мкл (0,590 ммоль) 2-хлорэтилхлорформиата и эту смесь перемешивали в течение 2 часов при комнатной температуре. Затем к реакционной смеси добавляли 210 мг (1,08 ммоль) раствора 28% метоксид натрия/метанол и эту смесь перемешивали в течение 2 часов при комнатной температуре, к реакционной смеси добавляли дополнительно 130 мг (0,674 ммоль) раствора 28% метоксид натрия/метанол и полученную смесь перемешивали в течение 15 часов при комнатной температуре. Затем реакционную смесь обрабатывали водой и экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток перекристаллизовывали из этилацетата с получением 107 мг (58%) указанного в заголовке соединения.
Пример 300
1-Циклогексил-N-[2-(1,1-диоксид-2-изотиазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 125 мг (62%) получали аналогично примеру 274 с использованием соединения, полученного в примере 287, вместо соединения, полученного в примере 132.
Пример 301
1-Циклогексил-N-[2-({[(2-гидроксиэтил)(метил)амино]карбонил}амино)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 160 мг (60%) получали аналогично примеру 279 с использованием соединения, полученного в примере 287, вместо соединения, полученного в примере 132.
Пример 302
1-Циклогексил-3-метил-N-[2-(3-метил-2-оксо-1-имидазолидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 110 мг (80%) получали аналогично примеру 280 с использованием соединения, полученного в примере 301, вместо соединения, полученного в примере 279.
Пример 303
Этил-4-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бутаноат
Указанное в заголовке соединение 763 мг (67%) получали аналогично примеру 7 с использованием HCl-соли этил-4-аминобутирата вместо бензиламина.
Пример 304
4-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бутановая кислота
Указанное в заголовке соединение 690 мг (выход количественный) получали аналогично примеру 41 с использованием соединения, полученного в примере 303, вместо соединения, полученного в примере 40.
Пример 305
1-Циклогексил-N-[2-(2,5-диоксо-1-имидазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 98 мг (67%) получали аналогично примеру 7 с использованием 3-(2-аминоэтил)-2,4-имидазолидиндиона вместо бензиламина.
Пример 306
1-Циклогексил-N-[4-(диметиламино-4-оксобутил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 101 мг (85%) получали аналогично примеру 285 с использованием соединения, полученного в примере 304, и раствора 2,0 М диметиламин/тетрагидрофуран вместо соединения, полученного в примере 282, и морфолина соответственно.
Пример 307
1-Циклогексил-3-метил-N-[2-(3,4,4-триметил-2,5-диоксо-1-имидазолидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,487 ммоль) соединения, полученного в примере 122, в 5 мл тетрагидрофурана добавляли 90 мг (0,634 ммоль) 1,5,5-триметилгидантоина, 166 мг (0,634 ммоль) трифенилфосфина и 289 мкл (0,634 ммоль) раствора 40% диэтилазодикарбоксилат/толуол и эту смесь перемешивали в течение 30 минут при комнатной температуре. После реакции реакционную смесь обрабатывали водой и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/2) с получением 146 мг (69%) указанного в заголовке соединения.
Пример 308
1-Циклогексил-N-[2-(2,4-диоксо-1,3-тиазолидин-3-ил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 106 мг (53%) получали аналогично примеру 307 с использованием 2,4-тиазолидинодиона вместо 1,5,5-триметилгидантоина.
Пример 309
1-Циклогексил-N-[1-(гидроксиметил)циклопропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 766 мг (93%) получали аналогично примеру 7 с использованием (1-аминоциклопропил)метанола вместо бензиламина.
Пример 310
1-Циклогексил-3-метил-N-{1-[(3-метил-2,5-диоксо-1-имидазолидинил)метил]циклопропил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 111 мг (58%) получали аналогично примеру 307 с использованием соединения, полученного в примере 309, и 1-метилгидантоина вместо соединения, полученного в примере 122, и 1,5,5-триметилгидантоина соответственно.
Пример 311
Метил-[(2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этил)амино]ацетат
К раствору 170 мг (0,555 ммоль) соединения, полученного в примере 287, в 5 мл ацетонитрила добавляли 52,5 мкл (0,555 ммоль) метилбромацетата и 153 мг (1,11 ммоль) карбоната калия и эту смесь нагревали с обратным холодильником при кипении в течение 3 часов. Реакционную смесь охлаждали и фильтровали. Фильтрат обрабатывали водой и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1-10/1) с получением 93 мг (44%) указанного в заголовке соединения.
Пример 312
Метил[(аминокарбонил)(2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}этил)амино]ацетат
К раствору 78,8 мг (0,208 ммоль) соединения, полученного в примере 311, в 1,5 мл диоксана и 1,5 мл воды добавляли 25,3 мг (0,312 ммоль) цианата калия и 36 мкл уксусной кислоты и эту смесь перемешивали в течение 1,5 часов при комнатной температуре. Реакционную смесь обрабатывали водой и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/метанол = 20/1-10/1) с получением 73 мг (84%) указанного в заголовке соединения.
Пример 313
1-Циклогексил-N-[2-(2,4-диоксо-1-имидазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 68 мг (0,161 ммоль) соединения, полученного в примере 312, в 6 мл метанола добавляли 13 мг (60% в масле; 0,323 ммоль) гидрида натрия и эту смесь перемешивали в течение 1,5 часов при комнатной температуре. Растворитель удаляли, остаток обрабатывали водой и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток перекристаллизовывали из этанола с получением 20 мг (32%) указанного в заголовке соединения.
Пример 314
1-Циклогексил-N-[2-(4,4-диметил-2,5-диоксо-1-имидазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 195 мг (96%) получали аналогично примеру 307 с использованием 5,5-диметилгидантоина вместо 1,5,5-триметилгидантоина.
Пример 315
1-Циклогексил-3-метил-N-[2-(5-метил-1,1-диоксид-1,2,5-тиадиазолидин-2-ил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 227 мг (94%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 60, вместо бензиламина.
Пример 316
1-Циклогексил-N-[2-(3-этил-2,4-диоксо-1-имидазолидинил)этил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 84 мг (65%) получали аналогично примеру 307 с использованием соединения, полученного в примере 313, и этанола вместо 1,5,5-триметилгидантоина и соединения, полученного в примере 122, соответственно.
Пример 317
1-Циклогексил-3-метил-N-[2-(3-метил-2,4-диоксо-1-имидазолидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 82 мг (66%) получали аналогично примеру 307 с использованием соединения, полученного в примере 313, и метанола вместо 1,5,5-триметилгидантоина и соединения, полученного в примере 122, соответственно.
Пример 318
1-Циклогексил-N-[(1S)-2-гидрокси-1-метилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 170 мг (56%) получали аналогично примеру 7 с использованием (S)-(+)-2-амино-1-пропанола вместо бензиламина.
Пример 319
1-Циклогексил-N-[(1S)-2-(2,5-диоксо-1-имидазолидинил)-1-метилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 46 мг (24%) получали аналогично примеру 307 с использованием соединения, полученного в примере 318, и гидантоина вместо соединения, полученного в примере 122, и 1,5,5-триметилгидантоина соответственно.
Пример 320
N-[(3R)-1-Бензилпирролидинил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 2,32 г (97%) получали аналогично примеру 7 с использованием (3R)-(-)-1-бензил-3-аминопирролидина вместо бензиламина.
Пример 321
1-Циклогексил-3-метил-N-[(3R)-пирролидинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 2,28 г (5,40 ммоль) соединения, полученного в примере 320, в 15 мл дихлорметана постепенно добавляли 1,16 мл (10,8 ммоль) 1-хлорэтилформиата при 0ºС и эту смесь перемешивали в течение 1 часа при той же самой температуре и в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении, к остатку добавляли 25 мл этанола и затем эту смесь нагревали с обратным холодильником при кипении в течение 2,5 часов. После охлаждения растворитель удаляли при пониженном давлении и остаток обрабатывали 6 М водным раствором HCl. Водный слой промывали эфиром, нейтрализовали 4 М водным раствором NaOH и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на щелочном силикагеле (элюент: дихлорметан/метанол = 50/1-30/1) с получением 1,06 г (59%) указанного в заголовке соединения.
Пример 322
1-Циклогексил-N-{(3R)-1-[(диметиламино)карбонил]пирролидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,451 ммоль) соединения, полученного в примере 321, в 5 мл дихлорметана добавляли 50 мкл (0,541 ммоль) N,N-диметилкарбамоилхлорида и 94 мкл (0,677 ммоль) триэтиламина и эту смесь перемешивали в течение 4 часов при комнатной температуре. Реакционную смесь обрабатывали насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на щелочном силикагеле (элюент: дихлорметан/метанол = 30/1-10/1) с получением 177 мг (97%) указанного в заголовке соединения.
Пример 323
HCl-соль 1-циклогексил-N-{(3R)-[(диметиламино)карбонил]пирролидинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
0,11 мл (0,44 ммоль) раствора 4 М HCl/этилацетат добавляли к раствору 150 мг (0,372 ммоль) указанного в заголовке соединения в 1 мл этилацетата, эту смесь обрабатывали эфиром и затем перемешивали в течение 2 часов. Осадки собирали с получением 152 мг (93%) указанного в заголовке соединения.
Пример 324
1-Циклогексил-N-[(1R)-2-гидрокси-1-метилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 357 мг (98%) получали аналогично примеру 7 с использованием (R)-(-)-2-амино-1-пропанола вместо бензиламина.
Пример 325
1-Циклогексил-N-[(1R)-2-(2,5-диоксо-1-имидазолидинил)-1-метилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 67 мг (18%) получали аналогично примеру 307 с использованием соединения, полученного в примере 324, и гидантоина вместо соединения, полученного в примере 122, и 1,5,5-триметилгидантоина соответственно.
Пример 326
1-Циклогексил-N-[(2S)-2-гидроксипропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 343 мг (94%) получали аналогично примеру 7 с использованием (S)-(-)-1-амино-2-пропанола вместо бензиламина.
Пример 327
1-Циклогексил-N-[(2R)-2-(2,5-диоксо-1-имидазолидинил)пропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 57 мг (15%) получали аналогично примеру 307 с использованием соединения, полученного в примере 326, и гидантоина вместо соединения, полученного в примере 122, и 1,5,5-триметилгидантоина соответственно.
Пример 328
1-Циклогексил-N-[(2R)-2-гидроксипропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 338 мг (93%) получали аналогично примеру 7 с использованием (R)-(-)-1-амино-2-пропанола вместо бензиламина.
Пример 329
1-Циклогексил-N-[(2S)-2-(2,5-диоксо-1-имидазолидинил)пропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 42 мг (11%) получали аналогично примеру 307 с использованием соединения, полученного в примере 328, и гидантоина вместо соединения, полученного в примере 122, и 1,5,5-триметилгидантоина соответственно.
Пример 330
1-Циклогексил-N-[(1R)-1-(гидроксиметил)пропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 355 мг (94%) получали аналогично примеру 7 с использованием (R)-(-)-2-амино-1-бутанола вместо бензиламина.
Пример 331
1-Циклогексил-N-{(1R)-1-[(2,5-диоксо-1-имидазолидинил)метил]пропил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 66 мг (18%) получали аналогично примеру 307 с использованием соединения, полученного в примере 330, и гидантоина вместо соединения, полученного в примере 122, и 1,5,5-триметилгидантоина соответственно.
Пример 332
1-Циклогексил-N-[(1R)-1-(гидроксиметил)-2-метилпропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 392 мг (99%) получали аналогично примеру 7 с использованием D-валинола вместо бензиламина.
Пример 333
1-Циклогексил-N-{(1R)-1-[(2,5-диоксо-1-имидазолидинил)метил]-2-метилпропил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 97 мг (22%) получали аналогично примеру 307 с использованием соединения, полученного в примере 332, и гидантоина вместо соединения, полученного в примере 122, и 1,5,5-триметилгидантоина соответственно.
Пример 334
трет-Бутил-2-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-метилпропилкарбамат
Указанное в заголовке соединение 493 мг (выход количественный) получали аналогично примеру 7 с использованием трет-бутил-2-амино-2-метилпропилкарбамата вместо бензиламина.
Пример 335
N-(2-Амино-1,1-диметилэтил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Смешанный раствор 470 мг (1,08 ммоль) соединения, полученного в примере 334, в 2 мл раствора 4 М HCl/диоксан перемешивали в течение 3 часов при комнатной температуре. Затем растворитель удаляли при пониженном давлении, остаток обрабатывали эфиром и полученные осадки собирали. Собранные осадки растворяли в воде и эту смесь нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 344 мг (92%) указанного в заголовке соединения.
Пример 336
1-Циклогексил-N-[2-(2,5-диоксо-1-имидазолидинил)-1,1-диметилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 304 мг (0,882 ммоль) соединения, полученного в примере 335, в 5 мл этанола добавляли постепенно раствор 114 мг (0,882 ммоль) этилизоцианатацетата в 5 мл этанола и эту смесь перемешивали в течение 3 часов при комнатной температуре. Растворитель удаляли при пониженном давлении, остаток растворяли в 5 мл этанола и затем 5 мл 6 М водного раствора HCl добавляли к этой смеси. Смесь нагревали с обратным холодильником при кипении в течение 3 часов и растворитель удаляли при пониженном давлении. Остаток нейтрализовали насыщенным водным раствором бикарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат) с получением 336 мг (91%) указанного в заголовке соединения.
Пример 337
HCl-соль 1-циклогексил-N-[2-(2,5-диоксо-1-имидазолидинил)-1,1-диметилэтил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 227 мг (70%) получали аналогично примеру 323 с использованием соединения, полученного в примере 336, вместо соединения, полученного в примере 322.
Пример 338
N-(3-Амино-2,2-диметилпропил)-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 162 мг (41%) получали аналогично примеру 7 с использованием 2,2-диметил-1,3-пропандиамина вместо бензиламина.
Пример 339
1-Циклогексил-N-[3-(2,5-диоксо-1-имидазолидинил)-2,2-диметилпропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 123 мг (72%) получали аналогично примеру 336 с использованием соединения, полученного в примере 338, вместо соединения, полученного в примере 335.
Пример 340
(±)-1-Циклогексил-N-[транс-2-(гидроксиметил)циклопропил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 280 мг (42%) получали аналогично примеру 7 с использованием (±)-транс-(2-аминоциклопропил)метанола вместо бензиламина.
Пример 341
1-Циклогексил-3-метил-N-[4-(3-оксо-1-пиперазинил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 215 мг (87%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 66, вместо бензиламина.
Пример 342
3-Метил-N-[4-(3-оксо-1-пиперазинил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 152 мг (77%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 66, и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 343
Метил-3-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бензоат
Указанное в заголовке соединение 1,78 г (95%) получали аналогично примеру 7 с использованием метил-м-аминобензоата вместо бензиламина.
Пример 344
3-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}бензойная кислота
Указанное в заголовке соединение 1,67 г (выход количественный) получали аналогично примеру 41 с использованием соединения, полученного в примере 343, вместо соединения, полученного в примере 40.
Пример 345
1-Циклогексил-N-{3-[(диметиламино)карбонил]фенил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 145 мг (90%) получали аналогично примеру 224 с использованием соединения, полученного в примере 344, и раствора 2 М диметиламин/тетрагидрофуран вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 346
1-Циклогексил-3-метил-N-[3-(4-морфолинилкарбонил)фенил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 167 мг (94%) получали аналогично примеру 224 с использованием соединения, полученного в примере 344, и морфолина вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 347
Метил-транс-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоксилат
Указанное в заголовке соединение 605 мг (99%) получали аналогично примеру 7 с использованием HCl-соли транс-4-аминоциклогексанкарбоксилата и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 348
транс-4-{[(3-Метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексанкарбоновая кислота
Указанное в заголовке соединение 540 мг (98%) получали аналогично примеру 41 с использованием соединения, полученного в примере 347, вместо соединения, полученного в примере 40.
Пример 349
N-{транс-4-[(Диметиламино)карбонил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 117 мг (91%) получали аналогично примеру 224 с использованием соединения, полученного в примере 348, и раствора 2 М диметиламин/тетрагидрофуран вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 350
3-Метил-N-[транс-4-(4-морфолинилкарбонил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 132 мг (93%) получали аналогично примеру 224 с использованием соединения, полученного в примере 348, и морфолина вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 351
N-{транс-4-[(4-Гидрокси-1-пиперидинил)карбонил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 137 мг (94%) получали аналогично примеру 224 с использованием соединения, полученного в примере 348, и 4-гидроксипиперидина вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 352
3-Метил-N-{транс-4-[(4-метил-1-пиперазинил)карбонил]циклогексил}-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 97 мг (76%) получали аналогично примеру 224 с использованием соединения, полученного в примере 348, и 1-метилпиперазина вместо соединения, полученного в примере 211, и гидроксиуксусной кислоты соответственно.
Пример 353
1-Циклогексил-3-метил-N-[3-(4-морфолинил)пропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 199 мг (90%) получали аналогично примеру 7 с использованием N-(3-аминопропил)морфолина вместо бензиламина.
Пример 354
1-Циклогексил-3-метил-N-[2-(4-морфолинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 174 мг (82%) получали аналогично примеру 7 с использованием N-(2-аминоэтил)морфолина вместо бензиламина.
Пример 355
1-Циклогексил-3-метил-N-[2-(1-пиперидинил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 148 мг (70%) получали аналогично примеру 7 с использованием N-(2-аминоэтил)пиперидина вместо бензиламина.
Пример 356
N-[транс-4-(Гидроксиметил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 628 мг (96%) получали аналогично примеру 206 с использованием соединения, полученного в примере 347, вместо соединения, полученного в примере 204.
Пример 357
(транс-4-{[(3-Метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)метил-п-толуолсульфонат
К суспензии 510 мг (1,35 ммоль) соединения, полученного в примере 356, в 20 мл дихлорметана и 20 мл хлороформа добавляли 270 мг (1,42 ммоль) п-толуолсульфонилхлорида и 131 мкл (1,62 ммоль) пиридина и эту смесь перемешивали в течение ночи при комнатной температуре. Затем к реакционной смеси дважды добавляли дополнительно 270 мг (1,42 ммоль) п-толуолсульфонилхлорида и 131 мкл (1,62 ммоль) пиридина при 50ºС и эту смесь перемешивали в течение ночи. К реакционной смеси дважды добавляли дополнительно 270 мг (1,42 ммоль) п-толуолсульфонилхлорида, 131 мкл (1,62 ммоль) пиридина и 226 мкл (1,62 ммоль) триэтиламина и эту смесь перемешивали в течение ночи. Затем реакционную смесь промывали водой и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/1 – только этилацетат) с получением 402 мг (56%) указанного в заголовке соединения.
Пример 358
3-Метил-N-[транс-4-(4-морфолинилметил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 120 мг (0,226 ммоль) соединения, полученного в примере 357, в 5 мл N,N-диметилформамида добавляли 79 мкл (0,903 ммоль) морфолина и эту смесь перемешивали в течение 12 часов при 100ºС. Затем реакционную смесь охлаждали до комнатной температуры и обрабатывали 20 мл этилацетата. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 40/1) с получением 52 мг (52%) указанного в заголовке соединения.
Пример 359
N-{транс-4-[(Диметиламино)метил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 92 мг (выход количественный) получали аналогично примеру 358 с использованием раствора 2 М диметиламин/тетрагидрофуран вместо морфолина.
Пример 360
N-{транс-4-[(4-Ацетил-1-пиперазинил)метил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 82 мг (87%) получали аналогично примеру 358 с использованием 1-ацетилпиперазина вместо морфолина.
Пример 361
N-{3-[(Диметиламино)сульфонил]фенил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 133 мг (66%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 67, и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 362
3-Метил-N-[3-(метилсульфонил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 74 мг (39%) получали аналогично примеру 7 с использованием HCl-соли 3-метилсульфониланилина и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 363
N-{3-[(2-{[трет-Бутил(диметил)силил]окси}этил)сульфонил]фенил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 135 мг (53%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 68, и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно.
Пример 364
N-[(2-Гидроксиэтил)сульфонил]фенил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 61 мг (60%) получали аналогично примеру 266 с использованием соединения, полученного в примере 363, вместо соединения, полученного в примере 265.
Пример 365
Диметансульфонат 1-циклогексил-N-[3-фтор-4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Смешанный раствор 456,5 мг (1,00 ммоль) соединения, полученного в примере 159, и 142,8 мкл (2,20 ммоль) метансульфоновой кислоты в 4 мл этанола концентрировали при пониженном давлении. Остаток обрабатывали 5 мл этанола и остаток растворяли в растворе нагреванием и дефлегмацией. Затем добавляли 2 мл изопропилового эфира и смесь охлаждали постепенно до комнатной температуры. Полученные осадки собирали фильтрованием с получением 383 мг (89%) указанного в заголовке соединения.
Пример 366
п-Толуолсульфонат 1-циклогексил-N-[3-фтор-4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К раствору 228,3 мг (0,50 ммоль) соединения, полученного в примере 159, в 2 мл этанола добавляли 104,6 мг (0,55 ммоль) моногидрата п-толуолсульфоновой кислоты при 50ºС и эту смесь концентрировали при пониженном давлении. Затем к остатку добавляли 1,5 мл изопропанола, остаток растворяли в этой смеси нагреванием при 70ºС и смесь постепенно охлаждали до комнатной температуры. Полученные осадки собирали фильтрованием с получением 281 мг (89%) указанного в заголовке соединения.
Пример 367
Метансульфонат 1-циклогексил-N-[4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К раствору 438,6 мг (1,00 ммоль) соединения, полученного в примере 114, в 4 мл этанола добавляли 71,4 мкл (1,10 ммоль) метансульфоновой кислоты и к этой смеси добавляли дополнительно 0,8 мл этилацетата. Затем, после нагревания с обратным холодильником при кипении эту смесь постепенно охлаждали до комнатной температуры. Полученные осадки собирали фильтрованием с получением 424 мг (79%) указанного в заголовке соединения.
Пример 368
п-Толуолсульфонат 1-циклогексил-N-[4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К суспензии 219,3 мг (0,50 ммоль) соединения, полученного в примере 114, в 3 мл этанола добавляли 104,6 мг (0,55 ммоль) моногидрата п-толуолсульфоната и смесь нагревали с обратным холодильником при кипении. Затем отделенные осадки растворяли добавлением 0,6 мл воды и эту смесь постепенно охлаждали до 0ºС. Полученные осадки собирали фильтрованием с получением 244 мг (80%) указанного в заголовке соединения.
Пример 369
3-Метил-N-[транс-4-(4-морфолинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 120 мг (0,45 ммоль) соединения, полученного в примере 195, в 2 мл 1,2-дихлорэтана добавляли 66 мкл (0,90 ммоль) тионилхлорида и эту смесь нагревали с обратным холодильником при кипении в течение 2 часов. После охлаждения реакционной смеси растворитель удаляли при пониженном давлении с получением промежуточного соединения хлорангидрида кислоты.
314 мкл (2,25 ммоль) триэтиламина и 139 мг (0,54 ммоль) соединения, полученного в примере получения 64, добавляли к раствору промежуточного соединения хлорангидрида кислоты в 5 мл безводного дихлорметана и эту смесь перемешивали в течение 3 часов при комнатной температуре. Реакционную смесь обрабатывали насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1-10/1) с получением 172 мг (88%) указанного в заголовке соединения.
Пример 370
1-Циклогексил-N-[6-(4-гидрокси-1-пиперидинил)-3-пиридинил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 216 мг (выход количественный) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 74, вместо бензиламина.
Пример 371
1-Циклогексил-N-[2,3-дифтор-4-(4-гидрокси-1-пиперидинил)фенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 177 мг (82%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 76, вместо бензиламина.
Пример 372
1-Циклогексил-N-[4-(4-гидрокси-1-пиперидинил)-3-метоксифенил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 189 мг (92%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 78, вместо бензиламина.
Пример 373
N-[3-Циано-4-(4-гидрокси-1-пиперидинил)фенил]-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 209 мг (99%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 80, вместо бензиламина.
Пример 374
Метил-5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-(4-гидрокси-1-пиперидинил)бензоат
Указанное в заголовке соединение 224 мг (99%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 82, вместо бензиламина.
Пример 375
5-{[(1-Циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-(4-гидрокси-1-пиперидинил)бензойная кислота
Указанное в заголовке соединение 167 мг (81%) получали аналогично примеру 41 с использованием соединения, полученного в примере получения 374, вместо соединения, полученного в примере 40.
Пример 376
N-[6-(4-Гидрокси-1-пиперидинил)-3-пиридинил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 202 мг (выход количественный) получали аналогично примеру 369 с использованием соединения, полученного в примере получения 74, вместо соединения, полученного в примере получения 64.
Пример 377
3-Метил-1-тетрагидро-2Н-пиран-4-ил-N-(1-тетрагидро-2Н-пиран-4-ил-4-пиперидинил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 187 мг (96%) получали аналогично примеру 369 с использованием соединения, полученного в примере получения 84, вместо соединения, полученного в примере получения 64.
Пример 378
1-Циклогексил-N-{6-[(4-гидрокси-1-пиперидинил)карбонил]-3-пиридинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 100 мг (0,26 ммоль) соединения, полученного в примере 103, в 5 мл безводного дихлорметана добавляли 39,4 мг (0,39 ммоль) 4-гидроксипиперидина, 53 мг (0,39 ммоль) 1-гидроксибензотриазола, 74,8 мг (0,39 ммоль) HCl-соли 1-этил-3-(3-диметиламинопропил)карбодиимида и 72,5 мкл (0,52 ммоль) триэтиламина и эту смесь перемешивали в течение 17 часов при комнатной температуре. Реакционную смесь обрабатывали насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 102 мг (84%) указанного в заголовке соединения.
Пример 379
1-Циклогексил-N-(6-{[(3-гидроксиэтил)амино]карбонил}-3-пиридинил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 76 мг (68%) получали аналогично примеру 378 с использованием 2-аминоэтанола вместо 4-гидроксипиперидина.
Пример 380
1-Циклогексил-3-метил-N-{6-[(4-метил-1-пиперазинил)карбонил]-3-пиридинил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 87 мг (72%) получали аналогично примеру 378 с использованием N-метилпиперазина вместо 4-гидроксипиперидина.
Пример 381
1-Циклогексил-N-[6-({[2-(диметиламино)этил]амино}карбонил-3-пиридинил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 71 мг (60%) получали аналогично примеру 378 с использованием N,N-диметилэтилендиамина вместо 4-гидроксипиперидина.
Пример 382
1-Циклогексил-N-(6-{[(транс-4-гидроксициклогексил)амино]карбонил}-3-пиридинил)-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 50 мг (39%) получали аналогично примеру 378 с использованием транс-4-аминоциклогексанола вместо 4-гидроксипиперидина.
Пример 383
1-Циклогексил-3-метил-N-{6-[(4-метил-1,4-диазепам-1-ил)карбонил]-3-пиридинил}-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 105 мг (84%) получали аналогично примеру 378 с использованием N-метилгомопиперазина вместо 4-гидроксипиперидина.
Пример 384
трет-Бутил-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-1-пиперидинкарбоксилат
Указанное в заголовке соединение 1,86 г (92%) получали аналогично примеру 369 с использованием 4-амино-1-Вос-пиперидина вместо соединения, полученного в примере получения 64.
Пример 385
3-Метил-N-(4-пиперидинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Смешанный раствор 1,81 г (4,03 ммоль) соединения, полученного в примере 384, в 10 мл раствора 4 М HCl/диоксан перемешивали в течение 30 минут при комнатной температуре и в течение 2 часов при 60ºС. После охлаждения реакционной смеси растворитель удаляли при пониженном давлении и остаток обрабатывали насыщенным водным раствором бикарбоната натрия и затем смесь экстрагировали хлороформом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 1,22 г (87%) указанного в заголовке соединения.
Пример 386
N-{1-[(Диметиламино)карбонил]-4-пиперидинил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 132 мг (91%) получали аналогично примеру 322 с использованием соединения, полученного в примере 385, вместо соединения, полученного в примере 321.
Пример 387
трет-Бутил-4-{4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}пиперидин-1-ил}-1-пиперидинкарбоксилат
К суспензии 220 мг (0,63 ммоль) соединения, полученного в примере 385, в 5 мл 1,2-дихлорэтана добавляли 15 мкл уксусной кислоты и 151 мг (0,757 ммоль) 1-Вос-4-пиперидона и эту смесь перемешивали в течение 30 минут при комнатной температуре. Затем к реакционной смеси добавляли 200 мг (0,95 ммоль) триацетоксиборгидрида натрия и смесь перемешивали в течение 6 часов при комнатной температуре. Реакционную смесь обрабатывали насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 230 мг (69%) указанного в заголовке соединения.
Пример 388
3-Метил-N-(пиперидин-4-ил-4-пиперидинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 165 мг (98%) получали аналогично примеру 385 с использованием соединения, полученного в примере 387, вместо соединения, полученного в примере 384.
Пример 389
3-Метил-N-(1-ацетилпиперидин-4-ил-4-пиперидинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 51 мг (62%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 388, вместо соединения, полученного в примере получения 2.
Пример 390
3-Метил-N-(1-метансульфонилпиперидин-4-ил-4-пиперидинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 68 мг (77%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 388, и метансульфонилхлорида вместо соединения, полученного в примере получения 2, и ацетилхлорида соответственно.
Пример 391
трет-Бутил-4-(транс-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1-пиперазинкарбоксилат
Указанное в заголовке соединение 456 мг (46%) получали аналогично примеру 369 с использованием соединения, полученного в примере получения 86, вместо соединения, полученного в примере получения 64.
Пример 392
трет-Бутил-4-(цис-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-1-пиперазинкарбоксилат
523 мг (52%) указанного в заголовке соединения получали в виде побочного продукта в примере 391.
Пример 393
Ди-HCl-соль 3-метил-N-[транс-4-(1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Смесь 419 мг (0,817 ммоль) соединения, полученного в примере 391, в 3 мл раствора 4 М HCl/диоксан и 1 мл метанола перемешивали в течение 5 часов при комнатной температуре. Растворитель удаляли при пониженном давлении и остаток обрабатывали этанолом. Полученные осадки собирали фильтрованием с получением 343 мг (83%) указанного в заголовке соединения.
Пример 394
Ди-HCl-соль 3-метил-N-[цис-4-(1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамида
Указанное в заголовке соединение 234 мг (51%) получали аналогично примеру 393 с использованием соединения, полученного в примере 392, вместо соединения, полученного в примере 391.
Пример 395
N-[транс-4-(4-Ацетил-1-пиперазинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 100 мг (70%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 388, и уксусного ангидрида вместо соединения, полученного в примере получения 2, и ацетилхлорида соответственно.
Пример 396
3-Метил-N-{транс-4-[4-(метилсульфонил)-1-пиперазинил]циклогексил}-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 109 мг (71%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 393, и метансульфонилхлорида вместо соединения, полученного в примере получения 2, и ацетилхлорида соответственно.
Пример 397
N-[цис-4-(4-Ацетил-1-пиперазинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 113 мг (66%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 394, и уксусного ангидрида вместо соединения, полученного в примере получения 2, и ацетилхлорида соответственно.
Пример 398
3-Метил-N-[1-(4-морфолинилкарбонил)-4-пиперидинил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 109 мг (69%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 385, и 4-морфолинилхлорида вместо соединения, полученного в примере получения 2, и ацетилхлорида соответственно.
Пример 399
3-Метил-N-{1-[(4-метил-1-пиперазинил)карбонил]-4-пиперидинил}-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 92 мг (56%) получали аналогично примеру получения 3 с использованием соединения, полученного в примере 385, и HCl-соли 4-метил-1-пиперазинкарбонилхлорида вместо соединения, полученного в примере получения 2, и ацетилхлорида соответственно.
Пример 400
N-(транс-4-Гидроксициклогексил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 843 мг (52%) получали аналогично примеру 396 с использованием транс-4-аминоциклогексанола вместо соединения, полученного в примере получения 64.
Пример 401
3-Метил-N-(4-оксоциклогексил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 828 мг (2,28 ммоль) соединения, полученного в примере 400, в 30 мл дихлорметана добавляли 983 мг (4,56 ммоль) хлорхромата пиридиния и 2 г молекулярных сит 4Å и эту смесь перемешивали в течение 4 часов при комнатной температуре. Реакционную смесь фильтровали через Celite® и фильтрат удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/этилацетат) и дополнительно очищали колоночной хроматографией на силикагеле (элюент: этилацетат) с получением 668 мг (81%) указанного в заголовке соединения.
Пример 402
N-[транс-4-(цис-2,6-Диметилморфолинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,415 ммоль) соединения, полученного в примере 401, в 3 мл 1,2-дихлорэтана добавляли 103 мкл (0,83 ммоль) цис-2,6-диметилморфолина и 15 мкл уксусной кислоты и эту смесь перемешивали в течение 30 минут при комнатной температуре. Затем к реакционной смеси добавляли 132 мг (0,623 ммоль) триацетоксиборгидрида натрия и эту смесь перемешивали в течение 4 часов при комнатной температуре. Реакционную смесь обрабатывали насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Органический слой удаляли при пониженном давлении и остаток очищали колоночной хроматографией на щелочном силикагеле (элюент: этилацетат/гексан = 1/1) с получением 132 мг (69%) указанного в заголовке соединения.
Пример 403
N-[цис-4-(цис-2,6-Диметилморфолинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 46 мг (24%) получали в примере 402 в виде побочного продукта.
Пример 404
1-Циклогексил-N-[6-(гидроксиметил)-3-пиридинил]-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 215 мг (58%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 87, вместо бензиламина.
Пример 405
Метил-5-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-пиридинкарбоксилат
К суспензии 700 мг (2,63 ммоль) соединения, полученного в примере 195, в 6 мл 1,2-дихлорэтана добавляли 384 мкл (5,26 ммоль) тионилхлорида и эту смесь нагревали с обратным холодильником при кипении в течение 2 часов. После охлаждения реакционной смеси растворитель удаляли при пониженном давлении с получением промежуточного соединения хлорангидрида кислоты.
Затем к раствору промежуточного соединения хлорангидрида кислоты, полученного, как описано выше, в 8 мл пиридина добавляли 400 мг (2,63 ммоль) метил-5-амино-2-пиридинкарбоксилата и эту смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь обрабатывали насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат) с получением 956 мг (91%) указанного в заголовке соединения.
Пример 406
5-{[(3-Метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-пиридинкарбоновая кислота
К раствору 923 мг (2,30 ммоль) соединения, полученного в примере 405, в 5 мл метанола добавляли 5 мл 1 М водного раствора NaOH и смесь перемешивали в течение 1,5 часов при 60ºС. После охлаждения реакционной смеси растворитель удаляли при пониженном давлении и остаток нейтрализовали добавлением 2,5 мл 2 М водного раствора HCl. Полученные осадки собирали с получением 870 мг (98%) указанного в заголовке соединения.
Пример 407
N-(6-{[(транс-4-Гидроксициклогексил)амино]карбонил}-3-пиридинил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 118 мг (94%) получали аналогично примеру 378 с использованием соединения, полученного в примере 406, и транс-4-аминоциклогексанола вместо соединения, полученного в примере 103, и 4-гидроксипиперидина соответственно.
Пример 408
N-[6-({[2-(Диметиламино)этил]амино}карбонил)-3-пиридинил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 108 мг (91%) получали аналогично примеру 378 с использованием соединения, полученного в примере 406, и N,N-диметилэтилендиамина вместо соединения, полученного в примере 103, и 4-гидроксипиперидина соответственно.
Пример 409
3-Метил-N-(6-{[(1-метил-4-пиперидинил)амино]карбонил}-3-пиридинил)-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 35,6 мг (36%) получали аналогично примеру 378 с использованием соединения, полученного в примере 406, и 4-амино-1-метилпиперидина вместо соединения, полученного в примере 103, и 4-гидроксипиперидина соответственно.
Пример 410
N-(6-{[(1-Ацетил-4-пиперидинил)амино]карбонил}-3-пиридинил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 109 мг (82%) получали аналогично примеру 378 с использованием соединения, полученного в примере 406, и 4-амино-1-ацетилпиперидина вместо соединения, полученного в примере 103, и 4-гидроксипиперидина соответственно.
Пример 411
1-Циклогексил-3-метил-N-[6-(4-морфолинилметил)-3-пиридинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 120 мг (0,324 ммоль) соединения, полученного в примере 404, в 3 мл этилацетата добавляли 90 мкл (0,648 ммоль) триэтиламина и 39 мкл (0,486 ммоль) метансульфонилхлорида и эту смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь обрабатывали этилацетатом и органический слой промывали насыщенным водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, соответственно, и затем сушили над безводным сульфатом натрия. Сульфат натрия удаляли фильтрованием и фильтрат обрабатывали 1 мл 4 М раствора HCl/диоксан и растворитель удаляли с получением HCl-соли (5-{[(1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}-2-пиридинил)метилметансульфоната в виде промежуточного соединения.
К суспензии полученного, как описано выше, промежуточного соединения в 3 мл ацетонитрила добавляли 162 мг (1,17 ммоль) карбоната калия, 28,8 мкл (0,33 ммоль) морфолина и 5,8 мг (0,035 ммоль) иодида калия и затем эту смесь перемешивали в течение 2 часов при 70ºС и в течение 15 часов при комнатной температуре. Затем реакционную смесь обрабатывали водой и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 114 мг (80%) указанного в заголовке соединения.
Пример 412
Метансульфонат 1-циклогексил-3-метил-N-[6-(4-морфолинилметил)-3-пиридинил]-1Н-тиено[2,3-c]пиразол-5-карбоксамида
К раствору 100 мг (0,227 ммоль) соединения, полученного в примере 411, в 2 мл этанола добавляли 14,8 мкл метансульфоновой кислоты и растворитель удаляли. Остаток перекристаллизовывали из изопропанола с получением 77 мг (63%) указанного в заголовке соединения.
Пример 413
1-Циклогексил-N-{6-[(4-гидрокси-1-пиперидинил)метил]-3-пиридинил}-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 104 мг (71%) получали аналогично примеру 411 с использованием 4-гидроксипиперидина вместо морфолина.
Пример 414
N-{6-[(4-Ацетил-1-пиперазинил)метил]-3-пиридинил}-1-циклогексил-3-метил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 102 мг (66%) получали аналогично примеру 411 с использованием 1-ацетилпиперазина вместо морфолина.
Пример 415
3-Метил-N-[транс-4-(4-метил-2-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 124 мг (72%) получали аналогично примеру 369 с использованием соединения, полученного в примере получения 91, вместо соединения, полученного в примере получения 64.
Пример 416
1-Циклогексил-3-метил-N-[транс-4-(4-метил-2-оксо-1-пиперазинил)циклогексил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 130 мг (75%) получали аналогично примеру 7 с использованием соединения, полученного в примере получения 91, вместо бензиламина.
Пример 417
3-Метил-N-[транс-4-(3-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 115 мг (62%) получали аналогично примеру 402 с использованием 2-пиперазина вместо цис-2,6-диметилморфолина.
Пример 418
3-Метил-N-[цис-4-(3-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 43 мг (23%) получали в примере 417 в виде побочного продукта.
Пример 419
3-Метил-N-[транс-4-(4-метил-3-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К суспензии 150 мг (0,415 ммоль) соединения, полученного в примере 401, в 3 мл 1,2-дихлорэтана добавляли 125 мг (0,83 ммоль) HCl-соли 1-метил-2-пиперазинона, 15 мкл уксусной кислоты и 82 мг (1,0 ммоль) ацетата натрия и эту смесь перемешивали в течение 30 минут при комнатной температуре. Затем к реакционной смеси добавляли 132 мг (0,623 ммоль) триацетоксиборгидрида натрия и эту смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь разбавляли насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 131 мг (69%) указанного в заголовке соединения.
Пример 420
3-Метил-N-[цис-4-(4-метил-2-оксо-1-пиперазинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 43 мг (11%) получали в примере 419 в виде побочного продукта.
Пример 421
Этил-1-(транс-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиридинкарбоксилат
Указанное в заголовке соединение 690 мг (37%) получали аналогично примеру 369 с использованием соединения, полученного в примере получения 93, вместо соединения, полученного в примере получения 64.
Пример 422
Этил-1-(цис-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиридинкарбоксилат
Указанное в заголовке соединение 1,10 г (58%) получали в примере 421 в виде побочного продукта.
Пример 423
N-{транс-4-[4-(Гидроксиметил)-1-пиперидинил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 59 мг (54%) получали аналогично примеру 206 с использованием соединения, полученного в примере 421, вместо соединения, полученного в примере 204.
Пример 424
N-{цис-4-[4-(Гидроксиметил)-1-пиперидинил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 61 мг (55%) получали аналогично примеру 206 с использованием соединения, полученного в примере 422, вместо соединения, полученного в примере 204.
Пример 425
N-[транс-4-(4-Гидрокси-1-пиперидинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 76 мг (42%) получали аналогично примеру 402 с использованием 4-гидроксипиперидина вместо цис-2,6-диметилморфолина.
Пример 426
N-(цис-4-{4-[(Диметиламино)карбонил]-1-пиперидинил}циклогексил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Смешанный раствор 400 мг (0,795 ммоль) соединения, полученного в примере 422, в 8 мл 6 М водного раствора HCl нагревали с обратным холодильником при кипении в течение 2,5 часов. После охлаждения реакционной смеси растворитель удаляли при пониженном давлении с получением HCl-соли 1-(цис-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиперидинкарбоновой кислоты в виде промежуточного соединения.
Затем к суспензии промежуточного соединения, полученного, как описано выше, в дихлорметане добавляли 0,60 мл (1,2 ммоль) раствора 2 М диметиламин/тетрагидрофуран, 229 мг (1,19 ммоль) HCl-соли 1-этил-3-(3-диметиламинопропил)карбодиимида, 746 мкл (5,35 ммоль) триэтиламина и 182 мг (1,19 ммоль) 1-гидроксибензотриазола и эту смесь перемешивали в течение 95 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на щелочном силикагеле (элюент: этилацетат) с получением 196 мг (49%) указанного в заголовке соединения.
Пример 427
HCl-соль 1-(транс-4-{[(3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-ил)карбонил]амино}циклогексил)-4-пиперидинкарбоновая кислота
Смешанный раствор 400 мг (0,795 ммоль) соединения, полученного в примере 421, в 6 М водном растворе HCl перемешивали в течение 2 часов при 70ºС. Растворитель удаляли с получением 465 мг (выход количественный) указанного в заголовке соединения.
Пример 428
N-(транс-4-{4-[(Диметиламино)карбонил]-1-пиперидинил}циклогексил)-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 195 мг (78%) получали аналогично примеру 378 с использованием соединения, полученного в примере 427, и раствора 2 М диметиламин/тетрагидрофуран вместо соединения, полученного в примере 103, и 4-гидроксипиперидина соответственно.
Пример 429
N’-(Дигидро-2Н-пиран-3(4Н)-илиден)бензогидразид
К раствору 3,48 г (34,1 ммоль) тетрагидро-2Н-пиран-3-ола в 350 мл дихлорметана добавляли 11,1 г (51,2 ммоль) хлорформиата пиридиния, 3,16 г (38,5 ммоль) ацетата натрия и 30 г молекулярных сит 4Å и эту смесь перемешивали в течение 4 часов при комнатной температуре. Затем реакционную смесь фильтровали через Celite® и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1) с получением дигидро-2Н-пиран-3(4Н)-она в виде промежуточного соединения.
Смешанный раствор промежуточного соединения, полученного, как описано выше, и 4,6 г (34,1 ммоль) бензоилгидразина в 20 мл метанола перемешивали в течение 4 часов при 60ºС. После охлаждения реакционной смеси растворитель удаляли и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 30/1) с получением 1,75 г (24%) указанного в заголовке соединения.
Пример 430
N’-Тетрагидро-2Н-пиран-3-илбензогидразид
К раствору 1,64 г (7,51 ммоль) соединения, полученного в примере 429, в метаноле добавляли 257 мг (6,76 ммоль) боргидрида натрия при 0ºС и эту смесь перемешивали в течение 3 часов при той же самой температуре. Растворитель удаляли и остаток обрабатывали водой и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 30/1) с получением 1,46 г (88%) указанного в заголовке соединения.
Пример 431
5-Метил-2-тетрагидро-2Н-пиран-3-ил-2,4-дигидро-3Н-пиразол-3-он
К раствору 1,44 г (6,53 ммоль) соединения, полученного в примере 430, в 10 мл воды добавляли 20 мл концентрированной HCl и эту смесь перемешивали в течение 24 часов при 100ºС. После охлаждения реакционной смеси нерастворимые вещества удаляли фильтрованием и фильтрат концентрировали с получением HCl-соли 1-(тетрагидро-2Н-пиран-3-ил)гидразина в виде промежуточного соединения.
Смесь промежуточного соединения, полученного, как описано выше, и 705 мкл (6,53 ммоль) метилацетоацетата перемешивали в течение 2 часов при 110ºС. Реакционную смесь охлаждали и разбавляли водой и этилацетатом, и затем нейтрализовали 1 М водным раствором NaOH. Растворитель удаляли и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1) с получением 793 мг (67%) указанного в заголовке соединения.
Пример 432
5-Хлор-3-метил-1-тетрагидро-2Н-пиран-3-ил-1Н-пиразол-4-карбальдегид
Указанное в заголовке соединение 452 мг (47%) получали аналогично примеру 193 с использованием соединения, полученного в примере 431, вместо соединения, полученного в примере 192.
Пример 433
Этил-3-метил-1-тетрагидро-2Н-пиран-3-ил-1Н-тиено[2,3-c]пиразол-5-карбоксилат
К раствору 259 мкл (2,36 ммоль) этилтиогликолата в 4 мл тетрагидрофурана добавляли 94 мг (2,36 ммоль) боргидрида натрия (60% в масле) при 0ºС и эту смесь перемешивали в течение 30 минут при комнатной температуре. Затем реакционную смесь охлаждали до 0ºС, к этой смеси добавляли постепенно 415 мг (1,81 ммоль) соединения, полученного в примере 432, в 4 мл тетрагидрофурана и эту смесь перемешивали в течение 2 часов при комнатной температуре. Затем реакционную смесь охлаждали до 0ºС, к этой смеси добавляли 94 мг (2,36 ммоль) боргидрида натрия (60% в масле) и смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь обрабатывали ледяной водой и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1) с получением 413 мг (78%) указанного в заголовке соединения.
Пример 434
3-Метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоновая кислота
Указанное в заголовке соединение 320 мг (89%) получали аналогично примеру 6 с использованием соединения, полученного в примере 433, вместо соединения, полученного в примере 5.
Пример 435
3-Метил-N-[транс-4-(4-морфолинил)циклогексил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 185 мг (95%) получали аналогично примеру 369 с использованием соединения, полученного в примере 434, вместо соединения, полученного в примере 195.
Пример 436
N-[транс-4-(4-Этил-3-оксо-1-пиперазинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 140 мг (71%) получали аналогично примеру 419 с использованием HCl-соли 1-этил-2-пиперазинона вместо HCl-соли 1-метил-2-пиперазинона.
Пример 437
N-[цис-4-(4-Этил-3-оксо-1-пиперазинил)циклогексил]-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 41 мг (21%) получали в примере 436 в виде побочного продукта.
Пример 438
N-{транс-4-[(4-Этил-3-оксо-1-пиперазинил)метил]циклогексил}-3-метил-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
К раствору 150 мг (0,282 ммоль) соединения, полученного в примере 357, в 3 мл N,N-диметилформамида добавляли 93 мг (0,564 ммоль) HCl-соли 1-этил-2-пиперазинона и 236 мкл (1,7 ммоль) триэтиламина и эту смесь перемешивали в течение 5 часов при 100ºС. Затем к реакционной смеси добавляли 43 мг (0,282 ммоль) иодида натрия и эту смесь перемешивали в течение 40 часов при 100ºС. К реакционной смеси добавляли дополнительно 100 мг (0,61 ммоль) HCl-соли 1-этил-2-пиперазинона и 50 мг (0,33 ммоль) иодида натрия и смесь перемешивали в течение 15 минут при 120ºС с использованием микроволновой печи. После реакции к реакционной смеси добавляли воду и смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 20/1-15/1) и дополнительно колоночной хроматографией на щелочном силикагеле (элюент: этилацетат) с получением 63 мг (46%) указанного в заголовке соединения.
Пример 439
3-Метил-N-{транс-4-[(4-метил-3-оксо-1-пиперазинил)метил]циклогексил}-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Указанное в заголовке соединение 24 мг (18%) получали аналогично примеру 438 с использованием HCl-соли 1-метил-2-пиперазинона вместо HCl-соли 1-этил-2-пиперазинона.
Пример 440
3-Метил-N-[4-(4-метил-2-оксо-1-пиперазинил)фенил]-1-тетрагидро-2Н-пиран-4-ил-1Н-тиено[2,3-c]пиразол-5-карбоксамид
Свободное основание указанного в заголовке соединения получали аналогично примеру 7 с использованием соединения, полученного в примере получения 72, и соединения, полученного в примере 195, вместо бензиламина и соединения, полученного в примере 6, соответственно. Затем 30,7 мкл (0,473 ммоль) метансульфоновой кислоты добавляли к раствору свободного основания соединения, полученного, как описано выше, в 2,5 мл изопропанола и эту смесь нагревали с обратным холодильником при кипении. Реакционную смесь охлаждали до комнатной температуры и полученные осадки собирали с получением 206 мг (83%) указанного в заголовке соединения.
Химическая структура и физико-химические данные соединений, полученных в вышеуказанных примерах получения и примерах, суммированы в таблицах 5-138.
Промышленная применимость
Данное изобретение обеспечивает производные тиенопиразола, имеющие селективное ингибирующее PDE 7 (фосфодиэстеразу VII) действие. Эти соединения являются эффективными соединениями для лечения различных типов таких заболеваний, как аллергические, воспалительные и иммунологические заболевания.
Формула изобретения
1. Соединения тиенопиразола, представленные следующей формулой (I):
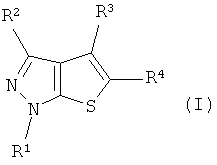
где R1 обозначает незамещенную С3-С8циклоалкильную группу или тетрагидропиранил;
R2 обозначает незамещенную С1-С3алкильную группу;
R3 обозначает атом водорода;
R4 обозначает
{1} фенильную группу, которая замещена атомом галогена; 6-7-членной моноциклической гетероциклической группой, содержащей 2 атома азота, причем указанная группа замещена С1-С6алкильной группой;
{2} -CO2R7; или
{3} -CONR5R6; где R5 и R6 являются одинаковыми или различными и представляют собой
[1] атом водорода;
[2] С1-С6алкильную группу;
причем указанная алкильная группа является незамещенной или замещенной группами, выбранными из
(a) гидроксильной группы;
(b) фенильной группы;
(c) 5-6-членной моноциклической гетероциклоалкильной группы, содержащей 1-3 одинаковых или различных гетероатома, таких как атом(ы) кислорода, азота или серы, причем указанная группа может быть замещена (1) оксогруппой; или (2) оксогруппой и С1-С6алкильной группой;
(d) С3-С8циклоалкильной группы, которая замещена (1) С1-С3алкоксикарбонильной группой или (2) гидроксиметильной группой;
(e) аминогруппы, которая может быть замещена (1) C1-С6алкильной группой; или (2) ацильной группой;
(f) карбоксильной группы;
(g) сложноэфирной группы: С1-С4алкоксикарбонильной;
(h) карбамоильной группы, которая замещена C1-С6алкильной группой или С1-С4алкоксикарбонильной группой;
(i) амидной группы, которая замещена (1) C1-С6алкильной группой; или (2) пиперидильной группой, замещенной С1-С6алкильной группой;
(j) С6-гетероциклоалкиламидной группы, содержащей 1 или 2 одинаковых или различных гетероатома, выбранных из кислорода, азота, причем указанная группа может быть замещена гидроксильной группой или С1-С6алкильной группой;
(k) сульфониламидной группы, замещенной С1-С6алкильной группой;
(m) группы -NR7COR8;
(n) группы -COR8;
(о) группы -NR9R10;
[3] С3-С8циклоалкильную группу, незамещенную или замещенную группами, выбранными из
(a) гидроксильной группы;
(b) оксогруппы;
(c) карбоксильной группы;
(d) С1-С4алкоксикарбонильной группы;
(е) цианогруппы; или
(f) С1-С6алкильной группы, которая замещена (1) гидроксильной группой; (2) аминогруппой, причем указанная аминогруппа, кроме того, замещена С1-С6алкильной группой; (3) толилсульфонилоксигруппой или (4) 5-6-членной моноциклической гетероциклической группой, содержащей два одинаковых или различных гетероатома, таких как атом(ы) кислорода или азота (причем указанная гетероциклическая группа может быть замещена (i) С1-С6алкильной группой, (ii) оксогруппой или (iii) ацетильной группой);
(g) амидной группы, причем указанная амидная группа замещена (1) С3-С8циклоалкильной группой или (2) C1-С6алкильной группой, которая дополнительно может быть замещена гидроксильной группой;
(h) С6-гетероциклоалкиламидной группы, содержащей один или два одинаковых или различных гетероатома, выбранных из атома азота или кислорода, причем указанная гетероциклоалкиламидная группа может быть замещена (1) С1-С6алкильной группой или (2) гидроксильной группой;
(i) аминогруппы, причем указанная аминогруппа может быть замещена (1) С1-С3алкильной группой, которая может быть дополнительно замещена С1-С3алкоксигруппой, (2) C1-С4ацильной группой, которая может быть дополнительно замещена карбоксильной группой или (3) C1-С4алкоксикарбонильной группой;
(j) гетероциклоалкильной группы, которая представляет собой 5-7-членную моноциклическую гетероциклическую группу, содержащую 1-2 одинаковых или различных гетероатома, таких как атом(ы) азота, кислорода или серы, причем указанная гетероциклоалкильная группа может быть замещена (1) С1-С6алкильной группой, которая дополнительно замещена гидроксильной группой; (2) оксогруппой;
(3) С1-С6алкильной группой; (4) С1-С4ацильной группой; (5) гидроксильной группой; (6) аминогруппой, причем указанная аминогруппа может быть замещена (i) C1-С6алкильной группой; (ii) С1-С4ацильной группой; (iii) С1-С4алкоксикарбонильной группой; (7) C1-С3алкоксигруппой; (8) С1-С4алкоксикарбонильной группой, которая может быть дополнительно замещена фенильной группой; (9) карбоксильной группой; (10) амидной группой, которая дополнительно замещена С1-С6алкильной группой; (11) сульфонильной группой, которая дополнительно замещена С1-С6алкильной группой;
(k) 1,4-диокса-8-азаспиро[4,5]декан-8-ила; или (1) уреидной группы, замещенной дополнительно С1-С6алкильной группой и С1-С6алкильной группой, замещенной гидроксильной или бензилоксикарбонильной группой;
[4] гетероциклоалкильную группу, содержащую
(a) гексагидро-1Н-пирроло[1,2-c]имидазолил;
(b) дигидро-1Н-индолил;
(с) пирролидинил;
(а) пиперидинил, где указанная гетероциклоалкильная группа представляет собой незамещенную группу или замещенную группу, содержащую
(1) бензильную группу;
(2) С1-С4ацильную группу;
(3) оксогруппу;
(4) тетрагидропиранил;
(5) пиперидинил, который может быть замещен (i) C1-С4ацильной группой; (ii) амидной группой, которая может быть замещена С1-С6алкильной группой или (iii) сульфонильной группой, которая замещена С1-С6алкильной группой;
(6) 1,4-диоксаспиро[4,5]декан-8-ильную группу;
(7) С1-С6алкильную группу, которая замещена (i) карбоксильной группой или (ii) С1-С4алкоксикарбонильной группой;
(8) амидную группу, которая замещена С1-С6алкильной группой;
(9) С6-гетероциклоалкиламидную группу, содержащую два одинаковых или различных гетероатома, выбранных из атома азота или кислорода, которая может быть замещена C1-С6алкильной группой;
(10) сульфонамидную группу, которая замещена C1-С6алкильной группой;
(11) С3-С8циклоалкильную группу, которая замещена (i) оксогруппой или (ii) гидроксильной группой;
(12) С1-С4алкоксикарбонильную группу;
[5] фенильную группу, которая не замещена или замещена группами, содержащими
(a) атом(ы) галогена;
(b) нитрогруппу;
(c) цианогруппу;
(d) C1-С3ацильную группу;
(e) аминогруппу, которая может быть замещена (1) С1-С4ацильной группой, которая может быть дополнительно замещена С1-С3алкоксигруппой; или (2) С1-С6алкильной группой, которая дополнительно замещена гидроксильной группой;
(f) амидную группу, причем указанная амидная группа замещена С1-С6алкильной группой, которая дополнительно может быть замещена (i) C1-С3алкоксигруппой; или (ii) гидроксильной группой;
(g) С1-С4алкоксикарбониламиногруппу;
(h) С1-С4алкоксикарбонильную группу;
(i) C1-С3алкоксигруппу, причем указанная алкоксигруппа может быть замещена (1) карбоксильной группой, (2) С1-С4алкоксикарбонильной группой или (3) амидной группой, которая дополнительно замещена С1-С6алкильной группой, (4) пиперазильной группой, которая замещена C1-С3алкильной группой (в которой указанная алкильная группа может быть дополнительно замещена гидроксильной группой или С1-С3ацилоксигруппой);
(j) карбоксильную группу;
(k) сульфоновую группу, которая может быть замещена С1-С3алкильной группой, которая может быть дополнительно замещена гидроксильной группой;
(l) сульфонамидную группу, замещенную С1-С3алкильной группой;
(m) С6-гетероциклоалкилсульфонамидную группу, содержащую один или два одинаковых или различных гетероатомов, таких как атом азота или кислорода, которая может быть замещена С1-С6алкильной группой, гидроксильной группой, трет-бутил(диметил)силилокси группой, C1-С4алкоксикарбонильной группой;
(n) аминосульфонильную группу, которая может быть замещена С1-С6алкильной группой;
(o) незамещенную С1-С6алкильную группу или замещенную группу, содержащую
(1) C1-С3алкоксигруппу;
(2) карбоксильную группу;
(3) С1-С3алкоксикарбонильную группу;
(4) амидную группу, которая замещена С1-С6алкильной группой;
(5) гидроксильную группу;
(6) аминогруппу, которая замещена С1-С3алкильной группой;
(7) морфолинил;
(8) диоксоимидазолидинильую группу, которая замещена С1-С6алкильной группой;
(р) С6-гетероциклоалкиламидную группу, содержащую один или два одинаковых или различных гетероатома, таких как атом азота или кислорода, которая может быть замещена гидроксильной или С1-С6алкильной группой;
(q) гетероциклоалкильную группу, которая представляет собой 5-7-членную моноциклическую гетероциклическую группу, содержащую 1-2 одинаковых или различных гетероатома, таких как атом(ы) азота или кислорода, причем указанный гетероциклоалкил может быть замещен
(1) гидроксильной группой;
(2) оксогруппой;
(3) С1-С4ацильной группой;
(4) С1-С6алкильной группой;
(5) аминогруппой, которая может быть замещена (i) C1-С6алкильной группой, и (ii) С1-С4алкоксикарбонильной группой;
(г) 1,4-диокса-8-азаспиро[4,5]декан-8-ильную группу;
(s) трифторметильную группу; и
(t) пиперазинильную группу, которая замещена C1-С6алкильной группой;
[6] гетероарильную группу, выбранную из группы, содержащей
(a) незамещенный индолил или индолил, замещенный С1-С5ацильной группой;
(b) незамещенный индолинил или индолинил, замещенный
(1) С1-С5ацильной группой;
(2) С1-С4алкоксикарбонильной группой;
(3) оксогруппой или
(4) сульфонильной группой, которая замещена C1-С3алкильной группой;
(c) незамещенный пиридил или пиридил, замещенный
(1) 1-2 атомами галогена;
(2) амидной группой, которая замещена (i) C1-С6алкильной группой, в которой указанная алкильная группа может быть дополнительно замещена аминогруппой (причем указанная аминогруппа дополнительно замещена C1-С6алкильной группой) или гидроксильной группой; (ii)
С3-С6циклоалкильной группой, которая замещена гидроксильной группой; (iii) пиперидильной группой, которая может быть замещена С1-С3алкильной группой или C1-С3ацильной группой;
(3) С6-гетероциклоалкиламидной группой, содержащей один или два гетероатома азота, которая замещена (i) C1-С6алкильной группой или (ii) гидроксильной группой;
(4) С1-С4ациламиногруппой;
(5) С1-С6алкильной группой, причем указанная алкильная группа замещена (i) гидроксильной группой, (ii) морфолинильной группой, (iii) пиперидинильной группой, которая может быть замещена гидроксильной группой или (iv) пиперазильной группой, которая может быть замещена С1-С4ацильной группой;
(6) карбоксильной группой;
(7) С1-С4алкоксикарбонильной группой;
(8) гетероциклоалкильной группой, выбранной из пиперидинила, пиперазинила, имидазолидинила (причем указанная гетероциклоалкильная группа замещена (i) гидроксильной группой, (ii) оксогруппой или (iii) C1-С6алкильной группой; или
[7] гетероциклоалкильную группу, где кольцо образовано вместе с атомом азота, соединяющим R5 или R6, и представляет собой (а) дигидро-1Н-индолинильную группу, которая замещена С1-С4ациламиногруппой; или (b) пиперидинильную группу, которая замещена (1) амидной группой (которая замещена С1-С6алкильной группой), (2) C1-С6алкильной группой (которая замещена гидроксильной группой), (3) карбоксильной группой, (4) С1-С4алкоксикарбонильной группой;
R7 представляет собой атом водорода или незамещенную С1-С3алкильную группу или С1-С3алкильную группу, замещенную С1-С4алкоксикарбонильной группой;
R8 представляет собой гетероциклоалкильную группу, выбранную из морфолинила, пиперидинила или пиперазинила, причем указанная гетероциклоалкильная группа является незамещенной или замещенной гидроксильной группой или C1-С6алкильной группой; или группу
-ОН, OR7 или -NR9R10;
R9 и R10, одинаковые или разные, обозначают атом водорода, незамещенную С1-С3алкильную группу или C1-С3алкильную группу, замещенную гидроксильной группой или С1-С4алкоксикарбонильной группой; пиперидинильную группу, замещенную С1-С6алкильной группой, С1-С4ацильную группу, замещенную гидроксильной группой, С1-С3алкоксигруппой; незамещенную ацильную группу; группу -SO2R7;
или их фармацевтически приемлемые соли.
2. Соединение по п.1, где R1 обозначает незамещенную С3-С8циклоалкильную группу.
3. Соединение по п.1, где R1 обозначает незамещенную циклогексильную группу.
4. Соединение по п.1, где R1 обозначает незамещенную тетрагидропиранильную группу.
5. Соединение по любому из пп.1-4, где R2 обозначает метильную группу.
6. Соединение по любому из пп.1-5, где R4 обозначает группу -CONR5R6.
7. Соединение по п.6, где любой из R5 и R6 обозначает атом водорода.
8. Соединение по п.6, где любой из R5 и R6 обозначает незамещенную С3-С8циклоалкильную группу или замещенную С3-С8циклоалкильную группу, где заместители указаны в п.1.
9. Соединение по п.6 или 7, где любой один из R5 и R6 обозначает С3-С8циклоалкильную группу, которая замещена гетероциклоалкильной группой, в которой указанная гетероциклоалкильная группа может быть дополнительно замещена заместителями, указанными в п.1.
10. Соединение по п.6 или 7, где любой из R5 и R6 обозначает фенильную группу, которая дополнительно замещена заместителями, указанными в п.1.
11. Соединение по п.6 или 7, где любой из R5 и R6 обозначает фенильную группу, которая замещена гетероциклоалкильной группой, которая может быть дополнительно замещена заместителями, указанными в п.1.
12. Фармацевтическая композиция для лечения аллергических заболеваний, воспалительных заболеваний или иммунологических заболеваний, содержащая соединение по любому из пп.1-11 или его фармацевтически приемлемую соль в качестве активного ингредиента.
13. Ингибитор PDE7 для лечения аллергических заболеваний, воспалительных заболеваний или иммунологических заболеваний, содержащий соединение по любому из пп.1-11 или его фармацевтически приемлемую соль в качестве активного ингредиента.
14. Способ получения соединений тиенопиразола, представленных формулой (I):
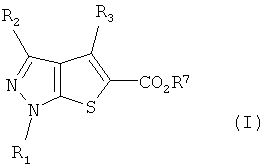
(где R1, R2, R3 и R7 имеют значения, определенные в п.1), предусматривающий хлорирование производного пиразол-5-она, представленного формулой (VI):
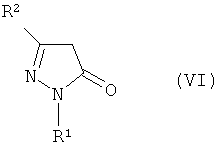
(где R1 и R2 имеют значения, определенные в п.1); и затем реакцию электрофильного замещения полученного соединения без отделения с образованием производного пиразола формулы (IV):
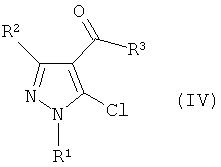
(где R1, R2 и R3 имеют значения, определенные в п.1); затем реакцию полученного производного пиразола формулы (IV) с соединением формулы (III) в присутствии основания:
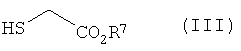
(где R7 имеет значения, определенные в п.1)
с образованием соединения формулы (II):
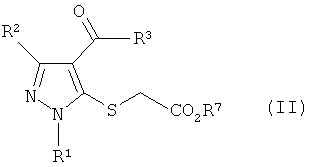
(где R1, R2, R3 и R7 имеют значения, определенные в п.1); и затем обработку полученного соединения формулы (II) основанием с получением соединения тиенопиразола формулы (I).
15. Способ получения соединений тиенопиразола, представленных формулой (I):

(где R1, R2, R3 и R7 имеют значения, определенные в п.1), предусматривающий реакцию электрофильного замещения производного хлорпиразола формулы (V):
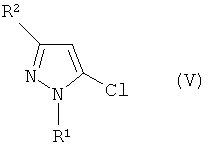
(где R1 и R2 имеют значения, определенные в п.1)
с получением производного пиразола формулы (IV):
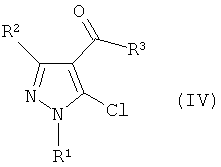
(где R1, R2 и R3 имеют значения, определенные в п.1); затем реакцию полученного производного пиразола формулы (IV) с соединением формулы (III) в присутствии основания:
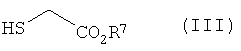
(где R7 имеет значения, определенные в п.1)
с образованием соединения формулы (II):
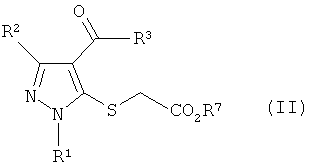
(где R1, R2, R3 и R7 имеют значения, определенные в п.1)
и затем обработку полученного соединения формулы (II) основанием с получением соединения тиенопиразола формулы (I).
16. Способ получения соединений тиенопиразола, представленных формулой (I):

(где R1, R2, R3 и R7 имеют значения, определенные в п.1), предусматривающий реакцию производного пиразола формулы (IV):
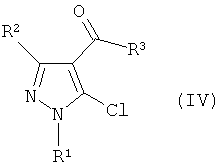
(где R1, R2 и R3 имеют значения, определенные в п.1)
с соединением формулы (III) в присутствии основания
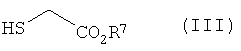
(где R7 имеет значения, определенные в п.1)
с образованием соединения формулы (II):
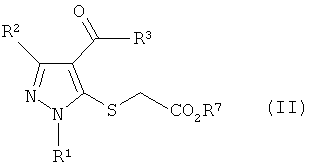
(где R1, R2, R3 и R7 имеют значения, определенные в п.1)
и затем обработку полученного соединения формулы (II) основанием с получением соединения тиенопиразола формулы (I).
17. Способ получения соединения тиенопиразола, представленного формулой (I), по п.16, где превращение соединения формулы (IV) в соединение формулы (I) проводят синтезом в одном сосуде без отделения соединения формулы (II).
18. Способ по одному из пп.14-17, где соединение формулы (III) представляет собой тиогликолевую кислоту или сложный эфир тиогликолевой кислоты.
19. Соединение формулы (IV)
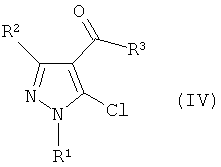
(где R1 имеет значения, определенные в п.1; R2 обозначает С1-С2алкильную группу и R3 обозначает атом водорода).
20. Соединение формулы (II):
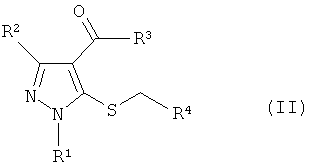
где R1 представляет собой незамещенную С3-С8циклоалкильную группу, R2 и R3 имеют значения, определенные в п.1, R4 представляет собой группу -CO2R7 и фенильную группу, замещенную атомом галогена, в которой R7 представляет собой незамещенную С1-С3алкильную группу.
РИСУНКИ
|