Патент на изобретение №2376307
|
||||||||||||||||||||||||||||||||||||||||||||||
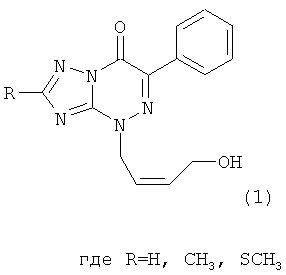
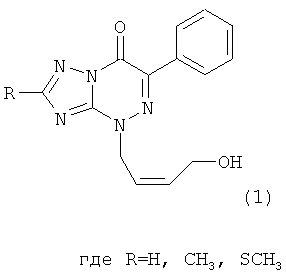
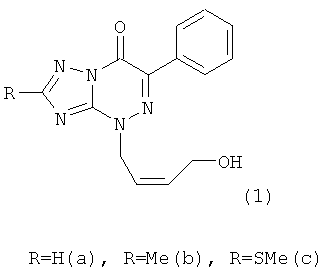
(54) 4-((Z)-4′-ГИДРОКСИБУТЕН-2′-ИЛ)-2-R-6-ФЕНИЛ-1,2,4-ТРИАЗОЛО[5,1-c][1,2,4]ТРИАЗИН-7-ОНЫ
(57) Реферат:
Настоящее изобретение относится к 4-((Z)-4
обладающие противовирусным действием в отношении вируса герпеса простого типа 1 (ВПГ-1). Технический результат: получены новые производные 1,2,4-триазоло[5,1-с][1,2,4]триазин-7-она, обладающие полезными биологическими свойствами. 1 табл.
1. Область техники, к которой относится изобретение. Изобретение относится к области молекулярной биологии, вирусологии и медицины и касается Z-изомеров 4-(4′-гидроксибутен-2′-ил)-2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]триазин-7-онов, обладающих противовирусным действием в отношении вируса герпеса простого типа 1 (ВПГ-1), предназначенных для лечения и профилактики инфекционных заболеваний человека, вызванных вирусом герпеса простого типа 1. Изобретение может быть использовано в лечебных учреждениях и научно-исследовательских лабораториях. 2. Уровень техники Актуальность проблемы противовирусной терапии в условиях выявления новых возбудителей опасных и медленных вирусных инфекций, а также быстрое появление мутантных штаммов вирусов, резистентных к применяемым лекарствам, вызывает потребность в новых эффективных и малотоксичных противовирусных препаратах. В настоящее время наиболее распространенной и перспективной группой противовирусных препаратов, эффективных в отношении вирусов герпеса, гепатитов, вируса иммунодефицита человека и других, являются ациклические нуклеозиды – ацикловир, ганцикловир, пенцикловир, его депо форма фамцикловир и проч. (Машковский М.Д. Лекарственные средства: в 2-х т. 14-е изд. М.: Новая волна. 2000. Т.1, 2.; Регистр лекарственных средств России. Энциклопедия лекарств. Под ред. Г.Л.Вышковского. М.: ООО РЛС-2004. 2004. 1503 с., E.De Clercq “Antiviral drugs: Current state of the art” J. of Clinical Virology 22 (2001) 73-89), которые являются структурными аналогами природных нуклеозидов пуринового ряда и ингибиторами ферментов синтеза вирусных нуклеиновых кислот
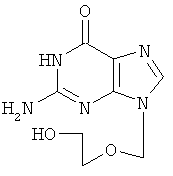
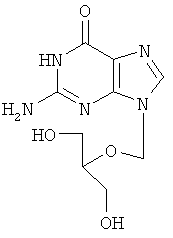
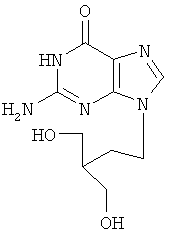
Недостатками имеющихся препаратов являются их низкая оральная биодоступность и достаточно высокая токсичность. Кроме указанных типов соединений имеются данные о противовирусном действии 6-нитро-1,2,4-триазоло[5,1-с]-1,2,4-триазин-7(4Н)-онов (Синтез и противовирусная активность 6-нитро-7-оксо-4,7-дигидроазоло [5,1-с][1,2,4]триазинов. В.Л.Русинов, Е.Н.Уломский, О.Н.Чупахин, М.М.Зубаиров, А.Б.Капустин, Н.И.Митин и др. / Химико-фармацевтический журнал.
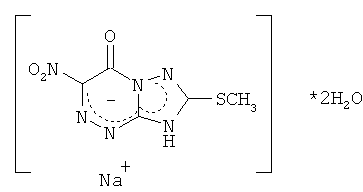
Известна натриевая соль 2-метилтио-6-нитро-1,2,4-триазоло[5,1-с]-1,2,4-триазин-7(4Н)-она дигидрат, которая принадлежит к ряду соединений, проявляющих противовирусное действие (О.Н.Чупахин, В.Л.Русинов, Е.Н.Уломский, В.Н.Чарушин, А.Ю.Петров, О.И.Киселев. Натриевая соль 2-метилтио-6-нитро-1,2,4-триазоло[5,1-с]-1,2,4-триазин-7(4Н)-она, дигидрат, обладающая противовирусной активностью. Патент РФ
Натриевая соль 2-метилтио-6-нитро-1,2,4-триазоло[5,1-с]-1,2,4-триазин-7(4Н)-она дигидрат является близким структурным аналогом заявляемых соединений и потому выбрана в качестве прототипа. Указанное соединение проявляет противовирусную активность в отношении вирусов ВЭЛ (венесуэльский энцефаломиэлит лошадей), ЛДР (лихорадка долины Рифт), Синдбис, ВБА (вирус болезни Ауески), вируса гриппа птиц в отношении вируса ЗЭЛ (западный энцефаломиэлит лошадей). Задачей изобретения является поиск новых соединений, обладающих более широким спектром противовирусного действия и низкой токсичностью. 3. Сущность изобретения Сущность изобретения составляют 4-((Z)-4′-гидроксибутен-2′-ил)-2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]триазин-7-оны общей формулы (1)
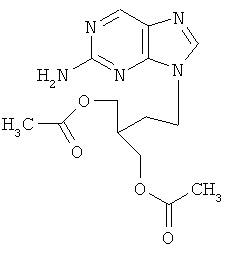
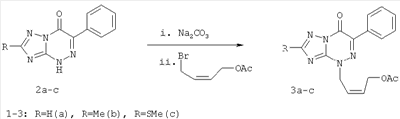
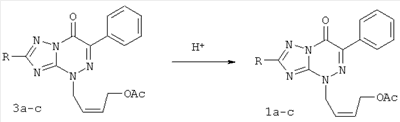
обладающие противовирусным действием в отношении вируса герпеса простого типа 1 (ВПГ-1). Фрагмент R в заявляемых соединениях является либо водородом, либо метильной группой, либо метилтиогруппой. 4. Сведения, подтверждающие возможность осуществления изобретения 4.1. Синтез заявляемых соединений Синтез заявляемых соединений осуществляют в две стадии. На первой стадии исходное соединение 2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]триазин-7-он (2) последовательно обрабатывают водным раствором карбоната натрия и после выделения осадка нагревают с (Z)-4-бромбутен-2-илацетатом в ДМФА с образованием промежуточного соединения – 4-((Z)-4′-ацетоксибутен-2′-ил)-2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]триазин-7-она (3). Строение промежуточных соединений (3) подтверждено данными элементного анализа, 1Н ЯМР, 13С ЯМР и ИК-спектроскопии На второй стадии промежуточное соединение 4-((Z)-4′-ацетоксибутен-2′-ил)-2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]три-азин-7-он (3) обрабатывают в метаноле хлористым ацетилом и получают заявляемое соединение 4-((Z)-4′-гидроксибутен-2′-ил)-2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]триазин-7-он (1). Строение заявляемых соединений (1) подтверждено данными элементного анализа, 1Н ЯМР, 13С ЯМР и ИК-спектроскопии 4.1.1. Синтез 4-((Z)-4′-Ацетоксибутен-2′-ил)-2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]три-азин-7-онов (3а-с). Суспензию 9.40 ммоль 6-фенил-2-R-1,2,4-триазоло[5,1-с][1,2,4]триазин-7-она (2а-с) в 6 мл 17% раствора Na2CO3 перемешивают при комнатной температуре в течение 0.5 ч, осадок отфильтровывают, сушат и растворяют в 10 мл ДМФА. К полученному раствору добавляют 1.77 г (9.20 ммоль) (2)-4-бромбутен-2-илацетата и реакционную массу нагревают на водяной бане 2 ч. К охлажденной реакционной массе добавляют 200 мл воды, осадок отфильтровывают и кристаллизуют из изопропилового спирта. 3а (R=Н): (30%), т.пл. 83°C. Спектр ЯМР 1Н (400 МГц, 3b (R=Me): (60%), т.пл. 70°С. Спектр ЯМР 1H (400 МГц, 3с (R=SMe): (67%), т.пл. 104°С. Спектр ЯМР 1Н (400 МГц, 4.1.2. Синтез 4-((Z)-4′-гидроксибутен-2′-ил)-2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]триазин-7-онов (1a-c). При температуре 5°С к 30 мл метилового спирта прибавляют 1 мл хлористого ацетила. К полученному раствору добавляют 1.5 ммоль 4-(4′-ацетоксибутен-2′-ил)-2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]триазин-7-она (3а-с) реакционную массу выдерживают при комнатной температуре 4 ч, нейтрализуют безводным ацетатом натрия и упаривают в вакууме водоструйного насоса на водяной бане. Из остатка методом колоночной хроматографии на силикагеле выделяют продукт (1a-c). Элюент этилацетат: гексан (4:1). 1a (R=Н): (41%), т.пл. 112°С. Спектр ЯМР 1Н (400 МГц, 1b (R=Me): (70%), т.пл. 125°С. Спектр ЯМР 1Н (400 МГц, 1c (R=SMe): (45%), т.пл. 146°С. Спектр ЯМР 1Н (400 МГц, 4.2. Противовирусное действие заявляемых соединений Материалы и методы Клетки. Использовали монослойные 24-часовые культуры перевиваемых линий клеток почек зеленой мартышки Vero-Е6 (ростовая питательная среда Игла (произв. Института полиомиелита и вирусных энцефалитов РАМН) с добавлением эмбриональной сыворотки телят ЭТС (7%) (произв. «ПанЭко», Москва). Вирусы. В работе использовали эталонный штамм вируса герпеса простого типа 1 ((ВПГ-1, штамм L2).
Противогерпесвирусная активность заявляемых соединений in vitro Противовирусную активность исследовали в культуре клеток Vero, выращенной в 96-луночных панелях (Linbro, Flow labor., UK). Культуру клеток инфицировали вирусом с множественностью 0,1 или 0,01 БОЕ/кл и инкубировали под жидкой средой поддержки (среды Игла и 199, соединенные в соотношении 1:1 + 2% эмбриональной телячьей сыворотки), содержащей препарат в известной концентрации. Препарат вносили непосредственно перед инфицированием. После инкубации в течение 48 или 72 часов, по достижении 95-100% цитопатического эффекта (ЦПЭ) определяли концентрацию, ингибирующую развитие вирусиндуцированного ЦПЭ на 50% по сравнению с контролем (ИД50), и концентрацию, ингибирующую развитие вирусиндуцированного ЦПЭ полностью (ИД95). Результаты исследования противовирусного действия приведены в таблице.
Новые соединения подавляют репликацию вируса герпеса простого типа 1 (ВПГ-1) в культуре клеток Vero, обеспечивают защиту клеток от цитопатогенного действия вируса и не проявляют токсичности в отношении хозяйских клеток вплоть до крайне высоких концентраций. Соединение-прототип обладает существенно более низким противовирусным действием в отношении ВПГ-1. Вирусологические тесты проведены в соответствии с описанными ранее протоколами.
Формула изобретения
4-((Z)-4
|
||||||||||||||||||||||||||||||||||||||||||||||

 -гидроксибутен-2
-гидроксибутен-2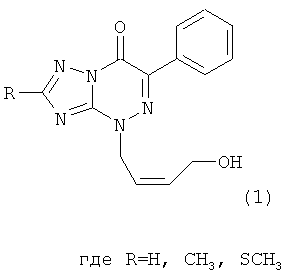
 9, 1990, с.41-44), являющихся структурными аналогами пуринов
9, 1990, с.41-44), являющихся структурными аналогами пуринов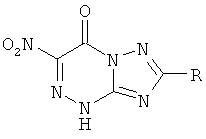
 м.д., nJ/Гц): 2.04 (с, 3Н, ОАс); 4.82 (д.д, 2Н, Н(4′), 3J=6.5,4J=1.3 Гц); 5.16 (д.д, 2Н, H(1′), 3J=6.5, 4J=1.2 Гц); 5.85 (д.т.т, 1Н, Н(2′), 3J=11.0, 3J=6.5, 4J=1.3 Гц); 5.94 (д.т.т, 1Н, Н(3′), 3J=11.0, 3J=6.5, 4J=1.2 Гц); 7.49-7.54 (м, 3Н Нm, Нр); 8.01 (м, 2Н, Н0); 8.45 (с, 1Н, Н-2). Спектр ЯМР 13С (100 МГц,
м.д., nJ/Гц): 2.04 (с, 3Н, ОАс); 4.82 (д.д, 2Н, Н(4′), 3J=6.5,4J=1.3 Гц); 5.16 (д.д, 2Н, H(1′), 3J=6.5, 4J=1.2 Гц); 5.85 (д.т.т, 1Н, Н(2′), 3J=11.0, 3J=6.5, 4J=1.3 Гц); 5.94 (д.т.т, 1Н, Н(3′), 3J=11.0, 3J=6.5, 4J=1.2 Гц); 7.49-7.54 (м, 3Н Нm, Нр); 8.01 (м, 2Н, Н0); 8.45 (с, 1Н, Н-2). Спектр ЯМР 13С (100 МГц,  /см-1: 1713, 1745(С=O).
/см-1: 1713, 1745(С=O).
 0,5(37,31) 0,25(22,73)
0,5(37,31) 0,25(22,73)