|
|
(21), (22) Заявка: 2006134037/04, 25.02.2005
(24) Дата начала отсчета срока действия патента:
25.02.2005
(30) Конвенционный приоритет:
26.02.2004 FR 0401950
(43) Дата публикации заявки: 10.04.2008
(46) Опубликовано: 20.12.2009
(56) Список документов, цитированных в отчете о
поиске:
J.Med.Chem. 2003, 46, 2352-2360. WO 99/26584 A, 03.06.1999. WO 02/087569 A, 07.11.2002. RU 2331637, 20.08.2008.
(85) Дата перевода заявки PCT на национальную фазу:
26.09.2006
(86) Заявка PCT:
FR 2005/000453 20050225
(87) Публикация PCT:
WO 2005/090347 20050929
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
АБУАБДЕЛЛА Ахмед (FR),
АЛЬМАРИО ГАРСИЯ Антонио (FR),
ХОРНАРТ Кристиан (FR),
ЛАРДЕНУА Патрик (FR),
МАРГЕ Франк (FR)
(73) Патентообладатель(и):
САНОФИ-АВЕНТИС (FR)
|
(54) ПРОИЗВОДНЫЕ АРИЛ- И ГЕТЕРОАРИЛПИПЕРИДИНКАРБОКСИЛАТОВ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА FAAH
(57) Реферат:
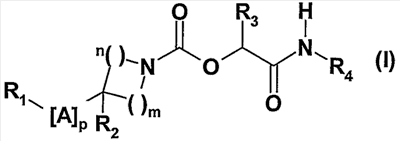
Изобретение относится к новым производным арил и гетероарилпиперидинкарбоксилатов формулы (I):
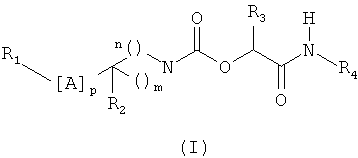
где: m и n означают целые числа от 1 до 3 такие, что m+n является целым числом от 2 до 5; р означает целое число от 1 до 7; А означает простую связь или выбран из одной или нескольких групп X, Y; Х означает -СН2-; Y означает С2-алкиниленовую группу; R1 означает группу R5, замещенную одной или несколькими группами R6 и/или R7; R2 означает Н, F, ОН; R3 означает Н; R4 означает Н, С1-6-алкил; R5 означает группу, выбранную из фенила, пиридинила, пиримидинила, пирролила, имидазолила, тиазолила, пиразолила, изоксазолила, оксадиазолила, нафтила, хинолинила, тетрагидрохинолинила, изохинолинила, тетрагидроизохинолинила, индолила, индолинила, изоиндолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензотриазолила, бензоксадиазолила, пирролопиридинила; R6 означает галоген, CN, С1-6-алкил, С3-7-циклоалкил, С1-6-алкокси, ОН, C1-6-фторалкил, C1-6-фторалкокси, или цикл, выбранный из пирролидинового и пиперидинового цикла, причем этот цикл необязательно замещен C1-6-алкильной группой; R7 означает фенильную группу, причем группа или группы R7 могут быть замещены одной или несколькими группами R6, одинаковыми или отличающимися друг от друга, выбранными из галогена, С1-6-алкила и
С1-6-фторалкила, С1-6-алкокси, в виде фармацевтически приемлемого основания или кислотно-аддитивной соли. Соединения пригодны в качестве ингибиторов фермента FAAH. 7 н. и 3 з.п. ф-лы, 1 табл.
Объектом изобретения являются производные арил- и гетероарилпиперидинкарбоксилатов, их получение и их применение в терапии.
Известны производные фенилалкилкарбаматов, диоксан-2-алкилкарбаматов и типа арилоксиалкилкарбаматов, описанные соответственно в документах FR2850377 A, WO2004/020430 A2 и PCT/FR2005/00028, являющиеся ингибиторами фермента FAAH (Fatty Acid Amido Hydrolase).
Потребность найти и разработать ингибиторы фермента FAAH существует всегда. Соединения согласно изобретению отвечают этой цели.
Соединения согласно изобретению отвечают общей формуле (I):
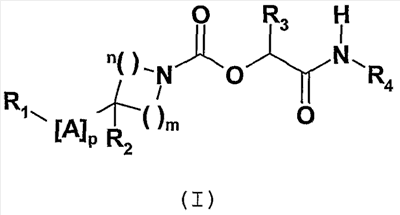
в которой
m и n означают целые числа от 1 до 3 такие, что m+n является целым числом от 2 до 5,
p означает целое число от 1 до 7,
A означает простую связь или выбран из одной или нескольких групп X, Y и/или Z,
X означает метиленовую группу, необязательно замещенную одной или двумя группами, представляющими C1-6-алкил, C3-7-циклоалкил или C3-7-циклоалкил-C1-3-алкилен,
Y означает C2-алкениленовую группу, необязательно замещенную одной или двумя группами, представляющими C1-6-алкил, C3-7-циклоалкил или C3-7-циклоалкил-C1-3-алкилен; или C2-алкиниленовую группу;
Z означает группу формулы:

o означает целое число от 1 до 5,
r и s означают целые числа и определены так, что r+s является числом от 1 до 5,
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7,
R2 означает атом водорода или фтора, гидроксильную группу, C1-6-алкокси или NR8R9,
R3 означает атом водорода или C1-6-алкильную группу,
R4 означает атом водорода или группу, представляющую C1-6-алкил, C3-7-циклоалкил или C3-7-циклоалкил-C1-3-алкил;
R5 означает группу, выбранную из фенила, пиридинила, пиримидинила, пиридазинила, пиразинила, триазинила, пирролила, фуранила, тиенила, имидазолила, оксазолила, тиазолила, пиразолила, изоксазолила, изотиазолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, нафтила, хинолинила, тетрагидрохинолинила, изохинолинила, тетрагидроизохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, нафтиридинила, бензофуранила, дигидробензофуранила, бензотиенила, дигидробензотиенила, индолила, индолинила, индазолила, изоиндолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензотриазолила, бензоксадиазолила, бензотиадиазолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила,
R6 означает атом галогена или группу, представляющую циано, нитро, C1-6-алкил,
C3-7-циклоалкил, C1-6-алкокси, гидроксил, C1-6-тиоалкил, C1-6-фторалкил, C1-6-фторалкокси, C1-6-фтортиоалкил, NR8R9, NR8COR9, NR8CO2R9, NR8SO2R9, COR8, CO2R8, CONR8R9, SO2R8, SO2NR8R9, -О-(C1-3-алкилен)-О или цикл, выбранный из азетидинового, пирролидинового, пиперидинового, морфолинового, тиоморфолинового, азепинового, пиперазинового цикла, причем этот цикл необязательно замещен C1-6-алкильной или бензильной группой;
R7 означает фенильную группу, фенилокси, бензилокси, нафтил, пиридинил, пиримидинил, пиридазинил или пиразинил, причем группа или группы R7 могут быть замещены одной или несколькими группами R6, одинаковыми или отличающимися друг от друга;
R8 и R9 независимо друг от друга означают атом водорода или C1-6-алкильную группу.
Таким образом, в рамках изобретения соединения общей формулы (I) могут содержать несколько групп A, одинаковых или отличных друг от друга.
Из соединений общей формулы (I) первую подгруппу соединений образуют соединения, в которых:
m и n означают целые числа, равные 1 или 2, такие, что m+n является целым числом от 2 до 4,
p означает целое число, равное от 1 до 3,
A означает простую связь, метиленовую группу или C2-алкинилен;
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7,
R2 означает атом водорода или гидроксильную группу,
R3 означает атом водорода или C1-6-алкильную группу,
R4 означает атом водорода или группу C1-6-алкил, C3-7-циклоалкил или C3-7-циклоалкил-C1-3-алкил,
R5 означает группу, выбранную из фенила, пиридинила, пиримидинила, имидазолила, тиазолила, пиразолила, изоксазолила, оксадиазолила, нафтила, тетрагидрохинолинила, изохинолинила, тетрагидроизохинолинила, индолила, индолинила, бензимидазолила, бензоксазолила, бензотиазолила, бензотриазолила, пирролопиридинила;
R6 означает атом галогена, в частности бром, хлор, фтор, или группу, представляющую циано, C1-6-алкил, в частности метил, бутил, изобутил, C3-7-циклоалкил, в частности циклопентил, C1-6-алкокси, в частности метокси или этокси, C1-6-фторалкил, в частности трифторметил, или пирролидиновый или пиперидиновый цикл, причем этот цикл необязательно замещен C1-6-алкильной группой, в частности изопропилом;
R7 означает фенильную группу, которая может быть замещена одной или несколькими группами R6, одинаковыми или отличающимися друг от друга.
Из соединений общей формулы (I) вторую подгруппу соединений образуют соединения, в которых:
m и n означают целые числа, равные 1 или 2, такие, что m+n является целым числом от 2 до 4;
p означает целое число от 1 до 3,
A означает простую связь, метиленовую группу или C2-алкинилен;
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7,
R2 означает атом водорода или гидроксильную группу,
R3 означает атом водорода или C1-6-алкильную группу,
R4 означает атом водорода или группу, представляющую C1-6-алкил, C3-7-циклоалкил или C3-7-циклоалкил-C1-3-алкил,
R5 означает группу, выбранную из фенила, пиридинила, пиримидинила, тиазолила, изоксазолила, нафтила, изохинолинила,
R6 означает атом галогена, в частности бром, хлор, фтор, или группу, представляющую циано, C1-6-алкил, в частности метил, бутил, изобутил, C3-7-циклоалкил, в частности циклопентил, C1-6-алкокси, в частности метокси или этокси, C1-6-фторалкил, в частности, трифторметил, или пирролидиновый или пиперидиновый цикл, причем этот цикл необязательно замещен C1-6-алкильной группой, в частности изопропилом,
R7 означает фенильную группу, которая может быть замещена одной или несколькими группами R6, одинаковыми или отличающимися друг от друга.
Из соединений общей формулы (I) третью подгруппу соединений образуют соединения, в которых:
m, n, p, A, R1 такие, как определено в первой подгруппе, определенной выше,
R3 означает атом водорода,
R4 означает атом водорода или С1-6-алкильную группу, в частности метил.
Из соединений определенных выше подгрупп можно назвать следующие соединения:
– [2-(метиламино)-2-оксоэтил]-4-{5-[4-(трифторметил)фенил]пиридин-2-ил}пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(4′-хлорбифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(4′-этоксибифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(3′,4′-дихлорбифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(3′-хлор-4′-фторбифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[(6-циклопентилпиридин-2-ил)метил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[2-(3-хлорфенил)этил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[2-(4-хлорфенил)этил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-{2-[3-(трифторметил)фенил]этил}пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-{2-[4-(трифторметил)фенил]этил}пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(2-бифенил-3-илэтил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[2-(1-нафтил)этил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[2-(2-нафтил)этил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[2-(6-циклопентилпиридин-2-ил)этил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[2-(6-пирролидин-1-илпиридин-2-ил)этил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(2-изохинолин-1-илэтил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[3-(3-хлорфенил)пропил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[3-(4-хлорфенил)пропил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-{3-[3-(трифторметил)фенил]пропил}пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-{3-[4-(трифторметил)фенил]пропил}пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[3-(3-цианофенил)пропил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(3-бифенил-2-илпропил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(3-бифенил-3-илпропил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[3-(1-нафтил)пропил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[3-(2-нафтил)пропил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[3-(1,3-тиазол-2-ил)пропил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[(3-хлорфенил)этинил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[(4-хлорфенил)этинил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(бифенил-3-илэтинил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(1-нафтилэтинил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(2-нафтилэтинил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(3-бифенил-2-илпроп-2-ин-1-ил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[(6-пирролидин-1-илпиридин-2-ил)метил]пиперидин-1-карбоксилат.
Из соединений общей формулы (I) одно подсемейство соединений образовано соединениями, отвечающими общей формуле (I’):
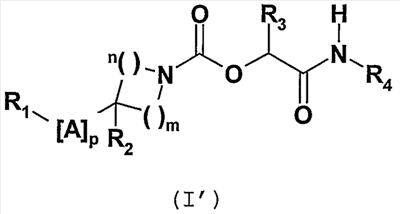
в которой
m и n означают целые числа от 1 до 3 такие, что m+n является целым числом от 2 до 5,
p означает целое число от 1 до 7,
A означает простую связь или выбрано из одной или нескольких групп X, Y и/или Z,
X означает метиленовую группу, необязательно замещенную одной или двумя группами, представляющими C1-6-алкил, C3-7-циклоалкил или C3-7-циклоалкил-C1-3-алкилен,
Y означает или C2-алкениленовую группу, необязательно замещенную одной или двумя группами, представляющими C1-6-алкил, C3-7-циклоалкил или C3-7-циклоалкил-C1-3-алкилен; или C2-алкиниленовую группу,
Z означает группу формулы:

o означает целое число от 1 до 5,
r и s означают целые числа и определены так, что r+s является числом от 1 до 5,
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7,
R2 означает атом водорода или фтор, гидроксильную группу, C1-6-алкокси или NR8R9,
R3 означает атом водорода или C1-6-алкильную группу,
R4 означает атом водорода или группу, представляющую C1-6-алкил, C3-7-циклоалкил или C3-7-циклоалкил-C1-3-алкил,
R5 означает группу, выбранную из фенила, пиридинила, пиримидинила, пиридазинила, пиразинила, триазинила, пирролила, фуранила, тиенила, имидазолила, оксазолила, тиазолила, пиразолила, изоксазолила, изотиазолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, нафтила, хинолинила, тетрагидрохинолинила, изохинолинила, тетрагидроизохинолинила, хиназолинила, хиноксалинила, фталазинила, циннолинила, нафтиридинила, бензофуранила, дигидробензофуранила, бензотиенила, дигидробензотиенила, индолила, индолинила, индазолила, изоиндолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензотриазолила, бензоксадиазолила, бензотиадиазолила, пирролопиридинила, фуропиридинила, тиенопиридинила, имидазопиридинила, оксазолопиридинила, тиазолопиридинила, пиразолопиридинила, изоксазолопиридинила, изотиазолопиридинила,
R6 означает атом галогена или группу, представляющую циано, нитро, C1-6-алкил,
C1-6-алкокси, гидроксил, C1-6-тиоалкил, C1-6-фторалкил, C1-6-фторалкокси, C1-6-фтортиоалкил, NR8R9, NR8COR9, NR8CO2R9, NR8SO2R9, COR8, CO2R8, CONR8R9,
SO2R8, SO2NR8R9 или -O-(C1-3-алкилен)-О,
R7 означает фенильную группу, фенилокси, бензилокси, нафтил, пиридинил, пиримидинил, пиридазинил или пиразинил, причем группа или группы R7 могут быть замещены одной или несколькими группами R6, одинаковыми или отличающимися друг от друга,
R8 и R9 независимо друг от друга означают атом водорода или C1-6-алкильную группу, или вместе с атомом или атомами, с которыми они связаны, образуют цикл, выбранный из азетидинового, пирролидинового, пиперидинового, морфолинового, тиоморфолинового, азепинового, пиперазинового цикла, необязательно замещенного C1-6-алкильной или бензильной группой.
Из соединений общей формулы (I’) первую подгруппу соединений образуют соединения, в которых:
m и n означают целые числа, равные 1 или 2, такие, что m+n является целым числом от 2 до 4,
p означает целое число, равное 1 или 2,
A означает простую связь или метиленовую группу;
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7,
R2 означает атом водорода или фтора, гидроксильную группу, C1-6-алкокси или NR8R9,
R3 означает атом водорода или C1-6-алкильную группу,
R4 означает атом водорода или группу, представляющую C1-6-алкил, C3-7-циклоалкил или C3-7-циклоалкил-C1-3-алкил,
R5 означает группу, выбранную из фенила, имидазолила, нафтила, тетрагидрохинолинила, тетрагидроизохинолинила, индолила, индолинила, бензимидазолила, бензотриазолила, пирролопиридинила,
R6 означает атом галогена, в частности бром, хлор, фтор, или C1-6-алкильную группу, в частности метил, бутил, C1-6-алкокси, в частности метокси или этокси, C1-6-фторалкил, в частности трифторметил,
R7 означает фенильную группу, которая может быть замещена одной или несколькими группами R6, одинаковыми или отличающимися друг от друга.
Из соединений общей формулы (I’) вторую подгруппу соединений образуют соединения, в которых:
m, n, p, A, R1 такие, как определено в первой подгруппе, определенной выше,
R3 означает атом водорода,
R4 означает атом водорода или C1-6-алкильную группу, в частности метил.
Из соединений общей формулы (I’) можно назвать следующие соединения:
– (2-амино-2-оксоэтил)-4-фенилпиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-фенилпиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-[3-(трифторметил)фенил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[3-(трифторметил)фенил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(4-фенил-1H-имидазол-1-ил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(1H-1,2,3-бензотриазол-1-ил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(4-бромфенил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(4′-фторбифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(4′-хлорбифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-гидрокси-4-(4′-метилбифенил-4-ил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(4′-бутилбифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-гидрокси-4-[4′-(трифторметил)бифенил-4-ил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-гидрокси-4-[4′-(метилокси)бифенил-4-ил]пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[4′-(этилокси)бифенил-4-ил]-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(3′,4′-дихлорбифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-[3′-фтор-4′-(метилокси)бифенил-4-ил]-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(3′-хлор-4′-фторбифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(нафталин-2-илметил)пиперидин-1-карбоксилат,
– [2-(метиламино)-2-оксоэтил]-4-(бифенил-4-илметил)пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-(1H-индол-1-илметил)пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-(2,3-дигидро-1H-индол-1-илметил)пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-(3,4-дигидрохинолин-1(2H)-илметил)пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-(3,4-дигидроизохинолин-2(1H)-илметил)пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-(1H-пирроло[2,3-b]пиридин-1-илметил)пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-(1H-бензимидазол-1-илметил)пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-[(4-фенил-1H-имидазол-1-ил)метил]пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-3-(2-фенилэтил)пирролидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-[2-(3,4-дигидрохинолин-1(2H)-ил)этил]пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-[2-(3,4-дигидроизохинолин-2(1H)-ил)этил]пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-[2-(1H-индол-1-ил)этил]пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-[2-(2,3-дигидро-1H-индол-1-ил)этил]пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-[2-(1H-пирроло[2,3-b]пиридин-1-ил)этил]пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-[2-(1H-бензимидазол-1-ил)этил]пиперидин-1-карбоксилат,
– (2-амино-2-оксоэтил)-4-[2-(4-фенил-1H-имидазол-1-ил)этил]пиперидин-1-карбоксилат.
Соединения общей формулы (I) могут содержать один или несколько асимметричных углеродов. Они могут существовать в форме энантиомеров или диастереомеров. Эти энантиомеры или диастереомеры, а также их смеси, в том числе рацемические смеси, являются частью изобретения.
Соединения формулы (I) могут существовать в виде оснований или кислотно-аддитивных солей. Такие аддитивные соли являются частью изобретения.
Эти соли предпочтительно получены с фармацевтически приемлемыми кислотами, но и соли других кислот, пригодные, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения.
Соединения общей формулы (I) могут находиться в виде гидратов или сольватов, а именно в виде ассоциатов или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть изобретения.
В контексте изобретения подразумевается, что:
– Ct-z, где t и z могут принимать значения от 1 до 7, означает углеродную цепь, которая может иметь от t до z атомов углерода, например, C1-3 означает углеродную цепь, которая может иметь от 1 до 3 атомов углерода;
– алкил означает насыщенную алифатическую группу, линейную или разветвленную; например, С1-6-алкильная группа означает углеродную цепь с 1-6 атомами углерода, линейную или разветвленную, в частности метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил;
– алкилен означает двухвалентную насыщенную алкильную группу, линейную или разветвленную, например, С1-3-алкиленовая группа означает двухвалентную углеродную цепь с 1-3 атомами углерода, линейную или разветвленную, в частности метилен, этилен, 1-метилэтилен, пропилен;
– циклоалкил означает циклическую алкильную группу, например, С3-7-циклоалкильная группа означает циклическую углеродную группу с 3-7 атомами углерода, в частности циклопропил, циклобутил, циклопентил, циклогексил, циклогептил;
– алкенилен означает двухвалентную ненасыщенную алифатическую группу с 2 атомами углерода, в частности этенилен;
– C2-алкинилиен означает группу -С С-; С-;
– алкокси означает -О-алкильную группу с насыщенной алифатической цепью, линейной или разветвленной;
– тиоалкил означает -S-алкильную группу с насыщенной алифатической цепью, линейной или разветвленной;
– фторалкил означает алкильную группу, в которой один или несколько атомов водорода замещены атомом фтора;
– фторалкокси означает алкоксигруппу, в которой один или несколько атомов водорода замещены атомом фтора;
– фтортиоалкил означает тиоалкильную группу, в которой один или несколько атомов водорода замещены атомом фтора;
– атом галогена означает фтор, хлор, бром или йод.
Соединения согласно изобретению могут быть получены по способу, показанному на следующей схеме.
Схема
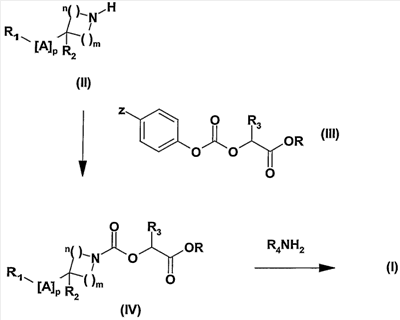
Соединения согласно изобретению могут быть получены, вводя в реакцию амин общей формулы (II), в которой R1, A, R2, p, m и n определены в общей формуле (I), с карбонатом общей формулы (III), в которой Z означает атом водорода или нитрогруппу, R3 определен в общей формуле (I), и R означает метильную или этильную группу, в растворителе, таком как толуол, дихлорэтан, ацетонитрил, или в смеси этих растворителей, при температуре, составляющей от 0°C до 80°C. Полученные сложные эфиры-карбаматы общей формулы (IV) преобразуют затем в соединения общей формулы (I) аминолизом амином общей формулы R4NH2, где R4 определен в общей формуле (I). Реакция аминолиза может быть проведена в растворителе, таком как метанол или этанол, или в смеси таких растворителей, как метанол и тетрагидрофуран.
Соединения общей формулы (I) или (IV), в которых R1 означает группу типа арил-арил, арил-гетероарил, гетероарил-арил или гетероарил-гетероарил, также могут быть получены реакцией соответствующих соединений общей формулы (I) или (IV), в которых R5 замещен атомом хлора, брома, йода или трифлатной группой в положении, куда должна быть введена группа R7, с производным арил- или гетероарилборной кислоты, следуя условиям реакции Сузуки (Chem. Rev. 1995, 95, 2457-2483) или с производным арил- или гетероарил-триалкилстаннана, следуя условиям реакции Штилла (Angew. Chem. Int. Ed. 1986, 25, 504-524).
Карбонаты общей формулы (III) могут быть получены по любому способу, описанному в литературе, например, путем реакции спирта общей формулы HOCHR2COOR, где R означает метильную или этильную группу, с хлорформиатом фенила или 4-нитрофенила, в присутствии такого основания, как триэтиламин или диизопропилэтиламин.
Соединения общей формулы (II), а также амины общей формулы R4NH2, когда способ их получения не описан, могут быть приобретены в торговле или описаны в литературе, или могут быть получены по другим способам, описанным в литературе или известным специалисту.
Соединения общей формулы (IV), в которой R1, A, R2, R3, p, m и n определены в общей формуле (I), и R означает метильную или этильную группу, являются новыми и также образуют часть изобретения. Они пригодны в качестве промежуточных соединений синтеза для получения соединений общей формулы (I).
Следующие примеры иллюстрируют получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими и только иллюстрируют настоящее изобретение. Микроанализ, ИК- и ЯМР-спектры и/или ЖХ-МС (жидкостная хроматография в сочетании с масс-спектроскопией) подтверждают структуру и чистоту полученных соединений.
Т.пл.(°C) означает температуру плавления в градусах Цельсия.
Номера, указанные в скобках в названиях примеров, соответствуют номерам, приведенным в первой колонке нижеследующей таблицы.
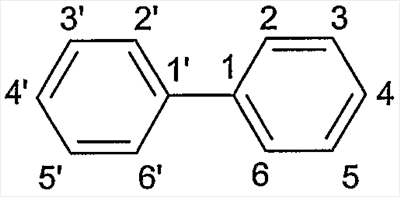
Для обозначения соединений в следующих примерах была использована номенклатура ИЮПАК (Международный Союз Чистой и Прикладной Химии, по-английски IUPAC). Например, для бифенильной группы соблюдалась следующая нумерация:
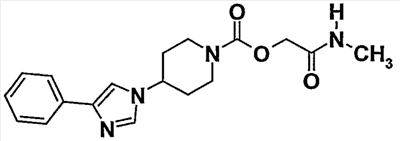
Пример 1 (соединение  14) 14)
[2-(метиламино)-2-оксоэтил]-4-(4-фенил-1H-имидазол-1-ил)пиперидин-1-карбоксилат
1.1. 1,1-диметилэтил-4-[(метилсульфонил)окси]пиперидин-1-карбоксилат
К раствору 3,0 г (14,9 ммоль) 1,1-диметилэтил-4-гидроксипиперидин-1-карбоксилата и 2,2 мл (17,9 ммоль) триэтиламина в 60 мл дихлорметана, охлажденному на ледяной бане, при перемешивании по каплям добавляют 1,4 мл (17,9 ммоль) метансульфонилхлорида. Продолжают перемешивать в течение одного часа при 0°C, затем 4 часа при температуре окружающей среды. Реакционную смесь разбавляют 100 мл дихлорметана и промывают последовательно 100 мл водного раствора гидрокарбоната натрия, затем насыщенным водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия. Сушат над сульфатом натрия и выпаривают досуха. Затем остаток растирают в смеси 50/50 циклогексана и диэтилового эфира, чтобы получить 3,7 г продукта в виде твердой белой субстанции.
1.2. 1,1-диметилэтил-4-(4-фенил-1H-имидазол-1-ил)пиперидин-1-карбоксилат
К суспензии 1,1 г (27,9 ммоль) гидрида натрия (60%-ная суспензия в масле) в 30 мл N,N-диметилформамида, охлажденной на ледяной бане, по каплям добавляют раствор 4,0 г (27,9 ммоль) 4-фенилимидазола в 40 мл N,N-диметилформамида. Затем перемешивают один час при температуре окружающей среды, после чего охлаждают до 0°C и по каплям добавляют 2,6 г (9,3 ммоль) 1,1-диметилэтил-4-[(метилсульфонил)окси]пиперидин-1-карбоксилата, полученного на стадии 1.1, в растворе в 20 мл N,N-диметилформамида. Затем нагревают до 80°C в течение 2 часов. Реакционную смесь охлаждают до температуры окружающей среды и разбавляют ее 150 мл воды и 150 мл этилацетата. Водную фазу декантируют и два раза экстрагируют 100 мл этилацетата. Органические фазы два раза промывают 100 мл воды, затем 100 мл насыщенного водного раствора хлорида натрия. Сушат над сульфатом натрия и выпаривают досуха. Остаток очищают хроматографией на силикагеле, элюируя смесью 98/2 дихлорметана и метанола, чтобы получить 1,0 г продукта в виде желтого масла.
1.3. 4-(4-фенил-1H-имидазол-1-ил)пиперидин
К раствору 1,0 г (3,05 ммоль) 1,1-диметилэтил-4-(4-фенил-1H-имидазол-1-ил)пиперидин-1-карбоксилата, полученного на стадии 1.2, в 60 мл дихлорметана, охлажденному на ледяной бане, по каплям добавляют 5,6 мл (76,3 ммоль) трифторуксусной кислоты. Затем перемешивают один час при температуре окружающей среды и выпаривают досуха. Остаток вводят в 25 мл воды и добавляют 2 мл 30%-ного водного раствора гидроксида натрия. Перемешивают в течение 30 минут, затем четыре раза экстрагируют 80 мл дихлорметана. Затем органические фазы промывают насыщенным водным раствором хлорида натрия, сушат их над сульфатом натрия и выпаривают досуха, чтобы получить 0,7 г продукта в виде желтого масла, используемого на следующей стадии как есть.
1.4. [2-(этилокси)-2-оксоэтил]-4-(4-фенил-1H-имидазол-1-ил)пиперидин-1-карбоксилат
Раствор 1,0 г (4,4 ммоль) 4-(4-фенил-1Н-имидазол-1-ил)пиперидина, полученного на стадии 1.3, и 1,18 г (5,2 ммоль) этил[(фенилоксикарбонил)окси]ацетата (J. Med. Chem, 1999, 42, 277-290) в 50 мл толуола нагревают при 60°C в течение ночи. Затем выпаривают досуха и остаток вводят в 80 мл этилацетата и 80 мл воды. Декантируют и водную фазу три раза экстрагируют 80 мл этилацетата. Затем органические фазы промывают 80 мл насыщенного водного раствора хлорида натрия. Сушат их над сульфатом натрия и выпаривают досуха. Остаток очищают хроматографией на силикагеле, элюируя смесью 98/2 дихлорметана и метанола, чтобы получить 0,35 г продукта.
1.5. [2-(метиламино)-2-оксоэтил]-4-(4-фенил-1H-имидазол-1-ил)пиперидин-1-карбоксилат
Растворяют 0,35 г (0,98 ммоль) [2-(этилокси)-2-оксоэтил]-4-(4-фенил-1H-имидазол-1-ил)пиперидин-1-карбоксилата, полученного на стадии 1.4, в 7 мл метанола. Добавляют 1,5 мл (3 ммоль) 2 М раствора метиламина в тетрагидрофуране. Через 16 часов при температуре окружающей среды добавляют 1 мл (2 ммоль) раствора метиламина (2 М) в тетрагидрофуране и оставляют взаимодействовать еще на 6 часов. Выпаривают досуха и остаток очищают хроматографией на силикагеле, элюируя смесью 98/2 затем 97/3, 96/4 и 95/5 дихлорметана и метанола. Затем растирают в диэтиловом эфире, чтобы получить 0,20 г продукта в виде твердой белой субстанции.
Температура плавления (°C): 192-194
ЖХ-МС: M+H=343
1H-ЯМР (CDCl3)  (м.д.): 7,75 (д, 2H), 7,60 (с, 1H), 7,40 (м, 2H), 7,25 (м, 2H), 6,05 (шир. с, 1H), 4,65 (с, 2H), 4,35 (м, 2H), 4,15 (м, 1H), 3,05 (м, 2H), 2,90 (д, 3H), 2,20 (м, 2H), 2,05-1,85 (м, 2H). (м.д.): 7,75 (д, 2H), 7,60 (с, 1H), 7,40 (м, 2H), 7,25 (м, 2H), 6,05 (шир. с, 1H), 4,65 (с, 2H), 4,35 (м, 2H), 4,15 (м, 1H), 3,05 (м, 2H), 2,90 (д, 3H), 2,20 (м, 2H), 2,05-1,85 (м, 2H).
Пример 2 (соединение  32) 32)
[2-(метиламино)-2-оксоэтил]-4-(4-бромфенил)-4-гидроксипиперидин-1-карбоксилат
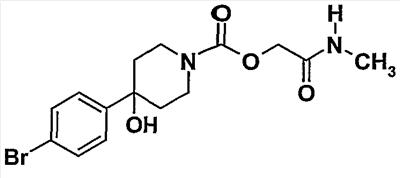
2.1. [2-(этилокси)-2-оксоэтил]-4-(4-бромфенил)-4-гидроксипиперидин-1-карбоксилат
Смесь 2,24 г (10 ммоль) этил[(фенилоксикарбонил)окси]ацетата и 2,56 г (10 ммоль) 4-(4-бромфенил)-4-пиперидинола в растворе в 40 мл толуола нагревают при 50°C в течение 20 часов. Раствор выпаривают досуха на водяной бане при пониженном давлении. Получают масло, которое напрямую используют на следующей стадии.
2.2. [2-(метиламино)-2-оксоэтил]-4-(4-бромфенил)-4-гидроксипиперидин-1-карбоксилат
[2-(этилокси)-2-оксоэтил]-4-(4-бромфенил)-4-гидроксипиперидин-1-карбоксилат, полученный на стадии 2.1, перемешивают в течение 3 часов в 33%-ном растворе метиламина в метаноле. Раствор концентрируют на водяной бане при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируя этилацетатом. Получают 2,6 г продукта в виде масла, которое постепенно отверждается.
Температура плавления (°C): 57-60
ЖХ-МС: M+H=371
1H-ЯМР (ДМСО-d6)  (м.д.): 1,55 (шир. с, 1H), 7,50 (д, 2H), 7,40 (д, 2H), 5,20 (с, 1H), 4,40 (с, 2H), 3,80 (м, 2H), 3,20 (м, 2H), 2,60 (д, 3H), 1,90-1,50 (м, 4H). (м.д.): 1,55 (шир. с, 1H), 7,50 (д, 2H), 7,40 (д, 2H), 5,20 (с, 1H), 4,40 (с, 2H), 3,80 (м, 2H), 3,20 (м, 2H), 2,60 (д, 3H), 1,90-1,50 (м, 4H).
Пример 3 (соединение  40) 40)
[2-(метиламино)-2-оксоэтил]-4-(3′,4′-дихлорбифенил-4-ил)-4-гидроксипиперидин-1-карбоксилат
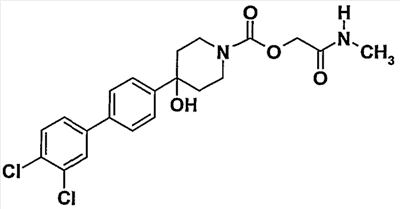
Смешивают 0,1 г (0,27 ммоль) [2-(метиламино)-2-оксоэтил]-4-(4-бромфенил)-4-гидроксипиперидин-1-карбоксилата, полученного согласно примеру 2, 0,077 г (0,4 ммоль) 3,4-дихлорфенилбороновой кислоты, 10 мг тетракис-(трифенилфосфин)палладия(0), 2 мл водного раствора (2 M) карбоната натрия, 0,5 мл этанола и 4 мл толуола, предварительно продутого азотом. Нагревают при 80°C при перемешивании в течение 20 часов. Фильтруют при высокой температуре через гидрофобный патрон, промывают тетрагидрофураном (ТГФ) и выпаривают досуха. Остаток очищают хроматографией ЖХ-МС на фазе окиси кремния, элюируя с градиентом смеси циклогексан/этилацетат/метанол, чтобы получить 0,069 г кристаллизованного продукта.
Температура плавления (°C): 156-158
ЖХ-МС: M+H=438
1H-ЯМР (ДМСО-d6)  (м.д.): 7,95 (с, 1H), 7,80 (м, 1H), 7,70 (м, 4H), 7,60 (м, 2H), 5,20 (с, 1H), 4,45 (с, 2H), 4,00 (м, 2H), 3,25 (м, 2H), 2,60 (д, 3H), 1,95 (м, 2H), 1,65 (м, 2H). (м.д.): 7,95 (с, 1H), 7,80 (м, 1H), 7,70 (м, 4H), 7,60 (м, 2H), 5,20 (с, 1H), 4,45 (с, 2H), 4,00 (м, 2H), 3,25 (м, 2H), 2,60 (д, 3H), 1,95 (м, 2H), 1,65 (м, 2H).
Пример 4 (соединение  43) 43)
[2-(метиламино)-2-оксоэтил]-4-(нафталин-2-илметил)пиперидин-1-карбоксилат
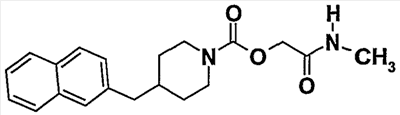
4.1. 1,1-диметилэтил-4-(нафталин-2-илметил)пиперидин-l-карбоксилат
В атмосфере аргона добавляют 8,0 мл раствора 0,5 н. (4 ммоль) 9-борбицикло[3.3.1]нонана в тетрагидрофуране к раствору 0,789 г (4 ммоль) 1,1-диметилэтил-4-метилиденпиперидин-1-карбоксилата (Tetrahedron Letters 1996, 37(30), 5233-5234) в растворе в 5 мл тетрагидрофурана. Кипятят с обратным холодильником в течение 3 часов. Охлаждают при температуре окружающей среды и добавляют 0,787 г (3,8 ммоль) 2-бромнафталина в растворе в 9 мл N,N-диметилформамида, 0,829 г (6,0 ммоль) карбоната калия в растворе в 1 мл воды и 0,16 г (0,20 ммоль) комплекса [1,1′-бис(дифенилфосфин)-ферроцен]дихлорпалладий(II)-дихлорметан). Кипятят с обратным холодильником в течение ночи. Реакционную смесь разбавляют 150 мл этилацетата и 50 мл воды. Органическую фазу декантируют и промывают 25 мл воды, затем 25 мл насыщенного водного раствора хлорида натрия. Сушат над сульфатом магния и выпаривают в вакууме. Остаток очищают хроматографией на силикагеле, элюируя смесью 99/1, затем 95/5 и 90/10 циклогексана и этилацетата, чтобы получить 0,79 г продукта в виде бесцветной вязкой жидкости.
4.2. 4-(нафталин-2-илметил)пиперидин
Растворяют 0,79 г (2,43 ммоль) 1,1-диметилэтил-4-(нафталин-2-илметил)пиперидин-1-карбоксилата, полученного на стадии 4.1, в 10 мл дихлорметана и добавляют 2 мл (25 ммоль) трифторуксусной кислоты. Перемешивают в течение 3 часов при температуре окружающей среды. Выпаривают при пониженном давлении, затем добавляют 4 мл 1,2-дихлорэтана и снова выпаривают. Остаток вводят в смесь 50 мл дихлорметана и 15 мл 10%-ного водного раствора гидроксида натрия. Органическую фазу декантируют и водную фазу два раза экстрагируют 25 мл дихлорметана. Органические фазы промывают 15 мл насыщенного водного раствора хлорида натрия, затем сушат над сульфатом натрия и выпаривают в вакууме, чтобы получить 0,52 г продукта в виде оранжевого масла, используемого на следующей стадии как есть.
4.3. [2-(этокси)-2-оксоэтил]-4-(нафталин-2-илметил)пиперидин-1-карбоксилат
В течение ночи нагревают при 60°C смесь 0,52 г (2,3 ммоль) 4-(нафталин-2-илметил)пиперидина, полученного на стадии 4.2, и 0,69 г (3,11 ммоль) этил[(фенилоксикарбонил)окси]ацетата в 10 мл толуола и 5 мл ацетонитрила. Выпаривают в вакууме. Остаток очищают хроматографией на силикагеле, элюируя смесью 90/10, затем 85/15 и 80/20 циклогексана и этилацетата, чтобы получить 0,56 г продукта в виде бесцветной вязкой жидкости.
4.4. [2-(метиламино)-2-оксоэтил]-4-(нафталин-2-илметил)пиперидин-1-карбоксилат
В 3 мл метанола растворяют 0,54 г (1,52 ммоль) [2-(этокси)-2-оксоэтил]-4-(нафталин-2-илметил)пиперидин-1-карбоксилата, полученного на стадии 4.3, и добавляют 3 мл (6,0 ммоль) 2 M раствора метиламина в тетрагидрофуране. Оставляют реагировать на ночь при температуре окружающей среды, затем добавляют 1,5 г окиси кремния и выпаривают. Остаток очищают хроматографией на силикагеле, элюируя смесью 98,5/1,5, затем 97/3 дихлорметана и метанола. Затем рекристаллизуют в смеси этилацетата и диизопропилового эфира, чтобы получить 0,43 г продукта в виде твердой белой субстанции.
Температура плавления (°C): 150-152
ЖХ-МС: M+H 341
1H-ЯМР (CDCl3)  (м.д.): 7,80 (м, 3H), 7,60 (с, 1H), 7,45 (м, 2H), 7,30 (д, 1H), 6,10 (м, 1H), 4,60 (с, 2H), 4,15 (м, 2H), 2,85 (д, 3H), 2,85-2,75 (м+д, 4H), 1,90-1,70 (м, 3H), 1,35-1,15 (м, 2H). (м.д.): 7,80 (м, 3H), 7,60 (с, 1H), 7,45 (м, 2H), 7,30 (д, 1H), 6,10 (м, 1H), 4,60 (с, 2H), 4,15 (м, 2H), 2,85 (д, 3H), 2,85-2,75 (м+д, 4H), 1,90-1,70 (м, 3H), 1,35-1,15 (м, 2H).
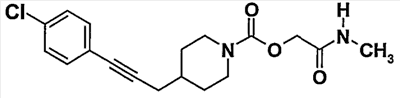
Пример 5 (соединение  107) 107)
[2-(метиламино)-2-оксоэтил]-4-[3-(4-хлорфенил)проп-2-ин-1-ил]пиперидин-1-карбоксилат
5.1. Трет-бутил-4-(2-оксоэтил)пиперидин-1-карбоксилат
К раствору 30,4 г (132 ммоль) трет-бутил-4-(2-гидроксиэтил)пиперидин-1-карбоксилата в 150 мл дихлорметана, охлажденному до 0°C, порциями добавляют 70,9 г (167 ммоль) (1,1,1-трис(ацетилокси)-1,1-дигидро-1,2-бензойдоксол-3-(1H)-она (реагент Десс-Мартина). Перемешивают 2 часа при температуре окружающей среды, затем добавляют 150 мл 10%-ного водного раствора тиосульфата натрия (Na2S2O3) и продолжают дополнительно перемешивать еще в течение 30 минут. Органическую фазу декантируют, промывают насыщенным водным раствором карбоната натрия, сушат над сульфатом натрия и выпаривают досуха, чтобы получить 30,1 г (132 ммоль) продукта в виде бесцветного масла, используемого на следующей стадии как есть.
5.2. Трет-бутил-4-(3,3-дибромпроп-2-ен-1-ил)пиперидин-1-карбоксилат
К раствору 139,4 г (531 ммоль) трифенилфосфина в 440 мл толуола, охлажденному до -20°C, добавляют 47,6 мл (531 ммоль) трибромметана, затем 59,6 г (531 ммоль) трет-бутилата калия. Продолжают перемешивать при -20°C в течение 15 минут, затем добавляют раствор 30,1 г (131 ммоль) трет-бутил-4-(2-оксоэтил)пиперидин-1-карбоксилата, полученного на стадии 5.1, в 240 мл толуола. Затем перемешивают при температуре окружающей среды в течение 3 часов. Добавляют 300 мл диэтилового эфира, фильтруют образовавшуюся твердую фазу и фильтрат выпаривают. Остаток очищают хроматографией на силикагеле, элюируя дихлорметаном, чтобы получить 32,6 г (85 ммоль) продукта в виде желтого масла.
5.3. Трет-бутил-4-проп-2-ин-1-илпиперидин-1-карбоксилат
Растворяют 32,6 г (85 ммоль) трет-бутил-4-(3,3-дибромпроп-2-ен-1-ил)пиперидин-1-карбоксилата, полученного на стадии 5.2, в 420 мл безводного тетрагидрофурана. Охлаждают до -78°C и при интенсивном перемешивании по каплям добавляют 106 мл раствора (1,6 M) н-бутиллития (170 ммоль) в гексане, растворенном в 100 мл безводного тетрагидрофурана. Продолжают перемешивать при -78°C в течение 3 часов, затем при -20°C в течение 1 часа. Охлаждают до -78°C и добавляют 130 мл 1,25 М раствора соляной кислоты в этаноле. Затем снова нагревают до температуры окружающей среды в течение одного часа. Добавляют воду и этилацетат. Органическую фазу декантируют, промывают ее насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и выпаривают досуха. Остаток очищают хроматографией на силикагеле, элюируя дихлорметаном, затем смесью 98/2 дихлорметана и метанола, чтобы получить 32,4 г (85,2 ммоль) продукта в виде бесцветного масла.
5.4. Трет-бутил-4-[3-(4-хлорфенил)проп-2-ин-1-ил]пиперидин-1-карбоксилат
Растворяют 2,29 г (9,6 ммоль) 1-хлор-4-йодбензола и 1,7 мл (12 ммоль) триэтиламина в 5 мл тетрагидрофурана. В атмосфере аргона добавляют 0,076 г (0,40 ммоль) йодида меди и 0,168 г (0,24 ммоль) комплекса дихлорид бис(трифенилфосфин)палладия, затем по каплям добавляют раствор 1,78 г (8 ммоль) трет-бутил-4-проп-2-ин-1-илпиперидин-1-карбоксилата, полученного на стадии 5.3, в 3 мл тетрагидрофурана. Продолжают перемешивать в течение ночи. Добавляют 25 мл воды и 100 мл этилацетата. Органическую фазу декантируют, промывают последовательно 25 мл 10%-ного аммония, 25 мл воды и 25 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом магния и выпаривают досуха. Остаток очищают хроматографией на силикагеле, элюируя смесью 95/5, затем 90/10 циклогексана и этилацетата, чтобы получить 2,15 г (6,44 ммоль) продукта в виде желтого масла.
5.5. 4-[3-(4-хлорфенил)проп-2-ин-1-ил]пиперидин
Растворяют 2,13 г (6,38 ммоль) трет-бутил-4-[3-(4-хлорфенил)проп-2-ин-1-ил]пиперидин-1-карбоксилата, полученного на стадии 5.4, в 15 мл дихлорметана. По каплям добавляют раствор 4,9 мл (63,8 ммоль) трифторуксусной кислоты в 5 мл дихлорметана. Оставляют взаимодействовать на ночь при температуре окружающей среды, затем выпаривают досуха. Добавляют 25 мл дихлорэтана и снова выпаривают досуха. Затем остаток вводят в смесь 70 мл этилацетата, 10 мл 1 н. водного раствора гидроксида натрия и 10 мл 30%-ного аммония. Органическую фазу декантируют, промывают 2 раза 10 мл воды, затем 10 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом натрия и выпаривают досуха, чтобы получить 1,39 г (5,94 ммоль) продукта в виде коричневого масла, используемого на следующей стадии как есть.
5.6. (2-этокси-2-оксоэтил)-4-[3-(4-хлорфенил)проп-2-ин-1-ил]пиперидин-1-карбоксилат
Раствор 1,39 г (5,94 ммоль) 4-[3-(4-хлорфенил)проп-2-ин-1-ил]пиперидина, полученного на стадии 5.5, и 1,86 г (8,33 ммоль) этил[(фенилоксикарбонил)окси]ацетата в 12 мл толуола нагревают при 70°C в течение 5 часов. Выпаривают досуха и остаток очищают хроматографией на силикагеле, элюируя смесью 90/10, затем 80/20 циклогексана и этилацетата, чтобы получить 1,89 г (5,19 ммоль) продукта в виде вязкого масла.
5.7. [2-(метиламино)-2-оксоэтил]-4-[3-(4-хлорфенил)проп-2-ин-1-ил]пиперидин-1-карбоксилат
Растворяют 0,91 г (2,51 ммоль) (2-этокси-2-оксоэтил)-4-[3-(4-хлорфенил)проп-2-ин-1-ил]пиперидин-1-карбоксилата, полученного на стадии 5.6, в 4 мл метанола. Добавляют 2,5 мл (25 ммоль) 33%-ного раствора метиламина в этаноле и оставляют на ночь при температуре окружающей среды. Выпаривают досуха и остаток очищают хроматографией на силикагеле, элюируя смесью 99,5/0,5 затем 98/2 и 96/4 дихлорметана и метанола. Кристаллизуют в гексане, затем сушат в вакууме, чтобы получить 0,50 г (1,43 ммоль) продукта в виде белого порошка.
Температура плавления (°C): 101-103
ЖХ-МС: M+H=349
1H-ЯМР (CDCl3)  (м.д.): 7,20 (м, 4H), 6,30 (м, 1H), 4,50 (шир. с, 2H), 4,10 (шир. д, 2H), 2,75 (м+д, 5H), 2,30 (д, 2H), 1,85-1,60 (м, 3H), 1,35-1,15 (м, 2H). (м.д.): 7,20 (м, 4H), 6,30 (м, 1H), 4,50 (шир. с, 2H), 4,10 (шир. д, 2H), 2,75 (м+д, 5H), 2,30 (д, 2H), 1,85-1,60 (м, 3H), 1,35-1,15 (м, 2H).
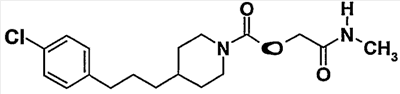
Пример 6 (соединение  83) 83)
[2-(метиламино)-2-оксоэтил]-4-[3-(4-хлорфенил)пропил]пиперидин-1-карбоксилат
Растворяют 0,156 г (0,448 ммоль) [2-(метиламино)-2-оксоэтил]-4-[3-(4-хлорфенил)проп-2-ин-1-ил]пиперидин-1-карбоксилата, полученного по примеру 5, в 2 мл этанола. Добавляют 16 мг диоксида платины. Перемешивают в атмосфере водорода при давлении и температуре окружающей среды в течение 2 часов, затем при 40°C в течение еще 2 часов. Фильтруют через целит и фильтрат выпаривают. Остаток очищают ВЭЖХ-хроматографией на геле Nucleosil, элюируя градиентом от 70/30/0 до 0/80/20 гексана, этилацетата и метанола, чтобы получить 0,108 мг (0,306 ммоль) продукта в виде твердой белой субстанции.
Температура плавления (°C): 118-120
ЖХ-МС: M+H=353
1H-ЯМР (CDCl3)  (м.д.): 7,25 (д, 2H), 7,10 (д, 2H), 6,05 (м, 1H), 4,60 (с, 2H), 4,10 (шир. д, 2H), 2,90 (д, 3H), 2,80 (шир. т, 2H), 2,60 (т, 2H), 1,75-1,55 (м, 4H), 1,45 (м, 1H), 1,35-1,05 (м, 4H). (м.д.): 7,25 (д, 2H), 7,10 (д, 2H), 6,05 (м, 1H), 4,60 (с, 2H), 4,10 (шир. д, 2H), 2,90 (д, 3H), 2,80 (шир. т, 2H), 2,60 (т, 2H), 1,75-1,55 (м, 4H), 1,45 (м, 1H), 1,35-1,05 (м, 4H).
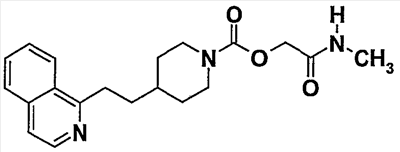
Пример 7 (соединение  74) 74)
[2-(метиламино)-2-оксоэтил]-4-(2-изохинолин-1-илэтил)-1-пиперидинкарбоксилат
7.1. Трет-бутил-4-(йодметил)-1-пиперидинкарбоксилат
К раствору 10 г (46,45 ммоль) трет-бутил-4-(гидроксиметил)-1-пиперидинкарбоксилата, 15,84 г (60,38 ммоль) трифенилфосфина и 4,74 г (69,67 ммоль) имидазола в 200 мл дихлорметана, охлажденному до примерно 0°C, малыми порциями добавляют 14,15 г (55,74 ммоль) йода (I2), поддерживая температуру реакционной среды между 0°C и 5°C. Продолжают перемешивать при 0°C в течение 1 часа, затем при температуре окружающей среды в течение 4 часов.
Добавляют 100 мл воды и 300 мл этилацетата. Органическую фазу декантируют, промывают ее последовательно насыщенным водным раствором тиосульфата натрия и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле, элюируя смесью 90/10 циклогексана и этилацетата. Получают 13,70 г (42,13 ммоль) продукта в виде бесцветного масла.
7.2. Трет-бутил-4-(2-изохинолин-1-илэтил)-1-пиперидинкарбоксилат
К раствору 2,202 г (15,38 ммоль) 1-метилизохинолина в 150 мл тетрагидрофурана, охлажденному до примерно -70°C, по каплям добавляют 10 мл (20 ммоль) раствора (2 М) диизопропиламида лития (LDA) в смеси тетрагидрофурана и н-гексана. Продолжают перемешивать при -70°C в течение 10 минут, затем медленно добавляют раствор 5 г (15,38 ммоль) трет-бутил-4-(йодметил)-1-пиперидинкарбоксилата, полученного на стадии 7.1, в 30 мл тетрагидрофурана. После 30 минут перемешивания при -70°C добавляют 100 мл насыщенного водного раствора хлорида аммония. Доводят до температуры окружающей среды, отделяют водную фазу, затем 3 раза экстрагируют ее этилацетатом. Соединенные органические фазы промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле, элюируя смесью 99/1, затем 98/2 дихлорметана и метанола. Получают 1,80 г (5,29 ммоль) продукта в виде желтого масла.
7.3. (2-пиперидин-4-илэтил)-1-изохинолин
К раствору 1,60 г (4,70 ммоль) трет-бутил-4-(2-изохинолин-1-илэтил)-1-пиперидинкарбоксилата, полученного на стадии 7.2, в 15 мл 1,4-диоксана добавляют при температуре окружающей среды, 3,90 мл (23,50 ммоль) раствора (6 н.) соляной кислоты в изопропаноле. Затем реакционную смесь держат при примерно 60°C в течение 12 часов.
Концентрируют досуха при пониженном давлении. Полученный гидрохлорид вводят в 5 мл воды, затем при перемешивании медленно добавляют 20%-ный водный раствор гидроксида натрия до pH 9. Водную фазу два раза экстрагируют хлороформом, соединенные органические фазы промывают насыщенным водным раствором хлорида натрия, сушат их над сульфатом натрия и концентрируют при пониженном давлении. Получают 0,400 г (1,66 ммоль) продукта в виде коричневого масла.
7.4. (2-этокси-2-оксоэтил)-4-(2-изохинолин-1-илэтил)-1-пиперидинкарбоксилат
Раствор 0,320 г (1,33 ммоль) (2-пиперидин-4-илэтил)-1-изохинолина, полученного на стадии 7.3, и 0,388 г (1,73 ммоль) этил[(фенилоксикарбонил)окси]ацетата в 10 мл толуола нагревают при 70°C в течение 18 часов. Доводят до температуры окружающей среды, концентрируют при пониженном давлении, затем полученный остаток очищают хроматографией на силикагеле, элюируя смесью 40/60 этилацетата и циклогексана. Таким образом получают 0,390 г (1,05 ммоль) продукта в виде вязкого масла.
7.5. [2-(метиламино)-2-оксоэтил]-4-(2-изохинолин-1-илэтил)-1-пиперидинкарбоксилат
К раствору 0,380 г (1,03 ммоль) (2-этокси-2-оксоэтил)-4-(2-изохинолин-1-илэтил)-1-пиперидинкарбоксилата, полученного на стадии 7.4, в 10 мл метанола, добавляют 2,60 мл (5,13 ммоль) раствора метиламина (2 M) в тетрагидрофуране. Продолжают перемешивать при температуре окружающей среды в течение 12 часов.
После концентрирования при пониженном давлении полученный остаток очищают хроматографией на силикагеле, элюируя смесью 95/5 дихлорметана и метанола. Получают твердое вещество, которое рекристаллизуют в смеси этилацетата и диизопропилового эфира. Таким путем получают 0,315 г (0,88 ммоль) продукта в виде твердой белой субстанции.
ЖХ-МС: M+H=356
Температура плавления (°C): 126-128
1H-ЯМР (CDCl3)  (м.д.): 8,50 (д, 1H), 8,15 (д, 1H), 7,90 (д, 1H), 7,70 (м, 2H), 7,55 (д, 1H), 6,10 (шир. с, 1H), 4,60 (шир. с, 2H), 4,20 (м, 2H), 3,35 (дд, 2H), 2,90 (м+д, 5H), 1,90 (м, 4H), 1,65 (м, 1H), 1,30 (м, 2H). (м.д.): 8,50 (д, 1H), 8,15 (д, 1H), 7,90 (д, 1H), 7,70 (м, 2H), 7,55 (д, 1H), 6,10 (шир. с, 1H), 4,60 (шир. с, 2H), 4,20 (м, 2H), 3,35 (дд, 2H), 2,90 (м+д, 5H), 1,90 (м, 4H), 1,65 (м, 1H), 1,30 (м, 2H).
В следующей ниже таблице 1 показаны химическая структура и физические свойства некоторых соединений согласно изобретению.
В этой таблице:
– все соединения находятся в виде свободного основания,
– н-бутил означает линейную бутильную группу.
 |
 |
R1 |
[A]p |
R2 |
n |
m |
R3 |
R4 |
Т.пл., °C (M+H) |
| 1. |
фенил |
связь |
H |
2 |
2 |
H |
H |
160-162 |
| 2. |
фенил |
связь |
H |
2 |
2 |
H |
CH3 |
76-78 |
| 3. |
3-CF3-фенил |
связь |
H |
2 |
2 |
H |
H |
(331) |
| 4. |
3-CF3-фенил |
связь |
H |
2 |
2 |
H |
CH3 |
(345) |
| 5. |
5-изобутилпиридин-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
98-100 |
| 6. |
6-изобутилпиридин-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
(334) |
| 7. |
6-циклопентилпиридин-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
(346) |
| 8. |
5-(4-F-фенил)-пиридин-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
151-153 |
| 9. |
6-(4-F-фенил)-пиридин-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
104-106 |
| 10. |
6-(4-Cl-фенил)-пиридин-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
136-138 |
| 11. |
5-(4-CF3-фенил)-пиридин-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
203-205 |
| 12. |
6-(4-CF3-фенил)-пиридин-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
128-130 |
| 13. |
5-(3-CF3-фенил)-1-метилпиразол-3-ил |
связь |
H |
2 |
2 |
H |
CH3 |
160-162 |
| 14. |
4-фенилимидазол-1-ил |
связь |
H |
2 |
2 |
H |
CH3 |
192-194 |
| 15. |
5-фенил-1,3,4-оксадиазол-2-ил |
связь |
H |
2 |
2 |
H |
H |
152-154 |
| 16. |
5-фенил-1,3,4-оксадиазол-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
114-116 |
| 17. |
5-(4-F-фенил)-1,3,4-оксадиазол-2-ил |
связь |
H |
2 |
2 |
H |
H |
158-160 |
| 18. |
5-(4-F-фенил)-1,3,4-оксадиазол-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
163-165 |
| 19. |
5-(3-CF3-фенил)-1,3,4-оксадиазол-2-ил |
связь |
H |
2 |
2 |
H |
H |
130-130 |
| 20. |
5-(3-CF3-фенил)-1,3,4-оксадиазол-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
123-125 |
| 21. |
3-(3-CF3-фенил)-1,2,4-оксадиазол-5-ил |
связь |
H |
2 |
2 |
H |
H |
133-135 |
| 22. |
3-(3-CF3-фенил)-1,2,4-оксадиазол-5-ил |
связь |
H |
2 |
2 |
H |
CH3 |
119-121 |
| 23. |
бензоксазол-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
137-139 |
| 24. |
бензотиазол-2-ил |
связь |
H |
2 |
2 |
H |
H |
148-150 |
| 25. |
бензотиазол-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
120-122 |
| 26. |
бензимидазол-2-ил |
связь |
H |
2 |
2 |
H |
CH3 |
213-215 |
| 27. |
бензимидазол-1-ил |
связь |
H |
2 |
2 |
H |
H |
206-208 |
| 28. |
2-фенилбензимидазол-1-ил |
связь |
H |
2 |
2 |
H |
CH3 |
193-195 |
| 29. |
бензотриазол-1-ил |
связь |
H |
2 |
2 |
H |
CH3 |
129-131 |
| 30. |
5-CF3-бензотриазол-1-ил |
связь |
H |
2 |
2 |
H |
H |
152-154 |
| 31. |
индол-1-ил |
связь |
H |
2 |
2 |
H |
H |
178-180 |
| 32. |
4-Br-фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
57-60 |
| 33. |
4-(4-F-фенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
212-214 |
| 34. |
4-(4-Cl-фенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
223-225 |
| 35. |
4-(4-CH3-фенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
179-181 |
| 36. |
4-(4-н-бутилфенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
(425) |
| 37. |
4-(4-CF3-фенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
191-193 |
| 38. |
4-(4-CH3О-фенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
175-176 |
| 39. |
4-(4-C2H5О-фенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
165-167 |
| 40. |
4-(3-Сl,4-Cl-фенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
156-158 |
| 41. |
4-(3-F,4-CH3О-фенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
(417) |
| 42. |
4-(3-Cl,4-F-фенил)фенил |
связь |
OH |
2 |
2 |
H |
CH3 |
123-125 |
| 43. |
нафталин-2-ил |
CH2 |
H |
2 |
2 |
H |
CH3 |
150-152 |
| 44. |
4-фенилфенил |
CH2 |
H |
2 |
2 |
H |
CH3 |
115-117 |
| 45. |
6-циклопентилпиридин-2-ил |
CH2 |
H |
2 |
2 |
H |
CH3 |
(360) |
| 46. |
6-(4-F-фенил)-пиридин-2-ил |
CH2 |
H |
2 |
2 |
H |
CH3 |
112-114 |
| 47. |
индол-1-ил |
CH2 |
H |
2 |
2 |
H |
H |
158-159 |
| 48. |
индолин-1-ил |
CH2 |
H |
2 |
2 |
H |
H |
115-116 |
| 49. |
1,2,3,4-тетрагидрохинолин-1-ил |
CH2 |
H |
2 |
2 |
H |
H |
158-159 |
| 50. |
1,2,3,4-тетрагидроизохинолин-2-ил |
CH2 |
H |
2 |
2 |
H |
H |
(332) |
| 51. |
пирроло[2,3-b]пиридин-1-ил |
CH2 |
H |
2 |
2 |
H |
H |
(317) |
| 52. |
бензимидазол-1-ил |
CH2 |
H |
2 |
2 |
H |
H |
(317) |
| 53. |
4-фенилимидазол-1-ил |
CH2 |
H |
2 |
2 |
H |
H |
124-125 |
| 54. |
фенил |
(CH2)2 |
H |
1 |
2 |
H |
CH3 |
(291) |
| 55. |
4-F-фенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
150-152 |
| 56. |
3-Cl-фенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
86-88 |
| 57. |
4-Cl-фенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
150-152 |
| 58. |
3-CF3-фенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
103-105 |
| 59. |
4-CF3-фенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
131-133 |
| 60. |
3-CN-фенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
(330) |
| 61. |
4-CH3-фенил |
(CH2)2 |
H |
2 |
2 |
H |
H |
125-127 |
| 62. |
4-CH3-фенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
117-119 |
| 63. |
4-CH3O-фенил |
(CH2)2 |
H |
2 |
2 |
H |
H |
123-125 |
| 64. |
4-CH3O-фенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
122-124 |
| 65. |
2-фенилфенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
(381) |
| 66. |
3-фенилфенил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
113-115 |
| 67. |
нафталин-1-ил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
112-114 |
| 68. |
нафталин-2-ил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
106-108 |
| 69. |
пиримидин-2-ил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
160-170 |
| 70. |
пиримидин-5-ил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
123-125 |
| 71. |
6-циклопентилпиридин-2-ил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
(374) |
| 72. |
6-пирролидин-1-илпиридин-2-ил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
130-132 |
| 73. |
тиазол-2-ил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
97-99 |
| 74. |
изохинолин-1-ил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
126-128 |
| 75. |
1,2,3,4-тетрагидрохинолин-1-ил |
(CH2)2 |
H |
2 |
2 |
H |
H |
(346) |
| 76. |
1,2,3,4-тетрагидроизохинолин-2-ил |
(CH2)2 |
H |
2 |
2 |
H |
H |
112-114 |
| 77. |
индол-1-ил |
(CH2)2 |
H |
2 |
2 |
H |
H |
(330) |
| 78. |
индолин-1-ил |
(CH2)2 |
H |
2 |
2 |
H |
H |
92-93 |
| 79. |
пирроло[2,3-b]пиридин-1-ил |
(CH2)2 |
H |
2 |
2 |
H |
H |
(331) |
| 80. |
бензимидазол-1-ил |
(CH2)2 |
H |
2 |
2 |
H |
H |
181-182 |
| 81. |
4-фенилимидазол-1-ил |
(CH2)2 |
H |
2 |
2 |
H |
H |
183-184 |
| 82. |
3-Cl-фенил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
92-94 |
| 83. |
4-Cl-фенил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
118-120 |
| 84. |
3-CF3-фенил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
106-108 |
| 85. |
4-CF3-фенил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
111-113 |
| 86. |
3-CN-фенил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
118-120 |
| 87. |
2-фенилфенил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
(395) |
| 88. |
3-фенилфенил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
116-118 |
| 89. |
нафталин-1-ил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
(369) |
| 90. |
нафталин-2-ил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
112-114 |
| 91. |
пиримидин-2-ил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
105-107 |
| 92. |
пиримидин-5-ил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
105-107 |
| 93. |
тиазол-2-ил |
(CH2)3 |
H |
2 |
2 |
H |
CH3 |
(326) |
| 94. |
3-Cl-фенил |
C C C |
H |
2 |
2 |
H |
CH3 |
85-87 |
| 95. |
4-Cl-фенил |
C C C |
H |
2 |
2 |
H |
CH3 |
122-124 |
| 96. |
3-CF3-фенил |
C C C |
H |
2 |
2 |
H |
CH3 |
(369) |
| 97. |
4-CF3-фенил |
C C C |
H |
2 |
2 |
H |
CH3 |
134-136 |
| 98. |
3-CN-фенил |
C C C |
H |
2 |
2 |
H |
CH3 |
(326) |
| 99. |
2-фенилфенил |
C C C |
H |
2 |
2 |
H |
CH3 |
(377) |
| 100. |
3-фенилфенил |
C C C |
H |
2 |
2 |
H |
CH3 |
(377) |
| 101. |
нафталин-1-ил |
C C C |
H |
2 |
2 |
H |
CH3 |
(351) |
| 102. |
нафталин-2-ил |
C C C |
H |
2 |
2 |
H |
CH3 |
(351) |
| 103. |
пиримидин-2-ил |
C C C |
H |
2 |
2 |
H |
CH3 |
(303) |
| 104. |
пиримидин-5-ил |
C C C |
H |
2 |
2 |
H |
CH3 |
136-138 |
| 105. |
тиазол-2-ил |
C C C |
H |
2 |
2 |
H |
CH3 |
(308) |
| 106. |
3-Cl-фенил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
91-93 |
| 107. |
4-Cl-фенил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
101-103 |
| 108. |
3-CF3-фенил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
113-115 |
| 109. |
4-CF3-фенил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
112-114 |
| 110. |
3-CN-фенил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
112-114 |
| 111. |
2-фенилфенил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
99-101 |
| 112. |
3-фенилфенил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
(391) |
| 113. |
нафталин-1-ил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
98-100 |
| 114. |
нафталин-2-ил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
99-101 |
| 115. |
пиримидин-2-ил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
91-93 |
| 116. |
пиримидин-5-ил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
113-115 |
| 117. |
тиазол-2-ил |
C CCH2 CCH2 |
H |
2 |
2 |
H |
CH3 |
112-114 |
| 118. |
6-пирролидин-1-илпиридин-2-ил |
CH2 |
H |
2 |
2 |
H |
CH3 |
119-121 |
| 119. |
6-(1-изопропилпиперидин-4-ил)пиридин-2-ил |
(CH2)2 |
H |
2 |
2 |
H |
CH3 |
(431) |
Соединения согласно изобретению были объектом фармакологических тестов, позволяющих определить их ингибирующее действие на ферменты FAAH (гидролаза амидов жирных кислот).
Ингибирующая активность была подтверждена в радиоферментном тесте, основанном на измерении продукта гидролиза (этаноламин [1-3H]) анандамида [этаноламин 1-3H] посредством FAAH (Life Sciences (1.995), 56, 1999-2005 и Journal of Pharmacology and Experimental Therapeutics (1997), 283, 729-734). Так, мозг мышей (без мозжечка) был извлечен и его сохраняли при -80°C. Мембранные гомогенаты были приготовлены непосредственно перед экспериментом путем гомогенизирования ткани на Polytron’е в буфере Tris-HCl 10 мМ (pH 8,0), содержащем 150 мМ NaCl и 1 мМ ЭДТА. Затем проводили энзиматическую реакцию в 70 мкл буфера, содержащего альбумин бычьей сыворотки без жирных кислот (1 мг/мл). Последовательно добавляли тестируемые соединения в разных концентрациях: анандамид [этаноламин 1-3H] (удельная активность 15-20 Ки/ммоль), разбавленный до 10 мкМ холодным анандамидом, и мембранный препарат (по 400 мкг замороженной ткани на опыт). Через 15 минут при 25°C энзиматическую реакцию останавливали путем добавления 140 мкл смеси хлороформ/метанол (2:1). Смесь перемешивали 10 минут, затем центрифугировали в течение 15 минут при 3500 об/мин. Аликвота (30 мкл) водной фазы, содержащей этаноламин [1-3H] рассчитана по сцинтилляции жидкости.
В этих условиях самые активные соединения по изобретению имеют CI50 (концентрация, ингибирующая 50% энзиматической активности контрольной FAAH) составляет от 0,001 до 1 мкМ.
Например, соединения  39 и 40 таблицы имеют CI50 соответственно 0,095 и 0,098 мкМ. 39 и 40 таблицы имеют CI50 соответственно 0,095 и 0,098 мкМ.
Таким образом, видно, что соединения согласно изобретению обладают ингибирующей активностью в отношении фермента FAAH.
Активность in vivo соединений по изобретению была оценена в тесте на аналгезию.
Так, внутрибрюшинное (i.p.) введение PBQ (фенилбензохинон, 2 мг/кг в 0,9%-ном растворе хлорида натрия, содержащем 5% этанола) самцам мышей серии OF1 весом 25-30 г, вызывает спазм брюшины, в среднем 30 перекрутов или сокращений за период от 5 до 15 минут после инъекции. Испытываемые соединения вводили перорально (p.o.) или внутрибрюшинно (i.p.) в суспензии Tween-80 концентрации 0,5%, за 60 или 120 минут до введения PBQ. В этих условиях самые сильнодействующие соединения по изобретению на 35-70% снижают число растяжений, вызванных PBQ, в диапазоне доз, составляющем от 1 до 30 мг/кг. Например, соединение  57 таблицы снижает число растяжений, вызванных PBQ, на 37% и 74% при дозе 3 мг/кг, соответственно через 60 минут и 120 минут. 57 таблицы снижает число растяжений, вызванных PBQ, на 37% и 74% при дозе 3 мг/кг, соответственно через 60 минут и 120 минут.
Фермент FAAH (Chemistry and Physics of Lipids, (2000), 108, 107-121) катализирует гидролиз эндогенных производных амидов и сложных эфиров разных жирных кислот, таких как N-арахидоноилэтаноламин (анандамид), N-пальмитоилэтаноламин, N-олеоилэтаноламин, олеамид или 2-арахидоноилглицерин. Кроме того, эти производные проявляют разную фармакологическую активность во взаимодействии с каннабиоидными и ваниллоидными рецепторами.
Соединения по изобретению блокируют этот путь разложения и увеличивают тканевую долю этих эндогенных веществ. Они могут применяться для этой цели при профилактике и лечении патологий, в которые вовлечены эндогенные каннабиоиды и/или любые другие субстраты, метаболизированные ферментом FAAH.
Можно назвать, например, следующие заболевания и недуги:
боль, в частности острые или хронические боли нейрогенного типа: мигрень, невропатические боли, в том числе формы, связанные с вирусом герпеса и диабетом;
острые или хронические боли, связанные с воспалительными заболеваниями: артрит, ревматоидный артрит, остеоартрит, спондилит, подагра, васкулярит, болезнь Крона, синдром раздраженной кишки;
острые или хронические периферические боли;
головокружения, рвота, тошнота, в частности являющиеся следствием химиотерапии;
нарушения пищевого поведения, в частности анорексия и кахексия различной природы;
неврологические и психиатрические патологии: дрожь, дискинезия, дистония, спастичность, обсессивно-компульсивные расстройства, синдром Туретта, все формы депрессии и тревоги любой природы и происхождения, расстройства настроения, психозы;
острые и хронические нейродегенеративные заболевания: болезнь Паркинсона, болезнь Альцгеймера, сенильная деменция, хорея Хантингтона, поражения, связанные с церебральной ишемией и черепно-мозговыми травмами;
эпилепсия;
нарушения сна, включая остановку дыхания во сне;
сердечно-сосудистые заболевания, в частности гипертензия, сердечная аритмия, артериосклероз, сердечные приступы, ишемия сердца;
почечная ишемия;
рак: доброкачественные опухоли кожи, папилломы и опухоли мозга, опухоли простаты, опухоли мозга (глиобластомы, медулло-эпителиомы, медуллобластомы, нейробластомы, опухоли эмбрионального происхождения, астроцитомы, астробластомы, эпендиомы, олигодендроглиомы, опухоль в сплетениях, нейроэпителиомы, опухоль эпифиза, эпендимобластомы, злокачественные менингиомы, саркоматозы, злокачественные меланомы, шванномы);
расстройства иммунной системы, в частности аутоиммунные заболевания: псориаз, красная волчанка, заболевания соединительной или связующей ткани, синдром Сьегрена, анкилостомный спондилоартрит, недифференцированный спондилоартрит, болезнь Бехчета, аутоиммунные гемолитические анемии, рассеянный склероз, боковой амиотрофический склероз, амилозы, отторжение пересадок, заболевания, действующие на плазмоцетарный ряд;
аллергические заболевания: мгновенная или замедленная гиперчувствительность, аллергические риниты или конъюнктивиты, контактные дерматиты;
инфекционные паразитарные, вирусные или бактериальные заболевания: СПИД, менингит; воспалительные заболевания, в частности заболевания суставов: артрит, ревматоидный артрит, остеоартрит, спондилит, подагра, васкулярит, болезнь Крона, синдром раздраженной кишки; остеопороз; глазные болезни: глазная гипертензия, глаукома;
болезни легких: заболевания дыхательных путей, бронхоспазмы, кашель, астма, хронический бронхит, хроническая непроходимость дыхательных путей, эмфизема;
желудочно-кишечные заболевания: синдром раздраженной кишки, воспалительные кишечные расстройства, язвы, диарея;
недержание мочи и воспаление мочевого пузыря.
Применение соединения формулы (I) в состоянии фармацевтически приемлемого основания, соли, гидрата или сольвата для получения лекарственного средства, предназначенного для лечения вышеназванных патологий, составляют неотъемлемую часть изобретения.
Объектом изобретения являются также лекарственные средства, которые содержат соединение формулы (I) или соль, а также фармацевтически приемлемый гидрат или сольват соединения формулы (I). Эти лекарственные средства находят применение в терапии, в частности при лечении вышеназванных патологий.
Согласно другому его аспекту настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве действующего вещества по меньшей мере одно соединение согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу соединения согласно изобретению, или фармацевтически приемлемой соли, сольвата или гидрата указанного соединения, и необязательно один или несколько фармацевтически приемлемых эксципиентов.
Указанные эксципиенты выбирают в соответствии с фармацевтической формой и желательным способом введения, из обычных эксципиентов, которые специалисту известны.
В фармацевтических композициях согласно настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, топического, местного, интратрахеального, интраназального, трансдермального, ректального введения или введения через легкие и глаза, действующее вещество вышеуказанной формулы (I) или его возможная соль, сольват или гидрат могут вводиться животным и людям для профилактики или лечения указанных выше расстройств или заболеваний в виде единой формы введения в смеси с классическими фармацевтическими эксципиентами.
Соответствующие единые формы введения включают формы для перорального приема, такие как таблетки, мягкие или твердые желатинозные капсулы, порошки, гранулы, жевательная резинка и оральные растворы или суспензии, формы для сублингвального, буккального, интратрахеального, внутриглазного, интраназального введения, введения путем ингаляции, формы для подкожного, внутримышечного или внутривенного введения, и ректальные или вагинальные формы введения. Для топического применения соединения согласно изобретению можно применять в кремах, гелях, помадах или лосьонах.
Например, единая форма приема соединения согласно изобретению в виде таблетки может содержать следующие компоненты:
| Соединение согласно настоящему изобретению: |
50,0 мг |
| Маннит: |
223,75 мг |
| Кроскармелоза натрия: |
6,0 мг |
| Кукурузный крахмал: |
15,0 мг |
| Гидроксипропилметилцеллюлоза: |
2,25 мг |
| Стеарат магния: |
3,0 мг |
Указанные единые формы могут быть дозированы так, чтобы позволить суточный прием от 0,01 до 20 мг действующего вещества на кг веса тела, согласно галеновой форме.
Могут быть особые случаи, когда подходят более высокие или более низкие дозировки; такие дозировки также не выходят за рамки изобретения. Согласно обычной практике, дозы, подходящие для каждого пациента, определяются врачом в соответствии со способом введения, весом и восприимчивостью указанного пациента.
Настоящее изобретение, согласно другому его аспекту, относится также к способу лечения указанных выше патологий, который включает прием пациентом эффективной дозы соединения согласно изобретению, одной из его фармацевтически приемлемых солей, сольвата или гидрата указанного соединения.
Формула изобретения
1. Соединение, отвечающее формуле (I)
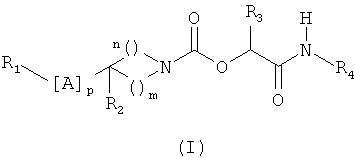
в которой m и n означают целые числа от 1 до 3 такие, что m+n является целым числом от 2 до 5,
р означает целое число от 1 до 7,
А означает простую связь или выбран из одной или нескольких групп X, Y,
Х означает метиленовую группу,
Y означает С2-алкиниленовую группу,
R1 означает группу R5, замещенную одной или несколькими группами R6 и/или R7,
R2 означает атом водорода или фтора, гидроксильную группу,
R3 означает атом водорода,
R4 означает атом водорода или группу, представляющую C1-6-алкил,
R5 означает группу, выбранную из фенила, пиридинила, пиримидинила, пирролила, имидазолила, тиазолила, пиразолила, изоксазолила, оксадиазолила, нафтила, хинолинила, тетрагидрохинолинила, изохинолинила, тетрагидроизохинолинила, индолила, индолинила, изоиндолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензотриазолила, бензоксадиазолила, пирролопиридинила,
R6 означает атом галогена или группу, представляющую циано, C1-6-алкил, С3-7-циклоалкил, С1-6-алкокси, гидроксил, C1-6-фторалкил, С1-6-фторалкокси, или цикл, выбранный из пирролидинового и пиперидинового цикла, причем этот цикл необязательно замещен С1-6-алкильной группой,
R7 означает фенильную группу, причем группа или группы R7 могут быть замещены одной или несколькими группами R6, одинаковыми или отличающимися друг от друга, выбранными из галогена, C1-6-алкила и С1-6-фторалкила, С1-6алкокси.
в виде фармацевтически приемлемого основания или кислотно-аддитивной соли.
2. Соединение формулы (I) по п.1, отличающееся тем, что:
m и n означают целые числа, равные 1 или 2, такие, что m+n является целым числом от 2 до 4,
р означает целое число, равное от 1 до 3,
А означает простую связь, метиленовую группу или С2-алкинилен;
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7,
R2 означает атом водорода или гидроксильную группу,
R3 означает атом водорода,
R4 означает атом водорода или группу C1-6-алкил,
R5 означает группу, выбранную из фенила, пиридинила, пиримидинила, имидазолила, тиазолила, пиразолила, изоксазолила, оксадиазолила, нафтила, тетрагидрохинолинила, изохинолинила, тетрагидроизохинолинила, индолила, индолинила, бензимидазолила, бензоксазолила, бензотиазолила, бензотриазолила, пирролопиридинила,
R6 означает атом галогена или группу, представляющую циано, C1-6-алкил, С3-7-циклоалкил, C1-6-алкокси, C1-6-фторалкил или пирролидиновый или пиперидиновый цикл, причем этот цикл необязательно замещен C1-6-алкильной группой,
R7 означает фенильную группу, которая может быть замещена одной или несколькими группами R6, одинаковыми или отличающимися друг от друга, выбранными из галогена, C1-6-алкила, C1-6-фторалкила, C1-6алкокси. в виде фармацевтически приемлемого основания или кислотно-аддитивной соли.
3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что:
m и n означают целые числа, равные 1 или 2, такие, что m+n является целым числом от 2 до 4,
р означает целое число от 1 до 3,
А означает простую связь, метиленовую группу или С2-алкинилен;
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7,
R2 означает атом водорода или гидроксильную группу,
R3 означает атом водорода,
R4 означает атом водорода или группу C1-6-алкил,
R5 означает группу, выбранную из фенила, пиридинила, пиримидинила, тиазолила, изоксазолила, нафтила, изохинолинила,
R6 означает атом галогена или группу, представляющую циано, С1-6-алкил, С3-7-циклоалкил, С1-6-алкокси, C1-6-фторалкил или пирролидиновый или пиперидиновый цикл, причем этот цикл необязательно замещен C1-6-алкильной группой,
R7 означает фенильную группу, которая может быть замещена одной или несколькими группами R6, одинаковыми или отличающимися друг от друга, выбранными из галогена, С1-6-алкила, C1-6-фторалкила, С1-6алкокси.
4. Соединение формулы (I) по п.1 или 2, отличающееся тем, что:
R3 означает атом водорода,
R4 означает атом водорода или C1-6-алкильную группу,
в состоянии фармацевтически приемлемого основания или кислотно-аддитивной соли.
5. Способ получения соединения формулы (I) по любому из пп.1-4, включающий этап, состоящий в превращении эфира-карбамата общей формулы (IV)
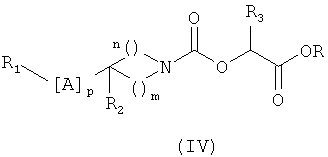
в которой R1, A, R2, R3, р, m и n такие, как определено в формуле (I) по п.1, и R означает метильную или этильную группу,
аминолизом с помощью амина общей формулы R4NH2., в которой R4 определен в формуле (I) по п.1.
6. Соединение, отвечающее общей формуле (IV),
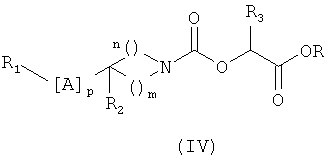
в которой R1, A, R2, R3, р, m и n такие, как определено в формуле (I) по п.1, и R означает метильную или этильную группу.
7. Фармацевтическая композиция, ингибирующая FAAH ферменты, содержащая по меньшей мере одно соединение формулы (I) по любому из пп.1-4, в состоянии фармацевтически приемлемого основания или соли, и необязательно одного или нескольких фармацевтически приемлемых эксципиентов.
8. Применение соединения формулы (I) по любому из пп.1-4, в состоянии фармацевтически приемлемого основания или соли, в качестве ингибирующего FAAH ферменты лекарственного средства.
9. Применение соединения формулы (I) по любому из пп.1-4, в состоянии фармацевтически приемлемого основания или соли, для получения ингибирующего FAAH лекарственного средства, предназначенного для предупреждения или лечения патологии, в которую вовлечены субстраты, метаболизированные ферментом FAAH.
10. Применение соединения формулы (I) по любому из пп.1-4, в состоянии фармацевтически приемлемого основания или соли, для получения лекарственного средства, предназначенного для предупреждения или лечения острых или хронических болей, головокружений, рвоты, тошноты, нарушений пищевого поведения, неврологических и психиатрических патологий, острых или хронических нейродегенеративных заболеваний, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, почечной ишемии, рака, расстройств иммунной системы, аллергических заболеваний, инфекционных паразитарных, вирусных или бактериальных заболеваний, воспалительных заболеваний, остеопороза, глазных болезней, болезней легких, желудочно-кишечных заболеваний или недержания мочи.
|
|