|
|
(21), (22) Заявка: 2008117846/04, 07.05.2008
(24) Дата начала отсчета срока действия патента:
24.01.2008
(46) Опубликовано: 20.12.2009
(56) Список документов, цитированных в отчете о
поиске:
ЕР 941994 А1,15.09.1999. WO 2001016111 А2, 08.03.2001. RU 2003129060 А,10.04.2005. RU 2291869 C2, 20.01.2007. NEPLYUEV V.M. и др. “Arylsulfonylacetonitrile series. II. Cyclization of arylamides of arylsulfonylcyanothienoacetic acid”, Химия гетероциклических соединений, 1970, 9, с.1194-7.
(62) Номер и дата подачи первоначальной заявки, из которой данная заявка выделена: 2008102154 24.01.2008
Адрес для переписки:
141400, Московская обл., г. Химки, ул. Рабочая, 2а, корп.1, ЦВТ “ХимРар”, Н.М. Шмаковой
|
(72) Автор(ы):
Иващенко Александр Васильевич (US),
Савчук Николай Филиппович (RU),
Иващенко Андрей Александрович (RU)
(73) Патентообладатель(и):
Иващенко Андрей Александрович (RU),
АЛЛА ХЕМ, ЛЛС (US)
|
(54) ЗАМЕЩЕННЫЕ 3,5-ДИАМИНО-4-СУЛЬФОНИЛ-ПИРАЗОЛЫ И 2-АМИНО-3-СУЛЬФОНИЛ-ПИРАЗОЛО[1,5-a]ПИРИМИДИНЫ – АНТАГОНИСТЫ СЕРОТОНИНОВЫХ 5-HT6 РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
(57) Реферат:
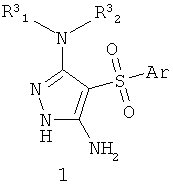
Данное изобретение относится к антагонистам серотониновых 5-НТ6 рецепторов общей формулы 1 и их фармацевтически приемлемым солям и/или гидратам, фармацевтическим композициям, лекарственным формам и способам получения. Изобретение также включает новые соединения формулы 1.1. Соединения изобретения могут найти применение для лечения и предупреждения развития состояний и заболеваний центральной нервной системы. В формулах 1 и 1.1
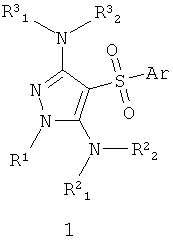 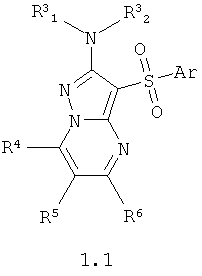
Ar представляет собой арил, выбранный из необязательно замещенного фенила или необязательно замещенного 5-6-членного гетероарила, содержащего в качестве гетероатома атом азота или атом серы; R1 представляет собой атом водорода, необязательно замещенный С1-С5алкил; Ar представляет собой арил, выбранный из необязательно замещенного фенила или необязательно замещенного 5-6-членного гетероарила, содержащего в качестве гетероатома атом азота или атом серы; R1 представляет собой атом водорода, необязательно замещенный С1-С5алкил; R2 1, 1,
R2 2, R3 2, R3 1, R3 1, R3 2 независимо друг от друга представляют собой атом водорода или заместитель аминогруппы, выбранный из необязательного замещенного С1-С4алкила, необязательного замещенного фенила, или R3 2 независимо друг от друга представляют собой атом водорода или заместитель аминогруппы, выбранный из необязательного замещенного С1-С4алкила, необязательного замещенного фенила, или R3 1 и R3 1 и R3 2 вместе с атомом азота, с которым они связаны, образуют необязательного замещенный насыщенный 6-членный гетероциклил, возможно содержащий атом азота в цикле; или R1 вместе с атомом азота, с которым он связан, и R2 2 вместе с атомом азота, с которым они связаны, образуют необязательного замещенный насыщенный 6-членный гетероциклил, возможно содержащий атом азота в цикле; или R1 вместе с атомом азота, с которым он связан, и R2 1 и R2 1 и R2 2 вместе с атомом азота, с которым они связаны, образуют замещенный пиримидиновый цикл. В формуле 1.1 R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил. 6 н. т 7 з.п. ф-лы, 11 ил., 4 табл. 2 вместе с атомом азота, с которым они связаны, образуют замещенный пиримидиновый цикл. В формуле 1.1 R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил. 6 н. т 7 з.п. ф-лы, 11 ил., 4 табл.
Данное изобретение относится к новым арилсульфонил-азагетероциклическим соединениям, к новым антагонистам серотониновых 5-НТ6 рецепторов, к новым лекарственным началам, фармацевтическим композициям, лекарственным средствам и способам их получения. Более конкретно, настоящее изобретение относится к антагонистам серотониновых 5-НТ6 рецепторов – замещенным 4-сульфонилпиразолов и 3-сульфонил-пиразоло[1,5-а]пиримидинов, лекарственным началам и фармацевтическим композициям, содержащим лекарственные начала в виде указанных соединений, а также к способу лечения и предупреждения развития различных когнитивных и нейродегенеративных заболеваний. В основе фармакологического эффекта новых лекарственных начал лежит их способность взаимодействовать с серотониновыми 5-НТ6 рецепторами, играющими важную роль для лечения заболеваний центральной нервной системе (ЦНС), в частности болезни Альцгеймера (БА), болезни Гантингтона, шизофрении, других нейродегенеративных заболеваний, когнитивных расстройств и ожирения.
Использование эффективных и селективных антагонистов серотониновых 5-НТ6 рецепторов для лечения заболеваний ЦНС, в частности шизофрении, БА и других нейродегенеративных заболеваний и когнитивных расстройств, является перспективным направлением для получения новых лекарств [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistry strategies to 5-НТ6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006; 11:283-299]. Эти рецепторы у млекопитающих находятся исключительно в центральной нервной системе, причем главным образом в участках головного мозга, ответственных за обучение и память [Ge rard С., Martres M.-P., Lefe rard С., Martres M.-P., Lefe vre К., Miquel M.-C, Verge vre К., Miquel M.-C, Verge D., Lanfumey L., Doucet E., Hamon M., El Mestikawy S. Immuno-localisation of serotonin 5-НТ6 receptor-like material in the rat central nervous system. Brain Research. 1997; 746:207-219]. Кроме того, показано [Dawson L.A., Nguyen H.Q., Li P. The 5-HT(6) receptor antagonist SB-271046 selectively enhances excitatory neurotransmission in the rat frontal cortex and hippocampus. Neuropsychopharmacology. 2001; 25:662-668], что 5-НТ6 рецепторы являются модуляторами нескольких нейромедиаторных систем, включая холинэргическую, норадренэргическую, глутаматэргическую и допаминэргическую. Учитывая фундаментальную роль этих систем в нормальных когнитивных процессах, а также их дисфункцию при нейродегенерации, становится очевидной исключительная роль 5-НТ6 рецепторов в формировании нормальной или «патологической» памяти. В большом числе современных работ показано, что блокирование 5-НТ6 рецепторов приводит к значительному усилению консолидации памяти в различных животных моделях обучения-запоминания-воспроизведения [Foley A.G., Murphy K.J., Hirst W.D., Gallagher H.C., Hagan J.J., Upton N., Walsh F.S., Regan C.M. The 5-HT(6) receptor antagonist SB-271046 reverses scopolamine-disrupted consolidation of a passive avoidance task and ameliorates spatial task deficits in aged rats. Neuropsychopharmacology. 2004; 29:93-100. Riemer C., Borroni E., Levet-Trafit В., Martin J.R., Poli S., Porter R.H., Bos M. Influence of the 5-HT6 receptor on acetylcholine release in the cortex: pharmacological characterization of 4-(2-bromo-6-pyrrolidin-l-ylpyridine-4-sulfonyl)phenylamine, a potent and selective 5-НТ6 receptor antagonist. J. Med. Chem. 2003; 46:1273-1276. King M.V., Woolley M.L., Topham I.A., Sleight A.J., Marsden C.A., Fone K.C. 5-HT6 receptor antagonists reverse delay-dependent deficits in novel object discrimination by enhancing consolidation e an effect sensitive to NMDA receptor antagonism. Neuropharmacology 2004; 47:195-204]. Также показано значительное улучшение когнитивных функций у старых крыс в модели водного лабиринта Моррисона при воздействии антагонистом 5-НТ6 рецепторов [Foley A.G., Murphy K.J., Hirst W.D., Gallagher H.C., Hagan J.J., Upton N., Walsh F.S., Regan C.M. The 5-HT(6) receptor antagonist SB-271046 reverses scopolamine-disrupted consolidation of a passive avoidance task and ameliorates spatial task deficits in aged rats. Neuropsychopharmacology. 2004; 29:93-100]. В последнее время достигнуто не только более глубокое понимание роли 5-НТ6 рецепторов в когнитивных процессах, но и более четкое формирование представлений о возможных фармакофорных свойствах их антагонистов [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistry strategies to 5-НТ6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006; 11:283-299]. Это привело к созданию высокоаффинных селективных лигандов («молекулярных инструментов»), а затем и клинических кандидатов. В настоящее время ряд антагонистов 5-НТ6 D., Lanfumey L., Doucet E., Hamon M., El Mestikawy S. Immuno-localisation of serotonin 5-НТ6 receptor-like material in the rat central nervous system. Brain Research. 1997; 746:207-219]. Кроме того, показано [Dawson L.A., Nguyen H.Q., Li P. The 5-HT(6) receptor antagonist SB-271046 selectively enhances excitatory neurotransmission in the rat frontal cortex and hippocampus. Neuropsychopharmacology. 2001; 25:662-668], что 5-НТ6 рецепторы являются модуляторами нескольких нейромедиаторных систем, включая холинэргическую, норадренэргическую, глутаматэргическую и допаминэргическую. Учитывая фундаментальную роль этих систем в нормальных когнитивных процессах, а также их дисфункцию при нейродегенерации, становится очевидной исключительная роль 5-НТ6 рецепторов в формировании нормальной или «патологической» памяти. В большом числе современных работ показано, что блокирование 5-НТ6 рецепторов приводит к значительному усилению консолидации памяти в различных животных моделях обучения-запоминания-воспроизведения [Foley A.G., Murphy K.J., Hirst W.D., Gallagher H.C., Hagan J.J., Upton N., Walsh F.S., Regan C.M. The 5-HT(6) receptor antagonist SB-271046 reverses scopolamine-disrupted consolidation of a passive avoidance task and ameliorates spatial task deficits in aged rats. Neuropsychopharmacology. 2004; 29:93-100. Riemer C., Borroni E., Levet-Trafit В., Martin J.R., Poli S., Porter R.H., Bos M. Influence of the 5-HT6 receptor on acetylcholine release in the cortex: pharmacological characterization of 4-(2-bromo-6-pyrrolidin-l-ylpyridine-4-sulfonyl)phenylamine, a potent and selective 5-НТ6 receptor antagonist. J. Med. Chem. 2003; 46:1273-1276. King M.V., Woolley M.L., Topham I.A., Sleight A.J., Marsden C.A., Fone K.C. 5-HT6 receptor antagonists reverse delay-dependent deficits in novel object discrimination by enhancing consolidation e an effect sensitive to NMDA receptor antagonism. Neuropharmacology 2004; 47:195-204]. Также показано значительное улучшение когнитивных функций у старых крыс в модели водного лабиринта Моррисона при воздействии антагонистом 5-НТ6 рецепторов [Foley A.G., Murphy K.J., Hirst W.D., Gallagher H.C., Hagan J.J., Upton N., Walsh F.S., Regan C.M. The 5-HT(6) receptor antagonist SB-271046 reverses scopolamine-disrupted consolidation of a passive avoidance task and ameliorates spatial task deficits in aged rats. Neuropsychopharmacology. 2004; 29:93-100]. В последнее время достигнуто не только более глубокое понимание роли 5-НТ6 рецепторов в когнитивных процессах, но и более четкое формирование представлений о возможных фармакофорных свойствах их антагонистов [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistry strategies to 5-НТ6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006; 11:283-299]. Это привело к созданию высокоаффинных селективных лигандов («молекулярных инструментов»), а затем и клинических кандидатов. В настоящее время ряд антагонистов 5-НТ6
| Таблица 1. |
| Антагонисты 5-НТ6 рецепторов как лекарственные кандидаты. |
| Лекарство |
Клиническая фаза испытаний |
Разработчик |
Терапевтическая группа |
Dimebon |
Фаза III |
Medivation (USA) |
Лечение болезни Альцгеймера |
| SGS-518 |
Фаза II |
Lilly, Saegis |
Лечение когнитивных заболеваний |
| SB-742457 |
Фаза II |
GlaxoSmithKline |
Лечение болезни Альцгеймера; Антипсихотик |
| Dimebon* |
Фаза I/IIа |
Medivation (USA) |
Лечение болезни Гангтинтона |
| Dimebon* |
Фаза II |
(Россия) |
Шизофрения |
| PRX-07034 |
Фаза I |
Epix Pharm. |
Лечение избыточного веса; Антипсихотик; Лечение когнитивных заболеваний |
| SB-737050A |
Фаза II |
GlaxoSmithKline |
Антипсихотик |
| BVT-74316 |
Фаза I |
Biovitrum |
Лечение избыточного веса |
| SAM-315 |
Фаза I |
Wyeth Pharm. |
Лечение болезни Альцгеймера |
| SYN-114 |
Фаза I |
Roche, Synosis Ther. |
Лечение когнитивных заболеваний |
| BGC-20-761 |
Предклиника |
BTG (London) |
Антипсихотик; Лечение когнитивных заболеваний |
| FMPO |
Предклиника |
Lilly |
Антипсихотик |
Dimebon |
Предклиника |
(Россия) |
Лечение инсульта |
Еще одним привлекательным свойством антагонистов 5-НТ6 рецепторов является их способность подавлять аппетит, что может привести к созданию на их основе принципиально новых средств для понижения избыточного веса и ожирения [Vicker S.P., Dourish С.Т. Serotonin receptor ligands and the treatment of obesity. Curr. Opin. Investig. Drugs. 2004; 5:377-388]. Этот эффект подтвержден во многих исследованиях [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistry strategies to 5-HT6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006; 11:283-299. Davies S.L. Drag discovery targets: 5-HT6 receptor. Drug Future. 2005; 30:479-495], его механизм основан на подавлении антагонистами 5-НТ6 рецепторов сигналинга гамма-аминомасляной кислоты и увеличении выброса альфа-меланоцит-стимулирующего гормона, что в конечном итоге приводит к уменьшению потребности в пище [Woolley M.L. 5-ht6 receptors. Curr. Drug Targets CNSNeurol. Disord. 2004; 3:59-79]. В настоящее время два антагониста 5-НТ6
В этой связи поиск селективных и эффективных антагонистов серотониновых 5-НТ6 рецепторов представляется оригинальным и перспективным подходом к созданию новых лекарственных средств для лечения широкого круга неврологических и нейродегенеративных заболеваний и когнитивных расстройств.
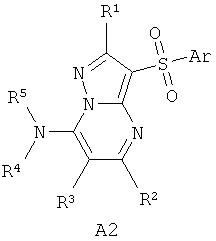
В литературе имеется значительное число публикаций, посвященных различным биологически активным сульфонилпроизводным азагетероциклов, в том числе лигандам серотониновых рецепторов. Так, например, известны замещенные 1-(2-аминоэтил)-4-арилсульфонил-пиразолы общей формулы А1 как лиганды серотониновых 5-НТ2c рецепторов [WO 2003057674 А1] и 7-амино-3-сульфонил-пиразоло[1,5-а]пиримидины А2 как антагонисты серотониновых 5-НТ6 рецепторов [ЕР 941994 А1, 1999],
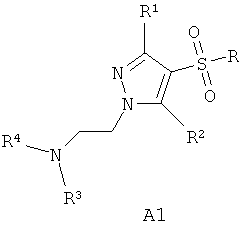 
A1: R=алкил, арил; R1 и R2=Н, ОН, алкил, алкокси; R3 и R4=Н, алкил, арил.
А2: Аr=арил, гетероциклил; R1=Н, алкил, алкилтио; R2=Н, алкил, галоген; R3=Н, алкил, гидроксиалкил; R4 и R5=Н; NR4R5=пиперазинил.
С целью разработки новых высокоэффективных нейропротекторных лекарственных средств авторами данного изобретения выполнены широкие исследования в ряду замещенных 4-сульфонилпиразолов и 3-сульфонил-пиразоло[1,5-а]пиримидинов, в результате чего найдены новые лекарственные начала, представляющие собой антагонисты 5-НТ6 рецепторов.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Агонисты» означают лиганды, которые, связываясь с рецепторами данного типа, активно способствуют передаче этими рецепторами свойственного им специфического сигнала и тем самым вызывают биологический ответ клетки.
«Азагетероцикл» означает ароматическую или неароматическую моноциклическую или полициклическую систему, содержащую в цикле, по крайней мере, один атом азота. Азагетероцикл может иметь один или более «заместителей циклической» системы. «Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько «низших алкильных» заместителей. Алкил может иметь один или несколько одинаковых или различных заместителей («алкильных заместителей»), включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонил, гетероаралкилокси, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или Rk 8Rk+1 8Rk+1 aN-, Rk aN-, Rk aRk+1 aRk+1 aNC(=O)-, Rk aNC(=O)-, Rk aRk+1 aRk+1 aNC(=S)-, Rk aNC(=S)-, Rk aRk+1 aRk+1 aNSO2-, где Rk aNSO2-, где Rk a и Rk+1 a и Rk+1 a независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе, например атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rk a независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе, например атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rk a и Rk+1 a и Rk+1 a вместе с атомом N, с которым они связаны, образуют через Rk a вместе с атомом N, с которым они связаны, образуют через Rk a и Rk+1 a и Rk+1 a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил, метоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными «алкильными заместителями» являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или Rk a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил, метоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными «алкильными заместителями» являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или Rk aRk+1 aRk+1 aN-, Rk aN-, Rk aRk+1 aRk+1 aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
«Алкилокси» означает алкил-О- группу, в которой алкил определен в данном разделе. Предпочтительными алкилокси группами являются метокси, этокси, н-пропокси, изо-пропокси и н-бутокси.
«Алкилоксикарбонил» означает алкил-О-С(=О) группу, в которой алкил определен в данном разделе. Предпочтительными алкилоксикарбонильными группами являются метоксикарбонил, этоксикарбонил, н-бутоксикарбонил, изо-пропилоксикарбонил, трет-бутилоксикарбонил.
«Аминогруппа» означает Rk aRk+1 aRk+1 aN-группу, замещенную или незамещенную «заместителем аминогруппы» Rk aN-группу, замещенную или незамещенную «заместителем аминогруппы» Rk a и Rk+1 a и Rk+1 a, значение которых определено в данном разделе, например амино (H2N-), метиламино, диэтиламино, пирролидино, морфолино, бензиламино или фенетиламино. a, значение которых определено в данном разделе, например амино (H2N-), метиламино, диэтиламино, пирролидино, морфолино, бензиламино или фенетиламино.
«Аннелированный цикл» (конденсированный цикл) означает би- или полициклическую систему, в которой аннелированный цикл и цикл или полицикл, с которым он «аннелирован», имеют как минимум два общих атома.
«Антагонисты» означают лиганды, которые связываются с рецепторами определенного типа и не вызывают активного клеточного ответа. Антагонисты препятствуют связыванию агонистов с рецепторами и, тем самым, блокируют передачу специфического рецепторного сигнала.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимущественно от 6 до 10 атомов углерода. Арил может содержать один или более «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями арильных групп являются фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом.
«Арилсульфонил» означает арил-SО2– группу, в которой значение арил определено в данном разделе.
«Галоген» означает фтор, хлор, бром и йод. Предпочтительными яляются фтор, хлор и бром.
«Гетероарил» означает ароматическую моноциклическую или полициклическую систему, включающую от 5 до 14 атомов углерода, предпочтительно от 5 до 10, в которой один или больше атомов углерода замещены гетероатомом или гетероатомами, такими как азот, сера или кислород. Приставка «аза», «окса» или «тиа» перед «гетероарил» означает наличие в циклической системе атома азота, атома кислорода или атома серы соответственно. Атом азота, находящийся в гетероариле, может быть окислен до N-оксида. Гетероарил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями гетероарилов являются пирролил, фуранил, тиенил, пиридил, пиразинил, пиримидинил, изооксазолил, изотиазолил, тетразолил, оксазолил, тиазолил, пиразолил, фуразанил, триазолил, 1,2,4-тиадиазолил, пиридазинил, хиноксалинил, фталазинил, имидазо[1,2-а]пиридинил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил, бензотиазенил, хинолинил, имидазолил, тиенопиридил, хиназолинил, тиенопиримидинил, пирролопиридин, имидазопиридил, изохинолинил, бензоазаиндолил, 1,2,4-триазинил, тиенопирролил, фуропирролил и др.
«Гетероциклил» означает ароматическую или неароматическую насыщенную моноциклическую или полициклическую систему, включающую от 3 до 10 атомов углерода, преимущественно от 5 до 6 атомов углерода, в которой один или несколько атомов углерода заменены на гетероатом, такой как азот, кислород, сера. Приставка «аза», «окса» или «тиа» перед гетероциклилом означает наличие в циклической системе атома азота, атома кислорода или атома серы соответственно. Гетероциклил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероциклиле, могут быть окислены до N-оксида, S-оксида или S-диоксида. Представителями гетероциклилов являются пиперидин, пирролидин, пиперазин, морфолин, тиоморфолин, тиазолидин, 1,4-диоксан, тетрагидрофуран, тетрагидротиофен и др.
«Гидрат» означает сольват, в котором вода является молекулой или молекулами растворителя.
«Заместитель» означает химический радикал, который присоединяется к скэффолду (фрагменту), например «заместитель алкильный», «заместитель аминогруппы», «заместитель карбамоильный», «заместитель циклической системы», значения которых определено в данном разделе.
«Заместитель алкильный» означает заместитель, присоединенный к алкилу, алкенилу, значение которых определено в данном разделе. Заместитель алкильный представляет собой водород, алкил, галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или Rk aRk+1 aRk+1 aN-, Rk aN-, Rk aRk+1 aRk+1 aNC(=O)-, Rk aNC(=O)-, Rk aRk+1 aRk+1 aNSO2-, где Rk aNSO2-, где Rk a и Rk+1 a и Rk+1 a независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе, например атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rk a независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе, например атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rk a и Rk+1 a и Rk+1 a вместе с атомом N, с которым они связаны, образуют через Rk a вместе с атомом N, с которым они связаны, образуют через Rk a и Rk+1 a и Rk+1 a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил метоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными «алкильными заместителями» являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или Rk a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил метоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными «алкильными заместителями» являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или Rk aRk+1 aRk+1 aN-, Rk aN-, Rk aRk+1 aRk+1 aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. Значение «заместителей алкильных» определено в данном разделе. aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. Значение «заместителей алкильных» определено в данном разделе.
«Заместитель аминогруппы» означает заместитель, присоединенный к аминогруппе. Заместитель аминогруппы представляет собой водород, алкил, циклоалкил, арил, гетероарил, гетероциклил, ацил, ароил, алкилсульфонил, арилсульфонил, гетероарилсульфонил, алкиламинокарбонил, ариламинокарбонил, гетероариламино- карбонил, гетероциклиламинокарбонил, алкиламинотиокарбонил, ариламинотио- карбонил, гетероариламинотиокарбонил, гетероциклиламинотиокарбонил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонилалкил, аралкоксикарбонил алкил, гетероаралкилоксикарбонилалкил.
«Замещенная аминогруппа» означает Rk aRk+1 aRk+1 aN-группу, в которой Rk aN-группу, в которой Rk a и Rk+1 a и Rk+1 a представляют собой заместители аминогруппы, значение которых определено в данном разделе. a представляют собой заместители аминогруппы, значение которых определено в данном разделе.
«Когнитивные расстройства или нарушения когнитивных функций (cognitive disorder)» означают нарушение (ослабление) умственных возможностей, включающих внимание, память, мышление, познание, обучение, речевые, мыслительные, исполнительные и творческие способности, ориентацию во времени и пространстве, в частности когнитивные расстройства, связанные с болезнями Альцгеймера, Паркинеона и Хантингтона; старческое слабоумие; возрастные расстройства памяти (age-associated memory impairment, AAMI); дисметаболические энцефалопатии; психогенные нарушения памяти; амнезия; амнестические расстройства; транзиторная глобальная амнезия; диссоциативная амнезия; васкулярная деменция; легкие (или умеренные) когнитивные нарушения (mild cognitive impairment, MCI); синдром нарушения внимания с гиперактивностью (attention deficit hyperactivity disorder, AD/HD); когнитивные нарушения, сопровождающие психотические заболевания, эпилепсию, делирий, аутизм, психозы, синдром Дауна, биполярные расстройства и депрессию; СПИД-ассоциированная деменция; деменция при гипотиреоидизме; деменция, индуцированная алкоголем, веществами, вызывающими зависимость, и нейротоксинами; деменция, сопровождающая нейродегенеративные заболевания, например, мозжечковую дегенерацию и амиотрофический латеральный склероз; когнитивные расстройства, развивающиеся при инсульте, инфекционных и онкологических заболеваниях головного мозга, а также при черепно-мозговых травмах; нарушения когнитивных функций, ассоциированные с аутоиммунными и эндокринными заболеваниями; и прочие когнитивные расстройства.
«Лекарственное начало» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» – вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Лиганды» (от латинского ligo – связывать) представляют собой химические вещества (малая молекула, неорганический ион, пептид, белок и прочее), способные взаимодействовать с рецепторами, которые трансформируют это взаимодействие в специфический сигнал.
«Нейродегенеративное заболевание (НЗ)» означает специфическое состояние и заболевание, характеризующиеся повреждением и первичной гибелью популяций нервных клеток в определенных областях центральной нервной системы. Нейродегенеративные заболевания включают, но не ограничивают, болезни Альцгеймера и Паркинсона; болезнь (хорею) Хантингтона; рассеянный склероз; мозжечковую дегенерацию; амиотрофический латеральный склероз; деменцию с тельцами Леви; спинальную мускульную атрофию; периферическую нейропатию; губчатый энцефалит («коровье бешенство», Creutzfeld-Jakob Disease); СПИД-ассоциированную деменцию; мультиинфарктную деменцию; лобно-височную деменцию; лейкоэнцефалопатию (болезнь исчезающего белого вещества); хронические нейродегенеративные заболевания; инсульт; ишемическое, реперфузионное и гипоксическое повреждение мозга; эпилепсия; церебральная ишемия; глаукома; черепно-мозговая травма; синдром Дауна; энцефаломиелит; менингит; энцефалит; нейробластома; шизофрения; депрессия. Кроме того, нейродегенеративные заболевания включают патологические состояния и расстройства, развивающиеся при гипоксии, злоупотреблении веществами, вызывающими зависимость, при воздействии нейротоксинов, инфекционных и онкологических заболеваниях головного мозга, а также нейрональные повреждения, ассоциированные с аутоиммунными и эндокринными заболеваниями; и прочие нейродегенеративные процессы.
«Низший алкил» означает линейный или разветвленный алкил с 1-4 атомами углерода.
«Сульфонил» означает R-SO2– группу, в которой R представляет собой алкил, циклоалкил, арил, гетероарил, гетероциклил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, значение которых определено в данном разделе.
«Рецепторы» (от латинского recipere – получать, узнавать) представляют собой биологические макромолекулы, расположенные на цитоплазматической мембране клетки или внутриклеточно, способные специфически взаимодействовать с ограниченным набором физиологически активных веществ (лигандов) и трансформировать сигнал об этом взаимодействии в определенный клеточный ответ.
«Терапевтический коктейль» представляет одновременно администрируемую комбинацию двух и более лекарственных препаратов, обладающих различным механизмом фармакологического действия и направленных на различные биомишени, участвующие в патогенезе заболевания.
«Фармацевтическая композиция» обозначает композицию, включающую в себя соединение формулы I и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как, парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные. (Подробное описание свойств таких солей дано в Berge S.M., et al., “Pharmaceutical Salts” J. Pharm. Sci. 1977, 66: 1-19.) Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты – лизин, орнитин и аргинин.
Цель настоящего изобретения заключается в создании новых антагонистов серотониновых 5-НТ6 рецепторов и новых лекарственных начал.
Поставленная цель достигается антагонистами серотониновых 5-НТ6 рецепторов общей формулы 1 или их фармацевтически приемлемыми солями и/или гидратами,
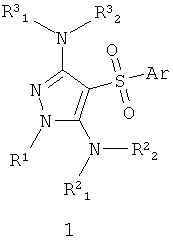
где Аr представляет собой арил, выбранный из необязательно замещенного фенила или необязательно замещенного 5-6-членного гетероарила, содержащего в качестве гетероатома атом азота или атом серы;
R1 представляет собой атом водорода, необязательно замещенный С1-С5алкил;
R2 1, R2 1, R2 2, R3 2, R3 1, R3 1, R3 2 независимо друг от друга представляют собой атом водорода или заместитель аминогруппы, выбранный из необязательного замещенного С1-С4алкила, необязательного замещенного фенила, или R3 2 независимо друг от друга представляют собой атом водорода или заместитель аминогруппы, выбранный из необязательного замещенного С1-С4алкила, необязательного замещенного фенила, или R3 1 и R3 1 и R3 2 вместе с атомом азота, с которым они связаны, образуют необязательного замещенный насыщенный 6-членный гетероциклил, возможно содержащий атом азота в цикле; 2 вместе с атомом азота, с которым они связаны, образуют необязательного замещенный насыщенный 6-членный гетероциклил, возможно содержащий атом азота в цикле;
или R1 вместе с атомом азота, с которым он связан, и R2 1 и R2 1 и R2 2 вместе с атомом азота, с которьм они связаны, образуют замещенный пиримидиновый цикл. 2 вместе с атомом азота, с которьм они связаны, образуют замещенный пиримидиновый цикл.
Предпочтительными антагонистами серотониновых 5-НТ6 рецепторов являются замещенные 2-амино-3-сульфонил-пиразоло[1,5-а]пиримидины общей формулы 1.1 или их фармацевтически приемлемые соли и/или гидраты,
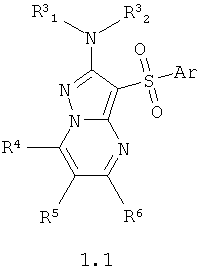
где Ar, R3 1 и R3 1 и R3 2 имеют вышеуказанное значение; R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил. 2 имеют вышеуказанное значение; R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил.
Более предпочтительными антагонистами серотониновых 5-НТ6 рецепторов являются замещенные 3-арилсульфонил-5,7-диметил-пиразоло[1,5-а]пиримидины общей формулы 1.1.1 или их фармацевтически приемлемые соли и/или гидраты,
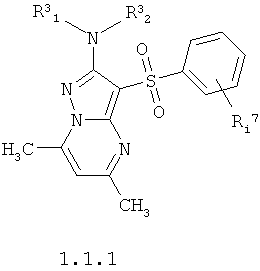
где R3 1 и R3 1 и R3 2 имеют вышеуказанное значение; Ri 2 имеют вышеуказанное значение; Ri 7 представляет собой один или два необязательно одинаковых заместителя циклической системы, выбранные из атома водорода, С1-С5алкила, трифторметила или атома галогена. 7 представляет собой один или два необязательно одинаковых заместителя циклической системы, выбранные из атома водорода, С1-С5алкила, трифторметила или атома галогена.
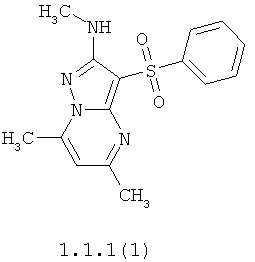
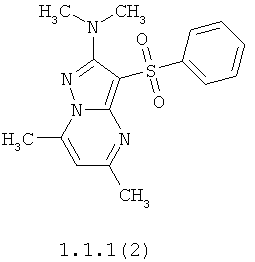
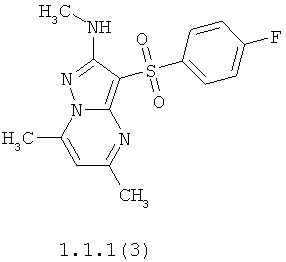
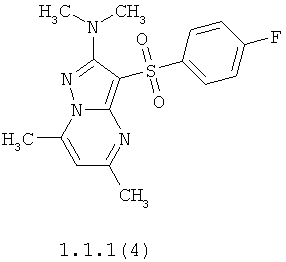
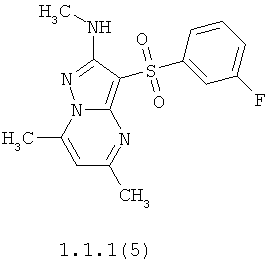
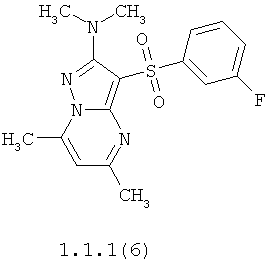
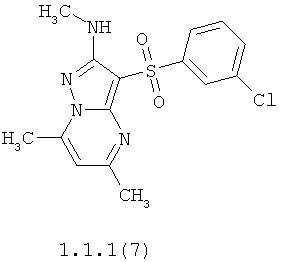
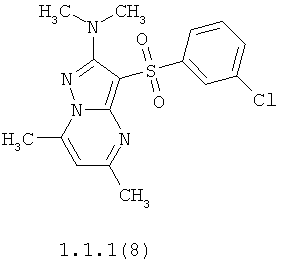
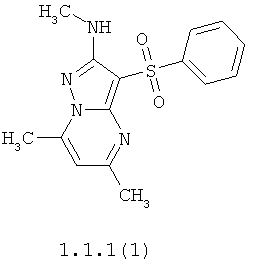
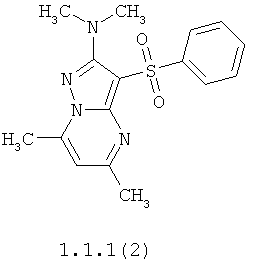
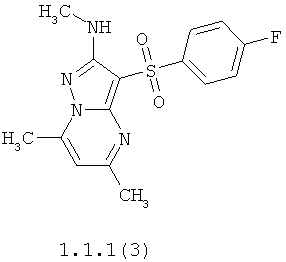
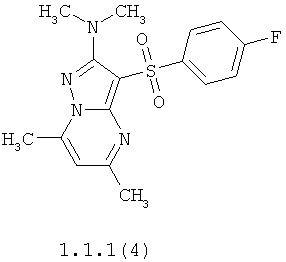
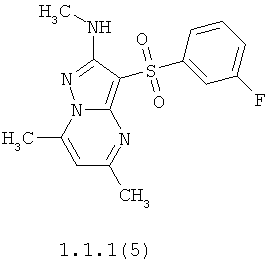
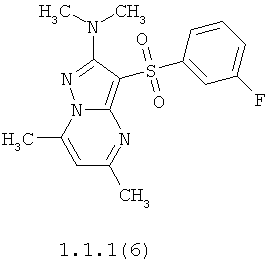
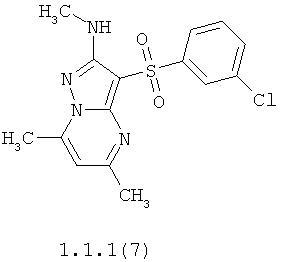
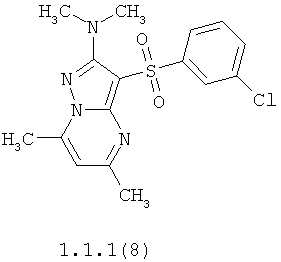
Более предпочтительными антагонистами серотониновых 5-НТ6 рецепторов являются 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(1), 5,7-диметил-2-диметиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(2), 5,7-диметил-2-метиламино-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(3), 5,7-диметил-2-диметиламино-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(4), 5,7-диметил-2-метиламино-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(5), 5,7-диметил-2-диметиламино-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(6), 5,7-диметил-2-метиламино-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(7), 5,7-диметил-2-диметиламино-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(8) или их фармацевтически приемлемые соли и/или гидраты.
Предметом данного изобретения является также лекарственное начало для фармацевтических композиций и лекарственных форм, представляющее собой, по крайней мере, один антагонист серотониновых 5-НТ6 рецепторов общей формулы 1, 1.1.
Предметом данного изобретения является также фармацевтическая композиция, взаимодействующая с серотониновыми 5-НТ6 рецепторами, для лечения и предупреждения развития различных состояний и заболеваний ЦНС людей и теплокровных животных, содержащая фармацевтически эффективное количество нового лекарственного начала, представляющего собой, по крайней мере, один антагонист серотониновых 5-НТ6 рецепторов общей формулы 1, 1.1.
Фармацевтическая композиция может включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с лекарственным началом общей формулы 1 по настоящему изобретению может включать и другие активные ингредиенты при условии, что они не вызывают нежелательных эффектов, например аллергических реакций.
При необходимости использования фармацевтических композиций по настоящему изобретению в клинической практике они могут смешиваться для изготовления различных форм, при этом они могут включать в свой состав традиционные фармацевтические носители; например, пероральные формы (такие как таблетки, желатиновые капсулы, пилюли, растворы или суспензии); формы для инъекций (такие как растворы или суспензии для инъекций, или сухой порошок для инъекций, который требует лишь добавления воды для инъекций перед использованием); местные формы (такие как мази или растворы).
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Предметом данного изобретения является также способ получения новой фармацевтической композиции смешением с инертным наполнителем и/или растворителем лекарственного начала, представляющего собой, по крайней мере, один антагонист серотониновых 5-НТ6 рецепторов общей формулы 1, 1.1.
Предметом данного изобретения является также лекарственное средство в форме таблеток, капсул или инъекций, помещенное в фармацевтически приемлемую упаковку, включающее в свой состав лекарственное начало, представляющее собой, по крайней мере, один антагонист серотониновых 5-НТ6 рецепторов общей формулы 1, 1.1 или фармацевтическую композицию, включающую это лекарственное начало, предназначенное для лечения и предупреждения патологических состояний и заболеваний ЦНС, патогенез которых связан с нарушением активации серотониновых 5-НТ6 рецепторов.
Согласно данному изобретению более предпочтительными являются лекарственные средства для профилактики и лечения болезни Альцгеймера и болезни Гантингтона.
Согласно данному изобретению более предпочтительными являются также лекарственные средства для профилактики и лечения психических расстройств и шизофрении.
Согласно данному изобретению более предпочтительными являются также лекарственные средства для профилактики и лечения ожирения.
Предметом данного изобретения является также способ профилактики и лечения заболеваний центральной нервной системы, патогенез которых связан с серотониновыми 5-НТ6 рецепторами у животных и людей, в том числе неврологических расстройств, нейродегенеративных и когнитивных заболеваний, который заключается во введении теплокровному животному или человеку нового лекарственного средства, содержащего лекарственное начало общей формулы 1.
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка фармацевтической композиции или лекарственного средства, содержащих лекарственное начало общей формулы 1, у пациентов может корректироваться в зависимости от: терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10~500 мг, предпочтительно 50~300 мг. Поэтому во время приготовления фармацевтических композиций по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10~500 мг лекарственного начала общей формулы 1, предпочтительно 50~300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно от одного до шести раз).
Предметом настоящего изобретения являются новые замещенные 3-сульфонил-пиразоло[1,5-а]пиримидины общей формулы 1.1 или их фармацевтически приемлемые соли и/или гидраты,

где Аr, R3 1 и R3 1 и R3 2 имеют вышеуказанное значение; R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил. 2 имеют вышеуказанное значение; R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил.
Предметом настоящего изобретения являются также новые замещенные 3-арилсульфонил-5,7-диметил-пиразоло[1,5-а]пиримидины общей формулы 1.1.1 или их фармацевтически приемлемые соли и/или гидраты,

где R3 1 и R3 1 и R3 2 имеют вышеуказанное значение; Ri 2 имеют вышеуказанное значение; Ri 7 представляет собой один или два необязательно одинаковых заместителя циклической системы, выбранных из атома водорода, С1-С5алкила, трифторметила или атома галогена. 7 представляет собой один или два необязательно одинаковых заместителя циклической системы, выбранных из атома водорода, С1-С5алкила, трифторметила или атома галогена.
Более предпочтительными соединениями общей формулы 1.1.1 являются 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(1), 5,7-диметил-2-диметиламино-3-фенил сульфонил-пиразоло[1,5-а]пиримидин 1.1.1(2), 5,7-диметил-2-метиламино-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(3), 5,7-диметил-2-диметиламино-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1 (4), 5,7-диметил-2-метиламино-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(5), 5,7-диметил-2-диметиламино-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(6), 5,7-диметил-2-метиламино-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(7), 5,7-диметил-2-диметиламино-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(8) и их фармацевтически приемлемые соли и/или гидраты,
3-Амино-4-сульфонил-1H-пиразолы общей формулы 1 (R2 1=R2 1=R2 2-H) получают взаимодействием 2-арил(гетарил)сульфонил-3-амино-3-метилсульфанил-акрилонитрилов общей формулы 2 с гидразинами общей формулы 3 по схеме, представленной ниже: 2-H) получают взаимодействием 2-арил(гетарил)сульфонил-3-амино-3-метилсульфанил-акрилонитрилов общей формулы 2 с гидразинами общей формулы 3 по схеме, представленной ниже:
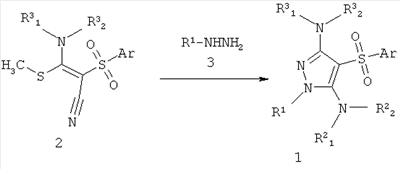
где Аr, R1, R3 1 и R3 1 и R3 2 имеют вышеуказанное значение; R2 2 имеют вышеуказанное значение; R2 1 и R2 1 и R2 2 представляют собой водород. 2 представляют собой водород.
Предметом настоящего изобретения является также способ получения новых замещенных 3-сульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1, 1.1а взаимодействием 3-амино-4-сульфонил-2Н-пиразолов общей формулы 1 (R1=R2 1=R2 1=R2 2=H) с 2=H) с  -дикарбонильными соединениями общей формулы 4 по схеме, представленной ниже: -дикарбонильными соединениями общей формулы 4 по схеме, представленной ниже:
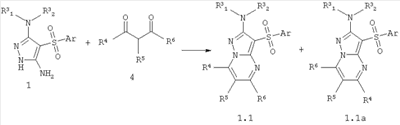
где Ar, R3 1, R3 1, R3 2, R4, R5 и R6 имеют вышеуказанное значение. 2, R4, R5 и R6 имеют вышеуказанное значение.
В случае, если дикетоны 4 являются симметричными (R4=R6), то образуется только один продукт реакции 1.1. Если же дикетоны 4 являются несимметричными, то образуется два продукта реакции 1.1 и 1.1а, которые разделяют общеизвестными способами, например, с помощью препаративной хроматографии или перекристаллизацией.
В представленных ниже примерах описан синтез антагонистов серотониновых 5-НТ6 рецепторов общей формулы 1 и их биологические испытания. Результаты анализов антагонистов серотониновых 5-НТ6 рецепторов общей формулы 1 и их биологическая активность по отношению к серотониновым рецепторам представлены в таблицах 2-4.
Представленные ниже примеры демонстрируют, но не ограничивают данное изобретение.
Изобретение поясняется чертежами.
Фиг.1. Концентрационные зависимости ингибирования антагонистом формулы 1.1.1(1) серотониновых 5-НТ6 рецепторов и Метиотепина как контроля.
Фиг.2. Улучшение памяти у самцов мышей линии BALB/c, нарушенной скополамином, под действием антагониста формулы 1.1.1(1) (CD-008-0216) в тесте «Пассивное избегание мышей в челночной камере». Время, через которое животные делают первый заход в темную камеру. В скобках указана концентрация вещества в мг/кг.
Фиг.3. Улучшение памяти у самцов мышей линии BALB/c, нарушенной скополамином, под действием антагониста формулы 1.1.1(1) (CD-008-0216) в тесте «Пассивное избегание мышей в челночной камере». Время, в течение которого животные находятся в светлой камере. В скобках указана концентрация вещества в мг/кг.
Фиг.4. Улучшение памяти у самцов мышей линии BALB/c, нарушенной скополамином, под действием антагониста формулы 1.1.1(1) (CD-008-0216) в тесте «Пассивное избегание мышей в челночной камере». Число заходов в темную камеру. В скобках указана концентрация вещества в мг/кг.
Фиг.5. Улучшение памяти у самцов мышей линии BALB/c, нарушенной МК-801, под действием антагониста формулы 1.1.1(1) (CD-008-0216) в тесте «Пассивное избегание мышей в челночной камере». Время, через которое животные делают первый заход в темную камеру. В скобках указана концентрация вещества в мг/кг.
Фиг.6. Улучшение памяти у самцов мышей линии BALB/c, нарушенной МК-801, под действием антагониста формулы 1.1.1(1) (CD-008-0216) в тесте «Пассивное избегание мышей в челночной камере». Время, в течение которого животные находятся в светлой камере. В скобках указана концентрация вещества в мг/кг.
Фиг.7. Улучшение памяти у самцов мышей линии BALB/c, нарушенной МК-801, под действием антагониста формулы 1.1.1(1) (CD-008-0216) в тесте «Пассивное избегание мышей в челночной камере». Число заходов в темную камеру. В скобках указана концентрация вещества в мг/кг.
Фиг.8. Поведение самцов мышей линии BALB/c под действием антагониста формулы 1.1.1(1) (CD-008-0216) и препаратов сравнения (Буспирон и Лоразепам) в тесте «Поведение мышей в приподнятом крестообразном лабиринте». Отношение времени, в течение которого животные находятся в открытых рукавах, ко времени, в течение которого животные находятся в открытых и закрытых рукавах. В скобках указана концентрация вещества в мг/кг.
Фиг.9. Поведение самцов мышей линии BALB/c под действием антагониста формулы 1.1.1(1) (CD-008-0216) и препаратов сравнения (Буспирон и Лоразепам) в тесте «Поведение мышей в приподнятом крестообразном лабиринте». Число дефекаций. В скобках указана концентрация вещества в мг/кг.
Фиг.10. Поведение самцов мышей линии BALB/c под действием антагониста формулы 1.1.1(1) (CD-008-0216) и препаратов сравнения (Буспирон и Лоразепам) в тесте «Поведение мышей в приподнятом крестообразном лабиринте». Отношение числа заходов животных в открытые рукава к числу заходов животных в открытые и закрытые рукава. В скобках указана концентрация вещества в мг/кг.
Фиг.11. Состояние неподвижности в течение последних 5 мин в тесте Порсолта. Антагонист формулы 1.1.1(1) (CD-008-0216) и соединения сравнения (Флуоксетин, Дезипрамин) вводили внутрибрюшинно ежедневно в течение 4 дней в дозах 0.05, 0,2 и 15 мг/кг соответственно. * – р<0.05.
Пример 1. Способ получения замещенных 3,5-диамино-4-сульфонил-пиразолов общей формулы 1. Нагревают при перемешивании в 15 мл изопропанола 7.85 ммоль 2-арил(гетарил)сульфонил-3-амино-3-метилсульфанил-акрилонитрила общей формулы 2 с 1.2-1.5 экв. гидразина общей формулы 3 в течение 0.5 ч (контроль по LCMS). После завершения реакции реакционную смесь выливают на смесь вода – лед, выпавшее масло быстро затвердевает, твердое вещество отфильтровывают, промывают водой, холодным изопропанолом, гексаном и перекристаллизовывают из подходящего растворителя. Получают 3,5-диамино-4-сульфонил-пиразолы общей формулы 1, представленные в таблице 2.
Пример 2. Общий способ получения замещенных 2-амино-3-сульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1. Кипятят 0.005 моль замещенного 3,5-диаминопиразола общей формулы 1 и 0.0055 моль соответствующего дикетона общей формулы 4 в 5 мл уксусной кислоты в течение 4 ч. Полученный раствор охлаждают. Выпавший осадок отфильтровывают, промывают метанолом и водой. В случае необходимости продукт подвергают перекристаллизации из подходящего растворителя, или хроматографической очистке, или хроматографическому разделению. Выход 3-сульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1 составляет 70-85%. В таблице 2 представлены некоторые примеры новых замещенных 2-амино3-сульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1 и данные их LCMS-анализов.
Пример 3. Определение антагонистической активности соединений общей формулы 1 по отношению к 5-НТ6 рецепторам. Соединения общей формулы 1 были испытаны на их способность препятствовать активации 5-НТ6 рецепторов серотонином. Используют клетки НЕК 293 (клетки почки человеческого эмбриона) с искусственно экспрессированным рецептором 5-НТ6
В таблице 2 представлены данные по % ингибирования 5-НТ6 рецепторов 10 µМ растворами соединений общей формулы 1. Как видно из представленных данных, испытанные соединения проявляют заметную активность по отношению к серотониновым 5-НТ6 рецепторам.
В таблице 3 представлены концентрационные зависимости ингибирования стимулированного серотонином производства внутриклеточного цАМФ некоторыми соединениями общей формулы 1, свидетельствующие об их антагонистической активности, и значения IC50, подтверждающие их умеренную или высокую активность в условиях функционального эссея.
Пример 4. Определение активности антагонистов серотониновых 5-НТ6 рецепторов общей формулы 1 в условиях конкурентного связывания с серотониновыми 5-НТ6 рецепторами.
Для проведения скрининга веществ на их потенциальную способность взаимодействовать с серотониновым рецептором 5-НТ6 используют метод радиолигандного связывания. Для этого готовят мембранные препараты из клеток HeLa, экспрессирующих рекомбинантный человеческий 5-НТ6 рецептор, путем гомогенизирования рекомбинантных клеток в стеклянном гомогенизаторе с последующим отделением плазматических мембран от ядер, митохондрий и клеточных обломков путем дифференциального центрифугирования. Определение связывания изучаемых соединений с 5-НТ6 рецептором проводят в соответствии с методикой, описанной в Monsma FJ Jr, Shen Y, Ward RP, Hamblin MW and Sibley DR, Cloning and expression of a novel serotonin receptor with high affinity for tricyclic psychotropic drags. Mol. Pharmacol. 43:320-327, 1993. В предпочтительном исполнении мембранные препараты инкубируют с меченым лигандом (1.5 nM [3H] Lysergic acid diethylamide) без и в присутствии исследуемых соединений в течение 120 мин при 37°С в среде, состоящей из 50 mМ Tris-HCl, рН 7.4, 150 mМ NaCl, 2 mM Ascorbic Acid, 0.001% BSA. Образцы после инкубации фильтруют под вакуумом на стекломикроволоконных фильтрах G/F (Millipor, USA), фильтры трижды промывают холодным раствором среды и радиоактивность измеряют с помощью сцинтилляционного счетчика MicroBeta 340 (PerkinElmer, USA). Неспецифическое связывание, которое составляло 30% от общего связывания, определяют инкубацией мембранных препаратов с радиолигандом в присутствии 5 µМ Serotonin (5-HT). В качестве положительного контроля используют Methiothepin. Связывание тестируемых соединений с рецептором определяют по их способности вытеснять радиоактивный лиганд и выражают в процентах вытеснения. Процент вытеснения определяют по следующей формуле:
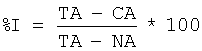 , ,
где ТА – это общая радиоактивность в присутствии только радиоактивного лиганда, СА – это радиоактивность в присутствии радиолиганда и тестируемого соединения и NA – это радиоактивность в присутствии радиолиганда и серотонина (5 µМ).
В таблице 4 и на фиг.1 в качестве одного из примеров представлены результаты испытаний 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидина 1.1.1(1) и Метиотепина как контроля, свидетельствующие о высокой активности (4.61 nМ) этого антагониста серотониновых 5-НТ6 рецепторов.
| Таблица 4. |
| Концентрационные зависимости ингибирования антагонистами общей формулы 1 серотониновых 5-НТ6 рецепторов и значения IC50 и Кi в условиях конкурентного эссея. |
| Соединение |
Концентрационные зависимости |
IС50, nМ |
Кi, nМ |
 Антагонист 1.1.1(1) Антагонист 1.1.1(1) |
См. фиг.1 |
0.511 |
0.237 |
 Контроль – Метиотепин Контроль – Метиотепин |
1.3 |
0.603 |
Пример 5. Получение лекарственного средства в форме таблеток. Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидина 1.1.1(1) и спрессовывают в брусок. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 560 мг каждая. Согласно изобретению аналогичным образом получают лекарственные средства, содержащие в качестве лекарственного начала другие соединения общей формулы 1.
Пример 6. Получение лекарственного средства в форме капсул. Тщательно смешивают 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(1) с порошком лактозы в соотношении 2:1. Полученную порошкоообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример 7. Получение лекарственного средства в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивают 500 мг 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидина 1.1.1(1) с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают.
Пример 8. Ноотропное действие (улучшение памяти, нарушенной скополамином) 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидина 1.1.1(1) в тесте «Пассивное избегание мышей в челночной камере». Использовалась челночная камера (Ugo Basile, Италия), которая состояла из двух отсеков. Все стенки одного из отсеков были непрозрачными, а второй отсек имел прозрачную крышку. Отсеки соединялись отверстием, которое могло закрываться вертикальной дверцей. Пол состоял из поперечных металлических прутьев, на которые могли подаваться импульсы постоянного тока. Эксперименты проведены на взрослых самцах мышей линии BALB/c весом 20-24 г.
В первый день опыта за 30 мин до обучения мышам внутрибрюшинно вводили физиологический раствор, скополамин (0,3 мг/кг) или скополамин в сочетании с 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидином 1.1.1(1). В каждой группе использовалось не менее 8 животных. Животных помещали в светлый отсек и регистрировали латентный период первого захода в темную камеру. При этом дверцу между отсеками закрывали, и животное в течение 3 с получало наказание током 0,6 мА. После этого животное возвращали в жилую клетку. Через 22-24 ч животное вновь помещали в светлый отсек челночной камеры и регистрировали латентный период первого захода в темный отсек, общее время пребывания в светлом отсеке и число заходов в темный отсек. Продолжительность наблюдения составляла 5 мин.
Эксперимент проводили в светлое время суток в изолированном лабораторном помещении с использованием “белого шума” интенсивностью около 70 дБ над порогом слышимости человека.
Скополамин вызывает нарушение обучения (памяти), которое выражается в виде увеличения латентного периода 1-го захода в темный отсек, увеличения времени пребывания в светлом отсеке и уменьшении числа заходов в темный отсек.
Способность 5,7-диметил-2-метиламино-3 -фенилсульфонил-пиразоло [1,5-а]пиримидина 1.1.1(1) улучшать обучение, нарушенное скополамином, рассматривается как свидетельство наличия у него ноотропного действия.
Полученные результаты, представленные на фиг.2, 3 и 4, свидетельствуют о способности 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидина 1.1.1(1) оказывать ноотропное действие.
Пример 9. Ноотропное действие (улучшение памяти, нарушенной МК-801) 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидина 1.1.1(1) в тесте «Пассивное избегание мышей в челночной камере». Эксперимент проводили, как в примере 8. В первый день опыта за 30 мин до обучения мышам внутрибрюшинно вводили физиологический раствор МК-801 (0.1 мг/кг). Параллельно независимым группам мышей до обучения внутрибрюшинно вводили физиологический раствор МК-801 в сочетании с 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидином 1.1.1(1).
Полученные результаты (фиг.5-7) свидетельствуют о способности 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидина 1.1.1(1) оказывать ноотропное действие.
Пример 10. Анксиолитическое (транквилизирующее) действие 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидина 1.1.1(1) в тесте «Поведение мышей в приподнятом крестообразном лабиринте». Длина рукавов лабиринта составляет 30 см, ширина 5 см, высота стенок 15 см. Два противоположных рукава закрыты с боков и торцов прозрачными стенками; два других – освещены и открыты. Мышь помещали в центр лабиринта, в течение 5 мин регистрировали число заходов в открытые и закрытые рукава и время, проведенное животными в открытых и закрытых рукавах. По этим данным вычисляли индексы предпочтения открытых рукавов как отношение числа заходов в открытые рукава, а также времени пребывания в открытых рукавах к общему числу заходов во все рукава и времени пребывания в них. В норме животные избегают открытых рукавов (индекс их предпочтения составляет 0,2-0,3). Вещества с анксиолитической активностью (транквилизирующей активностью) увеличивают этот показатель до 0,5-0,6 и более, а также уменьшают число дефекаций, не изменяя общую двигательную активность (общее число заходов в рукава).
Полученные результаты (фиг.8-10) свидетельствуют о том, что 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(1) проявляет анксиолитическую (транквилизирующую) активность, сравнимую с Буспироном и Лоразепамом.
Пример 11. Антидепрессивное действие 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидина 1.1.1(1) в тесте «Вынужденного плавания Порсолта у мышей».
Поведение «отчаяния» было предложено Порсолтом и др. (1977, 1978) в качестве модели депрессивно-подобного состояния, позволяющего тестировать антидепрессантную активность веществ. Для мышей или крыс, вынужденных плавать в ограниченном пространстве, из которого они не в состоянии выбраться, характерным является состояние неподвижности. Такое поведение является состоянием отчаяния, которое можно ослабить при помощи веществ, обладающих антидепрессивным типом действия у человека.
В эксперименте использовали самцов мышей линии BALB/c (20-30 г). Животное на 15 мин помещали в бассейн (высота 300 мм, диаметр 480 мм), на 70% заполненный водой с температурой ~25°С. По прошествии 3-5 мин активного плавания интенсивность движений начинает снижаться и сменяться фазами неподвижного плавания. Неподвижным животное считалось в том случае, если оно не производило ни одного движения в течение как минимум 1,5 с (этот параметр был использован при настройке программы ANY-maze ). Для анализа использовались экспериментальные данные, полученные в течение последних 5 мин теста. Результаты представлены на фиг.11. ). Для анализа использовались экспериментальные данные, полученные в течение последних 5 мин теста. Результаты представлены на фиг.11.
Полученные результаты (фиг.11) свидетельствуют о том, что 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(1), вводимый внутрибрюшинно ежедневно в течение 4 дней в дозе 0,2 мг/кг, проявляет высокую антидепрессантную активность, сравнимую с активностью Флуоксетина (Prozac) и Дезипрамина (Norpramin).
Формула изобретения
1. Антагонисты серотониновых 5-НТ6 рецепторов общей формулы 1 или их фармацевтически приемлемые соли и/или гидраты,

где Ar представляет собой арил, выбранный из необязательно замещенного фенила или необязательно замещенного 5-6-членного гетероарила, содержащего в качестве гетероатома атом азота или атом серы;
R1 представляет собой атом водорода, необязательно замещенный C1-C5алкил;
R2 1, R2 1, R2 2, R3 2, R3 1, R3 1, R3 2 независимо друг от друга представляют собой атом водорода или заместитель аминогруппы, выбранный из необязательного замещенного C1-C4алкила, необязательного замещенного фенила, или R3 2 независимо друг от друга представляют собой атом водорода или заместитель аминогруппы, выбранный из необязательного замещенного C1-C4алкила, необязательного замещенного фенила, или R3 1 и R3 1 и R3 2 вместе с атомом азота, с которым они связаны, образуют необязательного замещенный насыщенный 6-членный гетероциклил, возможно содержащий дополнительный атом азота в цикле; 2 вместе с атомом азота, с которым они связаны, образуют необязательного замещенный насыщенный 6-членный гетероциклил, возможно содержащий дополнительный атом азота в цикле;
или R1 вместе с атомом азота, с которым он связан, и R2 1 и R2 1 и R2 2 вместе с атомом азота, с которым они связаны, образуют замещенный пиримидиновый цикл. 2 вместе с атомом азота, с которым они связаны, образуют замещенный пиримидиновый цикл.
2. Антагонисты по п.1, представляющие собой замещенные 2-амино-3-сульфонил-пиразоло[1,5-а]пиримидины общей формулы 1.1 или их фармацевтически приемлемые соли и/или гидраты,

где Ar, R3 1 и R3 1 и R3 2 имеют вышеуказанное значение; R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил. 2 имеют вышеуказанное значение; R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил.
3. Антагонисты по п.2, представляющие собой замещенные 3-арилсульфонил-5,7-диметил-пиразоло[1,5-а]пиримидины общей формулы 1.1.1 или их фармацевтически приемлемые соли и/или гидраты,
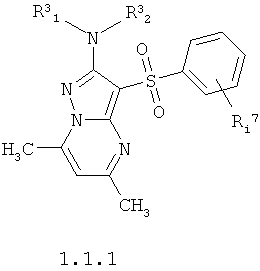
где R3 1 и R3 1 и R3 2 имеют вышеуказанное значение; Ri 2 имеют вышеуказанное значение; Ri 7 представляет собой один или два необязательно одинаковых заместителя циклической системы, выбранные из атома водорода, С1-С5 алкила, трифторметила или атома галогена. 7 представляет собой один или два необязательно одинаковых заместителя циклической системы, выбранные из атома водорода, С1-С5 алкила, трифторметила или атома галогена.
4. Антагонисты по п.3, представляющие собой 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(1), 5,7-диметил-2-диметиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(2), 5,7-диметил-2-метиламино-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(3), 5,7-диметил-2-диметиламино-3-(4-фторфенилсульфонил)-пиразоло [1,5-а]пиримидин 1.1.1(4), 5,7-диметил-2-метиламино-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(5), 5,7-диметил-2-диметиламино-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(6), 5,7-диметил-2-метиламино-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(7), 5,7-диметил-2-диметиламино-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(8) и их фармацевтически приемлемые соли и/или гидраты
5. Антагонист серотониновых 5-НТ6 рецепторов общей формулы 1 по любому из пп.1-4 в качестве лекарственного начала для получения фармацевтической композиции или лекарственной формы.
6. Фармацевтическая композиция, обладающая свойствами антагонистов серотониновых 5-НТ6 рецепторов, для лечения и предупреждения развития состояний и заболеваний центральной нервной системы, содержащая эффективное количество лекарственного начала по п.5.
7. Способ получения фармацевтической композиции по п.6 смешением с инертным наполнителем и/или растворителем, по крайней мере, одного лекарственного начала по п.5.
8. Лекарственное средство, обладающее свойствами антагонистов серотониновых 5-НТ6 рецепторов, предназначенное для лечения и предупреждения развития состояний и заболеваний центральной нервной системы, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, включающее лекарственное начало по п.5 или фармацевтическую композицию по п.6.
9. Способ профилактики и лечения заболеваний центральной нервной системы, патогенез которых связан с серотониновыми 5-НТ6 рецепторами, который заключается во введении лекарственного начала по п.5, или фармацевтической композиции по п.6, или лекарственного средства по п.8 в эффективном количестве.
10. Замещенные 2-амино-3-сульфонил-пиразоло[1,5-а]пиримидины общей формулы 1.1 или их фармацевтически приемлемые соли и/или гидраты,

где Ar, R3 1 и R3 1 и R3 2 имеют вышеуказанное значение; R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил. 2 имеют вышеуказанное значение; R4, R5 и R6 независимо друг от друга представляют собой атом водорода, необязательно замещенный C1-С3алкил или фенил.
11. Соединения по п.10, представляющие собой замещенные 3-арилсульфонил-5,7-диметил-пиразоло[1,5-а]пиримидины общей формулы 1.1.1 или их фармацевтически приемлемые соли и/или гидраты,

где R3 1 и R3 1 и R3 2 имеют вышеуказанное значение; R7 2 имеют вышеуказанное значение; R7 i представляет собой один или два необязательно одинаковых заместителя циклической системы, выбранные из атома водорода, С1-С5 алкила, трифторметила или атома галогена. i представляет собой один или два необязательно одинаковых заместителя циклической системы, выбранные из атома водорода, С1-С5 алкила, трифторметила или атома галогена.
12. Соединения по п.11, представляющие собой 5,7-диметил-2-метиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(1), 5,7-диметил-2-диметиламино-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(2), 5,7-диметил-2-метиламино-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(3), 5,7-диметил-2-диметиламино-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(4), 5,7-диметил-2-метиламино-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(5), 5,7-диметил-2-диметиламино-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(6), 5,7-диметил-2-метиламино-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(7), 5,7-диметил-2-диметиламино-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(8) и их фармацевтически приемлемые соли и/или гидраты
       
13. Способ получения замещенных 3-сульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1 по любому из п.10-12 взаимодействием 3,5-диамино-4-сульфонил-2Н-пиразолов общей формулы 1 с  -дикарбонильными соединениями общей формулы 4, -дикарбонильными соединениями общей формулы 4,
 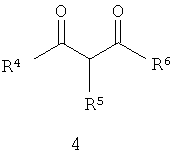
где Ar, R3 1, R3 1, R3 2, R4, R5 и R6 имеют вышеуказанное значение. 2, R4, R5 и R6 имеют вышеуказанное значение.
РИСУНКИ
|
|