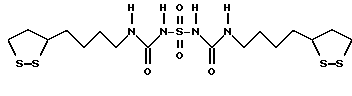Патент на изобретение №2165932
|
||||||||||||||||||||||||||
(54) ДИТИОЛАНОВЫЕ ПРОИЗВОДНЫЕ И ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ИХ ОСНОВЕ
(57) Реферат: Описываются новые дитиолановые производные общей формулы I 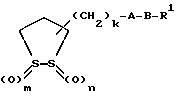 где один из m и n представляют собой 0, а другой представляет собой 0, 1 или 2, k представляет собой 0 или целое число от 1 до 12, R1 представляет собой атом водорода, один из заместителей  , определенных ниже, или необязательно замещенную алкильную группу, А представляет собой группу -CON(R2)SO2-, где R2 представляет собой атом водорода, алкил, аралкил, или один из заместителей , определенных ниже, или необязательно замещенную алкильную группу, А представляет собой группу -CON(R2)SO2-, где R2 представляет собой атом водорода, алкил, аралкил, или один из заместителей  , В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R6)N(R5)-, где R5 и R6 являются одинаковыми или отличными, и каждый из них представляет собой атом водорода, алкил, или R5 совместно с R1 и атомом азота, к которому они присоединены, могут образовывать гетероциклическое кольцо, содержащее в цикле от 5 до 7 атомов, или R1 может представлять собой группу формулы -OR7, где R7 представляет собой алкил, или один из заместителей , В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R6)N(R5)-, где R5 и R6 являются одинаковыми или отличными, и каждый из них представляет собой атом водорода, алкил, или R5 совместно с R1 и атомом азота, к которому они присоединены, могут образовывать гетероциклическое кольцо, содержащее в цикле от 5 до 7 атомов, или R1 может представлять собой группу формулы -OR7, где R7 представляет собой алкил, или один из заместителей  , и указанные заместители , и указанные заместители  , выбирают из арильных групп и гетероциклических групп, и их фармацевтически приемлемые соли. Соединения обладают отличной способностью увеличивать активность глутатионредуктазы и, таким образом, могут быть применены для лечения и предупреждения развития различных заболеваний, включая катаракту. 9 с. и 14 з.п.ф-лы, 5 табл. , выбирают из арильных групп и гетероциклических групп, и их фармацевтически приемлемые соли. Соединения обладают отличной способностью увеличивать активность глутатионредуктазы и, таким образом, могут быть применены для лечения и предупреждения развития различных заболеваний, включая катаракту. 9 с. и 14 з.п.ф-лы, 5 табл.
Изобретение относится к ряду новых дитиолановых производных, обладающих отличной способностью усиливать активность глутатионредуктазы. Изобретение также описывает способ получения данных соединений и способы, и композиции, в которых они применяются. Глутатион встречается во всех тканях живых организмов, является в клетках основным восстановителем и играет чрезвычайно важную роль в окислительно-восстановительных метаболических процессах. В частности, восстановленная форма глутатиона (GSH), благодаря наличию тиоловой группы, играет ключевую роль в различных клеточных защитных и репарационных механизмах. Глутатионпероксидаза катализирует реакции, вовлеченные в данные механизмы, и является важным ферментом в антиоксидантной системе, в которой пероксиды (например, пероксид водорода, пероксиды липидов и тому подобные) восстанавливаются GSH. С другой стороны, глутатионредуктаза представляет собой фермент, который восстанавливает окисленную форму глутатиона (глутатион окисленного типа: GSSG) в присутствии НАДФН с регенерацией GSH. Антиоксидантная система, включающая в себя данные вещества и ферменты, защищает клетки от вредного воздействия окислителей (например, описанных выше пероксидов, свободных радикалов и тому подобного). Оксидативный стресс возникает в случае, когда равновесие между окислителями и антиоксидантными механизмами сдвигается в сторону первых [J. Appl. Physiol. 1996 Nov., 81(5), 2199-2202] . Сообщалось, что оксидативный стресс связан с различными заболеваниями, такими как ишемическая болезнь сердца, катаракта, заболевания легких (например, идиопатический пневмосклероз, респираторный дистресс-синдром у взрослых, эмфизема, бронхиальная астма, бронхолегочная дисплазия и интерстициальный пневмосклероз), хроническая почечная недостаточность, заболевания нервной системы, включающей периферическую нервную систему и центральную нервную систему (например, болезнь Паркинсона, шизофрения, болезнь Альцгеймера, эпилепсия, боковой амиотрофический склероз и ишемия мозга), язвенная болезнь желудка, сахарный диабет, некроз и апоптоз гепатоцитов, включая этанол-индуцированную гепатопатию, вирусные инфекционные заболевания (включая грипп, гепатит В и ВИЧ-инфекцию) и злокачественные опухоли толстой и прямой кишок [J. Appl. Physiol. 1996 Nov., 81(5), 2199-2202; Free Radical Biology & Medicine, Vol. 21 N 6, 845-853 (1996); Free Radical Biology & Medicine, Vol. 20 N 7, 925-931 (1996); Gastroenterology, 112, 855-863 (1997); Free Radical Biology & Medicine, Vol. 34, 161-165 (1996); Lancet, 338, 215-216 (1991); Diabetologia, 39, 357-363 (1996); Eur. J. Cancer., 1996 Jan. , 32A(1), 30-38; Am. J. Med., 1991 Sep. 30. 91(3c), 95s-105s; Alcohol. Clin. Exp. Res. , 1996 Dec., 20(9 Suppl.), 340A-346A; Free Radical Biology & Medicine, Vol. 21 N 5, 641-649 (1996); Pharmacol. Toxicol., 1997 Apr., 80(4), 159-166; Cell. Mol. Biol. (Noisy-le-grand) 1996 Feb., 42(1), 17-26; Prostaglandins. Leukot. Essent. Fatty Acids, 1996 Aug., 55(1-2), 33-43; FASEB J., 1995 Sep., 9(12), 1173-1182]. В добавление к вышесказанному, считается, что оксидативный стресс является фактором в развитии синдрома Дауна, нефрита, панкреатита, дерматита, синдрома утомления, ревматизма, различных пороков развития (например, миопатии Дюшенна, облитерирующей кардиомиопатии, синдрома Дубина-Джонсона, примахиновой анемии и тому подобного), синдрома Фанкони, малигнизации и метастазирования, септицемии, повышенной проницаемости кровеносных сосудов, адгезии лейкоцитов, ретролетальной фиброплазии, сидероза, токсических эффектов лекарственных препаратов (например, карциностатических средств, включая хелатные комплексы платины, антибиотиков, антипаразитарных средств, paraquat, четыреххлористого углерода и галотана) и лучевых поражений [Yoshihiko Oyanagi, Superoxide Dismutase and agents controlling active oxygen species]. В W0 94/12527 описывается, что соединения, которые способствуют синтезу эндогенного GSH, могут применяться для лечения людей, в частности для лечения различных заболеваний, вызванных недостаточностью глутатиона, таких как патологических состояний, связанных с окислительным повреждением тканей, в особенности, вызванных избытком свободных радикалов. Некоторые примеры таких заболеваний представляют собой нарушения равновесия степени окисления в клетке вследствие злоупотребления алкоголем, воздействия ксенобиотиков, лучевого поражения, заболеваний печени, интоксикации лекарственными средствами и химическими агентами, отравления тяжелыми металлами, физиологического старения головного мозга (например, болезнь Паркинсона), дегенерации головного мозга из-за пониженного содержания глутатиона, вызванной изменением антиоксидантных защитных механизмов, такие как острые и хронические нейродегенеративные заболевания (например, острые патологические состояния, такие как острые ишемические состояния, в особенности, инфаркт головного мозга, гипогликемия и эпилептические припадки; хронические патологические состояния, такие как боковой амиотрофический склероз, болезнь Альцгеймера, хорея Гентингтона), заболевания, связанные с изменением функционирования иммунной системы, в особенности, возникшим в результате иммунотерапии опухоли, и бесплодие, в частности бесплодие у мужчин. Также описывается, что соединения могут быть применены для восстановления кровоснабжения органа после возникновения ишемического состояния, главным образом, связанного с повышенным содержанием свободных радикалов. Кроме того, в публикации патента Японии Kokai Showa 64-26516 описывается, что соединение, которое повышает содержание глутатиона, может быть применено для лечения и предотвращения различных заболеваний, включая катаракту, заболевания печени, нефриты. В настоящее время известно, что липоевая кислота (тиоктовая кислота), в молекуле которой содержится дитиолановое кольцо, влияет на биосинтез и регенерацию восстановленной формы глутатиона [I. Maitra et al. Free Radical Biology & Medicine, Vol. 18 N 4, 823-829 (1995)]. В данном литературном источнике сообщается, что общее содержание глутатиона (окисленной и восстановленной форм глутатиона) снижается при введении бутионинсульфоксимина (БСО), который является ингибитором глютатионсинтетазы, новорожденным крысам, причем снижение предупреждается введением совместно с БСО липоевой кислоты и что подавляется развитие катаракты. В дополнение к этому, в литературе описывается тестирование эффектов на глутатионредуктазу, полученных при введении одного лишь БСО или при совместном введении БСО и липоевой кислоты. Принимая во внимание данные результаты, можно прийти к пониманию того, что активность глутатионредуктазы не изменяется, когда БСО вводится непосредственно сам по себе, и того, что активность глутатионредуктазы также не повышается, когда в дополнение к БСО вводят липоевую кислоту. Таким образом, из литературных источников может быть сделан вывод о том, что общее содержание глутатиона повышается и что данные заболевания могут подвергаться лечению путем введения липоевой кислоты пациенту, который страдает заболеванием, вызванным недостаточностью синтеза глутатиона, но считается, что липоевая кислота не способна оказывать достаточного эффекта на заболевания, которые развиваются несмотря на достаточный уровень синтеза глутатиона, поскольку ясно, что она не повышает активность глутатионредуктазы. И наоборот, если может быть повышена активность глутатионредуктазы, то независимо от того, является ли или не является адекватным уровень синтеза глутатиона, заболевания, которые развиваются несмотря на достаточный уровень синтеза глутатиона и которые вызваны оксидативным стрессом, могут предупреждаться или подвергаться лечению, поскольку приток восстановленной формы глутатиона является повышенным. Кроме того, вообще, в случае глазных болезней, таких как катаракта, местное нанесение на глаз является предпочтительным по сравнению с пероральным применением. Однако, поскольку липоевая кислота является мощным раздражителем, наносить ее на глаз не представляется возможным. Мы открыли ряд дитиолановых производных, которые обладают способностью вызывать значительное повышение активности глутатионредуктазы и которые также устраняют пероксиды. Более того, соединения по настоящему изобретению оказывают меньший раздражающий эффект на глаза, нежели липоевая кислота, и сходные известные соединения являются, таким образом, особенно применимыми для местного применения. Во избежание сомнений, соединения по настоящему изобретению названы в соответствии с Правилами IUPAC с использованием в качестве материнского соединения липоевую кислоту (также известную как тиоктовая кислота). Данное соединение имеет формулу  Объектом настоящего изобретения является предоставление ряда новых дитиолановых производных. Дальнейшим и более специфичным объектом настоящего изобретения является предоставление таких соединений, которые повышают активность глутатионредуктазы. Краткое описание изобретения Соединения по настоящему изобретению представляют собой соединения формулы (I) 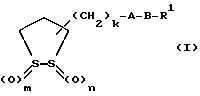 где один из m и n представляет собой 0, а другой представляет собой 0, 1 или 2; k представляет собой 0 или целое число от 1 до 12; R1 представляет собой: атом водорода, группу, выбранную из заместителей  , определенных ниже, или , определенных ниже, илиалкильную группу, содержащую от 1 до 12 атомов углерода, которая является незамещенной или является замещенной заместителями в количестве от 1 до 3, выбранными из группы, содержащей заместители  и заместители и заместители  , или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы; , или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы;A представляет собой одинарную связь, атом кислорода, карбонильную группу или группу формулы: -N(R2)CO-, -N(R2)CS-, -N-(R2)SO2, -CON(R2)N(R3)CO-, -CON(R2)CO-, -CON(R2)CS-, -CON(R2)SO2-, -O-CO-, -ON(R2)CO-, – ON(R2)SO2-, -O-CON(R2)N(R3)CO-, -O-CON(R2)CO-, -O-CON(R2)SO2-, -CO-O-, -CO-CO-, -CO-CON(R2)N(R3)CO-, -CO-CON(R2)CO-, -CO-CON(R2)SO2-, -N(R2)O-, -N(R2)COCO-, -N(R2)N(R3)CO-, – N(R2)N(R3)SO2-, -N(R2)CON(R3)N(R4)CO-, -N(R2)CON(R3)CO-, – N(R2)CON(R3)SO2– или -N(R2)CON(R3)SO2N(R4)CO- где R2, R3 и R4 являются одинаковыми или отличными, и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до 12 атомов углерода, аралкильную группу, аралкильную группу, арильный радикал которой замещен группами в количестве от 1 до 3, выбранных из группы, содержащей заместители  , ацильную группу или группу, выбранную из группы, содержащей заместители , ацильную группу или группу, выбранную из группы, содержащей заместители  ; ;В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R6)N(R5)-, где R5 и R6 являются одинаковыми или отличными, и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до 12 атомов углерода, аралкильную группу, аралкильную группу, арильный радикал которой замещен группами в количестве от 1 до 3, выбранных из группы, содержащей заместители  , ацильную группу или группу, выбранную из группы, содержащей заместители , ацильную группу или группу, выбранную из группы, содержащей заместители  , или R5, совместно с R1 и атомом азота, к которому они присоединены, могут образовывать гетероциклическое кольцо, содержащее в цикле от 5 до 7 атомов; , или R5, совместно с R1 и атомом азота, к которому они присоединены, могут образовывать гетероциклическое кольцо, содержащее в цикле от 5 до 7 атомов;или где A представляет собой группу формулы N(R2)CO-, -N(R2)CS-, -CON(R2)N(R3)CO-, -CON(R2)CO-, -CON(R2)CS-, – O-CO-, -ON(R2)CO-, -O-CON(R2)N(R3)CO-, -O-CON(R2)CO-, -CO-CON(R2)N(R3)CO-, -CO-CON(R2)CO-, -N(R2)N(R3)CO-, -N(R2)CON(R3)N(R4)CO- или -N(R2)CON(R3)CO- [где R2, R3 и R4 определены выше], и В представляет собой одинарную связь, R1 может представлять собой группу формулы -OR7 (где R7 представляет собой низшую алкильную группу, низшую алкенильную группу, аралкильную группу, аралкильную группу, арильный радикал которой замещен группами в количестве от 1 до 3, выбранных из группы, содержащей заместители  , или группу, выбранную из группы, содержащей заместители , или группу, выбранную из группы, содержащей заместители  ); );или, где A представляет собой группу формулы CON(R2)SO2-, -ON(R2)SO2-, -O-CON(R2)SO2-, -CO-CO-, -CO-CON(R2)SO2, -N(R2)COCO-, -N(R2)N(R3)SO2 или -N(R2)CON(R3)SO2– [где R2 и R3 определены выше], и В представляет собой одинарную связь, или где A не представляет собой атом кислорода, группу формулы -CO-O- или -N(R6)O-, и В представляет собой -N(R5)- [где R5 определен выше], R1 может представлять собой гидроксигруппу или группу формулы -OR7 (где R7 определен выше); заместители  выбирают из группы, содержащей арильные группы, гетероциклические группы, арильные группы, замещенные заместителями выбирают из группы, содержащей арильные группы, гетероциклические группы, арильные группы, замещенные заместителями  в количестве от 1 до 3, и гетероциклические группы, замещенные заместителями в количестве от 1 до 3, и гетероциклические группы, замещенные заместителями  в количестве от 1 до 3; в количестве от 1 до 3;заместители  выбирают из группы, содержащей низшие алкильные группы, галогенированные низшие алкильные группы, низшие алкоксигруппы, низшие алкилтиогруппы, гидроксигруппы, карбоксильные группы, карбамоильные группы, атом азота которых может быть замещен, низшие алкоксикарбонильные группы, атомы галогенов, нитрогруппы, аминные остатки, сульфогруппы, сульфамоильные группы, цианогруппы, гидроксизамещенные низшие алкильные группы; выбирают из группы, содержащей низшие алкильные группы, галогенированные низшие алкильные группы, низшие алкоксигруппы, низшие алкилтиогруппы, гидроксигруппы, карбоксильные группы, карбамоильные группы, атом азота которых может быть замещен, низшие алкоксикарбонильные группы, атомы галогенов, нитрогруппы, аминные остатки, сульфогруппы, сульфамоильные группы, цианогруппы, гидроксизамещенные низшие алкильные группы;заместители  выбирают из группы, содержащей низшие алкоксигруппы, низшие алкилтиогруппы, гидроксигруппы, нитрооксигруппы, карбоксильные группы, низшие алкоксикарбонильные группы, атомы галогенов, сульфогруппы, сульфамоильные группы, аминные остатки, карбамоильные группы, атом азота которых может быть замещен; выбирают из группы, содержащей низшие алкоксигруппы, низшие алкилтиогруппы, гидроксигруппы, нитрооксигруппы, карбоксильные группы, низшие алкоксикарбонильные группы, атомы галогенов, сульфогруппы, сульфамоильные группы, аминные остатки, карбамоильные группы, атом азота которых может быть замещен;при условии, если A представляет атом кислорода, В представляет собой одинарную связь или группу формулы -N(R5)- [где R5 определен выше], если A представляет собой группу формулы -CO-O- или -N(R2)O- [где R2 определен выше], В представляет собой одинарную связь, если k представляет собой 4, группа формулы -A-B-R1 не является карбоксильной группой, и их фармацевтически приемлемые соли. Настоящее изобретение также обеспечивает способ повышения активности глутатионредуктазы у млекопитающего, которое может представлять собой человека, путем введения указанному млекопитающему эффективного количества соединений формулы (I) или их фармацевтически приемлемых солей. Настоящее изобретение также обеспечивает способ лечения или предупреждения катаракты у млекопитающего, которое может представлять собой человека, путем введения указанному млекопитающему эффективного количества соединений формулы (I) или их фармацевтически приемлемых солей. Подробное описание изобретения В соединениях по настоящему изобретению один из m и n представляет собой 0, а другой представляет собой 0, 1 или 2. Предпочтительно либо как m, так и n представляют собой 0, либо один из m и n представляет собой 0, а другой представляет собой 1. Более предпочтительно как m, так и n представляют собой 0. Авторы настоящей заявки считают предпочтительными такие соединения формулы (I), где k представляет собой 0 или целое число от 1 до 6, более предпочтительно целое число от 2 до 6 и наиболее предпочтительно целое число от 4 до 6. Если R1 или заместитель  представляют собой арильную группу, она является карбоциклической ароматической углеводородной группой, содержащей в цикле от 6 до 14 атомов углерода в одном или нескольких ароматических карбоциклических кольцах, или представляет собой группу, конденсированную с циклоалкильной группой, содержащей в цикле от 3 до 10 атомов углерода. Примеры карбоциклических углеводородных групп, содержащих в цикле от 6 до 14 атомов углерода в одном или нескольких ароматических карбоциклических кольцах, включают фенильную, нафтильную (1- или 2-нафтильную), фенантренильную и антраценильную группы. Примером группы, в которой ароматическое карбоциклическое кольцо конденсировано с циклоалкильной группой, является 2-инданильная группа.
Если R1 или заместитель представляют собой арильную группу, она является карбоциклической ароматической углеводородной группой, содержащей в цикле от 6 до 14 атомов углерода в одном или нескольких ароматических карбоциклических кольцах, или представляет собой группу, конденсированную с циклоалкильной группой, содержащей в цикле от 3 до 10 атомов углерода. Примеры карбоциклических углеводородных групп, содержащих в цикле от 6 до 14 атомов углерода в одном или нескольких ароматических карбоциклических кольцах, включают фенильную, нафтильную (1- или 2-нафтильную), фенантренильную и антраценильную группы. Примером группы, в которой ароматическое карбоциклическое кольцо конденсировано с циклоалкильной группой, является 2-инданильная группа.
Если R1 или заместитель  представляют собой гетероциклическую группу, она содержит в цикле от 5 до 7 атомов, из которых от 1 до 3 представляют собой гетероатомы, выбранные из группы, содержащей гетероатомы серы, кислорода и азота. Группа может быть насыщенной или она может быть ненасыщенной и предпочтительно ароматической.
Если указанные в описании гетероциклические группы содержат 3 гетероатома, авторы заявки считают предпочтительным, чтобы все три, два или один из данных атомов представляли собой атомы азота, и соответственно ни один, один или два из них представляли собой атомы серы и/или кислорода.
Примеры таких насыщенных гетероциклических групп включают, например, пирролидинильную, имидазолидинильную, пиразолидинильную, оксазолидинильную, изоксазолидинильную, тиазолидинильную, изотиазолидинильную, дитиоланильную, тиадиазолидинильную, оксадиазолидинильную, дитиазолидинильную, пиперидильную, пиперазинильную, морфолинильную, тиоморфолинильную, диоксанильную и гомопиперазинильную группы. Из данных групп авторы настоящей заявки считают особенно предпочтительными такие 5-7-членные насыщенные гетероциклические группы, которые содержат один или два атома азота или содержат один атом азота и один атом серы или один атом кислорода, такие как пирролидинильная, тиазолидинильная, имидазолидинильная, пиперидильная, морфолинильная, тиоморфолинильная и пиперазинильная группы. При желании, описанные выше насыщенные гетероциклические группы могут быть замещены одним или двумя атомами, выбранными из группы, содержащей атомы серы и атомы кислорода, с образованием оксогруппы и/или тиоксогруппы. Примеры таких групп включают пиперидонильную, пирролидонильную, тиазолидонильную, диоксотиазолидинильную, тиоксодитиазолидинильную, диоксоимидазолидинильную и диоксооксазолидинильную группы.
Также, при желании, описанная выше насыщенная гетероциклическая группа может быть конденсирована с другой циклической группой, предпочтительно содержащей в цикле 3, 4, 5 или 6 атомов и которая может являться карбоциклической или гетероциклической, более предпочтительно бензольным кольцом. Примеры таких конденсированных кольцевых групп включают бензодиоксанильную, индолинильную, изоиндолинильную, бензооксазинильную, бензотиазолидинильную, бензотиазинильную, хроманильную, 6-ацетокси-2,5,7,8-тетраметилхроман-2-ильную и изоиндол-1,3-дион-2-ильную группы.
Примеры таких ароматических гетероциклических групп включают фурильную, тиенильную, пирролильную, азепинильную, пиразолильную, имидазолильную, оксазолильную, изоксазолильную, тиазолильную, изотиазолильную, оксадиазолильную, триазолильную, тетразолильную, тиадиазолильную, пиранильную, пиридильную, пиридазинильную, пиримидинильную и пиразинильную группы. Из них предпочтительными являются такие 5-7-членные ароматические гетероциклические группы, которые содержат по крайней мере один атом азота и могут содержать атом кислорода или атом серы. Примеры таких групп включают пирролильную, азепинильную, пиразолильную, имидазолильную, оксазолильную, изоксазолильную, тиазолильную, изотиазолильную, оксадиазолильную, триазолильную, тетразолильную, тиадиазолильную, пиридильную, пиридазинильную, пиримидинильную и пиразинильную группы. Предпочтительными являются пиридильная, имидазолильная, оксазолильная, пиразинильная и тиазолильная группы.
Также, при желании, описанная выше ароматическая гетероциклическая группа может быть конденсирована с другой циклической группой, предпочтительно содержащей в цикле 3, 4, 5 или 6 атомов и которая может являться карбоциклической или гетероциклической, более предпочтительно бензольным кольцом. Примеры таких конденсированных кольцевых групп включают индолильную, бензофурильную, бензотиенильную, бензооксазолильную, бензоимидазолильную, хинолильную, изохинолильную, хиноксалильную группы.
Также описанные выше ароматические гетероциклические группы могут быть замещены одним или двумя атомами, выбранными из группы, содержащей атомы серы и атомы кислорода, с образованием оксогруппы и/или тиоксогруппы, и примеры таких групп включают пиридонильные, оксазолонильные, пиразолонильные, изоксазолонильные и тиоксодитиазолильные группы.
При желании, любая из указанных выше арильных и гетероциклических групп может быть замещена одним или несколькими, предпочтительно от 1 до 3, заместителями, выбранными из группы, содержащей заместители представляют собой гетероциклическую группу, она содержит в цикле от 5 до 7 атомов, из которых от 1 до 3 представляют собой гетероатомы, выбранные из группы, содержащей гетероатомы серы, кислорода и азота. Группа может быть насыщенной или она может быть ненасыщенной и предпочтительно ароматической.
Если указанные в описании гетероциклические группы содержат 3 гетероатома, авторы заявки считают предпочтительным, чтобы все три, два или один из данных атомов представляли собой атомы азота, и соответственно ни один, один или два из них представляли собой атомы серы и/или кислорода.
Примеры таких насыщенных гетероциклических групп включают, например, пирролидинильную, имидазолидинильную, пиразолидинильную, оксазолидинильную, изоксазолидинильную, тиазолидинильную, изотиазолидинильную, дитиоланильную, тиадиазолидинильную, оксадиазолидинильную, дитиазолидинильную, пиперидильную, пиперазинильную, морфолинильную, тиоморфолинильную, диоксанильную и гомопиперазинильную группы. Из данных групп авторы настоящей заявки считают особенно предпочтительными такие 5-7-членные насыщенные гетероциклические группы, которые содержат один или два атома азота или содержат один атом азота и один атом серы или один атом кислорода, такие как пирролидинильная, тиазолидинильная, имидазолидинильная, пиперидильная, морфолинильная, тиоморфолинильная и пиперазинильная группы. При желании, описанные выше насыщенные гетероциклические группы могут быть замещены одним или двумя атомами, выбранными из группы, содержащей атомы серы и атомы кислорода, с образованием оксогруппы и/или тиоксогруппы. Примеры таких групп включают пиперидонильную, пирролидонильную, тиазолидонильную, диоксотиазолидинильную, тиоксодитиазолидинильную, диоксоимидазолидинильную и диоксооксазолидинильную группы.
Также, при желании, описанная выше насыщенная гетероциклическая группа может быть конденсирована с другой циклической группой, предпочтительно содержащей в цикле 3, 4, 5 или 6 атомов и которая может являться карбоциклической или гетероциклической, более предпочтительно бензольным кольцом. Примеры таких конденсированных кольцевых групп включают бензодиоксанильную, индолинильную, изоиндолинильную, бензооксазинильную, бензотиазолидинильную, бензотиазинильную, хроманильную, 6-ацетокси-2,5,7,8-тетраметилхроман-2-ильную и изоиндол-1,3-дион-2-ильную группы.
Примеры таких ароматических гетероциклических групп включают фурильную, тиенильную, пирролильную, азепинильную, пиразолильную, имидазолильную, оксазолильную, изоксазолильную, тиазолильную, изотиазолильную, оксадиазолильную, триазолильную, тетразолильную, тиадиазолильную, пиранильную, пиридильную, пиридазинильную, пиримидинильную и пиразинильную группы. Из них предпочтительными являются такие 5-7-членные ароматические гетероциклические группы, которые содержат по крайней мере один атом азота и могут содержать атом кислорода или атом серы. Примеры таких групп включают пирролильную, азепинильную, пиразолильную, имидазолильную, оксазолильную, изоксазолильную, тиазолильную, изотиазолильную, оксадиазолильную, триазолильную, тетразолильную, тиадиазолильную, пиридильную, пиридазинильную, пиримидинильную и пиразинильную группы. Предпочтительными являются пиридильная, имидазолильная, оксазолильная, пиразинильная и тиазолильная группы.
Также, при желании, описанная выше ароматическая гетероциклическая группа может быть конденсирована с другой циклической группой, предпочтительно содержащей в цикле 3, 4, 5 или 6 атомов и которая может являться карбоциклической или гетероциклической, более предпочтительно бензольным кольцом. Примеры таких конденсированных кольцевых групп включают индолильную, бензофурильную, бензотиенильную, бензооксазолильную, бензоимидазолильную, хинолильную, изохинолильную, хиноксалильную группы.
Также описанные выше ароматические гетероциклические группы могут быть замещены одним или двумя атомами, выбранными из группы, содержащей атомы серы и атомы кислорода, с образованием оксогруппы и/или тиоксогруппы, и примеры таких групп включают пиридонильные, оксазолонильные, пиразолонильные, изоксазолонильные и тиоксодитиазолильные группы.
При желании, любая из указанных выше арильных и гетероциклических групп может быть замещена одним или несколькими, предпочтительно от 1 до 3, заместителями, выбранными из группы, содержащей заместители  , определенные выше и иллюстрируемые примерами ниже.
Если R1 представляет собой алкильную группу, содержащую от 1 до 12 атомов углерода, она может представлять собой группу с прямой или разветвленной цепью, которая может являться незамещенной или может являться замещенной заместителями в количестве от 1 до 3, выбранными из группы, содержащей заместители , определенные выше и иллюстрируемые примерами ниже.
Если R1 представляет собой алкильную группу, содержащую от 1 до 12 атомов углерода, она может представлять собой группу с прямой или разветвленной цепью, которая может являться незамещенной или может являться замещенной заместителями в количестве от 1 до 3, выбранными из группы, содержащей заместители  , определенные выше и приведенные в пример ниже. Примеры таких незамещенных алкильных групп включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную, 2-пентильную, 3-пентильную, 2-метилбутильную, 3-метилбутильную, 1,1-диметилпропильную, 1,2-диметилпропильную, 2,2-диметилпропильную, гексильную, 2-гексильную, 3-гексильную, 2-метилпентильную, 3-метилпентильную, 4-метилпентильную, 1,1-диметилбутильную, 1,2-диметилбутильную, 1,3-диметилбутильную, 2,2-диметилбутильную, 2,3-диметилбутильную, 3,3-диметилбутильную, 1,1,2-триметилпропильную, 1,2,2-триметилпропильную, гептильную, 2-гептильную, 3-гептильную, 4-гептильную, 3,3-диметилпентильную, октильную, 2-метилгептильную, 2-этилгексильную, 1,1,3,3-тетраметилбутильную, нонильную, 2- нонильную, 3-нонильную, 4-нонильную, 5-нонильную, 2-метилоктильную, 3-метилоктильную, 4-метилоктильную, 5-метилоктильную, 6-метилоктильную, 7-метилоктильную, 8-метилоктильную, 6,6-диметилгептильную, децильную, 2-децильную, 3-децильную, 4-децильную, 5-децильную, 2-метилнонильную, 3-метилнонильную, 4-метилнонильную, 6,6-диметилоктильную, ундецильную, 2-ундецильную, 3-ундецильную, 4-ундецильную, 5-ундецильную, 6-ундецильную, 2-метилдецильную, 3-метилдецильную, 4-метилдецильную, 5-метилдецильную, 6-метилдецильную, 7-метилдецильную, 8-метилдецильную, 9-метилдецильную, 7-этилнонильную, додецильную, 2-додецильную, 3-додецильную, 4-додецильную, 5-додецильную, 6-додецильную, 2-метилундецильную, 3-метилундецильную, 4-метилундецильную, 5-метилундецильную, 6-метилундецильную, 7-метилундецильную, 8-метилундецильную, 9-метилундецильную и 10-метилундецильную группы. Из них предпочтительными являются неразветвленные или разветвленные алкильные группы, содержащие от 1 до 6 атомов углерода, более предпочтительными являются неразветвленные или разветвленные алкильные группы, содержащие от 1 до 4 атомов углерода, а наиболее предпочтительными являются метильная, этильная, пропильная, изопропильная, бутильная, изобутильная и трет-бутильная группы.
Альтернативно, R1 может представлять собой такую алкильную группу, в которой углеродная цепь прерывается одним или несколькими атомами кислорода и/или атомами серы. Примеры таких групп включают любые из указанных выше алкильных групп, которые замещены одной алкокси или алкилтиогруппой, которая, в свою очередь, может быть далее замещена алкокси или алкилтиогруппой, причем алкокси или алкилтиогруппы являются такими, как приведены в примерах ниже в отношении к заместителям , определенные выше и приведенные в пример ниже. Примеры таких незамещенных алкильных групп включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную, 2-пентильную, 3-пентильную, 2-метилбутильную, 3-метилбутильную, 1,1-диметилпропильную, 1,2-диметилпропильную, 2,2-диметилпропильную, гексильную, 2-гексильную, 3-гексильную, 2-метилпентильную, 3-метилпентильную, 4-метилпентильную, 1,1-диметилбутильную, 1,2-диметилбутильную, 1,3-диметилбутильную, 2,2-диметилбутильную, 2,3-диметилбутильную, 3,3-диметилбутильную, 1,1,2-триметилпропильную, 1,2,2-триметилпропильную, гептильную, 2-гептильную, 3-гептильную, 4-гептильную, 3,3-диметилпентильную, октильную, 2-метилгептильную, 2-этилгексильную, 1,1,3,3-тетраметилбутильную, нонильную, 2- нонильную, 3-нонильную, 4-нонильную, 5-нонильную, 2-метилоктильную, 3-метилоктильную, 4-метилоктильную, 5-метилоктильную, 6-метилоктильную, 7-метилоктильную, 8-метилоктильную, 6,6-диметилгептильную, децильную, 2-децильную, 3-децильную, 4-децильную, 5-децильную, 2-метилнонильную, 3-метилнонильную, 4-метилнонильную, 6,6-диметилоктильную, ундецильную, 2-ундецильную, 3-ундецильную, 4-ундецильную, 5-ундецильную, 6-ундецильную, 2-метилдецильную, 3-метилдецильную, 4-метилдецильную, 5-метилдецильную, 6-метилдецильную, 7-метилдецильную, 8-метилдецильную, 9-метилдецильную, 7-этилнонильную, додецильную, 2-додецильную, 3-додецильную, 4-додецильную, 5-додецильную, 6-додецильную, 2-метилундецильную, 3-метилундецильную, 4-метилундецильную, 5-метилундецильную, 6-метилундецильную, 7-метилундецильную, 8-метилундецильную, 9-метилундецильную и 10-метилундецильную группы. Из них предпочтительными являются неразветвленные или разветвленные алкильные группы, содержащие от 1 до 6 атомов углерода, более предпочтительными являются неразветвленные или разветвленные алкильные группы, содержащие от 1 до 4 атомов углерода, а наиболее предпочтительными являются метильная, этильная, пропильная, изопропильная, бутильная, изобутильная и трет-бутильная группы.
Альтернативно, R1 может представлять собой такую алкильную группу, в которой углеродная цепь прерывается одним или несколькими атомами кислорода и/или атомами серы. Примеры таких групп включают любые из указанных выше алкильных групп, которые замещены одной алкокси или алкилтиогруппой, которая, в свою очередь, может быть далее замещена алкокси или алкилтиогруппой, причем алкокси или алкилтиогруппы являются такими, как приведены в примерах ниже в отношении к заместителям  и и  . Характерные примеры таких групп включают алкоксиалкильные группы, содержащие от 2 до 10 атомов углерода, алкилтиоалкильные группы, содержащие от 2 до 10 атомов углерода, бензилоксиалкильные группы, алкильная часть которых содержит от 1 до 5 атомов углерода, и бензилтиоалкильные группы, алкильная часть которых содержит от 1 до 5 атомов углерода (бензильная часть бензилоксиалкильных и бензилтиоалкильных групп может являться незамещенной или замещенной заместителями в количестве от 1 до 3, выбранными из группы, содержащей заместители . Характерные примеры таких групп включают алкоксиалкильные группы, содержащие от 2 до 10 атомов углерода, алкилтиоалкильные группы, содержащие от 2 до 10 атомов углерода, бензилоксиалкильные группы, алкильная часть которых содержит от 1 до 5 атомов углерода, и бензилтиоалкильные группы, алкильная часть которых содержит от 1 до 5 атомов углерода (бензильная часть бензилоксиалкильных и бензилтиоалкильных групп может являться незамещенной или замещенной заместителями в количестве от 1 до 3, выбранными из группы, содержащей заместители  ). Из них предпочтительными являются метоксиметильная, метоксиэтильная, этоксиметильная, метилтиометильная, метилтиоэтильная, этилтиометильная, бензилоксиметилвная, бензилоксиэтильная, бензилтиометильная и 4-метоксибензилтиометильная группы.
Если R2, R3, R4, R5 или R6 представляет собой алкильную группу, содержащую от 1 до 12 атомов углерода, она может представлять собой группу с неразветвленной или разветвленной цепью, что определено и приведено в примере выше в отношении R1.
Если R2, R3, R4, R5 или R6 представляет собой аралкильную группу, то она представляет собой низшую алкильную группу (предпочтительно содержащую от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода, еще более предпочтительно от 1 до 3 атомов углерода и наиболее предпочтительно от 1 до 2 атомов углерода), которая замещена от 1 до 3 арильных групп, как определено и приведено в примере выше в отношении R1. Характерные примеры таких аралкильных групп включают бензильную, 1-фенилэтильную, 2-фенилэтильную, ). Из них предпочтительными являются метоксиметильная, метоксиэтильная, этоксиметильная, метилтиометильная, метилтиоэтильная, этилтиометильная, бензилоксиметилвная, бензилоксиэтильная, бензилтиометильная и 4-метоксибензилтиометильная группы.
Если R2, R3, R4, R5 или R6 представляет собой алкильную группу, содержащую от 1 до 12 атомов углерода, она может представлять собой группу с неразветвленной или разветвленной цепью, что определено и приведено в примере выше в отношении R1.
Если R2, R3, R4, R5 или R6 представляет собой аралкильную группу, то она представляет собой низшую алкильную группу (предпочтительно содержащую от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода, еще более предпочтительно от 1 до 3 атомов углерода и наиболее предпочтительно от 1 до 2 атомов углерода), которая замещена от 1 до 3 арильных групп, как определено и приведено в примере выше в отношении R1. Характерные примеры таких аралкильных групп включают бензильную, 1-фенилэтильную, 2-фенилэтильную,  -нафтилметильную, -нафтилметильную,  -нафтилметильную, дифенилметильную, трифенилметильную, -нафтилметильную, дифенилметильную, трифенилметильную,  -нафтилдифенилметильную и 9-антрилметильную группы. Из них предпочтительными являются бензильная, 1-фенилэтильная и 2-фенилэтильная группы. Любая из указанных выше групп может быть незамещенной, или она может быть замещена заместителями в количестве от 1 до 3, выбранными из группы, содержащей заместители -нафтилдифенилметильную и 9-антрилметильную группы. Из них предпочтительными являются бензильная, 1-фенилэтильная и 2-фенилэтильная группы. Любая из указанных выше групп может быть незамещенной, или она может быть замещена заместителями в количестве от 1 до 3, выбранными из группы, содержащей заместители  , определенные и приведенные в примере ниже.
Если R2, R3, R4, R5 или R6 представляет собой ацильную группу, она может представлять собой алифатическую, ароматическую или гетероциклическую ацильную группу, например: , определенные и приведенные в примере ниже.
Если R2, R3, R4, R5 или R6 представляет собой ацильную группу, она может представлять собой алифатическую, ароматическую или гетероциклическую ацильную группу, например:алкилкарбонильную группу, содержащую от 1 до 30, предпочтительно от 1 до 21 и более предпочтительно от 1 до 8 атомов углерода, такую как формильную, ацетильную, пропионильную, бутирильную, изобутирильную, пивалоильную, валерильную, изовалерильную, октаноильную, нонилкарбонильную, децилкарбонильную, 3-метилнонилкарбонильную, 8-метилнонилкарбонильную, 3-этилоктилкарбонильную, 3,7-диметилоктилкарбонильную, ундецилкарбонильную, додецилкарбонильную, тридецилкарбонильную, тетрадецилкарбонильную, пентадецилкарбонильную, гексадецилкарбонильную, 1-метилпентадецилкарбонильную, 14-метилпентадецилкарбонильную, 13,13-диметилтетрадецилкарбонильную, гептадецилкарбонильную, 15-метилгексадецил-карбонильную, октадецилкарбонильную, 1-метилгептадецилкарбонильную, нонадецилкарбонильную, эйкозилкарбонильную и генейкозилкарбонильную группы; из них предпочтительными являются группы, содержащие от 1 до 5 атомов углерода; галогенированную алкилкарбонильную группу, содержащую от 2 до 6 атомов углерода, предпочтительно от 2 до 3 атомов углерода, такую как хлорацетильная, дихлорацетильная, трихлорацетильная и трифторацетильная группы; низшую алкоксиалкилкарбонильную группу, в которой каждая из алкильной и алкоксичастей содержит предпочтительно от 1 до 4 атомов углерода, такую как метоксиацетильная группа; ненасыщенную алкилкарбонильную группу, содержащую от 3 до 6 атомов углерода, такую как акрилоильная, пропиолоильная, метакрилоильная, кротоноильная, аллилкарбонильная, изокротоноильная и (E)-2-метил-2-бутеноильная группы; арилкарбонильную группу, такую как бензоильная,  -нафтоильная и -нафтоильная и  -нафтоильная группы; -нафтоильная группы;галогенированную арилкарбонильную группу, такую как 2-бромбензоильная и 4-хлорбензоильная группы; замещенную низшим алкилом арилкарбонильную группу, такую как 2,4,6-триметилбензоильная и 4-толуоильная группы; гидроксизамещенную арилкарбонильную группу, такую как 3,5-диметил-4 -гидроксибензоильная и 3,5-ди-трет-бутил-4- гидроксибензоильная группы; замещенную низшим алкокси арилкарбонильную группу, такую как 4-анизоильная группа; нитрозамещенную арилкарбонильную группу, такую как 4-нитробензоильная и 2-нитробензоильная группы; замещенную низшим алкоксикарбонилом арилкарбонильную группу, такую как 2-(метоксикарбонил)бензоильная группа; замещенную арилом арилкарбонильную группу, такую как 4-фенилбензоильная группа; низшую алкоксикарбонильную группу, предпочтительно содержащую от 2 до 7 атомов углерода, такую как метоксикарбонильная, этоксикарбонильная, пропоксикарбо-нильная, бутоксикарбонильная, втор-бутоксикарбонильная, трет-бутоксикарбонильная и изобутоксикарбонильная группы; низшую алкоксикарбонильную группу, предпочтительно содержащую от 2 до 7 атомов углерода, которая замещена атомом галогена или тринизшийалкилсилильной группой, такую как 2,2,2-трихлорэтоксикарбонильная и 2-триметилсилил-этоксикарбонильная группы; аралкилкарбонильную группу, арильное кольцо которой может быть не замещено или может быть замещено 1 или 2 низшими алкокси- или нитрогруппами, такую как бензилкарбонильная, 4-метоксибензилкарбонильная, 3,4-диметоксибензилкарбонильная, 2-нитробензилкарбонильная и 4-нитробензилкарбонильная группы; низшую алкансульфонильную группу, предпочтительно содержащую от 1 до 6 атомов углерода, такую как метансульфонильная, этансульфонильная и пропансульфонильная группы; галогенированную низшую алкансульфонильную группу, предпочтительно содержащую от 1 до 6 атомов углерода, такую как хлорметансульфонильная, трифторметансульфонильная и пентафторэтансульфонильная группы; арилсульфонильную группу, арильная часть которой определена и приведена в пример выше в отношении R1, такую как бензолсульфонильная и п-толуолсульфонильная группы. Из указанных выше групп авторы заявки предпочтительными считают алифатические ацильные группы, ароматические ацильные группы, алкоксикарбонильные группы и низшие алкансульфонильные группы, более предпочтительно алкилкарбонильные группы и низшие алкоксикарбонильные группы. Если R5 совместно с R1 и атомом азота, к которому они присоединены, образует гетероциклическую группу, она содержит в цикле от 5 до 7, более предпочтительно от 5 до 6 атомов, из которых от 1 до 3 представляют собой гетероатомы, выбранные из группы, содержащей атомы азота, кислорода и серы, причем по крайней мере один из них представляет собой атом азота. Предпочтительно, содержится один или два атома азота и ни одного или один атом кислорода или атом серы. Примеры таких групп включают пирролидино, 3-тиазолидинильную, пиперидино, пиперазино, морфолино, тиоморфолино, гомопиперазино, имидазолидинильную и имидазолильную группы. Такие группы могут являться замещенными или незамещенными предпочтительно одним или двумя атомами кислорода и/или заместителями в количестве от 1 до 3, выбранными из группы, содержащей заместители  , как определены выше, и могут быть конденсированы с другой циклической группой, предпочтительно содержащей в цикле 3, 4, 5 или 6 атомов и которые могут являться карбоциклическими или гетероциклическими, более предпочтительно бензольным кольцом. Примерами таких групп являются N-метилпиперазино, N-трет-бутоксикарбонилпиперазино, 1- индолинильная, 2-карбокси-1-индолинильная, 2-метоксикарбонил-1- индолинильная, 3,4-диметилиндолин-2,5-дион-1-ильная и изоиндол-1,3-дион-2-ильная группы.
Если R7 или заместитель , как определены выше, и могут быть конденсированы с другой циклической группой, предпочтительно содержащей в цикле 3, 4, 5 или 6 атомов и которые могут являться карбоциклическими или гетероциклическими, более предпочтительно бензольным кольцом. Примерами таких групп являются N-метилпиперазино, N-трет-бутоксикарбонилпиперазино, 1- индолинильная, 2-карбокси-1-индолинильная, 2-метоксикарбонил-1- индолинильная, 3,4-диметилиндолин-2,5-дион-1-ильная и изоиндол-1,3-дион-2-ильная группы.
Если R7 или заместитель  представляет собой низшую алкильную группу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 1 до 6, предпочтительно от 1 до 4 атомов углерода, и примеры включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную, изопентильную, неопентильную, 2-метилбутильную, 1-этилпропильную, гексильную, изогексильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 1,2-диметилбутильную, 1,3-диметилбутильную, 2,3-диметилбутильную и 2-этилбутильную группы. Из них авторы заявки считают предпочтительными алкильные группы, содержащие 1-4 атомов углерода, особенно метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную группы и наиболее предпочтительно метильную группу.
Если R7 представляет собой низшую алкенильную группу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 2 до 6, предпочтительно от 3 до 4 атомов углерода, и примеры включают винильную, аллильную, металлильную, 1-пропенильную, изопропенильную, 1-бутенильную, 2- бутенильную, 3-бутенильную, 1-пентенильную, 2-пентенильную, 3-пентенильную, 4-пентенильную, 1-гексенильную, 2-гексенильную, 3-гексенильную и 4-гексенильную группы, из которых предпочтительными являются винильная, аллильная, металлильная, 1-пропенильная, изопропенильная и бутенильная группы, причем аллильная и 2-бутенильная группы являются наиболее предпочтительными.
Если R7 представляет собой аралкильную группу, она может представлять собой любую из аралкильных групп, определенных и приведенных в примере выше в отношении R2.
Если заместитель представляет собой низшую алкильную группу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 1 до 6, предпочтительно от 1 до 4 атомов углерода, и примеры включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную, изопентильную, неопентильную, 2-метилбутильную, 1-этилпропильную, гексильную, изогексильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 1,2-диметилбутильную, 1,3-диметилбутильную, 2,3-диметилбутильную и 2-этилбутильную группы. Из них авторы заявки считают предпочтительными алкильные группы, содержащие 1-4 атомов углерода, особенно метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную группы и наиболее предпочтительно метильную группу.
Если R7 представляет собой низшую алкенильную группу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 2 до 6, предпочтительно от 3 до 4 атомов углерода, и примеры включают винильную, аллильную, металлильную, 1-пропенильную, изопропенильную, 1-бутенильную, 2- бутенильную, 3-бутенильную, 1-пентенильную, 2-пентенильную, 3-пентенильную, 4-пентенильную, 1-гексенильную, 2-гексенильную, 3-гексенильную и 4-гексенильную группы, из которых предпочтительными являются винильная, аллильная, металлильная, 1-пропенильная, изопропенильная и бутенильная группы, причем аллильная и 2-бутенильная группы являются наиболее предпочтительными.
Если R7 представляет собой аралкильную группу, она может представлять собой любую из аралкильных групп, определенных и приведенных в примере выше в отношении R2.
Если заместитель  представляет собой галогенированную низшую алкильную группу, она может представлять собой любую из указанных выше алкильных групп, которая замещена по крайней мере одним атомом галогена. Хотя принципиального ограничения на количество галогеновых заместителей не существует и группа, при желании, может быть пергалогенирована, как правило, предпочтительными являются от 1 до 3 атомов галогена, выбранных из группы, содержащей атомы фтора, хлора, брома и йода. Примеры таких галогеналкильных групп включают хлорметильную, дихлорметильную, трихлорметильную, трифторметильную, 2-хлорэтильную, 2- фторэтильную, 2-бромэтильную, 2-йодэтильную, 2,2,2-трихлорэтильную, 2,2,2-трифторэтильную, 3-хлорпропильную, 3-фторпропильную, 3-бромпропильную, 3-йодпропильную, 3,3,3-трихлорпропильную, 3,3,3-трифторпропильную, 4-хлорбутильную, 4-фторбутильную, 4-бромбутильную и 4-йодбутильную группы.
Если заместитель представляет собой галогенированную низшую алкильную группу, она может представлять собой любую из указанных выше алкильных групп, которая замещена по крайней мере одним атомом галогена. Хотя принципиального ограничения на количество галогеновых заместителей не существует и группа, при желании, может быть пергалогенирована, как правило, предпочтительными являются от 1 до 3 атомов галогена, выбранных из группы, содержащей атомы фтора, хлора, брома и йода. Примеры таких галогеналкильных групп включают хлорметильную, дихлорметильную, трихлорметильную, трифторметильную, 2-хлорэтильную, 2- фторэтильную, 2-бромэтильную, 2-йодэтильную, 2,2,2-трихлорэтильную, 2,2,2-трифторэтильную, 3-хлорпропильную, 3-фторпропильную, 3-бромпропильную, 3-йодпропильную, 3,3,3-трихлорпропильную, 3,3,3-трифторпропильную, 4-хлорбутильную, 4-фторбутильную, 4-бромбутильную и 4-йодбутильную группы.
Если заместитель  или заместитель или заместитель  представляет собой низшую алкоксигруппу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 1 до 6, предпочтительно от 1 до 4 атомов углерода, и примеры включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси, 2-метилбутокси, 1-этилпропокси, гексилокси, изогексилокси, 3-метилпентилокси, 2-метилпентилокси, 1-метилпентилокси, 3,3-диметилбутокси, 2,2-диметилбутокси, 1,1- диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,3- диметилбутокси и 2-этилбутоксигруппы. Из них авторы заявки считают предпочтительными метокси, этокси, пропокси, изопропокси, бутокси и трет-бутоксигруппы, и наиболее предпочтительно, метоксигруппу.
Если заместитель представляет собой низшую алкоксигруппу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 1 до 6, предпочтительно от 1 до 4 атомов углерода, и примеры включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси, 2-метилбутокси, 1-этилпропокси, гексилокси, изогексилокси, 3-метилпентилокси, 2-метилпентилокси, 1-метилпентилокси, 3,3-диметилбутокси, 2,2-диметилбутокси, 1,1- диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,3- диметилбутокси и 2-этилбутоксигруппы. Из них авторы заявки считают предпочтительными метокси, этокси, пропокси, изопропокси, бутокси и трет-бутоксигруппы, и наиболее предпочтительно, метоксигруппу.
Если заместитель  или заместитель или заместитель  представляет собой низшую алкилтиогруппу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 1 до 6, предпочтительно, от 1 до 4 атомов углерода, и примеры включают метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио, изопентилтио, неопентилтио, 2-метилбутилтио, 1-этилпропилтио, гексилтио, изогексилтио, 4-метилпентилтио, 3-метилпентилтио, 2- метилпентилтио, 1-метилпентилтио, 3,3-диметилбутилтио, 2,2- диметилбутилтио, 1,1-диметилбутилтио, 1,2-диметилбутилтио, 1,3- диметилбутилтио, 2,3-диметилбутилтио и 2-этилбутилтиогруппы. Из них авторы заявки считают предпочтительными метилтио, этилтио, пропилтио, изопропилтио, бутилтио и изобутилтиогруппы и наиболее предпочтительно метилтиогруппу.
Если заместитель представляет собой низшую алкилтиогруппу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 1 до 6, предпочтительно, от 1 до 4 атомов углерода, и примеры включают метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио, изопентилтио, неопентилтио, 2-метилбутилтио, 1-этилпропилтио, гексилтио, изогексилтио, 4-метилпентилтио, 3-метилпентилтио, 2- метилпентилтио, 1-метилпентилтио, 3,3-диметилбутилтио, 2,2- диметилбутилтио, 1,1-диметилбутилтио, 1,2-диметилбутилтио, 1,3- диметилбутилтио, 2,3-диметилбутилтио и 2-этилбутилтиогруппы. Из них авторы заявки считают предпочтительными метилтио, этилтио, пропилтио, изопропилтио, бутилтио и изобутилтиогруппы и наиболее предпочтительно метилтиогруппу.
Если заместитель  или заместитель или заместитель  представляет собой аминный остаток, он представляет собой группу формулы -NRaRb, где Ra и Rb являются одинаковыми или отличными, и каждый из них представляет собой атом водорода, низшую алкильную группу (что определено и приведено в примере выше в отношении R7 или заместителя представляет собой аминный остаток, он представляет собой группу формулы -NRaRb, где Ra и Rb являются одинаковыми или отличными, и каждый из них представляет собой атом водорода, низшую алкильную группу (что определено и приведено в примере выше в отношении R7 или заместителя  ), циклоалкильную группу, содержащую в цикле от 3 до 8, предпочтительно 5 или 6 атомов углерода, арильную группу (что определено и приведено в примере выше в отношении R1), аралкильную группу (что определено и приведено в примере выше в отношении R2), гетероциклическую группу (что определено и приведено в примере выше в отношении R1), либо Ra и Rb вместе с атомом азота, к которому они присоединены, представляют собой азотсодержащую гетероциклическую группу (что определено и приведено в примере выше в отношении R5 и R1). Примеры таких групп включают: ), циклоалкильную группу, содержащую в цикле от 3 до 8, предпочтительно 5 или 6 атомов углерода, арильную группу (что определено и приведено в примере выше в отношении R1), аралкильную группу (что определено и приведено в примере выше в отношении R2), гетероциклическую группу (что определено и приведено в примере выше в отношении R1), либо Ra и Rb вместе с атомом азота, к которому они присоединены, представляют собой азотсодержащую гетероциклическую группу (что определено и приведено в примере выше в отношении R5 и R1). Примеры таких групп включают:аминогруппу; алкиламино и диалкиламиногруппы, такие как метиламино, этиламино, изопропиламино, бутиламино, диметиламино, диэтиламино, диизопропиламино и дибутиламиногруппы; циклоалкиламино и дициклоалкиламиногруппы, такие как циклопентиламино, циклогексиламино, дициклопентиламино и дициклогексиламиногруппы; насыщенные циклические аминогруппы, то есть гетероциклические группы, содержащие в кольце атом азота, такие как пирролидино, пиперидино, пиперазино, N-метилпиперазино, морфолино и тиоморфолиногруппы; арил- и аралкиламиногруппы, атом азота которых может быть замещен низшей алкильной группой, такие как анилино, бензиламино, N-метиланилино и N-метилбензиламиногруппы; и замещенную гетероциклоаминогруппу, в которой атом азота может быть замещен низшей алкильной группой, такую как пиридиламино, N-метилпиридиламино и N-этилпиридиламиногруппы. Из них авторы заявки предпочтительными считают аминогруппу, моно- и диалкиламиногруппы, насыщенные циклические аминогруппы (такие как пирролидино, пиперидино, пиперазино, N-метилпиперазино, морфолино и тиоморфолиногруппы) и арил- и аралкиламиногруппы, атом азота которых может быть замещен низшей алкильной группой (такие как анилино, бензиламино, N-метиланилино и N-метилбензиламиногруппы). Если заместитель  или заместитель или заместитель  представляет собой карбамоильную группу, атом азота которой может быть замещен, она представляет собой группу формулы -CONRa‘Rb‘, где Ra‘ и Rb‘ являются одинаковыми или отличными, и каждый из них представляет собой любые из атомов или групп, представляемых Ra и Rb, или один из Ra и Rb представляет собой атом водорода, а другой представляет собой ацильную группу (которая может представлять собой любую из ацильных групп, определенных и приведенных в примере выше в отношении R2) или аминосульфонильную группу. Примеры таких карбамоильных групп включают: представляет собой карбамоильную группу, атом азота которой может быть замещен, она представляет собой группу формулы -CONRa‘Rb‘, где Ra‘ и Rb‘ являются одинаковыми или отличными, и каждый из них представляет собой любые из атомов или групп, представляемых Ra и Rb, или один из Ra и Rb представляет собой атом водорода, а другой представляет собой ацильную группу (которая может представлять собой любую из ацильных групп, определенных и приведенных в примере выше в отношении R2) или аминосульфонильную группу. Примеры таких карбамоильных групп включают:карбамоильную группу; алкилкарбамоильные и диалкилкарбамоильные группы, такие как метилкарбамоильная, этилкарбамоильная, изо- пропилкарбамоильная, бутилкарбамоильная, диметилкарбамоильная, диэтилкарбамоильная, диизопропилкарбамоильная и дибутилкарбамоильная группы; циклоалкилкарбамоильные и дициклоалкилкарбамоильные группы, такие как циклопентилкарбамоильная, циклогексилкарбамоильная, дициклопентилкарбамоильная и дициклогексилкарбамоильная группы; насыщенные циклические аминокарбонильные группы, то есть карбонильные группы, присоединенные к гетероциклической группе, содержащей в кольце атом азота, такие как пирролидинокарбонильная, пиперидинокарбонильная, пиперазинокарбонильная, N-метилпиперазинокарбонильная, морфолинокарбонильная и тиоморфолинокарбонильная группы; арил- и аралкилкарбамоильные группы, атом азота которых может быть замещен низшей алкильной группой, такие как фенилкарбамоильная, бензилкарбамоильная, N-метилфенилкарбамоильная и N-метилбензилкарбамоильная группы; замещенную гетероциклом карбамоильную группу, в которой атом азота может быть замещен низшей алкильной группой, такую как пиридилкарбамоильная, N-метилпиридилкарбамоильная и N-этилпиридилкарбамоильная группы; и ацилкарбамоильные группы, особенно алкансульфониламинокарбонильные группы, такие как метансульфониламинокарбонильная группа и аминосульфониламинокарбонильная группа. Из них авторы заявки предпочтительными считают карбамоильную группу, моно- и диалкилкарбамоильные группы, насыщенные циклические карбамоильные группы (такие как пирролидинкарбонильная, пиперидинкарбонильная, пиперазинкарбонильная, N-метилпиперазинкарбонильная, морфолинкарбонильная и тиоморфолинкарбонильная группы), арил- и аралкилкарбамоильные группы, атом азота которых может быть замещен низшей алкильной группой (такие как фенилкарбамоильная, бензилкарбамоильная, N-метилфенилкарбамоильная и N-метилбензилкарбамоильная группы) или алкансульфониламинокарбонильная группа (такая как метансульфониламинокарбонильная группа). Если заместитель  или заместитель или заместитель  представляет собой низшую алкоксикарбонильную группу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 1 до 6, предпочтительно от 1 до 4 атомов углерода в алкокси части (т.е. от 2 до 7 атомов углерода в алкоксикарбонильной части), и примеры включают метоксикарбонильную, этоксикарбонильную, пропоксикарбонильную, изопропоксикарбонильную, бутоксикарбонильную, изобутоксикарбонильную, втор-бутоксикарбонильную, трет-бутоксикарбонильную, пентилоксикарбонильную, изопентилоксикарбонильную, неопентилоксикарбонильную, 2-метилбутоксикарбонильную, 1-этилпропоксикарбонильную, гексилоксикарбонильную, изогексилоксикарбонильную, 4-метилпентилоксикарбонильную, 3-метилпентилоксикарбонильную, 2-метилпентилоксикарбонильную, 1-метилпентилоксикарбонильную, 3,3-диметилбутоксикарбонильную, 2,2-диметилбутоксикарбонильную, 1,1-диметилбутоксикарбонильную, 1,2-диметилбутоксикарбонильную, 1,3- диметилбутоксикарбонильную, 2,3-диметилбутоксикарбонильную и 2-этилбутоксикарбонильную группы. Из них авторы заявки считают предпочтительными алкоксикарбонильные группы, содержащие от 1 до 4 атомов углерода, в особенности метоксикарбонильную, этоксикарбонильную, пропоксикарбонильную, изопропоксикарбонильную, бутоксикарбонильную и трет- бутоксикарбонильную группы, и наиболее предпочтительно метоксикарбонильную группу.
Если заместитель представляет собой низшую алкоксикарбонильную группу, она может представлять собой группу с неразветвленной или разветвленной цепью, содержащую от 1 до 6, предпочтительно от 1 до 4 атомов углерода в алкокси части (т.е. от 2 до 7 атомов углерода в алкоксикарбонильной части), и примеры включают метоксикарбонильную, этоксикарбонильную, пропоксикарбонильную, изопропоксикарбонильную, бутоксикарбонильную, изобутоксикарбонильную, втор-бутоксикарбонильную, трет-бутоксикарбонильную, пентилоксикарбонильную, изопентилоксикарбонильную, неопентилоксикарбонильную, 2-метилбутоксикарбонильную, 1-этилпропоксикарбонильную, гексилоксикарбонильную, изогексилоксикарбонильную, 4-метилпентилоксикарбонильную, 3-метилпентилоксикарбонильную, 2-метилпентилоксикарбонильную, 1-метилпентилоксикарбонильную, 3,3-диметилбутоксикарбонильную, 2,2-диметилбутоксикарбонильную, 1,1-диметилбутоксикарбонильную, 1,2-диметилбутоксикарбонильную, 1,3- диметилбутоксикарбонильную, 2,3-диметилбутоксикарбонильную и 2-этилбутоксикарбонильную группы. Из них авторы заявки считают предпочтительными алкоксикарбонильные группы, содержащие от 1 до 4 атомов углерода, в особенности метоксикарбонильную, этоксикарбонильную, пропоксикарбонильную, изопропоксикарбонильную, бутоксикарбонильную и трет- бутоксикарбонильную группы, и наиболее предпочтительно метоксикарбонильную группу.
Если заместитель  или заместитель или заместитель  представляет собой атом галогена, он может представлять собой атом фтора, хлора, брома или йода, предпочтительно атом фтора и хлора.
Если заместитель представляет собой атом галогена, он может представлять собой атом фтора, хлора, брома или йода, предпочтительно атом фтора и хлора.
Если заместитель 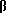 представляет собой гидроксизамещенную низшую алкильную группу, он может представлять собой любую из низших алкильных групп, определенных и приведенных в примере выше в отношении R2, которая замещена одной или несколькими гидроксигруппами. Примеры таких групп включают гидроксиметильную, гидроксиэтильную, гидроксипропильную и гидроксибутильную группы.
Из соединений по настоящему изобретению предпочтительными являются такие соединения формулы (I), в которых группа формулы -(CH2)k-ABR1 присоединена к 3-положению дитиоланового кольца. Такие соединения могут быть представлены формулой (I’) представляет собой гидроксизамещенную низшую алкильную группу, он может представлять собой любую из низших алкильных групп, определенных и приведенных в примере выше в отношении R2, которая замещена одной или несколькими гидроксигруппами. Примеры таких групп включают гидроксиметильную, гидроксиэтильную, гидроксипропильную и гидроксибутильную группы.
Из соединений по настоящему изобретению предпочтительными являются такие соединения формулы (I), в которых группа формулы -(CH2)k-ABR1 присоединена к 3-положению дитиоланового кольца. Такие соединения могут быть представлены формулой (I’)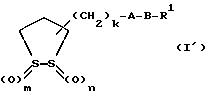 (в которой A, B, R1 k, m и n определены выше). Если соединения по настоящему изобретению содержат основную группу, такую как амино или иминогруппу, то эти соединения способны образовывать соли с кислотами. С другой стороны, если соединения по настоящему изобретению содержат кислую группу, такую как карбоксильную группу или имидогруппу, они способны образовывать соли с основаниями. Особого ограничения природы таких солей не существует, при условии, что там, где они предназначены для фармацевтического применения, они являются фармацевтически приемлемыми, то есть они не являются менее активными (или неприемлемо менее активными), чем соединение формулы (I), и не являются более токсичными (или неприемлемо более токсичными), чем соединение формулы (I). Примеры таких солей, образованных основной группой соединения по настоящему изобретению и кислотой, включают: соли минеральных кислот, в особенности галогенводородных кислот (таких как фтористо-водородная кислота, бромисто-водородная кислота, йодисто-водородная кислота и хлористо-водородная кислота), азотной кислоты, перхлорной кислоты, карбоновой кислоты, серной кислоты или фосфорной кислоты; соли низших алкилсульфоновых кислот, таких как метансульфоновая кислота, трифторметансульфоновая кислота или этансульфоновая кислота; соли арилсульфоновых кислот, таких как бензолсульфоновая кислота или п-толуолсульфоновая кислота; соли органических карбоновых кислот, таких как уксусная кислота, фумаровая кислота, винная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, бензойная кислота, миндальная кислота, аскорбиновая кислота, молочная кислота, глюконовая кислота или лимонная кислота; и соли аминокислот, таких как глицин, лизин, аргинин, орнитин, глютаминовая кислота или аспарагиновая кислота. Примеры таких солей, образованных кислотной группой соединения по настоящему изобретению и основанием, включают: соли щелочных металлов, таких как натрий, калий или литий; соли щелочно-земельных металлов, таких как барий или кальций; соли других металлов, таких как магний, алюминий или железо; соли аммония; соли органических оснований, такие как соли трет-октиламина, дибензиламина, морфолина, глюкозамина, алкилового эфира фенилглицина, этилендиамина, N-метилглюкамина, гуанидина, метиламина, диметиламина, диэтиламина, триэтиламина, диизопропиламина, циклогексиламина, дициклогексиламина, N, N-дибензилэтилендиамина, хлорпрокаина, прокаина, диэтаноламина, N-бензилфенэтиламина, пиперазина, тетраметиламмония и трис(гидроксиметил)аминометана; и соли аминокислот, таких как глицин, лизин, аргинин, орнитин, глютаминовая кислота или аспарагиновая кислота. Также, если соединение по настоящему изобретению оставляют на воздухе, оно может абсорбировать воду с образованием гидрата. Такие гидраты также составляют часть настоящего изобретения. Если соединение по настоящему изобретению содержит в молекуле асимметрический атом углерода, оно способно образовывать оптические изомеры, которые находятся в R- или в S-конфигурации. Несмотря на то что все они представлены здесь единой молекулярной формулой, настоящее изобретение включает как индивидуальные разделенные изомеры, так и смеси, включая их рацематы. В случае применения стереоспецифичных методик синтеза или в случае применения в качестве исходных продуктов оптически активных соединений индивидуальные изомеры могут быть получены непосредственно; с другой стороны, если получают смесь изомеров, индивидуальные изомеры могут быть получены в соответствии с традиционными методиками разделения. Из соединений по настоящему изобретению авторы заявки считают предпочтительными такие соединения формулы (I) и их соли, в которых: (A) один из m и n представляет собой 0, а другой представляет собой 0 или 1; (B) k представляет собой 0 или целое число от 1 до 8; (C) R1 представляет собой гидроксигруппу, алкоксигруппу, содержащую от 1 до 5 атомов углерода, гетероциклическую группу, алкильную группу, содержащую от 1 до 12 атомов углерода, которая является незамещенной или является замещенной заместителями в количестве от 1 до 3, выбранными из группы, содержащей заместители  и заместители и заместители  , или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы; , или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы;(D) A представляет собой группу формулы -CO-, -CON(R2)SO2-, -N(R2)CO-, -N(R2)CS-, -CON(R2)CO-, -N(R2)COCO- или -N(R2)SO2– [где R2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 12 атомов углерода, или бензильную группу], в особенности группу формулы -CON(R2)SO2-, -N(R2)CS- , -CON(R2)CO-, -N(R2)COCO- или -N(R2)SO2-; (E) В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)- [где R5 и R6 являются одинаковыми или отличными, и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до 12 атомов углерода, или бензильную группу]. Из указанных выше соединений авторы заявки считают предпочтительными такие соединения формулы (I), в которых m и n определены в (A) выше, k определен в (В) выше, R1 определен в (C) выше, A определен в (D) выше и В определен в (E) выше. Более предпочтительными соединениями по настоящему изобретению являются такие соединения формулы (I) и их соли, в которых: (F) как m, так и n представляют собой 0; (G) k представляет собой целое число от 2 до 6; (Н) R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу, алкоксигруппу, содержащую от 1 до 5 атомов углерода, или гидроксигруппу; (I) A представляет собой группу формулы -CO-, -CON(R2)SO2-, -N(R2)CO-, -N(R2)CS-, -CON(R2)CO-, -N(R2)COCO- или -N(R2)SO2– [где R2 представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода], в особенности группу формулы -CON(R2)SO2-, -N(R2)CS-, -CON(R2)CO-, -N(R2)COCO- или -N(R2)SO2-; (J) В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)- [где R5 и R6 являются одинаковыми или отличными, и каждый из них представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода]. Из указанных выше соединений авторы заявки считают предпочтительными такие соединения формулы (I), в которых m и n определены в (F) выше, k определен в (G) выше, R1 определен в (H) выше, A определен в (I) выше и В определен в (J) выше. Наиболее предпочтительными соединениями по настоящему изобретению являются такие соединения формулы (I) и их соли, в которых: (K) как m, так и n равны 0; (L) k равен 4 или 5; (M) R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу или алкоксигруппу, содержащую от 1 до 5 атомов углерода; (N) A представляет собой группу формулы -CONHSO2-, -CONCH3SO2-, -NHCO-, -NHCS-, -CONHCO-, -NHCOCO-, -NHSO2– или -CO-, в особенности группу формулы -CONHSO2-, -CONCH3SO2-, -NHCS-, -CONHCO-, -NHCOCO- или -NHSO2-; (О) В представляет собой одинарную связь или группу формулы -NH-, -NCH3– или -NHNCH3-. Из указанных выше соединений авторы заявки считают особенно предпочтительными такие соединения формулы (I), в которых m и n определены в (K) выше, k определен в (L) выше, R1 определен в (M) выше, A определен в (N) выше и В определен в (О) выше. Характерные примеры индивидуальных соединений по настоящему изобретению показаны в следующих формулах (I-1), (I-2) и (I-3), в которых замещающие группы показаны в соответствующей одной из Таблиц 1-3. В таблицах применяют следующие сокращения: Ac – ацетил; Bu – бутил; iBu – изобутил; sBu – втор-бутил; tBu – трет-бутил; Bz – бензил; 1,3-diox-IInd – изоиндол-1,3-дион-2-ил; 3,4-diMe-2,5-diox-1-Imdd – 3,4-диметилимидазолидин-2,5-дион-1-ил; Et – этил; Hx – гексил; Indn – индолинил; Me – метил; Mor – морфолино; Ph – фенил; Pipra – пиперазино; Pipri – пиперидино; Pn – пентил; iPn – изопентил; Pr – пропил; iPr – изопропил; Py – пиридил; Pyr – пирролидинил; Thiad – 3-тиазолидинил; Thmor – тиоморфолино. Также, в таблицах группы, представленные с Z-1 по Z-12, имеют следующие формулы:    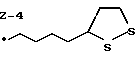 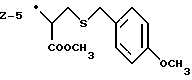 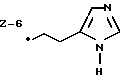 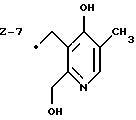 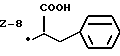 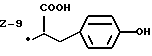 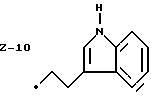 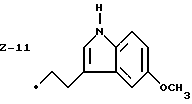 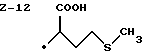 Наиболее предпочтительными соединениями являются N-[5-(1,2-дитиолан-3-ил)пентаноил]метансульфонамид (Соединение N 1-496); метил 3-[4-(1,2-дитиолан-3-ил)бутил]уреидоацетат (Соединение N 1-739); 2-(S)-{ 3-[4-(1,2-дитиолан-3-ил)бутил] уреидо} пропионовая кислота (Соединение N 1-740); метил 2-(S)-{3-[4-(1,2-дитиолан-3-ил)бутил]уреидо}пропионат (Соединение N 1-742); этил 3-[4-(1,2-дитиолан-3-ил)бутил] -1-метилуреидоацетат (этиловый эфир Соединения N 1-820); и N-[5-(1,2-дитиолан-3-ил)пентил]метансульфонамид (Соединение N 1-2470); и их фармацевтически приемлемые соли. Соединения по настоящему изобретению могут быть получены в соответствии с множеством способов, хорошо известных для получения соединений данного общего типа. Например, они могут быть получены в соответствии со следующими способами A-G. Способ A В данном способе соединение формулы (II) взаимодействует с соединением формулы (III) с получением соединения формулы (Ia), которое представляет собой соединение формулы (I), в котором каким-либо образом ограничены значения A и B. Схема реакции A приведена в конце описания. Стадия A1 На данной стадии дитиолановое производное формулы (Ia) получают путем проведения реакции между соединением формулы (II) и соединением формулы (III) в растворителе в присутствии основания. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Особого ограничения на природу применяемого растворителя не существует при условии, что он не оказывает нежелательного воздействия на течение реакции или на применяемые реагенты и что реагенты могут быть в нем растворены, по крайней мере в некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; нитрилы, такие как ацетонитрил, пропионитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и гексаметилфосфорный триамид; сульфоксиды, такие как диметилсульфоксид; и сульфоны, такие как сульфолан. Из них авторы заявки считают предпочтительными кетоны, простые эфиры и амиды, более предпочтительно ацетон, тетрагидрофуран, диметилформамид и N,N-диметилацетамид. Также не существует особого ограничения на природу применяемых оснований, и здесь с одинаковым успехом может быть применено любое основание, обычно применяемое в реакциях данного типа. Примеры таких оснований включают: неорганические основания, такие как карбонаты щелочных металлов (например, карбонат натрия, карбонат калия, карбонат лития или карбонат цезия), гидрокарбонаты щелочных металлов (например, гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития), гидриды щелочных металлов (например, гидрид лития, гидрид натрия или гидрид калия), гидроксиды щелочных металлов или щелочно-земельных металлов (например, гидроксид натрия, гидроксид калия, гидроксид бария или гидроксид лития), фториды щелочных металлов (например, фторид натрия или фторид калия); и алкоксиды щелочных металлов, таких как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия или метоксид лития. Из них предпочтительными являются карбонаты щелочных металлов, гидриды щелочных металлов и алкоксиды щелочных металлов, а карбонат калия, гидрид натрия и трет-бутоксид калия являются наиболее предпочтительными. Реакция может протекать в пределах широкого температурного интервала, и выбор точной температуры протекания реакции не является принципиальным для данного изобретения. Предпочтительная температура протекания реакции будет зависеть от таких факторов, как природа растворителя и исходный продукт и применяемый реагент. Однако, как правило, авторы заявки считают удобным проведение реакции при температуре от -20 до 100oC, более предпочтительно от 0 до 50oC. Время, необходимое для протекания реакции, также может широко варьировать в зависимости от множества факторов, особенно от температуры протекания реакции и от природы применяемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, изложенных выше, достаточным обычно является промежуток времени от 10 минут до 24 часов, более предпочтительно от 30 минут до 12 часов. Способ B Он описывает получение соединения формулы (Ib), которое представляет собой соединение формулы (I), в котором A представляет собой атом кислорода или группу формулы -N(R2)CO-, -N(R2)SO2-, -ON(R2)CO-, -ON(R2)SO2-, -N(R2)N(R3)CO-, -N(R2)N(R3)SO2-, -N(R2)CON(R3)N(R4)CO-, -N(R2)CON(R3)CO- или -N(R2)CON(R3)SO2– [где R2, R3 и R4 определены выше]. Схема реакции B приведена в конце описания. Стадия B1 На данной стадии дитиолановое производное формулы (Ib) получают путем проведения реакции между соединением формулы (IV) и соединением формулы (V) в растворителе в присутствии основания. Реакция является, по существу, такой же, что и описанная выше в cтадии A1, и может быть проведена с применением тех же растворителей, оснований и условий протекания реакции. Способ C. Он описывает получение соединения формулы (Ic), то есть соединения формулы (I), в котором A представляет собой группу формулы -N(R2)CO-, -N(R2)SO2-, -CON(R2)N(R3)CO-, -CON(R2)CO-, -CON(R2)SO2-, -O-CO-, -ON(R2)CO-, -ON(R2)SO2-, -O-CON(R2)N(R3)CO-, -O-CON(R2)CO-, -O-CON(R2)SO2, -CO-CON(R2)N(R3)CO-, -CO-CON(R2)CO-, -CO-CON(R2)SO2, -N(R2)CO-CO-, -N(R2)N(R3)CO-, -N(R2)N(R3)SO2-, -N(R2)CON(R3)N(R4)CO-, -N(R2)CON(R3)CO- или -N(R2)CON(R3)SO2– [где R2, R3 и R4 определены выше], и B представляет собой одинарную связь. Схема реакции C приведена в конце описания. Стадия C1 На данной cтадии дитиолановое производное формулы (Ic) получают путем ацилирования или сульфонилирования соединения формулы (VI) соединением формулы (VII) в растворителе в присутствии основания. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Особого ограничения на природу применяемого растворителя не существует при условии, что он не оказывает нежелательного воздействия на течение реакции или на применяемые реагенты и что реагенты могут быть в нем растворены, по крайней мере в некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; нитрилы, такие как ацетонитрил, пропионитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и гексаметилфосфорный триамид. Из них предпочтительными являются ароматические углеводороды, галогенированные углеводороды, простые эфиры и амиды, более предпочтительными являются галогенированные углеводороды, простые эфиры и амиды. Также не существует особого ограничения на природу применяемых оснований, и здесь с одинаковым успехом может быть применено любое основание, обычно применяемое в реакциях данного типа. Примеры таких оснований включают: органические основания, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, N-метилдициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино) пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N- диметиланилин, N, N-диэтиланилин, 1,5-диазабицикло[4.3.0] нон-5-ен (ДБН), 1,4-диазабицикло[2.2.2] октан (ДАБЦО) и 1,8-диазабицикло [5.4.0]ундец-7-ен (ДБУ), из них предпочтительными являются триэтиламин и диизопропилэтиламин. Реакция может протекать в пределах широкого температурного интервала, и выбор точной температуры протекания реакции не является принципиальным для данного изобретения. Предпочтительная температура протекания реакции будет зависеть от таких факторов, как природа растворителя и исходный продукт и применяемый реагент. Однако, как правило, авторы заявки считают удобным проведение реакции при температуре от -20 до 100oC, более предпочтительно от 0 до 80oC. Время, необходимое для протекания реакции, также может широко варьировать в зависимости от множества факторов, особенно от температуры протекания реакции и от природы применяемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, изложенных выше, достаточным обычно является промежуток времени от 5 минут до 2 суток, более предпочтительно от 20 минут до 1 суток. В качестве альтернативы, если соединение формулы (VI) взаимодействует с соединением формулы (VII), в котором E1 представляет собой карбонильную группу, реакция может быть проведена с применением соединения формулы HOOC-R1 (где R1 определен выше) путем взаимодействия соединения формулы (VI) с соединением формулы (VII) с применением конденсатора в растворителе в присутствии или в отсутствие основания. Особого ограничения на природу применяемых конденсаторов не существует, и здесь с одинаковым успехом может быть применен любой конденсатор, обычно применяемый в реакциях данного типа. Примеры таких конденсаторов включают: (1) комбинацию эфиров фосфорной кислоты, таких как диэтилцианофосфат или дифенилфосфорилазид, и описанного ниже основания; (2) карбодиимид, такой как 1,3-дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид или 1-этил-3-(3-диметиламинопропил) карбодиимид; комбинацию одного или нескольких указанных выше карбодиимидов и описанного ниже основания; комбинацию одного или нескольких указанных выше карбодиимидов и N-гидроксисоединения, такого как N-гидроксисукцинимид, 1-гидроксибензотриазол или N-гидрокси-5-норборнен-2,3-дикарбоксиимид; (3) комбинацию дисульфида, такого как 2,2′-дипиридилдисульфид или 2,2′- дибензотиазолилдисульфида, и фосфина, такого как трифенилфосфин или трибутилфосфин; (4) карбонат, такой как N,N’-дисукцинимидилкарбонат, ди-2-пиридилкарбонат или S,S’-бис(1-фенил-1H-тетразол-5-ил) дитиокарбонат; (5) хлорангидрид фосфиновой кислоты (phosphinic chloride), такой как хлорангидрид N,N’-бис(2-оксо-3-оксазолидинил) фосфиновой кислоты; (6) оксалат, такой как N,N’-дисукцинимидилоксалат, N,N’-дифталимидоксалат, N, N’-бис(5-норборнен-2,3-дикарбоксиимидил) оксалат, 1,1′-бис (бензотриазолил) оксалат, 1,1′-бис (6-хлорбензотриазолил)оксалат или 1,1′-бис(6-трифторметилбензотриазолил)оксалат; (7) комбинацию одного или нескольких указанных выше фосфинов и эфира азодикарбоновой кислоты, такого как диэтилазодикарбоксилат, или амида азодикарбоновой кислоты, такого как 1,1′-(азодикарбонил)дипиперидин; комбинацию одного или нескольких указанных выше фосфинов и описанного ниже основания; (8) 3′-сульфонат N-(низший алкил)-5-арилизоксазолия, такой как 3′-сульфонат N-этил-5-фенилизоксазолия; (9) дигетероарилдиселенид, такой как ди-2-пиридилдиселенид; (10) арилсульфонилтриазолид, такой как п-нитробензолсульфонилтриазолид; (11) галогенид 2-галоген-1-(низший алкил)пиридиния, такой как йодид 2-хлор-1-метилпиридиния; (12) имидазол, такой как 1,1′-оксалилдиимидазол или N,N’-карбонилдиимидазол; (13) фторборат 3-(низший алкил)-2-галогенбензотиазолия, такой как фторборат 3-этил-2-хлорбензотиазолия; (14) 3-(низший алкил)-бензотиазол-2-серон, такой как 3-метилбензотиазол-2-серон; (15) фосфат, такой как фенилдихлорфосфат или полифосфатный эфир; (16) галогенсульфонилизоцианат, такой как хлорсульфонилизоцианат; (17) галогенсилан, такой как триметилсилилхлорид или триэтилсилилхлорид; (18) комбинацию (низший алкан)сульфонилгалогенида, такого как метансульфонилхлорид и описанного ниже основания; (19) хлорид N,N,N’,N’-тетра (низший алкил) галогенформамидия, такой как хлорид N,N,N’,N’-тетраметилхлорформамидия; и (20) комбинацию (низший алкил) оксикарбонилгалогенида, такого как этилхлоркарбонат, и описанного ниже основания; предпочтительно, указанные выше варианты (1), (2), (7), (12) и (20). Реакцию обычно и предпочтительно проводят в присутствии растворителя. Особого ограничения на природу применяемого растворителя не существует при условии, что он не оказывает нежелательного воздействия на течение реакции или на применяемые реагенты и что реагенты могут быть в нем растворены, по крайней мере в некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и гексаметилфосфорный триамид. Также не существует особого ограничения на природу применяемых оснований, и здесь с одинаковым успехом может быть применено любое основание, обычно применяемое в реакциях данного типа. Примеры таких оснований включают: органические основания, такие как N-метилморфолин, триэтиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N, N-диметиламино) пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин и N,N-диэтиланилин. При желании, 4-(N,N-диметиламино) пиридин и 4-пирролидинопиридин могут быть объединены с другими основаниями и применены в каталитических количествах. Также, в целях более эффективного проведения реакции в реакционную смесь может быть добавлен осушитель, такой как молекулярное сито, четвертичная соль аммония (например, хлорид бензилтриэтиламмония или хлорид тетрабутиламмония), краун эфир, такой как дибензо-18-краун-6, или уловитель кислоты, такой как 3,4-дигидро-2H-пиридо[1,2-а] пиримидин-2-он. Реакция может протекать в пределах широкого температурного интервала, и выбор точной температуры протекания реакции не является принципиальным для данного изобретения. Предпочтительная температура протекания реакции будет зависеть от таких факторов, как природа растворителя и исходный продукт и применяемый реагент. Однако, как правило, авторы заявки считают удобным проведение реакции при температуре от -20 до 80oC, более предпочтительно от 0oC до комнатной температуры. Время, необходимое для протекания реакции, также может широко варьировать в зависимости от множества факторов, особенно от температуры протекания реакции и от природы применяемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, изложенных выше, достаточным обычно является промежуток времени от 10 минут до 3 суток, более предпочтительно, от 30 минут до 1 суток. Способ D Он описывает получение соединения формулы (Id), то есть соединения формулы (I), в котором A представляет собой карбонильную группу или группу формулы -CON(R2)N(R3)CO-, -CON(R2)CO-, -CON(R2)SO2-, -CO-O-, -CO-CON(R2)N(R3)CO-, -CO-CON(R2)CO- или -CO-CON(R2)SO2– [где R2 и R3 определены выше]. Схема реакции D приведена в конце описания. Стадия D1 На данной стадии дитиолановое производное формулы (Id) получают путем ацилирования соединения формулы (IX) соединением формулы (VIII) в растворителе в присутствии основания. Реакция является, по существу, такой же, что и описанная выше в стадии C1, и может быть проведена с применением тех же растворителей, оснований и условий протекания реакции. Альтернативно, дитиолановое производное формулы (Id) может быть получено путем взаимодействия соединения формулы (VIII’) с соединением формулы (IX) с применением конденсирующего агента в растворителе в присутствии или в отсутствие основания. 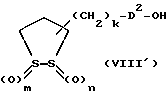 где D2, k, m и n определены выше. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Особого ограничения на природу применяемого растворителя не существует при условии, что он не оказывает нежелательного воздействия на течение реакции или на применяемые реагенты и что реагенты могут быть в нем растворены, по крайней мере в некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; и амиды, такие как формамид, диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и гексаметилфосфорный триамид. Также не существует особого ограничения на природу применяемых оснований, и здесь с одинаковым успехом может быть применено любое основание, обычно применяемое в реакциях данного типа. Примеры таких оснований включают: органические основания, такие как N-метилморфолин, триэтиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N, N-диметиламино) пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин и N,N-диэтиланилин. При желании, 4-(N, N-диметиламино)пиридин и 4-пирролидинопиридин могут быть объединены с другими основаниями и применены в каталитических количествах. Также, в целях более эффективного проведения реакции в реакционную смесь может быть добавлен осушитель, такой как молекулярное сито, четвертичная соль аммония (например, хлорид бензилтриэтиламмония или хлорид тетрабутиламмония), краун эфир, такой как дибензо-18-краун-6, или уловитель кислоты, такой как 3,4-дигидро-2H-пиридо[1,2-а] пиримидин-2-он. Реакция может протекать в пределах широкого температурного интервала, и выбор точной температуры протекания реакции не является принципиальным для данного изобретения. Предпочтительная температура протекания реакции будет зависеть от таких факторов, как природа растворителя и исходный продукт и применяемый реагент. Однако, как правило, авторы заявки считают удобным проведение реакции при температуре от -20 до 80oC, более предпочтительно от 0oC до комнатной температуры. Время, необходимое дли протекания реакции, также может широко варьировать в зависимости от множества факторов, особенно от температуры протекания реакции и от природы применяемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, изложенных выше, достаточным обычно является промежуток времени от 10 минут до 3 суток, более предпочтительно от 30 минут до 1 суток. Способ E. Он описывает получение соединения формулы (Ie), то есть соединения формулы (I), в котором: A представляет группу формулы -N(R2)CO- [где R2 представляет собой атом водорода], и B представляет группу формулы -N(R5)- или -N(R5)N(R6) – [где R5 и R6 определены выше]. Стадия E1 На данной стадии эфир изоциановой кислоты формулы (XI) получают путем азидирования карбоксильной группы соединения формулы (X) в растворителе в присутствии или в отсутствие катализатора с получением кислого азидного соединения и последующего нагревания. Реакцию азидирования обычно и предпочтительно проводят в присутствии растворителя. Особого ограничения на природу применяемого растворителя не существует при условии, что он не оказывает нежелательного воздействия на течение реакции или на применяемые реагенты и что реагенты могут быть в нем растворены, по крайней мере в некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид и хлороформ; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан и диметоксиэтан; нитрилы, такие как ацетонитрил; и амиды, такие как формамид, диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и гексаметилфосфорный триамид. Из них авторы заявки считают предпочтительными ароматические углеводороды, галогенированные углеводороды и простые эфиры. Также не существует особого ограничения на природу применяемых азидирующих агентов, и здесь с одинаковым успехом может быть применен любой азидирующий агент, обычно применяемый в реакциях данного типа. Примеры таких азидирующих агентов включают: диарилфосфорилазидные производные, такие как дифенилфосфорилазид; триалкилсилилазиды, такие как триметилсилилазид или триэтилсилилазид; и азиды щелочных металлов, такие как азид натрия, азид калия или азид лития. Из них авторы заявки считают предпочтительными диарилфосфорилазидные производные. Также не существует особого ограничения на природу применяемых катализаторов, и здесь с одинаковым успехом может быть применен любой катализатор, обычно применяемый в реакциях данного типа. Примеры таких катализаторов включают: кислоты Льюиса, такие как триалкилсилилтрифлаты (например, триметилсилилтрифлат и триэтилсилилтрифлат), трифторборанэтерат, хлорид алюминия и хлорид цинка; и органические основания, такие как N-метилморфолин, триэтиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино) пиридин, 2,6-ди(трет-бутил) -4-метилпиридин, хинолин, N,N-диметиланилин и N,N-диэтиланилин. Реакция может протекать в пределах широкого температурного интервала, и выбор точной температуры протекания реакции не является принципиальным для данного изобретения. Предпочтительная температура протекания реакции будет зависеть от таких факторов, как природа растворителя и исходный продукт и применяемый реагент. Однако, как правило, авторы заявки считают удобным проведение реакции при температуре от 20 до 180oC, более предпочтительно от 50 до 150oC. Время, необходимое для протекания реакции, также может широко варьировать в зависимости от множества факторов, особенно от температуры протекания реакции и от природы применяемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, изложенных выше, достаточным обычно является промежуток времени от 10 минут до 24 часов, более предпочтительно от 30 минут до 8 часов. Стадия E2 На данной стадии дитиолановое производное формулы (Ie) получают путем взаимодействия эфира изоциановой кислоты (XI) с соединением формулы (XII) в растворителе. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Особого ограничения на природу применяемого растворителя не существует при условии, что он не оказывает нежелательного воздействия на течение реакции или на применяемые реагенты и что реагенты могут быть в нем растворены, по крайней мере в некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; нитрилы, такие как ацетонитрил, пропионитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и гексаметилфосфорный триамид; сульфоксиды, такие как диметилсульфоксид; и сульфоны, такие как сульфолан. Из них авторы заявки считают предпочтительными ароматические углеводороды, галогенированные углеводороды, простые эфиры, нитрилы и амиды. Реакция может протекать в пределах широкого температурного интервала, и выбор точной температуры протекания реакции не является принципиальным для данного изобретения. Предпочтительная температура протекания реакции будет зависеть от таких факторов, как природа растворителя и исходный продукт и применяемый реагент. Однако, как правило, авторы заявки считают удобным проведение реакции при температуре от -20 до 100oC, более предпочтительно от 0 до 80oC. Время, необходимое для протекания реакции, также может широко варьировать в зависимости от множества факторов, особенно от температуры протекания реакции и от природы применяемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, изложенных выше, достаточным обычно является промежуток времени от 5 минут до 2 суток, более предпочтительно от 10 минут до 1 суток. Альтернативно, соединение формулы (I), в котором A представляет собой группу формулы -N(R2)CON(R3)N(R4)CO-, -N(R2)CON(R3)CO- или -N(R2)CON(R3)SO2– [где R2 представляет собой атом водорода, a R3 и R4 определены выше] может быть получено путем взаимодействия указанного выше эфира изоциановой кислоты формулы (XI) с соединением формулы: H-D3-B-R1 {где В и R1 определены выше, a D3 представляет собой группу формулы -N(R3)N(R4)CO-, -N(R3)CO- или -N(R3)SO2– [где R3 и R4 определены выше]} в соответствии с такой же процедурой, что и описана выше. Соединение формулы (I), в котором A представляет собой группу формулы -N(R2)CO- (где R2 представляет собой атом водорода), В представляет собой одинарную связь и R1 представляет собой группу OR7 (где R7 определен выше), может быть получено путем взаимодействия указанного выше эфира изоциановой кислоты формулы (XI) с соединением формулы: HOR7 (где R7 определен выше) в соответствии с такой же процедурой, что и описана выше. Атом водорода амино-, амидной или имидной группы может быть замещен другой группой путем взаимодействия соединения формулы (I), в которой R2, R3, R4, R5 и/или R7 представляют собой атом водорода, с соединением формулы: Y-R8 (в которой Y определен выше, a R8 представляет собой группу, отличную от атома водорода, в значении R2, R3, R4 и R6) в соответствии с указанным выше способом A, или путем алкилирования с применением комбинации спирта и карбодиимида, такого как дициклогексилкарбодиимид. Например, после того как дитиолановое производное по настоящему изобретению синтезировано в соответствии с указанным выше cпособом E, атом водорода амидной группы в соединении в соответствии с данными методиками может быть замещен другой группой. Способ F Он описывает получение соединения формулы (If), то есть соединения формулы (I), в котором: A представляет группу формулы -O-CO-, -N(R2)CO-, -N(R2)CS-, -CON(R2)CO-, -CON(R2)CS-, -ON(R2)CO-, -O-CON(R2CO-, -N(R2)N(R3)CO- или -N(R2)CON(R3CO- [где R2 и R3 определены выше], В представляет собой одинарную связь или группу формулы -N(R5‘)- [где R5‘ представляет собой группы, отличные от атома водорода в значении R5], и R1 представляет собой группу, определенную выше, отличную от атома водорода. Схема реакции F приведена в конце описания. Стадия F1 На данной стадии дитиолановое производное формулы (If) получают путем взаимодействия эфира изоциановой кислоты или эфира изотиоциановой кислоты формулы (XIII) с соединением формулы (VI). Реакция является, по существу, такой же, что и описанная выше в стадии E2, и может быть проведена с применением тех же растворителей, оснований и условий протекания реакции. Соединение формулы (If), где E3 представляет собой одинарную связь, a R1‘ представляет собой атом водорода также может быть получено путем проведения реакции с применением соединения формулы G=CN-R9 [где G определен выше, a R9 представляет собой силильную группу, такую как три (низший алкил)силильная группа, например, триметилсилил, триэтилсилил, изопропилдиметилсилил, трет-бутилдиметилсилил, метилдиизопропилсилил, метилди-трет-бутилсилил или триизопропилсилил, или три (низший алкил) силильная группа, замещенная 1 или 2 арильными группами, такая как дифенилметилсилильная, дифенилбутилсилильная, дифенилизопропилсилильная или фенилдиизопропилсилильная группы] вместо эфира изоциановой кислоты или эфира изотиоциановой кислоты формулы (XIII). Если дитиолановое кольцо в ходе проведения реакций, описанных в способах A-F, претерпевает размыкание с образованием дитиолового соединения, дитиолановое производное может быть получено путем окисления соединения с разомкнутым циклом с образованием дисульфидной связи. Реакцию окисления обычно проводят, применяя окислитель в присутствии растворителя. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Особого ограничения на природу применяемого растворителя не существует при условии, что он не оказывает нежелательного воздействия на течение реакции или на применяемые реагенты и что реагенты могут быть в нем растворены, по крайней мере в некоторой степени. Предпочтительные растворители включают водосодержащие органические растворители. Такие органические растворители включают: кетоны, такие как ацетон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или четыреххлористый углерод; нитрилы, такие как ацетонитрил; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид или гексаметилфосфорный триамид; сульфоксиды, такие как диметилсульфоксид; и спирты, такие как метанол или этанол. Также не существует особого ограничения на природу применяемых окислителей, и здесь с одинаковым успехом может быть применен любой окислитель, обычно применяемый в реакциях данного типа, при условии, что он способен образовывать дисульфидную связь. Примеры таких окислителей включают хлорид железа (III). Реакция может протекать в пределах широкого температурного интервала, и выбор точной температуры протекания реакции не является принципиальным для данного изобретения. Предпочтительная температура протекания реакции будет зависеть от таких факторов, как природа растворителя и исходный продукт и применяемый реагент. Однако, как правило, авторы заявки считают удобным проведение реакции при температуре от 0 до 150oC. Время, необходимое для протекания реакции, также может широко варьировать в зависимости от множества факторов, особенно от температуры протекания реакции и от природы применяемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, изложенных выше, достаточным обычно является промежуток времени от 10 минут до 24 часов. Способ G Он описывает получение соединения формулы (I), в котором по крайней мере один из m и n равен 1 или 2, то есть соединения формулы (Ig), из соединения формулы, в которой как m, так и n равны нулю, то есть соединения формулы (Ig’). Схема реакции G приведена в конце описания. Стадия G1 На данной стадии дитиолановое производное формулы (Ig) получают путем окисления соединения формулы (Ig’) [соединения формулы (I), где n и m равны 0]. Особого ограничения на природу применяемых окислителей не существует, и здесь с одинаковым успехом может быть применен любой окислитель, обычно применяемый в реакциях данного типа, при условии, что он способен окислить сульфид до сульфоксида или сульфона. Примеры таких окислителей включают: гидропероксиды, такие как пероксид водорода, трет-бутилгидропероксид или пентилгидропероксид; диалкилпероксиды, такие как ди-трет-бутилпероксид; надкислоты, такие как надбензойная кислота, м- хлорнадбензойная кислота или надуксусная кислота; эфиры надкислот, такие как метилнадбензоат; и диацилпероксиды, такие как бензоилпероксид. Из них авторы заявки считают особенно предпочтительными пероксид водорода, м-хлорнадбензойную кислоту или трет-бутилгидропероксид. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Особого ограничения на природу применяемого растворителя не существует при условии, что он не оказывает нежелательного воздействия на течение реакции или на применяемые реагенты и что реагенты могут быть в нем растворены, по крайней мере в некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; нитрилы, такие как ацетонитрил, пропионитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и гексаметилфосфорный триамид; сульфоксиды, такие как диметилсульфоксид; сульфоны, такие как сульфолан; спирты, такие как метанол и этанол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; и воду. Из них авторы заявки считают предпочтительными ароматические углеводороды, галогенированные углеводороды, кетоны, амиды, спирты и воду, более предпочтительно галогенированные углеводороды, кетоны, амиды, спирты и воду. Реакция может протекать в пределах широкого температурного интервала, и выбор точной температуры протекания реакции не является принципиальным для данного изобретения. Предпочтительная температура протекания реакции будет зависеть от таких факторов, как природа растворителя и исходный продукт и применяемый реагент. Однако, как правило, авторы заявки считают удобным проведение реакции при температуре от -50 до 100oC, более предпочтительно от -20 до 50oC. Время, необходимое для протекания реакции, также может широко варьировать в зависимости от множества факторов, особенно от температуры протекания реакции и от природы применяемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, изложенных выше, достаточным обычно является промежуток времени от 10 минут до 2 суток, более предпочтительно от 30 минут до 12 часов. По завершении каждой из указанных выше реакций желаемое соединение может быть выделено из реакционной смеси в соответствии с традиционными методиками. Например, желаемое соединение может быть получено с помощью: адекватной нейтрализации реакционной смеси; удаления нерастворимых веществ путем фильтрования в случае, если присутствуют нерастворимые вещества; добавления в реакционную смесь несмешивающегося с водой органического растворителя, такого как этилацетат; промывания водой или иным подходящим растворителем; отделения органического слоя, содержащего желаемое соединение; его сушки над осушителем, таким как безводный сульфат натрия или безводный сульфат магния; и удаления растворителя, например путем выпаривания. Полученное таким образом соединение при необходимости может быть выделено и очищено путем адекватного комбинирования традиционных методик, например перекристаллизации, переосаждения или иных методик выделения, широко применяемых для очистки органических соединений, например, с помощью адсорбционной колоночной хроматографии, применяя такой носитель, как силикагель, глинозем или магниевый силикагель типа Florisil; методики с применением синтетического адсорбента, такую как распределительная колоночная хроматография с применением такого носителя, как Sephadex LH-20 – (торговая марка, производимая Pharmacia Co. , Ltd.), Amberlite XAD-11 (торговая марка, производимая Rohm and Haas Co. Ltd.) и Diaion HP-20 (торговая марка, производимая Mitsubishi Kasei Corporation), методика с применением ионообменной хроматографии, или нормально-фазовая или обращенно-фазовая колоночная хроматография с применением силикагеля или алкилированного силикагеля (предпочтительно, жидкостная хроматография высокого разрешения), и элюирование подходящим элюентом. Исходные материалы в способах A-G являются известными соединениями или являются соединениями, синтезируемыми из известных соединений в соответствии с традиционными методиками. Например, аминное производное формулы (Ih), которое является, исходным продуктом в способе A, cпособе C и способе F, может быть получено в соответствии со способом H (см. в конце описания). Стадия H1 На данной стадии фталимидное производное формулы (XVI) получают путем проведения реакции Mitsunobu между соединением формулы (XIV) и фталимидом формулы (XV). Особого ограничения на природу применяемых в реакции Mitsunobu реагентов не существует, и здесь с одинаковым успехом может быть применен любой реагент, обычно применяемый в реакциях данного типа. Примеры таких реагентов включают: комбинацию азосоединения, такого как ди-(низший алкил) азодикарбоксилат (например, диметилазодикарбоксилат, диэтилазодикарбоксилат или диизопропилазодикарбоксилат) или азодикарбоксамида [такого как 1,1′-(азодикарбонил)дипиперидин] и фосфина, такого как триарилфосфин (например, трифенилфосфин) или три-(низший алкил) фосфин (например, трибутилфосфин), более конкретно, комбинацию ди-(низший алкил) азодикарбоксилата и триарилфосфина, наиболее предпочтительно комбинацию диметилазодикарбоксилата и трифенилфосфина. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Особого ограничения на природу применяемого растворителя не существует при условии, что он не оказывает нежелательного воздействия на течение реакции или на применяемые реагенты и что реагенты могут быть в нем растворены, по крайней мере в некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил, пропионитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N- метилпирролидинон и гексаметилфосфорный триамид; и сульфоксиды, такие как диметилсульфоксид и сульфолан. Из них авторы заявки считают предпочтительными ароматические углеводороды и простые эфиры. Реакция может протекать в пределах широкого температурного интервала, и выбор точной температуры протекания реакции не является принципиальным для данного изобретения. Предпочтительная температура протекания реакции будет зависеть от таких факторов, как природа растворителя и исходный продукт и применяемый реагент. Однако, как правило, авторы заявки считают удобным проведение реакции при температуре от -20 до 100oC, более предпочтительно от 0 до 50oC. Время, необходимое для протекания реакции, также может широко варьировать в зависимости от множества факторов, особенно от температуры протекания реакции и от природы применяемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, изложенных выше, достаточным обычно является промежуток времени от 10 минут до 3 суток, более предпочтительно от 30 минут до 12 часов. Стадия H2 На данной стадии аминовое производное формулы (Ih) получают путем взаимодействия фталимидного производного формулы (XVI) с бутиламином или гидразином в растворителе. Например, это может быть выполнено путем взаимодействия фталимидного производного формулы (XVI) с бутиламином в метаноле при комнатной температуре в течение 6 часов. Поскольку дитиолановые производные оказывают эффект, заключающийся в повышении активности глутатионредуктазы, композиция, которая повышает активность глутатионредуктазы, содержащая данные соединения или их фармацевтически приемлемые соли, может быть применена для предупреждения или лечения заболеваний, являющихся результатом оксидативного стресса. Примерами заболеваний, являющихся результатом оксидативного стресса, являются заболевания или патологические состояния, в том числе поражения, вызванные злоупотреблением алкоголем, воздействия ксенобиотиков, или лучевое поражение; оксидативные состояния в клетке, вызванные заболеваниями печени; интоксикация лекарственными средствами и химическими агентами (например, карциностатическими средствами, включая хелатные комплексы платины, антибиотиками, антипаразитарными средствами, paraquat, четыреххлористым углеродом и галотаном); отравление тяжелыми металлами; заболевания нервной системы, включая дегенеративные состояния головного мозга и нейронов (например, ишемия мозга, инфаркт головного мозга, гипогликемия, эпилептические припадки, боковой амиотрофический склероз, болезнь Альцгеймера, болезнь Паркинсона и хорея Гентингтона); заболевания, связанные с изменением функционирования иммунной системы, в частности, возникшим в результате иммунотерапии опухоли; бесплодие, в частности бесплодие у мужчин; ишемическая болезнь сердца; глазные болезни, такие как катаракта, ретролетальная фиброплазия и сидероз; заболевания легких, такие как идиопатический пневмосклероз, респираторный дистресс-синдром у взрослых, эмфизема, бронхиальная астма, бронхолегочная дисплазия и интерстициальный пневмосклероз; хроническая почечная недостаточность; язвенная болезнь желудка; малигнизация и метастазирование злокачественной опухоли, включая злокачественные опухоли толстой и прямой кишок; сахарный диабет; некроз и апоптоз гепатоцитов, включая этанол-индуцированную гепатопатию; вирусные инфекционные заболевания, включая грипп, гепатит В и ВИЧ-инфекцию; нарушения в системе крови или кровеносных сосудов, такие как синдром Фанкони, септицемия, повышенная проницаемость кровеносных сосудов и адгезия лейкоцитов; различные пороки развития, такие как синдром Дауна, миопатия Дюшенна, облитерирующая кардиомиопатия, синдром Дубина-Джонсона и примахиновая анемия; и воспалительные заболевания, такие как нефрит, панкреатит, дерматит синдром усталости, ревматизм. Особенно, дитиолановые производные и их фармацевтически приемлемые соли по настоящему изобретению могут быть применены для предупреждения или лечения заболеваний или патологических состояний, таких как поражения, вызванные радиацией, оксидативные состояния в клетке, вызванные заболеваниями печени, интоксикация (т.е. побочный эффект) карциностатическими средствами, включая хелатные комплексы платины, заболевания нервной системы, катаракта, сахарный диабет, некроз и апоптоз гепатоцитов, вирусные инфекционные заболевания и воспалительные заболевания. Среди описанных выше заболеваний, являющихся результатом оксидативного стресса, присутствуют некоторые заболевания, где, однажды развившись, эффекты являются необратимыми. Терапевтическое средство, применяемое при таком заболевании, означает лекарственный препарат, который предотвращает или замедляет развитие заболевания. Дитиолановые производные формулы (I) или их фармацевтически приемлемые соли по настоящему изобретению могут быть применены совместно с лекарственным препаратом, для которого является известным его действие в качестве профилактического средства или терапевтического средства при заболеваниях, указанных выше как заболевания, являющиеся результатом оксидативного стресса, и могут проявлять синергический эффект. Цианамид, дисульфирам, аденин и цистеин известны как лекарственные препараты для лечения поражения, вызванного злоупотреблением алкоголем, воздействия ксенобиотиков, или лучевое поражения; аминоэтилсульфоновая кислота, протопорфирин-динатрий и диизопропиламиндихлорацетат известны как лекарственные препараты для лечения оксидативных состояний в клетке, вызванных заболеваниями печени; глутатион, димеркапрол и кальцийдинатриевый эдетат (calcium disodium edetate) известны как лекарственные препараты для лечения интоксикации лекарственными средствами и химическими агентами (например, карциностатическими средствами, включая хелатные комплексы платины, антибиотиками, антипаразитарными средствами, paraquat, четыреххлористым углеродом и галотаном) или для лечения отравления тяжелыми металлами; фенобарбитал, фенитоин, бромкриптинмезилат, сульпирид, вальпроат-натрий, галоперидол, леводопа-карбидопа, идебенон и анирацетам известны как лекарственные препараты для лечения заболеваний нервной системы, включая дегенеративные состояния головного мозга и нейронов (например, ишемия головного мозга, инфаркт головного мозга, гипогликемия, эпилептические припадки, боковой амиотрофический склероз, болезнь Альцгеймера, болезнь Паркинсона и хорея Гентингтона); циклофосфамид, интерферон-  и интерферон- и интерферон- известны как лекарственные препараты для лечения заболеваний, связанные с изменением функционирования иммунной системы, в частности, возникшим в результате иммунотерапии опухоли; силденафил известен как лекарственный препарат для лечения бесплодия, в частности бесплодия у мужчин; дигитоксин и дигоксин известны как лекарственные препараты для лечения ишемической болезни сердца; пиреноксин известен как лекарственный препарат для лечения глазных болезней, таких как катаракта, ретролетальная фиброплазия и сидероз; теофиллин, кетотифенфумарат, эпинастингидрохлорид, пранлукаст и суплатасттозилат известны как лекарственные препараты для лечения заболеваний легких, таких как идиопатический пневмосклероз, респираторный дистресс-синдром у взрослых, эмфизема, бронхиальная астма, бронхолегочная дисплазия и интерстициальный пневмосклероз; фуросемид, этакриновая кислота и буметанид известны как лекарственные препараты для лечения хронической почечной недостаточности; тепренон, ребамипид, экабет-натрий, плаунотол, фамотидин, ранитидингидрохлорид и лансопразол известны как лекарственные препараты для лечения язвенной болезни желудка; ВВ-2516 и AG3340 известны как лекарственные препараты, применяющиеся при малигнизации и метастазировании злокачественной опухоли, включая злокачественные опухоли толстой и прямой кишок; эпалрестат, воглибоз, акарбоз, инсулин, глибенкламид и троглитазон известны как лекарственные препараты для лечения сахарного диабета; аминоэтилсульфоновая кислота, протопорфирин-динатрий и диизопропиламиндихлорацетат известны как лекарственные препараты для лечения состояний некроза и апоптоза гепатоцитов, включая этанол-индуцированную гепатопатию; ацикловир, зидовудин, интерферон- известны как лекарственные препараты для лечения заболеваний, связанные с изменением функционирования иммунной системы, в частности, возникшим в результате иммунотерапии опухоли; силденафил известен как лекарственный препарат для лечения бесплодия, в частности бесплодия у мужчин; дигитоксин и дигоксин известны как лекарственные препараты для лечения ишемической болезни сердца; пиреноксин известен как лекарственный препарат для лечения глазных болезней, таких как катаракта, ретролетальная фиброплазия и сидероз; теофиллин, кетотифенфумарат, эпинастингидрохлорид, пранлукаст и суплатасттозилат известны как лекарственные препараты для лечения заболеваний легких, таких как идиопатический пневмосклероз, респираторный дистресс-синдром у взрослых, эмфизема, бронхиальная астма, бронхолегочная дисплазия и интерстициальный пневмосклероз; фуросемид, этакриновая кислота и буметанид известны как лекарственные препараты для лечения хронической почечной недостаточности; тепренон, ребамипид, экабет-натрий, плаунотол, фамотидин, ранитидингидрохлорид и лансопразол известны как лекарственные препараты для лечения язвенной болезни желудка; ВВ-2516 и AG3340 известны как лекарственные препараты, применяющиеся при малигнизации и метастазировании злокачественной опухоли, включая злокачественные опухоли толстой и прямой кишок; эпалрестат, воглибоз, акарбоз, инсулин, глибенкламид и троглитазон известны как лекарственные препараты для лечения сахарного диабета; аминоэтилсульфоновая кислота, протопорфирин-динатрий и диизопропиламиндихлорацетат известны как лекарственные препараты для лечения состояний некроза и апоптоза гепатоцитов, включая этанол-индуцированную гепатопатию; ацикловир, зидовудин, интерферон- , интерферон- , интерферон- и интерферон- и интерферон- известны как лекарственные препараты для лечения вирусных инфекционных заболеваний, включая грипп, гепатит В и ВИЧ-инфекцию; производные эритропоэтина известны как лекарственные препараты для лечения нарушений в системе крови или кровеносных сосудов, такие как синдром Фанкони, септицемия, повышенная проницаемость кровеносных сосудов и адгезия лейкоцитов; фенипентол, камостатмезилат, индометацин, локсопрофен-натрий и диклофенак-натрий известны как лекарственные препараты для лечения воспалительных заболеваний, таких как нефрит, панкреатит, дерматит, синдром усталости и ревматизм.
Соединения по настоящему изобретению могут быть введены в любом традиционном фармацевтическом составе, природа которых будет зависеть от конкретного пациента и назначенного пути введения. Например, в случае перорального введения подходящие составы включают таблетки, капсулы, гранулы, порошки или сиропы. В случае парентерального введения подходящие составы включают инъекции или суппозитории. Данные составы могут быть приготовлены в соответствии с хорошо известными методиками с применением добавок, таких как наполнители, смазывающие вещества, связывающие вещества, дезинтеграторы, стабилизаторы, корригенты и разбавители.
Примеры подходящих наполнителей включают органические наполнители, например: производные сахаров, такие как лактоза, сахароза, глюкоза, маннит или сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, известны как лекарственные препараты для лечения вирусных инфекционных заболеваний, включая грипп, гепатит В и ВИЧ-инфекцию; производные эритропоэтина известны как лекарственные препараты для лечения нарушений в системе крови или кровеносных сосудов, такие как синдром Фанкони, септицемия, повышенная проницаемость кровеносных сосудов и адгезия лейкоцитов; фенипентол, камостатмезилат, индометацин, локсопрофен-натрий и диклофенак-натрий известны как лекарственные препараты для лечения воспалительных заболеваний, таких как нефрит, панкреатит, дерматит, синдром усталости и ревматизм.
Соединения по настоящему изобретению могут быть введены в любом традиционном фармацевтическом составе, природа которых будет зависеть от конкретного пациента и назначенного пути введения. Например, в случае перорального введения подходящие составы включают таблетки, капсулы, гранулы, порошки или сиропы. В случае парентерального введения подходящие составы включают инъекции или суппозитории. Данные составы могут быть приготовлены в соответствии с хорошо известными методиками с применением добавок, таких как наполнители, смазывающие вещества, связывающие вещества, дезинтеграторы, стабилизаторы, корригенты и разбавители.
Примеры подходящих наполнителей включают органические наполнители, например: производные сахаров, такие как лактоза, сахароза, глюкоза, маннит или сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал,  -крахмал, декстрин или карбоксиметилкрахмал; производные целлюлозы, такие как кристаллическая целлюлоза, низкозамещенная гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, карбоксиметилцеллюлоза-кальций или поперечно-сшитая карбоксиметилцеллюлоза-натрий; гуммиарабик; декстран; и пуллюлан; неорганические наполнители, включая производные кремния, такие как ангидрид кремниевой кислоты, синтетический алюмосиликат или магниевый алюминат мета-кремниевой кислоты; фосфаты, такие как фосфат кальция; карбонаты, такие как карбонат кальция; и сульфаты, такие как сульфат кальция.
Примеры подходящих смазывающих веществ включают стеариновую кислоту, стеараты металлов, такие как стеарат кальция или стеарат магния; тальк; коллоидный силикагель; воски, такие как пчелиный воск или спермацет; борная кислота; адипиновая кислота; сульфаты, такие как сульфат натрия; гликоль; фумаровая кислота; бензоат натрия; DL-лейцин; натриевые соли жирных кислот; лаурилсульфаты, такие как лаурилсульфат натрия или лаурилсульфат магния; силикаты, такие как ангидрид кремниевой кислоты или гидрат кремниевой кислоты; и указанные выше производные крахмала.
Примеры подходящих связывающих веществ включают поливинилпирролидон, Macrogol и соединения, сходные с описанными выше наполнителями.
Примеры подходящих дезинтеграторов включают соединения, сходные с описанными выше наполнителями; и химически модифицированные крахмалы или целлюлозы, такие как кросскармелоза-натрий, карбоксиметилкрахмал-натрий или сшитый поливинилпирролидон.
Примеры подходящих стабилизаторов включают параоксибензоаты, такие как метилпарабен или пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт или фенилэтиловый спирт; хлорид бензалкония; фенолы, такие как фенол или крезол; тимерозал; дегидроуксусная кислота; и сорбиновая кислота.
Примеры подходящих корригентов включают подсластители, уксус или ароматизаторы, такие как традиционно применяемые.
Более того, поскольку дитиолановое производное или его фармацевтически приемлемая соль по настоящему изобретению оказывает раздражающее действие на глаза в меньшей степени, оно может быть нанесено на глаза местно. Подходящие составы для местного нанесения на глаза включают растворы, суспензии, гели, мази и агенты, содержащие твердые включения.
Состав данных композиций для местного введения может содержать дитиолановое производное или его фармацевтически приемлемую соль в концентрации от 0,001% (предпочтительно, 0,01%) как нижний предел до 10% (предпочтительно, 5%) как высший предел.
При желании фармацевтический состав, содержащий активное соединение, может быть смешан с нетоксичным неорганическим или органическим носителем для изготовления фармацевтических препаратов.
Типичные фармацевтически приемлемые носители включают воду, смесь воды и смешивающегося с водой растворителя, такого как низший алканол или аралканол, растительное масло, полиалкиленгликоль, студень с применением вазелина в качестве основного материала, этилцеллюлозу, этилолеат, карбоксиметилцеллюлозу, поливинилпирролидон, изопропилмиристат и иные приемлемые носители, которые могут быть предпочтительно применены. Состав может содержать нетоксичные вспомогательные вещества, такие как эмульгатор, консервант, смачивающий агент и наполнитель, например полиэтиленгликоли 200, 300, 400 и 600, карбовоски 1000, 1500, 4000, 6000 и 10000, эфиры п-гидроксибензойной кислоты, такие как метил п-гидроксибензоат или пропил п-гидроксибензоат, четвертичное аммониевое соединение (например, хлорид бензэтония или хлорид бензалкония), которые известны как соединения, обладающие противогрибковыми свойствами при низких температурах и которые являются нетоксичными при применении, противогрибковое средство, такое как ртуть содержащая соль фенила, буферный компонент, такой как тимерозал, метил- и пропилпарабен, бензиловый спирт, фенилэтанол, хлорид натрия, борат натрия и ацетат натрия, буферный агент на основе глюконовой кислоты и сорбитмонолаурат, триэтаноламин, полиоксиэтиленсорбитмонопальмитат, диоктилсульфосукцинат натрия, монотиоглицерин, тиосорбит и этилендиаминтетрауксусная кислота.
Наполнители для составов офтальмологического назначения могут быть применены в качестве желаемой поддерживающей среды для соединений по настоящему изобретению, и примеры включают обычные буферные наполнители на основе фосфорной кислоты (например, натрий-фосфатный буфер или калий-фосфатный буфер), изотонические наполнители на основе борной кислоты, изотонические наполнители на основе хлорида натрия и изотонические наполнители на основе бората натрия.
В качестве дальнейшей альтернативы, фармацевтический состав может иметь форму твердого включения, которое остается почти неизменным после введения состава, или оно может быть также приготовлено в виде распадающегося включения, которое растворяется в слезной жидкости или которое разрушается иным образом.
Доза дитиоланового производного формулы (I) или его фармацевтически приемлемые соли по настоящему изобретению будет варьировать в зависимости от состояния и возраста пациента и формы и пути введения. Однако, например, в случае перорального введения, применительно к взрослым людям-пациентам, желательным является ежесуточное введение от 0,1 мг (предпочтительно, 1 мг) как нижний предел до 10000 мг (предпочтительно, 5000 мг) как высший предел. В случае внутривенного введения желательным является ежесуточное введение от 0,01 мг (предпочтительно, 0,1 мг) как нижний предел до 5000 мг (предпочтительно, 2000 мг) как высший предел. В случае местного нанесения на глаза желательным является ежесуточное введение от 0,001 мг (предпочтительно, 0,01 мг) как нижний предел до 500 мг (предпочтительно, 200 мг) как высший предел. Каждая из указанных выше доз может быть введена в виде разовой дозы или в виде разделенных доз. Размер доз и схема введения лекарственного препарата будет зависеть от состояния пациента.
Фармацевтические препараты по настоящему изобретению проиллюстрированы следующими неограничивающими примерами составов.
Пример состава 1 -крахмал, декстрин или карбоксиметилкрахмал; производные целлюлозы, такие как кристаллическая целлюлоза, низкозамещенная гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, карбоксиметилцеллюлоза-кальций или поперечно-сшитая карбоксиметилцеллюлоза-натрий; гуммиарабик; декстран; и пуллюлан; неорганические наполнители, включая производные кремния, такие как ангидрид кремниевой кислоты, синтетический алюмосиликат или магниевый алюминат мета-кремниевой кислоты; фосфаты, такие как фосфат кальция; карбонаты, такие как карбонат кальция; и сульфаты, такие как сульфат кальция.
Примеры подходящих смазывающих веществ включают стеариновую кислоту, стеараты металлов, такие как стеарат кальция или стеарат магния; тальк; коллоидный силикагель; воски, такие как пчелиный воск или спермацет; борная кислота; адипиновая кислота; сульфаты, такие как сульфат натрия; гликоль; фумаровая кислота; бензоат натрия; DL-лейцин; натриевые соли жирных кислот; лаурилсульфаты, такие как лаурилсульфат натрия или лаурилсульфат магния; силикаты, такие как ангидрид кремниевой кислоты или гидрат кремниевой кислоты; и указанные выше производные крахмала.
Примеры подходящих связывающих веществ включают поливинилпирролидон, Macrogol и соединения, сходные с описанными выше наполнителями.
Примеры подходящих дезинтеграторов включают соединения, сходные с описанными выше наполнителями; и химически модифицированные крахмалы или целлюлозы, такие как кросскармелоза-натрий, карбоксиметилкрахмал-натрий или сшитый поливинилпирролидон.
Примеры подходящих стабилизаторов включают параоксибензоаты, такие как метилпарабен или пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт или фенилэтиловый спирт; хлорид бензалкония; фенолы, такие как фенол или крезол; тимерозал; дегидроуксусная кислота; и сорбиновая кислота.
Примеры подходящих корригентов включают подсластители, уксус или ароматизаторы, такие как традиционно применяемые.
Более того, поскольку дитиолановое производное или его фармацевтически приемлемая соль по настоящему изобретению оказывает раздражающее действие на глаза в меньшей степени, оно может быть нанесено на глаза местно. Подходящие составы для местного нанесения на глаза включают растворы, суспензии, гели, мази и агенты, содержащие твердые включения.
Состав данных композиций для местного введения может содержать дитиолановое производное или его фармацевтически приемлемую соль в концентрации от 0,001% (предпочтительно, 0,01%) как нижний предел до 10% (предпочтительно, 5%) как высший предел.
При желании фармацевтический состав, содержащий активное соединение, может быть смешан с нетоксичным неорганическим или органическим носителем для изготовления фармацевтических препаратов.
Типичные фармацевтически приемлемые носители включают воду, смесь воды и смешивающегося с водой растворителя, такого как низший алканол или аралканол, растительное масло, полиалкиленгликоль, студень с применением вазелина в качестве основного материала, этилцеллюлозу, этилолеат, карбоксиметилцеллюлозу, поливинилпирролидон, изопропилмиристат и иные приемлемые носители, которые могут быть предпочтительно применены. Состав может содержать нетоксичные вспомогательные вещества, такие как эмульгатор, консервант, смачивающий агент и наполнитель, например полиэтиленгликоли 200, 300, 400 и 600, карбовоски 1000, 1500, 4000, 6000 и 10000, эфиры п-гидроксибензойной кислоты, такие как метил п-гидроксибензоат или пропил п-гидроксибензоат, четвертичное аммониевое соединение (например, хлорид бензэтония или хлорид бензалкония), которые известны как соединения, обладающие противогрибковыми свойствами при низких температурах и которые являются нетоксичными при применении, противогрибковое средство, такое как ртуть содержащая соль фенила, буферный компонент, такой как тимерозал, метил- и пропилпарабен, бензиловый спирт, фенилэтанол, хлорид натрия, борат натрия и ацетат натрия, буферный агент на основе глюконовой кислоты и сорбитмонолаурат, триэтаноламин, полиоксиэтиленсорбитмонопальмитат, диоктилсульфосукцинат натрия, монотиоглицерин, тиосорбит и этилендиаминтетрауксусная кислота.
Наполнители для составов офтальмологического назначения могут быть применены в качестве желаемой поддерживающей среды для соединений по настоящему изобретению, и примеры включают обычные буферные наполнители на основе фосфорной кислоты (например, натрий-фосфатный буфер или калий-фосфатный буфер), изотонические наполнители на основе борной кислоты, изотонические наполнители на основе хлорида натрия и изотонические наполнители на основе бората натрия.
В качестве дальнейшей альтернативы, фармацевтический состав может иметь форму твердого включения, которое остается почти неизменным после введения состава, или оно может быть также приготовлено в виде распадающегося включения, которое растворяется в слезной жидкости или которое разрушается иным образом.
Доза дитиоланового производного формулы (I) или его фармацевтически приемлемые соли по настоящему изобретению будет варьировать в зависимости от состояния и возраста пациента и формы и пути введения. Однако, например, в случае перорального введения, применительно к взрослым людям-пациентам, желательным является ежесуточное введение от 0,1 мг (предпочтительно, 1 мг) как нижний предел до 10000 мг (предпочтительно, 5000 мг) как высший предел. В случае внутривенного введения желательным является ежесуточное введение от 0,01 мг (предпочтительно, 0,1 мг) как нижний предел до 5000 мг (предпочтительно, 2000 мг) как высший предел. В случае местного нанесения на глаза желательным является ежесуточное введение от 0,001 мг (предпочтительно, 0,01 мг) как нижний предел до 500 мг (предпочтительно, 200 мг) как высший предел. Каждая из указанных выше доз может быть введена в виде разовой дозы или в виде разделенных доз. Размер доз и схема введения лекарственного препарата будет зависеть от состояния пациента.
Фармацевтические препараты по настоящему изобретению проиллюстрированы следующими неограничивающими примерами составов.
Пример состава 1Порошок 5 г N-[5-(1,2-дитиолан-3-ил)пентаноил]метансульфонамида (соединение из примера 2 далее), 895 г лактозы и 100 г кукурузного крахмала смешивают с помощью смесителя с получением порошка. Пример состава 2 Гранулы 5 г N-[5-(1,2-дитиолан-3-ил)пентаноил]сульфамида (соединение из примера 7 далее), 865 г лактозы и 100 г низкозамещенной гидроксипропилцеллюлозы смешивают. Затем к смеси добавляют 300 г 10% (м/о) водного раствора гидроксипропилцеллюлозы и затем полученную смесь перемешивают. Затем смесь гранулируют с помощью экструдера-гранулятора, после чего ее сушат с получением состава в виде гранул. Пример состава 3 Капсулы 5 г N-[4-(1,2-дитиолан-3-ил)бутил]-N’-метилмочевины (соединение из примера 8 далее), 115 г лактозы, 58 г кукурузного крахмала и 2 г стеарата магния смешивают, применяя V-образный смеситель. Затем 180 г смеси инкапсулируют в капсулы N 3 с получением состава в виде капсул. Пример состава 4 Таблетки 5 г (R)-N-[5-(1,2-дитиолан-3-ил)пентаноил]метансульфонамида (соединение из примера 40 далее), 90 г лактозы, 34 г кукурузного крахмала, 20 г кристаллической целлюлозы и 1 г стеарата магния смешивают с помощью смесителя. Смесь затем таблетируют с помощью таблетировочной машины с получением таблеток. Пример состава 5 Глазные капли Смешивают следующие компоненты: (R)-N-[5-(1,2-дитиолан-3-ил)пентаноил] метансульфонамид (соединение из примера 40) – 0,2 г Двузамещенный фосфат натрия – 0,716 г Однозамещенный фосфат натрия – 0,728 г Хлорид натрия – 0,400 г Метил п-гидроксибензоат – 0,026 г Пропил п-гидроксибензоат – 0,014 г Стерилизованная очищенная вода – q.s. Гидроксид натрия – q.s. Общий объем – 100 мл Значение pH смеси доводили до 7,0 и готовили глазные капли в соответствии с традиционной методикой. Пример состава 6 Глазные капли Смешивают следующие компоненты: (R)-N-[5-(1,2-дитиолан-3-ил)пентаноил] метансульфонамид (соединение из примера 40) – 0,2 г Двузамещенный фосфат натрия – 0,716 г Однозамещенный фосфат натрия – 0,728 г Хлорид натрия – 0,400 г Метил п-гидроксибензоат – 0,026 г Пропил п-гидроксибензоат – 0,014 г Стерилизованная очищенная вода – q.s. Аскорбиновая кислота – q.s. Гидроксид натрия – q.s. Общий объем – 100 мл Значение pH смеси доводили до 7,0 и готовили глазные капли в соответствии с традиционной методикой. Биологическая активность Биологическая активность соединений по настоящему изобретению проиллюстрирована следующими примерами тестов. Пример теста 1 Измерение активности глутатионредуктазы (а) Культура клеток из ткани хрусталика Экспериментальные животные представляли собой самцов крыс SD в возрасте от 6 до 8 недель (поставщик: Nippon SLC). Животных умерщвляли путем удушения с помощью вдыхания диоксида углерода. Затем иссекали оба глазных яблока каждого животного. На склере тыльной стороны глазных яблок делали разрез и затем иссекали стекловидное тело и радужную оболочку – ресничное тело с последующим иссечением хрусталика. Каждый полученный таким образом хрусталик культивировали путем погружения в 3 мл культурального раствора, описанного ниже, в 6-луночном планшете для культивирования клеток ткани (FALCON). Культивирование проводили в течение 72 часов в CO2-инкубаторе, в котором поддерживали температуру 37oC и влажность 100% в присутствии 5% CO2 в атмосфере (в воздухе). В качестве контрольного культурального раствора применяли среду 199 (Gibco), содержащую пенициллин (20 единиц/мл) и стрептомицин (20 мкг/мл). Опытный культуральный раствор содержал тестируемое соединение, добавленное к указанному выше культуральному раствору. Культивируемые хрусталики хранили замороженными до начала теста. (б) Измерение активности глутатионредуктазы После гомогенизации каждого замороженного крысиного хрусталика в 2 мл дистиллированной воды полученный гомогенат разделяли с помощью центрифугирования (10000 g, 20 минут), после чего полученный супернатант применяли в качестве ферментативного образца. 400 мкл ферментативного образца добавляли к 0,6 мл фосфатного буфера, содержащего 1 мМ окисленной формы глутатиона (GSSG) и 100 мкМ NADPH. После того как реакция в смеси протекала при 25oC в течение 6 минут, измеряли поглощение реакционной смеси (при 340 нм: т.е. ОП340нм). Разность (  ОП340нм) между значением ОП340нм до реакции и значения ОП340нм по завершении реакции применяли как индикатор активности глутатионредуктазы.
Результаты по соединению из примера 2 показаны в таблице 4.
Дитиолановые производные по настоящему изобретению проявляли отличный усиливающий эффект на активность глутатионредуктазы.
Пример теста 2 ОП340нм) между значением ОП340нм до реакции и значения ОП340нм по завершении реакции применяли как индикатор активности глутатионредуктазы.
Результаты по соединению из примера 2 показаны в таблице 4.
Дитиолановые производные по настоящему изобретению проявляли отличный усиливающий эффект на активность глутатионредуктазы.
Пример теста 2Тест на антикатарактную активность Экспериментальные животные представляли собой самцов крыс SD в возрасте 6 недель (поставщик: Nippon SLC). Животных умерщвляли путем удушения с помощью вдыхания диоксида углерода. Затем иссекали оба глазных яблока каждого животного. Иссеченные хрусталики культивировали при температуре 37oС в течение 24 часов в среде 199 (Gibco), содержащей 0,05 мг/мл тестируемого соединения и 5 мМ пероксид водорода. Для контрольного теста иссеченные хрусталики культивировали при температуре 37oС в течение 24 часов в нормальной культуральной жидкости (среда 199, Gibco) или в среде 199 (Gibco), содержащей 5 мМ пероксид водорода. После культивирования в течение 24 часов хрусталики промывали физиологическим раствором. Влагу на поверхности удаляли путем помещения хрусталиков на лист фильтровальной бумаги и затем хрусталики помещали на предметное стекло, после чего измеряли мутность хрусталика с помощью стереомикроскопа от “-” (степень мутности хрусталика, культивируемого в нормальной культуральной среде) до “++++” (степень мутности хрусталика, культивируемого в среде, содержащей пероксид водорода). Результаты показаны в таблице 5. Как можно заметить из приведенных выше результатов, соединения по настоящему изобретению существенно снижают непрозрачность хрусталика. ПРИМЕРЫ Далее настоящее изобретение проиллюстрировано по отношению к следующим неограничивающим Примерам. Пример 1 N-ацетил-  -тиоктамид -тиоктамид(Соединение N 1-271)  Смесь 0,76 г D,L-  -тиоктамида, 1,5 г уксусного ангидрида и 10 мл пиридина нагревали с обратным холодильником в течение 20 часов. Пиридин затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления и затем к остатку добавляли воду, который затем экстрагировали добавлением этилацетата. Экстракт дважды промывали водой и сушили над безводным сульфатом магния. 0,76 г сырого продукта, полученного путем выпаривания растворителя в условиях пониженного давления очищали по методу колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь гексан – этилацетат в качестве элюента с получением 0,45 г 3-(4-цианобутил)-1,2-дитиолана (обладающего значением Rf, равным 0,84 [тонкослойная хроматография на силикагеле с применением 1: 1 (по объему) смеси гексан : этилацетат в качестве проявляющего растворителя)], в виде первого компонента и 0,17 г указанного в заголовке соединения, имеющего точку плавления от 67 до 69oC в виде второго компонента.
Пример 2 -тиоктамида, 1,5 г уксусного ангидрида и 10 мл пиридина нагревали с обратным холодильником в течение 20 часов. Пиридин затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления и затем к остатку добавляли воду, который затем экстрагировали добавлением этилацетата. Экстракт дважды промывали водой и сушили над безводным сульфатом магния. 0,76 г сырого продукта, полученного путем выпаривания растворителя в условиях пониженного давления очищали по методу колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь гексан – этилацетат в качестве элюента с получением 0,45 г 3-(4-цианобутил)-1,2-дитиолана (обладающего значением Rf, равным 0,84 [тонкослойная хроматография на силикагеле с применением 1: 1 (по объему) смеси гексан : этилацетат в качестве проявляющего растворителя)], в виде первого компонента и 0,17 г указанного в заголовке соединения, имеющего точку плавления от 67 до 69oC в виде второго компонента.
Пример 2N-[5-(1,2-Дитиолан-3-ил)пентаноил]метансульфонамид (Соединение N 1-496)  (а) 0,88 г гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) промывали гексаном и к дисперсии добавляли при комнатной температуре 20 мл диметилформамида и 1,96 г метансульфонамида. Полученную смесь подвергали обработке ультразвуком в течение трех часов и затем выдерживали при комнатной температуре в течение ночи с получением реакционной смеси (A). Отдельно от этого 2,06 г D,L-  -липоевой кислоты растворяли в 20 мл диметилформамида и к раствору на ледяной бане добавляли 1,63 г N,N’-карбонилдиимидазола. Полученную смесь затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени реакционную смесь по каплям при комнатной температуре добавляли к указанной выше реакционной смеси (A) и смесь перемешивали в течение 7 часов. Реакционную смесь затем нагревали до 130oC в течение 3 часов, после чего ей давали охладиться и затем вливали в смесь воды со льдом. К смеси добавляли разбавленную водную соляную кислоту для доведения значения pH до 5 и смесь экстрагировали этилацетатом. Экстракт трижды промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель затем удаляли путем перегонки в условиях пониженного давления и полученный остаток очищали методом колоночной хроматографии на силикагеле, применяя 4:1 (по объему) смесь этилацетат : гексан, а затем чистый этилацетат, в качестве элюента, с получением 0,12 г указанного в заголовке соединения, имеющего точку плавления от 87 до 88oC.
(б) 25,0 г D,L- -липоевой кислоты растворяли в 20 мл диметилформамида и к раствору на ледяной бане добавляли 1,63 г N,N’-карбонилдиимидазола. Полученную смесь затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени реакционную смесь по каплям при комнатной температуре добавляли к указанной выше реакционной смеси (A) и смесь перемешивали в течение 7 часов. Реакционную смесь затем нагревали до 130oC в течение 3 часов, после чего ей давали охладиться и затем вливали в смесь воды со льдом. К смеси добавляли разбавленную водную соляную кислоту для доведения значения pH до 5 и смесь экстрагировали этилацетатом. Экстракт трижды промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель затем удаляли путем перегонки в условиях пониженного давления и полученный остаток очищали методом колоночной хроматографии на силикагеле, применяя 4:1 (по объему) смесь этилацетат : гексан, а затем чистый этилацетат, в качестве элюента, с получением 0,12 г указанного в заголовке соединения, имеющего точку плавления от 87 до 88oC.
(б) 25,0 г D,L- -липоевой кислоты растворяли в 500 мл безводного диметилформамида и к раствору на ледяной бане добавляли 21,57 г N,N’-карбонилдиимидазола, после чего полученную смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. Затем к реакционной смеси на ледяной бане добавляли 12,65 г -липоевой кислоты растворяли в 500 мл безводного диметилформамида и к раствору на ледяной бане добавляли 21,57 г N,N’-карбонилдиимидазола, после чего полученную смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. Затем к реакционной смеси на ледяной бане добавляли 12,65 гметансульфонамида и 5,80 г гидрида натрия (в виде 55% по массе дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 4 часов и затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли путем перегонки в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1: 1, 2: 1 и 3:1 (по объему) смеси этилацетат : гексан в качестве элюента с получением 19,85 г указанного в заголовке соединения, имеющего точку плавления от 85 до 88oC. Пример 3 N-[5-(1-Оксо-1,2-дитиолан-3-ил)пентаноил]метансульфонамид (Соединение N 2-496) 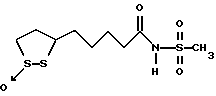 500 мг N-[5-(1,2-дитиолан-3-ил)пентаноил]метансульфонамида (полученного, как описано в Примере 2) растворяли в 10 мл ацетона и к раствору на ледяной бане добавляли 0,44 мл 31% (м/о) водного раствора пероксида водорода. Смесь перемешивали и затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени к реакционной смеси добавляли еще 0,2 мл 31% (м/о) водного раствора пероксида водорода и затем смесь перемешивали при комнатной температуре в течение 30 минут, а затем перемешивали на масляной бане при 50oC в течение 1 часа. Затем выдерживали при комнатной температуре в течение 3 суток, после чего ее перемешивали на масляной бане при 50oC в течение 10 часов; затем ее выдерживали при комнатной температуре в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 1:3 и 2:3 (по объему) смеси ацетонитрил : вода в качестве элюента. Из полученной таким образом элюированной фракции в условиях пониженного давления выпаривали растворитель и фракцию лиофилизировали с получением 0,15 г указанного в заголовке соединения (смеси диастереомеров) в виде бесцветного масла, обладающего значением Rf, равным 0,43 (тонкослойная хроматография на силикагеле с применением 10:1 (по объему) смеси этилацетат : метанол в качестве проявляющего растворителя). Пример 4 Натриевая соль N-[5-(1,2-дитиолан-3-ил)пентаноил] метансульфонамида (натриевая соль Соединения N 1-496) 750 мг N-[5-(1,2-дитиолан-3-ил)пентаноил]метан-сульфонамида (полученного, как описано в Примере 2) растворяли в 15 мл этилацетата и к смеси при комнатной температуре добавляли 482 мг 2-этилгексоата натрия. Смесь перемешивали в течение 2 часов, после чего ее выдерживали в течение 2 суток при комнатной температуре. Кристаллы, которые выпадали в осадок из реакционной смеси, собирали путем фильтрования с получением 550 мг указанного в заголовке соединения, имеющего точку плавления от 202 до 204oC. Пример 5 Этил 5-(1-оксо-1,2-дитиолан-3-ил)пентаноат и этил-5-(2-оксо- 1,2-дитиолан-3-ил)пентаноат (Соединение N 2-208 и Соединение N 3-208) 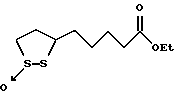 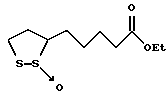 1,00 г D,L-  -липоевой кислоты растворяли в 20 мл ацетона и к раствору на бане со смесью сухой лед-ацетон добавляли 0,58 г 31% (м/о) водного раствора пероксида водорода. Смесь перемешивали в течение 2 часов и затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали добавлением этилацетата. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. К полученному таким образом остатку добавляли 16 мл безводного этанола и 4 мл 4 н. раствора хлороводорода в этилацетате и смесь перемешивали в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1, 2:1 и 3:1 (по объему) смеси этилацетат : гексан в качестве элюента с получением 0,26 г этил-5-(2-оксо- 1,2-дитиолан-3-ил)пентаноата, обладающего значением Rf, равным 0,41 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя) и 0,67 г этил 5-(1-оксо-1,2-дитиолан-3-ил)пентаноата, обладающего значением Rf, равным 0,29 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 6 -липоевой кислоты растворяли в 20 мл ацетона и к раствору на бане со смесью сухой лед-ацетон добавляли 0,58 г 31% (м/о) водного раствора пероксида водорода. Смесь перемешивали в течение 2 часов и затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали добавлением этилацетата. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. К полученному таким образом остатку добавляли 16 мл безводного этанола и 4 мл 4 н. раствора хлороводорода в этилацетате и смесь перемешивали в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1, 2:1 и 3:1 (по объему) смеси этилацетат : гексан в качестве элюента с получением 0,26 г этил-5-(2-оксо- 1,2-дитиолан-3-ил)пентаноата, обладающего значением Rf, равным 0,41 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя) и 0,67 г этил 5-(1-оксо-1,2-дитиолан-3-ил)пентаноата, обладающего значением Rf, равным 0,29 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 6N-[4-(1,2-Дитиолан-3-ил)бутил]-N’,N’-диметилмочевина (Соединение N 1-815) 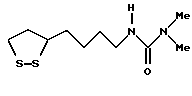 1,00 г D,L-  -липоевой кислоты растворяли в 20 мл толуола и к полученному раствору при комнатной температуре добавляли 2,00 мл триэтиламина и 1,25 мл дифенилфосфорилазида и затем смесь перемешивали на масляной бане при 80oC в течение 2 часов. Затем к реакционной смеси добавляли 0,47 г диметиламингидрохлорида и смесь перемешивали при комнатной температуре в течение 4 часов. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 20 мл безводного тетрагидрофурана и 0,52 мл 50% (по объему) водного раствора диметиламина; смесь затем выдерживали при комнатной температуре в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 9:1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане. Раствор лиофилизировали с получением 832 мг указанного в заголовке соединения, имеющего точку плавления от 52 до 53oC.
Пример 7 -липоевой кислоты растворяли в 20 мл толуола и к полученному раствору при комнатной температуре добавляли 2,00 мл триэтиламина и 1,25 мл дифенилфосфорилазида и затем смесь перемешивали на масляной бане при 80oC в течение 2 часов. Затем к реакционной смеси добавляли 0,47 г диметиламингидрохлорида и смесь перемешивали при комнатной температуре в течение 4 часов. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 20 мл безводного тетрагидрофурана и 0,52 мл 50% (по объему) водного раствора диметиламина; смесь затем выдерживали при комнатной температуре в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 9:1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане. Раствор лиофилизировали с получением 832 мг указанного в заголовке соединения, имеющего точку плавления от 52 до 53oC.
Пример 7N-[5-(1,2-Дитиолан-3-ил)пентаноил]сульфамид (Соединение N 1-539) 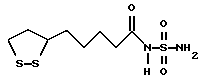 50 мг D,L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 421 мг N,N’-карбонилдиимидазола и затем смесь перемешивали при комнатной температуре в течение 3 часов. Затем к реакционной смеси на ледяной бане добавляли 461 мг сульфамида и 113 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали в течение 4 часов и затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 5-6, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток подвергали колоночной хроматографии на силикагеле, применяя 3:2, а затем 2:1 (по объему) смеси этилацетат : гексан в качестве элюента, а полученную фракцию затем перекристаллизовывали из 1:2:1 (по объему) смеси этанол : диизопропиловый эфир : гексан с получением 119 мг указанного в заголовке соединения, имеющего точку плавления от 141 до 142oC.
Пример 8 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 421 мг N,N’-карбонилдиимидазола и затем смесь перемешивали при комнатной температуре в течение 3 часов. Затем к реакционной смеси на ледяной бане добавляли 461 мг сульфамида и 113 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали в течение 4 часов и затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 5-6, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток подвергали колоночной хроматографии на силикагеле, применяя 3:2, а затем 2:1 (по объему) смеси этилацетат : гексан в качестве элюента, а полученную фракцию затем перекристаллизовывали из 1:2:1 (по объему) смеси этанол : диизопропиловый эфир : гексан с получением 119 мг указанного в заголовке соединения, имеющего точку плавления от 141 до 142oC.
Пример 8N-[4-(1,2-Дитиолан-3-ил)бутил]-N’-метилмочевина (Соединение N 1-733) 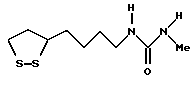 1,00 г D,L-  -липоевой кислоты растворяли в 20 мл толуола и к полученному раствору при комнатной температуре добавляли 2,00 мл триэтиламина и 1,25 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 3 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку на ледяной бане добавляли 20 мл тетрагидрофурана и 0,45 мл 40% (по объему) водного раствора метиламина и смесь перемешивали при комнатной температуре в течение 3 часов и затем выдерживали при комнатной температуре в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 20: 1 и 10: 1 (по объему) смеси этилацетат : метанол в качестве элюента с получением 425 мг указанного в заголовке соединения, имеющего точку плавления от 89 до 90oC.
Пример 9 -липоевой кислоты растворяли в 20 мл толуола и к полученному раствору при комнатной температуре добавляли 2,00 мл триэтиламина и 1,25 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 3 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку на ледяной бане добавляли 20 мл тетрагидрофурана и 0,45 мл 40% (по объему) водного раствора метиламина и смесь перемешивали при комнатной температуре в течение 3 часов и затем выдерживали при комнатной температуре в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 20: 1 и 10: 1 (по объему) смеси этилацетат : метанол в качестве элюента с получением 425 мг указанного в заголовке соединения, имеющего точку плавления от 89 до 90oC.
Пример 9N-[4-(1,2-Дитиолан-3-ил)бутил]мочевина (Соединение N 1-693) 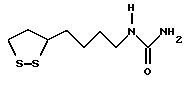 1,00 г D,L-  -липоевой кислоты растворяли в 20 мл толуола и к полученному раствору при комнатной температуре добавляли 0,80 мл триэтиламина и 1,25 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 4 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 20 мл тетрагидрофурана и 0,49 мл 28% (м/о) водного аммиака. Смесь затем перемешивали при комнатной температуре в течение 4 часов и затем выдерживали при комнатной температуре в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к смеси добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 2, после чего ее экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 10:1, 4:1 и 3:1 (по объему) смеси этилацетат : метанол в качестве элюента с получением 340 мг указанного в заголовке соединения, имеющего точку плавления от 110 до 113oC.
Пример 10 -липоевой кислоты растворяли в 20 мл толуола и к полученному раствору при комнатной температуре добавляли 0,80 мл триэтиламина и 1,25 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 4 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 20 мл тетрагидрофурана и 0,49 мл 28% (м/о) водного аммиака. Смесь затем перемешивали при комнатной температуре в течение 4 часов и затем выдерживали при комнатной температуре в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к смеси добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 2, после чего ее экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 10:1, 4:1 и 3:1 (по объему) смеси этилацетат : метанол в качестве элюента с получением 340 мг указанного в заголовке соединения, имеющего точку плавления от 110 до 113oC.
Пример 10N-[5-(1,2-Дитиолан-3-ил)пентаноил]бензолсульфонамид (Соединение N 1-457) 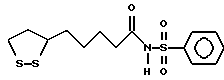 1,00 г D, L-  -липоевой кислоты растворяли в 20 мл безводного диметилформамида и к раствору на ледяной бане добавляли 0,86 г N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. К реакционной смеси на ледяной бане добавляли 0,83 г бензолсульфонамида и 0,23 г гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 2, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1: 2, 1: 1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента, а затем по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7, 1:1 и 7:3 (по объему) смеси ацетонитрил : вода в качестве элюента. Растворитель выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане. Раствор лиофилизировали с получением 0,61 г указанного в заголовке соединения, обладающего значением Rf, равным 0,51 (тонкослойная хроматография на силикагеле; с применением 2: 1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 11 -липоевой кислоты растворяли в 20 мл безводного диметилформамида и к раствору на ледяной бане добавляли 0,86 г N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. К реакционной смеси на ледяной бане добавляли 0,83 г бензолсульфонамида и 0,23 г гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 2, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1: 2, 1: 1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента, а затем по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7, 1:1 и 7:3 (по объему) смеси ацетонитрил : вода в качестве элюента. Растворитель выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане. Раствор лиофилизировали с получением 0,61 г указанного в заголовке соединения, обладающего значением Rf, равным 0,51 (тонкослойная хроматография на силикагеле; с применением 2: 1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 11Натриевая соль N-[5-(1,2-дитиолан-3-ил)пентаноил] бензолсульфонамида (натриевая соль Соединения N 1-457) 492 мг N-[5-(1,2-дитиолан-3-ил)пентаноил] бензолсульфонамида (полученного, как описано в Примере 10) растворяли в 8 мл этилацетата и 1 мл тетрагидрофурана и к смеси при комнатной температуре добавляли 283 мг 2-этилгексоата натрия. Смесь перемешивали в течение 1 часа 30 минут, после чего ее выдерживали в течение 2 суток. Кристаллы, которые выпадали в осадок из реакционной смеси, собирали путем фильтрования с получением 349 мг указанного в заголовке соединения, имеющего точку плавления от 213 до 215oC. Пример 12 Метиловый эфир 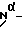 [5-(1,2-дитиолан-3 -ил)пентаноил]-Nim трет-бутоксикарбонилгистидина [5-(1,2-дитиолан-3 -ил)пентаноил]-Nim трет-бутоксикарбонилгистидина(Соединение N 1-70)  (Boc представляет собой трет-бутоксикарбонил). 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 422 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 2 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 629 мг дигидрохлорида метилового эфира L-гистидина и 0,70 мл триэтиламина и смесь перемешивали в течение 1 часа на ледяной бане и в течение еще 1 часа при комнатной температуре. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали методом колоночной хроматографии на силикагеле, применяя этилацетат, а затем 20:1, 10:1 и 5:1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель выпаривали из фракции, содержащей продукт, в условиях пониженного давления и затем к полученному таким образом остатку добавляли 5 мл этилацетата. К полученному раствору добавляли 0,55 мл ди-трет-бутилдикарбоната, 0,33 мл триэтиламина и каталитическое количество N, N-диметиламинопиридина и смесь перемешивали в течение 1 часа. Реакционную смесь затем очищали по методу колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан, а затем чистый этилацетат в качестве элюента. Растворитель выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане. Раствор лиофилизировали с получением 844 мг указанного в заголовке соединения, обладающего значением Rf, равным 0,41 (тонкослойная хроматография на силикагеле; с применением этилацетата в качестве проявляющего растворителя).
Пример 13 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 422 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 2 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 629 мг дигидрохлорида метилового эфира L-гистидина и 0,70 мл триэтиламина и смесь перемешивали в течение 1 часа на ледяной бане и в течение еще 1 часа при комнатной температуре. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали методом колоночной хроматографии на силикагеле, применяя этилацетат, а затем 20:1, 10:1 и 5:1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель выпаривали из фракции, содержащей продукт, в условиях пониженного давления и затем к полученному таким образом остатку добавляли 5 мл этилацетата. К полученному раствору добавляли 0,55 мл ди-трет-бутилдикарбоната, 0,33 мл триэтиламина и каталитическое количество N, N-диметиламинопиридина и смесь перемешивали в течение 1 часа. Реакционную смесь затем очищали по методу колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан, а затем чистый этилацетат в качестве элюента. Растворитель выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане. Раствор лиофилизировали с получением 844 мг указанного в заголовке соединения, обладающего значением Rf, равным 0,41 (тонкослойная хроматография на силикагеле; с применением этилацетата в качестве проявляющего растворителя).
Пример 13N  -[5-(1,2-Дитиолан-3- ил)пентаноил]гистидин -[5-(1,2-Дитиолан-3- ил)пентаноил]гистидин(Соединение N 1-71) 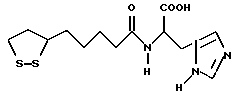 764 мг метилового эфира N  -[5-(1,2-дитиолан-3-ил)пентаноил]- Nim-тpет-бутoкcикapбoнилгиcтидинa (полученного, как описано в Примере 12) растворяли в 5 мл метанола и к раствору при комнатной температуре добавляли 5,1 мл 1 н. водного раствора гидроксида натрия, после чего полученную смесь перемешивали в течение 2 часов 30 минут. Затем к смеси добавляли 2,60 мл 2 н. водной соляной кислоты и полученную смесь перемешивали и выдерживали в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и полученный таким образом остаток очищали по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3: 7 (по объему) смесь ацетонитрил : вода в качестве элюента с получением 0,51 г смеси указанного в заголовке соединения (77%), имеющего точку плавления от 122 до 126oC, и хлорида натрия (23%).
Пример 14 -[5-(1,2-дитиолан-3-ил)пентаноил]- Nim-тpет-бутoкcикapбoнилгиcтидинa (полученного, как описано в Примере 12) растворяли в 5 мл метанола и к раствору при комнатной температуре добавляли 5,1 мл 1 н. водного раствора гидроксида натрия, после чего полученную смесь перемешивали в течение 2 часов 30 минут. Затем к смеси добавляли 2,60 мл 2 н. водной соляной кислоты и полученную смесь перемешивали и выдерживали в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и полученный таким образом остаток очищали по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3: 7 (по объему) смесь ацетонитрил : вода в качестве элюента с получением 0,51 г смеси указанного в заголовке соединения (77%), имеющего точку плавления от 122 до 126oC, и хлорида натрия (23%).
Пример 145-[5-(1,2-Дитиолан-3-ил)пентаноиламино] -1,2,4-дитиазол-3-тион (Соединение N 1-72) 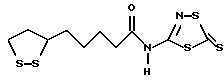 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 428 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 3 часов, после чего к реакционной смеси на ледяной бане добавляли 391 мг 3-амино-1,2,4-дитиазол-5-тиона и смесь перемешивали в течение 1 часа 30 минут. Ее выдерживали при комнатной температуре в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 1:2, 1:1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента и затем перекристаллизовывали из смеси этилацетат : гексан с получением 372 мг указанного в заголовке соединения, имеющего точку плавления от 158 до 161oC.
Пример 15 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 428 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 3 часов, после чего к реакционной смеси на ледяной бане добавляли 391 мг 3-амино-1,2,4-дитиазол-5-тиона и смесь перемешивали в течение 1 часа 30 минут. Ее выдерживали при комнатной температуре в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 1:2, 1:1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента и затем перекристаллизовывали из смеси этилацетат : гексан с получением 372 мг указанного в заголовке соединения, имеющего точку плавления от 158 до 161oC.
Пример 154-(1,2-Дитиолан-3-ил)бутиламиндифенилфосфат (дифенилфосфат Соединения N 1-1123)  1,00 г D, L-  -липоевой кислоты растворяли в 20 мл толуола и к раствору при комнатной температуре добавляли 2,00 мл триэтиламина и 1,25 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 2 часов 30 минут. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку на ледяной бане добавляли 20 мл тетрагидрофурана и 1,21 мл 40% (м/о) водного раствора О-метилгидроксиламингидрохлорида. Затем к смеси добавляли 2 мл метанола, после чего смесь перемешивали при комнатной температуре в течение 6 часов и затем выдерживали в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 2, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 3:1 (по объему) смесь этилацетат : метанол в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле (применяя 1:4 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента). Растворитель затем выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. К полученному таким образом остатку добавляли этилацетат для его перекристаллизации с получением 116 мг указанного в заголовке соединения, имеющего точку плавления от 100 до 103oC.
Пример 16 -липоевой кислоты растворяли в 20 мл толуола и к раствору при комнатной температуре добавляли 2,00 мл триэтиламина и 1,25 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 2 часов 30 минут. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку на ледяной бане добавляли 20 мл тетрагидрофурана и 1,21 мл 40% (м/о) водного раствора О-метилгидроксиламингидрохлорида. Затем к смеси добавляли 2 мл метанола, после чего смесь перемешивали при комнатной температуре в течение 6 часов и затем выдерживали в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 2, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 3:1 (по объему) смесь этилацетат : метанол в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле (применяя 1:4 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента). Растворитель затем выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. К полученному таким образом остатку добавляли этилацетат для его перекристаллизации с получением 116 мг указанного в заголовке соединения, имеющего точку плавления от 100 до 103oC.
Пример 16N,N’-Бис[4-(1,2-дитиолан-3-ил)бутил]мочевина (Соединение N 1-765) 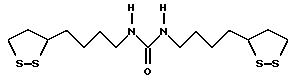 3,0 г D,L-  -липоевой кислоты растворяли в 60 мл толуола и к полученному раствору при комнатной температуре добавляли 2,40 мл триэтиламина и 3,70 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 60 мл трет-бутанола. Затем смесь перемешивали и выдерживали в течение 5 дней. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:5 и 1:3 (по объему) смесь этилацетат : гексан в качестве элюента. Растворитель удаляли путем выпаривания в условиях пониженного давления и к полученному остатку добавляли 5 мл диоксана. Растворитель затем удаляли путем выпаривания в условиях пониженного давления. К полученному таким образом остатку добавляли 5 мл 2 н. водной соляной кислоты и 10 мл метанола и смесь перемешивали на масляной бане при 60oC в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь нейтрализовали триэтиламином, после чего ее экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 260 мг сырого продукта.
160 мг сырого продукта очищали по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 2:3, 1:1, 3:2 и 7:3 (по объему) смеси ацетонитрил : вода в качестве элюента. Растворитель затем выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления с получением 87 мг указанного в заголовке соединения, имеющего точку плавления от 115 до 116oC.
Пример 17 -липоевой кислоты растворяли в 60 мл толуола и к полученному раствору при комнатной температуре добавляли 2,40 мл триэтиламина и 3,70 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 60 мл трет-бутанола. Затем смесь перемешивали и выдерживали в течение 5 дней. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:5 и 1:3 (по объему) смесь этилацетат : гексан в качестве элюента. Растворитель удаляли путем выпаривания в условиях пониженного давления и к полученному остатку добавляли 5 мл диоксана. Растворитель затем удаляли путем выпаривания в условиях пониженного давления. К полученному таким образом остатку добавляли 5 мл 2 н. водной соляной кислоты и 10 мл метанола и смесь перемешивали на масляной бане при 60oC в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь нейтрализовали триэтиламином, после чего ее экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 260 мг сырого продукта.
160 мг сырого продукта очищали по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 2:3, 1:1, 3:2 и 7:3 (по объему) смеси ацетонитрил : вода в качестве элюента. Растворитель затем выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления с получением 87 мг указанного в заголовке соединения, имеющего точку плавления от 115 до 116oC.
Пример 175-(1,2-Дитиолан-3-ил)пентаногидроксамовая кислота (Соединение N 1-58) 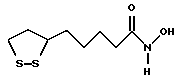 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 428 мг N,N’-карбонилдиимидазола и затем смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. Затем к реакционной смеси на ледяной бане добавляли 0,67 мл триэтиламина и 334 мг гидроксиламингидрохлорида и смесь перемешивали при комнатной температуре в течение 2 часов и затем выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 6-7, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 4:1 (по объему) смесь этилацетат : гексан, с последующей очисткой 20:1 (по объему) смесью этилацетат : метанол, в качестве элюента, а затем по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента. Раствор лиофилизировали с получением 0,38 г указанного в заголовке соединения, имеющего точку плавления от 63 до 64oC.
Пример 18 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 428 мг N,N’-карбонилдиимидазола и затем смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. Затем к реакционной смеси на ледяной бане добавляли 0,67 мл триэтиламина и 334 мг гидроксиламингидрохлорида и смесь перемешивали при комнатной температуре в течение 2 часов и затем выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 6-7, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 4:1 (по объему) смесь этилацетат : гексан, с последующей очисткой 20:1 (по объему) смесью этилацетат : метанол, в качестве элюента, а затем по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента. Раствор лиофилизировали с получением 0,38 г указанного в заголовке соединения, имеющего точку плавления от 63 до 64oC.
Пример 18N-[4-(1,2-Дитиолан-3-ил)бутил] -N’-[1-метоксикарбонил-2-(4-метоксибензилтио)этил]мочевина (Соединение N 1-766). 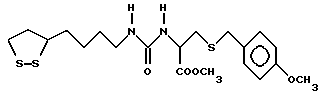 300 мг D,L-  -липоевой кислоты растворяли в 6 мл толуола и к раствору при комнатной температуре добавляли 0,24 мл триэтиламина и 0,37 мл дифенилфосфорилазида. Смесь перемешивали на масляной бане при 80oC в течение 2 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 434 мг метилового эфира S-(4-метоксибензил)-L-цистеина в 3 мл безводного тетрагидрофурана и смесь перемешивали при комнатной температуре в течение 3 часов и затем выдерживали в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и смесь перекристаллизовывали из этилацетата с получением 434 мг указанного в заголовке соединения, имеющего точку плавления от 105 до 107oC.
Пример 19 -липоевой кислоты растворяли в 6 мл толуола и к раствору при комнатной температуре добавляли 0,24 мл триэтиламина и 0,37 мл дифенилфосфорилазида. Смесь перемешивали на масляной бане при 80oC в течение 2 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 434 мг метилового эфира S-(4-метоксибензил)-L-цистеина в 3 мл безводного тетрагидрофурана и смесь перемешивали при комнатной температуре в течение 3 часов и затем выдерживали в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и смесь перекристаллизовывали из этилацетата с получением 434 мг указанного в заголовке соединения, имеющего точку плавления от 105 до 107oC.
Пример 19Бис[4-(1,2-Дитиолан-3-ил)бутиламид]гидразин-N,N’-дикарбоновой кислоты (Соединение N 1-936) 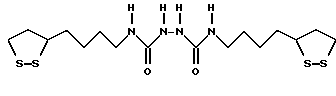 1,00 г D,L-  липоевой кислоты растворяли в 20 мл толуола и к полученному раствору добавляли 2,00 мл триэтиламина и 1,25 мл дифенилфосфорилазида. Смесь перемешивали на масляной бане при 70oC в течение 2 часов. Затем к реакционной смеси на ледяной бане добавляли 0,19 мл безводного гидразина и смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и полученный таким образом остаток промывали водой и этилацетатом. Нерастворимые вещества собирали путем фильтрования. Полученные таким образом нерастворимые вещества промывали 5:2:1 (по объему) смесью метанол: тетрагидрофуран : диметилформамид с получением 401 мг указанного в заголовке соединения, имеющего точку плавления от 205 до 207oC.
Пример 20 липоевой кислоты растворяли в 20 мл толуола и к полученному раствору добавляли 2,00 мл триэтиламина и 1,25 мл дифенилфосфорилазида. Смесь перемешивали на масляной бане при 70oC в течение 2 часов. Затем к реакционной смеси на ледяной бане добавляли 0,19 мл безводного гидразина и смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и полученный таким образом остаток промывали водой и этилацетатом. Нерастворимые вещества собирали путем фильтрования. Полученные таким образом нерастворимые вещества промывали 5:2:1 (по объему) смесью метанол: тетрагидрофуран : диметилформамид с получением 401 мг указанного в заголовке соединения, имеющего точку плавления от 205 до 207oC.
Пример 20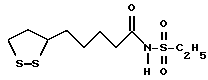 N-[5-(1,2-Дитиолан-3-ил)пентаноил]бензолсульфонамид (Соединение N 1-497) 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 428 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 1 часа. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 284 мг этансульфонамида в 3 мл диметилформамида и 113 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 1 часа и затем выдерживали в течение 3 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 2, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента, а затем по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7, 2:3 и 1: 1 (по объему) смеси ацетонитрил : вода в качестве элюента. Растворитель удаляли из полученной таким образом элюированной фракции путем выпаривания в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане. Раствор лиофилизировали с получением 30 мг указанного в заголовке соединения, имеющего точку плавления от 98 до 100oC.
Пример 21 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 428 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 1 часа. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 284 мг этансульфонамида в 3 мл диметилформамида и 113 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 1 часа и затем выдерживали в течение 3 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду и 2 н. водную соляную кислоту с тем, чтобы довести pH до 2, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента, а затем по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7, 2:3 и 1: 1 (по объему) смеси ацетонитрил : вода в качестве элюента. Растворитель удаляли из полученной таким образом элюированной фракции путем выпаривания в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане. Раствор лиофилизировали с получением 30 мг указанного в заголовке соединения, имеющего точку плавления от 98 до 100oC.
Пример 211,1-Диметил-4-[4-(1,2-дитиолан-3-ил)бутил]семикарбазид (Соединение N 1-861) 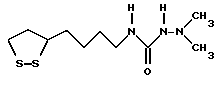 1,00 г D,L-  -липоевой кислоты растворяли в 10 мл толуола и к полученному раствору добавляли 0,80 мл триэтиламина и 1,25 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. Затем к смеси добавляли на ледяной бане 0,55 мл 1,1-диметилгидразина и смесь перемешивали при комнатной температуре в течение 1 часа и выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 3:1 (по объему) смесь этилацетат : гексан, а затем 10:1 (по объему) смесь этилацетат : метанол в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле (применяя 7: 13 и 2:3 (по объему) смеси ацетонитрил : вода в качестве элюента). Полученную таким образом элюированную фракцию лиофилизировали с получением 0,99 г указанного в заголовке соединения, имеющего точку плавления от 60 до 61oC.
Пример 22 -липоевой кислоты растворяли в 10 мл толуола и к полученному раствору добавляли 0,80 мл триэтиламина и 1,25 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. Затем к смеси добавляли на ледяной бане 0,55 мл 1,1-диметилгидразина и смесь перемешивали при комнатной температуре в течение 1 часа и выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 3:1 (по объему) смесь этилацетат : гексан, а затем 10:1 (по объему) смесь этилацетат : метанол в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле (применяя 7: 13 и 2:3 (по объему) смеси ацетонитрил : вода в качестве элюента). Полученную таким образом элюированную фракцию лиофилизировали с получением 0,99 г указанного в заголовке соединения, имеющего точку плавления от 60 до 61oC.
Пример 224-(1,2-Дитиолан-3-ил)бутиламид морфолин-4-карбоновой кислоты (Соединение N 1-1142) 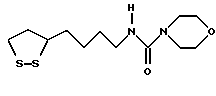 500 мг D,L-  -липоевой кислоты растворяли в 10 мл толуола и к полученному раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида и затем смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. Затем к реакционной смеси на ледяной бане добавляли 0,23 мл морфолина и смесь перемешивали при комнатной температуре в течение 2 часов и затем выдерживали в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 10: 1 (по объему) смеси этилацетат : метанол в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 3:7 и 2:3 (по объему) смесей ацетонитрил : вода в качестве элюента. Растворитель выпаривали из полученной таким образом элюированной фракции в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток растворяли в диоксане, раствор лиофилизировали с получением 0,51 г указанного в заголовке соединения, имеющего точку плавления от 74 до 77oC.
Пример 23 -липоевой кислоты растворяли в 10 мл толуола и к полученному раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида и затем смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. Затем к реакционной смеси на ледяной бане добавляли 0,23 мл морфолина и смесь перемешивали при комнатной температуре в течение 2 часов и затем выдерживали в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат, а затем 10: 1 (по объему) смеси этилацетат : метанол в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 3:7 и 2:3 (по объему) смесей ацетонитрил : вода в качестве элюента. Растворитель выпаривали из полученной таким образом элюированной фракции в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток растворяли в диоксане, раствор лиофилизировали с получением 0,51 г указанного в заголовке соединения, имеющего точку плавления от 74 до 77oC.
Пример 23N-Гидрокси-N’-[4-(1,2-дитиолан-3-ил)бутил]мочевина (Соединение N 1-750) 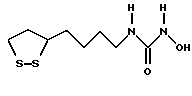 500 мг D,L-  -липоевой кислоты растворяли в 10 мл толуола и к полученному раствору добавляли 0,69 мл триэтиламина и 0,56 мл дифенилфосфорилазида и затем смесь перемешивали на масляной бане при 80oC в течение 2 часов. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку на бане, содержащей лед и водный раствор хлорида натрия, добавляли 10 мл безводного тетрагидрофурана и 181 мг гидроксиламин-гидрохлорида. Смесь перемешивали в течение 2 часов при температуре бани и затем перемешивали при комнатной температуре в течение 3 часов, после чего смесь выдерживали в течение 3 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, элюируя сначала 2:1 смесью этилацетат : гексан, затем чистым этилацетатом и, наконец, 10:1 (по объему) смесью этилацетат : метанол. Растворитель удаляли из полученной таким образом элюированной фракции путем выпаривания в условиях пониженного давления и выпавший в осадок порошок промывали смесью диметилформамид – тетрагидрофуран – метанол – этилацетат и подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 3: 7 и 1:1 (по объему) смесей ацетонитрил : вода в качестве элюента. Полученную таким образом элюированную фракцию концентрировали путем выпаривания в условиях пониженного давления и кристаллы, выпадавшие в осадок, собирали путем фильтрования с получением 85 мг указанного в заголовке соединения, имеющего точку плавления от 100 до 101oC.
Пример 24 -липоевой кислоты растворяли в 10 мл толуола и к полученному раствору добавляли 0,69 мл триэтиламина и 0,56 мл дифенилфосфорилазида и затем смесь перемешивали на масляной бане при 80oC в течение 2 часов. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку на бане, содержащей лед и водный раствор хлорида натрия, добавляли 10 мл безводного тетрагидрофурана и 181 мг гидроксиламин-гидрохлорида. Смесь перемешивали в течение 2 часов при температуре бани и затем перемешивали при комнатной температуре в течение 3 часов, после чего смесь выдерживали в течение 3 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, элюируя сначала 2:1 смесью этилацетат : гексан, затем чистым этилацетатом и, наконец, 10:1 (по объему) смесью этилацетат : метанол. Растворитель удаляли из полученной таким образом элюированной фракции путем выпаривания в условиях пониженного давления и выпавший в осадок порошок промывали смесью диметилформамид – тетрагидрофуран – метанол – этилацетат и подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 3: 7 и 1:1 (по объему) смесей ацетонитрил : вода в качестве элюента. Полученную таким образом элюированную фракцию концентрировали путем выпаривания в условиях пониженного давления и кристаллы, выпадавшие в осадок, собирали путем фильтрования с получением 85 мг указанного в заголовке соединения, имеющего точку плавления от 100 до 101oC.
Пример 24Имидазольная соль 2-[5-(1,2-дитиолан-3-ил) пентаноиламино]этансульфоновой кислоты (имидазольная соль Соединения N 1-57) 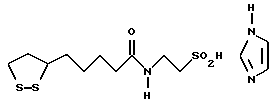 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к полученному раствору на ледяной бане добавляли 428 мг N,N’-карбонилдиимидазола и затем смесь перемешивали при комнатной температуре в течение 4 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 0,50 мл триэтиламина и 450 мг 2-аминоэтансульфоновой кислоты и смесь перемешивали при комнатной температуре в течение 4 часов 30 минут и затем выдерживали в течение 2 суток. По истечении данного промежутка времени реакционную смесь перемешивали на масляной бане при 50oC в течение 6 часов, а затем перемешивали на масляной бане при 70oC в течение 1 часа. Затем смесь выдерживали при комнатной температуре в течение ночи. Реакционную смесь затем перемешивали на масляной бане при 70oC в течение 2 часов и растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. Полученный таким образом остаток промывали этилацетатом и подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 1:9 (по объему) смесь ацетонитрил : вода в качестве элюента. Полученную таким образом элюированную фракцию лиофилизировали с получением 268 мг указанного в заголовке соединения, имеющего точку плавления от 96 до 99oC.
Пример 25 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к полученному раствору на ледяной бане добавляли 428 мг N,N’-карбонилдиимидазола и затем смесь перемешивали при комнатной температуре в течение 4 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 0,50 мл триэтиламина и 450 мг 2-аминоэтансульфоновой кислоты и смесь перемешивали при комнатной температуре в течение 4 часов 30 минут и затем выдерживали в течение 2 суток. По истечении данного промежутка времени реакционную смесь перемешивали на масляной бане при 50oC в течение 6 часов, а затем перемешивали на масляной бане при 70oC в течение 1 часа. Затем смесь выдерживали при комнатной температуре в течение ночи. Реакционную смесь затем перемешивали на масляной бане при 70oC в течение 2 часов и растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. Полученный таким образом остаток промывали этилацетатом и подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 1:9 (по объему) смесь ацетонитрил : вода в качестве элюента. Полученную таким образом элюированную фракцию лиофилизировали с получением 268 мг указанного в заголовке соединения, имеющего точку плавления от 96 до 99oC.
Пример 25N  – [5-(1,2-Дитиолан-3-ил) пентаноил]гистамин – [5-(1,2-Дитиолан-3-ил) пентаноил]гистамин(Соединение N 1-75) 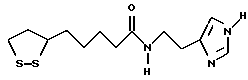 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к полученному раствору на ледяной бане добавляли 422 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. Затем к реакционной смеси при комнатной температуре добавляли 0,73 мл триэтиламина и 479 мг гистаминдигидрохлорида и смесь перемешивали в течение 4 часов 30 минут. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:0, 5:1 и 3:1 (по объему) смеси этилацетат : этанол в качестве элюента. Затем его перекристаллизовывали из 1:2 (по объему) смеси этилацетат : диизопропиловый эфир с получением 270 мг указанного в заголовке соединения, имеющего точку плавления от 108 до 110oC.
Пример 26 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к полученному раствору на ледяной бане добавляли 422 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. Затем к реакционной смеси при комнатной температуре добавляли 0,73 мл триэтиламина и 479 мг гистаминдигидрохлорида и смесь перемешивали в течение 4 часов 30 минут. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:0, 5:1 и 3:1 (по объему) смеси этилацетат : этанол в качестве элюента. Затем его перекристаллизовывали из 1:2 (по объему) смеси этилацетат : диизопропиловый эфир с получением 270 мг указанного в заголовке соединения, имеющего точку плавления от 108 до 110oC.
Пример 26
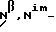 Биc[4-(1,2-дитиолан-3 -ил)бутилкарбамоил]гистамин Биc[4-(1,2-дитиолан-3 -ил)бутилкарбамоил]гистамин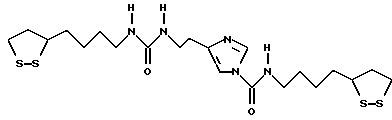 500 мг D,L-  -липоевой кислоты растворяли в 10 мл -липоевой кислоты растворяли в 10 млтолуола и затем к смеси добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образов остатку добавляли 5 мл безводного тетрагидрофурана с получением тетрагидрофуранового раствора. Отдельно 479 мг гистаминдигидрохлорида растворяли в 2 мл безводного диметилформамида и затем к раствору добавляли 0,72 мл триэтиламина, после чего полученную смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Затем к реакционной смеси добавляли 5 мл безводного тетрагидрофурана, а затем к ней на ледяной бане добавляли указанный выше тетрагидрофурановый раствор. Смесь перемешивали при комнатной температуре в течение 3 часов и затем выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0, 5:1 и 3:1 (по объему) смеси этилацетат : метанол в качестве элюента, после чего смесь подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 1:4, 3:7, 2:3 и 1: 1 (по объему) смесей ацетонитрил : вода в качестве элюента. Растворитель затем выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане и лиофилизировали с получением 52 мг указанного в заголовке соединения, имеющего точку плавления от 115 до 117oC. Пример 28 N-[4-(1,2-дитиолан-3-ил)бутил]-N’-метансульфонилмочевина (Соединение N 1-1069)  500 мг D,L-  -липоевой кислоты растворяли в 10 мл толуола и затем к смеси добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 2 часов.
Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 5 мл безводного диметилформамида с получением диметилформамидного раствора.
Отдельно в 5 мл безводного диметилформамида растворяли 247 мг метансульфонамида и затем к раствору добавляли 113 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле), после чего полученную смесь перемешивали при комнатной температуре в течение 2 часов. Затем к реакционной смеси на ледяной бане добавляли указанный выше диметилформамидный раствор и смесь перемешивали при комнатной температуре в течение 3 часов и выдерживали при комнатной температуре в течение 3 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К полученному таким образом остатку добавляли воду и смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего ее экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат в качестве элюента и активную фракцию затем перекристаллизовывали из этилацетата с получением 302 мг указанного в заголовке соединения, имеющего точку плавления от 125 до 127oC.
Пример 29 -липоевой кислоты растворяли в 10 мл толуола и затем к смеси добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 2 часов.
Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 5 мл безводного диметилформамида с получением диметилформамидного раствора.
Отдельно в 5 мл безводного диметилформамида растворяли 247 мг метансульфонамида и затем к раствору добавляли 113 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле), после чего полученную смесь перемешивали при комнатной температуре в течение 2 часов. Затем к реакционной смеси на ледяной бане добавляли указанный выше диметилформамидный раствор и смесь перемешивали при комнатной температуре в течение 3 часов и выдерживали при комнатной температуре в течение 3 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К полученному таким образом остатку добавляли воду и смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего ее экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя этилацетат в качестве элюента и активную фракцию затем перекристаллизовывали из этилацетата с получением 302 мг указанного в заголовке соединения, имеющего точку плавления от 125 до 127oC.
Пример 294-[4-(1,2-Дитиолан-3-ил)бутил]семикарбазиддифенилфосфат (дифенилфосфат Соединения N 1-858) 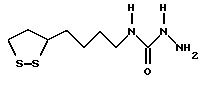 дифенилфосфат 500 мг D, L-  -липоевой кислоты растворяли в 10 мл 7 толуола и к полученному раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 3,5 мл безводного тетрагидрофурана. Раствор добавляли к 0,75 мг гидразина и затем к ним добавляли 2 мл безводного диметилформамида. Смесь перемешивали при комнатной температуре в течение 5 часов и выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли насыщенный водный раствор хлорида натрия, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:0, 10:1 и 5:1 (по объему) смеси этилацетата и метанола в качестве элюента, после чего его перекристаллизовывали из 1:1 (по объему) смеси этилацетат : диизопропиловый эфир с получением 125 мг указанного в заголовке соединения, имеющего точку плавления от 134 до 139oC.
Пример 30 -липоевой кислоты растворяли в 10 мл 7 толуола и к полученному раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 3,5 мл безводного тетрагидрофурана. Раствор добавляли к 0,75 мг гидразина и затем к ним добавляли 2 мл безводного диметилформамида. Смесь перемешивали при комнатной температуре в течение 5 часов и выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли насыщенный водный раствор хлорида натрия, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:0, 10:1 и 5:1 (по объему) смеси этилацетата и метанола в качестве элюента, после чего его перекристаллизовывали из 1:1 (по объему) смеси этилацетат : диизопропиловый эфир с получением 125 мг указанного в заголовке соединения, имеющего точку плавления от 134 до 139oC.
Пример 30N-[4-(1,2-Дитиолан-3-ил)бутил]-N’-аминосульфонилмочевина (Соединение N 1-1112) 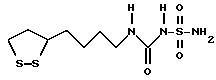 500 мг D,L-  -липоевой кислоты растворяли в 10 мл толуола и затем к смеси добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 70oC в течение 2 часов. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 5 мл безводного диметилформамида с получением диметилформамидного раствора.
Отдельно в 10 мл безводного диметилформамида растворяли 1,15 г сульфамида и затем к раствору на ледяной бане добавляли 524 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле), после чего полученную смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Затем к реакционной смеси на ледяной бане добавляли указанный выше диметилформамидный раствор и смесь перемешивали при комнатной температуре в течение 4 часов и выдерживали в течение 2 суток. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего ее экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1, 2:1 и 4:1 смеси этилацетат : гексан в качестве элюента. Затем его перекристаллизовывали из этанола с получением 126 мг указанного в заголовке соединения, имеющего точку плавления от 123 до 125oC.
Пример 31 -липоевой кислоты растворяли в 10 мл толуола и затем к смеси добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 70oC в течение 2 часов. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 5 мл безводного диметилформамида с получением диметилформамидного раствора.
Отдельно в 10 мл безводного диметилформамида растворяли 1,15 г сульфамида и затем к раствору на ледяной бане добавляли 524 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле), после чего полученную смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Затем к реакционной смеси на ледяной бане добавляли указанный выше диметилформамидный раствор и смесь перемешивали при комнатной температуре в течение 4 часов и выдерживали в течение 2 суток. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего ее экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1, 2:1 и 4:1 смеси этилацетат : гексан в качестве элюента. Затем его перекристаллизовывали из этанола с получением 126 мг указанного в заголовке соединения, имеющего точку плавления от 123 до 125oC.
Пример 31Метил N-[4-(1,2-дитиолан-3-ил)бутил]карбамат (Соединение N 1-676) 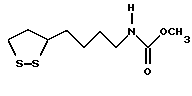 500 мг D,L-  -липоевой кислоты растворяли в 10 мл толуола и затем к смеси добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 10 мл безводного метанола. Смесь перемешивали при комнатной температуре в течение 6 часов и затем выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:4 и 1:2 (по объему) смеси этилацетат : гексан в качестве элюента, после чего смесь подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 1:4, 3:7, 2:3 и 1:1 (по объему) смесей ацетонитрил : вода в качестве элюента. Растворитель затем выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане и лиофилизировали с получением 324 мг указанного в заголовке соединения, имеющего точку плавления от 31 до 32oC.
Пример 32 -липоевой кислоты растворяли в 10 мл толуола и затем к смеси добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 10 мл безводного метанола. Смесь перемешивали при комнатной температуре в течение 6 часов и затем выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:4 и 1:2 (по объему) смеси этилацетат : гексан в качестве элюента, после чего смесь подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 1:4, 3:7, 2:3 и 1:1 (по объему) смесей ацетонитрил : вода в качестве элюента. Растворитель затем выпаривали из фракции, содержащей указанное в заголовке соединение, в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления и полученный таким образом остаток растворяли в диоксане и лиофилизировали с получением 324 мг указанного в заголовке соединения, имеющего точку плавления от 31 до 32oC.
Пример 32N-[2-(5-метокси-1Н-индол-3-ил)этил]липоамид (Соединение N 1-80) 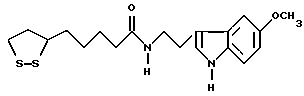 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 422 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 3 часов 30 минут. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 495 мг 5-метокситриптамина и смесь перемешивали в течение 3 часов при комнатной температуре и выдерживали при комнатной температуре в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду. Остаток экстрагировали этилацетатом и затем сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 2:1, 4:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента с получением 515 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,26 (тонкослойная хроматография на силикагеле; с применением 2: 1 смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 33 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору на ледяной бане добавляли 422 мг N,N’-карбонилдиимидазола. Затем смесь перемешивали при комнатной температуре в течение 3 часов 30 минут. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 495 мг 5-метокситриптамина и смесь перемешивали в течение 3 часов при комнатной температуре и выдерживали при комнатной температуре в течение ночи. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду. Остаток экстрагировали этилацетатом и затем сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 2:1, 4:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента с получением 515 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,26 (тонкослойная хроматография на силикагеле; с применением 2: 1 смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 33N-[4-(1,2-дитиолан-3-ил)бутил] -N’-[2-(5-метокси-1Н- индол-3-ил)этил] мочевина (Соединение N 1-772) 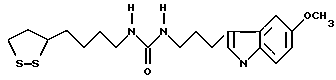 500 мг D, L-  -липоевой кислоты растворяли в 10 мл толуола и затем к раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 5 мл безводного тетрагидрофурана с получением тетрагидрофуранового раствора.
Отдельно 1,37 мг 5-метокситриптамина растворяли в смеси 10 мл безводного тетрагидрофурана и 4 мл безводного диметилформамида и полученный раствор добавляли на ледяной бане к указанному выше тетрагидрофурановому раствору. Смесь перемешивали на ледяной бане в течение 1 часа, а затем при комнатной температуре в течение 4 часов, после чего смесь выдерживали при комнатной температуре в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли насыщенный водный раствор хлорида натрия, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 3:1 и 1:0 (по объему) смеси этилацетат : гексан, а затем 10: 1 (по объему) смесь этилацетат : метанол в качестве элюента, после чего его перекристаллизовывали из этилацетата с получением 674 мг указанного в заголовке соединения, имеющего точку плавления от 100 до 101oC.
Пример 34 -липоевой кислоты растворяли в 10 мл толуола и затем к раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли 5 мл безводного тетрагидрофурана с получением тетрагидрофуранового раствора.
Отдельно 1,37 мг 5-метокситриптамина растворяли в смеси 10 мл безводного тетрагидрофурана и 4 мл безводного диметилформамида и полученный раствор добавляли на ледяной бане к указанному выше тетрагидрофурановому раствору. Смесь перемешивали на ледяной бане в течение 1 часа, а затем при комнатной температуре в течение 4 часов, после чего смесь выдерживали при комнатной температуре в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли насыщенный водный раствор хлорида натрия, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 3:1 и 1:0 (по объему) смеси этилацетат : гексан, а затем 10: 1 (по объему) смесь этилацетат : метанол в качестве элюента, после чего его перекристаллизовывали из этилацетата с получением 674 мг указанного в заголовке соединения, имеющего точку плавления от 100 до 101oC.
Пример 34N-[4-(1,2-Дитиолан-3-ил)бутил]пирролидин-1-карбоксамид (Соединение N 1-1139) 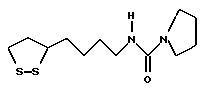 500 мг D,L-  -липоевой кислоты растворяли в 10 мл 1 безводного толуола и затем к раствору добавляли 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. К реакционной смеси на ледяной бане добавляли 0,22 мл пирролидина и смесь перемешивали при комнатной температуре в течение 1 часа и затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:0 и 10:1 (по объему) смеси этилацетат : метанол в качестве элюента, после чего его перекристаллизовывали из 1: 1:1 (по объему) смеси этилацетат : метанол : ацетонитрил с получением 231 мг указанного в заголовке соединения, имеющего точку плавления от 91 до 93oC.
Пример 35 -липоевой кислоты растворяли в 10 мл 1 безводного толуола и затем к раствору добавляли 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. К реакционной смеси на ледяной бане добавляли 0,22 мл пирролидина и смесь перемешивали при комнатной температуре в течение 1 часа и затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:0 и 10:1 (по объему) смеси этилацетат : метанол в качестве элюента, после чего его перекристаллизовывали из 1: 1:1 (по объему) смеси этилацетат : метанол : ацетонитрил с получением 231 мг указанного в заголовке соединения, имеющего точку плавления от 91 до 93oC.
Пример 351-[5-(1,2-Дитиолан-3-ил)пентаноил]пирролидин (Соединение N 1-1129) 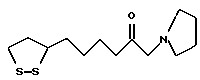 500 мг D, L- 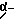 липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору добавляли 422 мг N,N’-карбонилдиимидазола. Полученную смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. К реакционной смеси на ледяной бане добавляли 0,22 мл пирролидина и смесь перемешивали при комнатной температуре в течение 2 часов. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 2:1, 3:1 и 1: 0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его растворяли в диоксане и лиофилизировали с получением 364 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,15 (тонкослойная хроматография на силикагеле, с применением этилацетата в качестве проявляющего растворителя).
Пример 36 липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору добавляли 422 мг N,N’-карбонилдиимидазола. Полученную смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. К реакционной смеси на ледяной бане добавляли 0,22 мл пирролидина и смесь перемешивали при комнатной температуре в течение 2 часов. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 2:1, 3:1 и 1: 0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его растворяли в диоксане и лиофилизировали с получением 364 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,15 (тонкослойная хроматография на силикагеле, с применением этилацетата в качестве проявляющего растворителя).
Пример 36N-[4-(1,2-Дитиолан-3-ил)бутил]пиперидин-1-карбоксамид (Соединение N 1-1140) 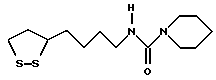 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного толуола и затем к раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. К реакционной смеси на ледяной бане добавляли 0,26 мл пиперидина и смесь выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 2:1, 4:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его перекристаллизовывали из 1:1 (по объему) смеси этилацетат : метанол с получением 252 мг указанного в заголовке соединения, имеющего точку плавления от 90 до 91oC.
Пример 37 -липоевой кислоты растворяли в 10 мл безводного толуола и затем к раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. К реакционной смеси на ледяной бане добавляли 0,26 мл пиперидина и смесь выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 2:1, 4:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его перекристаллизовывали из 1:1 (по объему) смеси этилацетат : метанол с получением 252 мг указанного в заголовке соединения, имеющего точку плавления от 90 до 91oC.
Пример 371-[5-(1,2-Дитиолан-3-ил)пентаноил]пиперидин (Соединение N 1-1130) 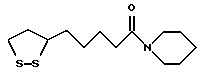 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору добавляли 422 мг N,N’-карбонилдиимидазола. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 0,26 мл пиперидина и смесь перемешивали при комнатной температуре в течение 4 часов и затем выдерживали в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 3:2 и 3:1 (по объему) смеси этилацетат : гексан в качестве элюента. Его растворяли в диоксане и лиофилизировали с получением 381 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,30 (тонкослойная хроматография на силикагеле, с применением 3:2 смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 38 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и к раствору добавляли 422 мг N,N’-карбонилдиимидазола. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 0,26 мл пиперидина и смесь перемешивали при комнатной температуре в течение 4 часов и затем выдерживали в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 3:2 и 3:1 (по объему) смеси этилацетат : гексан в качестве элюента. Его растворяли в диоксане и лиофилизировали с получением 381 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,30 (тонкослойная хроматография на силикагеле, с применением 3:2 смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 38N-[4-(1,2-Дитиолан-3-ил)бутил]тиоморфолин-4-карбоксамид (Соединение N 1-1143) 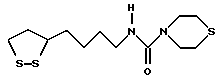 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного толуола и затем к раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. Затем к реакционной смеси при комнатной температуре добавляли 0,25 мл тиоморфолина и смесь перемешивали в течение 5 часов и затем выдерживали в течение 2 суток. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 3:2, 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Его растворяли в диоксане и лиофилизировали с получением 583 мг указанного в заголовке соединения, имеющего точку плавления от 80 до 81oC.
Пример 39 -липоевой кислоты растворяли в 10 мл безводного толуола и затем к раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа. Затем к реакционной смеси при комнатной температуре добавляли 0,25 мл тиоморфолина и смесь перемешивали в течение 5 часов и затем выдерживали в течение 2 суток. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 3:2, 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Его растворяли в диоксане и лиофилизировали с получением 583 мг указанного в заголовке соединения, имеющего точку плавления от 80 до 81oC.
Пример 39(S)-N-[5-(1,2-Дитиолан-3-ил)пентаноил]метансульфонамид (Соединение N 1-496) 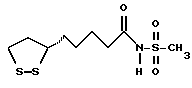 300 мг (S)-  -липоевой кислоты растворяли в 6 мл безводного диметилформамида и к раствору на ледяной бане добавляли 276 мг N,N’-карбонилдиимидазола и 1 мл безводного диметилформамида. Смесь затем перемешивали при комнатной температуре в течение 1 часа 30 минут. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 162 мг метансульфонилхлорида и 74 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 1 часа и выдерживали в течение 2 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1 и 3:1 (по объему) смеси этилацетат : гексан в качестве элюента. Его перекристаллизовывали из 1: 2 (по объему) смеси этилацетат : гексан с получением 154 мг указанного в заголовке соединения, имеющего точку плавления от 91 до 92oC.
Пример 40 -липоевой кислоты растворяли в 6 мл безводного диметилформамида и к раствору на ледяной бане добавляли 276 мг N,N’-карбонилдиимидазола и 1 мл безводного диметилформамида. Смесь затем перемешивали при комнатной температуре в течение 1 часа 30 минут. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 162 мг метансульфонилхлорида и 74 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 1 часа и выдерживали в течение 2 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1 и 3:1 (по объему) смеси этилацетат : гексан в качестве элюента. Его перекристаллизовывали из 1: 2 (по объему) смеси этилацетат : гексан с получением 154 мг указанного в заголовке соединения, имеющего точку плавления от 91 до 92oC.
Пример 40(R)-N-[5-(1,2-Дитиолан-3-ил) пентаноил]метансульфонамид (Соединение N 1-496) 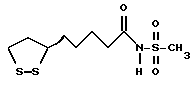 100 мг (R)-  -липоевой кислоты растворяли в 2 мл безводного диметилформамида и к раствору на ледяной бане добавляли 97 мг N,N’-карбонилдиимидазола. Смесь затем перемешивали при комнатной температуре в течение 4 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 57 мг метансульфонилхлорида и 26 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 5 часов и выдерживали в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1 и 3:1 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его растворяли в диоксане и лиофилизировали с получением 68 мг указанного в заголовке соединения, имеющего точку плавления от 71 до 73oC.
Пример 41 -липоевой кислоты растворяли в 2 мл безводного диметилформамида и к раствору на ледяной бане добавляли 97 мг N,N’-карбонилдиимидазола. Смесь затем перемешивали при комнатной температуре в течение 4 часов. По истечении данного промежутка времени к реакционной смеси на ледяной бане добавляли 57 мг метансульфонилхлорида и 26 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 5 часов и выдерживали в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1 и 3:1 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его растворяли в диоксане и лиофилизировали с получением 68 мг указанного в заголовке соединения, имеющего точку плавления от 71 до 73oC.
Пример 414-[5-(1,2-Дитиолан-3-ил) пентаноил]тиоморфолин (Соединение N 1-1133) 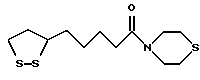 500 мг D, L-  -липоевой кислоты растворяли в 10 мл безводного диметилформамида и затем к раствору добавляли 422 мг N,N’-карбонилдиимидазола. Смесь затем перемешивали при комнатной температуре в течение 1 часа 30 минут, после чего ее выдерживали в течение ночи. По истечении данного промежутка времени к реакционной смеси добавляли 0,25 мл тиоморфолина и смесь перемешивали при комнатной температуре в течение 5 часов и затем выдерживали в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента. Его растворяли в диоксане и лиофилизировали с получением 385 мг указанного в заголовке соединения в виде желтого аморфного вещества, имеющего точку плавления от 31 до 32oC.
Пример 42 -липоевой кислоты растворяли в 10 мл безводного диметилформамида и затем к раствору добавляли 422 мг N,N’-карбонилдиимидазола. Смесь затем перемешивали при комнатной температуре в течение 1 часа 30 минут, после чего ее выдерживали в течение ночи. По истечении данного промежутка времени к реакционной смеси добавляли 0,25 мл тиоморфолина и смесь перемешивали при комнатной температуре в течение 5 часов и затем выдерживали в течение ночи. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления. Полученный таким образом остаток очищали по методу колоночной хроматографии на силикагеле, применяя 1:1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента. Его растворяли в диоксане и лиофилизировали с получением 385 мг указанного в заголовке соединения в виде желтого аморфного вещества, имеющего точку плавления от 31 до 32oC.
Пример 42N-[4-(1,2-Дитиолан-3-ил) бутил]-1-пиперазинилкарбоксамид (Соединение N 1-1141) 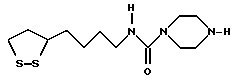 500 мг D,L-  -липоевой кислоты растворяли в 10 мл безводного толуола и к полученному раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 2 часов. Затем к реакционной смеси на ледяной бане добавляли раствор 1,03 г пиперазина в 10 мл безводного диметилформамида и смесь перемешивали при комнатной температуре в течение 3 часов 30 минут и затем выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь нейтрализовали путем добавления 2 н. водной соляной кислоты. Кристаллы, которые выпадали в осадок, собирали путем фильтрования и промывали водой и этилацетатом с получением 107 мг указанного в заголовке соединения, имеющего точку плавления от 175 до 177oC.
Пример 43 -липоевой кислоты растворяли в 10 мл безводного толуола и к полученному раствору добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида, после чего полученную смесь перемешивали на масляной бане при 80oC в течение 2 часов. Затем к реакционной смеси на ледяной бане добавляли раствор 1,03 г пиперазина в 10 мл безводного диметилформамида и смесь перемешивали при комнатной температуре в течение 3 часов 30 минут и затем выдерживали в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к полученному таким образом остатку добавляли воду, после чего смесь нейтрализовали путем добавления 2 н. водной соляной кислоты. Кристаллы, которые выпадали в осадок, собирали путем фильтрования и промывали водой и этилацетатом с получением 107 мг указанного в заголовке соединения, имеющего точку плавления от 175 до 177oC.
Пример 433-[5-(1,2-Дитиолан-3-ил) пентаноил]тиазолидин (Соединение N 1-1258) 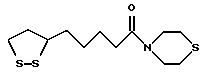 К раствору 500 мг D,L-  липоевой кислоты в 10 мл безводного диметилформамида добавляли 422 мг N,N’-карбонилдиимидазола. Полученную смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Затем к реакционной смеси по каплям добавляли 0,20 мл тиазолидина и затем смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь выдерживали в течение ночи при комнатной температуре и растворитель затем удаляли путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 1:1, 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, с последующей очисткой по методу обратно-фазовой препаративной колоночной хроматографии на силикагеле (применяя 2:3 (по объему) смесь ацетонитрил : вода в качестве элюента). Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления, а остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и полученный остаток растворяли в диоксане. Полученный раствор лиофилизировали с получением 317 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 40 до 41oC.
Пример 44 липоевой кислоты в 10 мл безводного диметилформамида добавляли 422 мг N,N’-карбонилдиимидазола. Полученную смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Затем к реакционной смеси по каплям добавляли 0,20 мл тиазолидина и затем смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь выдерживали в течение ночи при комнатной температуре и растворитель затем удаляли путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 1:1, 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, с последующей очисткой по методу обратно-фазовой препаративной колоночной хроматографии на силикагеле (применяя 2:3 (по объему) смесь ацетонитрил : вода в качестве элюента). Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления, а остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и полученный остаток растворяли в диоксане. Полученный раствор лиофилизировали с получением 317 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 40 до 41oC.
Пример 44N-[4-(1,2-Дитиолан-3-ил)бутил] -N’-(1-пиперидил)мочевина (Соединение N 1-1145) 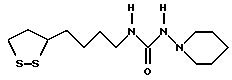 К раствору 500 мг D, L-  -липоевой кислоты в 10 мл безводного толуола добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида. Полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. Затем к реакционной смеси на ледяной бане по каплям добавляли 0,28 мл 1-аминопиперидина и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь затем выдерживали в течение ночи при комнатной температуре. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0 и 5:1 (по объему) смеси этилацетат : этанол в качестве элюента. Растворитель удаляли из элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 593 мг указанного в заголовке соединения в виде желтого аморфного вещества, имеющего точку плавления от 67 до 69oC.
Пример 45 -липоевой кислоты в 10 мл безводного толуола добавляли 0,36 мл триэтиламина и 0,56 мл дифенилфосфорилазида. Полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. Затем к реакционной смеси на ледяной бане по каплям добавляли 0,28 мл 1-аминопиперидина и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь затем выдерживали в течение ночи при комнатной температуре. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0 и 5:1 (по объему) смеси этилацетат : этанол в качестве элюента. Растворитель удаляли из элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 593 мг указанного в заголовке соединения в виде желтого аморфного вещества, имеющего точку плавления от 67 до 69oC.
Пример 45N-(1-Пиперидил)-5-(1,2-дитиолан-3-ил) пентанамид (Соединение N 1-1135) 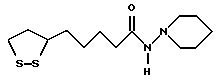 Реакцию проводили, как описано в Примере 43, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола и 0,28 мл 1-аминопиперидина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его перекристаллизовывали из этилацетата с получением 298 мг указанного в заголовке соединения в виде желтых игольчатых кристаллов, имеющего точку плавления от 108 до 109oC.
Пример 46 -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола и 0,28 мл 1-аминопиперидина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его перекристаллизовывали из этилацетата с получением 298 мг указанного в заголовке соединения в виде желтых игольчатых кристаллов, имеющего точку плавления от 108 до 109oC.
Пример 46Метил 3-[4-(1,2-дитиолан- 3-ил)бутил]уреидоацетат (Соединение N 1-739) 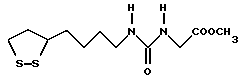 К раствору 500 мг D, L-  -липоевой кислоты в 10 мл безводного толуола добавляли 0,73 мл триэтиламина и 0,56 мл дифенилфосфорилазида. Полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления. Затем к остатку добавляли 10 мл безводного диметилформамида, после чего на ледяной бане добавляли 301 мг гидрохлорида метилового эфира L-глицина. Полученную смесь перемешивали при комнатной температуре в течение одного часа. По истечении данного промежутка времени реакционную смесь выдерживали в течение ночи при комнатной температуре, после чего растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле (применяя 3:17, 3:7 и 3:2 (по объему) смеси ацетонитрил : вода в качестве элюента). Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления и остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 336 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 62 до 64oC.
Пример 47 -липоевой кислоты в 10 мл безводного толуола добавляли 0,73 мл триэтиламина и 0,56 мл дифенилфосфорилазида. Полученную смесь перемешивали на масляной бане при 80oC в течение 1 часа 30 минут. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления. Затем к остатку добавляли 10 мл безводного диметилформамида, после чего на ледяной бане добавляли 301 мг гидрохлорида метилового эфира L-глицина. Полученную смесь перемешивали при комнатной температуре в течение одного часа. По истечении данного промежутка времени реакционную смесь выдерживали в течение ночи при комнатной температуре, после чего растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле (применяя 3:17, 3:7 и 3:2 (по объему) смеси ацетонитрил : вода в качестве элюента). Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления и остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 336 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 62 до 64oC.
Пример 47Метил [5-(1,2-дитиолан -3-ил)пентаноиламино]ацетат (Соединение N 1-47) 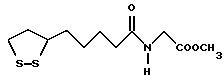 К раствору 500 мг D,L-  -липоевой кислоты в 10 мл безводного диметилформамид добавляли 422 мг N,N’-карбонилдиимидазола. Полученную смесь перемешивали при комнатной температуре в течение 2 часов, после чего к реакционной смеси по каплям добавляли 0,36 мл триэтиламина. Затем к реакционной смеси добавляли 301 мг гидрохлорида метилового эфира глицина и затем смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выдерживали при комнатной температуре в течение двух суток, а затем растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 1: 4, 3:7 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления и остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления, а остаток растворяли в диоксане, после чего его лиофилизировали с получением 320 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,26 (тонкослойная хроматография на силикагеле, с применением 3:1 смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 48 -липоевой кислоты в 10 мл безводного диметилформамид добавляли 422 мг N,N’-карбонилдиимидазола. Полученную смесь перемешивали при комнатной температуре в течение 2 часов, после чего к реакционной смеси по каплям добавляли 0,36 мл триэтиламина. Затем к реакционной смеси добавляли 301 мг гидрохлорида метилового эфира глицина и затем смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выдерживали при комнатной температуре в течение двух суток, а затем растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 1: 4, 3:7 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления и остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления, а остаток растворяли в диоксане, после чего его лиофилизировали с получением 320 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,26 (тонкослойная хроматография на силикагеле, с применением 3:1 смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 48{3-[4-(1,2-дитиолан-3-ил)бутил] уреидо}уксусная кислота (Соединение N 1-738) 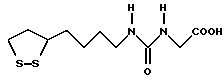 К раствору 218 мг метил {3-[4-(1,2-дитиолан-3-ил) бутил]уреидо}ацетата (полученного, как описано в Примере 46) в 4 мл метанола по каплям добавляли 2,1 мл 1 н. водного раствора гидроксида натрия и затем смесь перемешивали при комнатной температуре в течение 5 часов. Затем реакционную смесь выдерживали в течение ночи при комнатной температуре, после чего растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К полученному остатку добавляли воду. Полученный раствор нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего его экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток перекристаллизовывали из 3: 1 (по объему) смеси этилацетат : гексан с получением 64 мг указанного в заголовке соединения в виде бледно-желтого порошка, имеющего точку плавления от 95 до 96oC. Пример 49 [5-(1,2-Дитиолан-3-ил) пентаноиламино]уксусная кислота (Соединение N 1-46) 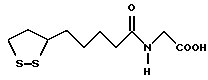 0,28 г метил [5-(1,2-дитиолан-3-ил)пентаноиламино] ацетата (полученного, как описано в Примере 47) растворяли в смеси 2 мл метанола и 2 мл тетрагидрофурана. К полученному раствору по каплям добавляли 2,0 мл 1 н. водного раствора гидроксида натрия и затем смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь затем выдерживали при комнатной температуре в течение ночи, после чего растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. Полученный раствор нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего его экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 156 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,12 (тонкослойная хроматография на силикагеле, с применением 5:1 смеси этилацетат : метанол в качестве проявляющего растворителя). Пример 50 Метил 2 (S)-{3-[4-(1,2-дитиолан -3-ил)бутил]уреидо}пропионат (Соединение N 1-742) 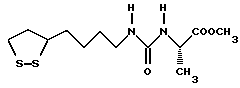 Реакцию проводили, как описано в Примере 46, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 335 мг гидрохлорида метилового эфира L-аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Этилацетат удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления и остаток перекристаллизовывали из 1:1:1 (по объему) смеси этилацетат : диизопропиловый эфир : гексан с получением 142 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 90 до 92oC.
Пример 51 -липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 335 мг гидрохлорида метилового эфира L-аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К полученному таким образом остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Этилацетат удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления и остаток перекристаллизовывали из 1:1:1 (по объему) смеси этилацетат : диизопропиловый эфир : гексан с получением 142 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 90 до 92oC.
Пример 51Метил 2 (S)-[5(1,2-дитиолан-3- ил)пентаноиламино]пропионат (Соединение N 1-50) 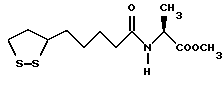 Реакцию проводили, как описано в Примере 47, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола и 0,36 мл триэтиламина и 335 мг гидрохлорида метилового эфира L-аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления, а остаток экстрагировали -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола и 0,36 мл триэтиламина и 335 мг гидрохлорида метилового эфира L-аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления, а остаток экстрагировалиэтилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего лиофилизировали с получением 271 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 48 до 49oC. Пример 52 2 (S)-{3-[4-(1,2-Дитиолан-3-ил) бутил]уреидо}пропионовая кислота (Соединение N 1-740) 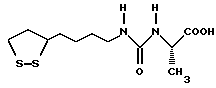 Реакцию проводили, как описано в Примере 46, но применяя 1,00 мг D,L-  -липоевой кислоты, 20 мл безводного толуола, 1,47 мл триэтиламина, 1,4 мл дифенилфосфорилазида, 740 мг гидрохлорида метилового эфира L-аланина и 20 мл безводного диметилформамида. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 2: 1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего остаток перекристаллизовывали из этилацетата с получением 0,80 г желтых кристаллов.
Полученные кристаллы растворяли в смеси 10 мл метанола и 3 мл тетрагидрофурана и затем к раствору по каплям добавляли 16,8 мл 1 н. водного раствора гидроксида натрия. Полученную смесь перемешивали при комнатной температуре в течение 6 часов 30 минут. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 141 мг указанного в заголовке соединения в виде бледно-желтых кристаллов, имеющего точку плавления от 128 до 130oC.
Пример 53 -липоевой кислоты, 20 мл безводного толуола, 1,47 мл триэтиламина, 1,4 мл дифенилфосфорилазида, 740 мг гидрохлорида метилового эфира L-аланина и 20 мл безводного диметилформамида. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 2: 1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего остаток перекристаллизовывали из этилацетата с получением 0,80 г желтых кристаллов.
Полученные кристаллы растворяли в смеси 10 мл метанола и 3 мл тетрагидрофурана и затем к раствору по каплям добавляли 16,8 мл 1 н. водного раствора гидроксида натрия. Полученную смесь перемешивали при комнатной температуре в течение 6 часов 30 минут. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 141 мг указанного в заголовке соединения в виде бледно-желтых кристаллов, имеющего точку плавления от 128 до 130oC.
Пример 532 (S)-[5-(1,2-дитиолан-3-ил) пентаноиламино]пропионовая кислота (Соединение N 1-48) 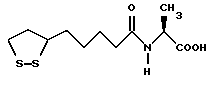 Реакцию проводили, как описано в Примере 49, но применяя 153 мг метил 2(S)-[5-(1,2-дитиолан-3-ил) пентаноиламино] пропионата (полученного, как описано в Примере 51), 3 мл метанола и 1,3 мл 1 н. водного раствора гидроксида натрия. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 90 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,18 (тонкослойная хроматография на силикагеле; с применением этилацетата в качестве проявляющего растворителя). Пример 54 Метил 3-{3-[4-(1,2-дитиолан-3-ил)бутил]уреидо}пропионат (метиловый эфир Соединения N 1-741) 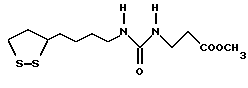 Реакцию проводили, как описано в Примере 46, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного толуола, 0,74 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 335 мг гидрохлорида метилового эфира -липоевой кислоты, 10 мл безводного толуола, 0,74 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 335 мг гидрохлорида метилового эфира  -аланина и 10 мл безводного диметилформамида. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 3: 1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего остаток перекристаллизовывали из 1:2 (по объему) смеси этилацетат : гексан с получением 213 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 67 до 69oC.
Пример 55 -аланина и 10 мл безводного диметилформамида. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 3: 1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего остаток перекристаллизовывали из 1:2 (по объему) смеси этилацетат : гексан с получением 213 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 67 до 69oC.
Пример 55Метил 3-[5-(1,2-дитиолан-3-ил) пентаноиламино]пропионат (метиловый эфир Соединения N 1-49) 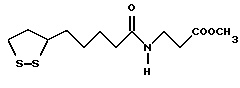 Реакцию проводили, как описано в Примере 47, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола и 0,36 мл триэтиламина и 335 мг гидрохлорида метилового эфира -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола и 0,36 мл триэтиламина и 335 мг гидрохлорида метилового эфира  -аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его перекристаллизовывали из 1:2 смеси этилацетат : гексан с получением 333 мг указанного в заголовке соединения в виде желтых ленточных кристаллов, имеющего точку плавления от 54 до 55oC.
Пример 56 -аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, после чего его перекристаллизовывали из 1:2 смеси этилацетат : гексан с получением 333 мг указанного в заголовке соединения в виде желтых ленточных кристаллов, имеющего точку плавления от 54 до 55oC.
Пример 563-{3-[4-(1,2-Дитиолан-3-ил)бутил] уреидо}пропионовая кислота (Соединение N 1-741) 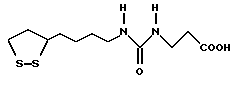 Реакцию проводили, как описано в Примере 48, но применяя 115 мг метил 3-{3-[4-(1,2-дитиолан-3-ил)бутил]уреидо}пропионата (полученного, как описано в Примере 54), 3 мл метанола, 2 мл тетрагидрофурана и 1,40 мл 1 н. водного раствора гидроксида натрия. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и выпавшие при этом в осадок кристаллы собирали путем фильтрования с получением 70 мг указанного в заголовке соединения в виде желтого порошка, имеющего точку плавления от 108 до 110oC. Пример 57 3-[5-(1,2-Дитиолан-3-ил)пентаноиламино]пропионовая кислота (Соединение N 1-49) 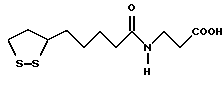 Реакцию проводили, как описано в Примере 49, но применяя 213 мг метил 3-[5-(1,2-дитиолан-3-ил)пентаноиламино] пропионата (полученного, как описано в Примере 55), 4 мл метанола и 1,80 мл 1 н. водного раствора гидроксида натрия. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 0,11 г указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 74 до 76oC. Пример 58 2-[5-(1,2-Дитиолан-3-ил) пентил]изоиндол-1,3-дион (Соединение N 1-2606)  К раствору 5,77 г трифенилфосфина в 20 мл тетрагидрофурана на ледяной бане по каплям добавляли 3,25 мл диметилазодикарбоксилата и затем смесь перемешивали при комнатной температуре в течение 30 минут. Затем к реакционной смеси добавляли 3,24 г фталимида, после чего по каплям добавляли смесь 20 ммоль 5-(1,2-дитиолан-3-ил)пентанола (полученного, как описано в Получении 1) в 30 мл толуола и 10 мл тетрагидрофурана и смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь выдерживали в течение ночи при комнатной температуре, после чего добавляли 1,57 г трифенилфосфина и 0,89 мл диметилазодикарбоксилата. Полученную смесь перемешивали при комнатной температуре в течение 7 часов 30 минут. Затем к реакционной смеси добавляли 0,88 г фталимида, 1,57 г трифенилфосфина и 0,89 мл диметилазодикарбоксилата. Реакционную смесь выдерживали в течение 4 суток. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:6 и 1:4 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем перегонки в условиях пониженного давления и к остатку добавляли 30 мл толуола. 1 мл полученной смеси взвешивали и растворитель удаляли из нее путем перегонки в условиях пониженного давления с получением 165 мг указанного в заголовке соединения в виде оранжевого масла, обладающего значением Rf, равным 0,35 (тонкослойная хроматография на силикагеле с применением 1:4 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 59 N-[5-(1,2-Дитиолан-3-ил) пентил]метансульфонамид (Соединение N 1-2470) 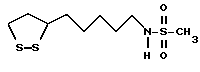 К раствору 0,24 г 2-[5-(1,2-дитиолан-3-ил)пентил] изоиндол-1,3-диона в 1 мл метанола добавляли 1 мл бутиламина. Полученную смесь затем перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь затем выдерживали в течение ночи при комнатной температуре. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления. К остатку добавляли 2 мл тетрагидрофурана, а затем к ним по каплям на ледяной бане добавляли 0,22 мл триэтиламина и 0,12 мл метансульфонилхлорида. Смесь затем перемешивали при комнатной температуре в течение 3 часов. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 1:1 (по объему) смесей ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления, а остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и полученный остаток растворяли в диоксане, после чего его лиофилизировали с получением 100 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 43 до 46oC. Пример 60 N-[5-(1,2-Дитиолан-3-ил) пентил]ацетамид (Соединение N 1-1962) 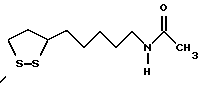 К смеси 1,3 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил] изоиндол- 1,3-диона, 9 мл толуола и 2 мл метанола добавляли 1 мл бутиламина. Полученную смесь перемешивали при комнатной температуре в течение 3 часов, после чего реакционную смесь выдерживали при комнатной температуре в течение 2 суток. Затем к реакционной смеси добавляли 1 мл бутиламина. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Затем к остатку добавляли 5 мл безводного тетрагидрофурана. Затем к полученной смеси на ледяной бане по каплям добавляли 0,28 мл триэтиламина и 0,14 мл ацетилхлорида и затем смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. По истечении данного промежутка времени растворитель удаляли путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0 и 10:1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель удаляли из элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 161 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 28 до 33oC. Пример 61 N-[5-(1,2-Дитиолан-3-ил)пентил]пропионамид (Соединение N 1-1963) 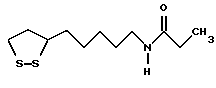 К раствору 1,6 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил] изоиндол-1,3-диона в 3 мл толуола добавляли 2 мл метанола и 2 мл бутиламина. Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Затем к остатку добавляли 5 мл пиридина. К полученной смеси по каплям добавляли 0,31 мл пропионового ангидрида и затем смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1, 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 1:4, 3:7, 2: 3 и 1: 1 (по объему) смесей ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления, а остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 125 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,45 (тонкослойная хроматография на силикагеле; с применением этилацетата в качестве проявляющего растворителя). Пример 62 [5-(1,2-Дитиолан-3-ил)пентил]мочевина (Соединение N 1-1993) 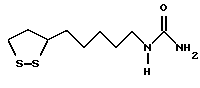 К раствору 1,6 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил]изоиндол-1,3-диона в 3 мл толуола добавляли 2 мл метанола и 2 мл бутиламина. Полученную смесь перемешивали при комнатной температуре в течение 5 часов 30 минут. Реакционную смесь затем выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. К остатку добавляли 5 мл тетрагидрофурана. К полученной смеси на ледяной бане по каплям добавляли 0,32 мл триметилсилилизоцианата и затем смесь перемешивали при комнатной температуре в течение 3 часов 30 минут. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0 и 5:1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель удаляли из элюата путем перегонки в условиях пониженного давления. Остаток перекристаллизовывали из этилацетата с получением 80 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 74 до 78oC. Пример 63 1-[5-(1,2-Дитиолан-3-ил)пентил]-3-метилтиомочевина (Соединение N 1-2567) 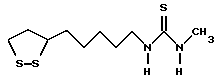 Реакцию проводили, как описано в Примере 62, но применяя 1,5 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил] изоиндол-1,3-диона в 3 мл толуола, 2 мл метанола, 2 мл бутиламина, 5 мл безводного тетрагидрофурана и 0,12 метилизотиоцианата. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0 и 20:1 (по объему) смеси этилацетат : метанол в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 3:7 и 1:1 (по объему) смесей ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток затем экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток перекристаллизовывали из 1:1 (по объему) смеси этилацетат : гексан с получением 183 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 64 до 65oC. Пример 64 Этил [5-(1,2-дитиолан-3-ил)пентил]карбамат (Соединение N 1-1977) 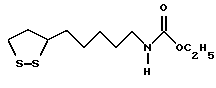 К раствору 1,6 ммоль 2-[5-(1,2-дитиолан-3-ил) пентил]изоиндол-1,3-диона в 3 мл толуола добавляли 2 мл метанола и 2 мл бутиламина. Полученную смесь перемешивали при комнатной температуре в течение 7 часов. По истечении данного промежутка времени реакционную смесь выдерживали при комнатной температуре в течение ночи. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К полученному остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. К остатку добавляли 2 мл безводного тетрагидрофурана, а затем на ледяной бане добавляли по каплям 0,33 мл триэтиламина и 0,23 мл этилхлорформиата. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 1: 3 и 1:2 (по объему) смеси этилацетат : гексан в качестве элюента, с последующей очисткой по методу обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления, а остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 75 мг указанного в заголовке соединения в виде красного масла, обладающего значением Rf, равным 0,46 (тонкослойная хроматография на силикагеле; с применением 1:2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 65 Метил N-[5-(1,2-дитиолан-3-ил)пентил]оксаламидат (Соединение N 1-2590) 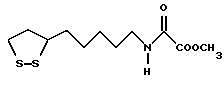 К раствору 1,5 ммоль 2-[5-(1,2-дитиолан -3-ил)пентил]изоиндол-1,3-диона в 3 мл толуола добавляли 2 мл метанола и 2 мл бутиламина. Полученную смесь перемешивали при комнатной температуре в течение одного часа. Затем реакционную смесь выдерживали при комнатной температуре в течение ночи. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. К остатку добавляли 4 мл безводного тетрагидрофурана, а затем на ледяной бане по каплям добавляли 0,32 мл триэтиламина и 0,21 мл хлорангидрида метилщавелевой кислоты. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 2:3 (по объему) смеси ацетонитрил вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток затем экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 154 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 42 до 43oC. Пример 66 N-[5-(1,2-Дитиолан-3-ил) пентил]сукцинамовая кислота (Соединение N 1-1970) 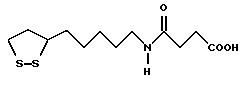 Реакцию проводили, как описано в Примере 61, но применяя 1,5 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил] изоиндол-1,3-диона в 3 мл толуола, 2 мл метанола, 2 мл бутиламина, 4 мл пиридина и 230 мг янтарного ангидрида. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 2: 3, 1: 1 и 3:2 (по объему) смесей ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 166 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления 74oC. Пример 67 4-[5-(1,2-Дитиолан-3-ил)пентилкарбамоил]бутановая кислота (Соединение N 1-2577) 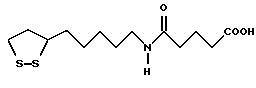 Реакцию проводили, как описано в Примере 61, но применяя 1,5 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил] изоиндол-1,3-диона в 3 мл толуола, 2 мл метанола, 2 мл бутиламина, 4 мл пиридина и 262 мг глутарового ангидрида. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 2: 3 (по объему) смеси ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 132 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 60 до 62oC. Пример 68 Метил-[5-(1,2-дитиолан-3-ил)пентиламино]ацетат (Соединение N 1-2584) 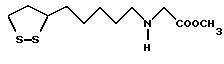 К раствору 1,6 ммоль 2-[5-(1,2-дитиолан-3-ил) пентил]изоиндол-1,3-диона в 3 мл толуола добавляли 2 мл метанола и 2 мл бутиламина. Полученную смесь выдерживали при комнатной температуре в течение ночи. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. К остатку добавляли 4 мл безводного тетрагидрофурана, а затем на ледяной бане добавляли по каплям 0,33 мл триэтиламина и 0,17 мл метилбромацетата. Полученную смесь перемешивали на ледяной бане в течение одного часа, а затем в течение 5 часов при комнатной температуре. Реакционную смесь выдерживали при комнатной температуре в течение 2 суток. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0 и 20:1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 195 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,55 (тонкослойная хроматография на силикагеле; с применением 4:1 (по объему) смеси этилацетат : метанол в качестве проявляющего растворителя). Пример 69 Метил 3-[5-(1,2-Дитиолан-3-ил) пентиламино]пропионат (метиловый эфир Соединения N 1-2586) 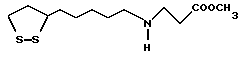 Реакцию проводили, как описано в Примере 68, но применяя 1,5 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил] изоиндол-1,3-диона, 2 мл метанола, 2 мл бутиламина, 4 мл безводного тетрагидрофурана, 0,24 мл триэтиламина и 0,19 метилбромпропионата. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0, 20:1 и 4: 1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 161 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,21 (тонкослойная хроматография на силикагеле; с применением 4:1 (по объему) смеси этилацетат : метанол в качестве проявляющего растворителя). Пример 70 Метил 2(R)-{3-[4-(1,2-дитиолан-3-ил) бутил]уреидо}пропионат (Соединение N 1-742) 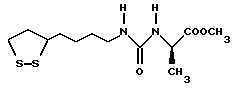 Реакцию проводили, как описано в Примере 46, но применяя 0,51 г D,L- 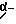 липоевой кислоты, 10 мл безводного толуола, 0,75 мл триэтиламина, 0,59 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 0,34 г гидрохлорида метилового эфира D-аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 1: 1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 0,27 г указанного в заголовке соединения в виде желтого порошка, имеющего точку плавления от 72 до 82oC.
Пример 71 липоевой кислоты, 10 мл безводного толуола, 0,75 мл триэтиламина, 0,59 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 0,34 г гидрохлорида метилового эфира D-аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя 1: 1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 0,27 г указанного в заголовке соединения в виде желтого порошка, имеющего точку плавления от 72 до 82oC.
Пример 712(R)-{3-[4-(1,2-дитиолан-3-ил) бутил]уреидо}пропионовая кислота (Соединение N 1-740) 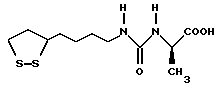 Реакцию проводили, как описано в Примере 48, но применяя 1,74 г метил 2(R)-{ 3-[4-(1,2-дитиолан-3-ил)бутил] уреидо} пропионата (полученного, как описано в Примере 70), 30 мл метанола, 22 мл тетрагидрофурана и 17,0 мл 1 н. водного раствора гидроксида натрия. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток перекристаллизовывали из этилацетата с получением 0,56 г указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 131 до 134oC. Пример 72 N-(2-{3-[4-(1,2-Дитиолан-3-ил) бутил]уреидо}пропионил) метансульфонамид (Соединение N 1-1280) 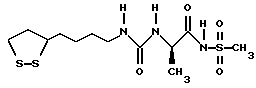 (а) К раствору 208 мг 2(R)-{3-[4-(1,2-дитиолан-3-ил)бутил] уреидо}пропионовой кислоты (полученной, как описано в Примере 71) в 2 мл безводного диметилформамида добавляли 127 мг N,N’-карбонилдиимидазола и смесь затем перемешивали при комнатной температуре в течение 3 часов 10 минут. (б) Тем временем 34 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) промывали гексаном и затем при комнатной температуре добавляли 3 мл безводного диметилформамида. К полученной смеси на ледяной бане добавляли 74 мг метансульфонамида и смесь затем перемешивали при комнатной температуре в течение 3 часов 45 минут. По истечении данного промежутка времени к реакционной смеси по каплям добавляли раствор, полученный, как описано на стадии (а) выше, и полученную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь затем выдерживали в течение ночи при комнатной температуре. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток перекристаллизовывали из метанола с получением 77 мг указанного в заголовке соединения в виде бледно-желтого порошка, имеющего точку плавления от 140 до 150oC. Пример 73 Метил 4-[5-(1,2-дитиолан-3-ил) пентаноиламино]бутаноат (метиловый эфир Соединения N 1-1275)  (а) К раствору 1 г D,L-  -липоевой кислоты в 20 мл безводного диметилформамида на ледяной бане добавляли 0,86 г N,N’-карбонилдиимидазола. Полученную смесь затем перемешивали при комнатной температуре в течение 1 часа 25 минут.
(б) Тем временем 0,23 г гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) промывали гексаном, после чего добавляли 20 мл безводного диметилформамида. Затем на ледяной бане добавляли 0,82 г метил 4-аминобутаноата и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа 45 минут. Затем к реакционной смеси на ледяной бане по каплям добавляли раствор, полученный, как описано на стадии (а) выше, и затем смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Реакционную смесь выдерживали в течение ночи при комнатной температуре, после чего растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. После нейтрализации путем добавления 2 н. водной соляной кислоты полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:1, а затем 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Этилацетат удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 0,83 г указанного в заголовке соединения в виде желтого порошка, имеющего точку плавления от 30 до 32oC.
Пример 74 -липоевой кислоты в 20 мл безводного диметилформамида на ледяной бане добавляли 0,86 г N,N’-карбонилдиимидазола. Полученную смесь затем перемешивали при комнатной температуре в течение 1 часа 25 минут.
(б) Тем временем 0,23 г гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) промывали гексаном, после чего добавляли 20 мл безводного диметилформамида. Затем на ледяной бане добавляли 0,82 г метил 4-аминобутаноата и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа 45 минут. Затем к реакционной смеси на ледяной бане по каплям добавляли раствор, полученный, как описано на стадии (а) выше, и затем смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Реакционную смесь выдерживали в течение ночи при комнатной температуре, после чего растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. После нейтрализации путем добавления 2 н. водной соляной кислоты полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:1, а затем 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Этилацетат удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 0,83 г указанного в заголовке соединения в виде желтого порошка, имеющего точку плавления от 30 до 32oC.
Пример 744-[5-(1,2-Дитиолан-3-ил) пентаноиламино]бутановая кислота (Соединение N 1-1275) 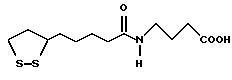 Реакцию проводили, как описано в Примере 49, но применяя 0,65 г метил 4-[5-(1,2-дитиолан-3-ил)пентаноиламино]бутаноата (полученного, как описано в Примере 73), 13 мл метанола и 1 н. водный раствор гидроксида натрия. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. После нейтрализации путем добавления 2 н. водной соляной кислоты полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток перекристаллизовывали из этилацетата с получением 0,28 г указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 56 до 58oC. Пример 75 Метил 4-{3-[4-(1,2-дитиолан-3-ил) бутил]уреидо}бутаноат (метиловый эфир Соединения N 1-1276) 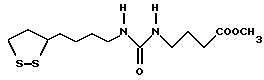 Реакцию проводили, как описано в Примере 46, но применяя 1,00 г D,L-  -липоевой кислоты, 20 мл безводного толуола, 1,48 мл триэтиламина, 1,15 мл дифенилфосфорилазида и 0,74 г гидрохлорида метил 4-аминобутаноата. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя этилацетат в качестве элюента. Этилацетат удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления с получением 1,18 г указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 63 до 70oC.
Пример 76 -липоевой кислоты, 20 мл безводного толуола, 1,48 мл триэтиламина, 1,15 мл дифенилфосфорилазида и 0,74 г гидрохлорида метил 4-аминобутаноата. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток подвергали колоночной хроматографии на силикагеле, применяя этилацетат в качестве элюента. Этилацетат удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления с получением 1,18 г указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 63 до 70oC.
Пример 76N-[5-(1,2-Дитиолан-3-ил) пентил]оксаламиновая кислота (Соединение N 1-2589) 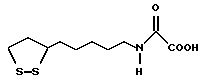 Реакцию проводили, как описано в Примере 49, но применяя 92 мг метил N-[5-(1,2-дитиолан-3-ил)пентил] оксаламидата (полученного, как описано в Примере 65), 4 мл метанола, 17 мл тетрагидрофурана и 0,6 мл 1 н. водного раствора гидроксида натрия. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду. Полученную смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 64 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 75 до 79oC. Пример 77 Метил N-[5-(1,2-дитиолан-3 -ил)пентил]сукцинимидат (метиловый эфир Соединения N 1-1970) 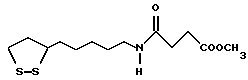 К смеси 89 мг N-[5-(1,2-дитиолан-3-ил)пентил]сукцинамовой кислоты, 1 мл метанола и 1,5 мл толуола добавляли по каплям 0,25 мл гексанового раствора, содержащего 2,0 М (триметилсилил)диазометан, и затем смесь перемешивали при комнатной температуре в течение 30 минут. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. Полученный остаток подвергали колоночной хроматографии на силикагеле, применяя 1:1 и 1:0 (по объему) смеси этилацетат и гексан в качестве элюента. Этилацетат и гексан удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Полученный остаток растворяли в диоксане, после чего его лиофилизировали с получением 77 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 46 до 48oC. Пример 78 Метил 4-[5-(1,2-дитиолан-3 -ил)пентилкарбамоил]бутаноат (метиловый эфир Соединения N 1-2577) 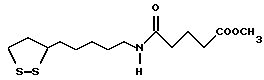 Реакцию проводили, как описано в Примере 77, но применяя 68 мг 4-[5-(1,2-дитиолан-3-ил)пентилкарбамоил] бутановой кислоты (полученной, как описано в Примере 67), 1 мл метанола, 1 мл толуола и 0,40 мл гексанового раствора, содержащего 2,0 М (триметилсилил)диазометан. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления. Полученный остаток подвергали колоночной хроматографии на силикагеле, применяя 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления. Полученный остаток растворяли в диоксане, после чего его лиофилизировали с получением 62 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 69 до 71oC. Пример 79 Этил {N-[5-(1,2-дитиолан-3 -ил)пентаноил]-N-метиламино} ацетат (этиловый эфир Соединения N 1-2520) 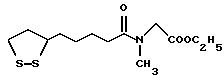 Реакцию проводили, как описано в Примере 47, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола, 0,36 мл триэтиламина и 399 мг гидрохлорида этилового эфира саркозина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 558 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,39 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 80 -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола, 0,36 мл триэтиламина и 399 мг гидрохлорида этилового эфира саркозина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 558 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,39 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 80Метил 4-{N-[5-(1,2-дитиолан-3 -ил)пентаноил]-N-метиламино}бутаноат (метиловый эфир Соединения N 1-2669) 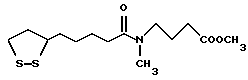 Реакцию проводили, как описано в Примере 47, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола, 0,36 мл триэтиламина и 486 мг гидрохлорида метил 4-(метиламино) бутаноата. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 4: 1 (по объему) смеси этилацетат : гексан в качестве элюента с последующим проведением обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 2: 3 и 9:11 (по объему) смесей ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления и остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 229 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,37 (тонкослойная хроматография на силикагеле; с применением 4:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 81 -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола, 0,36 мл триэтиламина и 486 мг гидрохлорида метил 4-(метиламино) бутаноата. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 4: 1 (по объему) смеси этилацетат : гексан в качестве элюента с последующим проведением обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 2: 3 и 9:11 (по объему) смесей ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем перегонки в условиях пониженного давления и остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления. Остаток растворяли в диоксане, после чего его лиофилизировали с получением 229 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,37 (тонкослойная хроматография на силикагеле; с применением 4:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 812-[4-(2,4-Диоксотиазолидин-5 -илметил)феноксиметил] – 2,5,7,8-тетраметилхроман-6-ил 5-(1,2-дитиолан-3-ил)пентаноат 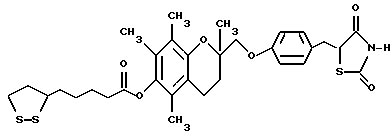 К 10 мл раствора 500 мг D,L-  -липоевой кислоты в безводном диметилформамиде на ледяной бане добавляли 0,36 мл триэтиламина и затем 0,25 мл этилхлорформиата и смесь перемешивали при комнатной температуре в течение 2 часов. По истечении данного промежутка времени к реакционному раствору на ледяной бане добавляли 1,06 г 5-[4-(2,5,7,8-тетраметилхроман-2-илметокси) бензил]тиазолидин-2,4-диона и смесь перемешивали при комнатной температуре в течение 5 часов, после чего ее выдерживали при комнатной температуре в течение ночи. Смесь затем перемешивали на масляной бане при 50oC в течение 1 часа и растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 3:2 (по объему) смесь этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:1 и 4:1 (по объему) смеси ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем выпаривания в условиях пониженного давления и остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 0,57 г указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,42 (тонкослойная хроматография на силикагеле; с применением 1:2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 82 -липоевой кислоты в безводном диметилформамиде на ледяной бане добавляли 0,36 мл триэтиламина и затем 0,25 мл этилхлорформиата и смесь перемешивали при комнатной температуре в течение 2 часов. По истечении данного промежутка времени к реакционному раствору на ледяной бане добавляли 1,06 г 5-[4-(2,5,7,8-тетраметилхроман-2-илметокси) бензил]тиазолидин-2,4-диона и смесь перемешивали при комнатной температуре в течение 5 часов, после чего ее выдерживали при комнатной температуре в течение ночи. Смесь затем перемешивали на масляной бане при 50oC в течение 1 часа и растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 3:2 (по объему) смесь этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:1 и 4:1 (по объему) смеси ацетонитрил : вода в качестве элюента. Ацетонитрил удаляли из полученного таким образом элюата путем выпаривания в условиях пониженного давления и остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 0,57 г указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,42 (тонкослойная хроматография на силикагеле; с применением 1:2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 822-(3,4-Дибензилокси-5-оксо- 2,5-дигидрофуран-2-ил)-2- гидроксиэтил 5-(1,2-дитиолан-3-ил)пентаноат 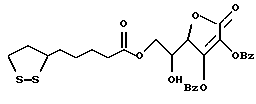 (“Bz” представляет собой бензил) К 6 мл раствора 300 мг D,L-  -липоевой кислоты в безводном диметилформамиде на ледяной бане добавляли 276 мг N,N’-карбонилдиимидазола и смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. По истечении данного промежутка времени к реакционному раствору на ледяной бане добавляли 0,24 мл триэтиламина и 536 мг 2,3-O-дибензиласкорбиновой кислоты и смесь перемешивали при комнатной температуре в течение 1 часа, после чего ее выдерживали при комнатной температуре в течение 2 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:3 и 1:1 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 11:9, 3:2 и 13:7 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 321 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,34 (тонкослойная хроматография на силикагеле; с применением 1: 2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 83 -липоевой кислоты в безводном диметилформамиде на ледяной бане добавляли 276 мг N,N’-карбонилдиимидазола и смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. По истечении данного промежутка времени к реакционному раствору на ледяной бане добавляли 0,24 мл триэтиламина и 536 мг 2,3-O-дибензиласкорбиновой кислоты и смесь перемешивали при комнатной температуре в течение 1 часа, после чего ее выдерживали при комнатной температуре в течение 2 суток. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:3 и 1:1 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 11:9, 3:2 и 13:7 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 321 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,34 (тонкослойная хроматография на силикагеле; с применением 1: 2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 835-(1,2-Дитиолан-3-ил)-1- (имидазол-1-ил)пентан-1-он 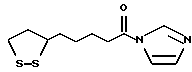 К 20 мл раствора 1,00 г D,L-  липоевой кислоты в безводном диметилформамиде на ледяной бане добавляли 0,86 г N,N’-карбонилдиимидазола и смесь перемешивали при комнатной температуре в течение 1 часа. По истечении данного промежутка времени к реакционному раствору на ледяной бане добавляли 311 мг хлорметансульфонамида и 104 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь затем выдерживали при комнатной температуре в течение ночи, после чего растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2: 1, 4:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 2: 3 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 245 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 37 до 39oC.
Пример 84 липоевой кислоты в безводном диметилформамиде на ледяной бане добавляли 0,86 г N,N’-карбонилдиимидазола и смесь перемешивали при комнатной температуре в течение 1 часа. По истечении данного промежутка времени к реакционному раствору на ледяной бане добавляли 311 мг хлорметансульфонамида и 104 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь затем выдерживали при комнатной температуре в течение ночи, после чего растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2: 1, 4:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 2: 3 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 245 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 37 до 39oC.
Пример 84трет-Бутил 4-[5-(1,2-дитиолан-3 -ил)пентаноил]пиперазин-1-карбоксилат (трет-бутоксикарбонильное производное Соединения N 1-1131) (“Boc” представляет собой трет-бутоксикарбонил). 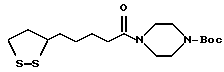 Реакцию проводили, как описано в Примере 43, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола и 484 мг N-трет-бутоксикарбонилпиперазина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат: гексан в качестве элюента. Остаток растворяли в диоксане и затем лиофилизировали с получением 520 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 70 до 71oC.
Пример 85 -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола и 484 мг N-трет-бутоксикарбонилпиперазина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат: гексан в качестве элюента. Остаток растворяли в диоксане и затем лиофилизировали с получением 520 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, имеющего точку плавления от 70 до 71oC.
Пример 855-(1,2-дитиолан-3-ил)-1 -(пиперазин-1-ил)пентан-1-он гидрохлорид (гидрохлорид Соединения N 1-1131) 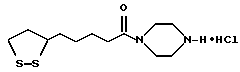 К 5 мл раствора 260 мг трет-бутил-4-[5-(1,2-дитиолан-3-ил) пентаноил] пиперазин-1-карбоксилата (полученного, как описано в Примере 84) в этилацетате по каплям добавляли 3 мл 4 н. раствора хлороводорода в этилацетате и смесь перемешивали при комнатной температуре в течение 3 часов. Кристаллы, которые выпадали в осадок, собирали путем фильтрования с получением 217 мг указанного в заголовке соединения в виде бледно-желтого порошка, имеющего точку плавления от 84 до 86oC. Пример 86 [4-(1,2-Дитиолан-3-ил) бутил]амид тиазолидин-3-карбоновой кислоты (Соединение N 1-1260) 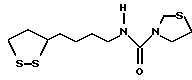 Реакцию проводили, как описано в Примере 44, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного толуола, 0,36 мл триэтиламина, 0,56 мл дифенилфосфорилазида и 0,20 г тиазолидина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из 1:1 (по объему) смеси этилацетат : гексан с получением 386 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 76 до 77oC.
Пример 87 -липоевой кислоты, 10 мл безводного толуола, 0,36 мл триэтиламина, 0,56 мл дифенилфосфорилазида и 0,20 г тиазолидина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из 1:1 (по объему) смеси этилацетат : гексан с получением 386 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 76 до 77oC.
Пример 87(1-Метил-2-нитроксиэтил)амид 5-(1, 2-дитиолан-3-ил) пентановой кислоты (нитрат Соединения N 1-2665) 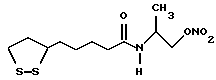 Реакцию проводили, как описано в Примере 47, но применяя 300 мг D,L-  -липоевой кислоты, 9 мл безводного диметилформамида, 259 мг N,N’-карбонилдиимидазола, 0,22 мл триэтиламина и 251 мг 1-метил-2-нитроксиэтиламина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 3:2 и 2:1 (по объему) смеси этилацетат: гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7, 2:3 и 7:3 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 119 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,39 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 88 -липоевой кислоты, 9 мл безводного диметилформамида, 259 мг N,N’-карбонилдиимидазола, 0,22 мл триэтиламина и 251 мг 1-метил-2-нитроксиэтиламина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 3:2 и 2:1 (по объему) смеси этилацетат: гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:7, 2:3 и 7:3 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 119 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,39 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 881-[4-(1,2-Дитиолан-3-ил) бутил]-3-(2-нитроксиэтил) мочевина (нитрат Соединения N 1-2661) 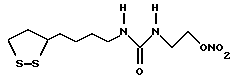 Реакцию проводили, как описано в Примере 46, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного толуола, 0,72 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 342 мг 2-нитроксиэтиламингидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия.
Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из 1:2 (по объему) смеси этилацетат : гексан с получением 58 мг указанного в заголовке соединения в виде бледно-желтого порошка, обладающего значением Rf, равным 0,31 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 89 -липоевой кислоты, 10 мл безводного толуола, 0,72 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 342 мг 2-нитроксиэтиламингидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия.
Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из 1:2 (по объему) смеси этилацетат : гексан с получением 58 мг указанного в заголовке соединения в виде бледно-желтого порошка, обладающего значением Rf, равным 0,31 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 893-(1,2-Дитиолан-3-ил)пропионовая кислота 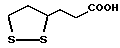 К раствору 500 мг 4,6-дитиоксигексановой кислоты в 5 мл 1 н. водного раствора гидроксида натрия добавляли 1,3 мл 2 н. водной соляной кислоты. Затем к реакционной смеси по каплям добавляли 5 капель 1% (м/о) водного раствора хлорида железа (III) и полученную смесь перемешивали при комнатной температуре в течение 1 часа в то время, как через смесь пропускали воздух. Затем к реакционному раствору добавляли воду и промывали затем этилацетатом. Водный слой нейтрализовали путем добавления 2 н. водной соляной кислоты и затем экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 388 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,59 (тонкослойная хроматография на силикагеле; с применением 2: 1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 90 2-[5-(1,2-Дитиолан-3-ил)пентаноиламино] ацетамид (амид Соединения N 1-46)  Реакцию проводили, как описано в Примере 47, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N-карбонилдиимидазола, 0,36 мл триэтиламина и 265 мг глицинамидгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и кристаллы, которые выпадали в осадок, собирали путем фильтрования с получением 330 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 105 до 108oC.
Пример 91 -липоевой кислоты, 10 мл безводного диметилформамида, 422 мг N,N-карбонилдиимидазола, 0,36 мл триэтиламина и 265 мг глицинамидгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и кристаллы, которые выпадали в осадок, собирали путем фильтрования с получением 330 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 105 до 108oC.
Пример 912-{3-[4-(1,2-Дитиолан-3-ил) бутил]уреидо}ацетамид (амид Соединения N 1-738) 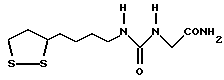 Реакцию проводили, как описано в Примере 46, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного толуола, 0,56 мл триэтиламина, 0,72 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 265 мг глицинамидгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 149 мг указанного в заголовке соединения в виде желтого порошка, имеющего точку плавления от 141 до 143oC.
Пример 92 -липоевой кислоты, 10 мл безводного толуола, 0,56 мл триэтиламина, 0,72 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 265 мг глицинамидгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 149 мг указанного в заголовке соединения в виде желтого порошка, имеющего точку плавления от 141 до 143oC.
Пример 921-(Индолин-1-ил)-5-(1,2 -дитиолан-3-ил)пентан-1-он (Соединение N 1-2674) 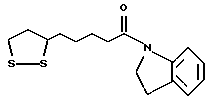 Реакцию проводили, как описано в Примере 43, но применяя 1,00 мг D,L-  липоевой кислоты, 30 мл безводного диметилформамида, 0,86 г N,N’-карбонилдиимидазола, 0,73 мл триэтиламина и 1,13 г метил индолин-2-карбоксилатгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:4 и 1:2 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:2 (по объему) смесь ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия.
Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 0,84 г указанного в заголовке соединения в виде бледно-желтого порошка, имеющего точку плавления от 65 до 66oC.
Пример 93 липоевой кислоты, 30 мл безводного диметилформамида, 0,86 г N,N’-карбонилдиимидазола, 0,73 мл триэтиламина и 1,13 г метил индолин-2-карбоксилатгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:4 и 1:2 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 3:2 (по объему) смесь ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия.
Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 0,84 г указанного в заголовке соединения в виде бледно-желтого порошка, имеющего точку плавления от 65 до 66oC.
Пример 93Метил 1-[4-(1,2-дитиолан-3-ил) бутилкарбамоил]индолин-2- карбоксилат (метиловый эфир Соединения N 1-2676) 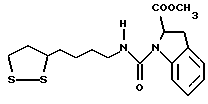 Реакцию проводили, как описано в Примере 44, но применяя 1,00 мг D,L-  -липоевой кислоты, 25 мл безводного толуола, 0,73 мл триэтиламина, 1,14 мл дифенилфосфорилазида и 0,94 г метил индолин-2-карбоксилата. Реакционный раствор промывали водой и толуольный слой отделяли и промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Толуол удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1: 2, 1:1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 485 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 86 до 89oC.
Пример 94 -липоевой кислоты, 25 мл безводного толуола, 0,73 мл триэтиламина, 1,14 мл дифенилфосфорилазида и 0,94 г метил индолин-2-карбоксилата. Реакционный раствор промывали водой и толуольный слой отделяли и промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Толуол удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1: 2, 1:1 и 2:1 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 485 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 86 до 89oC.
Пример 941-[4-(1,2-Дитиолан-3-ил) бутилкарбамоил]индолин-2-карбоновая кислота (Соединение N 1-2676) 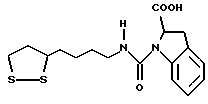 Реакцию проводили, как описано в Примере 48, но применяя 200 мг метил-1-[4-(1,2-дитиолан-3-ил) бутилкарбамоил]индолин-2-карбоксилата (полученного, как описано в Примере 93), 4 мл метанола, 2 мл тетрагидрофурана и 1,0 мл 1 н. водного раствора гидроксида натрия. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 98 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, обладающего значением Rf, равным 0,12 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 95 Метил 3-[3-(1,2-дитиолан-3 -ил)пропиониламино] пропионат 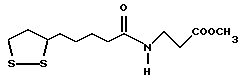 К 6 мл смеси 2,5 ммоль 3-(1,2-дитиолан-3-ил)пропионовой кислоты в смеси этилацетата и диметилформамида добавляли 5 мл безводного тетрагидрофурана. К реакционному раствору на ледяной бане добавляли 0,6 мл триэтиламина, 349 мг гидрохлорида метилового эфира  -аланина и 0,38 мл диэтилцианофосфата и полученную смесь перемешивали на ледяной бане в течение 1 часа. По истечении данного промежутка времени реакционную смесь перемешивали при комнатной температуре в течение 30 минут и затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1, 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 2: 3 (по объему) смесь ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 229 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,24 (тонкослойная хроматография на силикагеле; с применением 3:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 96 -аланина и 0,38 мл диэтилцианофосфата и полученную смесь перемешивали на ледяной бане в течение 1 часа. По истечении данного промежутка времени реакционную смесь перемешивали при комнатной температуре в течение 30 минут и затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1, 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 2: 3 (по объему) смесь ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 229 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,24 (тонкослойная хроматография на силикагеле; с применением 3:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 961,2-Дитиолан-4-карбоновая кислота 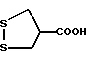 К 20 мл раствора 3,06 г метил (1,3-диацетилтио) пропил-2-карбоксилата в метаноле добавляли 40 мл 5 н. водной соляной кислоты и смесь нагревали с обратным холодильником в течение 5 часов 30 минут. По истечении данного промежутка времени реакционную смесь выдерживали при комнатной температуре в течение ночи и затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали разбавленным водным раствором гидрокарбоната натрия, а затем насыщенным водным раствором хлорида натрия, после чего его сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и к остатку добавляли 150 мл насыщенного водного раствора гидрокарбоната натрия и каталитическое количество гексагидрата хлорида железа (III) и затем смесь перемешивали при комнатной температуре в течение 8 часов. Реакционную смесь затем выдерживали при комнатной температуре в течение ночи, после чего растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Значение pH водного слоя доводили до 2 с помощью добавления водной соляной кислоты и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 0,25 г указанного в заголовке соединения в виде желтых кристаллов, обладающего значением Rf, равным 0,56 (тонкослойная хроматография на силикагеле; с применением 5:1 (по объему) смеси этилацетат : метанол в качестве проявляющего растворителя). Пример 97 Метил 1,2-дитиолан-4-илкарбониламиноацетат 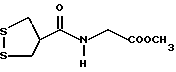 5 мл безводного тетрагидрофурана, 1,01 мл триэтиламина и 398 мг гидрохлорида метилового эфира глицина добавляли 5 мл раствора 3,3 ммоль 1,2-дитиолан-4-карбоновой кислоты (полученной, как описано в Примере 96) в безводном диметилформамиде и к полученной смеси на ледяной бане добавляли 0,55 мл диэтилцианофосфата, после чего смесь перемешивали при комнатной температуре в течение 5 часов. По истечении данного промежутка времени реакционную смесь выдерживали при комнатной температуре в течение ночи, после чего растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан в качестве элюента. Затем растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из 1: 2 (по объему) смеси этилацетат: гексан с получением 54 мг указанного в заголовке соединения в виде бледно-желтых кристаллов, имеющего точку плавления от 73 до 75oC. Пример 98 Метил 3-(1,2-дитиолан-4- илкарбонил)аминопропионат 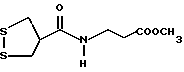 Реакцию проводили, как описано в Примере 97, но применяя 5 мл раствора 3,3 ммоль 1,2-дитиолан-4-карбоновой кислоты (полученной, как описано в Примере 96) в безводном диметилформамиде, 5 мл безводного тетрагидрофурана, 1,01 мл триэтиламина, 502 мг гидрохлорида метилового эфира  -аланина и 0,55 мл диэтилцианофосфата. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2: 1 (по объему) смесь этилацетат: гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из 2:1 (по объему) смеси этилацетат : гексан с получением 73 мг указанного в заголовке соединения в виде бледно-желтых кристаллов, обладающего значением Rf, равным 0,41 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 99 -аланина и 0,55 мл диэтилцианофосфата. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2: 1 (по объему) смесь этилацетат: гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из 2:1 (по объему) смеси этилацетат : гексан с получением 73 мг указанного в заголовке соединения в виде бледно-желтых кристаллов, обладающего значением Rf, равным 0,41 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 99C-хлор-N-[5-(1,2-дитиолан-3 -ил)пентил]метансульфонамид (Соединение N 1-2473) 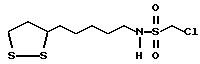 Реакцию проводили, как описано в Примере 60, но применяя 3 мл раствора 1,6 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил] изоиндол-1,3-диона (полученного, как описано в Примере 58) в толуоле, 2 мл метанола, 2 мл бутиламина, 5 мл безводного тетрагидрофурана, 0,33 мл триэтиламина и 0,21 хлорметансульфонилхлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:5 и 2: 3 (по объему) смеси этилацетат : гексан в качестве элюента. Этилацетат удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 42 мг указанного в заголовке соединения в виде коричневого масла, обладающего значением Rf, равным 0,29 (тонкослойная хроматография на силикагеле; с применением 2:5 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 100 N-[5-(1,2-Дитиолан-3-ил) пентил]бензамид (Соединение N 1-1923) 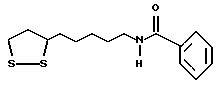 К 3 мл раствора 1,6 ммоль 2-[5-(1,2-дитиолан-3- ил)пентил]изоиндол-1,3-диона (полученного, как описано в Примере 58) в толуоле добавляли 2 мл метанола и 2 мл бутиламина и смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь выдерживали при комнатной температуре в течение 2 суток, после чего растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и к остатку добавляли 5 мл безводного тетрагидрофурана, 0,33 мл триэтиламина и 0,28 мл бензоилхлорида. Затем смесь перемешивали при комнатной температуре в течение 6 часов. По истечении данного промежутка времени растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 1:8, 1:4 и 1:2 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 2: 3 и 1: 1 (по объему) смесей ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток растворяли в диоксане и затем лиофилизировали с получением 56 мг указанного в заголовке соединения в виде желтого аморфного вещества, имеющего точку плавления от 58 до 59oC. Пример 101 N-[5-(1,2-Дитиолан-3-ил) пентил]никотинамид (Соединение N 1-1991) 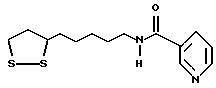 Реакцию проводили, как описано в Примере 100, но применяя 3 мл раствора 1,6 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил] изоиндол-1,3-диона (полученного, как описано в Примере 58) в толуоле, 2 мл метанола, 2 мл бутиламина, 5 мл безводного тетрагидрофурана, 0,33 мл триэтиламина и 427 мг гидрохлорида никотиноилхлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали колоночной хроматографии на силикагеле, применяя 3: 1 и 1: 0 (по объему) смеси этилацетат : гексан и 20:1 (по объему) смесь этилацетат : метанол в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 156 мг указанного в заголовке соединения в виде желтого аморфного вещества, имеющего точку плавления от 41 до 44oC. Пример 102 N-Бутил-N’-[5-(1,2-дитиолан-3 -ил)пентил]фталамид (N-бутиламид Соединения N 1-1936) 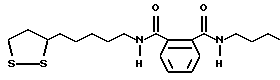 (а) К 6 мл раствора 3,0 ммоль 2-[5-(1,2-дитиолан-3-ил)пентил]изоиндол-1,3- диона (полученного, как описано в Примере 58) в толуоле добавляли 4 мл метанола и 4 мл бутиламина и смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь выдерживали при комнатной температуре в течение ночи, после чего растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и затем этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления с получением остатка. (б) К 5 мл раствора 770 мг N-трет-бутоксикарбонилтиазолидина в безводном диметилформамиде добавляли 584 мг N,N’-карбонилдиимидазола и смесь перемешивали при комнатной температуре в течение 3 часов. Затем к реакционной смеси на ледяной бане добавляли раствор остатка, полученного, как описано в стадии (а) выше, и полученную смесь перемешивали при комнатной температуре в течение 5 часов 30 минут. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления, а остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 1:1 (по объему) смеси ацетонитрил: вода в качестве элюента. Ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления и выпадавшие в осадок нерастворимые вещества собирали путем фильтрования с получением 118 мг указанного в заголовке соединения в виде белого порошка, обладающего значением Rf, равным 0,44 (тонкослойная хроматография на силикагеле; с применением 1:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 103 N-[4-(1,2-дитиолан-3-ил)бутил]-N’-(2-гидрокси-1-метилэтил)мочевина (Соединение N 1-2667)  Реакцию проводили, как описано в Примере 46, но применяя 1,00 г D,L-  -липоевой кислоты, 25 мл безводного толуола, 0,74 мл триэтиламина, 1,15 мл дифенилфосфорилазида и 0,39 мл D,L-аланинола. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 40:1 и 20:1 (по объему) смеси этилацетат : этанол в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из метанола с получением 0,63 г указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 87 до 89oC.
Пример 104 -липоевой кислоты, 25 мл безводного толуола, 0,74 мл триэтиламина, 1,15 мл дифенилфосфорилазида и 0,39 мл D,L-аланинола. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 40:1 и 20:1 (по объему) смеси этилацетат : этанол в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из метанола с получением 0,63 г указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 87 до 89oC.
Пример 1046-(1,2-Дитиолан-3-ил)гексановая кислота (Соединение N 1-1467)  К 7,16 г 6-(2-оксо-1,3-дитиан-4-ил)гексаннитрила добавляли 30 мл воды и 60 мл водной соляной кислоты и смесь нагревали с обратным холодильником в течение 5 часов. Реакционную смесь затем выдерживали при комнатной температуре в течение ночи, после чего ее нагревали с обратным холодильником в течение 2 часов 30 минут. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и к остатку добавляли 150 мл 1 н. водного раствора гидроксида натрия, 40 мл 2 н. водной соляной кислоты и 10 капель 1% (м/о) водного раствора хлорида железа (III). Смесь затем перемешивали при комнатной температуре в течение 2 часов 30 минут в то время, как через смесь пропускали воздух. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь промывали этилацетатом. Водный слой нейтрализовали путем добавления 2 н. водной соляной кислоты и затем к раствору добавляли этилацетат. Водный слой (а) и этилацетатный слой затем выделяли из смеси. Этилацетатный слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:1 (по объему) смесь этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в 40 мл толуола. Этилацетат выпаривали из этилацетатного слоя, освобожденного от указанного выше водного слоя (а) и к остатку добавляли 90 мл 1 н. водного раствора гидроксида натрия, 17 мл 2 н. водной соляной кислоты и 5 капель 1% (м/о) водного раствора хлорида железа (III) и смесь затем перемешивали при комнатной температуре в течение 1 часа в то время, как через смесь пропускали воздух. Реакционную смесь выдерживали при комнатной температуре в течение ночи и растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь промывали этилацетатом. Водный слой нейтрализовали путем добавления 2 н. водной соляной кислоты и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Экстракт объединяли с указанным выше толуольным раствором и растворитель удаляли из раствора путем выпаривания в условиях пониженного давления. Остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле с применением 2:3, 1:1 и 3:2 (по объему) смесей ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в 50 мл толуола. Толуол выпаривали из 2 мл полученного толуольного раствора и остаток растворяли в диоксане и затем лиофилизировали с получением 69 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,39 (тонкослойная хроматография на силикагеле; с применением 1: 1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 105 Метил-6-(1,2-дитиолан-3-ил)гексаноиламиноацетат (Соединение N 1-1347) 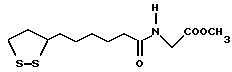 Реакцию проводили, как описано в Примере 47, но применяя 5 мл раствора 1,6 ммоль 6-(1,2-дитиолан-3-ил) гексановой кислоты (полученной, как описано в Примере 104) в толуоле, 7 мл безводного диметилформамида, 373 мг N,N’-карбонилдиимидазола, 0,25 мл триэтиламина и 199 мг гидрохлорида метилового эфира глицина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 3: 1 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 2:3 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 61 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, обладающего значением Rf, равным 0,28 (тонкослойная хроматография на силикагеле; с применением 2:1 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 106 Метил 2(S)-{N-[5-(1,2-дитиолан-3-ил) пентаноил]-N-метиламино}пропионат (Соединение N 1-1224) 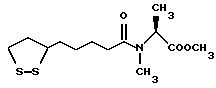 Реакцию проводили, как описано в Примере 47, но применяя 500 мг D,L-  -липоевой кислоты, 13 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола, 0,36 мл триэтиламина и 399 мг гидрохлорида метилового эфира N-метил-L-аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель выпаривали из элюата и остаток растворяли в диоксане и затем лиофилизировали с получением 374 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,29 (тонкослойная хроматография на силикагеле; с применением этилацетата в качестве проявляющего растворителя).
Пример 107 -липоевой кислоты, 13 мл безводного диметилформамида, 422 мг N,N’-карбонилдиимидазола, 0,36 мл триэтиламина и 399 мг гидрохлорида метилового эфира N-метил-L-аланина. Растворитель удаляли из реакционной смеси путем перегонки в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 3:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель выпаривали из элюата и остаток растворяли в диоксане и затем лиофилизировали с получением 374 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,29 (тонкослойная хроматография на силикагеле; с применением этилацетата в качестве проявляющего растворителя).
Пример 107N-[6-(1,2-Дитиолан-3-ил)гексаноил]метансульфонамид (Соединение N 1-1796) 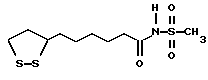 К 10 мл раствора 1,5 ммоль 6-(1,2-дитиолан-3-ил)гексановой кислоты (полученной, как описано в Примере 104) в толуоле добавляли 6 мл безводного диметилформамида и 276 мг N,N’-карбонилдиимидазола и смесь перемешивали при комнатной температуре в течение 4 часов 30 минут. К реакционному раствору затем добавляли 162 мг метансульфонамида и 74 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь затем выдерживали в течение ночи и растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь промывали этилацетатом и нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан в качестве элюента. Растворитель выпаривали из элюата и остаток вновь подвергали колоночной хроматографии на силикагеле, применяя 2:3 и 3:2 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 98 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,37 (тонкослойная хроматография на силикагеле; с применением 3:2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 108 Метил 3-[5-(1,2-дитиолан-3-ил)пентил]уреидоацетат (Соединение N 1-2039) 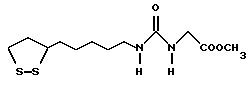 Реакцию проводили, как описано в Примере 46, но применяя 10 мл раствора 1,5 ммоль 6-(1,2-дитиолан-3-ил) гексановой кислоты (полученной, как описано в Примере 104) в толуоле, 6 мл безводного толуола, 0,42 мл триэтиламина, 0,39 мл дифенилфосфорилазида, 6 мл безводного диметилформамида и 254 мг гидрохлорида метилового эфира глицина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:4 и 3:2 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 16 мг указанного в заголовке соединения в виде желтых кристаллов, обладающего значением Rf, равным 0,62 (тонкослойная хроматография на силикагеле; с применением 2:3 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 109 Этил 3-[4-(1,2-дитиолан-3-ил)бутил]-1-метилуреидоацетат (этиловый эфир Соединения N 1-820) 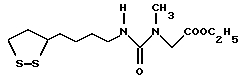 Реакцию проводили, как описано в Примере 46, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 399 мг гидрохлорида этилового эфира саркозина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 7: 13, 2:3 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 194 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, обладающего значением Rf, равным 0,43 (тонкослойная хроматография на силикагеле; с применением этилацетата в качестве проявляющего растворителя).
Пример 110 -липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 10 мл безводного диметилформамида и 399 мг гидрохлорида этилового эфира саркозина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1:0 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 7: 13, 2:3 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 194 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, обладающего значением Rf, равным 0,43 (тонкослойная хроматография на силикагеле; с применением этилацетата в качестве проявляющего растворителя).
Пример 1103-[4-(1,2-Дитиолан-3-ил)бутил] -1,5(S)- диметилимидазолидин-2,4-дион (Соединение N 1-2682) 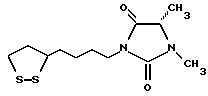 Реакцию проводили, как описано в Примере 46, но применяя 500 мг D,L-  -липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 5 мл безводного тетрагидрофурана, 5 мл безводного диметилформамида и 399 мг гидрохлорида метилового эфира N-метил-L-аланина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 3:2 и 1:1 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 2:3 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 283 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,29 (тонкослойная хроматография на силикагеле; с применением 3: 2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 111 -липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 5 мл безводного тетрагидрофурана, 5 мл безводного диметилформамида и 399 мг гидрохлорида метилового эфира N-метил-L-аланина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 3:2 и 1:1 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 2:3 и 1:1 (по объему) смеси ацетонитрил : вода в качестве элюента и ацетонитрил удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 283 мг указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,29 (тонкослойная хроматография на силикагеле; с применением 3: 2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Пример 111Метил 4-{3-[4-(1,2-Дитиолан-3 -ил)бутил]-1-метилуреидо} бутаноат (метиловый эфир Соединения N 1-2670) 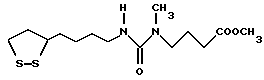 Реакцию проводили, как описано в Примере 46, но применяя 500 мг D,L-  липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 5 мл безводного диметилформамида и 477 мг метил 4-(метиламино)бутаноатгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0 и 20:1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 589 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, обладающего значением Rf, равным 0,47 (тонкослойная хроматография на силикагеле; с применением 20:1 (по объему) смеси этилацетат : метанол в качестве проявляющего растворителя).
Пример 112 липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 0,56 мл дифенилфосфорилазида, 5 мл безводного диметилформамида и 477 мг метил 4-(метиламино)бутаноатгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:0 и 20:1 (по объему) смеси этилацетат : метанол в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 589 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, обладающего значением Rf, равным 0,47 (тонкослойная хроматография на силикагеле; с применением 20:1 (по объему) смеси этилацетат : метанол в качестве проявляющего растворителя).
Пример 112N-[6-(1,2-Дитиолан-3 -ил)гексаноил]сульфамид (Соединение N 1-1839) 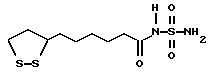 Реакцию проводили, как описано в Примере 107, но применяя 5 мл раствора 1,6 ммоль 6-(1,2-дитиолан-3-ил) гексановой кислоты (полученной, как описано в Примере 104) в толуоле, 7 мл безводного диметилформамида, 308 мг N,N’-карбонилдиимидазола, 365 мг сульфамида и 83 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле). Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 3:2 и 2:1 (по объему) смесь этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из 1:2 (по объему) смеси этилацетат : гексан с получением 92 мг указанного в заголовке соединения в виде бледно-желтых кристаллов, имеющего точку плавления от 130 до 132oC. Пример 113 N-(3-[4-(1,2-Дитиолан-3-ил) бутил]уреидоацетил} метансульфонамид (Соединение N 1-2643) 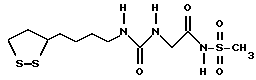 Реакцию проводили, как описано в Примере 73, но применяя 201 мг 3-[4-(1,2-дитиолан-3-ил)бутил] уреидоацетата (полученного, как описано в Примере 46), 4 мл безводного диметилформамида, 129 мг N,N’-карбонилдиимидазола, 76 мг метансульфонамида и 35 мг гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле). Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из метанола с получением 150 мг указанного в заголовке соединения в виде белых кристаллов, имеющего точку плавления от 157 до 158oC. Пример 114 N-{3-[4-(1,2-Дитиолан-3-ил) бутил]уреидоацетил}сульфамид (Соединение N 1-2647) 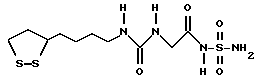 Реакцию проводили, как описано в Примере 73, но применяя 0,20 г 3-[4-(1,2-дитиолан-3-ил)бутил] уреидоуксусной кислоты (полученной, как описано в Примере 48), 4 мл безводного диметилформамида, 0,13 г N,N’-карбонилдиимидазола, 0,15 г сульфамида и 0,04 г гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле). Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из смеси метанол : этилацетат с получением 76 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 143 до 145oC. Пример 115 N-(2(R)-{3-[4-(1,2-Дитиолан-3-ил) бутил]уреидо}пропионил)сульфамид (Соединение N 1-2655) 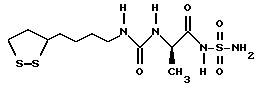 Реакцию проводили, как описано в Примере 73, но применяя 0,21 г 2(R)-{ 3-[4-(1,2-дитиолан-3-ил)бутил] уреидо} пропионовой кислоты (полученной, как описано в Примере 71), 5 мл безводного диметилформамида, 0,13 г N,N’-карбонилдиимидазола, 0,15 г сульфамида и 0,04 г гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле). Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 114 мг указанного в заголовке соединения в виде бледно-желтого порошка, имеющего точку плавления от 156 до 157oC. Пример 116 N-(2(S)-{ 3-[4-(1,2-Дитиолан-3-ил) бутил]уреидо}пропионил) метансульфонамид (Соединение N 1-2655) 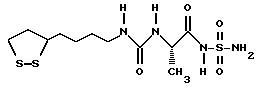 Реакцию проводили, как описано в Примере 73, но применяя 0,13 г 2(S)-{ 3-[4-(1,2-дитиолан-3-ил)бутил] уреидо} пропионовой кислоты (полученной, как описано в Примере 52), 4 мл безводного диметилформамида, 0,08 г N,N’-карбонилдиимидазола, 0,05 г метансульфонамида и 0,02 г гидрида натрия (в виде 55% (по массе) дисперсии в минеральном масле). Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 80 мг указанного в заголовке соединения в виде белого порошка, имеющего точку плавления от 142 до 147oC. Пример 117 4-{3-[4-(1,2-Дитиолан-3-ил) бутил]уреидо}бутановая кислота (Соединение N 1-1276) 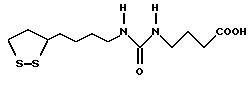 Реакцию проводили, как описано в Примере 48, но применяя 0,65 г 4-{3-[4-(1,2-дитиолан-3-ил)бутил] уреидо} бутаноат (полученный, как описано в Примере 75), 13 мл метанола и 7,10 мл 1 н. водного раствора гидроксида натрия. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 0,46 г указанного в заголовке соединения в виде бледно-желтого порошка, имеющего точку плавления от 94 до 99oC. Пример 118 Метил-5-[5-(1,2-дитиолан-3 -ил)пентаноиламино]пентаноат (метиловый эфир Соединения N 1-2657) 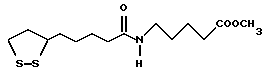 Реакцию проводили, как описано в Примере 47, но применяя 1,00 мг D,L-  -липоевой кислоты, 40 мл безводного диметилформамида, 0,56 г N,N’-карбонилдиимидазола, 0,74 мл триэтиламина и 0,89 метил 5-аминопентаноатгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1: 0 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток перекристаллизовывали из этилацетата с получением 1,10 г указанного в заголовке соединения в виде бледно-желтых кристаллов, имеющего точку плавления от 60 до 62oC.
Пример 119 -липоевой кислоты, 40 мл безводного диметилформамида, 0,56 г N,N’-карбонилдиимидазола, 0,74 мл триэтиламина и 0,89 метил 5-аминопентаноатгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 и 1: 0 (по объему) смеси этилацетат : гексан в качестве элюента. Затем остаток перекристаллизовывали из этилацетата с получением 1,10 г указанного в заголовке соединения в виде бледно-желтых кристаллов, имеющего точку плавления от 60 до 62oC.
Пример 119Метил 5-{3-[4-(1,2-дитиолан-3 -ил)бутил]уреидо}пропионат (метиловый эфир Соединения N 1-2659) 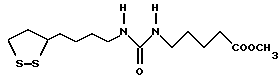 Реакцию проводили, как описано в Примере 46, но применяя 1,00 г D,L-  -липоевой кислоты, 20 мл безводного толуола, 1,48 мл триэтиламина, 1,15 мл дифенилфосфорилазида и 0,81 г метил 5-аминопентаноатгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан, а затем 9:1 (по объему) смесь этилацетат : этанол в качестве элюента с получением 1,27 г указанного в заголовке соединения в виде бледно-желтого порошка, имеющего точку плавления от 90 до 92oC.
Пример 120 -липоевой кислоты, 20 мл безводного толуола, 1,48 мл триэтиламина, 1,15 мл дифенилфосфорилазида и 0,81 г метил 5-аминопентаноатгидрохлорида. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:1 (по объему) смесь этилацетат : гексан, а затем 9:1 (по объему) смесь этилацетат : этанол в качестве элюента с получением 1,27 г указанного в заголовке соединения в виде бледно-желтого порошка, имеющего точку плавления от 90 до 92oC.
Пример 1205-[5-(1,2-Дитиолан-3-ил) пентаноиламино]пентановая кислота (Соединение N 1-2657) 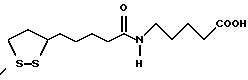 Реакцию проводили, как описано в Примере 49, но применяя 0,65 г метил 5-[5-(1,2-дитиолан-3-ил)пентаноиламино] пентаноат (полученный, как описано в Примере 118), 13 мл метанола и 5,09 мл 1 н. водного раствора гидроксида натрия. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 0,33 г указанного в заголовке соединения в виде бледно-желтовато-зеленых кристаллов, имеющего точку плавления от 98 до 100oC. Пример 121 5-{3-[4-(1,2-Дитиолан-3 -ил)бутил]уреидо}пентановая кислота (Соединение N 1-2659) 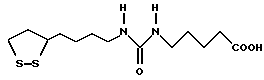 Реакцию проводили, как описано в Примере 48, но применяя 0,30 г метил 5-{3-[4-(1,2-дитиолан-3-ил)бутил]уреидо}пентаноат (полученный, как описано в Примере 119), 10 мл метанола и 3,14 мл 1 н. водного раствора гидроксида натрия. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду. Смесь нейтрализовали путем добавления 2 н. водной соляной кислоты, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из этилацетата с получением 0,23 г указанного в заголовке соединения в виде бледно-желтых кристаллов, имеющего точку плавления от 125 до 132oC. Пример 122 5-(1,2-Дитиолан-3-ил)-N- (2-гидроксиэтил)пентанамид (Соединение N 1-2661) 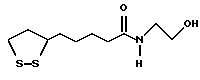 К 20 мл раствора 1,00 г D,L-  -липоевой кислоты в безводном диметилформамиде добавляли 0,86 г N,N’-карбонилдиимидазола и смесь перемешивали при комнатной температуре в течение 1 часа 20 минут. Затем к реакционному раствору добавляли 0,32 мл 2-аминоэтанола и полученную смесь перемешивали при комнатной температуре в течение 4 часов 10 минут. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 19:1 (по объему) смесь этилацетат : этанол в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 0,71 г указанного в заголовке соединения в виде желтого аморфного вещества, обладающего значением Rf, равным 0,38 (тонкослойная хроматография на силикагеле; с применением 19:1 (по объему) смеси этилацетат : этанол в качестве проявляющего растворителя).
Пример 123 -липоевой кислоты в безводном диметилформамиде добавляли 0,86 г N,N’-карбонилдиимидазола и смесь перемешивали при комнатной температуре в течение 1 часа 20 минут. Затем к реакционному раствору добавляли 0,32 мл 2-аминоэтанола и полученную смесь перемешивали при комнатной температуре в течение 4 часов 10 минут. Затем растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 19:1 (по объему) смесь этилацетат : этанол в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 0,71 г указанного в заголовке соединения в виде желтого аморфного вещества, обладающего значением Rf, равным 0,38 (тонкослойная хроматография на силикагеле; с применением 19:1 (по объему) смеси этилацетат : этанол в качестве проявляющего растворителя).
Пример 1235-(1,2-Дитиолан-3-ил)-N- (2-гидрокси-1-метилэтил) пентанамид (Соединение N 1-2665) 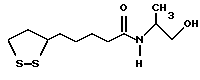 Реакцию проводили, как описано в Примере 122, но применяя 1,00 мг D,L-  -липоевой кислоты, 20 мл безводного диметилформамида, 0,86 г N,N’-карбонилдиимидазола и 0,42 мл D,L-аланинола. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя этилацетат в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 0,39 г указанного в заголовке соединения в виде желтого аморфного вещества, имеющего точку плавления от 52 до 56oC.
Пример 124 -липоевой кислоты, 20 мл безводного диметилформамида, 0,86 г N,N’-карбонилдиимидазола и 0,42 мл D,L-аланинола. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя этилацетат в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 0,39 г указанного в заголовке соединения в виде желтого аморфного вещества, имеющего точку плавления от 52 до 56oC.
Пример 124N-[4-(1,2-дитиолан-3-ил) бутил]-N’-(2-гидроксиэтил) мочевина (Соединение N 1-2663)  Реакцию проводили, как описано в Примере 46, но применяя 1,00 г D,L-  -липоевой кислоты, 20 мл безводного толуола, 0,74 мл триэтиламина, 1,15 мл дифенилфосфорилазида и 0,29 мл 2-гидрокси-1-этиламина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 39:1 и 19:1 (по объему) смеси этилацетат : этанол в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из метанола с получением 352 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 50 до 65oC.
Пример 125 -липоевой кислоты, 20 мл безводного толуола, 0,74 мл триэтиламина, 1,15 мл дифенилфосфорилазида и 0,29 мл 2-гидрокси-1-этиламина. Растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления и к остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат затем удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 39:1 и 19:1 (по объему) смеси этилацетат : этанол в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток перекристаллизовывали из метанола с получением 352 мг указанного в заголовке соединения в виде желтых кристаллов, имеющего точку плавления от 50 до 65oC.
Пример 125N-[5-(1,2-Дитиолан-3-ил) пентаноил]-N-метилметансульфонамид (Соединение N 1-2672) 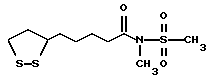 К 20 мл раствора 1,36 г дициклогексилкарбодиимида в безводном метаноле добавляли 40 мг хлорида меди, выдерживали при комнатной температуре в течение полутора часов. Растворитель затем удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. Затем к остатку добавляли 20 мл безводного диметилформамида и 1,00 г N-[5-(1,2-дитиолан-3-ил)пентаноил] метансульфонамида (полученного, как описано в Примере 2) и смесь перемешивали при 70oC на масляной бане в течение одного часа. Смесь выдерживали при комнатной температуре в течение ночи, после чего ее перемешивали при 70oC на масляной бане в течение 1 часа и растворитель удаляли из реакционной смеси путем выпаривания в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Нерастворимый продукт удаляли из экстракта путем фильтрования и фильтрат промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из раствора путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 2:3 и 1: 1 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток подвергали обращенно-фазовой препаративной колоночной хроматографии на силикагеле, применяя 1:1 и 3:2 (по объему) смеси ацетонитрил : вода в качестве элюента. Ацетонитрил затем удаляли из раствора путем выпаривания в условиях пониженного давления, после чего остаток экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 600 мг указанного в заголовке соединения в виде бледно-желтого аморфного вещества, обладающего значением Rf, равным 0,27 (тонкослойная хроматография на силикагеле; с применением 2:3 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя). Пример 126 Аллил N-[4-(1,2-дитиолан-3 -ил)бутил]карбамат 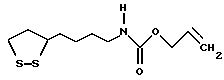 Реакцию проводили, как описано в Примере 31, но применяя 1,00 г D,L-  -липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 1,14 мл дифенилфосфорилазида и 2 мл аллилового спирта.
Реакционную смесь промывали водой, водный слой промывали этилацетатом, а этилацетатные смывы объединяли с указанным выше толуольным раствором. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:4 и 1:2 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 944 мг указанного в заголовке соединения в виде маслянистого желтого вещества, обладающего значением Rf, равным 0,49 (тонкослойная хроматография на силикагеле; с применением 1:2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Получение 1 -липоевой кислоты, 10 мл безводного толуола, 0,73 мл триэтиламина, 1,14 мл дифенилфосфорилазида и 2 мл аллилового спирта.
Реакционную смесь промывали водой, водный слой промывали этилацетатом, а этилацетатные смывы объединяли с указанным выше толуольным раствором. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1:4 и 1:2 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из элюата путем выпаривания в условиях пониженного давления и остаток растворяли в диоксане и затем лиофилизировали с получением 944 мг указанного в заголовке соединения в виде маслянистого желтого вещества, обладающего значением Rf, равным 0,49 (тонкослойная хроматография на силикагеле; с применением 1:2 (по объему) смеси этилацетат : гексан в качестве проявляющего растворителя).
Получение 15-(1,2-Дитиолан-3-ил)пентанол  К смеси 15,00 г D,L-  -липоевой кислоты в 15 мл метанола и 150 мл толуола на ледяной бане по каплям добавляли 44 мл гексанового раствора, содержащего 2,0 М (триметилсилил)диазометан, и затем смесь перемешивали при комнатной температуре в течение одного часа. Затем к реакционной смеси по каплям добавляли 11 мл гексанового раствора, содержащего 2,0 М (триметилсилил)диазометан. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Затем реакционную смесь выдерживали при комнатной температуре в течение 2 суток. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления с получением этил 5-(1,2-дитиолан-3-ил)пентаноата в виде желтого масла.
К суспензии 3,34, г литийалюминийгидрида в 150 мл безводного тетрагидрофурана при охлаждении смесью лед/хлорид натрия по каплям добавляли раствор этил 5-(1,2-дитолан-3-ил)пентаноата в 40 мл безводного тетрагидрофурана. Полученную смесь перемешивали при комнатной температуре в течение 3 часов 30 минут. Затем при охлаждении смесью лед/хлорид натрия к реакционной смеси добавляли декагидрат сульфата натрия и затем смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выдерживали при комнатной температуре в течение ночи и затем нерастворимые вещества отфильтровывали с применением набивки фильтра Целит (Celite) (торговая марка). Растворитель удаляли из фильтрата путем перегонки в условиях пониженного давления. Затем к остатку добавляли 50 мл метанола, 25 мл 1 н. водного раствора гидроксида натрия и 10 мл 2 н. водной соляной кислоты. Затем через полученную смесь пропускали воздух. К реакционной смеси по каплям добавляли пять капель 1% водного раствора хлорида железа (III) и затем смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь выдерживали при комнатной температуре в течение ночи и затем растворитель удаляли путем перегонки в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из раствора путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1: 2 и 1:1 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из полученного элюата путем перегонки в условиях пониженного давления и к остатку добавляли 30 мл толуола. Из полученного раствора отбирали 1 мл и растворитель удаляли путем перегонки в условиях пониженного давления с получением 0,13 г указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,39 (тонкослойная хроматография на силикагеле; с применением 1:1 (по объему) смеси этилацетат : гексан в качестве элюента). Т Т Т Т- -липоевой кислоты в 15 мл метанола и 150 мл толуола на ледяной бане по каплям добавляли 44 мл гексанового раствора, содержащего 2,0 М (триметилсилил)диазометан, и затем смесь перемешивали при комнатной температуре в течение одного часа. Затем к реакционной смеси по каплям добавляли 11 мл гексанового раствора, содержащего 2,0 М (триметилсилил)диазометан. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Затем реакционную смесь выдерживали при комнатной температуре в течение 2 суток. Растворитель затем удаляли из реакционной смеси путем перегонки в условиях пониженного давления с получением этил 5-(1,2-дитиолан-3-ил)пентаноата в виде желтого масла.
К суспензии 3,34, г литийалюминийгидрида в 150 мл безводного тетрагидрофурана при охлаждении смесью лед/хлорид натрия по каплям добавляли раствор этил 5-(1,2-дитолан-3-ил)пентаноата в 40 мл безводного тетрагидрофурана. Полученную смесь перемешивали при комнатной температуре в течение 3 часов 30 минут. Затем при охлаждении смесью лед/хлорид натрия к реакционной смеси добавляли декагидрат сульфата натрия и затем смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выдерживали при комнатной температуре в течение ночи и затем нерастворимые вещества отфильтровывали с применением набивки фильтра Целит (Celite) (торговая марка). Растворитель удаляли из фильтрата путем перегонки в условиях пониженного давления. Затем к остатку добавляли 50 мл метанола, 25 мл 1 н. водного раствора гидроксида натрия и 10 мл 2 н. водной соляной кислоты. Затем через полученную смесь пропускали воздух. К реакционной смеси по каплям добавляли пять капель 1% водного раствора хлорида железа (III) и затем смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь выдерживали при комнатной температуре в течение ночи и затем растворитель удаляли путем перегонки в условиях пониженного давления. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Этилацетат удаляли из раствора путем перегонки в условиях пониженного давления и остаток подвергали колоночной хроматографии на силикагеле, применяя 1: 2 и 1:1 (по объему) смеси этилацетат : гексан в качестве элюента. Растворитель удаляли из полученного элюата путем перегонки в условиях пониженного давления и к остатку добавляли 30 мл толуола. Из полученного раствора отбирали 1 мл и растворитель удаляли путем перегонки в условиях пониженного давления с получением 0,13 г указанного в заголовке соединения в виде желтого масла, обладающего значением Rf, равным 0,39 (тонкослойная хроматография на силикагеле; с применением 1:1 (по объему) смеси этилацетат : гексан в качестве элюента). Т Т Т Т-
Формула изобретения
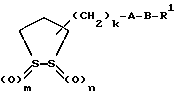 где одно из m и n равно 0, а другое равно 0, 1 или 2; k равно 0 или целому числу от 1 до 12; R1 представляет собой: атом водорода, группу, выбранную из заместителей  , определенных ниже, или алкильную группу, содержащую от 1 до 12 атомов углерода, которая является незамещенной или замещена заместителями , определенных ниже, или алкильную группу, содержащую от 1 до 12 атомов углерода, которая является незамещенной или замещена заместителями  и/или заместителями и/или заместителями  в количестве от 1 до 3, или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы; в количестве от 1 до 3, или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы;A представляет собой группу формулы -CON(R2)SO2-, в которой R2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 12 атомов углерода, аралкильную группу или аралкильную группу, арильный радикал которой замещен заместителями  в количестве от 1 до 3; в количестве от 1 до 3;В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R6) N(R5)-, где R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода, или R5 вместе с R1 и атомом азота, к которому они присоединены, могут образовывать гетероциклическое кольцо, содержащее в цикле от 5 до 7 атомов, которые могут быть замещены 1 или несколькими группами, выбранными из низших алкильных групп и оксогрупп, и могут далее быть конденсированы с фенильным кольцом; или, когда В представляет собой одинарную связь, R1 может представлять собой гидроксигруппу или группу формулы -OR7 (в которой R7 представляет собой низшую алкильную группу); заместители  выбраны из фенильных групп, фенильных групп, замещенных заместителями выбраны из фенильных групп, фенильных групп, замещенных заместителями  в количестве от 1 до 3, и гетероциклических групп, которые могут быть необязательно замещены заместителями в количестве от 1 до 3, и гетероциклических групп, которые могут быть необязательно замещены заместителями  в количестве от 1 до 3, или конденсированы с фенильным кольцом, и указанные гетероциклические группы, имеющие 5 или 6 атомов углерода, являются насыщенными, ненасыщенными или ароматическими и содержащими 1 или несколько гетероатомов, выбранных из атомов азота, кислорода или серы; в количестве от 1 до 3, или конденсированы с фенильным кольцом, и указанные гетероциклические группы, имеющие 5 или 6 атомов углерода, являются насыщенными, ненасыщенными или ароматическими и содержащими 1 или несколько гетероатомов, выбранных из атомов азота, кислорода или серы;заместители  выбраны из низших алкильных групп, галогенированных низших алкильных групп, низших алкоксигрупп, гидроксигрупп, карбоксигрупп, карбамоильных групп, атом азота которых может быть замещен низшей алкильной группой или низшей алкильной группой, которая, в свою очередь, замещена дитиолановой группой, и низших алкоксикарбонильных групп; выбраны из низших алкильных групп, галогенированных низших алкильных групп, низших алкоксигрупп, гидроксигрупп, карбоксигрупп, карбамоильных групп, атом азота которых может быть замещен низшей алкильной группой или низшей алкильной группой, которая, в свою очередь, замещена дитиолановой группой, и низших алкоксикарбонильных групп;заместители  выбраны из низших алкоксигрупп, низших алкилтиогрупп, гидроксигрупп, нитроксигрупп, карбоксигрупп, низших алкоксикарбонильных групп, атомов галогена, сульфогрупп, сульфамоильных групп и карбамоильных групп, атом азота которых может быть замещен аминосульфонильной группой, выбраны из низших алкоксигрупп, низших алкилтиогрупп, гидроксигрупп, нитроксигрупп, карбоксигрупп, низших алкоксикарбонильных групп, атомов галогена, сульфогрупп, сульфамоильных групп и карбамоильных групп, атом азота которых может быть замещен аминосульфонильной группой,и их фармацевтически приемлемые соли. 2. Соединение по п.1, представленное формулой I’  где A, B, R1, k, m и n определены в п.1, и его соли. 3. Соединение по п.1 или 2, в котором одно из m и n равно 0, а другое равно 0 или 1. 4. Соединение по любому из пп.1 – 3, в котором k равно 0 или целому числу от 1 до 8. 5. Соединение по любому из пп.1 – 4, в котором R1 представляет собой гетероциклическую группу, определенную в п.1, алкильную группу, содержащую от 1 до 12 атомов углерода, которая является незамещенной или замещена заместителями  и заместителями и заместителями  в количестве от 1 до 3, или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы.
6. Соединение по любому из пп.1 – 4, в котором R1 представляет собой гидроксигруппу или алкоксигруппу, содержащую от 1 до 5 атомов углерода.
7. Соединение по любому из пп.1 – 6, в котором А представляет собой группу формулы -CON(R2)SO2-, в которой R2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 12 атомов углерода, или бензильную группу.
8. Соединение по любому из пп.1 – 7, в котором В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)-, в которых R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
9. Соединение по п.1 или 2, в котором одно из m и n равно 0, а другое равно 0 или 1; k равно 0 или целому числу от 1 до 8; R1 представляет собой гетероциклическую группу, определенную в п.1, гидроксигруппу, алкоксигруппу, содержащую от 1 до 5 атомов углерода, алкильную группу, содержащую от 1 до 12 атомов углерода, которая является незамещенной или замещена заместителями в количестве от 1 до 3, или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы.
6. Соединение по любому из пп.1 – 4, в котором R1 представляет собой гидроксигруппу или алкоксигруппу, содержащую от 1 до 5 атомов углерода.
7. Соединение по любому из пп.1 – 6, в котором А представляет собой группу формулы -CON(R2)SO2-, в которой R2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 12 атомов углерода, или бензильную группу.
8. Соединение по любому из пп.1 – 7, в котором В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)-, в которых R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
9. Соединение по п.1 или 2, в котором одно из m и n равно 0, а другое равно 0 или 1; k равно 0 или целому числу от 1 до 8; R1 представляет собой гетероциклическую группу, определенную в п.1, гидроксигруппу, алкоксигруппу, содержащую от 1 до 5 атомов углерода, алкильную группу, содержащую от 1 до 12 атомов углерода, которая является незамещенной или замещена заместителями  и/или заместителями и/или заместителями  в количестве от 1 до 3, или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы; А представляет собой группу формулы -CON(R2)SO2-, в которых R2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 12 атомов углерода, или бензильную группу; и В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)-, в которых R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
10. Соединение по п.1 или 2, в котором оба m и n равны 0.
11. Соединение по любому из пп.1, 2 и 10, в котором k равно целому числу от 2 до 6.
12. Соединение по любому из пп.1, 2, 10 и 11, в котором R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу, определенную в п.1, алкоксигруппу, содержащую от 1 до 5 атомов углерода, или гидроксигруппу.
13. Соединение по любому из пп.1, 2, 10 – 12, в котором А представляет собой группу формулы -CON(R2)SO2-, в которых R2 представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
14. Соединение по любому из пп.1, 2, 10 – 13, в котором В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)-, в которых R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
15. Соединение по п.1 или 2, в котором оба m и n представляют собой 0; k равно целому числу от 2 до 6; R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу, определенную в п.1, алкоксигруппу, содержащую от 1 до 5 атомов углерода, или гидроксигруппу; А представляет собой группу формулы -CON(R2)SO2-, в которых R2 представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода; и В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)-, в которых R5 и R6 являются одинаковыми или отличными, и каждый представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
16. Соединение по любому из п.1 или 2, в котором k равно 4 или 5.
17. Соединение по любому из п.1, 2 и 16, в котором R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу, определенную в п. 1, или алкоксигруппу, содержащую от 1 до 5 атомов углерода.
18. Соединение по любому из пп.1, 2, 16 и 17, в котором А представляет собой группу формулы -CONHSO2– или -CONCH3SO2-.
19. Соединение по любому из пп.1, 2 и 16 – 18, в котором В представляет собой одинарную связь или группу формулы -NH-, -NCH3– или -NHNCH3-.
20. Соединение по п.1 или 2, в котором оба m и n равны 0; k равно 4 или 5; R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу, определенную в п.1, или алкоксигруппу, содержащую от 1 до 5 атомов углерода; А представляет собой группу формулы -CONHSO2– или -CONCH3SO2-; и В представляет собой одинарную связь или группу формулы -NH-, -NCH3– или -NHNCH3-.
21. Соединение по п. 1, представляющее собой N-[5-(1,2-дитиолан-3-ил)пентил]метансульфонамид и его фармацевтически приемлемые соли.
22. Лекарственное средство, обладающее способностью увеличивать активность глутатионредуктазы, отличающееся тем, что оно содержит в качестве активного вещества соединения формулы I по любому из пп.1 – 21.
23. Лекарственное средство, предназначенное для лечения или предупреждения катаракты у млекопитающих, отличающееся тем, что оно содержит в качестве активного вещества соединения формулы I по любому из пп.1 – 21.
Приоритет по признакам: в количестве от 1 до 3, или такую замещенную или незамещенную алкильную группу, в которой углеродная цепь прерывается атомом кислорода и/или атомом серы; А представляет собой группу формулы -CON(R2)SO2-, в которых R2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 12 атомов углерода, или бензильную группу; и В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)-, в которых R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
10. Соединение по п.1 или 2, в котором оба m и n равны 0.
11. Соединение по любому из пп.1, 2 и 10, в котором k равно целому числу от 2 до 6.
12. Соединение по любому из пп.1, 2, 10 и 11, в котором R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу, определенную в п.1, алкоксигруппу, содержащую от 1 до 5 атомов углерода, или гидроксигруппу.
13. Соединение по любому из пп.1, 2, 10 – 12, в котором А представляет собой группу формулы -CON(R2)SO2-, в которых R2 представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
14. Соединение по любому из пп.1, 2, 10 – 13, в котором В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)-, в которых R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
15. Соединение по п.1 или 2, в котором оба m и n представляют собой 0; k равно целому числу от 2 до 6; R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу, определенную в п.1, алкоксигруппу, содержащую от 1 до 5 атомов углерода, или гидроксигруппу; А представляет собой группу формулы -CON(R2)SO2-, в которых R2 представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода; и В представляет собой одинарную связь или группу формулы -N(R5)- или -N(R5)N(R6)-, в которых R5 и R6 являются одинаковыми или отличными, и каждый представляет собой атом водорода или алкильную группу, содержащую от 1 до 12 атомов углерода.
16. Соединение по любому из п.1 или 2, в котором k равно 4 или 5.
17. Соединение по любому из п.1, 2 и 16, в котором R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу, определенную в п. 1, или алкоксигруппу, содержащую от 1 до 5 атомов углерода.
18. Соединение по любому из пп.1, 2, 16 и 17, в котором А представляет собой группу формулы -CONHSO2– или -CONCH3SO2-.
19. Соединение по любому из пп.1, 2 и 16 – 18, в котором В представляет собой одинарную связь или группу формулы -NH-, -NCH3– или -NHNCH3-.
20. Соединение по п.1 или 2, в котором оба m и n равны 0; k равно 4 или 5; R1 представляет собой алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксикарбонилалкильную группу, содержащую от 3 до 8 атомов углерода, карбоксиалкильную группу, содержащую от 2 до 7 атомов углерода, гидроксиалкильную группу, содержащую от 2 до 5 атомов углерода, гетероциклическую группу, определенную в п.1, или алкоксигруппу, содержащую от 1 до 5 атомов углерода; А представляет собой группу формулы -CONHSO2– или -CONCH3SO2-; и В представляет собой одинарную связь или группу формулы -NH-, -NCH3– или -NHNCH3-.
21. Соединение по п. 1, представляющее собой N-[5-(1,2-дитиолан-3-ил)пентил]метансульфонамид и его фармацевтически приемлемые соли.
22. Лекарственное средство, обладающее способностью увеличивать активность глутатионредуктазы, отличающееся тем, что оно содержит в качестве активного вещества соединения формулы I по любому из пп.1 – 21.
23. Лекарственное средство, предназначенное для лечения или предупреждения катаракты у млекопитающих, отличающееся тем, что оно содержит в качестве активного вещества соединения формулы I по любому из пп.1 – 21.
Приоритет по признакам:02.04.97 – все признаки, за исключением значения  -карбамоильная группа может быть необязательно замещена по атому азота аминосульфонильной группой; низшая алкилтиогруппа и нитрокси группа; заместитель В, где R5 вместе с R1 и атомом азота, к которому они присоединены, образуют гетероциклическое кольцо и указанное гетероциклическое кольцо содержит семь кольцевых атомов; -карбамоильная группа может быть необязательно замещена по атому азота аминосульфонильной группой; низшая алкилтиогруппа и нитрокси группа; заместитель В, где R5 вместе с R1 и атомом азота, к которому они присоединены, образуют гетероциклическое кольцо и указанное гетероциклическое кольцо содержит семь кольцевых атомов;20.01.98 – значение  -карбомоильная группа может быть необязательно замещена по атому азота аминосульфонильной группой; -карбомоильная группа может быть необязательно замещена по атому азота аминосульфонильной группой;01.04.98 – значение  -низшая алкилтиогруппа и нитрокси группа; значение В, где R5 вместе с R1 и атомом азота, к котором они присоединены, образуют гетероциклическое кольцо и указанное гетероциклическое кольцо содержит семь кольцевых атомов. -низшая алкилтиогруппа и нитрокси группа; значение В, где R5 вместе с R1 и атомом азота, к котором они присоединены, образуют гетероциклическое кольцо и указанное гетероциклическое кольцо содержит семь кольцевых атомов.
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 02.04.2003
Извещение опубликовано: 10.01.2005 БИ: 01/2005
|
||||||||||||||||||||||||||