|
|
(21), (22) Заявка: 2008119517/04, 19.05.2008
(24) Дата начала отсчета срока действия патента:
19.05.2008
(46) Опубликовано: 27.11.2009
(56) Список документов, цитированных в отчете о
поиске:
STN on the Web БД CA 126:220284. STN on the Web БД CA 126:117615. RU 2273640 C2, 10.04.2006. RU 2038351 C1, 27.06.1995.
Адрес для переписки:
125047, Москва, Миусская пл., 9, ГОУ ВПО РХТУ им. Д.И. Менделеева, патентно-лицензионный отдел
|
(72) Автор(ы):
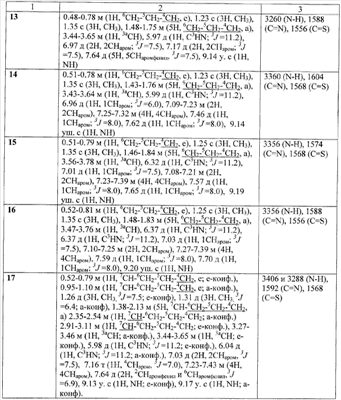
Гар Михаил Михайлович (RU),
Попков Сергей Владимирович (RU),
Архипова Ольга Николаевна (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Российский химико-технологический университет им. Д.И. Менделеева” (РХТУ им. Д.И. Менделеева) (RU)
|
(54) ЗАМЕЩЕННЫЕ 2-ТИОКАРБАМОИЛ-3-ФЕНИЛ-3,3а,4,5,6,7-ГЕКСАГИДРО-2Н-ИНДАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФУНГИЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ
(57) Реферат:
Изобретение относится к новым замещенным 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолам общей формулы I, 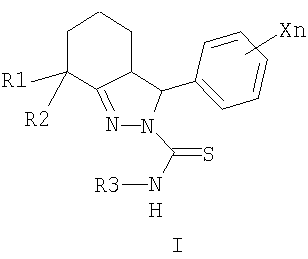
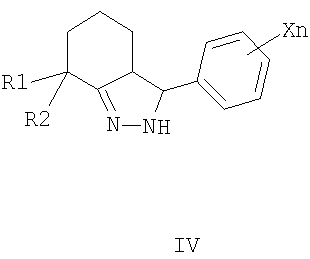
где R1=CH3, R2=H, СН3, R1+R2=(CH2)m, m=2-5;
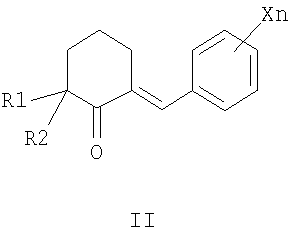
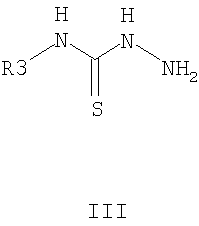
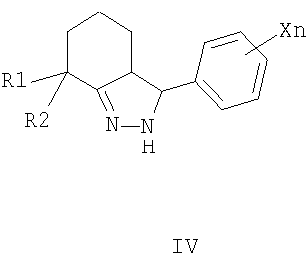
X=CkH2k+1, k=1-4, Hal, NO2, CkF2k+1 n=1-5; R3=CH3, Alk, Ar, и способам их получения, первый из которых заключается в конденсации 2-арилиденциклогексанонов II с тиосемикарбазидами III в алифатическом спирте в присутствии кислоты в качестве катализатора при нагревании (таким способом получают преимущественно 3,3а-цис-2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-
гексагидро-2H-индазолы формулы I); по второму способу конденсацией 2-арилиденциклогексанонов II с гидразингидратом при кипячении в алифатическом спирте, получают промежуточные N-незамещенные гексагидроиндазолы IV, которые ацилируют алкил- или арилизотиоцианатами в инертном растворителе в присутствии основного катализатора при комнатной температуре (таким способом получают преимущественно 3,3a-транс-2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-
гексагидро-2Н-индазолы формулы I).
Изобретение также относится к фунгицидной композиции, содержащей замещенные 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолы общей формулы I, например 7-метил- или 7,7-диметил-3-(4-хлорбензилиден)-3,3a,4,5,6,7-гексагидро-2H-индазолы, которые показывают фунгитоксичность выше, чем у эталона триадимефона. 4 н.п. ф-лы, 5 табл.
Изобретение относится к химии гетероциклических соединений, а именно к замещенным 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолам общей формулы I:
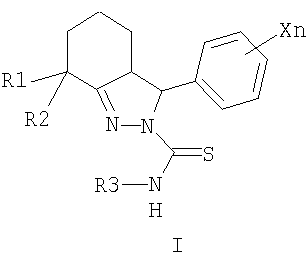
где R1 означает метильную группу, R2 означает атом водорода или метильную группу, либо R1 и R2 совместно означают полиметиленовую цепь с числом атомов углерода от 2 до 5; X, одинаковые или разные, означают алкильный заместитель с числом атомов углерода от 1 до 4, атом галогена, нитрогруппу или перфторалкильную группу с числом атомов углерода от 1 до 4; п означает целое число от 1 до 5; R3 означает атом водорода, алкильную или арильную группу, содержащую в качестве заместителей алкильную группу с числом атомов углерода от 1 до 4, атом галогена, нитрогруппу или перфторалкильную группу с числом атомов углерода от 1 до 4. Соединения общей формулы I могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов.
Изобретение относится также к способам получения соединений общей формулы I, к использованию этих соединений в композициях с другими активными и вспомогательными соединениями для борьбы с грибными болезнями растительных организмов, животных или человека.
 2 – P.207-210]. 2 – P.207-210].
R=CH3, (CH2)2N(CH3)2, (CH2)3N(CH3)2, (CH2)3N(C2H5)2
  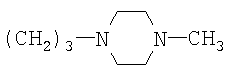
 2, – с.22-24], обладающие бактерицидными свойствами в частности 3-(5-нитрофурфурил)-7-(5-нитрофурфурилиден)-3,3a,4,5,6,7-гексагидро-2H-индазол, проявляющий высокую антистафилококковую активность [патент РФ 2, – с.22-24], обладающие бактерицидными свойствами в частности 3-(5-нитрофурфурил)-7-(5-нитрофурфурилиден)-3,3a,4,5,6,7-гексагидро-2H-индазол, проявляющий высокую антистафилококковую активность [патент РФ  2273640, МПК C07D 405/14 заявл. 11.01.2005, опубл. 10.04.2006]. 2273640, МПК C07D 405/14 заявл. 11.01.2005, опубл. 10.04.2006].
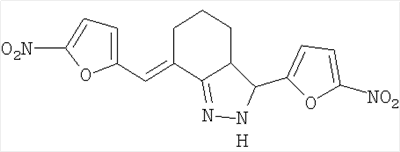
3-(5-Нитрофурфурил)-7-(5-нитрофурфурилиден)-3,3a,4,5,6,7-гексагидро-2H-индазол получают взаимодействием 2,6-ди-(5-нитрофурфурилиден)циклогексанона с гидразингидратом в среде пропанола-2 с выходом 80%.
Техническая задача состоит в увеличении эффективности и расширении ассортимента фунгицидных препаратов.
Техническим результатом является получение новых замещенных 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолов общей формулы I, обладающих фунгицидной активностью, способы их получения, а также увеличение эффективности фунгицидных средств за счет применения соединений общей формулы I и расширение ассортимента фунгицидных препаратов.
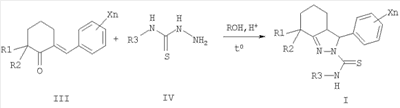
Согласно настоящему изобретению замещенные 2-тиокарбамоил-3-Фенил-3,3a,4,5,6,7-гексагидро-2H-индазолы общей формулы I, где R1 означает метальную группу, R2 означает атом водорода или метальную группу, либо R1 и R2 совместно означают полиметиленовую цепь с числом атомов углерода от 2 до 5; X, одинаковые или разные, означают алкильный заместитель с числом атомов углерода от 1 до 4, атом галогена, нитрогруппу или перфторалкильную группу с числом атомов углерода от 1 до 4; n означает целое число от 1 до 5; R3 означает атом водорода, алкильную или арильную группу, содержащую в качестве заместителей алкильную группу с числом атомов углерода от 1 до 4, атом галогена, нитрогруппу или перфторалкильную группу с числом атомов углерода от 1 до 4, получают взаимодействием соответствующих 2-арилиденциклогексанонов III с тиосемикарбазидами IV, где R1, R2 и R3 имеют те же значения, что и в общей формуле I, в среде алифатического спирта, например этанола, с использованием кислотного катализатора, например соляной кислоты или n-толуолсульфокислоты, при нагревании. Таким способом получают преимущественно 3,3a-цис-2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолы формулы I.
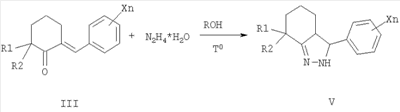
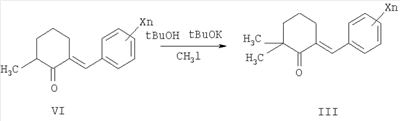
Согласно настоящему изобретению замещенные 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолы общей формулы I по другому способу получают в две стадии из 2-арилиденциклогексанонов III конденсацией с гидразингидратом при кипячении в алифатическом спирте, например этаноле, с последующим ацилированием промежуточных N-незамещенных гексагидроиндазолов V различными алкил- или арилизотиоцианатами VII в инертном растворителе, например диэтиловом эфире, при катализе основаниями, например триэтиламином, 1,8-диазобицикло[5.4.0]ундец-7-еном (ДБУ), тетраметилэтилендиамином (ТМЭДА) и др. Таким способом получают преимущественно 3,3a-транс-2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолы формулы I.
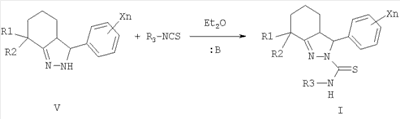
Соединения формулы I и соединения, которые могут использоваться в качестве промежуточных в способах их получения, могут существовать в одной или нескольких изомерных формах как в зависимости от цис- и транс-взаимного расположения 3- и 3a-протонов, так и в зависимости от числа ассиметрических центров молекулы. Следовательно, изобретение также относится ко всем пространственным и оптическим изомерам, к их рацемическим смесям и к соответствующим диастереоизомерам соответствующего ряда.
 7. – P.1317-1324.]: 7. – P.1317-1324.]:
 7. – Р.1317-1324]. 7. – Р.1317-1324].
Новые замещенные 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолы общей формулы I, обладают фунгицидной активностью.
Техническим результатом изобретения также является разработка фунгицидных композиций, состоящих из замещенных 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолов общей формулы I в концентрации 0,1-99% и вспомогательных веществ, которые успешно могут быть применены для борьбы с вредоносными грибковыми болезнями сельскохозяйственных культур, животных или человека.
Успешное применение пестицидов для борьбы с различными вредными организмами в большой степени зависит от препаративной формы препарата и условий, при которых действующее вещество контактирует с вредителями и возбудителями заболеваний растений. В зависимости от физико-химических свойств препарата, его назначения и способа применения выбирается наиболее эффективная и экономичная препаративная форма (композиция), это могут быть, например, дусты, гранулы, микрокапсулированные препараты, смачивающиеся порошки, концентраты эмульсий, мази, вододиспергируемые гранулы, суспензионные концентраты. Препаративные формы помимо действующего вещества, могут включать в свой состав наполнители, растворители, поверхностно-активные вещества, смягчители воды, синергические добавки и др. Известен препарат цинеб, который применяют в виде 70 и 80%-ного смачивающегося порошка для борьбы с болезнями яблони, сливы, картофеля томатов, огурцов капусты в период вегетации, а также как протравитель семян. [Пестициды и регуляторы роста растений: Справ, изд. / Н.Н.Мельников, К.В.Новожилов, С.Р.Белан. – М.: Химия, 1995, с.24, с.316.].
Изобретение может быть проиллюстрировано следующими примерами:
Пример 1. 2-Тиокарбамоил-3-(4-хлорфенил)-7,7-диметил-3,3a,4,5,6,7 гексагидро-2H-индазол (1)
Смесь 0.50 г (2.01 ммоль) 2,2-диметил-6 (4 хлорбензилиден) циклогексанона, 0.366 г (4.02 ммоль) тиосемикарбазида, 20 мл этанола и 2 мл (0,0236 моль) концентрированной соляной кислоты кипятят в течение 3 часов, охлаждают, упаривают растворитель в вакууме водоструйного насоса. К остатку прибавляют 15 мл диэтилового эфира и кипятят в течение 10 минут, осадок отфильтровывают, фильтрат упаривают в вакууме водоструйного насоса. Остаток перекристаллизовывают из изопропанола, получают 0.35 г (54%) 7,7-диметил-3-(4-хлорбензилиден)-3,3a,4,5,6,7-гексагидро-2H-индазола (1) с т.пл. 169-170°C, Rf=0,52 (хлороформ).
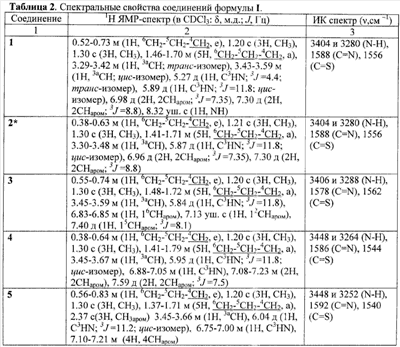
1Н ЯМР-спектр (в CDCl3:  , м.д.; J, Гц): 0.52-0.73 м (1Н, 6CH2–5CH2–4CH2, e), 1.20 с (3H, CH3), 1.30 с (3H, CH3), 1.46-1.70 м (5H, 6CH2–5CH2–4CH2, a), 3.29-3.42 м (1H, 3aCH; транс-изомер), 3.43-3.59 м (1H, 3aCH; цис-изомер), 5.27 д (1H, C3HN; 3J=4.4; транс-изомер), 5.89 д (1H, C3HN; 3J=11.8; цис-изомер), 6.98 д (2H, 2CHаром; 3J=7.35), 7.30 д (2H, 2CHаром; 3J=8.8), 8.32 уш. с (1H, NH). , м.д.; J, Гц): 0.52-0.73 м (1Н, 6CH2–5CH2–4CH2, e), 1.20 с (3H, CH3), 1.30 с (3H, CH3), 1.46-1.70 м (5H, 6CH2–5CH2–4CH2, a), 3.29-3.42 м (1H, 3aCH; транс-изомер), 3.43-3.59 м (1H, 3aCH; цис-изомер), 5.27 д (1H, C3HN; 3J=4.4; транс-изомер), 5.89 д (1H, C3HN; 3J=11.8; цис-изомер), 6.98 д (2H, 2CHаром; 3J=7.35), 7.30 д (2H, 2CHаром; 3J=8.8), 8.32 уш. с (1H, NH).
Найдено,%: C, 60.05; H, 6.45; N, 12.71; Cl, 10.93; S, 10.01. C16H20ClN3S. Вычислено, %: C, 59.70; H, 6.26; N, 13.06; Cl, 11.01; S, 9.96.
ИК-спектр (в вазелиновом масле;  , см-1): 3404 и 3280 (N-H), 1588 (C=N), 1556 (C=S). , см-1): 3404 и 3280 (N-H), 1588 (C=N), 1556 (C=S).
Аналогично получены замещенные 2-тиокарбамоил-3-арил-3,3a,4,5,6,7-гексагидро-2H-индазолы (Таблица 1)
Таблица 1.
Температуры плавления и выход синтезированных 2-тиокарбамоил-3-арил-3,3a,4,5,6,7 гексагидро-2Н-индазолов
 |
 |
R1 |
R2 |
R3 |
X |
Т.пл., °С |
Выход, % |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 1 |
CH3 |
CH3 |
H |
4-Cl |
169-170 |
54 |
| 2 |
CH3 |
CH3 |
H |
4-Br |
181-183 |
47 |
| 3 |
CH3 |
CH3 |
H |
3,4-Cl2 |
193-195 |
27 |
| 4 |
CH3 |
CH3 |
H |
4-CF3 |
190-191 |
28 |
| 5 |
CH3 |
CH3 |
H |
2-СН3 |
230-231 |
56 |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 6 |
CH3 |
CH3 |
H |
2,4-Cl2 |
195-196 |
15 |
| 7 |
CH3 |
CH3 |
H |
2-Br |
199-201 |
13 |
| 8 |
CH3 |
CH3 |
H |
2-Cl |
172-174 |
22 |
| 9 |
CH3 |
CH3 |
H |
4-NO2 |
164-166 |
60 |
| 10 |
CH3 |
H |
H |
4-Cl |
87-89 |
49 |
| 11 |
CH3 |
H |
H |
4-Br |
135-137 |
20 |
| 12 |
(CH2)3 |
H |
4-Cl |
213-215 |
63 |
| 13 |
CH3 |
CH3 |
C6H5 |
4-Cl |
170-172 |
67 |
| 14 |
CH3 |
CH3 |
C6H5 |
4-Br |
184-186 |
75 |
| 15 |
CH3 |
CH3 |
C6H5 |
2-Br |
195-196 |
43 |
| 16 |
CH3 |
CH3 |
C6H5 |
2-Cl |
193-194 |
41 |
| 17 |
CH3 |
H |
C6H5 |
4-Cl |
191-193 |
68 |
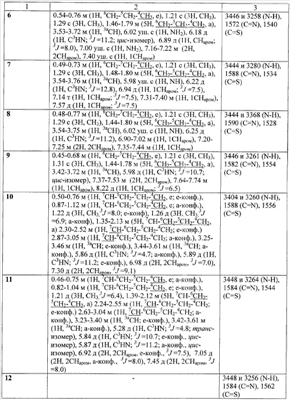
ЯМР 1Н спектры записаны на приборе «Bruker AC-200» (рабочая частота 200 МГц), химические сдвиги измерены относительно тетраметилсилана, в качестве растворителя использовали CDCl3 (для соединения * d6DMSO). ИК-спектры записаны на приборе “Specord M80” с призмами KBr или NaCl в тонком слое (жидкости) или в виде суспензии в вазелиновом масле (кристаллические вещества).
Пример 2. 3-(4-Хлорфенил)-7,7-диметил-3,3a,4,5,6,7-гексагидро-2H индазол (18) Раствор 3,73 г (0,015 моль) 2,2-диметил-6-(4-хлорбензилиден)циклогексанона и 1,65 г (0,033 моль; 1,65 мл) гидразин гидрата в 15 мл этанола кипятят в течение 2 часов, охлаждают, выпавший осадок отфильтровывают и промывают 2 мл этанола. Получают 3,70 г (94%) 3-(4-хлорфенил)-7,7-диметил-3,3a,4,5,6,7-гексагидро-2H-индазола (18) с т.пл. 104-106°C, Rf=0,36 (хлороформ).
ИК ( , см-1): 3354 (N-H), 1596 (C=N), 1504 (C=Cаром). , см-1): 3354 (N-H), 1596 (C=N), 1504 (C=Cаром).
Пример 3. 2-(N-Фенилтиокарбамоил)-3-(4-хлорфенил)-7,7-диметил-3,3a,4,5,6,7-гексагидро-2H-индазол(19)
К раствору 1,0 г (0,0038 моль) 3-(4-хлорфенил)-7,7-диметил-3,3a,4,5,6,7-гексагидро-2Н-индазола в 8 мл диэтилового эфира прибавляют 1,03 г (0,0076 моль) фенилтиоизоцианата и 0,025 г (0,25 ммоль) триэтиламина, реакционную массу перемешивают при комнатной температуре в течение 3 часов, упаривают растворитель, к остатку прибавляют 5 мл гексана, перемешивают, остаток промывают 2 мл гексана и перекристаллизовывают из смеси изопропилового спирта и ДМФА (4:1 по объему), получают 1,04 г (56%) 2-(N-фенилтиокарбамоил)-3-(4-хлорфенил)-7,7-диметил-3,3a,4,5,6,7-гексагидро-2H-индазола (19) с т.пл. 168-169°C, Rf=0,61 (хлороформ).
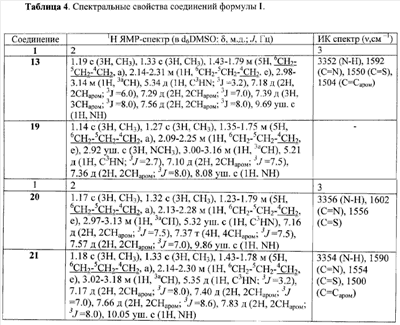
Аналогично получены замещенные 2-тиокарбамоил-3-арил-3,3a,4,5,6,7-гексагидро-2H-индазолы (Таблица 3)
Таблица 3.
Температуры плавления и выходы синтезированных 2-тиокарбамоил-3-арил-3,3a,4,5,6,7 гексагидро-2H-индазолов
 |
 |
R1 |
R2 |
R3 |
X |
Т.пл., °C |
Выход, % |
| 13 |
CH3 |
CH3 |
C6H5 |
4-Cl |
168-169 |
56 |
| 19 |
CH3 |
CH3 |
CH3 |
4-Cl |
206-207 |
54 |
| 20 |
CH3 |
CH3 |
4-ClC6H4 |
4-Cl |
194-195 |
47 |
| 21 |
CH3 |
CH3 |
4-CF3C6H4 |
4-Cl |
175-176 |
78 |
Пример 4. Композиция концентрата эмульсии
Действующее вещество: (замещенные 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолы) – 70 г
Алкилбензолсульфокислоты кальциевая соль (АБСК) – 15 г
Оксиэтилированный октилфенол (ОП-7) – 70 г
Циклогексанон – 280 г
Смесь ксилолов – 110 г
1-Метилнафталин – 45 г
Керосин в количестве, достаточном для получения 1 л раствора.
Пример 5. Испытания на фунгицидную активность соединений проводили в экспериментах in vitro. [Методические рекомендации по определению фунгицидной активности новых соединений. Черкассы: НИИТЭХИМ. 1984. 34 с.].
Действие препаратов на радиальный рост мицелия определяли растворением композиции соединения в ацетоне и внесением аликвоты в картофеле-сахарозный агар при 50°С до концентрации 30 мг/л по действующему веществу. Конечная концентрация ацетона в контрольных растворах и в растворах с действующими веществами составила 1%. В чашки Петри, содержащие 15 мл агаровой среды, наносили иглой культуры грибов на агаровую поверхность. Образцы выдерживали в инкубаторе при 25°С и измеряли радиальный рост через 3 суток. Процент ингибирования рассчитывали по Эбботу по отношению к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в таблице 3.
Таблица 5.
Результаты испытаний замещенных 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолов на фунгицидную активность в концентрации 30 мг/л. |
| Соединение |
Подавление развития микроорганизмов, % |
| V.i. |
R.s. |
F.o. |
F.m. |
B.s. |
S.s. |
| 1 |
40 |
50 |
46 |
58 |
77 |
26 |
| 2 |
48 |
52 |
27 |
56 |
67 |
25 |
| 3 |
28 |
41 |
27 |
47 |
73 |
19 |
| 4 |
47 |
34 |
9 |
29 |
64 |
26 |
| 5 |
25 |
43 |
6 |
19 |
55 |
24 |
| 6 |
50 |
53 |
28 |
48 |
63 |
14 |
| 7 |
33 |
21 |
10 |
29 |
49 |
6 |
| 8 |
30 |
36 |
15 |
50 |
38 |
11 |
| 9 |
25 |
7 |
8 |
– |
18 |
4 |
| 10 |
45 |
61 |
38 |
55 |
74 |
27 |
| 11 |
54 |
42 |
20 |
45 |
67 |
19 |
| 12 |
41 |
33 |
19 |
55 |
60 |
18 |
| 13* |
15 |
0 |
26 |
48 |
54 |
13 |
| 13** |
17 |
17 |
– |
– |
21 |
3 |
| 14 |
13 |
23 |
31 |
52 |
43 |
7 |
| 15 |
30 |
23 |
7 |
20 |
14 |
7 |
| 16 |
30 |
55 |
8 |
27 |
12 |
19 |
| 17 |
23 |
18 |
12 |
58 |
19 |
10 |
| 19 |
38 |
38 |
24 |
40 |
48 |
13 |
| 20 |
18 |
13 |
6 |
11 |
2 |
1 |
| 21 |
10 |
1 |
14 |
– |
0 |
3 |
| Триадимефон (эталон) |
41 |
43 |
77 |
87 |
44 |
61 |
* цис-2-[N-(4-хлорфенил)тиокарбамоил]-3-(4-хлорфенил)-7,7-диметил-3,3a,4,5,6,7-гексагидро-2H-индазол,
** транс-2-[N-(4-хлорфенил)тиокарбамоил]-3-(4-хлорфенил)-7,7-диметил-3,3a,4,5,6,7-гексагидро-2H-индазол. |
Триадимефон-3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-бутанон-2.
Обозначения фитопатогенных грибов: V.i. – Venturia inaequalis, R.s. – Rhizoctonia solani, F.o. – Fusarium oxysporum, F.m. – Fusarium moniliforme, B.s. – Bipolaris sorokiniana, S.s. – Sclerotinia sclerotiorum.
Применение соединений общей формулы I как в индивидуальном виде, так и в композициях с другими активными и вспомогательными соединениями, позволяет в случае применения соединений 1, 2, 6, 10, 11 более эффективно бороться с грибковыми заболеваниями сельскохозяйственных культур в сравнении с применяющимся сельскохозяйственным фунгицидом – триадимефоном.
Формула изобретения
1. Замещенные 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2Н-индазолы общей формулы I,

где R1 означает метильную группу, R2 означает атом водорода или метильную группу, либо R1 и R2 совместно означают полиметиленовую цепь с числом атомов углерода от 2 до 5, X, одинаковые или разные, означают алкильный заместитель с числом атомов углерода от 1 до 4, атом галогена, нитрогруппу или перфторалкильную группу с числом атомов углерода от 1 до 4, п означает целое число от 1 до 5, R3 означает атом водорода, алкильную группу с числом атомов углерода от 1 до 4 или арильную группу, содержащую в качестве заместителей атом водорода, атом галогена или перфторалкильную группу с числом атомов углерода от 1 до 4.
2. Способ получения замещенных 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолов общей формулы I, где R1 означает метильную группу, R2 означает атом водорода или метильную группу, либо R1 и R2 совместно означают полиметиленовую цепь с числом атомов углерода от 2 до 5, X, одинаковые или разные, означают алкильный заместитель с числом атомов углерода от 1 до 4, атом галогена, нитрогруппу или перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 1 до 5, R3 означает атом водорода, алкильную группу с числом атомов углерода от 1 до 4 или арильную группу, содержащую в качестве заместителей атом водорода, атом галогена или перфторалкильную группу с числом атомов углерода от 1 до 4,
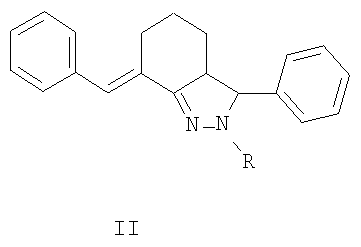
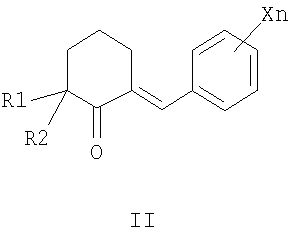
заключающийся в том, что замещенные 2-бензилиденциклогексаноны формулы II, где R1, R2, X и n имеют те же значения, что и в формуле I, вводят во взаимодействие с тиосемикарбазидами формулы III, где R3 имеет те же значения, что и в формуле I, в среде алифатического спирта в присутствии кислотных катализаторов при нагревании
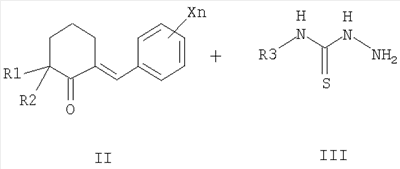
3. Способ получения замещенных 2-таокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолов общей формулы I, где R1 означает метильную группу, R2 означает атом водорода или метильную группу, либо R1 и R2 совместно означают полиметиленовую цепь с числом атомов углерода от 2 до 5, X, одинаковые или разные, означают алкильный заместитель с числом атомов углерода от 1 до 4, атом галогена, нитрогруппу или перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 1 до 5, R3 означает атом водорода, алкильную группу с числом атомов углерода от 1 до 4 или арильную группу, содержащую в качестве заместителей атом водорода, атом галогена или перфторалкильную группу с числом атомов углерода от 1 до 4,
заключающийся в том, что 2-арилиденциклогексаноны II, где R1, R2, X и n имеют те же значения, что и в формуле I, конденсируют с гидразингидратом при кипячении в среде алифатического спирта, с получением N-незамещенных гексагидроиндазолов формулы IV, где R1, R2 и Xn имеют те же значения, что и в формуле I, которые ацилируют алкил- или арилизотиоцианатами V, где R3 имеет те же значения, что и в формуле I, в инертном растворителе в присутствии оснований в качестве катализаторов
4. Фунгицидная композиция, содержащая действующее вещество в концентрации 0,1-99% и вспомогательные вещества, отличающаяся тем, что в качестве фунгицида используют замещенные 2-тиокарбамоил-3-фенил-3,3a,4,5,6,7-гексагидро-2H-индазолы формулы I по п.1.
|
|