|
|
(21), (22) Заявка: 2008145610/04, 19.11.2008
(24) Дата начала отсчета срока действия патента:
19.11.2008
(46) Опубликовано: 27.11.2009
(56) Список документов, цитированных в отчете о
поиске:
Шкляев Ю.В., Масливец А.Н. – Журнал органической химии, т.32, вып.2, с.319, 1996. RU 2272030 С2, 20.03.2006.
Адрес для переписки:
614990, г.Пермь, ул. Букирева, 15, ПГУ, патентному поверенному А.А. Онорину
|
(72) Автор(ы):
Халтурина Валерия Владиславовна (RU),
Шкляев Юрий Владимирович (RU),
Масливец Андрей Николаевич (RU),
Махмудов Рамиз Рагипович (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Пермский государственный университет” (RU)
|
(54) (1Z,3Z)-4-АРИЛ-4-ГИДРОКСИ-1-(3,3-ДИАЛКИЛ-3,4-ДИГИДРОИЗОХИНОЛИН-1(2H)-ИЛИДЕН)-БУТ-3-ЕН-4-ОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат:
Изобретение относится к области органической химии, а именно к новым соединениям (1Z,3Z)-4-арил-4-гидрокси-1-(3,3-диалкил-3,4-дигидроизохинолин-1(2Н)-илиден)-бут-3-ен-4-онам общей формулы:
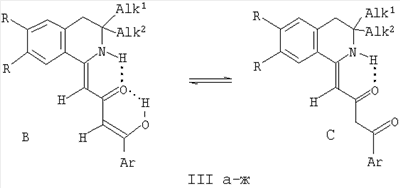
III: R=Н, Alk1=Alk2=Me, Ar=Ph (a), Ar=С6Н4Ме-n (б), Alk1=Me, Alk2=Bu, Ar=Ph (в), Ar=C6H4Me-n (г), R=OMe, Alk1=Alk2=Me, Ar=Ph (д), Ar=C6H4Me-n (e), R=OEt, Alk1=Alk2=Me, Ar=Ph (ж). Изобретение также относится к способу их получения. Технический результат – получение новых соединений, которые обладают анальгетической активностью и могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем. 2 н. и 2 з.п. ф-лы, 1 табл.
Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям класса 3,4-дигидроизохинолина, и к способу их получения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем.
1. Известны структурные аналоги заявленных соединений, получаемые взаимодействием 5-арилфуран-2,3-дионов (Ia-ж) с 3,3-диалкил-1-метил-3,4-дигидроизохинолинами (IIа-г) в абсолютном бензоле или абсолютном хлороформе в течение 2-30 минут (Журнал органической химии. 1996. Вып.32. С319). Синтез структурных аналогов осуществляется по следующей схеме:
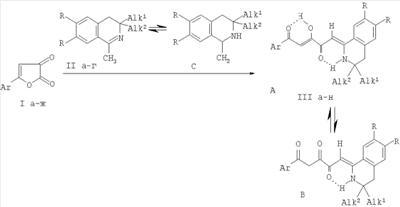
I: Ar = Ph (а), C6H4Ме-n (б), С6H4Cl-n (в), С6Н4ОМе-n (г), C6H4NO2-n (д), C6H4F-n (е),
С6Н4 Вr-n (ж); II: R=Н, Alk1=Alk2=Me (a), Alk1=Me, Alk2=Bu (б), R=OMe, Alk1=Alk2=Me (в), R+R=OCH2CH2O, Alk1=Alk2=Me (г); III: R=H, Alk1=Alk2=Me, Ar=Ph (a), Ar=С6Н4Ме-n (б), Ar=С6Н4Сl-n (в), Ar=C6H4F-n (г), Ar=С6Н4Вr-n (д), Alk1=Me, Alk2=Bu, Ar=С6Н4Ме-n (e), R=OMe, Alk1=Alk2=Me, Ar=Ph (ж), Ar=С6Н4Ме-n (з), Ar=С6Н4Сl-n (и), Ar=С6Н4ОМе-n (к), Ar=С6H4NO2-n (л), Ar=C6H4F-n (м), R+R=OCH2CH2O, Alk1=Alk2=Me, Ar=Ph (н).
К недостаткам данного способа относится невозможность получения аналогичных соединений с боковой цепью из четырех атомов углерода.
Задачей изобретения является разработка способа синтеза (1Z,3Z)-4-арил-4-гидрокси-1-(3,3-диалкил-3,4-дигидроизохинолин-1(2H)-илиден)-бут-3-ен-4-онов.
Поставленная задача осуществляется путем кипячения 6-арил-2,2-диметил-4H-1,3-диоксин-4-онов (Iа,б) с 1-метил-3,4-дигидроизохинолинами (IIа-г), взятыми в соотношении 1:1 по схеме:
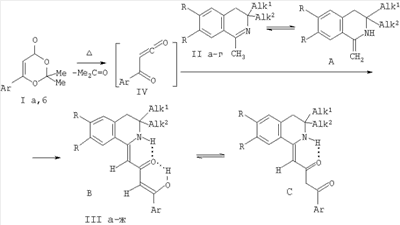
I: Ar=Ph (а), C6H4Me-n (б); II: R=H, Alk1=Alk2=Me (a), Alk1=Me, Alk2=Bu (б), R=OMe, Alk1=Alk2=Me (в), R=OEt, Alk1=Alk2=Me (г); III: R=H, Alk1=Alk2=Me, Ar=Ph (a), Ar=С6Н4Ме-n (б), Alk1=Me, Alk2=Bu, Ar=Ph (в), Ar=С6Н4Ме-n (г), R=OMe, Alk1=Alk2=Me, Ar=Ph (д), Ar=С6Н4Ме-n (e), R=OEt, Alk1=Alk2=Me, Ar=Ph (ж).
Процесс ведут при температуре 108-110°С, а в качестве растворителя используют абсолютный толуол. Данная реакция сопровождается ацилированием группы  -СН таутомерной енаминоформы А изохинолинов (IIа-г) ароилкетенами (IV), генерируемыми при термическом элиминировании молекулы ацетона из 6-арил-2,2-диметил-4H-1,3-диоксин-4-онов (1а,б). -СН таутомерной енаминоформы А изохинолинов (IIа-г) ароилкетенами (IV), генерируемыми при термическом элиминировании молекулы ацетона из 6-арил-2,2-диметил-4H-1,3-диоксин-4-онов (1а,б).
Из патентной и технической литературы не были выявлены способы получения (1Z,3Z)-4-арил-4-гидрокси-1-(3,3-диалкил-3,4-дигидроизохинолин-1(2H)-илиден)-бут-3-ен-4-онов, имеющие сходные признаки с заявляемым способом, а именно, не использовались исходные продукты – 6-арил-2,2-диметил-4H-1,3-диоксин-4-оны, растворители, в которых проходит реакция, и интервал температур, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1
(1Z,3Z)-4-Гидрокси-1-(3,3-диметил-3,4-дигидроизохинолин-1(2H)-илиден)-4-фенилбут-3-ен-2-он (IIIа)
Раствор 2.0 ммоль 2,2-диметил-6-фенил-4H-1,3-диоксин-4-она (Iа) и 2.0 ммоль изохинолина (IIа) в 20 мл абсолютного толуола кипятили 60 мин, охлаждали, выпавший осадок соединения (IIIа) отфильтровывали. Выход 85%, масло.
Найдено, %: С 78.82; Н 6.75; N 4.20. C21H21NO2.
Вычислено, %: С 78.97; Н 6.63; N 4.39.
Пример 2
(1Z,3Z)-4-Гидрокси-1-(3,3-Диметил-3,4-дигидроизохинолин-1(2H)-илиден)-4-(4-толил)бут-3-ен-2-он (IIIб)
Раствор 2.0 ммоль 2,2-диметил-6-(4-толил)-4H-1,3-диоксин-4-она (1б) и 2.0 ммоль изохинолина (IIа) в 20 мл абсолютного толуола кипятили 60 мин, охлаждали, выпавший осадок соединения (IIIб) отфильтровывали. Выход 86%, масло.
Найдено, %: С 79.24; Н 7.15; N 4.02. C22H23NO2.
Вычислено, %: С 79.25; Н 6.95; N 4.20.
Пример 3
(1Z,3Z)-4-Гидрокси-1-(3-бутил-3-метил-3,4-дигидроизохинолин-1(2H)-илиден)-4-фенилбут-3-ен-2-он (IIIв)
Раствор 2.0 ммоль 2,2-диметил-6-фенил-4H-1,3-диоксин-4-она (Iа) и 2.0 ммоль изохинолина (IIб) в 20 мл абсолютного толуола кипятили 60 мин, охлаждали, выпавший осадок соединения (IIIв) отфильтровывали. Выход 84%, масло.
Найдено, %: С 79.68; Н 7.53; N 3.70. C24H27NO2.
Вычислено, %: С 79.74; Н 7.53; N 3.87.
Пример 4
(1Z,3Z)-4-Гидpoкcи-1-(3-бyтил-3-мeтил-3,4-дигидроизохинолин-1(2H)-илиден)-4-(4-толил)бут-3-ен-2-он (IIIг)
Раствор 2.0 ммоль 2,2-диметил-6-(4-толил)-4H-1,3-диоксин-4-она (Iб) и 2.0 ммоль изохинолина (IIб) в 20 мл абсолютного толуола кипятили 60 мин, охлаждали, выпавший осадок соединения (IIIг) отфильтровывали. Выход 85%. Т.пл. 164-166°С (разл.).
Найдено, %: С 79.85; Н 7.83; N 3.59. C25H29NO2.
Вычислено, %: С 79.96; Н 7.78; N 3.73.
Пример 5
(1Z,3Z)-4-Гидрокси-1-(3,3-диметил-6,7-диметокси-3,4-дигидроизохинолин-1(2H)-илиден)-4-фенилбут-3-ен-2-он (IIIд)
Раствор 2.0 ммоль 2,2-диметил-6-фенил-4H-1,3-диоксин-4-она (Iа) и 2.0 ммоль изохинолина (IIв) в 20 мл абсолютного толуола кипятили 60 мин, охлаждали, выпавший осадок соединения (IIIд) отфильтровывали. Выход 87%. Т.пл. 142-143°С (разл.).
Найдено, %: С 72.68; Н 6.84; N 3.67. C23H25NO4.
Вычислено, %: С 72.80; Н 6.64; N 3.69.
Пример 6
(1Z,3Z)-4-Гидрокси-1-(3,3-Диметил-6,7-диметокси-3,4-дигидроизохинолин-1(2H)-илиден)-4-(4-толил)бут-3-ен-2-он (IIIе)
Раствор 2.0 ммоль 2,2-диметил-6-(4-толил)-4H-1,3-диоксин-4-она (Iб) и 2.0 ммоль изохинолина (IIв) в 20 мл абсолютного толуола кипятили 60 мин, охлаждали, выпавший осадок соединения (IIIе) отфильтровывали. Выход 88%. Т.пл. 139-141°С (разл.).
Найдено, %: С 73.25; Н 6.94; N 3.53. C24H27NO4.
Вычислено, %: С 73.26; Н 6.92; N 3.56.
Пример 7
(1Z,3Z)-4-Гидрокси-1-(3,3-диметил-6,7-диэтокси-3,4-дигидроизохинолин-1(2H)-илиден)-4-фенилбут-3-ен-2-он (IIIж)
Раствор 2.0 ммоль 2,2-диметил-6-фенил-4H-1,3-диоксин-4-она (Iа) и 2.0 ммоль изохинолина (IIг) в 20 мл абсолютного толуола кипятили 60 мин, охлаждали, выпавший осадок соединения (IIIж) отфильтровывали. Выход 89%. Т.пл. 133-135°С (разл.).
Найдено, %: С 73.61; Н 7.25; N 3.43. C25H29NO4.
Вычислено, %: С 73.69; Н 7.17; N 3.44.
В ИК-спектрах (вазелиновое масло) соединений (IIIа-ж) присутствуют полосы валентных колебаний енольной группы ОН и группы NH, участвующих в образовании внутримолекулярных водородных связей (ВВС), в виде широкой полосы в области 3384-3417 см-1, карбонильной группы в положении 2, участвующей в образовании ВВС, в виде широкой полосы в области 1582-1591 см-1.
В спектрах ЯМР 1Н соединений (IIIа-ж) кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют синглет шести протонов двух метильных групп в положении 3 изохинолинового фрагмента в области 1.27-1.28 м.д. [у соединений (IIIа, б, д-ж)], синглет трех протонов метильной группы при 1.27 м.д. и группа сигналов девяти протонов бутильной группы в положении 3 изохинолинового фрагмента в области 0.96-1.22 м.д. [у соединений (IIIв, г)], синглет двух протонов группы СН2 в положении 4 изохинолинового фрагмента в области 2.82-2.91 м.д., синглет протона группы С1Н в области 5.67-5.77 м.д., синглет протона группы С3Н в области 6.18-6.28 м.д., синглет протона группы NH в области 10.42-10.57 м.д., синглет протона енольной группы ОН в области 16.04-16.07 м.д., относящиеся к кетоенольной форме В соединений (IIIа-ж). Кроме того, в спектрах ЯМР 1Н соединений (IIIа-ж) имеются минорные наборы сигналов дикетонной формы С: сигналы протонов ароматических колец и связанных с ними групп, синглет шести протонов двух метильных групп в положении 3 изохинолинового фрагмента в области 1.19-1.20 м.д. [у соединений (IIIа, б, д-ж)], синглет трех протонов метильной группы при 1.24 м.д. и группа сигналов девяти протонов бутильной группы в положении 3 изохинолинового фрагмента в области 0.90-1.16 м.д. [у соединений (IIIв, г)], синглет двух протонов группы СН2 в положении 4 изохинолинового фрагмента в области 2.76-2.86 м.д., синглет двух протонов группы С3Н2 в области 4.00-4.10 м.д., синглет протона группы С1Н в области 5.76-5.87 м.д., синглет протона группы NH в области 10.95-11.08 м.д. Спектральные характеристики соединений (IIIа-ж) свидетельствуют о их существовании в растворе в ДМСО-d6 в виде смеси кетоенольной формы В и дикетонной формы С в соотношении ~9:1.
Предлагаемый способ достаточно прост в осуществлении, одностадиен и позволяет получить (1Z,3Z)-4-арил-4-гидрокси-1-(3,3-диалкил-3,4-дигидроизохинолин-1(2H)-илиден)-бут-3-ен-4-оны практически с количественным выходом, которые найдут применение в качестве исходных продуктов для синтеза гетероциклических систем и в фармакологии в качестве потенциальных лекарственных средств.
Пример 8
Фармакологическое исследование (1Z,3Z)-4-гидрокси-1-(3-бутил-3-метил-3,4-дигидроизохинолин-1(2H)-илиден)-4-(4-толил)бут-3-ен-2-она (IIIг) и (1Z,3Z)-4-гидрокси-1-(3,3-Диметил-6,7-диметокси-3,4-дигидроизохинолин-1(2H)-илиден)-4-фенилбут-3-ен-2-она (IIIд) на наличие анальгетической активности.
Анальгетическую активность соединений (IIIг, д) по отношению к анальгину определяли методом термического раздражения «горячая пластинка» по Эдди и Леймбах на беспородных мышах массой 18-22 г (Eddy N.B., Leimbarh D.J.-Pharmacol and Exper.Gher., 1953, 385-393). Статистическую обработку экспериментального материала проводили с использованием t критерия Стьюдента (М.Л. Беленький, Элементы количественной оценки фармакологического эффекта. – 2-е изд. – Л., 1963. – с.152). Эффект считали достоверным при р<0,05.
Проведенные исследования показали (см. таблицу), что соединения (IIIг, д) обладают анальгетической активностью. Данные о фармакологической активности аналогов заявляемых соединений в доступной литературе отсутствуют.
| Анальгетическая активность соединений (IIIг, д) |
 соединения соединения |
Доза, мг/кг |
Время оборонительного рефлекса через |
| 2 часа |
2,5 часа |
| IIIг |
50, в/б |
 |
21,7±3,12 |
| IIIд |
50, в/б |
 |
18,3±2,10 |
| Контроль 2% крахм. слизь |
50, в/б |
8,9±0,8 |
10,6±1,21 |
| Анальгин |
93 (ЕД50) [2] |
12,8±1,9 |
16,3±3,0 |
Формула изобретения
1. (1Z,3Z)-4-арил-4-гидрокси-1-(3,3-диалкил-3,4-дигидроизохинолин-1(2Н)-илиден)-бут-3-ен-4-оны общей формулы
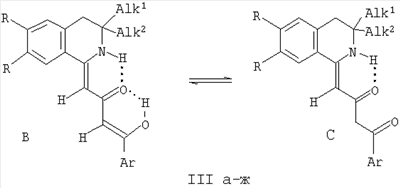
III: R=Н, Alk1=Alk2=Me, Ar=Ph (a), Ar=С6Н4Ме-n (б), Alk1=Me, Alk2=Bu, Ar=Ph (в), Ar=С6Н4Ме-n (г), R=OMe, Alk1=Alk2=Me, Ar=Ph (д), Ar=C6H4Me-n (e), R=OEt, Alk1=Alk2=Me, Ar=Ph (ж).
2. Способ получения (1Z,3Z)-4-арил-4-гидрокси-1-(3,3-диалкил-3,4-дигидроизохинолин-1(2Н)-илиден)-бут-3-ен-4-онов общей формулы

III: R=Н, Alk1=Alk2=Me, Ar=Ph (a), Ar=С6Н4Ме-n (б), Alk1=Me, Alk2=Bu, Ar=Ph (в), Ar=С6Н4Ме-n (г), R=OMe, Alk1=Alk2=Me, Ar=Ph (д), Ar=C6H4Me-n (e), R=OEt, Alk1=Alk2=Me, Ar=Ph (ж),
отличающийся тем, что 6-арил-2,2-диметил-4Н-1,3-диоксин-4-оны (Iа,б) подвергают взаимодействию с 1-метил-3,4-дигидроизохинолинами (IIa-г) в среде органического растворителя.
3. Способ по п.2, отличающийся тем, что процесс ведут при температуре 108-110°С.
4. Способ по п.2, отличающийся тем, что в качестве растворителя используют абсолютный толуол.
|
|