Патент на изобретение №2373287
|
||||||||||||||||||||||||||
(54) СПОСОБ ИДЕНТИФИКАЦИИ БАКТЕРИЙ РОДА PSEUDOMONAS
(57) Реферат:
Изобретение относится к микробиологии. Суточные агаровые культуры бактерий засевают по одной петле в растворе хлорида натрия на сектора питательной среды, содержащей ионы бария хлорида бария, и той же питательной среды без ионов бария (контроль). Инкубируют посевы при 28°С в течение 24 ч, после чего идентифицируют бактерии рода Pseudomonas по отсутствию роста бактерий на питательной среде с ионами бария при наличии роста бактерий на той же питательной среде без ионов бария. Наличие желто-зеленой флуоресценции газона бактерий и окружающей его питательной среды выявляет группу флуоресцирующих псевдомонад. Используют синтетическую питательную среду при следующем содержании ингредиентов, г/л: L-пролин 1,0-3,0, L-глютамат натрия или L-глютамин 1,0-3,0, NaCl 5,0, MgCl2·6H2O 0,05, KH2PO4 0,05, К2НРO4 0,1, агар бактериологический 15,0, вода дистиллированная до 1 литра, pH 7,2±0,2, суплемент хлорид бария (ВаСl2·2Н2O) 6,0-16,0. При этом ингредиенты, кроме хлорида бария, растворяют при нагревании, кипятят среду в течение 5 минут, разливают часть готовой среды в стерильные чашки Петри (питательная среда без ионов бария), в оставшуюся часть горячей среды вносят расчетное количество хлорида бария по указанной прописи, перемешивают, разливают в стерильные чашки (питательная среда с ионами бария). Изобретение позволяет повысить стандартность и упростить исследования по идентификации бактерий рода Pseudomonas. 2 табл.
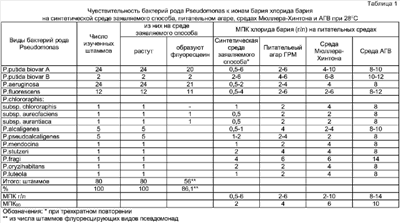
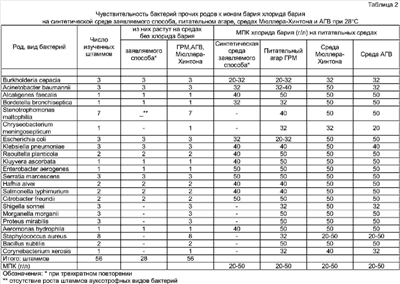
Изобретение относится к области микробиологии. Может быть использовано при бактериологических исследованиях по идентификации бактерий рода Pseudomonas и производстве питательных сред для этих исследований. Известен способ идентификации бактерий рода Pseudomonas на основе их уникальной чувствительности к ионам бария. Явление избирательной барийчувствительности бактерий рода Pseudomonas впервые обнаружено нами (Сиволодский Е.П. Патент Исследованиями других авторов на широком наборе видов псевдомонад была подтверждена избирательная чувствительность к ионам бария бактерий рода Pseudomonas (Киприанова Е.А., Бойко О.И. Чувствительность к ионам бария и ЭДТА как таксономический маркер рода Pseudomonas. – Mикpoбиoлoгия. – 1992. – T.61. – Из приведенных аналогов выбран прототипом способ, используемый в статье Киприановой Е.А., Бойко О.И. (Микробиология. – 1992. – Т.61. – Недостатками прототипного способа и других аналогов являются: – отсутствие стандартности исследования ввиду использования для определения барийчувствительности бактерий различных питательных сред из естественного сырья (гидролизатов рыбы, пептона) с неопределенным составом субстратов, связующих ионы бария, что обусловливает различную аналитическую чувствительность способа; – необходимость стерилизации используемой питательной среды в паровом стерилизаторе при 121°С. Целью изобретения является повышение стандартности и упрощение исследования по идентификации бактерий рода Pseudomonas. В соответствии с изобретением поставленная цель достигается тем, что исследуемые суточные агаровые культуры вносят по одной петле диаметром 2 мм в 0,2 мл стерильного 0,85% раствора хлорида натрия в лунке стерильного планшета, перемешивают и засевают по одной петле одномиллиардной взвеси бактерий радиальным штрихом на сектор питательной среды, содержащей ионы хлорида бария, и той же питательной среды без хлорида бария (контроль), при этом используют синтетическую питательную среду следующего состава ингредиентов, г/л: L-пролин – 1,0-3,0; L-глютамат натрия или L-глютамин – 1,0-3,0; NaCl – 5,0; MgCl2·6H2O – 0,05; KH2PO4 – 0,05; K2HPO4 – 0,1; агар бактериологический – 15,0; вода дистиллированная – 1 литр; pH – 7,2±0,2; суплемент хлорид бария (ВаСl2·2Н2O) – 6,0-16,0; при этом ингредиенты, кроме хлорида бария, растворяют при нагревании, кипятят среду в течение 5 минут, разливают часть готовой среды в стерильные чашки Петри (контрольная питательная среда без ионов бария), в оставшуюся часть горячей питательной среды вносят расчетное количество хлорида бария по указанной прописи, перемешивают, разливают в стерильные чашки Петри (питательная среда с ионами бария); инкубируют посевы при 28°С в течение 24 ч, после чего идентифицируют бактерии рода Pseudomonas по отсутствию роста бактерий на питательной среде с ионами бария при наличии роста бактерий на той же среде без ионов бария, при этом наличие желто-зеленой флуоресценции газона бактерий и окружающей его питательной среды выявляет группу флуоресцирующих псевдомонад. При росте бактерий на обеих питательных средах они относятся к прочим родам; при отсутствии роста на обеих питательных средах бактерии относятся к ауксотрофным видам прочих родов бактерий. Примечание. Биологический контроль качества питательной среды заявляемого способа проводят при первом изготовлении среды и изменении серии любого ее компонента. Для контроля применяют штамм Pseudomonas aeruginosa АТСС 27853, используемый в бактериологических лабораториях для контроля определения чувствительности псевдомонад к антибиотикам. Применяют среды с тремя концентрациями хлорида бария (0,5; 1,0; 2,0 г/л) и контрольную среду без хлорида бария. Методика приготовления синтетической питательной среды с ионами бария и без ионов бария, а также методика испытания бактерий указаны выше. Качество питательной среды соответствует требованиям, если контрольный штамм P.aeruginosa АТСС 27853 будет иметь при испытании МПК хлорида бария 1 г/л и на контрольной среде без хлорида бария наблюдается его пышный рост с продукцией флуоресцеина. Срок годности готовых питательных сред в чашках Петри 7 суток при хранении от +4 до +8°С. Отличительный существенный признак способа – использование в качестве питательной среды для определения барийчувствительности синтетической питательной среды указанного выше состава, содержащей в качестве источника азота и углерода только аминокислоты L-пролин (1,0-3,0 г/л) и L-глютамат натрия или L-глютамин (1,0-3,0) при минимальном количестве солей и источник ионов бария хлорид бария в интервале 6,0-16,0 г/л. Отличительный существенный признак способа не применялся в прототипе, аналогах и не известен из уровня техники. Отличительный существенный признак не следует явным образом из уровня техники. Состав синтетической питательной среды заявляемого способа разработан на основании результатов наших экспериментов по изучению профилей утилизации 20 белковых аминокислот в качестве единственного источника азота и углерода псевдомонад, выполненных на 100 штаммах P.aeruginosa, 40 штаммах P.putida, 24 штаммах P.fluorescens, 5 штаммах P.alcaligenes, 5 штаммах P.pseudoalcaligenes, включая типовые штаммы, а также на типовых штаммах 8 других видов псевдомонад (P.clororaphis, P.aureofaciens, P.aurantiaca, P.stutzeri, P.mendocina, P.fragi, P.oryzih abitans, P.luteola). Результаты, еще неопубликованные, показали, что все виды и штаммы флуоресцирующих псевдомонад используют в качестве единственного источника азота и углерода L-глютаминовую кислоту (L-глютамат натрия), L-глютамин, L-пролин, в то время как некоторые виды и штаммы нефлуоресцирующих псевдомонад (P.stutzeri, P.alcaligenes, P.pseudoalcaligenes) вариабельны по этим аминокислотам, но при сочетании двух из них (L-пролина и L-глютамата натрия или L-глютамина) обеспечивается рост всех исследуемых штаммов псевдомонад. Это обеспечивает замену указанными аминокислотами минеральных источников азота в известных синтетических питательных средах, например NH4H2PO4 в среде Козера, используемой для выделения псевдомонад (Смирнов В.В., Киприанова Е.А. Бактерии рода Pseudomonas. – Киев: Наукова думка, 1990. – С.221), что снижает связывание ионов бария и повышает аналитическую чувствительность среды. Синтетическая питательная среда Козера вообще не пригодна для определения барийчувствительности псевдомонад, так как при любом органическом источнике углерода не обеспечивает роста всех видов и штаммов псевдомонад. Отличительный существенный признак способа непосредственно определяет достижение поставленной цели: 1. Повышается стандартность исследования ввиду замены питательных сред прототипного способа и аналогов, содержащих гидролизаты или пептоны неопределенного состава, синтетической питательной средой точно воспроизводимого состава; достигается воспроизводимость показателей барийчувствительности псевдомонад и других бактерий, определяющих диагностически значимый интервал концентраций хлорида бария в питательной среде (6-16 г/л), при котором все штаммы псевдомонад подавляются и все штаммы прочих родов бактерий растут, при воспроизводимости роста всех штаммов псевдомонад на той же питательной среде без хлорида бария (контроль). Указанные характеристики питательной среды были воспроизводимы при трехкратном повторении (табл.1 и табл.2) 2. Исследование упрощается ввиду исключения стерилизации питательной среды заявляемого способа в паровом стерилизаторе при 121°С, так как синтетическая питательная среда заявляемого способа не допускает роста посторонних ауксотрофных бактерий, в том числе аэробных спорообразующих бактерий. Для изготовления и приготовления питательной среды достаточно кипятить (100°С) ее в течение 5 минут и сразу же добавить хлорид бария, что уничтожает все вегетативные формы бактерий. Возможно сохранение спор анаэробных и аэробных спорообразующих бактерий, однако споры анаэробов не прорастают в аэробных условиях исследования, споры аэробов рода Bacillus не прорастают, так как являются ауксотрофами и не могут расти на минимальной синтетической среде. Опыт использования питательной среды заявляемого способа, обеспложенной только кипячением в течение 5 минут, показал отсутствие прорастания среды посторонней микрофлорой во всех случаях инкубации посевов псевдомонад при экспериментах на средах с хлоридом бария и без хлорида бария в течение 24-48 ч при 28°С (200 чашек Петри) и инкубации незасеянной среды в чашках Петри при 28°С и 37°С в течение 7 суток (20 чашек). Питательная среда заявляемого способа, стерилизованная в паровом стерилизаторе при 121°С в течение 20 минут или обеспложенная кипячением в течение 5 минут, имеет одинаковые показатели барийчувствительности псевдомонад при обязательном условии внесения хлорида бария в горячую среду сразу после стерилизации или после кипячения. Дополнительными техническими результатами способа, обусловленными его отличительным признаком, являются: – повышение аналитической чувствительности заявляемого способа в сравнении с прототипом и другими аналогами – минимальная подавляющая рост концентрация хлорида бария для 90% изученных штаммов псевдомонад на питательной среде заявляемого способа равна 2 г/л (МПК90 – 2 г/л) при диапазоне подавляющих концентраций хлорида бария для видов псевдомонад 0,5-6 г/л (табл.1); на мясопептонном агаре прототипного способа МПК90 – 5 г/л хлорида бария при диапазоне МПК хлорида бария для видов псевдомонад 0,5-10 г/л; на питательном агаре для культивирования микроорганизмов (ГРМ – агар) производства научно-производстенного центра генно-инженерных препаратов г.Оболенск МПК90 – 4 г/л при диапазоне МПК 2-6 г/л (табл.1); на питательной среде Мюллера – Хинтона для определения чувствительности микроорганизмов к антибиотикам (производства фирмы Hi – Меdia, Индия) МПК90 – 6 г/л при диапазоне МПК 2-10 г/л (табл.1); на питательной среде для определения чувствительности микроорганизмов к антибиотикам (среда АГВ) производства НПО Питательные среды г.Махачкала МПК90 – 10 г/л при диапазоне МПК хлорида бария 8-14 г/л; – выявление синтеза флуоресцеина у 86,1% штаммов флуоресцирующих видов псевдомонад на контрольной среде заявляемого способа (без хлорида бария), что исключает необходимость данного исследования при дальнейшей видовой идентификации псевдомонад (табл.1); – выявление ауксотрофных штаммов прочих родов бактерий, которые не растут на контрольной среде заявляемого способа (без хлорида бария), что исключает необходимость проведения данного исследования при дальнейшей видовой идентификации прочих родов бактерий (табл.2). Существенными признаками заявляемого способа являются также посевная доза исследуемой культуры, температура и время инкубации. При посеве на питательную среду заявляемого способа 1 петли диаметром 2 мм взвеси бактерий, полученной при разведении одной петли суточной агаровой культуры в 0,2 мл 0,85% раствора хлорида натрия, обеспечивается посевная доза 1-2·107 КОЕ, что достаточно для пышного роста всех штаммов псевдомонад на контрольной среде (без хлорида бария) и роста всех штаммов прочих родов бактерий (кроме ауксотрофов). Инкубацию посевов следует проводить при 28°С, так как этот режим обеспечивает рост всех видов псевдомонад и прочих родов бактерий; инкубация при 35-37°С подавляет рост некоторых видов психротрофных псевдомонад и значительно угнетает продукцию флуоресцеина псевдомонадами. Посевы бактерий достаточно инкубировать в течение 24 ч, что обеспечивает рост всех штаммов бактерий. Примеры, подтверждающие возможность осуществления способа Пример 1. Исследуемый материал – суточные агаровые культуры бактерий Примечание к примеру 1. Методика приготовления питательной среды заявляемого способа. В 1 л дистиллированной воды вносят сухую смесь ингредиентов, содержащую (г/л): L-пролин – 1,0; L-глютамат натрия – 1,0; NaCl – 5,0; MgCl2·6H2O – 0,05; КН2РO4 – 0,05; К2НРO4 – 0,1; агар бактериологический – 15,0; pH – 7,2±0,2; растворяют при нагревании до кипения, кипятят в течение 5 минут, разливают часть среды в стерильные чашки Петри (контрольная среда без ионов бария), в оставшуюся часть горячей среды вносят хлорид бария из расчета 6 г/л, перемешивают, разливают в стерильные чашки Петри (питательная среда с ионами бария). Питательные среды в чашках Петри пригодны к использованию в течение 7 суток при хранении от +4 до +8°С. Контроль новой партии питательной среды – обнаружение у контрольного штамма P.aeruginosa АТСС 27853 МПК хлорида бария 1 г/л и продукции флуоресцеина на контрольной среде без хлорида бария при изучении по методике примера 1. Пример 2. Исследуемый материал – суточную агаровую культуру бактерий Пример 3. Исследуемый материал – суточные агаровые культуры бактерий Пример 4. Исследуемый материал – суточную агаровую культуру бактерий Таким образом, при всех предельных концентрациях ингредиентов питательной среды заявляемого способа получены четкие достоверные результаты родовой идентификации бактерий Pseudomonas, выявления продукции флуоресцеина псевдомонадами, выявления ауксотрофности у прочих родов бактерий при отсутствии роста на средах посторонней микрофлоры. Синтетическая питательная среда заявляемого способа стандартна по составу, позволяет получать воспроизводимые результаты идентификации псевдомонад с более высокой аналитической чувствительностью, чем другие среды этого предназначения, более проста по методике приготовления.
Формула изобретения
Способ идентификации бактерий рода Pseudomonas, состоящий в том, что исследуемые суточные агаровые культуры бактерий засевают по одной петле диаметром 2 мм одноммиллиардной взвеси в 0,85%-ном растворе хлорида натрия радиальным штрихом на сектора питательной среды, содержащей ионы бария хлорида бария, и той же питательной среды без ионов бария (контроль), инкубируют посевы при 28°С в течение 24 ч, после чего идентифицируют бактерии рода Pseudomonas по отсутствию роста бактерий на питательной среде с ионами бария при наличии роста бактерий на той же питательной среде без ионов бария, при этом наличие желто-зеленой флуоресценции газона бактерий и окружающей его питательной среды выявляет группу флуоресцирующих псевдомонад; при росте бактерий на обеих питательных средах они принадлежат к прочим родам; при отсутствии роста на обеих питательных средах бактерии относятся к ауксотрофным видам прочих родов, отличающийся тем, что используют синтетическую питательную среду при следующем содержании ингредиентов, г/л:
при этом ингредиенты, кроме хлорида бария, растворяют при нагревании, кипятят среду в течение 5 мин, разливают часть готовой среды в стерильные чашки Петри (питательная среда без ионов бария), в оставшуюся часть горячей среды вносят расчетное количество хлорида бария по указанной прописи, перемешивают, разливают в стерильные чашки (питательная среда с ионами бария). |
||||||||||||||||||||||||||

 1296577 Российской Федерации на изобретение “Средство для селективного подавления роста бактерий рода Pseudomonas”, приоритет от 21 мая 1985 г., заявка
1296577 Российской Федерации на изобретение “Средство для селективного подавления роста бактерий рода Pseudomonas”, приоритет от 21 мая 1985 г., заявка