|
|
(21), (22) Заявка: 2006134639/13, 01.03.2005
(24) Дата начала отсчета срока действия патента:
01.03.2005
(30) Конвенционный приоритет:
01.03.2004 EP 04100813.7
(43) Дата публикации заявки: 10.04.2008
(46) Опубликовано: 20.11.2009
(56) Список документов, цитированных в отчете о
поиске:
GB 1395777 А, 29.05.1975. ЕР 0402724 А1, 19.12.1990. US 5502043 А, 26.03.1996. RU 2245714 C1, 10.02.2005.
(85) Дата перевода заявки PCT на национальную фазу:
02.10.2006
(86) Заявка PCT:
EP 2005/050877 20050301
(87) Публикация PCT:
WO 2005/082942 20050909
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
БОЛЛ Михель (DE),
ФИШ Андреас (CH),
ШПАН Донат Р. (CH)
(73) Патентообладатель(и):
Б. БРАУН МЕЛЬЗУНГЕН АГ (DE)
|
(54) ГИДРОКСИЭТИЛКРАХМАЛ
(57) Реферат:
Изобретение относится к области медицины, а именно к гидроксиэтилкрахмалу. Описан гидроксиэтилкрахмал со средней молекулярной массой Mw, большей или равной 500000, отличающийся тем, что молярная степень замещения MS составляет от 0,25 до 0,5 и С2/С6 – отношение составляет от 2 до менее 8, фармацевтическая композиция на его основе, применение этой фармацевтической композиции для получения плазмозаменителя или плазморасширителя, а также применение этой фармацевтической композиции для поддержания нормоволемии и/или для улучшения макро- и микроциркуляции, и/или для улучшения трофического снабжения кислородом, и/или для стабилизации гемодинамики, и/или для улучшения объемной эффективности, и/или для уменьшения вязкости плазмы, и/или для повышения толерантности к анемии, и/или для гемодилюции, в частности для терапевтической гемодилюции при нарушениях кровоснабжения и артериальных, особенно периферических артериальных облитерирующих, заболеваниях. Также описан способ получения данного гидроксиэтилкрахмала, предусматривающий превращение суспендированного в воде крахмала этиленоксидом и последующий частичный гидролиз полученного производного крахмала кислотой до желаемого диапазона молекулярных масс гидроксиэтилкрахмала. Данное изобретение позволило получить гидроксиэтилкрахмал с малой склонностью к кумуляции и малым влиянием на свертывание крови и одновременно с длительным периодом полураспада. 6 н. и 21 з.п., 1 ил., 7 табл.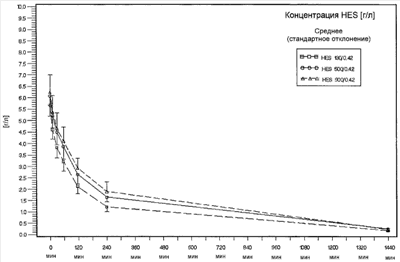
Настоящее изобретение относится к гидроксиэтилкрахмалу, а также к способу получения такого гидроксиэтилкрахмала. Кроме того, изобретение относится к фармацевтической композиции, содержащей гидроксиэтилкрахмал, а также к применению такой фармацевтической композиции для получения кровезаменителя, плазмозаменителя или плазморасширителя, а также к применению этой фармацевтической композиции для поддержания нормоволемии и/или для улучшения макро- и микроциркуляции, и/или для улучшения трофического снабжения кислородом, и/или для стабилизации гемодинамики, и/или для улучшения объемной эффективности, и/или для уменьшения вязкости плазмы крови, и/или для повышения толерантности к анемии, и/или для гемодилюции, в частности для терапевтической гемодилюции при нарушениях кровоснабжения и артериальных, особенно периферических артериальных облитерирующих, заболеваниях.
Замена внутрисосудистой жидкости относится к важным мерам при профилактике и терапии гиповолемии, а именно независимо от того, возникает ли волемия в результате непосредственной потери крови или жидкостей тела (при острых кровотечениях, травмах, операциях, ожогах), в результате нарушений распределения между макро- и микроциркуляцией (как при сепсисе) или в результате вазодилатации (например, при введении в наркоз). Применимые для этих показаний инфузионные растворы должны восстанавливать нормальный объем крови и поддерживать перфузию жизненно важных органов, а также периферический кровоток. Одновременно эти растворы не должны чрезмерно загружать кровоток и они не должны иметь побочных действий. В этом отношении все существующие в настоящее время растворы кровезаменителей обнаруживают преимущества и недостатки. Так называемые кристаллоидные растворы (растворы электролитов), хотя и в значительной степени лишены непосредственных побочных действий, однако обеспечивают только краткосрочную или неадекватную стабилизацию внутрисосудистого объема и гемодинамики. При ярко выраженной или более продолжительно длящейся гиповолемии они должны вводиться инфузией в избыточных количествах, так как они не остаются исключительно во внутрисосудистом компартменте, а быстро распределяются во внесосудистом пространстве. Быстрый отток во внесосудистое пространство не только ограничивает наполняющее циркуляцию действие кристаллоидных растворов, но таит в себе также риск периферических и легочных отеков. Кроме угрозы для жизни, которую может представлять отек легкого, он приводит, кроме того, к ухудшению трофического кровоснабжения, которое также ухудшается периферическим отеком.
В противоположность этому коллоидные растворы независимо от того, содержат ли они коллоиды природного или синтетического происхождения, являются гораздо более надежными в их действии. Это объясняется тем, что они на основе их коллоидосмотического действия более долго сохраняют доставляемую жидкость в кровотоке, чем кристаллоиды, и таким образом защищают ее от оттока в интерстиций. С другой стороны, коллоидные растворы кровозаменителей в большей степени, чем кристаллоидные растворы, дают повод для нежелательных реакций. Так, природный коллоид альбумин, как все производные крови или плазмы крови, таит в себе риск заражения вирусными заболеваниями; кроме того, он может вступать во взаимодействия с другими лекарственными средствами, например ингибиторами АСЕ; наконец, доступность альбумина является ограниченной и его применение в качестве кровезаменителей является чрезвычайно дорогим. Дополнительные опасения в отношении применения альбумина в качестве кровезаменителя имеют их причину в ингибировании эндогенного синтеза альбумина при его экзогенной доставке и в его легкой экстравазации. Под этим понимают переход из кровотока в экстравазальное (внесосудистое) пространство, где это может привести из-за коллоидосмотических эффектов альбумина к нежелательным и длительно сохраняющимся скоплениям жидкости.
В случае синтетических коллоидов тяжелые анафилактические реакции и массивное нарушение свертывания крови привели к тому, что препараты декстрана почти полностью исчезли из терапии. Растворы гидроксиэтилкрахмала (HES) обладают, правда, также потенциалом в запуске анафилактических реакций и во влиянии на свертывание крови, но в меньшей степени, чем декстран. Серьезные анафилактические реакции (реакции со степенью тяжести III и IV) наблюдаются с HES-растворами – в отличие от применения декстрана – крайне редко; и влияние на свертывание крови, которое присуще высокомолекулярным растворам, могло быть значительно уменьшено последующим развитием HES-растворов в последние годы. В сравнении с растворами желатина, которые также находят применение в качестве плазмозаменителей и позволяют в значительной степени избегать свертывания крови, HES-растворы, по меньшей мере их высокомолекулярные и среднемолекулярные формы осуществления, имеют преимущество более длительной продолжительности пребывания в плазме и эффективности.
В ЕР-А-0402724 раскрыто получение и применение гидроксиэтилкрахмала со средней молекулярной массой (Mw) 60000-600000, молярной степенью замещения (MS) 0,15-0,5 и степенью замещения (DS) 0,15-0,5. Описана быстрая (6-12 часов) и полная расщепляемость применяемых в качестве плазмозаменителей гидроксиэтилкрахмалов. Конкретно исследовали при этом гидроксиэтилкрахмал в пределах предпочтительного диапазона средних молекулярных масс 100000-300000, в частности, со средней молекулярной массой 234000.
В US-А-5502043 раскрыто применение гидроксиэтилкрахмалов со средней молекулярной массой Mw 110000-150000, молярной степенью замещения MS 0,38-0,5 и степенью замещения DS 0,32-0,45 для улучшения микроциркуляции при периферическом артериальном нарушении кровоснабжения. Кроме того, в этой публикации описано применение низкомолекулярных (Mw 110000-150000) гидроксиэтилкрахмалов, которые вследствие их низкой молекулярной массы поддерживают низкую вязкость плазмы и тем самым гарантируют улучшение микроциркуляции в кровообращении. Однако в этой публикации не рекомендуется применение более высокомолекулярных гидроксиэтилкрахмалов, таких как, например, гидроксиэтилкрахмал с молекулярной массой 500000, так как они, несмотря на низкое молярное замещение (MS=0,28), повышают вязкость плазмы и тем самым ухудшают микроциркуляцию.
В настоящее время во всем мире используют HES-препараты в качестве коллоидных кровезаменителей, которые по существу различаются по их молекулярной массе и наряду с этим по размеру этерификации гидроксиэтильными группами и по другим параметрам. Самым известным представителем этого класса веществ являются так называемые гептакрахмал (HES 450/0,7) и пентакрахмал (HES 200/0,5). В последнем случае речь идет о наиболее распространенном в настоящее время «стандартном HES». Наряду с ним HES 200/0,62 и HES 70/0,5 играют меньшую роль. В случае указанных данных в отношении молекулярной массы речь идет, как и в случае указанных данных в отношении других параметров, об усредненных величинах, причем в основе этой декларации молекулярных масс лежит средняя молекулярная масса (Mw), которая дается в дальтонах (например, в случае HES 200000) или в большинстве случаев в килодальтонах (например, в случае HES 200). Размер этерификации с гидроксиэтильными группами характеризуется молярным замещением MS (например, 0,5, как в HES 200/0,5; MS = среднее молярное отношение гидроксиэтильных групп к ангидроглюкозным единицам) или степенью замещения (DS = отношение одно- или многократно гидроксилированных глюкоз к общему числу ангидроглюкозных единиц). В соответствии с их молекулярной массой находящиеся в клиническом применении HES-растворы подразделяются на высокомолекулярные (450 кД), среднемолекулярные (200-250 кД) и низкомолекулярные (70-130 кД).
Что касается действий HES-растворов на свертывание, то следует различать между неспецифическими и специфическими влияниями. Неспецифическое влияние на свертывание крови осуществляется на основе разбавления крови (гемодилюция), которое имеет место при инфузии растворов HES- и других кровезаменителей в кровоток. Этим разбавлением крови затрагиваются также факторы свертывания, концентрации которых понижаются в зависимости от размера и продолжительности вызываемого инфузией разбавления крови и белков плазмы. В соответствии с этим большие или затяжные воздействия могут приводить к обнаруживаемой лабораторной диагностикой, в экстремальных случаях к клинически релевантной гипокоагулируемости.
Наряду с этим гидроксиэтилкрахмал может оказывать специфическое влияние на свертывание крови, за которое становятся ответственными несколько факторов. Так, обнаруживают при определенных условиях или с определенными HES-препаратами снижение белков свертывания фактора VIII (F VIII) и фактора фон Виллебранда (vWF), которое превышает обусловленное гемодилюцией снижение общих белков плазмы. Обусловлено ли это более сильное, чем ожидаемое снижение, уменьшенным образованием или высвобождением F VIII/vWF, HES-обусловленными эффектами образования покрытия («coating») на эндотелии сосудов или другими механизмами, полностью не выяснено.
Однако HES влияет не только на концентрацию указанных факторов свертывания, но, очевидно, также и на функцию тромбоцитов. За это является ответственным полностью или частично связывание HES с поверхностью тромбоцитов, которое ингибирует доступ лигандов к рецептору фибриногена тромбоцитов.
Эти специфические действия HES на свертывание крови особенно выражены при использовании высокомолекулярного HES (например, HES 450/0,7), в то время как они уже не играют такой большой роли в случае среднемолекулярного (например, HES 250/0,5) или низкомолекулярного HES (например, HES 130/0,4 или HES 70/0,5) (J. Treib et al., Intensive Care Med. (1999), S.258-268; O. Langeron et al., Anesth. Analg. (2001), S. 855-862; R.G. Strauss et al., Transfusion (1988), S.257-260; M. Jamnicki et al., Anesthesiology (2000), S.1231-1237).
При сравнении профиля риска высокомолекулярного HES с профилем риска средне- и низкомолекулярных препаратов можно установить у последних явное уменьшение риска, а именно не только в отношении взаимодействия со свертыванием крови, но также в отношении определенных фармакокинетических свойств. Так, растворы высокомолекулярного HES обнаруживают сильное накопление в кровотоке, тогда как этот недостаток в случае среднемолекулярного HES имеется лишь в ослабленной форме и в случае низкомолекулярных препаратов практически уже отсутствует. Тот факт, что в случае растворов низкомолекулярного HES, такого как HES 130/0,4 уже не возникает накапливание, является релевантным терапевтическим прогрессом, так как концентрации HES в плазме в рутинных клинических условиях определять невозможно, и даже экстремально высокие концентрации, к которым могут привести растворы высокомолекулярного HES в пределах нескольких дней, остаются поэтому необнаруженными. В случае высокомолекулярного HES количество кумулирующегося в кровотоке «остаточного HES» неизвестно пользователю, но оно тем не менее влияет на кинетику и поведение того HES, который по незнанию дополнительно был введен вливанием к еще имеющимся в наличии в кровотоке количествам. Поэтому высокомолекулярный HES в соответствии с уровнем техники не поддается измерению в его действии; он остается в кровотоке дольше, чем это требовалось бы на основании терапевтических причин или было бы желательно, и его метаболическая судьба не выяснена.
В отличие от этого низкомолекулярный HES в пределах приблизительно 20-24 часов после инфузии полностью исчезает из кровотока. Благодаря этому устраняются эффекты избытка и не происходит, особенно при повторяемой инфузии, накопления. Фармакокинетическое поведение низкомолекулярного крахмала является в отличие от поведения высокомолекулярного крахмала поддающимся определению и его можно легко регулировать. Не возникает слишком сильная нагрузка кровотока или механизмов элиминации.
Это само по себе выгодное поведение низкомолекулярного HES в сравнении с высокомолекулярными препаратами достигается, однако, со значительно более короткими периодами полураспада в плазме. Период полураспада в плазме низкомолекулярного HES составляет только приблизительно половину периода полураспада HES 200 или менее (J.Waitzinger et al., Clin. Drug Invest. (1998) S.151-160) и лежит в диапазоне периодов полураспада препаратов желатина, которые классифицируются как исключительно кратковременно действующие. Правда, короткий период полураспада кровезаменителя не является в принципе недостатком, так как он может быть компенсирован более частым или более высоким введением соответствующего кровезаменителя. Однако при тяжелой или продолжительной гиповолемии кровезаменитель с коротким периодом полураспада и короткой продолжительностью действия таит в себе опасность недостаточного наполнения кровотока (подобно кристаллоидным растворам) или, при соответствующем более высоком дозировании для компенсации этого недостатка, риск чрезмерной перегрузки интерстициальной жидкости.
На этом фоне существует потребность в кровезаменителе, который отличается, с одной стороны, малой склонностью к кумуляции и малым влиянием на свертывание крови (как низкомолекулярный HES), но, с другой стороны, обнаруживает более длительный период полураспада, чем низкомолекулярные, близкие к кристаллоидным растворам HES-растворы.
В поисках гидроксиэтилкрахмала с такими свойствами теперь было обнаружено, что имеются гидроксиэтилкрахмалы для HES-растворов с более продолжительным периодом полураспада в плазме в сравнении с известными растворами низкомолекулярного HES, и они могут быть также приготовлены, и эти высокомолекулярные растворы по изобретению неожиданным образом не обнаруживают таких недостатков известных высокомолекулярных растворов, как, например, их свойство накапливаться в кровотоке или их ярко выраженное ингибирование свертывания крови.
Таким образом, предметом настоящего изобретения в одном варианте осуществления является гидроксиэтилкрахмал со средней молекулярной массой Mw, большей или равной 500000, причем молярная степень замещения MS составляет 0,25-0,5, предпочтительно 0,35-0,50 (0,35 MS MS 0,50) и отношение С2/С6 составляет 2-< 8. 0,50) и отношение С2/С6 составляет 2-< 8.
На гидроксиэтилкрахмалы согласно изобретению влияет молярная степень замещения MS. Молярная степень замещения (молярное замещение) определяется как среднее количество гидроксиэтильных групп на ангидроглюкозную единицу (Sommermeyer et al., Krankenhauspharmazie (1987), S.271-278). Молярная степень замещения может быть определена в соответствии с Ying-Che Lee et al., Anal. Chem. (1983) 55, 334 и K.L. Hodges et al., Anal. Chem. (1979) 51, 2171. Известное количество HES подвергают при этом при добавлении адипиновой кислоты и иодистоводородной кислоты (HI) в ксилоле эфирному расщеплению. После этого высвобождающийся этилиодид определяют количественно газовой хроматографией с использованием внутреннего стандарта (толуола) и наружного стандарта (эталонных растворов этилоиодида). Молярная степень замещения MS влияет на действие гидроксиэтилкрахмалов данного изобретения. При выборе слишком высокого показателя MS применение гидроксиэтилкрахмалов в качестве кровезаменителя может приводить к кумуляционному действию в кровотоке. С другой стороны, при выборе слишком низкого показателя MS применение гидроксиэтилкрахмалов в качестве кровезаменителя может приводить к слишком быстрому распаду гидроксиэтилкрахмала в кровотоке и посредством этого уменьшать желаемую продолжительность периода полураспада в плазме. Предпочтительной оказалась молярная степень замещения MS 0,35-0,5 (0,35 MS MS 0,50), предпочтительно 0,39 0,50), предпочтительно 0,39 0,45 (0,39 0,45 (0,39 MS MS 0,45) и, в частности, молярная степень замещения MS>0,4-0,44 (0,40,44). 0,45) и, в частности, молярная степень замещения MS>0,4-0,44 (0,40,44).![]()
Гидроксиэтилкрахмалы по изобретению принадлежат к высокомолекулярным гидроксиэтилкрахмалам и обнаруживают предпочтительно среднюю молекулярную массу (Mw) более 60000-1500000, особенно предпочтительно 620000-1200000 и, в частности, 700000-1000000. Эти гидроксиэтилкрахмалы в зависимости от приготовления существуют не в виде молекулярно однородного вещества с определенной молекулярной массой, а в виде смеси молекул различной величины, которые замещены различным образом гидроксиэтильными группами. Поэтому характеристика таких смесей требует использования статистически усредненных величин. Поэтому для обозначения средней молекулярной массы служит усредненная молекулярная масса (Mw), причем общее определение этого среднего показателя приведено в Sommermeyer et al., Krankenhauspharmazie (1987), S.271-278).
Определение молекулярной массы выполняют при помощи GPC-MALLS с использованием GPC-колонок TSKgel G 6000 PW, G 5000 PW, G 3000 PW и G 2000 PW (7,5 мм×30 см), детектора MALLS (DAWN-EOS; Wyatt Deutschland GmbH, Woldert) и RI-детектора (Optilab DSP; Wyatt Deutschland GmbH, Woldert) при скорости тока 1,0 мл/мин в 50 мМ фосфатном буфере рН 7,0. Обработка данных может проводиться с использованием программы ASTRA (Wyatt Deutschland GmbH, Woldert).
Предпочтительными являются гидроксиэтилкрахмалы, которые получены из природного или частично гидролизованного крахмала зерновых или картофеля. При этом особенно предпочтительным на основании их высокого содержания амилопектина является применение крахмалов из восковидных разновидностей соответствующих растений, когда они существуют (например, восковидная кукуруза, восковидный рис).
Гидроксиэтилкрахмалы по изобретению описываются далее отношением замещения при С2 к замещению при С6 ангидроглюкозных единиц. Это отношение, которое в рамках изобретения используется в виде сокращения С2/С6-отношение, обозначает отношение количества замещенных в положении 2 ангидроглюкозных единиц к количеству замещенных в положении 6 ангидроглюкозных единиц гидроксиэтилкрахмала. С2/С6-отношение HES может варьироваться в широких границах посредством количества применяемого при гидроксиэтилировании гидроксида натрия, как представлено в таблице 1 и таблице 2. Чем выше используемое количество NaOH, тем сильнее активируются гидроксигруппы в положении 6 при ангидроглюкозе крахмала для гидроксиэтилирования. Поэтому С2/С6-отношение снижается с повышением концентрации NaOH во время гидроксиэтилирования. Определение выполняют, как описано Sommermeyer et al., Krankenhauspharmazie (1987), S.271-278. С2/С6-отношения составляют в следующем порядке предпочтительно 3-<8, 2-7, 3-7, 2,5 7, 2,5-6 или 4-6. Это С2/С6-отношение представляет в случае высокомолекулярных HES по изобретению дополнительный вклад в решение лежащих в основе данного изобретения задач. 7, 2,5-6 или 4-6. Это С2/С6-отношение представляет в случае высокомолекулярных HES по изобретению дополнительный вклад в решение лежащих в основе данного изобретения задач.
Гидроксиэтилкрахмалы в соответствии с изобретением на основе их превосходной переносимости и их хорошей расщепляемости в организме человека и животных пригодны для применения в различных фармацевтических композициях.
В одном конкретном варианте осуществления HES по изобретению обнаруживают среднюю молекулярную массу 700000-1000000, молярную степень замещения MS более 0,4-0,44 (0,40,44) и С2/С6-отношение 2-7, предпочтительно 3-7 и, в частности, 2,5-6.![]()
Следующим предметом изобретения является способ получения гидроксиэтилкрахмала по изобретению. Этот способ предусматривает следующие стадии:
(i) превращение суспендированного в воде крахмала, предпочтительно кукурузного крахмала, особенно предпочтительно частично гидролизованного, так называемого жидкокипящего крахмала, этиленоксидом и
(ii) частичный гидролиз полученного производного крахмала (крахмалопродукта), предпочтительно хлористоводородной кислотой, до желаемого среднего диапазона молекулярных масс гидроксиэтилкрахмала.
Для получения гидроксиэтилкрахмалов по изобретению пригодны в принципе все известные крахмалы, прежде всего природные или частично гидролизованные крахмалы, предпочтительно зерновой или картофельный крахмалы, в частности крахмалы с высоким содержанием амилопектина. В одном конкретном варианте осуществления способа по изобретению используют крахмалы из восковидных разновидностей, в частности восковидной кукурузы и/или восковидного риса. В одном предпочтительном варианте осуществления получение HES выполняют превращением суспендированного в воде зернового и/или картофельного крахмала, предпочтительно жидкокипящего восковидного кукурузного крахмала, этиленоксидом. Предпочтительно эта реакция катализируется добавлением подщелачивающих средств, предпочтительно гидроксидов щелочных металлов, например гидроксида натрия или гидроксида калия. Поэтому в одном предпочтительном варианте осуществления способа по изобретению к суспендированному в воде крахмалу добавляют дополнительно подщелачивающее средство, предпочтительно NaOH. К суспендированному крахмалу добавляют это подщелачивающее средство предпочтительно в таком количестве, что молярное отношение подщелачивающего средства к крахмалу составляет более чем 0,2, предпочтительно 0,25-1, в частности 0,3-0,8. Посредством отношения этиленоксида к крахмалу во время стадии гидроксиэтилирования можно при этом по желанию регулировать молярную степень замещения, т.е. молярное отношение гидроксиэтильных групп к ангидроглюкозным единицам на протяжении желаемого MS-диапазона. Предпочтительно превращение (реакция обмена) между этиленоксидом и суспендированным крахмалом происходит в диапазоне температур 30-70, предпочтительно 35-45оС. Обычно после этой реакции обмена происходит в случае необходимости удаление остаточных количеств этиленоксида. Сразу же после этого превращения происходит во второй стадии кислотный частичный гидролиз дериватизированного крахмала. Под частичным гидролизом следует при этом понимать гидролиз связанных друг с другом альфа-гликозидной связью глюкозных элементарных звеньев крахмала. В принципе для этого кислотного гидролиза могут использоваться все известные специалисту кислоты, но предпочтительными являются минеральные кислоты, в частности хлористоводородная кислота. Гидролиз может также выполняться ферментативно, причем используются стандартные (рыночные) амилазы.
В следующем предпочтительном варианте осуществления изобретение включает в себя дополнительно стадии (iii) стерильного фильтрования и в случае необходимости (iv) ультрафильтрации. При проведении в способе по изобретению вышеописанных фильтрований кислотный частичный гидролиз исходного HES проводят до средней молекулярной массы, которая находится несколько ниже желаемой молекулярной массы молекулы-мишени. Посредством ультрафильтрации низкомолекулярные побочные продукты реакции, прежде всего этиленгликоль, могут быть удалены, причем средняя молекулярная масса на основе удаления части низкомолекулярной HES-фракции легко повышается.
Предпочтительно, происходящие из этого способа получения растворы сразу после этого разбавляют до желаемой концентрации HES, доводят хлористоводородной кислотой до желаемого осмотического давления, стерильно фильтруют и помещают в подходящие контейнеры. В случае необходимости может выполняться стерилизация предпочтительно сжатым водяным паром.
Таким образом, следующим предметом изобретения является фармацевтическая композиция, содержащая один или более гидроксиэтилкрахмалов данного изобретения. Фармацевтическая композиция по изобретению может быть приготовлена в принципе в любой мыслимой галеновой форме предоставления. В предпочтительном варианте осуществления изобретения фармацевтические композиции по изобретению могут инъецироваться или вводиться инфузией внутривенно. Таким образом, предпочтительно эти фармацевтические композиции представлены в виде водного раствора или в виде коллоидного водного раствора. Предпочтительно, эти композиции содержат гидроксиэтилкрахмалы по изобретению в концентрации до 20, более предпочтительно от 0,5 до 15, особенно предпочтительно от 2 до 12, в частности от 4 до 10, например 6%.
Данные в отношении количества приводятся, если они не приведены в ином виде, в %, которые в рамках изобретения равны г/100 мл раствора.
В следующем варианте осуществления фармацевтические композиции по изобретению содержат дополнительно хлорид натрия, предпочтительно 0,6-2%, особенно предпочтительно 0,9%. 0,9% раствор хлорида натрия в воде называют также физиологическим раствором хлорида натрия. Он обнаруживает осмотическое давление, равное осмотическому давлению сыворотки крови, и поэтому является пригодным в качестве изотонического раствора для внутривенной инъекции или инфузии. Для получения изотоничности могут быть использованы также все другие осмотически активные вещества, пока они являются не вызывающими опасений и хорошо переносимыми, такими как глюкоза, заменители глюкозы (фруктоза, сорбит, ксилит) или глицерин. В следующем предпочтительном варианте осуществления фармацевтические композиции могут дополнительно содержать адаптированные к плазме электролиты. Приготовление таких изотонических композиций известно специалисту. Примером изотонического раствора с адаптированными к плазме электролитами является так называемый раствор Tyrode. Он содержит 0,8 г NaCl, 0,02 г KCl, 0,02 г CaCl2, 0,01 г MgCl2, 0,005 г NaH2PO4, 0,1 г NaHCO3 и 0,1 г глюкозы в 100 мл дистиллированной воды. Следующим примером является так называемый раствор Рингера, который содержит 0,8% хлорид натрия, 0,02% хлорид калия, 0,02% хлорид кальция и 0,1% гидрокарбонат натрия. При этом, разумеется, анионы электролитов могут быть заменены метаболизируемыми анионами, так, например, в растворе Рингера гидрокарбонат натрия может быть заменен 0,3 или 0,6% лактата натрия. Соответствующий состав или раствор электролитов известен специалисту как «лактат Рингера». Следующими метаболизируемыми анионами, которые могут применяться по отдельности или в комбинации, являются ацетат (например, «ацетат Рингера») или малат.
В следующем варианте осуществления изобретения фармацевтические композиции могут быть также представлены в виде гипертонических растворов. Гипертоническими растворами являются растворы с осмотическим давлением, более высоким, чем осмотическое давление крови человека. Применение гипертонических фармацевтических композиций при некоторых картинах заболеваний может быть предпочтительным. Требующееся высокое осмотическое давление гипертонических растворов устанавливается добавлением соответствующих количеств осмотически активных веществ, например хлорида натрия, который для этой цели может применяться в концентрациях до 7,5% и более.
Во избежание и для уменьшения опасности инфекций фармацевтические композиции по изобретению предпочтительно стерильно фильтруют или стерилизуют нагреванием. Для целей стерилизации по изобретению водных или коллоидных водных фармацевтических композиций пригодны, в частности, мелкопористые фильтровальные картриджи, которые, например, доступны под товарным названием SARTROPE из фирмы Sartorius. Пригодными являются, например, такие фильтровальные картриджи с диаметром пор 0,2 мкм. Кроме того, фармацевтические композиции по изобретению могут стерилизоваться нагреванием без ухудшения гидроксиэтилкрахмалов. Предпочтительно, стерилизацию нагреванием проводят при температуре выше 100оС, особенно предпочтительно от 105 до 150оС, в частности от 110 до 130оС, например при 121оС на протяжении периода времени до 30 минут, предпочтительно до 25 минут, в частности от 18 до 22 минут.
В предпочтительном варианте осуществления фармацевтическая композиция является кровезаменителем. Кровезаменители находят применение при замене интравазальной (внутрисосудистой) жидкости в организмах человека и животных. Кровезаменители находят применение, в частности, при профилактике и терапии гиповолемии. При этом неважно, происходит ли гиповолемия в результате непосредственной потери крови или жидкостей тела, например при потере крови при острых кровотечениях, травмах, операциях, ожогах и т.д., или в результате нарушений распределения между макро- и микроциркуляцией, например при сепсисе, или в результате вазодилатации, например при введении в наркоз. При этом кровезаменители подразделяются на так называемые плазмозаменители и так называемые плазморасширители. В случае плазмозаменителей применяемый интравазально объем этого заменителя соответствует также объему, который подается в сосуды. В случае плазморасширителей, напротив, применяемый интравазально объем жидкости расширителя является меньшим, чем реально вводимый в сосуды объем. Этот феномен основывается на том, что посредством применения плазморасширителя нарушается онкотическое равновесие между внутри- и внесосудистым пространством и из внесосудистого пространства дополнительный объем жидкости втекает в обработанную сосудистую систему.
Плазморасширители отличаются от плазмозаменителей по существу тем, что концентрация содержащихся гидроксиэтилкрахмалов по изобретению является повышеной и/или концентрация имеющихся в каждом случае электролитов вызывает онкотическое и/или осмотическое неравновесие.
Фармацевтические композиции по изобретению могут дополнительно содержать фармацевтическое активное вещество или комбинации фармацевтических активных веществ и таким образом служить в качестве среды для введения растворенных в ней активных веществ, в частности, посредством инъекции и инфузии.
Следующим предметом изобретения является применение фармацевтической композиции по изобретению для приготовления кровезаменителя или плазмозаменителя или плазморасширителя.
Фармацевтические композиции по изобретению могут особенно предпочтительно использоваться в качестве кровезаменителя или плазмозаменителя или плазморасширителя. Предпочтительно, эти фармацевтические композиции служат для поддержания нормоволемии (нормального объема крови). Поддержание нормоволемии имеет особенное значение для гемодинамической стабильности, которая оказывает решающее влияние на организм человека и животных, например, в отношении кровяного давления, скорости диуреза или частоты сердечных сокращения. Для по возможности быстрой компенсации поддержания нормоволемии после потери внутрисосудистой жидкости фармацевтические композиции по изобретению оказались особенно полезными, так как они в сравнении с известными в существующем уровне техники плазмозаменителями, в частности низкомолекулярными HES-растворами, например HES 130/0,4, обнаруживают пролонгированный период полураспада в плазме, в частности в решающей фазе непосредственно после инфузии. Фармацевтические композиции по изобретению являются предпочтительными также потому, что неожиданным образом было обнаружено, что при применении этих композиций вязкость крови или плазмы в отличие от высокомолекулярных HES, описанных в US 5502043, не повышается и потому, что свертывание крови ингибируется меньше, чем с другими высокомолекулярными композициями. То, что вязкость плазмы неожиданным образом не повышается, способствует при этом также улучшению микроциркуляции, а также улучшенному трофическому снабжению тканей кислородом.
Следующим предметом изобретения является применение фармацевтической композиции по изобретению для поддержания нормоволемии и/или для улучшения макро- и микроциркуляции, и/или для улучшения трофического снабжения кислородом, и/или для стабилизации гемодинамики, и/или для улучшения объемной эффективности, и/или для уменьшения вязкости плазмы крови, и/или для повышения толерантности к анемии, и/или для гемодилюции, в частности для терапевтической гемодилюции при нарушениях кровоснабжения и артериальных, особенно периферических артериальных облитерирующих, заболеваниях.
Фармацевтические композиции по изобретению или гидроксиэтилкрахмалы по изобретению используют предпочтительно для получения лекарственных средств, в частности лекарственных средств для поддержания нормоволемии и/или для улучшения макро- и микроциркуляции, и/или для улучшения трофического снабжения кислородом, и/или для стабилизации гемодинамики, и/или для улучшения объемной эффективности, и/или для уменьшения вязкости плазмы крови, и/или для повышения толерантности к анемии, и/или для гемодилюции, в частности для терапевтической гемодилюции при нарушениях кровоснабжения и артериальных, особенно периферических артериальных облитерирующих, заболеваниях.
Кроме того, фармацевтические композиции по изобретению или гидроксиэтилкрахмалы по изобретению используют предпочтительно в способах для лечения с целью поддержания нормоволемии и/или для улучшения макро- и микроциркуляции, и/или для улучшения трофического снабжения кислородом, и/или для стабилизации гемодинамики, и/или для улучшения объемной эффективности, и/или для уменьшения вязкости плазмы крови, и/или для повышения толерантности к анемии, и/или для гемодилюции, в частности для терапевтической гемодилюции при нарушениях кровоснабжения и артериальных, особенно периферических артериальных облитерирующих, заболеваниях.
Следующим предметом изобретения является набор, включающий в себя по отдельности
(i) гидроксиэтилкрахмал по изобретению,
(ii) стерильный солевой раствор, предпочтительно раствор хлорида натрия, и в случае необходимости
(iii) фармацевтическое активное вещество или комбинацию активных веществ.
В предпочтительном варианте осуществления этот набор по изобретению содержит отдельные компоненты (i), (ii) и в случае необходимости (iii) в отдельных камерах в многокамерном пакете, причем все компоненты могут быть представлены по отдельности, но также определенные компоненты, например (i) и (ii), могут находиться вместе в одной камере.
Изобретение будет объяснено более подробно при помощи приведенных ниже примеров.
Примеры получения исходных веществ для HES
Пример 1: Получение исходных веществ для HES с идентичными MS и С2/С6-отношением, но с отличающимися молекулярными массами
Описанные в экспериментальной части разновидности HES для исследований in vivo получали из единственной реакционной смеси посредством фракционированного гидролиза. Для этой цели выполняли следующее. 30 кг жидкокипящего крахмала восковидной кукурузы суспендировали в 52,2 кг WFI (воды для инъекционных целей) при комнатной температуре при сильном перемешивании. Для оптимального гидролиза крахмала эту суспензию сразу после этого клейстеризовали нагреванием до по меньшей мере 85оС. После многократных созданий атмосферы инертного газа в суспензии азотом посредством 10-минутного пропускания азота и последующей откачки воздуха вакуумированием крахмал активировали добавлением 5,1 кг NaOH. После этого в реактор вводили 4,159 кг охлажденного этиленоксида в жидкой форме и температуру медленно повышали до 40оС и оставляли эту реакционную смесь на 2 часа при продолжающемся перемешивании при этой температуре. Непревращенный этиленоксид обрабатывали инертным газом, как описано выше, и удаляли из реакционной смеси. Затем из этого исходного крахмала получали при помощи ступенчатого кислотного гидролиза 3 HES-препарата с идентичными MS и С2/С6-отношением, но с отличающейся Mw. Для уменьшения молекулярной массы этот раствор доводили 20%-ной HCl до рН 2,0, нагревали до 75 ± 1оС и оставляли при этой температуре, пока средняя молекулярная масса Mw HES-коллоида, определенная при помощи GPC-MALLS, не снижалась до 865 кД. Треть этой смеси для гидролиза вынимали из реактора и тотчас же охлаждали до температур ниже 50оС. После обесцвечивания раствора обработкой активированным углем раствор фильтровали с использованием предварительного фильтра и стерильного фильтра и после разбавления до 12% очищали ультрафильтрацией (UF). Для этого использовали полиэфирсульфоновые мембраны фирмы Millipore с пределом молекулярной массы 10 кД. В ходе ультрафильтрации Mw несколько повышается на основе частичной элиминации низкомолекулярной фракции HES. Это повышение зависит от исходной Mw коллоидного препарата, но прежде всего от декларируемого предела отсечения молекулярной массы используемой UF-мембраны и используемого заряда UF-мембраны. Для получения желаемой молекулярной массы после ультрафильтрации должно быть сначала экспериментально получено смещение Mw во время ультрафильтрации с имеющимся зарядом UF-мембраны. Следует обратить внимание также на то, что с момента взятия пробы для определения Mw во время кислотного гидролиза до получения установленного показателя Mw гидролиз продолжается. Поэтому понижение Mw следует систематически определять на протяжении всей продолжительности гидролиза и оценивать экстраполяцией Mw на протяжении этого времени момент, при котором достигается целевая Mw. Затем гидролиз прерывают к этому экстраполированному моменту. Оставшуюся после извлечения первой трети смесь для гидролиза продолжали обрабатывать далее, пока средняя молекулярная масса Mw не снизилась до 460 кД. После этого вторую треть обрабатывали таким же образом, как и первую треть. Оставшуюся треть параллельно с этим гидролизовали далее до Mw 95 кД и подвергали тому же самому способу обработки, какой использовали для двух других частичных смесей. Из частичной смеси 1 был получен HES 900/0,42 (С2/С6-отношение = 4,83), из частичной смеси 2 был получен HES 500/0,42 (С2/С6-отношение = 4,83) и из частичной смеси 3 был получен HES 130/0,42 (С2/С6-отношение = 4,83).
После завершения ультрафильтрации концентрацию коллоида доводили до 6% и рН доводили до 5,5, этот раствор делали изотоническим добавлением NaCl, помещали в стеклянные склянки на 500 мл и стерилизовали 20 минут при 121оС.
Пример 2: Получение следующих исходных веществ HES
Для получения коллоидов HES с другими молярными степенями замещения и С2/С6-отношениями проводили серию дополнительных экспериментов в сходном размере реакционных смесей, причем количество этиленоксида соответствующим образом варьировали. Кроме того, кислотный гидролиз останавливали при достижении различных Mw (целевых Mw). Эти эксперименты представлены в суммированном виде в следующей таблице 1:
| Таблица 1 |
 |
Пример 1 |
Пример 2 |
Пример 3 |
Пример 4 |
Пример 5 |
| Условия реакции |
 |
 |
 |
 |
 |
| Крахмал (кг) |
30,0 |
30,0 |
30,0 |
30,0 |
30,0 |
| WFI (кг) |
52,0 |
52,0 |
52,0 |
52,0 |
52,0 |
| NaOH 50% (кг) |
9,5 |
4,7 |
4,7 |
9,5 |
4,7 |
| Этиленоксид (кг) |
4,0 |
3,6 |
4,4 |
4,5 |
3,8 |
| Целевая Mw (после кислотного гидролиза (кДа) |
1500 |
990 |
885 |
770 |
665 |
| Характеристика HES |
 |
 |
 |
 |
 |
| MS (моль/моль) |
0,39 |
0,40 |
0,45 |
0,46 |
0,42 |
| Mw после UF (кДа) |
1520 |
1050 |
915 |
795 |
710 |
| С2/С6-отношение |
2,3 |
6,0 |
5,9 |
2,2 |
6,1 |
Пример 3: Влияние молярного отношения NaOH к крахмалу во время гидроксиэтилирования на С2/С6-отношение
Чтобы показать регулируемость С2/С6-отношений посредством молярного отношения NaOH к ангидроглюкозным единицам крахмала, смешивали 30 кг жидкокипящего крахмала восковидной кукурузы с различными количествами NaOH и превращали этиленоксидом при 40оС. В таблице 2 приведены используемые количества реагентов и С2/С6-отношения, а также MS полученных посредством этой реакции HES-продуктов. Как можно видеть, С2/С6-отношение понижается с повышением отношения NaOH относительно крахмала. Это приводит к тому, что катализируемое щелочью гидроксиэтилирование крахмала при низкой концентрации NaOH происходит преимущественно в положении 2 ангидроглюкозных единиц, которые являются самыми реакционноспособными. Посредством более высоких концентраций NaOH С6-гидроксигруппы, сами по себе менее реакционноспособные, также достаточно сильно активируются, чтобы эффективно гидроксиэтилироваться.
| Таблица 2 |
| Регуляция С2/С6-отношения во время гидроксиэтилирования |
| Опыт |
WFI [кг] |
Крахмал [кг] |
NaOH (50 масс.%) [кг] |
Молярное отношение NaOH к крахмалу |
Этиленоксид [кг] |
MS |
C2/C6 |
| #1 |
50 |
30 |
1,5 |
0,1 |
4,0 |
0,4 |
12 |
| #2 |
50 |
30 |
4,5 |
0,3 |
3,8 |
0,4 |
7 |
| #3 |
50 |
30 |
11,1 |
0,75 |
4,4 |
0,4 |
3 |
Примеры получения готовых продуктов HES
В следующей таблице 3 приведены рецептуры для получения различных растворов HES. HES использовали в виде концентрата HES после ультрафильтрации. Количество концентрата HES, которое необходимо для приготовления 6%-ного или 10%-ного раствора HES, определяли при этом с использованием тройного правила. Другая возможность состоит в применении высушенного распылением HES, что не представляет никакой трудности для специалиста, который имеет башню распылительной сушилки. Используемый HES имел молекулярную массу 900 кД и MS 0,42.
В резервуар на 200 л отвешивали в каждом случае необходимое количество концентрата HES и указанные в таблице количества солей и раствора NaOH и эти соли растворяли при перемешивании. После доведения рН растворов 1, 4, 5, 7 и 8 до 5,5 и растворов 2, 3, 6 до 6,0 добавляли столько воды для инъекций (WFI), что достигались теоретические концентрации Na в соответствии со спецификацией.
Как легко видно для специалиста, изменением навесок приведенных активных компонентов или добавок, а также исключением или добавлением дополнительных веществ рецептуры могут варьироваться в широких границах и при применении других разновидностей HES также с этими соответствующими растворами.
| Таблица 3 |
 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| Рецептуры получения |
| HES [г/л] |
60 |
60 |
60 |
60 |
100 |
100 |
100 |
100 |
| NaCl [г/л] |
9,00 |
6,369 |
17,37 |
100,0 |
9,00 |
6,369 |
30,00 |
60,00 |
| KCl [г/л] |
0 |
0,373 |
0,373 |
0 |
0 |
0,373 |
0 |
0 |
| MgCl2 [г/л] |
0 |
0,203 |
0,203 |
0 |
0 |
0,203 |
0 |
0 |
| CaCl2 [г/л] |
0 |
0,294 |
0,294 |
0 |
0 |
0,294 |
0 |
0 |
| Na-ацетат [г/л] |
0 |
5,032 |
5,032 |
0 |
0 |
5,032 |
0 |
0 |
| Результаты анализа растворов |
| HES [%] |
6,0 |
6,1 |
6,0 |
5,9 |
10,0 |
10,1 |
9,9 |
10,0 |
| Na [мM] |
153,9 |
146,1 |
334,3 |
1711 |
153,7 |
146,0 |
512,5 |
1026 |
| K [мM] |
0 |
5,1 |
5,0 |
0 |
0 |
5,0 |
0 |
0 |
| Mg [мM] |
0 |
1,0 |
0,9 |
0 |
0 |
1,0 |
0 |
0 |
| Ca [мM] |
0 |
2,1 |
2,0 |
0 |
0 |
2,0 |
0 |
0 |
| Cl [мM] |
154,8 |
120,2 |
308,5 |
1712 |
154,8 |
120,1 |
513,7 |
1028 |
| Ацетат [мM] |
0 |
37,0 |
37,0 |
0 |
0 |
37,0 |
0 |
0 |
| pH |
5,5 |
6,0 |
5,9 |
5,3 |
5,4 |
6,1 |
5,4 |
5,5 |
Способы измерения примеров применения
Далее описаны способы измерения, при помощи которых исследовали пробы крови и плазмы.
Измерения нативной крови
Смешанные с цитратом пробы крови обрабатывали в лаборатории следующим образом.
Пробу использовали немедленно для измерения вязкости крови (Rheostress® 1, Thermo-Haake, Karlsruhe, Deutschland) при линейно увеличивающихся скоростях срезания 1-240 в секунду. Исследовали вязкость при скоростях срезания 1/с и 128/с. Перед Thromboelastograph®-анализом (TEG®, Haemoscope Corporation, Niles, Illinois) пробы крови инкубировали в течение одного часа на теплой водяной бане 37оС. Рекальцификацию крови и TEG®-измерения проводили в соответствии с рекомендациями изготовителя. Определяли индекс коагуляции (CI), который суммирует несколько парциальных функций тромбоэластографии.
Измерения на плазме
Пробы крови центрифугировали в течение 15 минут при 4оС и 3000 об/мин (Rota-na/RP, Hettich, Bach, Schweiz). Вязкость плазмы измеряли в соответствии со способом, уже описанным для определения в крови.
Протромбиновое время (РТ) и активированное парциальное тромбопластиновое время (aPTT) определяли с использованием автоматического анализатора коагуляции (BCS, Dade Behring, Marburg, Deutschland) при помощи РТ-реагента, содержащего рекомбинантный фактор крови (Innovin®, Dade Behring), и aPTT-реагента, содержащего эллаговую кислоту (Actin FS®, Dade Behring). РТ-показатели переводили в INR-показатели на основе ISI-показателей, которые поставлялись изготовителем. Функциональную активность фактора фон Виллебранда (vWF) определяли при помощи коммерческих тестов с кофактором ристоцетина. (vWF RCA, Dade Behring) в автоматическом анализаторе коагуляции (BCS, Dade Behring). Активность vWF получали с использованием способности тромбоцитов человека агглютинировать в присутствии ристоцетина. Агглютинацию определяли при помощи измерений мутности с использованием анализатора коагуляции. Антиген vWF обнаруживали при помощи коммерческого набора ELISA (Asserachrom vWF antigenic, Roche Diagnostics, Rotkreuz, Schweiz) в соответствии с инструкцией изготовителя.
Концентрацию HES количественно определяли после экстракции из плазмы крови и гидролиза до структурных единиц мономеров глюкозы (H. Forster et al., Infusionstherapie 1981; 2: 88-94). Пробы плазмы (1 мл) инкубировали при 100оС в течение 60 минут, после чего к ним добавляли 0,5 мл 35% раствора КОН (масса/масса) (Fluka, Buchs, Schweiz). HES осаждали добавлением 10 мл ледяного абсолютного этанола (Fluka, Buchs, Schweiz) к супернатанту реакционной смеси и затем гидролизовали кислотным гидролизом в 2 н. HCl (Fluka, Buchs, Schweiz) в течение 60 минут при 100оС. Определение глюкозы выполняли с использованием набора для ферментативного теста на основе гексокиназы/глюкозо-6-фосфатазы (Boehringer Mannheim, Darmstadt, Deutschland).
Расчет фармакокинетических параметров с использованием модели двух компартментов с константной скоростью инфузии при применении фактических доз и продолжительностей инфузии (WinNonlin, Version 4.1, Pharsight Corp, Mountainview, CA).
Статистический анализ
Показатели приведены в виде средней величины ± стандартное отклонение. Оба раствора HES с высокой молекулярной массой (500 и 900 кД) сравнивали с низкомолекулярным раствором (130 кД) при помощи JMP 5.1 Statustikpakets (SAS Institute, Inc, Cary, NC). Взаимодействие эффектов растворов и временных эффектов испытывали с использованием двухстороннего анализа ANOVA и с учетом коррекции согласно Bonferroni. Для статистического анализа фармакокинетических параметров применяли t-критерий для непарных данных по Стьюденту. р<0,05 оценивали как статистически значимый.
Примеры применения
Для вышеописанных экспериментов in vivo применяли гидроксиэтилкрахмалы по изобретению со средними молекулярными массами (Mw) 500000 и 900000 дальтон и идентичным молярным замещением (MS=0,42) и идентичным С2/С6-отношением (4,83) (далее в примерах применения обозначаемых как HES 500/0,42 или HES 900/0,42) (см. пример получения исходных веществ для HES). Оба гидроксиэтилкрахмала (HES 900/0,42 и HES 500/0,42) растворяли в 0,9%-ном растворе хлорида натрия в концентрации 6% при применении фильтровальных картриджей 0,2 мкм (Sartpore; Sartorius), стерильно фильтровали, помещали в стеклянные склянки и стерилизовали нагреванием при 121оС в течение 15 минут. В качестве сравнительного раствора служил низкомолекулярный крахмал (Mw=130000 дальтон) с идентичными MS и С2/С6-отношением (далее в примерах применения обозначаемый как HES 130/0,42), который был также в 6% концентрации в 0,9% растворе хлорида натрия. Как описано, его получали из реакционной смеси, сходной с рекционной смесью для высокомолекулярных гидроксиэтилкрахмалов по изобретению, от которой эта смесь отличалась только молекулярной массой.
ИССЛЕДОВАНИЕ ЭЛИМИНАЦИИ ИЗ ПЛАЗМЫ И ВЛИЯНИЯ НА СВЕРТЫВАНИЕ КРОВИ
30 свиней рандомизировали в 3 группах по 10 животных на каждую группу. Одна группа получала внутривенную инфузию HES 900/0,42, другая – инфузию HES 500/0,42 и третья – инфузию HES 130/0,42 в качестве сравнения. Во всех случаях доза составляла 20 мл/кг массы тела (KG) в каждом случае 6% растворов HES и инфузия длилась 30 минут. Для инфузии и последующих взятий крови животных анестезировали и использовали управляемую искусственную вентиляцию легких. Забор крови выполняли перед началом инфузии после 5, 20, 40, 60, 120 и 240 минут, а также спустя 24 часа после завершения инфузии. В пробах крови или полученных из них пробах плазмы определяли: вязкость крови и вязкость плазмы, концентрацию HES, протромбиновое время, частичное тромбопластиновое время, фактор фон Виллебранда, фактор VIII и кофактор ристоцетина, а также обычные тромэластографические признаки. Из хода концентраций HES от завершения инфузии до 24 часов после нее рассчитывали площади под кривой зависимости концентрации от времени (= AUC, от Area Under the Curve),  – и – и  -период полураспада, а также клиренс. Расчет AUC выполняли согласно log-линейной формуле трапеций, а для расчета прочих фармакокинетических параметров за основу брали модель двух компартментов. Из нее получали 2 периода полураспада -период полураспада, а также клиренс. Расчет AUC выполняли согласно log-линейной формуле трапеций, а для расчета прочих фармакокинетических параметров за основу брали модель двух компартментов. Из нее получали 2 периода полураспада  и и  , причем , причем  -период полураспада отличается переходом HES из центрального компартмента (соответствует в широком смысле внутрисосудистому пространству) в периферический компартмент, а -период полураспада отличается переходом HES из центрального компартмента (соответствует в широком смысле внутрисосудистому пространству) в периферический компартмент, а  -период полураспада отличается перераспределением в обратном направлении. -период полураспада отличается перераспределением в обратном направлении.
Ход концентрации HES и фармакокинетические параметры позволяют установить более длительную продолжительность пребывания высокомолекулярных вариантов (HES 900/0,42 и HES 500/0,42) в сравнении с низкомолекулярным HES (HES 130/0,42). Так, AUC и периоды  -полураспада в случае высокомолекулярных вариантов были значимо большими или более длительными, чем в случае низкомолекулярных контролей; в соответствии с этим клиренс высокомолекулярных типов HES был значимо более низким, чем клиренс низкомолекулярного HES. -полураспада в случае высокомолекулярных вариантов были значимо большими или более длительными, чем в случае низкомолекулярных контролей; в соответствии с этим клиренс высокомолекулярных типов HES был значимо более низким, чем клиренс низкомолекулярного HES.
Неожиданным образом и совершенно по-другому, чем в случае известных типов среднемолекулярных или высокомолекулярных HES (HES 200/0,5; HES 200/0,6; HES 450/0,7), не было, однако, при концентрации в плазме до момента «24 часа после инфузии» никакого релевантного различия между высокомолекулярными вариантами по изобретению и низкомолекулярным сравнительным раствором (сравните чертеж). Это означает, что высокомолекулярные гидроксиэтилкрахмалы данного изобретения в решающей для объемной эффективности фазе непосредственно после инфузии имели значимо более длительную продолжительность пребывания, чем низкомолекулярный сравнительный HES, но что они в отличие от известных высокомолекулярных типов HES не обнаруживали склонности к кумуляции в кровотоке. Вместо этого варианты HES по изобретению спустя 24 часа после инфузии, так же как низкомолекулярный сравнительный HES, практически полностью исчезали из кровотока.
| Таблица 4 |
| Раствор |
HES 130/0,42 |
HES 500/0,42 |
HES 900/0,42 |
| AUC(г*мин/л) |
1156 ± 223 |
1542 ± 142** |
1701 ± 321** |
| CL(мл/мин) |
39,1 ± 7,9 |
30,1 ± 5,4* |
26,0 ± 4,1** |
t1/2 (мин) (мин) |
39,9 ± 10,7 |
53,8 ± 8,6* |
57,1 ± 12,3* |
t1/2 (мин) (мин) |
331,8 ± 100,0 |
380,6 ± 63,3 |
379,9 ± 75,8 |
Таблица 4: Площади под кривой зависимости концентрации от времени (AUC), Клиренс (CL), альфа- и бета-период полураспада (t1/2 и t1/2 и t1/2 ) после инфузии в каждом случае 20 мл/кг 6% HES 130/0,42, 6% HES 500/0,42 или 6% HES 900/0,42 у свиньи. ) после инфузии в каждом случае 20 мл/кг 6% HES 130/0,42, 6% HES 500/0,42 или 6% HES 900/0,42 у свиньи.
Определение значимости выполняли между HES 500 и HES 900, в каждом случае в сравнении с HES 130/0,42 с использованием t-критерия для непарных данных согласно Стьюденту * р < 0,01; ** р < 0,001.
Высокомолекулярные разновидности HES (HES 500/0,42 и HES 900/0,42) показали значимо большие площади под кривой зависимости концентрации от времени (AUC) в соответствии с более высокой продолжительностью пребывания во внутрисосудистом пространстве, значимо более длительные начальные периоды полураспада в плазме (t1/2 ) и значимо более низкие скорости клиренса, чем в случае низкомолекулярного HES (HES 130/0,42). ) и значимо более низкие скорости клиренса, чем в случае низкомолекулярного HES (HES 130/0,42).
Фиг.1 показывает ход кривой концентрации низкомолекулярной HES (HES 130/0,42) и высокомолекулярных HES (HES 500/0,42 и HES 900/0,42) в плазме после инфузии 20 мл/кг каждого раствора HES у свиней. HES 500/0,42 и HES 900/0,42 сначала элиминировались медленнее из внутрисосудистого пространства, чем HES 130/0,42 (см. также таблицу 4: Фармакокинетические параметры); однако в конечной фазе элиминации, т.е. через 24 часа после окончания инфузии, уже не имелось никакого релевантного различия между концентрациями в плазме (средние концентрации были ниже 0,2 г/л и, следовательно, в области предела определения).
Таким образом, оказалось, что гидроксиэтилкрахмалы по изобретению, с одной стороны, имеют более длительный начальный период полураспада в плазме, чем известные в настоящее время низкомолекулярные растворы (HES 130/0,42), но, с другой стороны, могли элиминироваться в пределах 24 часов после инфузии так же хорошо, как и последние названные, выгодные в этом отношении низкомолекулярные сравнительные препараты.
Проведенные анализы свертывания (тесты плазматического свертывания, тромбоэластография, определение концентраций vWF) также дали неожиданные и совершенно другие результаты, чем результаты, которые могли достигаться до сих пор с высокомолекулярными препаратами HES. В то время как уже среднемолекулярные и в еще более ярко выраженной степени высокомолекулярные гидроксиэтилкрахмалы до сих пор обнаруживали гораздо более сильное ухудшение свертывания крови в смысле гипокоагулируемости, чем растворы низкомолекулярных HES (J. Treib et al., Intensive Care Med. (1999), S. 258-268; R.C. Strauss et al., Transfusion (1988), S. 257-260), между высокомолекулярными препаратами HES по изобретению и известным низкомолекулярным сравнительным раствором не оказалось значимых различий.
| Таблица 5 |
| Параметр |
Раствор |
Перед инфузией |
5 минут после инфузии |
1 час после инфузии |
2 часа после инфузии |
4 часа после инфузии |
24 часа после инфузии |
р-показатель |
| РТ (с) |
HES 130/0,42 |
8,57±0,73 |
9,15±0,66 |
9,00±0,70 |
9,06±0,67 |
8,77±0,42 |
9,30±0,64 |
– |
| HES 500/0,42 |
9,32±1,90 |
9,08±0,49 |
8,97±0,56 |
8,80±0,33 |
8,57±0,37 |
9,38±0,58 |
0,533 |
| HES 900/0,42 |
8,59±1,06 |
8,66±0,51 |
8,56±0,56 |
8,40±0,27 |
8,21±0,27 |
9,42±0,51 |
0,068 |
| аРТТ (с) |
HES 130/0,42 |
12,19±1,83 |
14,19±4,21 |
13,68±3,57 |
13,59±1,57 |
13,11±1,10 |
14,58±3,01 |
– |
| HES 500/0,42 |
11,97±1,00 |
13,37±1,12 |
12,65±0,73 |
13,04±1,31 |
13,17±1,31 |
13,72±1,40 |
0,893 |
| HES 900/0,42 |
11,94±1,31 |
12,59±1,16 |
13,10±1,62 |
12,87±1,06 |
12,78±2,02 |
13,37±1,50 |
0,706 |
| Cl |
HES 130/0,42 |
4,53±1,33 |
3,30±0,91 |
4,18±0,91 |
4,81±0,63 |
4,48±0,65 |
5,22±0,35 |
– |
| HES 500/0,42 |
5,04±0,81 |
2,88±1,28 |
4,47±0,77 |
4,71±0,65 |
4,18±0,98 |
5,14±0,79 |
0,303 |
| HES 900/0,42 |
5,35±0,79 |
3,28±1,18 |
4,47±0,93 |
4,93±0,82 |
4,68±1,03 |
5,53±0,55 |
0,468 |
| vWF функциональный (%) |
HES 130/0,42 |
33,41±10,18 |
30,09±7,68 |
32,20±8,63 |
33,59±10,94 |
40,91±10,48 |
28,80±6,84 |
– |
| HES 500/0,42 |
32,11±4,85 |
25,38±3,84 |
27,65±4,32 |
30,80±4,67 |
37,94±4,65 |
23,04±4,19 |
0,853 |
| HES 900/0,42 |
30,48±3,95 |
24,78±3,35 |
27,14±4,14 |
31,41±4,83 |
37,87±8,06 |
24,84±6,74 |
0,768 |
| vWF антигенный (%) |
HES 130/0,42 |
46,10±8,45 |
35,80±4,83 |
39,40±8,42 |
40,10±9,21 |
44,30±6,80 |
38,22±5,54 |
– |
| HES 500/0,42 |
42,80±4,13 |
37,90±7,37 |
35,50±4,22 |
37,60±7,41 |
39,80±10,65 |
38,00±8,15 |
0,499 |
| HES 900/0,42 |
48,10±19,56 |
33,30±5,48 |
35,70±5,89 |
37,80±4,26 |
42,00±4,85 |
41,67±6,08 |
0,473 |
Таблица 5 показывает временной ход плазматического параметра свертывания протромбинового времени (РТ), активированного парциального тромбопластинового времени (aPTT), функциональной активности фактора фон Виллебранда (vWF функциональный) и антигенную концентрацию фактора фон Виллебранда и временной ход индекса коагуляции (CI) тромбоэластографии после инфузии в каждом случае 20 мл/кг 6% HES 130/0,42, 6% HES 500/0,42 или 6% HES 900/0,42 у свиньи. Испытание статистической значимости (взаимодействие эффекта раствора и эффекта времени) выполняли между HES 500/0,42 и HES 900/0,42 в каждом случае в сравнении с HES 130/0,42 с использованием двустороннего ANOVA. Несмотря на более высокие молекулярные массы, более высокие концентрации, а также более длительные продолжительности пребывания в плазме (сравните фиг.1 и таблицу 4), высокомолекулярные разновидности HES (HES 500/0,42 и HES 900/0,42) влияли на свертывание крови не больше, чем низкомолекулярные HES (HES 130/0,42).
Другими словами, гидроксиэтилкрахмалы по изобретению, несмотря на достигнутые посредством повышения молекулярной массы более длительные продолжительности пребывания в плазме, не обнаруживали недостатки известных высокомолекулярных растворов HES, таких как, например, ухудшение свертывания крови.
Кроме того, неожиданным образом в исследованиях на животных оказалось, что высокомолекулярные гидроксиэтилкрахмалы по изобретению в отличие от известных высокомолекулярных гидроксиэтилкрахмалов не повышали вязкость крови и плазмы в сравнении с низкомолекулярным HES. При низких силах срезания в случае гидроксиэтилкрахмалов по изобретению обнаружили даже более низкую вязкость, чем в случае низкомолекулярного HES (сравните таблицу 6: Вязкость плазмы).
| Таблица 6 |
| Параметр |
Раствор |
Перед инфузией |
5 минут после инфузии |
20 минут после инфузии |
40 минут после инфузии |
Вязкость плазмы  = 1/с (мПас) = 1/с (мПас) |
HES
130/0,42 |
0,016383±0,008241 |
0,012721±0,005245 |
0,012620±0,004280 |
0,012875±0,003349 |
HES
500/0,42 |
0,012313±0,005196 |
0,012582±0,001873 |
0,013591±0,001912 |
0,012936±0,002555 |
HES
900/0,42 |
0,016869±0,007240 |
0,012375±0,002487 |
0,015985±0,005659 |
0,015968±0,006499 |
Вязкость плазмы  = 128/с (мПас) = 128/с (мПас) |
HES
130/0,42 |
0,001208±0,000097 |
0,001327±0,000644 |
0,001138±0,000089 |
0,001167±0,000105 |
HES
500/0,42 |
0,001246±0,000212 |
0,001110±0,000045 |
0,001125±0,000058 |
0,001106±0,000037 |
HES
900/0,42 |
0,001271±0,000078 |
0,001141±0,000064 |
0,001174±0,000065 |
0,001166±0,000075 |
| Параметр |
Раствор |
1 час после инфузии |
2 часа после инфузии |
4 часа после инфузии |
24 часа после инфузии |
р-показатель |
Вязкость плазмы  = 1/с (мПас) = 1/с (мПас) |
HES
130/0,42 |
0,014928±0,003944 |
0,018318±0,006364 |
0,015097±0,007475 |
0,024577±0,008847 |
– |
HES
500/0,42 |
0,013070±0,002860 |
0,011384±0,005949 |
0,013736±0,003974 |
0,015434±0,004320 |
0,005 |
HES
900/0,42 |
0,013678±0,002252 |
0,014217±0,003234 |
0,013557±0,003713 |
0,015556±0,004308 |
0,003 |
Вязкость плазмы  = 128/с (мПас) = 128/с (мПас) |
HES
130/0,42 |
0,001142±0,000084 |
0,001272±0,000217 |
0,001232±0,000136 |
0,001229±0,000102 |
– |
HES
500/0,42 |
0,001112±0,000048 |
0,001206±0,000114 |
0,001183±0,000112 |
0,001257±0,000068 |
0,386 |
HES
900/0,42 |
0,001146±0,000055 |
0,001304±0,000224 |
0,001228±0,000096 |
0,001247±0,000104 |
0,444 |
Таблица 6 показывает временной ход вязкости плазмы при низкой и высокой силах срезания ( =1/с и =1/с и  =128/с после инфузии в каждом случае 20 мл/кг 6% HES 130/0,42, 6% HES 500/0,42 или 6% HES 900/0,42 у свиньи. Испытание статистической значимости (взаимодействие эффекта раствора и эффекта времени) выполняли между HES 500/0,42 и HES 900/0,42 в каждом случае в сравнении с HES 130/0,42 с использованием двустороннего ANOVA и не установили никаких различий между высокомолекулярными разновидностями HES (HES 900 и HES 500) и низкомолекулярным HES (HES 130). При низких силах срезания взаимодействие эффекта раствора и эффекта времени при вязкости плазмы в случае высокомолекулярных HES (HES 500/0,42 и HES 900/0,42) оказалось более низким в сравнении с низкомолекулярным HES (HES 130/0,42). Однако это объяснялось эффектом времени, а не эффектом раствора. При высоких силах срезания не было никакого различия: в частности, вязкость плазмы в случае высокомолекулярных разновидностей HES (HES 900/0,42 и HES 500/0,42) была не выше, чем в случае низкомолекулярного HES (HES 130/0,42). =128/с после инфузии в каждом случае 20 мл/кг 6% HES 130/0,42, 6% HES 500/0,42 или 6% HES 900/0,42 у свиньи. Испытание статистической значимости (взаимодействие эффекта раствора и эффекта времени) выполняли между HES 500/0,42 и HES 900/0,42 в каждом случае в сравнении с HES 130/0,42 с использованием двустороннего ANOVA и не установили никаких различий между высокомолекулярными разновидностями HES (HES 900 и HES 500) и низкомолекулярным HES (HES 130). При низких силах срезания взаимодействие эффекта раствора и эффекта времени при вязкости плазмы в случае высокомолекулярных HES (HES 500/0,42 и HES 900/0,42) оказалось более низким в сравнении с низкомолекулярным HES (HES 130/0,42). Однако это объяснялось эффектом времени, а не эффектом раствора. При высоких силах срезания не было никакого различия: в частности, вязкость плазмы в случае высокомолекулярных разновидностей HES (HES 900/0,42 и HES 500/0,42) была не выше, чем в случае низкомолекулярного HES (HES 130/0,42).
Таким образом, вязкость плазмы не повышается растворами HES по изобретению. Тот факт, что не наблюдали никакого повышения вязкости плазмы, является неожиданным, поскольку гидроксиэтилкрахмал со сравнимой молекулярной массой 500000, как описано в US-А-5502043 (сравнительный пример 3), обнаруживал повышение вязкости плазмы. Если вязкость плазмы не повышается, то это приводит к ненарушенной капиллярной перфузии (микроциркуляции) и к улучшенному трофическому снабжению кислородом ткани.
Наряду с вышеописанными исследованиями in vivo проводили также исследования in vitro, при которых исследовали специально влияние С2/С6-отношений на свертывание крови, а именно также при помощи тромбоэластографии. Для этой цели готовили три раствора высокомолекулярного HES (Mw: 800 кД) с низкой MS (0,4) и низким (3:1), средним (7:1) или высоким (12:1) С2/С6-отношением и исследовали следующим образом. Из 30 хирургических пациентов мужчин и женщин (критерии выбора: известные нарушения свертывания, лечение ингибиторами свертывания крови, прием ацетилсалициловой кислоты или других нестероидных противовоспалительных лекарственных средств в пределах 5 дней перед операцией) во время введения в анестезию брали пробу крови. В каждой пробе крови измеряли свертывание при помощи тромбоэластографии, а именно в неразбавленной крови и после гемодилюции in vitro (20%, 40% и 60%) с каждым из 3 растворов HES (HES 800/0,4/3:1, HES 800/0,4/7:1 или HES 800/0,4/12:1). Определяли, как и при исследованиях in vivo, индекс коагуляции (CI), который суммирует отдельные парциальные функции тромбоэластографии. Средние величины (± SD (стандартное отклонение)) полученных показателей CI представлены в следующей таблице 7, а именно в виде отклонения от CI в каждом случае в неразбавленной пробе крови.
| Таблица 7 |
 |
HES 800/0,4/3:1 |
HES 800/0,4/7:1 |
HES 800/0,4/12:1 |
| 20% гемодилюция |
-2,32 |
-2,86 |
-3,35 |
 |
(1,20) |
(1,22) |
(1,07) |
| 40% гемодилюция |
-5,91 |
-6,17 |
-6,50 |
 |
(1,68) |
(2,03) |
(1,69) |
| 60% гемодилюция |
-9,71 |
-10,37 |
-10,55 |
 |
(2,70) |
(3,05) |
(2,60) |
При всех ступенях гемодилюции CI относительно CI нативной крови снижался тем меньше, действие на свертывание крови также было тем меньше, чем ниже было С2/С6-отношение используемых для гемодилюции HES. Эффект раствора между сериями гемодилюций был значимо различным (р<0,05; ANOVA). Эти результаты показали, что понижение С2/С6-отношения гидроксиэтилкрахмалов является благоприятным для их влияния на свертывание крови, а именно в том смысле, что свертывание крови при низком С2/С6-отношении менее ингибируется, чем при высоком С2/С6-отношении. Это имеет значение постольку, поскольку, когда растворы HES применяют, в частности, в качестве плазмозаменителя после травматических или обусловленных операцией кровотечений, в этой ситуации потерю крови нельзя дополнительно увеличивать ингибированием свертывания крови. Кроме того, результаты вышеописанного исследования показывают, что от С2/С6-отношения растворов HES исходит собственное действие на свертывание крови, которое не зависит от других молекулярных параметров HES и их поведения в кровотоке. Это не было до сих пор известным.
Формула изобретения
1. Гидроксиэтилкрахмал со средней молекулярной массой Mw, большей или равной 500000, отличающийся тем, что молярная степень замещения MS составляет от 0,25 до 0,5 и С2/С6-отношение составляет от 2 до менее 8.
2. Гидроксиэтилкрахмал по п.1, отличающийся тем, что молярная степень замещения MS равна 0,35-0,5, предпочтительно 0,39- 0,45, в частности является большей, чем 0,4-0,44. 0,45, в частности является большей, чем 0,4-0,44.
3. Гидроксиэтилкрахмал по п.1, отличающийся тем, что средняя молекулярная масса составляет от более 600000 до 1500000, предпочтительно 620000-1200000, особенно предпочтительно 700000-1000000.
4. Гидроксиэтилкрахмал по п.1, отличающийся тем, что С2/С6-отношение равно 2-7, предпочтительно 2,5- 7, особенно предпочтительно 2,5-6 и, в частности предпочтительно 4-6. 7, особенно предпочтительно 2,5-6 и, в частности предпочтительно 4-6.
5. Гидроксиэтилкрахмал по п.1, отличающийся тем, что он может быть получен из крахмала восковидной кукурузы.
6. Фармацевтическая композиция, включающая в себя гидроксиэтилкрахмал по одному из пп.1-5.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что она представлена в виде водного раствора или в виде коллоидного водного раствора.
8. Фармацевтическая композиция по п.6, отличающаяся тем, что гидроксиэтилкрахмал представлен в концентрации до 20%.
9. Фармацевтическая композиция по п.6, отличающаяся тем, что гидроксиэтилкрахмал представлен в концентрации 0,5-15%.
10. Фармацевтическая композиция по п.6, отличающаяся тем, что гидроксиэтилкрахмал представлен в концентрации 2-12%.
11. Фармацевтическая композиция по п.6, отличающаяся тем, что гидроксиэтилкрахмал представлен в концентрации 4-10%.
12. Фармацевтическая композиция по п.6, отличающаяся тем, что гидроксиэтилкрахмал представлен в концентрации 6%.
13. Фармацевтическая композиция по п.6, отличающаяся тем, что она дополнительно содержит хлорид натрия.
14. Фармацевтическая композиция по п.13, отличающаяся тем, что она дополнительно содержит хлорид натрия в концентрации 0,9%.
15. Фармацевтическая композиция по п.6, отличающаяся тем, что она дополнительно содержит адаптированный к плазме электролит.
16. Фармацевтическая композиция по п.6, отличающаяся тем, что она представлена в виде забуференного раствора и/или в виде раствора с метаболизируемыми анионами.
17. Фармацевтическая композиция по п.6, отличающаяся тем, что она представлена в виде гипертонического раствора.
18. Фармацевтическая композиция по п.6, отличающаяся тем, что она является стерильно-отфильтрованной или стерилизованной нагреванием.
19. Фармацевтическая композиция по п.6, отличающаяся тем, что она является кровезаменителем.
20. Применение фармацевтической композиции по одному из пп.6-19 для получения плазмозаменителя или плазморасширителя.
21. Способ получения гидроксиэтилкрахмала по одному из пп.1-5, предусматривающий
(i) превращение суспендированного в воде крахмала, предпочтительно кукурузного крахмала, этиленоксидом и
(ii) последующий частичный гидролиз полученного производного крахмала кислотой, предпочтительно хлористоводородной кислотой до желаемого диапазона молекулярных масс гидроксиэтилкрахмала, где С2/С6-отношение составляет от 2 до менее 8.
22. Способ по п.21, отличающийся тем, что к суспендированному в воде крахмалу добавляют подщелачивающее средство, предпочтительно NaOH.
23. Способ по п.21, отличающийся тем, что к суспендированному крахмалу добавляют подщелачивающее средство в таком количестве, что молярное отношение подщелачивающего средства к крахмалу равно более 0,2, предпочтительно 0,25-1, в частности 0,3-0,8.
24. Способ по п.21, отличающийся тем, что этот способ включает в себя дополнительно стадии (iii) стерилизации и, в случае необходимости, (iv) ультрафильтрации.
25. Применение фармацевтической композиции по одному из пп.6-19 для поддержания нормоволемии и/или для улучшения макро- и микроциркуляции, и/или для улучшения трофического снабжения кислородом, и/или для стабилизации гемодинамики, и/или для улучшения объемной эффективности, и/или для уменьшения вязкости плазмы, и/или для повышения толерантности к анемии, и/или для гемодилюции, в частности для терапевтической гемодилюции при нарушениях кровоснабжения и артериальных, особенно периферических артериальных облитерирующих заболеваниях.
26. Набор, включающий в себя по отдельности
(i) гидроксиэтилкрахмал по пп.1-5,
(ii) стерильный солевой раствор, предпочтительно раствор хлорида натрия, и в случае необходимости
(iii) фармацевтическое активное вещество или комбинацию активных веществ.
27. Набор по п.26, отличающийся тем, что отдельные компоненты (i), (ii) и в случае необходимости (iii) находятся в отдельных камерах в многокамерном пакете.
РИСУНКИ
|
|