|
|
(21), (22) Заявка: 2007139027/04, 23.10.2007
(24) Дата начала отсчета срока действия патента:
23.10.2007
(43) Дата публикации заявки: 27.04.2009
(46) Опубликовано: 20.11.2009
(56) Список документов, цитированных в отчете о
поиске:
RU 2296756 C2, 10.04.2007. RU 2296756 C2, 10.04.2007. RU 2296756 C2, 10.04.2007. US 6166251 A, 26.12.2000. RU 2186027 C1, 27.07.2002. RU 2186029 C1, 27.07.2002. RU 2237749 C2, 27.07.2002.
Адрес для переписки:
125424, Москва, Волоколамское ш., 75, к.1, ФГУП “ГосНИИ БП”
|
(72) Автор(ы):
Романов Дмитрий Владимирович (RU),
Лямин Алексей Иванович (RU),
Ивановская Нина Павловна (RU),
Жедулов Александр Евгеньевич (RU),
Осин Николай Сергеевич (RU),
Васильев Николай Валентинович (RU)
(73) Патентообладатель(и):
Федеральное государственное унитарное предприятие “Государственный научно-исследовательский институт биологического приборостроения” (ФГУП “ГосНИИ БП”) (RU)
|
(54) КОМПЛЕКСООБРАЗУЮЩИЕ БЕНЗОСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ  -ДИКАРБОНИЛЬНЫЙ ЗАМЕСТИТЕЛЬ С ФТОРИРОВАННЫМИ РАДИКАЛАМИ -ДИКАРБОНИЛЬНЫЙ ЗАМЕСТИТЕЛЬ С ФТОРИРОВАННЫМИ РАДИКАЛАМИ
(57) Реферат:
Изобретение относится к области синтеза новых аналитических реагентов комплексообразующего типа, пригодных для допирования наночастиц и использования в области люминесцентно-спектрального анализа, технологии биочипов, а также в качестве экстрагентов ионов тяжелых и редкоземельных металлов. Описываются комплексообразующие бензосодержащие гетероциклические соединения, содержащие  -дикарбонильный заместитель с фторированными радикалами формулы: HetAr-С(O)СН2С(O)CF3, где HetAr= -дикарбонильный заместитель с фторированными радикалами формулы: HetAr-С(O)СН2С(O)CF3, где HetAr=
образующие люминесцирующие комплексы с ионами Eu3+. Предложенные соединения по длительности люминесценции и эффективности связывания находятся на уровне ближайших по структуре соединений, однако при этом являются легкодоступными в отношении технологии получения и обладают повышенной растворимостью в воде, составляющей >10-4 моль/л, в связи с чем могут быть использованы для создания принципиально новых схем биочипов с временной, пространственной и спектральной селекцией сигнала. 5 ил., 1 табл.
Изобретение относится к области синтеза новых аналитических реагентов комплексообразующего типа и может быть использовано в области люминесцентного анализа, в частности для клинической диагностики объектов биогенного происхождения, а также в областях науки и техники, связанных с процессами комплексообразования ионов тяжелых металлов и применения наноразмерных аналитических реагентов.
Известен способ флуоресцентно-спектроскопического определения биологически активных веществ, при осуществлении которого используются маркеры на основе комплексов лантаноидов, связанных с определяемыми веществами посредством полиаминополикарбоновых кислот типа диэтилентриаминопентауксусной кислоты (ДТПА), обладающих высокими константами связывания с ионом лантаноидов (>1018 л/моль) (США, патент  4808541, НКИ 436/501). Недостатком этих соединений является то, что они не обладают люминесцентными свойствами. 4808541, НКИ 436/501). Недостатком этих соединений является то, что они не обладают люминесцентными свойствами.
Для детектирования связанных ионов лантаноидов в этом способе приходится перекомплексовывать их в другой хелат с люминесцирующим  -дикетоном (например, нафтоилтрифторацетоном (НТА). Метод, известный под названием DELFIA, осуществляется в среде так называемого усиливающего раствора (УР), состоящего из буфера рН -дикетоном (например, нафтоилтрифторацетоном (НТА). Метод, известный под названием DELFIA, осуществляется в среде так называемого усиливающего раствора (УР), состоящего из буфера рН 3,5, синергического агента триоктилфосфиноксида (ТОФО) и мицеллобразователя Тритона Х-100. Недостатком НТА является то, что он обладает константой связывания с ионом европия (Eu3+) порядка 107 л/моль и не может быть использован для прямого мечения биологических структур. Для надежного выявления малых концентраций аналита (10-13 – 10-8 моль/л по Eu3+) НТА в УР используется в большом избытке (1,5.10-5 моль/л). Недостатком этого комплексообразователя является также и то, что максимум возбуждения люминесценции комплекса НТА – Eu3+ находится при ~340 нм, что требует применения дорогостоящих источников возбуждения типа лазера или импульсных газонаполненных ламп, а также кварцевой оптики в канале возбуждения. 3,5, синергического агента триоктилфосфиноксида (ТОФО) и мицеллобразователя Тритона Х-100. Недостатком НТА является то, что он обладает константой связывания с ионом европия (Eu3+) порядка 107 л/моль и не может быть использован для прямого мечения биологических структур. Для надежного выявления малых концентраций аналита (10-13 – 10-8 моль/л по Eu3+) НТА в УР используется в большом избытке (1,5.10-5 моль/л). Недостатком этого комплексообразователя является также и то, что максимум возбуждения люминесценции комплекса НТА – Eu3+ находится при ~340 нм, что требует применения дорогостоящих источников возбуждения типа лазера или импульсных газонаполненных ламп, а также кварцевой оптики в канале возбуждения.
Известны бифункциональные соединения на основе 2,6-дизамещенных пиридинов, образующие комплексы с ионами лантаноидов, и их использование в качестве ковалентных маркеров в анализах биоспецифических взаимодействий (США, патент  6127529, НКИ 534/10). Эти комплексы обладают большей стабильностью по сравнению с комплексами на основе полиаминополикарбоновых кислот и могут быть использованы при повышенных температурах, в электрофоретических условиях, в присутствии дополнительных комплексообразователей и т.п. Они обладают люминесцентными свойствами и могут быть применены для анализа in situ (например, при гомогенном иммуноанализе). Вместе с тем из-за низкой квантовой эффективности этих маркеров чувствительность определения невысока (~10-4 моль/л аналита в реакционной среде). В основном эти соединения применяются для прямого мечения биологических объектов ионом европия с последующим перекомплексованием их в УР (см., например, Clin.Chem., v.46, 2000, р.р.658-666). Максимум возбуждения их комплексов с Eu3+ также не превышает 330 нм. 6127529, НКИ 534/10). Эти комплексы обладают большей стабильностью по сравнению с комплексами на основе полиаминополикарбоновых кислот и могут быть использованы при повышенных температурах, в электрофоретических условиях, в присутствии дополнительных комплексообразователей и т.п. Они обладают люминесцентными свойствами и могут быть применены для анализа in situ (например, при гомогенном иммуноанализе). Вместе с тем из-за низкой квантовой эффективности этих маркеров чувствительность определения невысока (~10-4 моль/л аналита в реакционной среде). В основном эти соединения применяются для прямого мечения биологических объектов ионом европия с последующим перекомплексованием их в УР (см., например, Clin.Chem., v.46, 2000, р.р.658-666). Максимум возбуждения их комплексов с Eu3+ также не превышает 330 нм.
Известны флуоресцентные комплексы ионов лантаноидов на основе производных терпиридинов, обладающих высокими константами связывания (США, патент  5457186, НКИ 534/15). В отличие от комплексов на основе пиридиновых производных они обладают несколько улучшенными значениями квантовой эффективности, но таким же коротковолновым возбуждением ( 5457186, НКИ 534/15). В отличие от комплексов на основе пиридиновых производных они обладают несколько улучшенными значениями квантовой эффективности, но таким же коротковолновым возбуждением ( 340 нм). Кроме того, стоимость этих реагентов достаточно высока, так как для достижения наибольшего эффекта используются дейтерированные производные. 340 нм). Кроме того, стоимость этих реагентов достаточно высока, так как для достижения наибольшего эффекта используются дейтерированные производные.
Известны реагенты для мечения на основе комплексов ионов лантаноидов с бис- -дикарбонильными структурами, содержащими также хромофорную (ароматическую) и электроноакцепторную (фторзамещенные алкильные группы) части (США, патент -дикарбонильными структурами, содержащими также хромофорную (ароматическую) и электроноакцепторную (фторзамещенные алкильные группы) части (США, патент  6166251, НКИ 562/828). Эти комплексы обладают достаточной интенсивностью флуоресценции, более чем в 10 раз превышающую интенсивность флуоресценции реагентов известных систем (LKB). Недостатком указанных соединений является то, что максимум длины волны возбуждения комплексов также не превышает 340 нм. 6166251, НКИ 562/828). Эти комплексы обладают достаточной интенсивностью флуоресценции, более чем в 10 раз превышающую интенсивность флуоресценции реагентов известных систем (LKB). Недостатком указанных соединений является то, что максимум длины волны возбуждения комплексов также не превышает 340 нм.
Близкими к заявляемым соединениям по технической сущности являются дибензосодержащие пятичленные циклические соединения, содержащие два симметричных  -дикарбонильных заместителя с фторированными радикалами (RU, патент -дикарбонильных заместителя с фторированными радикалами (RU, патент  2296756, МКИ C07D 307/91). Так, некоторые из заявляемых соединений образуют стабильные (константы связывания 2296756, МКИ C07D 307/91). Так, некоторые из заявляемых соединений образуют стабильные (константы связывания  1011 л/моль) длительно люминесцирующие (времена жизни люминесценции 1011 л/моль) длительно люминесцирующие (времена жизни люминесценции  порядка 600÷900 мкс) комплексы с ионами Eu3+ и имеют максимумы возбуждения в области порядка 600÷900 мкс) комплексы с ионами Eu3+ и имеют максимумы возбуждения в области  360 нм. Однако вещества этого типа недостаточно хорошо растворимы в воде (<10-4 моль/л), могут участвовать в неспецифических (гидрофобных) взаимодействиях с материалами твердой фазы и, как следствие, снижать чувствительность иммуноанализа при мечении ими биологических макромолекул. Таким образом, эти соединения не могут использоваться в ряде задач иммуноанализа, в том числе для создания допированных наночастиц, получаемых водоэмульсионной полимеризацией. Кроме того, эти соединения достаточно сложны при очистке и выделении, обладают остаточной “фоновой” люминесценцией и не позволяют выявлять ионы европия в концентрациях ниже 10-13 М. 360 нм. Однако вещества этого типа недостаточно хорошо растворимы в воде (<10-4 моль/л), могут участвовать в неспецифических (гидрофобных) взаимодействиях с материалами твердой фазы и, как следствие, снижать чувствительность иммуноанализа при мечении ими биологических макромолекул. Таким образом, эти соединения не могут использоваться в ряде задач иммуноанализа, в том числе для создания допированных наночастиц, получаемых водоэмульсионной полимеризацией. Кроме того, эти соединения достаточно сложны при очистке и выделении, обладают остаточной “фоновой” люминесценцией и не позволяют выявлять ионы европия в концентрациях ниже 10-13 М.
Задачей является создание соединений, растворимых в воде и органических растворителях и характеризующихся оптимальным набором люминесцентно-спектральных свойств при комплексообразовании, в частности, с ионами Eu3+ (времена жизни люминесценции  порядка 300÷600 мкс при возбуждении в области порядка 300÷600 мкс при возбуждении в области  340-360 нм), синтез которых может быть легко осуществлен и легко воспроизводиться и при этом не требуется высокой квалификации исполнителей, а их очистка может быть осуществлена с минимальными затратами. 340-360 нм), синтез которых может быть легко осуществлен и легко воспроизводиться и при этом не требуется высокой квалификации исполнителей, а их очистка может быть осуществлена с минимальными затратами.
Техническим результатом, достигаемым при использовании заявляемых соединений, являются их оптимальные люминесцентно-спектральные характеристики при образовании комплексов с ионами тяжелых металлов и растворимость в воде в концентрациях >10-4 моль/л, что позволяет проводить чувствительное обнаружение как самих ионов, так и других аналитов, допированных наночастицами.
Технический результат достигается предлагаемыми соединениями, представляющими собой комплексообразующие бензосодержащие гетероциклические соединения, образующие люминесцирующие комплексы с ионами Eu3+ содержащие  -дикарбонильный заместитель с фторированными радикалами, общей формулы: HetAr-С(O)СН2С(O)CF3, -дикарбонильный заместитель с фторированными радикалами, общей формулы: HetAr-С(O)СН2С(O)CF3,
где HetAr=
    
Авторам не известны растворимые в воде и органических растворителях комплексообразующие бензосодержащие гетероциклические соединения, содержащие  -дикарбонильный заместитель с фторированными радикалами. Кроме того, авторам не известны комплексы фторированных -дикарбонильный заместитель с фторированными радикалами. Кроме того, авторам не известны комплексы фторированных  -дикарбонильных соединений с ионами лантаноидов, которые при использовании, например, в условиях проведения анализа биоспецифического связывания обеспечивают указанный выше технический результат. Следовательно, заявляемое техническое решение удовлетворяет критерию «Новизна». -дикарбонильных соединений с ионами лантаноидов, которые при использовании, например, в условиях проведения анализа биоспецифического связывания обеспечивают указанный выше технический результат. Следовательно, заявляемое техническое решение удовлетворяет критерию «Новизна».
Известны технические решения, в которых использованы соединения, содержащие  -дикарбонильные заместители и различные ароматические хромофоры. Соединение, описанное в патенте США -дикарбонильные заместители и различные ароматические хромофоры. Соединение, описанное в патенте США  6166251, НКИ 562/828, обеспечивает получение комплексов, обладающих достаточно высокими константами связывания Eu3+, но коротковолновым ( 6166251, НКИ 562/828, обеспечивает получение комплексов, обладающих достаточно высокими константами связывания Eu3+, но коротковолновым ( 340 нм) возбуждением. Заявляемые соединения позволяют получать комплексы Eu3+ с приемлемыми для допирования наночастиц константами связывания (~107 М-1) и интенсивной длительной люминесценцией при возбуждении в области длин волн 340 нм) возбуждением. Заявляемые соединения позволяют получать комплексы Eu3+ с приемлемыми для допирования наночастиц константами связывания (~107 М-1) и интенсивной длительной люминесценцией при возбуждении в области длин волн  340 нм. Следовательно, предлагаемое техническое решение соответствует критерию “Уровень техники”. 340 нм. Следовательно, предлагаемое техническое решение соответствует критерию “Уровень техники”.
Заявляемые соединения и их комплексы с ионами лантаноидов могут найти применение в качестве маркеров и усилителей в различных способах анализа с использованием флуориметрии с временным разрешением люминесценции и особенно для допирования наночастиц. В области клинической диагностики они могут быть использованы для определения белков, гормонов, токсинов, нуклеиновых кислот и других объектов биогенного происхождения (например, микроорганизмов и вирусов), являющихся участниками биоспецифических взаимодействий. В области аналитической химии заявляемые реагенты могут быть применены для обнаружения редкоземельных элементов, их концентрирования и выделения, в том числе в хроматографии. В области техники они могут быть применены в качестве экстрагентов ионов тяжелых и редкоземельных металлов с целью их извлечения и/или очистки от их примесей сточных и контурных вод. Наиболее перспективно их применение в целях производства биочипов. Следовательно, заявляемое техническое решение соответствуют критерию «Промышленная применимость».
В общем случае заявляемые  -дикарбонильные соединения получаются конденсацией Кляйзена (схема 1), хотя созданию каждого типа гетероароматических соединений соответствуют свои оптимальные параметры: конденсирующий агент, щелочной реагент, условия реакции, стехиометрия компонентов и т.п. -дикарбонильные соединения получаются конденсацией Кляйзена (схема 1), хотя созданию каждого типа гетероароматических соединений соответствуют свои оптимальные параметры: конденсирующий агент, щелочной реагент, условия реакции, стехиометрия компонентов и т.п.

В качестве конденсирующего агента можно использовать сложные эфиры и ангидриды, галогенангидриды алифатических кислот, предпочтительно, однако, применять алкиловые эфиры трифторуксусной кислоты.
В качестве щелочных реагентов можно применять этилат натрия, метилат натрия, металлический натрий, амид натрия, гидриды натрия и лития. Если  -дикарбонильные соединения получаются в присутствии алкоголятов натрия с удовлетворительными выходами, то следует использовать именно эти реагенты, так как они менее опасны в обращении, чем металлический натрий или гидриды и менее способны к образованию побочных продуктов, чем металлический натрий или амид натрия. Предпочтительно применять в качестве реагентов метиловый эфир трифторуксусной кислоты и метилат натрия. -дикарбонильные соединения получаются в присутствии алкоголятов натрия с удовлетворительными выходами, то следует использовать именно эти реагенты, так как они менее опасны в обращении, чем металлический натрий или гидриды и менее способны к образованию побочных продуктов, чем металлический натрий или амид натрия. Предпочтительно применять в качестве реагентов метиловый эфир трифторуксусной кислоты и метилат натрия.
В качестве растворителей при осуществлении конденсации Кляйзена используются любые инертные растворители, не меняющиеся в условиях реакции. К ним, в частности, принадлежат: ациклические и циклические простые эфиры, ациклические и циклические углеводороды, апротонные биполярные растворители. Предпочтение отдается одному из вышеперечисленных растворителей в зависимости от конкретно взятого исходного ацетильного соединения.
При проведении реакции предпочтительным оказалось соотношение компонентов: ацетильное соединение – конденсирующий агент – щелочной реагент как 1:1,2:1,2, хотя оно может изменяться в каждом конкретном случае.
Температура реакции может колебаться от -5°С до температуры кипения растворителя, однако предпочтительно от -5°С до +40°С.
Реакцию можно проводить как при атмосферном, так и при повышенном или пониженном давлении, однако обычно работают при атмосферном давлении.
Заявляемые бензосодержащие гетероциклические соединения, имеющие  -дикарбонильный заместитель с трифторметильной группой приведенной выше общей формулы, представляют собой индивидуальные химические соединения ряда -дикарбонильный заместитель с трифторметильной группой приведенной выше общей формулы, представляют собой индивидуальные химические соединения ряда  -дикетонов, в которых в качестве хромофорного фрагмента выступают гетероароматические циклы. В каждом из них присутствует -дикетонов, в которых в качестве хромофорного фрагмента выступают гетероароматические циклы. В каждом из них присутствует  -дикарбонильная группировка (в положении 3 у индола, бензотиофена и фенотиазина и положении 2 у бензофурана и хинолина), ковалентно связанная с фторсодержащими фрагментами, которые обеспечивают сдвиг кето-енольного равновесия в сторону енола и за счет этого облегчают образование координационной связи с ионами редкоземельных элементов. Максимум возбуждения люминесценции комплексов предлагаемых соединений с Eu3+ варьирует в зависимости от структуры в интервале 340÷360 нм. -дикарбонильная группировка (в положении 3 у индола, бензотиофена и фенотиазина и положении 2 у бензофурана и хинолина), ковалентно связанная с фторсодержащими фрагментами, которые обеспечивают сдвиг кето-енольного равновесия в сторону енола и за счет этого облегчают образование координационной связи с ионами редкоземельных элементов. Максимум возбуждения люминесценции комплексов предлагаемых соединений с Eu3+ варьирует в зависимости от структуры в интервале 340÷360 нм.
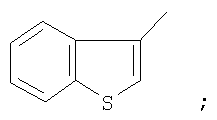
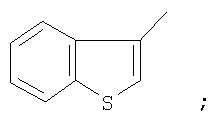
На фигуре 1 приведена структурная формула соединения 1-(1-бензотиофен-3-ил)-4,4,4-трифтор-1,3-бутандиона;
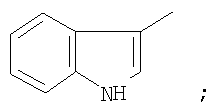
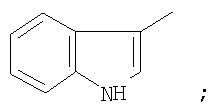
на фигуре 2 – 4,4,4-трифтор-1-(1H-индол-3-ил)-1,3-бутандиона;
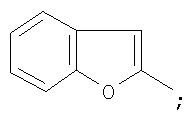
на фигуре 3 – 1-(1-бензофуран-2-ил)-4,4,4-трифтор-1,3-бутандиона;
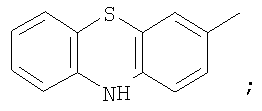
на фигуре 4 – 4,4,4-трифтор-1-(10H-фенотиазин-3-ил)-1,3-бутандиона;
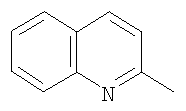
на фигуре 5 – 4,4,4-трифтор-1-(2-хинолинил)-1,3-бутандиона.
Примеры синтеза заявляемых соединений
Пример 1
Синтез 1-(1-бензотиофен-3-ил)-4,4,4-трифтор-1,3-бутандиона
К суспензии гидрида лития (25 ммоль) в сухом диэтиловом эфире (40 мл) прибавляли раствор метилового эфира трифторуксусной кислоты (5,6 ммоль) в этиловом эфире (5 мл) и раствор 3-бензотиофенилметилкетона (5,6 ммоль) в этиловом эфире (10 мл). Реакционную массу кипятили 24 часа, охлаждали до комнатной температуры, обрабатывали раствором продажной концентрированной серной кислоты (3,7 г) в дистиллированной воде (20 мл). Органический слой отделяли и промывали дистиллированной водой (3×7 мл), выдерживали при остаточном давлении 15 Торр в течение 1 часа при 80°С. Сухой остаток перекристаллизовывали из гептана (20 мл), промывали гексаном (3×5 мл) и получали  -дикетон, который представляет собой кристаллическое вещество с Тпл=57°С. Выход целевого продукта 0,98 ммоль (6,0%). -дикетон, который представляет собой кристаллическое вещество с Тпл=57°С. Выход целевого продукта 0,98 ммоль (6,0%).
1Н-ЯМР: 6.6 (с, 1Н,=СН); 7.5 (м, 2Н, 2=СН); 7.9 (д, 1Н, =СН, J=7); 8.4 (с, 1Н,=СН); 8.65 (д, 1Н, =СН); 15.2 (ушс, 1Н, ОН);
19F-ЯМР: 0.4 (с, 3F, CF3);
МВ=272,2; C12H7F3O2S.
Элементный анализ: найдено С – 52,75%, Н – 2,34%, вычислено С – 52,94%, Н – 2,59%.
Пример 2
Синтез 4,4,4-трифтор-1-(1H-индол-3-ил)-1,3-бутандиона
Металлический натрий (12 ммоль) растворяли в сухом метаноле (5 мл), затем реакционную массу концентрировали досуха при остаточном давлении 20 Торр в течение 1 часа при 90°С. Прибавляли сухой диэтиловый эфир (15 мл) и раствор метилового эфира трифторуксусной кислоты (12 ммоль) в этиловом эфире (5 мл), затем прибавляли 3-индолилметилкетон (5 ммоль). Полученную суспензию выдерживали при 50°С и перемешивании в замкнутом объеме в течение 15 часов, охлаждали до комнатной температуры, обрабатывали раствором продажной концентрированной уксусной кислоты (1,5 г) в дистиллированной воде (40 мл). Органический слой отделяли и промывали дистиллированной водой (3×10 мл), выдерживали при остаточном давлении 20 Торр в течение 1 часа при 85°С. Сухой остаток перекристаллизовывали из хлороформа (65 мл), промывали хлороформом (3×5 мл) и получали  -дикетон, представляющий кристаллическое вещество с Тпл=199°С. Выход целевого продукта 1,32 ммоль (25,0%). -дикетон, представляющий кристаллическое вещество с Тпл=199°С. Выход целевого продукта 1,32 ммоль (25,0%).
1Н-ЯМР: 6.45 (с, 1Н, =СН); 7.2 (м, 2Н, 2=СН); 7.5 (м, 1Н, =СН); 8.2 (м, 1Н, =СН); 8.55 (с, 1Н, =СН); 12.35 (ушс, 1Н, NH);
19F-ЯМР: 3.3 (с, 3F, CF3);
МВ=255.2; C12H8F3NO2.
Элементный анализ: найдено С – 56,85%, Н – 3,24%, N 5,21%, вычислено С – 56,48%, Н – 3,16%, N 5,49%.
Пример 3
Синтез 1-(1-бензофуран-2-ил)-4,4,4-трифтор-1,3-бутандиона
Металлический натрий (25 ммоль) растворяли в сухом метаноле (7 мл), затем реакционную массу концентрировали досуха при остаточном давлении 15 Торр в течение 1 часа при 110°С. Прибавляли сухой диэтиловый эфир (20 мл) и в течение 15 минут метиловый эфир трифторуксусной кислоты (25 ммоль), затем раствор 2-бензофурилметилкетона (25 ммоль) в диэтиловом эфире (10 мл). Реакционную массу кипятили в течение 6,5 часов при перемешивании, охлаждали до комнатной температуры, обрабатывали раствором продажной концентрированной серной кислоты (7,5 г) в дистиллированной воде (40 мл). Органический слой отделяли и промывали дистиллированной водой (3×25 мл), выдерживали при остаточном давлении 20 Торр в течение 1 часа при 75°С, фракционировали и получали  -дикетон в виде кристаллического вещества с Тпл=74°С (Ткип=91 (2) °С). Выход целевого продукта 1,58 ммоль (8,0%). -дикетон в виде кристаллического вещества с Тпл=74°С (Ткип=91 (2) °С). Выход целевого продукта 1,58 ммоль (8,0%).
1Н-ЯМР: 6.75 (с, 1Н, =СН); 7.35 (т, 2Н, 2=СН, J=6); 7.6 (д, 1Н, =СН, J=8); 7.75 (т, 1Н, =СН); 7.8 (д, 1Н, =СН); 7.95 (с, 1Н, =СН);
19F-ЯМР: 2.4 (с, 3F, CF3);
МВ=256,2; C12H7F3O3.
Элементный анализ: найдено С – 56,68%, Н – 2,50%, вычислено С – 56,26%, Н – 2,75%.
Пример 4
Синтез 4,4,4-трифтор-1-(10H-фенотиазин-3-ил)-1,3-бутандиона
Металлический натрий (15 ммоль) растворяли в сухом метаноле (6 мл), затем реакционную массу концентрировали досуха при остаточном давлении 22 Торр в течение 1 часа при 85°С. Прибавляли сухой диэтиловый эфир (20 мл) и в течение 15 минут раствор метилового эфира трифторуксусной кислоты (15 ммоль) в этиловом эфире (5 мл), затем прибавляли 3-тиазинилметилкетон (5 ммоль). Полученную суспензию кипятили при перемешивании в течение 2 часов, охлаждали до комнатной температуры, обрабатывали раствором продажной концентрированной серной кислоты (4,6 г) в дистиллированной воде (40 мл). Органический слой отделяли и промывали дистиллированной водой (3×15 мл), выдерживали при остаточном давлении 20 Торр в течение 3 часов при 85°С. Сухой остаток перекристаллизовывали из смеси (25 мл) хлороформ-гептан (8:1), промывали хлороформом (3×5 мл) и получали  -дикетон, в виде кристаллического вещества с Тпл=188°С. Выход целевого продукта 3,22 ммоль (24,8%). -дикетон, в виде кристаллического вещества с Тпл=188°С. Выход целевого продукта 3,22 ммоль (24,8%).
1Н-ЯМР: 6.6 (д, 1Н, =СН, J=7); 6.65 (с, 1Н, =СН); 6.7 (м, Н, =СН); 6.8 (д, 1Н, =СН, J=8); 6.9 (м, 2Н, 2=СН); 7.2 (с, 1Н, =СН); 7.4 (д, 1Н, =СН, J=8); 8.65 (с, 1Н, NH);
19F-ЯМР: 5.1 (с, 3F, CF3);
MB=337,3; C16H10F3NO2S.
Элементный анализ: найдено С – 56,51%, Н – 2,59%; вычислено С – 56,97%, Н – 2,99%.
Пример 5
Синтез 4,4,4-трифтор-1-(2-хинолинил)-1,3-бутандиона
Металлический натрий 0,28 г (12,2 ммоль) растворяли в 10 мл сухого метанола, затем реакционную массу концентрировали досуха при остаточном давлении 22 Торр в течение 1 часа при 85°С. К полученному метилату натрия прибавляли 0,80 г (4,67 ммоль) ацетилхинолина в 15 мл сухого диэтилового эфира, раствор метилового эфира трифторуксусной кислоты 0,66 г (5,14 ммоль) в 5 мл сухого диэтилового эфира. Полученную суспензию кипятили при перемешивании 3 часа, охлаждали до комнатной температуры, обрабатывали раствором концентрированной серной кислоты 2 г в 5 мл дистиллированной воды. Органический слой отделяли, промывали дистиллированной водой (3×10 мл), водный слой экстрагировали эфиром (3×5), объединенные эфирные слои упаривали. Получали 4,4,4-трифторо-1-(2-хинолинил)-1,3-бутандион 0,34 ммоль (7,21%), грязно-желтое твердое вещество т. разл. 280-282°С. 1Н-ЯМР-спектр ( , м. д.): 6,98 (с, 1Н, =СН); 7,62 (м, 1Н, =СН,); 7,77 (м, 1Н, =СН,); 7,95 (д, 1Н, =СН); 8,19 (м, 2Н, 2=СН); 8,38 (д, 1Н, =СН); , м. д.): 6,98 (с, 1Н, =СН); 7,62 (м, 1Н, =СН,); 7,77 (м, 1Н, =СН,); 7,95 (д, 1Н, =СН); 8,19 (м, 2Н, 2=СН); 8,38 (д, 1Н, =СН);
19F-ЯМР: 3.2 (с, 3F, CF3);
МВ=267,2; C13H8F3NO2.
Элементный анализ: найдено С – 58,18%, Н – 3,20%, N – 5,18% C20H11F6NO4, вычислено С – 58,43%, Н – 3,02%, N – 5,24%.
Пример 6
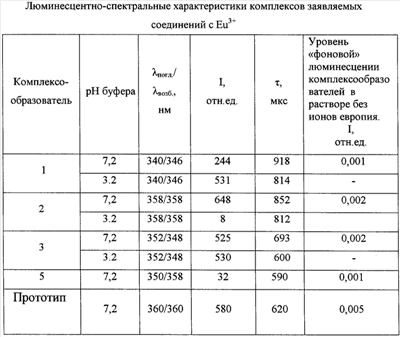
Люминесцентно-спектральные свойства комплексов заявляемых соединений с Eu3+
Регистрацию спектрально-люминесцентных характеристик комплексов осуществляли в диапазоне длин волн 230÷800 нм на флуориметре с временным разрешением люминесценции – модель Perkin-Elmer LS-5B, США. Соответствующие результаты приведены в таблице, где  погл/ погл/ возб – длина волны поглощения/возбуждения люминесценции комплекса при регистрации эмиссии на 615 нм, I – интенсивность люминесценции в максимуме возбуждения и регистрации в относительных единицах (время задержки регистрации эмиссии люминесценции td – 0,1 мс, время регистрации эмиссии люминесценции tg – 1 мс), возб – длина волны поглощения/возбуждения люминесценции комплекса при регистрации эмиссии на 615 нм, I – интенсивность люминесценции в максимуме возбуждения и регистрации в относительных единицах (время задержки регистрации эмиссии люминесценции td – 0,1 мс, время регистрации эмиссии люминесценции tg – 1 мс),  – время жизни люминесценции. – время жизни люминесценции.
Все характеристики получены в водных растворах, содержащих 5·10-5 моль/л ТОФО и 0,1% Тритона Х-100. Для нейтральной среды (0,05 моль/л Трис-буфер рН 7,2) приведены результаты, полученные от комплексов лиганд – Eu3+ стехиометрического состава 1:1 (концентрации лиганд: ион =10-8:5·10-6 моль/л), для кислой (среда УР рН 3,2) – состава 3:1 (концентрации лиганд: ион =1.5·10-5:10-8 моль/л).
Из данных, приведенных в таблице, следует, что заявляемые соединения образуют интенсивно и длительно люминесцирующие комплексы с Eu3+ в нейтральных средах. В кислой среде хорошие люминесцентные характеристики сохраняют соединения (1) и (3), что позволяет использовать их в качестве перекомплексообразователей в способе иммуноанализа на основе DELFIA.
Формула изобретения
Комплексообразующие бензосодержащие гетероциклические соединения, содержащие  -дикарбонильный заместитель с фторированными радикалами, общей формулы -дикарбонильный заместитель с фторированными радикалами, общей формулы
HetAr-С(O)СН2С(O)CF3,
где HetAr=
  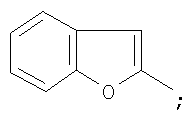 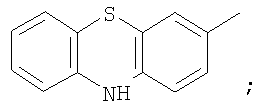 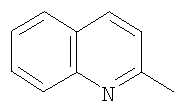
образующие люминесцирующие комплексы с ионами Eu3+.
РИСУНКИ
|
|