|
|
(21), (22) Заявка: 2008125868/15, 26.06.2008
(24) Дата начала отсчета срока действия патента:
26.06.2008
(46) Опубликовано: 20.11.2009
(56) Список документов, цитированных в отчете о
поиске:
ЛИДИН Р.А. и др. Химические свойства неорганических веществ. – М.: Химия, 1997, с.381, рубрика 761, реакция 4. SU 1308549 A1, 07.05.1987. RU 2253607 C1, 10.06.2005. KR 890005057 B1, 09.12.1989. GB 846832 A, 31.08.1960. НЕКРАСОВ Б.В. Курс общей химии. – М.: Госхимиздат, 1962, с.235.
Адрес для переписки:
142432, Московская обл., г. Черноголовка, ул. Первая, 22, кв.64, В.Г. Глебовскому
|
(72) Автор(ы):
Глебовский Вадим Георгиевич (RU),
Сидоров Николай Сергеевич (RU),
Штинов Евгений Дмитриевич (RU)
(73) Патентообладатель(и):
Глебовский Вадим Георгиевич (RU)
|
(54) СПОСОБ ПОЛУЧЕНИЯ ГАЗООБРАЗНОГО ХЛОРА И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ
(57) Реферат:
Изобретение может быть использовано в области неорганической химии. Способ получения газообразного хлора включает проведение в реакторе окислительно-восстановительной реакции между бихроматом калия и концентрированной соляной кислотой. Скорость реакции и скорость потока образующегося газообразного хлора регулируют путем изменения температуры в реакторе в пределах 40-70°С, а газообразный хлор отводят из реактора. Предложено устройство для получения газообразного хлора. Изобретение позволяет повысить управляемость процесса получения газообразного хлора для стабильного обеспечения хлоридных процессов получения высокочистых металлов в лабораторных и полупромышленных условиях. 2 н.п. ф-лы, 1 ил.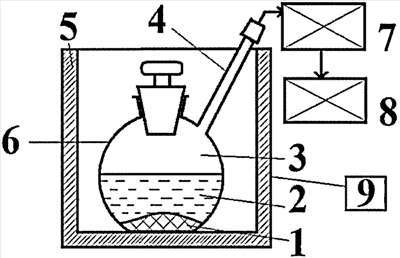
Изобретение относится к области неорганической химии и может быть использовано при проведении хлоридных процессов получения высокочистых металлов.
Известен метод получения газообразного хлора, выбранный нами за прототип, который используется в лабораторной и полупромышленной практике для получения хлора, для чего используют химическую реакцию взаимодействия перманганата калия с концентрированной соляной кислотой:
2KMnO4+16HCl 5Cl2 5Cl2 +2KCl+2MnCl2+8H2O. +2KCl+2MnCl2+8H2O.
Недостатком данного метода является то, что необходимо непрерывно регулировать скорость подачи соляной кислоты HCl в зону реакции, причем скорость реакции существенно замедляется по мере накопления продуктов реакции (KCl, MnCl2, H2O). Присутствие в зоне реакции воды приводит к уменьшению концентрации соляной кислоты, что тоже является недостатком метода. Серьезным непреодолимым недостатком метода является невозможность существенного изменения скорости потока хлора.
Наиболее близким к заявленному способу является способ получения газообразного хлора [Лидин Р.А. и др. Химические свойства неорганических веществ. М., Химия, 1997, с.381, рубрика 761, реакция 4]. Известный способ включает окислительно-восстановительную реакцию, которую проводят между бихроматом калия и концентрированной кислотой:
K2Cr2O7+14HCl 3Cl2 3Cl2 +2KCl+2CrCl2+7H2O. +2KCl+2CrCl2+7H2O.
Наиболее близким к заявленному устройству можно рассматривать устройство, известное из авторского свидетельства SU 1308549, Кл. C01B 7/01, 1987.
Техническая задача – повышение управляемости процесса получения газообразного хлора для стабильного обеспечения процессов получения высокочистых металлов в лабораторных и полупромышленных условиях.
Это достигается тем, что в известном способе получения газообразного хлора, включающем реакцию бихромата калия и концентрированной соляной кислоты с образованием газообразного хлора, указанную окислительно-восстановительную реакцию проводят в реакторе, при этом скорость реакции и скорость потока образующегося газообразного хлора регулируют путем изменения температуры в реакторе в пределах 40-70°С, а газообразный хлор отводят из реактора. Данная реакция протекает при повышенных температурах, поэтому отпадает необходимость непрерывного регулирования скорости подачи концентрированной соляной кислоты в зону реакции. При контролируемом изменении температуры от 40°С до 70°С скорость реакции увеличивается почти вдвое, а при понижении температуры в этом диапазоне выделение газообразного хлора контролируемо уменьшается, что дает прекрасную возможность управляемого изменения скорости потока хлора на выходе из реактора. Ниже 25°С реакция образования газообразного хлора прекращается вообще.
Это достигается тем, что в устройстве для реализации способа получения газообразного хлора, включающем реактор с бихроматом калия и концентрированной соляной кислотой, реактор с реагентами помещен в термостат, поддерживающий заданную температуру в пределах 40-70°С с помощью устройства для регулирования температуры.
На чертеже представлено лабораторное устройство для получения газообразного хлора: 1 – реагент (бихромат калия); 2 – реагент (концентрированная соляная кислота); 3 – газообразный хлор; 4 – отводная труба; 5 – термостат; 6 – реактор; 7 – устройство для очистки хлора; 8 – накопитель хлора; 9 – устройство для регулирования температуры.
Способ получения газообразного хлора осуществляется следующим образом. Реагенты в виде бихромата калия и концентрированной соляной кислоты помещают в реактор 6, между реагентами происходит окислительно-восстановительная реакция с выделением газообразного хлора 3, скорость реакции регулируют термостатом 5 с помощью устройства 9 для регулирования температуры реакции, газообразный хлор 3 отводят из реактора по отводной трубе 4 в устройство для очистки 7 и накопитель 8.
Пример реализации способа.
В термостат с устройством для регулирования температуры помещали реактор в виде колбы, в колбу засыпали бихромат калия (45 г) и добавляли концентрированную соляную кислоту (70 мл). Реакция между этими реагентами начиналась сразу же, но ее скорость можно было легко увеличивать путем нагрева колбы с реагентами путем изменения температуры в термостате. Изменение температуры от 40°С до 70°С приводило к увеличению скорости реакции вдвое. Уменьшение нагрева приводило к уменьшению скорости потока газообразного хлора. В лабораторной версии предлагаемого способа и устройства, включенной в технологическую схему получения высокочистых металлов хлоридным способом, с помощью одной «заправки» реактора получали до 300 г высокочистого титана. В целом было произведено более 2000 г высокочистого титана при шести «заправках» реактора.
Таким образом, приведенные результаты показывают, что при проведении процессов получения высокочистых металлов с использованием газообразного хлора предлагаемый способ обеспечивает контролируемое получение хлора с заданной скоростью подачи хлора в реактор для хлорирования металлов и соответственно высокую стабильность совмещенных технологий.
Формула изобретения
1. Способ получения газообразного хлора, включающий окислительно-восстановительную реакцию между бихроматом калия и концентрированной соляной кислотой, отличающийся тем, что указанную окислительно-восстановительную реакцию проводят в реакторе, при этом скорость реакции и скорость потока образующегося газообразного хлора регулируют путем изменения температуры в реакторе в пределах 40-70°С, а газообразный хлор отводят из реактора.
2. Устройство для осуществления способа по п.1, включающее реактор, заполненный реагентами, отличающееся тем, что реактор с реагентами помещен в термостат, поддерживающий заданную температуру в пределах 40-70°С с помощью устройства для регулирования температуры.
РИСУНКИ
|
|