|
|
(21), (22) Заявка: 2007129842/14, 05.01.2005
(24) Дата начала отсчета срока действия патента:
05.01.2005
(30) Конвенционный приоритет:
05.01.2004 US 60/534,553
04.02.2004 US 60/542,176
(43) Дата публикации заявки: 10.02.2009
(46) Опубликовано: 27.10.2009
(56) Список документов, цитированных в отчете о
поиске:
WO 03101458, 11.12.2003. RU 2242978 C2, 27.12.2004. РОЩИНА И.Ф. и др. Оценка эффективности терапии акатинолом мемантином больных с болезнью Альцгеймера по результатам нейропсихологического исследования. Consilium medicum. Психиатрия и психофармакотерапия, Том 04, N 6, 2002. АНДРОСОВА Л.В. и др. Акатинол мемантин при болезни Альцгеймера:клинико-иммунологические корреляции, ж. Неврологии и психиатрии,  9, 2000, с.36-38. GORTELMEYER R. et al., Memantine in the treatment of mild to moderate dementia syndrome. A double-blind placebo-controlled study, Arzneimittelforschung, 1992, 42 (7): 904-13. 9, 2000, с.36-38. GORTELMEYER R. et al., Memantine in the treatment of mild to moderate dementia syndrome. A double-blind placebo-controlled study, Arzneimittelforschung, 1992, 42 (7): 904-13.
(85) Дата перевода заявки PCT на национальную фазу:
03.08.2007
(86) Заявка PCT:
US 2005/000145 20050105
(87) Публикация PCT:
WO 2005/067908 20050728
Адрес для переписки:
129090, Москва, ул.Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. А.В.Мицу, рег. 364 364
|
(72) Автор(ы):
МАКДОНАЛЬД Скотт (US),
ГЕРГЕЛ Айван (US),
ШТЕФФЛЕР Альбрехт (DE),
МЕБИУС Ханс-Йорг (DE),
ВИРТ Ивонне (DE),
ПОТКИН Стивен (US)
(73) Патентообладатель(и):
МЕРЦ ФАРМА ГМБХ УНД КО. КГАА (DE)
|
(54) МЕМАНТИН ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА ЛЕГКОЙ И ОТ ЛЕГКОЙ ДО УМЕРЕННОЙ СТЕПЕНИ ТЯЖЕСТИ
(57) Реферат:
Изобретение относится к медицине, в частности к неврологии, и касается вариантов способа лечения болезни Альцгеймера. Для этого мемантин или его фармацевтически приемлемую соль вводят в начальной дозе 5 мг в сутки с увеличением на 5 мг в сутки каждую неделю до конечной дозы 20 мг в сутки. Способ монотерапии позволяет эффективно лечить пациентов с болезнью Альцгеймера от легкой до умеренной степени тяжести, которых в частности ранее лечили ингибитором ацетилхолинэстеразы. 2 н. и 8 з.п. ф-лы, 3 табл., 2 ил.
По настоящей заявке испрашивается приоритет предварительных заявок США порядковых  60/534553, поданной 5 января 2004 г., и 60/542176, поданной 4 февраля 2004 г., полное содержание которых приведено здесь в качестве ссылки. 60/534553, поданной 5 января 2004 г., и 60/542176, поданной 4 февраля 2004 г., полное содержание которых приведено здесь в качестве ссылки.
Область изобретения
Настоящее изобретение относится к способу лечения индивидуумов, страдающих деменцией типа Альцгеймера от легкой до умеренной степени тяжести, посредством введения эффективного количества мемантина. Настоящее изобретение также относится к способу предупреждения уменьшения интенсивности метаболизма глюкозы, связанного с регрессией болезни Альцгеймера у индивидуумов, страдающих деменцией от легкой до умеренной степени тяжести.
Предпосылки изобретения
Деменция и болезнь Альцгеймера
Деменция представляет собой тяжелое расстройство, поражающее так много, как 10% индивидуумов старше 65 лет и более 24% индивидуумов старше 85 лет (Hofman et al., Int. J. Epidemiol. 1991; 20: 736-748; Jorm and Jolley, Neurology. 1998; 51: 728-733; Lobo et al., Neurology. 2000; 54 (Suppl. 5): S4-S9). Болезнь Альцгеймера (AD) является все в большей степени преобладающей формой нейродегенерации, насчитывающей приблизительно 50%-60% всех случаев деменции среди людей старше 65 лет. Деменцию, связанную с AD, обозначают сенильной деменцией типа Альцгеймера (SDAT), подобно болезни Альцгеймера. AD клинически характеризуют прогрессирующей потерей памяти, познавательной способности, мышления, способности к умозаключениям и эмоциональной стабильности, что постепенно приводит к глубоким психическим нарушениям и, в конечном итоге, к смерти. AD представляет собой прогрессирующее расстройство со средней продолжительностью около 8,5 лет между появлением клинических симптомов и смертью. Считают, что AD представляет собой четвертую из наиболее распространенных медицинских причин смерти и поражает приблизительно 4-5 миллионов человек в Соединенных Штатах. Распространенность AD после возраста 65 лет удваивается каждые 5 лет (National Institute on Aging: Prevalence and costs of Alzheimer’s disease. Progress Report on Alzheimer’s disease. NIH Publication No. 993616, November 1998; Polvikoski et al., Neurology. 2001; 56: 1690-1696). В настоящее время во всем мире AD поражает приблизительно 15 миллионов человек (включая все расы и этнические группы) и вследствие относительного увеличения числа пожилых людей в населении ее распространение, по-видимому, будет увеличиваться в течение двух-трех следующих десятилетий. В настоящее время AD является неизлечимой. Лечение, эффективно предупреждающее AD или облегчающее ее симптомы и течение, в настоящее время неизвестно.
Гибель нейронов. AD связана с гибелью пирамидальных нейронов и потерей нейрональных синапсов в областях мозга, связанных с высшими ментальными функциями (Francis et al., J. Neurol. Neurosurg. Psychiatry. 1999; 66: 137-147). В мозге индивидуумов с AD обнаруживают характерные очаги, названные сенильными (или амилоидными) бляшками, амилоидную ангиопатию (отложения амилоида в кровеносных сосудах) и нейрофибриллярные клубки. Меньшее число этих очагов при более ограниченном анатомическом распределении обнаружено также в мозге большинства престарелых людей, у которых клинически не обнаружена AD. Амилоидные бляшки и амилоидная ангиопатия характеризуют также мозг индивидуумов с трисомией 21 (синдромом Дауна) и наследственной церебральной геморрагией с амилоидозом голландского типа (HCHWA-D). В настоящее время для точного диагноза AD, как правило, необходимо обнаружение вышеупомянутых очагов в ткани мозга пациентов, умерших от заболевания, или, редко, в малых образцах биопсии ткани мозга, взятых во время инвазивной нейрохирургической процедуры. Однако врачи обычно диагностируют AD на основании набора симптомов, полагаясь на известную корреляцию между такими симптомами и симптомологией, полученной при биопсии.
AD связана с массовой гибелью холинергических нейронов в базальном ядре Мейнерта (Perry et al., Br. Med. J. 1978; 2: 1456-1459; Geula and Mesulam, Cholinergic systems and related neuropathological predilection patterns in Alzheimer disease. In: Alzheimer’s disease. Terry et al. eds.; New York: Raven Press; 1994, p.263-291). Передача сигнала этими нейронами опосредована высвобождающимся из клеток нейромедиатором ацетилхолином (ACh). Лекарственные средства, избирательно усиливающие холинергическое действие посредством ингибирования холинергического катаболического фермента ацетилхолинэстеразы (AChE), который разрушает ACh после того, как последний секретируется в синаптические щели (Goff and Coyle, Am. J. Psychiatry. 2001; 158: 1367-1377), использовали для лечения AD. В настоящее время наиболее широко применяемыми в клинике ингибиторами ацетилхолинэстеразы (AChEI) являются донепезил, галантамин и ривастигмин.
Деменция и метаболизм. Структурная нейровизуализация играет важную роль в начальной оценке деменции для того, чтобы исключать потенциально поддающиеся лечению причины. Деменция, связанная с AD, отличается от других форм деменции по характерной билатеральной картине сниженного метаболизма, которая является наиболее заметной в височной, теменной и префронтальной ассоциативных областях, а также в задней части поясной области и предклинье, с относительной сохранностью первичной сенсомоторной коры, базального ядра, таламуса, ствола мозга и мозжечка (Small & Leiter, J Clin Psychiatry. 1998; 59 Suppl 11: 4-7). Тяжесть уменьшения интенсивности метаболизма глюкозы соответствует тяжести деменции и коррелирует с местной потерей нейронов. (McGeer et al., Can J Neurol Sci. 1986; 13 (4 Suppi): 511-6). Области мозга, наиболее пораженные болезнью Альцгеймера, меняются с течением времени. Исследования метаболизма in vivo позитронно-эмиссионной томографией с “18F-фтордезоксиглюкозой (FDG PET) показали гипометаболизм в обширных кортикальных областях, включая лобную и височную доли и область гиппокампа, начиная с ранних стадий AD. С помощью FDG PET измеряют местный кровоток и/или метаболизм глюкозы и предполагают, что она способна выявлять функциональные аномалии перед появлением структурных изменений (Ichimiya et al., Psychiatry Clin Neurosci. 1998; 52 Suppl: S223-5; Reiman et al., Proc Natl Acad Sci USA. 2001 13; 98(6): 3334-9; Silverman et al., J Nucl Med. 2002; 43(2): 253-66; Small et al., Curr Neurol Neurosci Rep. 2003; 3(5): 385-92).
Антагонисты NMDA-рецептора и мемантин
Избыточная или патологическая активация рецепторов глутамата, в частности, тех, которые избирательно активируются N-метил-D-аспартатом (NMDA), также вовлечена в процессы, лежащие в основе дегенерации холинергических клеток в мозге пациентов с AD (Greenamyre et al., Neurobiol. Aging. 1989; 10: 593-602; Francis et al., J. Neurochem. 1993; 60: 263-291; Li et al., J. Neuropathol. Exp. Neurol. 1997; 56: 901-911; Wu and Rowan, Neuroreport. 1995; 6: 2409-2413). Рецептор NMDA является основным для нескольких физиологических процессов синаптической пластичности, включая память и обучение (Collinridge and Singer, Trends Pharmacol. Sci. 1990; 11: 290-296).
Антагонисты рецептора NMDA потенциально обладают широким рядом терапевтических применений при многочисленных расстройствах CNS, таких как острая нейродегенерация (например, связанная с инсультом и травмой), хроническая нейродегенерация (например, связанная с болезнью Паркинсона, AD, болезнью Гентингтона и боковым амиотрофическим склерозом [ALS]), эпилепсия, лекарственная зависимость, депрессия, тревожность и хроническая боль (обзоры см. в: Parsons et al., Drug News Perspect. 1998; 11: 523-569; Parsons et al., 1999, выше; Jentsch and Roth, Neuropsychopharmacology. 1999; 20: 201-205; Doble, Therapie. 1995; 50: 319-337). Функционального ингибирования рецепторов NMDA можно достигать посредством воздействия на различные участки узнавания в комплексе рецептора NMDA. Такие участки включают в себя i) участок для первичного медиатора (конкурентный); ii) участок для фенциклидина, расположенный внутри катионного канала (неконкурентный); iii) модуляторный участок для полиамина, и iii) нечувствительный к стрихнину коагонистический аллостерический участок для глицина (глицин В) (Parsons et al., 1999, выше).
Считают, что возбуждающий нейромедиатор глутамат играет важную роль в патофизиологии (в отличие от этиологии) нейродегенеративных заболеваний, таких как AD, болезнь Паркинсона и боковой амиотрофический склероз. Глутамат стимулирует приблизительно 70% всех возбуждающих синапсов в CNS, и дисфункциональное хроническое высвобождение глутамата может производить длительное возбуждающее действие посредством активации рецептора глутамата. Эта длительная активация опосредована рецептором глутамата NMDA и может приводить к дегенерации и гибели кортикальных нейронов.
Мемантин (1-амино-З,5-диметиладамантан) является аналогом 1-аминоциклогексана (описанного, например, в патентах США  4122193; 4273774; 5061703), который представляет собой системно активный неконкурентный антагонист рецептора NMDA, обладающий умеренной аффинностью для рецептора, сильной зависимостью от разности потенциалов и кинетикой быстрого блокирования/разблокирования. Доказано, что мемантин и другие 1-аминоалкилциклогексаны применимы для облегчения различных прогрессирующих нейродегенеративных расстройств, таких как деменция у пациентов с AD от умеренной до тяжелой степени тяжести, болезнь Паркинсона и спастичность (см., например, патенты США 4122193; 4273774; 5061703), который представляет собой системно активный неконкурентный антагонист рецептора NMDA, обладающий умеренной аффинностью для рецептора, сильной зависимостью от разности потенциалов и кинетикой быстрого блокирования/разблокирования. Доказано, что мемантин и другие 1-аминоалкилциклогексаны применимы для облегчения различных прогрессирующих нейродегенеративных расстройств, таких как деменция у пациентов с AD от умеренной до тяжелой степени тяжести, болезнь Паркинсона и спастичность (см., например, патенты США  5061703; 5614560 и 6034134; Parsons et al., 1999, выше; Möebius, ADAD. 1999; 13: S172-178; Danysz et al., Neurotox. Res. 2000; 2: 85-97; Winblad and Poritis, Int. J. Geriatr. Psychiatry. 1999; 14: 135-146; Görtelmeyer et al. 1992, выше; Danysz et al., Curr. Pharm. Des. 2002; 8: 835-843; Jirgensons et. al., Eur. J. Med. Chem. 2000; 35: 555-565). 5061703; 5614560 и 6034134; Parsons et al., 1999, выше; Möebius, ADAD. 1999; 13: S172-178; Danysz et al., Neurotox. Res. 2000; 2: 85-97; Winblad and Poritis, Int. J. Geriatr. Psychiatry. 1999; 14: 135-146; Görtelmeyer et al. 1992, выше; Danysz et al., Curr. Pharm. Des. 2002; 8: 835-843; Jirgensons et. al., Eur. J. Med. Chem. 2000; 35: 555-565).
В настоящее время мемантин принят в Европе для лечения AD от умеренно тяжелой до тяжелой степени тяжести и в Соединенных Штатах для лечения AD от умеренной до тяжелой степени тяжести. Кроме того, введение мемантина пациентам с AD от умеренной до тяжелой степени тяжести, поддерживаемым на AChEI донепезиле, привело к неожиданно большему облегчению симптомов по сравнению с пациентами с AD, получающими плацебо. Этот эффект не был обнаружен для пациентов с AD от легкой до умеренной степени тяжести, где комбинированная терапия, включающая в себя введение мемантина и AChEI, не привела к какому-нибудь преимуществу по сравнению с одним AChEI.
Сущность изобретения
Настоящее изобретение относится к способу лечения болезни Альцгеймера от легкой до умеренной степени тяжести посредством введения эффективного количества мемантина.
В одном из вариантов осуществления мемантин вводят в диапазоне от приблизительно 5-100 мг/сутки.
В другом варианте осуществления мемантин вводят в диапазоне от приблизительно 10-40 мг/сутки.
В другом варианте осуществления мемантин вводят в дозе приблизительно 20 мг/сутки.
В дополнительном варианте осуществления мемантин вводят пациентам с болезнью Альцгеймера от легкой до умеренной, которым ранее вводили, но прекратили, ингибиторы AChEI, такие как донепезил.
В другом варианте осуществления мемантин вводят пациентам с болезнью Альцгеймера легкой степени тяжести.
Настоящее изобретение относится также к способу предупреждения снижения метаболизма глюкозы в кортикальной и субкортикальной областях мозга у субъектов с AD от легкой до умеренной степени тяжести посредством введения эффективного количества мемантина.
В одном из вариантов осуществления мемантин вводят в диапазоне от приблизительно 5-100 мг/сутки.
В другом варианте осуществления мемантин вводят в дозе приблизительно 20 мг/сутки.
Краткое описание фигур
Фигура 1. На фигуре 1 показаны различия в местной метаболической активности мозга, оцененной путем PET у субъектов с AD от легкой до умеренной степени тяжести, после 24 недель плацебо по сравнению с исходным уровнем. Средние уровни относительной метаболической активности совмещали со стандартной матрицей отображения поверхности по SPM. Красным отмечены более высокие уровни метаболической активности после плацебо; синим показаны более низкие уровни активности. Статистически значимые (p<0,025) местные различия определяют с пороговым значением 10 вокселов для поправки на множественные сравнения. Изображения а и b представляют собой боковые кортикальные поверхности; изображения c-i представляют собой осевые изображения (z=-31 мм, -19 мм, -8 мм, 8 мм, 14 мм, 29 мм, 60 мм относительно линии AC-PC, соответственно); изображение j представляет собой сагиттальное изображение при +33 мм (правая сторона мозга). Координаты х, у и z соответствуют стереотаксическому пространству Talairach.
Фигура 2. На фигуре 2 показаны различия в местной метаболической активности мозга, оцененной путем PET у субъектов с AD после 24 недель приема 20 мг мемантина в сутки по сравнению с исходным уровнем. Красным отмечены более высокие уровни метаболической активности после приема мемантина; синим показаны более низкие уровни активности. Статистически значимые (p<0,025) местные различия определяют с пороговым значением 10 вокселов для поправки на множественные сравнения. Описания изображений являются такими же, как приведенные на фигуре 1, за исключением того, что изображение j представляет собой сагиттальное изображение при -4 мм (левая сторона мозга).
Подробное описание
Настоящее изобретение неожиданно показало пользу от лечения мемантином по сравнению с плацебо для пациентов с сенильной деменцией типа Альцгеймера (SDAT) от легкой до умеренной степени тяжести. Этот результат является неожиданным с точки зрения предыдущего исследования, в котором добавление мемантина к режиму введения AChEI не показало улучшенной эффективности по сравнению с терапией одним AchEI для лечения AD от легкой до умеренной степени тяжести. Настоящий результат является неожиданным еще и по той причине, что большинство из группы пациентов, которых лечили мемантином, составляли индивидуумы, которых ранее лечили AChEI, но для которых прекратили терапию AChEI либо потому, что они не отвечали, либо потому, что они не могли переносить неблагоприятные побочные эффекты, либо и из-за того, и из-за другого.
Настоящее изобретение основано на результатах рандомизированного двойного слепого, контролируемого плацебо многоцентрового исследования с параллельными группами, сравнивающего мемантин с плацебо у амбулаторных пациентов с диагнозом вероятной AD согласно критериям NINCDS-ADRDA. Тяжесть от легкой до умеренной устанавливали с использованием баллов краткой шкалы оценки психического статуса (MMSE) ( 10 и 10 и  22; 0 является наименьшим баллом, а 30 является наивысшим баллом). 22; 0 является наименьшим баллом, а 30 является наивысшим баллом).
Настоящее изобретение также неожиданно показало, что мемантин, введенный пациентам с AD от легкой до умеренной степени тяжести, предупреждает снижение метаболизма глюкозы в кортикальных и субкортикальных областях у таких пациентов по сравнению с плацебо. Эти данные основаны на результатах процедур сканирования PET для 10 пациентов (5 для мемантина и 5 для плацебо) в одном пункте многоцентрового испытания, описанного выше.
В исследовании по настоящему изобретению участвовало приблизительно 400 пациентов, зарегистрированных в 42 центрах. Оценку первичной эффективности осуществляли по оценочной шкале нарушений при болезни Альцгеймера – когнитивной подшкале (ADAS-соg) и шкале общего впечатления врача о происходящих изменениях, включая информацию лица, осуществляющего уход за больными (CIBIC-плюс). Вторичную эффективность определяли с использованием совместного исследования болезни Альцгеймера – элементарных действий по самообслуживанию (ADCS-ADL) и критериев по психоневрологическому опроснику (NPI).
ADAS-cog включает в себя шкалу из 11 пунктов, которую используют для оценки тяжести выбранных областей когнитивных нарушений (память, речь, ориентация, способность к умозаключениям и практика). Баллы находятся в диапазоне от 0 до 70, более низкие баллы указывают на меньшую тяжесть, а балл 70 представляет наихудшие когнитивные нарушения. Ее использование для оценки и отслеживания изменений у пациентов с болезнью Альцгеймера от легкой до умеренной степени тяжести широко признано. ADAS-cog применяли при каждом посещении клиники, начиная с исходного посещения, и в конце 4, 8, 12, 18 и 24 недели (или при преждевременном прекращении).
CIBIC-плюс представляет собой общую оценку, которую получают посредством независимого подробного опроса пациента и лица, осуществляющего уход за больным, опытным экспертом/клиницистом, которому неизвестны баллы всех других психометрических тестов (после исходного посещения), проведенных как часть этого протокола, и кто иным образом не знаком с пациентом. Баллы 1-3 означают улучшение; балл 4 означает отсутствие изменений (по сравнению с исходной точкой); баллы 5-7 означают ухудшение. Эксперт по CIBIC оценивает тяжесть заболевания в исходной точке. Используя результаты в исходной точке для контроля, эксперт затем опрашивает пациента и лицо, осуществляющее уход за больным, в конце 4, 8, 12, 18 и 24 недели (или при преждевременном прекращении), для получения баллов «впечатления об изменениях». Формат данной шкалы является производным от шкалы совместного исследования болезни Альцгеймера – общего впечатления врача о происходящих изменениях (ADCS-CGIC) (Schneider, L. et al, Alzheimer Dis Assoc Disord. 1997; 11 Suppl 2: S22-32). CIBIC-плюс применяли при каждом посещении клиники, начиная с исходного посещения.
Опросник ADCS-ADL состоит из 23 вопросов, применяемых для измерения функциональных способностей пациентов с деменцией. Эти вопросы выбраны из большого набора 49 вопросов оригинальной шкалы ADL. Более распространенным выбором является выбор 19 вопросов из той же группы 49 вопросов. Каждый пункт ADL содержит серии иерархических подвопросов, выстроенных в порядке от наивысшего уровня независимого выполнения каждой ADL до полной утраты. Общая сумма баллов опросника ADSC-ADL находится в диапазоне от 0 (более низкий функциональный статус) до 78 (более высокий функциональный статус). Более высокий балл указывает на лучший функциональный статус. Опросник заполняют посредством опроса лица, находящегося в близком контакте с пациентом, и он охватывает наиболее обычные и постоянные способности пациента в течение четырех предшествующих недель (Galasko et al., Alzheimer Dis Assoc Disord. 1997; 11 Suppl 2: S33-9). ADCS-ADL применяли при каждом посещения клиники, начиная с исходного посещения.
NPI представляет собой утвержденную шкалу для оценки нарушений поведения у пациентов с деменцией (Cummings et al., Neurology. 1994, 44(12): 2308-14). По ней получают как общий балл (сумму баллов 12 доменов), так и баллы для каждого из подклассов (например, бредовые идеи, галлюцинации, возбуждение/агрессивность, депрессия/дисфория, тревожность, растормаживание, экзальтация/эйфория, апатия/безразличие, раздражительность/лабильность, аберрантная двигательная активность). Для каждой подшкалы измеряют как частоту, так и тяжесть каждого поведения. Общая сумма балов NPI находится в диапазоне от 0 (более высокий функциональный статус) до 144 (более низкий функциональный статус). NPI основан на ответах лица, осуществляющего уход за больным. NPI применяли в исходной точке и в конце 12 и 24 недели (или при преждевременном прекращении).
Через 24 недели было показано статистически значимое улучшение согласно ADAS-cog, CIBIC-плюс и общим критериям NPI.
Определения
«Мемантин» обозначает 1-амино-3,5-диметиладамантан или фармацевтически приемлемые соли, такие как гидрохлоридная соль. В соединенных Штатах торговым наименованием для мемантина является Наменда®, в Германии – Акатинол, а в Европейском Союзе Аксура и Эбикса. Мемантин является объектом патентов США  4122193 и 4273774. 4122193 и 4273774.
Можно использовать различные соли и изомеры (включая стереоизомеры и энантиомеры) мемантина. Термин «соли» может включать в себя кислотно-аддитивные соли или аддитивные соли свободных оснований. Примеры кислот, которые можно использовать для получения фармацевтически приемлемых кислотно-аддитивных солей, включают в себя неорганические кислоты, такие как соляная, серная или фосфорная кислота, и органические кислоты, такие как уксусная, малеиновая, янтарная или лимонная кислота, и т.д. Все эти соли (или другие подобные соли) могут быть получены общепринятыми способами. Природа соли не является критичной, при условии что она является нетоксичной и в основном не мешает желаемой фармакологической активности. Предпочтительной солью для способа по настоящему изобретению является гидрохлоридная соль.
Фраза «фармацевтически приемлемый», как используется в связи с композициями по изобретению, относится к активным молекулам и другим ингредиентам таких композиций, которые являются физиологически переносимыми и, как правило, не вызывают неблагоприятных реакций (токсичности или побочных эффектов) при введении млекопитающему (например, человеку). Предпочтительно, как используется в данном описании, термин «фармацевтически приемлемый» означает одобренный контрольным органом федерального или государственного правительства или перечисленный в фармакопее США или другой общепризнанной фармакопее для использования для млекопитающих, и более конкретно, для человека.
Термин «носитель», применяемый к фармацевтическим композициям по изобретению, относится к растворителю, эксципиенту или связующему, с которым вводят активное соединение (например, производное 1-аминоциклогексана). Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода, солевые растворы, водные растворы глюкозы, водные растворы глицерина, и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Подходящие фармацевтические носители описаны в “Remington’s Pharmaceutical Sciences” by E.W.Martin, 18th Edition.
Термин «пациент» или «нуждающийся в этом субъект», как используется в данном описании, относится к млекопитающему. В частности, термин относится к людям с диагнозом AD от легкой до умеренной степени тяжести. В частности, термин относится к людям с диагнозом AD от легкой до умеренной степени тяжести, для которых показано также снижение интенсивности метаболизма глюкозы (GMR) по сравнению с индивидуумами без AD.
«Сенильную деменцию типа Альцгеймера от легкой до умеренной степени тяжести» (SDAT) или болезнь Альцгеймера от легкой до умеренной степени тяжести можно диагностически оценить как «вероятную болезнь Альцгеймера» согласно критериям Национального института неврологических и коммуникативных нарушений и инсульта и Ассоциации болезни Альцгеймера и родственных нарушений (NINCDS-ADRDA), описанным выше и в примерах ниже. Критерии NINCDS-ADRDA для вероятной болезни Альцгеймера приведены в примере 1.
Диагноз «от легкой до умеренной степени тяжести» полностью находится в компетенции обычного специалиста в области терапии при использовании стандартных критериев, включая клиническую оценку по шкалам, описанным выше и ниже. В качестве примера использовали следующие области числовых значений на стандартизованной краткой шкале оценки психического статуса (MMSE; шкала 0-30) для диагноза болезни Альцгеймера от легкой до умеренной, умеренной и от умеренной до тяжелой степени тяжести.
AD от легкой до умеренной степени тяжести диагностировали как определяемую по баллам MMSE 10-22 в настоящем исследовании, а также от 10-26 в исследованиях с использованием других лекарственных средств для лечения болезни Альцгеймера от легкой до умеренной степени тяжести (например, донепезила). Болезнь Альцгеймера от умеренной до тяжелой степени тяжести диагностировали у субъектов с баллами MMSE от 3 до 14, или от 5 до 14.
Соответственно, диагноз «легкая» болезнь Альцгеймера можно поставить для субъектов, обладающих более высокими баллами в описанных выше диапазонах, например, приблизительно 15-26 по MMSE, предпочтительно приблизительно 15-22. Легкую болезнь Альцгеймера диагностировали также в диапазоне по MMSE 18-22.
Вышеуказанному противопоставляют тяжелую болезнь Альцгеймера, которую определяют баллами 5-9 по MMSE. Тяжелую болезнь Альцгеймера диагностируют также по баллу MMSE меньше 10.
Следует отметить, что шкала MMSE является не единственным способом диагностировать легкую болезнь Альцгеймера, однако, является удобной. При этом не следует рассматривать формулу изобретения как требующую проведения стадии «определения балла» для пациента по шкале MMSE. Таким образом, пациентом с легкой болезнью Альцгеймера является пациент, обладающий баллом 15 или выше при оценке пациента по шкале MMSE. При использовании другой шкалы «легкую» AD определяют как диагноз AD или вероятную AD на основании баллов, которые четко не перекрываются с диапазоном баллов для AD от умеренной до тяжелой степени тяжести, установленным для той же самой шкалы.
Термин «лечение» используют в данном описании для обозначения ослабления или облегчения по меньшей мере одного симптома заболевания у субъекта. Например, по отношению к деменции термин «лечение» может означать ослабление или облегчение когнитивного нарушения (такого как нарушение памяти и/или ориентации), или нарушения общего функционирования (элементарных действий по самообслуживанию), и/или замедление, или обращение прогрессирующего ухудшения ADL, или когнитивного нарушения у индивидуумов с SDAT от легкой до умеренной степени тяжести.
В значении по настоящему изобретению термин «лечение» означает также ингибирование, т.е. предотвращение или задержку прогрессирования заболевания у пациентов с наличием дополнительных симптомов, связанных с SDAT, таких как, но не ограничиваясь ими, идентифицированные с использованием одного или нескольких из критериев ADAS-cog и CIBIC-плюс, критериев ADCS-ADL или общих критериев NPI, определенных выше. Термин «задержка прогрессирования» используется в данном описании для обозначения более медленного, чем ожидают, развития или задержки ухудшения заболевания у субъекта по сравнению с не подвергавшимся лечению субъектом. Для болезни Альцгеймера это можно определить, например, по получению более медленного, чем ожидают, ухудшения по таким измерениям, как когнитивные показатели, у пациентов, которых лечили, по сравнению с измерениями у пациентов, которых не лечили (которые отображают ожидаемое прогрессирование заболевания). Когнитивные показатели можно измерять с использованием, например, оценочной шкалы нарушений при болезни Альцгеймера – когнитивной подшкалы (ADAS-соg), или совместного исследования болезни Альцгеймера – элементарных действий по самообслуживанию (ADCS-ADL). Например, обычным прогрессированием заболевания у субъектов с легкой болезнью Альцгеймера является увеличение от приблизительно 1 до приблизительно 3 пунктов по ADAS-cog в течение периода времени приблизительно 6 месяцев. Однако прогрессирование заболевания является высоко индивидуальным и зависит также от таких факторов, как исходное состояние пациента. Таким образом, ожидаемый уклон ухудшения будет «более пологим» для пациента, находящегося в хорошей физической форме и обладающего только легким нарушением, чем для пациента, находящегося в худшей физической форме и обладающего более выраженным нарушением, даже если обоих пациентов оценивают как страдающих «легкой» болезнью Альцгеймера. Специалисты в данной области принимают это во внимание.
В конкретном варианте осуществления термин «лечение» означает также увеличение интенсивности метаболизма глюкозы, или ингибирование дальнейшего снижения интенсивности метаболизма в кортикальных и субкортикальных областях мозга у пациентов с AD от легкой до умеренной степени тяжести, связанного с регрессией. Это можно оценивать также сравнением метаболизма глюкозы у подвергавшихся лечению пациентов с метаболизмом у не подвергавшихся лечению пациентов. Уменьшение снижения метаболизма глюкозы у подвергавшихся лечению пациентов или более медленное, чем ожидали, снижение или стабильность метаболизма глюкозы у подвергавшихся лечению пациентов по сравнению с не подвергавшимися лечению пациентами является признаком благоприятного действия, сопровождающего лечение. Это можно определять, например, по сканограммам позитронно-эмиссионной томографии (PET) или по вычислениям, например, посредством совмещения со стандартной матрицей отображения поверхности и статистического определения с использованием статистического параметрического картирования. Однако для оценки изменений метаболизма глюкозы можно использовать любой известный в данной области техники способ, включая высокоразрешающий MRI.
Термин «профилактическое лечение» означает также профилактическое применение мемантина для субъекта для предотвращения поведения или событий, связанных с SDAT при AD от легкой до умеренной степени тяжести. Субъекты, страдающие AD или подверженные риску развития AD, такие как субъекты с наследственным характером AD, можно идентифицировать диагностическими или прогностическими анализами согласно общепринятому опыту в данной области. В конкретном варианте осуществления термин «профилактическое лечение» относится к ингибированию (т.е. предупреждению, отсрочке или облегчению) снижения метаболизма глюкозы в кортикальных и субкортикальных областях мозга индивидуумов с AD от легкой до умеренной степени тяжести или индивидуумов с присутствием данного симптома, иным образом не удовлетворяющих критериям для окончательного или даже предварительного диагноза AD.
Термин «терапевтически эффективное количество» используется в данном описании для обозначения количества или дозы мемантина, эффективного для облегчения, отсрочки или предупреждения симптома, поведения или события, связанного с SDAT у пациентов с AD от легкой до умеренной степени тяжести. Альтернативно, терапевтически эффективное количество является достаточным, чтобы вызывать улучшение клинически значимого состояния или параметра (согласно лечащему врачу, применяющему один или несколько вышеупомянутых наборов критериев), связанного с SDAT, у нуждающегося в этом индивидуума.
«Отвечающим» обозначают пациента, для которого изменение от исходной точки (посещение 2) до 24 недели по ADAS-cog является меньшим или равным -4. В переводе на CIBIC-плюс отвечающим обозначают пациента, для которого показатель CIBIC-плюс является «заметно улучшенным» или «умеренно улучшенным», или «минимально улучшенным», или «без изменений» на 24 неделе.
«Неблагоприятное событие» (АЕ) определяют согласно терминологии Всемирной Организации Здравоохранения (WHOART, Version 1998/Q4). АЕ, происходящее во время периода двойного слепого лечения, считают вызванным лечением АЕ (ТЕАЕ), если оно не присутствовало перед началом лечения по двойному слепому исследованию, или если оно присутствовало перед началом лечения по двойному слепому исследованию, однако. его тяжесть увеличилась во время периода двойного слепого лечения. АЕ, произошедшее более чем через 30 суток после даты последнего лечения по двойному слепому исследованию (дата начала АЕ – дата последнего лечения по двойному слепому исследованию >30), не считают ТЕАЕ. «Серьезное неблагоприятное событие» (SAE) представляет собой событие, приводящее к смерти, представляет собой непосредственную угрозу для жизни, требует госпитализации пациента или приводит к стабильной или значительной инвалидности/нетрудоспособности.
«Кортикальные» и «субкортикальные» области мозга включают в себя, но не ограничиваются ими, орбитальную область коры головного мозга; заднюю часть поясной области; ретроспленальную и заднюю парагиппокампальную извилину; верхнюю височную извилину; зрительные области коры головного мозга;
дорсолатеральную префронтальную область коры головного мозга;
задний таламус; кору мозжечка; правый полюс височной доли и среднюю височную извилину; правый средний таламус; левую скорлупу; правую верхнюю париетальную и правую премоторную области коры головного мозга, левую двигательную зону коры головного мозга; правый островок; лимбические структуры, такие как боковые миндалины, орбитальную область коры головного мозга; границу между парагиппокампальной извилиной и средней веретенообразной извилиной; переднюю височную долю; переднюю и заднюю системы контроля внимания; премоторную область, нижнюю теменную область (связанную с речью), область верхушки пирамиды височной кости; орбитальную и дорсальную префронтальные области коры головного мозга.
Термины «билатеральный» или «билатерально» означают, что включают обе стороны мозга, или их области, тогда как термин «унилатеральный» или «унилатерально» относится только к одной стороне мозга.
«FDG PET» обозначает компьютерное изображение, применяемое для количественной оценки изменений метаболической активности тканей организма.
«Интенсивность метаболизма глюкозы (GMR)» обозначает, как быстро происходит метаболизм глюкозы в мозге. Мозг соответствует приблизительно 2% общей массы тела, однако, отвечает за 20% общей утилизации кислорода в организме и 65% потребности организма в глюкозе (Lundgren (ed.) Acute neuroscience nursing: concepts and care. Boston: Jones & Bartlett, 1986). Различные структуры мозга обладают различными метаболическими потребностями. Серое вещество мозга, в частности, лобных долей, обладает наивысшими метаболическими потребностями. Интенсивность метаболизма затылочной, теменной и височных долей вместе с базальным ядром и мозжечком более низкая. Ствол мозга обладает самой низкой метаболической потребностью.
Термины «приблизительно» и «около», как правило, означают приемлемую степень ошибки или разброса для измеряемого количества, полученные в результате характера или точности измерений. Как правило, степень ошибки или разброса лежит в пределах 20 процентов (%), предпочтительно, в пределах 10% и более предпочтительно, в пределах 5% от данного значения или диапазона значений. Численные величины, приведенные в данном описании, являются приблизительными, если не указано иначе, что означает, что термин «приблизительно» или «около» можно подразумевать, когда он не указан прямо.
Составление, дозирование и введение
Мемантин (NAMENDA®) является коммерчески доступным в виде гидрохлоридной соли. Согласно настоящему изобретению лекарственная форма мемантина может представлять собой твердый, полутвердый или жидкий состав. Составление мемантина в полутвердой или жидкой форме известно в данной области, поскольку активный ингредиент является высокорастворимым в водной среде. Обычно активное вещество, т.е. мемантин, будет составлять между 0,1 и 99% по массе состава, более конкретно, между 0,5 и 20% по массе для составов, предназначенных для инъекции, и между 0,2 и 50% по массе для составов, подходящих для перорального введения.
Фармацевтический состав содержит активные ингредиенты, необязательно, в сочетании с фармацевтически приемлемыми адъювантами, растворителями, эксципиентами и/или инертными носителями.
Для получения фармацевтических составов комбинации по изобретению в форме единиц дозирования для перорального применения выбранные соединения можно смешивать с твердым эксципиентом, например, лактозой, сахарозой, сорбитом, маннитом, крахмалами, такими как картофельный крахмал, кукурузный крахмал или амилопектин, производными целлюлозы, связующим, таким как желатин или поливинилпирролидон, дезинтегрирующими средствами, например, натриевым гликолятом крахмала, перекрестно-сшитым PVP, кросс-кармеллозой натрия и скользящими веществами, такими как стеарат магния, стеарат кальция, полиэтиленгликоль, воски, парафин и т.п., и затем прессовать в таблетки. Если требуются таблетки с покрытием, сердцевины, полученные как описано выше, можно покрывать концентрированным раствором сахара, который может содержать, например, гуммиарабик, желатин, тальк, диоксид титана и т.п. Альтернативно, таблетки могут быть покрыты полимером, известным специалисту в данной области, где полимер растворяют в легколетучем органическом растворителе или смеси органических растворителей. К этим покрытиям можно добавлять красители, чтобы легко различать таблетки, содержащие различные активные вещества или различные количества активных соединений.
Для составления мягких желатиновых капсул активные вещества можно смешивать, например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы активных веществ с использованием либо вышеупомянутых эксципиентов для таблеток, например, лактозы, сахарозы, сорбита, маннита, крахмалов (например, картофельного крахмала, кукурузного крахмала или амилопектина), производных целлюлозы, либо желатина. Можно также наполнять твердые желатиновые капсулы жидким или полутвердым лекарственным средством.
Стандартную лекарственную форму для перорального введения можно получать, например, в блистерной упаковке. Таблетки мемантина доступны в блистерных упаковках по 50 или 100 таблеток.
Лекарственные формы для ректального применения могут представлять собой растворы или суспензии или их можно получать в форме суппозиториев, содержащих активные вещества в смеси с нейтральной жировой основой, или желатиновых ректальных капсул, содержащих активные вещества в смеси с растительным маслом или вазелиновым маслом. Жидкие составы для перорального применения могут быть в форме сиропов или суспензий, например, растворов, содержащих от приблизительно 0,2% до приблизительно 20% по массе описанных здесь активных веществ, где остаток представляет собой сахар и смесь этанола, воды, глицерина и пропиленгликоля. Необязательно, такие жидкие составы могут содержать окрашивающие вещества, вкусовые вещества, сахарин и карбоксиметилцеллюлозу в качестве загустителя или другие эксципиенты, известные специалистам в данной области.
Растворы для парентерального применения посредством инъекции можно получить в виде водного раствора водорастворимой фармацевтически приемлемой соли активных веществ, предпочтительно в концентрации от приблизительно 0,5% до приблизительно 10% по массе. Эти растворы могут содержать также стабилизаторы и/или буферные вещества и их можно для удобства получать в ампулах с различными единицами дозирования.
Приемлемые ежесуточные дозы мемантина для терапевтического лечения людей составляют приблизительно 0,01-10 мг/кг массы тела для перорального введения и 0,001-10 мг/кг массы тела для парентерального введения.
В одном из вариантов осуществления покрытые пленкой таблетки по 5 или 10 мг вводят дважды в сутки для диапазона дозирования 10-40 мг/сутки. Однако могут быть введены и были введены низкие и более высокие дозы в диапазоне 5-100 мг/сутки и в более широком диапазоне 5-150 мг/сутки.
В предпочтительном варианте осуществления мемантин вводят в диапазоне от приблизительно 5 мг до приблизительно 100 мг в сутки, предпочтительно от приблизительно 10 до приблизительно 40 мг в сутки, более предпочтительно приблизительно 20 мг/сутки.
Однако для любой фармацевтической композиции, применяемой в способе по изобретению, терапевтически эффективную дозу можно первоначально определить по модели на животных для достижения диапазона циркулирующей в плазме концентрации, включающего IC50 (т.е. концентрацию тестируемого соединения, обеспечивающую половину максимального ингибирования активности рецептора NMDA в соответствующих областях мозга). Кривые зависимости «доза-эффект», выведенные из систем на животных, затем используют для определения тестируемых доз для начальных клинических исследований у человека. При определении безопасности каждой композиции доза и частота введения должны превышать дозу и частоту, предполагаемые для использования в клиническом испытании, или равняться им.
Другими факторами, которые надо учитывать, являются способ введения, состояние пациента или рассматриваемого животного, такое как возраст, масса тела, пол, чувствительность, питание, период введения, применяемые в сочетании лекарственные средства, тяжесть заболевания. Подходящие дозу и время введения в конкретных условиях можно определить по тесту, основанному на описанных выше показателях, но их можно уточнить и принять окончательное решение согласно суждению специалиста-практика и обстоятельствам для каждого пациента (возраст, общее состояние, тяжесть симптомов, пол, и т.д.) по общепринятым клиническим способам.
Токсичность и терапевтическую эффективность композиции по изобретению можно определить стандартными фармацевтическими способами у экспериментальных животных, например, определением LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной для 50% популяции). Отношение дозы терапевтического эффекта к дозе токсического эффекта представляет собой терапевтический индекс и его можно выразить в виде отношения ED50/LD50. Предпочтительными являются композиции, обладающие более высокими терапевтическими индексами.
Продолжительность лечения может быть краткосрочной, например, несколько недель (например, 10-14 недель), или долговременной, пока лечащий врач не сочтет, что дальнейшее введение не является необходимым для получения пользы.
ПРИМЕРЫ
Изобретение описано также конкретными примерами. Однако применение таких примеров является только иллюстративным и никоим образом не ограничивает объем и значение изобретения или любого представленного в качестве примера термина. Подобным образом, изобретение не является ограниченным какими-либо конкретными предпочтительными вариантами осуществления, описанными здесь. Действительно, многие модификации и варианты по изобретению будут очевидны специалистам в данной области при чтении данного описания и могут быть осуществлены без отклонения от сущности и объема изобретения. Таким образом, изобретение является ограниченным только терминами прилагаемой формулы изобретения с полным объемом эквивалентов того, что названо в формуле изобретения.
ПРИМЕР 1: РАНДОМИЗИРОВАННОЕ, КОНТРОЛИРУЕМОЕ ПЛАЦЕБО ДВОЙНОЕ СЛЕПОЕ ИССЛЕДОВАНИЕ МЕМАНТИНА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕИМЕРА ОТ ЛЕГКОЙ ДО УМЕРЕННОЙ СТЕПЕНИ ТЯЖЕСТИ
Исследование состояло из 1-2 недель односторонне-слепого лечения плацебо с последующими 24 неделями двойного слепого лечения. Результаты оценивали в течение семи посещений клиники; при начальном отборе, в исходной точке и в конце недель 4, 8, 12, 18 и 24.
Группа пациентов и диагноз. Группа для исследования состояла из амбулаторных пациентов в возрасте по меньшей мере 50 лет и с диагнозом вероятной AD при отборе согласно критериям NINCDS-ADRDA. Эти критерии состояли в следующем:
– деменция, определенная по клиническому осмотру и по MMSE и дополнительно подтвержденная неврологическими тестами
– расстройство 2 или более познавательных областей
– прогрессивное ухудшение памяти и других когнитивных функций
– отсутствие нарушений сознания
– начало в возрасте 40-90
– отсутствие системных заболеваний, таких как сердечно-сосудистые заболевания, которые могут объяснять когнитивные изменения.
Вспомогательные критерии включают в себя:
– прогрессирующее ухудшение конкретных когнитивных функций, таких как речь, двигательные навыки и восприятие (афазия, апраксия, агнозия, соответственно).
– нарушение элементарных действий по самообслуживанию
– генетическая предрасположенность к заболеванию, в частности, документированная невропатологически.
– лабораторные результаты: нормальная люмбальная пункция, EEG и доказательство церебральной атрофии по СТ или MRI.
Клинические признаки могут включать в себя также:
– плато в течение болезни
– сопутствующие симптомы: депрессию, бессонницу, несдержанность, бредовые идеи, ошибочное восприятие, галлюцинации, катастрофические вербальные, эмоциональные или физические вспышки, сексуальные расстройства и потерю массы;
– увеличенный моторный тонус, миоклонию или нарушение походки
– судороги
– нормальную для возраста СТ.
Эти критерии включают в себя также опросники, например, по шкале Хачински (Rosen et al., Ann Neurol. 1980; 7(5): 486-8 – ишемия,  4), по шкале Монтгомери и Асбурга для оценки депрессии (MADRS – <22 при отборе) и по MMSE, описанные ниже. В течение 12 месяцев от внесения в списки проводили также подтверждающие сканирования СТ или MR. Перед началом получали информированное согласие от пациента, лица, осуществляющего уход за больным, или юридического представителя. При отборе проводили также полный медицинский осмотр и получали образцы крови и мочи. 4), по шкале Монтгомери и Асбурга для оценки депрессии (MADRS – <22 при отборе) и по MMSE, описанные ниже. В течение 12 месяцев от внесения в списки проводили также подтверждающие сканирования СТ или MR. Перед началом получали информированное согласие от пациента, лица, осуществляющего уход за больным, или юридического представителя. При отборе проводили также полный медицинский осмотр и получали образцы крови и мочи.
Группу пациентов, которым вводили по меньшей мере одну дозу мемантина в двойном слепом исследовании и для которых завершили по меньшей мере одну оценку эффективности после исходной точки либо по ADAS-cog, либо по CIBIC-плюс, обозначали группой «предназначенной для лечения» (ITT). Рандомизированную группу пациентов, получивших по меньшей мере одну дозу лекарственного средства в двойном слепом исследовании, обозначали «безопасной группой». Рандомизированная группа обозначала всех пациентов, рандомизированных для исследования.
Группа пациентов и исходные характеристики приведены в таблице 1 ниже:
| Таблица 1 |
| Характеристики при испытании и исходные характеристики (безопасная группа) |
 |
Плацебо |
Мемантин |
Всего |
| Группа, n |
 |
 |
 |
| Рандомизированная) |
202 |
201 |
403 |
Безопасная (с лечением)
В зависимости от назначенного лечения (ITT-группа) |
202 |
201 |
403 |
 |
 |
 |
| 198 |
196 |
394 |
| Исключение, % Всего |
17,30% |
17,90% |
17,60% |
| Исключение из-за АЕ |
5,0% |
9,50% |
7,20% |
| Возраст (лет) |
 |
 |
 |
| Средний |
77 |
78 |
77,5 |
| Медианный |
78 |
79 |
79 |
| Диапазон |
51-95 |
53-92 |
51-95 |
| Исходный MMSE |
 |
 |
 |
 22 22 |
 |
 |
 |
| Средний |
17,2 |
17,4 |
17,3 |
 14, n 14, n |
49 |
50 |
99 |
| >14, n |
153 |
151 |
304 |
Воздействия
Пациентов направляли на двойное слепое лечение на 24 недели с предварительным вводным односторонне-слепым периодом плацебо в течение 7-14 суток. Вводный период имел место единственно для цели достижения согласования. Пациентов рандомизировали по группам мемантина или плацебо в перемещаемых блоках по четверо согласно списку рандомизации. При начальном посещении пациентам последовательно назначали рандомизационные коды. В течение испытания индивидуальный рандомизационный код пациента не сообщали. Коды лечения открывали в конце исследования после закрытия базы данных.
Данное исследование проводили как исследование с фиксированной дозой. Всем пациентам, записанным в группу мемантина, вводили начальную дозу 5 мг в сутки; дозу титровали с возрастанием по 5 мг в неделю до конечной дозы 20 мг/сутки (вводимой в виде двух таблеток по 5 мг дважды в сутки). Лекарственное средство для исследования предоставляли в блистерных упаковках, содержащих замаскированное лекарственное средство для исследования, так что таблетки плацебо и мемантина были визуально одинаковыми, и все пациенты ежесуточно получали четыре таблетки лекарственного средства по исследованию (в сочетаниях таблеток мемантина по 5 мг и соответствующих таблеток плацебо). Временное уточнение дозы проводили между неделями 3 и 8 для пациентов, претерпевающих дозолимитирующие нежелательные явления. Однако всем пациентам было необходимо вводить намеченную дозу 20 мг/сутки к концу 8 недели. Для пациентов, не способных переносить намеченную дозу к 8 неделе, исследование прекращали.
Группе пациентов не вводили другой антагонист рецептора NMDA в качестве сопутствующего лекарственного средства.
Статистический анализ. Для первичных измерений эффективности (например, изменения от исходной точки (посещение 2) до 24 недели по общим баллам ADAS-cog для группы ITT) проводили сравнение между мемантином и плацебо с использованием двухфакторного анализа ковариаций (ANCOVA) с группой воздействия и центром в качестве двух факторов, и исходных баллов в качестве ковариаций. На 24 неделе применяли как способ переноса последнего измерения вперед (LOCF) для подстановки при отсутствии данных, так и способ анализ наблюдаемых случаев (ОС).
Показатели по CIBIC-плюс анализировали с использованием теста СМН, контролируемого для центра исследований (всего 35 центров). Описательную статистику рассчитывали при посещении.
Для вторичных измерений эффективности проводили сравнение между мемантином и плацебо с использованием двухфакторного анализа ковариаций (ANCOVA) с группой воздействия и центром в качестве двух основных эффектов, и исходных баллов в качестве ковариаций. Описательную статистику рассчитывали при посещении. Все анализы и в этом случае проводили с использованием как способа переноса последнего измерения вперед (LOCF) для подстановки при отсутствии данных, так и способа анализ наблюдаемых случаев (ОС).
Результаты ANCOVA суммировали с использованием средних наименьших квадратов (LS) для каждой группы лечения с соответствующей стандартной ошибкой (SE), разницы между курсами лечения (2-24 недели) по средним наименьшим квадратам с соответствующими 95% доверительными интервалами, и значение р при сравнении курсов лечения соответствует сумме квадратов SAS типа III.
Эффективность. Статистических улучшений параметров первичной эффективности ADAS-org и CIBIC-плюс достигали посредством анализа LOCF для группы ITT, со значением p 0,003 и 0,004, соответственно. См. таблицу 2 ниже:
| Таблица 2 |
| Эффективность на 24 неделе (группа ITT) |
| Анализ LOCF |
Анализ ОС |
 |
Разница* |
значение p |
Разница* |
значение p |
| ADAS-cog |
-1,9 |
0,003 |
-1,1 |
0,130 |
| CIBIC+ |
-0,32 |
0,004 |
-0,26 |
0,030 |
| ACDS-ADL |
0,1 |
0,890 |
0,0 |
0,975 |
| Общий NPI |
-3,5 |
0,011 |
-2,1 |
0,143 |
| *: мемантин минус плацебо, на основании среднего значения для CIBIC+, и среднего значения LS для ADAS-cog, ADL и общего NPI |
Видно, что, как определено по CIBIC-плюс и анализу LOCF для группы ITT, из 196 пациентов, случайно отобранных для мемантина, у 9 обнаружено «заметное улучшение» и у 27 обнаружено «умеренное улучшение» по сравнению с 7 и 21 в группе, случайно отобранной для плацебо (198). Аналогично, у 18 и 1 из группы, получавшей лечение мемантином, обнаружено умеренное ухудшение или заметное ухудшение, соответственно, по сравнению с 34 и 3, соответственно, из группы, получавшей лечение плацебо (данные не представлены). Посредством анализа ОС у 8 пациентов при лечении мемантином обнаружено умеренное улучшение и у 24 обнаружено минимальное улучшение по сравнению с 7 и 19 пациентами, соответственно, в группе, получавшей лечение плацебо. Кроме того, у 1 пациента при лечении мемантином обнаружено заметное ухудшение по сравнению с 3 в группе плацебо, и у 17 пациентов при лечении мемантином по сравнению с 27 пациентами, получавшими лечение плацебо, обнаружено умеренное ухудшение (данные не представлены).
Группу отвечающих по CIBIC-плюс и ADAS-cog сравнивали с не отвечающими для оценки эффекта плацебо. Как показано в таблице 3 ниже, анализы CIBIC-плюс согласно LOCF показали, что 100 пациентов, обозначенных отвечающими, получали плацебо, в то время как 132 получали мемантин, и 97 описанных как «не отвечающие» получали плацебо, в то время как только 64 не отвечающих получали мемантин. Подобные результаты получили в анализах ОС по CIBIC-плюс, где 85 «отвечающих» получали плацебо и 108 получали мемантин, и 81 «не отвечающий» получал плацебо и 56 получали мемантин.
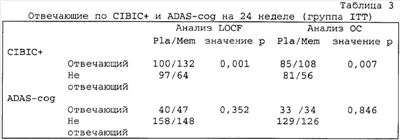
Примечание: Отвечающий по ADAS-cog: изменение от исходной точки по общему ADAS-cog  -4. Отвечающий по CIBIC+: показатели по CIBIC+=1, 2, 3, 4 (отсутствие изменений или улучшение). -4. Отвечающий по CIBIC+: показатели по CIBIC+=1, 2, 3, 4 (отсутствие изменений или улучшение). |
 |
Из пациентов в безопасной группе приблизительно 66% ранее вводили по меньшей мере одно лекарственное средство до данного исследования (никому из пациентов не вводили никаких лекарственных средств против деменции в течение одного месяца перед началом данного исследования). Из них приблизительно 69% пациентов при лечении плацебо и 62% пациентов при лечении мемантином ранее получали лекарственные средства против деменции. Из них приблизительно 65% индивидуумов при лечении плацебо и 59% индивидуумов при лечении мемантином применяли AChEI, такие как донепезил, галантамин или ривастигмин. Эти результаты показали, что мемантин был эффективным для индивидуумов с SDAT от легкой до умеренной степени тяжести, для которых прекращено предыдущее лечение другими лекарственными средствами против деменции, особенно AChEI.
Результаты обнаружили уже на 8 неделе посредством LOCF, когда среднее изменение LS в группе, случайно отобранной для плацебо, измеренное с использованием ADAS-cog, составляло 0,2, а в группе, случайно отобранной для мемантина, составляло -1,2 (значение p 0,003). На 12 неделе среднее LS составляло -0,1 для группы с лечением плацебо и -1,4 для группы с лечением мемантином (р=0,009).
По измерениям ADAS-cog для ОС также обнаружено достоверное улучшение на 8 неделе в группе с лечением мемантином, где среднее LS составляло -1,1 по сравнению с 0,2 для плацебо (р=0,006).
Аналогично для CIBIC-плюс, статистически значимого улучшения в группе с лечением мемантином по сравнению с плацебо достигали на 12 неделе с использованием LOCF и ОС.
Для общего NPI достоверности с использованием LOCF достигали на 24 неделе. Из отдельных критериев NPI три были достоверно лучшими для лечения мемантином по сравнению с группой, получавшей лечение плацебо. Достижение статистической достоверности для общего балла NPI приписывают подпороговому улучшению по нескольким критериям, не только по трем критериям, для которых обнаружены достоверные изменения по отдельности.
Отсутствие обнаружения статистически значимого изменения по ACDS-ADL может быть обусловлено конкретным выбором 23 вопросов или просто фактом, что для данного типа группы пациентов (с AD от легкой до умеренной степени тяжести) еще не наблюдается серьезного ухудшения различных симптомов, которые составляют критерии оценки. В любом случае, предварительная неспособность клинического исследования показать, что мемантин обладает какими-либо дополнительными преимуществами по сравнению с донепезилом у пациентов с AD от легкой до умеренной степени тяжести (особенно после успешности подобного исследования для пациентов с AD от умеренной до тяжелой степени тяжести), будет удерживать специалистов в данной области от использования мемантина для группы с тяжестью от легкой до умеренной.
Каждое из предшествующих соображений и все они вместе делают настоящие клинические результаты неожиданными.
ПРИМЕР 2: ЭФФЕКТЫ МЕМАНТИНА НА МЕТАБОЛИЗМ ГЛЮКОЗЫ В МОЗГЕ ПРИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА ОТ ЛЕГКОЙ ДО УМЕРЕННОЙ СТЕПЕНИ ТЯЖЕСТИ
Методы
Лекарственная терапия. Как указано выше, пациентов рандомизировали для введения 20 мг/сутки (10 дважды в сутки) мемантина или плацебо в течение 24 недель. Проводили сканирования PET для 10 пациентов (5, получающих мемантин и 5, получающих плацебо) в исходной точке и в конце 24 недели.
Сбор данных сканирования PET. Субъектов подвергали сканированию PET в University of California, Irvine Brain Imaging Center с использованием предназначенного для головы сканера GE 2048-15B. Получали тридцать срезов с 6,5-мм интервалами (15 в каждом из двух наборов), чтобы покрыть весь мозг. Проводили коррекцию экранирования получением трансмиссионной сканограммы с использованием игольчатого источника 68Ge. Маску для лица из термоотверждающейся пластмассы использовали, чтобы поддерживать субъекта неподвижно в течение 60 минут полного получения изображения. Сканограммы преобразовывали с помощью пустого и трансмиссионного сканирования. В анализах для исследования использовали количественную оценку изображения PET и корректировали общие интрасубъективные различия с использованием нормализации (пропорциональная шкала).
Методы получения и анализа изображения PET. Различия в местном поглощении FDG анализировали с использованием программного обеспечения SPM99 (Wellcome Department of Cognitive Neurology, London, UK), реализованного на платформе Matlab (MathWorks Inc., Sherborn, MA).
Статистическое параметрическое картирование (SPM) представляет собой пространственно расширенные статистические процессы, разработанные для тестирования гипотез о местных специфических эффектах по данным нейроизображений. Статистическое параметрическое картирование сочетает общую линейную модель и теорию случайных полей Гаусса для получения статистических заключений относительно местных эффектов. Изображения пространственно нормализуют с использованием аффинного преобразования с двенадцатью параметрами, определяемыми минимизацией остаточной суммы квадратов между каждым изображением и контрольным или матричным изображением, соответствующим стандартному пространству, определенному Talairach и Tournoux. Исходную матрицу изображений, полученную при разделении плоскостей коррекции 256х256х30 с размером воксела 4,5 мм × 4,5 мм × 6,5 мм, трансформировали и повторно разделяли на слои до разделения плоскостей коррекции до матрицы 79×95×68 с размером воксела 2 мм × 2 мм × 2 мм, более близко соответствующей стандартному анатомическому пространству Talairach, и сглаживали с использованием (5 мм FWHM) изотропной гауссовой функции влияния. Перед статистическими выводами изображения масштабировали до общепринятого стандарта, чтобы учитывать общие разбросы между субъектами с течением времени (пропорциональная шкала).
Для тестирования гипотез относительно местных специфических эффектов состояния определения сравнивали с использованием линейных контрастов. Полученный набор размеров воксела для каждого контраста представляет собой параметрическое картирование по t-статистике, SPM (t), которое трансформировали в единицы нормального распределения SPM(z) с заданными границами p<0,025 без коррекции. Полученные фокусы затем характеризовали в переводе на высоту пика (u). Достоверность для каждой области оценивали на основании вероятности того, что наблюдаемая высота пика могла появиться случайно P(Zmax>u). Поскольку максимальная интенсивность и пространственная протяженность области выше u не являются независимыми, простая коррекция «по Бонферрони» для множественных сравнений является неприемлемой. Соответственно, для поправки на множественные сравнения проводили определение порога пространственной протяженности для 10 вокселов на основании теории случайных полей Гаусса.
Анатомическую локализацию значимых областей осуществляли посредством сравнения с атласом Talaraich и Tournoux с подтверждением специалистом по анатомии нервной системы, не осведомленным о распределении по группам. Координаты Talairach и Tournoux приведены в скобках после соответствующих областей мозга. Следует отметить, однако, что существующая технология получения изображений PET не позволяет точной анатомической локализации до конкретных субкортикальных ядер и сублобулярных кортикальных областей. В некоторых способах применяли совместную регистрацию в пределах отдельных матриц MRI для помощи в верификации анатомической локализации. В настоящем исследовании такие матрицы не были доступны. Интерпретация не осведомленным специалистом по анатомии нервной системы помогала в анатомической верификации посредством применения динамической интерпретации контуров мозга на основании известных анатомических структур и последующих изменений в местном метаболизме между соседними срезами.
Задание Снодграсс по названию рисунков. Некоторые исследования семантических способностей при деменции типа Альцгеймера позволяют предполагать, что семантические нарушения могут влиять на конкретные области познания. По настоящему изобретению всех пациентов, подвергавшихся сканированию PET, оценивали во время получения изображений с использованием активационного задания Снодграсс по названию рисунков. Задание во время поглощения FDG использовали для изображения увеличения в гиппокампе и височной доле. Данное активационное задание по названию рисунков Снодграсс было чувствительным к произнесению названий объектов, которое нарушено при AD от легкой до умеренной степени тяжести. Активационное задание по названию рисунков Снодграсс и анализ выполнения частично основаны на скорости идентификации и произнесения названий, соответствующих набору из 260 рисунков (Snodgrass and Vanderwart, J. Experimental Psychology: Human Learning and Memory 1980; 6(2): 174-215). Рисунки представляют собой черно-белые изображения, выполненные согласно набору правил, которые обеспечивают последовательность иллюстрированного представления. Рисунки были стандартизованы по четырем переменным центральной важности для памяти и процесса познания:
Результаты
В условиях плацебо против исходной точки (фигура 1) большинство изменений представляло собой билатеральное снижение GMR на всем протяжении кортикальных и субкортикальных областей. Оно включало в себя билатеральное снижение в орбитальной области коры головного мозга, задней части поясной области, ретроспленальной и задней парагиппокампальной извилины, верхней височной извилины, зрительных областей коры головного мозга, дорсолатеральной префронтальной области коры головного мозга, заднего таламуса и коры мозжечка. Унилатеральное снижение наблюдали в правом полюсе височной доли и височной средней извилины, правом среднем таламусе, левой скорлупе, правой верхней париетальной и правой премоторной области коры головного мозга, левой двигательной зоне коры головного мозга и правом островке. Ограниченное увеличение наблюдали в лимбических структурах, таких как боковая миндалина, орбитальная область коры головного мозга, граница между парагиппокампальной извилиной и средней веретенообразной извилиной, и передняя височная доля.
У пациентов при лечении мемантином (фигура 2) усиление метаболизма наблюдали билатерально на всем протяжении CNS, включая кору головного мозга, мозжечок и ствол мозга. В коре головного мозга более сильное увеличение обнаружили в правом полушарии, так же как билатерально в орбитальной области коры головного мозга, зрительных областях коры головного мозга, верхней и нижней париетальных областях коры головного мозга, задней части поясной области, ретроспленальной области коры головного мозга и задней парагиппокампальной извилины, средней префронтальной и передней поясной области коры, премоторной области коры и дорсальной префронтальной области коры. Субкортикальное усиление имело место в широкой области левого ядра моста, правой области крыши, области левого субталамического ядра/красного ядра и правой скорлупы. Для отдельной области в левой зрительной области коры головного мозга и левой скорлупе обнаружили снижение метаболизма глюкозы.
Рассматривая активационное задание Снодграсс по названию рисунков, субъекты после лечения мемантином были в состоянии выполнить задачу лучше, чем можно выполнить случайно. Не обнаружили достоверных различий в выполнении задания Снодграсс между двумя группами лечения.
Обсуждение
В данном пилотном исследовании показано, что у пациентов, получавших лечение плацебо, как правило, было обнаружено ожидаемое снижение метаболизма в большинстве кортикальных областей в течение периода 24 недель. Имело место также легкое усиление метаболизма в некоторых лимбических областях (например, в орбитальной области коры головного мозга и в передних структурах височной доли, как показано ранее (Potkin et al., Int J Neuropsychopharmacol. 2001; 4(3): 223-30). В настоящем исследовании обнаружено также некоторое снижение метаболизма в средней затылочной зоне коры головного мозга у пациентов при лечении плацебо. Это противоречит легкому усилению метаболизма в затылочном полюсе, наблюдаемому в предшествующем исследовании авторов настоящего изобретения. Наблюдаемые изменения метаболизма у пациентов при лечении плацебо соответствовали снижению функционирования системы контроля внимания, особенно задней системы контроля внимания (крыши, заднего таламуса, задней части поясной области, верхней теменной дольки и предклинья полушарий головного мозга).
Полностью отличающуюся картину наблюдали у субъектов при лечении мемантином. Как правило, для областей, в которых наблюдали статистически значимое снижение у пациентов при лечении плацебо, наблюдали усиление метаболизма. Эти области усиления метаболизма после мемантина включают в себя кортикальные структуры передней и задней системы контроля внимания, так же как премоторную область, нижнюю париетальную (связанную с речью) область, область верхушки пирамиды височной кости, а также орбитальную и дорсальную префронтальную области коры головного мозга. Кроме того, были обнаружены отдельные области унилатерального усиления в крыше, так же как в базальных ядрах/экстрапирамидальных структурах (ядро моста, область субталамического/красного ядра, скорлупа и мозжечок).
Применение PET для документирования эффектов лечения обладает определенными преимуществами для возможности исследования местных изменений метаболизма мозга с течением времени. Эти измерения обладают преимуществами по сравнению с современными диагностическими измерениями, например, CIBC-плюс и ADAS-cog. Например, CIBIC-плюс зависит от наблюдений лица, осуществляющего уход за больными, и на нее могут влиять различия в компетентности лиц, осуществляющих уход за больными. FDG PET преодолевает некоторые из этих ограничений.
Кроме того, все субъекты были способны выполнить активационное задание Снодграсс по названию рисунков лучше, чем можно выполнить случайно; таким образом, испытание не страдает от эффектов пола или потолка, в отличие от многих тестов памяти. Данное свойство способа тестирования предохраняет от вялости мотивации и уныния как факторов, мешающих выполнению. Не обнаружили достоверных отличий в выполнении задания Снодграсс; таким образом, выполнение не объясняет наблюдаемых результатов.
Мемантин, неконкурентный антагонист NMDA, эффективность которого показана для пациентов с AD от умеренной до тяжелой степени тяжести, является эффективным также для лечения AD от легкой до умеренной степени тяжести и может обращать ожидаемые метаболические изменения, связанные с регрессией AD.
Формула изобретения
1. Способ лечения болезни Альцгеймера от легкой до умеренной степени тяжести, заключающийся во введении нуждающемуся в этом субъекту эффективного количества мемантина или его фармацевтически приемлемой соли, причем мемантин или его фармацевтически приемлемую соль вводят в начальной дозе 5 мг в сутки с увеличением на 5 мг в сутки каждую неделю до конечной дозы 20 мг в сутки.
2. Способ лечения болезни Альцгеймера от легкой до умеренной степени тяжести у субъектов, которых ранее лечили ингибитором ацетилхолинэстеразы (AChEI), где способ заключается во введении нуждающемуся в этом субъекту эффективного количества мемантина или его фармацевтически приемлемой соли.
3. Способ по п.2, где лечение определяют по улучшению или отсутствию ухудшения, или по более медленному, чем ожидали, ухудшению по меньшей мере по одной из оценок, выбранной из группы, состоящей из оценок по оценочной шкале нарушений при болезни Альцгеймера когнитивной подшкале (ADAS-cog), опроснику совместного исследования болезни Альцгеймера – элементарных действий по самообслуживанию (ADCS-ADL) и шкале общего впечатления врача о происходящих изменениях плюс-версии (CIBIC-плюс).
4. Способ по п.2, где мемантин вводят в дозе, лежащей в диапазоне от приблизительно 5 до приблизительно 100 мг/сутки.
5. Способ по п.1, где где доза составляет от приблизительно 10 мг до приблизительно 40 мг/сутки.
6. Способ по п.5, где доза составляет приблизительно 20 мг/сутки (10 мг дважды в сутки).
7. Способ по п.2, в котором заболеванием является болезнь Альцгеймера легкой тяжести.
8. Способ по п.7, где мемантин вводят ежесуточно в дозе, лежащей в диапазоне от приблизительно 5 до приблизительно 100 мг/сутки.
9. Способ по п.8, где доза составляет от приблизительно 10 мг до приблизительно 40 мг/сутки.
10. Способ по п.7, где лечение определяют по улучшению или по уменьшению или остановке ухудшения по меньшей мере по одной из оценок, выбранной из группы, состоящей из оценок по оценочной шкале нарушений при болезни Альцгеймера когнитивной подшкале (ADAS-cog), опроснику совместного исследования болезни Альцгеймера элементарных действий по самообслуживанию (ADCS-ADL) и шкале общего впечатления врача о происходящих изменениях плюс-версии (CIBIC-плюс).
РИСУНКИ
|
|