|
(21), (22) Заявка: 2008115703/28, 21.04.2008
(24) Дата начала отсчета срока действия патента:
21.04.2008
(46) Опубликовано: 20.08.2009
(56) Список документов, цитированных в отчете о
поиске:
RU 2250456 C1, 20.04.2005. DE 4025426 A1, 13.02.1992. DE 4025425 A1, 13.02.1992. Higa M. A novel measurement method of Donnan potential at an interface between a charged membrane and mixed salt solution. J. Membr. Sci. 1998. V.140. p.213-220.
Адрес для переписки:
394006, г.Воронеж, Университетская пл., 1, ГОУ ВПО “Воронежский государственный университет”, Центр коммерциализации технологии (ЦКТ)
|
(72) Автор(ы):
Бобрешова Ольга Владимировна (RU),
Кулинцов Петр Иванович (RU),
Агупова Мария Владимировна (RU),
Паршина Анна Валерьевна (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Воронежский государственный университет” (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ ДОННАНОВСКОГО ПОТЕНЦИАЛА
(57) Реферат:
Изобретение относится к области аналитической химии и мембранных технологий и может быть использовано для потенциометрического определения ионного состава электромембранных систем. Технический результат изобретения заключается в повышении точности и стабильности оценки величины доннановского потенциала. Способ определения доннановского потенциала заключается в измерении ЭДС двухэлектродной ячейки, в которой полоса ионообменной мембраны, подобно солевому мостику, погружена одним концом в раствор, концентрация которого близка к концентрации внутреннего раствора мембраны, а другим – в исследуемый раствор, измерение производится с помощью двух электродов сравнения, контактирующих соответственно с исследуемым и концентрированным растворами, при этом электрохимическая цепь замыкается вдоль мембраны, а диффузия в фазе мембраны и примембранных слоях является бесконечно медленной относительно времени эксперимента. 4 ил.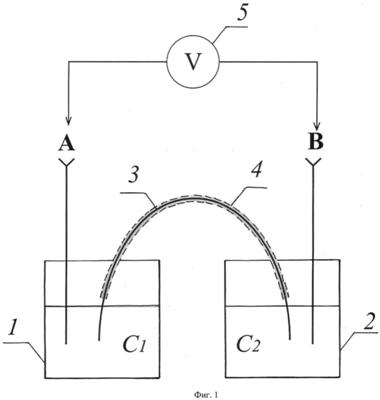
Изобретение относится к области аналитической химии и мембранных технологий. Оно может быть использовано для потенциометрического определения ионного состава электромембранных систем.
Недостатком данного способа явилась диффузия из концентрированного раствора в равновесный, в результате которой регистрируемые значения потенциала начинали изменяться уже через 100 с. В связи со значительным вкладом диффузионных потенциалов в измеряемый суммарный потенциал, данный способ позволял осуществлять только приблизительную оценку доннановского потенциала, отличающуюся низкими точностью и воспроизводимостью.
Заявляемое изобретение предназначено для оценки величины доннановского потенциала на индивидуальной границе исследуемый раствор/ионообменная мембрана при несущественном влиянии диффузионных потенциалов в мембране и в растворе.
Технический результат заключается в повышении точности и стабильности оценки величины доннановского потенциала на индивидуальной границе исследуемый раствор/ионообменная мембрана.
Технический результат достигается тем, что в способе определения доннановского потенциала, заключающемся в измерении ЭДС двухэлектродной ячейки, в которой полоса ионообменной мембраны, подобно солевому мостику, погружена одним концом в раствор, концентрация которого близка к концентрации внутреннего раствора мембраны, а другим – в исследуемый раствор, измерение производится с помощью двух электродов сравнения, контактирующих соответственно с исследуемым и концентрированным растворами, при этом электрохимическая цепь замыкается вдоль мембраны, а диффузия в фазе мембраны и примембранных слоях является бесконечно медленной относительно времени эксперимента.
В данном способе полоса ионообменной мембраны одним концом погружена в раствор, концентрация которого близка к концентрации внутреннего раствора мембраны. Другим концом, уподобляемым датчику в ионоселективном электроде, мембрана погружается в исследуемый раствор. Электрохимическая цепь замыкается вдоль мембраны. Измерение производится с помощью двух электродов сравнения (например, хлорсеребряных), которые контактируют с исследуемым и концентрированным растворами напрямую или посредством солевых мостиков в зависимости от качественного и количественного состава данных растворов. Градиент концентрации в фазе мембраны и примембранных слоях в такой системе стремится к нулю.
Схема ячейки для определения доннановского потенциала по данному способу представлена на фиг.1.
Ячейка состоит из двух стаканчиков 1 и 2 объемом 20 см3, заполненных соответственно исследуемым и концентрированным растворами электролита. Полоса ионообменной мембраны 3 размером 1×10 см одним концом погружена в концентрированный раствор, другим – в исследуемый раствор. Исследуемая мембрана находится в полиэтиленовой пленке 4, предохраняющей ее от пересыхания. Измерение производится с использованием двух хлорсеребряных электродов А, В, которые включаются в цепь с высокоомным вольтметром 5.
Способ реализуется следующим образом. Полоска исследуемой ионообменной мембраны, изначально приведенная в равновесие с исследуемым раствором электролита С1, одним концом опускается в этот раствор, а другим – в концентрированный раствор С2, концентрация которого близка к концентрации внутреннего раствора мембраны. Электроды А и В помещаются соответственно в растворы C1 и С2 или контактируют с ними посредством солевых мостиков в зависимости от качественного и количественного состава данных растворов. Через 10-15 минут фиксируют значение потенциала, которое остается постоянным в течение нескольких часов.
Электрохимическая цепь для определения доннановской разности потенциалов имеет вид:
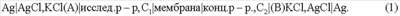
Общая ЭДС такой цепи складывается из разности потенциалов на каждой межфазной границе:
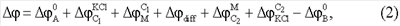
где 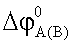 – стандартный потенциал хлорсеребряного электрода А(В); – стандартный потенциал хлорсеребряного электрода А(В);
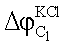 – разность потенциалов на границе насыщенный раствор КСl/исследуемый раствор C1; – разность потенциалов на границе насыщенный раствор КСl/исследуемый раствор C1;
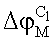 – разность потенциалов на границе исследуемый раствор C1/мембрана; – разность потенциалов на границе исследуемый раствор C1/мембрана;
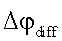 – диффузионный потенциал в фазе мембраны; – диффузионный потенциал в фазе мембраны;
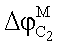 – разность потенциалов на границе мембрана/концентрированный раствор С2; – разность потенциалов на границе мембрана/концентрированный раствор С2;
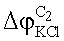 – разность потенциалов на границе концентрированный раствор С2/насыщенный раствор KCl. – разность потенциалов на границе концентрированный раствор С2/насыщенный раствор KCl.
Рассмотрим подробно вклады скачков потенциала на отдельных границах в общую ЭДС цепи (1).
1. Для измерений используют хлорсеребряные электроды с равными стандартными потенциалами, поэтому потенциалы электродов А и В в цепи (1) точно компенсируют друг друга.
Потенциалы жидкостного соединения на границах насыщенного раствора хлорида калия электродов А, В с рабочими растворами рассчитываются по уравнению Гендерсона [2]. В случае, если диффузионные потенциалы не соизмеримы с погрешностью эксперимента, в систему вводятся солевые мостики, соединяющие электроды А, В с рабочими растворами. Состав солевых мостиков подбирается таким образом, чтобы суммарный вклад в ЭДС цепи (1) диффузионных потенциалов на их границах был минимален.
2. Близость к нулю разности потенциалов на границе мембрана/концентрированный раствор электролита достигается одним порядком концентраций внутреннего раствора мембраны и внешнего раствора С2. Концентрация раствора С2 может составлять 1-3 моль/л, в зависимости от обменной емкости мембраны и типа электролита.
3. Предполагается, что в области исследуемых концентраций соотношение Доннана остается справедливым, то есть селективность ионообменной мембраны близка к идеальной и исключает проникновение коионов в фазу мембраны. Время диффузии ионов из концентрированного раствора вдоль мембраны является на порядки меньшим времени эксперимента. Экспериментально показано, что измеряемый суммарный потенциал в системе устанавливается 10-15 минут и остается постоянным в течение нескольких часов.
То есть электрохимическая цепь заявляемого способа построена таким образом, что вклады скачков потенциала в общую ЭДС цепи (1) на всех границах, кроме доннановского потенциала на границе исследуемый раствор/мембрана, либо пренебрежимо малы, либо компенсируют друг друга.
ПРИМЕР 1
Для тестирования заявляемого способа исследованы системы с перфторированными сульфокатионитовыми мембранами МФ-4СК и водными растворами хлорида калия, в которых должна выполняться логарифмическая зависимость доннановского потенциала от концентрации противоиона в растворе.
Образцы перфторированных сульфокатионитовых мембран МФ-4СК размером 1×10 см приводят в равновесие с растворами хлорида калия. Концентрация KCl в исследуемых растворах варьировалась в интервале от 0,001 до 0,050 моль/л.
Соответственно схеме, представленной на фиг.1, полосы исследуемых мембран в ПЭ кожухе одним концом опускают в исследуемый раствор KCl С1, а другим – в 1 М раствор KCl С2. Хлорсеребряные электроды А, В помещают соответственно в растворы C1, С2 и включают в цепь с вольтметром 5. Через 15 минут фиксируют значение потенциала, которое остается постоянным в течение нескольких часов.
На фиг.2 представлены концентрационные зависимости 1, 2, 3 доннановского потенциала в системах KCl/МФ-4СК с мембранами обменной емкостью 0,6; 0,9; 1,1 ммоль/г соответственно. Зависимости доннановского потенциала от концентрации противоиона в растворе являются логарифмическими с достоверностью аппроксимации 0,9.
На основании полученных данных рассчитаны значения обменной емкости исследуемых мембран. Полученные результаты сопоставлены со стандартными методиками. В таблице на фиг.4 представлены значения обменной емкости для пяти мембран МФ-4СК, определенной по стандартной методике 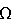 ст и по данным доннановского потенциала ст и по данным доннановского потенциала 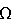 . Точность, чувствительность, правильность метода составили соответственно 3%, 0,02 ммоль/г, 0,04 ммоль/г. . Точность, чувствительность, правильность метода составили соответственно 3%, 0,02 ммоль/г, 0,04 ммоль/г.
ПРИМЕР 2
Образцы перфторированных сульфокатионитовых мембран МФ-4СК размером 1×10 см приводят в равновесие с растворами моногидрохлорида лизина. Концентрация LysHCl в исследуемых растворах варьировалась в интервале от 0,001 до 0,100 моль/л.
Соответственно схеме, представленной на фиг.1, полосы исследуемых мембран в ПЭ кожухе одним концом опускают в исследуемый раствор LysHCl C1, а другим – в 1 М раствор LysHCl С2.
Хлорсеребряные электроды А и В контактируют с исследуемым и концентрированным растворами посредством солевых мостиков 0,001 моль/л LysHCl и 0,100 моль/л LysHCl.
На фиг.3 представлены концентрационные зависимости 1, 2 доннановского потенциала в системах LysHCl/MФ-4CK с мембранами обменной емкостью 0,9; 1,1 ммоль/г соответственно. Логарифмический вид зависимостей доннановского потенциала от концентрации LysHCl сохраняется с достоверностью аппроксимации 0,9. Стабильная логарифмическая функция в диапазоне исследуемых концентраций позволяет использовать заявляемый способ для потенциометрического определения ионного состава растворов моногидрохлорида лизина методом градуировочного графика.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Гельферих Ф. На рисунке 2 Иониты. Основы ионного обмена / Ф.Гельферих. – М.: Изд-во иностр. лит-ры, 1962. – 490 с.
2. Феттер К. Электрохимическая кинетика / К.Феттер. – М.: Химия, 1962. – 856 с.
Формула изобретения
Способ определения доннановского потенциала, заключающийся в измерении ЭДС двухэлектродной ячейки, в которой полоса ионообменной мембраны, подобно солевому мостику, погружена одним концом в раствор, концентрация которого близка к концентрации внутреннего раствора мембраны, а другим – в исследуемый раствор, измерение производится с помощью двух электродов сравнения, контактирующих соответственно с исследуемым и концентрированным растворами, при этом электрохимическая цепь замыкается вдоль мембраны, а диффузия в фазе мембраны и примембранных слоях является бесконечно медленной относительно времени эксперимента.
РИСУНКИ
|