Патент на изобретение №2364600
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) N,N’-ДИФТОРБОРИЛЬНЫЕ КОМПЛЕКСЫ N-(3-АРИЛ-2Н-ИЗОИНДОЛ-1-ИЛ)-N-(3-АРИЛ-1Н-ИЗОИНДОЛ-1-ИЛИДЕН)АМИНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат:
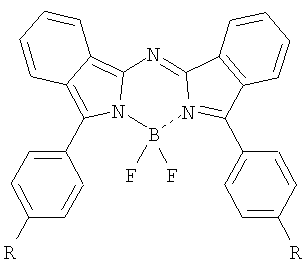
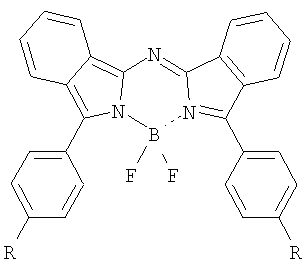
Изобретение относится к новому классу фотосенсибилизаторов для фотодинамической терапии – N,N’-дифторборильным комплексам N-(3-арил-2H-изоиндол-1-ил)-N-(3-арил-1H-изоиндол-1-илиден)аминов общей формулы
где R=H, C1-C4-алкил, OC1-C4-алкил, Ph, Br, а также способу их получения, заключающемуся в обработке соответствующего лиганда эфиратом трехфтористого бора в присутствии вторичного или третичного амина в кипящем бензоле. Описываемые фотосенсибилизаторы обладают высокой фотоиндуцированной активностью и являются перспективными для практического применения в методе фотодинамической терапии. 2 н.п. ф-лы, 2 табл., 1 ил.
Настоящее изобретение относится к химии и химической технологии, а более конкретно – к синтезу представителей нового класса органических соединений, N,N’-дифторборильных комплексов N-(3-арил-2Н-изоиндол-1-ил)-N-(3-арил-1Н-изоиндол-1-илиден)аминов (3,3′-диарилазадиизоиндолилметенов). Эти соединения могут быть использованы, например, в качестве органических красителей и люминофоров, а также как фотосенсибилизаторы для фотодинамической терапии (ФДТ). В предлагаемом изобретении ставится задача синтеза эффективных фотосенсибилизаторов, поглощающих в ближней ИК-области спектра, для их использования в фотодинамической терапии. Поставленная задача решена тем, что синтезирован ряд N,N’-дифторборильных комплексов N-(3-арил-2Н-изоиндол-1-ил)-N-(3-арил-1Н-изоиндол-1-илиден)аминов общей формулы
где R=H, C1-C4-алкил, OC1-C4-алкил, Ph, Br. Указанная задача решается также тем, что предложенные соединения получают обработкой соответствующего лиганда эфиратом трехфтористого бора в присутствии вторичного или третичного амина в кипящем бензоле. Комплексы (I-VI) представляют собой кристаллические порошки от темно-зеленого до черного цвета с металлическим блеском, устойчивы на адсорбентах, вследствие чего протекание реакции можно анализировать методами тонкослойной хроматографии и электронной спектроскопии. В отличие от тетраарилазадипиррометенов, сопряженная система которых содержит цепочку из двух пиррольных колец, хромофорная система молекул предлагаемых соединений характеризуется наличием сопряженной цепочки, построенной из двух остатков изоиндола, связанных друг с другом мостиком из атома азота, и двух фенильных заместителей в изоиндольных циклах. Поэтому в соответствии с длиной сопряженной цепочки диарилазадиизоиндолилметены обладают более глубоким цветом. В электронных спектрах поглощения N,N’-дифторборильных комплексов алкилдипиррометенов длинноволновая полоса находится в области 480-580 нм, а у их азааналогов – тетраарилазадипиррометенов – эта полоса смещена в область 650-690 нм. Спектры поглощения синтезированных дифторборильных комплексов (I-VI) характеризуются узкой длинноволновой полосой высокой интенсивности (lg
Настоящее изобретение иллюстрируется следующими примерами. ПРИМЕР 1. N-(3-Фенил-2Н-изоиндол-1-ил)-N(3-фенил-1Н-изоиндол-1-илиден)амин (VII). 6Н6), N,N’-Дифторборил-N-(3-фенил-2H-изоиндол-1-ил)-N-(3-фенил-1H-изоиндолил-1-илиден)амин (I) получен взаимодействием 0.0001 моля лиганда (VII) с 0.0008 моля BF3·Et2O в присутствии 0.001 моля диизопропиламина в кипящем бензоле (0.41 моля) с выходом 70%, т.пл. 252-254°С. Электронный спектр поглощения (CHCl3), ПРИМЕР 2. N-[3-(4-трет-Бутилфенил)-2H-изоиндол-1-ил]-N-[3-(4-трет-бутилфенил)-1H-изоиндол-1-илиден]амин (VIII) синтезирован из фталонитрила и трет-бутилфенилмагнийбромида с выходом 27% аналогично соединению (VII). Т.пл. 262-264°С. Электронный спектр поглощения (C6H6), ПРИМЕР 3. 6H6), N,N’-Дифторборил-N-[3-(4-анизил)-2H-изоиндол-1-ил]-N-[3-(4-анизил)-1H-изоиндол-1-илиден]амин (III) синтезирован аналогично (II) из лиганда (IX) с BF3·Et2O с выходом 62%, т.пл. 254-255°С. Электронный спектр поглощения (CHCl3), ПРИМЕР 4. N-[3-(4-Бутoкcифeнил)-2H-индоиндол-1-ил]-N-[3-(4-бутоксифенил)-1H-изoиндoл-1-илиден]амин (X) получен из фталонитрила и 4-бутоксифенилмагнийбромида с выходом 12%, т.пл. 209-211°С. Электронный спектр поглощения (C6H6), ПРИМЕР 5. N-[3-(4-Бифенилил)-2H-изоиндол-1-ил]-N-[3-(4-бифенилил)-1H-изоиндол-1-илиден]-амин (XI) синтезирован из фталонитрила и 4-бифенилилмагнийиодида с выходом 12%, т.пл. 320-322°С. Электронный спектр поглощения (C6H6), N,N’-Дифтopбopил-N-[3-(4-бифeнилил)-2H-изoиндoл-1-ил]-N-[3-(4-бифeнилил)-1H-изоиндол-1-илиден]амин (V) синтезирован из лиганда (XI) и BF3·Et2O аналогично (I) с выходом 76%, т.пл. 318-320°С. Электронный спектр поглощения (CHCl3), ПРИМЕР 6. N-[3-(4-Бромфенил)-2H-изоиндол-1-ил]-[3-(4-бромфенил)-1H-изоиндол-1-илиден]-амин (XII) выделен из реакции фталонитрила с 4-бромфенилмагнийбромидом с выходом 25%, т.пл. 280-282°С. Электронный спектр поглощения (C6H6), N,N’-Дифтopбopил-N-[3-[(4-бpoмфeнил)-2H-изoиндoл-1-ил]-N-[3-(4-бpoмфeнил)-1H-изоиндол-1-илиден]амин (VI) синтезирован из лиганда (XII) с выходом 86% аналогично соединению (I), т.пл. 274-276°С. Электронный спектр поглощения (CHCl3), Предлагаемые соединения могут быть также получены с использованием в качестве аминов диэтиламина, триэтиламина, пиридина и 1,8-диазабицикло[5.4.0]-ундецен-7 (ДБУ). ПРИМЕР 7. Фотодинамическая активность комплексов (II) и (III) in vivo. Экспериментальные исследования проводят на мышах-самках линии BDF1 массой 20-22 г. В качестве экспериментальной опухоли используют модель перевиваемой саркомы S-37, привитой подкожно на наружную поверхность бедра нижней конечности. Сенсибилизированную опухоль облучают с помощью терапевтического аппарата для фотодинамической терапии АТО-1 с непрерывным спектром излучения (плотность мощности излучения 220 мВт/см2, плотность дозы 120 Дж/см2). Перед облучением шерсть над опухолью удаляют. Для контроля используют мышей-опухоленосителей, не подвергшихся какому-либо воздействию. Эффективность воздействия оценивают по изменению объема опухоли (Vоп) и рассчитанным исходя из него значениям торможения роста опухоли (ТРО). Изучение in vivo биологической и фотодинамической активности комплекса (II) в водном растворе 4% Проксанола 268 проводят в дозах 1.2 и 6.2 мг/кг, комплекса (III) – в дозах 0.1, 0.5, 1.4 и 6.9 мг/кг. Растворы фотосенсибилизаторов вводят внутривенно, однократно на 6 день роста опухоли за 0.5 и 24 часа до проведения ФДТ. Количество животных в группах – от 4 до 7, продолжительность наблюдения – 20 дней. Результаты испытаний представлены в Табл.2. Комплекс (II) при его внутривенном введении в дозах 1.2 и 6.2 мг/кг в отсутствие облучения не подавляет рост экспериментальной опухоли. При облучении сенсибилизированных опухолей за 0.5 ч до сеанса ФДТ подавления роста опухоли также не отмечено. При проведении ФДТ через 24 ч после введения зарегистрирован биологически значимый антибластический эффект на протяжении всего периода наблюдения. Значения ТРО при дозе 6.2 мг/кг на 15-й день наблюдения составляют 98.5%, при дозе 1.2 мг/кг – 74.9%. Значительная противоопухолевая эффективность ФДТ наблюдается и у комплекса (III), введенного за 0.5 ч до облучения опухоли. Высокие значения ТРО отмечены на протяжении 20 дней наблюдения при использовании его в дозах от 0.1 до 6.9 мг/кг (Табл.2).
Итак, предлагаемые в настоящем изобретении соединения – N,N’-дифторборильные комплексы N-(3-арил-2H-изоиндол-1-ил)-N-(3-арил-1H-изоиндол-1-илиден)аминов обладают высокой фотоиндуцированной активностью и представляют собой новый класс эффективных фотосенсибилизаторов, которые могут быть использованы для лечения опухолей методом ФДТ.
Формула изобретения
1. N,N‘-Дифторборильные комплексы N-(3-арил-2H-изоиндол-1-ил)-N-(3-арил-1H-изоиндол-1-илиден)аминов общей формулы 2. Способ получения соединений по п.1, заключающийся в обработке соответствующего лиганда эфиратом трехфтористого бора в присутствии вторичного или третичного амина в кипящем бензоле.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 126, p 10619-10631.
126, p 10619-10631.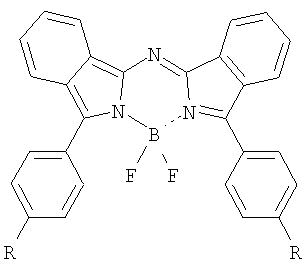

 4.9) в ближней ИК-области спектра при 715-736 нм (Табл.1). На чертеже приведены электронные спектры поглощения комплексов (I-IV) в бензоле: 1 – (I), 2 – (II), 3 – (III), 4 – (IV). Параметры спектров поглощения соединений (V-VI) приведены в примерах 5 и 6 соответственно.
4.9) в ближней ИК-области спектра при 715-736 нм (Табл.1). На чертеже приведены электронные спектры поглощения комплексов (I-IV) в бензоле: 1 – (I), 2 – (II), 3 – (III), 4 – (IV). Параметры спектров поглощения соединений (V-VI) приведены в примерах 5 и 6 соответственно. макс, нм
макс, нм