|
|
(21), (22) Заявка: 2008104977/14, 11.02.2008
(24) Дата начала отсчета срока действия патента:
11.02.2008
(46) Опубликовано: 27.07.2009
(56) Список документов, цитированных в отчете о
поиске:
RU 2188456 С2 27.08.2002. RU 2149463 C1 20.05.2000. SU 999089 A1 23.02.1983. КИРПАТОВСКИЙ В.И. Рефлюксная модель острого восходящего пиелонефрита у крыс. Пленум Правления Всероссийского общества урологов, 1996, с.158-159. РАКШАИНА М. Ц. Фитотерапия экспериментального пиелонефрита экстрактом толокнянки обыкновенной. – Актуальные проблемыфармакологии и поиска новых лекарственных препаратов, 1994, т.7, с.106. BERRY V, et al. Comparative efficacy of gemifloxacin in experimental models of pyelonephritis and wound infection. J Antimicrob Chemother. 2000 Apr; 45 Suppl 1:87-93. MUSHER D.M. et al. Emergence of variant forms of Staphylococcus aureus after exposure to gentamicin and infectivity of the variants in experimental animals. J Infect Dis. 1977 Sep; 136(3):360-9.
Адрес для переписки:
644043, г.Омск, ул. Ленина, 12, ОмГМА, патентный отдел
|
(72) Автор(ы):
Цуканов Антон Юрьевич (RU),
Калиниченко Дмитрий Анатольевич (RU),
Михно Иван Ильич (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Омская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию” (RU)
|
(54) СПОСОБ МОДЕЛИРОВАНИЯ ОСТРОГО ПИЕЛОНЕФРИТА
(57) Реферат:
Изобретение относится к экспериментальной медицине и может быть использовано для моделирования острого пиелонефрита. Для этого интраоперационно сужают верхнюю треть мочеточника на 2/3 исходного диаметра. Затем пункционно создают очаг асептического некроза в паренхиме почки введением 0,5 мл 10% раствора хлорида кальция, в который вводят бактериальную культуру под ультразвуковым контролем. В качестве бактериальной культуры используют суспензию золотистого стафилококка из расчета 104 микробных тел в 1 мл в дозе 1 мл. Способ обеспечивает адекватное воспроизведение модели. 1 з.п. ф-лы, 7 ил.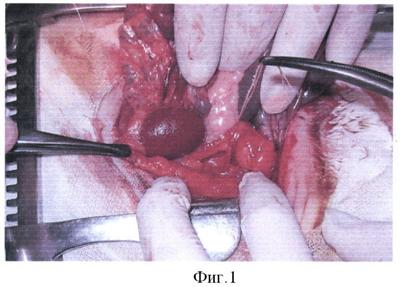
Изобретение относится к области медицины и найдет применение при лечении патологических процессов у человека.

Проведенными исследованиями выявлены различные способы моделирования пиелонефрита. Так, авторским свидетельством  1422239 МПК G09В 23/28 N33 Есилевского Ю.М. с соавт. защищен “Способ моделирования пиелонефрита”. Для осуществления способа однократно внутривенно вводили 20-25% раствор этанола, а затем также внутривенно кишечную палочку. Недостатком этого способа является то, что для моделирования применяется сильнодействующее токсическое вещество, что не соответствует клиническим условиям развития заболевания. 1422239 МПК G09В 23/28 N33 Есилевского Ю.М. с соавт. защищен “Способ моделирования пиелонефрита”. Для осуществления способа однократно внутривенно вводили 20-25% раствор этанола, а затем также внутривенно кишечную палочку. Недостатком этого способа является то, что для моделирования применяется сильнодействующее токсическое вещество, что не соответствует клиническим условиям развития заболевания.
Авторским свидетельством  15485827 МПК G09В 23/28 Есилевского Ю.М. с соавт. защищен “Способ моделирования интерстициального нефрита”, который осуществлялся путем перевязки почечной вены на 15-60 мин. Недостатками этого способа является то, что создается грубое нарушение оттока крови, на фоне которого развивается абактериальный интерстициальный процесс и на развитие заболевания оказывает влияние операционная травма. 15485827 МПК G09В 23/28 Есилевского Ю.М. с соавт. защищен “Способ моделирования интерстициального нефрита”, который осуществлялся путем перевязки почечной вены на 15-60 мин. Недостатками этого способа является то, что создается грубое нарушение оттока крови, на фоне которого развивается абактериальный интерстициальный процесс и на развитие заболевания оказывает влияние операционная травма.
Недостатками вышеперечисленных методик является сохранение нормального пассажа мочи.
Целью настоящего изобретения является приближение модели к патогенезу заболевания.
Поставленная цель достигается путем интраоперационного сужения верхней трети мочеточника на 2/3 диаметра и в введении в послеоперационном периоде бактериальной культуры под УЗ контролем в паренхиму почки.
На фигуре 1 представлен момент операции – выделена левая почка, мочеточник взят на держалку.
Фигура 2 – мочеточник прошит и перевязан в верхней трети. Фигура 3 – расширение мочеточника выше места перевязки. Фигура 4 – ультразвуковая картина каликопиелоэктазии. Фигура 5 – ультразвуковая картина очагового пиелонефрита. Фигура 6 – микроскопическая картина абсцесса почки. Фигура 7 – массивная лейкоцитарная инфильтрация с разрушением эпителиальной выстилки лоханки.
Способ осуществляют следующим образом. Кроликам породы «Серый великан» под общим обезболиванием препаратом «Золитил» в объеме 5,0 мл выполняют лапаротомию, выделяют левую почку и верхнюю треть левого мочеточника. Мочеточник на границе верхней и средней трети суживают путем прошивания и перевязки синтетической нерассасывающейся нитью на 2/3 исходного диаметра. Для определения степени созданной обструкции выше места перевязки вводят около 0,5 мл раствора NaCl 0,9% – раствор частично поступает в нижележащие отделы мочеточника, заполняется расширенная лоханка. В послеоперационном периоде спустя 7 суток животным выполняют УЗ-исследование почек. При этом у всех животных отмечена уретеропиелоэктазия на стороне операции (фиг.4).
Создание абсцесса почки проводят следующим образом. Под ультразвуковым контролем в почечную паренхиму по задней поверхности с целью создания очага асептического некроза, на 8 сутки после операции пункционно вводят 10% раствор хлорида кальция в объеме 0,5 мл. На следующие сутки (9-е от момента операции) осуществляют УЗ-контроль. У всех животных отмечено формирование гипоэхогенного участка некроза размером 0,4-0,6 см в месте введения препарата. Далее под УЗ-контролем через 1 сутки в зону некроза пункционно вводят бактериальную суспензию золотистого стафилококка из расчета 104 микробных тел в 1 мл, стандартизацию проводят по оптическому бактериальному стандарту мутности.
За лабораторным животным осуществляют наблюдение, заключающееся в ежедневном измерении температуры в прямой кишке, контроле лабораторных показателей (общий и биохимический анализы крови), гемодинамических показателей, ультразвуковом сканировании почек. Через сутки (на 10 сутки после операции) у всех животных отмечен подъем температуры тела в среднем на 2,1±0,3 градуса по Цельсию, толщина паренхимы почек на стороне вмешательства по данным УЗИ увеличилась в 1,5 раза. На 2-е сутки после введения (11-е после операции) по данным ультразвукового исследования в местах инъекции появились гипоэхогенные образования от 0,5 до 0,8 см с жидкостным компонентом (фиг.3).
В разные сроки наблюдения – через 3, 5 суток после моделирования пиелонефрита животных выводят из эксперимента. При патоморфологическом исследовании отмечена густая инфильтрация полиморфноядерными лейкоцитами в интерстиции мозгового и коркового слоев, множественные микроабсцессы, инфильтрация нейтрофильными лейкоцитами стенок полостной системы (чашечек, лоханки), в просветах канальцев – скопления сегментоядерных нейтрофильных лейкоцитов; отмечался умеренный перитубулярный и периваскулярный фиброз. Данные морфологические изменения во всех случаях занимают менее 2/3 объема, то есть носят ограниченный характер. Клубочки в воспалительный процесс не вовлечены (фиг.4, 5).
Пример 1. Лабораторному животному весом 2,5 кг в возрасте 4 месяцев под общим наркозом золитилом 5,0 мл выполнена лапаротомия, вскрыта околопочечная фасция слева. При ревизии: выделена левая почка 2,3×4,2 см и мочеточник диаметром 0,2 см, до границы верхней и средней третей. Мочеточник прошит и перевязан на 2/3 от исходного диаметра полисорбом 0000. Контроль гемостаза – сухо. Рана послойно ушита кетгутом. Швы на кожу однорядные х/б. Спустя 7 суток от момента операции животному под УЗ-контролем введено в паренхиму нижнего полюса левой почки 1,0 мл 10% CaCl. На следующие сутки (9 от момента операции) кролику под УЗИ контролем введено в паренхиму левой почки в зону некроза 1,0 мл культуры Staph. aureus. Спустя 10 минут от введения у животного развилась картина бактериально-токсического шока (сознание отсутствовало, положение вынужденное, зрачки на свет не реагировали, пульс нитевидный). Через 30 минут данное состояние самостоятельно разрешилось. В процессе дальнейшего наблюдения отмечено: животное вялое, адинамичное, не кормится. Температура тела сохранялась на уровне 39,9°С. На 3 сутки от создания модели пиелонефрита животное погибло. Вскрытие: в брюшной полости незначительное количество серозно-геморрагического отделяемого, к левой почке подпаян кишечник. Спайки разделены. Почка увеличена в размерах: 4,6×4×3 см. Имеется расширение лоханки и верхней трети мочеточника до 3,5 мм. Паренхима утолщена. В месте инъекции околопочечная клетчатка пропитана гноем. Мозговой и корковый слои не дифференицируются. При микроскопическом исследовании: отмечена интенсивная очагово-сливная инфильтрация мозгового слоя почки смешанного клеточного состава (нейтрофильные лейкоциты, лимфоциты, плазматические клетки) с формированием микроабсцессов, прорывом последних в тубулярную систему (скопление в просветах собирательных трубочек сегментоядерных лейкоцитов).
Пример 2. Кролик массой 2,1 кг после воспроизведения опыта по вышеописанной методики наблюдался в течении 5 суток после введения в паренхиму почки культуры стафилококка. В процессе наблюдения сохранялась лихорадка до 42°С, тахикардия, высокий лейкоцитоз периферической крови до 13,5 тыс./мкл. На 5 сутки от введения бактериальной культуры животное выведено из эксперимента путем введения летальной дозы гексенала. При вскрытии: к левой почке подпаян кишечник. Спайки разделены. Почка увеличена в размерах: 4,8×3,9×3,2 см. Имеется расширение лоханки и верхней трети мочеточника до 3,3 мм. Паренхима утолщена. В месте инъекции околопочечная клетчатка пропитана гноем. Мозговой и корковый слои не дифференцируются. Микроскопическая картина идентична картине примера 1.
Таким образом, выявленные лабораторные и морфологические данные свидетельствуют о том, что в экспериментальных условиях у кроликов воспроизведен острый пиелонефрит. Предлагаемый способ моделирования пиелонефрита обеспечивает воспроизведение модели, приближенной к клиническому течению заболевания у человека, дает возможность получения стойкой воспроизводимости модели для изучения патогенеза пиелонефрита и снизить затраты на его моделирование.
Формула изобретения
1. Способ моделирования острого пиелонефрита, включающий введение бактериальной культуры в паренхиму почки, отличающийся тем, что интраоперационно сужают верхнюю треть мочеточника на 2/3 исходного диаметра, пункционно создают очаг асептического некроза в паренхиме почки введением 0,5 мл 10%-ного раствора хлорида кальция, в который вводят бактериальную культуру под ультразвуковым контролем.
2. Способ по п.1, отличающийся тем, что в качестве бактериальной культуры используют суспензию золотистого стафилококка из расчета 104 микробных тел в 1 мл в дозе 1 мл.
РИСУНКИ
|
|